Спосіб експериментального моделювання неерозивного пошкодження стравоходу in vivo за вмістом сірководню (h2s)
Номер патенту: 88624
Опубліковано: 25.03.2014
Автори: Заячківська Оксана Станіславівна, Грицевич Назар Романович, Гжегоцький Мечислав Романович
Формула / Реферат
1. Спосіб експериментального моделювання неерозивних пошкоджень стравоходу in vivo, що включає індукцію пошкоджень стравоходу, який відрізняється тим, що пошкодження стравоходу моделюють за вмістом сірководню (H2S) шляхом одноразового введення інгібіторів цистатіонін-γ-ліази (CSE) та цистатіонін-β-синтази (CBS), L-триптофану та донора синтезу сірководню сульфіду натрію (NaHS) за 0,5 год. до індукції водно-іммобілізаційного стресу.
2. Спосіб за п. 1, який відрізняється тим, що вводять внутрішньоочеревинно інгібітор CSE - DL-пропаргілгліцин у дозі 25 мг/кг, інгібітор CBS - О-карбоксиметил-гідроксиламіну геміхлорид - у дозі 3 ммоль/л та донор синтезу H2S NaHS - у дозі 100 млмоль/кг, L-триптофан вводять з їжею у дозі 400 мг/кг.
Текст
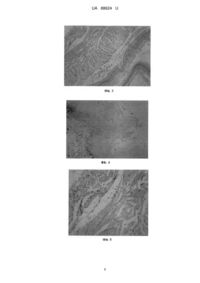
Реферат: Спосіб експериментального моделювання неерозивних пошкоджень стравоходу in vivo включає індукцію пошкоджень стравоходу. При цьому пошкодження стравоходу моделюють за вмістом сірководню (H2S) шляхом одноразового введення інгібіторів цистатіонін-γ-ліази (CSE) та цистатіонін-β-синтази (CBS), L-триптофану та донора синтезу сірководню сульфіду натрію (NaHS) за 0,5 год. до індукції водно-іммобілізаційного стресу. UA 88624 U (12) UA 88624 U UA 88624 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до медицини та фізіології травлення, а також експериментальної гастроентерології, і може бути використана в гастроентерологічних доклінічних чи трансляційних дослідженнях шляхом моделювання превиразкових ушкоджень слизової оболонки стравоходу, які співвідносні з такими, що виникають при гастроезофагеальній рефлюксній хворобі, зокрема при неерозивній рефлюксній хворобі стравоходу (НЕРХ). Гастроезофагеальна рефлюксна хвороба (ГЕРХ) - хронічне гастроентерологічне захворювання, що за поширеністю перевищує пептичну виразку та часто з невідомих причин призводить до розвитку карцином [1]. В ульцерогенезі слизової оболонки стравоходу (СОС) важливу роль відіграють численні прозапальні чинники [2], а процес загоєння пошкодження СОС зумовлений клітинними та молекулярними механізмами, пов'язаними з підепітеліальним компонентом бар'єрної функції стравоходу. Зміна проникності судин СОС спричиняє дисфункцію епітеліального бар'єру за умов моделювання як топічних уражень кислотнопепсинового і алкалічно-біліарного, так і стрес-індукованого генезу [3]. Враховуючи значення вазоактивних чинників цитопротекції, особлива роль належить ендогенним газотрансмітерам: оксиду азоту, монооксиду вуглецю, сірководню (гідроген сульфіду, H 2S), які легко дифундують через мембрани у клітини та змінюють їхні функції. Особливу увагу привертає H 2S, біосинтез якого залежить від активності цистатіонін-γ-ліази (від англ.: cystathionine γ-lyase, CSE), цистатіонін-β-синтази (від англ.: cystathionine β-synthetase, CBS) і який бере участь у регулюванні судинного тонусу, передачі нервових імпульсів та секреції інсуліну [4]. Відомо, що H2S є ключовою сигнальною молекулою плейотропних механізмів, які контролюють лейкоцитарно-ендотеліальну адгезію, запальні реакції, апоптоз, а також репарацію за рахунок зміни експресії циклооксигенази II [5], виявлено його фізіологічну роль у ноціцепції, секреторній та моторно-евакуаторній функціях травної системи [6]. Проте роль H 2S у езофагоцитопротекції не з'ясована. В останні роки було доведено причетність порушень функціонування Lтриптофан-серотонін-мелатонінової системи у регулювання фізіологічних функцій в організмі, було встановлено роль мелатоніну у забезпеченні бар'єрної функції стравоходу та обґрунтовано раціональність її терапевтичного потенціалу для езофагопротекції [7]. Серед мішеней дії цієї системи особливе місце займає модуляторний контроль редокс статусу, протизапальна дія та вазотропна дія, проте ефект її донора L-триптофану на СОС на тлі змін транссульфування залишається невідомим. Серед доклінічних технік привертають увагу експериментальне моделювання ГЕРХ з використанням перфузування стравоходу через спеціальний катетер кислотними розчинами та жовчі або їхньої комбінації [8], хірургічні втручання, наприклад сіалоаденектомія, [9] тощо чи дослідження, проведені на культурі клітин стравоходу ех vivo або in vitro [10]. До головних недоліків проаналізованих моделей належать складність оперативної техніки, тривалість експерименту, дороге обладнання, залучене в дослідженні, та погана відтворюваність на доступних лабораторних тваринах, а також характер пошкоджень СОС (виразково-ерозивний езофагіт), що не дозволяє дослідити ранні ознаки ураження стравоходу, а саме преерозивні зміни. Дослідження за умов ex vivo або in vitro не дозволяють прослідкувати комплексні зміни в стравоході та механізми розвитку дисфункцій на системному рівні в організмі, що беруть участь в патогенезі ГЕРХ. Вищеозначене обумовило завдання подолати наявні несприятливі труднощі і розробити доступний спосіб експериментального моделювання ураження СОС, що за структурно-функціональними характеристиками був би співвідносний з ураженнями епітеліального бар'єру стравоходу, що виникають під час ГЕРХ. Найближчим аналогом є спосіб моделювання in vivo неерозивного пошкодження стравоходу у C57BL/6 мишей, що являють собою лабораторний вид генетично модифікованих мишей з ослабленою імунною системою, яких годували специфічною дієтою з обмеженим вмістом цинку та додаванням гідрофобних жовчних кислот та дезоксихолевої кислоти [11]. Недоліком його є індукція пошкоджень стравоходу, що є аналогом розвитку та прогресування ГЕРХ до стравоходу Барретта, без врахування патогенетичних механізмів зниження резистентності епітеліального бар'єру стравоходу, в основі яких зміни проникності судин та індукція запалення. Цим способом неможливо визначити передумови та етіологію змін вазотропного компоненту СОС до дії екстремального навантаження. Ще одною вадою цього способу є висока кошторисна вартість, що включає видатки на специфічних тварин, догляд за ними впродовж 69 днів експерименту. В основу корисної моделі поставлена задача створити спосіб експериментального моделювання неерозивного ураження стравоходу in vivo шляхом модифікації біосинтезу сірководню (H2S), що призведе до змін цитопротекції та резистентності епітеліального бар'єру, появи неерозивних пошкоджень, що за структурно-функціональними характеристиками будуть співвідносними до змін стравоходу під час НЕРХ і ГЕРХ. 1 UA 88624 U 5 10 15 20 25 30 35 40 45 50 55 60 Поставлена задача вирішується тим, що у способі експериментального моделювання неерозивних пошкодження стравоходу in vivo, що включає індукцію пошкоджень стравоходу, згідно з корисною моделлю, пошкодження стравоходу моделюють за вмістом сірководню (H 2S) шляхом одноразового введення інгібіторів цистатіонін-γ-ліази (CSE) та цистатіонін-β-синтази (CBS), L-триптофану та донора синтезу сірководню сульфіду натрію (NaHS) за 0,5 год. до індукції водно-іммобілізаційного стресу. Поставлена задача вирішується також тим, що вводять внутрішньоочеревинно інгібітор CSE-DL-пропаргілгліцин у дозі 25 мг/кг, інгібітор CBS - О-карбоксиметил-гідроксиламіну геміхлорид - у дозі 3 ммоль/л та донор синтезу H2S NaHS - у дозі 100 млмоль/кг, L-триптофан вводять з їжею у дозі 400 мг/кг. Інструментом досліджень значення газотрансмітерів, згідно з сучасною методологією, є блокада ензимів (для H2S-CSE і CBS), від яких залежить їх синтез, або додаткове введення відповідного донору (для H2S-NaHS), що збільшує продукцію газотрансмітеру [12]. У запропонованій корисній моделі застосовують блокаду дії ензимів CSE і CBS, від яких залежить синтез сірководню H2S, природного компоненту цитопротекції, шляхом одноразового внутрішньоочеревинного введення інгібітора CSE-DL-пропаргілгліцин (від англ.: propargylglycine, PAG) та інгібітора CBS - О-карбоксиметил-гідроксиламіну геміхлорид (від англ., Ocarboxymethyl-hydroxylamine hemihydrochloride, CHH) та донора синтезу сірководню - сульфіду натрію (NaHS) за 0,5 год. до індукції водно-іммобілізаційного стресу. Запропонований спосіб дозволяє in vivo дослідити роль H2S у цитопротекції та резистентності СОС для індукції неерозивних стрес-асоційованих пошкоджень за умов моделювання його біосинтезу, використовуючи інгібітори, L-триптофан (L-Try) та донор синтезу сірководню - екзогенний NaHS. Експериментальні дослідження проілюстровані графічними зображеннями (мікрофотографіями): на фіг. 1 відображена СОС у тварин контрольної групи без ознак пошкодження; на фіг. 2 - індукція стресу у тварин із застосуванням СНН; на фіг. 3 - дія PAG на підслизову основу; на фіг. 4 - преерозивні зміни СОС на тлі блокади синтезу H2S; на фіг. 5 введення NaHS поверхневий шар епітелію, підслизову основу, ІПС; на фіг. 6 - вплив використання L-Try на пухку сполучну тканину, ІПС та ІЕВ; на фіг. 7 - поверхневий епітеліальний шар та роговий шар без виявлених змін; на фіг. 8 - вплив індукції L-Try на підепітеліальний компонент СОС; на фіг. 9 - вплив поєднаної дії NaHS і L-Try на підслизову основу СОС. Неерозивне пошкодження стравоходу моделюють шляхом 3,5-годинного водноіммобілізаційного стресу за Takagi, 1964, у щурів, що отримували 0,9 % розчин NaCl 1,0 мл (як плацебо), L-триптофан 400 мг/кг та інгібітори CSE, пропаргілгліцин, PAG (25 мг/кг), CBS, карбоксиметил-гідроксиламін геміхлорид (СНН, 3 ммоль/л), донор біосинтезу H 2S, NaHS (100 млмоль/кг) за 0,5 год. до індукції стресу. Тварин виводили з експерименту під анестезією -1 кетаміном (60 мг/кг ). Для визначення важкості неерозивного пошкодження гістоморфометричним аналізом досліджували індекси епітеліальної пластинки та зміни підепітеліальних структур нижньої третини стравоходу за візуально-аналоговою шкалою. Подвійні, рандомізовані морфо-функціональні дослідження слизової оболонки нижньої третини стравоходу проводили на нелінійних щурах-самцях (n=70) масою 170-200 г, згідно з прийнятими міжнародними етичними принципами роботи ("Правила проведення робіт з використанням лабораторних тварин", 2007) та відповідно до положень "Європейської конвенції про захист хребетних тварин, які використовуються для експериментів та інших наукових цілей" (Страсбург, 1985). Тварин розділили на групу контролю (інтактні) та таких, які не отримували або отримували з їжею L-триптофан (L-Try) у дозі 400 мг/кг маси (в-во "Sigma", США) впродовж 7 днів. Для індукції уражень СОС щурам індукували водно-іммобілізаційний стрес (ВІС, модель Takagi, 1964) з попередньою 12 год. депривацією від їжі та вільним доступом до води. Для моделювання зміни цитопротекції шляхом модифікації активності транссульфування застосовували введення фізрозчину (1,0 мл 0,9 розчину NaCl) внутрішньоочеревинно (в.о.), PAG у дозі 25 мг/кг, в.о., СНН, 3 ммоль/л, в.о., та донор синтезу H2S NaHS у дозі 100 млмоль/кг (усі препарати - в-во "Antibe Therapeutics", Канада). Для виведення тварин з експерименту застосовували кетамін у дозі 25 мл/кг, в.о. Для морфо-функціонального аналізу гістологічний матеріал нижньої третини стравоходу та місця переходу стравоходу в шлунок фіксували у 4 % нейтральному формаліні, серійні гістологічні зрізи товщиною 5 мкм фарбували гематоксиліном і еозином (ГЕ) та здійснювали візуалізацію з використанням мікроскопа Swift Instruments International (Японія) і цифрової відеокамери Echoo-Imager 5020200 Microscope Digital Eyepiece (Китай). Стан бар'єрної функції стравоходу оцінювали за морфо-функціональним аналізом відповідно до візуальноаналогової шкали (ВАШ) з урахуванням таких кількісно-якісних критеріїв: 1) стан епітеліальної 2 UA 88624 U 5 10 15 20 25 30 35 40 45 50 55 60 вистилки за індексом альтерації (ІЕВ): 0 - зміни відсутні, 1 - розволокнення рогового шару, 2 вогнищева базофілія мас кератину, 3 - десквамація рогових мас, вакуолізація клітин базального шару, везикулярні ядра; 2) стан підепітеліальних структур за індексом їхніх змін (ІПС): 0 - зміни відсутні, 1 - дифузний набряк підслизової основи, 2 - виражений нерівномірний набряк підслизової основи та незначна інфільтрація, 3 - виражений набряк та дезорганізація підслизової основи, периваскулярні або субепітеліальні інфільтрати, периваскулярні крововиливи; 3) стан м'язової оболонки за проявами некрозу: 0 - зміни відсутні, 1 - каріорексис, каріопікпоз, 2 - фокальний некроз; 3 - генералізований некроз. Ступінь змін епітеліальної пластинки та підепітеліальних структур СОС у препаратах оцінювали мофрометричним аналізом у відносних одиницях згідно зі стандартною шкалою за допомогою програмного забезпечення UTHSCSA "Image Tool for Windows. Version 2.00" (США). Ступінь пошкодження СОС обраховували шляхом визначення (у відсотках) відношення товщини ділянки ушкоджень епітеліального компонента та підепітеліальних структур (у відносних одиницях) до товщини епітеліального бар'єру. Статистичний аналіз отриманих результатів проведено за допомогою програми "Statistica 5,5" (США) з обчисленням середньоарифметичного і стандартного відхилень та похибки середніх значень, порівняння середніх значень двох вибірок за допомогою t-критерію, р
ДивитисяДодаткова інформація
Автори англійськоюZaiachkivska Oksana Stanislavivna, Hzhehotskyi Mechyslav Romanovych
Автори російськоюЗаячковская Оксана Станиславовна, Гжегоцкий Мечислав Романович
МПК / Мітки
МПК: A61B 10/00, G09B 23/28
Мітки: моделювання, пошкодження, h2s, експериментального, спосіб, сірководню, стравоходу, неерозивного, вмістом
Код посилання
<a href="https://ua.patents.su/10-88624-sposib-eksperimentalnogo-modelyuvannya-neerozivnogo-poshkodzhennya-stravokhodu-in-vivo-za-vmistom-sirkovodnyu-h2s.html" target="_blank" rel="follow" title="База патентів України">Спосіб експериментального моделювання неерозивного пошкодження стравоходу in vivo за вмістом сірководню (h2s)</a>
Наступний патент: Пристрій для дренування шлунка при його проксимальній резекції
Випадковий патент: Пристрій для сушіння матеріалів