Спосіб моделювання лікувальної дії антибіотиків при розвитку патологічного процесу в ротовій порожнині експериментальних тварин на фоні довготривалого впливу опіоїдного анальгетика
Номер патенту: 96423
Опубліковано: 10.02.2015
Автори: Пальтов Євгеній Володимирович, Корнійчук Олена Петрівна, Фік Володимир Богуславович, Федечко Йосип Михайлович, Кривко Юрій Ярославович, Онисько Роман Михайлович
Формула / Реферат
Спосіб моделювання лікувальної дії антибіотиків при розвитку патологічного процесу в ротовій порожнині на фоні впливу опіоїдного анальгетика, що включає мікробіологічне дослідження запальних процесів, який відрізняється тим, що в експериментальних тварин на фоні довготривалого впливу опіоїдного анальгетика (від 6-ти до 10-ти тижнів) здійснюють динамічне дослідження мікрофлори зубної бляшки, ясен, слизової оболонки ротової порожнини з визначенням видового складу мікробіоценозів та їхніх кількісних співвідношень із застосуванням мікроскопічного і бактеріологічного методів, а також дискометричного методу визначення антибіотикограм в різні терміни запального процесу, та встановлюють антибіотик широкого спектра дії з метою усунення впливу мікробних агентів на прикінцевому етапі експерименту.
Текст
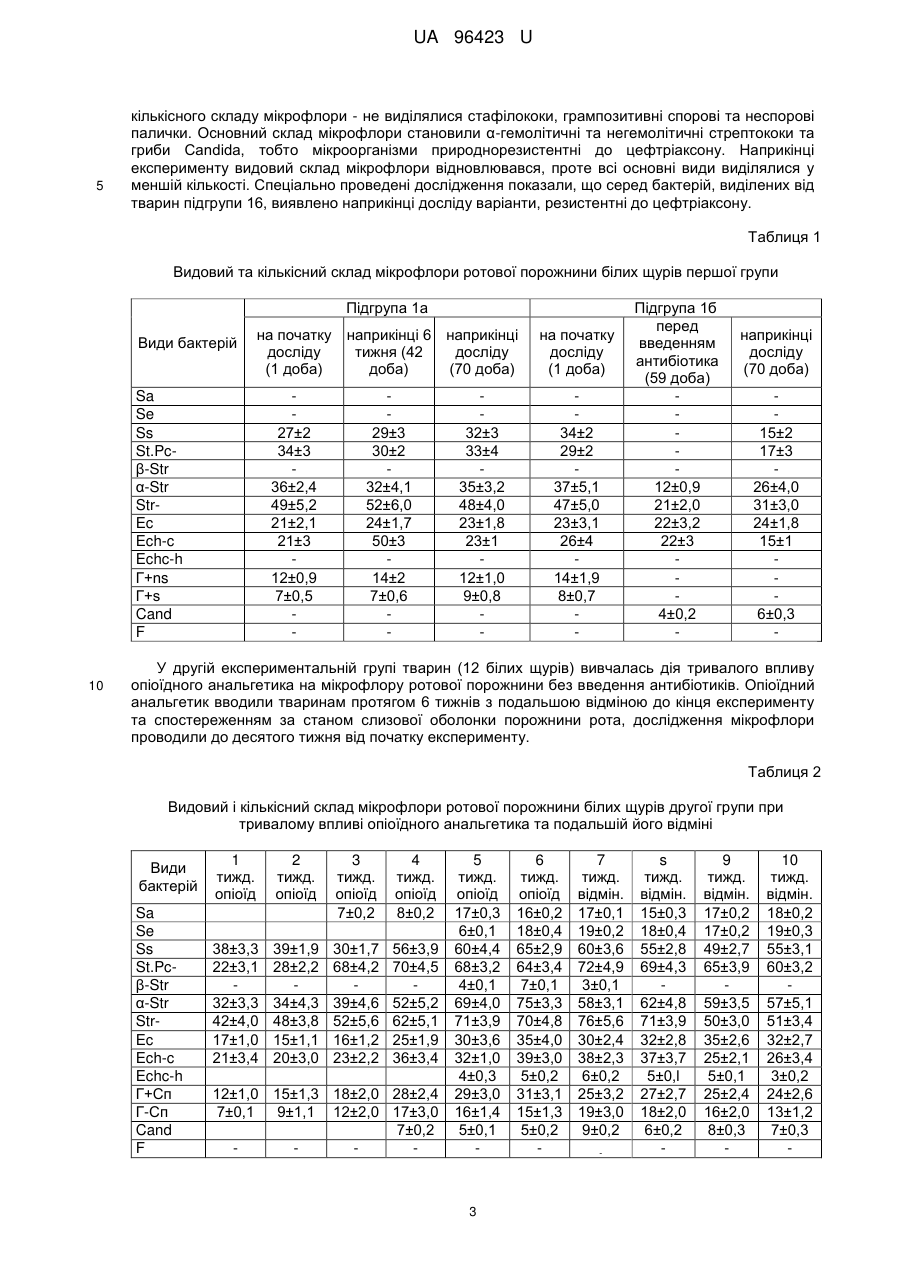
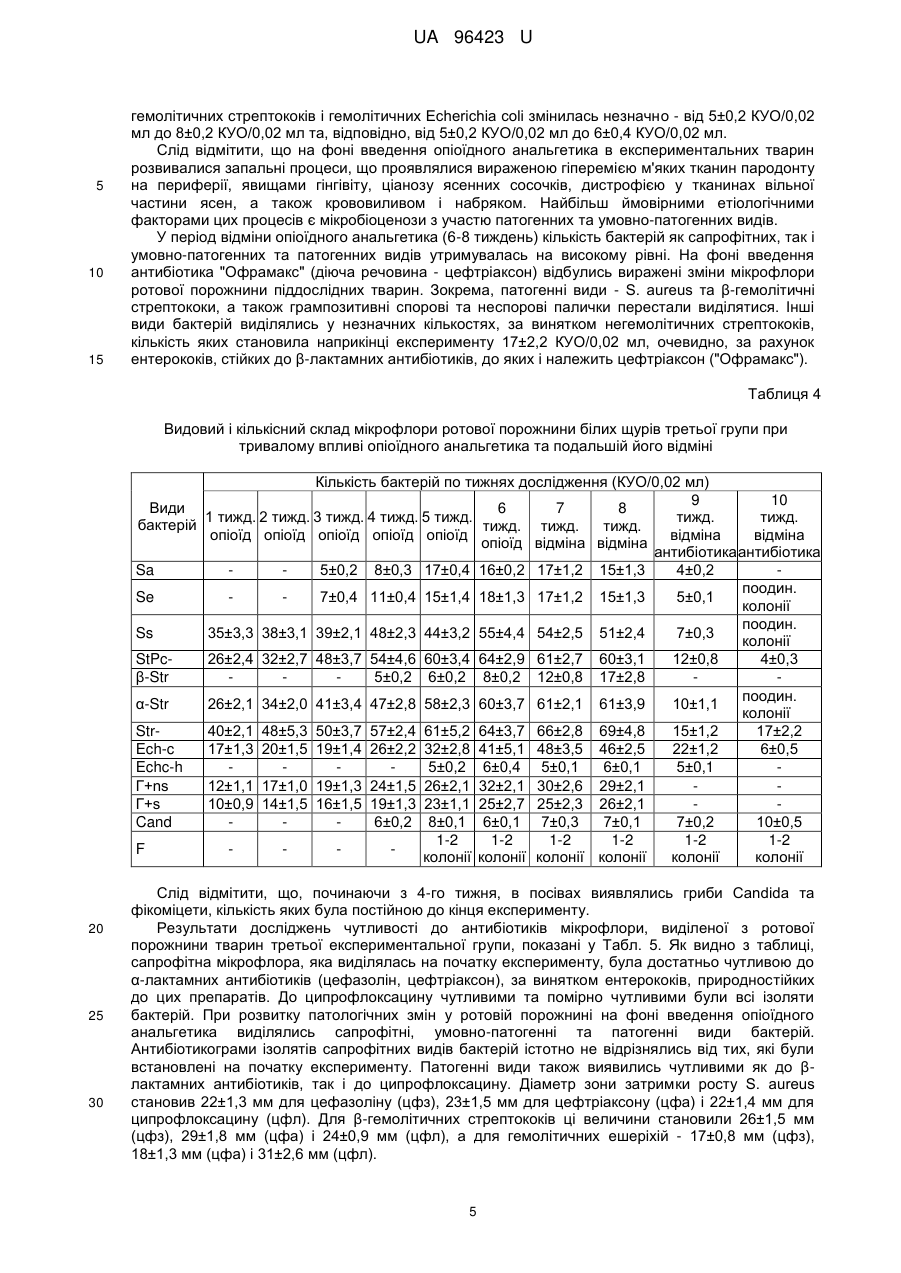
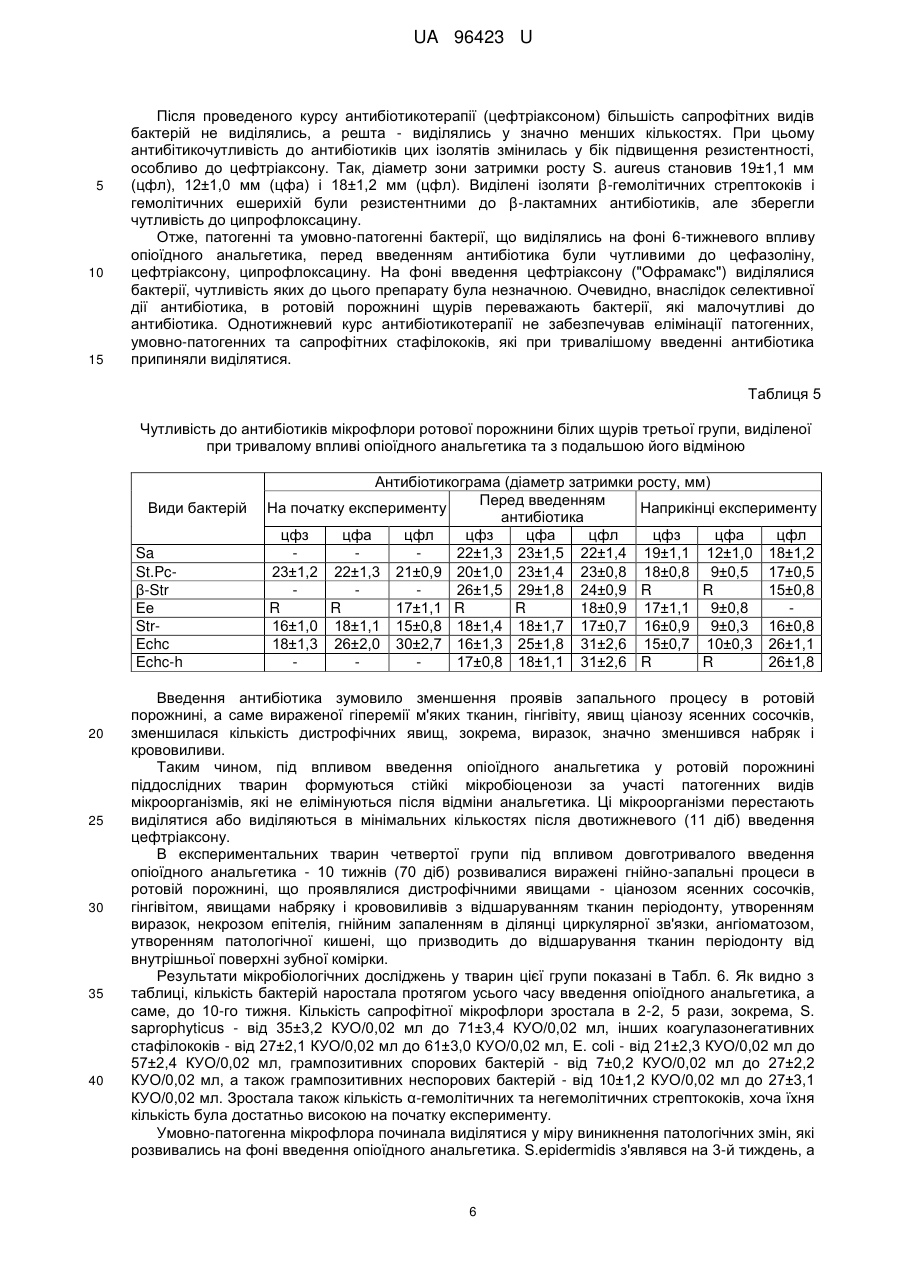
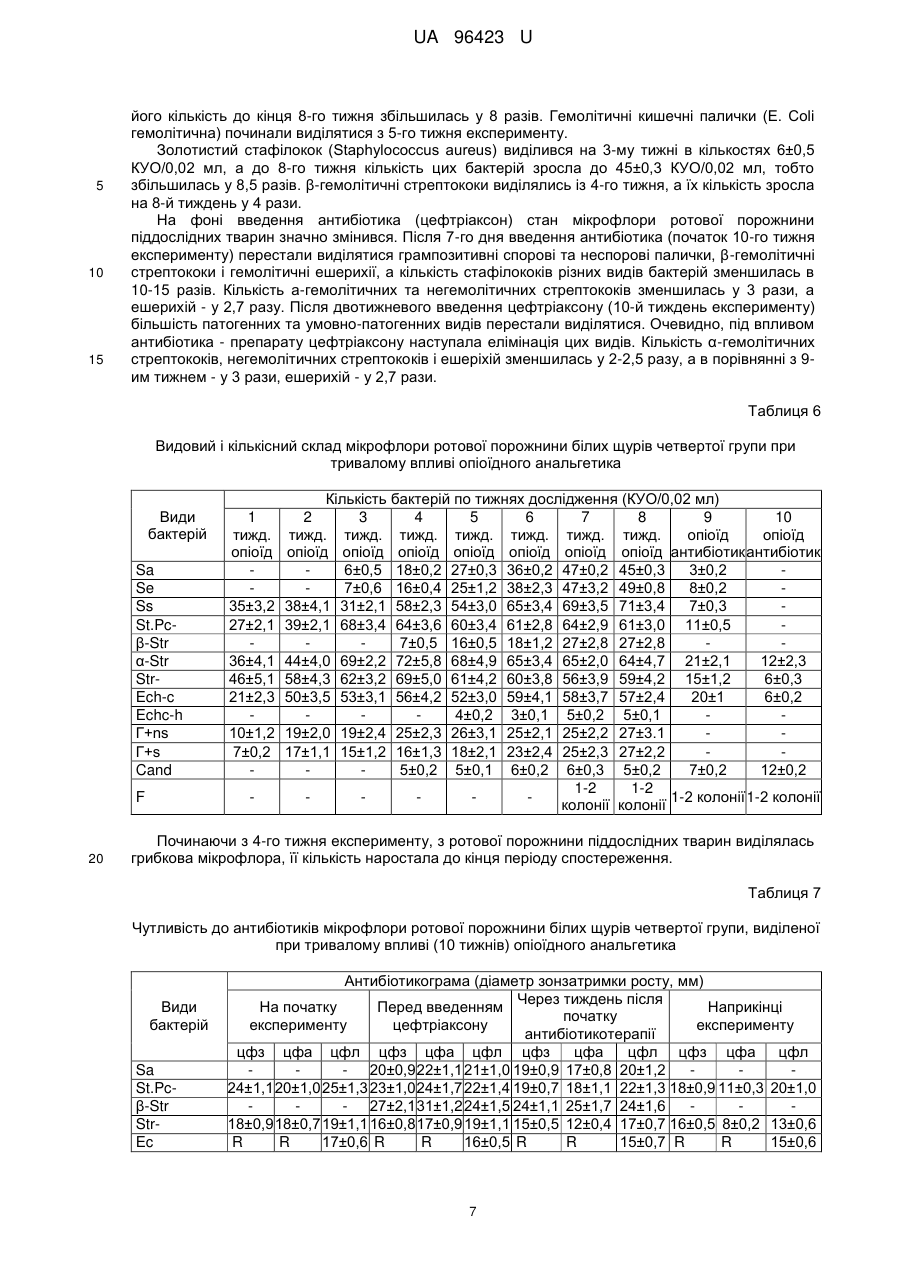
Реферат: Спосіб моделювання лікувальної дії антибіотиків при розвитку патологічного процесу в ротовій порожнині на фоні впливу опіоїдного анальгетика включає мікробіологічне дослідження запальних процесів. В експериментальних тварин на фоні довготривалого впливу опіоїдного анальгетика (від 6-ти до 10-ти тижнів) здійснюють динамічне дослідження мікрофлори зубної бляшки, ясен, слизової оболонки ротової порожнини з визначенням видового складу мікробіоценозів та їхніх кількісних співвідношень із застосуванням мікроскопічного і бактеріологічного методів, а також дискометричного методу визначення антибіотикограм в різні терміни запального процесу, та встановлюють антибіотик широкого спектра дії з метою усунення впливу мікробних агентів на прикінцевому етапі експерименту. UA 96423 U (12) UA 96423 U UA 96423 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до медицини, зокрема мікробіології та анатомії, і може бути використана при моделюванні коригуючого впливу антибіотикотерапією як лікувальної дії при гнійно-запальних процесах, що розвинулися в результаті довготривалого побічного впливу опіоїдного анальгетика. Відомий спосіб діагностики та лікування стоматологічної патології в опіоїдозалежних пацієнтів в залежності від віку, стажу прийому наркотиків, вираженості абстинентного синдрому і постабстинентного стану, який полягає в комплексному підході до обстеження таких пацієнтів для визначення частоти та інтенсивності розвитку запальних процесів зубощелепової системи, а також імунологічного статусу ротової порожнини, біохімічних зсувів та мікробіологічної картини [Фурсова А.Д. Патогенетические особенности стоматологического статуса и лечения наркоманов в зависимости от стажа опиоидной зависимости и выраженности абстинентного синдрома: автореф. дис. канд.мед.наук: спец. - Стоматология. - Москва, 2009]. Таким способом досягається контроль за розвитком запальних процесів ротової порожнини та пародонту, зокрема, в опіоїдозалежних осіб, але він не дає можливості коригувати лікувальні заходи в залежності від динаміки патологічного процесу та змін складу властивостей патогенних складових мікробіоценозів, які виникають внаслідок дії антибіотиків. В основу корисної моделі поставлено задачу створити спосіб моделювання лікувальної дії антибіотиків при виражених гнійно-запальних процесах ротової порожнини, які розвинулися при довготривалій дії опіоїдного анальгетика, який буде базуватися на динамічному аналізі мікробіоценозів ротової порожнини за видовими та кількісними показниками і антибіотикочутливістю, що дасть можливість усувати чи мінімізувати дію патогенетично важливих елементів мікробіоценозу і спричиняти позитивний вплив на стан тканин пародонта та слизової оболонки порожнини рота. Поставлена задача вирішується тим, що у способі моделювання лікувальної дії антибіотиків при розвитку патологічного процесу в ротовій порожнині на фоні впливу опіоїдного анальгетика, що включає мікробіологічне дослідження запальних процесів, згідно з корисною моделлю, в експериментальних тварин на фоні довготривалого впливу опіоїдного анальгетика (від 6-ти до 10-ти тижнів) здійснюють динамічне дослідження мікрофлори зубної бляшки, ясен, слизової оболонки ротової порожнини з визначенням видового складу мікробіоценозів та їхніх кількісних співвідношень із застосуванням мікроскопічного і бактеріологічного методів, а також дискометричного методу визначення антибіотикограм в різні терміни запального процесу, та встановлюють антибіотик широкого спектру дії для усунення впливу мікробних агентів на прикінцевому етапі експерименту. Запропонований спосіб дає можливість визначити найбільш імовірні мікробні етіологічні агенти на різних етапах запального процесу при довготривалій дії опіоїдного анальгетика та застосувати відповідний антибіотик для усунення їхньої дії, а також обґрунтувати корекцію або заміну схеми антибіотикотерапії на основі даних повторних досліджень. Спосіб моделювання лікувальної дії антибіотиків при розвитку патологічного процесу в ротовій порожнині експериментальних тварин на фоні довготривалого впливу опіоїдного анальгетика здійснюють таким чином. Досліджують мікрофлору ротової порожнини експериментальних тварин, наприклад, білих щурів, на фоні довготривалого хронічного впливу (від 6-ти до 10-ти тижнів) опіоїдного анальгетика, наприклад, препарату "Налбуфін" (похідна речовина - морфінан, виробник РусанФарма Лтд, Індія), що викликатиме розвиток запальних процесів ротової порожнини, та для корекції, а саме можливої лікувальної дії, для чого застосовують антибіотики, зокрема "Офрамакс" (діюча речовина - цефтріаксон, виробник Ranbaxy, Індія). Дослідження проведено на білих статево-зрілих щурах-самцях лінії "Wistar", середньою масою 160 г, віком 3,5-7,5 місяців. Перед проведенням дослідів виконали огляд, зважування та маркування кожної тварини. Відібраних тварин утримували в окремій клітці на стандартному харчовому раціоні віварію. Проводили загальний огляд стану слизової оболонки в ділянці власне ротової порожнини та присінку рота. Слизова оболонка в цих ділянках та в ділянці ясен була помірно зволожена, блідо-рожевого забарвлення без явищ патологічного ураження. Експериментальні дослідження мікрофлори ротової порожнини щурів на антибіотикочутливість проводили до початку досліду та в динаміці протягом 10 тижнів, з взяттям матеріалу кожного тижня на фоні впливу опіоїдного анальгетика (наприклад, препарату "Налбуфін"). При цьому проводили мікробіологічні посіви на середовища та мікроскопічне дослідження мазків, забраних з поверхні ясен, в ділянці пародонта верхньої та нижньої щелеп та слизової оболонки присінка рота і власне ротової порожнини. Матеріал забирали каліброваною бактеріологічною петлею і поміщали в пробірки з цукровим бульйоном. Одночасно готували мазки для мікроскопічного дослідження. Посів матеріалу з пробірок 1 UA 96423 U 5 10 15 20 25 30 35 40 45 50 55 60 проводили на МПА, кров'яний агар, ЖСА, середовище Ендо та середовище Сабуро. Виділені ізоляти бактерій ідентифікували за комплексом морфо-тинкторіальних та біохімічних властивостей. Для кількісної характеристики мікрофлори проводили посів 0,02 мл матеріалу на диференціальні середовища (три проби одного матеріалу) і підраховували кількість колонієутворюючих одиниць (КУО) для кожного з виявлених видів. При дослідженні видового складу виявлялися такі види: S.aureus (Sa), S. epidermidis (Se), S. saprophyticus (Ss), коагулазонегативні стафілококи інших видів (St.Pc-), β-гемолітичні стрептококи (β-Str), α-гемолітичні стрептококи (α-Str), негемолітичні стрептококи (Str-), ентерококи (Ес), Echerichia coli (Ech-c), Echerichia coli з гемолітичними властивостями (Echc-h), грампозитивні неспорові бактерії (Г+ns), грампозитивні спорові бактерії (Г+s), гриби Candida (Cand), фікоміцети (F). Антибіотикограми визначали дискометричним методом. Виділені однодобові бульйонні культури бактерій засівали у кількості 0,5 мл на стандартне середовище Мюлера-Хілтона або на кров'яний агар, надмір рідини видаляли. На поверхню середовища накладали стандартні паперові диски, які містили точну дозу антибіотика (1-10 мкг, в залежності від стандарту на препарат). Посіви інкубували 24 години у термостаті, після чого вимірювали діаметр зони затримки росту. Мікробіологічні дослідження проводили у чотирьох групах тварин в експерименті тривалістю до 70-ти діб (10 тижнів). Перша група - контрольна, де експериментальні тварини (12 білих щурів) були розділені на дві підгрупи - 1а та 1б. В підгрупі 1а (6 білих щурів), у якій досліджували стан мікрофлори ротової порожнини щурів в умовах віварію, тварини не одержували опіоїдного анальгетика і антибіотика. Стан мікрофлори досліджували тричі: на першу добу експерименту, на 42-гу добу (кінець 6-го тижня) і на 70-ту добу - 10-й тиждень (завершення експерименту). У підгрупі 16 (6 білих щурів) досліджували зміни мікрофлори ротової порожнини щурів під час проведення антибіотикотерапії (11 діб), наприклад, препаратом "Офрамакс" (діюча речовина - цефтріаксон). Стан мікрофлори досліджували тричі: на початку дослідження (1-ша доба), а також перед введенням антибіотика (59-та доба експерименту) та безпосередньо після закінчення введення антибіотика і експерименту (70-та доба). Друга група - вивчали мікрофлору ротової порожнини тварин (12 білих щурів) протягом 10ти тижнів, антибіотик не вводили, опіоїдний анальгетик (препарат "Налбуфін", похідна речовина - морфінан) вводили протягом 6-ти тижнів з подальшою відміною та забором матеріалу наприкінці 10-го тижня експерименту. Третя група - досліджували стан мікрофлори ротової порожнини тварин (12 білих щурів) протягом 10-ти тижнів: під впливом опіоїдного анальгетика протягом 6-ти тижнів з подальшою відміною препарату до кінця експерименту і введенням антибіотика (діюча речовина цефтріаксон) на завершальному етапі експерименту (9-10-му тижні). Мікробіологічні дослідження проводили щотижня (10 досліджень). У виділених ізолятів бактерій досліджували чутливість до антибіотиків (цефазоліну, цефтріаксону та ципрофлоксацину) тричі протягом експерименту - на початку, перед введенням антибіотика і наприкінці досліджень. Четверта група - досліджували стан мікрофлори ротової порожнини тварин (12 білих щурів) протягом всього експерименту. Вводили опіоїдний анальгетик - 10 тижнів із забором матеріалу наприкінці експерименту (70-та доба) та введенням антибіотика на завершальному етапі експерименту (9-10 тижні). Мікробіологічні дослідження проводились щотижня (10 досліджень). У виділених ізолятів бактерій досліджували чутливість до цефазоліну, цефтріаксону та ципрофлоксацину чотири рази, а саме, на початку експерименту, перед введенням цефтріаксону, через тиждень після початку антибіотикотерапії та наприкінці експерименту. В першій контрольній підгрупі 1а мікробіологічне дослідження, з метою вивчення мікробіоценозу ротової порожнини в нормі, без дії шкідливого фактора, було проведено в першу добу експерименту, наприкінці 6 тижня (42 доба) і наприкінці експерименту - 10-й тиждень (70-та доба). В контрольній підгрупі 16 досліджували мікрофлору ротової порожнини тварини початку експерименту, перед введенням антибіотика (59-та доба) і відповідно після завершення дослідження антибіотикотерапії (70-та доба). Результати досліджень в першій групі показані в Табл. 1. Як видно з даних, наведених у цій таблиці, в тварин контрольної підгрупи 1а виділялася сапрофітна мікрофлора у помірних кількостях. Протягом періоду спостереження видовий та кількісний склад мікрофлори істотно не змінювався. У тварин контрольної підгрупи 16, які одержували цефтріаксон, видовий та кількісний склад мікрофлори ротової порожнини перед введенням не відрізнявся від контрольної підгрупи 1а. Після введення антибіотика відмічено виражені зміни видового та 2 UA 96423 U 5 кількісного складу мікрофлори - не виділялися стафілококи, грампозитивні спорові та неспорові палички. Основний склад мікрофлори становили α-гемолітичні та негемолітичні стрептококи та гриби Candida, тобто мікроорганізми природнорезистентні до цефтріаксону. Наприкінці експерименту видовий склад мікрофлори відновлювався, проте всі основні види виділялися у меншій кількості. Спеціально проведені дослідження показали, що серед бактерій, виділених від тварин підгрупи 16, виявлено наприкінці досліду варіанти, резистентні до цефтріаксону. Таблиця 1 Видовий та кількісний склад мікрофлори ротової порожнини білих щурів першої групи Підгрупа 1a Види бактерій на початку наприкінці 6 наприкінці досліду тижня (42 досліду (1 доба) доба) (70 доба) Sa Se Ss St.Pcβ-Str α-Str StrEc Ech-c Echc-h Г+ns Г+s Cand F 10 27±2 34±3 36±2,4 49±5,2 21±2,1 21±3 12±0,9 7±0,5 29±3 30±2 32±4,1 52±6,0 24±1,7 50±3 14±2 7±0,6 32±3 33±4 35±3,2 48±4,0 23±1,8 23±1 12±1,0 9±0,8 на початку досліду (1 доба) 34±2 29±2 37±5,1 47±5,0 23±3,1 26±4 14±1,9 8±0,7 Підгрупа 1б перед введенням антибіотика (59 доба) 12±0,9 21±2,0 22±3,2 22±3 4±0,2 наприкінці досліду (70 доба) 15±2 17±3 26±4,0 31±3,0 24±1,8 15±1 6±0,3 У другій експериментальній групі тварин (12 білих щурів) вивчалась дія тривалого впливу опіоїдного анальгетика на мікрофлору ротової порожнини без введення антибіотиків. Опіоїдний анальгетик вводили тваринам протягом 6 тижнів з подальшою відміною до кінця експерименту та спостереженням за станом слизової оболонки порожнини рота, дослідження мікрофлори проводили до десятого тижня від початку експерименту. Таблиця 2 Видовий і кількісний склад мікрофлори ротової порожнини білих щурів другої групи при тривалому впливі опіоїдного анальгетика та подальшій його відміні Види бактерій Sa Se Ss St.Pcβ-Str α-Str StrEc Ech-c Echc-h Г+Сп Г-Сп Cand F 1 тижд. опіоїд 2 тижд. опіоїд 3 тижд. опіоїд 7±0,2 4 тижд. опіоїд 8±0,2 38±3,3 22±3,1 32±3,3 42±4,0 17±1,0 21±3,4 39±1,9 28±2,2 34±4,3 48±3,8 15±1,1 20±3,0 30±1,7 68±4,2 39±4,6 52±5,6 16±1,2 23±2,2 56±3,9 70±4,5 52±5,2 62±5,1 25±1,9 36±3,4 12±1,0 15±1,3 18±2,0 28±2,4 7±0,1 9±1,1 12±2,0 17±3,0 7±0,2 5 тижд. опіоїд 17±0,3 6±0,1 60±4,4 68±3,2 4±0,1 69±4,0 71±3,9 30±3,6 32±1,0 4±0,3 29±3,0 16±1,4 5±0,1 3 6 тижд. опіоїд 16±0,2 18±0,4 65±2,9 64±3,4 7±0,1 75±3,3 70±4,8 35±4,0 39±3,0 5±0,2 31±3,1 15±1,3 5±0,2 7 тижд. відмін. 17±0,1 19±0,2 60±3,6 72±4,9 3±0,1 58±3,1 76±5,6 30±2,4 38±2,3 6±0,2 25±3,2 19±3,0 9±0,2 s тижд. відмін. 15±0,3 18±0,4 55±2,8 69±4,3 62±4,8 71±3,9 32±2,8 37±3,7 5±0,l 27±2,7 18±2,0 6±0,2 9 тижд. відмін. 17±0,2 17±0,2 49±2,7 65±3,9 59±3,5 50±3,0 35±2,6 25±2,1 5±0,1 25±2,4 16±2,0 8±0,3 10 тижд. відмін. 18±0,2 19±0,3 55±3,1 60±3,2 57±5,1 51±3,4 32±2,7 26±3,4 3±0,2 24±2,6 13±1,2 7±0,3 UA 96423 U 5 10 15 Результати дослідження мікрофлори тварин другої групи показані в Табл. 2. Як видно з таблиці, виражені зміни мікрофлори ротової порожнини піддослідних щурів почали з'являтися на 3-4 тижнях від початку введення опіоїдного анальгетика. В цей період від тварин виділялися патогенні та умовно-патогенні мікроорганізми, зокрема, S.aureus, гемолітичні кишечні палички, β-гемолітичні стрептококи, S. epidermidis. Ці бактерії виділялись протягом усього періоду спостереження - до 10-го тижня, за винятком β-гемолітичних стрептококів, які виділялись протягом 5-7 тижнів у незначних кількостях, а саме, 4±0,1-7±0,1 КУО/0,02 мл. Кількість S.aureus зросла протягом 3-7 тижнів у 2,5 рази і утримувалась на рівні 15±0,3-18±0,2 КУО/0,02 мл до кінця експерименту. Аналогічна динаміка кількісних змін виявлена для S. epidermidis (зростання втричі). Кількість сапрофітних видів бактерій також зростала, починаючи з 3-4 тижня. Кількість колоній S. saprophyticus, ентерококів і α-гемолітичних стрептококів зросла вдвічі, коагулазонегативних стафілококів - у 2,7 рази, негемолітичних стрептококів та Е. соlі - у 1,5 рази. Значно зростала кількість грампозитивних спорових та неспорових бактерій. Гриби Candida виділялись, починаючи з 4 тижня експерименту у невеликих кількостях, а саме, 5-9 КУO/0,02 мл. Слід відмітити, що на фоні введення опіоїдного анальгетика у тварин розвивались запальні процеси ясен і слизової оболонки ротової порожнини в цілому, інтенсивність яких наростала до кінця експерименту. 20 Таблиця 3 Чутливість до антибіотиків мікрофлори ротової порожнини, виділеної при впливі опіоїдного анальгетика в другій групі Aнтибіотикограма (діаметр затримки росту, мм) Види бактерій На початку експерименту Через 6 тижнів Наприкінці експерименту цфз цфа цфл цфз цфа цфл цфз цфа цфл Sa 24±1,0 23±1,1 25±1,2 23±1,2 24±1,0 22±1,1 St.Pc17±0,8 19±01,0 20±1,8 18±0,9 20±0,8 24±0,9 25±1,0 21±1,0 23±1,2 p-Str Ее R R 14±0,3 R R 13±0,4 R R 12±0,4 Str16±0,9 16±0,9 14±0,7 15±0,2 15±0,2 15±1,0 15±0,6 15±0,6 14±0,8 Ech-c 15±0,4 15±0,4 32±2,4 16±0,3 16±0,2 31±2,3 15±0,3 15±0,3 30±2,8 Echc-h 13±0,2 13±0,2 32±2,0 25 30 35 40 Дослідження чутливості мікрофлори до антибіотиків проводили на початку експерименту, через 6 тижнів та наприкінці досліду. Результати наведені в Табл. 3. Як видно з таблиці, чутливість окремих представників патогенної та умовно-патогенної мікрофлори істотно не змінилась. Діаметр зон затримки росту золотистого стафілокока становив 22,1±1,1-25,1±1,2 КУО/0,02 мл для трьох антибіотиків - цефазоліну, цефтріаксону та ципрофлоксацину. Малочутливими чи стійкими до антибіотиків були ентерококи та негемолітичні стрептококи. Грамнегативна мікрофлора - ешеріхії та гемолітичні ешеріхії - виявилась найбільш чутливою до ципрофлоксацину. Таким чином, дані експерименту показують, що на фоні тривалого впливу опіоїдного анальгетика спостерігаються зміни мікрофлори ротової порожнини - збільшення кількості сапрофітних видів, поява патогенних і умовно-патогенних видів. Чутливість до антибіотиків у ході експерименту не змінювалась. Результати досліджень видового та кількісного складу мікрофлори ротової порожнини піддослідних тварин третьої групи показані в Табл. 4. Як видно з цієї таблиці, на фоні введення опіоїдного анальгетика (1-6 тижні) кількість бактерій-сапрофітів зростала в декілька разів. Кількість S. saprophyticus зростала від 35±3,3 КУО/ 0,02 мл до 55±4,4 КУО/0,02 мл, αгемолітичних стрептококів від 26±2,1 КУО/ 0,02 мл до 60±3,7 КУО/ 0,02 мл, негемолітичних стрептококів - від 40±2,1 КУО/0,02 мл до 64±3,7 КУО/0,02 мл, Е. соlі - від 17±1,3 КУО/0,02 мл до 41±5,1 КУО/0,02 мл. Кількість грампозитивних спорових та неспорових паличок зростала в 2,5 разу. Починаючи з третього-четвертого з'являлись бактерії, кількісні показники цих видів наростали до шостого тижня. Так, кількісний показник щодо S. aureus зріс від 5±0,2 КУО/0,02 мл до 16±0,2 КУО/0,02 мл, S. epidermidis - від 7±0,4 КУО/0,02 мл до 18±1,3 КУО/0,02 мл. Кількість β 4 UA 96423 U 5 10 15 гемолітичних стрептококів і гемолітичних Echerichia coli змінилась незначно - від 5±0,2 КУО/0,02 мл до 8±0,2 КУО/0,02 мл та, відповідно, від 5±0,2 КУО/0,02 мл до 6±0,4 КУО/0,02 мл. Слід відмітити, що на фоні введення опіоїдного анальгетика в експериментальних тварин розвивалися запальні процеси, що проявлялися вираженою гіперемією м'яких тканин пародонту на периферії, явищами гінгівіту, ціанозу ясенних сосочків, дистрофією у тканинах вільної частини ясен, а також крововиливом і набряком. Найбільш ймовірними етіологічними факторами цих процесів є мікробіоценози з участю патогенних та умовно-патогенних видів. У період відміни опіоїдного анальгетика (6-8 тиждень) кількість бактерій як сапрофітних, так і умовно-патогенних та патогенних видів утримувалась на високому рівні. На фоні введення антибіотика "Офрамакс" (діюча речовина - цефтріаксон) відбулись виражені зміни мікрофлори ротової порожнини піддослідних тварин. Зокрема, патогенні види - S. aureus та β-гемолітичні стрептококи, а також грампозитивні спорові та неспорові палички перестали виділятися. Інші види бактерій виділялись у незначних кількостях, за винятком негемолітичних стрептококів, кількість яких становила наприкінці експерименту 17±2,2 КУO/0,02 мл, очевидно, за рахунок ентерококів, стійких до β-лактамних антибіотиків, до яких і належить цефтріаксон ("Офрамакс"). Таблиця 4 Видовий і кількісний склад мікрофлори ротової порожнини білих щурів третьої групи при тривалому впливі опіоїдного анальгетика та подальшій його відміні Кількість бактерій по тижнях дослідження (КУО/0,02 мл) 9 10 Види 6 7 8 1 тижд. 2 тижд. 3 тижд. 4 тижд. 5 тижд. тижд. тижд. бактерій тижд. тижд. тижд. опіоїд опіоїд опіоїд опіоїд опіоїд відміна відміна опіоїд відміна відміна антибіотика антибіотика Sa 5±0,2 8±0,3 17±0,4 16±0,2 17±1,2 15±1,3 4±0,2 поодин. Se 7±0,4 11±0,4 15±1,4 18±1,3 17±1,2 15±1,3 5±0,1 колонії поодин. Ss 35±3,3 38±3,1 39±2,1 48±2,3 44±3,2 55±4,4 54±2,5 51±2,4 7±0,3 колонії StPc26±2,4 32±2,7 48±3,7 54±4,6 60±3,4 64±2,9 61±2,7 60±3,1 12±0,8 4±0,3 β-Str 5±0,2 6±0,2 8±0,2 12±0,8 17±2,8 поодин. α-Str 26±2,1 34±2,0 41±3,4 47±2,8 58±2,3 60±3,7 61±2,1 61±3,9 10±1,1 колонії Str40±2,1 48±5,3 50±3,7 57±2,4 61±5,2 64±3,7 66±2,8 69±4,8 15±1,2 17±2,2 Ech-c 17±1,3 20±1,5 19±1,4 26±2,2 32±2,8 41±5,1 48±3,5 46±2,5 22±1,2 6±0,5 Echc-h 5±0,2 6±0,4 5±0,1 6±0,1 5±0,1 Г+ns 12±1,1 17±1,0 19±1,3 24±1,5 26±2,1 32±2,1 30±2,6 29±2,1 Г+s 10±0,9 14±1,5 16±1,5 19±1,3 23±1,1 25±2,7 25±2,3 26±2,1 Cand 6±0,2 8±0,1 6±0,1 7±0,3 7±0,1 7±0,2 10±0,5 1-2 1-2 1-2 1-2 1-2 1-2 F колонії колонії колонії колонії колонії колонії 20 25 30 Слід відмітити, що, починаючи з 4-го тижня, в посівах виявлялись гриби Candida та фікоміцети, кількість яких була постійною до кінця експерименту. Результати досліджень чутливості до антибіотиків мікрофлори, виділеної з ротової порожнини тварин третьої експериментальної групи, показані у Табл. 5. Як видно з таблиці, сапрофітна мікрофлора, яка виділялась на початку експерименту, була достатньо чутливою до α-лактамних антибіотиків (цефазолін, цефтріаксон), за винятком ентерококів, природностійких до цих препаратів. До ципрофлоксацину чутливими та помірно чутливими були всі ізоляти бактерій. При розвитку патологічних змін у ротовій порожнині на фоні введення опіоїдного анальгетика виділялись сапрофітні, умовно-патогенні та патогенні види бактерій. Антибіотикограми ізолятів сапрофітних видів бактерій істотно не відрізнялись від тих, які були встановлені на початку експерименту. Патогенні види також виявились чутливими як до βлактамних антибіотиків, так і до ципрофлоксацину. Діаметр зони затримки росту S. aureus становив 22±1,3 мм для цефазоліну (цфз), 23±1,5 мм для цефтріаксону (цфа) і 22±1,4 мм для ципрофлоксацину (цфл). Для β-гемолітичних стрептококів ці величини становили 26±1,5 мм (цфз), 29±1,8 мм (цфа) і 24±0,9 мм (цфл), а для гемолітичних ешеріхій - 17±0,8 мм (цфз), 18±1,3 мм (цфа) і 31±2,6 мм (цфл). 5 UA 96423 U 5 10 15 Після проведеного курсу антибіотикотерапії (цефтріаксоном) більшість сапрофітних видів бактерій не виділялись, а решта - виділялись у значно менших кількостях. При цьому антибітикочутливість до антибіотиків цих ізолятів змінилась у бік підвищення резистентності, особливо до цефтріаксону. Так, діаметр зони затримки росту S. aureus становив 19±1,1 мм (цфл), 12±1,0 мм (цфа) і 18±1,2 мм (цфл). Виділені ізоляти β-гемолітичних стрептококів і гемолітичних ешерихій були резистентними до β-лактамних антибіотиків, але зберегли чутливість до ципрофлоксацину. Отже, патогенні та умовно-патогенні бактерії, що виділялись на фоні 6-тижневого впливу опіоїдного анальгетика, перед введенням антибіотика були чутливими до цефазоліну, цефтріаксону, ципрофлоксацину. На фоні введення цефтріаксону ("Офрамакс") виділялися бактерії, чутливість яких до цього препарату була незначною. Очевидно, внаслідок селективної дії антибіотика, в ротовій порожнині щурів переважають бактерії, які малочутливі до антибіотика. Однотижневий курс антибіотикотерапії не забезпечував елімінації патогенних, умовно-патогенних та сапрофітних стафілококів, які при тривалішому введенні антибіотика припиняли виділятися. Таблиця 5 Чутливість до антибіотиків мікрофлори ротової порожнини білих щурів третьої групи, виділеної при тривалому впливі опіоїдного анальгетика та з подальшою його відміною Види бактерій Sa St.Pcβ-Str Ее StrEchc Echc-h 20 25 30 35 40 Антибіотикограма (діаметр затримки росту, мм) Перед введенням На початку експерименту Наприкінці експерименту антибіотика цфз цфа цфл цфз цфа цфл цфз цфа цфл 22±1,3 23±1,5 22±1,4 19±1,1 12±1,0 18±1,2 23±1,2 22±1,3 21±0,9 20±1,0 23±1,4 23±0,8 18±0,8 9±0,5 17±0,5 26±1,5 29±1,8 24±0,9 R R 15±0,8 R R 17±1,1 R R 18±0,9 17±1,1 9±0,8 16±1,0 18±1,1 15±0,8 18±1,4 18±1,7 17±0,7 16±0,9 9±0,3 16±0,8 18±1,3 26±2,0 30±2,7 16±1,3 25±1,8 31±2,6 15±0,7 10±0,3 26±1,1 17±0,8 18±1,1 31±2,6 R R 26±1,8 Введення антибіотика зумовило зменшення проявів запального процесу в ротовій порожнині, а саме вираженої гіперемії м'яких тканин, гінгівіту, явищ ціанозу ясенних сосочків, зменшилася кількість дистрофічних явищ, зокрема, виразок, значно зменшився набряк і крововиливи. Таким чином, під впливом введення опіоїдного анальгетика у ротовій порожнині піддослідних тварин формуються стійкі мікробіоценози за участі патогенних видів мікроорганізмів, які не елімінуються після відміни анальгетика. Ці мікроорганізми перестають виділятися або виділяються в мінімальних кількостях після двотижневого (11 діб) введення цефтріаксону. В експериментальних тварин четвертої групи під впливом довготривалого введення опіоїдного анальгетика - 10 тижнів (70 діб) розвивалися виражені гнійно-запальні процеси в ротовій порожнині, що проявлялися дистрофічними явищами - ціанозом ясенних сосочків, гінгівітом, явищами набряку і крововиливів з відшаруванням тканин періодонту, утворенням виразок, некрозом епітелія, гнійним запаленням в ділянці циркулярної зв'язки, ангіоматозом, утворенням патологічної кишені, що призводить до відшарування тканин періодонту від внутрішньої поверхні зубної комірки. Результати мікробіологічних досліджень у тварин цієї групи показані в Табл. 6. Як видно з таблиці, кількість бактерій наростала протягом усього часу введення опіоїдного анальгетика, а саме, до 10-го тижня. Кількість сапрофітної мікрофлори зростала в 2-2, 5 рази, зокрема, S. saprophyticus - від 35±3,2 КУО/0,02 мл до 71±3,4 КУО/0,02 мл, інших коагулазонегативних стафілококів - від 27±2,1 КУО/0,02 мл до 61±3,0 КУО/0,02 мл, Е. соlі - від 21±2,3 КУО/0,02 мл до 57±2,4 КУО/0,02 мл, грампозитивних спорових бактерій - від 7±0,2 КУО/0,02 мл до 27±2,2 КУО/0,02 мл, а також грампозитивних неспорових бактерій - від 10±1,2 КУО/0,02 мл до 27±3,1 КУО/0,02 мл. Зростала також кількість α-гемолітичних та негемолітичних стрептококів, хоча їхня кількість була достатньо високою на початку експерименту. Умовно-патогенна мікрофлора починала виділятися у міру виникнення патологічних змін, які розвивались на фоні введення опіоїдного анальгетика. S.epidermidis з'являвся на 3-й тиждень, а 6 UA 96423 U 5 10 15 його кількість до кінця 8-го тижня збільшилась у 8 разів. Гемолітичні кишечні палички (Е. Соlі гемолітична) починали виділятися з 5-го тижня експерименту. Золотистий стафілокок (Staphylococcus aureus) виділився на 3-му тижні в кількостях 6±0,5 КУО/0,02 мл, а до 8-го тижня кількість цих бактерій зросла до 45±0,3 КУО/0,02 мл, тобто збільшилась у 8,5 разів. β-гемолітичні стрептококи виділялись із 4-го тижня, а їх кількість зросла на 8-й тиждень у 4 рази. На фоні введення антибіотика (цефтріаксон) стан мікрофлори ротової порожнини піддослідних тварин значно змінився. Після 7-го дня введення антибіотика (початок 10-го тижня експерименту) перестали виділятися грампозитивні спорові та неспорові палички, β-гемолітичні стрептококи і гемолітичні ешерихії, а кількість стафілококів різних видів бактерій зменшилась в 10-15 разів. Кількість а-гемолітичних та негемолітичних стрептококів зменшилась у 3 рази, а ешерихій - у 2,7 разу. Після двотижневого введення цефтріаксону (10-й тиждень експерименту) більшість патогенних та умовно-патогенних видів перестали виділятися. Очевидно, під впливом антибіотика - препарату цефтріаксону наступала елімінація цих видів. Кількість α-гемолітичних стрептококів, негемолітичних стрептококів і ешеріхій зменшилась у 2-2,5 разу, а в порівнянні з 9им тижнем - у 3 рази, ешерихій - у 2,7 рази. Таблиця 6 Видовий і кількісний склад мікрофлори ротової порожнини білих щурів четвертої групи при тривалому впливі опіоїдного анальгетика Види бактерій Sa Se Ss St.Pcβ-Str α-Str StrEch-c Echc-h Г+ns Г+s Cand F 20 1 тижд. опіоїд 35±3,2 27±2,1 36±4,1 46±5,1 21±2,3 10±1,2 7±0,2 Кількість бактерій по тижнях дослідження (КУO/0,02 мл) 2 3 4 5 6 7 8 9 10 тижд. тижд. тижд. тижд. тижд. тижд. тижд. опіоїд опіоїд опіоїд опіоїд опіоїд опіоїд опіоїд опіоїд опіоїд антибіотик антибіотик 6±0,5 18±0,2 27±0,3 36±0,2 47±0,2 45±0,3 3±0,2 7±0,6 16±0,4 25±1,2 38±2,3 47±3,2 49±0,8 8±0,2 38±4,1 31±2,1 58±2,3 54±3,0 65±3,4 69±3,5 71±3,4 7±0,3 39±2,1 68±3,4 64±3,6 60±3,4 61±2,8 64±2,9 61±3,0 11±0,5 7±0,5 16±0,5 18±1,2 27±2,8 27±2,8 44±4,0 69±2,2 72±5,8 68±4,9 65±3,4 65±2,0 64±4,7 21±2,1 12±2,3 58±4,3 62±3,2 69±5,0 61±4,2 60±3,8 56±3,9 59±4,2 15±1,2 6±0,3 50±3,5 53±3,1 56±4,2 52±3,0 59±4,1 58±3,7 57±2,4 20±1 6±0,2 4±0,2 3±0,1 5±0,2 5±0,1 19±2,0 19±2,4 25±2,3 26±3,1 25±2,1 25±2,2 27±3.1 17±1,1 15±1,2 16±1,3 18±2,1 23±2,4 25±2,3 27±2,2 5±0,2 5±0,1 6±0,2 6±0,3 5±0,2 7±0,2 12±0,2 1-2 1-2 1-2 колонії 1-2 колонії колонії колонії Починаючи з 4-го тижня експерименту, з ротової порожнини піддослідних тварин виділялась грибкова мікрофлора, її кількість наростала до кінця періоду спостереження. Таблиця 7 Чутливість до антибіотиків мікрофлори ротової порожнини білих щурів четвертої групи, виділеної при тривалому впливі (10 тижнів) опіоїдного анальгетика Види бактерій Sa St.Pcβ-Str StrEc Антибіотикограма (діаметр зонзатримки росту, мм) Через тиждень після На початку Перед введенням Наприкінці початку експерименту цефтріаксону експерименту антибіотикотерапії цфз цфа цфл цфз цфа цфл цфз цфа цфл цфз цфа цфл - 20±0,9 22±1,1 21±1,0 19±0,9 17±0,8 20±1,2 24±1,1 20±1,0 25±1,3 23±1,0 24±1,7 22±1,4 19±0,7 18±1,1 22±1,3 18±0,9 11±0,3 20±1,0 - 27±2,1 31±1,2 24±1,5 24±1,1 25±1,7 24±1,6 18±0,9 18±0,7 19±1,1 16±0,8 17±0,9 19±1,1 15±0,5 12±0,4 17±0,7 16±0,5 8±0,2 13±0,6 R R 17±0,6 R R 16±0,5 R R 15±0,7 R R 15±0,6 7 UA 96423 U Продовження таблиці 7 Види бактерій Echc Echc-h 5 10 15 20 25 Антибіотикограма (діаметр зонзатримки росту, мм) Через тиждень після На початку Перед введенням Наприкінці початку експерименту цефтріаксону експерименту антибіотикотерапії цфз цфа цфл цфз цфа цфл цфз цфа цфл цфз цфа цфл 19±2,1 22±1,0 32±2,3 18±0,9 28±1,8 34±1,5 17±0,8 10±0,5 31±2,1 16±0,6 8±0,3 26±12,8 - 21±1,5 27±1,5 33±2,4 18±0,9 15±0,88 28±1,9 Результати дослідження антибіотикочутливості мікрофлори, яка виділялась у піддослідних тварин четвертої групи, показані в Табл. 7. Як видно з таблиці, патогенні види - S. aureus, βгемолітичні стрептококи та гемолітичні кишечні палички були достатньо чутливими до трьох досліджених антибіотиків - цефазоліну, цефтріаксону та ципрофлоксацину, що привело до елімінації цієї мікрофлори з ротової порожнини під впливом цефтріаксону (препарат "Офрамакс"). Мікрофлора, яка виділялась на фоні введення антибіотика і після закінчення експерименту, виявилась малочутливою до антибіотиків, зони затримки росту ізолятів коагулазонегативних стафілококів, які виділялись на початку дослідження і перед введенням антибіотика, становили 20-25 мм, а тих, що виділялись наприкінці експерименту, - 11-20 мм. Виявлена найменша чутливість щодо цефтріаксону ізолятів, виділених наприкінці досліду, 11±0,3 мм, тоді як перед введенням антибіотика зона затримки росту становила 20±1,0 мм. Аналогічні зміни чутливості до цефтріаксону виявлені у негемолітичних стрептококів та кишкової палички, тому ці бактерії не елімінувалися при введенні цефтріаксону. Ентерококи, природностійкі до β-лактамних антибіотиків - цефтріаксону та цефазоліну, виділялись на всіх етапах експерименту, а їхня чутливість до ципрофлоксацину не змінювалась. Таким чином, результати досліджень, проведених на експериментальних тваринах, показують, що під впливом антибіотика (цефтріаксону) відбуваються виражені видові та кількісні зміни мікрофлори. Ці зміни виявились в елімінації патогенних видів, значному зменшенні кількості умовно-патогенних та сапрофітних видів. Одночасно виявлено позитивні зміни щодо перебігу патологічних змін у ротовій порожнині, які розвивались на фоні введення опіоїдного анальгетика. Однак, при проведенні монотерапії цефтріаксоном в кінці курсу лікування виділялись ізоляти з підвищеною резистентністю або й резистентні до антибіотика. Отже, вибрана лабораторна модель вказує на необхідність застосування препаратів антибіотиків (цефтріаксону) відповідно до чутливості до них мікрофлори. Це дає можливість обґрунтувати оптимальне використання антибіотиків у клініці для хворих з подібною патологією. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 30 35 Спосіб моделювання лікувальної дії антибіотиків при розвитку патологічного процесу в ротовій порожнині на фоні впливу опіоїдного анальгетика, що включає мікробіологічне дослідження запальних процесів, який відрізняється тим, що в експериментальних тварин на фоні довготривалого впливу опіоїдного анальгетика (від 6-ти до 10-ти тижнів) здійснюють динамічне дослідження мікрофлори зубної бляшки, ясен, слизової оболонки ротової порожнини з визначенням видового складу мікробіоценозів та їхніх кількісних співвідношень із застосуванням мікроскопічного і бактеріологічного методів, а також дискометричного методу визначення антибіотикограм в різні терміни запального процесу, та встановлюють антибіотик широкого спектра дії з метою усунення впливу мікробних агентів на прикінцевому етапі експерименту. 40 Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
Автори англійськоюFIK VOLODYMYR BOHUSLAVOVYCH, Paltov Yevhenii Volodymyrovych, Korniichuk Olena Petrivna, Kryvko Yurii Yaroslavovych
Автори російськоюФИК ВЛАДИМИР БОГУСЛАВОВИЧ, Пальтов Евгений Владимирович, Корнийчук Елена Петровна, Кривко Юрий Ярославович
МПК / Мітки
МПК: G09B 23/28, G01N 33/48
Мітки: ротовій, експериментальних, патологічного, розвитку, процесу, фоні, дії, спосіб, впливу, моделювання, порожнини, анальгетика, опіоїдного, лікувальної, довготривалого, антибіотиків, тварин
Код посилання
<a href="https://ua.patents.su/10-96423-sposib-modelyuvannya-likuvalno-di-antibiotikiv-pri-rozvitku-patologichnogo-procesu-v-rotovijj-porozhnini-eksperimentalnikh-tvarin-na-foni-dovgotrivalogo-vplivu-opiodnogo-analgetika.html" target="_blank" rel="follow" title="База патентів України">Спосіб моделювання лікувальної дії антибіотиків при розвитку патологічного процесу в ротовій порожнині експериментальних тварин на фоні довготривалого впливу опіоїдного анальгетика</a>
Попередній патент: Спосіб термічної утилізації органічних відходів з сезонним алгоритмом використання одержаних альтернативних видів палива при теплопостачанні мікрорайону
Наступний патент: Термоелектричні гілки з наноструктурованих матеріалів bi-sb-te p-типу провідності
Випадковий патент: Спосіб хірургічного лікування цистоцеле