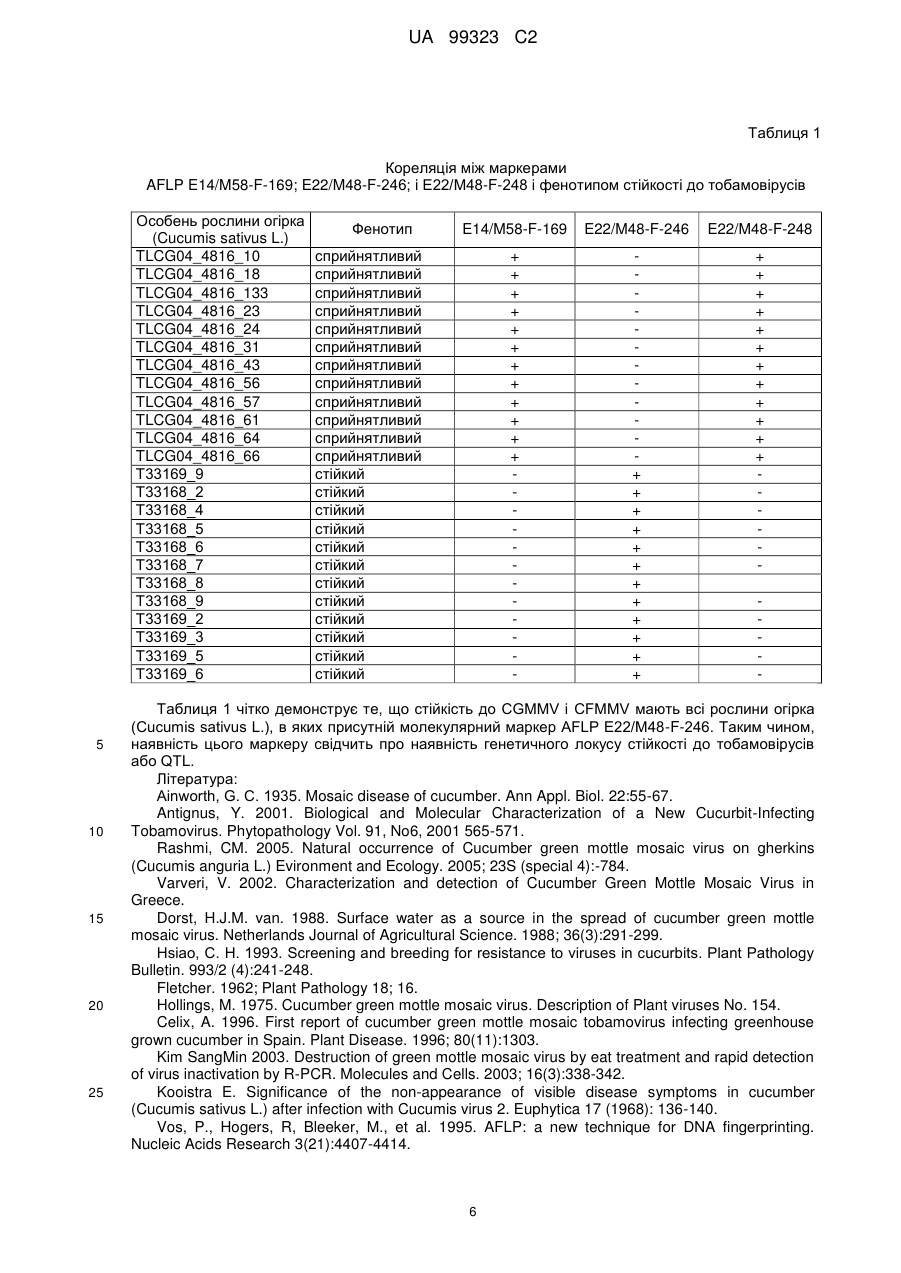
Маркер для ідентифікації генетичного локусу стійкості до тобамовірусів в геномі огірка
Номер патенту: 99323
Опубліковано: 10.08.2012
Автори: ван Кампен Брігіт, Вілтердінк Роналд, Фабер Нанне, Мазереу Яп
Формула / Реферат
1. Застосування молекулярного маркера для ідентифікації генетичного локусу в геномі рослини огірка, який надає стійкості до тобамовірусів, де вказаний генетичний локус, який надає стійкості до тобамовірусів, характеризується ампліфікованим фрагментом нуклеїнової кислоти розміром 246 п. о., шляхом використання праймерів молекулярного поліморфізму довжини ампліфікованих фрагментів (AFLP) SEQ ID NO: 1 і SEQ ID NO: 2 в аналізі молекулярного поліморфізму довжини ампліфікованих фрагментів (AFLP).
2. Застосування за п. 1, де вказана стійкість до тобамовірусів включає стійкість до вірусу зеленої крапчастої мозаїки огірка (CGMMV) і вірусу крапчастої мозаїки плодів огірка (CFMMV).
3. Застосування за п. 1, де вказана стійкість до тобамовірусів включає стійкість до тобамовірусів з підгруп 1 або 2 або обох.
Текст
Реферат: Винахід належить до застосування молекулярного маркера, генетично зчепленого з генетичним локусом загальної стійкості до тобамовірусів, особливо до двох важливих з комерційної точки зору патогенних тобамовірусів, тобто вірусу зеленої крапчастої мозаїки огірка (CGMMV) і вірусу UA 99323 C2 (12) UA 99323 C2 крапчастої мозаїки плодів огірка (CFMMV), для ідентифікації даного локусу в геномі рослини огірка (Cucumis sativus L.). UA 99323 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується молекулярного маркеру, генетично зчепленого з генетичним локусом в геномі рослини огірка, що передає стійкість до тобамовірусів, особливо до двох важливих з комерційної точки зору патогенних тобамовірусів, тобто вірусу зеленої крапчастої мозаїки огірка (CGMMV) і вірусу крапчастої мозаїки плодів огірка (CFMMV), і що дозволяє ідентифікувати даний локус в геномі рослини огірка (Cucumis sativus L.). Крім того, даний винахід стосується способів забезпечення рослин огірка (Cocumis sativus L.), рослин, частин рослин і плодів стійкістю до тобамовірусів, особливо до двох важливих з комерційної точки зору патогенних тобамовірусів, тобто вірусу зеленої крапчастої мозаїки огірка (CGMMV) і вірусу крапчастої мозаїки плодів огірка (CFMMV). Рослини огірка (тобто рослини ботанічного виду Cucumis sativus) належать до сімейства Cucurbitaceae, що також включає такі рослини, як дині і гарбуз. Як правило, їстівні плоди рослини позначають як огірки. Огірки, як правило, являють собою циліндричні, покриті зеленою шкіркою плоди, що приблизно на 96 % складаються з води. Рослина огірка Cucumis sativus L., що культивується з давніх здавен, є важливою плодовою культурою у всьому світі. Огірки, як правило, збирають незрілими, і їх можна застосовувати для одержання соління і продажу в свіжому вигляді. Тобамовіруси, що інфікують представників роду гарбузових, можна поділити на дві підгрупи: підгрупу І, що включає штами й ізоляти, які позначаються в літературі вірусом зеленої крапчастої мозаїки огірка (CGMMV, що складається зі штамів CV3, CV4, CGMMV-W, CGMMV-SH і CGMMV-Is), і підгрупу II, що включає вірус крапчастої мозаїки плодів огірка (CFMMV), вірус зеленої крапчастої мозаїки Kyuri (KGMMV), і штам Yodo CGMMV, близький до KGMMV і який можна розглядати як його штам (Antigus, 2001). Вірус зеленої крапчастої мозаїки огірка (CGMMV) є РНК-вмісним вірусом роду тобамовірусів, який спричиняє важке захворювання гарбузових. Штами CGMMV вперше описані у Великобританії і Європі (Ainsworth, 1935). Вірус присутній у всіх тканинах (Hollings, 1975), швидко переноситься на руки працівника, одяг, ножі й інше обладнання, а також передається з насінням. Для контролю вірусного зараження насіння широко застосовують температурну обробку насіння (Kim, 2003). CGMMV також може розповсюджуватися по поверхні води (Drost, 1988). Описані симптоми пожовтіння, мозаїчності і скручування листя, хоча, можливо найбільш значущими є описи помірно сильних крапчастості і деформації плодів. Подібна крапчастість і деформація плоду швидко роблять заражені культури неприйнятними для торгівлі. Вірус зеленої крапчастої мозаїки огірка (CGMMV) можливо є найбільш поширеним і відомим з тобамовірусів, що інфікують культури огірків. CGMMV є глобальною проблемою в областях вирощування огірків подібних до Нідерландів, Іспанії (Сеlіх, 1996), Греції (Varveri, 2002) і Індії (Rashmi, 2005). Втрати урожаю можуть становити 15 % (Fletcher, 1962). Робилися спроби виявити стійкість огірків до CGMMV (Hsiao, 1993), і знайдені деякі безсимптомні штами з Азії (Kooistra, 1968). Іншим членом сімейства тобамовірусів, що заподіює значну економічну шкоду рослинам огірка (Cucumis sativus L.), є CFMMV. Симптоми інфікування вірусом крапчастої мозаїки плодів огірка (CFMMV), як правило, вперше виявляють на плодах і верхньому листі у відносно просунутій стадії росту. Симптоми враження листя включають виражений мозаїцизм, облямування жилок і жовту крапчастість. У деяких випадках повністю розвинені рослини демонструють важкі симптоми в'янення, які приводять до загибелі рослини. Швидке поширення вірусу всередині теплиць може приводити до значних втрат урожаю. Розглядаючи економічну шкоду, що заподіюється тобамовірусами рослинам огірка (Cucumis sativus L.), особливо CGMMV, CFMMV, включаючи їх варіанти, надто бажано одержати генетичні маркери, генетично зчеплені з генетичним локусом стійкості до тобамовірусів або локусом якісних ознак (QTL), і що дозволяють ідентифікувати даний локус, а також придати цю стійкість до тобамовірусів важливим з економічної точки зору сортам Cucumis sativus L. Таким чином, метою даного винаходу є надання таких генетичних маркерів. За першим аспектом даний винахід стосується способу одержання стійкої до тобамовірусів рослини огірка (Cucumis sativus L.), що включає в собі: (a) ідентифікацію генетичного локусу стійкості до тобамовірусів в першій рослині огірка (Cucumis sativus L.); (b) перенесення ідентифікованого генетичного локусу стійкості до тобамовірусів у другу рослину огірка (Cucumis sativus L.), таким чином, придаючи вказаній другій рослині огірка (Cucumis sativus L.) стійкості до тобамовірусів; де генетичний локус стійкості до тобамовірусів характеризується присутністю ампліфікованого фрагмента нуклеїнової кислоти розміром від 241 до 251 п.о. при аналізі 1 UA 99323 C2 5 10 15 20 25 30 35 40 45 50 55 60 молекулярного поліморфізму довжини ампліфікованих фрагментів (AFLP) із застосуванням праймерів SEQ ID NO:1 і SEQ ID NO:2 для молекулярного поліморфізму довжини ампліфікованих фрагментів (AFLP). За даним винаходом, праймер SEQ ID NO:1 містить послідовність нуклеїнової кислоти 5GAC TGC GTA CCA ATT CGT-3', а праймер SEQ ID NO:2 містить послідовність нуклеїнової кислоти 5'-GAT GAG ТСС TGA GTA АСА С-3'. Маркер молекулярного поліморфізму довжин ампліфікованих фрагментів (AFLP), генетично зчеплений з генетичним локусом стійкості до тобамовірусів і що дозволяє ідентифікувати даний локус, позначений в цьому документі як маркер E22/M48-F-246 (розмір ампліфікованого фрагмента нуклеїнової кислоти при застосуванні праймерів SEQ ID NO:1 і 2 становить 241-251 п.о., переважно - 245-247 п.о., найбільш переважно - 246 п.о.). Першою рослиною огірка (Cucumis sativus L.) за даним винаходом може бути будь-яка рослина огірка (Cucumis sativus L.), що має фенотип стійкості до тобамовірусів, особливо до CGMMV і CFMMV, зумовленої генетичним локусом, ідентифікованим за присутністю ампліфікованого фрагмента нуклеїнової кислоти, як визначено вище (маркер E22/M48-F-246). Присутність ампліфікованого фрагмента нуклеїнової кислоти або молекулярного маркеру AFLP E22/M48-F-246, і, таким чином, присутність даного генетичного локусу стійкості можна визначити із застосуванням будь-якого прийнятного молекулярно-біологічного способу аналізу продуктів ампліфікації нуклеїнових кислот, такого як електрофорез в гелі, гібридизація, афінна хроматографія, флуоресценція і т.д. В особливо переважному варіанті здійснення фрагменти ампліфікують і ідентифікують за допомогою способу ампліфікації і детекції нуклеїнової кислоти, що позначається в даній галузі як молекулярний поліморфізм довжини ампліфікованих фрагментів (AFLP, Zabeau, 1993, і Vos, 1995). Аналіз поліморфізму довжин ампліфікованих фрагментів (AFLP) є основаним на полімеразній ланцюговій реакції (ПЛР) способом генетичного фінгерпринтингу, розробленого на початку 1990-х pp. компанією Keygene. Для розрізання геномної ДНК в AFLP застосовують ферменти рестрикції з подальшим лігуванням з кінцями рестрикованих фрагментів комплементарних дволанцюгових адаптерів. Потім підгрупу рестрикованих фрагментів ампліфікують із застосуванням пар праймерів, комплементарних адаптеру і рестрикованим фрагментам. Фрагменти візуалізують в денатуруючих поліакриламідних гелях із застосуванням авторадіографії або флуоресцентних способів. Як правило, в результаті цього одержують множину ампліфікованих фрагментів нуклеїнових кислот різного розміру. Порівнюючи ампліфіковані фрагменти нуклеїнової кислоти, одержані, наприклад, із сприйнятливої і стійкої рослини, можна ідентифікувати у двох фенотипів ампліфіковані фрагменти нуклеїнової кислоти, які розрізнюються, також що позначаються як маркери. У цьому випадку специфічний маркер AFLP, що позначається як маркер AFLP E22/M48-F246, генетично зчеплений з локусом стійкості і який дозволяє ідентифікувати даний локус, ідентифікували за присутністю ампліфікованого фрагмента нуклеїнової кислоти розміром 241251 п.о., переважно - 245-247 п.о., найбільш переважно - 246 п.о. Цей маркер присутній у стійких рослинах разом з рядом інших ампліфікованих фрагментів AFLP, які не відрізняються і відсутній у сприйнятливих рослин. Потрібно зазначити, що в ході визначення генетичного локусу стійкості до тобамовірусів в першій рослині огірка (Cucumis sativus L.) аналіз AFLP рослин огірка (Cucumis sativus L.) із застосуванням праймерів AFLP SEQ ID NO:1 і 2 показав наявність другого ампліфікованого фрагмента нуклеїнової кислоти, що відрізняється за розміром від даного маркеру AFLP E22/M48-F-246 на 2 п.о. За даним винаходом даний більш довгий (2 п.о.) ампліфікований фрагмент нуклеїнової кислоти генетично не зчеплений з генетичним локусом стійкості до тобамовірусів і не може служити для ідентифікації даного локусу. Іншими словами, при аналізі AFLP із застосуванням праймерів AFLP SEQ ID NO:1 і 2 перша рослина огірка (Cucumis sativus L.) за даним винаходом повинна демонструвати наявність маркеру AFLP E22/M48-F-246за даним винаходом вказаного розміру, але також вона може демонструвати наявність другого ампліфікованого фрагменту нуклеїнової кислоти більшого розміру (2 п.о.). Даний винахід стосується обох перших рослин огірка (Cucumis sativus L.), тобто які демонструють маркер AFLP E22/M48-F-246 або які демонструють маркер AFLP E22/M48-F-246 і, додатково, другий трохи більший (2 п.о.) фрагмент. Однак, перші рослини огірка (Cucumis sativus L.), які демонструють лише другий трохи більший (2 п.о.) фрагмент, не включені в даний винахід. 2 UA 99323 C2 5 10 15 20 25 30 35 40 45 50 55 Беручи до уваги зазначене вище, вибір першої рослини огірка (Cucumis sativus L.) за даним винаходом по суті включає в себе визначення локусу стійкості до тобамовірусів у рослини із застосуванням молекулярно-біологічних способів. Це викликано тим, що даний локус стійкості до тобамовірусів, генетично зчеплений з маркером AFLP E22/M48-F-246, не можна визначити тільки із застосуванням загального для звичайних способів селекції відбору на основі фенотипу. Іншими словами, ідентифікація генетичного локусу стійкості до тобамовірусів в першій рослині огірка (Cucumis sativus L.) не стосується тільки застосування, звичайного способу відбору. Після ідентифікації генетичного локусу стійкості до тобамовірусів за даним винаходом в першій рослині огірка (Cucumis sativus L.), генетичний локус переносять у другу рослину огірка (Cucumis sativus L.), таким чином, надаючи стійкості до тобамовірусів вказаної другої рослини огірка (Cucumis sativus L.). Переважно, перенесення генетичного локусу стійкості до тобамовірусів за даним винаходом включає загальноприйняті способи селекції, такі як традиційне схрещування першої рослини огірка (Cucumis sativus L.) з другою рослиною огірка (Cucumis sativus L.) і подальше одне або декілька зворотних схрещувань з другою рослиною огірка (Cucumis sativus L.). Однак переважно поєднувати такі загальноприйняті способи селекції з молекулярно-біологічними способами для підтримання даного генетичного локусу стійкості у другій рослині огірка (Cucumis-sativus L.). В порівнянні із загальноприйнятими способами селекції, надання даного маркеру AFLP E22/M48-F-246 за даним винаходом робить можливим швидку селекцію прийнятних стійких до тобамовірусів нащадків після кожного зворотного схрещування, дозволяючи уникнути для ідентифікації прийнятних стійких до тобамовірусів нащадків застосування для кожного покоління трудомістких способів скринінгу, що дорого коштують, таких як вірусна інфекція і створення стійкого фенотипу. У переважному варіанті здійснення друга рослина огірка (Cucumis sativus L.) є сприйнятливою до тобамовірусів комерційним сортом. Переносячи в цю рослину даний генетичний локус стійкість при збереженні інших комерційно значущих високоякісних генетичних і фенотипічних характеристик одержують рослину огірка (Cucumis sativus L.) із збільшеною економічною цінністю. У найбільш переважному варіанті здійснення, спосіб за даним винаходом дозволяє одержувати рослину огірка (Cucumis sativus L.) з генотипом другої рослини огірка (Cucumis sativus L.), доповненим генетичним локусом стійкості до тобамовірусів першої рослини огірка (Cucumis sativus L.). Таким чином, за другим аспектом, даний винахід також стосується рослини огірка (Cucumis sativus L.) з генотипом сприйнятливого до тобамовірусів сорту рослини огірка (Cucumis sativus L.), доповненим генетичним локусом стійкості до, тобамовірусів, де генетичний локус стійкості до тобамовірусів характеризується присутністю ампліфікованого фрагмента нуклеїнової кислоти розміром від 241 до 251 п.о., переважно - від 245 до 247 п.о., найбільш переважно - 246 п.о., що одержується із застосуванням праймерів молекулярного поліморфізму довжини ампліфікованих фрагментів (AFLP) SEQ ID NO:1 і SEQ ID NO:2 при аналізі молекулярного поліморфізму довжини ампліфікованих фрагментів (AFLP). Стійкість до тобамовірусів, наприклад, генетичний локус стійкості до тобамовірусів за даним винаходом щонайменше придає в переважному варіанті здійснення стійкість до вірусу зеленої крапчастої мозаїки огірка (CGMMV) і вірусу крапчастої мозаїки плодів огірка (CFMMV). За третім аспектом даний винахід стосується використання генетичного локусу стійкості до тобамовірусів для одержання стійких до тобамовірусів рослин огірка (Cucumis sativus L.), де генетичний локус стійкості до тобамовірусів характеризується, як визначено вище. За цим третім аспектом даного винаходу стійкість до тобамовірусів включає стійкість до вірусу зеленої крапчастої мозаїки огірка (CGMMV) і вірусу крапчастої мозаїки плодів огірка (CFMMV). За четвертим аспектом даний винахід стосується генетичного локусу стійкості до тобамовірусів, що характеризується ампліфікованим фрагментом нуклеїнової кислоти розміром від 241 до 251 п.о., одержаним із застосуванням праймерів молекулярного поліморфізму довжини ампліфікованих фрагментів (AFLP) SEQ ID NO:1 і SEQ ID NO:2 при аналізі молекулярного поліморфізму довжини ампліфікованих фрагментів (AFLP). Переважно, даний генетичний локус стійкості до тобамовірусів характеризується ампліфікованим фрагментом нуклеїнової кислоти AFLP розміром від 245 до 247 п.о. Найбільш переважно, генетичний локус стійкості до тобамовірусів за даним винаходом характеризується ампліфікованим фрагментом нуклеїнової кислоти AFLP розміром 246 п.о. 3 UA 99323 C2 5 10 15 20 25 30 35 40 45 50 55 60 Потрібно зазначити, що в даний винахід не включені генетичні локуси, що визначаються тільки за одержуваним із застосуванням праймерів AFLP SEQ ID NO:1 і SEQ ID NO:2 AFLP ампліфікованим фрагментом нуклеїнової кислоти трохи більшого, в порівнянні з описаним вище фрагментом, розміру (2 п.о.). За четвертим аспектом даного винаходу стійкість до тобамовірусів переважно включає стійкість до вірусу зеленої крапчастої мозаїки огірка (CGMMV) і вірусу крапчастої мозаїки плодів огірка (CFMMV). Далі даний винахід буде детально описаний в супроводжувальних прикладах. ПРИКЛАДИ Приклад 1: Ідентифікація сприйнятливої і стійкої рослин огірка (Cucumis sattnyofls L.) Вступ Для класифікації рослин огірка (Cucumis sativus L.) як сприйнятливих і стійких до інфікування вірусом зеленої крапчастої мозаїки огірка (CGMMV) і вірусом крапчастої мозаїки плодів огірка (CFMMV) застосовували наведений нижче протокол. Щонайменше для Нідерландів, кращим часом для проведення аналізу є період з вересня по квітень. Рослинний матеріал Стійкі і сприйнятливі рослини (Cucumis sativus L.)для тестування висівали у вермикуліт середнього розміру і вирощували при 24 °C, прикритими вермикулітом невеликого розміру. Через 4-5 діб (як тільки розправлялися сім'ядолі) саджанці переносили в блоки мінеральної вати, і, через 2 доби рослини переносили в карантинну теплицю. Через кожний блок з 40 екземплярів рослин як сприйнятливий контроль розміщували сприйнятливий контроль Тугіа F1 (комерційний сорт огірка Enza Zaden F1, Нідерланди), і саджанці інокулювали в сім'ядолі, переважно через 4 доби після їх поміщення в карантинну теплицю. Патоген Одержували ізоляти CGMMV і CFMMV. У короткому викладі, для одержання інокулятів готували свіжий фосфатний буфер (0,1 М розчин фосфату, pH 7,7). Відбирали матеріал листя із зараженої рослини огірка (Cucumis sativus L.) з недавно розвиненими симптомами. Брали тканину молодого листя без стебла з чіткими симптомами. Приблизно, на 1 г матеріалу листя використовували 5 мл буфера. Матеріал листя перемелювали, таким чином, одержуючи вірусні ізоляти. Для інфікування вирощені зазначеним вище способом рослини в сонячну погоду затіняли покривалом за одну добу до інфікування. Через день після інфікування покривало знімали. Однак у разі інтенсивної освітленості покривало необхідно залишати ще на добу. У разі низької вологості вологість можна підвищувати за допомогою зволоження сірих лотків безпосередньо після інфікування для запобігання морщенню сім'ядолей внаслідок пошкодження при інфікуванні. Температурний режим становив 18-20 °C вночі і 22-25 °C вдень. Рослини трохи присипали карборундом через подвійну марлю. В інокулят занурювали губку і двічі протирали всю поверхню обох сім'ядолей. Хоч вірус був стабільним, інфікування необхідно продовжувати менше 1 години. Характеристика У перших двох листів рослин огірка не виявляли симптомів (як у сприйнятливих, так і у стійких рослин). На стадії від третього до четвертого листа симптоми легко дозволяють оцінити сприйнятливість або стійкість. Приклад 2: Ідентифікація маркерів AFLP, що визначають QTL стійкості до тобамовірусів Вступ У даному прикладі в стійких рослинах огірка (Cucumis sativus L.) із застосуванням загального аналізу QTL (BQA), виконаного Keygene N.V. (Wageningen, Нідерланди) ідентифікували локус якісної ознаки (QTL). Для виявлення маркеру стійкості відбирали популяцію з 98 індивідуальних рослин. На двох групах, які містять індивідуальні рослини, що демонструють "граничні фенотипи" стійкості до тобамовірусів, піддавали скринінгу сукупність комбінацій 96 праймерів AFLP. Потім п'ять маркерів-кандидатів верифікували на 12 стійких і 12 сприйнятливих особнях. Ідентифікація і верифікація маркеру Із 130 рослин одержували матеріал листя: популяції Cuc1879-01OK561 з 98 індивідуальних рослин для одержання тестованої популяції, 30 інбредних ліній батьків-донорів Cuc1879-01 і батьківських ліній популяції. Виділяли ДНК і одержували матриці EcoRI/Msel. Проводили фінгерпринт-тест 130 рослин із застосуванням комбінації праймерів Е14/М59. BSA і верифікація на індивідуальних рослинах BQA проводили за допомогою скринінгу сукупності комбінацій 96 праймерів на групі, яка включає десять "гранично стійких" індивідуальних рослин, і групі, яка включає десять "гранично 4 UA 99323 C2 5 10 15 20 25 30 35 40 45 50 сприйнятливих" індивідуальних рослин. Даний скринінг в результаті привів до ідентифікації наступних маркерів-кандидатів: E14/M58-F-169-P2 E22/M48-F-248/246 (біалельний) Потім ці маркери перевіряли на 24 особнях (12 стійких особнів і 12 сприйнятливих особнів). На основі цієї верифікації підтвердили зв'язок даних маркерів зі стійкістю до тобамовірусів. Верифікація маркерів-кандидатів на популяції Після скринінгу комбінацій 96 праймерів і подальшої валідації маркерів ідентифікували один передбачуваний QTL. Для того щоб визначити чи є ідентифікований QTL насправді окремим QTL провели аналіз зчеплення. Маркери (E14/M58-F-169-P2 і біалельний маркер E22/M48-F-248/246) перевіряли на 46 додаткових окремих рослинах з популяції 98 рослин. Одержували масив даних про маркери і об'єднували з масивом даних, одержаним на 24 рослинах. На основі цього аналізу робили висновок про зчеплення чотирьох маркерів з одним QTL. Аналіз маркерів із застосуванням WinQTLCartographer Для визначення кореляції між фенотипом і генотипом масив даних про маркери аналізували за допомогою пакету програмного забезпечення " WinQTLCartographer. Для аналізу одиничного маркеру (SMA) розраховували величину LOD, що дорівнює 12. Для картування інтервалів (IM) розраховували 95 % рівень значущості, проводячи 1000 пермутацій на даних за фенотипами і його визначили як LOD 0,9. Для даного QTL розрахували величину LOD і процент з'ясовної дисперсії (LOD: 9; Поясн. дисп.: 49,5). Висновки Для ідентифікації QTL стійкості до тобамовірусів проводили BQA. Всього піддавали скринінгу 96 поєднань праймерів на партії з десяти "гранично стійких" індивідуальних рослин і партії з десяти "гранично сприйнятливих" індивідуальних рослин. Маркери-кандидати, один з яких був біалельним, верифікували на 12 "гранично стійких" і 12 "гранично сприйнятливих" індивідуальних рослинах і на 48 інших індивідуальних рослинах з популяції. Зону QTL ідентифікували із застосуванням підходу BQA. Даний QTL пояснює приблизно 50 % дисперсії. Основуючись на TestPC (приблизно п'ять маркерів), в 30 інбредних лініях від стійких батьківських донорів Cuc 1879-01 не виявили гетерогенності. Приклад 3: Ідентифікація стійких рослин огірка (Cucumis sativus L.) за допомогою молекулярного маркеру Молекулярний аналіз Із застосуванням стандартних протоколів одержували геномний матеріал зі сприйнятливих, тобто які демонструють один або декілька симптомів вірусної інфекції як описано вище, і стійких індивідуальних рослин огірка (Cucumis sativus L.). Потім даний геномний матеріал розщеплювали із застосуванням прийнятних ферментів рестрикції (EcoRI/Msel) і, після лігування адаптерів, піддавали ампліфікації нуклеїнові кислоти AFLP із застосуванням пари праймерів SEQ ID NO:1 5-GAC TGC GTA CCA ATT CGT-3' і SEQ ID NO:2 5'- GAT GAG ТСС TGA GTA АСА C-3' або пари праймерів SEQ ID NO:3 5'- GAC TGC GTA CCA ATT САТ-3' і SEQ ID NO:4 5'- GAT GAG ТСС TGA GTA ACG T-3'. Одержані продукти ампліфікації розділювали із застосуванням електрофорезу в гелі для визначення розміру. Наявність маркерів AFLP в геномі особнів рослин огірка (Cucumis sativus L.) визначали як відсутність (-) або як наявність (+). Зокрема, за присутністю маркеру AFLP E14/M58-F-169 (не включеного в даний винахід, праймери SEQ ID NO:3 і 4) спостерігали смугу, що відповідає приблизно 169 п.о.; за присутністю маркеру AFLP E22/M48-F-248 (не включеного в даний винахід, праймери SEQ ID NO:3 і 4) спостерігали смугу, що відповідає приблизно 248 п.о. Маркер AFLP E14/M48-F-246 (включений в даний винахід, праймери SEQ ID NO:3 і 4) з очікуваним розміром приблизно в 246 п.о. генетично корелює з генотипом стійкості. Результати наведені в таблиці 1 нижче. 5 UA 99323 C2 Таблиця 1 Кореляція між маркерами AFLP E14/M58-F-169; E22/M48-F-246; і Е22/М48-F-248 і фенотипом стійкості до тобамовірусів Особень рослини огірка (Cucumis sativus L.) TLCG04_4816_10 TLCG04_4816_18 TLCG04_4816_133 TLCG04_4816_23 TLCG04_4816_24 TLCG04_4816_31 TLCG04_4816_43 TLCG04_4816_56 TLCG04_4816_57 TLCG04_4816_61 TLCG04_4816_64 TLCG04_4816_66 Т33169_9 Т33168_2 Т33168_4 Т33168_5 Т33168_6 Т33168_7 Т33168_8 Т33168_9 Т33169_2 Т33169_3 Т33169_5 Т33169_6 5 10 15 20 25 Фенотип E14/M58-F-169 E22/M48-F-246 E22/M48-F-248 + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + сприйнятливий сприйнятливий сприйнятливий сприйнятливий сприйнятливий сприйнятливий сприйнятливий сприйнятливий сприйнятливий сприйнятливий сприйнятливий сприйнятливий стійкий стійкий стійкий стійкий стійкий стійкий стійкий стійкий стійкий стійкий стійкий стійкий Таблиця 1 чітко демонструє те, що стійкість до CGMMV і CFMMV мають всі рослини огірка (Cucumis sativus L.), в яких присутній молекулярний маркер AFLP E22/M48-F-246. Таким чином, наявність цього маркеру свідчить про наявність генетичного локусу стійкості до тобамовірусів або QTL. Література: Ainworth, G. С. 1935. Mosaic disease of cucumber. Ann Appl. Biol. 22:55-67. Antignus, Y. 2001. Biological and Molecular Characterization of a New Cucurbit-Infecting Tobamovirus. Phytopathology Vol. 91, No6, 2001 565-571. Rashmi, CM. 2005. Natural occurrence of Cucumber green mottle mosaic virus on gherkins (Cucumis anguria L.) Evironment and Ecology. 2005; 23S (special 4):-784. Varveri, V. 2002. Characterization and detection of Cucumber Green Mottle Mosaic Virus in Greece. Dorst, H.J.M. van. 1988. Surface water as a source in the spread of cucumber green mottle mosaic virus. Netherlands Journal of Agricultural Science. 1988; 36(3):291-299. Hsiao, С. Н. 1993. Screening and breeding for resistance to viruses in cucurbits. Plant Pathology Bulletin. 993/2 (4):241-248. Fletcher. 1962; Plant Pathology 18; 16. Hollings, M. 1975. Cucumber green mottle mosaic virus. Description of Plant viruses No. 154. Celix, A. 1996. First report of cucumber green mottle mosaic tobamovirus infecting greenhouse grown cucumber in Spain. Plant Disease. 1996; 80(11):1303. Kim SangMin 2003. Destruction of green mottle mosaic virus by eat treatment and rapid detection of virus inactivation by R-PCR. Molecules and Cells. 2003; 16(3):338-342. Kooistra E. Significance of the non-appearance of visible disease symptoms in cucumber (Cucumis sativus L.) after infection with Cucumis virus 2. Euphytica 17 (1968): 136-140. Vos, P., Hogers, R, Bleeker, M., et al. 1995. AFLP: a new technique for DNA fingerprinting. Nucleic Acids Research 3(21):4407-4414. 6 UA 99323 C2 Zabeau M and P. Vos. 1993. Selective restriction fragment amplification: a general method for DNA fingerprinting. European Patent Office, publication 0534858 A1, bulletin 93/13. 5 212 ДНК 213 Штучна 220 7 UA 99323 C2 223 праймер 4 для аналізу молекулярного поліморфізму довжини ампліфікованого фрагмента 400 4 gatgagtcct gagtaacgt 5 ФОРМУЛА ВИНАХОДУ 10 15 1. Застосування молекулярного маркера для ідентифікації генетичного локусу в геномі рослини огірка, який надає стійкості до тобамовірусів, де вказаний генетичний локус, який надає стійкості до тобамовірусів, характеризується ампліфікованим фрагментом нуклеїнової кислоти розміром 246 п. о., шляхом використання праймерів молекулярного поліморфізму довжини ампліфікованих фрагментів (AFLP) SEQ ID NO: 1 і SEQ ID NO: 2 в аналізі молекулярного поліморфізму довжини ампліфікованих фрагментів (AFLP). 2. Застосування за п. 1, де вказана стійкість до тобамовірусів включає стійкість до вірусу зеленої крапчастої мозаїки огірка (CGMMV) і вірусу крапчастої мозаїки плодів огірка (CFMMV). 3. Застосування за п. 1, де вказана стійкість до тобамовірусів включає стійкість до тобамовірусів з підгруп 1 або 2 або обох. Комп’ютерна верстка Л.Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
Назва патенту англійськоюMarker for identification of genetic tobamovirus resistance locus in cucumber genome
Автори англійськоюMazereeuw, Jaap, van Kampen, Brigit, Faber, Nanne, Wilterdink, Ronald
Назва патенту російськоюМаркер для идентификации генетического локуса стойкости к тобамовирусам в геноме огурца
Автори російськоюМазереу Яп, ван Кампен Бригит, Фабер Нанне, Вилтердинк Роналд
МПК / Мітки
МПК: C12Q 1/68, C12N 15/82, A01H 5/00
Мітки: стійкості, локусу, тобамовірусів, огірка, маркер, геномі, генетичного, ідентифікації
Код посилання
<a href="https://ua.patents.su/10-99323-marker-dlya-identifikaci-genetichnogo-lokusu-stijjkosti-do-tobamovirusiv-v-genomi-ogirka.html" target="_blank" rel="follow" title="База патентів України">Маркер для ідентифікації генетичного локусу стійкості до тобамовірусів в геномі огірка</a>
Попередній патент: Гідродинамічна муфта транспортного засобу
Наступний патент: Правила керування і тарифікації політики (рсс), основані на протоколі мобільності
Випадковий патент: Прилад візуального відображення інформації