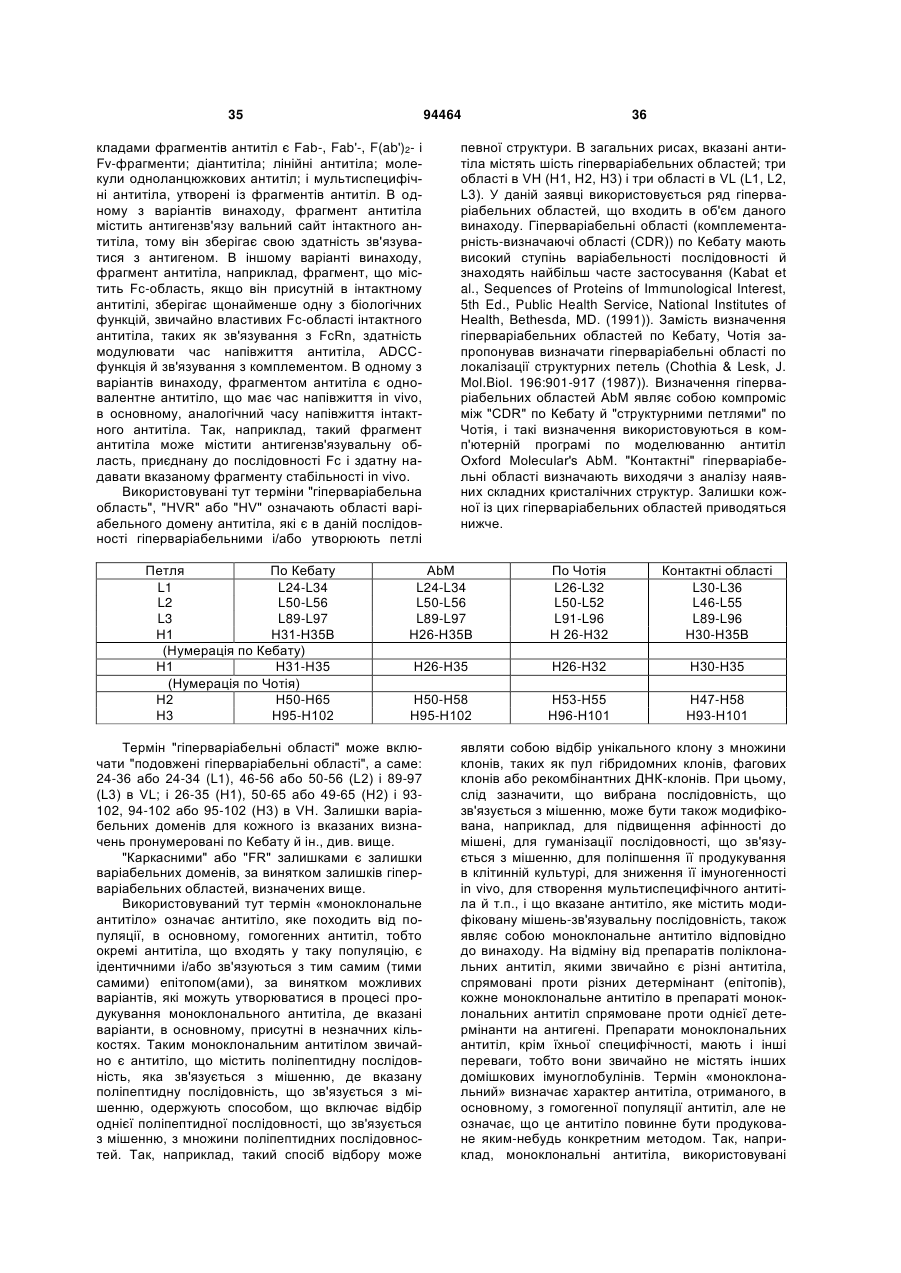
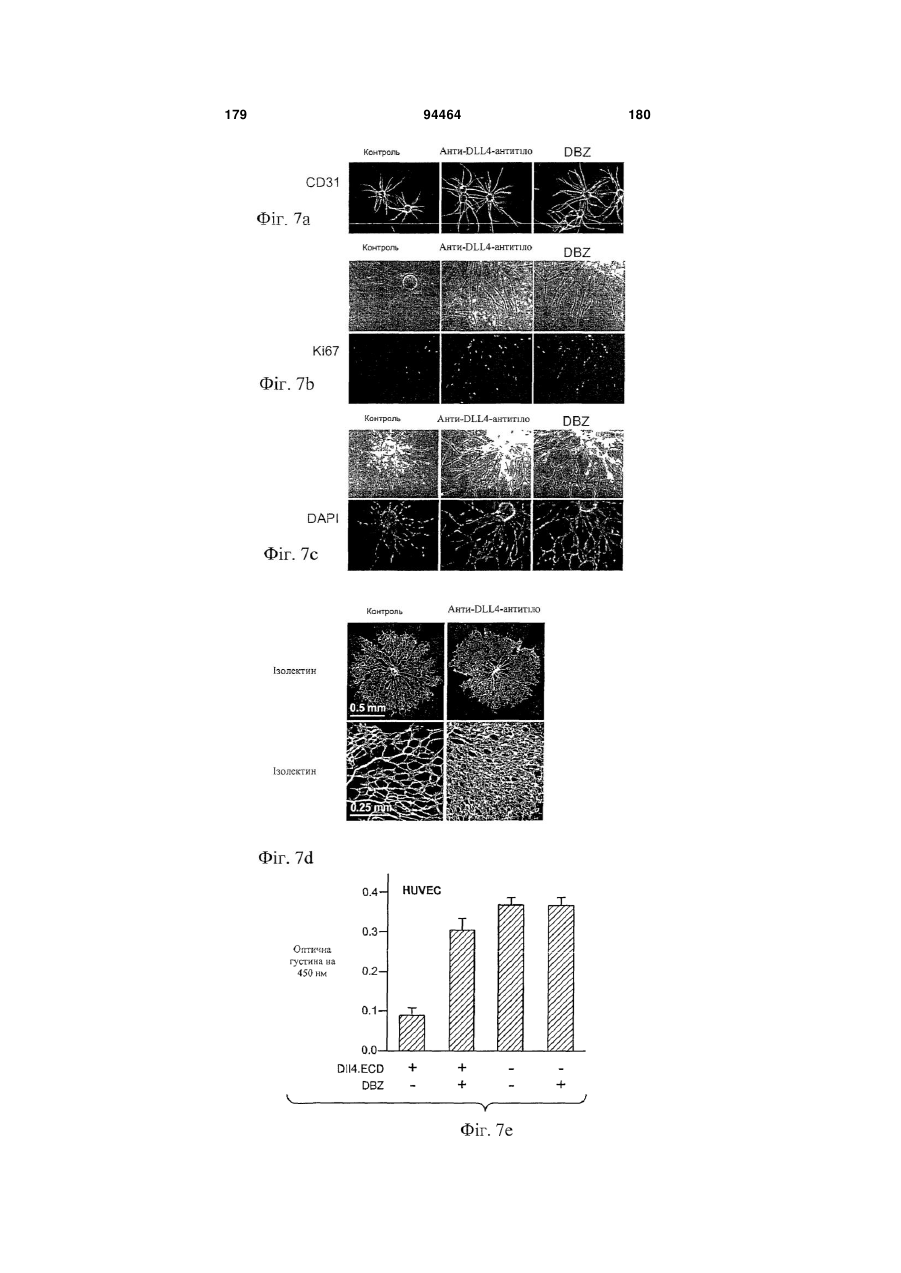
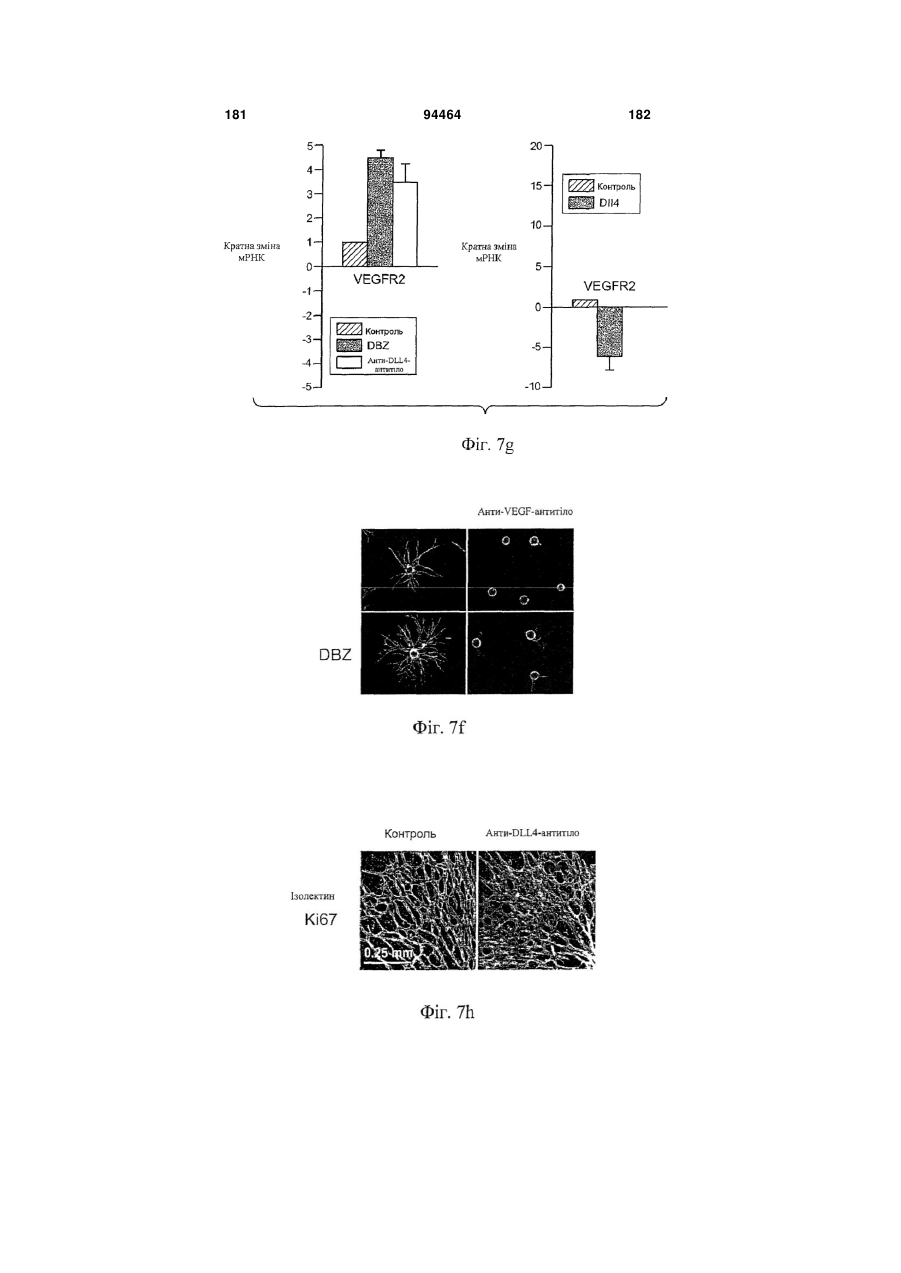
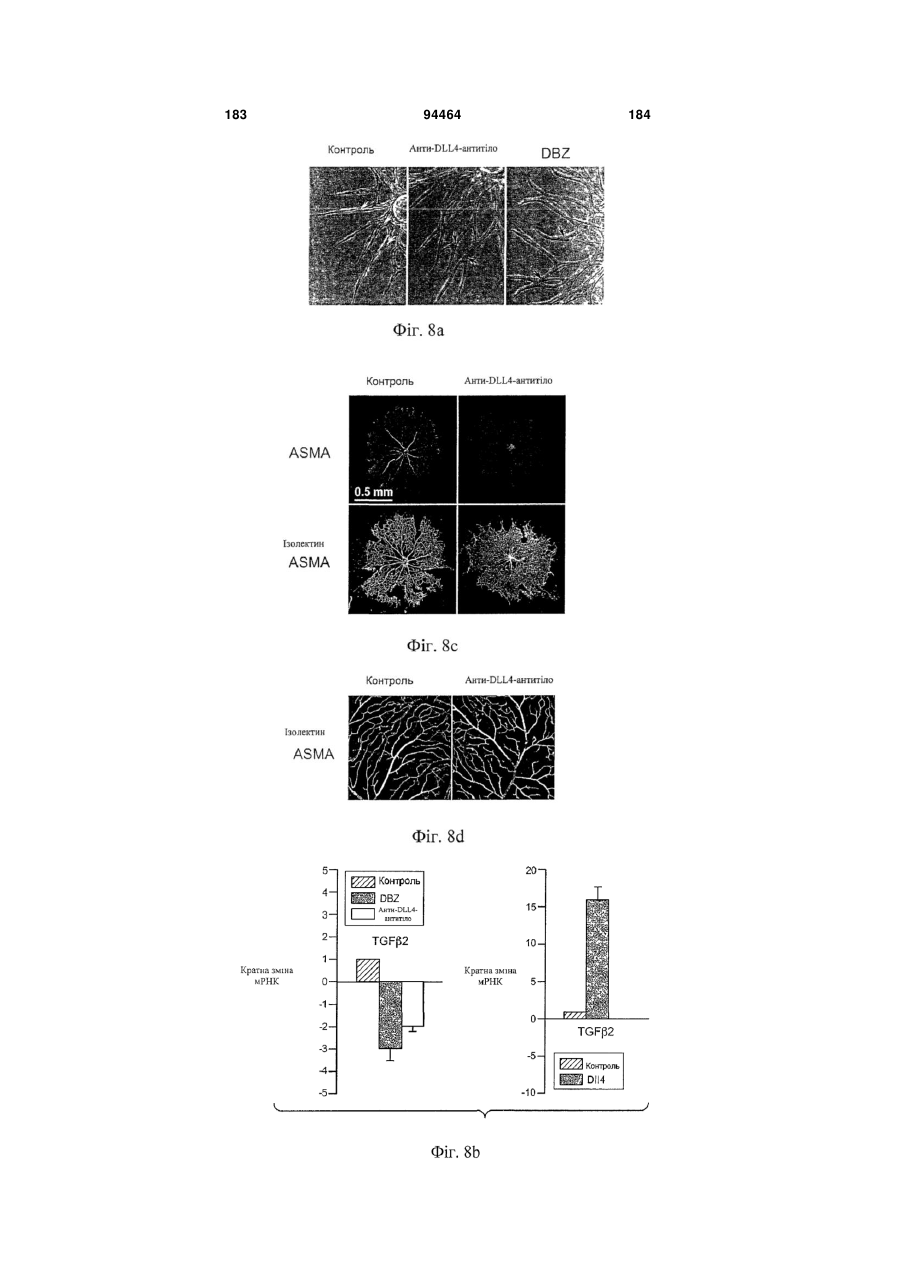
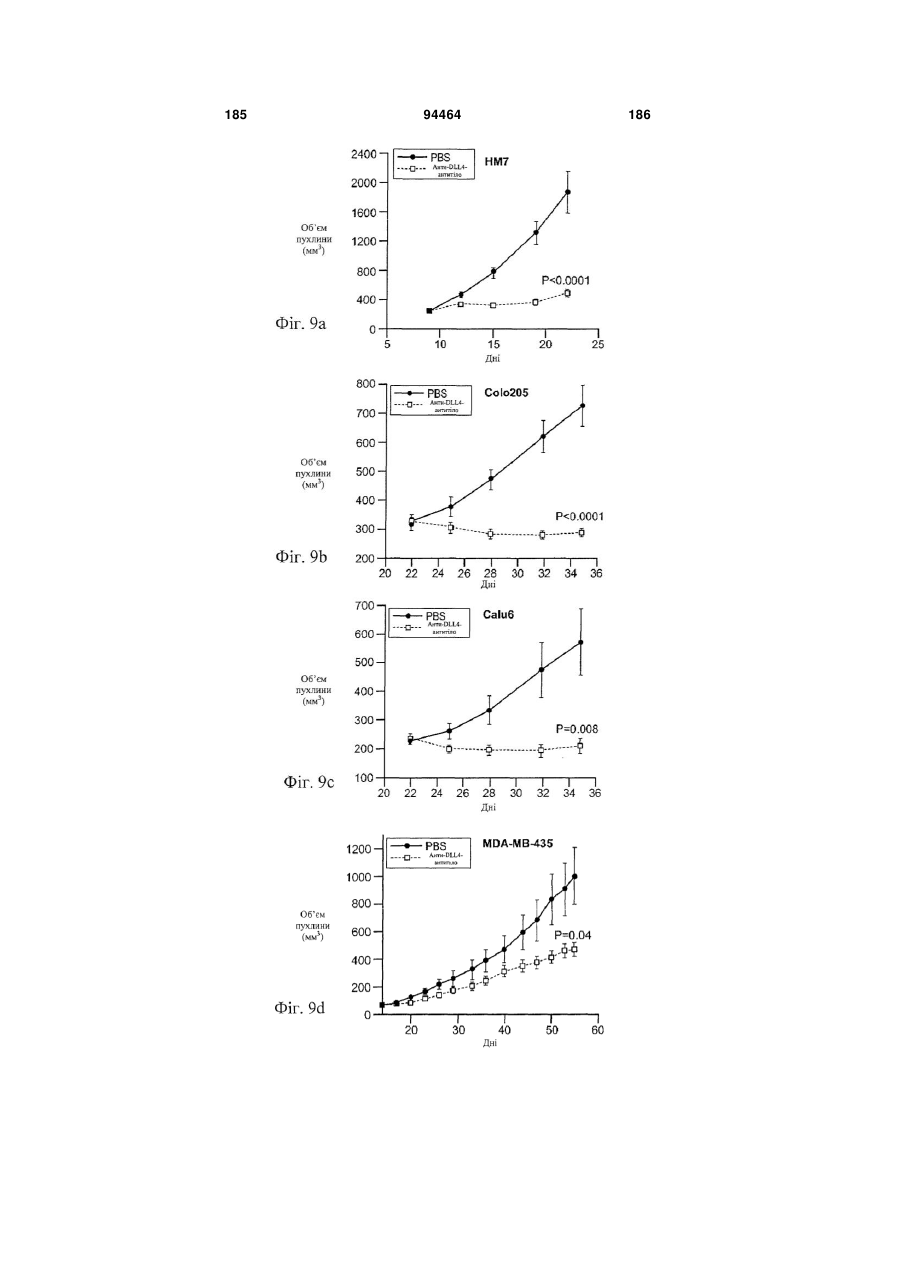
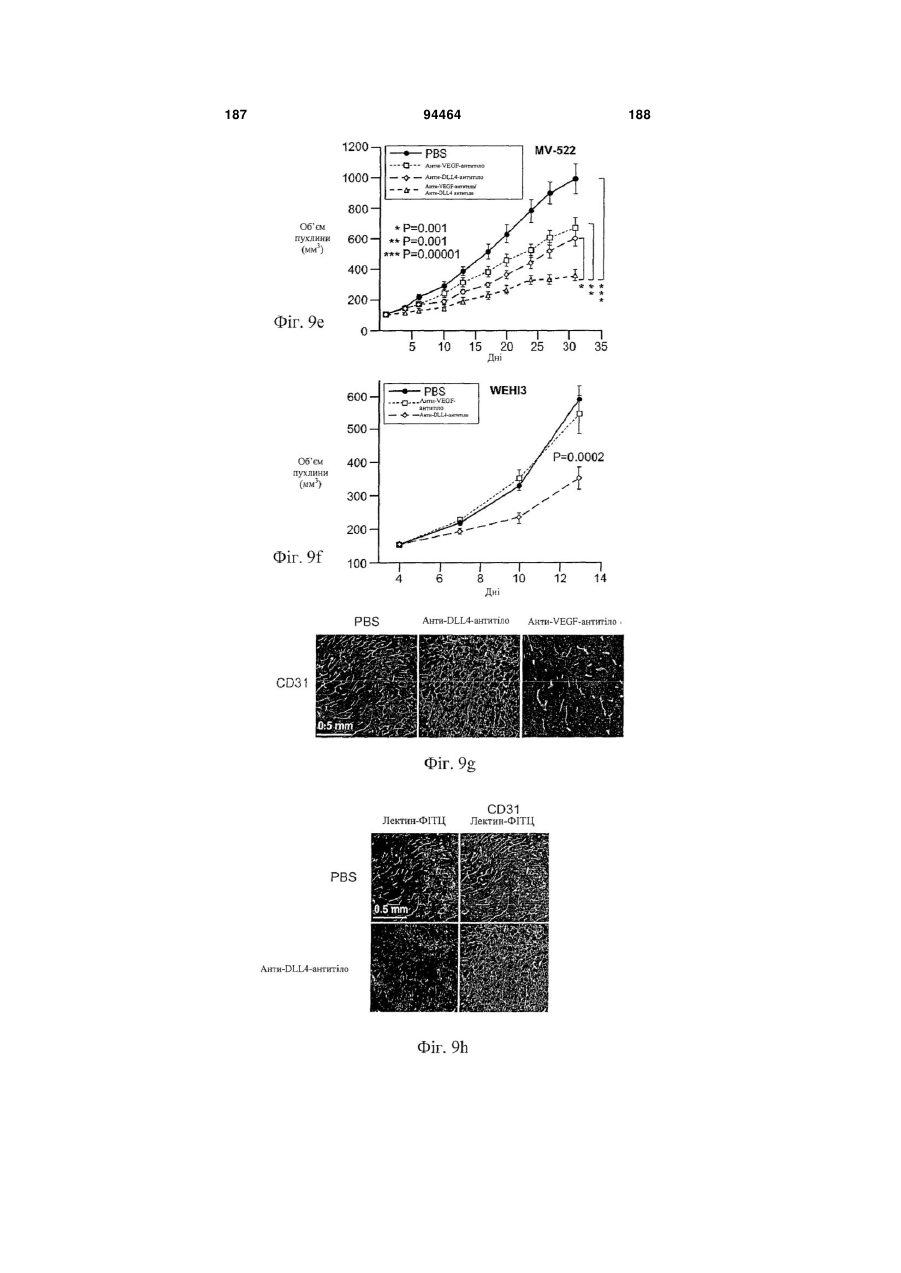
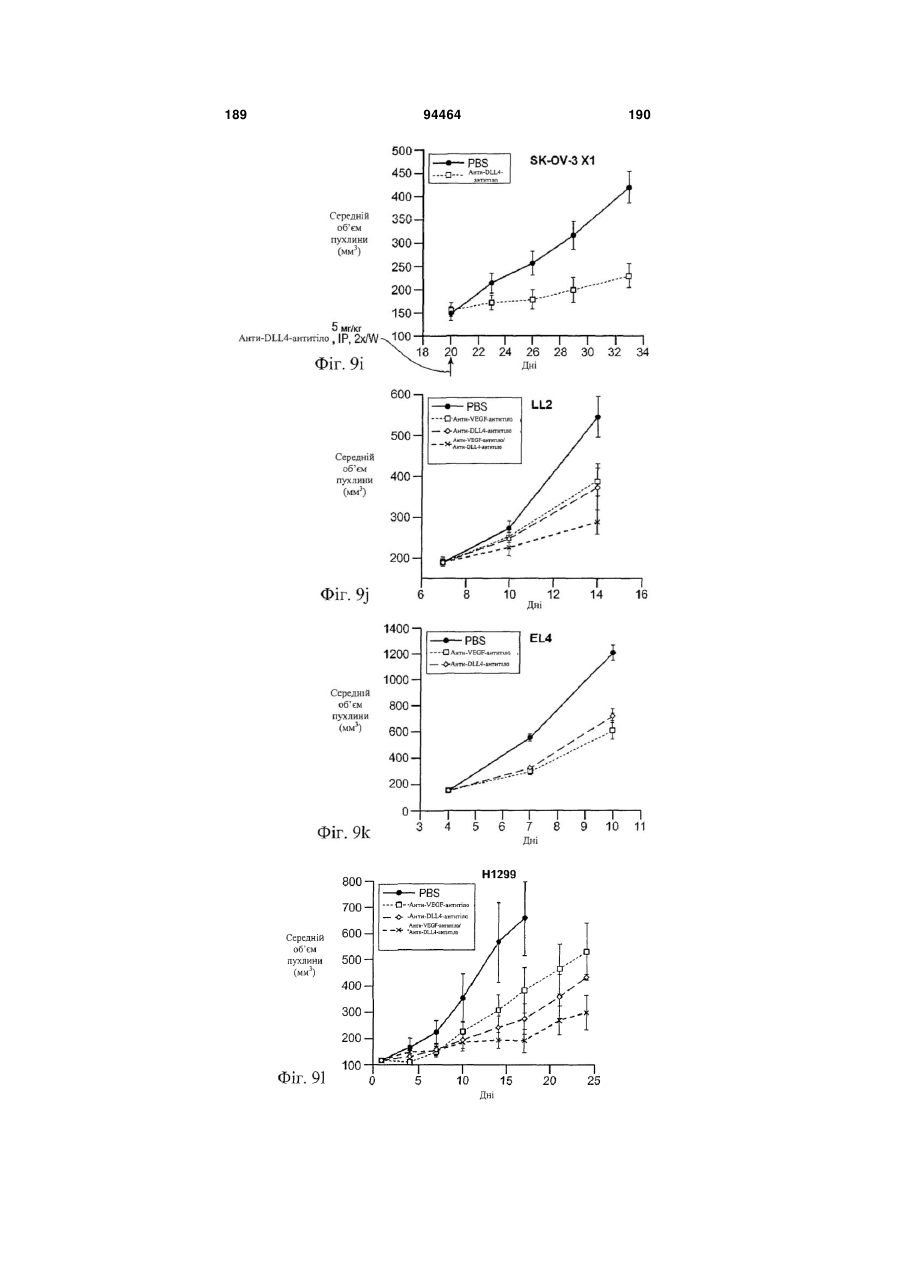
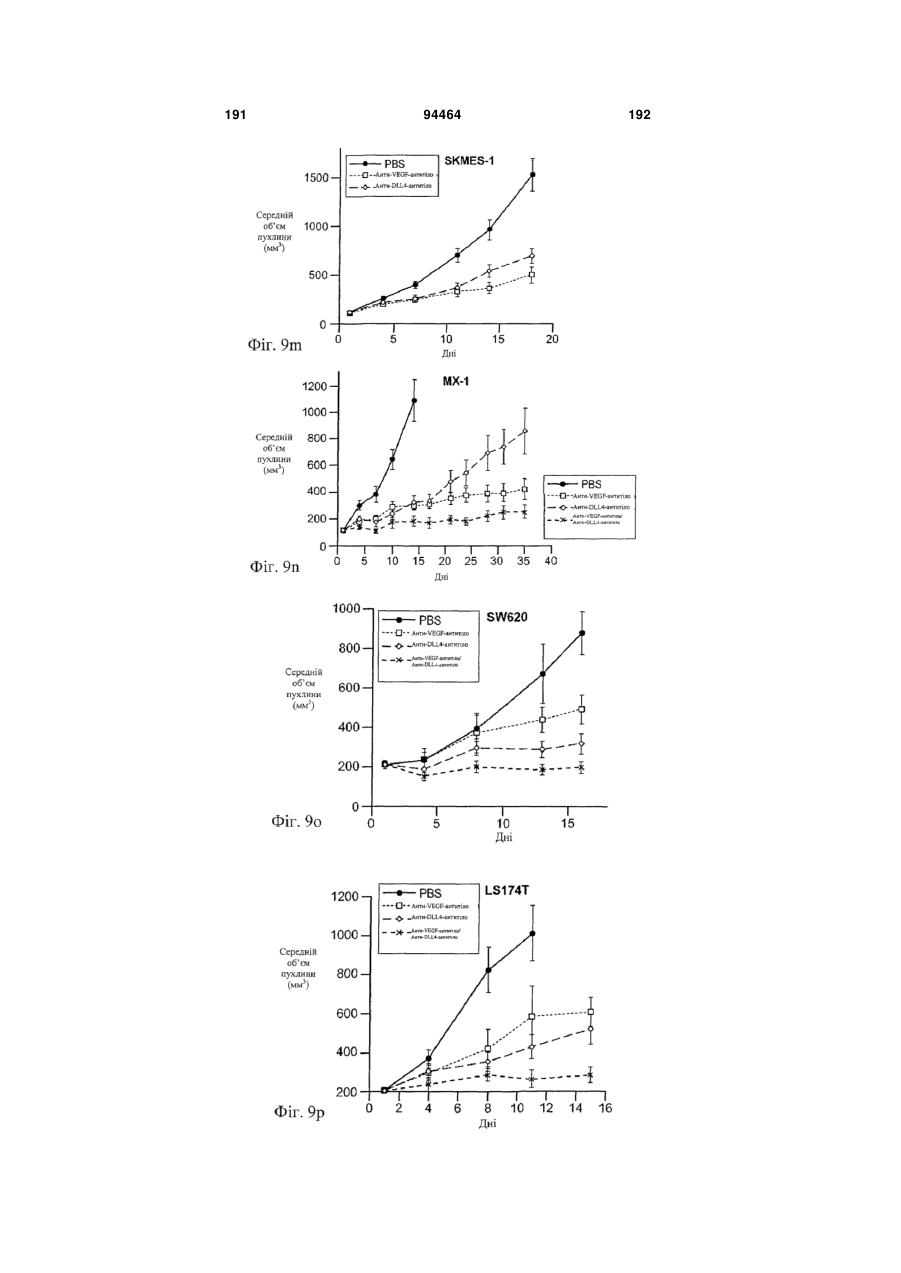
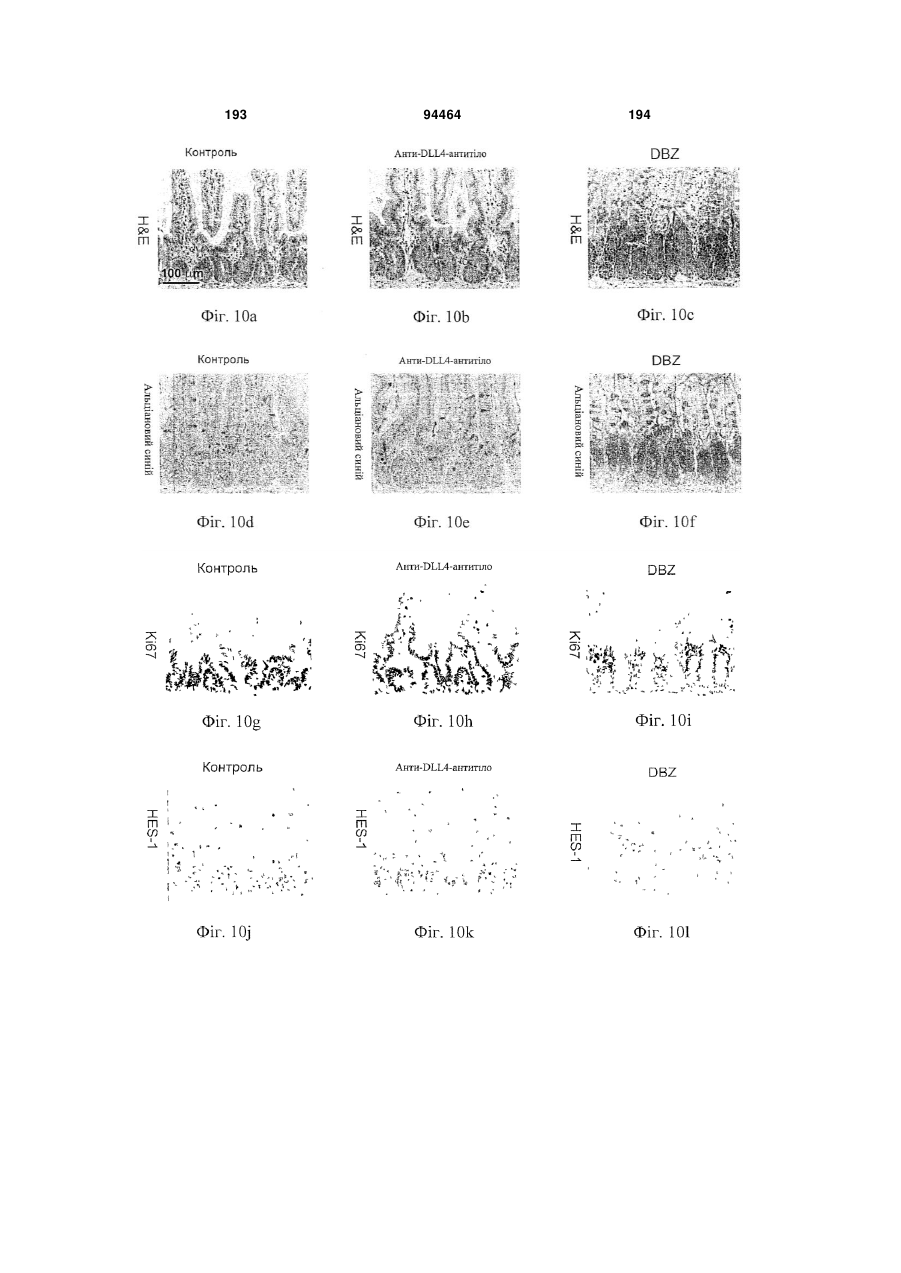
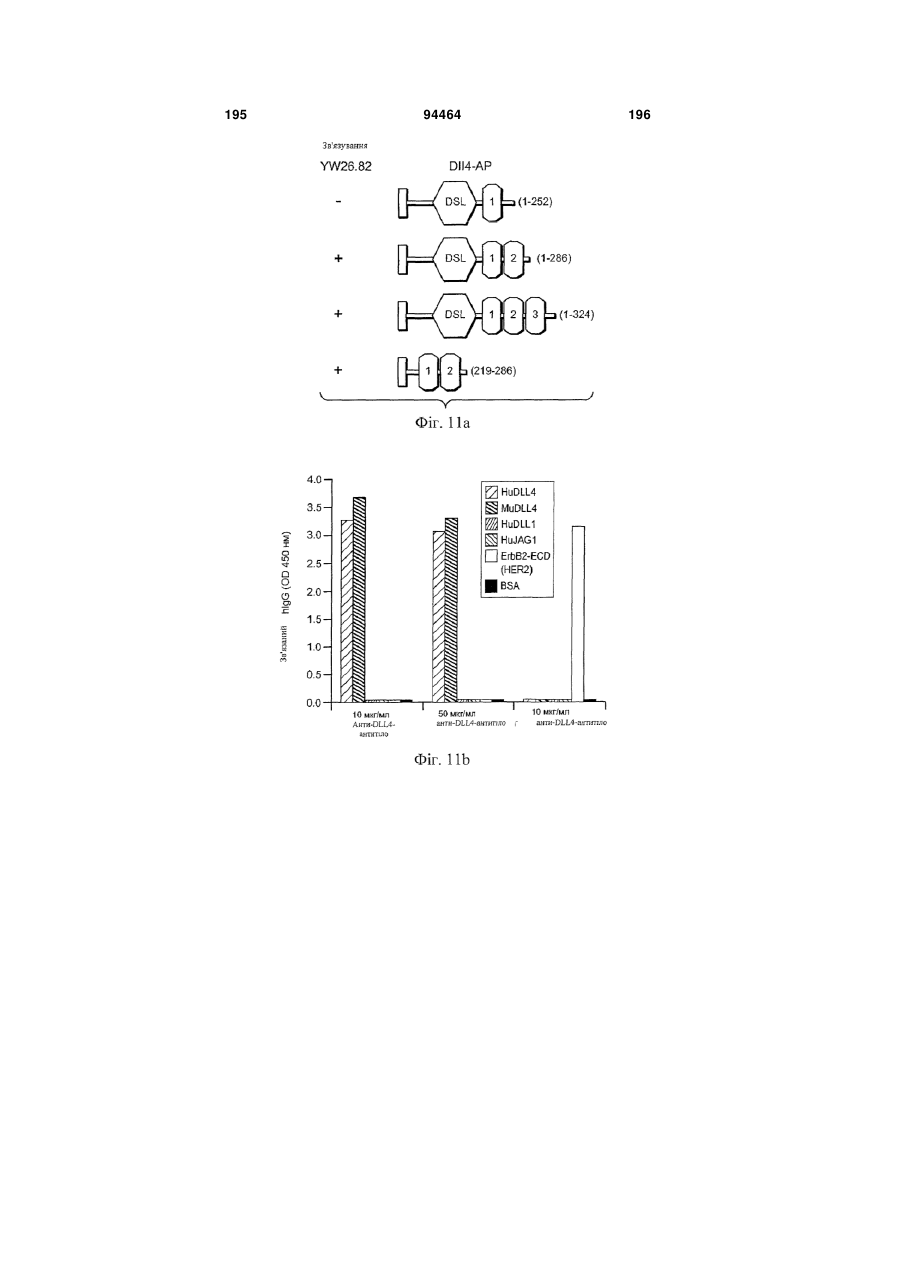
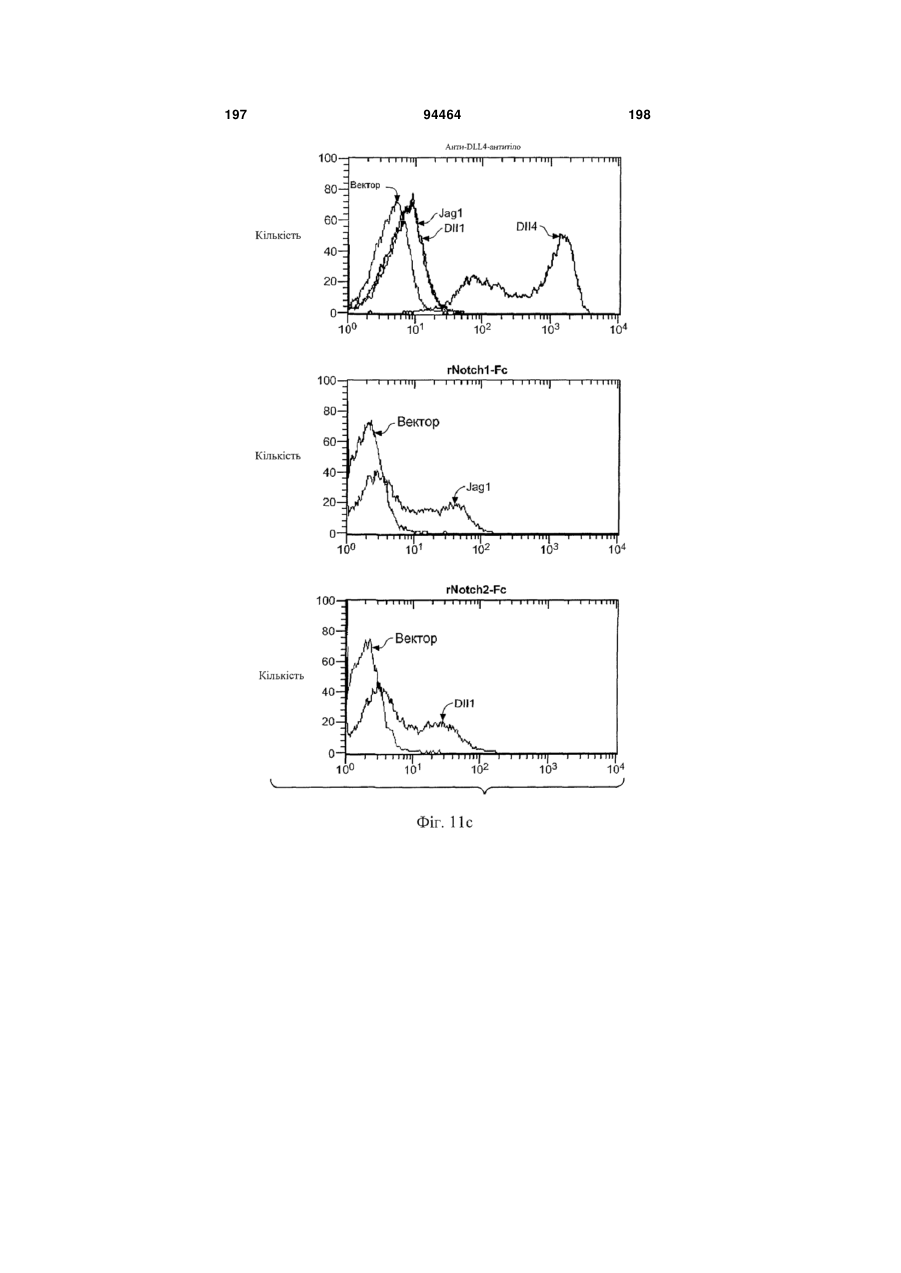
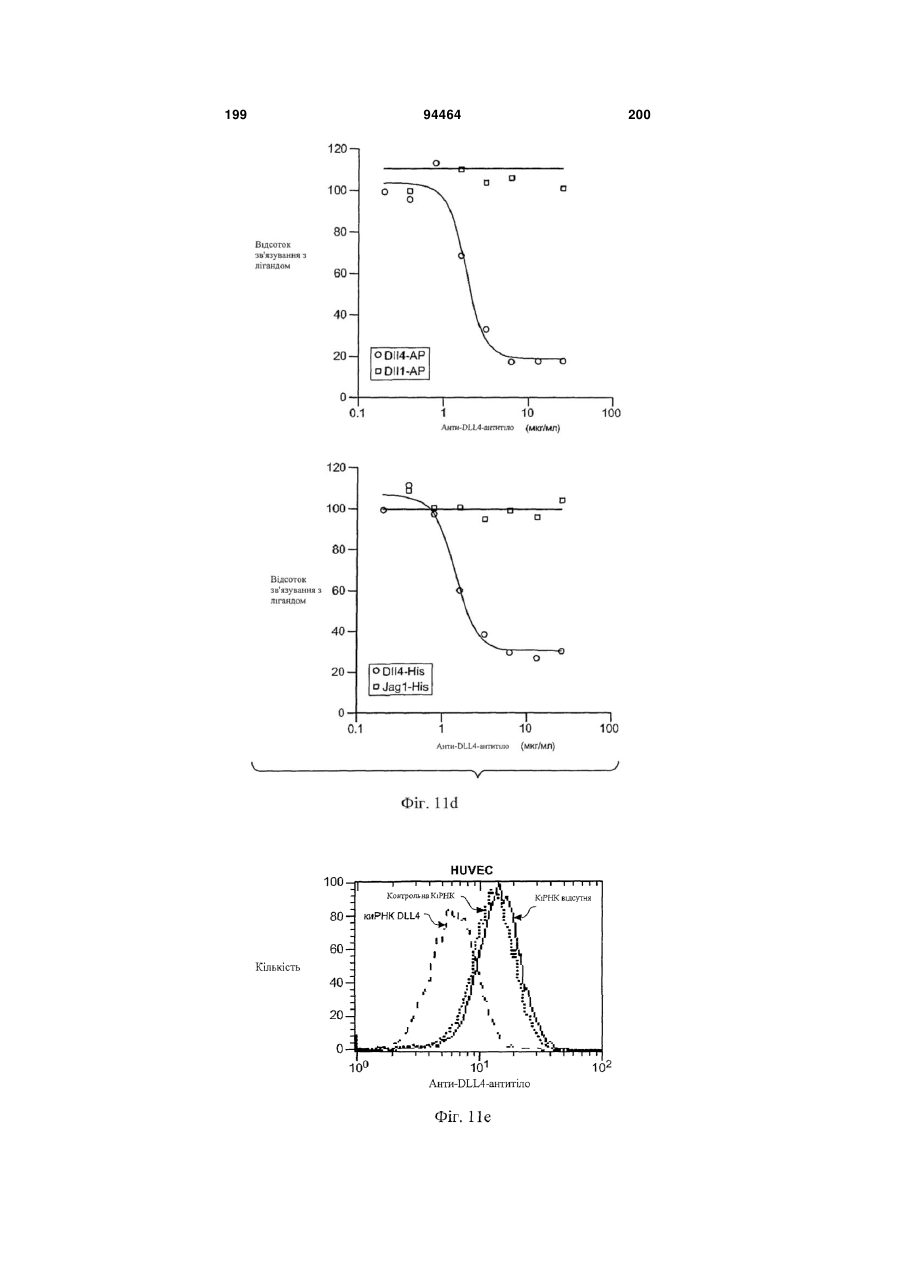
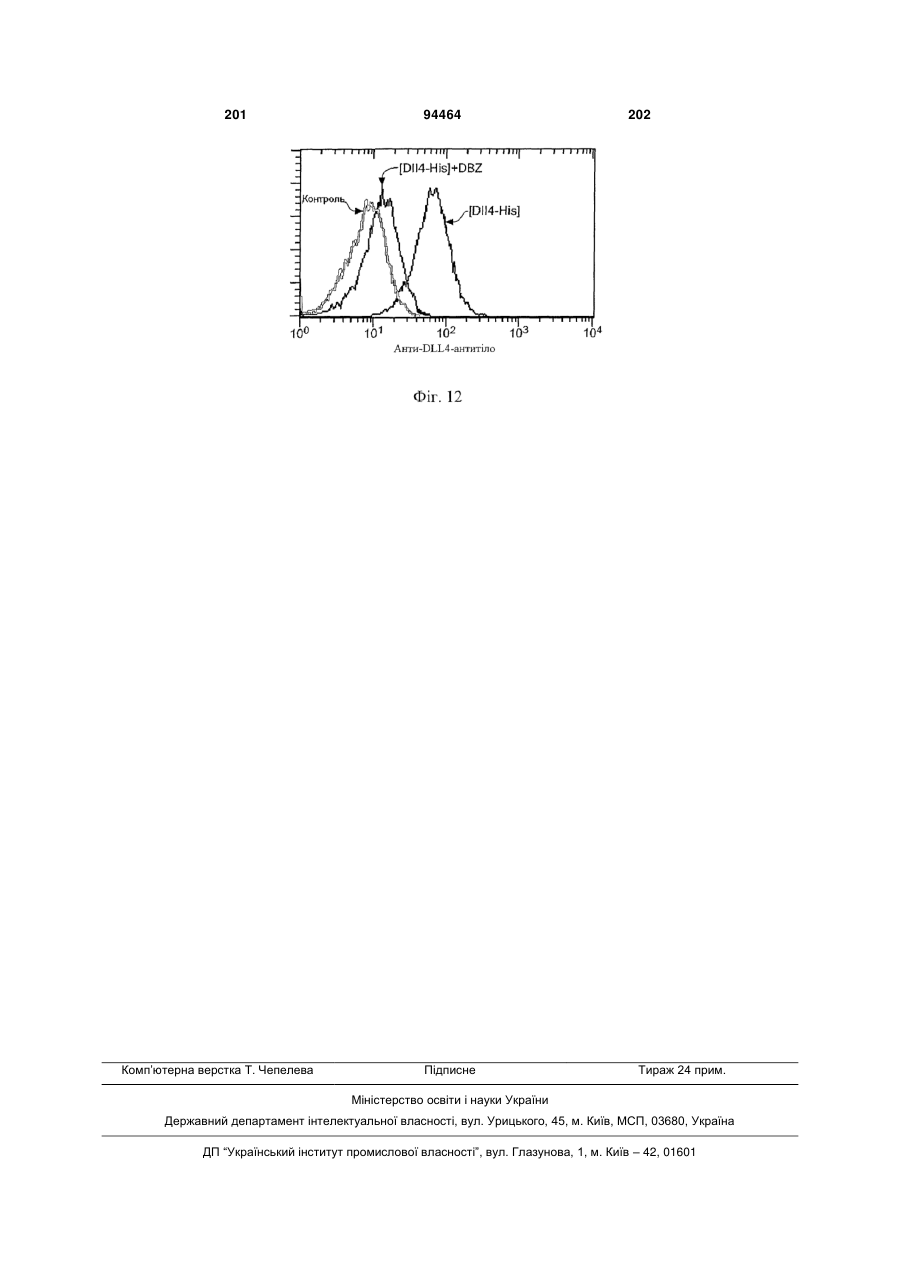
Виділене антитіло до dll4 та його застосування
Формула / Реферат
1. Виділене анти-DLL4-антитіло, яке містить
(a) щонайменше одну, дві, три, чотири або п'ять послідовностей гіперваріабельних областей (HVR), вибраних із групи, яка складається з:
(і) HVR-L1, що містить послідовність А1-А11, де А1-А11 являє собою RASQDVSTAVA (SEQ ID NO:10);
(іі) HVR-L2, що містить послідовність В1-В7, де В1-В7 являє собою SASFLYS (SEQ ID NO:11);
(ііі) HVR-L3, що містить послідовність С1-С9, де С1-С9 являє собою QQSYTGTVT (SEQ ID NO: 18);
(iv) HVR-H1, що містить послідовність D1-D10, де D1-D10 являє собою GFTFTDNWIS (SEQ ID NO:1);
(v) HVR-H2, що містить послідовність Е1-Е18, де Е1-Е18 являє собою GYISPNSGFTYYADSYKG (SEQ ID NO:8) і
(vi) HVR-H3, що містить послідовність F1-F15, де F1-F15 являє собою VYYCARDNFGGYFDY (SEQ ID NO:9); і
(b) щонайменше один варіант HVR, де вказаний варіант послідовності HVR має модифікацію щонайменше одного залишку послідовності, представленої в SEQ ID NO:1-18.
2. Виділене анти-DLL4-антитіло, яке містить
(а) щонайменше одну, дві, три, чотири або п'ять послідовностей гіперваріабельних областей (HVR), вибраних із групи, яка складається з:
(і) HVR-L1, що містить послідовність А1-А11, де А1-А11 являє собою RASQDVSTAVA (SEQ ID NO:10);
(іі) HVR-L2, що містить послідовність В1-В7, де В1-В7 являє собою SASFLYS (SEQ ID NO:11);
(ііі) HVR-L3, що містить послідовність С1-С9, де С1-С9 являє собою QQSYNGPST (SEQ ID NO:15);
(iv) HVR-H1, що містить послідовність D1-D10, де D1-D10 являє собою GFTFTDNWIS (SEQ ID NO:1);
(v) HVR-H2, що містить послідовність Е1-Е18, де El-E18 являє собою GVINPNSGATEYADSVKG (SEQ ID NO:5); і
(vi) HVR-H3, що містить послідовність F1-F15, де F1-F15 являє собою VYYCARDNFGGYFDY (SEQ ID NO:9); і
(b) щонайменше один варіант HVR, де вказаний варіант послідовності HVR має модифікацію щонайменше одного залишку послідовності, представленої в SEQ ID NO:1-18.
3. Антитіло за п. 1 або 2, де варіант HVR-L3 містить 1-6 (1, 2, 3, 4, 5 або 6) замін у будь-якій комбінації з нижченаведених положень: 91 (S або W), 92 (Y або F), 93 (Т, N або S), 94 (Т або G), 95 (Р, Q, А або Т) і/або 96 (Р, S, А або V).
4. Антитіло за п. 1 або 2, де варіант HVR-H2 містить 1-4 (1, 2, 3 або 4) заміни в будь-якій комбінації з наступних положень: 50 (V, L або Y), 52 (N або S), 52а (Р або S) або 53 (N, Q, Т або І).
5. Виділене анти-DLL4-антитіло, що містить одну, дві, три, чотири, п'ять або шість HVR, де кожна HVR містить, складається або по суті складається з послідовності, вибраної із групи, яка складається з SEQ ID NO:1-18, і де SEQ ID NO:10 відповідає HVR-L1, SEQ ID NO:11 відповідає HVR-L2, SEQ ID NO:12, 13, 14, 15, 16, 17 або 18 відповідає HVR-L3, SEQ ID NO:1 або 2 відповідає HVR-H1, SEQ ID NO:3, 4, 5, 6, 7 або 8 відповідає HVR-H2 і SEQ ID NO:9 відповідає HVR-Н3.
6. Антитіло за п. 5, що містить HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 і HVR-H3, де кожна із цих областей містить, відповідно, SEQ ID NO:10, 11, 14, 2, 3 і 9.
7. Антитіло за п. 5, що містить HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 і HVR-H3, де кожна із цих областей містить, відповідно, SEQ ID NO:10, 11, 15, 1, 5 і 9.
8. Антитіло за п. 5, що містить HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 і HVR-H3, де кожна із цих областей містить, відповідно, SEQ ID NO:10, 11, 16, 1, 6 і 9.
9. Антитіло за п. 5, що містить HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 і HVR-H3, де кожна із цих областей містить, відповідно, SEQ ID NO:10, 11, 17, 1, 7 і 9.
10. Антитіло за п. 5, що містить HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-Н2 і HVR-H3, де кожна із цих областей містить, відповідно, SEQ ID NO:10, 11, 18, 1, 8 і 9.
11. Антитіло за будь-яким із пп. 1-10, де щонайменше частина каркасної послідовності являє собою консенсусну людську каркасну послідовність.
12. Антитіло за п. 1 або 2, де вказаною модифікацією є заміна, інсерція або делеція.
13. Антитіло за будь-яким із пп. 1-12, що містить людську консенсусну каркасну послідовність підгрупи каппа.
14. Антитіло за будь-яким із пп. 1-12, що містить людську консенсусну каркасну послідовність важкого ланцюга підгрупи III.
15. Антитіло за п. 14, де вказане антитіло має заміну в одному або декількох з положень 71, 73 і 78.
16. Антитіло за п. 15, де вказана заміна присутня в одному або декількох з положень R71A, N73T і N78A.
17. Полінуклеотид, що кодує антитіло за будь-яким із пп. 1-16.
18. Вектор, що містить полінуклеотид за п. 17.
19. Вектор за п. 18, який є експресуючим вектором.
20. Клітина-хазяїн, що містить вектор за п. 18 або 19.
21. Клітина-хазяїн за п. 20, що є прокаріотичною клітиною.
22. Клітина-хазяїн за п. 20, що є еукаріотичною клітиною.
23. Клітина-хазяїн за п. 20, що є клітиною ссавця.
24. Спосіб одержання анти-DLL4-антитіла, який передбачає (а) експресію вектора за п. 19 у прийнятній клітині-хазяїні й (b) виділення вказаного антитіла.
25. Спосіб одержання імунокон'югата, що містить анти-DLL4-антитіло, що передбачає (а) експресію вектора за п. 19 у прийнятній клітині-хазяїні й (b) виділення вказаного антитіла.
26. Спосіб за п. 24 або 25, де вказаною клітиною-хазяїном є прокаріотична клітина.
27. Спосіб за п. 24 або 25, де вказаною клітиною-хазяїном є еукаріотична клітина.
28. Спосіб детектування DLL4, що включає в себе детектування комплексу "DLL4-анти-DLL4-антитіло" у біологічному зразку.
29. Спосіб діагностики розладу, асоційованого з експресією DLL4, що передбачає детектування комплексу "DLL4-анти-DLL4-антитіло" у біологічному зразку, отриманому в пацієнта, що страждає на вказаний розлад, або в пацієнта з підозрою на такий розлад.
30. Спосіб за будь-яким із пп. 28-29, де вказане анти-DLL4-антитіло є детектовано міченим.
31. Композиція, що містить анти-DLL4-антитіло за будь-яким із пп. 1-16.
32. Композиція, що містить полінуклеотид за будь-яким із пп. 17-19.
33. Композиція за п. 31 або 32, що додатково містить носій.
34. Спосіб лікування пухлини, раку або розладу клітинної проліферації, що передбачає введення ефективної кількості антитіла за будь-яким із пп. 1-16 індивідууму, який потребує такого лікування, відповідно до чого пухлина, рак або розлад клітинної проліферації виліковують.
35. Спосіб за п. 34, де вказаним пухлинним, раковим або клітинно-проліферативним захворюванням є рак товстої кишки, рак легенів або рак молочної залози.
36. Спосіб за п. 34 або 35, що додатково передбачає введення ефективної кількості антиангіогенного засобу.
37. Спосіб за п. 36, де вказаним антиангіогенним засобом є антагоніст фактора росту судинного ендотелію (VEGF).
38. Спосіб за п. 37, де вказаним антагоністом VEGF є анти-VEGF-антитіло.
39. Спосіб за п. 38, де вказаним анти-VEGF-антитілом є бевацизумаб.
40. Спосіб за будь-яким із пп. 34-39, що додатково передбачає введення ефективної кількості хіміотерапевтичного засобу.
41. Спосіб підвищення ефективності антиангіогенного засобу в індивідуума, що страждає на патологічний стан, асоційований з ангіогенезом, що передбачає введення індивідууму, крім антиангіогенного засобу, ефективної кількості антитіла за будь-яким із пп. 1-16, і тим самим підвищення ефективності вказаного антиангіогенного засобу.
42. Спосіб за п. 41, де вказаний патологічний стан, асоційований з ангіогенезом, являє собою пухлину, рак і/або розлад клітинної проліферації.
43. Спосіб за п. 41, де вказаним патологічним станом, асоційованим з ангіогенезом, є внутрішньоочне неоваскулярне захворювання.
Текст
1. Виділене анти-DLL4-антитіло, яке містить (a) щонайменше одну, дві, три, чотири або п'ять послідовностей гіперваріабельних областей (HVR), вибраних із групи, яка складається з: (і) HVR-L1, що містить послідовність А1-А11, де А1-А11 являє собою RASQDVSTAVA (SEQ ID NO:10); (іі) HVR-L2, що містить послідовність В1-В7, де В1В7 являє собою SASFLYS (SEQ ID NO:11); (ііі) HVR-L3, що містить послідовність С1-С9, де С1-С9 являє собою QQSYTGTVT (SEQ ID NO: 18); (iv) HVR-H1, що містить послідовність D1-D10, де D1-D10 являє собою GFTFTDNWIS (SEQ ID NO:1); (v) HVR-H2, що містить послідовність Е1-Е18, де Е1-Е18 являє собою GYISPNSGFTYYADSYKG (SEQ ID NO:8) і (vi) HVR-H3, що містить послідовність F1-F15, де F1-F15 являє собою VYYCARDNFGGYFDY (SEQ ID NO:9); і (b) щонайменше один варіант HVR, де вказаний варіант послідовності HVR має модифікацію щонайменше одного залишку послідовності, представленої в SEQ ID NO:1-18. 2. Виділене анти-DLL4-антитіло, яке містить (а) щонайменше одну, дві, три, чотири або п'ять послідовностей гіперваріабельних областей (HVR), вибраних із групи, яка складається з: (і) HVR-L1, що містить послідовність А1-А11, де А1-А11 являє собою RASQDVSTAVA (SEQ ID NO:10); (іі) HVR-L2, що містить послідовність В1-В7, де В1В7 являє собою SASFLYS (SEQ ID NO:11); (ііі) HVR-L3, що містить послідовність С1-С9, де С1-С9 являє собою QQSYNGPST (SEQ ID NO:15); (iv) HVR-H1, що містить послідовність D1-D10, де D1-D10 являє собою GFTFTDNWIS (SEQ ID NO:1); 94464 4 (v) HVR-H2, що містить послідовність Е1-Е18, де El-E18 являє собою GVINPNSGATEYADSVKG (SEQ ID NO:5); і (vi) HVR-H3, що містить послідовність F1-F15, де F1-F15 являє собою VYYCARDNFGGYFDY (SEQ ID NO:9); і (b) щонайменше один варіант HVR, де вказаний варіант послідовності HVR має модифікацію щонайменше одного залишку послідовності, представленої в SEQ ID NO:1-18. 3. Антитіло за п. 1 або 2, де варіант HVR-L3 містить 1-6 (1, 2, 3, 4, 5 або 6) замін у будь-якій комбінації з нижченаведених положень: 91 (S або W), 92 (Y або F), 93 (Т, N або S), 94 (Т або G), 95 (Р, Q, А або Т) і/або 96 (Р, S, А або V). 4. Антитіло за п. 1 або 2, де варіант HVR-H2 містить 1-4 (1, 2, 3 або 4) заміни в будь-якій комбінації з наступних положень: 50 (V, L або Y), 52 (N або S), 52а (Р або S) або 53 (N, Q, Т або І). 5. Виділене анти-DLL4-антитіло, що містить одну, дві, три, чотири, п'ять або шість HVR, де кожна HVR містить, складається або по суті складається з послідовності, вибраної із групи, яка складається з SEQ ID NO:1-18, і де SEQ ID NO:10 відповідає HVR-L1, SEQ ID NO:11 відповідає HVR-L2, SEQ ID NO:12, 13, 14, 15, 16, 17 або 18 відповідає HVR-L3, SEQ ID NO:1 або 2 відповідає HVR-H1, SEQ ID NO:3, 4, 5, 6, 7 або 8 відповідає HVR-H2 і SEQ ID NO:9 відповідає HVR-Н3. 6. Антитіло за п. 5, що містить HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 і HVR-H3, де кожна із цих областей містить, відповідно, SEQ ID NO:10, 11, 14, 2, 3 і 9. 7. Антитіло за п. 5, що містить HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 і HVR-H3, де кожна із цих областей містить, відповідно, SEQ ID NO:10, 11, 15, 1, 5 і 9. 8. Антитіло за п. 5, що містить HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 і HVR-H3, де кожна із цих областей містить, відповідно, SEQ ID NO:10, 11, 16, 1, 6 і 9. 9. Антитіло за п. 5, що містить HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 і HVR-H3, де кожна із цих областей містить, відповідно, SEQ ID NO:10, 11, 17, 1, 7 і 9. 10. Антитіло за п. 5, що містить HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-Н2 і HVR-H3, де кожна із цих областей містить, відповідно, SEQ ID NO:10, 11, 18, 1, 8 і 9. 11. Антитіло за будь-яким із пп. 1-10, де щонайменше частина каркасної послідовності являє собою консенсусну людську каркасну послідовність. 12. Антитіло за п. 1 або 2, де вказаною модифікацією є заміна, інсерція або делеція. 13. Антитіло за будь-яким із пп. 1-12, що містить людську консенсусну каркасну послідовність підгрупи каппа. 14. Антитіло за будь-яким із пп. 1-12, що містить людську консенсусну каркасну послідовність важкого ланцюга підгрупи III. 15. Антитіло за п. 14, де вказане антитіло має заміну в одному або декількох з положень 71, 73 і 78. 16. Антитіло за п. 15, де вказана заміна присутня в одному або декількох з положень R71A, N73T і N78A. 5 94464 6 17. Полінуклеотид, що кодує антитіло за будь-яким із пп. 1-16. 18. Вектор, що містить полінуклеотид за п. 17. 19. Вектор за п. 18, який є експресуючим вектором. 20. Клітина-хазяїн, що містить вектор за п. 18 або 19. 21. Клітина-хазяїн за п. 20, що є прокаріотичною клітиною. 22. Клітина-хазяїн за п. 20, що є еукаріотичною клітиною. 23. Клітина-хазяїн за п. 20, що є клітиною ссавця. 24. Спосіб одержання анти-DLL4-антитіла, який передбачає (а) експресію вектора за п. 19 у прийнятній клітині-хазяїні й (b) виділення вказаного антитіла. 25. Спосіб одержання імунокон'югата, що містить анти-DLL4-антитіло, що передбачає (а) експресію вектора за п. 19 у прийнятній клітині-хазяїні й (b) виділення вказаного антитіла. 26. Спосіб за п. 24 або 25, де вказаною клітиноюхазяїном є прокаріотична клітина. 27. Спосіб за п. 24 або 25, де вказаною клітиноюхазяїном є еукаріотична клітина. 28. Спосіб детектування DLL4, що включає в себе детектування комплексу "DLL4-анти-DLL4антитіло" у біологічному зразку. 29. Спосіб діагностики розладу, асоційованого з експресією DLL4, що передбачає детектування комплексу "DLL4-анти-DLL4-антитіло" у біологічному зразку, отриманому в пацієнта, що страждає на вказаний розлад, або в пацієнта з підозрою на такий розлад. 30. Спосіб за будь-яким із пп. 28-29, де вказане анти-DLL4-антитіло є детектовано міченим. 31. Композиція, що містить анти-DLL4-антитіло за будь-яким із пп. 1-16. 32. Композиція, що містить полінуклеотид за будьяким із пп. 17-19. 33. Композиція за п. 31 або 32, що додатково містить носій. 34. Спосіб лікування пухлини, раку або розладу клітинної проліферації, що передбачає введення ефективної кількості антитіла за будь-яким із пп. 116 індивідууму, який потребує такого лікування, відповідно до чого пухлина, рак або розлад клітинної проліферації виліковують. 35. Спосіб за п. 34, де вказаним пухлинним, раковим або клітинно-проліферативним захворюванням є рак товстої кишки, рак легенів або рак молочної залози. 36. Спосіб за п. 34 або 35, що додатково передбачає введення ефективної кількості антиангіогенного засобу. 37. Спосіб за п. 36, де вказаним антиангіогенним засобом є антагоніст фактора росту судинного ендотелію (VEGF). 38. Спосіб за п. 37, де вказаним антагоністом VEGF є анти-VEGF-антитіло. 39. Спосіб за п. 38, де вказаним анти-VEGFантитілом є бевацизумаб. 40. Спосіб за будь-яким із пп. 34-39, що додатково передбачає введення ефективної кількості хіміотерапевтичного засобу. 41. Спосіб підвищення ефективності антиангіогенного засобу в індивідуума, що страждає на патологічний стан, асоційований з ангіогенезом, що передбачає введення індивідууму, крім антиангіогенного засобу, ефективної кількості антитіла за будь-яким із пп. 1-16, і тим самим підвищення ефективності вказаного антиангіогенного засобу. 42. Спосіб за п. 41, де вказаний патологічний стан, асоційований з ангіогенезом, являє собою пухлину, рак і/або розлад клітинної проліферації. 43. Спосіб за п. 41, де вказаним патологічним станом, асоційованим з ангіогенезом, є внутрішньоочне неоваскулярне захворювання. В загальних рисах, даний винахід належить до галузі молекулярної біології. Більш конкретно, даний винахід належить до анти-DLL4-антитіл і до їх застосування. Забезпечення кровопостачання є основною потребою для багатьох фізіологічних і патологічних процесів. Для активного росту тканин, таких як ембріони й пухлини, необхідно адекватне кровопостачання. Таке кровопостачання забезпечується завдяки продукуванню проангіогенних факторів, що стимулюють утворення нових кровоносних судин у процесі, який називається ангіогенезом. Утворення судин є складним, але планомірним біологічним процесом, що включає в себе всі або багато які з наступних стадій: а) проліферацію ендотеліальних клітин (EC) з існуючих EC або їх диференціювання із клітин-попередників; b) міграцію й коалесценцію EC з утворенням канатикоподібних структур; с) тубулогенез судинних канатиків з утворенням судин, які мають центральний просвіт; d) розростання існуючих канатиків або судин з утворенням вторинних судин; e) наступне ремоделювання й утворення нових форм із первинного судинного сплетення; і f) рекрутинг періендотельальних клітин в ендотеліальні судини, що надає цим судинам підтримуючих й модуляторних функцій; де вказаними клітинами є перицити для невеликих капілярів, клітини гладких м'язів для більш великих судин і клітини міокарда в серце. Hanahan, Science 277:48-50 (1997); Hogan & Kolodziej, Nat. Rev. Genet. 3:513-23 (2002); Lubarsky & Krasnow, Cell 112:19-28 (2003). У цей час добре відомо, що ангіогенез бере участь у патогенезі різних захворювань. Такими захворюваннями є солідні пухлини й метастази, атеросклероз, ретролентальна фіброплазія, гемангіоми, хронічне запалення, внутрішньоочні неоваскулярні захворювання, такі як проліферативні ретинопатії, наприклад, діабетична ретинопатія, вікова дегенерація жовтої плями (AMD), неоваскулярна глаукома, імунне відторгнення імплантованої тканини рогівки й інших тканин, ревматоїдний 7 артрит і псоріаз. Folkman et al., J. Biol. Chem. 267:10931-34 (1992); Klagsbrun et al., Amu. Rev. Physiol. 53:217-39 (1991); і Garner Α., "Vascular diseases," In: Pathobiology of Ocular Disease. A Dynamic Approach, Garner Α., Klintworth GK, eds., 2nd Edition (Marcel Dekker, NY, 1994), pp 16251710. У випадку росту пухлини, ангіогенез, мабуть, відіграє вирішальну роль у переході від гіперплазії до неоплазії й у забезпеченні надходження поживних елементів, необхідних для росту пухлин і утворення метастазів. Folkman et al., Nature 339:58 (1989). Неоваскуляризація сприяє переважному росту пухлинних клітин і набуванню ними проліферативної автономії в порівнянні з нормальними клітинами. Розвиток пухлини звичайно починається з однієї аберантної клітини, що може проліферуватися тільки до розміру в декілька кубічних міліметрів, що зумовлено певною відстанню від доступного капілярного ложа, і така клітина може залишатися «сплячою», тобто вона може не піддаватися подальшому росту й дисемінуванню протягом тривалого періоду. Потім деякі пухлинні клітини набувають ангіогенного фенотипу з активацією ендотеліальних клітин, які після проліферації й дозрівання утворюють нові капілярні кровоносні судини. Ці новостворені судини не тільки сприяють продовженню росту первинної пухлини, але також дисемінуванню й реколонізації метастатичних пухлинних клітин. Відповідно до цього спостерігається кореляція між щільністю мікросудин у пухлинних зрізах і виживаністю пацієнтів, що страждають раком молочної залози й деякими іншими пухлинами. Weidner et al., N. Engl. J. Med, 324:1-6 (1991); Horak et al., Lancet 340:1120-24 (1992); Macchiarini et al., Lancet 340:145-46 (1992). Точні механізми, що регулюють перемикання ангіогенезу, поки ще не встановлені, хоча й імовірно, що неоваскуляризація пухлинної маси є результатом загального співвідношення множини стимуляторів і інгібіторів ангіогенезу (Folkman, Nat. Med. 1(1):27-31 (1995)). Процес розвитку судин строго регулюється. У цей час уже відомо, що велика кількість молекул, головним чином, секретованих факторів, продукованих оточуючими клітинами, регулюють диференціювання, проліферацію, міграцію й коалесценцію EC із утворенням канатикоподібних структур. Так, наприклад, васкулярний ендотеліальний фактор росту (VEGF) був ідентифікований як ключовий фактор, що бере участь у стимуляції ангіогенезу й в індукуванні проникності судин. Ferrara et al., Endocr. Rev. 18:4-25 (1997). Виявлення того факту, що втрата навіть одного алелю VEGF приводить до загибелі ембріона вказує на незамінну роль, що відіграє цей фактор в розвитку й диференціюванні судинної системи. Крім того, було показано, що VEGF є ключовим медіатором неоваскуляризації, асоційованої з розвитком пухлинних і внутрішньоочних захворювань. Ferrara et al., Endocr. Rev. див. вище. мРНК VEGF надекспресується більшістю досліджуваних людських пухлин. Berkman et al., J. Clin. Invest. 91:153-59 (1993); Brown et al., Human Pathol. 26:86-91 (1995); Brown et al., Cancer Res. 53:4727-35 (1993); Mattern et al., Brit. J. Cancer 94464 8 73:931-34 (1996); Dvorak et al., Am. J. Pathol. 146:1029-39(1995). Крім того, рівні концентрації VEGF у внутрішньоочній рідині в значній мірі корелюють із активною проліферацією кровоносних судин у пацієнтів із діабетичнаа ретинопатією й іншою асоційованою з ішемією ретинопатією. Aiello et al., N. Engl. J. Med. 331:1480-87 (1994). Крім того, були проведені дослідження, які виявили локалізацію VEGF у хороїдальних неоваскулярних мембранах у пацієнтів, що страждають на AMD. Lopez et al., Invest. Ophthalmol. Vis. Sci. 37:855-68 (1996). Нейтралізуючі анти-VEGF-антитіла придушують ріст різних людських пухлинних клітинних ліній в «голих» мишей (Kim et al., Nature 362:841-44 (1993); Warren et al., J. Clin. Invest. 95:1789-97 (1995); Borgstrorn et al., Cancer Res. 56:4032-39 (1996); Melnyk et al., Cancer Res. 56:921-24 (1996)), також інгібують внутрішньоочний ангіогенез у моделях ішемічних захворювань сітківки (Adamis et al., Arch. Ophthalmol. 114:66-71 (1996)). Тому моноклональні анти-VEGF-антитіла або інші інгібітори дії VEGF є перспективними кандидатами на їхнє застосування для лікування пухлинних і різних внутрішньоочних неоваскулярних захворювань. Такі антитіла описані, наприклад, в ЕР 817648, опублікованому 14 січня 1998 року; у заявках WO 98/45331 і WO 98/45332, опублікованих 15 жовтня 1998 року. Одне з анти-VEGF-aнтитіл, бевацизумаб, було дозволено Управлінням з контролю за якістю харчових продуктів, медикаментів і косметичних засобів (FDA) до його застосування в комбінації з хіміотерапією для лікування конкретних ракових захворювань, фрагмент анти-VEGFaнтитілa, ранібізумаб, був дозволений FDA до застосування для лікування вікової (мокрої) дегенерації жовтої плями. У цей час обидва цих лікарських засоби проходять клінічні випробування. Очевидно, що необхідність одержання агентів, які мають клінічні ознаки, що є оптимальними для розробки терапевтичних засобів, залишається актуальною. Винахід, описаний у даній заявці, задовольняє цій вимозі й має інші переваги. Всі цитовані тут роботи, включаючи патентні заявки й публікації, у всій їхній повноті включені в даний опис за допомогою посилання. Даний винахід частково оснований на ідентифікації різних DLL4-зв'язувальних агентів (таких як імунокон'югати, антитіла і їхні фрагменти). DLL4 являє собою важливу й переважну терапевтичну мішень, і даний винахід належить до композицій і до способів, основаних на зв'язуванні з DLL4. Описані тут DLL4-зв'язувальні агенти відповідно до винаходу являють собою важливі терапевтичні й діагностичні засоби, які можуть бути використані для лікування патологічних станів, асоційованих з експресією і/або активністю каскаду реакцій DLL4рецептору Notch. Відповідно до цього, даний винахід належить до способів, композицій, наборів і промислових виробів, асоційованих з ВІХ4зв'язуванням. Даний винахід належить до антитіл, які зв'язуються (наприклад, специфічно зв'язуються) з DLL4. 9 В одному зі своїх аспектів даний винахід належить до виділеного анти-0ІХ4-антитіла, де повнорозмірна IgG-форма антитіла специфічно зв'язується з людським DLL4 з афінністю зв'язування приблизно 1 нМ або більше або приблизно 500 пМ або більше. Як добре відомо фахівцям, афінність зв'язування ліганду з його рецептором може бути визначена за допомогою різних аналізів і виражена різними кількісними величинами. Відповідно до цього, в одному з варіантів винаходу, афінність зв'язування виражена величинами Kd і являє собою природну афінність зв'язування (наприклад, з мінімальними ефектами авідності). Звичайно й переважно, афінність зв'язування вимірюють in vitro у безклітинному або в клітинному середовищі. Для вимірювання афінності зв'язування може бути використаний будь-який з відомих аналізів, включаючи описані тут аналізи, наприклад, Віасоrе®, радіоімуноаналіз (РІА) і ELISA. У деяких варіантах винаходу виділене анти-DLL4-антитіло зв'язується з людським і мишачим DLL4 з аналогічною афінністю, тобто афінність зв'язування з людським DLL4 перевищує афінність зв'язування з мишачим DLL4 не більше ніж в 100 разів або менше. У деяких варіантах винаходу афінність зв'язування з людським DLL4 перевищує афінність зв'язування з мишачим DLL4 не більше ніж в 10 разів або менше. У деяких варіантах винаходу антитіло специфічно зв'язується з мишачим DLL4 з афінністю зв'язування приблизно 1 нМ або більше або приблизно 500 пМ або більше. В одному зі своїх аспектів даний винахід належить до виділеного анти-DLL4-антитіла. де повнорозмірна IgG-форма антитіла специфічно зв'я5 зується з людським DLL4 з kon приблизно 2×10 5 або більше або приблизно 1×10 або більше. Як добре відомо фахівцям, kon зв'язування ліганду з його рецептором може бути визначена за допомогою різних аналізів і виражена різними кількісними величинами. В одному зі своїх аспектів даний винахід належить до виділеного антитіла, що зв'язується з лігандзв'язувальною областю DLL4. У деяких варіантах винаходу, виділене антитіло зв'язується з поліпептидом, що включає позаклітинний домен DLL4, або що складається, або, в основному, що складається із цього домена. У деяких варіантах винаходу, виділене антитіло зв'язується з поліпептидом, що включає, що складається або, в основному, що складається з них, амінокислоти 252-282, 1-252, 1-286, 1-324 і/або 219-286 людського DLL4. В одному зі своїх аспектів даний винахід належить до виділеного анти-DLL4-антитіла, яке конкурує з рецептором Notch за зв'язування з DLL4. В одному зі своїх аспектів даний винахід належить до виділеного анти-DLL4-антитіла, яке інгібує, знижує і/або блокує біологічну активність DLL4. В одному з аспектів винаходу, анти-DLL4антитіло відповідно до винаходу включає: (а) щонайменше одну, дві, три, чотири, п'ять або шість послідовностей гіперваріабельних областей (HVR), вибраних із групи, яка складається з: 94464 10 (і) HVR-L1, що містить послідовність Α1-A11, де Α1-A11 являє собою RASQDVSTAVA (SEQ ID NO:10); (іі) HVR-L2, що містить послідовність В1-В7, де В1-В7 являє собою SASFLYS (SEQ ID NO:11); (ііі) HVR-L3, що містить послідовність С1-С9, де С1-С9 являє собою QQSYNGPST (SEQ ID NO:15); (iv) HVR-H1, що містить послідовність D1-D10, де D1-D10 являє собою GFTFTDNWIS (SEQ ID NO:1); (ν) HVR-H2, що містить послідовність Δ1-Е18, де Δ1-Е18 являє собою GVINPNSGATEYADSVKG (SEQ ID NO:5) і (vi) HVR-H3, що містить послідовність F1-F15, де F1-F15 являє собою VYYCARDNFGGYFDY (SEQ ID NO:9); і (b) щонайменше один варіант HVR, де вказаний варіант послідовності HVR має модифікацію щонайменше одного залишку послідовності, представленої в SEQ ID NO:1-18. В одному з аспектів винаходу, анти-DLL4антитіло відповідно до винаходу включає: (a) щонайменше одну, дві, три, чотири або п'ять послідовностей гіперваріабельних областей (HVR), вибраних із групи, яка складається з: (і) HVR-L1, що містить послідовність Α1-A11, де Α1-A11 являє собою RASQDVSTAVA (SEQ ID NO:10); (іі) HVR-L2, що містить послідовність В1-В7, де В1-В7 являє собою SASFLYS (SEQ ID NO:11); (ііі) HVR-L3, що містить послідовність С1-С9, де С1-С9 являє собою QQSVNGPAT (SEQ ID NO:14); (iv) HVR-H1, що містить послідовність D1-D10, де D1-D10 являє собою GFSFRDNWIS (SEQ ID NO:2); (ν) HVR-H2, що містить послідовність Е1-Е18, де Е1-Е18 являє собою GVINPNSGSTDYADSVKG (SEQ ID NO:3); (vi) HVR-H3, що містить послідовність F1-F15, де F1-F15 являє собою VYYCARDNFGGYFDY (SEQ ID NO:9); і (b) щонайменше один варіант HVR, де вказаний варіант послідовності HVR має модифікацію щонайменше одного залишку послідовності, представленої в SEQ ID NO:1-18. В одному з аспектів винаходу, анти-DLL4антитіло відповідно до винаходу включає: (а) щонайменше одну, дві, три, чотири або п'ять послідовностей гіперваріабельних областей (HVR), вибраних із групи, яка складається з: (і) HVR-L1, що містить послідовність Α1-A11, де Α1-A11 являє собою RASQDVSTAVA (SEQ ID NO:10); (іі) HVR-L2, що містить послідовність В1-В7, де В1-В7 являє собою SASFLYS (SEQ ID NO:11); (ііі) HVR-L3, що містить послідовність С1-С9, де С1-С9 являє собою QQSYTGTVT (SEQ ID NO:18); (iv) HVR-H1. що містить послідовність D1-D10, де D1-D10 являє собою GFTFTDNWIS (SEQ ID NO:1); 11 (ν) HVR-H2, що містить послідовність Δ 1-Е 18, де Δ 1-Е 18 являє собою GYISPNSGFTYYADSVKG (SEQ ID NO:8) and (vi) HVR-H3, що містить послідовність F1-F15, де F1-F15 являє собою VYYCARDNFGGYFDY (SEQ ID NO:9); і (b) щонайменше один варіант HVR, де вказаний варіант послідовності HVR має модифікацію щонайменше одного залишку послідовності, представленої в SEQ ID NO:1-18. В одному зі своїх аспектів даний винахід належить до антитіла, що містить одну, дві, три, чотири, п'ять або шість HVR, де кожна HVR включає послідовність, або складається, або, в основному, складається з послідовності, вибраної із групи, яка складається з SEQ ID NO:1-18, і де SEQ ID NO:10 відповідає HVR-L1, SEQ ID NO:11 відповідає HVRL2, SEQ ID NO:12, 13, 14, 15, 16, 17 або 18 відповідають HVR-L3, SEQ ID NO:1 або 2 відповідають HVR-H1, SEQ ID NO:3, 4, 5, 6, 7 або 8 відповідають HVR-H2, SEQ ID NO:9 відповідає HVR-H3. В одному з варіантів винаходу, антитіло відповідно до винаходу містить HVR-L1, HVR-L2, HVR-L3, HVRH1, HVR-H2 і HVR-H3, де кожна із цих областей включає в вказаному порядку SEQ ID NO:10, 11, 12, 1, 3, 9. В одному з варіантів винаходу, антитіло відповідно до винаходу містить HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 і HVR-H3, де кожна із цих областей включає в вказаному порядку SEQ ID NO:10, 11, 13, 1, 4, 9. В одному з варіантів винаходу, антитіло відповідно до винаходу містить HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 і HVRH3, де кожна із цих областей включає в вказаному порядку SEQ ID NO:10, 11, 14, 2, 3, 9. В одному з варіантів винаходу, антитіло відповідно до винаходу містить HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 і HVR-H3, де кожна із цих областей включає в вказаному порядку SEQ ID NO:10, 11, 15, 1, 5, 9. В одному з варіантів винаходу, антитіло відповідно до винаходу містить HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 і HVR-H3, де кожна із цих областей включає в вказаному порядку SEQ ID NO:10, 11, 16, 1, 6, 9. В одному з варіантів винаходу, антитіло відповідно до винаходу містить HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 і HVRH3, де кожна із цих областей включає в вказаному порядку SEQ ID NO:10, 11, 17, 1, 7, 9. В одному з варіантів винаходу, антитіло відповідно до винаходу містить HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 і HVR-H3, де кожна із цих областей включає в вказаному порядку SEQ ID NO:10, 11, 18, 1, 8, 9. Варіанти HVR в антитілі відповідно до винаходу можуть мати модифікації в одному або декількох (наприклад, у двох, трьох, чотирьох, п'яти або більше) залишках в HVR. В одному з варіантів винаходу, варіант HVR-L3 містить 1-6 (1, 2, 3, 4, 5 або 6) замін у будь-якій комбінації в нижченаведених положеннях: 91 (S або W), 92 (Y або F), 93 (Τ, Ν або S), 94 (Т або G), 95 (Р, Q, А або Т) і/або 96 (Р, S, А або V). В одному з варіантів винаходу варіант HVR-H2 містить 1-4 (1, 2, 3 або 4) замін у будь-якій комбінації в нижченаведених положеннях: 50 (V, L або 94464 12 Y), 52 (N або S), 52а (Р або S) або 53 (N, Q, Τ або І). Букви в дужках після кожного положення вказують на репрезентативне заміщення (тобто репрезентативну заміну) амінокислот; і як очевидно фахівцеві в даній галузі, допустимість заміни однієї амінокислоти іншою амінокислотою відповідно до описаного тут винаходом може бути оцінена рутинними відомими і/або описаними тут методами. В одному зі своїх аспектів даний винахід належить до антитіла, що включає область HVR-H1, яка містить послідовність SEQ ID NO:1 або 2. В одному зі своїх аспектів даний винахід належить до антитіла, що включає область HVR-H2, яка містить послідовність SEQ ID NO:3, 4, 5, 6, 7 або 8. В одному зі своїх аспектів даний винахід належить до антитіла, що включає область HVR-H3, яка містить послідовність SEQ ID NO:9. В одному зі своїх варіантів, даний винахід належить до антитіла, що включає область HVR-L1, яка містить послідовність SEQ ID NO:10. В одному зі своїх варіантів, даний винахід належить до антитіла, що включає область HVR-L2, яка містить послідовність SEQ ID NO:11. В одному зі своїх варіантів, даний винахід належить до антитіла, що включає область HVRL3, яка містить послідовність SEQ ID NO:12, 13, 14, 15, 16, 17 або 18. В одному зі своїх аспектів даний винахід належить до антитіла, що включає щонайменше одну, щонайменше дві або всі три нижченаведені послідовності: (і) послідовність HVR-H1, що містить послідовність SEQ ID NO:1; (іі) послідовність HVR-H2, що містить послідовність SEQ ID NO:5; (ііі) послідовність HVR-H3, що містить послідовність SEQ ID NO:9. В одному зі своїх аспектів даний винахід належить до антитіла, що включає щонайменше одну, щонайменше дві або всі три нижченаведені послідовності: (і) послідовність HVR-L1, що містить послідовність SEQ ID NO:10; (іі) послідовність HVR-L2, що містить послідовність SEQ ID NO:11; (ііі) послідовність HVR-L3, що містить послідовність SEQ ID NO:15. В одному зі своїх аспектів даний винахід належить до антитіла, що включає щонайменше одну, щонайменше дві або всі три нижченаведені послідовності: (і) послідовність HVR-H1, що містить послідовність SEQ ID NO:1; (іі) послідовність HVR-H2, що містить послідовність SEQ ID NO:8; (ііі) послідовність HVR-H3, що містить послідовність SEQ ID NO:9. В одному зі своїх аспектів даний винахід належить до антитіла, що включає щонайменше одну, щонайменше дві або всі три нижченаведені послідовності: (і) послідовність HVR-L1, що містить послідовність SEQ ID NO:10; 13 (іі) послідовність HVR-L2, що містить послідовність SEQ ID NO:11; (ііі) послідовність HVR-L3, що містить послідовність SEQ ID NO:18. Амінокислотні послідовності SEQ ID NO:1-18 пронумеровані для кожної окремої HVR (тобто НІ, Н2 або НЗ), як показано на фігурах 1а і 1b, де вказана нумерація відповідає системі нумерації Кебата, описаній нижче. В одному зі своїх аспектів даний винахід належить до антитіл, що включають послідовності HVR важкого ланцюга, як показано на фігурах 1а і 1b. В одному зі своїх аспектів даний винахід належить до антитіл, що включають послідовності HVR легкого ланцюга, як показано на фігурах 1а і 1b. Деякі варіанти антитіл відповідно до винаходу включають варіабельний домен легкого ланцюга гуманізованого антитіла 4D5 (huMAb4D5-8) (HERCEPTIN®, Genentech, Inc., South San Francisco, CA, USA) (також описаного в патенті США № 6407213 і Lee et al., J. Моl. Βiοl (2004), 340(5): 1073-93)), представленого нижче в SEQ ID NO:52. 1 Asp He Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr lle Thr Cys ArR Ala Ser Gln Asp Val Asn Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu lle Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr lle Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu lle Lys 107 (SEQ ID NO:52) (залишки HVR підкреслені) В одному з варіантів винаходу, послідовність варіабельного домену легкого ланцюга huMAb4D58 модифікована в одному або декількох положеннях 30, 66 і 91 (Asn, Arg і His вказані вище жирним шрифтом/курсивом, відповідно). В одному з варіантів винаходу, модифікована послідовність huMAb4D5-8 містить Ser у положенні 30, Gly у положенні 66 і/або Ser у положенні 91. Відповідно до цього, в одному з варіантів винаходу, антитіло відповідно до винаходу містить варіабельний домен легкого ланцюга, що має послідовність, представлену нижче в SEQ ID NO:53: 1 Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu lle Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys 107 (SEQ ID NO:53) (залишки HVR підкреслені) Замінені залишки в huMAb4D5-8 вказані вище жирним шрифтом/курсивом. Антитіла відповідно до винаходу можуть містити будь-яку прийнятну послідовність каркасного домена у варіабельній області, за умови, що активність зв'язування з DLL4 буде, в основному, зберігатися. Так, наприклад, у деяких варіантах винаходу, антитіла відповідно до винаходу містять 94464 14 консенсусну послідовність каркасної області людського важкого ланцюга підгрупи III. В одному з варіантів цих антитіл, консенсусна послідовність каркасних областей містить заміну в положенні 71, 73 і/або 78. У деяких варіантах цих антитіл, у положенні 71 присутній А, у положенні 73 присутній Τ і/або в положенні 78 присутній А. В одному з варіантів винаходу, вказані антитіла включають каркасні послідовності варіабельного домену важкого ланцюга huMAb4D5-8 (HERCEPTIN , Genentech, Inc., South San Francisco, CA, USA) (також описаного в патентах США №№ 6407213 і 5821337 і в публікації Lee et al., J. Моl. Вiol. (2004), 340(5):1073-93). В одному з варіантів винаходу, ці антитіла також включають консенсусну послідовність каркасної області людського легкого ланцюга l. В одному з варіантів винаходу, вказані антитіла включають послідовності HVR легкого ланцюга huMAb4D5-8 (описані в патентах США №№ 6407213 і 5821337). В одному з варіантів винаходу, вказані антитіла включають послідовності варіабельного домену легкого ланцюга huMAb4D5-8 (HERCEPTIN®, Genentech, Inc., South San Francisco, CA, USA) (також описаного в патентах США №№ 6407213 і 5821337 і Lee et al., J. Моl. Biol. (2004), 340(5): 1073-93). В одному з варіантів винаходу, вказане антитіло відповідно до винаходу включає варіабельний домен важкого ланцюга, де каркасна послідовність включає послідовність SEQ ID NO:19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36 і/або 37, послідовності HVR Н1, Н2 і Н3 являють собою SEQ ID NO:1, 5 і/або 9, відповідно. В одному з варіантів винаходу, антитіло відповідно до винаходу включає варіабельний домен легкого ланцюга, де каркасна послідовність включає послідовність SEQ ID NO:38, 39, 40 і/або 41, послідовності HVR L1, L2 і L3 являють собою SEQ ID NO:10, 11 і/або 15, відповідно. В одному з варіантів винаходу, антитіло відповідно до винаходу містить варіабельний домен важкого ланцюга, де каркасна послідовність включає послідовність SEQ ID NO:19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36 і/або 37, послідовності HVR Н1, Н2 і Н3 являють собою SEQ ID NO:2, 3 і/або 9, відповідно. В одному з варіантів винаходу, антитіло відповідно до винаходу містить варіабельний домен легкого ланцюга, де каркасна послідовність включає послідовність SEQ ID NO:38, 39, 40 і/або 41, послідовності HVR L1, L2 і L3 являють собою SEQ ID NO:10, 11 і/або 14, відповідно. В одному з варіантів винаходу, антитіло відповідно до винаходу містить варіабельний домен важкого ланцюга, де каркасна послідовність включає послідовність SEQ ID NO:19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36 і/або 37, послідовності HVR Н1, Н2 і Н3 являють собою SEQ ID NO:1, 8 і/або 9, відповідно. В одному з варіантів винаходу, антитіло відповідно до винаходу містить варіабельний домен легкого ланцюга, де каркасна послідовність включає послідовність SEQ ID NO:38, 39, 40 і/або 41, послідовності HVR L1, L2 і L3 являють собою SEQ ID NO:10, 11 і/або 18, відповідно. 15 В одному з варіантів винаходу, антитіло відповідно до винаходу містить варіабельний домен важкого ланцюга, де каркасна послідовність включає послідовність SEQ ID NO:46, 47, 48 і/або 49, послідовності HVR Н1, Н2 і Н3 являють собою SEQ TD NO:1; 5 і/або 9, відповідно. В одному з варіантів винаходу, антитіло відповідно до винаходу містить варіабельний домен легкого ланцюга, де каркасна послідовність включає послідовність SEQ ID NO:42, 43, 44 і/або 45, послідовності HVR L1, L2 і L3 являють собою SEQ ID NO:10, 11 і/або 15, відповідно. В одному з варіантів винаходу, антитіло відповідно до винаходу містить варіабельний домен важкого ланцюга, де каркасна послідовність включає послідовність SEQ ID NO:46, 47, 48 і/або 49, послідовності HVR Н1, Н2 і Н3 являють собою SEQ ID NO:2, 3 і/або 9, відповідно. В одному з варіантів винаходу, антитіло відповідно до винаходу містить варіабельний домен легкого ланцюга, де каркасна послідовність включає послідовність SEQ ID NO:42, 43, 44 і/або 45, послідовності HVR L1, L2 і L3 являють собою SEQ ID NO:10, 11 і/або 14, відповідно. В одному з варіантів винаходу, антитіло відповідно до винаходу містить варіабельний домен важкого ланцюга, де каркасна послідовність включає послідовність SEQ ID NO:46, 47, 48 і/або 49, послідовності HVR Н1, Н2 і Н3 являють собою SEQ ID NO:1, 8 і/або 9, відповідно. В одному з варіантів винаходу, антитіло відповідно до винаходу містить варіабельний домен легкого ланцюга, де каркасна послідовність включає послідовність SEQ ID NO:42, 43, 44 і/або 45, послідовності HVR L1, L2 і L3 являють собою SEQ ID NO:10, 11 і/або 18, відповідно. В одному з варіантів винаходу, антитіло відповідно до винаходу піддають афінному дозріванню з досягненням потрібної афінності зв'язування з мішенню. В одному із прикладів, афінно зріле антитіло відповідно до винаходу містить заміну в одному або декількох положеннях амінокислот Н28, Н30, Н31, Н32, Н3З, L91, L92, L93, L94, L95 і/або L96. В одному із прикладів, афінно зріле антитіло відповідно до винаходу містить одну або декілька з нижченаведених замін: (а) у важкому ланцюзі, V50L, V50Y, N52S, P52aS, N53Q, N53T, N531, S56A, S56F, T57S, D58E, D58I, D58A, D58Y, або (b), у легкому ланцюзі, S91W, Y92F, T93N, T93S, T94G, P95Q, Р95А, Р95Т, P96S, Р96А, P96V. В одному з варіантів винаходу, антитіло відповідно до винаходу містить варіабельний домен важкого ланцюга, що включає послідовність SEQ ID NO:54. В одному з варіантів винаходу., антитіло відповідно до винаходу містить варіабельний домен легкого ланцюга, що включає послідовність SEQ ID NO:55. В одному з варіантів винаходу, антитіло відповідно до винаходу містить варіабельний домен важкого ланцюга, що включає послідовність SEQ ID NO:54, і варіабельний домен легкого ланцюга, що включає послідовність SEQ ID NO:55. В одному з варіантів винаходу, антитіло відповідно до винаходу містить варіабельний домен важкого ланцюга, що включає послідовність SEQ ID NO:56. В одному з варіантів винаходу, антитіло 94464 16 відповідно до винаходу містить варіабельний домен легкого ланцюга, що включає послідовність SEQ ID NO:57. В одному з варіантів винаходу, антитіло відповідно до винаходу містить варіабельний домен важкого ланцюга, що включає послідовність SEQ ID NO:56, і варіабельний домен легкого ланцюга, що включає послідовність SEQ ID NO:57. В одному з варіантів винаходу, антитіло відповідно до винаходу містить варіабельний домен важкого ланцюга, що включає послідовність SEQ ID NO:58. В одному з варіантів винаходу, антитіло відповідно до винаходу містить варіабельний домен легкого ланцюга, що включає послідовність SEQ ID NO:59. В одному з варіантів винаходу, антитіло відповідно до винаходу містить варіабельний домен важкого ланцюга, що включає послідовність SEQ ID NO:58, і варіабельний домен легкого ланцюга, що включає послідовність SEQ ID NO:59. В одному зі своїх аспектів даний винахід належить до антитіла, яке конкурує з будь-якими вищезгаданими антитілами за зв'язування з DLL4. В одному зі своїх аспектів даний винахід належить до антитіла, що зв'язується з таким же епітопом на DLL4, з яким зв'язується будь-яке з вищезгаданих антитіл. Як відомо фахівцям і як докладно описано нижче, положення/межі амінокислот, що визначають гіперваріабельну область антитіла, можуть варіюватися залежно від оточуючих амінокислот і від різних дефініцій, відомих фахівцям (описаних нижче). Деякі положення у варіабельному домені можуть розглядатися як гібридні гіперваріабельні положення, де ці положення, очевидно, можуть бути присутніми в гіперваріабельній області відповідно до одного ряду ознак, можуть бути присутніми і поза гіперваріабельною областю відповідно до іншого ряду ознак. Одне або декілька із цих положень може також знаходитися в подовжених гіперваріабельних областях (як докладно визначено нижче). У деяких варіантах винаходу, вказаним антитілом є моноклональне антитіло. У деяких варіантах винаходу, вказаним антитілом є поліклональне антитіло. У деяких варіантах винаходу, вказане антитіло вибране із групи, яка складається з химерного антитіла, афінно зрілого антитіла, гуманізованого антитіла й людського антитіла. У деяких варіантах винаходу, вказаним антитілом є фрагмент антитіла. У деяких варіантах винаходу, вказаним антитілом є Fab, Fab', Fab'-SH, F(ab')2 або scFv. В одному з варіантів винаходу, вказаним антитілом є химерне антитіло, наприклад, антитіло, що включає антигензв'язувальні послідовності, що походять від не-людського донора й приєднані до гетерологічної не-людської, людської або гуманізованої послідовності (наприклад, послідовностей каркасного і/або константного домена). В одному з варіантів винаходу, вказаним не-людським донором є миша. В одному з варіантів винаходу, антигензв'язувальна послідовність є синтетичною, наприклад, вона може бути отримана за допомогою мутагенезу (наприклад, шляхом скринінгу методом фагового представлення й т.п.). В одному з варіантів винаходу, химерне антитіло відповідно до 17 винаходу має мишачі V-області й людську Собласть. В одному з варіантів винаходу, мишача V-область легкого ланцюга приєднана до людського легкого ланцюга каппа. В одному з варіантів винаходу, мишача V-область важкого ланцюга приєднана до людської С-області IgG1. Гуманізованими антитілами відповідно до винаходу є антитіла, що мають амінокислотні заміни в FR і афінно зрілі варіанти із замінами в приєднаних CDR. Замінені амінокислоти в CDR або FR не обмежуються амінокислотами, які присутні в антитілі-донорі або реципієнті. В інших варіантах винаходу, антитіла відповідно до винаходу також містять заміни амінокислотних залишків в Fc-області, які поліпшують ефекторну функцію, включаючи поліпшення CDC- і/або ADCC-функції й посилення цитолізу В-клітин. Іншими антитілами відповідно до винаходу є антитіла, що мають специфічні заміни, які підвищують стабільність. В інших варіантах винаходу, антитіла відповідно до винаходу містять заміни амінокислотних залишків в Fcобласті, які послаблюють ефекторну функцію, включаючи ослаблення CDC- і/або ADCC-функції і/або ослаблення цитолізу В-клітин. У деяких варіантах винаходу, антитіла відповідно до винаходу характеризуються зниженим рівнем зв'язування (наприклад, відсутністю зв'язування) з фактором Clq людської системи комплементу і/або з людським Fc-рецептором на природних клітинах-кілерах (NK). У деяких варіантах винаходу, антитіла відповідно до винаходу характеризуються зниженим рівнем зв'язування (наприклад, відсутністю зв'язування) з людським FcRI, FcRIIA і/або FcRIIIA. У деяких варіантах винаходу, антитіла відповідно до винаходу належать до класу IgG (наприклад, IgG1 або IgG4) і містять щонайменше одну мутацію в Е233, L234, G236, D265, D270, N297, Е318, K320, К322, А327, А330, Р331 і/або Р329 (нумерація проводилася відповідно до Європейської системи нумерації (EU)). У деяких варіантах винаходу, вказані антитіла включають мутацію L234A/L235A або D265A/N297A. В одному зі своїх аспектів даний винахід належить до антитіл проти поліпептидів DLL4, які містять будь-яку з описаних тут антигензв'язувальних послідовностей, де вказані антитіла проти поліпептидів DLL4 специфічно зв'язуються з DLL4. Антитіла відповідно до винаходу зв'язуються (наприклад, специфічно зв'язуються) з DLL4, у деяких варіантах винаходу, вони можуть модулювати один або декілька видів DLL4-асоційованих ефектів, включаючи, але не обмежуючись ними,ослаблення або блокування активації рецептора Notch, ослаблення або блокування молекулярного сигналу, який передається після передачі сигналу рецептора Notch, порушення або блокування зв'язування рецептора Notch з DLL4 і/або стимуляцію проліферації ендотеліальних клітин і/або інгібування диференціювання ендотеліальних клітин і/або інгібування артеріальної диференціації і/або інгібування судинної перфузії пухлини, і/або лікування і/або попередження розвитку пухлини, клітинно-проліферативного розладу або раку; і/або лікування або попередження розладу, асоційованого з експресією і/або активністю DLL4 і/або ліку 94464 18 вання або попередження розладу, асоційованого з експресією і/або активністю рецептора Notch. У деяких варіантах винаходу, антитіло відповідно до винаходу специфічно зв'язується з DLL4. У деяких варіантах винаходу, антитіло специфічно зв'язується з позаклітинним доменом DLL4 (ECD). У деяких варіантах винаходу, антитіло специфічно зв'язується з поліпептидом, що складається, або, в основному, що складається з позаклітинного домена DLL4. У деяких варіантах винаходу, антитіло специфічно зв'язується з DLL4 з KD приблизно 1 нМ або більше, або приблизно 500 пМ або більше. У деяких варіантах винаходу, антитіло специфічно 5 зв'язується з людським DLL4 з kon приблизно 2×10 5 або більше, або приблизно 1×10 або більше. У деяких варіантах винаходу, антитіло відповідно до винаходу послаблює, інгібує і/або блокує активність DLL4 in vivo і/або in vitro. У деяких варіантах винаходу, антитіло конкурує з DLL4-лігандом за зв'язування з DLL4 (послаблює і/або блокує зв'язування рецептора Notch з DLL4). В одному зі своїх аспектів даний винахід належить до композицій, що містять одне або декілька антитіл відповідно до винаходу й носій. В одному з варіантів винаходу, вказаний носій є фармацевтично прийнятним. В одному зі своїх аспектів даний винахід належить до нуклеїнових кислот, що кодують антиDLL4-антитіло відповідно до винаходу. В одному зі своїх аспектів даний винахід належить до векторів, що містять нуклеїнову кислоту відповідно до винаходу. В одному зі своїх аспектів даний винахід належить до композицій, що містять одну або декілька нуклеїнових кислот відповідно до винаходу й носій. В одному з варіантів винаходу, вказаний носій є фармацевтично прийнятним. В одному зі своїх аспектів даний винахід належить до клітин-хазяїв, що містять нуклеїнову кислоту або вектор відповідно до винаходу. Вказаним вектором може бути вектор будь-якого типу, наприклад, рекомбінантний вектор, такий як експресійний вектор. При цьому можуть бути використані будь-які клітини-хазяї. В одному з варіантів винаходу, клітиною-хазяєм є прокаріотична клітина, наприклад, Е.соlі. В одному з варіантів винаходу, клітиною-хазяєм є еукаріотична клітина, наприклад, клітина ссавця, така як клітина яєчника китайського хом'ячка (СНО). В одному зі своїх аспектів даний винахід належить до способів одержання антитіла відповідно до винаходу. Так, наприклад, даний винахід належить до способів одержання анти-DLL4-антитіла (яке, як визначено в даній заявці, є повнорозмірним антитілом або фрагментом антитіла) або імунокон'югата, де вказаний спосіб включає експресію в прийнятній клітині-хазяїні рекомбінантного вектора відповідно до винаходу, що кодує вказане антитіло (або його фрагмент), і виділення вказаного антитіла. В одному зі своїх аспектів даний винахід належить до промислового виробу, що включає контейнер і композицію, яка міститься в цьому контейнері, де вказана композиція включає одне або декілька анти-ВІХ4-антитіл відповідно до винахо 19 ду. В одному з варіантів винаходу, вказана композиція також містить антиангіогенний агент. В одному з варіантів винаходу, вказаним антиангіогенним агентом є анти-VEGF-антитіло, наприклад, бевацизумаб. В одному з варіантів винаходу, вказана композиція містить нуклеїнову кислоту відповідно до винаходу. В одному з варіантів винаходу, вказана композиція, що містить антитіло, також містить носій, що, у деяких варіантах винаходу, є фармацевтично прийнятним. В одному з варіантів винаходу, у вказаному контейнері присутня друга композиція, де вказана друга композиція містить антиангіогенний агент. В одному з варіантів винаходу, вказаним антиангіогенним агентом є антиDLL4-антитіло, наприклад, бевацизумаб. В одному з варіантів винаходу, промисловий виріб відповідно до винаходу також включає інструкції із введення вказаної(их) композиції(й) (наприклад, антитіла) індивідууму (наприклад, інструкції із застосування будь-якого з описаних тут способів). В одному зі своїх аспектів даний винахід належить до набору, який містить перший контейнер, що включає композицію, яка містить одне або декілька анти-DLL4-антитіл відповідно до винаходу, і другий контейнер, що включає буфер. В одному з варіантів винаходу, вказаний буфер є фармацевтично прийнятним. В одному з варіантів винаходу, композиція, що містить антитіло, також містить носій, що, у деяких варіантах винаходу, є фармацевтично прийнятним. В одному з варіантів винаходу, вказаний набір також включає інструкції із введення вказаної композиції (наприклад, антитіла) індивідууму. В одному зі своїх аспектів даний винахід належить до застосування анти-ОКЬ4-антитіла відповідно до винаходу з метою одержання лікарського засобу для терапевтичного і/або профілактичного лікування захворювання, такого як рак, пухліну і/або клітинно-проліферативний розлад. У деяких варіантах винаходу, вказаним розладом є патологічний стан, асоційований з ангіогенезом. В одному зі своїх аспектів даний винахід належить до застосування нуклеїнової кислоти відповідно до винаходу з метою одержання лікарського засобу для терапевтичного і/або профілактичного лікування захворювання, такого як рак, пухліну і/або клітинно-проліферативний розлад. У деяких варіантах винаходу, вказаним розладом є патологічний стан, асоційований з ангіогенезом. В одному зі своїх аспектів даний винахід належить до застосування експресійного вектора відповідно до винаходу з метою одержання лікарського засобу для терапевтичного і/або профілактичного лікування захворювання, такого як рак, пухліну і/або клітинно-проліферативний розлад. У деяких варіантах винаходу, вказаним розладом є патологічний стан, асоційований з ангіогенезом. В одному зі своїх аспектів даний винахід належить до застосування клітини-хазяя відповідно до винаходу з метою одержання лікарського засобу для терапевтичного і/або профілактичного лікування захворювання, такого як рак, пухліну і/або клітинно-проліферативний розлад. У деяких варіа 94464 20 нтах винаходу, вказаним розладом є патологічний стан, асоційований з ангіогенезом. В одному зі своїх аспектів даний винахід належить до застосування промислового виробу відповідно до винаходу з метою одержання лікарського засобу для терапевтичного і/або профілактичного лікування захворювання, такого як рак, пухліну і/або клітинно-проліферативний розлад. У деяких варіантах винаходу, вказаним розладом є патологічний стан, асоційований з ангіогенезом. В одному зі своїх аспектів даний винахід належить до застосування набору відповідно до винаходу з метою одержання лікарського засобу для терапевтичного і/або профілактичного лікування захворювання, такого як рак, пухліну і/або клітинно-проліферативний розлад. У деяких варіантах винаходу, вказаним розладом є патологічний стан, асоційований з ангіогенезом. Даний винахід належить до способів і композицій, які можуть бути застосовані для лікування патологічних станів, асоційованих з експресією і/або активністю DLL4, наприклад, з підвищеною або зниженою експресією і/або активністю, або небажаною експресією і/або активністю DLL4. В одному зі своїх аспектів даний винахід належить до способів лікування або попередження пухлини, раку і/або клітинно-проліферативного розладу, асоційованих з підвищеною експресією і/або активністю DLL4, де вказані способи включають введення ефективної кількості анти-DLL4антитіла індивідууму, який потребує такого лікування. В одному зі своїх аспектів даний винахід належить до способів ослаблення, інгібування, блокування або попередження росту пухлини або ракової пухлини, де вказані способи включають введення ефективної кількості анти-DLL4-антитіла індивідууму, який потребує такого лікування. В одному зі своїх аспектів даний винахід належить до способів лікування пухлини, раку і/або клітинно-проліферативного розладу, де вказані способи включають введення ефективної кількості анти-DLL4-антитіла індивідууму, який потребує такого лікування. В одному зі своїх аспектів даний винахід належить до способів інгібування ангіогенезу, де вказані способи включають введення ефективної кількості анти-DLL4-антитіла індивідууму, який потребує такого лікування. В одному зі своїх аспектів даний винахід належить до способів лікування патологічного стану, асоційованого з порушенням ангіогенезів, де вказані способи включають введення ефективної кількості анти-DLL4-антитіла індивідууму, який потребує такого лікування. У деяких варіантах винаходу, вказаним патологічним станом, асоційованим з ангіогенезом, є пухлина, рак і/або клітинно-проліферативний розлад. У деяких варіантах винаходу, вказаним патологічним станом, асоційованим з ангіогенезом, є внутрішньоочне неоваскулярне захворювання. Способи відповідно до винаходу можуть бути застосовані для лікування будь-якого релевантного патологічного стану. Репрезентативні розлади описані в даній заявці, і такими розладами є ракові 21 захворювання, вибрані із групи, яка складається із дрібноклітинного раку легенів, нейробластоми, меланоми, карциноми молочної залози, раку шлунка, раку прямої і ободової кишки (CRC) і гепатоцелюлярної карциноми, включаючи метастази вказаних ракових захворювань. Способи відповідно до винаходу можуть також включати додаткові стадії лікування. Так, наприклад, в одному з варіантів винаходу, вказаний спосіб додатково включає стадію, у якій клітину- і/або тканину-мішень (наприклад, ракову клітину) піддають променевій терапії або хіміотерапії, або обробляють антиангіогенним агентом. В іншому своєму аспекті, даний винахід належить до способів детектування DLL4, де вказані способи включають детектування комплексу «DLL4-анти-DLL4-антитіло» у зразку. Використовуваний тут термін «детектування» включає якісне і/або кількісне детектування (на вимірних рівнях) у присутності або за відсутності контролю. В іншому своєму аспекті, даний винахід належить до способів діагностики розладу, асоційованого з експресією і/або активністю DLL4, де вказані способи включають детектування комплексу «DLL4-анти-DLL4-антитіло» у біологічному зразку, узятому в пацієнта, що страждає на вказаний розлад або з підозрою на вказаний розлад. У деяких варіантах винаходу, експресія DLL4 є підвищеною або аномальною. У деяких варіантах винаходу, вказаним розладом є пухлина, рак і/або клітиннопроліферативний розлад. В іншому своєму аспекті, даний винахід належить до будь-якого з описаних тут анти-DLL4антитіл, де вказане анти-DLL4-антитіло містить детектовану мітку. В іншому своєму аспекті, даний винахід належить до комплексу, який складається з будь-яких описаних тут анти-DLL4-антитіл і DLL4. У деяких варіантах винаходу, вказаний комплекс присутній in vivo або in vitro. У деяких варіантах винаходу, вказаний комплекс включає ракові клітини. У деяких варіантах винаходу, анти-DLL4-антитіло є детектовано міченим. Фігура 1a, b: Послідовності петлі HVR важкого ланцюга й легкого ланцюга анти-DLL4-антитіл. На цих фігурах представлені послідовності HVR важкого ланцюга, Н1, Н2 і Н3, і послідовності HVR легкого ланцюга, L1, L2 і L3. Послідовності пронумеровані наступним чином: клон 152.26 (HVR-H1 являє собою SEQ ID NO:1; HVR-H2 являє собою SEQ ID NO:3; HVR-H3 являє собою SEQ ID NO:9; HVR-L1 являє собою SEQ ID NO:10; HVR-L2 являє собою SEQ ID NO:11; HVR-L3 являє собою SEQ ID NO:12); клон 152.26.6 (HVR-H1 являє собою SEQ ID NО:1; HVR-H2 являє собою SEQ ID NO:4; HVRH3 являє собою SEQ ID NO:9; HVR-L1 являє собою SEQ ID NO:10; HVR-L2 являє собою SEQ ID NO:11; HVR-L3 являє собою SEQ ID NO:13); клон 152.26.14 (HVR-H1 являє собою SEQ ID NO:2; HVR-H2 являє собою SEQ ID NO:3; HVR-H3 являє собою SEQ ID NO:9; HVR-L1 являє собою SEQ ID NO:10; HVR-L2 являє собою SEQ ID NO:11; HVRL3 являє собою SEQ ID NO:14); клон 152.26.20 (HVR-H1 являє собою SEQ ID NO:1; HVR-Н2 являє собою SEQ ID NO:5; HVR-H3 являє собою SEQ ID 94464 22 NO:9; HVR-L1 являє собою SEQ ID NO:10; HVR-L2 являє собою SEQ ID NO:11; HVR-L3 являє собою SEQ ID NO:15); клон 152.26.34 (HVR-H1 являє собою SEQ ID NO:1; HVR-H2 являє собою SEQ ID NO:6; HVR-H3 являє собою SEQ ID NO:9; HVR-L1 являє собою SEQ ID NO:10; HVR-L2 являє собою SEQ ID NO:11; HVR-L3 являє собою SEQ ID NO:16); клон 152.26.40 (HVR-H1 являє собою SEQ ID NO:1; HVR-H2 являє собою SEQ ID NO:7; HVRH3 являє собою SEQ ID NO:9; HVR-L1 являє собою SEQ ID NO:10; HVR-L2 являє собою SEQ ID NO:11; HVR-L3 являє собою SEQ ID NO:17); і клон 152.26.82 (HVR-H1 являє собою SEQ ID NO:1; HVR-H2 являє собою SEQ ID NO:8; HVR-H3 являє собою SEQ ID NO:9; HVR-L1 являє собою SEQ ID NO:10; HVR-L2 являє собою SEQ ID NO:11; HVRL3 являє собою SEQ ID NO:18). Положення амінокислот пронумеровані відповідно до системи нумерації Кебата, як описано нижче. Фігури 2 і 3: репрезентативні акцепторні людські консенсусні послідовності каркасної області, які використовуються для здійснення даного винаходу із застосуванням нижченаведених ідентифікаторів послідовності: Консенсусні каркасні послідовності варіабельної області важкого ланцюга (УКГ) (фіг. 2а, b) Консенсусна послідовність людської каркасної області VH підгрупи І мінус CDR по Кебату (SEQ ID NO:19) Консенсусна послідовність людської каркасної області VH підгрупи І мінус подовжені гіперваріабельні області (SEQ ID NO:20-22) Консенсусна послідовність людської каркасної області VH підгрупи II мінус CDR по Кебату (SEQ ID NO:23) Консенсусна послідовність людської каркасної області VH підгрупи І мінус подовжені гіперваріабельні області (SEQ ID NO:24-26) Консенсусна послідовність людської каркасної області VH підгрупи II мінус подовжені Консенсусна послідовність людської каркасної області VH підгрупи III мінус CDR по Кебату (SEQ ID NO:27) Консенсусна послідовність людської каркасної області VH підгрупи III мінус подовжені гіперваріабельні області (SEQ ID NO:28-30) Акцепторна послідовність людської каркасної області VH мінус CDR по Кебату (SEQ ID NO:31) Акцепторна послідовність людської каркасної області VH мінус подовжені гіперваріабельні області (SEQ ID NO:32-33) Акцепторна послідовність 2 людські каркасні області VH мінус CDR по Кебату (SEQ ID NO:34) Акцепторна послідовність 2 людські каркасні області VH мінус подовжені гіперваріабельні області (SEQ ID NO:35-37) Консенсусні послідовності каркасної області варіабельної області легкого ланцюга (VL) (фіг. 3) Консенсусна послідовність людської каркасної області ланцюга каппа VL підгрупи І (SEQ ID NO:38) Консенсусна послідовність людської каркасної області ланцюга каппа VL підгрупи II (SEQ ID NO:39) 23 Консенсусна послідовність людської каркасної області ланцюга каппа VL підгрупи III (SEQ ID NO:40) Консенсусна послідовність людської каркасної області ланцюга каппа VL підгрупи IV (SEQ ID NO:41) Фігура 4: Послідовності каркасної області легкого й важкого ланцюгів huMAb4D5-8. Числа у верхньому індексі/виділені жирним шрифтом, указують на положення амінокислот, пронумеровані по Кебату. Фігура 5: Модифіковані/змінені послідовності каркасної області легкого й важкого ланцюгів huMAb4D5-8. Числа у верхньому індексі/виділені жирним шрифтом указують на положення амінокислот, пронумеровані по Кебату. Фігура 6: Варіабельні області важкого ланцюга й вентиляції областей легкого ланцюга клонів антитіл 26.20, 26.14 і 26.82. Фігура 7: DLL4-опосередковувана передача сигналу Notch регулює проліферацію ЕК. а-с, f: аналізи на розростання HUVEC в тривимірних фібринових гелях. Анти-DLL4-антитіло (YW26.82) або DBZ стимулюють розростання HUVECs (а). Kі67-забарвлювання показало, що анти-DLL4антитіло або DBZ викликають гіперпроліферацію HUVEC (b). Анти-DLL4-антитіло або DBZ підвищують рівень розростання HUVEC у присутності SFкондиціонованого середовища (с). d, h: Системна доставка анти-DLL4-антитіла викликає масивну акумуляцію ЕК у сітківці немовлят. Зображення судинної системи сітківки, отримані на конфокальному мікроскопі з невеликим збільшенням (угорі) і з більшим збільшенням (унизу) (забарвлювання ізолектином). (d): Kі67-забарвлювання вказувало на збільшення рівня проліферації ЕК у сітківці немовлят, обробленої анти-DLL4-антитілом (h). e: активація Notch під дією іммобілізованого DLL4 приводила до інгібування проліферації HUVEC. f: Анти-VEGF-aнтитілo інгібувало розростання HUVEC у присутності або за відсутності DBZ. g: Регуляція VEGFR2 під дією Notch. Кількісний ПЛРаналіз на експресію VEGFR2 у відповідь на блокаду Notch у культурі клітин HUVEC в тривимірному фібриновому гелі (7 днів) під дією анти-DLL4антитіла або DBZ (ліворуч) або активація Notch у культурі клітин HUVEC в двовимірному гелі (36 годин) під дією іммобілізованого DLL4 (праворуч). Анти-DLL4-антитіло й DBZ використовували при 5 мкг/мл і 0,08 мкМ, відповідно (а-с, e-g). Фігура 8: DLL4-опосередковувана передача сигналу Notch регулює диференціювання ЕК. а: Порожнина-подібні структури (білі стрілки), утворені клітинами HUVEC, що ростуть у фібринових гелях, елімінувалися в присутності анти-DLL4антитіла або DBZ. Замість цього, ці розростання були щільно впаковані клітинами (чорні стрілки). b: Регуляція TGFβ2 під дією Notch. Кількісний ПЛРаналіз експресії TGFΒ2 у відповідь на блокаду Notch у культурі клітин HUVEC в тривимірному фібриновому гелі (7 днів) під дією анти-DLL4антитіла або DBZ (ліворуч) або активація Notch у культурі клітин HUVEC в двовимірному гелі (36 годин) під дією іммобілізованого DLL4 (праворуч), с: Анти-DLL4-антитіло блокує розвиток артерій. 94464 24 Зображення сітківки, забарвленої альфа-актином гладкого м'яза (ASMA) і ізолектином, отримані для новонародженої миші на конфокальному мікроскопі. Новонароджених мишей обробляли як показані на Фіг. 1d. d: Зображення забарвленої ASMA і ізолектином сітківки, отримані на конфокальному мікроскопі для дорослої миші. 8-тижневих мишей обробляли PBS або aHra-DLL4-антитілом (10 мг/кг, два рази на тиждень) протягом двох тижнів. Фігура 9: Селективне блокування DLL4 і/або VEGF порушує ангіогенез пухлини й інгібує ріст пухлини, a-f: Результати, отримані для пухлинних моделей: НМ7 (а), Соlо205 (b), Саlu6 (с), MDA-MB435 (d), MV-522 (e) і WEHI3 (f). Представлений середній об'єм пухлини із середньоквадратичною помилкою, g-h: Гістологічний аналіз судин пухлин. Імуногістохімічний аналіз на анти-СD31-антитіла, проведений на зрізах пухлин EL4, узятих у контрольних мишей і в мишей, оброблених анти-DLL4антитілом і анти-VEGF-антитілом (g): Перфузія лектину й забарвлювання анти-CD31-антитілом у зрізах пухлини EL4 (h). і-р: Результати, отримані для пухлинних моделей: SK-OV-3X1 (і), LL2 (j), EL4 (k), Н1299 (l), SKMES-1(m), MX-l(n), SW620(o) і LS174T(p). Фігура 10: DLL4/Notch не відіграє важливої ролі в гомеостазі мишачої тонкої кишки. Були проведені імуногістохімічні дослідження тонкого кишечнику, узятого в контрольних мишей (a, d, g, j), у мишей, оброблених анти-DLL4-антитілом (10 мг/кг, два рази на тиждень протягом 6 тижнів) (b, e, h, k), і в мишей, оброблених DBZ (30 мкмоль/кг щодня протягом 5 днів) (с, f, і, l). Як показало забарвлювання Н&Е (а, b, с) і альціановим синім (d, e, f), DBZ викликає заміну популяції клітин ТА бокаловидними клітинами. Така зміна повністю була відсутня після обробки анти-DLL4-антитілом. Забарвлювання КІ67 (g, h, і) і HES-1 (j, k, l) додатково підтвердило, що анти-DLL4-антитіло нездатне імітувати дію DBZ. Фігура 11: Характеризація анти-DLL4-антитіла. а: Картування епітопа моноклонального антиDLL4-aнтитілa (Mab) YW26.82. Схематичне представлення набору мутантів DLL4, експресованих у вигляді С-кінцевих гібридних білків лужної фосфатази (ЛФ) у людській плаценті. Середовище, яке кондиціоноване клітинами 293Т і містить гібридні білки, тестували на 96-ямкових мікротитраційних планшетах, сенсибілізованих очищеним антиDLL4-антитілом (YW26.82, 0,5 мкг/мл). Зв'язаний DLL4.AP детектували з використанням 1-Step PNPP (Pierce) як субстрату і вимірювали оптичну густину (OD) на 405 нм. b-d: Селективне зв'язування YW26.82 з DLL4. 96-ямкові планшети Nunc MaxiSorp™ покривали очищеними рекомбінантними білками, як вказано вище (1 мкг/мл). Зв'язування YW26.82 у вказаних концентраціях вимірювали за допомогою ELISA-аналізу. Зв'язані антитіла детектували за допомогою кон'югату «антилюдське антитіло - ПХ» з використанням ТМВ як субстрату і вимірювали оптичну густину (OD) на 405 нм. Як аналітичний контроль використовували анти-HER 2-антитіло й рекомбінантний ErbB2-ECD (b). FACS-аналіз клітин 293, тимчасово трансфікованих вектором, повнорозмірним DLL4, Jag1 або 25 DLL1. Значний рівень зв'язування YW26.82 детектувався тільки на DLL4-транефікованих клітинах (верхня панель). Експресію Jag1 і DLL1 підтверджували шляхом зв'язування рекомбінантного щурячого Notch 1-Fc (rrNotch1-Fc, середня панель) і рекомбінантного щурячого Notch2-Fc (rrNotch2-Fc, нижня панель), відповідно. YW26.82, rrNotch1-Fc або rrNotch2-Fc (систему R& D) використовували в концентрації 2 мкг/мл, потім використовували козяче антитіло проти людського IgG, кон'юговане з ФЕ (1:500, Jackson ImmunoResearch) (c). АнтиDLL4-антитіло блокувало зв'язування DLL4-AP, але не DLL1-АР, з нанесеним rNotch1, при обчисленій ІС50 ~12 нМ (ліва панель). Анти-DLL4aнтитілo блокувало зв'язування DLL4-His, але не Jag1-His, з нанесеним rNotchl, при обчисленій ІС50 ~8 нм (права панель) (d). e: Специфічне зв'язування YW26.82 з ендогенно експресованим DLL4. FACS-аналіз HUVEC, трансфікованим контрольною або DLL4-cпецифічно кіРНК. YW26.82 використовували при 2 мкг/мл, потім використовували козяче антитіло проти людського IgG, кон'юговане з ФЕ (1:500, Jackson ImmunoResearch) (е). Фігура 12: Позитивна регуляція DLL4 за допомогою активації Notch. HUVEC стимулювали іммобілізованим С-кінцевим His-міченим людським DLL4 (амінокислоти 1-404) за відсутності або в присутності DBZ (0,08 мкМ). Через 36 годин після стимуляції, ендогенну експресію DLL4 оцінювали за допомогою FACS-аналізу, проведеного з використанням анти-DLL4-антитіла. Даний винахід належить до анти-DLL4-антитіл, які можуть бути використані, наприклад, для лікування або попередження патологічних станів, асоційованих з експресією і/або активністю DLL4, наприклад, з підвищеною експресією і/або активністю або з небажаною і/або активністю DLL4. У деяких варіантах винаходу, антитіла відповідно до винаходу використовуються для лікування пухлини, раку і/або клітиннопроліферативного розладу. У деяких варіантах винаходу, антитіла відповідно до винаходу використовуються для лікування патологічного стану, асоційованого з ангіогенезом. В іншому аспекті винаходу, aнти-DLL4антитіла відповідно до винаходу можуть бути використані як реагенти для детектування і/або виділення DLL4, наприклад, для детектування DLL4 у тканинах і клітинах різних типів. Даний винахід також належить до способів одержання анти-DLL4-антитіл і полінуклеотидів, які кодують анти-DLL4-антитіла. Загальні методи Описані або цитовані тут методи й процедури, по суті, добре відомі фахівцям і звичайно застосовуються відповідно до стандартної методики, відомої фахівцям, наприклад, із широко застосовуваною методикою, описаної в керівництвах Sambrook et al., Molecular Cloning: A Laboratory Manual 3rd. edition (2001) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. CURRENT PROTOCOLS IN MOLECULAR BIOLOGY (F. M. Ausubel, et al. eds., (2003)); the series METHODS IN ENZYMOLOGY (Academic Press, Inc.): PCR 2: A PRACTICAL APPROACH (M. 94464 26 J. MacPherson, B. D. Hames і G. R. Taylor eds. (1995)), Harlow and Lane, eds. (1988) ANTIBODIES, A LABORATORY MANUAL, and ANIMAL CELL CULTURE (R. I. Freshney, ed. (1987)). Визначення "Виділене" антитіло являє собою антитіло, яке було ідентифіковане й відділене від компонентів його природного оточення і/або виділене з таких компонентів. Домішковими компонентами його природного оточення є речовини, які можуть негативно впливати на діагностичне або терапевтичне застосування вказаного антитіла, і такими речовинами можуть бути ферменти, гормони й інші білкові або не-білкові розчинені речовини. У переважних варіантах винаходу, вказане антитіло може бути очищене (1) більш ніж на 95% по масі антитіла, як може бути визначено методом Лаурі, найбільш переважно, більш ніж на 99% по масі антитіла, (2) до рівня, достатнього для продукування Nкінцевої або внутрішньої амінокислотної послідовності, що складається щонайменше з 15 залишків, з використанням секвенатора із центрифугальними чашками, або (3) до гомогенності, оцінюваної за допомогою електрофорезу в ПААГ-ДСН у відновлювальних або в невідновлювальних умовах, з використанням кумассі синього, або, переважно, срібного барвника. Виділеним антитілом є антитіло in situ у рекомбінантних клітинах, оскільки в них відсутній щонайменше один компонент природного оточення цього антитіла. Аналогічним чином, виділеним антитілом є антитіло в середовищі, що оточує рекомбінантні клітини. Однак, звичайно, виділене антитіло може бути отримане щонайменше в одну стадію очищення. «Виділена» молекула нуклеїнової кислоти являє собою молекулу нуклеїнової кислоти, яка була ідентифікована й відділена щонайменше від однієї домішкової молекули нуклеїнової кислоти, з якою вона звичайно асоціюється в природному джерелі нуклеїнової кислоти, яка кодує антитіло. Виділена молекула нуклеїнової кислоти має форму або структуру, що відрізняються від форми або структури природної молекули. Отже, виділені молекули нуклеїнової кислоти відрізняються від молекул нуклеїнової кислоти, які присутні у природних клітинах. Однак, виділена молекула нуклеїнової кислоти включає молекулу нуклеїнової кислоти, яка міститься в клітинах, які звичайно експресують антитіло, де, наприклад, молекула нуклеїнової кислоти присутня в хромосомі в положенні, що відрізняється від положення цієї нуклеїнової кислоти в природних клітинах. Використовуваний тут термін "залишок варіабельного домену, пронумерований по Кебату" або "амінокислотне положення, пронумероване по Кебату" і їхні варіанти означає систему, використовувану для нумерації варіабельних доменів важкого ланцюга або варіабельних доменів легкого ланцюга антитіл, описаної в довіднику по антитілах Кебата (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed., Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Відповідно до цієї системи нумерації, фактична первинна амінокислотна послідовність може містити менше число або додаткове число аміно 27 кислот, що відповідає вкороченій або подовженій FR- або CDR-області варіабельного домену. Так, наприклад, варіабельний домен важкого ланцюга може включати інсерцію однієї амінокислоти (залишку 52а відповідно до нумерації Кебата) після залишку 52 Н2, і залишки (наприклад, залишки 82а, 82b і 82с і т.п., відповідно до нумерації Кебата), вбудовані після залишку 82 FR важкого ланцюга. Нумерація залишків даного антитіла по Кебату може бути здійснена після вирівнювання його послідовності в областях гомології зі "стандартною" послідовністю, пронумерованою по Кебату. Використовувані тут терміни "по суті, аналогічний" або "по суті, той же самий" означають достатньо високий ступінь подібності між двома чисельними величинами (звичайно, між одною величиною, що відповідає антитілу відповідно до винаходу, і іншою величиною, що відповідає еталонному/порівнюваному антитілу), саме, такий ступінь подібності, що дозволяв би фахівцеві в даній галузі вважати розходження між цими двома величинами несуттєвим або біологічно і/або статистично незначними відносно їх біологічних властивостей, зумовлених вказаними величинами (наприклад, величинами Kd). Розходження між вказаними двома величинами становить, переважно, менше ніж приблизно 50%, більш переважно, менше ніж приблизно 40%, ще більш переважно, менше ніж приблизно 30%, ще більш переважно, менше ніж приблизно 20%, найбільш переважно, менше ніж приблизно 10% у порівнянні з величинами еталонного/порівнюваного антитіла. Термін "афінність зв'язування", по суті, означає силу сумарних нековалентних взаємодій одного сайту зв'язування молекули (наприклад, антитіла) з його партнером по зв'язуванню (наприклад, з антигеном). Якщо це не обговорено особливо, то використовуваний тут термін "афінність зв'язування" означає природну афінність зв'язування, при якій відбувається взаємодія 1:1 між членами пар зв'язування (наприклад, антитіла з антигеном). Афінність зв'язування молекули X з її партнером Y, в загальних рисах, може називатися константою дисоціації (Kd). Афінність може бути визначена стандартними методами, відомими фахівцям, включаючи описані тут методи. Низькоафінні антитіла звичайно зв'язуються з антигеном з меншою швидкістю й мають тенденцію легко дисоціюватися, тоді як високоафінні антитіла звичайно зв'язуються з антигеном з більшою швидкістю й мають тенденцію залишатися зв'язаними протягом більш тривалого періоду часу. Фахівцям у даній галузі відомі різні методи вимірювання афінності зв'язування, і для здійснення даного винаходу може бути застосований будь-який із цих методів. Конкретні репрезентативні варіанти здійснення винаходи описані нижче. В одному з варіантів винаходу, "Kd" або "величину Kd" відповідно до винаходу визначають за допомогою аналізу на зв'язування з радіоактивно міченим антигеном (РІА), здійснюваного з використанням Fab-варіанта антитіла, що представляє інтерес, і його антигену, описаного нижче, де вказаний аналіз дозволяє вимірювати афінність зв'язування Fab з антигеном у розчині шляхом врівно 94464 28 125 важування Fab мінімальною концентрацією Iміченого антигену в присутності титраційного набору немічених антигенів, з наступною іммобілізацією зв'язаного антигену на планшеті, сенсибілізованому антитілом проти Fab-фрагмента (Chen et al. (1999) J. Моl. Biol. 293:865-881). З метою створення відповідних умов для аналізу, мікротитрапійні планшети (Dynex) сенсибілізують протягом ночі 5 мкг/мл зв'язувального анти-Fab-антитіла (Cappel Labs) в 50 мМ карбонаті натрію (рН 9,6), потім блокують 2%-ним (мас/об.) альбумін бичачої сироватки в PBS протягом 2-5 годин при кімнатній температурі (приблизно при 23 °С). У неадсорбуючому планшеті (Nunc # 269620), 100 пМ 125 або 26 пМ І-антигену змішують із серійними розведеннями Fab, що представляє інтерес (наприклад, відповідно до оцінки анти-VЕGР-антитіла, Fab-12, Presta et al. (1997) Cancer Res. 57:45934599). Потім Fab, що представляє інтерес, інкубують протягом ночі, однак, для гарантії досягнення рівноваги, інкубування може бути проведене протягом більше тривалого періоду часу (наприклад, 65 годин). Після цього суміші переносять у планшет для іммобілізації й інкубують при кімнатній температурі (наприклад, протягом однієї години). Потім розчин видаляють і планшет вісім разів промивають 0,1% Твіном-20 в PBS. Після сушіння планшетів додають 150 мкл/ямку сцинтиляційної рідини (MicroScint™-20; Packard), і планшети підраховують на гамма-лічильнику Topcount (Packard) протягом десяти хвилин. Концентрації кожного Fab, які становлять 20% або менше від максимального зв'язування, відбирають для їхнього використання в аналізах на конкурентне зв'язування. Відповідно до іншого варіанта винаходу, Kd або величину Kd вимірюють в аналізі методом поверхневого плазмонного резонансу з використанням Віасоrе™-2000 або BIAcore™-3000 (BIAcore, Inc., Piscataway, NJ) при 25°С с використанням чипів СМ5 з іммобілізованим на них антигеном при величині одиниць відгуку (RU), що становить ~10. Коротко, біосенсорні чіпи з карбоксиметильованим декстраном (СМ5, BIAcore Inc.) активують гідрохлоридом N-етил-N'-(3диметиламінопропіл)карбодііміду (EDC) і Nгідроксисукцинімідом (NHS) відповідно до інструкцій постачальників. Антиген розводять 10 мМ ацетатом натрію, рН 4,8, до 5 мкг/мл (~0,2 мкМ), потім ін'єктують при швидкості потоку 5 мкл/хвилину до досягнення величини одиниць відгуку (RU) зв'язаного білка, що становить ~10. Після ін'єкції антигену, для блокування непрореагувавших груп уводять 1М етаноламін. Для вимірювання кінетики реакції вводять ін'єкції дворазових серійних розведень Fab (0,78 нМ-500 нМ) в PBS, що містить 0,05% твіну® 20 (PBST) при 25°С і при швидкості потоку приблизно 25 мкл/хв. Швидкість асоціації (kon) і швидкість дисоціації (koff) обчислюють із використанням простої лангмюрівської моделі зв'язування 1:1 (BIAcore Evaluation Software version 3.2) при одночасній побудові сенсорограм асоціації й дисоціації. Константу рівноважної дисоціації (Kd) обчислюють як відношення koff/kon. Див., наприклад, Chen, Y., et al. (1999) J. Моl. Biol. 293:8656 -1 881. Якщо швидкість асоціації перевищує 10 Μ · 29 -1 с , як було визначено вище методом поверхневого плазмонного резонансу, то така швидкість асоціації може бути визначена методом гасіння флуоресценції, що дозволяє вимірювати збільшення або зменшення інтенсивності флуоресцентного випромінювання (збудження = 295 нм; випромінювання = 340 нм, смуга пропускання 16 нм) при 25°С для 20 нМ антитіла проти антигену (в Fabформі) в PBS, рН 7,2, у присутності зростаючих концентрацій антигену, як було виміряно на спектрометрі, такому як спектрофотометр, оснащений обмежником потоку (Aviv Instrumtnts), або на спектрофотометрі SLM-Aminco серії 8000 (ThermoSpectronic), оснащеному кюветою для перемішування, що містить червоний барвник. "Швидкість асоціації" або "kon" відповідно до винаходу може бути також визначена описаним вище методом поверхневого плазмонного резонансу з використанням Віасоrе™-2000 або BIAcore™-3000 (BIAcore, Inc., Piscataway, NJ) при 25°С і з використанням чипів СМ5 з іммобілізованим на них антигеном при величині одиниць відгуку (R.U), що становить ~10. Коротко, біосенсорні чіпи з карбоксиметильованим декстраном (СМ5, BIAcore Inc.) активують гідрохлоридом N-етил-N'(3-диметиламінопропілл)карбодііміду (EDC) і Nгідроксисукцинімідом (NHS) відповідно до інструкцій постачальників. Антиген розводять 10 мМ ацетатом натрію, рН 4;8, до 5 мкг/мл (~0,2 мкМ) потім ін'єктують при швидкості потоку 5 мкл/хвилину до досягнення величини одиниць відгуку (RU) зв'язаного білка, що становить ~10. Після ін'єкції антигену, для блокування непрореагувавших груп уводять 1М етаноламін. Для вимірювання кінетики реакції ін'єктують дворазові серійні розведення Fab (0,78 нМ-500 нМ) в PBS, що містить 0,05% твіну® 20 (PBST) при 25°С і при швидкості потоку приблизно 25 мкл/хв. Швидкість асоціації (kon) і швидкості дисоціації (koff) обчислюють із використанням простої лангмюрівської моделі зв'язування 1:1 (BIAcore Evaluation Software version 3.2) при одночасній побудові сенсорограм асоціації й дисоціації. Константу рівноважної дисоціації (Kd) обчислюють як відношення koff/kon. Див., наприклад, Chen, Y., et al. (1999) J. Моl. Biol. 293:865881. Однак, якщо швидкість асоціації перевищує 6 -1 -1 10 М ·с , як було визначено вище за допомогою аналізу методом поверхневого плазмонного резонансу, то таку швидкість асоціації переважно визначають методом гасіння флуоресценції, що дозволяє вимірювати збільшення або зменшення інтенсивності флуоресцентного випромінювання (збудження = 295 нм; випромінювання = 340 нм, смуга пропускання 16 нм) при 25°С для 20 нМ антитіла проти антигену (в Fab-формі) в PBS, рН 7,2, у присутності зростаючих концентрацій антигену, які вимірюються на спектрометрі, такому як спектрофотометр, оснащений обмежником потоку (Aviv Instrumetnts), або на спектрофотометрі SLMAminco серії 8000 (ThermoSpectronic), оснащеному кюветою для перемішування. Використовуваний тут термін "вектор" означає молекулу нуклеїнової кислоти, здатну переносити іншу нуклеїнову кислоту, до якої вона приєднана. Одним типом векторів є "плазміда", що представ 94464 30 ляє собою кільцеву дволанцюжкову ДНК-петлю, з якої можуть бути ліговані додаткові ДНК-сегменти. Іншим типом вектора є фаговий вектор. Ще одним типом вектора є вірусний вектор, у якому додаткові ДНК-сегменти можуть бути ліговані з вірусним геномом. Деякі вектори здатні автономно реплікуватися в клітині-хазяїні, у яку вони були уведені (наприклад, бактеріальні вектори, що мають бактеріальний оріджин реплікації, і епісомні вектори ссавців). Інші вектори (наприклад, не-епісомні вектори ссавців) можуть інтегруватися в геном клітини-хазяя після їхнього введення в вказану клітинухазяя, у результаті чого вони можуть реплікуватися разом з геномом хазяя. Крім того, деякі вектори здатні регулювати- експресію - генів, до яких вони були функціонально приєднані. Такі вектори називаються тут "рекомбінантними експресійними векторами" (або просто "рекомбінантними векторами"). В загальних рисах, експресійні вектори, звичайно застосовувані в методах рекомбінантних ДНК, часто мають форму плазмід. У даному описі, терміни "плазміда" і "вектор" можуть бути взаємозамінними, оскільки плазміда є найпоширенішою формою вектора. Використовувані тут терміни "полінуклеотид" або "нуклеїнова кислота" є взаємозамінними й означають полімери будь-якої довжини, що складаються з нуклеотидів, і такими полімерами є ДНК і РНК. Нуклеотидами можуть бути дезоксирибонуклеотиди, рибонуклеотиди, модифіковані нуклеотиди або основи і/або їхні аналоги, або будь-який субстрат, що може бути включений у полімер за допомогою ДНК- або РНК-полімерази, або за допомогою реакції синтезу. Полінуклеотид може містити модифіковані нуклеотиди, такі як метильовані нуклеотиди і їхні аналоги. Якщо це необхідно, то модифікація нуклеотидної структури може бути здійснена до або після сборки полімеру. Нуклеотидні послідовності можуть перериватися ненуклеотидними компонентами. Полінуклеотид може бути додатково модифікований після синтезу, наприклад, шляхом його кон'юговання з міткою. Модифікаціями інших типів є, наприклад, "кепи"; заміна одного або декількох природних нуклеотидів їхніми аналогами;міжнуклеотидні модифікації, такі як, наприклад, модифікації шляхом введення незаряджених зв'язків (наприклад, метилфосфонатів, фосфотриефірів, фосфоамідатів, карбаматів і т.п.) і заряджених зв'язків (наприклад, фосфортіоатів, фосфордитіоатів і т.п.); модифікації, що містять бічні групи, такі як, наприклад, білки (наприклад, нуклеази, токсини, антитіла, сигнальні пептиди, полі-L-лізин, і т.п.); модифікації, що містять інтеркалюючі агенти (наприклад, акридин, псорален і т.п.); модифікації, що містять хелатоутворювальні агенти (наприклад, метали, радіоактивні метали, бор, метали-окислювачі й т.п.); модифікації, що містять алкілуючі агенти; модифікації, що містять модифіковані зв'язки (наприклад, альфа-аномерні нуклеїнові кислоти й т.п.), також немодифіковані форми полінуклеотиду(ів). Крім того, будь-які гідроксильні групи, звичайно присутні в цукрах, можуть бути замінені, наприклад, фосфонатними групами й фосфатними групами; захищені стандартними захисними групами; або активо 31 вані з утворенням додаткових зв'язків з додатковими нуклеотидами; або вони можуть бути кон'юговані із твердими або напівтвердими носіями. 5'- і 3'-кінцеві ОН можуть бути фосфорильовані або заміщені амінами або органічними "кепуючими" групами, які складаються з 1-20 атомів вуглецю. Інші гідроксили можуть бути також дериватизировані стандартними захисними групами. Полінуклеотиди можуть також містити аналогічні форми цукрів, таких як рибоза або дезоксирибоза, відомих фахівцям, включаючи, наприклад, 2'-метилрибозу-2'-О-алілрибозу; 2'-фторабо 2'азидорибозу; карбоциклічні аналоги цукрів; альфааномерні цукри; епімерні цукри, такі як арабіноза, ксилоза або ліксоза; цукор піранозу, цукор фуранозу; седогептулозу; ациклічні аналоги й основні нуклеозилні аналоги, такі як метилрибозид. Один або декілька фосфодіефірних зв'язків можуть бути замінені альтернативними лінкерними групами. Такими альтернативними лінкерними групами є, але не обмежуються ними, варіанти, у яких фосфат замінений P(O)S ("тіоат"), P(S)S ("дитіоат"), (O)NR2 ("амідат"), P(O)R, P(O)OR', С або СН2 ("формацеталь"), де кожний з R або R' незалежно являє собою Η або заміщений або незаміщений алкіл (С1-20), який необов'язково містить ефірний зв'язок (-О-), арил, алкеніл, циклоалкіл, циклоалкеніл або аралдил. Не всі зв'язки в полінуклеотиді повинні бути ідентичними. Вищенаведений опис належить до всіх використовуваних тут полінуклеотидів, включаючи РНК і ДНК. Використовуваний тут термін "олігонуклеотид", в загальних рисах, означає короткі, в основному, одноланцюжкові, звичайно синтетичні полінуклеотиди, довжина яких становить, головним чином, але необов'язково, менше ніж приблизно 200 нуклеотидів. Терміни "олігонуклеотид" і "полінуклеотид" не є взаємовиключними. Вищенаведений опис полінуклеотидів може однаково й повністю належати до олігонуклеотидів. "Відсоток (%) ідентичності амінокислотних послідовностей" пептидів або поліпептидів визначають як відсоток амінокислотних залишків у послідовності-кандидаті, які ідентичні амінокислотним залишкам у конкретній пептидній або поліпептидній послідовності, після вирівнювання цих послідовностей і введення в них "пробілів", якщо це необхідно, для досягнення максимального відсотка ідентичності послідовностей, причому які-небудь консервативні заміни не розглядаються як частина ідентичних послідовностей. Вирівнювання, здійснюване з метою визначення відсотка ідентичності амінокислотних послідовностей, може бути проведене різними методами, відомими фахівцям, наприклад, з використанням загальнодоступних комп'ютерних програм, таких як програми BLAST, BLAST-2, ALIGN або MegAlign (DNASTAR). Фахівець у даній галузі може самостійно визначити відповідні параметри вирівнювання, включаючи використання будь-яких алгоритмів, необхідних для досягнення оптимального вирівнювання по всій довжині порівнюваних послідовностей. Однак, в цілях даного винаходу, % ідентичності амінокислотних послідовностей обчислюють із застосуванням комп'ютерних програм ALIGN-2, використову 94464 32 ваної для порівняння послідовностей. Комп'ютерна програма ALIGN-2, призначена для порівняння послідовностей, була розроблена фірмою Genentech, Inc. і вказаний вихідний код був зареєстрований у документації для користувачів у Відомстві по копірайту США, Вашингтон, D.C., 20559, під реєстраційним номером U.S. Copyright Registration № TXU510087. Програма ALIGN-2 є загальнодоступною програмою, що поставляється фірмою Genentech, Inc., South San Francisco, California. Програма ALIGN-2 повинна бути складена для застосування в операційній системі UNIX, переважно, у цифровій системі UNIX V4.0D. Всі параметри порівняння послідовностей були встановлені в програмі ALIGN-2 і не змінювалися. У випадку, якщо для порівняння амінокислотних послідовностей використовується програма ALIGN-2, то % ідентичності даної амінокислотної послідовності А з даною амінокислотною послідовністю В (яка альтернативно може бути названа даною амінокислотною послідовністю А, що має або становить певний % ідентичності з даною амінокислотною послідовністю В) обчислюють наступним чином: 100·X/Y, де X являє собою число амінокислотних залишків, які були оцінені як повністю відповідні при вирівнюванні послідовностей з використанням програми ALIGN-2, за допомогою якої проводили порівняння послідовностей А і В, і де Υ являє собою повне число амінокислотних залишків у послідовності В. При цьому, слід зазначити, що якщо довжина амінокислотної послідовності А не дорівнює довжині амінокислотної послідовності В, то % ідентичності амінокислотної послідовності А амінокислотної послідовності В не дорівнює % ідентичності амінокислотної послідовності В амінокислотної послідовності А. Якщо це не обговорено особливо, то загальний % ідентичності використовуваних тут амінокислотних послідовностей обчислювали як описані в попередньому параграфі з використанням комп'ютерної програми ALIGN-2. Використовуваний тут термін «DLL4» (який є синонімом терміну «дельта-подібний 4"), означає, якщо це не обговорено особливо або не виходить з контексту винаходу, будь-який нативний або модифікований (природний або синтетичний) поліпептид DLL4. Термін «нативна послідовність», зокрема, охоплює природні зрізані або секретовані форми (наприклад, послідовність позаклітинного домена), природні варіанти (наприклад, альтернативно сплайсовані форми) і природні алельні варіанти. Термін «DLL4 дикого типу», в основному, означає поліпептид, що містить амінокислотну послідовність природного білка DLL4. Термін «послідовність DLL4 дикого типу", в основному, означає амінокислотну послідовність, яка присутня у природному DLL4. Використовуваний тут термін «рецептор Notch» (який є синонімом терміну «Notch»), означає, якщо це не обговорено особливо або не виходить з контексту винаходу, будь-який нативний або модифікований (природний або синтетичний) поліпептид рецептора Notch. У людини присутній 33 чотири рецептори Notch (Notch 1, Notch2, Notch3 i Notch4). Використовуваний тут термін «рецептор Notch» включає будь-який один або всі чотири людських рецептори Notch. Термін «нативна послідовність», зокрема, охоплює природні зрізані або секретовані форми (наприклад, послідовність позаклітинного домена), природні варіанти (наприклад, альтернативно сплайсовані форми) і природні алельні варіанти. Термін «рецептор Notch дикого типу», в основному, означає поліпептид, що містить амінокислотну послідовність природного білка рецептора Notch. Термін «послідовність рецептора Notch дикого типу", в основному, означає амінокислотну послідовність, яка присутня у природному рецепторі Notch. Використовувані тут терміни «антитіло» і «імуноглобулін» є синонімами, вживаними в найширшому змісті, і включають моноклональні антитіла (наприклад, повнорозмірні або інтактні моноклональні антитіла), поліклональні антитіла, полівалентні антитіла, мультиспецифічні антитіла (наприклад, біспецифічні антитіла, за умови, що вони мають потрібну біологічну активність), також можуть включати деякі фрагменти антитіл (більш докладно описані нижче). Антитіло може бути людським, гуманізованим і/або афінно зрілим. Термін "варіабельний" належить до деяких частин варіабельних доменів, які мають значні відмінності в послідовностях різних антитіл і беруть участь у зв'язуванні кожного конкретного антитіла з його конкретним антигеном, також визначають специфічність кожного конкретного антитіла стосовно його конкретного антигену. Однак, варіабельність нерівномірно розподіляється по всіх варіабельних доменах антитіл. Вона концентрується в трьох сегментах, які називаються комплементарність-визначаючими областями (CDR) або гіперваріабельними областями (HVR), присутніми у варіабельних доменах як легкого, так і важкого ланцюга. Найбільш висококонсервативні частини варіабельних доменів називаються каркасними областями (FR). Кожний варіабельний домен нативного важкого й легкого ланцюгів містить чотири FR, що мають, головним чином, β-складчасту конфігурацію й з'єднані трьома CDR, які утворюють петлі, що з'єднують, у деяких випадках, що утворюють частину β-складчастої структури. Гіперваріабельні області (CDR) у кожному ланцюзі втримуються в безпосередній близькості одна від одної за допомогою FR, і, разом CDR іншого ланцюга, беруть участь в утворенні антигензв'язувального сайту антитіл (див. Kabat et al. Sequences of Proteins of Immunological Interest, Fifth Edition, National Institutes of Health, Bethesda, MD (1991)). Константні домени не беруть особистої участі у зв'язуванні антитіла з антигеном, але мають різні ефекторні функції, такі як участь антитіла в антитіло-залежній клітинній цитотоксичності. Гідроліз антитіл папаїном приводить до продукування двох ідентичних антиген-зв'язувальних фрагментів, які називаються "Fab''-фрагментами, кожний з яких має один антигензв'язувальний сайт, і іншого Fc-фрагмента, позначення якого вказує на його здатність до швидкої кристалізації. Обробка пепсином приводить до утворення 94464 34 Р(аb')2-фрагменту, що має два антигензв'язувальних сайти й має здатність перехресно зв'язуватися з антигеном. «Δν» являє собою мінімальний фрагмент антитіла, що містить повнорозмірний сайт розпізнавання антигену й антигензв'язувальний сайт антитіла. У дволанцюжковому Fv, ця область складається з димера, що включає один варіабельний домен важкого ланцюга й один варіабельний домен легкого ланцюга, жорстко зв'язані нековалентним зв'язком. В одноланцюжковому Fv, один варіабельний домен важкого ланцюга й один варіабельний домен легкого ланцюга може бути ковалентно зв'язаний гнучким пептидним лінкером, у результаті чого, легкий й важкий ланцюги можуть асоціюватися один з одним з утворенням «димерної» структури, аналогічної структурі дволанцюжкового Fv. Він має таку конфігурацію, при якій три CDR кожного варіабельного домену взаємодіють один з одним і визначають антигензв'язувальний сайт на поверхні димера VH-VL. У цілому, шість CDR надають даному антитілу антигензв'язувальної специфічності. Однак, навіть один варіабельний домен (або половина Fv, що містить тільки три CDR, специфічних до антигену) може мати здатність розпізнавати антиген і зв'язуватися із цим антигеном, хоча, можливо, з більш низькою афінністю, ніж повний сайт зв'язування. Fab-фрагмент також містить константний домен легкого ланцюга й перший константний домен (СН1) важкого ланцюга. Fаb'-фрагменти відрізняються від Fab-фрагментів декількома залишками, приєднаними в карбокси-кінця домена СН1 важкого ланцюга, включаючи один або декілька цистеїнів від шарнірної області антитіла. Fab'-SH являє собою Fab', у якому цистеїновий(і) залишок(шки) константних доменів мають вільну ті олову групу. По своїй природі, F(ab')2-фрагменти антитіла продукуються як пари Fab'-фрагментів, які зв'язані між собою шарнірними цистеїновими залишками. Відомі також і інші хімічні зв'язки фрагментів антитіл. «Легкі ланцюги» антитіл (імуноглобулінів), що походять від хребетних будь-якого виду, можуть бути віднесені до одного із двох абсолютно різних типів ланцюгів, які називаються каппа () і лямбда (), виходячи з амінокислотних послідовностей їх константних доменів. Імуноглобуліни, залежно від амінокислотної послідовності константного домена їхніх важких ланцюгів, можуть бути віднесені до різних класів. Існує п'ять основних класів імуноглобулінів: IgA, IgD, IgE, IgG i IgM, і деякі з них можуть бути також розділені на підкласи (ізотипи), наприклад, IgG1, IgG2, IgG3, IgG4, IgA1 і IgA2. Константні домени важкого ланцюга, які відповідають імуноглобулінам різних класів, позначаються , , , і , відповідно. Субодиничні структури й тривимірні конфігурації імуноглобулінів різних класів добре відомі фахівцям. «Фрагменти антитіл» містять тільки частину інтактного антитіла, де вказана частина, якщо вона присутня в інтактному антитілі, переважно, зберігає щонайменше одну функцію, переважно, більшість функцій або всі функції, звичайно властиві такій частині природного інтактного антитіла. При 35 94464 кладами фрагментів антитіл є Fab-, Fab'-, F(ab')2- і Fv-фрагменти; діантитіла; лінійні антитіла; молекули одноланцюжкових антитіл; і мультиспецифічні антитіла, утворені із фрагментів антитіл. В одному з варіантів винаходу, фрагмент антитіла містить антигензв'язу вальний сайт інтактного антитіла, тому він зберігає свою здатність зв'язуватися з антигеном. В іншому варіанті винаходу, фрагмент антитіла, наприклад, фрагмент, що містить Fc-область, якщо він присутній в інтактному антитілі, зберігає щонайменше одну з біологічних функцій, звичайно властивих Fc-області інтактного антитіла, таких як зв'язування з FcRn, здатність модулювати час напівжиття антитіла, ADCCфункція й зв'язування з комплементом. В одному з варіантів винаходу, фрагментом антитіла є одновалентне антитіло, що має час напівжиття in vivo, в основному, аналогічний часу напівжиття інтактного антитіла. Так, наприклад, такий фрагмент антитіла може містити антигензв'язувальну область, приєднану до послідовності Fc і здатну надавати вказаному фрагменту стабільності in vivo. Використовувані тут терміни "гіперваріабельна область", "HVR" або "HV" означають області варіабельного домену антитіла, які є в даній послідовності гіперваріабельними і/або утворюють петлі Петля По Кебату L1 L24-L34 L2 L50-L56 L3 L89-L97 Н1 Н31-Н35В (Нумерація по Кебату) Н1 Н31-Н35 (Нумерація по Чотія) Н2 Н50-Н65 Н3 Н95-Н102 36 певної структури. В загальних рисах, вказані антитіла містять шість гіперваріабельних областей; три області в VH (Н1, Н2, Н3) і три області в VL (L1, L2, L3). У даній заявці використовується ряд гіперваріабельних областей, що входить в об'єм даного винаходу. Гіперваріабельні області (комплементарність-визначаючі області (CDR)) по Кебату мають високий ступінь варіабельності послідовності й знаходять найбільш часте застосування (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed., Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Замість визначення гіперваріабельних областей по Кебату, Чотія запропонував визначати гіперваріабельні області по локалізації структурних петель (Chothia & Lesk, J. Mol.Biol. 196:901-917 (1987)). Визначення гіперваріабельних областей АbМ являє собою компроміс між "CDR" по Кебату й "структурними петлями" по Чотія, і такі визначення використовуються в комп'ютерній програмі по моделюванню антитіл Oxford Molecular's AbM. "Контактні" гіперваріабельні області визначають виходячи з аналізу наявних складних кристалічних структур. Залишки кожної із цих гіперваріабельних областей приводяться нижче. АbМ L24-L34 L50-L56 L89-L97 Н26-Н35В По Чотія L26-L32 L50-L52 L91-L96 Η 26-Η32 Контактні області L30-L36 L46-L55 L89-L96 Н30-Н35В Н26-Н35 Η26-Η32 Н30-Н35 Н50-Н58 Н95-Н102 Н53-Н55 Н96-Н101 Н47-Н58 Н93-Н101 Термін "гіперваріабельні області" може включати "подовжені гіперваріабельні області", а саме: 24-36 або 24-34 (L1), 46-56 або 50-56 (L2) і 89-97 (L3) в VL; і 26-35 (Н1), 50-65 або 49-65 (Н2) і 93102, 94-102 або 95-102 (Н3) в VH. Залишки варіабельних доменів для кожного із вказаних визначень пронумеровані по Кебату й ін., див. вище. "Каркасними" або "FR" залишками є залишки варіабельних доменів, за винятком залишків гіперваріабельних областей, визначених вище. Використовуваний тут термін «моноклональне антитіло» означає антитіло, яке походить від популяції, в основному, гомогенних антитіл, тобто окремі антитіла, що входять у таку популяцію, є ідентичними і/або зв'язуються з тим самим (тими самими) епітопом(ами), за винятком можливих варіантів, які можуть утворюватися в процесі продукування моноклонального антитіла, де вказані варіанти, в основному, присутні в незначних кількостях. Таким моноклональним антитілом звичайно є антитіло, що містить поліпептидну послідовність, яка зв'язується з мішенню, де вказану поліпептидну послідовність, що зв'язується з мішенню, одержують способом, що включає відбір однієї поліпептидної послідовності, що зв'язується з мішенню, з множини поліпептидних послідовностей. Так, наприклад, такий спосіб відбору може являти собою відбір унікального клону з множини клонів, таких як пул гібридомних клонів, фагових клонів або рекомбінантних ДНК-клонів. При цьому, слід зазначити, що вибрана послідовність, що зв'язується з мішенню, може бути також модифікована, наприклад, для підвищення афінності до мішені, для гуманізації послідовності, що зв'язується з мішенню, для поліпшення її продукування в клітинній культурі, для зниження її імуногенності in vivo, для створення мультиспецифічного антитіла й т.п., і що вказане антитіло, яке містить модифіковану мішень-зв'язувальну послідовність, також являє собою моноклональне антитіло відповідно до винаходу. На відміну від препаратів поліклональних антитіл, якими звичайно є різні антитіла, спрямовані проти різних детермінант (епітопів), кожне моноклональне антитіло в препараті моноклональних антитіл спрямоване проти однієї детермінанти на антигені. Препарати моноклональних антитіл, крім їхньої специфічності, мають і інші переваги, тобто вони звичайно не містять інших домішкових імуноглобулінів. Термін «моноклональний» визначає характер антитіла, отриманого, в основному, з гомогенної популяції антитіл, але не означає, що це антитіло повинне бути продуковане яким-небудь конкретним методом. Так, наприклад, моноклональні антитіла, використовувані 37 відповідно до даного винаходу, можуть бути отримані різними методами, включаючи, наприклад, гібридомний метод (наприклад, Kohler et al., Nature, 256:495 (1975); Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563681, (Elsevier, N.Y., 1981)), методи рекомбінантних ДНК (див., наприклад, патент США № 4816567), технології фагового представлення (див., наприклад, Clackson et al., Nature, 352:624-628 (1991); Marks et al., J. Моl. Biol, 222:581-597 (1991); Sidhu et al., J. Моl. Вiol. 338(2):299-310 (2004); Lee et al., J. Mol. Biol.340(5): 1073-1093 (2004); Fellouse, Proc. Nat. Acad. Sci. USA 101 (34): 12467-12472 (2004); і Lee et al. J. Immunol. Methods 284(1-2): 119-132 (2004), і методи продукування людських або гуманізованих антитіл у тварин, які мають частини або всі локуси людського імуноглобуліну або гени, що кодують послідовності людського імуноглобуліну (див., наприклад, WO 1998/24893; WO 1996/34096; WO 1996/33735; WO 1991/10741; Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggemann et al., Year in Immuno., 7:33 (1993); патенти США № 5545806; .5569.825; 5591669 „(усе від. GenPharm)i 5545807j WO 1997/17852; патента СЩА № 5545807; 5545806; 5569825; 5625126; 5633425 і 5661016; Marks et al., Bio/Technology, 10: 779-783 (1992); Lonberg et al., Nature, 368: 856-859 (1994); Morrison, Nature, 368: 812-813 (1994); Fishwild et al. Nature Biotechnology, 14: 845-851 (1996); Neuberger, Nature Biotechnology, 14: 826 (1996); and Lonberg and Huszar, Intern. Rev. Immunol, 13: 65-93 (1995). «Гуманізовані» форми не-людських антитіл (наприклад, мишачих антитіл) являють собою химерні антитіла, які містять мінімальну послідовність, що походить від не-людського імуноглобуліну. Здебільшого, гуманізовані антитіла являють собою людські імуноглобуліни (антитіло реципієнта), у яких залишки, що походять від гіперваріабельної області даного антитіла-реципієнта, замінені залишками, що походять від гіперваріабельної області не-людського антитіла (донорного антитіла), такого як мишаче антитіло, щуряче антитіло, кроляче антитіло або антитіло приматів, що не є людиною, де вказані антитіла мають потрібну специфічність, афінність і зв'язувальну здатність. У деяких випадках, залишки каркасної області (FR) людського імуноглобуліну замінені відповідними не-людськими залишками. Крім того, гуманізовані антитіла можуть містити залишки, не виявлені в антитілі реципієнта або в антитілі донора. Ці модифікації вводять для поліпшення властивостей антитіла. В загальних рисах, гуманізоване антитіло може містити, в основному, всі або щонайменше один, звичайно два варіабельних домени, у яких всі або майже всі гіперваріабельні петлі відповідають гіперваріабельним петлям не-людського імуноглобуліну, і всі або майже всі FR являють собою FR з послідовністю людського імуноглобуліну. Гуманізоване антитіло також містить, але необов'язково, щонайменше частину константної області імуноглобуліну (Fc), звичайно, області 94464 38 людського імуноглобуліну. Більш докладний опис див. в Jones et al. Nature, 321:522-525 (1986); Riechmann et al. Nature 332:323-329 (1998) і в Presta Curr. Op. Struct. Biol, 2:593-596 (1992). Див. також нижченаведені оглядові статті й цитовані там роботи: Vaswani and Hamilton, Ann. Allergy, Asthma & Immunol. 1:105-115 (1998); Harris, Biochem. Soc. Transactions 23:1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5:428-433 (1994). «Химерні антитіла» (імуноглобуліни) мають частину важкого і/або легкого ланцюга, ідентичного або гомологічного відповідним послідовностям антитіл, що походять від конкретного виду або належать до конкретного класу або підкласу, інший(і) ланцюг(и) ідентичний(і) або гомологічний(і) відповідним послідовностям антитіл, що походять від іншого виду або належать до іншого класу або підкласу антитіл, також від фрагментів таких антитіл, за умови, що вони мають потрібну біологічну активність (патент США № 4816567; і Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)). Використовуване тут гуманізоване антитіло являє собою підпослідовність химерних антитіл. «Одноланцюжковий Fv-фрагмент» або « scFvфрагмент» антитіл включає домени VH і VL антитіла, де вказані домени присутні в одному поліпептидному ланцюзі. Звичайно, поліпептид scFv також містить між доменами VH і VL поліпептидний лінкер, який забезпечує утворення scFv зі структурою, необхідною для зв'язування з антигеном. Опис scFv можна знайти в роботі Pluckthun «The Pharmacology of Monoclonal Antibodies», vol. 113, Rosenburg & Moore eds., Springer-Verlag, New York, pp.269-315 (1994). Термін «антиген» означає попередньо визначений антиген, з яким може селективно зв'язуватися антитіло. Антигеном-мішенню може бути поліпептид, вуглевод, нуклеїнова кислота, ліпід, гаптен або інша природна або синтетична сполука. Переважним антигеном-мішенню є поліпептид. Термін "діантитіла" означає невеликі фрагменти антитіл із двома антигензв'язувальними сайтами, де вказані фрагменти включають варіабельний домен важкого ланцюга (VH), з'єднаний з варіабельним доменом легкого ланцюга (VL) в одному і тому ж поліпептидному ланцюзі (VH-VL). Якщо лінкер є занадто коротким для утворення пари між двома доменами на одному і тому ж ланцюзі, то домени змушені спарюватися з комплементарними доменами іншого ланцюга й утворювати два антигензв'язувальних сайти. Діантитіла більш докладно описані, наприклад, в ЕР 404097; в WO 93/11161 і в Hollinger et al. Proc. Natl. Acad. Sci.,USA, 90:6444-6448 (1993). «Людське антитіло» являє собою антитіло, що має амінокислотну послідовність, яка відповідає амінокислотній послідовності антитіла, продукованого в людини і/або отриманого будь-якими описаними тут методами конструювання людських антитіл. Таке визначення людського антитіла, зокрема, виключає гуманізоване антитіло, що містить не-людські антигензв'язувальні залишки. «Афінно зріле» антитіло являє собою антитіло, що має одну або кілька модифікацій в одній 39 або декількох CDR, що дозволяє підвищувати афінність даного антитіла до антигену, у порівнянні з батьківським антитілом, що не має такої(их) модифікації(ій). Переважні афінно зрілі антитіла мають наномолярні або навіть пікомолярні афінності по відношенню до антигену-мішені. Афінно зрілі антитіла одержують відомими методами. У публікації Marks і ін. (Bio/Technology 10:779-783 (1992) описане дозрівання афінності в результаті перестановки доменів VH і VL. Неспецифічний мутагенез CDR і/або каркасних залишків описаний у публікаціях Barbas et al., Proc. Natl. Acad. Sci, USA, 91:3809-3813 (1994); Schier et al., Gene 169:147-155 (1995); Yelton et al., J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995) і Hawkins et al., J. Моl. Вiol. 226:889-896 (1992). Термін «ефекторні функції» антитіл означає біологічні активності, властиві Fc-області (Fcобласті нативної послідовності або Fc-області варіанта амінокислотної послідовності) антитіла й варіюються в залежності від ізотипу антитіла. Прикладами ефекторних функцій антитіла є зв'язування із Clq і комплемент-залежна цитотоксичність; зв'язування з Fc-рецептором; антитіло-залежна клітинно-опосередкована цитотоксичність (ADCC); фагоцитоз; негативна регуляція рецепторів клітинної поверхні (наприклад, В-клітинного рецептора); і активація В-клітин. "Антитіло-залежна клітинно-опосередкована цитотоксичність" або "ADCC" означає форму цитотоксичності, при якій секретований Ig, пов'язаний з Fc-рецепторами (FcR), присутніми на деяких цитотоксичних клітинах (наприклад, природних клітинах-кілерах (NK), нейтрофілах і макрофагах), дозволяє цим цитотоксичним ефекторним клітинам специфічно зв'язуватися з антигенвмісними клітинами-мішенями й викликати загибель клітинмішеней під дією цитотоксинів. Ці антитіла «озброюють» цитотоксичні клітини і є абсолютно необхідними для такого цитолізу. Первинні клітини, які опосередковують ADCC, тобто NK-клітини, експресують тільки FcRIII, тоді як моноцити експресують FcRI, FcRII і FcRIII. Дані, отримані для експресії FcR на гемопоетичних клітинах, систематизовані в таблиці 3 на сторінці 464 Ravetch & KinetAnnu. Rev. Immunol. (1991) 9:457-92. Для оцінки АDСС-активності молекули, яка представляє, інтерес, може бути проведений аналіз на ADCC in vitro, такий як аналіз, описаний у патентах США №№ 5500362 або 5821337, або Presta, у патенті США № 6737056. Ефекторними клітинами, що підходять для таких аналізів, є мононуклеарні клітини периферичної крові (МКПК) і природні клітиникілери (NK). Альтернативно або додатково, ADCCактивність молекули, яка представляє інтерес, може бути оцінена in vivo, наприклад, на моделі тварини, такий як модель, описана Clynes et al., Proc. Natl. Acad. Sci., USA, 95:652-656 (1998). «Людські ефекторні клітини» являють собою лейкоцити, які експресують один або декілька FcR і здійснюють ефекторні функції. Переважно, такі клітини експресують щонайменше FcRIII і здійснюють ефекторну ADCC-функцію. Прикладами людських лейкоцитів, які опосередковують ADCC, 94464 40 є мононуклеарні клітини периферичної крові (МКПК), природні клітини-кілери (NK), моноцити, цитотоксичні Т-клітини й нейтрофіли, при цьому, переважними є МКПК і NK. Ефекторні клітини можуть бути виділені із природного джерела, наприклад, із крові. Терміни «Fc-рецептор» або «FcR» використовуються для опису рецептора, який зв'язується з Fc-областю антитіла. Переважним FcR є людський FcR з нативною послідовністю. Крім того, переважним FcR є FcR, що зв'язується з антитілом IgG (гамма-рецептор), і рецептори підкласів FcRI, FcRII і FcRIII, включаючи алельні варіанти й альтернативно сплайсовані форми цих рецепторів. Рецепторами FcRII є FcRIIA ("активуючий рецептор") і FcRIIB ("інгібуючий рецептор"), які мають аналогічні амінокислотні послідовності, що відрізняються, головним чином, своїми цитоплазматичними доменами. Активуючий рецептор FcRIIA містить у своєму цитоплазматичному домені активуючий мотив імунорецептора на основі тирозину (ІТАМ). Інгібуючий рецептор FcRIIB містить у своєму цитоплазматичному домені інгібуючий мотив імунорецептора на основі тирозину (ІТІМ). (див. огляд М. Daeron, Annu. Rev. Immunol., 15:203-234 (1997)). FcR описані в публікаціях Ravetch & Kinet, Annu. Rev. Immunol. 9:457-92 (1991); Capel et al., Immunomethods, 4:25-34 (1994) і de Haas et al., J. Lab. Clin. Med., 126:330-41 (1995). Використовуваний тут термін "FcR" також охоплює й інші FcR, включаючи FcR, які будуть ідентифіковані в майбутньому. Цей термін також включає рецептор, наявний у немовлят, FcRn, що є відповідальним за передачу материнських IgG плоду (Guyer et al., J. Immunol., 117:587 (1976) і Kim et al., J. Immunol., 24:249 (1994)) і регулює гомеостаз імуноглобулінів. В WO 00/42072 (Presta) описані варіанти антитіл з підвищеним або зниженим рівнем зв'язування з FcR. Зміст даної патентної публікації конкретно вводиться в даний опис за допомогою посилання. Див., також, Shields et al. J. Biol. Chem. 9(2): 65916604 (2001). Методи вимірювання рівня зв'язування з FcRn відомі фахівцям (див., наприклад, Ghetie 1997, Hinton 2004). Зв'язування з людським FcRn in vivo і час напівжиття поліпептидів, які мають високу афінність зв'язування з людським FcRn, у сироватці, можуть бути оцінені, наприклад, у тпансгенних мишей або в трансфікованих людських клітинних лініях, експресуючий людський FcRn, або в приматів, яким були уведені варіанти поліпептидів Fc. "Комплемент-залежна цитотоксичність" або "CDC" означає лізис клітин-мішеней у присутності комплементу. Класичний шлях активації комплементу ініціюється зв'язуванням першого компонента системи комплементу (Clq) з антитілами (відповідного підкласу), які зв'язуються з їх когнатним антигеном. Для оцінки активації комплементу може бути проведений аналіз на CDC, наприклад, як описано Gazzano-Santoro et al., J. Immunol. Methods, 202:163 (1996). Поліпептидні варіанти, які мають модифіковані амінокислотні послідовності Fc-області й мають підвищену або знижену здатність зв'язуватися з Clq, описані в патенті США № 6194551В1 і в WO 41 99/51642. Зміст цих патентних публікацій конкретно вводиться в даний опис за допомогою посилання. Див. також Idusogie et al. J. Immunol. 164: 41784184 (2000). Термін «поліпептид, що містить Fc-область» означає поліпептид, такий як антитіло або імуноадгезин (визначення див. нижче), які містять Fcобласть. С-кінцевий лізин (залишок 447 відповідно до Європейської системи нумерації EU) Fc-області може бути видалений, наприклад, у процесі очищення поліпептиду або шляхом рекомбінантного конструювання нуклеїнової кислоти, що кодує даний поліпептид. Відповідно до цього, композиція, що містить поліпептид, що має Fc-область відповідно до винаходу, може містити поліпептиди із залишком K447; поліпептиди, де всі K447 були видалені; або суміш поліпептидів, які містять і не містить залишок K447. "Блокуюче" антитіло або "антитіло-антагоніст" являє собою антитіло, яке інгібує або знижує біологічну активність антигену, з яким воно зв'язується. Переважні блокуючі антитіла або антитілаантагоністи, в основному, або повністю інгібують біологічну активність антигену. Використовуваний тут термін "антитілоагоніст" означає антитіло, що імітує щонайменше одну з функціональних активностей поліпептиду, що представляє інтерес. «Акцепторана людська каркасна область», використовувана з метою даного винаходу, являє собою каркасну область, що містить амінокислотну послідовність каркасної області VL або VH, яка походить від каркасної області людського імуноглобуліну або від консенсусної каркасної області людського імуноглобуліну. Акцепторна людська каркасна область, яка «походить від» каркасної області людського імуноглобуліну або від консенсусної каркасної області людського імуноглобуліну, може включати ту ж саму амінокислотну послідовність, або вона може містити амінокислотну послідовність із уже наявними модифікаціями. У випадку якщо амінокислотні модифікації вже присутні, то переважно, щоб їхнє число становило не більш ніж 5, переважно 4 або менше або 3 або менше. У випадку якщо амінокислотні модифікації вже присутні в VH, то переважно, щоб такі модифікації були присутні тільки в трьох, двох або в одному з положень 71Н, 73Н і 78Н; так, наприклад, амінокислотними залишками в таких положеннях можуть бути 71А, 73Т і/або 78А. В одному з варіантів винаходу, послідовність акцепторної людської каркасної області VL ідентична послідовності каркасної області VL людського імуноглобуліну або консенсусній послідовності каркасної області людського імуноглобуліну. «Консенсусна послідовність людської каркасної області» являє собою каркасну область, що має амінокислотний залишок, що найбільше часто зустрічається у наборі з каркасних послідовностей VL або VH людського імуноглобуліну. Загалом кажучи, послідовності VL або VH людського імуноглобуліну вибирають із підгрупи послідовностей варіабельного домену. Звичайно, підгрупа таких послідовностей являє собою підгрупу, описану Кебатом і ін. В одному з варіантів винаходу, підг 94464 42 рупою для VL є підгрупа каппа І, описана Кебатом і ін. В одному з варіантів винаходу, підгрупою для VH є підгрупа III, описана Кебатом і ін. «Консенсусна послідовність каркасної області VH підгрупи III» включає консенсусну послідовність, що походить від амінокислотних послідовностей у варіабельній області важкого ланцюга підгрупи III, описаної Кебатом і ін. В одному з варіантів винаходу, консенсусна амінокислотна послідовність каркасної області VH підгрупи III містить щонайменше частину або всі нижченаведені послідовності: EVQLVESGGGLVQPGGSLRLSCAAS (SEQ ID NO:42)-H1-WVRQAPGKGLEWV (SEQ ID NO:43)H2-RFTISRDNSKNTLYLQMNSLRAEDTAVYYC (SEQ ID NO:44)-H3-WGQGTLVTVSS (SEQ ID NO:45). «Консенсусна послідовність каркасної області VL підгрупи І» включає консенсусну послідовність, що походить від амінокислотних послідовностей у варіабельній області легкого ланцюга каппа підгрупи І, описаної Кебатом і ін. В одному з варіантів винаходу, консенсусна амінокислотна послідовність каркасної області VL підгрупи І містить щонайменше частину або всі нижченаведені послідовності: DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO:46)-L1-WYQQKPGKAPKLLIY (SEQ ID NO:47)L2-GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO:48)-L3-FGQGTKVEIK (SEQ ID NO:49). Термін «розлад» або «захворювання» означає будь-який стан, який сприйнятливий до лікування речовиною/молекулою або способом відповідно до винаходу. Такими розладами є хронічні й гострі розлади або захворювання, включаючи патологічні стани, які створюють у даного ссавця схильність до розглянутого розладу. Необмежуючими прикладами описаних тут розладів, що піддаються лікуванню, є злоякісні й доброякісні пухлини; карцинома, бластома й саркома. Терміни "клітинно-проліферативний розлад" і "проліферативний розлад" означають розлади, асоційовані з певним ступенем аномальної проліферації клітин. В одному з варіантів винаходу, вказаним клітинно-проліферативним розладом є рак. Використовуваний тут термін "пухлина" означає всі неопластичні клітини, що піддаються росту й проліферації, незалежно від того, чи є вони доброякісними або злоякісними, і всі предракові й ракові клітини й тканини. Використовувані тут терміни "рак", "раковий", "клітинно-проліферативний розлад", "проліферативний розлад" і "пухлина" не є взаємовиключними. Використовувані тут терміни "рак" і "раковий" належать до фізіологічного стану ссавців, що звичайно характеризується нерегульованим ростом/проліферацією клітин. Прикладами ракових захворювань є, але не обмежуються ними, карцинома, лімфома, бластома, саркома й лейкоз. Більш конкретними прикладами таких ракових захворювань є плоскоклітинний рак, дрібноклітинний рак легенів, не-дрібноклітинний рак легенів, аденокарцинома легенів, плоскоклітинна карцинома легенів, рак черевної порожнини, гепатоцелюлярний рак, рак шлунково-кишкового тракту, рак підш 43 лункової залози, гліобластома, рак шийки матки, рак яєчника, рак печінки, рак сечового міхура, гепатома, рак молочної залози, рак товстої кишки, рак прямої і ободової кишки, карцинома ендометрію або матки, карцинома слинної залози, рак нирок, рак печінки, рак передміхурової залози, рак вульви, рак щитовидної залози, карцинома печінки, рак шлунка, меланома й різні типи раку голови й шиї. Порушення ангіогенезу може приводити до розвитку багатьох розладів, які можуть бути піддані лікуванню композиціями й способами відповідно до винаходу. Такими розладами є не-неопластичні й неопластичні стани. Неопластичними розладами є, але не обмежуються ними, стани, описані вище. Не-неопластичними станами є, але не обмежуються ними, небажана або аберантна гіпертрофія, артрит, ревматоїдний артрит (РА), псоріаз, псоріазні бляшки, саркоїдоз, атеросклероз, атеросклеротичні бляшки, діабетична і інші проліферативні ретинопатії, включаючи ретинопатію недоношених або ретролентальну фіброплазію, неоваскулярну глаукому, старечу дегенерацію жовтої плями, діабетичний набряк жовтої плями, неоваскуляризацію рогівки ока, неоваскуляризацію трансплантата рогівки ока, відторгнення трансплантата рогівки ока, неоваскуляризацію сітківки/судинної оболонки ока, неоваскуляризацію кута очного яблука (почервоніння ока), неоваскулярне захворювання очей, рестеноз судин, артеріовенозні мальформації (АВМ), менінгіому, гемангіому ангиофіброму, гіперплазію щитовидної залози (включаючи хворобу Грейвса), захворювання, асоційовані із трансплантацією рогівки очі й інші тканини; хронічне запалення, запалення легенів, гостре ураження легенів/респіраторний дистрес-синдром дорослих (РДСВ), сепсис, первинну легеневу гіпертензія, злоякісні ексудати в області легенів, набряк головного мозку (наприклад, асоційований з інсультом/закритим ушкодженням/травмою голови), синовіт, утворення паннусапри РА, осифіціюючий міозит, гіпертрофію кісток, остеоартрит (ОА), що не піддається лікуванню асцит, полікістоз яєчника, ендометріоз, захворювання, асоційовані із секвестрацією рідини в третьому просторі (порожнини порожнистих органів) (панкреатит, тунельний синдром, опіки, захворювання кишечнику), фіброму матки, передчасні пологи, хронічне запалення, таке як ВЗК (хвороба Крона й виразковий коліт), відторгнення ниркового аллотрансплантату, запальне захворювання кишечнику, нефротичний синдром, небажаний або аберантний ріст тканинної маси (не-ракових тканин), гемофілічну артропатію, гіпертрофовані рубці, придушення росту волосся, синдром Ослера-Вебера, піогенну гранульому, ретролентальну фіброплазію, склеродермію, трахому, васкулярну адгезію (зрощення судин), синовіт, дерматит, прееклампсію, асцити, випоти в область перикарду (наприклад, асоційовані з перикардитом) і плевральні випоти. Використовуваний тут термін "лікування" означає клінічне втручання з метою зміни природних процесів, що відбуваються в організмі індивідуума й у клітинах, що піддаються лікуванню, і таке лікування може бути профілактичним, або воно може бути здійснене в процесі розвитку клінічної патоло 94464 44 гії. Бажаними ефектами лікування є запобігання рецидиву або зниження частоти рецидивів, ослаблення симптомів, зменшення будь-яких прямих або опосередкованих патологічних наслідків захворювання, попередження метастазів, зниження ступеню прогресування захворювання, ослаблення або зниження ступеню патологічного стану, також ремісія або поліпшення прогнозу. У деяких варіантах винаходу, антитіла відповідно до винаходу використовуються для вповільнення розвитку захворювання або розладу. Термін «індивідуум» означає хребетне, переважно, ссавеця, найбільш переважно, людину. Термін «ссавці» включає, але не обмежується ними, сільськогосподарських тварин (таких як корови), тварин, що беруть участь у спортивних змаганнях, домашніх вихованців (таких як кішки, собаки й коні), приматів, мишей і щурів. «Ссавцями», що піддаються лікуванню, є будь-які тварини, класифіковані як ссавці, включаючи людину, домашніх і сільськогосподарських тварин, також тварин, що втримуються в зоопарках, тварин, що беруть участь у спортивних змаганнях або домашніх вихованцях, таких як собаки, коня, кішки, корови й т.п. Переважним ссавцем є людина. Термін "ефективна кількість" означає кількість, що є ефективною у визначених дозах і протягом визначеного періоду часу, необхідних для досягнення потрібного терапевтичного або профілактичного результату. "Терапевтично ефективна кількість" речовини/молекули відповідно до винаходу, агоніста або антагоніста може варіюватися залежно від таких факторів, як патологічний стан, вік, стать й маса індивідуума, також здатність даної речовини/молекули, агоніста або антагоніста виробляти потрібну відповідь в індивідуума. Терапевтично ефективною кількістю також є кількість, при введенні якої терапевтично сприятливі ефекти вказаної речовини/молекули, агоніста або антагоніста переважають над будь-якими їх токсичними або побічними ефектами. Термін "профілактично ефективна кількість" означає кількість, яка є ефективною у визначених дозах і протягом визначеного періоду часу, необхідних для досягнення потрібного профілактичного результату. Оскільки профілактичну дозу вводять індивідуумам перед початком розвитку захворювання або на ранній стадії розвитку захворювання, то звичайно, але необов'язково, така профілактично ефективна кількість повинна бути меншою терапевтично ефективної кількості. Використовуваний тут термін "цитотоксичний засіб" означає речовину, яка інгібує або запобігає функції клітин і/або викликає деструкцію клітин. Цей термін включає радіоактивні ізотопи (напри211 131 125 90 186 188 153 212 клад, At , I , I , Y , Re , Re , Sm , Ві , 32 Ρ і радіоактивні ізотопи Lu), хіміотерапевтичні засоби, наприклад, метотрексат, адріаміцин, вінкаалкалоїди (вінкристин, вінбластин, етопозид), доксорубіцин, мелфалан, мітоміцин С, хлорамбуцил, даунорубіцин або інші інтеркалюючі агенти, ферменти і їхні фрагменти, такі як нуклеолітичні ферменти, антибіотики й токсини, такі як токсини у вигляді невеликих молекул, або ферментативно 45 активні токсини бактеріального, грибкового, рослинного або тваринного походження, включаючи їхні фрагменти і/або варіанти, і різні протипухлинні або протиракові засоби, описані нижче. Нижче описані й інші цитотоксичні засоби. Протипухлинний засіб викликає деструкцію пухлинних клітин. "Хіміотерапевтичний засіб" являє собою хімічну сполуку, яка використовується для лікування раку. Прикладами хіміотерапевтичних засобів є алкілуючі агенти, такі як тіотепа й циклофосфамід цитоксан®; алкілсульфонати, такі як бусульфан, імпросульфан і піпосульфан; азиридини, такі як бензодопа, карбоквон, метуредопа й уредопа; етиленіміни й метиламеламіни, включаючи альтретамін, триетиленмеламін, триетиленфосфорамід, триетилентіофосфорамід і триметилолмеламін; ацетогеніни (а зокрема, буллатацин і буллатацинон); дельта-9-тетрагідроканабінол (дронабінол, маринол®); бета-лапахон; лапахол; колхіцини; бетулінова кислота; камптотецин (включаючи синтетичний аналог топотекан (гікамтин®), СРТ-11 (іринотекан, камптозар®), ацетилкамптотецин, скополектин і 9-амінокамптотецин); бріостатин; калістатин; СС-1065 (включаючи його синтетичні аналоги, такі як адозелезин, карзелезин і бізелезин); подофілотоксин; подофілінова кислота; теніпозид; криптофіцини (зокрема, криптофіцин 1 і криптофіцин 8); доластатин; дуокарміцин (включаючи синтетичні аналоги, KW-2189 і СВ 1-ТМ1); елеутеробін; панкратистатин; саркодиктиїн; спонгістатин; азотні аналоги гірчичного газу, такі як хлорамбуцил, хлорнафазин, холофосфамід, естрамустин, іфосфамід, мехлоретамін, гідрохлорид оксиду мехлоретаміну, мелфалан, новембіхін, фенестерин, преднімустин, трофосфамід, урациловий аналог гірчичного газу; нітрозосечовини, такі як кармустин, хлорозотоцин, фотемустин, ломустин, німустин і ранімнустин; антибіотики, такі як енедиїнові антибіотики (наприклад, каліхеаміцин, зокрема, каліхеаміцин гама II і каліхеаміцин омега II (див., наприклад, Agnew, Chem. Intl. Ed. Engl, 33:183-186 (1994)); динеміцин, включаючи динеміцин А; еспераміцин, також неокарзиностатиновий хромофор і споріднені хромофори, такі як хромопротеїнові енедиїнові антибіотики), аклациномізини, актиноміцин, аутраміцин, азасерин, блеоміцини, кактиноміцин, карабіцин, карміноміцин, карзинофілин, хромоміцини, дактиноміцин, даунорубіцин, деторубіцин, L-норлейцин, доксирубіцин адріаміцин® (включаючи морфолінодоксорубіцин, ціаноморфолінодоксорубіцин, 2піролінодоксорубіцин і дезоксидоксорубіцин), епірубіцин, езорубіцин, ідарубіцин, марцеломіцин, мітоміцини, такі як мітоміцин С, мікофенолова кислота, ногаламіцин, оливоміцини, пепломіцин, потфіроміцин, пуроміцин, квеламіцин, родорубіцин, стрептонігрин, стрептозоцин, туберцидин, убенімекс, зиностатин, зорубіцин; антиметаболіти, такі як метотрексат і 5-фторурацил (5-FU); аналоги фолієвої кислоти, такі як деноптерин, метотрексат, птероптерин, триметрексат; пуринові аналоги, такі як флударабин, 6-меркаптопурин, тіаміприн, тіогуанін; піримідинові аналоги, такі як анцитабін, азацитидин, 6-азауридин, кармофур, цитарабін, дидезоксіуридин, доксифлуридин, еноцитабін, 94464 46 флоксуридин; андрогени, такі як калустерон, пропіонат дромостанолону, епітіостанол, мепітіостан, тестолактон; антиадренергичні засоби, такі як аміноглютетимід, мітотан, трилостан; замінник фолієвої кислоти, такий як фролінова кислота; ацеглатон; альдофосфамідний глікозид; амінолевулінова кислота; енілурацил; амсакрин; бестрабуцил; бізантрен; едатраксат; дефофамін; демеколцин; діазиквон; елфорнітин; ацетат еліптинію; епотилон; етоглюцид; нітрат галію; гідроксисечовина; лентинан; лонідаїнін; майтанзиноїди, такі як майтазин і анзамітоцини; мітогуазон; мітоксантрон; мопідамнол; нітраерин; пентостатин; фенамет; пірарубіцин; лозоксантон; 2-етилгідразид; прокарбіазцин; полісахаридний комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофіран; спірогерманій; тенуазонова кислота; триазиквон; 2,2',2"-трихлортриетиламін; трихотецени (а зокрема, токсин Т-2, веракурин А, рорідин А і ангуїдин); уретан; віндезин (елдизин®, філдезин®); дакарбазин; маномустин; мітобронітол; мітолактол; піпоброман; гацитозин; арабінозид ("Аrа-С"); тіотепа; таксоїди, наприклад, паклітаксел Таксол® (Bristol-Myers Squibb Oncology, Princeton, N.J.); Абраксан™, який не містить кремофору, сконструйована на основі альбуміну композиція з наночастинок паклітакселу (American Pharmaceuticals Partners, Schaumberg, Illinois) і доцетаксел Таксотер® (Rhone-Poulenc Rorer, Antony, France); хлоранбуцил; гемцитабін (Гемзар®); 6-тіогуанін; меркаптопурин; метотрексат; аналоги платини, такі як цисплатин і карбоплатин; вінбластин (Велбан®); платина; етопозид (VP-16); іфосфамід; мітоксантрон; вінкристин (Онковін®); оксаліплатин; лейковорин; вінорелбін (Навелбин®); новантрон; едатрексат; дауноміцин; аміноптерин; ібандронат; інгібітор топоізомерази RFS 2000; дифторметилорнітин (ДМФО); ретиноїди, такі як ретиноєва кислота; капецитабін (Кселода®); фармацевтично прийнятні солі, оксидиабо похідні всіх вищевказаних сполук, також комбінації із двох або більше вищевказаних сполук, такі як CHOP, де вказана абревіатура використовується в комбінованій терапії й означає циклофосфамід, доксорубіцин, вінкристин і преднізолон, і FOLFOX, де вказана абревіатура використовується в комбінованій терапії й означає оксаліплатин (Елоксатин®), 5-FU і лейкововін. У це визначення також входять протигормональні засоби, які регулюють, знижують, блокують або інгібують дію гормонів, які можуть стимулювати ріст ракової пухлини, і ці засоби часто застосовуються для системного або загального лікування. Такими засобами можуть бути самі гормони. Прикладами таких засобів є антиестрогени й селективні модулятори рецептора естрогену (SERM), включаючи, наприклад, тамоксифен (включаючи тамоксифен Нолвадекс®), ралоксифен Евиста®, дролоксифен, 4-гідрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон і тореміфен Фарестон®; антипрогестерони; інгібітори рецептора естрогену (ERD); засоби, що придушують або блокують функції яєчників, наприклад, агоністи рилізинг-фактора лютеїнізуючого гормону (LHRH), такі як Лупрон® і ацетат лейпроліду Елігард®, 47 ацетат гозереліну, ацетат бузереліну й триптерелін; інші антиандрогени, такі як флутамід, нілутамід і бікалутамід; і інгібітори ароматази, які інгібують фермент ароматазу й регулюють продукування естрогенів у корі надниркової залози, такі як, наприклад, 4(5)-імідазоли, аміноглутетимід, ацетат мегестролу Мегаза®, екземестан Аромазин®, форместан, фадрозол, ворозол Ривізор®, летрозол Фемара® і анастрозол Аримідекс®. Крім того, у таке визначення хіміотерапевтичних засобів входять біфосфонати, такі як клодронат (наприклад, Бонефос® або Остак®), етидронат Дидрокал®, NE-58095, золедронова кислота/золедронат Зомета®, алендронат Фозамакс®, памідронат Аредия®, тилудронат Скелид® або ризедронат Актонел®, також троксацитабін (нуклеозидний аналог 1, 3-діоксоланцитозину); антисмислові олігонуклеотиди, зокрема, олігонуклеотиди, які інгібують експресію генів шляху передачі сигналу, які беруть участь у небажаній проліферації клітин, такі як, наприклад, РКС-Альфа, Raf, H-Ras і рецептор епідермального фактора росту (EGF-R); вакцини, такі як вакцина Тератопа® і вакцини, застосовувані в генотерапії, наприклад, вакцина Алловектин®, вакцина Лейвектин® і вакцина Ваксид®; інгібітор топоізомерази 1 Луртотекан®; rmRH Абарелікс®; дитозилат лапатинібу (інгібітор тирозинкінази, що складається із двох невеликих молекул Erb-2 і EGFR, також відомий як GW572016) і фармацевтично прийнятні солі, оксиди або похідні всіх вищевказаних сполук. Використовуваний тут термін "ріст-інгібуючий засіб" означає сполуку або композицію, що інгібує ріст клітин (таких як клітини, які експресують DLL4), або in vitro, або in vivo. Таким чином, засобом, який інгібує ріст клітин, може бути засіб, що значно знижує відсоток клітин (таких як клітини, які експресують DLL4) у фазі S. Прикладами засобів, які інгібують ріст клітин, є засоби, що блокують проходження клітинного циклу (в іншій фазі, крім фази S), такі як засоби, які індукують блокування фази G1 і фази М. Класичними засобами, що блокують фазу М, є вінкаалкалоїди (вінкристин і вінбластин), таксани й інгібітори топоізомерази II, такі як доксорубіцин, епірубіцин, даунорубіцин, етопозид і блеоміцин. Засобами, які блокують фазу G1, що також блокують перехід у фазу S, є, наприклад, ДНК-алкілуючі агенти, такі як тамоксифен, преднізон, дакарбазин, мехлоретамін, цисплатин, метотрексат, 5-фторурацил і ага-С. Додаткову інформацію можна знайти в публікації The Molecular Basis of Cancer, Mendelsohn & Israel, eds., Chapter 1, entitled "Cell cycle regulation, oncogenes and antineoplastic drugs", Murakami et al. (WB Saunders: Philadelphia, 1995), зокрема, на стор. 13. Таксани (паклітаксел і доцетаксел) являють собою протиракові лікарські засоби, які одержуються з дерева тис. Доцетаксел (Таксотер®, Rhone-Poulenc Rorer), який одержується з Європейського тиса, являє собою напівсинтетичний аналог паклітакселу (Таксола®, Bristol-Myers Squibb). Паклітаксел і доцетаксел індукують зборку мікротрубочок з тубулінових димерів і стабілізують мікротрубочки шляхом попередження деполімеризації, що приводить до інгібування мітозу клітин. 94464 48 "Доксорубіцин" являє собою антрацикліновий антибіотик. Доксорубіцин має повну хімічну назву (8S-цис)-10-[(3-аміно-2,3,6-тридезокси--L-ліксогексапіранозил)окси]-7,8,9,10-тетрагідро-6,8,11тригідрокси-8-(гідроксіацетил)-1-метокси-5,12нафтацендіон. Термін "протипухлинна композиція" означає композицію, що може бути використана для лікування раку й містить щонайменше один активний терапевтичний засіб, наприклад, «протираковий засіб». Прикладами терапевтичних засобів (протиракових засобів, які також називаються тут «протипухлинним засобом») є, але не обмежуються ними, наприклад, хіміотерапевтичні засоби, рістінгібуючі засоби, цитотоксичні засоби, засоби, використовувані в променевій терапії, антиангіогенні засоби, апоптотичні засоби, антитубулінові засоби, токсини й інші засоби для лікування раку, наприклад, нейтралізуючі анти-VEGF-антитіло, антагоніст VEGF, анти-НЕR-2-антитіло, анти-СD20антитіло, антагоніст рецептора епідермального фактора росту (EGFR) (наприклад, інгібітор тирозинкінази), інгібітор HER1/EGFR, ерлотиніб, інгібітор СОХ-2 (наприклад, целекоксиб), інтерферони, цитокіни, антагоністи (наприклад, нейтралізуючі антитіла), які зв'язуються з одним або декількома рецепторами ЕrbВ2, ЕrbВ3, ЕrbВ4 або VEGF, інгібітори тирозинкіназних рецепторів тромбоцитарного фактора росту (PDGF) і/або фактор стовбурових клітин (SCF) (наприклад, мезилат іматинібу (Gleevec® Novartis)), TRAIL/Apo2L, і інші біологічно активні засоби й органічні хімічні сполуки й т.п. Використовуваний у даній заявці термін "проліки" означає попередник або похідне фармацевтично активної речовини, які, у порівнянні з батьківським лікарським засобом, є менш цитотоксичними по відношенню до пухлинних клітин і здатні ферментативно активуватися або перетворюватися в більш активну зрілу форму. Див., наприклад, Wilman, "Prodrags in Cancer Chemotherapy" Biochemical Society Transactions, 14, pp.375-382, 615th Meeting Belfast (1986) і Stella et al. "Prodrags: A Chemical Approach to Targeted Drug Delivery", Directed Drug Delivery, Borchardt et al., (ed.), pp.247-267, Humana Press (1985). Проліками відповідно до винаходу є, але не обмежуються ними, фосфатвмісні проліки; тіофосфатвмісні проліки; сульфатвмісні проліки; пептидвмісні проліки; лікарські засоби, модифіковані Dамінокислотою; глікозильовані проліки; βлактамвмісні проліки; проліки, що містять необов'язково заміщений феноксіацетамід; або проліки, що містять, але необов'язково, заміщений фенілацетамід; 5-фторцитозинові й інші 5-фторуридинові проліки, які можуть бути перетворені в більш активний цитотоксичний вільний лікарський засіб. Прикладами цитотоксичних лікарських засобів, які можуть бути дериватизовані з одержанням пролікарської форми для її використання даному винаході, є але не обмежуються ними, хіміотерапевтичні засоби, описані вище. Термін «антиангіогенний засіб» або «інгібітор ангіогенезу» означає речовину з невеликою молекулярною масою, полінуклеотид (включаючи, наприклад, інгібуючу РНК (РНКі або кіРНК)), поліпеп 49 тид, виділений білок, рекомбінантний білок, антитіло або його кон'югати або гібридні білки, які прямо або опосередковано інгібують ангіогенез, васкулогенез або небажану проникність судин. Так, наприклад, антиангіогенним засобом є антитіло або інший антагоніст, спрямований проти ангіогенного агента, визначені вище, наприклад, антитіла проти VEGF, антитіла проти рецепторів VEGF, фрагменти розчинних рецепторів VEGF або невеликі молекули, що блокують передачу сигналу рецептора VEGF (наприклад, PTK787/ZK2284, SU6668, SUTENT®/SU11248 (малат сунитинібу), AMG706 або молекули, описані, наприклад, у Міжнародній патентній заявці WO 2004/113304). Антиангіогенними засобами також є природні інгібітори ангіогенезу, наприклад, антіостатин, ендостатин і т.п. Див., наприклад, Klagsbrun and D'Amore, Annu. Rev. Physiol, 53:217-39 (1991); Streit and Detmar, Oncogene, 22:3172-3179 (2003) (наприклад, таблицю 3, у якій перераховані антиангіогенні засоби для лікування злоякісної меланоми); Ferrara & Alitalo, Nature Medicine 5(12):1359-1364 (1999); Tonini et al., Oncogene, 22:6549-6556 (2003) (наприклад, таблиця 2, у якій перераховані антиангіогенні фактори); і Sato Int. J. Clin. Oncol, 8:200-206 (2003) (наприклад, таблицю 1, у якій перераховані антиангіогенні засоби, використовувані в клінічних випробуваннях). Композиції відповідно до винаходу й способи їхнього одержання Даний винахід належить до композицій, включаючи фармацевтичні композиції, що містять антиDLL4-антитіло, і до полінуклеотидів, які містять послідовності, що кодують анти-DLL4-антитіло. Використовувані тут композиції містять одне або декілька антитіл, що зв'язуються з DLL4, і/або один або декілька полінуклеотидів, які містять послідовності, що кодують одне або декілька антитіл, що зв'язуються з DLL4. Такі композиції можуть також містити прийнятні носії, такі як фармацевтично прийнятні наповнювачі, включаючи буфери, добре відомі фахівцям. Даний винахід також охоплює варіанти виділених антитіл і полінуклеотидів. Даний винахід також охоплює варіанти в основному, чистих антитіл і полінуклеотидів. Анти-DLL4-антитілами відповідно до винаходу є, переважно, моноклональні антитіла. В об'єм даного винаходу також входять Fab, Fab'-, Fab'SH- і F(ab')2-фрагменти анти-DLL4-антитіл, які тут розглядаються. Вказані фрагменти антитіл можуть бути отримані традиційними способами, такими як ферментативний гідроліз, або вони можуть бути продуковані методами рекомбінантних ДНК. Вказані фрагменти антитіл можуть бути химерними або гуманізованими. Ці фрагменти можуть бути використані в діагностичних або терапевтичних цілях, описаних нижче. Моноклональні антитіла одержують із популяції, в основному, гомогенних антитіл, тобто окремі антитіла, що входять до складу такої популяції, є ідентичними за винятком можливих природних мутацій, які можуть бути присутніми у невеликих кількостях. Таким чином, термін «моноклональ 94464 50 ний» визначає характер антитіла, що не є сумішшю дискретних антитіл. Моноклональні анти-DLL4-антитіла відповідно до винаходу можуть бути отримані гібридомним методом, уперше описаним Kohler et al., Nature, 256:495 (1975), або вони можуть бути отримані методами рекомбінантних ДНК (патент США №4816567). У гібридомному методі, миша або іншу прийнятну тварину-хазяїн, таку як хом'ячок, імунізують для вироблення в нього лімфоцитів, продукуючих або здатних продукувати антитіла, що специфічно зв'язуються з білком, використовуваним для імунізації. Антитіла проти DLL4 звичайно виробляються у тварин після багаторазових підшкірних (sc) або внутріочеревинних (ір) ін'єкцій DLL4 і ад'юванта. DLL4 може бути отриманий добре відомими методами, деякі з яких більш докладно описані нижче. Так, наприклад, рекомбінантне продукування DLL4 описане нижче. В одному з варіантів винаходу, тварин імунізують похідним DLL4, що містить позаклітинний домен (ECD) DLL4, приєднаний до Fcчастини важкого ланцюга імуноглобуліну. У переважному варіанті винаходу, тварин імунізують гібридним білком «DLL4-IgG1». Тварин звичайно імунізують монофосфорилліпідом А (МРL)/дикриноміколятом трегалози (TDM) для вироблення відповіді проти імуногенних кон'югатів або похідних DLL4 (Ribі Immunochem. Research, Inc., Hamilton, MT), i отриманий розчин ін'єктують черезшкірно в множину ділянок. Через два тижні, тваринам вводять ударну дозу. Ще через 7-14 днів, у тварин беруть кров, і сироватку аналізують на титри анти-DLL4-антитіл. Тваринам вводять ударну дозу доти, поки титр не буде досягати «плато» (тобто постійного рівня). Альтернативно, лімфоцити можуть бути імунізовані in vitro. Потім лімфоцити піддають зливанню з мієломними клітинами з використанням прийнятного агента для злиття, такого як поліетиленгліколь, у результаті чого утворюються гібридомні клітини (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Отримані наступним чином гібридомні клітини висівають і культивують в прийнятному культуральному середовищі, що, переважно, містить одну або декілька речовин, інгібуючих ріст або виживання не-злитих батьківських мієломних клітин. Так, наприклад, якщо батьківські мієломні клітини не містять ферменту гіпоксантин-гуанінфосфорибозилтрансферази (HGPRT або HPRT), то культуральне середовище, використовуване для одержання гібридом, звичайно включає гіпоксантин, аміноптерин і тимідин (середовище HAT), тобто речовини, що попереджають ріст HGPRTдефіцитних клітин. Переважними мієломними клітинами є клітини, які здатні піддаватися ефективному зливанню, підтримувати стабільне продукування високих рівнів антитіл вибраними антитіло-продукуючими клітинами і є чутливими до середовища, такого як середовище HAT. Із цих клітин, переважними мієломними клітинними лініями є мишачі мієломні лінії, такі як клітинні лінії, що походять від клітин мишачих пухлин МОРС-21 і МРС-11, наявних в 51 інституті Salk Institute Cell Distribution Center, San Diego, California USA, і клітин SP-2 або X63-Ag8653, наявних в Американській колекції типових культур, Rockville, Maryland USA. Для продукування людських моноклональних антитіл також використовуються людські мієломні клітинні лінії й гетеромієломні клітинні лінії "миша-людина" (Kozbor J. Immunol, 133:3001 (1984) & Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp.51-63 (Marcel Dekker, Inc., New York, 1987)). Культуральне середовище для росту гібридомних клітин аналізують на продукування моноклональних антитіл проти DLL4. Специфічність зв'язування моноклональних антитіл, продукованих гібридомними клітинами, визначають, переважно, шляхом імунопреципітації або шляхом проведення in vitro аналізу на зв'язування, такого як радіоімуноаналіз (РІА) або твердофазний імунноферментний аналіз (ELISA). Афінність зв'язування моноклонального антитіла може бути, наприклад, визначена за допомогою аналізу Скетчарда, описаного Munson et al., Anal. Biochem., 107:220 (1980). Після ідентифікації гібридомних клітин, які продукують антитіла з потрібною специфічністю, афінністю і/або активністю, клони можуть бути субклоновані шляхом проведення процедур лімітуючого розведення і культивовані стандартними методами (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Прийнятними культуральними середовищами, призначеними для досягнення даної мети, є, наприклад, середовище D-MEM або RPMI-1640. Крім того, гібридомні клітини можуть бути вирощені in vivo як асцитні пухлини у тварин. Моноклональні антитіла, секретовані субклонами, відповідним чином виділяють із культурального середовища, асцитної рідини або сироватки шляхом проведення стандартних процедур очищення імуноглобулінів, таких як, наприклад, хроматографія на білку А-сефарозі, хроматографія на гідроксіапатитах, гель-електрофорез, діаліз або афінна хроматографія. Анти-DLL4-антитіла відповідно до винаходу можуть бути отримані з використанням комбінаторних бібліотек для скринінгу на клони синтетичних антитіл з потрібною активністю або активностями. У принципі, клони синтетичних антитіл відбирають шляхом скринінгу фагових бібліотек, що містять фаг, який представляє різні фрагменти варіабельної області антитіла (Fv), приєднані до білка оболонки фага. Такі фагові бібліотеки піддають пеннінгу за допомогою афінної хроматографії проти потрібного антигену. Клони, які експресують Fvфрагменти, здатні зв'язуватися з потрібним антигеном, піддають адсорбції на антигені й, тим самим, їхньому відділенню від клонів, що не зв'язуються, у бібліотеці. Потім клони, що зв'язуються, елююють з антигену, після чого число цих клонів може бути збільшене шляхом проведення додаткових циклів адсорбції/елюювання антигену. Будьяке з анти-DLL4-антитіл відповідно до винаходу може бути отримане із застосуванням прийнятної процедури скринінгу антигену для відбору на клон 94464 52 фага, що представляє інтерес, з наступним конструюванням повнорозмірного клону анти-DLL4антитіла з використанням послідовностей Fv, що походять від клону фага, що представляє інтерес, і прийнятних послідовностей константної області (Fc), описаних Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3. Антигензв'язувальний домен антитіла утворюється із двох варіабельних (V) областей, що складаються приблизно з 110 амінокислот, одна з яких знаходиться в легкому ланцюзі (VL), інша - у важкому ланцюзі (VH), і в цих варіабельних областях присутні три гіперваріабельні петлі або комплементарність-визначаючі області (CDR). Варіабельні домени можуть бути функціонально представлені на фагу або як одноланцюжкові Fv-(scFv)фрагменти, у яких VH і VL ковалентно зв'язані один з одним за допомогою короткого гнучкого пептиду, або як Fab-фрагменти, у яких кожний їх цих варіабельних доменів приєднаний до константного домену й піддається нековалентній взаємодії, як описано Winter et al., Ann. Rev. Immunol, 12: 433-455 (1994). Використовувані тут scFv-κοдуючі фагові клони й Fab-кодуючі фагові клони, у цілому, називаються «фаговими Fv-клонами» або «Fvклонами». Набори генів VH і VL можуть бути окремо клоновані за допомогою полімеразної ланцюгової реакції (ПЛР) і піддані неспецифічній рекомбінації у фагових бібліотеках, потім вони можуть бути проаналізовані на антигензв'язувальні клони, як описано в публікації Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Бібліотеки від імунізованих джерел дозволяють одержати антитіла, що мають високу афінність до імуногену, і при цьому, не вимагають проведення процедури конструювання гібридом. Альтернативно, може бути клонований набір людських антитіл дикого типу з одержанням одного джерела людських антитіл проти неаутоантигенів, також аутоантигенів широкого ряду, не застосовуючи, при цьому, яку-небудь імунізацію, як описано Griffiths et al., ΔΜΒΟ J, 12: 725-734 (1993). І нарешті, вихідні бібліотеки можуть бути також синтезовані шляхом клонування неаранжованих сегментів V-гена зі стовбурових клітин і з використанням ПЛР-праймерів, що містять рандомізовану послідовність, яка кодує у високому ступені варіабельні СDR3-області, з метою досягнення реаранжирування in vitro, як описано Hoogenboom & Winter, J. Моl. Віоl., 227: 381388(1992). Для представлення фрагментів антитіл шляхом їхнього приєднання до мінорного оболонкового білку рІll використовують нитчатий фаг. Фрагменти антитіл можуть бути представлені у вигляді одноланцюжкових Fv-фрагментів, у яких домени VH і VL приєднані на одному і тому ж поліпептидному ланцюзі за допомогою гнучкого поліпептидного спейсера, наприклад, як описано Marks et al., J. Моl. Βiοl., 222: 581-597 (1991), або у вигляді Fabфрагментів, у яких один ланцюг приєднаний до рІll, інший секретується в периплазму бактеріальної клітини-хазяя, де відбувається сборка структури оболонкового білка Fab, що відображається на 53 поверхні фага за допомогою заміни деяких з оболонкових білків дикого типу, наприклад, як описано в публікації Hoogenboom et al., Nucl. Acids Res., 19: 4133-4137(1991). Звичайно, нуклеїнові кислоти, які містять гени, що кодують фрагменти антитіл, одержують із імунних клітин, узятих у людини або тварин. Якщо необхідно одержати бібліотеку, що складається переважно із клонів анти-DLL4-антитіл, то індивідуума імунізують DLL4 для виробляння в нього гуморальної відповіді, потім, для конструювання бібліотеки, виділяють клітини селезінки і/або циркулюючі В-клітини, що не належать до популяції лімфоцитів периферичної крові (ЛПК). У переважному варіанті винаходу, бібліотеку генів фрагментів людського антитіла, що містить переважно клони анти-DLL4-антитіла, одержують за допомогою вироблення відповіді у вигляді продукування анти-DLL4-антитіл у трансгенних мишей, що несуть масив функціональних генів людського імуноглобуліну (і не містять функціональної системи продукування ендогенного антитіла), де така DLL4-імунізація буде приводити до утворення Вклітин, продукуючих людські антитіла проти DLL4. Генерування трансгенних мишей, продукуючих людське антитіло, описано нижче. Додаткове збагачення клітинної популяції реактивними анти-DLL4-антитілами може бути досягнуте за допомогою прийнятної процедури скринінгу для виділення В-клітин, експресуючих DLL4специфічне мембрано-зв'язане антитіло, наприклад, шляхом поділу клітин за допомогою DLL4афінної хроматографії або адсорбції клітин на DLL4, міченому флуорохромом, і наступного клітинного сортингу з активацією флуоресценції (FACS). Альтернативно, використання клітин селезінки і/або В-клітин або інших ЛПК, узятих від неімунізованого донора, забезпечує переважне представлення можливого репертуару антитіл, також дозволяє конструювати бібліотеку антитіл у тварин будь-якого виду (у людини або в інших тварин), у яких DLL4 не є антигенним. Для створення бібліотек, що включають конструкцію генів антитіл in vitro, в індивідуума беруть стовбурові клітини й виділяють нуклеїнові кислоти, що кодують неаранжовані сегменти генів антитіл. Імунні клітини, що представляють інтерес, можуть бути виділені у тваринних різних видів, таких як людина, миші, щура, зайцеподібні, вовки, собаки, кішки, свині, корови, коні, птахи й т.п. Нуклеїнову кислоту, що кодує сегменти генів варіабельних областей антитіла (включаючи VH- і VL-сегменти), виділяють із клітин, що представляють інтерес, і ампліфікують. У випадку використання бібліотек реаранжованих генів VH і VL, потрібна ДНК може бути отримана шляхом виділення геномної ДНК або мРНК із лімфоцитів з наступним проведенням полімеразної ланцюгової реакції (ПЛР) з використанням праймерів, що відповідають 5'- і 3'-кінцям реаранжованих генів VH і VL, описаних у публікації Orlandi et al., Proc. Natl. Acad. Sci. (USA), 86: 3833-3837 (1989), і тим самим одержання різних наборів V-генів для експресії. V-гени можуть бути ампліфіковані із кДНК і геномної ДНК 94464 54 із використанням зворотних праймерів біля 5'кінця екзону, що кодує зрілий V-домен, і прямих праймерів, отриманих на основі J-сегмента як описано в публікаціях Orlandi et al. (1989) і Ward et al., Nature, 341: 544-546 (1989). Однак для ампліфікації із кДНК, зворотні праймери можуть бути також отримані на основі лідерного екзону, як описано в публікації Jones et al., Biotechnol, 9: 88-89 (1991), прямі праймери можуть бути уведені в константну область, як описано в публікації Sastry et al., Proc. Natl. Acad Sci. (USA), 86: 5728-5732 (1989). Для максимізації комплементарності можуть бути отримані вирождені праймери, описані в публікації Orlandi et al. (1989) або Sastry et al. (1989). Переважно, різноманіття бібліотек максимізують із використання ЛПР-праймерів, націлених на кожне сімейство V-генів, з метою ампліфікації всіх наявних аранжувань VH і VL, присутніх у зразку нуклеїнової кислоти імунної клітини, наприклад, методом, описаним у публікації Marks et al., J. Моl. Вiol., 222: 581-597 (1991), або методом, описаним у публікації (Drum et al., Nucleic Acids Res., 21: 44914498 (1993). Для клонування ампліфікованої ДНК в експресійні вектори, у ПЛР-праймер можуть бути уведені рідкі рестрикцию сайти як мітка біля одного кінця, як описано Orlandi et al. (1989), або таке введення може бути здійснене за допомогою ПЛРампліфікації з використанням міченого праймера, як описано Clackson et al., Nature, 352: 624-628 (1991). Набори синтетично реаранжованих генів V можуть бути отримані in vitro з V-генних сегментів. Більшість сегментів людських генів VH були клоновані й секвеновані (як повідомлялося в публікації Tomlinson et al., J. Моl. Biol., 227: 776-798 (1992)), потім картовані (як повідомлялося в публікації Matsuda et al., Nature Genet., 3: 88-94 (1993); і ці клоновані сегменти (включаючи всі основні конформації петлі Н1 і Н2) можуть бути використані для одержання різних наборів генів VH з використанням ПЛР-праймерів, кодуючих петлі Н3, що мають різні послідовності й різні довжини, як описано в публікації Hoogenboom і Winter, J. Моl. Βiοl., 227: 381-388 (1992). Можуть бути також отримані набори VH, що мають все різноманіття послідовностей, зосереджене в довгій петлі Н3 однієї довжини, як описано в публікації Barbas et al., Proc. Natl Acad Sci USA, 89: 4457-4461 (1992). Були клоновані й секвеновані людські сегменти V і V (як повідомлялося в публікації Williams & Winter, Eur. J. Immunol, 23: 1456-1461 (1993)) і такі сегменти можуть бути використані для одержання синтетичних наборів легких ланцюгів. Набори синтезованих генів V, отриманих на основі складчастої структури ряду VH і VL, і L3 і Н3 різної довжини, будуть кодувати антитіла зі структурою, яка значно варіюється. Після ампліфікації кодуючої ДНК гена V, сегменти гена V зародкової лінії можуть бути реаранжовані in vitro методами, описаними в публікації Hoogenboom and Winter, J. МоІ. Biol., 227: 381-388 (1992). Набори фрагментів антитіл можуть бути сконструйовані шляхом об'єднання наборів генів VH і VL декількома шляхами. Кожний набір може бути створений у різних векторах, і ці вектори піддають 55 рекомбінації in vitro, наприклад, як описано в публікації Hogrefe et al., Gene, 128: 119-126 (1993), або in vivo шляхом комбінаторного інфікування, наприклад, системою ІохР, описаною в публікації Waterhouse et al., Nucl. Acids Res., 21: 2265-2266 (1993). У методі рекомбінації in vivo використовується дволанцюжкова природа Fab-фрагментів для усунення обмеження, що накладається на розмір бібліотеки й пов'язаного з ефективністю трансформації Е. соІі. Вихідні набори VH і VL клонують окремо, один у фагміду, інший - у фаговий вектор. Потім дві бібліотеки об'єднують шляхом інфікування бактерії, що містить фагміду, фагом, так, щоб кожна клітина містила різні комбінації, розмір бібліотеки був обмежений тільки числом 12 присутніх клітин (приблизно 10 клонів). Обидва вектори містять сигнали рекомбінації in vivo, у результаті чого гени VH і VL піддаються рекомбінації з утворенням одного реплікону й спільно впаковуються у фагові віріони. Ці величезні бібліотеки представляють велику кількість різних антитіл з -1 -8 високою афінністю (Kd приблизно 10 М). Альтернативно, такі набори можуть бути послідовно клоновані в той самий вектор, наприклад, як описано в публікації Barbas et al., Proc. Natl. Acad. Sci. USA, 88: 7978-7982 (1991), або вони можуть бути зібрані разом за допомогою ПЛР, потім клоновані, наприклад, як описано в публікації Clackson et al., Nature, 352: 624-628 (1991). ПЛРзборка може бути також здійснена для приєднання ДНК VH і VL до ДНК, що кодує гнучкий пептидний спейсер, з утворенням наборів одноланцюжкових Fv (scFv). У ще одному методі, «ПЛР-Зборка в клітинах» застосовується для об'єднання генів VH і VL у лімфоцитах за допомогою ПЛР із наступним клонуванням наборів зчеплених генів, як описано в публікації Embleton etal.,Nucl. Acids Res., 20: 38313837 (1992). Антитіла, продуковані вихідними бібліотеками (природними або синтетичними), можуть мати не-1 6 7 високу афінність (Kd приблизно від 10 до 10 М 1 ), однак дозрівання афінності може бути також змодельоване in vitro шляхом конструювання й повторного відбору із вторинних бібліотек, як описано в публікації Winter et al. (1994), див. вище. Так, наприклад, мутація може бути уведена випадково in vitro з використанням полімеразної реакції з імовірністю помилки (reported in Leung et al., Technique, 1: 11-15 (1989)) у методі, описаному Hawkins et al., J. Моl. Biol., 226: 889-896 (1992) або методі, описаному Gram et al., Proc. Natl. Acad. Sci USA, 89: 3576-3580 (1992). Крім того, дозрівання афінності може бути здійснене за допомогою випадкової мутації однієї або декількох CDR, наприклад, за допомогою ПЛР, проведеної з використанням праймерів, що несуть рандомізовану послідовність, що охоплює представляючу інтерес CDR в окремо вибраних Fv-клонах, і за допомогою скринінгу клонів з більш високою афінністю. У заявці WO 9607754 (опублікованій 14 березня 1996) описаний метод індукування мутагенезу в гіперваріабельні області легкого ланцюга імуноглобуліну з одержанням бібліотеки генів легкого ланцюга. Іншим ефективним методом є рекомбінація доменів VH або VL, відібраних за допомогою фагового 94464 56 представлення, з наборами природних варіантів V-домену, виділених у неімунізованих донорів, і скринінг на більш високу афінність, проведений у декілька раундів перестановки ланцюгів, як описано в публікації Marks et аІ., Biotechnol, 10: 779-783 (1992). Цей метод дозволяє продукувати антитіла -9 й фрагменти антитіл з афінностями в межах 10 М. Послідовності нуклеїнової кислоти й амінокислотні послідовності DLL4 відомі фахівцям. Послідовність нуклеїнової кислоти, що кодує DLL4, може бути сконструйована з використанням амінокислотної послідовності потрібної області DLL4. Альтернативно, послідовність кДНК (або її фрагменти) депонована в GenBank під per. № ΝΜ_019074. DLL4 являє собою трансмембранний білок. Позаклітинна область містить 8 EGFподібних повторів, також домен DSL, який є консервативним для всіх лігандів Notch і необхідним для зв'язування з рецептором. Передбачений білок також містить трансмембранну область і цитоплазматичний «хвіст», який не містить яких-небудь каталітичних мотивів. Людський білок DLL4 являє собою білок з 685 амінокислот і містить наступні області: сигнальний пептид (амінокислоти 1-25); MNNL (амінокислоти 26-92); DSL (амінокислоти 155-217); EGF-подібну область (амінокислоти 221251); EGF-подібну область (амінокислоти 252-282); EGF-подібну область (амінокислоти 284-322); EGF-подібну область (амінокислоти 324-360); EGF-подібну область (амінокислоти 366-400); EGF-подібну область (амінокислоти 402-438); EGF-подібну область (амінокислоти 440-476); EGF-подібну область (амінокислоти 480-518); трансмембранну область (амінокислоти 529-551); цитоплазматичний домен (амінокислоти 552-685). Людський DLL4 має реєстраційний номер ΝΜ_019074, мишачий DLL4 має реєстраційний номер NM_019074. ДНК, що кодують DLL4, можуть бути отримані різними методами, відомими фахівцям. Такими методами є, але не обмежується ними, хімічний синтез, проведений будь-якими методами, описаними в публікації Engels et al., Agnew. Chem. Int. Ed. Engl, 28: 716-734 (1989), такими як методи з використанням триефіру, фосфіту, фосфорамідиту й Н-фосфонату. В одному з варіантів винаходу, для конструювання DLL4-кодуючої ДНК використовують кодони, що є переважними при експресії в клітинах-хазяях. Альтернативно, ДНК, що кодує DLL4, може бути виділена з геномної бібліотеки або бібліотеки кДНК. Після конструювання молекули ДНК, що кодує DLL4, цю молекулу ДНК функціонально приєднують до послідовності регуляції експресії в експресійному векторі, такому як, плазміда, де вказана регуляторна послідовність розпізнається клітиноюхазяєм, трансформованою даним вектором. В загальних рисах, плазмідні вектори містять послідовності реплікації й регуляторні послідовності, що походять від видів, сумісних із клітиною-хазяєм. Такий вектор звичайно містить сайт реплікації, також послідовності, що кодують білки, що дозволяють здійснювати фенотиповий відбір у трансформованих клітинах. Прийнятні вектори для екс 57 пресії в прокаріотичних і в еукаріотичних клітинаххазяях відомі фахівцям, і деякі з них більш докладно описані нижче. При цьому, можуть бути використані еукаріотичні організми, такі як дріжджі, або клітини, що походять від багатоклітинних організмів, таких як ссавці. ДНК, що кодує DLL4, може бути, але необов'язково, функціонально приєднана до секреторної лідерної послідовності, що може приводити до секреції продукту експресії клітиною-хазяєм у культуральному середовищі. Прикладами секреторних лідерних послідовностей є stll, екотин, lamB, ГД (глутамат-дегідрогеназа) вірусу герпеса, Ірр, лужна фосфотаза, інвертаза й альфа-фактор. У даному винаході може бути також використана лідерна послідовність білка А, що складається з 36 амінокислот (Abrahmsen et al., EMBO J., 4: 3901 (1985)). Клітини-хазяї трансфікують, переважно, трансформують вищеописаними експресійними або клонуючими векторами відповідно до винаходу й культивують у прийнятних поживних середовищах, модифікованих, якщо це необхідно, для індукування промоторів, відбору трансформантів або ампліфікації генів, що кодують потрібні послідовності. Термін «трансфекція» означає поглинання експресійного вектора клітиною-хазяєм, незалежно від того, чи експресує вона які-небудь кодуючі послідовності чи ні. Різні методи трансфекції відомі середньому фахівцеві в даній галузі, і такими методами є, наприклад, СаРО4-преципітація й електропорація. Успішну трансфекцію звичайно визначають по будь-якій ознаці, що вказує на присутність вказаного вектора в клітині-хазяї. Методи трансфекції добре відомі фахівцям, і деякі з них більш докладно описані в даній заявці. Термін «трансформація» означає введення ДНК в організм так, щоб вона могла реплікуватися як позахромосомний елемент або як хромосомний компонент. Залежно від використовуваної клітинихазяя, трансформацію здійснюють із застосуванням стандартних методів, що підходять для таких клітин. Методи трансформації добре відомі фахівцям, і деякі з них більш докладно описані в даній заявці. Прокаріотичні клітини-хазяї, використовувані для продукування DLL4, можуть бути культивовані, в основному, як описано в керівництві Sambrook et al., див. вище. Клітини-хазяї ссавців, які використовуються для продукування DLL4, можуть бути культивовані в різних середовищах, які добре відомі фахівцям, і деякі з яких описані в даній заявці. Клітини-хазяї, описані в даній заявці, включають клітини в культурі in vitro, також клітини тварини-хазяя. Очищення DLL4 може бути здійснене добре відомими методами, деякі з яких описані в даній заявці. Очищені DLL4 можуть бути зв'язані з відповідною матрицею, такою як сфери з агарозним гелем, акриламідні сфери, скляні кульки, целюлоза, різні акрилові співполімери, гідроксилметакрилатні гелі, співполімери поліакрилової й поліметакрилової кислоти, найлон, нейтральні й іонні носії й т.п., з 94464 58 метою їхнього використання в афінній хроматографії для поділу клонів, представлених на фагах. Приєднання білка DLL4 до матриці може бути здійснене будь-якими методами, описаними в Methods in Enzymology, vol. 44 (1976). Методи, звичайно застосовувані для приєднання лігандів білків до полісахаридних матриць, наприклад, агарози, декстрану або целюлози, включають активацію носія ціангалогенідами й наступне зв'язування первинних аліфатичних або ароматичних амінів пептидних лігандів з активованою матрицею. Альтернативно, DLL4 може бути використаний для покриття ямок адсорбційних планшетів і експресований на клітинах-хазяях, прикріплених до адсрорбційних планшетів, або він може бути використаний у клітинному сортингу або кон'югований з біотином для зв'язування зі сферами, покритими стрептавідином, або він може бути використаний у будь-якому іншому відомому методі для пеннінгу бібліотек фагового представлення. Зразки фагових бібліотек піддають контактуванню з іммобілізованим DLL4 в умовах, що підходять для зв'язування щонайменше частини фагових частинок з адсорбентом. Звичайно, для імітації фізіологічних умов вибирають відповідні рН, іонну силу, температуру й т.п. Фаги, пов'язані із твердою фазою, промивають, потім елююють кислотою, наприклад, як описано в публікації Barbas et al., Proc. Natl. Acad. Sci USA, 88: 7978-7982 (1991), або лугом, наприклад, як описано в публікації Marks et al., J. Моl. Вiol., 222: 581-597 (1991), або шляхом конкурентного зв'язування з антигеном DLL4, наприклад, відповідно до процедури, аналогічній процедурі, здійснюваній в методі конкурентного зв'язування з антигеном, як описано в публікації Clackson et al., Nature, 352: 624-628 (1991). Фаги можуть бути піддані 1000-кратному збагаченню в одному раунді відбору. Крім того, збагачені фаги можуть бути вирощені в бактеріальній культурі й піддані додатковим раундам відбору. Ефективність відбору залежить від багатьох факторів, включаючи кінетику дисоціації під час промивання, і від здатності множини фрагментів антитіла одночасно зв'язуватися з антигеном на одному фагу. Антитіла зі швидкою кінетикою дисоціації (і слабкою афінністю зв'язування) можуть бути фіксовані завдяки короткочасним промиванням, застосуванню мультивалентного фагового представлення й високої щільності покриття антигену на твердій фазі. Така висока щільність не тільки дозволяє стабілізувати фаг завдяки мультивалентним взаємодіям, але також сприяє повторному зв'язуванню фага, що є дисоційованим. Відбір антитіл зі слабкою кінетикою дисоціацією (і з високою афінністю зв'язування) може бути поліпшений завдяки більш тривалим промиванням і застосуванню моновалентного фагового представлення, описаного в публікації Bass et al., Proteins, 8: 309-314 (1990) і в WO 92/09690, також завдяки низькій щільності покриття антигену, як описано в публікації Marks et al., BiotechnoІ, 10: 779-783 (1992). Може бути проведений відбір між фаговими антитілами з різними афінностями, навіть із афінністю, яка не дуже відрізняється, по відношенню 59 до DLL4. Однак випадкова мутація вибраного антитіла (наприклад, внесена при здійсненні деяких з описаних вище методів дозрівання афінності), імовірно, буде приводити до утворення множини мутантів, більшість із яких будуть зв'язуватися з антигеном, деякі з них із ще більшою афінністю. При обмеженому рівні DLL4, не кожен фаг з високою афінністю може витримати таку конкуренцію. Для збереження всіх мутантів з більш високою афінністю, фаги можуть бути інкубовані з надлишком біотинільованого DLL4, але цей біотинільований DLL4 повинен мати більш низьку молярну концентрацію, ніж молярна константа афінності мішені для DLL4. Потім фаги з високою афінністю зв'язування можуть бути захоплені парамагнітними сферами, покритими стрептавідином. Таке «рівноважне захоплення» дає можливість проводити відбір антитіл по їх афінності зв'язування із чутливістю, що дозволяє з великого надлишку фагів з меншою афінністю виділити мутантні клони, що мають лише у два рази більш високуафінність. Умови, використовувані для промивання фагів, пов'язаних із твердою фазою, можуть бути також змінені для виявлення їхніх відмінностей виходячи з кінетики дисоціації. Клони анти-DLL4-антитіл можуть бути відібрані по їхній активності. В одному зі своїх варіантів, даний винахід належить до анти-DLL4-антитіл, які блокують зв'язування рецептора Notch (такого як Notch1, Notch2, Notch3 і/або Notch4) з DLL4, але не блокують зв'язування рецептора Notch із другим білком. Fv-клони, що відповідають таким антиDLL4-антитілам, можуть бути відібрані шляхом: (1) виділення клонів анти-DLL4-антитіл з фагової бібліотеки як описано вище, і, але необов'язково, ампліфікації виділеної популяції фагових клонів шляхом культивування такої популяції в прийнятному бактеріальному хазяї; (2) вибору DLL4 і другого білка, проти якого необхідно продукувати блокуючу й не-блокуючу активність, відповідно; (3) адсорбції фагових клонів анти-DLL4-антитіл на іммобілізованому DLL4; (4) використання надлишку другого білка для елюювання будь-яких небажаних клонів, що розпізнають DLL4-зв'язувальні детермінанти, які перекриваються зі зв'язувальними детермінантами другого білка або мають спільні з ним зв'язувальні детермінанти; і (5) елюювання клонів, які залишаються адсорбованими після проведення стадії (4). Клони з потрібними блокуючими/неблокуючими властивостями, можуть бути також, але необов'язково, збагачені шляхом проведення однієї або декількох повторних процедур відбору, описаних у даній заявці. ДНК, що кодує продуковані гібридомою моноклональні антитіла або Fv-клони фагового представлення відповідно до винаходу, можуть бути легко виділені й секвеновані відповідно до стандартних процедур (наприклад, з використанням олігонуклеотидних праймерів, які здатні специфічно ампліфікувати представляючі інтерес кодуючі області важкого й легкого ланцюгів з гібридоми або фагової Днк-матриці). Після виділення, ця ДНК може бути убудована в експресійні вектори, які потім трансфікують у клітини-хазяї, такі як клітини Е.соlі, мавпячі клітини СО, клітини яєчника китайського 94464 60 хом'ячка (СНО) або мієломні клітини, які, в інших випадках, не продукують білок імуноглобуліну, у результаті чого в цих рекомбінантних клітинаххазяях синтезуються потрібні моноклональні антитіла. Обговорення рекомбінантної експресії антитіло-кодуючої ДНК у бактеріях можна знайти в оглядових статтях Skerra et al., Curr. Opinion in Immunol., 5:256-262 (1993) і Pluckthun, Immunol. Revs., 130:151-188 (1992). ДНК, коду.хf Fv-клони відповідно до винаходу, може бути об'єднана з відомими послідовностями ДНК, що кодують константні області важкого ланцюга і/або легкого ланцюга (наприклад, відповідає послідовності ДНК можуть бути отримані, як описано в публікації Kabat et al., див. вище) з утворенням клонів, що кодують повнорозмірні важкі і/або легкі ланцюги або їхні фрагменти. Слід зазначити, що в цих цілях можуть бути використані константні області будь-якого ізотипе, включаючи константні області IgG, IgM, IgA, IgD i IgE, і такі константні області можуть бути отримані від людини або тварин будь-яких видів. У визначення використовуваного тут терміна «химерне» і «гібридне» антитіло входить Fv-клон, що походить від ДНК варіабельного домену тварини одного виду (наприклад, людини), що був потім приєднаний до ДНК константної області тварини іншого виду з утворенням кодуючої(их) послідовності(ей) «гібрида» повнорозмірного важкого ланцюга і/або легкого ланцюга. У переважному варіанті винаходу, Fvклон, що походить від ДНК людського варіабельного домену, приєднують до ДНК людської константної області з утворенням кодуючої(их) послідовності(ей) для всіх людських повнорозмірних важких і/або легких ланцюгів і/або їхніх фрагментів. ДЕК, що кодує анти-DLL4-антитіло, що походить від гібридоми відповідно до винаходу, може бути також модифікована, наприклад, шляхом заміни гомологічних мишачих послідовностей, що походять від гібридомного клону, кодуючою послідовністю для людських константних доменів важкого й легкого ланцюгів (наприклад, як у способі, описаному Morrison et al., Proc. Natl. Acad. Sci. USA, 81: 6851-6855 (1984)). ДНК, що кодує антитіло, що походить від гібридоми або Fv-клону або його фрагмент, може бути також модифікована шляхом ковалентного зв'язування імуноглобулінкодуючої послідовності з повнорозмірною послідовністю, що кодує не-імуноглобуліновий поліпептид, або з її частиною. Таким чином можуть бути отримані «химерні» або «гібридні» антитіла, що мають специфічність зв'язування з антитілами, що походять від Fv-клону або гібридомного клону. Фрагменти антитіл Даний винахід охоплює фрагменти антитіл. У деяких випадках переважніше використовувати фрагменти антитіл, не повнорозмірні антитіла. Чим менший розмір фрагментів, тим швидший їхній кліренс і вища ймовірність поліпшення доставки в солідні пухлини. Для одержання фрагментів антитіл були розроблені різні методи. Традиційно, ці фрагменти утворюються в результаті протеолітичного розщеплення інтактних антитіл (див., наприклад,
ДивитисяДодаткова інформація
Назва патенту англійськоюIsolated anti-dll4 antibody and methods using same
Автори англійськоюYan Minhong, Wu Yan
Назва патенту російськоюВыделенное антитело к dll4 и его применение
Автори російськоюЯнь Минхонг, Ву Ян
МПК / Мітки
МПК: A61K 39/395, C12P 21/08, C07K 16/18, C12N 15/13, A61P 35/00, G01N 33/577
Мітки: застосування, виділене, антитіло
Код посилання
<a href="https://ua.patents.su/101-94464-vidilene-antitilo-do-dll4-ta-jjogo-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Виділене антитіло до dll4 та його застосування</a>
Попередній патент: Статор електричної машини
Наступний патент: Комбіновані препарати з вмістом біфепруноксу та l-dopa
Випадковий патент: Спосіб профілактики кандидозу слизової оболонки порожнин рота у хворих на цукровий діабет