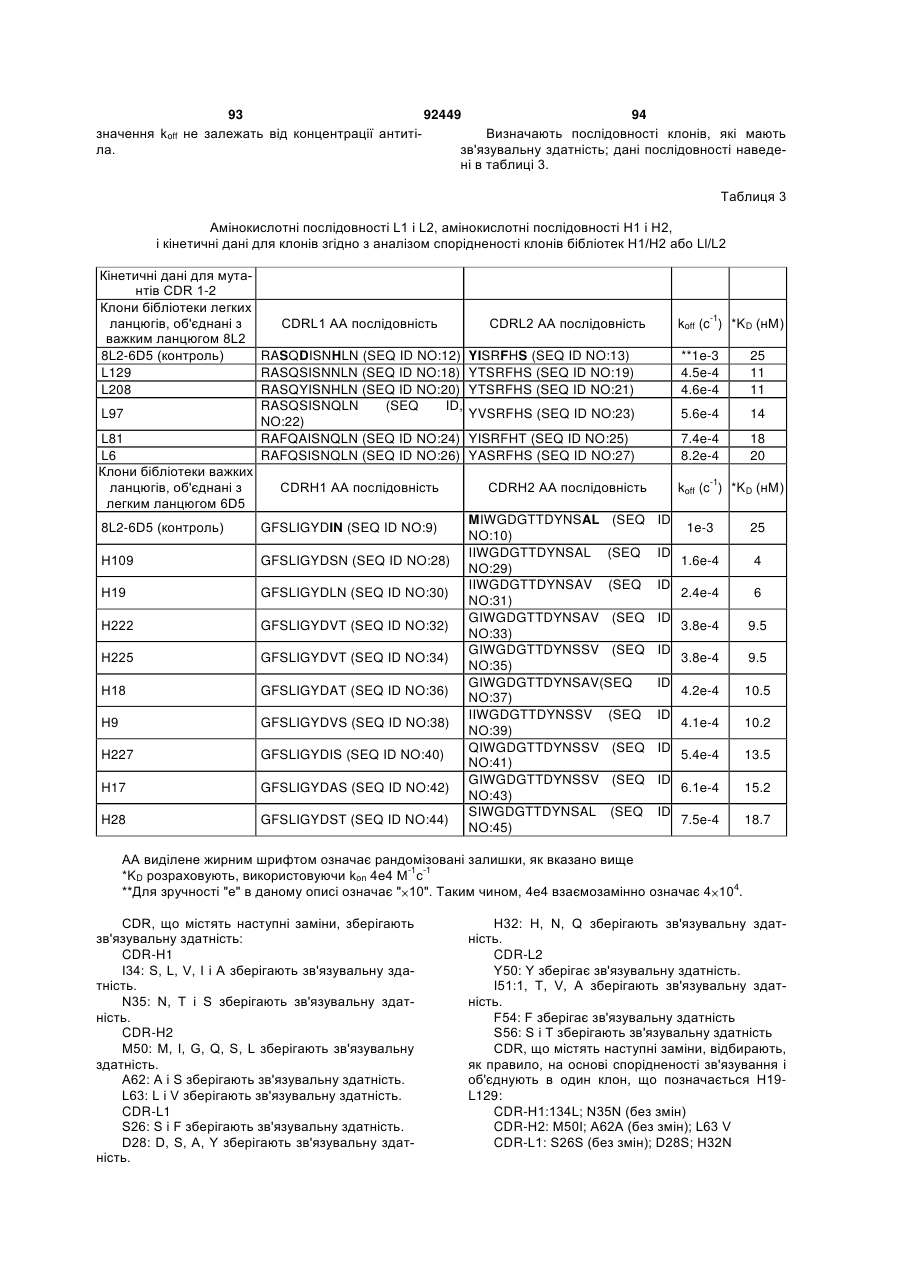
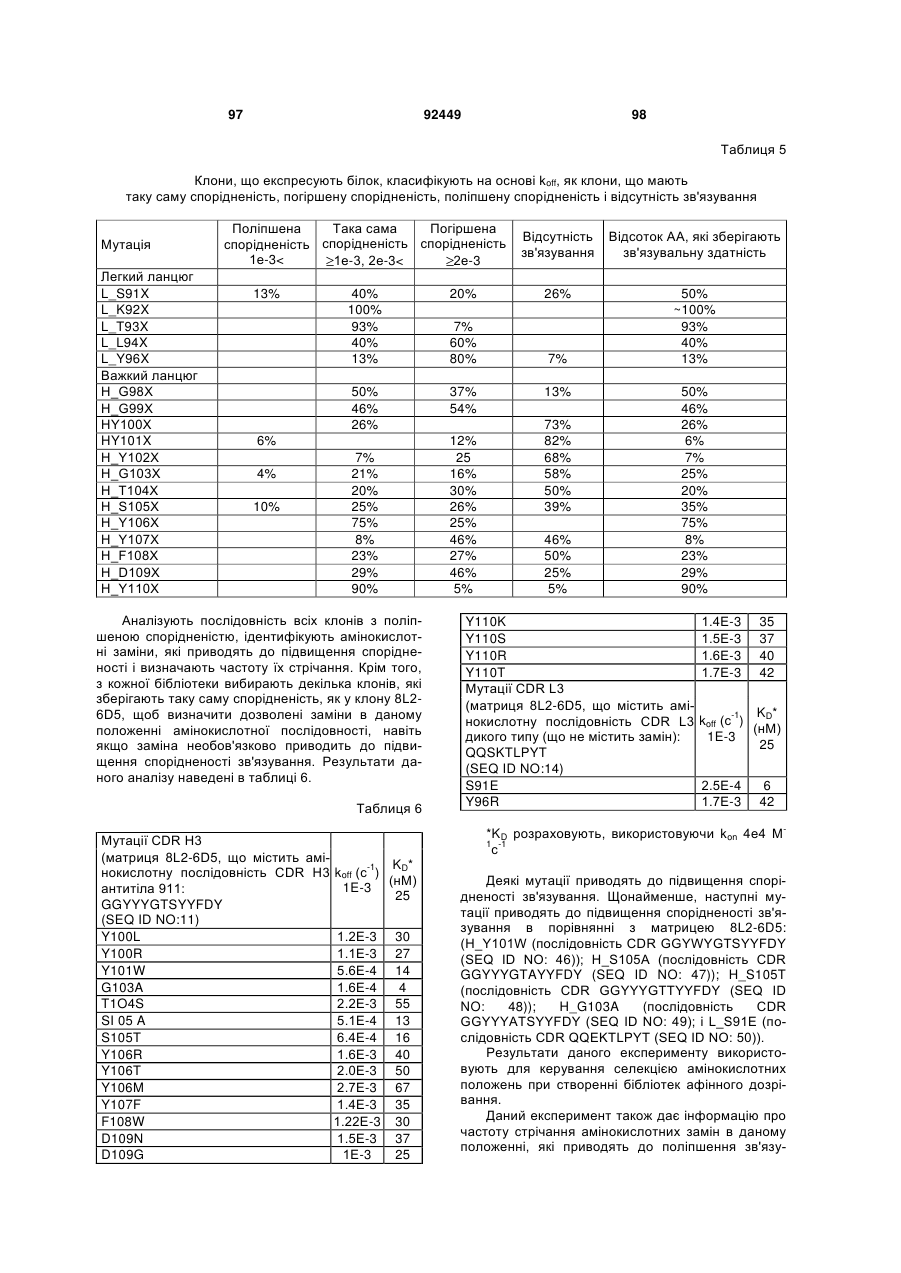
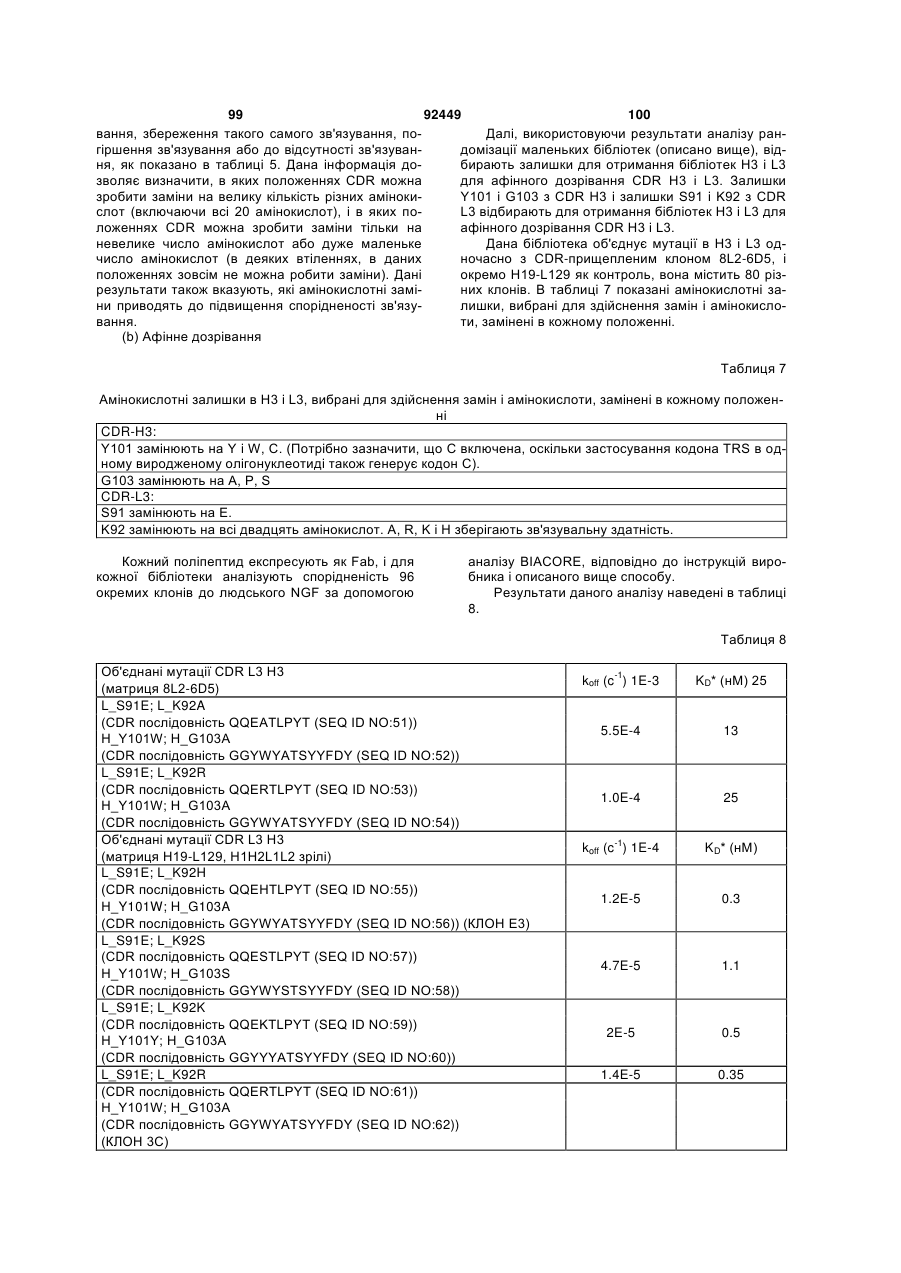
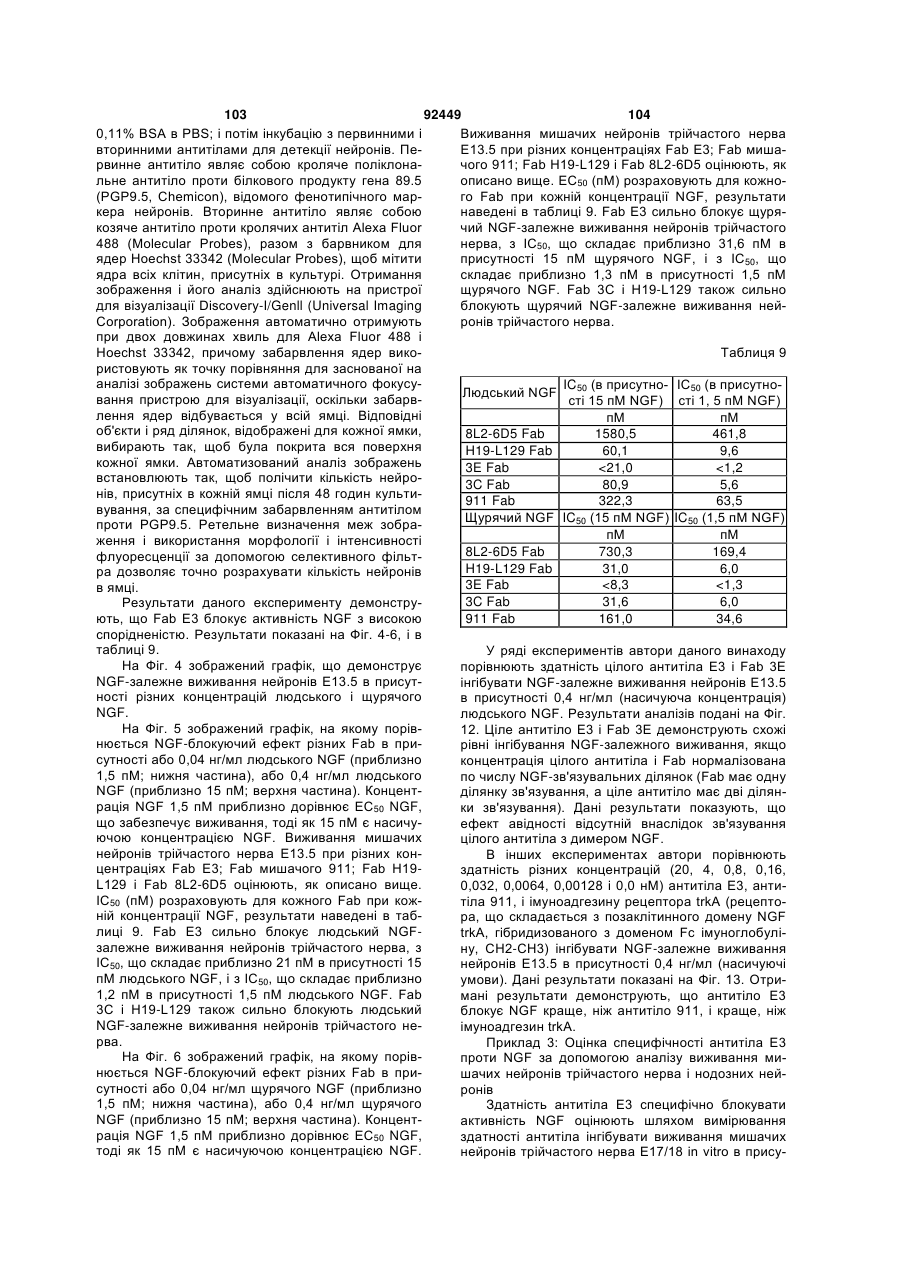
Антитіло проти ngf і спосіб його застосування
Формула / Реферат
1. Антитіло проти фактора росту нервів (NGF) або його фрагмент, що містять
(a) варіабельну область важкого ланцюга, що включає:
(i) ділянку CDR1 послідовності SEQ ID NO: 30;
(ii) ділянку CDR2 послідовності SEQ ID NO: 31;
(iii) ділянку CDR3, вибрану із групи, що складається з послідовностей SEQ ID NO: 5, 58, 60, 62 і 64; і
(b) варіабельну область легкого ланцюга, що включає:
(i) ділянку CDR1 послідовності SEQ ID NO: 18;
(ii) ділянку CDR2 послідовності SEQ ID NO: 19;
(iii) ділянку CDR3, вибрану із групи, що складається з послідовностей SEQ ID NO: 8, 57, 59, 61 і 63, причому варіабельна ділянка важкого ланцюга містить заміну V71К.
2. Антитіло або його фрагмент за п. 1, де антитіло або його фрагмент містить варіабельну область важкого ланцюга, що включає:
(a) ділянку CDR1, представлену в SEQ ID NO: 3;
(b) ділянку CDR2, представлену в SEQ ID NO: 4; і
(c) ділянку CDR3, представлену в SEQ ID NO: 5;
де антитіло зв'язується з NGF.
3. Антитіло або його фрагмент за п. 1, де антитіло або його фрагмент містить варіабельну область легкого ланцюга, що включає:
(a) ділянку CDR1, представлену в SEQ ID NO: 6;
(b) ділянку CDR2, представлену в SEQ ID NO: 7; і
(c) ділянку CDR3, представлену в SEQ ID NO: 8;
де антитіло зв'язується з NGF.
4. Антитіло або його фрагмент за п. 3, де антитіло або його фрагмент також містить варіабельну область важкого ланцюга, що включає:
(a) ділянку CDR1, представлену в SEQ ID NO: 3;
(b) ділянку CDR2, представлену в SEQ ID NO: 4; і
(c) ділянку CDR3, представлену в SEQ ID NO: 5.
5. Антитіло або його фрагмент за будь-яким з попередніх пунктів, де антитіло або його фрагмент також містить константну ділянку важкого ланцюга людського IgG2a.
6. Антитіло або його фрагмент за п. 5, де антитіло або його фрагмент також містить константну ділянку людського легкого ланцюга каппа.
7. Антитіло або його фрагмент за п. 5 або 6, в якому константна ділянка важкого ланцюга людського IgG2a є модифікованою.
8. Антитіло або його фрагмент за п. 7, в якому константна ділянка важкого ланцюга людського IgG2a містить мутації А330P331 на S330S331, нумерація амінокислот проводиться з посиланням на послідовність IgG2a дикого типу.
9. Антитіло або його фрагмент за будь-яким з попередніх пунктів, де варіабельна область важкого ланцюга містить послідовність, представлену в SEQ ID NO: 1.
10. Антитіло або його фрагмент за будь-яким з попередніх пунктів, де варіабельна область легкого ланцюга містить послідовність, представлену в SEQ ID NO: 2.
11. Антитіло або його фрагмент за будь-яким з попередніх пунктів, де важкий ланцюг містить амінокислотну послідовність, представлену в SEQ ID NO: 16.
12. Антитіло або його фрагмент за будь-яким з попередніх пунктів, де легкий ланцюг містить амінокислотну послідовність, представлену в SEQ ID NO: 17.
13. Антитіло або його фрагмент за будь-яким з попередніх пунктів, де антитіло або його фрагмент зв'язується з людським NGF з KD, що становить приблизно 100 пМ або менше.
14. Антитіло або його фрагмент за п. 13, де антитіло або його фрагмент також зв'язується з NGF гризунів.
15. Антитіло проти NGF або його фрагмент, що містять:
(a) варіабельну область важкого ланцюга, що містить послідовність SEQ ID NO: 1; і
(b) варіабельну область легкого ланцюга, що містить послідовність SEQ ID NO: 2.
16. Антитіло проти NGF або його фрагмент, що містять:
(a) важкий ланцюг, що містить амінокислотну послідовність SEQ ID NO: 16; і
(b) легкий ланцюг, що містить амінокислотну послідовність SEQ ID NO: 17.
17. Фармацевтична композиція, що містить (a) антитіло або його фрагмент за будь-яким з попередніх пунктів і (b) фармацевтично прийнятний наповнювач.
18. Набір, що містить антитіло або його фрагмент за будь-яким з пп. 1-16.
19. Спосіб одержання антитіла або його фрагмента за будь-яким з пп. 1-16, що включає експресію in vitro полінуклеотиду, що кодує антитіло або його фрагмент за будь-яким з пп. 1-16, у клітині-хазяїні, відмінній від людської клітини.
20. Спосіб лікування болю при ревматоїдному артриті у суб'єкта, що включає введення суб'єктові ефективної кількості антитіла або його фрагмента за будь-яким з пп. 1-16.
21. Спосіб за п. 20, де полегшення болю відбувається протягом приблизно 24 годин після введення суб'єкту антитіла проти NGF або його фрагмента.
22. Спосіб за п. 20, де полегшення болю відбувається протягом приблизно чотирьох днів після введення суб'єкту антитіла проти NGF або його фрагмента.
23. Спосіб за п. 20, де антитіло проти NGF або його фрагмент специфічно зв'язується з людським NGF.
24. Спосіб за п. 20, де антитіло проти NGF являє собою антитіло або його фрагмент, що містять амінокислотні послідовності, представлені в SEQ ID NO: 1 і 2.
25. Спосіб за п. 20, де суб'єктом є людина.
26. Спосіб лікування запальної кахексії, пов'язаної з ревматоїдним артритом, у суб'єкта, що включає введення суб'єктові ефективної кількості антитіла або його фрагмента за будь-яким з пп. 1-16.
27. Спосіб за п. 26, де антитіло проти NGF або його фрагмент специфічно зв'язується з людським NGF.
28. Спосіб за п. 26, де антитіло проти NGF являє собою антитіло або його фрагмент, що містять амінокислотні послідовності, представлені в SEQ ID NO: 1 і 2.
29. Спосіб п. 26, де суб'єктом є людина.
30. Спосіб лікування болю при остеоартриті у суб'єкта, що включає введення суб'єктові ефективної кількості антитіла або його фрагмента за будь-яким з пп. 1-16.
31. Спосіб за п. 30, де антитіло проти NGF або його фрагмент специфічно зв'язується з людським NGF.
32. Спосіб за п. 30, де антитіло проти NGF являє собою антитіло або його фрагмент, що містять амінокислотні послідовності, представлені в SEQ ID NO: 1 і 2.
33. Спосіб п. 30, де суб'єктом є людина.
34. Спосіб лікування болю в суб'єкта, що включає введення суб'єктові ефективної кількості антитіла або його фрагмента за будь-яким з пп. 1-16.
35. Спосіб за п. 34, де антитіло проти NGF або його фрагмент специфічно зв'язується з людським NGF.
36. Спосіб за п. 34, де антитіло проти NGF являє собою антитіло або його фрагмент, що містять амінокислотні послідовності, представлені в SEQ ID NO: 1 і 2.
37. Спосіб п. 34, де суб'єктом є людина.
38. Виділений полінуклеотид, що містить нуклеотидну послідовність, яка кодує антитіло або його фрагмент за будь-яким з пп. 1-16.
39. Полінуклеотид за п. 38, де полінуклеотид містить нуклеотидну послідовність, представлену в SEQ ID NO:65.
40. Полінуклеотид за п. 38, де полінуклеотид містить нуклеотидну послідовність, представлену в SEQ ID NO:66.
41. Полінуклеотид за п. 38, де полінуклеотид містить нуклеотидну послідовність, представлену в SEQ ID NO:67.
42. Полінуклеотид за п. 38, де полінуклеотид містить нуклеотидну послідовність, представлену в SEQ ID NO:68.
43. Полінуклеотид за п. 38, де полінуклеотид містить нуклеотидну послідовність, представлену в SEQ ID NO:66 і нуклеотидну послідовність, представлену в SEQ ID NO:68.
44. Вектор, який містить полінуклеотид, що містить нуклеотидну послідовність, яка кодує антитіло або його фрагмент за будь-яким з пп. 1-16.
45. Ізольована клітина-хазяїн, яка містить полінуклеотид, що містить нуклеотидну послідовність, яка кодує антитіло або його фрагмент за будь-яким з пп. 1-16.
Текст
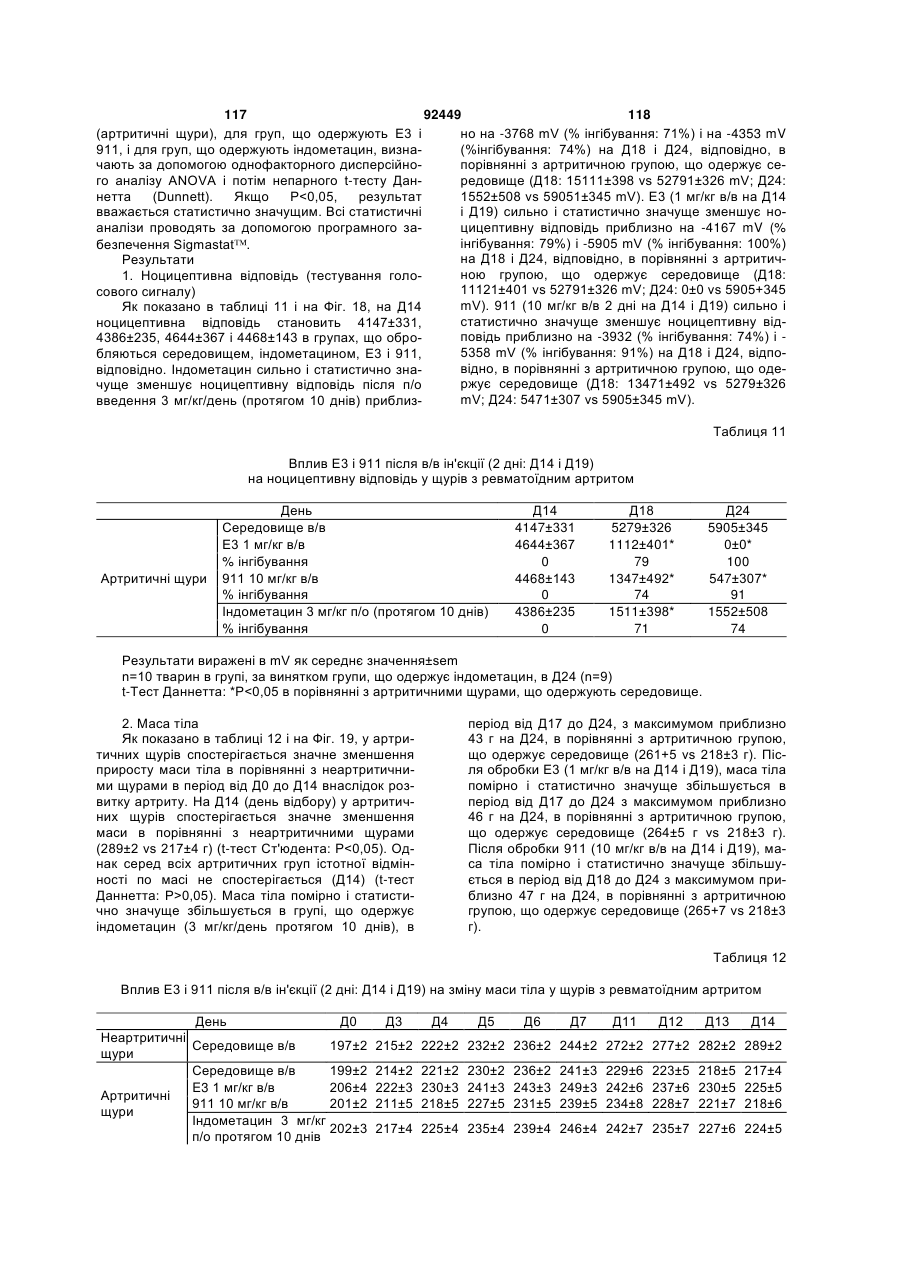
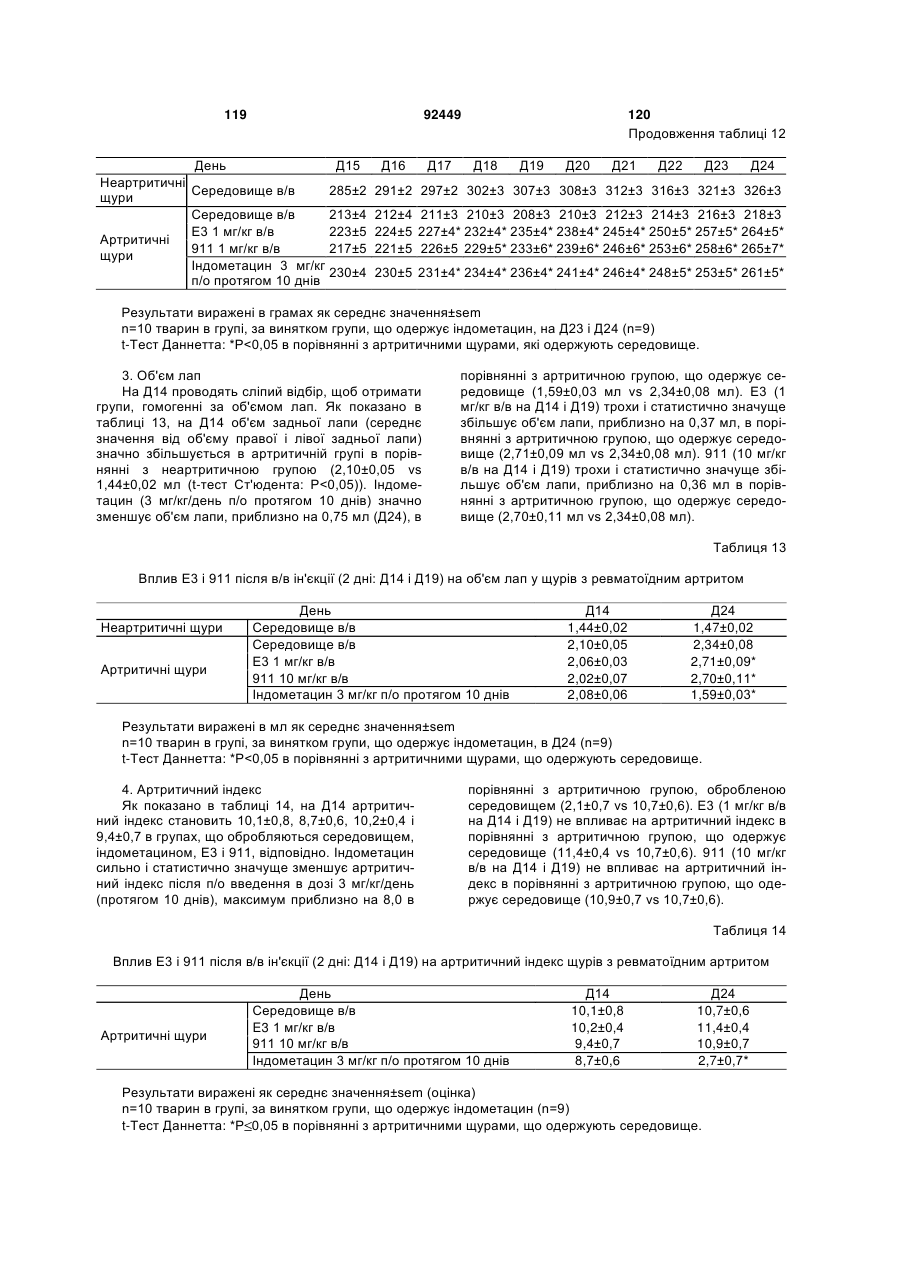
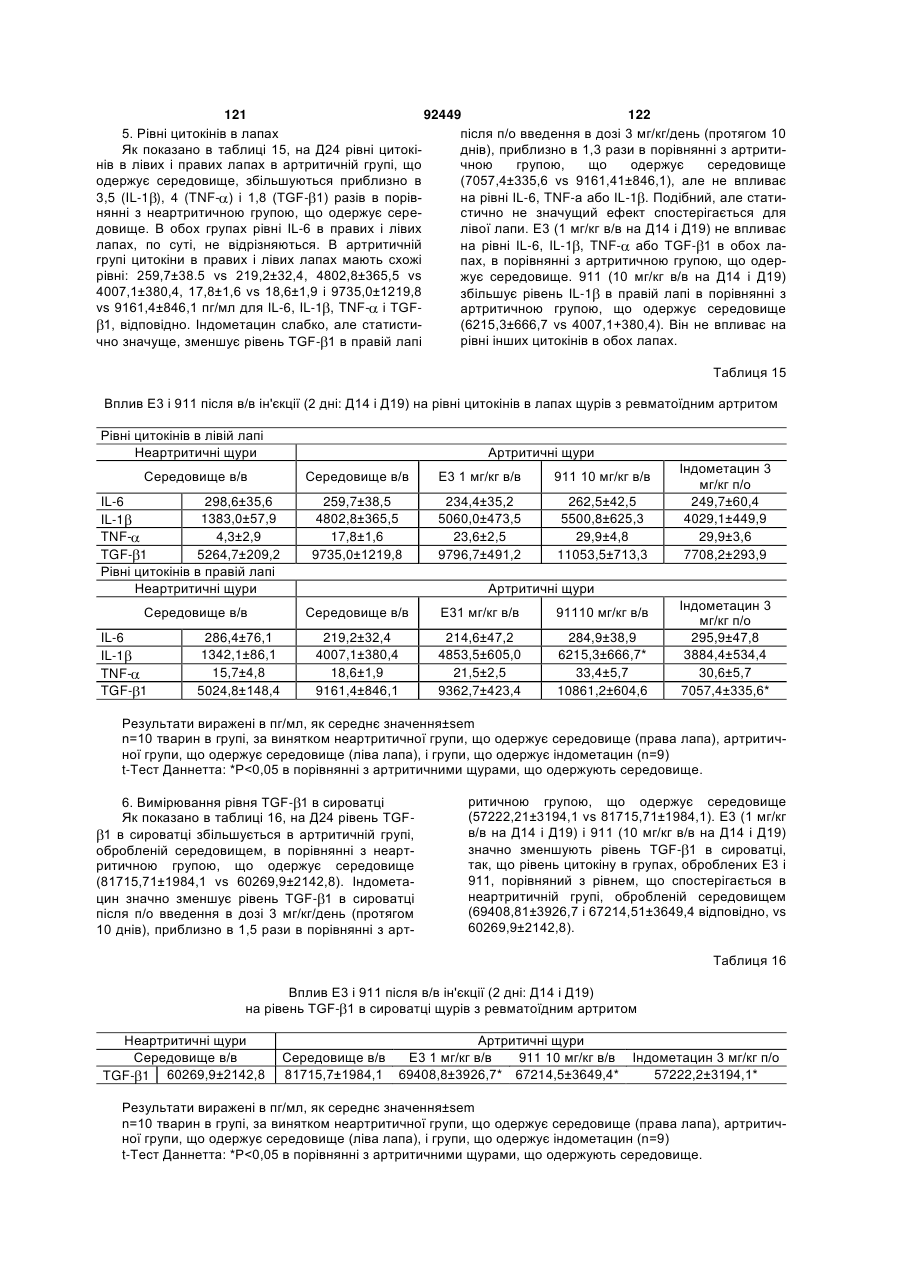
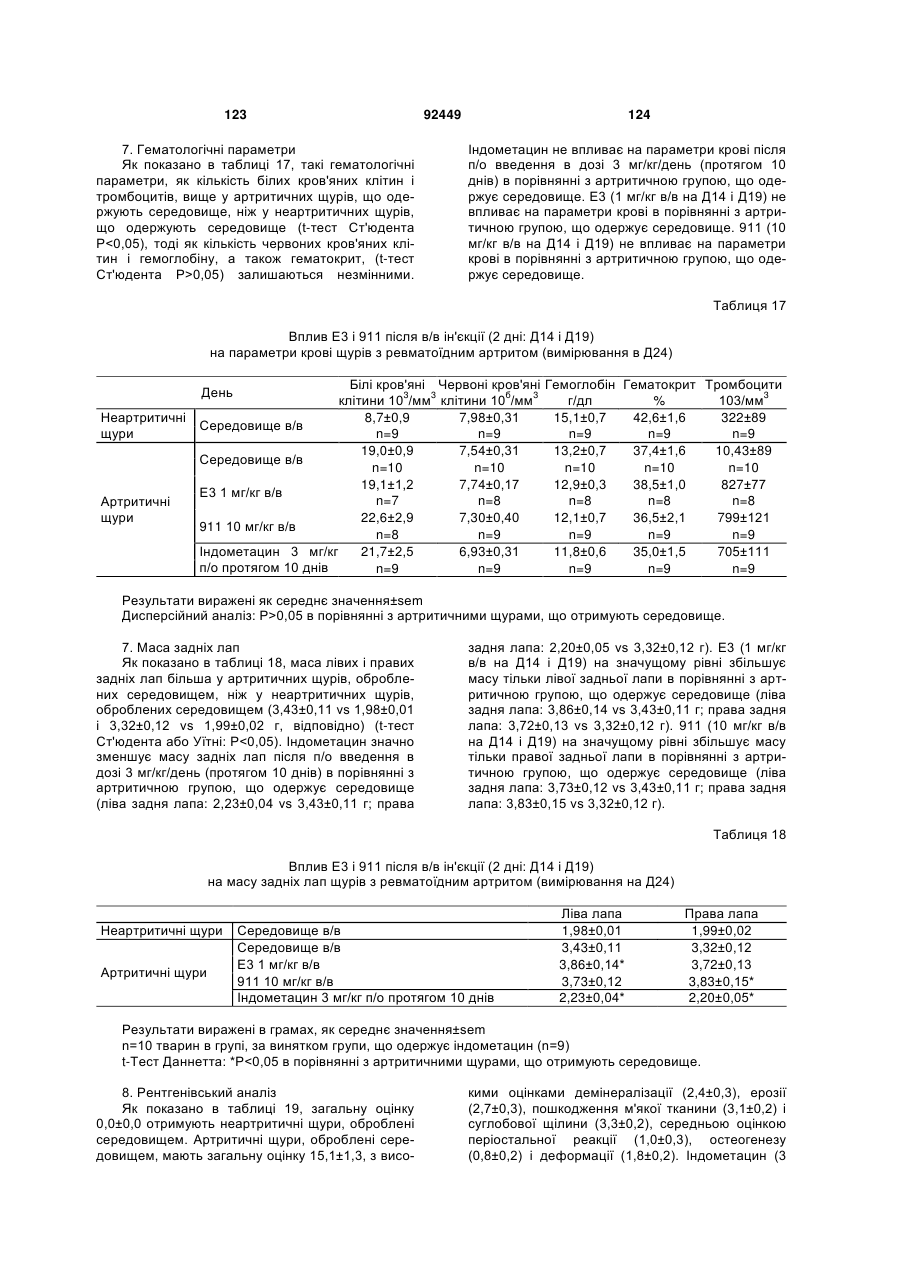
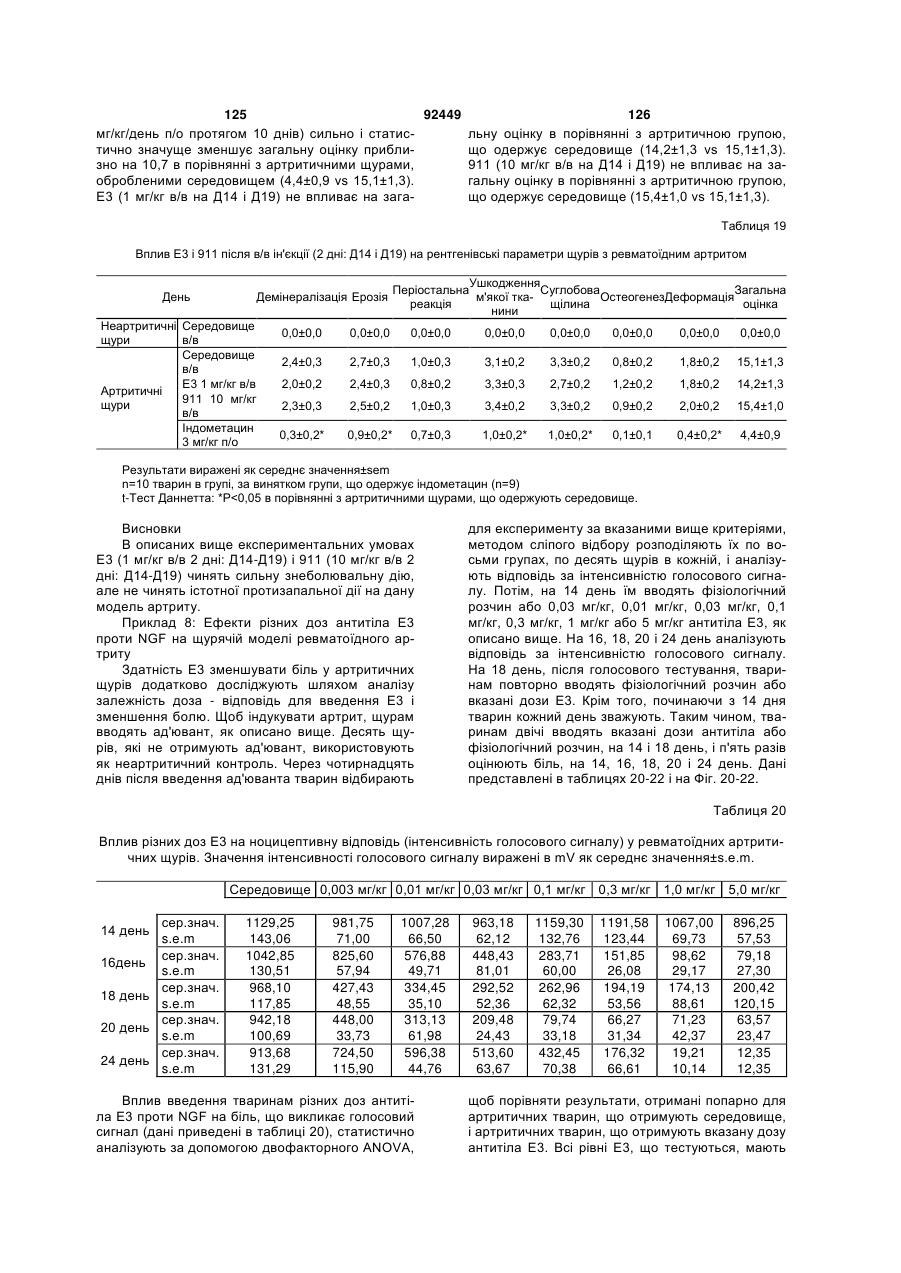
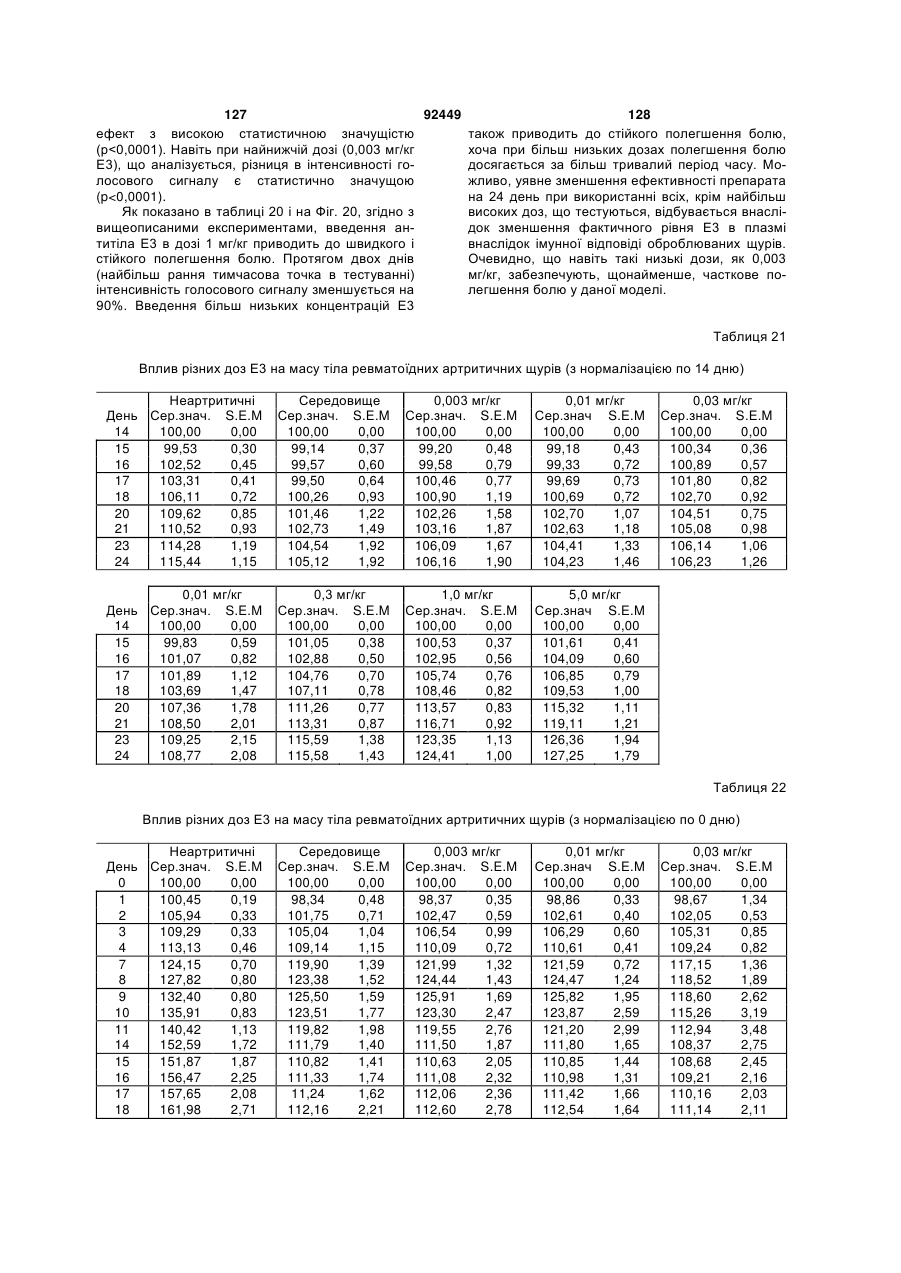
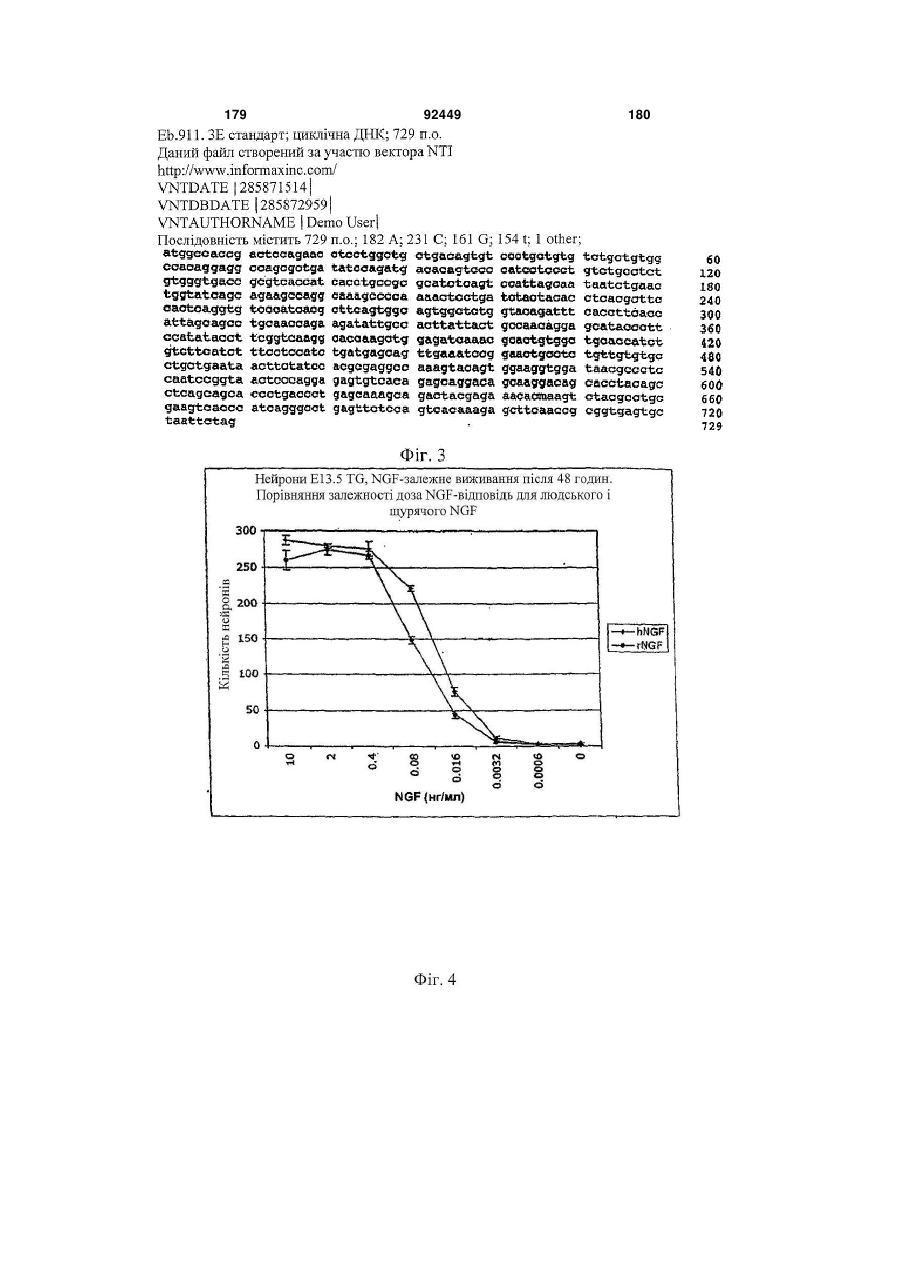
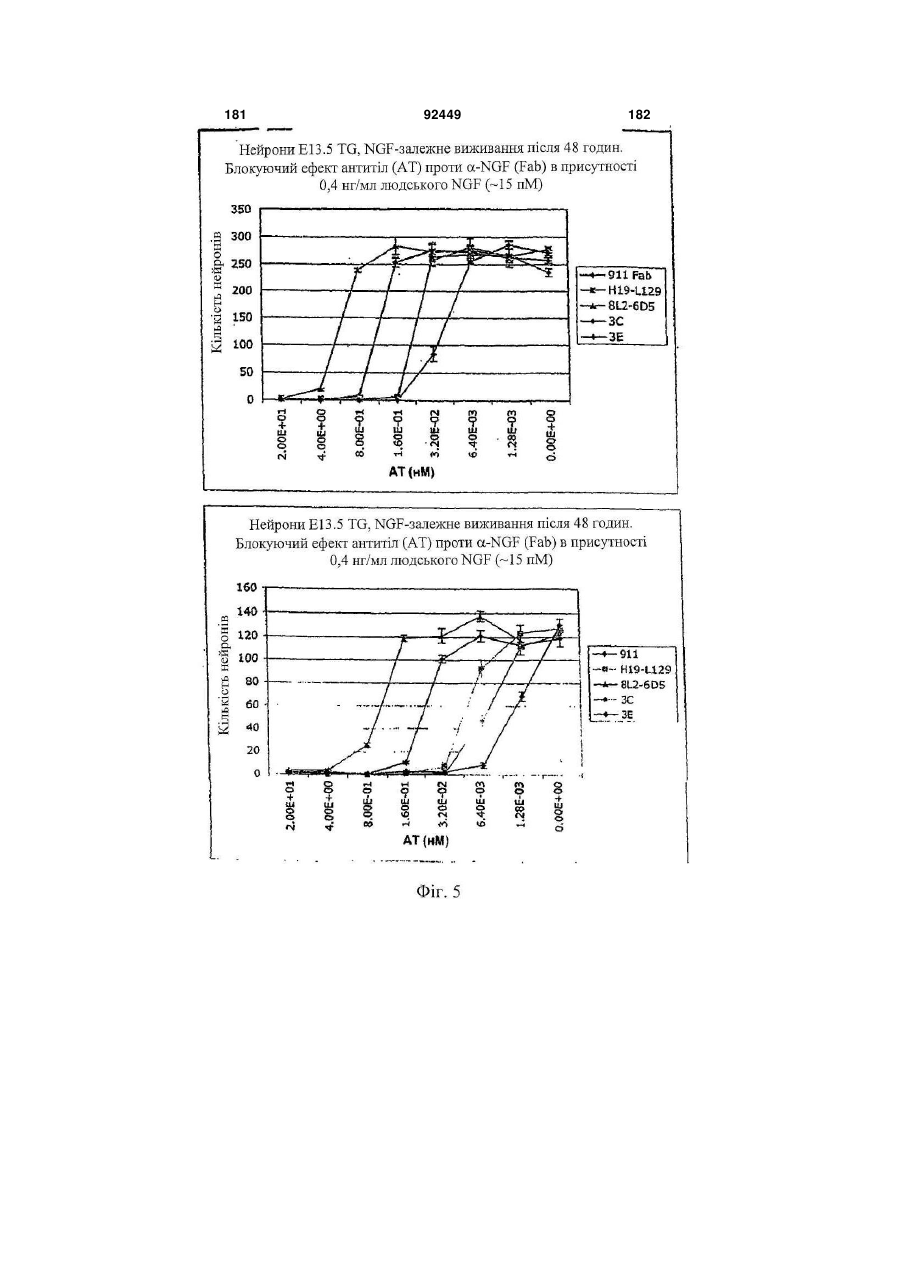
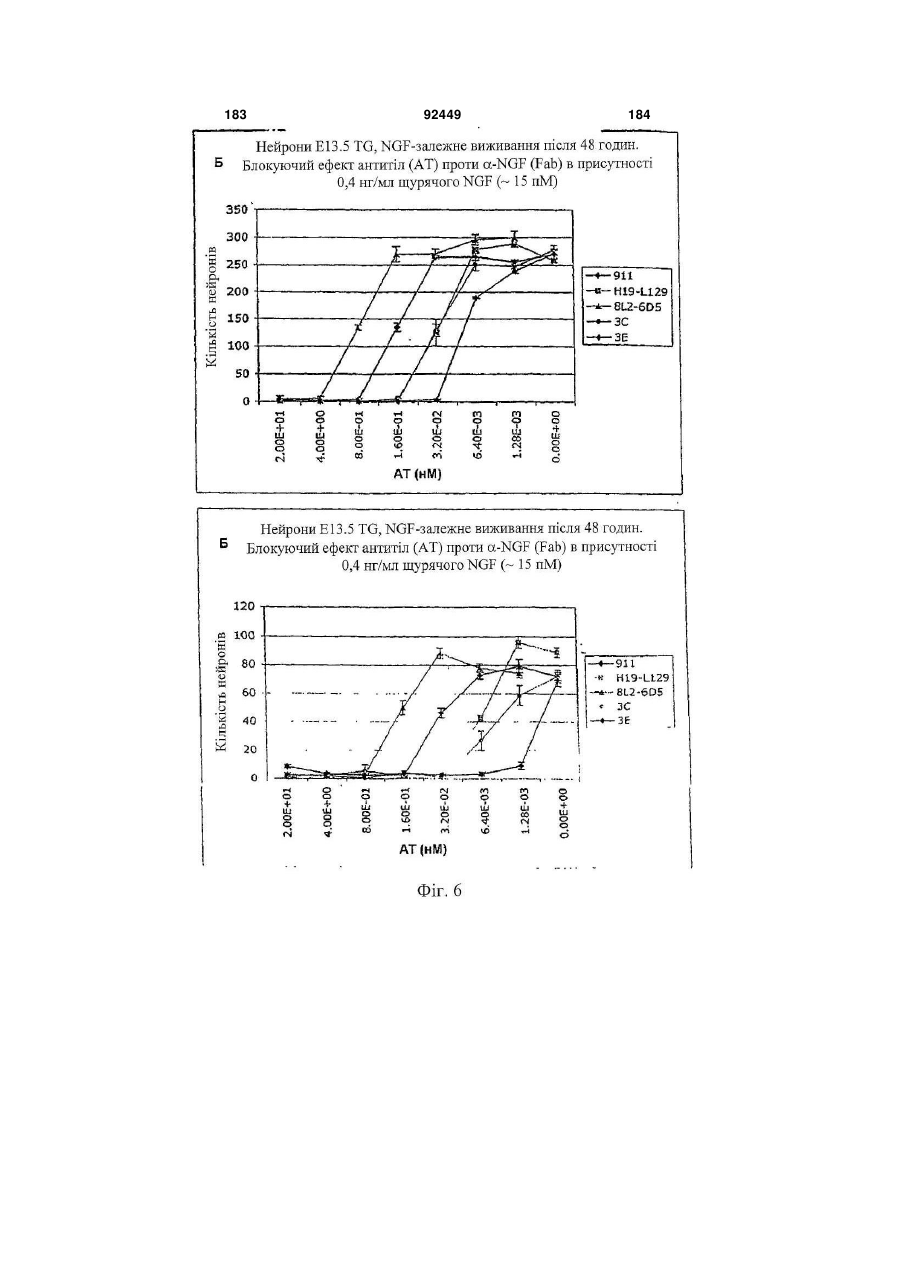
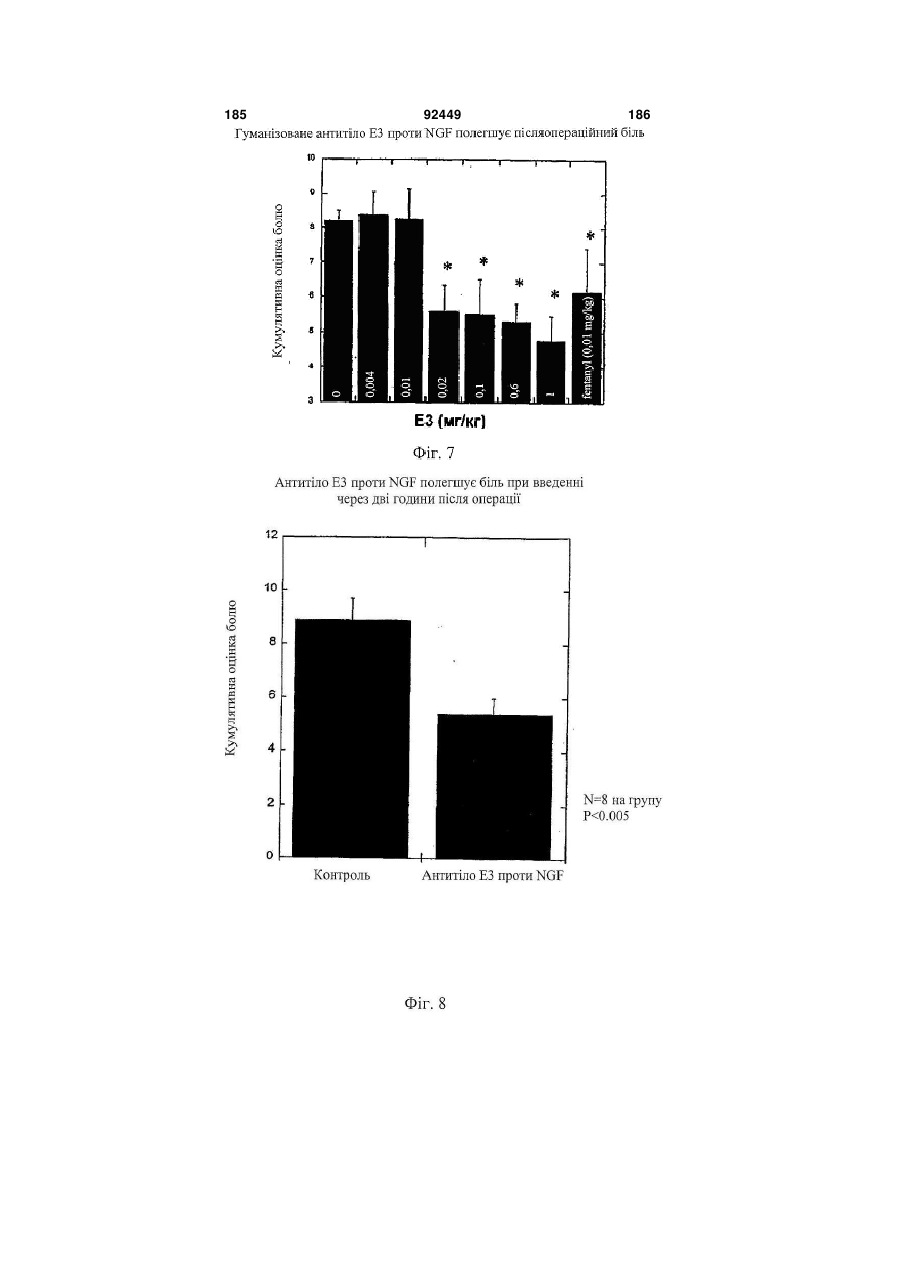
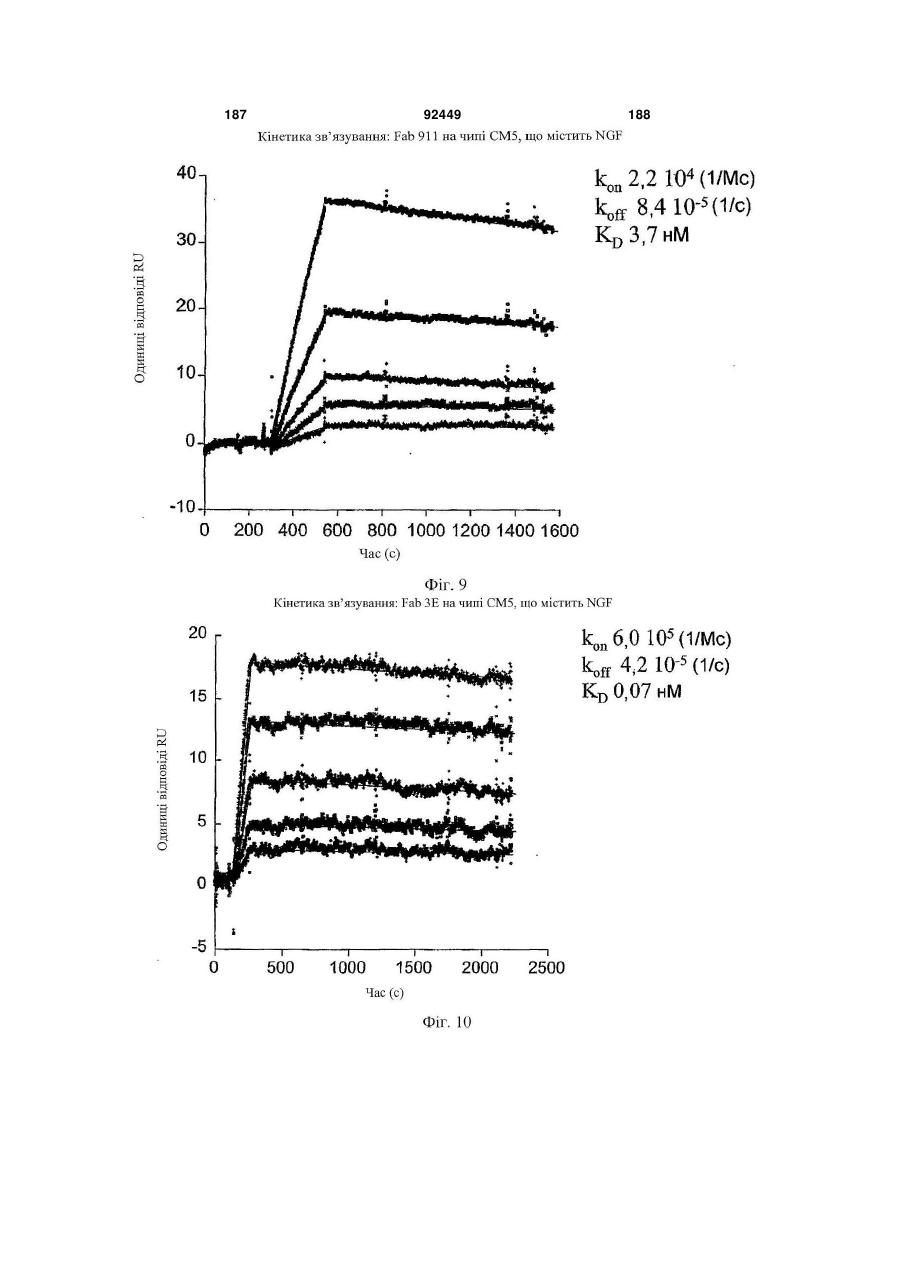
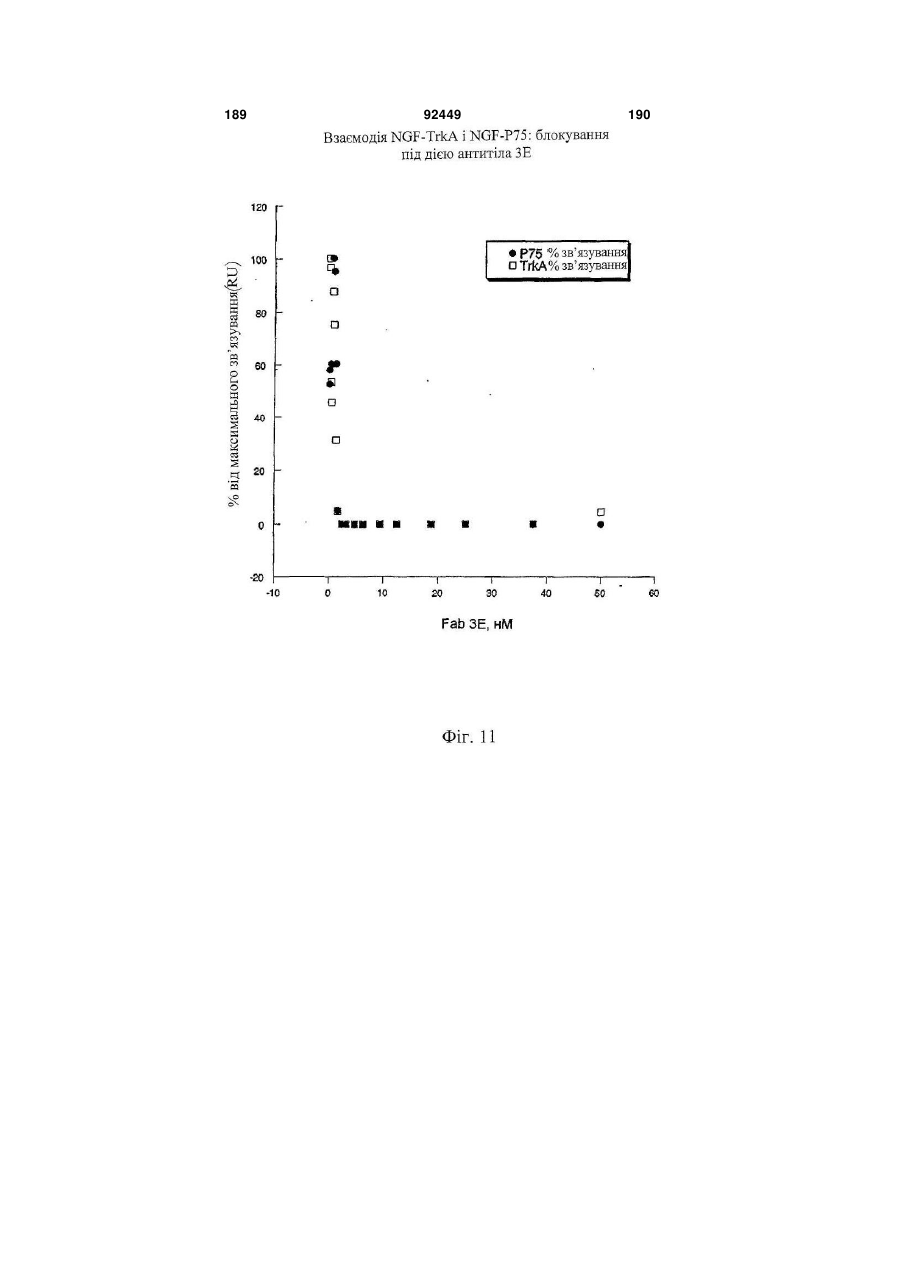
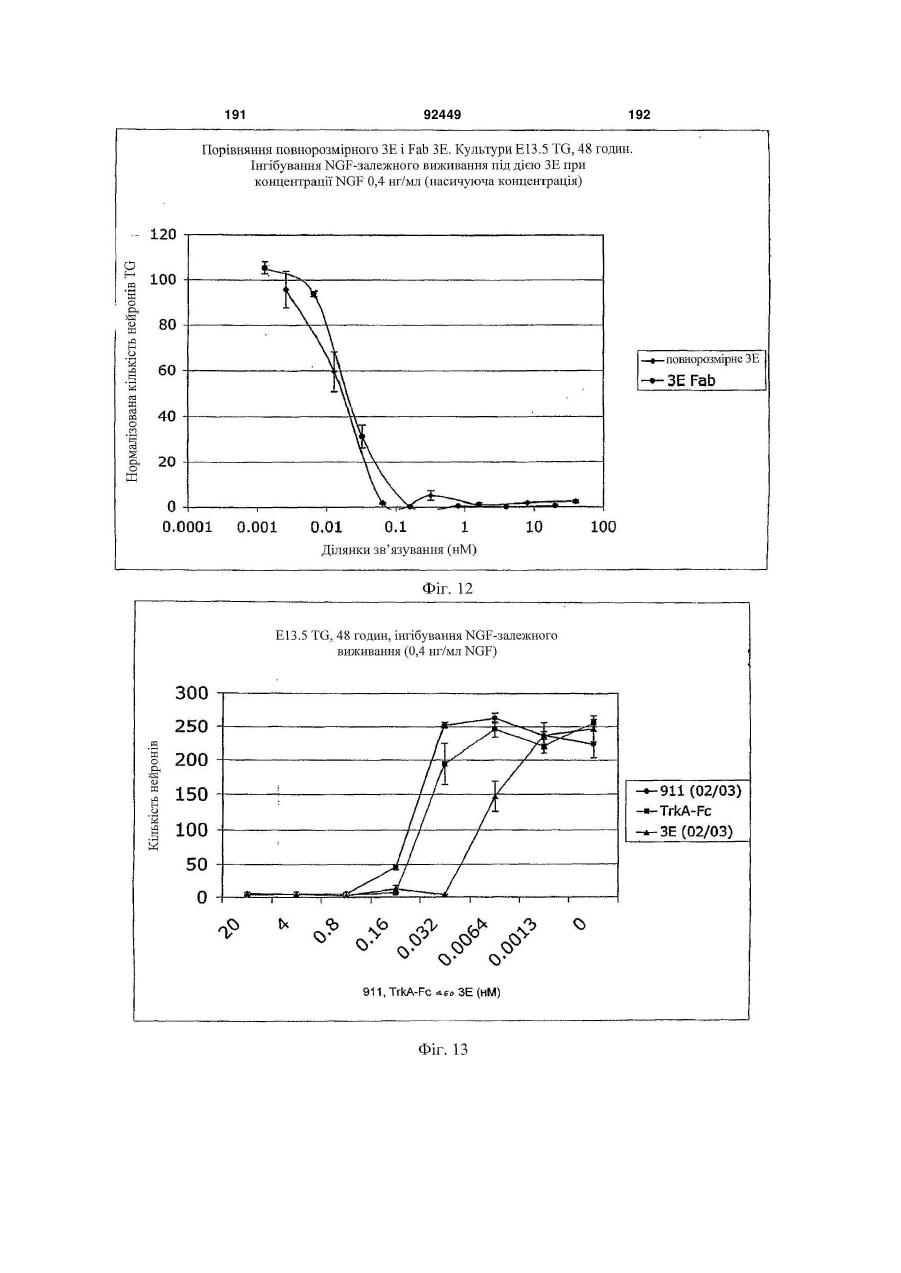
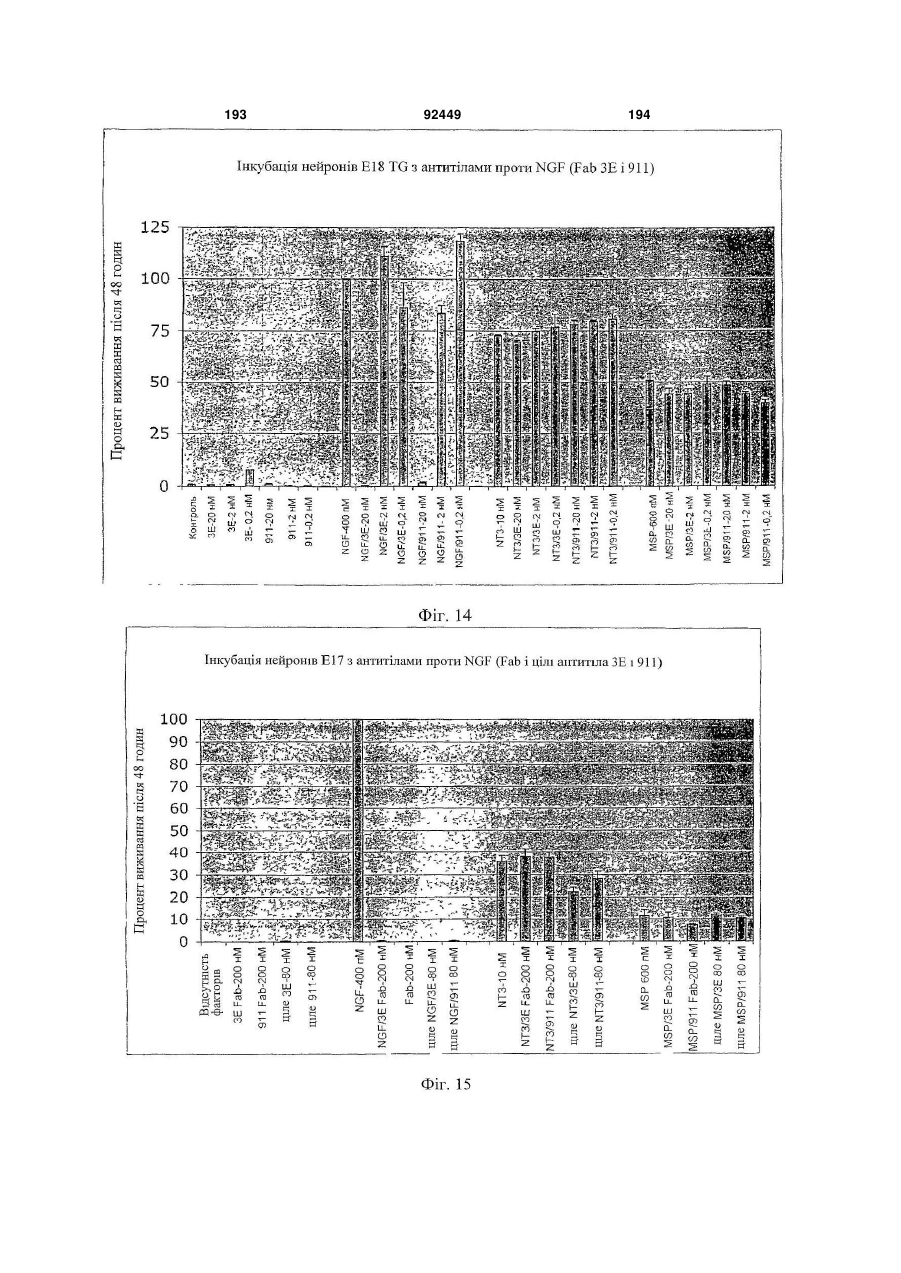
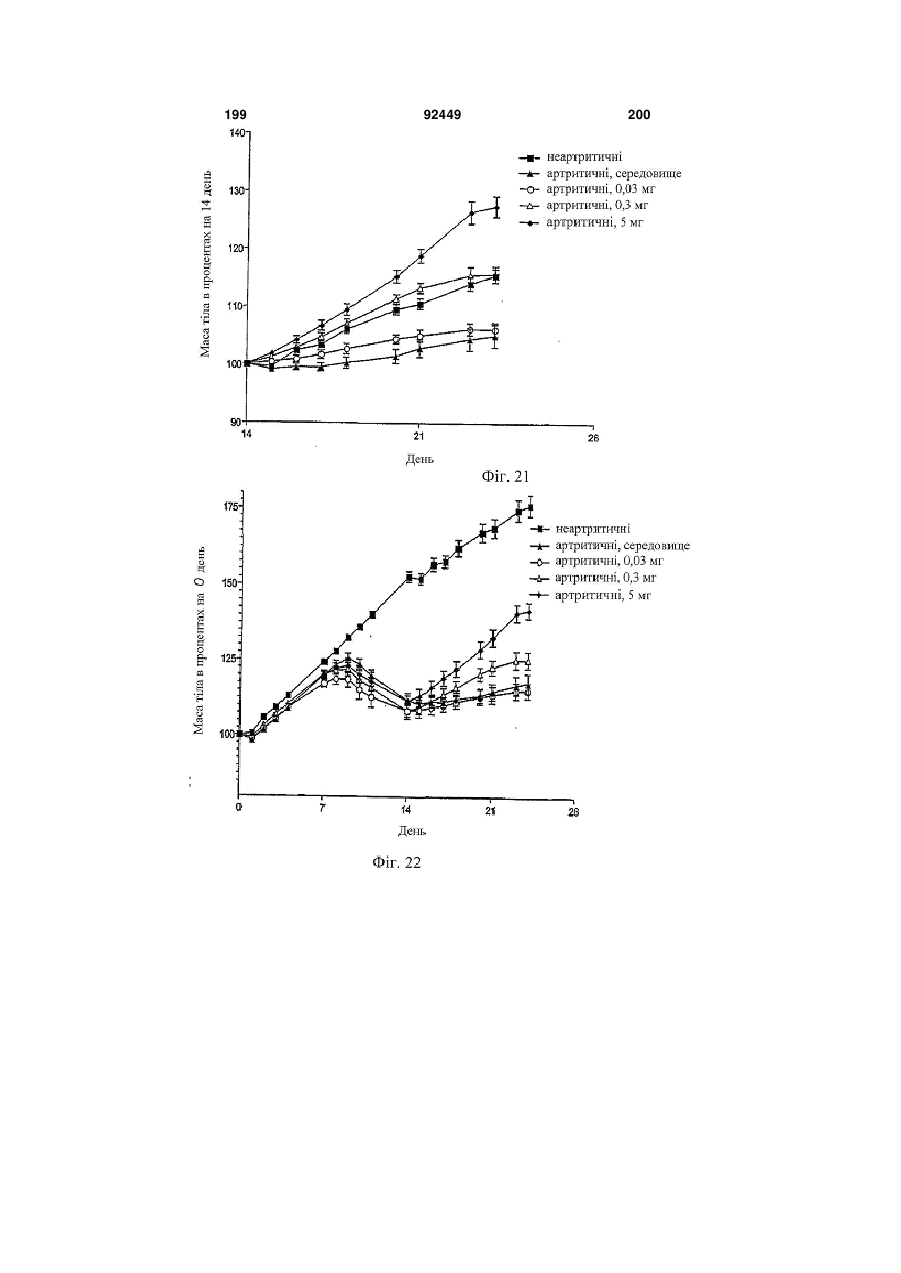
1. Антитіло проти фактора росту нервів (NGF) або його фрагмент, що містять (a) варіабельну область важкого ланцюга, що включає: (i) ділянку CDR1 послідовності SEQ ID NO: 30; 2 (19) 1 3 92449 4 амінокислот проводиться з посиланням на посліамінокислотні послідовності, представлені в SEQ довність IgG2a дикого типу. ID NO: 1 і 2. 9. Антитіло або його фрагмент за будь-яким з по25. Спосіб за п. 20, де суб'єктом є людина. передніх пунктів, де варіабельна область важкого 26. Спосіб лікування запальної кахексії, пов'язаної ланцюга містить послідовність, представлену в з ревматоїдним артритом, у суб'єкта, що включає SEQ ID NO: 1. введення суб'єктові ефективної кількості антитіла 10. Антитіло або його фрагмент за будь-яким з або його фрагмента за будь-яким з пп. 1-16. попередніх пунктів, де варіабельна область легко27. Спосіб за п. 26, де антитіло проти NGF або го ланцюга містить послідовність, представлену в його фрагмент специфічно зв'язується з людським SEQ ID NO: 2. NGF. 11. Антитіло або його фрагмент за будь-яким з 28. Спосіб за п. 26, де антитіло проти NGF являє попередніх пунктів, де важкий ланцюг містить амісобою антитіло або його фрагмент, що містять нокислотну послідовність, представлену в SEQ ID амінокислотні послідовності, представлені в SEQ NO: 16. ID NO: 1 і 2. 12. Антитіло або його фрагмент за будь-яким з 29. Спосіб п. 26, де суб'єктом є людина. попередніх пунктів, де легкий ланцюг містить амі30. Спосіб лікування болю при остеоартриті у сунокислотну послідовність, представлену в SEQ ID б'єкта, що включає введення суб'єктові ефективної NO: 17. кількості антитіла або його фрагмента за будь13. Антитіло або його фрагмент за будь-яким з яким з пп. 1-16. попередніх пунктів, де антитіло або його фрагмент 31. Спосіб за п. 30, де антитіло проти NGF або зв'язується з людським NGF з KD, що становить його фрагмент специфічно зв'язується з людським приблизно 100 пМ або менше. NGF. 14. Антитіло або його фрагмент за п. 13, де анти32. Спосіб за п. 30, де антитіло проти NGF являє тіло або його фрагмент також зв'язується з NGF собою антитіло або його фрагмент, що містять гризунів. амінокислотні послідовності, представлені в SEQ 15. Антитіло проти NGF або його фрагмент, що ID NO: 1 і 2. містять: 33. Спосіб п. 30, де суб'єктом є людина. (a) варіабельну область важкого ланцюга, що міс34. Спосіб лікування болю в суб'єкта, що включає тить послідовність SEQ ID NO: 1; і введення суб'єктові ефективної кількості антитіла (b) варіабельну область легкого ланцюга, що місабо його фрагмента за будь-яким з пп. 1-16. тить послідовність SEQ ID NO: 2. 35. Спосіб за п. 34, де антитіло проти NGF або 16. Антитіло проти NGF або його фрагмент, що його фрагмент специфічно зв'язується з людським містять: NGF. (a) важкий ланцюг, що містить амінокислотну пос36. Спосіб за п. 34, де антитіло проти NGF являє лідовність SEQ ID NO: 16; і собою антитіло або його фрагмент, що містять (b) легкий ланцюг, що містить амінокислотну посамінокислотні послідовності, представлені в SEQ лідовність SEQ ID NO: 17. ID NO: 1 і 2. 17. Фармацевтична композиція, що містить (a) ан37. Спосіб п. 34, де суб'єктом є людина. титіло або його фрагмент за будь-яким з поперед38. Виділений полінуклеотид, що містить нуклеоніх пунктів і (b) фармацевтично прийнятний наповтидну послідовність, яка кодує антитіло або його нювач. фрагмент за будь-яким з пп. 1-16. 18. Набір, що містить антитіло або його фрагмент 39. Полінуклеотид за п. 38, де полінуклеотид місза будь-яким з пп. 1-16. тить нуклеотидну послідовність, представлену в 19. Спосіб одержання антитіла або його фрагменSEQ ID NO:65. та за будь-яким з пп. 1-16, що включає експресію 40. Полінуклеотид за п. 38, де полінуклеотид місin vitro полінуклеотиду, що кодує антитіло або його тить нуклеотидну послідовність, представлену в фрагмент за будь-яким з пп. 1-16, у клітині-хазяїні, SEQ ID NO:66. відмінній від людської клітини. 41. Полінуклеотид за п. 38, де полінуклеотид міс20. Спосіб лікування болю при ревматоїдному артить нуклеотидну послідовність, представлену в триті у суб'єкта, що включає введення суб'єктові SEQ ID NO:67. ефективної кількості антитіла або його фрагмента 42. Полінуклеотид за п. 38, де полінуклеотид місза будь-яким з пп. 1-16. тить нуклеотидну послідовність, представлену в 21. Спосіб за п. 20, де полегшення болю відбуваSEQ ID NO:68. ється протягом приблизно 24 годин після введення 43. Полінуклеотид за п. 38, де полінуклеотид міссуб'єкту антитіла проти NGF або його фрагмента. тить нуклеотидну послідовність, представлену в 22. Спосіб за п. 20, де полегшення болю відбуваSEQ ID NO:66 і нуклеотидну послідовність, предється протягом приблизно чотирьох днів після ставлену в SEQ ID NO:68. введення суб'єкту антитіла проти NGF або його 44. Вектор, який містить полінуклеотид, що містить фрагмента. нуклеотидну послідовність, яка кодує антитіло або 23. Спосіб за п. 20, де антитіло проти NGF або його фрагмент за будь-яким з пп. 1-16. його фрагмент специфічно зв'язується з людським 45. Ізольована клітина-хазяїн, яка містить полінукNGF. леотид, що містить нуклеотидну послідовність, яка 24. Спосіб за п. 20, де антитіло проти NGF являє кодує антитіло або його фрагмент за будь-яким з собою антитіло або його фрагмент, що містять пп. 1-16. 5 Перехресне посилання на споріднені заявки За даною заявкою вимагається пріоритет на основі попередніх заявок на видачу патенту США серійний номер 60/436905, поданої 24 грудня 2002 p.; серійний номер 60/443522, поданої 28 січня 2003 p.; і серійний номер 60/510006, поданої 8 жовтня 2003 p., які включені в даний опис як посилання у всій їх повноті. Галузь винаходу Даний винахід відноситься до антитіл проти NGF (таким як антагоністичні антитіла проти NGF). Даний винахід також відноситься до застосування таких антитіл для лікування і/або профілактики болю, в тому числі післяопераційного болю, болю при ревматоїдному артриті і болю при остеоартриті. Заява, що стосується досліджень або розробок, які підтримуються урядом Не можна застосувати в даному випадку. Передумови створення винаходу Фактор росту нервів (NGF) був першим ідентифікованим нейротрофіном, і його роль в розвитку і виживанні як периферичних, так і центральних нейронів добре охарактеризована. Показано, що NGF є ключовим фактором виживання і формування нейронів при розвитку периферичних симпатичних і ембріональних сенсорних нейронів, а також базальних холінергічних нейронів переднього мозку. Smeyne et al., Nature 368: 246-249 (1994) і Crowley et al., Cell 76: 1001-1011 (1994). NGF здійснює підвищуючу регуляцію експресії нейропептидів в сенсорних нейронах (Lindsay and Harmer, Nature 337: 362-364 (1989)), причому його активність опосередковується двома різними рецепторами, зв'язаними з мембраною, рецептором TrkA і загальним рецептором нейротрофінів р75 (які іноді називають рецепторами NGF "з високою спорідненістю" і "з низькою спорідненістю", відповідно). Chao et al., Science 232: 518-521 (1986). Огляд по NGF дивіться в Huang et al., Annu. Rev. Neurosci. 24: 677-736 (2001); Bibel et al., Genes Dev. 14: 2919-2937 (2000). Визначена кристалічна структура NGF і NGF в комплексі з рецептором trkA. Див. Nature 254: 411 (1991); Nature 401: 184-188 (1996). Фактор росту нервів (NGF) був першим ідентифікованим нейротрофіном, і його роль в розвитку і виживанні як периферичних, так і центральних нейронів добре охарактеризована. Показано, що NGF є ключовим фактором виживання і формування нейронів при розвитку периферичних симпатичних і ембріональних сенсорних нейронів, а також базальних холінергічних нейронів переднього мозку (Smeyne et al., Nature 368:246-249 (1994) і Crowley et al., Cell 16: 1001-1011 (1994)). NGF здійснює підвищуючу регуляцію експресії нейропептидів в сенсорних нейронах (Lindsay et al., Nature 337: 362-364 (1989)), причому його активність опосередковується двома різними рецепторами, зв'язаними з мембраною, тирозинкіназним рецептором TrkA і рецептором р75, який за структурою близький до інших членів сімейства рецепторів фактора некрозу пухлини (Chao et al., Science 232: 518-521 (1986)). 92449 6 NGF активно бере участь в процесах, які відбуваються не тільки в нервовій системі, але і поза нею. Наприклад, показано, що NGF підвищує проникність судин (Otten, et al., Eur J Pharmacol. 106: 199-201 (1984)), посилює імунні відповіді Т- і Вклітин (Otten, et al., Proc. Natl. Acad. Sci. USA 86: 10059-10063 (1989)), індукує диференціацію лімфоцитів і проліферацію тучних клітин, а також спричиняє вивільнення розчинних біологічних сигналів з тучних клітин (Matsuda, et al., Proc. Natl. Acad. Sci. USA 85: 6508-6512 (1988); Pearce, et al., J. Physiol. 372: 379-393 (1986); Bischoff, et al., Blood 79: 2662-2669 (1992); Horigome, et al., J Biol. Chem. 268: 14881-14887 (1993)). Хоч показано, що екзогенно доданий NGF здатний здійснювати всі згадані ефекти, важливо зазначити, що існує мало даних, які свідчать про те, що ендогенний NGF відіграє важливу роль в будь-якому з вказаних процесів in vivo (Torcia, et al., Cell. 85 (3): 345-56 (1996)). Отже, неясно, який ефект може мати інгібування біоактивності ендогенного NGF, якщо воно має місце. NGF продукується багатьма типами клітин, що включають в себе тучні клітини (Leon, et al., Proc. Natl. Acad. Sci. USA 91: 3739-3743 (1994)), Влімфоцити (Torcia, et al., Cell 85: 345-356 (1996), кератиноцити (Di Marco, et al., J. Biol. Chem. 268: 22838-22846)), гладком'язеві клітини (Ueyama, et al., J Hypertens. 11: 1061-1065 (1993)), фібробласти (Lindholm, et al., Eur. J. Neurosci. 2: 795-801 (1990)), клітини бронхіального епітелію (Kassel, et al., Clin. Exp. Allergy 31: 1432-40 (2001)), клітини ниркового мезангію (Steiner, et al., Am. J; Physiol. 261: F792-798 (1991)) і м'язові трубочки скелетної мускулатури (Schwartz, et al., J Photochem. Photobiol. B66: 195-200 (2002)). Рецептори NGF виявлені в різних типах клітин поза нервовою системою. Наприклад, TrkA виявлений в людських моноцитах, Т- і В-лімфоцитах і тучних клітинах. Зв'язок між підвищеними рівнями NGF і рядом запальних станів спостерігали у хворих людей, а також у деяких тваринних моделей. Дані стани включають в себе системний червоний вовчак (Bracci-Laudiero, et al., Neuroreport 4: 563-565 (1993)), розсіяний склероз (Bracci-Laudiero, et al., Neurosci. Lett. 147: 9-12 (1992)), псоріаз (Raychaudhuri, et al., Acta Derm. Venereol. 78: 84-86 (1998)), артрит (Falcim, et al., Ann. Rheum. Dis. 55: 745-748 (1996)), інтерстиціальний цистит (Okragly, et al., J. Urology 161: 438-441 (1999)) і астму (Braun, et al., Eur. J. Immunol. 28: 3240-3251 (1998)). Відповідно, підвищені рівні NGF в периферичних тканинах пов'язані з гіпералгезією і запаленням і спостерігаються при деяких видах артриту. Синовіальна оболонка хворих з ревматоїдним артритом експресує високі рівні NGF, тоді як в незапаленій синовіальній оболонці NGF не детектується (Aloe, et al., Arch. Rheum. 35: 351-355 (1992)). Подібні результати спостерігали у щурів з експериментально індукованим ревматоїдним артритом (Aloe, et al., Clin. Exp. Rheumatol. 10: 203-204 (1992)). Підвищені рівні NGF, нарівні із збільшен 7 92449 8 ням числа тучних кліток, виявлені у трансгенних містить один або декілька гіперваріабельних обламишей, що страждають на артрит (Aloe, el al., Int. J стей (CDR) з легкого і/або важкого ланцюга антитіTissue Reactions-Exp. Clin. Aspects 15: 139-143 ла E3, як показано на Фіг. 1А і 1B. (1993)). В РСТ-публікації № WO 02/096458 розкриВ іншому аспекті даний винахід відноситься до вається застосування антитіл проти NGF, деякі антитіла, що містить легкий ланцюг, який кодує властивості яких дозволяють використовувати їх полінуклеотид, що продукується клітиноюдля лікування різних порушень, пов'язаних з NGF, хазяїном з депозитним номером АТСС № РТАтаких як запальний стан (наприклад, ревматоїдний 4893 або АТСС № РТА-4894. В іншому аспекті артрит). Було описано, що очищене антитіло проти даний винахід відноситься до антитіла, що містить NGF, введене артритичним трансгенним мишам, важкий ланцюг, який кодує полінуклеотид, що прощо несуть ген людського фактора некрозу пухлиндукується клітиною-хазяїном з депозитним номером АТСС № РТА-4895. В іншому аспекті даний (TNF- ), спричиняє зменшення числа тучних винахід відноситься до антитіла, що містить (а) клітин, а також зменшення рівнів гістаміну і речолегкий ланцюг, який кодує полінуклеотид, що провини Ρ в синовіальній оболонці артритичних мидукується клітиною-хазяїном з депозитним номешей (Aloe et al., Rheumatol. Int. 14: 249-252 (1995)). ром АТСС № РТА-4894 або АТСС № РТА-4893; і Було показано, що введення екзогенного антитіла (b) важкий ланцюг, який кодує полінуклеотид, що проти NGF зменшує підвищений рівень TNF- у продукується клітиною-хазяїном з депозитним ноартритичних мишей (Manni et al., Rheumatol. Int. мером АТСС № РТА-4895 (для зручності в даному 18: 97-102 (1998)). описі полінуклеотидам, що продукуються депоноКрім того, підвищена експресія NGF і високованими клітинами-хазяїнами, приписуються депоафінного рецептора NGF (TrlcA) спостерігається в зитні номери АТСС №№ РТА-4894, РТА-4893 і хондроцитах людей, що страждають на остеоартРТА-4895). В іншому аспекті, даний винахід віднорит (Iannone et al., Rheumatology 41: 1413-1418 ситься до антитіла, що містить варіабельну об(2002)). ласть легкого ланцюга, яку кодує полінуклеотид, Описані антагоністичні антитіла гризунів проти що продукується клітиною-хазяїном з депозитним NGF. Див., наприклад, Hongo et al., Hybridoma номером АТСС № РТА-4894 або АТСС № РТА(2000) 19 (3): 215-227; Ruberti et Al. (1993) Cell. 4893. В іншому аспекті, даний винахід відноситься Molec. Neurobiol. 13 (5): 559-568. Однак, якщо для до антитіла, що містить варіабельну область важлікування людей використовуються антитіла грикого ланцюга, яку кодує полінуклеотид, що продузунів, у значного числа суб'єктів, що отримують кується клітиною-хазяїном з депозитним номером лікування, розвивається імунна відповідь проти АТСС № РТА-4895. В іншому аспекті даний винамишачих антитіл. Крім того, доведено, що ефектохід відноситься до антитіла, що містить (а) варіарні функції мишачих антитіл для людини менш бельну область легкого ланцюга, яку кодує полінуефективні. Таким чином, існує потреба в антагоніклеотид, що продукується клітиною-хазяїном з стичних антитілах проти NGF, що включають в депозитним номером АТСС № РТА-4894 або себе гуманізовані антагоністичні антитіла проти АТСС № РТА-4893, і (b) варіабельну область важNGF. кого ланцюга, яку кодує полінуклеотид, що продуВсі розкриті тут посилання, публікації і патенткується клітиною-хазяїном з депозитним номером ні заявки включені в даний опис як посилання у АТСС № РТА-4895. У наступному аспекті даний всій їх повноті. винахід відноситься до антитіла, що містить (а) Короткий опис винаходу один або декілька CDR, що кодуються полінуклеоВинахід, що розкривається в даному описі відтидом, який продукується клітиною-хазяїном з деноситься до антитіл проти фактора росту нервів. позитним номером АТСС № РТА-4894; і/або (b) В іншому аспекті даний винахід відноситься до важкий ланцюг, який кодує полінуклеотид, що прогуманізовалогр і афінно-зрілого антитіла, E3, яке дукується клітиною-хазяїном з депозитним номеспецифічно зв'язується з фактором росту нервів ром АТСС № РТА-4895. ("NGF") людини і гризунів. Амінокислотні послідовУ деяких втіленнях антитіло містить константності важких і легких ланцюгів варіабельних облану ділянку важкого ланцюга людського IgG2a. В стей E3 наведені на Фіг. 1A (SEQ ID NO: 1) і 1B деяких втіленнях антитіло містить константну ді(SEQ ID NO: 2), відповідно. Фрагменти CDR антилянку людського легкого ланцюга каппа. У деяких тіла E3 (в тому числі фрагменти CDR Chothia і втіленнях антитіло містить модифіковану констанKabat) схематично зображені на Фіг. 1А і 1B. Амітну ділянку, таку як імунологічно інертна константнокислотні послідовності важких і легких ланцюгів на ділянка, яка, наприклад, не запускає опосередE3 і окремі довгасті CDR також наведені нижче кований комплементом лізис або не стимулює (див. "послідовності антитіл", нижче). антитілозалежну клітиноопосередковану цитотокВ іншому аспекті даний винахід відноситься до сичність (ADCC). В інших втіленнях константну антитіла, що містить фрагмент або ділянку антитіділянку модифікують, як описано в Eur. J. Immunol. ла E3 (в даному описі даний термін використову(1999) 29: 2613-2624; заявці РСТ № ється як взаємозамінний з терміном "E3"). В одноPCT/GB99/01441; і/або патентній заявці Великобму втіленні фрагмент являє собою легкий ланцюг ританії № 9809951.8. У наступних втіленнях антиантитіла E3, як показаний на Фіг. 1B. В іншому втітіло містить константну ділянку важкого ланцюга ленні фрагмент являє собою важкий ланцюг антилюдського IgG2a, що несе наступні мутації: тіла E3, як показаний на Фіг. 1A. У наступному втіА330Р331 замінені на S330S331 (нумерація аміноленні фрагмент містить один або декілька кислот проводиться з посиланням на послідовність варіабельних областей легкого і/або важкого ланцюга антитіла E3. У наступному втіленні фрагмент 9 92449 10 IgG2a дикого типу). Eur. J. Immunol. (1999) 29: собою Y, R, Τ або М; де Υ107 являє собою Υ або 2613-2624. F; де F108 являє собою F або W; де D109 являє В іншому аспекті даний винахід відноситься до собою S, A, C, G, D, Ν, Τ або G; і де Υ110 являє поліпептидів (які необов'язково можуть являти собою будь-яку амінокислоту. собою антитіло), що містять будь-який один або В іншому аспекті даний винахід відноситься до декілька з наступних фрагментів: а) один або декіполіпептидів (таких як антитіло), які містять варіалька CDR антитіла E3, показані на Фіг. 1А і 1B; b) бельну область важкого ланцюга, що включає в CDR H3 важкого ланцюга антитіла E3, показаний себе SEQ ID NO: 11, де G98 являє собою G, S, А, на Фіг. 1A; с) CDR L3 легкого ланцюга антитіла E3, С, V, N, D або Т; де G99 являє собою G, S, А, С, V, показаний на Фіг. 1B; d) три CDR легкого ланцюга N, D або Т; де Y100 являє собою Y, L або R; де антитіла E3, показані на Фіг. 1B; e) три CDR важкоY101 являє собою Υ або W; де G103 являє собою го ланцюга антитіла E3, показані на Фіг. 1A; і f) три G, А або S; де Т104 являє собою Τ або S; де S105 CDR легкого ланцюга і три CDR важкого ланцюга являє собою S, А або Т; де Υ106 являє собою Y, антитіла E3, показані на Фіг. 1А і 1B. Даний винахід R, Τ або М; де Υ107 являє собою Υ або F; де F108 також відноситься до поліпептидів (які необов'язявляє собою F або W; де D109 являє собою S, A, ково можуть являти собою антитіло), що містять C, G, D, Ν, Τ або G; і де Υ110 являє собою будьбудь-який один або декілька з наступних фрагменяку амінокислоту. тів: а) один або декілька (один, два, три, чотири, В іншому аспекті даний винахід відноситься до п'ять або шість) CDR, отриманих з антитіла E3, поліпептидів (таких як антитіло), які містять варіапоказаних на Фіг. 1А і 1B; b) CDR, отриманий з бельну область легкого ланцюга, що включає в CDR H3 важкого ланцюга антитіла E3, показаний себе SEQ ID NO: 12, де S26 являє собою S або F; на Фіг. 1A; і/або с) CDR, отриманий з CDR L3 легD28 являє собою D, S, А або Y; і Н32 являє собою кого ланцюга антитіла E3, показаний на Фіг. 1B. У Η, Ν або Q. деяких втіленнях CDR можуть являти собою Kabat В іншому аспекті даний винахід відноситься до CDR, Chothia CDR, або поєднання Kabat CDR i поліпептидів (таких як антитіло), які містять варіаChothia CDR (звані тут "розширені" або "комбінобельну область легкого ланцюга, що включає в вані" CDR). У деяких втіленнях поліпептиди (такі себе SEQ ID NO: 13, де I51 являє собою І, Т, V або як антитіло) зв'язуються з NGF (таким як людський А; і S56 являє собою S або Т. NGF). У деяких втіленнях поліпептиди містять В іншому аспекті даний винахід відноситься до будь-які описані тут конфігурації CDR (в тому числі поліпептидів (таких як антитіло), які містять варіапоєднання, варіанти та ін.). бельну область легкого ланцюга, що включає в В одному аспекті даний винахід відноситься до себе SEQ ID NO: 14, де S91 являє собою S або Ε; поліпептидів (таких як антитіло), які містять варіаΚ92 являє собою Κ, Η, R або S; і де Y96 являє собельну область важкого ланцюга, що включає в бою Υ або R. себе SEQ ID NO: 9, де I34 являє собою S, L, V, А В іншому аспекті даний винахід відноситься до або І; а N35 замінений на Ν, Τ або S. Для зручності поліпептидів (таких як антитіло), які містять варіав даному описі термін "замінений" або "являє собельну область легкого ланцюга, що включає в бою" в даному контексті, або вживаний відносно себе SEQ ID NO: 14, де S91 являє собою S або Ε; амінокислот, означає вибір амінокислоти для вкаΚ92 являє собою будь-яку амінокислоту; Т93 явзаного положення. Очевидно, що заміна або вибір ляє собою будь-яку амінокислоту; і де Y96 являє можуть являти собою амінокислоту, зображену в собою Υ або R. SEQ ID або на фігурі. В одному аспекті даний винахід відноситься до В іншому аспекті даний винахід відноситься до поліпептидів (таких як антитіло), які містять амінополіпептидів (таких як антитіло), які містять варіакислотну послідовність, наведену в SEQ ID NO: 9, бельну область важкого ланцюга, що включає в де I34 являє собою S, L, V, А або І; і N35 являє себе SEQ ID NO: 10, де М50 являє собою М, І, G, собою Ν, Τ або S. Q, S або L; A62 являє собою А або S; а L63 являє В іншому аспекті даний винахід відноситься до собою L або V. поліпептидів (таких як антитіло), які містять аміноВ іншому аспекті даний винахід відноситься до кислотну послідовність, наведену в SEQ ID NO: 10, поліпептидів (таких як антитіло), які містять варіаде М50 являє собою М, І, G, Q, S або L; A62 являє бельну область важкого ланцюга, що включає в собою А або S; і L63 являє собою L або V. себе SEQ ID NO: 11, де Υ100 являє собою Y, L або В іншому аспекті даний винахід відноситься до R; де Υ101 являє собою Υ або W; де G103 являє поліпептидів (таких як антитіло), які містять амінособою G, А або S; де Τ104 являє собою Τ або S; кислотну послідовність, наведену в SEQ ID NO: 11, де S105 являє собою S, А або Т; де Υ106 являє де Υ100 являє собою Y, L або R; де Υ101 являє собою Y, R, Τ або М; де Υ107 являє собою Υ або собою Υ або W; де G103 являє собою G, А або S; F; де F108 являє собою F або W; де D109 являє де Τ104 являє собою Τ або S; де S105 являє сособою D, N або G; і де Υ110 являє собою Υ, До, S, бою S, А або Т; де Υ106 являє собою Y, R, Τ або R або Т. М; де Υ107 являє собою Υ або F; де F108 являє В іншому аспекті даний винахід відноситься до собою F або W; де D109 являє собою D, N або G; і поліпептидів (таких як антитіло), які містять варіаде Υ110 являє собою Υ, K, S, R або Т. бельну область важкого ланцюга, що включає в В іншому аспекті даний винахід відноситься до себе SEQ ID NO: 11, де Υ100 являє собою Y, L або поліпептидів (таких як антитіло), які містять аміноR; де Υ101 являє собою Υ або W; де G103 являє кислотну послідовність, наведену в SEQ ID NO: 11, собою G, А або S; де Т104 являє собою Τ або S; де Y100 являє собою Y, L або R; де Y101 являє де S105 являє собою S, А або Т; де Υ106 являє собою Υ або W; де G103 являє собою G, А або S; 11 92449 12 де Т104 являє собою Τ або S; де S105 являє сомістить ділянку CDR3 послідовності SEQ ID NO: бою S, А або Т; де Υ106 являє собою Y, R, Τ або 11, де G98 являє собою G, S, А, С, V, N, D або Т; М; де Υ107 являє собою Υ або F; де F108 являє де G99 являє собою G, S, А, С, V, N, D або Т; де собою F або W; де D109 являє собою S, A, C, G, D, Y100 являє собою Y, L або R; де Y101 являє соΝ, Τ або G; і де Υ110 являє собою будь-яку амінобою Υ або W; де G103 являє собою G, А або S; де кислоту. Т104 являє собою Τ або S; де S105 являє собою В іншому аспекті даний винахід відноситься до S, А або Т; де Υ106 являє собою Y, R, Τ або М; де поліпептидів (таких як антитіло), які містять аміноΥ107 являє собою Υ або F; де F108 являє собою F кислотну послідовність, наведену в SEQ ID NO: 11, або W; де D109 являє собою S, A, C, G, D, Ν, Τ або де G98 являє собою G, S, А, С, V, N, D або Т; де G; і де Υ110 являє собою будь-яку амінокислоту. У G99 являє собою G, S, А, С, V, N, D або Т; де Υ100 деяких втіленнях поліпептид (такий як антитіло) являє собою Y, L або R; де Υ101 являє собою Υ додатково містить варіабельну область легкого або W; де G103 являє собою G, А або S; де Т104 ланцюга антитіла. являє собою Τ або S; де S105 являє собою S, А В іншому аспекті даний винахід відноситься до або Т; де Υ106 являє собою Y, R, Τ або М; де Υ107 поліпептидів (таких як антитіло), які містять варіаявляє собою Υ або F; де F108 являє собою F або бельну область легкого ланцюга, що включає в W; де D109 являє собою S, A, C, G, D, Ν, Τ або G; і себе ділянку CDR1 послідовності SEQ ID NO: 12, де Υ110 являє собою будь-яку амінокислоту. де S26 являє собою S або F; D28 являє собою D, В іншому аспекті даний винахід відноситься до S, А або Y; і Н32 являє собою Η, Ν або Q; ділянку поліпептидів (таких як антитіло), які містять аміноCDR2 послідовності SEQ ID NO: 13, де I51 являє кислотну послідовність, наведену в SEQ ID NO: 12, собою І, Т, V або A; a S56 являє собою S або Т; і де S26 являє собою S або F; D28 являє собою D, ділянку CDR3 послідовності SEQ ID NO: 14, де S91 S, А або Y; і Н32 являє собою Η, Ν або Q. являє собою S або Ε; Κ92 являє собою K, Н, R або В іншому аспекті даний винахід відноситься до S; і де Y96 являє собою Υ або R. В деяких втіленполіпептидів (таких як антитіло), які містять амінонях варіабельна область легкого ланцюга містить кислотну послідовність, наведену в SEQ ID NO: 13, ділянку CDR3 послідовності SEQ ID NO: 14, де S91 де I51 являє собою І, Т, V або А; і S56 являє собою являє собою S або Е; K92 являє собою будь-яку S або Т. амінокислоту; Т93 являє собою будь-яку амінокисВ іншому аспекті даний винахід відноситься до лоту; і де Y96 являє собою Υ або R. В деяких втіполіпептидів (таких як антитіло), які містять аміноленнях поліпептид (такий як антитіло) також міскислотну послідовність, наведену в SEQ ID NO: 14, тить важкий ланцюг антитіла. де S91 являє собою S або Ε; Κ92 являє собою K, В іншому аспекті даний винахід відноситься до Н, R або S; і де Y96 являє собою Υ або R. поліпептидів (таких як антитіло), які містять (а) В іншому аспекті даний винахід відноситься до варіабельну область важкого ланцюга, що вклюполіпептидів (таких як антитіло), які містять аміночає в себе ділянку CDR1 послідовності SEQ ID NO: кислотну послідовність, наведену в SEQ ID NO: 14, 9, де I34 являє собою S, L, V, А або І; і N35 являє де S91 являє собою S або Е; K92 являє собою собою Ν, Τ або S; ділянку CDR2 послідовності будь-яку амінокислоту; Т93 являє собою будь-яку SEQ ID NO: 10, де М50 являє собою М, І, G, Q, S амінокислоту; і де Y96 являє собою Υ або R. або L; A62 являє собою А або S; і L63 являє собою В іншому аспекті даний винахід відноситься до L або V; і ділянку CDR3 послідовності SEQ ID NO: поліпептидів (таких як антитіла, в тому числі, гу11, де Υ100 являє собою Y, L або R; де Υ101 явманізовані антитіла), які містять варіабельну обляє собою Υ або W; де G103 являє собою G, А або ласть важкого ланцюга, що включає в себе ділянку S; де Т104 являє собою Τ або S; де S105 являє CDR1 послідовності SEQ ID NO: 9, де I34 являє собою S, А або Т; де Υ106 являє собою Y, R, Τ або собою S, L, V, А або І; і N35 являє собою Ν, Τ або М; де Υ107 являє собою Υ або F; де F108 являє S; ділянку CDR2 послідовності SEQ ID NO: 10, де собою F або W; де D109 являє собою D, N або G; М50 являє собою М, І, G, Q, S або L; A62 являє де Υ110 являє собою Υ, K, S, R або Т; і (b) варіасобою А або S; і L63 являє собою L або V; і ділянку бельну область легкого ланцюга, що включає в CDR3 послідовності SEQ ID NO: 11, де Y100 являє себе ділянку CDR1 послідовності SEQ ID NO: 12, собою Y, L або R; де Y101 являє собою Υ або W; де S26 являє собою S або F; D28 являє собою D, де G103 являє собою G, А або S; де T104 являє S, А або Y; і Н32 являє собою Η, Ν або Q; ділянку собою Τ або S; де S105 являє собою S, А або Τ; CDR2 послідовності SEQ ID NO: 13, де I51 являє де Υ106 являє собою Υ, R, Τ або Μ; де Υ107 являє собою І, Т, V або A; a S56 являє собою S або Т; і собою Υ або F; де F108 являє собою F або W; де ділянку CDR3 послідовності SEQ ID NO: 14, де S91 D109 являє собою D, N або G; де Υ110 являє соявляє собою S або Ε; Κ92 являє собою K, Н, R або бою Υ, Κ, S, R або Т. В деяких втіленнях варіабеS; і де Y96 являє собою Υ або R. В деяких втіленльна область важкого ланцюга містить ділянку нях варіабельна область легкого ланцюга містить CDR3 послідовності SEQ ID NO: 11, де Y100 являє ділянку CDR3 послідовності SEQ ID NO: 14, де S91 собою Y, L або R; де Y101 являє собою Υ або W; являє собою S або Ε; Κ92 являє собою будь-яку де G103 являє собою G, А або S; де Τ104 являє амінокислоту; Т93 являє собою будь-яку амінокиссобою Τ або S; де S105 являє собою S, А або Т; лоту; і де Y96 являє собою Υ або R. В деяких втіде Υ106 являє собою Y, R, Τ або М; де Υ107 являє леннях варіабельна область важкого ланцюга міссобою Υ або F; де F108 являє собою F або W; де тить ділянку CDR3 послідовності SEQ ID NO: 11, D109 являє собою S, A, C, G, D, Ν, Τ або G; де де Y100 являє собою Y, L або R; де Y101 являє Υ110 являє собою будь-яку амінокислоту. В інших собою Υ або W; де G103 являє собою G, А або S; втіленнях варіабельна область важкого ланцюга де Τ104 являє собою Τ або S; де S105 являє со 13 92449 14 бою S, А або Т; де Υ106 являє собою Y, R, Τ або собою Υ або R. В деяких втіленнях поліпептид М; де Υ107 являє собою Υ або F; де F108 являє містить амінокислотну послідовність, наведену в собою F або W; де D109 являє собою S, A, C, G, D, SEQ ID NO: 14, де S91 являє собою S або Ε; Κ92 Ν, Τ або G; де Υ110 являє собою будь-яку аміноявляє собою будь-яку амінокислоту; Т93 являє кислоту. В інших втіленнях варіабельна область собою будь-яку амінокислоту; і де Y96 являє соважкого ланцюга містить ділянку CDR3 послідовбою Υ або R. В деяких втіленнях поліпептид (такий ності SEQ ID NO: 11, де G98 являє собою G, S, А, як антитіло) також містить варіабельну область С, V, N, D або Т; де G99 являє собою G, S, А, С, V, важкого ланцюга антитіла. N, D або Т; де Y100 являє собою Y, L або R; де В іншому аспекті даний винахід відноситься до Y101 являє собою Υ або W; де G103 являє собою поліпептидів (таких як антитіло), які містять (а) G, А або S; де Т104 являє собою Τ або S; де S105 амінокислотну послідовність, наведену в SEQ ID являє собою S, А або Т; де Υ106 являє собою Y, NO: 9, де I34 являє собою S, L, V, А або І; а N35 R, Τ або М; де Υ107 являє собою Υ або F; де F108 являє собою Ν, Τ або S; амінокислотну послідовявляє собою F або W; де D109 являє собою S, A, ність, наведену в SEQ ID NO: 10, де М50 являє C, G, D, Ν, Τ або G; і де Υ110 являє собою будьсобою М, І, G, Q, S або L; А62 являє собою А або яку амінокислоту. У деяких втіленнях поліпептид S; a L63 являє собою L або V; і амінокислотну постакож містить легкий ланцюг антитіла. лідовність, наведену в SEQ ID NO: 11, де Υ100 В іншому аспекті даний винахід відноситься до являє собою Y, L або R; де Υ101 являє собою Υ поліпептидів (таких як антитіло, в тому числі, гуабо W; де G103 являє собою G, А або S; де Т104 манізоване антитіло), які містять амінокислотну являє собою Τ або S; де S105 являє собою S, А послідовність, наведену в SEQ ID NO: 9, де I34 або Т; де Υ106 являє собою Y, R, Τ або М; де Υ107 являє собою S, L, V, А або І; а N35 являє собою Ν, являє собою Υ або F; де F108 являє собою F або Τ або S; амінокислотну послідовність, наведену в W; де D109 являє собою D, N або G; і де Υ110 явSEQ ID NO: 10, де М50 являє собою М, І, G, Q, S ляє собою Υ, K, S, R або Т; і (b) амінокислотну поабо L; A62 являє собою А або S; і L63 являє собою слідовність, наведену в SEQ ID NO: 12, де S26 L або V; і амінокислотну послідовність, наведену в являє собою S або F; D28 являє собою D, S, А або SEQ ID NO: 11, де Υ100 являє собою Y, L або R; Y; і Н32 являє собою Η, Ν або Q; амінокислотну де Υ101 являє собою Υ або W; де G103 являє сопослідовність, наведену в SEQ ID NO: 13, де I51 бою G, А або S; де Τ104 являє собою Τ або S; де являє собою І, Т, V або А; і S56 являє собою S або S105 являє собою S, А або Т; де Υ106 являє соТ; і амінокислотну послідовність, наведену в SEQ бою Y, R, Τ або М; де Υ107 являє собою Υ або F; ID NO: 14, де S91 являє собою S або Ε; Κ92 являє де F108 являє собою F або W; де D109 являє сособою K, Н, R або S; і де Y96 являє собою Υ або бою D, N або G; де Υ110 являє собою Υ, K, S, R R. В деяких втіленнях поліпептид містить амінокиабо Т. В деяких втіленнях поліпептид містить аміслотну послідовність, наведену в SEQ ID NO: 14, нокислотну послідовність, приведену в SEQ ID NO: де S91 являє собою S або Е; K92 являє собою 11, де Y100 являє собою Y, L або R; і де Y101 явбудь-яку амінокислоту; Т93 являє собою будь-яку ляє собою Υ або W; де G103 являє собою G, А або амінокислоту; і де Y96 являє собою Υ або R. В S; де Т104 являє собою Τ або S; де S105 являє деяких втіленнях поліпептид містить амінокислотсобою S, А або Т; де Υ106 являє собою Y, R, Τ або ну послідовність, наведену в SEQ ID NO: 11, де М; де Υ107 являє собою Υ або F; де F108 являє Υ100 являє собою Y, L або R; де Υ101 являє сособою F або W; де D109 являє собою S, A, C, G, D, бою Υ або W; де G103 являє собою G, А або S; де Ν, Τ або G; і де Υ110 являє собою будь-яку аміноT104 являє собою Τ або S; де S105 являє собою кислоту. В інших втіленнях поліпептид містить аміS, А або Т; де Υ106 являє собою Y, R, Τ або М; де нокислотну послідовність, наведену в SEQ ID NO: Υ107 являє собою Υ або F; де F108 являє собою F 11, де G98 являє собою G, S, А, С, V, N, D або Т; або W; де D109 являє собою S, A, C, G, D, Ν, Τ або де G99 являє собою G, S, А, С, V, N, D або Т; де G; де Υ110 являє собою будь-яку амінокислоту. В Y100 являє собою Y, L або R; де Y101 являє соінших втіленнях поліпептид містить амінокислотну бою Υ або W; де G103 являє собою G, А або S; де послідовність, наведену в SEQ ID NO: 11, де G98 Т104 являє собою Τ або S; де S105 являє собою являє собою G, S, А, С, V, N, D або Т; де G99 явS, А або Т; де Υ106 являє собою Y, R, Τ або М; де ляє собою G, S, А, С, V, N, D або Т; де Y100 являє Υ107 являє собою Υ або F; де F108 являє собою F собою Y, L або R; де Y101 являє собою Υ або W; або W; де D109 являє собою S, А, С, G, D, Ν, Τ або де G103 являє собою G, А або S; де Т104 являє G; і де Υ110 являє собою будь-яку амінокислоту. У собою Τ або S; де S105 являє собою S, А або Т; деяких втіленнях поліпептид (такий як антитіло) де Υ106 являє собою Y, R, Τ або М; де Υ107 являє також містить варіабельну область легкого ланцюсобою Υ або F; де F108 являє собою F або W; де га антитіла. D109 являє собою S, А, С, G, D, Ν, Τ або G; і де В іншому аспекті даний винахід відноситься до Υ110 являє собою будь-яку амінокислоту. У деяких поліпептидів (таких як антитіло), які містять аміновтіленнях поліпептид також містить варіабельну кислотну послідовність, наведену в SEQ ID NO: 12, область легкого ланцюга антитіла. де S26 являє собою S або F; D28 являє собою D, В іншому аспекті даний винахід відноситься до S, А або Y; a H32 являє собою Η, Ν або Q; амінополіпептиду (такого, як антитіло), що містить варікислотну послідовність, наведену в SEQ ID NO: 13, абельну область важкого ланцюга, що включає в де I51 являє собою І, Т, V або A; a S56 являє сосебе: (а) ділянку CDR1 послідовності SEQ ID NO: бою S або Т; і амінокислотну послідовність, наве9, де I34 являє собою S, L, V, А або І; а N35 замідену в SEQ ID NO: 14, де S91 являє собою S або нений на Ν, Τ або S; (b) ділянку CDR2 послідовноΕ; Κ92 являє собою Κ, Η, R або S; і де Y96 являє сті SEQ ID NO: 10, де M50 являє собою I, G, Q, S 15 92449 16 або L; A62 являє собою А або S; a L63 являє сонокислотну послідовність (таку, як послідовність бою L або V; і (с) ділянку CDR3 послідовності SEQ CDR3), вибрану з SEQ ID NO: 46 або 50. У наступID NO: 11, де Υ100 являє собою Υ, L або R; де них втіленнях поліпептид також містить одну або Y101 являє собою Υ або W; де G103 являє собою декілька з амінокислотних послідовностей, навеG, А або S; де Τ104 являє собою Τ або S; де S105 дених в SEQ ID NO: 3, 4, 5, 6, 7 і 8. В наступних являє собою S, А або Т; де Υ106 являє собою Y, втіленнях поліпептид також містить одну або декіR, Τ або М; де Υ107 являє собою Υ або F; де F108 лька з амінокислотних послідовностей, наведених являє собою F або W; де D109 являє собою D, N в SEQ ID NO: 9, 10, 11, 12, 13, 14 і 15. або G; і де Υ110 являє собою Υ, K, S, R або Т; де В іншому аспекті даний винахід відноситься до антитіло зв'язується з NGF. поліпептиду (такому, як антитіло), що містить аміВ іншому аспекті даний винахід відноситься до нокислотну послідовність (таку, як ділянка CDR, поліпептидів (таких як антитіла), що містять варіанаприклад, ділянка CDRH1 і/або CDRH2), вибрану бельну область легкого ланцюга, що включає в з (a) SEQ ID NO: 28 і/або 29; (b) SEQ ID NO: 30 себе: (а) ділянку CDR1 послідовності SEQ ID NO: і/або 31; (с) SEQ ID NO: 32 і/або 33; (d) SEQ ID NO: 12, де S26 являє собою S або F; D28 являє собою 34 і/або 35; (e) SEQ ID NO: 36 і/або 37; (f) SEQ ID D, S, А або Y; a H32 являє собою Η, Ν або Q; (b) NO: 38 і/або 39; і (g) SEQ ID NO: 40 і 41. У деяких ділянку CDR2 послідовності SEQ ID NO: 13, де I51 втіленнях поліпептид містить амінокислотну посліявляє собою І, Т, V або A; a S56 являє собою S довність (наприклад, ділянка CDRH1), вибрану з або Т; і (с) ділянку CDR3 послідовності SEQ ID NO: SEQ ID NO: 28, 30, 32, 34, 36, 38 і 40. У деяких 14, де K92 являє собою Κ, Η, R або S; і де Y96 втіленнях поліпептид містить амінокислотну посліявляє собою Υ або R; де антитіло зв'язується з довність (наприклад, ділянка CDRH2), вибрану з NGF. SEQ ID NO: 29, 31, 33, 35, 37, 39 і 41. У наступних В іншому аспекті даний винахід відноситься до втіленнях поліпептид також містить одну або декіполіпептидів (таких як антитіла), що містять (а) лька з амінокислотних послідовностей, наведених варіабельну область важкого ланцюга, що вклюв SEQ ID NO: 3, 4, 5, 6, 7 і 8. В наступних втіленнях чає в себе: (і) ділянку CDR1 послідовності SEQ ID поліпептид також містить одну або декілька з аміNO: 9, де I34 замінений на S, L, V, А або І; а N35 нокислотних послідовностей, наведених в SEQ ID замінений на Ν, Τ або S; (іі) ділянку CDR2 послідоNO:9,10, 11,12, 13, 14 і 15. вності SEQ ID NO: 10, де М50 являє собою І, G, Q, В іншому аспекті даний винахід відноситься до S або L; A62 являє собою А або S; a L63 являє поліпептиду (такого, як антитіло), що містить амісобою L або V; і (ііі) ділянку CDR3 послідовності нокислотну послідовність (наприклад, ділянка SEQ ID NO: 11, де Υ100 являє собою Y, L або R; CDR, така як CDRL1 і/або CDRL2), вибрану з (a) де Υ101 являє собою Υ або W; де G103 являє соSEQ ID NO: 18 і/або 19; (b) SEQ ID NO: 20 і/або 21; бою G, А або S; де Т104 являє собою Τ або S; де і (с) SEQ ID NO: 22 і/або 23. У деяких втіленнях S105 являє собою S, А або Т; де Υ106 являє сополіпептид містить амінокислотну послідовність бою Y, R, Τ або М; де Υ107 являє собою Υ або F; (наприклад, ділянка CDRL1), вибрану з SEQ ID де F108 являє собою F або W; де D109 являє соNO: 18, 20 і 22. У деяких втіленнях поліпептид місбою D, N або G; де Υ110 являє собою Υ, K, S, R тить амінокислотну послідовність (наприклад, діабо Т; і (b) варіабельну область легкого ланцюга, лянка CDRL2), вибрану з SEQ ID NO: 19, 21 і 23. У що включає в себе: (і) ділянку CDR1 послідовності наступних втіленнях поліпептид також містить одSEQ ID NO: 12, де S26 являє собою S або F; D28 ну або декілька з амінокислотних послідовностей, являє собою D, S, А або Y; a H32 являє собою Η, наведених в SEQ ID NO: 3, 4, 5, 6, 7, 8. В наступΝ або Q; (іі) ділянку CDR2 послідовності SEQ ID них втіленнях поліпептид також містить одну або NO: 13, де I51 являє собою І, Т, V або A; a S56 декілька з амінокислотних послідовностей, навеявляє собою S або Т; і (ііі) ділянку CDR3 послідовдених в SEQ ID NO: 9, 10, 11, 12, 13, 14 і 15. ності SEQ ID NO: 14, де S91 являє собою S або Ε; В іншому аспекті даний винахід відноситься до Κ92 являє собою K, Н, R або S; і де Y96 являє сополіпептиду (такого, як антитіло), що містить амібою Υ або R; де антитіло зв'язується з NGF. нокислотну послідовність (наприклад, ділянку Якщо не вказано інакше, вибір (наприклад, CDR, така як CDRL3 і/або CDRH3), вибрану з (a) заміна) амінокислоти в одному положенні здійснюSEQ ID NO: 51 і/або 52; (b) SEQ ID NO: 55 і/або 56; ється незалежно від вибору амінокислоти в іншому (с) SEQ ID NO: 57 і/або 58; (с) SEQ ID NO: 59 і/або положенні. 60; (d) SEQ ID NO: 61 і/або 62; (e) SEQ ID NO: 63 У деяких втіленнях полінуклеотиди (такі як ані/або 64. У деяких втіленнях поліпептид містить титіло) зв'язуються з NGF (таким як людський амінокислотну послідовність (наприклад, ділянку NGF). У деяких втіленнях поліпептиди містять CDRL3), вибрану з SEQ ID NO: 51, 55, 57, 59, 61 і будь-які описані тут конфігурації CDR (в тому числі 63. У деяких втіленнях поліпептид містить амінопоєднання, варіанти та ін.). кислотну послідовність (наприклад, ділянку У даному описі використовується послідовна CDRH3), вибрану з SEQ ID NO: 52, 56, 58, 60, 62 і нумерація варіабельної області. Фахівцеві в даній 64. У наступних втіленнях поліпептид також місгалузі відомо, що існує декілька систем нумерації тить амінокислотну послідовність, наведену в одантитіл (таких як нумерація по Rabat і Chothia), і ній або декількох з SEQ ID NO: 18, 19, 30 і 31. У що від послідовної нумерації можна перейти до наступних втіленнях поліпептид також містить одіншої системи нумерації, такої як нумерація по ну або декілька з амінокислотних послідовностей, Kabat або нумерація по Chothia. наведених в SEQ ID NO: 3, 4, 5, 6, 7 і 8. В наступВ іншому аспекті даний винахід відноситься до них втіленнях поліпептид також містить одну або поліпептиду (такого, як антитіло), що містить амі 17 92449 18 декілька з амінокислотних послідовностей, навеють в присутності приблизно 1,5 пМ NGF. У деяких дених в SEQ ID NO: 9, 10, 11, 12, 13, 14 і 15. втіленнях поліпептиди (а) зв'язують NGF з KD В іншому аспекті даний винахід відноситься до менш ніж приблизно 100 пМ; і/або (b) інгібують поліпептиду (такого, як антитіло), що містить одну людський NGF-залежне виживання мишачих нейабо декілька з амінокислотних послідовностей ронів Ε 13.5 трійчастого нерва з ІС50, що складає (таких як ділянка CDR), наведених в SEQ ID NO: приблизно 20 пМ або менше, де ІС50 вимірюють в 61, 63, 18, 19, 30 і 31. присутності приблизно 15 пМ NGF; і/або (с) інгібуВ одному аспекті даний винахід відноситься до ють людський NGF-залежне виживання мишачих антитіла проти NGF (такого, як антагоністичне аннейронів Е13.5 трійчастого нерва з ІС50, що склатитіло), яке зв'язується з NGF (таким як людський дає приблизно 2 пМ або менше, де ІС50 вимірюють NGF) з високою спорідненістю. У деяких втіленнях в присутності приблизно 1,5 пМ. висока спорідненість означає, що антитіло (а) зв'яЯк випливає з даного опису, з даного винаходу зується з NGF з KD менш ніж приблизно 2 нМ (наособливо виключені поліпептидні втілення, що приклад, приблизно 1 нМ, 800 пМ, 600 пМ, 400 пМ, включають в себе амінокислотну послідовність, 200 пМ, 100 пМ, 90 пМ, 80 пМ, 70 пМ, 60 пМ, 50 пМ ідентичну амінокислотній послідовності мишачого моноклонального антитіла 911. Розширені посліабо менше), і/або koff, менш ніж приблизно 6 10-5 с1 довності CDR Mab 911 показані на Фіг. 1А і 1B, і в ; і/або (b) інгібує (зменшує і/або блокує) людський SEQ ID NO: 9-14. NGF-залежне виживання мишачих нейронів Е13.5 У деяких втіленнях даний винахід відноситься трійчастого нерва з ІС50 (в присутності приблизно до будь-кого з вищезгаданих поліпептидів або ан15 пМ NGF), що складає приблизно 200 пМ, 150 титіл, де поліпептид (такий як антитіло) є також пМ, 100 пМ, 80 пМ, 60 пМ, 40 пМ, 20 пМ, 10 пМ, виділеним. У деяких втіленнях поліпептид (такий або менше; і/або (с) інгібує (зменшує і/або блокує) як антитіло) є по суті очищеним. В наступних втілюдський NGF-залежне виживання мишачих нейленнях поліпептид (такий як антитіло) є афінно ронів Е13.5 трійчастого нерва з ІС50 (в присутності зрілим. В інших втіленнях антитіло є антагоністичприблизно 1,5 пМ NGF), що складає приблизно 50 ним антитілом. В деяких втіленнях поліпептид (тапМ, 40 пМ, 30 пМ, 10 пМ, 20 пМ, 10 пМ, 5 пМ, 2 пМ, кий як антитіло) містить людські каркасні послідов1 пМ, або менше; і/або (d) інгібує (зменшує і/або ності. У наступних втіленнях поліпептид (такий як блокує) щурячий NGF-залежне виживання мишаантитіло) в каркасній частині містить один або дечих нейронів Ε13.5 трійчастого нерва з ІС50 (в прикілька залишків, не характерних для людини. В сутності приблизно 15 пМ NGF), що складає прибдеяких втіленнях поліпептид (такий як антитіло) лизно 150 пМ, 125 пМ, 100 пМ, 80 пМ, 60 пМ, 40 зв'язується з NGF (таким як людський NGF) з KD 2 пМ, 30 пМ, 20 пМ, 10 пМ, 5 пМ, або менше; і/або нМ або менше. У деяких втіленнях поліпептид міс(e) інгібує (зменшує і/або блокує) щурячий NGFтить одну або декілька (наприклад, 2, 3, 4, 5, 6, 7, 8 залежне виживання мишачих нейронів Ε13.5 трійабо більше) людських амінокислотних замін у відчастого нерва з ІС50 (в присутності приблизно 1,5 мінній від людської амінокислотній послідовності пМ NGF), що складає приблизно 30 пМ, 25 пМ, 20 (такій як послідовність варіабельної області, напМ, 15 пМ, 10 пМ, 5 пМ, 4 пМ, 3 пМ, 2 пМ, 1 пМ, приклад, послідовність CDR, така як каркасна посабо менше; і/або (f) і/або зв'язує NGF з більш вилідовність). У деяких втіленнях поліпептид містить сокою спорідненістю, ніж рецептор trkA. щонайменше 1, щонайменше 2, або щонайменше В іншому аспекті даний винахід відноситься до 3, 4, 5, 6 або більше амінокислотних замін в амінополіпептидів (таких як антитіло), де поліпептиди кислотній послідовності вихідного поліпептиду (а) зв'язуються з NGF (таким як людський NGF) з (такій як амінокислотна послідовність антитіла 911, KD менш ніж приблизно 2 нМ (наприклад, приблизнаприклад, одна або декілька з SED ID NO: 9-14). но 1 нМ, 800 пМ, 600 пМ, 400 пМ, 200 пМ, 100 пМ, В деяких втіленнях зв'язувальна спорідненість 90 пМ, 80 пМ, 70 пМ, 60 пМ, 50 пМ, або менше), антитіла змінюється (в деяких втіленнях підвищуі/або koff, менш ніж приблизно 6x10-5 с-1; і/або (b) ється) в порівнянні зі спорідненістю вихідного анінгібують людський NGF-залежне виживання мититіла (такого, як Mab 911). У наступних втіленнях шачих нейронів Ε13.5 трійчастого нерва з ІС50 (в зв'язувальна спорідненість антитіла нижче зв'язуприсутності приблизно 15 пМ NGF), що складає вальної спорідненості рецептора trkA NGF (такого, приблизно 200 пМ, 150 пМ, 100 пМ, 80 пМ, 60 пМ, як людський NGF). В деяких втіленнях поліпептиди 40 пМ, 20 пМ, 10 пМ, або менше; і/або (с) інгібують можуть являти собою антитіла. В деяких втіленнях людський NGF-залежне виживання мишачих нейантитіла являють собою людські антитіла. В інших ронів Ε13.5 трійчастого нерва з ІС50 (в присутності втіленнях антитіла являють собою гуманізовані приблизно 1,5 пМ NGF), що складає приблизно 50 антитіла. У наступних втіленнях антитіла являють пМ, 40 пМ, 30 пМ, 10 пМ, 20 пМ, 10 пМ, 5 пМ, 2 пМ, собою моноклональні антитіла. У деяких втіленнях 1 пМ, або менше; і/або зв'язують NGF з більш виантитіло являє собою афінно зріле антитіло. сокою спорідненістю, ніж рецептор trkA. У деяких Даний винахід відноситься до полінуклеотидів втіленнях поліпептиди (а) зв'язують NGF з KD, (в тому числі виділених полінуклеотидів), що менш ніж приблизно 2 нМ; і/або (b) інгібують людвключають в себе полінуклеотиди, що кодують ський NGF-залежне виживання мишачих нейронів вказані вище втілення. Е13.5 трійчастого нерва з ІС50, що складає прибВ іншому аспекті даний винахід відноситься до лизно 100 пМ або менше, де ІС50 вимірюють в виділеного полінуклеотиду, що включає в себе присутності приблизно 15 пМ NGF; і/або (с) інгібуполінуклеотид, що кодує фрагмент або ділянку ють людський NGF-залежне виживання мишачих антитіла E3 (в даному описі також називається нейронів Ε13.5 трійчастого нерва з ІС50, що скла"E3"). В одному втіленні фрагмент являє собою дає приблизно 10 пМ або менше, де ІС50 вимірю 19 92449 20 легкий ланцюг антитіла E3, як показано на Фіг. 1B. РТА-4895. У деяких втіленнях клітина-хазяїн є кліВ іншому втіленні фрагмент являє собою важкий тиною ссавця. ланцюг антитіла E3, як показаний на Фіг. 1A. У В іншому аспекті даний винахід відноситься до наступному втіленні фрагмент містить один або комплексу NGF з антитілом E3. В іншому аспекті декілька варіабельних областей легкого і/або важкомплекс є виділеним. В іншому аспекті комплекс кого ланцюга антитіла E3. У наступному втіленні є по суті очищеним. фрагмент містить один або декілька гіперваріабеВ іншому аспекті даний винахід відноситься до льних областей (CDR) легкого і/або важкого ланкомплексу NGF з будь-ким з описаних тут антитіл цюга антитіла E3, як показано на Фіг. 1А і 1B. або поліпептидів. В іншому аспекті комплекс є виВ іншому аспекті даний винахід являє собою діленим. В іншому аспекті комплекс є по суті очивиділений полінуклеотид, що включає в себе поліщеним. нуклеотид, що кодує антитіло E3. У деяких втіленВ іншому аспекті даний винахід відноситься до нях полінуклеотид включає в себе один з полінукфармацевтичної композиції, що містить будь-який леотидів, показаних на Фіг. 2 і 3, або обидва. з описаних тут поліпептидів (в тому числі антитіл, В іншому аспекті даний винахід відноситься до таких як антитіло E3) або полінуклеотидів, таких як виділеного полінуклеотиду, який кодує легкий ланфармацевтична композиція, що містить антитіло цюг E3 з депозитним номером АТСС № РТА-4893 E3, або антитіло, що містить фрагмент антитіла або АТСС № РТА-4894. В іншому аспекті даний E3, і фармацевтично прийнятний наповнювач. винахід відноситься до виділеного полінуклеотиду, В іншому аспекті даний винахід відноситься до який кодує важкий ланцюг E3 з депозитним номеспособу отримання антитіла E3, що включає в ром АТСС № РТА-4895. У наступному аспекті дасебе отримання клітини-хазяїна, що містить вектор ний винахід відноситься до виділеного полінуклеоекспресії, який кодує антитіло E3; культивування тиду, що містить (а) полінуклеотид з депозитним клітини-хазяїна або її потомства в умовах, які дономером АТСС № РТА-4893 або РТА-4894, який зволяють отримати антитіло E3; і очищення антикодує варіабельну область, і (b) полінуклеотид з тіла E3. У деяких втіленнях вектор експресії місдепозитним номером АТСС № РТА-4895, що кодує тить одну з полінуклеотидних послідовностей, варіабельну область. В іншому аспекті даний випоказаних на Фіг. 2 і 3, або обидві ці послідовності. нахід відноситься до виділеного полінуклеотиду, В іншому аспекті даний винахід відноситься до що містить (а) полінуклеотид з депозитним номеспособу отримання антитіла E3, що включає в ром АТСС № РТА-4893 або РТА-4894, що кодує себе експресію полінуклеотиду, що кодує легкий один або декілька CDR; і/або (b) полінуклеотид з ланцюг E3, і полінуклеотиду, що кодує важкий ладепозитним номером АТСС № РТА-4895, що кодує нцюг E3 у відповідній клітині, де полінуклеотид, що один або декілька CDR. кодує легкий ланцюг E3, має депозитний номер В іншому аспекті даний винахід відноситься до АТС С № РТА-4893 і/або АТСС № РТА-4894, а полінуклеотидів, що кодують описані тут антитіла полінуклеотид, що кодує важкий ланцюг E3, має (в тому числі фрагменти антитіл) або поліпептиди. депозитний номер АТСС № РТА-4895; як правило, В іншому аспекті даний винахід відноситься до з подальшим витяганням і/або виділенням антитівекторів (в тому числі векторів експресії і клонула. вання) і клітин-хазяїнів, що містять будь-який розВ іншому аспекті даний винахід відноситься до критий тут полінуклеотид. способів отримання описаних тут поліпептидів Як видно з даного опису, в даний винахід осо(таких як антитіла) шляхом експресії одного або бливо включені полінуклеотидні втілення, що декількох полінуклеотидів, що кодують антитіло включають в себе полінуклеотидну послідовність, (причому легкий і важкий ланцюги можуть експреідентичну полінуклеотидній послідовності мишачосуватися окремо або разом, з одного вектора), у го моноклонального антитіла 911. Розширені посвідповідній клітині, як правило, з подальшим витялідовності CDR Mab 911 показані на Фіг. 1А і 1B і в ганням і/або виділенням антитіл або поліпептидів, SEQ ID NO: 9-14. що представляють інтерес. В іншому аспекті даний винахід відноситься до В іншому аспекті даний винахід відноситься до клітини-хазяїна, що містить полінуклеотид, що способу пригнічення біологічної активності NGF кодує легкий ланцюг E3, і полінуклеотид, що кодує (такого, як людський NGF) за допомогою будьважкий ланцюг E3, де полінуклеотид(и), що кодує якого з описаних тут поліпептидів (включаючи анлегкий ланцюг E3, має депозитний номер АТСС № титіла, такі як антитіло E3). В одному втіленні споРТА-4893 і/або АТСС № РТА-4894, а полінуклеосіб включає в себе приведення в контакт людськотид, що кодує важкий ланцюг E3, має депозитний го фактора росту нервів з будь-яким з описаних номер АТСС № РТА-4895. У деяких втіленнях клітут поліпептидів (включаючи антитіло E3), внаслітина-хазяїн містить полінуклеотид, що включає в док чого активність NGF (наприклад, активність себе (а) полінуклеотид з депозитним номером людського фактора росту нервів) пригнічується, АТСС № РТА-4893 або РТА-4894, що кодує варіазменшується, блокується або ослаблюється. бельну область, і/або (b) полінуклеотид з депозитВ іншому аспекті даний винахід відноситься до ним номером АТСС № РТА-4895, що кодує варіаспособу детекції NGF за допомогою будь-якого з бельну область. У деяких втіленнях клітина-хазяїн описаних тут поліпептидів (включаючи антитіла, містить полінуклеотид, що кодує (а) один або декітакі як антитіло E3). Присутність NGF визначають лька CDR, що кодуються полінуклеотидом з депошляхом детекції комплексу NGF з будь-яким з зитним номером АТСС № РТА-4893 або РТА-4894; описаних тут поліпептидів (таких як антитіло E3). і/або (b) один або декілька CDR, що кодуються Термін "детекція" в даному описі включає в себе полінуклеотидом з депозитним номером АТСС № якісне і/або кількісне визначення (рівнів, що вимі 21 92449 22 рюються) в порівнянні з контролем, або без порівФіг. 1A: амінокислотна послідовність варіабеняння з контролем. льної області важкого ланцюга антитіла E3 (познаВ іншому аспекті даний винахід відноситься до чена "6" і "5+афінно зрілий H3"). CDR Chothia і способу лікування болю шляхом введення ефекCDR Kabat підкреслені і виділені жирним шрифтом тивної кількості композиції, що містить антитіло E3, і курсивом, відповідно. На Фіг. 1A також порівнюабо будь-яке з описаних тут поліпептидних (вклюються первинні структури наступних амінокислотчаючи антитіла) або полінуклеотидних втілень. У них послідовностей варіабельних областей важкодеяких втіленнях біль являє собою післяопераційго ланцюга: (1) послідовності CDR H1 (SEQ ID ний біль. NO:9), Н2 (SEQ ID NO:10) і H3 (SEQ ID NO:11) миВ іншому аспекті даний винахід відноситься до шачого антитіла 911; (2) акцепторної послідовності способу профілактики або лікування у суб'єкта людської зародкової лінії VH4-59 (позначеної болю при ревматоїдному артриті шляхом введен"VH4-59" або "2") (SEQ ID NO:69); (3) акцепторних ня суб'єкту ефективної кількості антагоністичного послідовностей з прищепленими розширеними антитіла проти NGF. Згідно з даним винаходом, CDR мишачого антитіла 911 (позначених "CDRбуло показано, що антагоністичне антитіло проти прищеплені" або "3") (SEQ ID NO:70); (4) CDRNGF може інгібувати або блокувати біль, пов'язаприщеплених акцепторних послідовностей, що ний з ревматоїдним артритом. У деяких втіленнях містять заміну V71K (позначених "3+одна каркасна біль зменшується протягом приблизно 24 годин мутація" або "4") (SEQ ID NO:71); (5) клону, що після введення антагоністичного антитіла проти містить афінно зрілі CDR H1 і Н2 (позначеного "5" NGF. У деяких втіленнях біль зменшується протяабо "4+афінно-зрілий H1, Н2") (SEQ ID NO:72) ; і гом приблизно 4 днів після введення антагоністичантитіла E3 (як описано вище) (SEQ ID NO:1). ного антитіла проти NGF. У деяких втіленнях біль Фіг. 1B: амінокислотна послідовність варіабезменшується до появи симптомів поліпшення зальної області легкого ланцюга антитіла E3 (познапального стану у суб'єкта, або у відсутність таких чена "5" або "4+афінно зрілий L3"). CDR Chothia і симптомів. CDR Kabat підкреслені і виділені жирним шрифтом В іншому аспекті даний винахід відноситься до і курсивом, відповідно. На Фіг. 1B також порівнюспособів зниження частоти виникнення болю при ються первинні структури наступних амінокислотревматоїдному артриті, зменшення болю при ревних послідовностей варіабельних областей легкоматоїдному артриті, пригнічення болю при ревмаго ланцюга: (1) послідовності CDRL1 (SEQ ID тоїдному артриті, полегшення болю при ревматоїNO:12), L2 (SEQ ID NO:13) і L3 (SEQ ID NO:14) дному артриті, і/або сповільнення виникнення, мишачого антитіла 911; (2) акцепторної послідоврозвитку або прогресування болю при ревматоїдності людської зародкової лінії 08 (позначеної "08" ному артриті у суб'єкта, причому вказані способи або "2") (SEQ ID NO:73); (3) акцепторних послідоввключають в себе введення суб'єкту ефективної ностей з прищепленими розширеними CDR мишакількості антагоністичного антитіла проти NGF. чого антитіла 911 (позначених "CDR-прищеплені" В іншому аспекті даний винахід відноситься до або "3") (SEQ ID NO:74); (4) CDR-прищеплених способу профілактики або лікування у суб'єкта акцепторних послідовностей (позначених болю при остеоартриті шляхом введення суб'єкту "3+афінно зрілі L1, L2" або вище). ефективної кількості антагоністичного антитіла Фіг. 2: полінуклеотид, який містить полінуклеопроти NGF. тидну послідовність, що кодує варіабельну обВ іншому аспекті даний винахід відноситься до ласть важкого ланцюга антитіла E3. способів лікування у суб'єкта запальної кахексії Фіг. 3: полінуклеотид, який містить полінуклео(втрати ваги), пов'язаної з ревматоїдним артритом, тидну послідовність, що кодує варіабельну общо включає в себе введення ефективної кількості ласть легкого ланцюга антитіла E3. антагоністичного антитіла проти NGF. В іншому Фіг. 4: графік, який зображає NGF-залежне виаспекті даний винахід відноситься до способів живання нейронів Ε13.5 в присутності різних конзниження частоти виникнення болю при остеоартцентрацій людського і щурячого NGF. На осі X відриті, зменшення болю при остеоартриті. придукладають значення концентрації NGF (нг/мл), а на шення болю при остеоартриті, полегшення болю осі Υ - кількість нейронів. при остеоартриті, і/або сповільнення виникнення, Фіг. 5: графік, в якому порівнюється блокуюча розвитку або прогресування болю при остеоартридія різних Fab на NGF в присутності або 0,04 нг/мл ті у суб'єкта, причому вказані способи включають в людського NGF (приблизно 1,5 пМ; нижня частисебе введення суб'єкту ефективної кількості антана), або 0,4 нг/мл людського NGF (приблизно 15 гоністичного антитіла проти NGF. пМ; верхня частина). Оцінюють виживання мишаВ іншому аспекті даний винахід відноситься до чих нейронів трійчастого нерва Ε13.5 при різних наборів і композицій, що включають в себе одну концентраціях Fab E3; Fab мишачого 911; Fab або декілька з описаних тут композицій. Згадані H19-L129 і Fab 8L2-6D5. ІС50 (пМ) розраховують набори, як правило, з відповідним комплектувандля кожного Fab при кожній концентрації NGF, ням і забезпечені відповідними інструкціями, можрезультати наведені в таблиці9. Fab E3 сильно на використати для проведення будь-якого з опиблокує людський NGF-залежне виживання нейросаних тут способів. нів трійчастого нерва, при цьому ІС50 становить Даний винахід також відноситься до описаних приблизно 21 пМ в присутності 15 пМ людського композицій і наборів для будь-якого описаного тут NGF, і приблизно 1,2 пМ в присутності 1,5 пМ людзастосування, наприклад, як лікарський засіб, і/або ського NGF. Fab 3С і H19-L129 також сильно блодля промислового отримання лікарського засобу. кують людський NGF-залежне виживання нейронів Короткий опис малюнків трійчастого нерва. В обох частинах на осі X відк 23 92449 24 ладають значення концентрації антитіла (нМ), а на відкладають кількість ділянок зв'язування NGF осі Υ - кількість нейронів. Концентрація NGF 1,5 пМ (нМ), а на осі Υ - нормалізовану кількість нейронів близька до ІС50, тоді як 15 пМ - це насичуюча контрійчастого нерва (TG). Ціле антитіло E3 і Fab 3E центрація NGF. демонструють однакові рівні інгібування NGFФіг. 6: графік, в якому порівнюється блокуюча залежного виживання нейронів трійчастого нерва, дія різних Fab на NGF в присутності або 0,04 нг/мл якщо концентрацію цілого антитіла і Fab нормаліщурячого NGF (приблизно 1,5 пМ; нижня частина), зують за кількістю ділянок зв'язування NGF (Fab або 0,4 нг/мл щурячого NGF (приблизно 15 пМ; має одну ділянку зв'язування, а ціле антитіло має верхня частина). Оцінюють виживання мишачих дві ділянки зв'язування). нейронів трійчастого нерва Е13.5 при різних конФіг. 13: графік, що демонструє здатність різних центраціях Fab E3; Fab мишачого 911; Fab H19концентрацій (20, 4, 0,8, 0,16, 0,032, 0,0064, L129 і Fab 8L2-6D5, як описано вище. ІС50 (пМ) 0,00128 і 0,0 нМ) антитіла E3 (зафарбовані трикутрозраховують для кожного Fab при кожній конценники; званого "3E"), антитіла 911 (зафарбовані трації NGF, результати наведені в таблиці 9. Fab кружки) і рецептора імуноадгезину trkA (заштрихоE3 сильно блокує людський NGF-залежне виживані квадрати; званого "trkA-Fc") інгібувати NGFвання нейронів трійчастого нерва, при цьому ІС50 залежне виживання нейронів трійчастого нерва становить приблизно 31,6 пМ в присутності 15 пМ Ε13.5 в присутності 0,4 нг/мл людського NGF (умощурячого NGF, і приблизно 1,3 пМ в присутності ви насичення). На осі X відкладають значення 1,5 пМ щурячого NGF. Fab 3C і H19-L129 також концентрації антитіла (нМ), а на осі Υ - кількість сильно блокують щурячий NGF-залежне виживаннейронів. Отримані результати показують, що ання нейронів трійчастого нерва. Концентрація NGF титіло E3 блокує NGF набагато краще, ніж мишаче 1,5 пМ близька до ІС50, тоді як 15 пМ - це насичуюмоноклональне антитіло 911 проти NGF або імуча концентрація NGF. В обох частинах на осі X ноадгезин trkA. відкладають значення концентрації антитіла (нМ), Фіг. 14: графік, який демонструє, що антагоніса на осі Υ - кількість нейронів. тичне антитіло E3 проти NGF (назване на фігурі Фіг. 7: графік, що зображає біль в стані спо"3E") або Fab 911 не інгібують виживання нейрокою, оцінений через 24 години після хірургічної нів, стимульоване NT3, NT4/5 і MSP, навіть при операції, і який показує, що введення 0,02 мг/кг, концентрації антитіла 200 нМ. Дані представлені 0,1 мг/кг, 0,6 мг/кг або 1 мг/кг антитіла E3 проти як середній відсоток виживання в культурі через NGF зменшує біль. "*" означає статистично значу48 годин (кожна точка: середнє значення щу відмінність (р
ДивитисяДодаткова інформація
Назва патенту англійськоюAnti-ngf antibodies and methods using same
Автори англійськоюShelton David L., Rosenthal Arnon, Rosenthal Arnon
Назва патенту російськоюАнтитело против ngf и способ его применения
Автори російськоюШелтон Дэвид Л., Понз Хауме, Розенталь Арнон
МПК / Мітки
МПК: A61K 39/395, A61P 37/00, C07K 16/22, C07K 19/00
Мітки: антитіло, застосування, спосіб
Код посилання
<a href="https://ua.patents.su/103-92449-antitilo-proti-ngf-i-sposib-jjogo-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Антитіло проти ngf і спосіб його застосування</a>