Антитіло до cd38 для лікування раку
Номер патенту: 114879
Опубліковано: 28.08.2017
Автори: Бартл Лаура М., Парк Пітер Ю, Таварес Даніель, Декерт Ютта, Блан Веронік, Голмахер Віктор С., Скалетская Анна, Міколь Венсан
Формула / Реферат
1. Гуманізоване антитіло або його фрагмент, що зв'язується з епітопом, які специфічно зв'язують CD38,
де вказане антитіло або його фрагмент, що зв'язується з епітопом, включають щонайменше один важкий ланцюг і щонайменше один легкий ланцюг, де
вказаний важкий ланцюг включає три послідовні області, що визначають комплементарність, які мають амінокислотні послідовності, представлені SEQ ID NO: 13, амінокислотними залишками 50-66 SEQ ID NO: 66 і SEQ ID NO: 15, і де вказаний легкий ланцюг включає три послідовні області, що визначають комплементарність, які мають амінокислотні послідовності, представлені SEQ ID NO: 16, 17 і 18,
де вказані антитіло або його фрагмент, що зв'язується з епітопом, здатні викликати цитоліз клітин CD38+ за допомогою апоптозу, антитілозалежної клітинно-опосередкованої цитотоксичності (ADCC) і комплементзалежної цитотоксичності (CDC).
2. Гуманізоване антитіло або його фрагмент, що зв'язується з епітопом, за п. 1, які відрізняються тим, що вказане антитіло або його фрагмент, що зв'язується з епітопом, здатні викликати цитоліз клітин CD38+ за допомогою апоптозу за відсутності клітин строми або одержаних зі строми цитокінів.
3. Гуманізоване антитіло або його фрагмент, що зв'язується з епітопом, за будь-яким з пп. 1-2, які відрізняються тим, що вказана клітина CD38+ являє собою клітину лімфоми, лейкозну клітину або клітину множинної мієломи.
4. Гуманізоване антитіло або його фрагмент, що зв'язується з епітопом, за п. 3, які відрізняються тим, що вказана клітина CD38+ являє собою клітину неходжкінської лімфоми (NHL), клітину лімфоми Беркітта (BL), клітину множинної мієломи (MM), клітину хронічного В-лімфолейкозу (B-CLL), клітину гострого В- і Т-лімфолейкозу (ALL), клітину Т-клітинної лімфоми (TCL), клітину гострого мієлолейкозу (AML), клітину волосатоклітинного лейкозу (HCL), клітину лімфоми Ходжкіна (HL) або клітину хронічного мієлолейкозу (CML).
5. Гуманізоване антитіло або його фрагмент, що зв'язується з епітопом, за п. 1, які відрізняються тим, що
вказане антитіло або його фрагмент, що зв'язується з епітопом, здатні викликати цитоліз щонайменше 24 % клітин лімфоми Daudi за допомогою апоптозу за відсутності клітин строми або цитокінів, одержаних зі строми; і/або
вказане антитіло або його фрагмент, що зв'язується з епітопом, здатні викликати цитоліз більше ніж 7 % клітин лімфоми Ramos за допомогою апоптозу за відсутності клітин строми або цитокінів, одержаних зі строми; і/або
вказане антитіло або його фрагмент, що зв'язується з епітопом, здатні викликати цитоліз більше ніж 11 % клітин множинної мієломи MOLP-8 за допомогою апоптозу за відсутності клітин строми або цитокінів, одержаних зі строми; і/або
вказане антитіло або його фрагмент, що зв'язується з епітопом, здатні викликати цитоліз більше ніж 36 % клітин лімфоми SU-DHL-8 за допомогою апоптозу за відсутності клітин строми або цитокінів, одержаних зі строми; і/або
вказане антитіло або його фрагмент, що зв'язується з епітопом, здатні викликати цитоліз більше ніж 62 % клітин лейкозу DND-41 за допомогою апоптозу за відсутності клітин строми або цитокінів, одержаних зі строми; і/або
вказане антитіло або його фрагмент, що зв'язується з епітопом, здатні викликати цитоліз більше ніж 27 % клітин лімфоми NU-DUL-1 за допомогою апоптозу за відсутності клітин строми або цитокінів, одержаних зі строми; і/або
вказане антитіло або його фрагмент, що зв'язується з епітопом, здатні викликати цитоліз більше ніж 9 % клітин лейкозу JVM-13 за допомогою апоптозу за відсутності клітин строми або цитокінів, одержаних зі строми; і/або
вказане антитіло або його фрагмент, що зв'язується з епітопом, здатні викликати цитоліз більше ніж 4 % клітин лейкозу НС-1 за допомогою апоптозу за відсутності клітин строми або цитокінів, одержаних зі строми.
6. Гуманізоване антитіло або його фрагмент, що зв'язується з епітопом, за будь-яким з попередніх пунктів, які відрізняються тим, що вказане антитіло або його фрагмент, що зв'язується з епітопом, зв'язуються з CD38 з kD 3´10-9 М або нижче.
7. Гуманізоване антитіло або його фрагмент, що зв'язується з епітопом, за п. 1, які відрізняються тим, що вказане антитіло або його фрагмент, що зв'язується з епітопом, включають щонайменше одну константну область людини.
8. Гуманізоване антитіло або його фрагмент, що зв'язується з епітопом, за п. 1, які відрізняються тим, що вказане гуманізоване антитіло або його фрагмент, що зв'язується з епітопом, включають варіабельну область важкого ланцюга, що має амінокислотну послідовність SEQ ID NO: 66.
9. Гуманізоване антитіло або його фрагмент, що зв'язується з епітопом, за п. 1, які відрізняються тим, що вказане гуманізоване антитіло або його фрагмент, що зв'язується з епітопом, включають варіабельну область легкого ланцюга, що має амінокислотну послідовність, вибрану з групи SEQ ID NO: 62 і 64.
10. Гуманізоване антитіло або його фрагмент, що зв'язується з епітопом, за п. 1, які відрізняються тим, що вказане антитіло або його фрагмент, що зв'язується з епітопом, являють собою фрагмент Fab, Fab', F(ab')2 або Fv.
11. Кон'югат, що включає антитіло, або його фрагмент, що зв'язується з епітопом, за будь-яким з пп. 1-10, з'єднані з цитотоксичним агентом.
12. Кон'югат за п. 11, який відрізняється тим, що вказаний цитотоксичний агент вибраний з групи, яка складається з мейтансиноїду, невеликого лікарського засобу, похідного томейміцину, похідного лептоміцину, проліків, таксоїду, СС-1065 і аналога СС-1065.
13. Кон'югат за п. 12, який відрізняється тим, що вказаний цитотоксичний агент являє собою мейтансин DM1 формули:
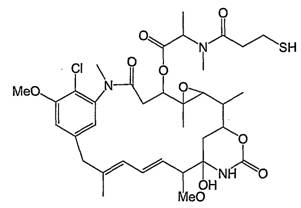
або
вказаний цитотоксичний агент являє собою мейтансин DM4 формули:
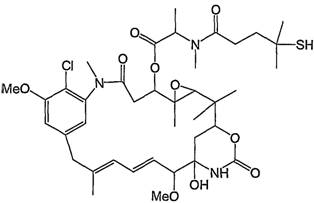 ,
,
або
вказаний цитотоксичний агент являє собою похідне томейміцину, вибране з групи, що складається з:
8,8'-[1,3-бензолдіїлбіс(метиленокси)]-біс[(S)-2-ет-(Е)-иліден-7-метокси-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[5-метокси-1,3-бензолдіїлбіс(метиленокси)]-біс[(S)-2-ет-(Е)-иліден-7-метокси-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[1,5-пентандіїлбіс(окси)]-біс[(S)-2-ет-(Е)-иліден-7-метокси-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[1,4-бутандіїлбіс(окси)]-біс[(S)-2-ет-(Е)-иліден-7-метокси-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[3-метил-1,5-пентандіїлбіс(окси)]-біс[(S)-2-ет-(Е)-иліден-7-метокси-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[2,6-піридиндіїлбіс(окси)]-біс[(S)-2-ет-(Е)-иліден-7-метокси-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[4-(3-трет-бутоксикарбоніламінопропілокси)-2,6-піридиндіїлбіс-(метиленокси)]-біс[(S)-2-ет-(Е)-иліден-7-метокси-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[5-(3-амінопропілокси)-1,3-бензолдіїлбіс(метиленокси)}-біс[(S)-2-ет-(Е)-иліден-7-метокси-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[5-(N-метил-3-трет-бутоксикарбоніламінопропіл)-1,3-бензолдіїлбіс(метиленокси)]-біс[(S)-2-ет-(Е)-иліден-7-метокси-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-{5-[3-(4-метил-4-метилдисульфанілпентаноїламіно)пропілокси]-1,3-бензолдіїлбіс(метиленокси)-біс[(S)-2-ет-(Е)-иліден-7-метокси-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[5-ацетилтіометил-1,3-бензолдіїлбіс(метиленокси)]-біс[(S)-2-метилен-7-метокси-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону],
складного трет-бутилового ефіру біс-{2-[(S)-2-метилен-7-метокси-5-оксо-1,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-8-ілокси]етил}карбамінової кислоти,
8,8'-[3-(2-ацетилтіоетил)-1,5-пентандіїлбіс(окси)]-біс[(S)-2-метилен-7-метокси-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[5-(N-4-меркапто-4,4-диметилбутаноїл)аміно-1,3-бензолдіїлбіс(метиленокси)]-біс[7-метокси-2-метилен-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[5-(N-4-метилдитіо-4,4-диметилбутаноїл)аміно-1,3-бензолдіїлбіс(метиленокси)]-біс[7-метокси-2-метилен-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[5-(N-метил-N-(2-меркапто-2,2-диметилетил)аміно-1,3-бензолдіїл(метиленокси)]-біс[7-метокси-2-метилен-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[5-(N-метил-N-(2-метилдитіо-2,2-диметилетил)аміно-1,3-бензолдіїл(метиленокси)]-біс[7-метокси-2-метилен-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[(4-(2-(4-меркапто-4-метил)пентанамідоетокси)піридин-2,6-диметил)діокси]-біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[(1-(2-(4-метил-4-метилдисульфаніл)пентанамідоетокси)бензол-3,5-диметил)діокси]-біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[(4-(3-(4-метил-4-метилдисульфаніл)пентанамідопропокси)піридин-2,6-диметил)діокси]-біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[(4-(4-(4-метил-4-метилдисульфаніл)пентанамідобутокси)піридин-2,6-диметил)діокси]-біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[(4-(3-[4-(4-метил-4-метилдисульфанілпентаноїл)піперазин-1-іл]пропіл)піридин-2,6-диметил)діокси]-біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[(1-(3-[4-(4-метил-4-метилдисульфанілпентаноїл)піперазин-1-іл]пропіл)бензол-3,5-диметил)діокси]-біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[(4-(2-{2-[2-(4-метил-4-метилдисульфанілпентаноїламіно)етокси]етокси}етокси)піридин-2,6-диметил)діокси]-біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[(1-(2-{2-[2-(2-{2-[2-(4-метил-4-метилдисульфанілпентаноїламіно)етокси]етокси}етокси)етокси]етокси}етокси)бензол-3,5-диметил)діокси]-біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[(1-(2-{2-[2-(4-метил-4-метилдисульфанілпентаноїламіно)етокси]етокси}етокси)бензол-3,5-диметил)діокси]-біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[(4-(2-{2-[2-(2-{2-[2-(4-метил-4-метилдисульфанілпентаноїламіно)етокси]етокси}етокси)етокси]етокси}етокси)піридин-2,6-диметил)діокси]-біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[(1-(2-[метил-(2-метил-2-метилдисульфанілпропіл)аміно]етокси)бензол-3,5-диметил)діокси]-біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[(4-(3-[метил-(4-метил-4-метилдисульфанілпентаноїл)аміно]пропіл)піридин-2,6-диметил)діокси]-біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[(4-(3-[метил-(2-метил-2-метилдисульфанілпропіл)аміно]пропіл)піридин-2,6-диметил)діокси]-біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1-c][1,4]бензодіазепін-5-ону],
8,8'-[(1-(4-метил-4-метилдисульфаніл)пентанамідо)бензол-3,5-диметил)діокси]-біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1-c][1,4]бензодіазепін-5-ону],
або
вказаний цитотоксичний агент являє собою похідне лептоміцину, вибране з групи, що складається з:
(2-метилсульфанілетил)аміду (2E,10E,12E,16Z,18E)-(R)-6-гідрокси-3,5,7,9,11,15,17-гептаметил-19-((2S,3S)-3-метил-6-оксо-3,6-дигідро-2Н-піран-2-іл)-8-оксо-нонадека-2,10,12,16,18-пентаноєвої кислоти,
біс-[(2-меркаптоетил)аміду (2E,10E,12E,16Z,18E)-(R)-6-гідрокси-3,5,7,9,11,15,17-гептаметил-19-((2S,3S)-3-метил-6-оксо-3,6-дигідро-2Н-піран-2-іл)-8-оксо-нонадека-2,10,12,16,18-пентаноєвої кислоти],
(2-меркаптоетил)аміду (2E,10E,12E,16Z,18E)-(R)-6-гідрокси-3,5,7,9,11,15,17-гептаметил-19-((2S,3S)-3-метил-6-оксо-3,6-дигідро-2Н-піран-2-іл)-8-оксо-нонадека-2,10,12,16,18-пентаноєвої кислоти,
(2-метилдисульфанілетил)аміду (2E,10E,12E,16Z,18E)-(R)-6-гідрокси-3,5,7,9,11,15,17-гептаметил-19-((2S,3S)-3-метил-6-оксо-3,6-дигідро-2Н-піран-2-іл)-8-оксо-нонадека-2,10,12,16,18-пентаноєвої кислоти,
(2-метил-2-метилдисульфанілпропіл)аміду (2E,10E,12E,16Z,18E)-(R)-6-гідрокси-3,5,7,9,11,15,17-гептаметил-19-((2S,3S)-3-метил-6-оксо-3,6-дигідро-2Н-піран-2-іл)-8-оксо-нонадека-2,10,12,16,18-пентаноєвої кислоти,
(2-меркапто-2-метил)аміду (2E,10E,12E,16Z,18E)-(R)-6-гідрокси-3,5,7,9,11,15,17-гептаметил-19-((2S,3S)-3-метил-6-оксо-3,6-дигідро-2Н-піран-2-іл)-8-оксо-нонадека-2,10,12,16,18-пентаноєвої кислоти.
14. Застосування антитіла або його фрагмента, що зв'язується з епітопом, за будь-яким з пп. 1-10 або кон'югата за будь-яким з пп. 11-13 як лікарського засобу.
15. Фармацевтична композиція, що містить антитіло або його фрагмент, що зв'язується з епітопом, за будь-яким з пп. 1-10 або кон'югат за будь-яким з пп. 11-13 і фармацевтично прийнятний носій або ексципієнти.
16. Фармацевтична композиція за п. 15, яка відрізняється тим, що композиція містить ще один терапевтичний засіб.
17. Фармацевтична композиція за п. 16, яка відрізняється тим, що ще один терапевтичний засіб являє собою антагоніст епідермального фактора росту (EGF), фактора росту фібробластів (FGF), фактора росту гепатоцитів (HGF), тканинного фактора (TF), білка С, білка S, фактора росту, одержаного з тромбоцитів (PDGF), герегуліну, білка, що стимулює макрофаги (MSP), або фактора росту судинного ендотелію (VEGF), або антагоніст рецептора епідермального ростового фактора (EGF), фактора росту фібробластів (FGF), фактора росту гепатоцитів (HGF), тканинного фактора (TF), білка С, білка S, фактора росту, одержаного з тромбоцитів (PDGF), герегуліну, білка, що стимулює макрофаги (MSP), або фактора росту судинного ендотелію (VEGF), включаючи рецептор HER2, рецептор HER3, c-MET, і тирозинкіназ інших рецепторів; або вказаний ще один терапевтичний засіб являє собою антитіло, спрямоване проти кластера антигенів диференціації, вибраного з групи, що включає CD3, CD14, CD19, CD20, CD22, CD25, CD28, CD30, CD33, CD36, CD40, CD44, CD52, CD55, CD59, CD56, CD70, CD79, CD80, CD103, CD134, CD137, CD138 і CD152.
18. Застосування антитіла або його фрагмента, що зв'язується з епітопом, за будь-яким з пп. 1-10 або кон'югата за будь-яким з пп. 11-13 для одержання лікарського засобу для лікування раку або аутоімунного захворювання.
19. Застосування за п. 18, яке відрізняється тим, що
вказаний рак вибраний з групи, що складається з карциноми, включаючи карциному сечового міхура, молочної залози, ободової кишки, нирки, печінки, легені, яєчника, підшлункової залози, шлунка, шийки матки, щитовидної залози і шкіри; включаючи плоскоклітинну карциному; пухлини мезенхімального походження, включаючи фібросаркому і рабдоміосаркому; інші пухлини, включаючи меланому, семіному, тератокарциному, нейробластому і гліому; пухлини центральної і периферичної нервової системи, включаючи астроцитому, нейробластому, гліому і шваноми; пухлини мезенхімального походження, включаючи фібросаркому, рабдоміосаркому і остеосаркому; та інші пухлини, включаючи меланому, пігментну ксеродермію, кератоакантому, семіному, фолікулярний рак щитовидної залози і тератокарциному щитовидної залози, або
вказаний рак вибраний з групи, що складається з гематопоетичних пухлин лімфоїдної лінії диференціювання, включаючи лейкоз, неходжкінську лімфому, гострий лімфолейкоз, гострий лімфобластний лейкоз, В-клітинну лімфому, Т-клітинну лімфому, лімфому Беркітта; лімфому Ходжкіна, волосатоклітинний лейкоз, множинну мієлому, хронічний лімфолейкоз; гематопоетичних пухлин мієлоїдної лінії диференціювання, включаючи гострі і хронічні мієлолейкози і промієлоцитарний лейкоз, або
вказане аутоімунне або запальне захворювання вибране з групи, що складається з системного червоного вовчака, ревматоїдного артриту, розсіяного склерозу, хвороби Крона, виразкового коліту, гастриту, тироїдиту Хашимото, анкілозуючого спондиліту, кріоглобулінемічного васкуліту, пов'язаного з гепатитом С, хронічного осередкового енцефаліту, псевдопухирчатки, гемофілії А, мембранопроліферативного гломерулонефриту, синдрому Шегрена, дерматоміозиту дорослих і ювенільного дерматоміозиту, поліміозиту дорослих, хронічного висипу, первинного біліарного цирозу, ідіопатичної тромбоцитопенічної пурпури, нейромієліту зорового нерва, дистиреоїдної хвороби Грейвса, псевдопухирчатки, мембранопроліферативного гломерулонефриту, синдрому Чарга-Штрауса і астми.
20. Застосування за п. 18 або 19, де вказаний рак являє собою множинну мієлому.
21. Застосування за п. 18, що додатково включає застосування ще одного терапевтичного засобу при одержанні такої ж або іншої композиції.
22. Застосування за п. 21, яке відрізняється тим, що ще один терапевтичний засіб являє собою антагоніст фактора росту фібробластів (FGF), фактора росту гепатоцитів (HGF), тканинного фактора (TF), білка С, білка S, фактора росту, одержаного з тромбоцитів (PDGF), герегуліну, білка, що стимулює макрофаги (MSP), або фактора росту судинного ендотелію (VEGF), або антагоніст рецептора епідермального фактора росту (EGF), фактора росту фібробластів (FGF), фактора росту гепатоцитів (HGF), тканинного фактора (TF), білка С, білка S, фактора росту, одержаного з тромбоцитів (PDGF), герегуліну, білка, що стимулює макрофаги (MSP), або фактора росту судинного ендотелію (VEGF), включаючи рецептор HER2, рецептор HER3, c-MET, і тирозинкіназ інших рецепторів, або вказаний ще один терапевтичний засіб являє собою антитіло, спрямоване проти кластера антигенів диференціації, вибраного з групи, що включає CD3, CD14, CD19, CD20, CD22, CD25, CD28, CD30, CD33, CD36, CD40, CD44, CD52, CD55, CD59, CD56, CD70, CD79, CD80, CD103, CD134, CD137, CD138 і CD152.
23. Спосіб діагностики раку у суб'єкта, наявність раку у якого відома або підозрюється, причому вказаний спосіб включає:
а) приведення клітин вказаного пацієнта у контакт з антитілом або його фрагментом, що зв'язується з епітопом, за пп. 1-10,
b) вимірювання зв'язування вказаного антитіла або його фрагмента, що зв'язується з епітопом, із вказаними клітинами, і
с) порівняння вираження у частині (b) з його вираженням у здорового еталонного суб'єкта або стандарту.
24. Спосіб за п. 23, який відрізняється тим, що вказаний рак вибраний з групи, що складається з карциноми, включаючи карциному сечового міхура, молочної залози, ободової кишки, нирки, печінки, легені, яєчника, підшлункової залози, шлунка, шийки матки, щитовидної залози і шкіри; включаючи плоскоклітинну карциному; пухлини мезенхімального походження, включаючи фібросаркому і рабдоміосаркому; інші пухлини, включаючи меланому, семіному, тератокарциному, нейробластому і гліому; пухлини центральної і периферичної нервової системи, включаючи астроцитому, нейробластому, гліому і шваноми; пухлини мезенхімального походження, включаючи фібросаркому, рабдоміосаркому і остеосаркому; та інші пухлини, включаючи меланому, пігментну ксеродермію, кератоакантому, семіному, фолікулярний рак щитовидної залози і тератокарциному щитовидної залози, або вказаний рак вибраний з групи, що складається з гематопоетичних пухлин лімфоїдної лінії диференціювання, включаючи лейкоз, неходжкінську лімфому, гострий лімфолейкоз, гострий лімфобластний лейкоз, В-клітинну лімфому, Т-клітинну лімфому, лімфому Беркітта; лімфому Ходжкіна, волосатоклітинний лейкоз, множинну мієлому, хронічний лімфолейкоз; гематопоетичних пухлин мієлоїдної лінії диференціювання, включаючи гострі і хронічні мієлолейкози і промієлоцитарний лейкоз.
25. Спосіб за п. 23, який відрізняється тим, що вказані клітини знаходяться у замороженій або фіксованій тканині або клітинах від вказаного пацієнта.
26. Полінуклеотид, який відрізняється тим, що вказаний полінуклеотид кодує антитіло за пп. 1-10.
27. Рекомбінантний вектор, що включає полінуклеотид за п. 26.
28. Клітина-хазяїн, що включає вектор за п. 27.
29. Антитіло, яке специфічно зв'язує CD38, де вказане антитіло включає: легкий ланцюг, що містить варіабельну область, представлену амінокислотною послідовністю SEQ ID NO: 62; і важкий ланцюг, що містить варіабельну область, представлену амінокислотною послідовністю SEQ ID NO: 66.
Текст
Реферат: UA 114879 C2 (12) UA 114879 C2 Винахід належить до гуманізованого антитіла, антитіла з реструктурованою поверхнею, фрагмента антитіла і їх кон'югатів з цитотоксичними агентами, що специфічно зв'язуються з + CD38, здатні викликати цитоліз клітин CD38 шляхом апоптозу, антитілозалежної клітинноопосередкованої цитотоксичності (ADCC) і комплементзалежної цитотоксичності (CDC) для лікування пухлин, що експресують білок CD38. UA 114879 C2 5 10 15 20 25 30 35 40 45 50 55 60 ОПИС Попередній рівень техніки CD38 являє собою трансмембранний глікопротеїн II типу, що має молекулярну масу 45 кД, з довгим С-кінцевим позаклітинним доменом і коротким N-кінцевим цитоплазматичним доменом. Білок CD38 являє собою біфункціональний ектофермент, що може каталізувати перетворення + NAD (нікотинамід-аденін-динуклеотиду) у циклічну АДФ-рибозу (cADPR), а також гідролізувати + cADPR в АДФ-рибозу. Протягом онтогенезу CD38 з'являється на комітованих CD34 стовбурових клітинах і комітованих лінією диференціювання попередниках лімфоїдних, еритроїдних і мієлоїдних клітин. Експресія CD38 зберігається головним чином у лімфоїдній лінії диференціювання при рівнях експресії, що варіюються, на різних стадіях розвитку Т- і В-клітин. CD38 піддається стимулюючій регуляції при багатьох гематопоетичних злоякісних захворюваннях і у лініях клітин, одержаних при різних гематопоетичних злоякісних захворюваннях, включаючи не-ходжкінську лімфому (NHL), лімфому Беркітта (BL), множинну мієлому (MM), В-хронічний лімфолейкоз (B-CLL), В- і Т-гострий лімфолейкоз (B-ALL), Т-клітинну лімфому (TCL), гострий мієлолейкоз (AML), волосато-клітинний лейкоз (HCL), лімфому Ходжкіна (HL), хронічний мієлолейкоз (CML). З іншого боку, найбільш примітивними плюрипотентними стовбуровими клітинами гематопоетичної системи є CD38 . Експресія CD38 при гематопоетичних злоякісних захворюваннях і її кореляція з прогресуванням захворювання робить CD38 привабливою мішенню для терапії антитілом. 2+ Повідомлялося, що CD38 бере участь у мобілізації Са (M. Morra et al., 1998, FASEB J., 12: 581-592; M. T. Zilber et al., 2000, Proc Natl Acad Sci USA, 97: 2840-2845) і у передачі сигналів за допомогою фосфорилування тирозину численних молекул, що передають сигнали, включаючи фосфорилазу C-γ, ZAP-70, syk і cbl, у лімфоїдних і мієлоїдних клітинах або лініях клітин (A. Funaro et al., 1993, Eur J Immunol, 23: 2407-2411; M. Morra et al., 1998, EASES J., 12: 581-592; A. Funaro et al., 1990, J Immunol, 145: 2390-2396; M. Zubiaur et al., 1997, J Immunol, 159: 193-205; S. Deaglio et al., 2003, Blood102: 2146-2155; E. Todisco et al., 2000, Blood, 95: 535-542; M. Konopleva et al., 1998, J Immunol, 161: 4702-4708; M. T. Zilber et al., 2000, Proc Natl Acad Sci USA, 97: 28402845; A. Kitanaka et al., 1997, J Immunol, 159: 184-192; A. Kitanaka et al., 1999, J Immunol, 162: 1952-1958; R. Mallone et al., 2001, Int Immunol, 13: 397-409). На підставі цих спостережень припускалося, що CD38 являє собою важливу молекулу, що передає сигнали, при дозріванні і активації лімфоїдних і мієлоїдних клітин протягом їх нормального розвитку. Точна роль CD38 у передачі сигналів і гематопоезі ще не зрозуміла, зокрема, оскільки у більшості з цих досліджень передачі сигналів використовувалися лінії клітин, що ектопічно надмірно експресують CD38 і моноклональні антитіла до CD38, що є не фізіологічними лігандами. Оскільки білок CD38 має ферментативну активність, що продукує cADPR, молекулу, 2+ що викликає мобілізацію Са (H. C. Lee et al., 1989, J Biol Chem, 264: 1608-1615; H. С. Lee and R. Aarhus, 1991, Cell Regul, 2: 203-209), припускалося, що лігування CD38 моноклональними 2+ антитілами запускає мобілізацію Са і передачу сигналів у лімфоцитах збільшенням продукування cADPR (H.C. Lee et al., 1997, Adv Exp Med Biol, 419: 411-419). На відміну від цієї гіпотези, аналіз усікання і точкової мутації білка CD38 показав, що для передачі сигналів, опосередкованої антитілами до CD38, немає необхідності ні в його цитоплазматичній хвостовій частині, ні в його ферментативній активності (A. Kitanaka et al., 1999, J Immunol, 162: 1952-1958; F. E. Lund et al., 1999, J Immunol, 162: 2693-2702; S. Hoshino et al., 1997, J Immunol, 158, 741747). - Найкращий доказ функції CD38 одержаний на мишах після "нокауту" CD38 / , які мають природжений дефект імунітету і знижену залежну від Т-клітин гуморальну реакцію, внаслідок дефекту міграції дендритних клітин (S. Partida-Sanchez et al., 2004, Immunity, 20: 279-291; S. Partida-Sanchez et al., 2001, Nat Med, 7: 1209-1216). Проте, не зрозуміло, чи ідентична функція CD38 у мишей функції CD38 у людей, оскільки тип експресії CD38 під час гематопоезу значно відрізняється між людиною і мишею: а) на відміну від незрілих стовбурових клітин-попередників у людей, аналогічні стовбурові клітини-попередники у мишей експресують більш високий рівень CD38 (T. D. Randall et al., 1996, Blood, 87: 4057-4067; R. N. Dagher et al., 1998, Biol Blood Marrow Transplant, 4: 69-74), b) хоча під час розвитку людських В-клітин високі рівні експресії CD38 виявляються у В-клітинах і плазматичних клітинах гермінального центру (F. M. Uckun, 1990, Blood, 76: 1908-1923; M. Kumagai et al., 1995, J Exp Med, 181: 1101-1110), у миші рівні експресії CD38 у відповідних клітинах низькі (A. M. Oliver et al., 1997, J Immunol, 158: 1108-1115; A. Ridderstad and D. M. Tarlinton 1998, J Immunol, 160: 4688-4695). У літературі було описано декілька антитіл проти людського CD38 з різними проліферативними властивостями на різних пухлинних клітинах і лініях клітин. Наприклад, химерне антитіло ОКТ10 з мишачим Fab і людським IgG1 Fc дуже ефективно опосередковує 1 UA 114879 C2 5 10 15 20 25 30 35 40 45 50 55 60 антитіло-залежну клітинно-опосередковану цитотоксичність (ADCC) проти клітин лімфоми у присутності мононуклеарних ефекторних клітин периферичної крові або від пацієнтів з ММ, або від здорових індивідуумів (F.K. Stevenson et al. 1991, Blood, 77: 1071-1079). Було показано, що прищеплений CDR-гуманізований варіант антитіла до CD38 AT13/5 має високу активність ADCC проти CD38-позитивних ліній клітин (US 09/797,941 A1). Було показано, що людські моноклональні антитіла до CD38 опосередковують цитоліз in vitro CD38-позитивних ліній клітин під впливом ADCC і/або комплемент-залежної цитотоксичності (CDC), і затримують ріст пухлини у мишей SCID, які несуть лінії клітин ММ RPMI-8226 (WO2005/103083 A2). З іншого боку, декілька антитіл до CD38, IB4, SUN-4B7 і OKT10, але не IB6, AT1 або AT2, викликали проліферацію мононуклеарних клітин периферичної крові (РВМС) від здорових індивідуумів (C.M. Ausiello et al. 2000, Tissue Antigens, 56: 539-547). Було показано, що деякі з антитіл попереднього рівня техніки здатні запускати апоптоз у В+ клітинах CD38 . Однак, вони можуть робити це у присутності стромальних клітин або цитокінів, одержаних зі строми. Повідомлялося, що агоністичне антитіло до CD38 (IB4) запобігає апоптозу В-клітин людського гермінального центру (GC) (S. Zupo et al. 1994, Eur J Immunol, 24: 1218-1222) і викликає проліферацію клітин KG-1 і HL-60 AML (M. Konopleva et al. 1998, J Immunol, 161: 47024708), але викликає апоптоз у лімфобластичних клітинах Jurkat T (M. Morra et al. 1998, FASEB J, 12: 581-592). Інше антитіло до CD38 Т16 викликало апоптоз незрілих лімфоїдних клітин і лейкозних лімфобластних клітин від пацієнта з ALL (M.Kumagai et al. 1995, J Exp Med, 181: 11011110), і лейкозних лімфобластних клітин від пацієнта з AML (E. Todisco et al. 2000, Blood, 95: 535-542), але Т16 викликало апоптоз тільки у присутності стромальних клітин або одержаних зі строми цитокінів (IL-7, IL-3, фактор стовбурових клітин). З іншого боку, деякі антитіла попереднього рівня техніки викликають апоптоз після поперечного зшивання, але повністю позбавлені якої-небудь апоптозної активності при інкубації окремо (WO 2006/099875). Через те, що CD38 являє собою привабливу мішень для антитіло-терапії щодо різних гематопоетичних злоякісних захворювань, заявники генерували і провели скринінг великої кількості антитіл проти людського CD38 для виявлення високої ефективності при наступних трьох видах цитотоксичної активності проти CD38-позитивних злоякісних гематопоетичних клітин: індукція апоптозу, ADCC і CDC. У даному винаході описані нові антитіла до CD38, здатні + викликати цитоліз клітин CD38 трьома різними цитотоксичними механізмами: індукція апоптозу, ADCC і CDC. Слід зазначити, що у даному винаході описуються перші антитіла до CD38, що + здатні безпосередньо викликати апоптоз клітин CD38 , навіть за відсутності стромальних клітин або цитокінів, одержаних зі строми. Короткий опис суті винаходу Метою винаходу є надання антитіл, що специфічно зв'язують CD38 і здатні викликати + цитоліз клітин CD38 за допомогою апоптозу. У той час як деякі антитіла попереднього рівня техніки здатні запустити апоптоз тільки при поперечному зшиванні, але інакше позбавлені якоїнебудь апотозної активності, антитіла за винаходом здатні викликати апоптозну загибель клітин + CD38 навіть при окремій інкубації. В одному аспекті винаходу, антитіла за винаходом здатні + викликати цитоліз В-клітин CD38 за допомогою ADCC або CDC. У ще одному аспекті, антитіла + за винаходом здатні викликати цитоліз клітин CD38 , щонайменше, двома з зазначених вище механізмів, тобто, за допомогою апоптозу, ADCC і CDC. Слід зазначити, що антитіла за винаходом являють собою перші антитіла до CD38, які, як було продемонстровано, викликають + цитоліз В-клітин CD38 усіма трьома різними механізмами: за допомогою апоптозу, ADCC і CDC. У ще одному варіанті здійснення винаходу, зазначені антитіла здатні викликати цитоліз В-клітин + CD38 за допомогою апоптозу навіть за відсутності стромальних клітин або цитокінів, одержаних зі строми. + Антитіла за винаходом здатні, зокрема, викликати цитоліз злоякісних В-клітин CD38 , включаючи клітини лімфоми, клітини лейкозу і клітини множинної мієломи. У деяких варіантах + здійснення, В-клітина CD38 являє собою клітину NHL, BL, MM, B-CLL, ALL, TCL, AML, HCL, HL або CML. В одному аспекті винаходу, антитіла за винаходом здатні викликати лізис, щонайменше, 24 % клітин лімфомиDaudi і/або, щонайменше, 7 % клітин лімфоми Ramos, і/або 11 % клітин множинної мієломи MOLP-8, і/або 36 % клітин лімфоми SU-DHL-8, і/або 62 % клітин лейкозу DND-41, і/або 27 % клітин лімфоми NU-DUL-1, і/або 9 % клітин лейкозу JVN-13, і/або 4 % клітин лейкозу НС-1 за допомогою апоптозу за відсутності стромальних клітин або цитокінів, одержаних зі строми. Антитіла за винаходом можуть бути поліклональними або моноклональними. Переважними є моноклональні антитіла до CD38. У більш переважному варіанті здійснення надаються мишачі 2 UA 114879 C2 5 10 15 20 25 30 35 40 45 50 55 60 антитіла, вибрані з 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39, що повністю характеризуються у даному описі стосовно амінокислотних послідовностей їх варіабельних областей і легкого, і важкого ланцюга, послідовності кДНК генів варіабельних областей легкого і важкого ланцюга, ідентифікації їх CDR (областей, що визначають комплементарність), ідентифікації їх поверхневих амінокислот і засобів для їх експресії у рекомбінантній формі. Даний винахід включає химерні варіанти мишачого моноклонального антитіла до CD38, вибраного з 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39. Також включені такі, що мають модифіковану поверхню, або гуманізовані варіанти антитіл 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39, де відкриті на поверхні залишки каркасу варіабельної області антитіл або їх фрагменти, що зв'язують епітоп, заміщені і у легкому, і у важкому ланцюгах для більш близького нагадування відомих поверхонь людського антитіла. Гуманізовані антитіла і їх фрагменти, що зв'язують епітоп, за даним винаходом мають поліпшені властивості у тому, що вони є менш імуногенними (або повністю не імуногенними), ніж мишачі варіанти у людей, яким вони вводяться. Таким чином, різні варіанти гуманізованих антитіл 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39 і їх фрагментів, що зв'язують епітоп, за даним винаходом специфічно розпізнають CD38, у той же час не являючись імуногенними для людини. Гуманізовані варіанти антитіл 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39 за даним винаходом повністю характеризуються у даному описі стосовно їх відповідних амінокислотних послідовностей варіабельних областей і легкого, і важкого ланцюга, послідовностей ДНК генів варіабельних областей легкого і важкого ланцюга, ідентифікації областей, що визначають комплементарність (CDR), ідентифікації поверхневих амінокислотних залишків каркасу їх варіабельної області, і опису засобів їх експресії у рекомбінантній формі. Винахід також передбачає застосування кон'югатів між цитотоксичними кон'югатами, що включають (1) агент, що зв'язує клітину, який розпізнає і зв'язує CD38, і (2) цитотоксичний агент. У цитотоксичних кон'югатах, клітина, що зв'язує агент, має високу спорідненість з CD38, а цитотоксичний агент має високий ступінь цитотоксичності для клітин, які експресують CD38, таких як цитотоксичні кон'югати за даним винаходом, що утворюють ефективні цитолітичні агенти. У переважному варіанті здійснення агент, що зв'язує клітину, представляє антитіло до CD38 (наприклад, 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39) або його фрагмент, що зв'язує епітоп, більш переважно, гуманізоване антитіло до CD38 (наприклад, 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39) або його фрагмент, що зв'язує епітоп, де цитотоксичний агент ковалентно приєднаний, або безпосередньо через розщеплюваний або нерозщеплюваний лінкер, до антитіла або до його фрагмента, що зв'язує епітоп. У більш переважних варіантах здійснення, агент, що зв'язується з клітиною, являє собою гуманізовані антитіла (38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39) або їх фрагмент, що зв'язує епітоп. А цитотоксичний агент являє собою таксол, мейтансиноїд, похідне томейміцину, похідне лептоміцину, СС-1065 або аналог СС-1065. Більш переважно, агент, що зв'язується з клітиною, являє собою гуманізоване антитіло до CD38 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39, а цитотоксичний агент являє собою сполуку мейтансину, таку як DM1 або DM4. Даний винахід також охоплює застосування фрагментів антитіл до CD38, що зберігають здатність зв'язувати CD38. В іншому аспекті винаходу передбачається застосування функціональних еквівалентів антитіл до CD38. Даний винахід також включає спосіб інгібування росту клітини, що експресує CD38. У переважних варіантах здійснення, спосіб інгібування росту клітини, що експресує CD38, відбувається in vivo і приводить до загибелі клітини, хоча також включені застосування in vitro і ex vivo. Даний винахід також включає терапевтичну композицію, яка включає антитіло до CD38 або кон'югат антитіла до CD38-цитотоксичного агента, і фармацевтично прийнятний носій або ексципієнт. У деяких варіантах здійснення, терапевтична композиція включає другий терапевтичний агент. Другий терапевтичний агент можна вибрати з групи, що включає антагоністи епідермального ростового фактора (EGF), фактора росту фібробластів (FGF), фактора росту гепатоцитів (HGF), тканинного фактора (TF), білка С, білка S, фактора росту, одержаного з тромбоцитів (PDGF), герегуліну, білка, що стимулює макрофаги (MSP), або фактора росту судинного ендотелію (VEGF), або антагоніста рецептора епідермального ростового фактора (EGF), фактора росту фібробластів (FGF), фактора росту гепатоцитів (HGF), тканинного фактора (TF), білка С, білка S, фактора росту, одержаного з тромбоцитів (PDGF), герегуліну, білка, що стимулює макрофаги (MSP), або фактора росту судинного ендотелію (VEGF), включаючи рецептор HER2, рецептор HER3, c-MET і тирозин-кіназ інших рецепторів. 3 UA 114879 C2 5 10 15 20 25 30 35 40 45 50 55 Другий терапевтичний агент можна також вибрати з групи, що включає антитіла, націлені на кластери антигенів диференціації (CD), включаючи CD3, CD14, CD19, CD20, CD22, CD25, CD28, CD30, CD33, CD36, CD40, CD44, CD52, CD55, CD59, CD56, CD70, CD79, CD80, CD103, CD134, CD137, CD138 і CD152. Цей другий терапевтичний агент можна також вибрати з групи хіміотерапевтичних або імуномодуляторних агентів. Даний винахід, крім того, включає спосіб лікування суб'єкта, який має рак або запальне захворювання, включаючи аутоімунне захворювання, з використанням терапевтичної композиції. У деяких варіантах здійснення, рак вибраний з групи, що складається з NHL, BL, MM, B-CLL, ALL, TCL, AML, HCL, HL і CML. В іншому варіанті здійснення аутоімунне захворювання вибране з групи, що складається з системного червоного вовчака, розсіяного склерозу, ревматоїдного артриту, хвороби Крона, виразкового коліту, гастриту, тироїдиту Хашимото, анкілозуючого спондиліту, кріоглобулінемічного васкуліту, пов'язаного з гепатитом С, хронічного осередкового енцефаліту, бульозної псевдопухирчатки, гемофілії А, мембранопроліферативного гломерулонефриту, синдрому Шегрена, дерматоміозиту дорослих і ювенільного дерматоміозиту, хронічного висипу, первинного біліарного цирозу, ідіопатичної тромбоцитопенічної пурпури, нейромієліту зорового нерва, дистироїдного захворювання Грейвса, бульозної псевдопухирчатки, мембранопроліферативного гломерулонефриту, синдрому Чурга-Штрауса і астми. У переважних варіантах здійснення, цитотоксичний кон'югат включає антитіло до CD38 і цитотоксичний агент. У більш переважних варіантах здійснення, цитотоксичний кон'югат включає кон'югат гуманізованого антитіла 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39 з DM1, гуманізованого антитіла 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39 з DM4, або гуманізованого антитіла 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39 з таксаном, і кон'югат вводиться нарівні з фармацевтично прийнятним носієм або ексципієнтами. В іншому аспекті винаходу, антитіла до CD38 використовуються для виявлення білка CD38 у біологічному зразку. У переважному варіанті здійснення зазначені антитіла використовуються для визначення рівнів CD38 у пухлинній тканині. Даний винахід також включає набір, що включає антитіло до CD38 або кон'югат антитіла до CD38-цитотоксичного агента та інструкції із застосування. У переважних варіантах здійснення, антитіла до CD38 являють собою гуманізовані антитіла 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39, цитотоксичний агент являє собою сполуку мейтансину, таку як DM1 або DM4, похідне томейміцину, похідне лептоміцину або токсан, і інструкції стосуються застосування кон'югатів при лікуванні суб'єкта, який має рак. Набір може також включати компоненти, необхідні для одержання фармацевтично прийнятної сполуки, такі як розріджувач, якщо кон'югат знаходиться у ліофілізованому стані або у концентрованій формі, і для введення сполуки. За відсутності інших вказівок, всі наведені у даному описі посилання і патенти включені у нього як посилання. Короткий опис креслень На фіг. 1А показаний аналіз FACS (лазерним аналізатором клітин з інтенсивності флюоресценції) специфічного зв'язування очищених мишачих антитіл до CD38, 38SB13, 38SB18, 38SB19, клітин від 38 до 300-19, що експресують людський CD38, і CD38-позитивних клітин лімфоми Ramos. На фіг. 1В показаний аналіз FACS специфічного зв'язування очищених мишачих антитіл до CD38, 38SB30, 38SB31, 38SB39, і контрольного антитіла до CD38 АТ 13/5 до клітин 300-19, що експресують людський CD38, і CD38-позитивних клітин лімфоми Ramos. На фіг. 2 показані криві титрування зв'язування 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39, адаптованих клітинами Ramos. На фіг. 3 показані точкові графіки FACS (FL4-H; забарвлювання TO-PRO-3; вісь y і FL1-H; забарвлювання анексину FITC (флюоресцеїном-ізотіоціанатом) клітин Ramos, що піддаються апоптозу, після інкубації з 38SB18, 38SB19 або AT13/5 (10 нм) протягом 24 год. На фіг. 4А показані середні процентні частки клітин Ramos, що піддаються апоптозу, після інкубації з 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39, 38SB7, 38SB23, IB4, AT13/5, OKT10 або SUN-4B7. На графік нанесені середні процентні частки анексин V-позитивні клітини (вісь у; включає і TO-PRO-позитивні, і TO-PRO-негативні клітини) зі зразків у двох повтореннях. На фіг. 4В показані середні процентні частки клітин Daudi, що піддаються апоптозу, після інкубації протягом 24 год. з тим же набором антитіл, як на фіг. 4А. На фіг. 4С показані середні процентні частки клітин Molp-8, що піддаються апоптозу, після інкубації протягом 24 год. з тим же набором антитіл, як на фіг. 4А. 4 UA 114879 C2 5 10 15 20 25 30 35 40 45 50 55 60 На фіг. 5А показана схема людського вектора експресії, використовуваного для експресії hu38SB19-LC. На фіг. 5В показана схема людського вектора експресії, використовуваного для експресії hu38SB19-HC. На фіг. 5С показана схема людського вектора експресії, використовуваного для експресії і hu38SB19LC, і hu38SB19HC. На фіг. 6А показані величини активності ADCC, опосередкованої антитілами ch38SB13 ch38SB18 і ch38SB19, стосовно клітин Ramos. На фіг. 6В показані величини активності ADCC, опосередкованої антитілами ch38SB30 ch38SB31 і ch38SB39, стосовно клітин Ramos. На фіг. 7А показані величини активності ADCC, опосередкованої антитілами ch38SB18, ch38SB19, ch38SB31 і контрольним антитілом, що не зв'язує химерний людський IgG1, стосовно клітин множинної мієломи LP-1. На фіг. 7В порівнюються величини активності ADCC, опосередкованої антитілами ch38SB19 і мишачим 38SB19 стосовно клітин Daudi. На фіг. 8А показані величини активності ADCC, опосередкованої антитілом ch38SB19 і контрольним антитілом, що не зв'язує химерний людський IgG1, стосовно клітин NALM-6 B-ALL. На фіг. 8В показані величини активності ADCC, опосередкованої антитілом ch38SB19 і контрольним антитілом, що не зв'язує химерний людський IgG1, стосовно клітин MOLT-6 T-ALL. На фіг. 9А показані величини активності CDC, опосередкованої антитілами ch38SB13, ch38SB318, ch38SB319, ch38SB30 і ch38SB39 стосовно клітин Raji-IMG. На фіг. 9В показані величини активності CDC, опосередкованої антитілами ch38SB319 і ch38SB31 стосовно клітин Raji-IMG. На фіг. 10 показані величини активності CDC, опосередкованої антитілами ch38SB18, ch38SB19, ch38SB31 і контрольним антитілом, що не зв'язує химерний людський IgG1, стосовно клітин множинної мієломи LP-1. На фіг. 11А показані величини активності CDC, опосередкованої антитілами ch38SB13, ch38SB19 і ch38SB39, стосовно клітин Daudi. На фіг. 11В показані величини активності CDC, опосередкованої антитілами ch38SB18 і ch38SB30, стосовно клітин Daudi. На фіг. 11С показані величини активності CDC, опосередкованої антитілами ch38SB19 і ch38SB31, стосовно клітин Daudi. На фіг. 12А показані криві титрування зв'язування ch38SB19, hu38SB19 v1.00 і hu38SB19 v1.20 для зв'язування з клітинами Ramos. На фіг. 12В показані криві зв'язування, що порівнюють ch38SB19, hu38SB19 v1.00 і hu38SB19 v1.20 за їх здатністю конкурувати зі зв'язуванням біотинільованого мишачого антитіла за зв'язування 38SB19 з клітинами Ramos. На фіг. 13 показані середні процентні частки клітин Daudi, що піддаються апоптозу після 24 год. інкубації з антитілом ch38SB19, hu38SB19 v1.00 або hu38SB19 v1.20. На фіг. 14 показані величини активності ADCC, опосередкованої антитілами ch38SB19, hu38SB19 v1.00, hu38SB19 v1.20 і контрольним антитілом, що не зв'язує химерний людський IgG1, стосовно клітин множинної мієломи LP-1. На фіг. 15А показані величини активності CDC, опосередкованої антитілами ch38SB19, hu38SB19 v1.00 і hu38SB19 v1.20, стосовно клітин лімфоми Raji-IMG. На фіг. 15В показані величини активності CDC, опосередкованої антитілами ch38SB19, hu38SB19 v1.00 і hu38SB19 v1.20, стосовно клітин множинної мієломи LP-1. На фіг. 15С показані величини активності CDC, опосередкованої антитілами ch38SB19, hu38SB19 v1.00 і hu38SB19 v1.20, стосовно клітин Т-клітинного гострого лімфобластичного лейкозу DND-41. На фіг. 16 показані середні процентні частки анексин V-позитивних клітин після 24 год. інкубації з антитілом hu38SB19 v1.00 до клітин дифузійної великої В-клітинної лімфоми SU-DHL8, до клітин В-клітинної лімфоми NU-DUL-1, до клітин Т-клітинного гострого лімфобластичного лейкозу DND-41, до клітин хронічного В-клітинного лімфолейкозу JVM-13 і до клітин волосатоклітинного лейкозу НС-1. На фіг. 17 показаний відсоток виживання мишей SCID, які несуть прищеплені дисеміновані людські пухлини Ramos. Як зазначено, мишей лікували мишачим антитілом 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39 або PBS (сольовий розчин з фосфатним буфером). На фіг. 18 показаний відсоток виживання мишей SCID, які несуть прищеплені дисеміновані людські пухлини Daudi. Як зазначено, мишей лікували мишачим антитілом hu38SB19 або mu38SB19, або PBS. 5 UA 114879 C2 5 10 15 20 25 30 35 40 45 50 55 На фіг. 19 показаний середній об'єм пухлини мишей SCID, які несуть ксенотрансплантати пухлин множинної мієломи NCI-H929. Як зазначено, мишей лікували антитілом hu38SB19, контрольним антитілом, що не зв'язує IgG1, або PBS. На фіг. 20 показаний середній об'єм пухлини мишей SCID, що несуть ксенотрансплантати пухлин множинної мієломи MOLP-8. Як зазначено, мишей лікували антитілом hu38SB19, mu38SB19, контрольним антитілом, що не зв'язує IgG1, або PBS. Детальний опис винаходу У даній заявці описані нові антитіла, здатні специфічно зв'язувати CD38. Зокрема, заявники знайшли нові антитіла, що специфічно зв'язують CD38 на клітинній поверхні і викликають + цитоліз клітини CD38 за допомогою апоптозу. В одному аспекті винаходу, антитіла до CD38 + також здатні викликати цитоліз клітини CD38 за допомогою антитіло-залежної клітинноопосередкованої цитотоксичності (ADCC). В іншому аспекті винаходу, антитіла до CD38 за + винаходом також здатні викликати цитоліз клітини CD38 за допомогою комплемент-залежної цитотоксичності (CDC). У ще одному аспекті винаходу, антитіла до CD38 за винаходом також + здатні викликати цитоліз клітини CD38 , щонайменше, двома зазначеними вище механізмами, за допомогою апоптозу, ADCC і CDC. Зокрема, у переважному варіанті здійснення антитіла до + CD38 за винаходом здатні викликати цитоліз клітини CD38 , за допомогою апоптозу, ADCC і CDC. Таким чином, винахід стосується першого антитіла до CD38, здатного викликати цитоліз + клітини CD38 , трьома різними механізмами. Раніше були описані антитіла, здатні зв'язувати CD38 і запускати апотозний цитоліз клітин + CD38 (M. Kumagai et al., 1995, J Exp Med, 181: 1101-11110; E. Todisco et al. 2000, Blood, 95: 535542), але антитіла за винаходом є першими, в яких продемонстрована апоптозна активність за відсутності клітин строми або одержаних зі строми цитокінів. Використовуваний у даному описі термін "строма" стосується не злоякісної опорної тканини пухлини, що включає сполучну тканину, кровоносні судини і запальні клітини. Стромальні клітини продукують ростові фактори та інші речовини, включаючи цитокіни, які можуть впливати на поводження ракових клітин. Використовуваний у даному описі термін "цитокін" стосується дрібних білків, що секретуються (наприклад, IL-1, IL-2, IL-4, IL-5 і IL-6б IFNg, IL-3-IL-7 і GM-CSF), які опосередковують і регулюють імунітет, запалення і гематопоез. У даній заявці показано, що антитіла попереднього рівня техніки не здатні запускати апоптозний цитоліз за відсутності клітин строми або одержаних зі строми цитокінів. Навпаки, антитіла до CD38а за винаходом проявляють у таких же умовах високу апоптозну активність. -9 В іншому аспекті, антитіла за винаходом здатні зв'язуватися з білком CD38 з k D 310 або нижче. Використовуваний у даному описі термін "CD38" стосується трансмембранного білка II типу, що включає, наприклад, амінокислотну послідовність, як послідовність у Genbank (генному банку) під номером доступу NP_001766. "Клітина CD38" являє собою клітину, що експресує + білок CD38. Переважно, клітина CD38 являє собою клітину ссавця. + В одному варіанті здійснення клітина CD38 являє собою злоякісну клітину. У переважному + варіанті здійснення клітина CD38 являє собою пухлинну клітину, одержану при гематопоетичному злоякісному захворюванні. У більш переважному варіанті здійснення клітина + CD38 являє собою клітину лімфоми, клітину лейкозу або клітину множинної мієломи. У ще + одному переважному варіанті здійснення клітина CD38 являє собою клітину HNL, BL, MM, BCLL, ALL, TCL, AML, HCL, HL або CML. Таким чином, в одному варіанті здійснення винахід стосується антитіл до CD38, здатних до цитолізу, щонайменше, 24 % клітин лімфоми Daudi, за відсутності клітин строми або цитокінів, одержаних зі строми. В іншому варіанті здійснення антитіла до CD38 за винаходом, здатні до цитолізу, щонайменше, 7 % клітин лімфоми Ramos, за відсутності клітин строми або цитокінів, одержаних зі строми. В іншому варіанті здійснення антитіла до CD38 за винаходом здатні до цитолізу, щонайменше, 11 % клітин множинної мієломи MOLP-8, за відсутності клітин строми або цитокінів, одержаних зі строми. В іншому варіанті здійснення антитіла до CD38 за винаходом здатні до цитолізу, щонайменше, 36 % клітин лімфоми SU-DHL-8, за відсутності клітин строми або цитокінів, одержаних зі строми. В іншому варіанті здійснення антитіла до CD38 за винаходом здатні до цитолізу, щонайменше, 27 % клітин лімфоми NU-DHL-1, за відсутності клітин строми або цитокінів, одержаних зі строми. В іншому варіанті здійснення антитіла до CD38 за винаходом здатні до цитолізу, щонайменше, 62 % клітин лейкозу DND-41, за відсутності клітин строми або цитокінів, одержаних зі строми. В іншому варіанті здійснення антитіла до CD38 за винаходом здатні до цитолізу, щонайменше, 9 % клітин лейкозу LVM-13, за відсутності клітин строми або цитокінів, одержаних зі строми. В іншому варіанті здійснення 6 UA 114879 C2 5 10 15 20 25 30 35 40 45 50 55 60 антитіла до CD38 за винаходом здатні до цитолізу, щонайменше, 4 % клітин лейкозу НС-1, за відсутності клітин строми або цитокінів, одержаних зі строми. Антитіла Термін "антитіло" використовується у даному описі у найширшому значенні і, зокрема, охоплює моноклональні антитіла (включаючи моноклональні антитіла повної довжини) будьякого ізотипу, такі як IgG, IgM, IgA, IgD і IgE, поліклональні антитіла, мультиспецифічні антитіла, химерні антитіла і фрагменти антитіл. Антитіло, що взаємодіє зі специфічним антигеном, можна генерувати рекомбінатними способами, такими як вибір бібліотек рекомбінатних антитіл у фагу або аналогічних векторах, або імунізацією тварини антигеном або нуклеїновою кислотою, що кодує антиген. Типове IgG антитіло складається з двох ідентичних важких ланцюгів і двох ідентичних легких ланцюгів, які з'єднані дисульфідними містками. Кожний важкий і легкий ланцюг містить константну область і варіабельну область. Кожна варіабельна область містить три сегменти, які називають "області, що визначають комплементарність" ("CDR") або "гіперваріабельні області", що у першу чергу відповідальні за зв'язування з епітопом антигену. Вони звичайно іменуються CDR1, CDR2 і CDR3, послідовно пронумеровані від N-кінця. Більш високо консервативні частини варіабельних областей називаються "каркасними областями". Використовуваний у даному описі термін "VH" або "VH" стосується варіабельної області важкого ланцюга імуноглобуліну антитіла, включаючи важкий ланцюг Fv, scFv, dsFv, Fab, Fab" або фрагмента F(ab")2. Посилання на "VL" або "VL" стосується варіабельної області легкого ланцюга імуноглобуліну антитіла, включаючи легкий ланцюг Fv, scFv, dsFv, Fab, Fab" або фрагмента F(ab")2. "Поліклональне антитіло" являє собою антитіло, що було одержане серед або у присутності одного або декількох інших, не ідентичних антитіл. В цілому, поліклональні антитіла одержують з В-лімфоцитів у присутності декількох інших В-лімфоцитів, що продукують не ідентичні антитіла. Звичайно, поліклональні антитіла одержують безпосередньо у імунізованої тварини. Використовуваний у даному описі термін "моноклональне антитіло" являє собою антитіло, одержане з популяції власне кажучи однорідних антитіл, тобто, антитіла, що утворюють цю популяцію, власне кажучи ідентичні, за винятком можливих мутацій, що природно зустрічаються, які можуть бути присутніми у невеликих кількостях. Ці антитіла направлені проти одного епітопу і тому є високо специфічними. "Епітоп" являє собою ділянку антигену, з якою зв'язується антитіло. Якщо антиген являє собою полімер, такий як білок або полісахарид, то епітоп може бути утворений суміжними залишками або не суміжними залишками, тісно зближеними укладанням антигенного полімеру. У білках, епітопи, утворені суміжними амінокислотами, звичайно утримуються при впливі денатуруючих розчинників, тоді як епітопи, утворені не суміжними амінокислотами, звичайно втрачаються при зазначеному впливі. Використовуваний у даному описі термін "К D" стосується константи дисоціації визначеної взаємодії антитіла/антигену. Даний винахід походить з нових мишачих антитіл до CD38, у даному винаході 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39, що повністю характеризуються стосовно амінокислотних послідовностей і легких, і важких ланцюгів, ідентифікації CDR, ідентифікації поверхневих амінокислот і засобів їх експресії у рекомбінантній формі. У даній заявці описані первинні амінокислотні і ДНК послідовності легкого і важкого ланцюгів антитіл 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39, і гуманізованих варіантів. Клітинні лінії гібридоми, що продукують мишачі антитіла до CD38 антитіл 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39, були депоновані в Американській колекції типових культур (10801 University Bld, Manassas, VA, 201 10-2209, USA), 21 червня 2006 року, під депозитними номерами відповідно РТА-7667, РТА-7669, РТА-7670, РТА-7666, РТА-7668 і РТА-7671. Обсяг даного винаходу не обмежується антитілами і фрагментами, що включають ці послідовності. Замість цього, антитіла і фрагменти, що специфічно зв'язують CD38, і здатні + лізувати клітини CD38 за допомогою апоптозу, ADCC і/або CDC, охоплюються обсягом даного винаходу. Таким чином, антитіла і фрагменти антитіл можуть відрізнятися від антитіла 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39 або гуманізованих похідних в амінокислотних послідовностях їх каркасу, CDR, легкого ланцюга і важкого ланцюга, і все-таки охоплюються обсягом даного винаходу. В одному варіанті здійснення даний винахід стосується антитіл або їх фрагменту, що зв'язується з епітопом, що включає одну або декілька CDR, що мають амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35 і 36. У 7 UA 114879 C2 5 10 15 20 25 30 35 40 45 50 55 переважному варіанті здійснення антитіла за винаходом включають, щонайменше, один важкий ланцюг, і, щонайменше, один легкий ланцюг, і зазначений важкий ланцюг включає три послідовних CDR, що мають амінокислотні послідовності, вибрані з групи, яка складається з SEQ ID NO: 1, 2, 3, 7, 8, 9, 13, 14, 15, 19, 20, 21, 25, 26, 27, 31, 32 і 33, і зазначений легкий ланцюг включає три послідовних CDR, що мають амінокислотні послідовності, вибрані з групи, яка складається з SEQ ID NO: 4, 5, 6, 10, 11, 12, 16, 17, 18, 22, 23, 24, 28, 29, 30, 34, 35 і 36. У більш переважному варіанті здійснення антитіла за винаходом включають три CDR, що мають амінокислотні послідовності, вибрані з групи SEQ ID NO: 1, 2, 3, 4, 5 і 6. У ще одному більш переважному варіанті здійснення надається антитіло 38SB13, яке включає, щонайменше, один важкий ланцюг і, щонайменше, один легкий ланцюг, і зазначений важкий ланцюг включає три послідовних CDR, що мають амінокислотні послідовності, вибрані з групи SEQ ID NO: 1, 2 і 3, а зазначений легкий ланцюг включає три послідовних CDR, що мають амінокислотні послідовності, вибрані з групи SEQ ID NO: 4, 5 і 6. У більш переважному варіанті здійснення антитіла за винаходом включають три CDR, що мають амінокислотні послідовності, вибрані з групи SEQ ID NO: 7, 8, 9, 10, 11 і 12. У ще одному більш переважному варіанті здійснення надається антитіло 38SB18, яке включає, щонайменше, один важкий ланцюг і, щонайменше, один легкий ланцюг, і зазначений важкий ланцюг включає три послідовних CDR, що мають амінокислотні послідовності, вибрані з групи SEQ ID NO: 7, 8 і 9, а зазначений легкий ланцюг включає три послідовних CDR, що мають амінокислотні послідовності, вибрані з групи SEQ ID NO: 10, 11 і 12. В іншому більш переважному варіанті здійснення антитіла за винаходом включають три CDR, що мають амінокислотні послідовності, вибрані з групи SEQ ID NO: 13, 14, 15, 16, 17 і 18. У ще одному більш переважному варіанті здійснення надається антитіло 38SB19, яке включає, щонайменше, один важкий ланцюг і, щонайменше, один легкий ланцюг, і зазначений важкий ланцюг включає три послідовних CDR, що мають амінокислотні послідовності, вибрані з групи SEQ ID NO: 13, 14 і 15, а зазначений легкий ланцюг включає три послідовних CDR, що мають амінокислотні послідовності, вибрані з групи SEQ ID NO: 16, 17 і 18. В іншому більш переважному варіанті здійснення антитіла за винаходом включають три CDR, що мають амінокислотні послідовності, вибрані з групи SEQ ID NO: 19, 20, 21, 22, 23, 24. У ще одному більш переважному варіанті здійснення надається антитіло 38SB30, яке включає, щонайменше, один важкий ланцюг і, щонайменше, один легкий ланцюг, і зазначений важкий ланцюг включає три послідовних CDR, що мають амінокислотні послідовності, вибрані з групи SEQ ID NO: 19, 20 і 21, а зазначений легкий ланцюг включає три послідовних CDR, що мають амінокислотні послідовності, вибрані з групи SEQ ID NO: 22, 23 і 24. В іншому більш переважному варіанті здійснення антитіла за винаходом включають три CDR, що мають амінокислотні послідовності, вибрані з групи SEQ ID NO: 25, 26, 27, 28, 29 і 30. У ще одному більш переважному варіанті здійснення надається антитіло 38SB31, яке включає, щонайменше, один важкий ланцюг і, щонайменше, один легкий ланцюг, і зазначений важкий ланцюг включає три послідовних CDR, що мають амінокислотні послідовності, вибрані з групи SEQ ID NO: 25, 26 і 27, а зазначений легкий ланцюг включає три послідовних CDR, що мають амінокислотні послідовності, вибрані з групи SEQ ID NO: 28, 29 і 30. В іншому більш переважному варіанті здійснення антитіла за винаходом включають три CDR, що мають амінокислотні послідовності, вибрані з групи SEQ ID NO: 31, 32, 33, 34, 35 і 36. У ще одному більш переважному варіанті здійснення надається антитіло 38SB19, яке включає, щонайменше, один важкий ланцюг і, щонайменше, один легкий ланцюг, і зазначений важкий ланцюг включає три послідовних CDR, що мають амінокислотні послідовності, вибрані з групи SEQ ID NO: 31, 32 і 33, а зазначений легкий ланцюг включає три послідовних CDR, що мають амінокислотні послідовності, вибрані з групи SEQ ID NO: 34, 35 і 36. В іншому варіанті здійснення антитіла до CD38 за винаходом включають V L, що має амінокислотну послідовність, вибрану з групи, що складається з SEQ ID NO: VL для 38, 40, 42, 44, 46 і 48. У більш переважному варіанті здійснення надається антитіло 38SB13, яке включає VL, що має амінокислотну послідовність, яка складається з SEQ ID NO: 38. У більш переважному варіанті здійснення надається антитіло 38SB18, яке включає V L, що має амінокислотну послідовність, яка складається з SEQ ID NO: 40. У більш переважному варіанті здійснення надається антитіло 38SB19, яке включає V L, що має амінокислотну послідовність, яка складається з SEQ ID NO: 42. У більш переважному варіанті здійснення надається антитіло 38SB30, яке включає VL, що має амінокислотну послідовність, яка складається з SEQ ID NO: 44. У більш переважному варіанті здійснення надається антитіло 38SB31, яке включає VL, що має амінокислотну послідовність, яка складається з SEQ ID NO: 46. У більш переважному варіанті 8 UA 114879 C2 5 10 15 20 25 30 35 40 45 50 55 60 здійснення надається антитіло 38SB39, яке включає V L, що має амінокислотну послідовність, яке складається з SEQ ID NO: 48. В іншому варіанті здійснення антитіла за винаходом включають VH, що має амінокислотну послідовність, вибрану з групи, що складається з SEQ ID NO: 50, 52, 54, 56, 58 і 60. У більш переважному варіанті здійснення надається антитіло 38SB13, яке включає V H, що має амінокислотну послідовність, яка складається з SEQ ID NO: 50. У більш переважному варіанті здійснення надається антитіло 38SB18, яке включає VH, що має амінокислотну послідовність, яка складається з SEQ ID NO: 52. У більш переважному варіанті здійснення надається антитіло 38SB19, яке включає VH, що має амінокислотну послідовність, яка складається з SEQ ID NO: 54. У більш переважному варіанті здійснення надається антитіло 38SB30, яке включає V H, що має амінокислотну послідовність, яка складається з SEQ ID NO: 56. У більш переважному варіанті здійснення надається антитіло 38SB31, яке включає VH, що має амінокислотну послідовність, яка складається з SEQ ID NO: 58. У більш переважному варіанті здійснення надається антитіло 38SB39, яке включає VH, що має амінокислотну послідовність, яка складається з SEQ ID NO: 60. Химерні і гуманізовані антитіла 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39 Використовуваний у даному описі термін "химерне антитіло" означає антитіло, в якому константна область або її частина, з'єднана з константною областю іншого виду, або таке, що належить до іншого класу або підкласу антитіл. "Химерне антитіло" також стосується антитіла, в якому варіабельна область або її частина, змінена, заміщена або замінена, для того, щоб константна область була зв'язана з варіабельною областю іншого виду, або стосується іншого класу або підкласу антитіл. Способи одержання химерних антитіл відомі у даній галузі. Див., наприклад, Morrison, 1985, Science, 229: 1202; Oi et al., 1986, BioTechniques, 4: 214; Gillies et al., 1989, J. Immunol. Methods, 125: 191-202; патенти США №№ 5807715, 4816567 і 4816397, що повністю включені у даний опис як посилання. В одному варіанті здійснення винаходу, надаються химерні варіанти 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39. Зокрема, зазначені химерні варіанти містять, щонайменше, одну людську константну область. У більш переважному варіанті здійснення ця людська константна область являє собою константну область людського IgG1/Каппа. Використовуваний у даному описі термін "гуманізоване антитіло" стосується химерного антитіла, що містить мінімальну послідовність, одержану з не людського імуноглобуліну. Метою гуманізації є зниження імуногенності ксеногенного антитіла, такого як мишаче антитіло, для введення у людське, у той же час зберігаючи повну спорідненість зв'язування антигену і специфічності антитіла. Гуманізовані антитіла або антитіла, адаптовані проти відторгнення іншими ссавцями, можна одержати, використовуючи декілька технологій, таких як реструктурування поверхні і трансплантація CDR. У використовуваній у даному винаході технології реструктурування поверхні застосовується комбінація молекулярного моделювання, статистичного аналізу і мутагенезу для зміни на CDR поверхні варіабельних областей антитіла для нагадування поверхні відомих антитіл хазяїна-мішені. Технологія трансплантації CDR включає заміщення областей, що визначають комплементарність, наприклад, мишачого антитіла, у людський каркасний домен, наприклад, див. WO 92/22653. Гуманізовані химерні антитіла переважно мають константні області і варіабельні області, відмінні від областей, що визначають комплементарність (CDR), одержаних власне кажучи або винятково з відповідних областей людського антитіла, і CDR, одержаних власне кажучи або винятково у ссавця, відмінного від людини. Стратегії і способи реструктурування поверхні антитіл та інші способи зниження імуногенності антитіл всередині іншого хазяїна розкриті у патенті США № 5639641, що повністю включений у даний опис як посилання. Стисло, у переважному способі (1) генерується суміщення положень пула варіабельних областей важкого і легкого ланцюга антитіла для одержання набору відкритих на поверхні положень каркасу варіабельної області важкого і легкого ланцюга, де положення суміщення для всіх варіабельних областей ідентичні, щонайменше, приблизно на 98 %; (2) визначається набір відкритих на поверхні амінокислотних залишків каркасу варіабельної області важкого і легкого ланцюга для антитіла гризунів (або його фрагмента); (3) ідентифікується набір відкритих на поверхні амінокислотних залишків каркасу варіабельної області важкого і легкого ланцюга, який найбільш близько ідентичний набору відкритих на поверхні амінокислотних залишків у гризунів; (4) набір відкритих на поверхні амінокислотних залишків каркасу варіабельної області важкого і легкого ланцюга, визначений на стадії (2), заміщується набором відкритих на поверхні амінокислотних залишків каркасу варіабельної області важкого і легкого ланцюга, ідентифікованим на стадії (3), за винятком тих амінокислотних залишків, які знаходяться у межах 5 Ǻ від будь-якого атома будьякого залишку областей, що визначають комлементарність, антитіла гризунів; і (5) одержують 9 UA 114879 C2 5 10 15 20 25 30 35 40 45 50 55 60 гуманізоване антитіло гризуна, що має специфічність зв'язування. Антитіла можуть бути гуманізовані з використанням різних інших методик, включаючи трансплантацію CDR (EP 0 239 400; WO 91/09967; патенти США №№ 5530101 і 5585089), покривання тонким шаром або реструктурування поверхні (EP 0 592 106; EP 0 519 596; Padlan E. A., 1991, Molecular Immunology 28(4/5): 489-498; Studnicka G. M. et al., 1994, Protein Engineering, 7(6): 805-814; Roguska MA et al., 1994, PNAS, 91: 969-973) і перетасування ланцюга (патент США № 5565332). Людські антитіла можна одержати різноманітними способами, відомими у даній галузі, включаючи способи представлення фагу. Див. також патенти США №№4444887, 4716111, 5545806 і 5814318; і опис міжнародних патентних заявок під номерами WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 і WO 91/10741 (зазначені посилання повністю включені як посилання). Даний винахід стосується гуманізованих антитіл або їх фрагментів, що розпізнають CD38 і + викликають цитоліз клітин CD38 за допомогою апоптозу, ADCC і/або CDC. У ще одному варіанті здійснення гуманізовані антитіла або їх фрагменти, що зв'язують епітоп, здатні + викликати цитоліз клітин CD38 усіма трьома механізмами. У ще одному варіанті здійснення гуманізовані антитіла або їх фрагменти, що зв'язують епітоп, здатні викликати цитоліз клітин + CD38 за допомогою апоптозу навіть за відсутності клітин строми або цитокінів, одержаних зі строми. Переважним варіантом здійснення такого гуманізованого антитіла є гуманізоване антитіло 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39, або його фрагмент, що зв'язує епітоп. У більш переважних варіантах здійснення, надаються піддані реструктуризації поверхні або гуманізовані варіанти антитіл 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39, де відкриті на поверхні залишки антитіла або його фрагменти заміщені і у легкому, і у важкому ланцюгах для більш близького нагадування відомих поверхонь людського антитіла. Гуманізовані антитіла 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39 або їх фрагменти, що зв'язують епітоп, за даним винаходом мають поліпшені властивості. Наприклад, гуманізовані антитіла 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39 або їх фрагменти, що зв'язують епітоп, специфічно розпізнають білок CD38. Більш переважно, гуманізовані антитіла 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39 або їх фрагменти, що зв'язують епітоп, мають + додаткову здатність викликати цитоліз клітин CD38 за допомогою апоптозу, ADCC і/або CDC. Гуманізовані варіанти антитіл 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39 також повністю характеризуються стосовно їх відповідних амінокислотних послідовностей варіабельних областей і легкого, і важкого ланцюга, послідовності ДНК генів для варіабельних областей і легкого, і важкого ланцюга, ідентифікації CDR, ідентифікації їх поверхневих амінокислот і опису засобів для їх експресії у рекомбінантній формі. Однак, обсяг даного винаходу не обмежується антитілами і фрагментами, що включають ці послідовності. Навпаки, + всі антитіла і фрагменти, що специфічно зв'язують CD38 і здатні викликати цитоліз клітин CD38 за допомогою апоптозу, ADCC і/або CDC, охоплюються обсягом даного винаходу. Переважно, + такі антитіла здатні викликати цитоліз клітин CD38 всіма трьома механізмами. Таким чином, антитіла і фрагменти, що зв'язують епітоп, за даним винаходом можуть відрізнятися від антитіл 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39 або їх гуманізованих похідних амінокислотними послідовностями їх каркасу, CDR і/або легкого ланцюга і важкого ланцюга, і все-таки охоплюються обсягом даного винаходу. CDR антитіл 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39 ідентифікуються моделюванням і їх молекулярні структури прогнозувалися. І у даному випадку, хоча CDR важливі для розпізнавання епітопу, вони не істотні для антитіл і фрагментів за винаходом. Відповідно, надаються антитіла і фрагменти, що мають поліпшені властивості, одержані, наприклад, формуванням спорідненості антитіла за даним винаходом. Послідовності варіабельних областей важкого ланцюга і легкого ланцюга антитіл 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39 і послідовності їх CDR не були раніше відомі і представлені у даній заявці. Такі зведення можна використовувати для одержання гуманізованих варіантів антитіл 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39. Ці гуманізовані антитіла до CDR38 або їх похідні можна також використовувати як агент, що зв'язує клітини, за даним винаходом. Таким чином, в одному варіанті здійснення даний винахід стосується гуманізованих антитіл або їх фрагмента, що зв'язує епітоп, що включає одну або декілька CDR, які мають амінокислотну послідовність, вибрану з групи, що складається з SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35 і 36. У переважному варіанті здійснення гуманізовані антитіла за винаходом включають, щонайменше, один важкий ланцюг, і, щонайменше, один легкий ланцюг, і зазначений важкий 10 UA 114879 C2 5 10 15 20 25 30 35 40 45 50 55 60 ланцюг включає три послідовних CDR, що мають амінокислотні послідовності, вибрані з групи, яка складається з SEQ ID NO: 1, 2, 3, 7, 8, 9, 13, 14, 15, 19, 20, 21, 25, 26, 27, 31, 32 і 33, і зазначений легкий ланцюг включає три послідовних CDR, що мають амінокислотні послідовності, вибрані з групи, яка складається з SEQ ID NO: 4, 5, 6, 10, 11, 12, 16, 17, 18, 22, 23, 24, 28, 29, 30, 34, 35 і 36. У ще одному переважному варіанті здійснення надається гуманізований варіант 38SB13, що включає, щонайменше, один важкий ланцюг і, щонайменше, один легкий ланцюг, де зазначений важкий ланцюг включає три послідовних області, що визначають комплементарність, які мають амінокислотні послідовності, представлені SEQ ID NO: 1, 2 і 3, і де зазначений легкий ланцюг включає три послідовних області, що визначають комплементарність, які мають амінокислотні послідовності, представлені SEQ ID NO: 4, 5 і 6. У ще одному переважному варіанті здійснення надається гуманізований варіант 38SB18, що включає, щонайменше, один важкий ланцюг і, щонайменше, один легкий ланцюг, де зазначений важкий ланцюг включає три послідовних області, що визначають комплементарність, які мають амінокислотні послідовності, представлені SEQ ID NO: 7, 8 і 9, і де зазначений легкий ланцюг включає три послідовних області, що визначають комплементарність, які мають амінокислотні послідовності, представлені SEQ ID NO: 10, 11 і 12. У ще одному переважному варіанті здійснення надається гуманізований варіант 38SB19, що включає, щонайменше, один важкий ланцюг і, щонайменше, один легкий ланцюг, де зазначений важкий ланцюг включає три послідовних області, що визначають комплементарність, які мають амінокислотні послідовності, представлені SEQ ID NO: 13, 14 і 15, і де зазначений легкий ланцюг включає три послідовних області, що визначають комплементарність, які мають амінокислотні послідовності, представлені SEQ ID NO: 16, 17 і 18. У ще одному переважному варіанті здійснення надається гуманізований варіант 38SB30, що включає, щонайменше, один важкий ланцюг і, щонайменше, один легкий ланцюг, де зазначений важкий ланцюг включає три послідовних області, що визначають комплементарність, які мають амінокислотні послідовності, представлені SEQ ID NO: 19, 20 і 21, і де зазначений легкий ланцюг включає три послідовних області, що визначають комплементарність, які мають амінокислотні послідовності, представлені SEQ ID NO: 22, 23 і 24. У ще одному переважному варіанті здійснення надається гуманізований варіант 38SB31, що включає, щонайменше, один важкий ланцюг і, щонайменше, один легкий ланцюг, де зазначений важкий ланцюг включає три послідовних області, що визначають комплементарність, які мають амінокислотні послідовності, представлені SEQ ID NO: 25, 26 і 27, і де зазначений легкий ланцюг включає три послідовних області, що визначають комплементарність, які мають амінокислотні послідовності, представлені SEQ ID NO: 28, 29 і 30. У ще одному переважному варіанті здійснення надається гуманізований варіант 38SB39, що включає, щонайменше, один важкий ланцюг і, щонайменше, один легкий ланцюг, де зазначений важкий ланцюг включає три послідовних області, що визначають комплементарність, які мають амінокислотні послідовності, представлені SEQ ID NO: 31, 32 і 33, і де зазначений легкий ланцюг включає три послідовних області, що визначають комплементарність, які мають амінокислотні послідовності, представлені SEQ ID NO: 34, 35 і 36. В одному варіанті здійснення даний винахід стосується гуманізованих антитіл або їх фрагментів, що включають VH, що має амінокислотну послідовність, вибрану з групи SEQ ID NO: 66 і 72. У переважному варіанті здійснення надається гуманізоване антитіло 38SB19, що включає VH, що має амінокислотну послідовність, представлену SEQ ID NO: 66. В іншому переважному варіанті здійснення надається гуманізоване антитіло 38SB31, що включає VH, що має амінокислотну послідовність, представлену SEQ ID NO: 72. В іншому варіанті здійснення даний винахід стосується гуманізованих антитіл або їх фрагментів, що включають VL, що має амінокислотну послідовність, вибрану з групи SEQ ID NO: 62, 64, 68 і 70. У переважному варіанті здійснення надається гуманізоване антитіло 38SB19, що включає VL, що має амінокислотну послідовність, вибрану з групи SEQ ID NO: 62 і 64. В іншому переважному варіанті здійснення надається гуманізоване антитіло 38SB31, що включає VL, що має амінокислотну послідовність, вибрану з групи SEQ ID NO: 68 і 70. Гуманізовані антитіла 38SB19 і їх фрагменти, що зв'язують епітоп, за даним винаходом можуть також включати заміщення в амінокислотних залишках легкого і/або важкого ланцюга в одному або декількох положеннях, визначених сірими залишками у таблицях 1А і 1В, що являють собою мишачі поверхневі каркасні залишки, що були замінені з вихідного мишачого залишку на відповідні каркасні поверхневі залишки у людському антитілі, 28Е4. Залишки, позначені зірочкою (*) у таблиці 1В, відповідають мишачим зворотним мутаціям у варіанті важкого ланцюга гуманізованого 38SB19 (SEQ ID NO: 65). Залишки для зворотних мутацій знаходяться проксимальніше CDT і були вибрані, як описано у патенті США № 5639641, або за аналогією вибору залишків, що при попередніх зусиллях гуманізації привели до зменшення 11 UA 114879 C2 5 10 15 20 25 30 35 40 45 50 55 60 спорідненості зв'язування антигену (Roguska et al., 1996, заявки на патенти США 2003/0235582 і 2005/0118183). Аналогічним чином, гуманізовані антитіла 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39 і їх фрагменти, що зв'язують епітоп, за даним винаходом можуть також включати заміщення амінокислотних залишків легкого і/або важкого ланцюга. Полінуклеотиди, вектори і клітини-хазяїни Надаються нуклеїнові кислоти, що кодують антитіла до CD38а за винаходом. В одному варіанті здійснення молекула нуклеїнової кислоти кодує важкий і/або легкий ланцюг анти-CD38 імуноглобуліну. У переважному варіанті здійснення одна нуклеїнова кислота кодує важкий ланцюг анти-CD38 імуноглобуліну, а інша нуклеїнова кислота кодує легкий ланцюг анти-CD38 імуноглобуліну. В іншому аспекті винаходу, надаються полінуклеотиди, що кодують поліпептиди, які мають амінокислотну послідовність, вибрану з групи SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70 і 72. У переважному варіанті здійснення поліпептид за винаходом вибраний з групи, що складається з SEQ ID NO: 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69 і 71. Винахід не обмежується зазначеними полінуклеотидами, але також включає всі полінуклеотиди, які проявляють, щонайменше, 80 % ідентичність із зазначеними полінуклеотидами. Винахід стосується векторів, що включають полінуклеотиди за винаходом. В одному варіанті здійснення вектор містить полінуклеотид, що кодує важкий ланцюг анти-CD38 імуноглобуліну. В іншому варіанті здійснення зазначений полінуклеотид кодує легкий ланцюг анти-CD38 імуноглобуліну. Винахід також стосується векторів, що включають молекули полінуклеотиду, що кодують гібридні білки, модифіковані антитіла, фрагменти антитіл і їх зонди. Для експресії важкого і/або легкого ланцюга антитіл до CD38 за винаходом, полінуклеотиди, що кодують зазначені важкий і/або легкий ланцюги, вставляються у вектори експресії для того, щоб гени були функціонально зв'язані з транскрипційними і трансляційними послідовностями. Вектори експресії включають плазміди, YAC (дріжджові штучні хромосоми), косміди, ретровірус, епісоми, одержані з EBV (вірусу Епштейна-Барра) і всі інші вектори, які, як відомо фахівцям у даній галузі, підходять для забезпечення експресії зазначених важкого і/або легкого ланцюгів. Фахівцю у даній галузі буде зрозуміло, що полінуклеотиди, які кодують важкий і легкий ланцюги, можна клонувати у різні вектори або у той самий вектор. У переважному варіанті здійснення зазначені полінуклеотиди клонуються у той самий вектор. Полінуклеотиди за винаходом і вектори, що включають ці молекули, можна використовувати для трансформації придатної клітини-хазяїна ссавця. Трансформація може здійснюватися будьяким відомим способом введення полінуклеотидів у клітину-хазяїна. Такі способи добре відомі фахівцю у даній галузі і включають трансформацію, опосередковану декстраном, осадження фосфатом кальцію, трансфекцію, опосередковану полібреном, злиття протопластів, електропороутворення, інкапсулювання полінуклеотиду у ліпосоми, біолістичну ін'єкцію і пряму мікроін'єкцію ДНК в ядра. Фрагменти антитіл Антитіла за даним винаходом включають обговорені вище антитіла повної довжини, а також їх фрагменти, що зв'язують епітоп. Використовувані у даному винаході "фрагменти антитіл" включають будь-яку частину антитіла, що зберігає здатність зв'язувати епітоп, розпізнаваний антитілом повної довжини, і у цілому іменовані "фрагментами, що зв'язують епітоп". Приклади фрагментів антитіл включають без обмеження Fab, Fab' і F(ab') 2, Fd, одноланцюжкові Fvs (scFv), одноланцюжкові антитіла, зв'язані дисульфідом Fvs (dsFv), і фрагменти, що включають або область VL, або VH. Фрагменти, що зв'язують епітоп, які включають одноланцюжкові антитіла, можуть включати варіабельну область (області) окремо або у комбінації з усіма або частиною з наступних: шарнірною областю, доменами СН1, СН2 і СН3. Такі фрагменти можуть містити один або обидва фрагменти Fab, або фрагмент F(ab') 2. Переважно, фрагменти антитіла містять всі шість CDR цільного антитіла, хоча також функціональними є фрагменти, що містять менше, ніж всі такі області, наприклад, 3, 4 або 5 CDR. Крім того, фрагменти можуть являти собою або можуть комбінувати члени будь-якого з наступних класів імуноглобуліну: IgG, IgM, IgA, IgD або IgE і їх підкласів. Фрагменти Fab і F(ab")2 можна одержати протеолітичним розщепленням з використанням ферментів, таких як папін (фрагменти Fab) або пепсин (фрагменти F(ab") 2). Фрагменти "одноланцюжкові FV" ("scFv") являють собою фрагменти, що зв'язують епітоп, які містять, щонайменше, один фрагмент варіабельної області важкого ланцюга антитіла (VH), зв'язаний, щонайменше, з одним фрагментом варіабельної області легкого ланцюга антитіла 12 UA 114879 C2 5 10 15 20 25 30 35 40 45 50 55 (VL). Лінкер може являти собою короткий, гнучкий пептид, вибраний для забезпечення того, що належне тривимірне укладання областей VL і VH відбувається після того як воно зв'язується так, щоб зберегти специфічність зв'язування молекули-мішені з усім антитілом, з якого одержаний одноланцюжковий фрагмент антитіла. Карбоксильний кінець послідовності V L або VH може бути ковалентно зв'язаний лінкером з амінокислотним кінцем комплементарної послідовності V L або VH. Одноланцюжкові фрагменти антитіл за даним винаходом містять амінокислотні послідовності, які мають, щонайменше, одну з варіабельної області або області, що визначає комплементарність (CDR), цільних антитіл, описаних у даному описі, але позбавлені деяких або всіх константних доменів цих антитіл. Ці константні домени не є необхідними для зв'язування з антигеном, але складають основну частину структури цільних антитіл. Тому одноланцюжкові фрагменти антитіл можуть подолати деякі з проблем, пов'язаних з використанням антитіл, що містять частину або весь константний домен. Наприклад, одноланцюжкові фрагменти антитіл мають тенденцію не мати небажаних взаємодій між біологічними молекулами і константною областю важкого ланцюга, або іншої небажаної біологічної активності. Крім того, одноланцюжкові фрагменти антитіл значно менші, ніж цільні антитіла, і тому можуть мати більшу проникність у капіляри, ніж цільні антитіла, дозволяючи одноланцюжковим фрагментам антитіл більш ефективно локалізуватися і зв'язуватися з цільовими ділянками зв'язування антигенів. Також, фрагменти антитіла можуть бути одержані у відносно великому масштабі у прокаріотичних клітинах, таким чином, полегшуючи їх одержання. Крім того, відносно невеликий розмір одноланцюжкових фрагментів антитіл робить менш ймовірною можливість виклику імунної відповіді у реципієнта, ніж цільними антитілами. Одноланцюжкові фрагменти антитіл можуть бути генеровані молекулярним клонуванням, бібліотекою представлення фагу антитіла або аналогічними методиками, добре відомими фахівцю у даній галузі. Ці білки можна одержати, наприклад, в еукаріотичних клітинах або прокаріотичних клітинах, включаючи бактерії. Фрагменти, що зв'язують епітоп, за даним винаходом можуть також генеруватися з використанням різних способів представлення фагу, відомих у даній галузі. У способах представлення фагу, функціональні домени антитіл представляються на поверхні частинок фагу, які несуть полінуклеотидні послідовності, що кодують їх. Зокрема, такий фаг можна використовувати для представлення доменів, що зв'язують епітоп, які експресуються з репертуару або бібліотеки комбінаторних антитіл (наприклад, людських або мишачого). Фаг, що експресує домен, що зв'язує епітоп, який зв'язує антиген, що представляє інтерес, може бути вибранийабо ідентифікований антигеном, наприклад, з використанням міченого антигену, зв'язаного або захопленого на тверду поверхню або гранулу. Фаг, використовуваний у цих способах, являє собою звичайно нитчастий фаг, що включає домени зв'язування fd і M13, що експресуються з фагу Fab, Fv або стабілізовані дисульфідом Fv домени антитіла, рекомбінантно злиті або з геном III фагу, або з білком гена VIII. Приклади способів представлення фагу, які можна використовувати для одержання фрагментів, що зв'язують епітоп, за даним винаходом, включають способи, описані у документах Brinkman et al., 1995, J. Immunol. Methods, 182: 41-50; Ames et al., 1995, J. Immunol. Methods, 184: 177-186; Kettleborough et al., 1994, Eur. J. Immunol., 24: 952-958; Persic et al., 1997, Gene, 187: 9-18; Burton et al., 1994, Advances in Immunology, 57: 191-280; WO/1992/001047; WO 90/02809; WO 91/10737; WO 92/01047; WO 92/18619; WO 93/11236; WO 95/15982; WO 95/20401; і патенти США №№ 5698426; 5223409; 5403484; 5580717; 5427908; 5750753; 5821047; 5571698; 5427908; 5516637; 5780225; 5658727; 5733743 і 5969108, кожний з яких повністю включений у даний опис як посилання. Після вибору фагу, можна виділити області фагу, що кодують фрагменти, і використовувати їх для генерування фрагментів, що зв'язують епітоп, за допомогою експресії у вибраного хазяїна, включаючи клітини ссавців, клітини комах, клітини рослин, дріжджі і бактерії, з використанням технології рекомбінантної ДНК, наприклад, як у деталях описано нижче. Наприклад, методики для рекомбінантного одержання фрагментів Fab, Fab" і F(ab") 2 можна також використовувати із застосуванням способів, відомих у даній галузі, таких як способи, описані у WO 92/22324; Mullinax ef al., 1992, BioTechniques, 12(6): 864-869; Sawai et al., 1995, AJRI, 34: 26-34; і Better et al., 1988, Science, 240:1041-1043; зазначені посилання повністю включені у даний опис як посилання. Приклади методик, які можна застосовувати для одержання одноланцюжкових Fvs, і антитіл, включають ті, які описані у патентах США №№ 4946778 і 5258498; Huston et al, 1991, Methods in Enzymology, 203: 46-88; Shu et al., 1993, PNAS, 90: 7995-7999; Skerra et al., 1988, Science, 240:1038-1040. 13 UA 114879 C2 5 10 15 20 25 30 35 40 45 50 55 60 Функціональні еквіваленти В обсяг винаходу також включені функціональні еквіваленти антитіла до CD38 і гуманізованого антитіла проти рецептора CD38. Термін "функціональні еквіваленти" включає антитіла з гомологічними послідовностями, химерні антитіла, штучні антитіла і модифіковані антитіла, наприклад, де кожний функціональний еквівалент визначається здатністю зв'язуватися з білком CD38. Фахівцю у даній галузі буде зрозуміло, що є перекриття у групі молекул, називаних "фрагментами антитіл", і групі, називаній "функціональні еквіваленти". Способи одержання функціональних еквівалентів відомі фахівцю у даній галузі і описані, наприклад, у документах WO 93/21319, EP 239,400; WO 89/09622, EP 338,745 і EP 332,424, що повністю включені як посилання. Антитіла з гомологічними послідовностями являють собою ті антитіла з амінокислотними послідовностями, що мають гомологію послідовності з амінокислотною послідовністю антитіла до CD38 за даним винаходом. Переважно, гомологія наявна з амінокислотною послідовністю варіабельних областей антитіла до CD38а і гуманізованого антитіла до CD38 за даним винаходом. "Гомологія послідовності" застосовно до амінокислотної послідовності у даному описі визначається як послідовність з гомологією послідовності, щонайменше, приблизно 90 %, 91 %, 92 %, 93 % або 94 %, а більш переважно, з гомологією послідовності, щонайменше, приблизно 95 %, 96 %, 97 %, 98 % або 99 % з іншою амінокислотною послідовністю, за даними визначення, наприклад, способом дослідження FASTA (флюоресцентним імуносорбентним тестом), відповідно до документу Pearson and Lipman, 1988, Proc. Natl. Acad. Sci. USA, 85: 24442448. Штучні антитіла включають фрагменти scFv, діатіла, триатіла, тетратіла і mru (див. огляди Winter, G. and Milstein, C, 1991, Nature, 349: 293-299; Hudson, P.J., 1999, Current Opinion in Immunology, 11: 548-557), кожне з яких має здатність зв'язування з антигеном. В одноланцюжковому фрагменті Fv (scFv) домени VH і VL антитіла з'єднані гнучким пептидом. Звичайно, цей лінкерний пептид має довжину приблизно 15 амінокислотних залишків. Якщо лінкер є набагато меншим, наприклад, складається з 5 амінокислот, то утворюються діатіла, що являють собою бівалентні димери scFv. Якщо лінкер скорочений менш ніж до трьох амінокислотних залишків, то утворюються тримерні і тетрамерні структури, що називаються триатілами і тетратілами. Найменшою одиницею зв'язування антитіла є CDR, звичайно, CDR2 важкого ланцюга, що має достатнє специфічне розпізнавання і зв'язування, таким чином вона може використовуватися окремо. Такий фрагмент називається молекулярною одиницею розпізнавання або mru. Декілька таких mru можуть бути з'єднані разом короткими лінкерними пептидами, таким чином утворюючи штучний зв'язувальний білок з більш високою авідністю, ніж одиночнаmru. Функціональні еквіваленти за даним винаходом також включають модифіковані антитіла, наприклад, антитіла, модифіковані ковалентним приєднанням будь-якого типу молекули до антитіла. Наприклад, модифіковані антитіла включають антитіла, що були модифіковані, наприклад, глікозилюванням, ацетилюванням, пегілюванням, фосфорилуванням, амідуванням, дериватизацією відомими захисними/блокуючими групами, протеолітичним розщепленням, зв'язком з клітинним лігандом або іншим білком і т.д. Ковалентне приєднання не перешкоджає генеруванню антитілом анти-ідіотипічної реакції. Ці модифікації можна проводити відомими методиками, включаючи без обмеження специфічне хімічне розщеплення, ацетилювання, формілування, метаболічний синтез тунікаміцину і т.д. Крім того, модифіковані антитіла можуть містити одну або декілька не класичних амінокислот. Функціональні еквіваленти можна одержати взаємообміном різними CDR на різних ланцюгах всередині різних каркасів. Так, наприклад, різні класи антитіла можливі для даного набору CDR заміщенням різних важких ланцюгів, за допомогою чого можна одержати, наприклад, типи і ізотипи антитіл IgG1-4, IgM, IgA1-2, IgD, IgE. Аналогічним чином, штучні антитіла у межах обсягу винаходу можна одержати закладенням даного набору CDR всередину повністю синтетичного каркасу. Функціональні еквіваленти можна легко одержати мутацією, делецією і/або вставкою всередину послідовностей варіабельної і/або константної області, які фланкують визначений набір CDR з використанням широкого різноманіття способів, відомих у даній галузі. Фрагменти антитіл і функціональні еквіваленти за даним винаходом охоплюють ті молекули, які мають ступінь зв'язування, що виявляється, з CD38, у порівнянні з антитілом 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39. Ступінь зв'язування, що виявляється, включає усі величини у діапазоні, щонайменше, 10-100 %, переважно, щонайменше, 50 %, 60 % або 70 %, більш переважно, щонайменше, 75 %, 80 %, 85 %, 90 %, 95 % або 99 % здатності зв'язування мишачого антитіла 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39 з CD38. 14 UA 114879 C2 5 10 15 20 25 30 35 40 45 50 55 60 Вдосконалені антитіла CDR мають першорядне значення для розпізнавання епітопу і зв'язування з антитілом. Однак, зміни можуть здійснюватися у залишках, що включають CDR, без перешкоджання здатності антитіла розпізнавати і зв'язувати його споріднений по жіночій лінії епітоп. Наприклад, можна здійснити зміни, що не впливають на розпізнавання епітопу, але все-таки збільшують спорідненість зв'язування антитіла з епітопом. Таким чином, в обсяг даного винаходу також включені вдосконалені варіанти і мишачих, і гуманізованих антитіл, що також специфічно розпізнають і зв'язують CD38, переважно, з підвищеною спорідненістю. У декількох дослідженнях проведений аналіз впливів введення однієї або декількох змін амінокислот у різних положеннях у послідовності антитіла, на підставі знання послідовності первинного антитіла, на його властивостях, таких як зв'язування і рівень експресії (Yang, W. P. et al., 1995, J. Mol. Biol., 254: 392-403; Rader, С et al., 1998, Proc. Natl. Acad. Sci. USA, 95: 89108915; Vaughan, T. J. et al., 1998, Nature Biotechnology, 16: 535-539). У цих дослідженнях еквіваленти первинного антитіла генерувалися зміною послідовностей генів важкого і легкого ланцюга у CDR1, CDR2, CDR3 або каркасних областях, використовуючи такі способи як олігонуклеотид-опосередкований, сайт-направлений мутагенез, касетний мутагенез, схильна до помилки PCR (полімеразно-ланцюгова реакція), перетасування ДНК або мутаторні штами E. coli (Vaughan, T. J. et al., 1998, Nature Biotechnology, 16: 535-539; Adey, N. B. et al., 1996, Chapter 16, pp. 277-291, in "Phage Display of Peptides and Proteins", Eds. Kay, В. К. et al., Academic Press). Ці способи зміни послідовності первинного антитіла привели до поліпшеної спорідненості вторинних антитіл (Gram, H. et al., 1992, Proc. Natl. Acad. Sci. USA, 89: 3576-3580; Boder, E. T. et al., 2000, Proc. Natl. Acad. Sci. USA, 97: 10701-10705; Davies, J. and Riechmann, L, 1996, Immunotechnolgy, 2: 169-179; Thompson, J. et al., 1996, J. Mol. Biol., 256: 77-88; Short, M. K. et al., 2002, J. Biol. Chem., 277: 16365-16370; Furukawa, K. et al., 2001, J. Biol. Chem., 276: 2762227628). Шляхом аналогічної спрямованої стратегії зміни одного або декількох амінокислотних залишків антитіла, послідовності антитіл, описані у даному винаході, можна використовувати для одержання антитіл до СD38 з поліпшеними функціями, включаючи поліпшену спорідненість до CD38. Переважні амінокислотні заміщення являють собою ті, які: (1) знижують сприйнятливість до протеолізу, (2) знижують сприйнятливість до окиснення, (3) змінюють спорідненість зв'язування для утворення білкових комплексів і (4) додають або модифікують інші фізико-хімічні або функціональні властивості таких аналогів. Аналоги можуть включати різні мутеїни послідовності, відмінної від пептидної послідовності, що природно зустрічається. Наприклад, одиночні або множинні амінокислотні заміщення (переважно, консервативні амінокислотні заміщення) можна внести у послідовність, що природно зустрічається (переважно, у частину поліпептиду, зовні від домену (доменів), що утворюють міжмолекулярні контакти. Консервативне амінокислотне заміщення не повинне власне кажучи змінювати структурні характеристики батьківської послідовності (наприклад, амінокислота, що заміщує, не повинна мати тенденцію до руйнування спіралі, що виникає у батьківській послідовності, або до руйнування інших типів вторинної структури, що характеризує батьківську послідовність). Приклади визнаних у даній галузі поліпептидних вторинних і третинних структур описані у документах Proteins, Structures and Molecular Principles (Creighton, Ed., W. H. Freeman and Company, New York (1984)); Introduction to Protein Structure (C. Branden and J. Tooze, eds., Garland Publishing, New York, N. Y. (1991)); і Thornton et al., 1991, Nature, 354: 105, кожний з яких включений у даний опис як посилання. Вдосконалені антитіла також включають ті антитіла, які мають поліпшені характеристики, що одержані стандартними методиками імунізації тварин, утворення гібридоми і відбору антитіл зі специфічними характеристиками. Вдосконалені антитіла відповідно до винаходу включають, зокрема, антитіла з посиленими функціональними властивостями. Особливий інтерес являють собою ті антитіла, що мають підвищену здатність опосередкування клітинних цитотоксичних ефекторних функцій, таких як ADCC. Такі антитіла можна одержати здійсненням одиночних або множинних заміщень у константному каркасі антитіла, таким чином, змінюючи взаємодію з Fc рецепторами. Способи конструювання таких мутантів можна знайти, наприклад, у документах Lazar et al. (2006, Proc. Natl. Acad. Sci. U.S.A. 103(11): 4005-4010) і Okazaki et al. (2004, J. Mol. Biol. 336(5): 1239-49). Див. також WO 03/074679, WO 2004/029207, WO 2004/099249, WO2006/047350, WO 2006/019447, WO 2006/105338, WO 2007/041635. Можна також використовувати лінії клітин, специфічно сконструйовані для одержання вдосконалених антитіл. Зокрема, ці лінії змінили регуляцію шляху глікозилювання, приводячи до одержання антитіл, які слабко фукозильовані або навіть 15 UA 114879 C2 5 10 15 20 25 30 35 40 45 50 55 повністю дефукозильовані. Такі лінії клітин і способи конструювання описані, наприклад, у документах Shinkawa et al. (2003, J. Biol. Chem. 278(5): 3466-3473), Ferrara et al. (2006, J. Biol. Chem. 281(8): 5032-5036; 2006, Biotechnol. Bioeng. 93(5): 851-61), EP 1331266, EP 1498490, EP 1498491, EP 1676910, EP 1792987 і WO 99/54342. Даний винахід також включає цитотоксичні кон'югати. Ці цитотоксичні кон'югати включають два первинних компоненти, агент, що зв'язує клітину, і цитотоксичний агент. Використовуваний у даному описі термін "агент, що зв'язується з клітиною" стосується агента, що специфічно розпізнає і зв'язується з білками CD38 на клітинній поверхні. В одному варіанті здійснення агент, що зв'язується з клітиною, специфічно розпізнає CD38, таким чином він забезпечує кон'югатам можливість діяти націленим чином при невеликій кількості побічних ефектів, що виникають у результаті неспецифічного зв'язування. В іншому варіанті здійснення агент, що зв'язується з клітиною, за даним винаходом також специфічно розпізнає білок CD38, так, щоб кон'югати були у контакті з клітиною-мішенню протягом достатнього періоду часу для забезпечення частині цитотоксичного препарату кон'югату можливості дії на клітину і/або надання кон'югатам достатнього часу, за який вони можуть інтерналізуватися клітиною. У переважному варіанті здійснення цитотоксичні кон'югати включають антитіло до CD38 як агент, що зв'язується з клітиною, більш переважно, мишаче моноклональне антитіло 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39. В іншому переважному варіанті здійснення агент, що зв'язується з клітиною, являє собою химерний варіант зазначеного антитіла до CD38. У більш переважному варіанті здійснення цитотоксичний кон'югат включає гуманізоване антитіло 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39 або його фрагмент, що зв'язує епітоп. Антитіло 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39 здатне специфічно розпізнавати CD38 і прицільним чином направляє цитотоксичний агент до патологічної клітини або тканини, такої як ракова клітина. Другий компонент цитотоксичних кон'югатів за даним винаходом являє собою цитотоксичний агент. Використовуваний у даному описі термін "цитотоксичний агент" стосується речовини, що знижує або блокує функцію або ріст клітин, і/або викликає руйнування клітин. У переважних варіантах здійснення, цитотоксичний агент являє собою лікарський препарат, проліки, таксоїд, мейтансиноїд, такий як DM1 або DM4, похідне томейміцину, похідне лептоміцину, СС-1065 або аналог СС-1065. У переважних варіантах здійснення, агенти, що зв'язуються з клітиною, за даним винаходом ковалентно приєднані, безпосередньо або за допомогою розщеплюваного або нерозщеплюваного лінкера, до цитотоксичного агента. Агенти, що зв'язуються з клітиною, цитотоксичні агенти і лінкери більш детально обговорюються нижче. Агенти, що зв'язуються з клітиною Ефективність сполук за даним винаходом як терапевтичних агентів залежить від ретельного вибору відповідного агента, що зв'язується з клітиною. Агенти, що зв'язуються з клітиною, можуть бути будь-якого виду, відомого у даний час, або які стають відомими, і включають пептиди і не пептиди. Агент, що зв'язується з клітиною, може являти собою будь-яку сполуку, що може зв'язуватися з клітиною, або специфічним, або неспецифічним чином. В цілому, вони можуть являти собою антитіла (особливо, моноклональні антитіла), лімфокіни, гормони, ростові фактори, вітаміни, молекули транспорту поживних речовин (таких як трансферин), або будь-яку іншу молекулу, що зв'язується з клітиною, або речовину. Більш специфічні приклади агентів, що зв'язуються з клітиною, які можна використовувати, включають: а) поліклональні антитіла; b) моноклональні антитіла; с) фрагменти антитіл, такі як Fab, Fab" і F(ab")2, Fv (Parham, 1983, J. Immunol., 131: 28952902; Spring et al., 1974, J. Immunol., 113: 470-478; Nisonoff et al., 1960, Arch. Biochem. Biophys., 89: 230-244). Зокрема, моноклональне антитіло до CD38, вибране з 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39, можна використовувати як агент, що зв'язується з клітиною, відповідно до даного винаходу. Аналогічним чином, зазначений агент, що зв'язується з клітиною, може являти собою химерний варіант одного з моноклональних антитіл 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39. Переважно, гуманізоване антитіло до CD38 використовується як агент, що зв'язується з клітиною, за даним винаходом. Більш переважно, гуманізоване антитіло до CD38 вибране з гуманізованих або підданих реструктуруванню поверхні антитіл 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 і 38SB39. 16 UA 114879 C2 5 10 15 20 25 30 35 40 45 50 55 Цитотоксичні агенти В іншому варіанті здійснення гуманізоване антитіло або його фрагмент, що зв'язує епітоп, можуть бути спряжено зв'язані з лікарським засобом, таким як мейтансиноїд, для утворення проліків, що мають специфічну цитотоксичність стосовно клітин, які експресують антиген, шляхом націлювання препарату на білок CD38. Цитотоксичні кон'югати, що включають такі антитіла, і дрібний, високо токсичний препарат (наприклад, мейтансиноїди, таксани, похідні томейміцину, похідні лептоміцину і аналоги СС-1065), можна використовувати як терапевтичний засіб для лікування пухлин, таких як лімфома, лейкоз і множинна мієлома. Цитотоксичний агент, використовуваний у цитотоксичному кон'югаті за даним винаходом, може являти собою будь-яку сполуку, що приводить до цитолізу або викликає цитоліз, або якимнебудь чином зменшує життєздатність клітин. Переважні цитотоксичні агенти включають, наприклад, мейтансиноїди і аналоги мейтансиноїдів, таксоїди, похідні томейміцину, похідні тептоміцину, СС-1065 і аналоги СС-1065, доластатин і аналоги доластатину, визначені нижче. Ці цитотоксичні агенти спряжено зв'язані з антитілами, фрагментами антитіл, функціональними еквівалентами, вдосконаленими антитілами і їх аналогами, як описано у даному описі. Цитотоксичні кон'югати можна одержати способами in vitro. Для з'єднання проліків з антитілом використовується з'єднувальна група. Придатні з'єднувальні групи добре відомі у даній галузі і включають дисульфідні групи, групи, лабільні до пептидази, і групи, лабільні до естерази. Переважні з'єднувальні групи являють собою дисульфідні групи і тіоефірні групи. Наприклад, кон'югати можуть конструюватися з використанням реакції обміну дисульфідів або утворенням тіоефірного зв'язку між антитілом і лікарським препаратом або проліками. Мейтансиноїди Серед цитотоксичних агентів, які можна використовувати у даному винаході для утворення цитотоксичного кон'югату, знаходяться мейтансиноїди і аналоги мейтансиноїдів. Приклади придатних мейтансиноїдів включають мейтансинол і аналоги мейтансинолу. Мейтансиноїди являють собою лікарські препарати, які інгібують утворення мікротрубочок, і які є високо токсичними для клітин ссавців. Приклади придатних аналогів мейтансинолу включають ті, які мають модифіковане ароматичне кільце, і ті, які мають модифікації в інших положеннях. Такі придатні мейтансиноїди описані у патентах США №№ 4424219; 4256746; 4294757; 4307016; 4313946; 4315929; 4331598; 4361650; 4362663; 4364866; 4450254; 4322348; 4371533; 6333410; 5475092; 5,585,499 і 5846545. Конкретні приклади придатних аналогів мейтансинолу, що мають модифіковане ароматичне кільце, включають: (1) С-19-дехлор (патент США № 4256746) (одержуваний відновленням LAH ансамітоцину Р2); (2) С-20-гідрокси (або С-20-диметил) +/-C-19-дехлор (патенти США №№ 4361650 і 4307016) (одержувані деметилуванням з використанням Streptomyces або Actinomyces або дехлоруванням з використанням LAH); і (3) С-20-деметокси, С-20-ацилокси (-OCOR), +/-дехлор (патент США № 4294757) (одержуваний ацилюванням з використанням ацилхлоридів). Конкретні приклади придатних аналогів мейтансинолу, що мають модифікації інших положень, включають: (1) C-9-SH (патент США № 4424219) (одержуваний взаємодією мейтансинолу з H 2S або P2S5); (2) С-14-алкоксиметил (деметокси/CH2OR) (патент США № 4331598); (3) С-14-гідроксиметил або ацилоксиметил (CH2OH або CH2OAc) (патент США № 4450254) (одержувані з Nocardia); (4) С-15-гідрокси/ацилокси (патент США № 4364866) (одержуваний перетворенням мейтансинолу Streptomyces); (5) С-15-метокси (патенти США №№ 4313946 і 4315929) (виділений з Trewia nudiflora); (6) C-18-N-деметил (патенти США №№ 4362663 і 4322348) (одержаний деметилуванням мейтансинолу Streptomyces); (7) 4,5-деокси (патент США № 4371533) (одержаний відновленням мейтансинолу трихлоридом титану/LAH). У переважному варіанті здійснення цитотоксичні кон'югати за даним винаходом використовують мейтансиноїд, що містить тіол (DM1), формально іменований N2'-деацетил-N2'(3-меркапто-1-оксопропіл)мейтансином, як цитотоксичний агент. DM1 представлений наведеною нижче структурною формулою (I): 17 UA 114879 C2 5 10 15 20 В іншому переважному варіанті здійснення цитотоксичні кон'югати за даним винаходом використовують тіол-вмісний мейтансиноїд, N2'-деацетил-N2'-(4-метил-4-меркапто-1оксопентил)мейтансин, як цитотоксичний агент. DM4 представлений наведеною нижче структурною формулою (II): В інших варіантах здійснення винаходу, можна використовувати інші мейтансини, включаючи мейтансиноїди, що містять тіол і дисульфід, що несуть моно- або ді-алкільне заміщення на атомі вуглецю, що несе атом сірки. Вони включають мейтансиноїд, що має на С-3, С-14 гідроксиметилі, С-15 гідрокси або С-20 десметилі ацилований амінокислотний бічний ланцюг з ацильною групою, що несе блоковану сульфгідрильну групу, де атом вуглецю ацильної групи, що несе тіольну функціональну групу, має один або два замісники, причому зазначені замісники являють собою CH3, C2H5, лінійний або розгалужений алкіл або алкеніл, що має від 1 до 10 атомів вуглецю, циклічний алкіл або алкеніл, що має від 3 до 10 атомів вуглецю, феніл, заміщений феніл або гетероциклічний ароматичний або гетероциклоалкільний радикал, і, крім того, де один із замісників може являти собою Н, і де ацильна група має довжину лінійного ланцюга, щонайменше, 3 атоми вуглецю між карбонільною функціональною групою і атомом сірки. Такі додаткові мейтансини включають сполуки, представлені формулою (III): де: В' являє собою 18 UA 114879 C2 5 10 15 20 25 30 35 40 45 де: кожний з R1 і R2 незалежно являє собою CH3, C2H5, лінійний алкіл або алкеніл, що має від 1 до 10 атомів вуглецю, розгалужений або циклічний алкіл або алкеніл, що має від 3 до 10 атомів вуглецю, феніл, заміщений феніл або гетероциклічний ароматичний або гетероциклоалкільний радикал, і при додаванні R2 може являти собою Н; A, B, D означають циклоалкіл або циклоалкеніл, що має від 3 до 10 атомів вуглецю, простий або заміщений арилом або гетероциклічним ароматичним або гетероциклоалкільним радикалом; кожний з R3, R4, R5, R6, R7, R8, R9, R11 і R12 являє собою незалежно Н, CH3, C2H5, лінійний алкіл або алкеніл, що має від 1 до 10 атомів вуглецю, розгалужений або циклічний алкіл або алкеніл, що має від 3 до 10 атомів вуглецю, феніл, заміщений феніл або гетероциклічний ароматичний або гетероциклоалкільний радикал; кожний з l, m, n, o, p, q, r, s і t незалежно дорівнює 0 або цілому числу від 1 до 5, за умови, що, щонайменше, два з l, m, n, o, p, q, r, s і t не дорівнюють нулю одночасно; і Z являє собою H, SR або -COR, де R являє собою лінійний алкіл або алкеніл, що має від 1 до 10 атомів вуглецю, розгалужений або циклічний алкіл або алкеніл, що має від 3 до 10 атомів вуглецю, або простий або заміщений арил або гетероциклічний ароматичний або гетероциклоалкільний радикал. Переважні варіанти здійснення сполук формули (III) включають сполуки формули (III), де: R1 являє собою Н, R2 являє собою метил і Z являє собою H. R1 і R2 являють собою метил і Z являє собою H. R1 являє собою Н, R2 являє собою метил і Z являє собою -SCH3. R1 і R2 являють собою метил і Z являє собою -SCH3. Такі додаткові мейтансини також включають сполуки, представлені формулою (IV-L), (IV-D) або (IV-D, L): де: Y являє собою де: кожний з R1 і R2 незалежно являє собою CH3, C2H5, лінійний алкіл або алкеніл, що має від 1 до 10 атомів вуглецю, розгалужений або циклічний алкіл або алкеніл, що має від 3 до 10 атомів вуглецю, феніл, заміщений феніл або гетероциклічний ароматичний абогетероциклоалкільний радикал, і при додаванні R2 може являти собою Н; кожний з R3, R4, R5, R6, R7 і R8 являє собою незалежно Н, CH3, C2H5, лінійний алкіл або алкеніл, що має від 1 до 10 атомів вуглецю, розгалужений або циклічний алкіл або алкеніл, що має від 3 до 10 атомів вуглецю, феніл, заміщений феніл або гетероциклічний ароматичний або гетероциклоалкільний радикал; кожний з l, m і n незалежно дорівнює цілому числу від 1 до 5, і при додаванні n може дорівнювати 0; Z являє собою H, SR або -COR, де R являє собою лінійний або розгалужений алкіл або алкеніл, що має від 1 до 10 атомів вуглецю, циклічний алкіл або алкеніл, що має від 3 до 10 атомів вуглецю, або простий або заміщений арил або гетероциклічний ароматичний або гетероциклоалкільний радикал; і May являє собою мейтансиноїд, що несе бічний ланцюг на С-3, С-14 гідроксиметилі, С-15 гідрокси або С-20 десметилі. Переважні варіанти здійснення формул (IV-L), (IV-D) і (IV-D, L) включають сполуки формул (IV-L), (IV-D) і (IV-D, L), де: 19 UA 114879 C2 5 10 15 20 25 30 35 40 R1 являє собою Н, R2 являє собою метил, кожний з R5, R6, R7 і R8 являє собою незалежно Н, і кожний m дорівнює 1, n дорівнює 0, і Z являє собою Н. R1 і R2 являють собою метил, кожний з R5, R6, R7, R8 являє собою Н, l і m дорівнюють 1, n дорівнює 0, і Z являє собою Н. R1 являє собою Н, R2 являє собою метил, кожний з R5, R6, R7, R8 являє собою Н, кожний l і m дорівнює 1, n дорівнює 0, і Z являє собою -SCН3. R1 і R2 являють собою метил, кожний з R5, R6, R7, R8 являє собою Н, l і m дорівнюють 1, n дорівнює 0, і Z являє собою -SCН3. Переважно, цитотоксичний агент представлений формулою (IV-L). Такі додаткові мейтансини також включають сполуки, представлені формулою (V): Y являє собою де: кожний з R1 і R2 незалежно являє собою CH3, C2H5, лінійний алкіл або алкеніл, що має від 1 до 10 атомів вуглецю, розгалужений або циклічний алкіл або алкеніл, що має від 3 до 10 атомів вуглецю, феніл, заміщений феніл або гетероциклічний ароматичний або гетероциклоалкільний радикал, і при додаванні R2 може являти собою Н; кожний з R3, R4, R5, R6, R7 і R8 являє собою незалежно Н, CH3, C2H5, лінійний алкіл або алкеніл, що має від 1 до 10 атомів вуглецю, розгалужений або циклічний алкіл або алкеніл, що має від 3 до 10 атомів вуглецю, феніл, заміщений феніл або гетероциклічний ароматичний або гетероциклоалкільний радикал; кожний з l, m і n незалежно дорівнює цілому числу від 1 до 5, і при додаванні n може дорівнювати 0; і Z являє собою H, SR або -COR, де R являє собою лінійний алкіл або алкеніл, що має від 1 до 10 атомів вуглецю, розгалужений або циклічний алкіл або алкеніл, що має від 3 до 10 атомів вуглецю, або простий або заміщений арил або гетероциклічний ароматичний або гетероциклоалкільний радикал. Переважні варіанти здійснення формули (V) включають сполуки формули (V), де: R1 являє собою Н, R2 являє собою метил, кожний з R5, R6, R7 і R8 являє собою Н; кожний з l і m дорівнює 1; n дорівнює 0; і Z являє собою Н. R1 і R2 являють собою метил, кожний з R5, R6, R7 і R8 являє собою Н, l і m дорівнюють 1; n дорівнює 0; і Z являє собою Н. R1 являє собою Н, R2 являє собою метил, кожний з R5, R6, R7 і R8 являє собою Н, кожний l і m дорівнює 1, n дорівнює 0, і Z являє собою -SCН3. R1 і R2 являють собою метил, кожний з R5, R6, R7 і R8 являє собою Н, l і m дорівнюють 1, n дорівнює 0, і Z являє собою -SCН3. Такі додаткові мейтансини, крім того, включають сполуки, представлені формулою (VI-L), (VI-D) або (VI-D, L): де: 20 UA 114879 C2 5 10 15 20 25 30 35 40 Y2 являє собою де: кожний з R1 і R2 незалежно являє собою CH3, C2H5, лінійний алкіл або алкеніл, що має від 1 до 10 атомів вуглецю, розгалужений або циклічний алкіл або алкеніл, що має від 3 до 10 атомів вуглецю, феніл, заміщений феніл або гетероциклічний ароматичний або гетероциклоалкільний радикал, і при додаванні R2 може являти собою Н; кожний з R3, R4, R5, R6, R7 і R8 являє собою незалежно Н, CH3, C2H5, лінійний або циклічний алкіл або алкеніл, що має від 1 до 10 атомів вуглецю, розгалужений або циклічний алкіл або алкеніл, що має від 3 до 10 атомів вуглецю, феніл, заміщений феніл або гетероциклічний ароматичний або гетероциклоалкільний радикал; кожний з l, m і n незалежно дорівнює цілому числу від 1 до 5, і при додаванні n може дорівнювати 0; Z2 являє собою SR або -COR, де R являє собою лінійний алкіл або алкеніл, що має від 1 до 10 атомів вуглецю, розгалужений або циклічний алкіл або алкеніл, що має від 3 до 10 атомів вуглецю, або простий або заміщений арил або гетероциклічний ароматичний або гетероциклоалкільний радикал; і May являє собою мейтансиноїд. Такі додаткові мейтансиноїди також включають сполуки, представлені формулою (VII): де: Y2" являє собою де: кожний з R1 і R2 незалежно являє собою CH3, C2H5, лінійний або розгалужений алкіл або алкеніл, що має від 1 до 10 атомів вуглецю, циклічний алкіл або алкеніл, що має від 3 до 10 атоміввуглецю, феніл, заміщений феніл або гетероциклічний ароматичний або гетероциклоалкільний радикал, і при додаванні R2 може являти собою Н; кожний A, B, D незалежно означає циклоалкіл або циклоалкеніл, що має від 3 до 10 атомів вуглецю, простий або заміщений арил або гетероциклічний ароматичний або гетероциклоалкільний радикал; кожний з R3, R4, R5, R6, R7, R8, R9, R11 і R12 являє собою незалежно Н, CH3, C2H5, лінійний алкіл або алкеніл, що має від 1 до 10 атомів вуглецю, розгалужений або циклічний алкіл або алкеніл, що має від 3 до 10 атомів вуглецю, феніл, заміщений феніл або гетероциклічний ароматичний або гетероциклоалкільний радикал; кожний з l, m, n, o, p, q, r, s і t незалежно дорівнює 0 або цілому числу від 1 до 5, за умови, що, щонайменше, два з l, m, n, o, p, q, r, s і t не дорівнюють нулю одночасно; і Z2 являє собою SR або -COR, де R являє собою лінійний алкіл або алкеніл, що має від 1 до 10 атомів вуглецю, розгалужений або циклічний алкіл або алкеніл, що має від 3 до 10 атомів вуглецю, або простий або заміщений арил або гетероциклічний ароматичний або гетероциклоалкільний радикал. Переважні варіанти здійснення сполук формули (VII) включають сполуки формули (VII), де: R1 являє собою Н і R2 являє собою метил. Зазначені вище мейтансиноїди можуть бути спряжено зв'язані з антитілом до CD38 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39 або його гомологом або фрагментом, де антитіло 21 UA 114879 C2 5 10 15 20 25 30 зв'язане з мейтансиноїдом з використанням тіольної або дисульфідної функціональної групи, яка присутня на ацильній групі бічного ланцюга ацилованої амінокислоти, що виявляється на С3, С-14 гідроксиметилі, С-15 гідрокси або С-20 десметилі мейтансиноїду, і де ацильна група бічного ланцюга ацилованої амінокислоти має свою тіольну або дисульфідну функціональну групу, що локалізується на атомі вуглецю, що має один або два замісники, причому зазначені замісники являють собою CH3, C2H5, лінійний алкіл або алкеніл, що має від 1 до 10 атомів вуглецю, феніл, заміщений феніл або гетероциклічний ароматичний або гетероциклоалкільний радикал, і при додаванні одного з замісників може являти собою Н, і де ацильна група має довжину лінійного ланцюга, щонайменше, три атоми вуглецю між карбонільною функціональною групою і атомом сірки. Переважний кон'югат за даним винаходом являє собою той, який містить антитіло до CD38 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39, або його гомолог або фрагмент, спряжено зв'язаний з мейтансиноїдом формули (VIII): де: Y1" являє собою де: кожний A, B, D незалежно означає циклоалкіл або циклоалкеніл, що має від 3 до 10 атомів вуглецю, простий або заміщений арилом або гетероциклічним ароматичним або гетероциклоалкільним радикалом; кожний з R3, R4, R5, R6, R7, R8, R9, R11 і R12 являє собою незалежно Н, CH3, C2H5, лінійний алкіл або алкеніл, що має від 1 до 10 атомів вуглецю, розгалужений або циклічний алкіл або алкеніл, що має від 3 до 10 атомів вуглецю, феніл, заміщений феніл або гетероциклічний ароматичний або гетероциклоалкільний радикал; і кожний з l, m, n, o, p, q, r, s і t незалежно дорівнює 0 або цілому числу від 1 до 5, за умови, що, щонайменше, два з l, m, n, o, p, q, r, s і t не дорівнюють нулю одночасно. Переважно, R1 являє собою Н, а R2 являє собою метил або R1 і R2 являють собою метил. Ще більш переважний кон'югат за даним винаходом являє собою той, який містить антитіло до CD38 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39, або його гомолог або фрагмент, спряжено зв'язаний з мейтансиноїдом формули (IX-L), (IX-D) або (IX-D, L): де: Y1 являє собою 35 22 UA 114879 C2 5 10 15 20 25 30 35 40 45 де: кожний з R1 і R2 незалежно являє собою CH3, C2H5, лінійний алкіл або алкеніл, що має від 1 до 10 атомів вуглецю, розгалужений або циклічний алкіл або алкеніл, що має від 3 до 10 атомів вуглецю, феніл, заміщений феніл, гетероциклічний ароматичний або гетероциклоалкільний радикал, і при додаванні R2 може являти собою Н; кожний з R3, R4, R5, R6, R7 і R8 являє собою незалежно Н, CH3, C2H5, лінійний алкіл або алкеніл, що має від 1 до 10 атомів вуглецю, розгалужений або циклічний алкіл або алкеніл, що має від 3 до 10 атомів вуглецю, феніл, заміщений феніл або гетероциклічний ароматичний або гетероциклоалкільний радикал; кожний з l, m і n незалежно дорівнює цілому числу від 1 до 5, і при додаванні n може дорівнювати нулю; і May являє собою мейтансинол, що несе бічний ланцюг на С-3, С-14 гідроксиметилі, С-15 гідрокси або С-20 десметилі. Переважні варіанти здійснення сполук формул (IX-L), (IX-D) і (IX-D, L) включають сполуки формул (IX-L), (IX-D) і (IX-D, L), де: R1 являє собою Н, R2 являє собою метил або кожний з R1 і R2 являє собою метил, R1 являє собою Н, R2 являє собою метил, кожний з R5, R6, R7 і R8 являє собою Н; кожний з l і m дорівнює 1; n дорівнює 0, R1 і R2 являють собою метил; кожний з R5, R6, R7 і R8 являє собою Н;кожний з l і m дорівнює 1; n дорівнює 0. Переважно, цитотоксичний агент представлений формулою (IX-L). Ще один переважний кон'югат за даним винаходом являє собою той, який містить антитіло до CD38 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39 або його гомолог або фрагмент, спряжено зв'язаний з мейтансиноїдом формули (X): де замісники є такими як визначено вище для формули (IX). Особливо переважними є будь-які з описаних вище сполук, де R 1 являє собою Н, R2 являє собою метил, кожний з R5, R6, R7 і R8 являє собою Н; кожний з l і m дорівнює 1; і n дорівнює 0. Крім того, особливо переважними є будь-які з описаних вище сполук, де R 1 і R2 являють собою метил, кожний з R5, R6, R7 і R8 являє собою Н; l і m дорівнюють 1; і n дорівнює 0. Крім того, переважним є L-аміноацильний стереоізомер. Кожний з мейтансиноїдів, про який йде мова в одночасно поданій заявці на патент США № 10/849,136, поданій 20 травня 2004 р., можна також використовувати у цитотоксичному кон'югаті за даним винаходом. Повний опис заявки на патент США № 10/849,136 включений у даний опис шляхом посилання. З'єднувальні групи, що містять дисульфід Для з'єднання мейтансиноїду з агентом, що зв'язується з клітиною, таким як антитіло 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39, мейтансиноїд містить зв'язувальну частину. Зв'язувальна частина містить хімічний зв'язок, що забезпечує можливість вивільнення повністю активних мейтансиноїдів у визначеній ділянці. Придатні хімічні зв'язки добре відомі у даній галузі і включають дисульфідні зв'язки, кислотно-лабільні зв'язки, фотолабільні зв'язки, пептидазо-лабільні зв'язки і естеразо-лабільні зв'язки. Переважними є дисульфідні зв'язки. Зв'язувальна частина також містить реактивну хімічну групу. У переважному варіанті здійснення реактивна хімічна група може бути ковалентно зв'язана з мейтансиноїдом через зв'язувальну частину у вигляді дисульфідного зв'язку. Особливо переважні реактивні хімічні групи являють собою складні ефіри N-сукцинімідилу і складні ефіри N-сульфосукцинімідилу. 23 UA 114879 C2 5 10 15 20 25 30 35 40 45 50 55 Особливо переважні мейтансиноїди, що містять зв'язувальну частину, що містить реактивну хімічну групу, являють собою складні С-3 ефіри мейтансинолу і його аналоги, де зв'язувальна частина містить дисульфідний зв'язок, а хімічна реактивна група містить складний ефір Nсукцинімідилу або N-сульфосукцинімідилу. Багато положень на мейтансиноїдах можуть служити як положення для хімічного зв'язку зв'язувальної частини. Наприклад, очікується, що можна використовувати положення С-3, що має гідроксильну групу, положення С-14, модифіковане гідроксиметилом, положення С-15, модифіковане гідрокси, і положення С-20, що має гідрокси групу. Однак, положення С-3 є переважним, і особливо переважне С-3 положення мейтансинолу. Хоча синтез складних ефірів мейтансинолу, що мають зв'язувальну частину, описаний з погляду зв'язувальних частин, що містять дисульфідний зв'язок, фахівцю у даній галузі буде зрозуміло, що у даному винаході також можуть використовуватися зв'язувальні частини з іншими хімічними зв'язками (як описано вище), як і інші мейтансиноїди. Визначені приклади інших хімічних зв'язків включають кислотно-лабільні зв'язки, фотолабільні зв'язки, пептидазолабільні зв'язки і естеразо-лабільні зв'язки. В описі патенту США № 5208020, включеного у даний опис, мова йде про одержання мейтансиноїдів, що несуть такі зв'язки. Синтез мейтансиноїдів і похідних мейтансиноїдів, що мають дисульфідний зв'язок, що несе реактивну групу, описаний у патентах США №№ 6441163 і 6333410, і у заявці на патент США № 10/161,651, кожний з яких включений у даний опис шляхом посилання. Мейтансиноїди, що містять реактивну групу, таку як DM1, вступають у взаємодію з антитілом, таким як антитіло 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39, для одержання цитотоксичних кон'югатів. Ці кон'югати можуть бути очищені ВЕРХ або гельфільтрацією. Декілька чудових схем одержання таких кон'югатів антитіла-мейтансиноїду представлені у патенті США № 6333410 і у заявках на патенти США №№ 09/867,598, 10/161,651 і 10/024,290, кожний з яких повністю включений у даний опис шляхом посилання. В цілому, розчин антитіла у водному буфері може інкубуватися з молярним надлишком мейтансиноїдів, що мають дисульфідний зв'язок, що несе реактивну групу. Реакційну суміш можна погасити додаванням надлишку аміну (такого як етаноламін, таурин і т.д.). Потім кон'югат антитіла-мейтансиноїду може очищатися гель-фільтрацією. Кількість молекул мейтансиноїду, зв'язаних на молекулі антитіла, можна визначити спектрометричним вимірюванням співвідношення спектральної поглинальної здатності при 252 нм і 280 нм. Переважно у середньому 1-10 молекул мейтансиноїду/молекулу антитіла. Кон'югати антитіл з мейтансиноїдними лікарськими засобами можна оцінити для визначення їх здатності придушувати проліферацію різних ліній небажаних клітин in vitro. Наприклад, лінії клітин, такі як лінія людських клітин лімфоми Daudi, лінія людських клітин лімфоми Ramos, лінія клітин людської множинної мієломи MOPL-8, і лінія клітин людського гострого Т клітинного лімфолейкозу MOLT-4, можна легко використовувати для оцінки цитотоксичності цих сполук. Клітини, що підлягають оцінці, можуть бути піддані впливу сполук протягом 24 годин, і фракції клітин, що вижили, можуть бути виміряні у прямих аналізах відомими методами. Потім за результатами аналізів можна розрахувати величини IC50. З'єднувальні групи, що містять PEG Мейтансиноїди можуть бути також зв'язані з агентами, що зв'язуються з клітинами, з використанням з'єднувальних груп PEG, як описано у заявці на патент США № 10/024,290. Ці з'єднувальні групи PEG розчинні і у воді, і у неводних розчинниках, і можуть використовуватися для з'єднання одного або декількох цитотоксичних агентів з агентом, що зв'язується з клітиною. Ілюстративні з'єднувальні групи PEG включають гетеро-біфункціональні лінкери PEG, що зв'язуються з цитотоксичними агентами, і з агентами, що зв'язуються з клітинами, на протилежних кінцях лінкерів через функціональну сульфгідрильну або дисульфідну групу на одному кінці, і активний складний ефір на іншому кінці. Як загальний приклад синтезу цитотоксичного кон'югату з використанням з'єднувальної групи PEG, визначені деталі можна знайти з посиланням на заявку на патент США № 10/024,290. Синтез починається з взаємодії одного або декількох цитотоксичних агентів, що несуть реактивну частину PEG, з агентом, що зв'язується з клітиною, що приводить до заміщення кінцевого реактивного складного ефіру кожної реактивної частини PEG амінокислотним залишком агента, що зв'язується з клітиною, для виходу цитотоксичного кон'югату, що містить один або декілька цитотоксичних агентів, ковалентно зв'язаних з агентом, що зв'язується з клітиною, через з'єднувальну групу PEG. 24 UA 114879 C2 5 10 15 20 25 30 35 40 Таксани Цитотоксичний агент, використовуваний у цитотоксичних кон'югатах відповідно до даного винаходу, може також являти собою таксан або його похідне. Таксани являють собою сімейство сполук, що включає паклітаксел (таксол), цитотоксичний натуральний продукт, і доцетаксел (таксотер), напівсинтетичне похідне, дві сполуки, що широко використовуються при лікуванні раку. Таксани являють собою отрути мітотичного веретена, що інгібують деполімеризацію тубуліну, що приводить до загибелі клітини. Хоча доцетаксел і паклітаксел є корисними засобами при лікуванні раку, їх протипухлинна активність обмежена через їх неспецифічну токсичність стосовно нормальних клітин. Крім того, сполуки, подібні до паклітакселу і доцетакселу, є недостатньо активними для застосування у кон'югатах агентів, що зв'язуються з клітинами. Переважний таксан для використання при одержанні цитотоксичного кон'югату, являє собою таксан формули (XI): Способи синтезу таксанів, які можна використовувати у цитотоксичних кон'югатах за даним винаходом, нарівні зі способами спряженого зв'язування таксанів з агентами, що зв'язуються з клітинами, такими як антитіла, описані у деталях у патентах США №№ 5416064, 5475092, 6340701, 6372738 і 6436931 та у заявках на патенти США №№ 10/024,290, 10/144,042, 10/207,814, 10/210,112 і 10/369,563. Похідні томейміцину Цитотоксичний агент відповідно до даного винаходу може також являти собою похідне томейміцину. Похідні томейміцину являють собою пірол[1,4]бензодіазепіни (PBD), відомий клас сполук, які надають свої біологічні ефекти ковалентним зв'язуванням з N2 гуаніну у малій борозенці ДНК. PBD включають ряд зв'язувальних агентів малої борозенки, таких як антраміцин, неотраміцин і DC-81. Нові похідні томейміцину, що зберігають високу цитотоксичність і можуть ефективно зв'язуватися з агентами, що зв'язуються з клітинами, описані у Міжнародній заявці № PCT/B2007/000142, зміст якої включений у даний опис шляхом посилання. Комплекси агента, що зв'язується з клітиною, - похідного томейміцину - забезпечують можливість повної міри цитотоксичної дії похідних томейміцину для цільового застосування тільки проти небажаних клітин, таким чином уникаючи побічних ефектів внаслідок ушкодження не цільових здорових клітин. Цитотоксичний агент відповідно до даного винаходу містить один або декілька похідних томейміцину, зв'язаних з агентом, що зв'язується з клітиною, таким як антитіло 38SB13, 38SB18, 38SB19, 38SB30, 38SB31 або 38SB39, через зв'язувальну групу. Зв'язувальна група є частиною хімічної групи, що ковалентно зв'язана з похідним томейміцину за допомогою звичайних способів. У переважному варіанті здійснення хімічна частина може бути ковалентно зв'язана з похідним томейміцину через дисульфідний зв'язок. Похідні томейміцину, які можна використовувати у даному винаході, мають формулу (XII), показану нижче: 25 UA 114879 C2 де 5 10 15 20 25 30 35 40 45 50 являє собою необов'язковий одиночний зв'язок; являє собою або одиночний зв'язок, або подвійний зв'язок; за умови, коли являє собою одиночний зв'язок, U і U', однакові або різні, незалежно являють собою H, W і W', однакові або різні, незалежно вибрані з групи, що складається з ОН, простого ефіру, такого як -OR, складного ефіру (наприклад, ацетат), такого як -OCOR, карбонату, такого як -OCOOR, карбамату, такого як -OCONRR', циклічного карбамату, таким чином N10 і C11 є частиною циклу, сечовини, такої як -NRCONRR', тіокарбамату, такого як OCSNHR, циклічного тіокарбамату, таким чином N10 і C11 є частиною циклу, -SH, сульфіду, такого як -SR, сульфоксиду, такого як -SOR, сульфону, такого як -SOOR, сульфонату, такого як SO3, сульфонаміду, такого як -NRSOOR, аміну, такого як -NRR', необов'язкового циклічного аміну, таким чином N10 і C11 є частиною циклу, гідроксиламінового похідного, такого як -NROR', аміду, такого як -NRCOR, азидо, такого як -N3, ціано, галоїду, триалкілу або триарилфосфонію, групи, що походить з амінокислоти; переважно, W і W" є однаковими або різними і являють собою OH, Ome, Oet, NHCONH2, SMe; і коли являє собою подвійний зв'язок, U і U" відсутні і W і W" являють собою Н; R1, R2, R1', R2' є однаковими або різними і незалежно вибрані з галіду або алкілу, необов'язково заміщених одним або більше з Hal, CN, NRR", CF 3, OR, арилу, Het, S(O)q, або R1 і R2 і R1' і R2' утворюють разом подвійний зв'язок, що відповідно містить групу =В і B". Переважно, R1 і R2 і R1' і R2' утворюють разом подвійний зв'язок, що відповідно містить групу =В і B". В і B'є однаковими або різними і незалежно вибрані з алкенілу, необов'язково заміщеного одним або більше з Hal, CN, NRR', CF3, OR, арилу, Het, S(O)q, або В і B' являють собою атом кисню. Переважно, В=B'. Переважно, В=B'= =CH2 або =CH-CH3, X, X' є однаковими або різними і незалежно вибрані з однієї або більше з груп -O-, -NR-, (C=O)-, S(O)q-. Переважно, X=X'. Більш переважно, X=X'=O. A, A' є однаковими або різними і незалежно вибрані з алкілу або алкенілу, який необов'язково містить атом кисню, азоту або сірки, причому кожний необов'язково заміщений однією або більше з груп Hal, CN, NRR', CF3, OR, S(O)q, арилу, Het, алкілу, алкенілу. Переважно, A=А'. Більш переважно, A=А'= лінійний незаміщений алкіл. Y, Y' є однаковими або різними і незалежно вибрані з H, OR; Переважно, Y=Y'. Більш переважно, Y=Y'=Оалкіл, більш переважно, Ометил. Т являє собою -NR-, -O-, -S(O)q, або 4-10-членний арил, циклоалкіл, гетероцикліл або гетероарил, причому кожний необов'язково заміщений одним або декількома Hal, CN, NRR', CF3, R, OR, S(O)q, і/або лінкером (лінкерами), або розгалужений алкіл, необов'язково заміщений одним або декількома Hal, CN, NRR', CF3, OR, S(O)q, і/або лінкером (лінкерами), або лінійний алкіл, заміщений одним або декількома Hal, CN, NRR', CF 3, OR, S(O)q, і/або лінкером (лінкерами). Переважно, Т являє собою 4-10-членний арил або гетероарил, більш переважно, феніл або піридил, необов'язково заміщений одним або декількома лінкером (лінкерами). Зазначений лінкер включає з'єднувальну групу. Придатні з'єднувальні групи добре відомі у даній галузі і включають тіольні, сульфідні, дисульфідні групи і естеразо-лабільні групи. Переважними є дисульфідні групи і тіоефірні групи. Коли з'єднувальна група являє собою групу, що містить тіол, сульфід (чи так званий тіоефір -S-) або дисульфід (-S-S-), бічний ланцюг, що несе тіольну, сульфідну або дисульфідну групу, може бути лінійним або розгалуженим, ароматичним або гетероциклічним. Середній фахівець у даній галузі може легко ідентифікувати придатні бічні ланцюги. 26 UA 114879 C2 5 10 15 20 25 30 35 40 45 50 Переважно, лінкер має формулу: -G-D-(Z)p-S-Z', де G являє собою одиночний або подвійний зв'язок, -O-, -S- або -NR-; D являє собою одиночний або зв'язок -E-, -E-NR-, -E-NR-F-, -E-O-, -E-O-F-, -E-NR-CO-, -ENR-CO-F-, -E-CO-, -CO-E-, -E-CO-F, -E-S-, -E-S-F-, -E-NR-C-S-, -E-NR-CS-F-; де E і F є однаковими або різними і незалежно вибрані з лінійного або розгалуженого (OCH2CH2)іалкіл(OCH2CH2)j-, -алкіл(OCH2CH2)i-алкіл-, -(OCH2CH2)i-, (OCH2CH2)iциклоалкіл(OCH2CH2)j-, -(OCH2CH2)iгетероцикліл(OCH2CH2)j-, (OCH2CH2)іарил(OCH2CH2)j-, -(OCH2CH2)ігетероарил(OCH2CH2)j-, -алкіл(OCH2CH2)іалкіл(OCH2CH2)j-, -алкіл-(OCH2CH2)і-, -алкіл-(OCH2CH2)іциклоалкіл(OCH2CH2)j-, алкіл(OCH2CH2)ігетероцикліл(OCH2CH2)j-, -алкіл-(OCH2CH2)іарил(OCH2CH2)j-, алкіл(OCH2CH2)ігетероарил(OCH2CH2)j-, -циклоалкіл-алкіл-, алкіл-циклоалкіл-, -гетероциклілалкіл-, -алкіл-гетероцикліл-, -алкіл-арил-, арил-алкіл-, -алкіл-гетероарил-, -гетероарил-алкіл-; де і та j, ідентичні або різні, являють собою цілі числа і незалежно вибрані з 0, 1-2000; Z являє собою лінійний або розгалужений -алкіл-; Р=0 або 1; Z' являє собою Н, захисну групу тіолу, таку як COR, R20 і SR20, де R20 являє собою Н, метил, алкіл, необов'язково заміщений циклоалкіл, арил, гетероарил або гетероцикліл, за умови, що коли Z' являє собою Н, зазначена сполука знаходиться у рівновазі з відповідною сполукою, утвореною внутрішньомолекулярною циклізацією, що виникає у результаті додавання тіольної групи -SH на іміновий зв'язок -NH= однієї з частин PBD. n, n', однакові або різні, = 0 або 1. Q=0, 1 або 2. R, R' однакові або різні і незалежно вибрані з Н, алкілу, арилу, причому кожний необов'язково заміщений Hal, CN, NRR', CF3, R, OR, S(O)q, арилом, Het; або їх фармацевтично прийнятні солі, гідрати або гідровані солі, або поліморфні кристалічні структури цих сполук або їх оптичні ізомери, рацемати, діастереомери або енантіомери. Сполуки загальної формули (XII), що мають геометричні і стереоізомери, також є частиною винаходу. Відомо, що подвійний зв'язок N-10, C-11 похідного томейміцину формули (XII) легко перетворюється оборотним чином у відповідні імінові аддукти у присутності води, спирту, тіолу, первинного або вторинного аміну, сечовини та інших нуклеофілів. Цей процес оборотний і може легко регенерувати відповідні похідні томейміцину у присутності дегідратуючого агента, у не протонному органічному розчиннику, у вакуумі або при високій температурі (Z. Tozuka, 1983, J.Antibiotics, 36: 276). Таким чином, у даному винаході можна також використовувати оборотні похідні томейміцину загальної формули (XIII): де A, X, Y, n, А', Х', Y', n', R1, R2, R1', R2' визначаються як у формулі (XII) і W, W' є однаковими або різними і вибрані з групи, що складається з ОН, простого ефіру, такого як -OR, складного ефіру (наприклад, ацетату), такого як -OCOR, -COOR, карбонату, такого як -OCOOR, карбамату, такого як -OCONRR', циклічного карбамату, для того, щоб N10 і C11 були частиною циклу, сечовини, такої як -NRCONRR', тіокарбамату, такого як -OCSNHR, циклічного тіокарбамату, такого, щоб N10 і C11 були частиною циклу, -SH, сульфіду, такого як -SR, сульфоксиду, такого як -SOR, сульфону, такого як -SOOR, сульфонату, такого як -SO3, сульфонаміду, такого як -NRSOOR, аміну, такого як -NRR', необов'язково циклічного аміну для того, щоб N10 і C11 були частиною циклу, похідного гідроксиламіну, такого як -NROR', аміду, такого як -NRCOR, -NRCONRR', азидо, такого як -N3, ціано, галоїду, триалкілу або триарилфосфонію, групи, одержаної з амінокислоти. Переважно, W і W' є однаковими або різними і являють собою OH, Ome, Oet, NHCONH2, SMe. Таким чином, сполуки формули (XIII) можна розглядати як сольвати, що включають воду, коли розчинник являє собою воду; ці сольвати можуть бути особливо корисними. У переважному варіанті здійснення похідні за винаходом вибрані з групи, що складається з: 27 UA 114879 C2 5 10 15 20 25 30 35 40 45 50 55 8,8'-[1,3-бензолдіїлбіс(метиленокси)]-біс[(S)-2-ет-(Е)-иліден-7-метокси-1,2,3,11а-тетрагідро5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону] 8,8'-[5-метокси-1,3-бензолдіїлбіс(метиленокси)]-біс[(S)-2-ет-(Е)-иліден-7-метокси-1,2,3,11атетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону] 8,8'-[1,5-пентандіїлбіс(окси)]-біс[(S)-2-ет-(Е)-иліден-7-метокси-1,2,3,11а-тетрагідро-5Нпірол[2,1-c][1,4]бензодіазепін-5-ону] 8,8'-[1,4-бутандіїлбіс(окси)]-біс[(S)-2-ет-(Е)-иліден-7-метокси-1,2,3,11а-тетрагідро-5Нпірол[2,1-c][1,4]бензодіазепін-5-ону] 8,8'-[3-метил-1,5-пентандіїлбіс(окси)]-біс[(S)-2-ет-(Е)-иліден-7-метокси-1,2,3,11а-тетрагідро5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону] 8,8'-[2,6-піридиндіїлбіс(окси)]-біс[(S)-2-ет-(Е)-иліден-7-метокси-1,2,3,11а-тетрагідро-5Нпірол[2,1-c][1,4]бензодіазепін-5-ону] 8,8'-[4-(3-трет-бутоксикарбоніламінопропілокси)-2,6-піридиндіїлбіс-(метиленокси)]-біс[(S)-2ет-(Е)-иліден-7-метокси-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону] 8,8'-[5-(3-амінопропілокси)-1,3-бензолдіїлбіс(метиленокси)]-біс[(S)-2-ет-(Е)-иліден-7-метокси1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону] 8,8'-[5-(N-метил-3-трет-бутоксикарбоніламінопропіл)-1,3-бензолдіїлбіс(метиленокси)]-біс[(S)2-ет-(Е)-иліден-7-метокси-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону] 8,8'-{5-[3-(4-метил-4-метилдисульфаніл-пентаноїламіно)пропілокси]-1,3бензолдіїлбіс(метиленокси}]-біс[(S)-2-ет-(Е)-иліден-7-метокси-1,2,3,11а-тетрагідро-5Н-пірол[2,1c][1,4]бензодіазепін-5-ону] 8,8'-[5-ацетилтіометил-1,3-бензолдіїлбіс(метиленокси)]-біс[(S)-2-метилен-7-метокси1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону] Складного трет-бутилового ефіру біс-{2-[(S)-2-метилен-7-метокси-5-оксо-1,3,11а-тетрагідро5Н-пірол[2,1-c][1,4]бензодіазепін-8-ілокси]етил}карбамінової кислоти 8,8'-[3-(2-ацетилтіоетил)-1,5-пентандіїлбіс(окси)]-біс[(S)-2-метилен-7-метокси-1,2,3,11атетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону] 8,8'-[5-(N-4-меркапто-4,4-диметилбутаноїл)аміно-1,3-бензолдіїлбіс(метиленокси)]-біс[7метокси-2-метилен-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону] 8,8'-[5-(N-4-метилдитіо-4,4-диметилбутаноїл)аміно-1,3-бензолдіїлбіс(метиленокси)]-біс[7метокси-2-метилен-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону] 8,8'-[5-(N-метил-N-(2-меркапто-2,2-диметилетил)аміно-1,3-бензолдіїл(метиленокси)]-біс[7метокси-2-метилен-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону] 8,8'-[5-(N-метил-N-(2-метилдитіо-2,2-диметилетил)аміно-1,3-бензолдіїл(метиленокси)]-біс[7метокси-2-метилен-1,2,3,11а-тетрагідро-5Н-пірол[2,1-c][1,4]бензодіазепін-5-ону] 8,8'-[(4-(2-(4-меркапто-4-метил)пентанамідоетокси)піридин-2,6-диметил)діокси]-біс[(S)-2-ет(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1-c][1,4]бензодіазепін-5-ону] 8,8'-[(1-(2-(4-метил-4-метилдисульфаніл)пентанамідоетокси)бензол-3,5-диметил)діокси]біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1-c][1,4]бензодіазепін-5-ону] 8,8'-[(4-(3-(4-метил-4-метилдисульфаніл)пентанамідопропокси)піридин-2,6-диметил)діокси]біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1-c][1,4]бензодіазепін-5-ону] 8,8'-[(4-(4-(4-метил-4-метилдисульфаніл)пентанамідобутокси)піридин-2,6-диметил)діокси]біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1-c][1,4]бензодіазепін-5-ону] 8,8'-[(4-(3-[4-(4-метил-4-метилдисульфанілпентаноїл)піперазин-1-іл]пропіл)піридин-2,6диметил)діокси]-біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1c][1,4]бензодіазепін-5-ону] 8,8'-[(1-(3-[4-(4-метил-4-метилдисульфанілпентаноїл)піперазин-1-іл]пропіл)бензол-3,5диметил)діокси]-біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1c][1,4]бензодіазепін-5-ону] 8,8'-[(4-(2-{2-[2-(4-метил-4-метилдисульфанілпентаноїламіно)етокси]етокси}етокси)піридин2,6-диметил)діокси]-біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1c][1,4]бензодіазепін-5-ону] 8,8'-[(1-(2-{2-[2-(2-{2-[2-(4-метил-4метилдисульфанілпентаноїламіно)етокси]етокси}етокси)етокси]-етокси}етокси)бензол-3,5диметил)діокси]-біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1c][1,4]бензодіазепін-5-ону] 8,8'-[(1-(2-{2-[2-(4-метил-4-метилдисульфанілпентаноїламіно)етокси]етокси}етокси)бензол3,5-диметил)діокси]-біс[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропірол[2,1c][1,4]бензодіазепін-5-ону] 28
ДивитисяДодаткова інформація
Автори російськоюPark, Peter U., Bartle, Laura M., Skaletskaya, Anna, Golmakher, Viktor S., Tavares, Daniel, Deckert, Jutta, Mikol, Vincent, Blanc, Veronigue
МПК / Мітки
МПК: C07K 16/46, C07K 16/28
Мітки: лікування, антитіло, раку
Код посилання
<a href="https://ua.patents.su/104-114879-antitilo-do-cd38-dlya-likuvannya-raku.html" target="_blank" rel="follow" title="База патентів України">Антитіло до cd38 для лікування раку</a>
Попередній патент: Спосіб корекції обличчя та тіла «energy»
Наступний патент: Вагонний залізничний візок та його елементи
Випадковий патент: Фітозбір для лікування і профілактики мастопатії












































































































