Антитіло, яке зв’язує мезотелін, та імунокон’югат
Номер патенту: 113838
Опубліковано: 27.03.2017
Автори: Чжан Інь, Денніс Марк, Скейлс Сюзанна Дж., Спенсер Сьюзан Д.
Формула / Реферат
1. Виділене антитіло, яке зв'язує мезотелін, де антитіло містить (i) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:20, (ii) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:21, (iii) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:22, (iv) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:17, (v) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:18, і (vi) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:19.
2. Антитіло за п. 1, яке є моноклональним антитілом.
3. Антитіло за п. 1, яке є людським, гуманізованим або химерним антитілом людини.
4. Антитіло за п. 1, яке є фрагментом антитіла, який зв'язує мезотелін.
5. Антитіло за п. 1, де мезотелін є мезотеліном людини SEQ ID NO:43.
6. Антитіло за п. 1, де антитіло зв’язує епітоп SEQ ID NO:43, де епітоп містить E153 і D174 відповідно до нумерації SEQ ID NO:43, і яке в деяких випадках має одну або декілька наведених нижче характерних властивостей:
(а) не проявляє зниженого зв'язування з глікозилованими формами мезотеліну в порівнянні з неглікозилованими формами мезотеліну;
(b) не блокує зв'язування мезотеліну з муцином 16 (MUC16); і/або
(с) зв'язує мезотелін з афінністю, що дорівнює ≤5 нМ.
7. Антитіло за п. 6, де антитіло не блокує зв'язування мезотеліну з MUC16.
8. Антитіло за п. 7, де антитіло не блокує зв'язування глікозилованих форм мезотеліну з MUC16 в порівнянні з неглікозилованими формами мезотеліну.
9. Антитіло за п. 6, де антитіло не виявляє зниженого зв'язування з глікозилованими формами мезотеліну в порівнянні з неглікозилованими формами мезотеліну.
10. Антитіло за п. 1, яке додатково містить варіабельний домен легкого ланцюга, що містить послідовність FR2 каркасної ділянки SEQ ID NO:25 і послідовність FR3 SEQ ID NO:27.
11. Антитіло за п. 1, де антитіло містить:
(а) послідовність VH, яка принаймні на 95 % ідентична амінокислотній послідовності SEQ ID NO:8;
(b) послідовність VL, яка принаймні на 95 % ідентична амінокислотній послідовності SEQ ID NO:4;
(c) послідовність VH, як в (а), і послідовність VL, як в (b).
12. Антитіло за п. 1, що містить послідовність VH SEQ ID NO:8.
13. Антитіло за п. 1, що містить послідовність VL SEQ ID NO:4.
14. Антитіло, що містить послідовність VH SEQ ID NO:8 і послідовність VL SEQ ID NO:4.
15. Антитіло за п. 1, яке є IgG1, IgG2a або IgG2b антитілом.
16. Антитіло за п. 1, кон'юговане з міткою.
17. Антитіло за п. 16, де міткою є випромінювач позитронів.
18. Антитіло за п. 17, де випромінювачем позитронів є 89Zr.
19. Імунокон'югат з формулою Ab-(L-D)p, де:
(а) Ab є антитілом за п. 1;
(b) L є лінкером;
(с) D є лікарським засобом з формулою DE
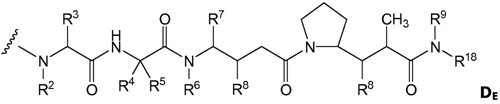 ,
,
і де R2 і R6 кожний є метилом, R3 і R4 кожний є ізопропілом, R5 є Н, R7 є втор-бутилом, кожний R8 незалежно вибраний із CH3, O-CH3, OH і Н; R9 є Н; і R18 являє собою -С(R8)2-C(R8)2-арил; і
(d) р приймає значення від 1 до 8.
20. Імунокон'югат за п. 19, де лікарським засобом є ауристатин.
21. Імунокон'югат за п. 20, де лікарським засобом є монометилауристатин Е (MMAE).
22. Імунокон'югат за п. 19, де лінкер здатний до розщеплення протеазою.
23. Імунокон'югат за п. 22, де лінкер містить дипептид val-cit.
24. Імунокон'югат за п. 19, що має формулу:
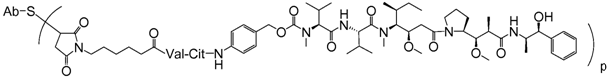 ,
,
де S є атомом сірки.
25. Імунокон'югат за п. 24, де р приймає значення від 2 до 5.
26. Імунокон'югат за п. 24, що містить антитіло за п. 6.
27. Імунокон'югат за п. 24, що містить антитіло за п. 14.
28. Фармацевтична композиція, що містить імунокон'югат за п. 19 і фармацевтично прийнятний носій.
29. Фармацевтична композиція за п. 28, що додатково містить додатковий терапевтичний засіб.
30. Фармацевтична композиція за п. 29, де додатковим терапевтичним засобом є гемцитабін.
31. Фармацевтична композиція за п. 29, де додатковим терапевтичним засобом є анти-MUC16 антитіло, кон'юговане із цитотоксичним агентом.
Текст
Реферат: Винахід стосується антитіла, яке зв’язує мезотелін, фармацевтичної композиції, що його містить, та імунокон'югата. UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 60 Споріднені заявки По даній заявці відповідно до 35 USC 119(е) заявляється пріоритет попередньої заявки № 61/459962, поданої 20 грудня 2010 року, повний опис якої включений в цей документ як посилання. Список послідовностей Дана заявка містить список послідовностей, який був поданий на розгляд в форматі ASCII за допомогою EFS-Web і включений в повному обсязі як посилання в даний документ. Вказана копія ASCII, створена 29 листопада 2011 р., названа P4532R1-WO.txt і має розмір, який дорівнює 53169 байт. Галузь винаходу Даний винахід стосується антитіл проти мезотеліну і імунокон'югатів, і способів їх застосування. Передумови створення винаходу Мезотелін є глікопротеїном клітинної поверхні, який експресується в нормі в мезотелії (очеревині, перикарді і плеврі). Однак експресія мезотеліну значно підвищується в різних типах пухлин. Мезотелін взаємодіє із MUC16 (який називається ще СА125), муциноподібним глікопротеїном, раніше ідентифікованим як антиген пухлини яєчника. MUC16 має позаклітинний домен, що містить принаймні 14000 залишків і характеризується тандемними повторами, розміром 156 амінокислот кожний, які називають муциновими повторами (див., наприклад, O'Brien et al., Tumour Biol. 22:348-366 (2001); Yin et al., J. Biol. Chem. 276:27371-27375 (2001).) Передбачають, що взаємодія між мезотеліном і MUC16 грає роль в адгезії і метастазуванні гетеротипових клітин. (Див., наприклад, Rump et al., J. Biol. Chem. 279:9190-9198 (2004)). Мезотелін синтезується у вигляді білкового попередника розміром 71 кДа, зріла частина якого експресується на клітинній поверхні. Цей білковий попередник протеолітично розщеплюється фурином на компонент, що від'єднується, розміром 31 кДа (який називається мегакаріоцитарним потенціюючим фактором, або MPF) і компонент мезотеліну розміром 40 кДа. Останній компонент може залишатися пов'язаним із клітинною поверхнею через GPI-зв'язок, але також може бути відщеплений протеолітичним способом. У даній галузі існує гостра необхідність в речовинах, дія яких націлена на мезотелін для діагностики і лікування пов'язаних із мезотеліном патологічних станів, таких як рак. Даний винахід заповнює цей пробіл і має інші переваги. Суть винаходу Даний винахід стосується антитіл проти мезотеліну і імунокон'югатів, і способів їх застосування. У одному із аспектів представлено виділене антитіло, яке зв'язується з мезотеліном, де антитіло вибране із: (i) антитіла, яке зв'язує епітоп SEQ ID NO:43, який містить E153 і D174, і яке в деяких випадках має одну або декілька наступних характеристик: (а) не виявляє зниженого зв'язування із глікозилованими формами мезотеліну; (b) не блокує зв'язування мезотеліну із MUC16 і (с) зв'язує мезотелін із афінністю ≤5 нМ; (ii) антитіла, яке зв'язує епітоп SEQ ID NO:43, який містить Е211, і яке в деяких випадках має одну або декілька наступних характеристик: (а) не блокує зв'язування мезотеліну із MUC19; і (b) зв'язує мезотелін із афінністю ≤5 нМ; і (iii) антитіла, яке зв'язує епітоп в межах амінокислот 1-131 SEQ ID NO:43 і зв'язує мезотелін із афінністю ≤5 нМ. У певних варіантах здійснення винаходу антитіло є моноклональним антитілом. У певних варіантах здійснення винаходу антитіло є антитілом людини, гуманізованим або химерним антитілом. У певних варіантах здійснення винаходу антитіло є фрагментом антитіла, яке зв'язує мезотелін. У певних варіантах здійснення винаходу мезотелін є мезотеліном людини із послідовністю SEQ ID NO:43. У певних варіантах здійснення винаходу антитіло містить: (а) (i) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:22, (ii) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:19, і (iii) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:21; (b) (i) HVRH3, що містить амінокислотну послідовність SEQ ID NO:39, (ii) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:35 і (iii) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:37; або (с) HVR-H3, HVR-L3 і HVR-H2 антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером ATCC PTA-11464. У певних варіантах здійснення винаходу антитіло містить (а) (i) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:20, (ii) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:21, і (iii) HVR-H3 що містить амінокислотну послідовність SEQ ID NO:22; (b) (i) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:36, (ii) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:37, і (iii) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:39; або (с) HVR-H1, HVR-H2 і HVR-H3 антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером ATCC PTA 1 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 60 11464. У одному із таких варіантів здійснення винаходу антитіло містить (а) (i) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:20, (ii) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:21, (iii) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:22, (iv) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:17, (v) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:18, і (vi) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:19; (b) (i) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:36, (ii) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:37, (iii) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:39, (iv) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:33, (v) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:34, і (vi) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:35; або (с) HVR-H1, HVR-H2, HVR-H3, HVR-L1, HVR-L2 і HVR-L3 антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером ATCC PTA-11464. У додатковому варіанті здійснення винаходу антитіло містить (i) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:20, (ii) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:21, (iii) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:22, (iv) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:17, (v) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:18, і (vi) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:19, і додатково, який містить варіабельний домен легкого ланцюга, що містить послідовність FR2 каркасної ділянки SEQ ID NO:25 і FR3 послідовність SEQ ID NO:27. У певних варіантах здійснення винаходу антитіло містить (а) (i) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:17, (ii) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:18, і (iii) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:19; (b) (i) HVRL1, що містить амінокислотну послідовність SEQ ID NO:33, (ii) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:34, і (iii) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:35; або (с) HVR-L1, HVR-L2 і HVR-L3 антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером ATCC PTA-11464. У одному із таких варіантів здійснення винаходу антитіло містить HVR-L1, що містить амінокислотну послідовність SEQ ID NO:17, HVR-L2, що містить амінокислотну послідовність SEQ ID NO:18, і HVR-L3, що містить амінокислотну послідовність SEQ ID NO:19, і додатково містить варіабельний домен легкого ланцюга, що містить послідовність FR2 каркасної ділянки SEQ ID NO: 25 і FR3 послідовність SEQ ID NO:27. У певних варіантах здійснення винаходу антитіло містить (а) послідовність VH, яка принаймні на 95 % ідентична амінокислотній послідовності SEQ ID NO:8; (b) послідовність VL, яка принаймні на 95 % ідентична амінокислотній послідовності SEQ ID NO:4; (с) послідовність VH як в (а) і послідовність VL як в (b); послідовність VH, яка принаймні на 95 % ідентична амінокислотній послідовності SEQ ID NO:16; (е) послідовність VL, яка принаймні на 95 % ідентична амінокислотній послідовності SEQ ID NO:12; (f) послідовність VH як в (d) і послідовність VL як в (е); послідовність VH, яка принаймні на 95 % ідентична амінокислотній послідовності VH антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464; (h) послідовність VL, яка принаймні на 95 % ідентична амінокислотній послідовності VL антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464; або (i) послідовність VH як в (g) і послідовність VL як в (h). У одному із таких варіантів здійснення винаходу антитіло містить послідовність VH SEQ ID NO:8, послідовність VH SEQ ID NO:16 або послідовність VH антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером ATCC РТА-11464. У іншому такому варіанті здійснення винаходу антитіло містить послідовність VL SEQ ID NO:4, послідовність VL SEQ ID NO:12, або послідовність VL антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464. У іншому аспекті винахід стосується антитіла, що містить (а) послідовність VH SEQ ID NO:8 і послідовність VL SEQ ID NO:4; (b) послідовність VH SEQ ID NO:16 і послідовність VL SEQ ID NO:12; (с) послідовність VH і послідовність VL антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464; або (d) антитіло, продуковане гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464. У певних варіантах здійснення винаходу антитіло за будь-яким із вищеперерахованих варіантів здійснення являє собою антитіло IgG1, IgG2a або IgG2b. У додатковому аспекті винахід являє виділену нуклеїнову кислоту, що кодує антитіло за будь-яким із вищеперерахованих варіантів здійснення винаходу. У одному із варіантів здійснення винахід стосується клітини-хазяїна, що містить нуклеїнову кислоту. У іншому варіанті здійснення винахід стосується способу отримання антитіла, способу, що містить культивування клітини-хазяїна так, що відбувається продукція антитіла. У іншому аспекті винахід стосується імунокон'югату формули Ab-(L-D)р, де: 2 UA 113838 C2 (а) Ab є антитілом як в будь-якому із вищеперерахованих варіантів здійснення винаходу; (b) L являє собою лінкер; (с) D є лікарським засобом, що має формулу DE 5 10 15 20 25 30 35 40 45 50 2 6 3 4 5 7 8 і де R і R кожна є метилом, R і R кожна є ізопропілом, R є Н, R є втор-бутилом, кожна R 9 18 8 8 незалежно вибирається із СН3, О-СН3, ОН і Н; R є Н; і R є -С(R )2-C(R )2-арил; і (d) р приймає значення від 1 до 8. У одному із варіантів здійснення винаходу лікарським засобом є ауристатин. У одному із таких варіантів здійснення винаходу лікарським засобом є ММАЕ. У іншому варіанті здійснення винаходу лінкер має сайт розщеплення протеазою. У одному із таких варіантів здійснення винаходу лінкер містить дипептид val-cit. У іншому варіанті здійснення винаходу імунокон'югат має формулу: де S є атомом сірки. У одному із таких варіантів здійснення винаходу р приймає значення від 2 до 5. В іншому такому варіанті здійснення винаходу антитіло містить (i) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:20, (ii) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:21, (iii) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:22, (iv) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:17, (v) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:18, і (vi) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:19. У іншому такому варіанті здійснення винаходу антитіло містить (i) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:36, (ii) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:37, (iii) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:39, (iv) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:33, (v) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:4, і (vi) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:35. У іншому такому варіанті здійснення винаходу антитіло містить (а) послідовність VH SEQ ID NO:8 і послідовність VL SEQ ID NO:4. У іншому такому варіанті здійснення винаходу антитіло містить (b) послідовність VH SEQ ID NO:16 і послідовність VL SEQ ID NO:12. У іншому аспекті винахід стосується фармацевтичної композиції, що містить імунокон'югат, як в будь-якому із вищеперерахованих варіантів здійснення, і фармацевтично прийнятний носій. У одному із варіантів здійснення винаходу фармацевтична композиція додатково містить додаткову терапевтичну речовину. У одному із таких варіантів здійснення винаходу терапевтичним засобом є гемцитабін. У іншому такому варіанті здійснення винаходу додатковим терапевтичним засобом є антитіла проти MUC16, кон'юговані із цитотоксичним агентом. У додатковому аспекті винахід стосується імунокон'югату, як в будь-якому із вищеперерахованих варіантів здійснення винаходу для застосування як лікарського засобу. У певних варіантах здійснення винахід стосується імунокон'югату, як в будь-якому із вищеперерахованих варіантів здійснення винаходу для застосування в лікуванні позитивних по мезотеліну ракових пухлин. У одному із таких варіантів здійснення винаходу позитивне по мезотеліну злоякісне новоутворення вибране із раку підшлункової залози, раку яєчників, раку легені, раку ендометрія і мезотеліоми. У іншому такому варіанті здійснення винаходу позитивний по мезотеліну рак є раком, позитивним по двох антигенах. У додатковому аспекті винахід стосується застосування імунокон'югатів, як в будь-якому із вищеперерахованих варіантів здійснення, для отримання лікарського препарату. У одному із варіантів здійснення винаходу лікарський препарат призначений для лікування позитивного по мезотеліну раку. У одному із таких варіантів здійснення винаходу позитивне по мезотеліну злоякісне новоутворення вибране із раку підшлункової залози, раку яєчників, раку легені, раку ендометрія і мезотеліоми. У іншому із таких варіантів здійснення винаходу позитивне по мезотеліну злоякісне новоутворення є раком, позитивним по двох антигенах. У іншому аспекті винахід стосується способу лікування індивідуума із позитивним по мезотеліну злоякісним новоутворенням, спосіб, що містить призначення індивідууму ефективної 3 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 60 кількості імунокон'югату, як в будь-якому із вищеперерахованих варіантів здійснення винаходу. У одному із варіантів здійснення позитивне по мезотеліну злоякісне новоутворення вибране із раку підшлункової залози, раку яєчників, раку легені, раку ендометрія і мезотеліоми. У іншому варіанті здійснення винаходу позитивне по мезотеліну злоякісне новоутворення є раком, позитивним по двох антигенах. У іншому варіанті здійснення винаходу спосіб додатково містить призначення додаткового терапевтичного засобу індивідууму. У одному із таких варіантів здійснення винаходу додатковим терапевтичним засобом є гемцитабін. У іншому такому варіанті здійснення винаходу додатковим терапевтичним засобом є антитіло проти MUC16, кон'юговане із цитотоксичним агентом. У іншому аспекті винахід стосується способу інгібування проліферації позитивної по мезотеліну клітини, спосіб, що містить вплив на клітину імунокон'югату, як в будь-якому із вищеперерахованих варіантів здійснення винаходу в умовах, придатних для зв'язування імунокон'югату із мезотеліном на поверхні клітини, тим самим інгібуючи проліферацію клітини. У одному із варіантів здійснення винаходу такою клітиною є клітина підшлункової залози, яєчника, легені, мезотеліоми і ендометрія. У іншому варіанті здійснення винаходу ця клітина є позитивною по двох антигенах клітиною. У іншому аспекті винахід стосується антитіла, як в будь-якому із вищеперерахованих варіантів здійснення, де антитіло кон'юговане із міткою. У одному із варіантів здійснення винаходу міткою є випромінювач позитронів. У одному із таких варіантів здійснення винаходу 89 випромінювачем позитронів є Zr. У іншому аспекті винахід стосується способу виявлення мезотеліну людини в біологічному зразку, спосіб, що містить взаємодію біологічного зразка з антитілом проти мезотеліну, як в будь-якому із вищеперерахованих варіантів здійснення в умовах, відповідних для зв'язування антитіла проти мезотеліну із природним мезотеліном людини, і детекцію наявності або відсутності комплексу, утвореного антитілом проти мезотеліну і природним мезотеліном людини в біологічному зразку. У одному із варіантів здійснення винаходу антитіло проти мезотеліну містить (а) HVR-H1, HVR-H2, HVR-H3, HVR-L1, HVR-L2 і HVR-L3 антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464; (b) послідовність VH і послідовність VL антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464; або (d) антитіло, продуковане гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464. У іншому варіанті здійснення винаходу біологічним зразком є зразок раку підшлункової залози, зразок раку яєчника, зразок раку легені, зразок раку ендометрія або зразок мезотеліоми. У іншому варіанті здійснення винаходу спосіб містить проведення імуногістохімічного аналізу зрізу тканини. У іншому варіанті здійснення винаходу біологічним зразком є сироватка. У додатковому аспекті винахід стосується способу виявлення позитивного по мезотеліну злоякісного новоутворення, спосіб, що містить призначення міченого антитіла проти мезотеліну, де антитіло проти мезотеліну, як в будь-якому із вищеперерахованих варіантів здійснення, призначене для індивіда, що має або у якого передбачають наявність позитивного по мезотеліну злоякісного новоутворення, і виявлення міченого антитіла проти мезотеліну у індивіда, де виявлення міченого антитіла проти мезотеліну вказує на позитивне по мезотеліну злоякісне новоутворення у індивіда. У одному із варіантів здійснення винаходу мічене антитіло проти мезотеліну містить антитіло проти мезотеліну, кон'юговане із випромінювачем позитронів. 89 У одному із таких варіантів здійснення винаходу випромінювачем позитронів є Zr. Короткий опис фігур На фігурі 1 показано, що мезотелін утвориться шляхом протеолітичного розщеплення білкового попередника із відділенням 31 кДа компонента (званого мегакаріоцитарним потенціюючим фактором, або MPF) і 40 кДа компоненти мезотеліну. Останній компонент може залишатися зв'язаним із клітинною поверхнею, але може також бути відділений. "СНО" означає чотири сайти глікозилування, один - в MPF і три - в мезотеліні. На фігурі 2 показано графічне представлення рівнів експресії гена мезотеліну людини в різних тканинах, як описано в Прикладі А. На фігурі 3 показані властивості моноклональних антитіл проти мезотеліну, виділених, як описано в Прикладі В. На фігурі 4 показано поєднання мишачих послідовностей варіабельної області легкого ланцюга антитіла 7D9 (mu7D9) і їх гуманізованих варіантів (7D9.v1 і 7D9.v3). На фігурі 5 показано поєднання мишачих послідовностей варіабельної області важкого ланцюга антитіла 7D9 (mu7D9) і їх гуманізованих варіантів (7D9.v1 і 7D9.v3). На фігурі 6 показані властивості химерних і гуманізованих варіантів 7D9, як описано в Прикладі С. 4 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 60 На фігурі 7 показано поєднання мишачих послідовностей варіабельної області легкого ланцюга антитіла 22A10 (22A10) і їх гуманізованих варіантів (hu22A10graft і 22A10.v83). На фігурі 8 показано поєднання мишачих послідовностей варіабельної області важкого ланцюга антитіла 22A10 (22A10) і їх гуманізованих варіантів (hu22A10graft і 22A10.v83). На фігурі 9А показаний аналіз Скетчарда гуманізованих варіантів 22A10 на стабільно трансфікованих мезотеліном клітинах BJAB, як описано в Прикладі С. На фігурі 9В показана імунопреципітація мезотеліну під дією гуманізованих варіантів 22A10 із тих же самих стабільно трансфікованих клітин BJAB, як описано в Прикладі С. На фігурі 10А показані послідовності гіперваріабельних і каркасних областей гуманізованих варіантів 7D9. На фігурі 10В показані послідовності гіперваріабельних і каркасних областей гуманізованих варіантів 22A10. На фігурі 11 показана гомологія послідовностей мезотеліну із різних видів, як описано в Прикладі D. На фігурі 11 представлені SEQ ID NO: 43 і 46-48, відповідно, в порядку трапляння. На фігурі 12 показана перехресна реактивність h7D9.v3 і h22A10.v83 із мезотеліном із різних видів, як описано в Прикладі D. На фігурі 13 показана афінність зв'язування гуманізованих антитіл проти мезотеліну, як визначено аналізом Скетчарда трансфікованих клітинних ліній, стабільно експресуючих мезотелін, і клітинних ліній, експресуючих ендогенний мезотелін, як описано в Прикладі Е. На фігурі 14 показані результати конкурентного аналізу антитіла 7D9 або 22A10 і інших моноклональних антитіл, перерахованих на фігурі 3, як описано в Прикладі F. На фігурі 15 показані конструкти химерного мезотеліну, що використовуються для картування епітопу (накреслені в масштабі), як описано в Прикладі G. На фігурі 15 показані "EVEK", "DAEQ" і "DVER" у вигляді SEQ ID NO:51-53, відповідно. На фігурі 16 показані результати FACS за оцінкою зв'язування 7D9 і 22A10 із клітинами, які експресують химерний мезотелін, як описано в Прикладі G. На фігурі 17 показана мутаційна стратегія для ідентифікації амінокислот, з якими зв'язуються h7D9.v3 і h22A10.v83, як описано в Прикладі G. На фігурі 17 представлена "EVEK" у a вигляді SEQ ID NO:51; "Human132-212", "Cyno132-212", "R t132-212" і "Mouse132-212" у вигляді SEQ ID NO:54-57, відповідно; людські і мишачі "MUT1", "MUT3", "MUT6", "MUT7", "MUT9", "MUT10", "MUT13" і "MUT15" у вигляді SEQ ID NO:58-73, відповідно; і "STKD" і "SVKD" у вигляді SEQ ID NO:73 і 74, відповідно. На фігурі 18А показані результати FACS за оцінкою зв'язування h7D9.v3 і h22A10.v83 з клітинами, які експресують мутантні білки мезотеліну людини, як описано в Прикладі G. На фігурі 18В показані результати FACS за оцінкою зв'язування h7D9.v3 із клітинами, які експресують мутантні білки мезотеліну яванської макаки, як описано в Прикладі G. На фігурі 19 показані ключові амінокислотні залишки в межах епітопів, із якими зв'язуються 7D9/h7D9.v3 і 22A10/h22A10.v83, як описано в Прикладі G. На фігурі 19 представлені SEQ ID NO:54-57, відповідно, в порядку трапляння. На фігурі 20 показано зв'язування h7D9.v3 із глікозилованим мезотеліном, як описано в Прикладі Н. На фігурі 21 показані результати двох аналізів виявлення наявності або відсутності блокування зв'язування мезотеліну із MUC19 під дією антитіл 19C3, 7D9 і 22A10 і навпаки, як описано в Прикладі I. На фігурі 22 показана експресія мезотеліну в протоковій аденокарциномі підшлункової залози способом імуногістохімії (IHC), як описано в Прикладі J. На фігурі 23 показана експресія мезотеліну в серозній аденокарциномі яєчників способом імуногістохімії (IHC), як описано в Прикладі J. На фігурі 24 показана експресія мезотеліну в аденокарциномі недрібноклітинного раку легені (NSCLC) способом імуногістохімії (IHC), як описано в Прикладі J. На фігурі 25 показана експресія мезотеліну в тканинах яванської макаки (панелі праворуч) способом імуногістохімії (IHC), як описано в Прикладі J. На фігурі 26 показано, що імунокон'югат h7D9.v3-vcMMAE демонструє ефективність дії в ксенотрансплантаті підшлункової залози HPAC, як описано в Прикладі L. На фігурі 27 показано, що імунокон'югат h7D9.v3-vcMMAE демонструє ефективність дії в вихідному ксенотрансплантаті підшлункової залози, як описано в Прикладі M. На фігурі 28 показано, що імунокон'югат h7D9.v3-vcMMAE демонструє ефективність дії в моделі ксенотрансплантата пухлини яєчника, як описано в Прикладі N. На фігурі 29 показано, що імунокон'югат h7D9.v3-vcMMAE демонструє ефективність дії в моделі ксенотрансплантата плоскоклітинної карциноми легені, як описано в Прикладі О. 5 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 60 На фігурі 30 показано, що ефективність дії імунокон'югату h7D9.v3-vcMMAE відносно мезотеліну людини подібно такому імунокон'югату h22A10.v83-vcMMAE відносно мезотеліну яванської макаки в пухлинних моделях ксенотрансплантата трансфікованих клітин BJAB, як описано в Прикладі Р. На фігурі 31 показано, що ефективність дії імунокон'югату h7D9.v3-vcMMAE подібна такому імунокон'югату h22A10.v83-vcMMAE в мезотеліомі і моделях пухлини яєчника, як описано в Прикладі Р. На фігурі 32 показано, що MUC16 утворить комплекс із мезотеліном, і два білки спільно відділяються від клітинних ліній, позитивних по двох антигенах, як описано в Прикладі Q. На фігурі 33 показано, що 19С3, але не 7D9, витісняє заздалегідь зв'язаний MUC16 від мезотеліну. Докладний опис варіантів здійснення винаходу I. Визначення "Акцепторна каркасна ділянка людини" в рамках цього документа є каркасною ділянкою, що містить амінокислотну послідовність каркасної ділянки варіабельного домену легкого ланцюга (VL) або каркасної ділянки варіабельного домену важкого ланцюга (VH) із каркасної ділянки імуноглобуліну людини або консенсусної каркасної ділянки людини, як вказано нижче. Акцепторна каркасна ділянка людини, "отримана із" каркасної ділянки імуноглобуліну людини або консенсусної каркасної ділянки людини, може містити ту ж саму амінокислотну послідовність вищезгаданого, або вона може містити зміни амінокислотної послідовності. У деяких варіантах здійснення винаходу число амінокислотних замін становить 10 або менше, 9 або менше, 8 або менше, 7 або менше, 6 або менше, 5 або менше, 4 або менше, 3 або менше, або 2 або менше. У деяких варіантах здійснення винаходу акцепторна каркасна ділянка людини VL ідентична послідовності каркасної ділянки VL імуноглобуліну людини або послідовності консенсусної каркасної ділянки людини. "Афінність" стосується сили сумарних нековалентних взаємодій між одиничним сайтом зв'язування молекули (наприклад, антитіла) і його партнером зв'язування (наприклад, антигеном). Якщо не вказано інше, "афінність зв'язування" в тому значенні, в якому використовується в цьому документі, стосується властивої афінності зв'язування, яка відображає взаємодію 1:1 між членами пари зв'язування (наприклад, антитілом і антигеном). Афінність молекули Х для її партнера Y може загалом бути охарактеризована константою дисоціації (Kd). Афінність може бути виміряна загальноприйнятими способами, відомими в даній галузі техніки, включаючи такі, описані в цьому документі. Конкретні ілюстративні і типові варіанти здійснення для вимірювання афінності зв'язування описані нижче. Антитіло із "дозрілою афінністю" стосується антитіла із однією або декількома змінами в одній або декількох гіперваріабельних ділянках (HVR) в порівнянні із вихідним антитілом, якому не властиві такі зміни, що приводять до поліпшення афінності зв'язування антитіла з антигеном. Терміни "антитіло проти мезотеліну" і "антитіло, яке зв'язується з мезотеліном" стосуються антитіла, яке здатне зв'язувати мезотелін із достатньою афінністю, завдяки чому антитіло може бути ефективним як діагностичний і/або терапевтичний засіб при направленому впливі на мезотелін. У одному із варіантів здійснення винаходу ступінь зв'язування антитіла проти мезотеліну із білком, відмінним від мезотеліну, складає приблизно менше 10 % зв'язування даного антитіла із мезотеліном згідно із вимірюваннями, наприклад, радіоімуноаналізу (RIA). У певних варіантах здійснення винаходу антитіло, яке зв'язується з мезотеліном, має константу дисоціації (Kd) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ або ≤0,001 нМ (наприклад, -8 -8 -13 -9 -13 10 М або менше, наприклад, від 10 М до 10 М, наприклад, від 10 М до 10 М). У певних варіантах здійснення винаходу антитіло проти мезотеліну зв'язується з епітопом мезотеліну, який консервативний у мезотелінів із різних біологічних видів. Термін "антитіло" використовується в цьому документі в самому широкому значенні слова і охоплює різні структури антитіла, включаючи, крім іншого, моноклональні антитіла, поліклональні антитіла, мультиспецифічні антитіла (наприклад, біспецифічні антитіла) і фрагменти антитіла за умови, що вони виявляють необхідну антигензв'язувальну активність. "Фрагмент антитіла" стосується молекули, відмінної від інтактного антитіла, яка містить частину інтактного антитіла і зв'язує антиген, із яким зв'язується інтактне антитіло. Приклади фрагментів антитіла включають, крім іншого, Fv, Fab, Fab', Fab'-SH, F(ab')2; діатіла; лінійні антитіла; одноланцюжкові молекули антитіла (наприклад, scFv); і мультиспецифічні антитіла, утворені із фрагментів антитіла. "Антитіло, яке зв'язується із тим же самим епітопом", що і контрольне антитіло, стосується антитіла, яке блокує зв'язування контрольного антитіла із його антигеном в конкурентному аналізі на 50 % або більше, і навпаки, контрольне антитіло блокує зв'язування антитіла із його 6 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 антигеном в конкурентному аналізі на 50 % або більше. Типовий конкурентний аналіз представлений в цьому документі. Терміни "злоякісне новоутворення" або "рак" стосуються фізіологічного стану або його описують у ссавців, що звичайно характеризується нерегульованим клітинним зростанням/проліферацією. Приклади раку включають, крім іншого, карциному, лімфому (наприклад, лімфому Ходжкіна і неходжкінську лімфому), бластому, саркому і лейкемію. Більш приватні приклади таких злоякісних пухлин включають плоскоклітинний рак, дрібноклітинний рак легені, недрібноклітинний рак легені, аденокарциному легені, плоскоклітинну карциному легені, рак очеревини, гепатоцелюлярний рак, рак шлунково-кишкового тракту, рак підшлункової залози, гліому, рак шийки матки, рак яєчника, рак печінки, рак сечового міхура, гепатому, рак молочної залози, рак товстої кишки, рак товстої і прямої кишок, карциному ендометрія або матки, карциному слинних залоз, рак нирки, рак печінки, рак простати, рак вульви, рак щитовидної залози, печінкову карциному, лейкемію і інші лімфопроліферативні порушення, і різні типи раку голови і шиї. Термін "химерне" антитіло стосується антитіла, в якому частина важкого і/або легкого ланцюга отримана із певного джерела або виду, в той час як частина важкого і/або легкого ланцюга, що залишилася, отримана із іншого джерела або виду. "Клас" антитіла стосується типу константного домену або константної області, що були у важкого ланцюга. Існує п'ять основних класів антитіл: IgA, IgD, IgE, IgG і IgM, і деякі із них можуть бути додатково розділені на підкласи (ізотипи), наприклад, IgG 1, IgG2, IgG3, IgG4, IgA1 і IgA2. Константні домени важкого ланцюга, які відповідають різним класам імуноглобулінів, називаються α, δ, ε, γ і µ, відповідно. Термін "цитотоксичний агент" в тому значенні, в якому він тут використовується, стосується речовини, яка інгібує або запобігає клітинній функції і/або викликає загибель або руйнування 211 131 клітини. Цитотоксичні агенти включають, крім іншого, радіоактивні ізотопи (наприклад, At , I , 125 90 186 188 153 212 32 212 I , Y , Re , Re , Sm , Bi , P , Pb і радіоактивні ізотопи Lu); хіміотерапевтичні засоби або лікарські препарати (наприклад, метотрексат, адріаміцин, алкалоїди барвінку (вінкристин, вінбластин, етопозид), доксорубіцин, мелфалан, мітоміцин С, хлорамбуцил, даунорубіцин або інші інтеркалуючі агенти); інгібітори росту; ферменти і їх фрагменти, такі як нуклеолітичні ферменти; антибіотики; токсини, такі як низькомолекулярні токсини або токсини, які мають ферментативну активність, бактеріального, грибкового, рослинного або тваринного походження, включаючи фрагменти і/або варіанти вищезазначеного; і різні протипухлинні або протиракові засоби, розглянуті нижче. Термін "позитивне по двох антигенах злоякісне новоутворення" стосується злоякісної пухлини, що містить клітини, які позитивні як по мезотеліну, так і по MUC16. Термін "позитивна по двох антигенах клітина" стосується клітини, яка експресує як мезотелін, так і MUC16 на своїй поверхні. "Ефекторні функції" стосуються тієї біологічної активності, властивої області Fc антитіла, які варіюють залежно від ізотипу антитіла. Приклади ефекторних функцій антитіла включають: зв'язування C1q і комплемент-залежну цитотоксичність (CDC); зв'язування рецептора Fc; антитілозалежну клітинно-опосередковану цитотоксичність (ADCC); фагоцитоз; зниження регуляції рецепторів клітинної поверхні (наприклад, В-клітинного рецептора); і В-клітинну активацію. "Ефективна кількість" речовини, наприклад, фармацевтичної композиції, стосується кількості, ефективної в дозуванні і протягом необхідних періодів часу для досягнення необхідного терапевтичного або профілактичного результату. Термін "епітоп" стосується певної ділянки на молекулі антигену, з якою зв'язується антитіло. Термін "Fc-область" в цьому документі використовується для визначення С-кінцевої області важкого ланцюга імуноглобуліну, яка містить принаймні частину константної області. Термін містить нативну послідовність Fc-областей і відмінні від неї Fc-області. У одному із варіантів здійснення винаходу Fc-область важкого ланцюга IgG людини простягається від Cys226, або від Pro230, до карбоксильного кінця важкого ланцюга. Однак С-кінцевий лізин (Lys447) Fc-області може бути присутнім або відсутнім. Якщо інше не вказане в цьому документі, нумерацію амінокислотних залишків в Fc-області або константній області здійснюють відповідно до нумераційної системи EU, яка також називається індексом EU, як описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991. "Каркасна ділянка" або "FR" стосується залишків варіабельного домену, відмінних від залишків гіперваріабельної області (HVR). FR варіабельного домену, в основному, складається 7 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 із чотирьох доменів FR: FR1, FR2, FR3 і FR4. Відповідно, послідовності HVR і FR, як правило, з'являються в наступній послідовності в VH (або VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4. Терміни "повнорозмірне антитіло", "інтактне антитіло" і "ціле антитіло" використовуються в цьому документі взаємозамінно відносно антитіла, що має структуру, значною мірою схожу із структурою нативного антитіла, або що має важкі ланцюги, які містять Fc-область, як указано в цьому документі. Термін "глікозиловані форми мезотеліну" стосується природних форм мезотеліну, які модифікуються на пост-трансляційному рівні шляхом додавання вуглеводних залишків. Терміни "клітина-хазяїн", "клітинна лінія-хазяїн" і "клітинна культура-хазяїн" використовуються взаємозамінно і стосуються клітин, в які була введена екзогенна нуклеїнова кислота, включаючи потомство таких клітин. Клітини-хазяїни включають "трансформанти" і "трансформовані клітини", які включають вихідну трансформовану клітину і потомство, отримане із неї без урахування числа пасажів. Потомство може не бути повністю ідентичним вихідній клітині за вмістом нуклеїнової кислоти, але може містити мутації. Мутантне потомство, яке має ті ж самі функції або біологічну активність, класифіковану або відібрану в спочатку трансформованій клітині, включене в цей документ. "Антитіло людини" являє собою антитіло, яке має амінокислотну послідовність, яка відповідає антитілу, продукованому людиною або клітиною людини або отримано із відмінного від людини джерела, яке використовує репертуар антитіл людини або інші кодуючі антитіло послідовності людини. Це визначення антитіла людини виключає гуманізоване антитіло, що містить антигензв'язуючі залишки, відмінні від таких людини. "Консенсусна каркасна область людини" є каркасною областю, яка є амінокислотними залишками, що найчастіше зустрічаються при відборі послідовностей каркасної області VL або VH імуноглобуліну людини. Як правило, відбір послідовностей VL або VH імуноглобуліну людини здійснюють із підгрупи послідовностей варіабельного домену. Як правило, підгрупа послідовностей є підгрупою, як в Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3. В одному із варіантів здійснення винаходу для VL, підгрупа є підгрупою каппа I, як в Kabat et al., див. вище. У одному із варіантів здійснення винаходу для VH, підгрупа є підгрупою III, як в Kabat et al., див. вище. "Гуманізоване" антитіло стосується химерного антитіла, що містить амінокислотні залишки із HVR, відмінних від людських, і амінокислотні залишки із FR людини. У певних варіантах здійснення винаходу гуманізоване антитіло містить практично весь принаймні один, і звичайно два, варіабельні домени, де всі або практично всі HVR (наприклад, CDR) відповідають таким антитіла, відмінного від людського, і всі або практично всі FR відповідають таким антитілам людини. Гуманізоване антитіло в деяких випадках може включати принаймні частину константної області антитіла, отриманої із антитіла людини. "Гуманізована форма" антитіла, наприклад, відмінне від людини антитіло, стосується антитіла, яке піддавалось гуманізації. Термін "гіперваріабельна ділянка" або "HVR" в тому значенні, в якому використовується в цьому документі, стосується кожної із ділянок варіабельного домену антитіла, які є гіперваріабельними по послідовності і/або утворюють задані структурою петлі ("гіперваріабельні петлі"). Як правило, нативі чотириланцюжкові антитіла включають шість HVR; три в VH (H1, H2, H3) і три в VL (L1, L2, L3). HVR, як правило, включають амінокислотні залишки із гіперваріабельних петель і/або із "областей, які визначають комплементарність" (CDR), при цьому останні із згаданих мають найбільшу варіабельність послідовності і/або залучені до розпізнавання антигену. Типові гіперваріабельні петлі утворені амінокислотними залишками 2632 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (H2) і 96-101 (H3). (Chothia and Lesk, J. Mol. Biol. 196:901-917 (1987)). Типові CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 і CDR-H3) утворені амінокислотними залишками 24-34 області L1, 50-56 області L2, 89-97 області L3, 3135В області Н1, 50-65 області Н2 і 95-102 області Н3. (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)). За винятком CDR1 в VH, CDR, як правило, включають амінокислотні залишки, утворюючі гіперваріабельні петлі. CDR також включають "залишки, які визначають специфічність" або "SDR", які є залишками, взаємодіючими із антигеном. SDR знаходяться всередині областей CDR, умовно названими-CDR, або а-CDR. Типові a-CDR (a-CDR-L1, a-CDRL2, a-CDR-L3, a-CDR-H1, a-CDR-H2 і a-CDR-H3) утворені амінокислотними залишками 31-34 області L1, 50-55 області L2, 89-96 області L3, 31-35B області H1, 50-58 області Н2 і 95-102 області Н3 (див. Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008)). Якщо не вказане інше, залишки HVR і інші залишки у варіабельному домені (наприклад, залишки FR) пронумеровані в цьому документі відповідно до Kabat et al., див. вище. 8 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 "Імунокон'югат" є антитілом, кон'югованим із однією або декількома гетерологічними молекулами, включаючи, крім іншого, цитотоксичний агент. "Індивідуум" або "індивід" є ссавцем. Ссавці включають, крім іншого, домашніх тварин (наприклад, корів, овець, кішок, собак і коней), приматів (наприклад, людей і відмінних від людини приматів, як, наприклад, мавп), кроликів і гризунів (наприклад, мишей і щурів). У певних варіантах здійснення, індивідуумом або індивідом є людина. "Виділене антитіло" являє собою антитіло, яке було відділене від домішки його природного оточення. У деяких варіантах здійснення винаходу антитіло очищають до більше, ніж 95 % або 99 % ступеня чистоти, що визначається, наприклад, електрофоретичними (наприклад, SDSPAGE, ізоелектричне фокусування (IEF), капілярний електрофорез) або хроматографічними (наприклад, іонно-обмінна або зворотно-фазова HPLC) способами. Для детального розгляду способів оцінки чистоти антитіл див., наприклад, Flatman et al., J. Chromatogr. В 848:79-87 (2007). "Виділена нуклеїнова кислота" стосується молекули нуклеїнової кислоти, яка була відділена від домішки її природного оточення. Виділена нуклеїнова кислота містить молекулу нуклеїнової кислоти, що міститься в клітинах, які, як правило, містять молекулу нуклеїнової кислоти, але молекула нуклеїнової кислоти знаходиться поза хромосомою або має хромосомну локалізацію, відмінну від її природної хромосомної локалізації. "Виділена нуклеїнова кислота, яка кодує антитіло проти мезотеліну", стосується однієї або декількох молекул нуклеїнової кислоти, що кодують важкі і легкі ланцюги антитіла (або їх фрагменти), включаючи таку(і) молекулу(и) нуклеїнової кислоти в складі одиничного вектора або окремих векторів, і таку(і) молекулу(и) нуклеїнової кислоти, що має(ють) одну або декілька локалізацій в клітині-хазяїні. Термін "мезотелін" в тому значенні, в якому використовується в цьому документі, стосується будь-якого природного, зрілого мезотеліну, утвореного внаслідок процесингу білкового попередника мезотеліну в клітині. Термін містить мезотелін із будь-яких хребетних, включаючи ссавців, таких як примати (наприклад, люди і яванські макаки) і гризуни (наприклад, миші і щури), якщо не вказане інше. Термін також містить природні варіанти мезотеліну, наприклад, варіанти сплайсингу або алельні варіанти. Амінокислотна послідовність типового білкового попередника мезотеліну людини наведена в SEQ ID NO:42, і типовий мезотелін людини наведена в SEQ ID NO:43. Додаткові типові послідовності мезотеліну описані в цьому документі. Термін "позитивне по мезотеліну злоякісне новоутворення" стосується злоякісної пухлини, що містить клітини, які експресують мезотелін на своїй поверхні. Термін "позитивна по мезотеліну клітина" стосується клітини, якої експресує мезотелін на своїй поверхні. Термін "моноклональне антитіло" в тому значенні, в якому використовується в цьому документі, стосується антитіла, отриманого із популяції значною мірою гомогенних антитіл, тобто, індивідуальні антитіла, що входять до складу популяції, ідентичні і/або зв'язують один і той же епітоп, за винятком можливих варіантних антитіл, наприклад, що містять мутації, що зустрічаються в природі або виникаючих під час виробництва препаратів моноклонального антитіла, при цьому такі варіанти антитіл в основному присутні в слідових кількостях. На відміну від препаратів поліклональних антитіл, які звичайно включають різні антитіла, направлені проти різних детермінант (епітопів), кожне моноклональне антитіло препарату моноклонального антитіла направлене проти однієї детермінанти антигену. Таким чином, визначення "моноклональне" вказує на властивість антитіла, отриманого із практично гомогенної популяції антитіл, і не повинно бути витлумачене як таке, що вимагає виробництва антитіла яким-небудь конкретним способом. Наприклад, моноклональні антитіла, що підлягають використанню відповідно до даного винаходу, можуть бути отримані різними методиками, включаючи, крім іншого, гібридомну технологію, біотехнологію на основі рекомбінантної ДНК, способи фагового дисплея і способи застосування трансгенних тварин, що містять всі або частину локусів імуноглобуліну людини, при цьому такі способи або інші типові способи створення моноклональних антитіл описані в цьому документі. Термін "позитивне по MUC16 злоякісне новоутворення" стосується злоякісної пухлини, що містить клітини, які експресують MUC16 на своїй поверхні. Термін "позитивна по MUC16 клітина" стосується клітини, яка експресує MUC16 на своїй поверхні. "Незахищене антитіло" стосується антитіла, яке не кон'юговане із гетерологічною молекулою (наприклад, цитотоксичним агентом) або радіоактивною міткою. Незахищене антитіло може входити до складу фармацевтичної композиції. 9 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 60 "Нативні антитіла" стосуються молекул природних імуноглобулінів із різною структурою. Наприклад, нативні антитіла IgG є гетеротетрамерними глікопротеїнами масою приблизно 150000 дальтон, що складаються із двох ідентичних легких ланцюгів і двох ідентичних важких ланцюгів, які зв'язані між собою дисульфідними містками. Від N- до С-кінця кожний важкий ланцюг має варіабельну ділянку (VH), яка також називається варіабельним доменом важкого ланцюга, за яким йдуть три константні домени (СН1, СН2 і СН3). Подібним чином, від N- до Скінця кожний легкий ланцюг має варіабельну ділянку (VL), яка також називається варіабельним доменом легкого ланцюга, за яким йде константний легкий (CL) домен. Легкий ланцюг антитіла може бути віднесений до одного із двох типів, званих каппа (κ) і лямбда (λ), на основі амінокислотної послідовності їх константного домену. Термін "вкладиш" використовується відносно інструкцій, звичайно вкладених в комерційні упаковки терапевтичних продуктів, які містять інформацію про свідчення до застосування, використання, дозування, способи застосування, комбінованої терапії, протипоказаннях і/або запобіжних засобах, що стосуються використання таких терапевтичних продуктів. "Процент (%) ідентичності амінокислотної послідовності" в порівнянні із контрольною послідовністю поліпептиду визначають як процент амінокислотних залишків в послідовності, яка представляє інтерес, які ідентичні амінокислотним залишкам в контрольній послідовності поліпептиду, після поєднання послідовностей і внесення пропусків, у випадку необхідності, для досягнення максимального процента ідентичності послідовності, і не розглядаючи будь-які консервативні заміни як частину ідентичності послідовності. Поєднання з метою визначення процента ідентичності амінокислотної послідовності може бути досягнуто різними шляхами, які знаходяться в рамках знань в даній галузі техніки, наприклад, використовуючи загальнодоступні комп'ютерні програми, такі як BLAST, BLAST-2, ALIGN або Megalign (DNASTAR) програми. Фахівці в даній галузі техніки можуть визначити придатні параметри для поєднання послідовностей, включаючи будь-які алгоритми, необхідні для досягнення максимального поєднання по всій довжині послідовностей, що підлягають порівнянню. У рамках цього документа, однак, значення % ідентичності амінокислотної послідовності отримують, використовуючи комп'ютерну програму порівняння послідовностей ALIGN-2. Авторські права на комп'ютерну програму порівняння послідовностей ALIGN-2 має Genentech, Inc., і текст програми був поданий разом із документацією по використанню у відомство з охорони авторського права США, Washington D.C., 20559, де він був зареєстрований під реєстраційним номером реєстрації авторського права США TXU510087. Програма ALIGN-2 загальнодоступна в Genentech, Inc., South San Francisco, California або може бути скомпільована із тексту програми. Програма ALIGN-2 може бути скомпільована для використання в операційній системі UNIX, включаючи цифровий UNIX V4.0D. Всі параметри порівняння послідовностей задані в програмі ALIGN-2 і не змінюються. У випадках, коли ALIGN-2 застосовують для порівняння амінокислотних послідовностей, % ідентичності послідовності амінокислот даної амінокислотної послідовності А по відношенню, з або залежно від даної амінокислотної послідовності В (що альтернативно може бути сформульовано як дана амінокислотна послідовність А, яка має або містить певний % ідентичності послідовності амінокислот відносно, з або залежно від даної амінокислотної послідовності В) обчислюють таким чином: 100 помножити на частку X/Y, де Х являє собою число амінокислотних залишків, розраховане як ідентичні пари програмою поєднання послідовностей ALIGN-2 при поєднанні А і В в даній програмі, і де Y являє собою загальне число амінокислотних залишків в В. Слід розуміти, що у випадку, якщо довжина амінокислотної послідовності А не дорівнює довжині амінокислотної послідовності В, % ідентичності послідовності амінокислот А відносно В не буде дорівнювати % ідентичності послідовності амінокислот В відносно А. Якщо спеціально не указано інше, всі значення % ідентичності послідовності амінокислот, що використовуються в цьому документі, отримують, як описано в попередньому абзаці, використовуючи комп'ютерну програму ALIGN-2. Термін "фармацевтична композиція" стосується препарату, який знаходиться в такій лікарській формі, щоб біологічна активність активного інгредієнта, що міститься в ній, була ефективною, і який не містить додаткових компонентів, які є недопустимо токсичними для індивіда, якому призначають дану композицію. "Фармацевтично прийнятний носій" стосується інгредієнта в фармацевтичній композиції, відмінного від активного інгредієнта, який є нетоксичним для індивіда. Фармацевтично прийнятний носій містить, крім іншого, буфер, допоміжну речовину, стабілізатор або консервант. "Лікування" (і його граматичні варіації, такі як "лікувати" або "що лікує") в тому значенні, в якому використовується в цьому документі, стосується клінічного втручання в спробі змінити 10 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 природний хід хвороби індивідуума, що підлягає лікуванню, і може бути виконано або в профілактичних цілях, або під час протікання клінічної патології. Бажані ефекти лікування включають, крім іншого, запобігання вияву або повторному вияву захворювання, часткове зняття симптомів, зменшення яких-небудь прямих або непрямих патологічних наслідків захворювання, запобігання метастазуванню, зниження швидкості прогресування захворювання, поліпшення або тимчасове полегшення стану захворювання, і ремісію або поліпшений прогноз. У деяких варіантах здійснення винаходу антитіла за винаходом використовуються для затримки розвитку захворювання або для сповільнення прогресування захворювання. Термін "варіабельна ділянка" або "варіабельний домен" стосується домену важкого або легкого ланцюга антитіла, який залучений до зв'язування антитіла з антигеном. Варіабельні домени важкого ланцюга і легкого ланцюга (VH і VL, відповідно) природного антитіла, в основному, мають схожі структури, де кожний домен містить чотири консервативні каркасні області (FR) і три гіперваріабельні ділянки (HVR). (Див., наприклад, Kindt et al. Kubi Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007).) Одиничний домен VH або VL може виявитися достатнім для придання антигензв'язуючої специфічності. Більш того антитіла, які зв'язують певний антиген, можуть бути виділені, використовуючи домен VH або VL із антитіла, який зв'язує антиген для скринінгу бібліотеки комплементарних доменів VL або VH, відповідно. Див., наприклад, Portolano et al., J. Immunol. 150:880-887 (1993); Clarkson et al., Nature 352:624-628 (1991). Термін "вектор" в тому значенні, в якому використовується в цьому документі, стосується молекули нуклеїнової кислоти, здатної розмножати іншу нуклеїнову кислоту, до якої вона приєднана. Термін містить вектор як структура нуклеїнової кислоти, яка самореплікується, а також вектор, вбудований в геном клітини-хазяїна, в яку він був введений. Певні вектори здатні керувати експресією нуклеїнової кислоти, із якою вони функціонально зв'язані. Такі вектори називаються в цьому документі "експресійними векторами". II. Композиції і способи У одному із аспектів, винахід оснований, частково, на антитілах, які зв'язуються з мезотеліном, і імунокон'югатах, які містять такі антитіла. Антитіла і імунокон'югати за винаходом придатні, наприклад, для діагностики або лікування позитивних по мезотеліну злоякісних пухлин. А. Типові антитіла проти мезотеліну У одному із аспектів, винахід являє виділені антитіла, які зв'язують мезотелін. Природний мезотелін з'являється внаслідок розщеплення білкового попередника мезотеліну в клітині, утворюючи мезотелін і мегакаріоцитарний потенціюючий фактор (MPF), як показано на фігурі 1. Мезотелін містить укорочення С-кінця відносно білка-попередника. Таке укорочення може зумовлювати зв'язування якоря GPI. Мезотелін може залишатися пов'язаним із клітинною поверхнею, наприклад, через якір GPI, або мезотелін може від'єднувати від клітини (наприклад, якір GPI може розщеплюватися досі не ідентифікованим ферментом) із утворенням мезотеліну, який відщепився, в клітинній культурі або сироватці крові тварин. Типова послідовність білкового попередника природної мезотеліну людини представлена як SEQ ID NO:42, і відповідна послідовність мезотеліну представлена як SEQ ID NO:43 (відповідаючи амінокислотам 296-580 SEQ ID NO:42). Альтернативна послідовність мезотеліну відповідає амінокислотам 296-598 SEQ ID NO:42. SEQ ID NO:44 являє собою природний варіант SEQ ID NO:42, результатом процесинга якого є мезотелін, що має послідовність SEQ ID NO:45. SEQ ID NO:45 містить вставку із восьми амінокислотних залишків в позиції 116 амінокислоти відносно SEQ ID NO:43. Альтернативна форма мезотеліну, представлена в SEQ ID NO:45, мабуть, становить ~5 % транскриптів мезотеліну в пухлинних клітинних лініях. У певних варіантах здійснення винаходу антитіло проти мезотеліну має щонайменше одну або декілька наведених нижче властивостей в будь-якому поєднанні: (а) зв'язує епітоп SEQ ID NO:43, який містить (i) E153 і D174 або (ii) E211; (b) виявляє або не виявляє змінене або зменшене зв'язування із різними глікозилованими формами мезотеліну; (с) блокує або не блокує зв'язування мезотеліну із MUC16; (d) зв'язує мезотелін з афінністю ≤5 нМ, або альтернативно ≤1 нМ, або альтернативно ≤0,5 нМ, або альтернативно ≤0,1 нМ, і в деяких випадках ≥0,0001 нМ. У будь-якому із вищенаведених варіантів здійснення винаходу антитіло, яке не блокує зв'язування мезотеліну із MUC16, являє собою антитіло, яке посилює зв'язування мезотеліну із MUC16. У іншому варіанті здійснення винаходу антитіло проти мезотеліну зв'язує епітоп SEQ ID NO:43, який містить Е153 і D174. У одному із таких варіантів здійснення винаходу антитіло 11 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 60 проти мезотеліну додатково має одну або декілька нижченаведених властивостей в будь-якому поєднанні: (a) не виявляє зменшене зв'язування із глікозилованими формами мезотеліну; (b) не блокує зв'язування мезотеліну з MUC16; (с) зв'язує мезотелін із афінністю ≤5 нМ, або альтернативно ≤1 нМ, або альтернативно ≤0,5 нМ, і в деяких випадках ≥0,0001 нМ. У таких варіантах здійснення винаходу антитіло, яке не блокує зв'язування мезотеліну із MUC16, посилює зв'язування мезотеліну із MUC16 і/або антитіло зв'язується із афінністю ≤1 нМ. Характерне антитіло, що має наведені вище властивості, є 7D9, і його гуманізовані варіанти, такі як h7D9.v3, розглянуті в цьому документі. У будь-якому із вищезазначених варіантів здійснення винаходу мезотелін, з яким зв'язується антитіло проти мезотеліну, є мезотеліном людини. У іншому варіанті здійснення винаходу антитіло проти мезотеліну зв'язує епітоп SEQ ID NO:43, який містить Е211. У одному із таких варіантів здійснення винаходу антитіло проти мезотеліну додатково має одну або декілька наведених нижче властивостей: (а) не блокує зв'язування мезотеліну із MUC16; (b) зв'язує мезотелін з афінністю ≤5 нМ, або альтернативно ≤1 нМ, або альтернативно ≤0,5 нМ, і в деяких випадках ≥0,0001 нМ. У таких варіантах здійснення винаходу антитіло, яке не блокує зв'язування мезотеліну із MUC16, посилює зв'язування мезотеліну із MUC16, і/або антитіло зв'язується із афінністю ≤1 нМ. Характерним антитілом, що має вищезгаданими властивостями, є 22А10, і його гуманізовані варіанти, такі як 22А10.v83, розглянуті в цьому документі. У будь-якому із вищенаведених варіантів здійснення винаходу мезотелін, з яким зв'язується антитіло проти мезотеліну, є мезотеліном людини, мезотеліном яванської макаки і/або мезотеліном щура. У іншому варіанті здійснення винаходу антитіло проти мезотеліну: (а) зв'язується з епітопом в межах амінокислот 1-131 SEQ ID NO:43; і (b) зв'язує мезотелін із афінністю ≤5 нМ, або альтернативно ≤1 нМ, або альтернативно ≤0,5 нМ, або альтернативно ≤0,1 нМ, і в деяких випадках ≥0,0001 нМ. У одному із таких варіантів здійснення винаходу антитіло блокує зв'язування мезотеліну із MUC16 і/або зв'язується із епітопом в межах амінокислот 1-64 або 1-70 SEQ ID NO:43. У одному із таких варіантів здійснення винаходу антитіло витісняє MUC16 із зв'язку з мезотеліном. Характерним антитілом, що має вищезазначеними властивостями, є 19С3, розглянуте в цьому документі. У будь-якому із вищенаведених варіантів здійснення винаходу мезотелін, з яким зв'язується антитіло проти мезотеліну, є мезотеліном людини. Способи Щоб визначити, "чи зв'язується з епітопом SEQ ID NO:43, що містить Е153 і D174" або "чи зв'язується з епітопом SEQ ID NO:43, що містить Е211" антитіло проти мезотеліну, ці залишки піддаються мутуванню в поліпептиді, що містить SEQ ID NO:43, і аналізують зв'язування антитіла з мутованим поліпептидом, який експресується в клітинах 293, способом FACS, як описано в Прикладі G, де значне зниження (≥70 % зниження) або усунення зв'язування антитіла із мутантним поліпептидом вказує на те, що антитіло зв'язується з епітопом SEQ ID NO:43, що містить Е153 і D174 або Е211. Щоб визначити, чи дійсно антитіло проти мезотеліну "не виявляє ослабленої взаємодії із глікозилованими формами мезотеліну", міченого мезотелін людини експресується в клітинах СНО, його очищають (за допомогою мітки) і додатково розділяють відповідно до заряду на колонці Mono S на фракції з високою (фракція А11), середньою (А12), низькою (В1) і практично відсутнім (В5) ступенем глікозилування мезотеліну, як описано в Прикладі Н. Кожну фракцію наносять на чип із заздалегідь зв'язаним антитілом проти мезотеліну і вимірюють швидкість асоціації і швидкість дисоціації для кожної фракції. Якщо значення афінності для кожної фракції знаходиться в межах 25 % один від одного, це вказує на те, що антитіло не виявляє ослабленої взаємодії з глікозилованими формами мезотеліну. Щоб визначити, чи дійсно антитіло проти мезотеліну "блокує зв'язування мезотеліну із MUC16", "не блокує зв'язування мезотеліну із MUC16" або "посилює зв'язування мезотеліну із MUC16", виконують аналіз зв'язування MUC16 таким чином. Зокрема, біотинільований фрагмент MUC16 (що містить три муцинові повтори) інкубують із клітинами А431, стабільно експресуючих мезотелін в присутності або відсутності антитіла проти мезотеліну, і рівень зв'язування біотинільованого MUC16 із клітинами визначають FACS за допомогою стрептавідину-РЕ. Сайт зв'язування MUC16 в молекулі мезотеліну був експериментальним чином локалізований в перших 64 амінокислотних залишках мезотеліну (Kaneko et al., J. Biol Chem. 248:3739-49 (2009)). З іншого боку, клітини РС3, стабільно експресують MUC16, 12 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 60 інкубують в присутності очищеного мезотеліну-his8 ("his8" представлений у вигляді SEQ ID NO:49), заздалегідь інкубованого із антитілами проти мезотеліну, і зв'язування очищених комплексів мезотелін-his8:антитіло із MUC16-експресуючими клітинами визначають способом FACS, використовуючи анти-His6 антитіло, кон'юговане з Alexa-647 ("His6" представлений у вигляді SEQ ID NO:50). Якщо в будь-якому із вищезгаданих способів, сигнал FACS на ≥50 % нижче в присутності антитіла проти мезотеліну, ніж в його відсутність, тоді вважають, що антитіло блокує зв'язування мезотеліну із MUC16. Якщо в будь-якому із вищезгаданих способів, сигнал FACS не знижується ≥50 % в присутності антитіла проти мезотеліну, тоді вважають, що антитіло не блокує зв'язування мезотеліну із MUC16. Якщо в останньому із згаданих вище способів аналізу сигнал FACS збільшується в присутності антитіла проти мезотеліну, ніж в його відсутність, тоді вважають, що антитіло збільшує зв'язування мезотеліну з MUC16. "Чи зв'язується антитіло проти мезотеліну із афінністю ≤5 нМ, або альтернативно ≤1 нМ, або альтернативно ≤0,5 нМ, або альтернативно ≤0,1 нМ" визначають згідно з аналізом Biacore, як описано в цьому документі в розділі II.A.1. Зокрема, Kd вимірюють, використовуючи поверхневий плазмонний резонансний аналіз, використовуючи BIACORE®-2000 або BIACORE®-3000 (BIAcore, Inc., Piscataway, NJ) при 25 °C застосовуючи чипи із іммобілізованим антигеном СМ5 при ~10 одиницях відповіді (RU). Коротко, карбоксиметиловані декстранові біосенсорні чипи (CM5, BIACORE, Inc.) активуються N-етил-N'-(3-диметиламінопропіл)карбодііміду гідрохлоридом (EDC) і N-гідроксисукцинімідом (NHS) відповідно до рекомендацій фірми-виробника. Антигеном, що підлягає дослідженню, є мезотелін, синтезований і виділений із E.coli, як описано в Прикладі В. Антиген розводять 10 мМ ацетату натрію, рН 4,8 до концентрації 5 мкг/мл (~0,2 мкМ) до введення при швидкості потоку 5 мкл/хв. для досягнення приблизно 10 одиниць відповіді (RU) пов'язаного білка. Після ін'єкції антигену вводять 1М етаноламін для блокування груп, що не беруть участь в реакції. Для кінетичних вимірювань двократне серійне розведення Fab (від 0,78 нМ до 500 нМ) вводить в PBS із 0,05 % полісорбат TM 20 (TWEEN-20 ) сурфактантом (PBST) при 25 °C при швидкості потоку, який дорівнює приблизно 25 мкл/хв. Швидкості асоціації (k on) і швидкості дисоціації (k off) обчислюють, використовуючи просту взаємно-однозначну модель зв'язування Ленгмюра (BIACORE® Evaluation Software version 3.2) шляхом одночасного вирівнювання сенсограм асоціації і дисоціації. Рівноважну константу дисоціації (Kd) обчислюють за відношенням k off/kon. Див., наприклад, Chen et al., J. Mol. Biol. 293:865-881 (1999). Якщо швидкість асоціації перевищує 106 -1 -1 М с , використовуючи вищезгаданий спосіб поверхневого плазмонного резонансного аналізу, тоді швидкість асоціації може бути визначена шляхом використання методики гасіння флуоресценції, яка вимірює збільшення або зменшення інтенсивності емісії флуоресценції (збудження=295 нм; емісія=340 нм, 16 нм смуга пропускання) при 25 °C 20 нМ антитіла (Fab форма) проти антигену в PBS, рН 7,2, в присутності збільшуваних концентрацій антигену згідно із вимірюваннями спектрофотометра, такого як обладнаний зупинкою потоку спектрофотометр TM (Aviv Instruments) або розрахованого на 8000 зразків SLM-AMINCO спектрофотометр (ThermoSpectronic) із обертовою кюветою. Антитіло 7D9 і інші варіанти здійснення винаходу У одному із аспектів винахід стосується антитіла проти мезотеліну, що містить принаймні один, два, три, чотири, п'ять або шість HVR, вибрані із (а) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:20; (b) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:21; (с) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:22; (d) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:17; (е) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:18; і (f) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:19. У одному із аспектів винахід стосується антитіла, що містить принаймні одну, принаймні дві, або всі три послідовності VH HVR, вибрані із (а) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:20; (b) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:21; і (с) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:22. У одному із варіантів здійснення винаходу антитіло містить HVR-H3, що містить амінокислотну послідовність SEQ ID NO:22. У іншому варіанті здійснення винаходу антитіло містить HVR-H3, що містить амінокислотну послідовність SEQ ID NO:22, і HVR-L3, що містить амінокислотну послідовність SEQ ID NO:19. У додатковому варіанті здійснення винаходу антитіло містить HVRH3, що містить амінокислотну послідовність SEQ ID NO:22, HVR-L3, що містить амінокислотну послідовність SEQ ID NO:19, і HVR-H2, що містить амінокислотну послідовність SEQ ID NO:21. У додатковому варіанті здійснення винаходу антитіло містить (а) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:20; (b) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:21; і (с) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:22. 13 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 60 У іншому аспекті, винахід стосується антитіла, що містить принаймні одну, принаймні дві, або всі три VL HVR послідовності, вибрані із (а) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:17; (b) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:18; і (с) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:19. У одному із варіантів здійснення винаходу антитіло містить (а) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:17; (b) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:18; і (с) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:19. У іншому аспекті антитіло за винаходом містить (а) VH домен, що містить принаймні одну, принаймні дві, або всі три послідовності VH HVR, вибрані із (i) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:20, (ii) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:21, і (iii) HVR-H3, що містить амінокислотну послідовність, вибрану із SEQ ID NO:22; і (b) VL домен, що містить принаймні одну, принаймні дві, або всі три послідовності VL HVR, вибрані із (i) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:17, (ii) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:18, і (с) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:19. У іншому аспекті винахід стосується антитіла, що містить (а) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:20; (b) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:21; (с) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:22; (d) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:17; (е) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:18; і (f) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:19. У будь-якому із вищезазначених варіантів здійснення винаходу антитіло проти мезотеліну є гуманізованим. У одному із варіантів здійснення, антитіло проти мезотеліну містить HVR, як в будь-якому із вищезазначених варіантів здійснення, і додатково містить акцепторну каркасну ділянку людини, наприклад, каркасна ділянка імуноглобуліну людини або консенсусна каркасна ділянка людини. У певних варіантах здійснення акцепторною каркасною ділянкою людини є консенсусна каркасна ділянка VL каппа I людини (VLKI) і/або каркасна ділянка VH (VHATA), яка відрізняється від консенсусної послідовності підгрупи III VH людини (VH III) по 3 положеннях: R71A, N73T і L78A (Carter et al., Proc. Natl. Acad. Sci. USA 89:4285 (1992)). У іншому варіанті здійснення винаходу антитіло проти мезотеліну містить HVR, як в будь-якому із вищезазначених варіантів здійснення винаходу і додатково містить варіабельний домен легкого ланцюга, що містить послідовність каркасної ділянки FR2 SEQ ID NO:25, і послідовність FR3 SEQ ID NO:27. У одному із таких варіантів здійснення винаходу каркасною ділянкою варіабельного домену легкого ланцюга є модифікована консенсусна каркасна ділянка (VL KI) VL каппа I, що має FR2 послідовність SEQ ID NO:25 і FR3 послідовність SEQ ID NO:27. У іншому аспекті антитіло проти мезотеліну містить послідовність варіабельного домену (VH) важкого ланцюга, яка принаймні на 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 % або 100 % ідентична амінокислотній послідовності SEQ ID NO:8. У певних варіантах здійснення винаходу послідовність VH, яка принаймні на 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 % або 99 % ідентична, містить заміни (наприклад, консервативні заміни), вставки або делеції відносно контрольної послідовності, але антитіло проти мезотеліну, що містить таку послідовність, зберігає здатність зв'язувати мезотелін. У певних варіантах здійснення винаходу всього від 1 до 10 амінокислот були замінені, вставлені і/або делетовані в SEQ ID NO:8. У певних варіантах здійснення винаходу заміни, вставки або делеції здійснюють в ділянках поза HVR (тобто, в FR). У деяких випадках, антитіло проти мезотеліну містить VH послідовність SEQ ID NO: 8, включаючи посттрансляційні модифікації цієї послідовності. У окремому варіанті здійснення винаходу VH містить один, два або три HVR, вибрані із: (а) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:20, (b) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:21, і (с) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:22. У іншому аспекті винахід стосується антитіла проти мезотеліну, де антитіло містить варіабельний домен легкого ланцюга (VL), який принаймні на 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 % або 100 % ідентичний амінокислотній послідовності SEQ ID NO:4. У певних варіантах здійснення винаходу послідовність VL, яка принаймні на 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 % або 99 % ідентична, містить заміни (наприклад, консервативні заміни), вставки або делеції відносно контрольної послідовності, але антитіло проти мезотеліну, що містить таку послідовність, зберігає здатність зв'язувати мезотелін. У певних варіантах здійснення винаходу всього від 1 до 10 амінокислот були замінені, вставлені і/або делетовані в SEQ ID NO:4. У певних варіантах здійснення винаходу заміни, вставки або делеції здійснюють в ділянках поза HVR (тобто, в FR). У деяких випадках, антитіло проти мезотеліну містить VL послідовність SEQ ID NO:4, включаючи посттрансляційні модифікації цієї 14 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовності. У окремому варіанті здійснення винаходу VL містить один, два або три HVR, вибрані із: (а) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:17, (b) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:18, і (с) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:19. У іншому аспекті винахід стосується антитіла проти мезотеліну, де антитіло містить VH, як в будь-якому із вищеописаних варіантів здійснення винаходу і VL, як в будь-якому із вищеописаних варіантів здійснення винаходу. У одному із варіантів здійснення винаходу антитіло містить послідовності VH і VL в SEQ ID NO:8 і SEQ ID NO:4, відповідно, включаючи посттрансляційні модифікації цих послідовностей. У додатковому аспекті винахід стосується антитіла, яке зв'язує той же самий епітоп, що і антитіло проти мезотеліну за даним винаходом. Наприклад, в певних варіантах здійснення винахід стосується антитіла, яке зв'язує той же самий епітоп, що і антитіло проти мезотеліну, що містить послідовність VH SEQ ID NO:8 і послідовність VL SEQ ID NO:4. У певних варіантах здійснення винахід стосується антитіла, яке зв'язує епітоп SEQ ID NO:43 із ділянки амінокислот 152-175, всередині нього або його охоплюючи. У певних варіантах здійснення винахід стосується антитіла, яке зв'язує епітоп SEQ ID NO:43, який містить Е153 і D174. У певних таких варіантах здійснення винаходу антитіло зв'язує амінокислотні залишки E153 і D174. У додатковому аспекті винаходу антитіло проти мезотеліну за будь-яким із вищеописаних варіантів здійснення винаходу є моноклональним антитілом, включаючи химерне, гуманізоване антитіло або антитіло людини. У одному із варіантів здійснення винаходу антитілом проти мезотеліну є фрагмент антитіла, наприклад, Fv, Fab, Fab', scFv, діатіло або F(ab') 2 фрагмент. У іншому варіанті здійснення винаходу антитіло є практично повнорозмірним антитілом, наприклад, антитілом IgG1 або іншим класом або ізотипом антитіл, як визначено в цьому документі. У додатковому аспекті антитіло проти мезотеліну за будь-яким із вищеописаних варіантів здійснення винаходу може мати будь-яку характерну властивість, нарізно або в поєднанні, як описано в Розділах 1-7 нижче: Антитіло 22А10 і інші варіанти здійснення винаходу У одному із аспектів винахід стосується антитіла проти мезотеліну, що містить принаймні один, два, три, чотири, п'ять або шість HVR, вибраних із (а) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:36; (b) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:37; (с) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:38 або 39; (d) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:33; (е) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:34; і (f) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:35. У одному із аспектів винахід стосується антитіла, що містить принаймні одну, принаймні дві або всі три послідовності VH HVR, вибрані із (а) HVR-H1, що містить амінокислотну послідовність SEQ ID NO: 36; (b) HVR-H2, що містить амінокислотну послідовність SEQ ID NO: 37; і (с) HVR-H3, що містить амінокислотну послідовність SEQ ID NO: 38 або 39. У одному із варіантів здійснення винаходу антитіло містить HVR-H3, що містить амінокислотну послідовність SEQ ID NO:38 або 39. У іншому варіанті здійснення винаходу антитіло містить HVR-H3, що містить амінокислотну послідовність SEQ ID NO:38 або 39, і HVR-L3, що містить амінокислотну послідовність SEQ ID NO:35. У додатковому варіанті здійснення винаходу антитіло містить HVR-H3, що містить амінокислотну послідовність SEQ ID NO:38 або 39, HVRL3, що містить амінокислотну послідовність SEQ ID NO:35, і HVR-H2, що містить амінокислотну послідовність SEQ ID NO:37. У додатковому варіанті здійснення винаходу антитіло містить (а) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:36; (b) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:37; і (с) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:38 або 39. У іншому аспекті винахід стосується антитіла, що містить принаймні одну, принаймні дві або всі три послідовності VL HVR, вибрані із (а) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:33; (b) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:34; і (с) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:35. У одному із варіантів здійснення винаходу антитіло містить (а) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:33; (b) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:34; і (с) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:35. У іншому аспекті антитіло за винаходом містить (а) домен VH, що містить принаймні одну, принаймні дві або всі три послідовності VH HVR, вибрані із (i) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:36, (ii) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:37, і (iii) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:38 або 39; і (b) 15 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 60 домен VL, що містить принаймні одну, принаймні дві або всі три послідовності VL HVR, вибрані із (i) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:33, (ii) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:34; і (с) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:35. У іншому аспекті винахід стосується антитіла, що містить (а) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:36; (b) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:37; (с) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:38 або 39; (d) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:33; (е) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:34; і (f) HVR-L3, що містить амінокислотну послідовність, вибрану із SEQ ID NO:35. У будь-якому із вищеописаних варіантів здійснення винаходу антитіло проти мезотеліну є гуманізованим. У одному із варіантів здійснення, антитіло проти мезотеліну містить HVR, як в будь-якому із вищеописаних варіантів здійснення, і додатково містить акцепторну каркасну ділянку людини, наприклад, каркасна ділянка імуноглобуліну людини або консенсусна каркасна ділянка людини. У певних варіантах здійснення винаходу акцепторною каркасною ділянкою людини є акцепторна каркасна ділянка VLKI і/або VHIII. У іншому аспекті, антитіло проти мезотеліну містить послідовність варіабельного домену важкого ланцюга (VH), яка принаймні на 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 % або 100 % ідентична амінокислотній послідовності SEQ ID NO:16. У певних варіантах здійснення винаходу послідовність VH, яка принаймні на 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 % або 99 % ідентична, містить заміни (наприклад, консервативні заміни), вставки або делеції відносно контрольної послідовності, але антитіло проти мезотеліну, що містить таку послідовність, зберігає здатність зв'язувати мезотелін. У певних варіантах здійснення винаходу всього від 1 до 10 амінокислот були замінені, вставлені і/або делетовані в SEQ ID NO:16. У певних варіантах здійснення винаходу заміни, вставки або делеції здійснюють в ділянках поза HVR (тобто, в FR). У деяких випадках, антитіло проти мезотеліну містить VH послідовність SEQ ID NO:16, включаючи посттрансляційні модифікації цієї послідовності. У окремому варіанті здійснення винаходу VH містить один, два або три HVR, вибрані із: (а) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:36, (b) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:37, і (с) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:38 або 39. У іншому аспекті, стосується антитіла проти мезотеліну, де антитіло містить варіабельний домен легкого ланцюга (VL), який принаймні на 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 % або 100 % ідентичний амінокислотній послідовності SEQ ID NO:12. У певних варіантах здійснення винаходу послідовність VL, яка принаймні на 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 % або 99 % ідентична, містить заміни (наприклад, консервативні заміни), вставки або делеції відносно контрольної послідовності, але антитіло проти мезотеліну, що містить таку послідовність, зберігає здатність зв'язувати мезотелін. У певних варіантах здійснення винаходу всього від 1 до 10 амінокислот були замінені, вставлені і/або делетовані в SEQ ID NO:12. У певних варіантах здійснення винаходу заміни, вставки або делеції здійснюють в ділянках поза HVR (тобто, в FR). У деяких випадках, антитіло проти мезотеліну містить VL послідовність SEQ ID NO:12, включаючи посттрансляційні модифікації цієї послідовності. У окремому варіанті здійснення винаходу VL містить один, два або три HVR, вибрані із: (а) HVRL1, що містить амінокислотну послідовність SEQ ID NO:33; (b) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:34; і (с) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:35. У іншому аспекті винахід стосується антитіла проти мезотеліну, де антитіло містить VH, як в будь-якому із розглянутих вище варіантів здійснення винаходу і VL, як в будь-якому із розглянутих вище варіантів здійснення винаходу. У одному із варіантів здійснення винаходу антитіло містить VH і VL послідовності в SEQ ID NO:16 і SEQ ID NO:12, відповідно, включаючи посттрансляційні модифікації цих послідовностей. У додатковому аспекті винахід стосується антитіла, яке зв'язує той же самий епітоп, як антитіло проти мезотеліну за даним винаходом. Наприклад, в певних варіантах здійснення винахід стосується антитіла, яке зв'язує той же самий епітоп, як антитіло проти мезотеліну, що містить VH послідовність SEQ ID NO:16 і VL послідовність SEQ ID NO:12. У певних варіантах здійснення винахід стосується антитіла, яке зв'язує епітоп SEQ ID NO:43 із ділянки амінокислот 211-327, всередині нього або його охоплюючи. У певних варіантах здійснення винахід стосується антитіла, яке зв'язує епітоп SEQ ID NO:43, який містить Е211. У певних таких варіантах здійснення винаходу антитіло зв'язує амінокислотний залишок Е211. У додатковому аспекті винаходу антитіло проти мезотеліну за будь-яким із вищеописаних варіантів здійснення винаходу є моноклональним антитілом, включаючи химерне, гуманізоване 16 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 60 антитіло або антитіло людини. У одному із варіантів здійснення винаходу антитілом проти мезотеліну є фрагмент антитіла, наприклад, Fv, Fab, Fab', scFv, діатіло або F(ab') 2 фрагмент. У іншому варіанті здійснення винаходу антитіло є практично повнорозмірним антитілом, наприклад, антитілом IgG2а або іншим класом або ізотипом антитіл, як визначено в цьому документі. У додатковому аспекті антитіло проти мезотеліну за будь-яким із вищеописаних варіантів здійснення винаходу може мати будь-яку характерну властивість, нарізно або в поєднанні, як описано в Розділах 1-7 нижче: Антитіло 19С3 і інші варіанти здійснення винаходу У одному із аспектів винахід стосується антитіла проти мезотеліну, що містить принаймні один, два, три, чотири, п'ять або шість HVR антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464. У контексті даного розділу HVR обведені контуром у вигляді набору амінокислот, відповідних CDR, як визначено в цьому документі. У одному із аспектів винахід стосується антитіла, що містить принаймні одну, принаймні дві або всі три послідовності VH HVR антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464. У одному із варіантів здійснення винаходу антитіло містить HVR-H3 антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464. У іншому варіанті здійснення винаходу антитіло містить HVR-H3 і HVR-L3 антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464. У додатковому варіанті здійснення винаходу антитіло містить HVR-H3, HVR-L3 і HVR-H2 антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464. У додатковому варіанті здійснення винаходу антитіло містить HVR-H1, HVR-H2 і HVR-H3 антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464. У іншому аспекті винахід стосується антитіла, що містить принаймні одну, принаймні дві або всі три послідовності VL HVR антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464. У одному із варіантів здійснення винаходу антитіло містить HVR-L1, HVR-L2 і HVR-L3 антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464. У іншому аспекті антитіло по винаходу містить (а) VH домен, що містить принаймні одну, принаймні дві або всі три VH HVR послідовності антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464; і (b) VL домен, що містить принаймні одну, як мінімум дві або всі три VL HVR послідовності антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464. У іншому аспекті винахід стосується антитіла, що містить HVR-H1, HVR-H2, HVR-H3, HVRL1, HVR-L2 і HVR-L3 антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464. У будь-якому із розглянутих вище варіантів здійснення винаходу антитіла проти мезотеліну є гуманізованими. У одному із таких варіантів здійснення, антитіло є гуманізованою формою антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464. У додатковому варіанті здійснення винаходу антитіло проти мезотеліну містить HVR, як в будьякому із розглянутих вище варіантів здійснення винаходу і додатково містить акцепторну каркасну ділянку людини, наприклад, каркасна ділянка імуноглобуліну людини або консенсусна каркасна ділянка людини. У іншому аспекті антитіло проти мезотеліну містить послідовність варіабельного домену важкого ланцюга (VH), що має принаймні 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 % або 100 % ідентичність VH антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464. У певних варіантах здійснення винаходу послідовність VH містить заміни (наприклад, консервативні заміни), вставки або делеції відносно контрольної послідовності, але антитіло проти мезотеліну, що містить таку послідовність, зберігає здатність зв'язувати мезотелін. У певних варіантах здійснення винаходу всього від 1 до 10 амінокислот були замінені, вставлені і/або делетовані в VH антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464. У певних варіантах здійснення винаходу заміни, вставки або делеції здійснюють в ділянках поза HVR (тобто, в FR). У деяких випадках, антитіло проти мезотеліну містить VH послідовність антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464, включаючи посттрансляційні модифікації цієї послідовності. У окремому варіанті здійснення винаходу VH містить один, два або три HVR, вибрані із HVR-H1, HVR-H2 і HVR-H3 антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464. У іншому аспекті винахід стосується антитіла проти мезотеліну, де антитіло містить варіабельний домен легкого ланцюга (VL), який принаймні на 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 % або 100 % ідентичний VL антитіла, продукованого гібридомою 17 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 60 19С3 із ідентифікаційним номером АТСС РТА-11464. У певних варіантах здійснення винаходу послідовність VL, яка принаймні на 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 % або 99 % ідентична, містить заміни (наприклад, консервативні заміни), вставки або делеції відносно контрольної послідовності, але антитіло проти мезотеліну, що містить таку послідовність, зберігає здатність зв'язувати мезотелін. У певних варіантах здійснення винаходу всього від 1 до 10 амінокислот були замінені, вставлені і/або делетовані в VL антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464. У певних варіантах здійснення винаходу заміни, вставки або делеції здійснюють в ділянках поза HVR (тобто, в FR). У деяких випадках, антитіло проти мезотеліну містить VL послідовність антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464, включаючи посттрансляційні модифікації цієї послідовності. У окремому варіанті здійснення винаходу VL містить один, два або три HVR, вибрані із HVR-L1, HVR-L2 і HVR-L3 антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464. У іншому аспекті винахід стосується антитіла проти мезотеліну, де антитіло містить VH, як в будь-якому із розглянутих вище варіантів здійснення винаходу і VL, як в будь-якому із розглянутих вище варіантів здійснення винаходу. У одному із варіантів здійснення винаходу антитіло містить послідовності VH і VL антитіла, продукованого гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464, відповідно, включаючи посттрансляційні модифікації цих послідовностей. У додатковому аспекті винахід стосується антитіла, яке зв'язує той же самий епітоп, як антитіло проти мезотеліну за даним винаходом. Наприклад, в певних варіантах здійснення винахід стосується антитіла, яке зв'язує той же самий епітоп, як антитіло, продуковане гібридомою 19С3 із ідентифікаційним номером АТСС РТА-11464. У додатковому аспекті винаходу антитіло проти мезотеліну за будь-яким із розглянутих вище варіантів здійснення винаходу є моноклональним антитілом, включаючи химерне, гуманізоване антитіло або антитіло людини. У одному із варіантів здійснення винаходу антитілом проти мезотеліну є фрагментом антитіла, наприклад, Fv, Fab, Fab', scFv, діатіло або F(ab')2 фрагмент. У іншому варіанті здійснення винаходу антитіло є практично повнорозмірним антитілом, наприклад, антитілом IgG2b або іншим класом або ізотипом антитіл, як визначено в цьому документі. У додатковому аспекті, антитіло проти мезотеліну за будь-яким із вищеописаних варіантів здійснення винаходу може мати будь-яку характерну властивість, нарізно або в поєднанні, як описано в Розділах 1-7 нижче: 1. Афінність антитіла У певних варіантах здійснення винаходу константа дисоціації (Kd) антитіла за даним винаходом дорівнює (Kd) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ або ≤0,001 нМ, і в -13 -8 -8 -13 деяких випадках ≥10 М (наприклад, 10 М або менше, наприклад, від 10 М до 10 М, -9 -13 наприклад, від 10 М до 10 М). У одному із варіантів здійснення винаходи Kd вимірюють способом аналізу зв'язування радіоактивно міченого антигену (RIA), що виконується із використанням Fab фрагмента антитіла, яке представляє інтерес, і його антигену, як описано представленим нижче способом. Афінність зв'язування Fabs для антигену в розчині вимірюють урівноваженням Fab мінімальною 125 концентрацією ( I)-міченого антигену в присутності серій розведення неміченого антигену, потім виявляючи зв'язаний антиген за допомогою покритого антитілами до Fab планшета (див., наприклад, Chen et al., J. Mol. Biol. 293:865-881 (1999)). Для визначення умов проведення аналізу, багатоямкові планшети MICROTITER® (Thermo Scientific) покривають протягом ночі 5 мкг/мл антитілами до Fab (Cappel Labs) по виявленню зв'язаного антигену в 50 мМ карбонаті натрію (рН 9,6) і потім блокують 2 % (вага/об'єм) бичачим сироватковим альбуміном в PBS протягом від двох до п'яти годин при кімнатній температурі (приблизно 23 °C). У планшетах без 125 адсорбенту (Nunc #269620) 100 пкМ або 26 пкМ [ I]-антиген змішують із серійним розведенням Fab, який представляє інтерес (наприклад, у випадку оцінки антитіл до VEGF, Fab-12, в Presta et al., Cancer Res. 57:4593-4599 (1997)). Fab, який представляє інтерес, потім інкубують протягом ночі; однак, інкубація може продовжуватися більш тривалий період (наприклад, приблизно 65 годин) для забезпечення досягнення рівноважного стану. Потім суміші переносять в фіксуючий планшет для інкубації при кімнатній температурі (наприклад, протягом однієї години). Розчин потім видаляють і планшет промивають вісім разів 0,1 % полісорбатом 20 (TWEEN-20®) в PBS. TM Як тільки планшети висихають, додають 150 мкл/ямка сцинтилятора (MICROSCINT-20 ; TM Packard), і планшети обраховують в лічильнику гамма-випромінювання TOPCOUNT (Packard) протягом 10 хвилин. Концентрації кожного Fab, які демонструють 20 % або меншу величину від максимального зв'язування, вибирають для використання в конкурентному аналізі зв'язування. 18 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до іншого варіанта здійснення винаходи Kd вимірюють шляхом використання поверхневого плазмонного резонансного аналізу, використовуючи BIACORE®-2000 або BIACORE®-3000 (BIAcore, Inc., Piscataway, NJ) при 25 °C, застосовуючи чипи із іммобілізованим антигеном СМ5 при ~10 одиницях відповіді (RU). Коротко, карбоксиметиловані декстранові біосенсорні чипи (CM5, BIACORE, Inc.) активуються N-етил-N'-(3диметиламінопропіл)карбодііміду гідрохлоридом (EDC) і N-гідроксисукцинімідом (NHS) відповідно до рекомендацій фірми-виробника. Антиген розводять 10 мМ ацетатом натрію, рН 4,8, до концентрації 5 мкг/мл (~0,2 мкМ) до введення при швидкості потоку 5 мкл/хвилина для досягнення приблизно 10 одиниць відповіді (RU) зв'язаного білка. Після ін'єкції антигену вводять 1М етаноламін для блокування груп, що не беруть участь в реакції. Для кінетичних вимірювань двократне серійне розведення Fab (від 0,78 нМ до 500 нМ) вводить в PBS з 0,05 % полісорбат TM 20 (TWEEN-20 ) сурфактантом (PBST) при 25 °C при швидкості потоку, рівному приблизно 25 мкл/хв. Швидкості асоціації (k on) і швидкості дисоціації (k off) обчислюють, використовуючи просту взаємно-однозначну модель зв'язування Ленгмюра (BIACORE® Evaluation Software version 3.2) шляхом одночасного вирівнювання сенсограм асоціації і дисоціації. Рівноважну константу дисоціації (Kd) обчислюють по відношенню k off/kon. Див., наприклад, Chen et al., J. Mol. Biol. 6 -1 -1 293:865-881 (1999). Якщо швидкість асоціації перевищує 10 М с , використовуючи вищезгаданий спосіб поверхневого плазмонного резонансного аналізу, тоді швидкість асоціації може бути визначена шляхом використання методики гасіння флуоресценції, яка вимірює збільшення або зменшення інтенсивності емісії флуоресценції (збудження=295 нм; емісія=340 нм, 16 нм смуга пропускання) при 25 °C 20 нМ антитіла (Fab форма) проти антигену в PBS, рН 7,2, в присутності концентрацій антигену, які збільшуються згідно із вимірюваннями спектрофотометра, такого як обладнаний зупинкою потоку спектрофотометр (Aviv Instruments) TM або розрахованого на 8000 зразків SLM-AMINCO спектрофотометр (ThermoSpectronic) із обертовою кюветою. 2. Фрагменти антитіла У певних варіантах здійснення винаходу антитіло за даним винаходом є фрагментом антитіла. Фрагменти антитіла включають, крім іншого, Fab, Fab', Fab'-SH, F(ab')2, Fv і scFv фрагменти, і інші фрагменти, розглянуті нижче. Для огляду певних фрагментів антитіла див. Hudson et al., Nat. Med. 9:129-134 (2003). Для огляду фрагментів scFv див., наприклад, Pluckthün, in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer-Verlag, New York), pp. 269-315 (1994); див. також WO 93/16185; і патенти США №№ 5571894 і 5587458. Для обговорення фрагментів Fab і F(ab') 2, що містять залишки зв'язування епітопу рецептора реутилізації і, що мають підвищений час життя in vivo, див. патент США № 5869046. Діатіла є фрагментами антитіла з двома антигензв'язуючими сайтами, які можуть бути бівалентними або біспецифічними. Див., наприклад, EP 404097; WO 1993/01161; Hudson et al., Nat. Med. 9:129-134 (2003); і Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993). Триатіла і тетратіла також описані в Hudson et al., Nat. Med. 9:129-134 (2003). Однодоменні антитіла є фрагментами антитіла, що містять весь варіабельний домен важкого ланцюга антитіла або його частину або весь варіабельний домен легкого ланцюга антитіла або його частину. У певних варіантах здійснення винаходу однодоменне антитіло є однодоменним антитілом людини (Domantis, Inc., Waltham, MA; див., наприклад, патент США № 6248516 В1). Фрагменти антитіла можуть бути отримані різними способами, включаючи, крім іншого, протеолітичне розщеплення інтактного антитіла, а також продукцію рекомбінантними клітинамихазяїнами (наприклад, Е. coli або фагами), як описано в цьому документі. 3. Химерні і гуманізовані антитіла У певних варіантах здійснення винаходу антитіло за даним винаходом є химерним антитілом. Певні химерні антитіла описані, наприклад, в патенті США №4816567; і Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)). В одному прикладі, химерне антитіло містить відмінний від варіабельної ділянки людини (наприклад, варіабельна ділянка, отримана із миші, щура, хом'яка, кролика або відмінного від людини примата, такого як мавпа) і константна ділянка людини. У додатковому прикладі, химерне антитіло є антитілом із "переключеним синтезом класу", в якому клас або підклас був змінений при порівнянні із вихідним антитілом. Химерні антитіла включають їх антигензв'язуючі фрагменти. У певних варіантах здійснення винаходу химерне антитіло є гуманізованим антитілом. Як правило, відмінне від людини антитіло гуманізують для зниження імуногенності для людини, при цьому зберігаючи специфічність і афінність вихідної відмінної від антитіла людини. У основному, гуманізоване антитіло містить один або декілька варіабельних доменів, в яких HVR, 19 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад, CDR (або їх частини) отримані із відмінної від антитіла людини, і FR (або їх частини) отримані із послідовностей антитіла людини. Гуманізоване антитіло, в деяких випадках, також містить принаймні частину константної ділянки людини. У деяких варіантах здійснення винаходу деякі залишки FR в гуманізованому антитілі замінені відповідними залишками із відмінної від антитіла людини (наприклад, антитіло, із якого отримані залишки HVR), наприклад, із метою відновлення або поліпшення специфічності або афінності антитіла. Гуманізовані антитіла і способи їх отримання розглянуті, наприклад, в Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008) і додатково описані, наприклад, в Riechmann et al., Nature 332:323-329 (1988); Queen et al., Proc. Natl. Acad. Sci. USA 86:10029-10033 (1989); патенті США №№ 5821337, 7527791, 6982321 і 7087409; Kashmiri et al., Methods 36:25-34 (2005) (що описує пересадку SDR (aCDR); Padlan, Mol. Immunol. 28:489-498 (1991) (що описує "відновлення поверхні"); Dall'Acqua et al., Methods 36:43-60 (2005) (що описує "перестановку FR"); і Osbourn et al., Methods 36:61-68 (2005) і Klimka et al., Br. J. Cancer, 83:252-260 (2000) (описуючий спосіб "направленої селекції" відносно перестановки FR). Каркасні області людини, які можуть бути використані для гуманізації, включають, крім іншого: каркасні області, вибрані, використовуючи спосіб "найкращої відповідності" (див., наприклад, Sims at al., J. Immunol. 151:2296 (1993)); каркасні області, отримані із консенсусної послідовності антитіл людини певної підгрупи варіабельних ділянок легкого або важкого ланцюга (див., наприклад, Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); і Presta et al. J. Immunol., 151:2623 (1993)); зрілі (соматично мутовані) каркасні ділянки людини або каркасні ділянки зародкової лінії людини (див., наприклад, Almagro and Fransson, Front. Biosci. 13:16191633 (2008)); і каркасні ділянки, отримані із бібліотек скринінгу FR (див., наприклад, Baca et al., J. Biol. Chem. 272:10678-10684 (1997) і Rosok et al., J. Biol. Chem. 271:22611-22618 (1996)). 4. Антитіла людини У певних варіантах здійснення винаходу антитіло за даним винаходом є антитілом людини. Антитіла людини можуть бути отримані, використовуючи різні методики, відому в даній галузі техніку. Антитіла людини описані в загальних рисах в статтях van Dijk and van de Winkel, Curr. Opin. Pharmacol. 5: 368-74 (2001) і Lonberg, Curr. Opin. Immunol. 20:450-459 (2008). Антитіла людини можуть бути отримані введенням імуногена трансгенній тварині, яка була модифікована з метою продукування інтактних антитіл людини або інтактних антитіл із варіабельними ділянками людини у відповідь на антигенний стимул. Такі тварини звичайно містять всі імуноглобулінові локуси людини або їх частину, які заміняють ендогенні імуноглобулінові локуси, або які знаходяться поза хромосомою або випадковим чином інтегровані в хромосоми тварин. У таких трансгенних мишах ендогенні імуноглобулінові локуси, в основному, інактивовані. Для огляду способів отримання антитіл людини із трансгенних тварин див. Lonberg, Nat. Biotech. 23:1117-1125 (2005). Див. також, наприклад, патенти США TM №№ 6075181 і 6150584, що описують технологію XENOMOUSE ; патент США № 5770429, що описує технологію HuMab®; патент США № 7041870, що описує технологію K-M MOUSE®, і публікацію патентної заявки США № US 2007/0061900, що описує технологію VelociMouse®). Варіабельні ділянки людини із інтактних антитіл, продуковані такими тваринами, можуть бути додатково модифіковані, наприклад, шляхом поєднання із іншою константною ділянкою людини. Антитіла людини можуть бути також отримані основаними на гібридомній технології способами. Були описані мієломні і мишаче-людські гетеромієломні клітинні лінії людини для продукування моноклональних антитіл людини. (Див., наприклад, Kozbor J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987); і Boerner et al., J. Immunol., 147:86 (1991).) Людські антитіла, отримані за допомогою технології використання В-клітинної гібридоми людини, також описані в Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006). Додаткові способи включають такі, описані, наприклад, в патенті США № 7189826 (що описує продуковання моноклональних антитіл IgM людини гібридомними клітинними лініями) і в статті Ni, Xiandai Mianyixue, 26(4):265268 (2006) (яка описує гібридоми людина-людина). Технологія застосування гібридоми людини (технологія Trioma) також описана в статті Vollmers and Brandlein, Histology and Histopathology, 20(3):927-937 (2005) і Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3):185-91 (2005). Антитіла людини можуть бути також отримані шляхом виділення послідовностей варіабельного домену клону Fc, вибраних із бібліотек фагового дисплея людського походження. Такі послідовності варіабельного домену можуть потім бути комбіновані з необхідним константним доменом людини. Технології відбору антитіл людини із бібліотек антитіл описані нижче. 20 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 5. Антитіла, отримані із бібліотек Антитіла за винаходом можуть бути виділені шляхом скринінгу комбінаторних бібліотек для антитіл із необхідною активністю або активностями. Наприклад, цілий ряд способів відомі в даній галузі техніки для отримання бібліотек фагового дисплея і скринінгу таких бібліотек по виявленню антитіл, що мають необхідні характеристикам зв'язування. Такі способи розглянуті, наприклад, в Hoogenboom et al., Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Totowa, NJ, 2001) і додатково конкретизовані, наприклад, в McCafferty et al., Nature 348:552-554; Clackson et al., Nature 352: 624-628 (1991); Marks et al., J. Mol. Biol 222: 581-597 (1992); Marks and Bradbury, in Methods in Molecular Biology 248:161-175 (Lo, ed., Human Press, Totowa, NJ, 2003); Sidhu et al., J. Mol. Biol 338(2): 299-310 (2004); Lee et al., J. Mol. Вiol. 340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467-12472 (2004); і Lee et al, J. Immunol. Methods 284(1-2): 119-132(2004). У певних способах фагового дисплея, репертуари генів VH і VL окремо клонують способом полімеразної ланцюгової реакції (ПЛР) і рекомбінують випадковим чином в фагових бібліотеках із подальшим їх скринінгом по виявленню антигензв'язуючого фагу, як описано в статті Winter et., Ann. Rev. Immunol., 12:433-455 (1994). В фазі, як правило, представлені фрагменти антитіла або у вигляді одноланцюжкових фрагментів Fv (scFv), або у вигляді фрагментів Fab. Бібліотеки із імунізованих джерел представляють високо афінні антитіла відносно імуногену без необхідності створення гібридом. Альтернативно, може бути клонований інтактний репертуар (наприклад, із людини) для забезпечення єдиним джерелом антитіл до широкого набору відмінних від власних і також власних антигенів без якої-небудь імунізації, як описано Griffiths et al., EMBO J, 12:725-734 (1993). І нарешті, інтактні бібліотеки можуть бути також отримані штучно шляхом клонування не перегрупованих V-генних сегментів із стовбурових клітин і використання ПЛР-праймерів, що містять випадкову послідовність, для кодування високо варіабельних ділянок CDR3 і виконання перегрупування in vitro, як описано в статті Hoogenboom and Winter, J. Mol. Biol., 227:381-388 (1992). Патентні публікації, що розглядають фагові бібліотеки антитіл людини, включають, наприклад: патент США № 5750373 і патентні публікації США №№ 2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936 і 2009/0002360. Антитіла або фрагменти антитіл, виділені із бібліотек антитіл людини, вважаються в цьому документі антитілами людини або фрагментами антитіл людини. 6. Мультиспецифічні антитіла У певних варіантах здійснення винаходу антитіло за даним винаходом є мультиспецифічним антитілом, наприклад, біспецифічним антитілом. Мультиспецифічні антитіла є моноклональними антитілами, які мають специфічність зв'язування принаймні для двох різних сайтів. У певних варіантах здійснення винаходу одна із специфічностей зв'язування призначена для мезотеліну і інша - для будь-якого іншого антигену. У певних варіантах здійснення винаходу біспецифічні антитіла можуть зв'язуватися із двома різними епітопами мезотеліну. Біспецифічні антитіла можуть також бути використані для локалізації цитотоксичних агентів на клітинах, яких експресують мезотелін. Біспецифічні антитіла можуть бути приготовані у вигляді повнорозмірних антитіл або фрагментів антитіл. Методики створення мультиспецифічних антитіл включають, крім іншого, рекомбінантну спільну експресію двох пар важкого ланцюга-легкого ланцюга імуноглобуліну, що мають різні специфічності (див. Milstein and Cuello, Nature 305:537 (1983)), WO 93/08829 і Traunecker et al., EMBO J. 10:3655 (1991) і техніку "виступ-у-заглиблення" (див., наприклад, патент США № 5731168). Мультиспецифічні антитіла можуть бути також отримані шляхом створення електростатичних ефектів регулювання для отримання Fc-гетеродимерних молекул антитіла (WO 2009/089004A1); перехресного зв'язування двох або більше антитіл або фрагменти (див., наприклад, патент США № 4676980 і Brennan et al., Science, 229: 81 (1985)); використання лейцинових блискавок для отримання біспецифічних антитіл (див., наприклад, Kostelny et al., J. Immunol., 148(5):1547-1553 (1992)); використання технології "діатіло" для створення фрагментів біспецифічного антитіла (див., наприклад, Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:64446448 (1993)); і використання димерів одноланцюжкових Fv (sFv) (див., наприклад, Gruber et al., J. Immunol., 152:5368 (1994)); і приготування триспецифічних антитіл, як описано, наприклад, в Tutt et al. J. Immunol. 147:60 (1991). Сконструйовані антитіла з трьома або більше функціональними сайтами зв'язування антигену, включаючи "антитіла, що нагадують восьминога", також включені в цей документ (див., наприклад, US 2006/0025576A1). 21 UA 113838 C2 5 10 15 20 Антитіло або фрагмент в цьому документі також містить "FAb подвійної дії" або "DAF", що містить сайт зв'язування антигену, який зв'язується з мезотеліном, а також із іншим, відмінним від нього антигеном (див., US 2008/0069820, наприклад). 7. Варіанти антитіл У певних варіантах здійснення винаходу розглядаються варіанти амінокислотної послідовності антитіл, представлених в цьому документі. Наприклад, бажано поліпшити афінність зв'язування і/або інші біологічні властивості антитіла. Варіанти амінокислотної послідовності антитіла можуть бути отримані шляхом внесення придатних модифікацій в нуклеотидну послідовність, яка кодує антитіло, або шляхом пептидного синтезу. Такі модифікації включають, наприклад, делеції і/або вставки, і/або заміни залишків всередині амінокислотних послідовностей антитіла. Будь-яка комбінація делеції, вставки або заміни може бути здійснена для отримання остаточного конструкта за умови, що остаточний конструкт має необхідні характеристики, наприклад, антигензв'язувальні. а) Варіанти заміни, вставки і делеції У певних варіантах здійснення винаходу представлені варіанти антитіл, які мають одну або декілька амінокислотних замін. Сайти, що представляють інтерес для заміщувального мутагенезу включають HVR і FR. Консервативні заміни представлені в Таблиці 1 під заголовком "переважні заміни". Більш істотні зміни представлені в Таблиці 1 під заголовком "типові заміни" і, як додатково описано нижче, відносно класів бічних ланцюгів амінокислот. Амінокислотні заміни можуть бути внесені в антитіло, що представляє інтерес, і продукти піддають скринінгу на предмет необхідної активності, наприклад, збереженого/поліпшеного зв'язування антигену, зниженої імуногенності або поліпшеної ADCC або CDC. Таблиця 1 Вихідний залишок Ala (А) Arg (R) Asn (N) Asp (D) Cys (С) Gln (Q) Glu (Е) Gly (G) His (Н) Ile (I) Leu (L) Lys (K) Met (M) Phe (F) Pro (Р) Ser (S) Thr (Т) Trp (W) Tyr (Y) Val (V) 25 30 35 Типові заміни Val; Leu; Ile Lys; Gln; Asn Gln; His; Asp, Lys; Arg Glu; Asn Ser; Ala Asn; Glu Asp; Gln Ala Asn; Gln; Lys; Arg Leu; Val; Met; Ala; Phe; норлейцин Норлейцин; Ile; Val; Met; Ala; Phe Arg; Gln; Asn Leu; Phe; Ile Trp; Leu; Val; Ile; Ala; Tyr Ala Thr Val; Ser Tyr; Phe Trp; Phe; Thr; Ser Ile; Leu; Met; Phe; Ala; Норлейцин Переважні заміни Val Lys Gln Glu Ser Asn Asp Ala Arg Leu Ile Arg Leu Tyr Ala Thr Ser Tyr Phe Leu Амінокислоти можуть бути об'єднані в групи відповідно до загальних властивостей бічних ланцюгів: (1) гідрофобні: норлейцин, Met, Ala, Val, Leu, Ile; (2) нейтральні гідрофільні: Cys, Ser, Thr, Asn, Gln; (3) кислі: Asp, Glu; (4) основні: His, Lys, Arg; (5) залишки, що впливають на орієнтацію ланцюга: Gly, Pro; (6) ароматичні: Trp, Tyr, Phe. Неконсервативні заміни можуть спричинити зміну членства в одному класі на таке в іншому класі. Один тип замісного варіанта містить заміну одного або декількох залишків гіперваріабельної ділянки вихідного антитіла (наприклад, гуманізованного або антитіла людини). Як правило, 22 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіант(и), які отримується(ються) в результаті, вибраний(і) для подальшого дослідження, мають модифікації (наприклад, поліпшення) певних біологічних властивостей (наприклад, підвищену афінність, знижену імуногенність) відносно вихідного антитіла і/або практично зберігають певні біологічні властивості вихідного антитіла. Типовим замісним варіантом є антитіло із дозрілою афінністю, яке може бути успішно отримане, наприклад, використовуючи оснований на фаговому дисплеї спосіб дозрівання афінності, як такий, описаний в цьому документі. Коротко, вносять мутації в один або декілька залишків HVR і варіантні антитіла клонують в фаговому векторі і відбирають за певною біологічною активністю (наприклад, афінності зв'язування). Зміни (наприклад, заміни) можуть бути внесені в HVR, наприклад, для поліпшення афінності антитіл. Такі зміни можуть бути внесені в "гарячі точки" HVR, тобто залишки, що кодуються кодонами, які зазнають мутування із високою частотою під час соматичного процесу дозрівання (див., наприклад, Chowdhury, Methods Mol. Biol. 207:179-196 (2008)), і/або SDR (a-CDR), внаслідок чого отримують варіантну VH або VL, що піддається тестуванню на предмет афінності зв'язування. Дозрівання афінності шляхом конструювання і повторного відбору із повторних бібліотек вже було описано, наприклад, в Hoogenboom et al., Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Totowa, NJ (2001)). У деяких варіантах здійснення дозрівання афінності вносять різноманітність у варіабельні гени, вибрані для дозрівання, будь-якими різними способами (наприклад, ПЛР із внесенням помилок, перестановка ланцюгів або олігонуклеотид-направлений мутагенез). Потім створюють повторну бібліотеку. Потім проводять скринінг бібліотеки для ідентифікації якого-небудь варіанта антитіла із необхідною афінністю. Інший спосіб внесення варіабельності містить HVR-направлені підходи, в яких декілька залишків HVR (наприклад, 4-6 залишків за один раз) розташовують у випадковому порядку. Залишки HVR, залучені до зв'язування антигену, можуть бути специфічно ідентифіковані, наприклад, використовуючи аланін-скануючий мутагенез або моделювання. Зокрема, звичайно мішенями є CDR-H3 і CDR-L3. У певних варіантах здійснення винаходу заміни, вставки або делеції можуть мати місце в одному або декількох HVR за умови, що такі зміни істотно не знижують здатність антитіла зв'язувати антиген. Наприклад, консервативні зміни (наприклад, консервативні заміни, передбачені в цьому документі), які істотно не знижують афінність зв'язування, можуть бути зроблені в HVR. Такі зміни можуть бути поза "гарячими точками" HVR або SDR. У певних варіантах здійснення варіантних послідовностей VH і VL, розглянутих вище, кожний HVR або незмінений, або містить не більше однієї, двох або трьох амінокислотних замін. Придатним способом ідентифікації залишків або ділянок антитіла, що є мішенню мутагенезу, є "аланін-скануючий мутагенез", як описано Cunningham and Wells (1989) Science, 244:1081-1085. В цьому способі залишок або група цільових залишків (наприклад, заряджені залишки, такі як arg, asp, his, lys і glu) ідентифікують і замінюють нейтральною або негативно зарядженою амінокислотою (наприклад, аланіном або поліаланіном), щоб визначити чи змінилася взаємодія антитіла із антигеном. Додаткові заміни можуть бути внесені в місцях розташування амінокислот, демонструючи функціональну чутливість до первинних замін. Альтернативно, або додатково, кристалічна структура комплексу антиген-антитіло використовується для ідентифікації точок контакту між антитілом і антигеном. Такі контактуючі залишки і сусідні залишки можуть виступати як мішень або бути видалені як кандидати для заміни. Варіанти можуть бути піддані скринінгу з метою визначення можливої наявності у них необхідних властивостей. Вставки амінокислотної послідовності включають аміно- і/або карбокси-кінцеві зчеплення, що варіюють по довжині від одного залишку до поліпептидів, що містять сотню або більше залишки, а також вставки всередині послідовності, що складаються із одного або множини амінокислотних залишків. Приклади кінцевих вставок включають антитіло з N-кінцевим метіоніловим залишком. Інші інсерційні варіанти молекули антитіла включають зчеплення Nабо С-кінця антитіла з ферментом (наприклад, для ADEPT) або поліпептидом, який збільшує час життя антитіла в сироватці. b) Глікозиловані варіанти У певних варіантах здійснення винаходу антитіло за даним винаходом, змінено для збільшення або зменшення ступеня глікозилування даного антитіла. Внесення або делеція сайтів глікозилування в рамках антитіла можуть бути успішно виконані шляхом зміни амінокислотної послідовності таким чином, що один або більше сайтів глікозилування створюється або видаляється. У випадку, коли антитіло містить ділянку Fc, карбогідрат, до нього приєднаний, може бути змінений. Нативні антитіла, продуковані клітинами ссавців, звичайно включають розгалужений, 23 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 60 2-антенарний олігосахарид, який, як правило, приєднаний за допомогою N-зв'язку з Asn297 домену СН2 ділянки Fc. Див., наприклад, Wright et al. TIBTECH 15:26-32 (1997). Олігосахарид може включати різні карбогідрати, наприклад, манозу, N-ацетилглюкозамін (GlcNAc), галактозу і сіалову кислоту, а також фукозу, приєднану до GlcNAc у "стеблі" 2-антенарної олігосахаридної структури. У деяких варіантах здійснення винаходу модифікації олігосахариду антитіла за винаходом можуть бути створені з метою створення варіантів антитіла із певними поліпшеними властивостями. У одному із варіантів здійснення винаходу представлені варіанти антитіла, що мають карбогідратну структуру, в якій відсутня фукоза, приєднана (напряму або опосередковано) до ділянки Fc. Наприклад, кількість фукози в такому антитілі може складати від 1 % до 80 %, від 1 % до 65 %, від 5 % до 65 % або від 20 % до 40 %. Кількість фукози визначають обчисленням середньої кількості фукози в сахаридному ланцюгу в положенні Asn297 відносно суми всіх глікоструктур, прикріплених до Asn297 (наприклад, комплексних, гібридних і високоманозних структур) згідно із вимірюваннями способом мас-спектрометрії MALDI-TOF, як описано в WO 2008/077546, наприклад Asn297 стосується аспарагінового залишку, розташованого приблизно в позиції 297 ділянки Fc (нумерація EU залишків ділянки Fc); однак Asn297 може бути також розташований приблизно±3 амінокислоти вище або нижче позиції 297, тобто між позиціями 294 і 300, внаслідок незначних варіацій послідовності антитіла. Такі фукозиловані варіанти можуть мати поліпшену функцію ADCC. Див., наприклад, публікацію патенту США №№ US 2003/0157108 (Presta, L.); US 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Приклади публікацій, що стосуються "дефукозилованих" або "позбавлених фукози" варіантів антитіла, включають: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO2005/053742; WO2002/031140; Okazaki et al. J. Mol. Biol. 336:1239-1249 (2004); Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004). Приклади клітинних ліній, здатних продукувати дефукозиловані антитіла, включають Lec13 CHO клітини, позбавлені фукозилування білків (Ripka et al., Arch. Biochem. Biophys. 249:533-545 (1986); патентна заявка США № US 2003/0157108 A1, Presta, L., і WO 2004/056312 A1, Adams et al., зокрема в Прикладі 11), і нокаутні клітинні лінії, такі як нокаутні по гену альфа-1,6-фукозилтрансферази, FUT8, клітини СНО (див., наприклад, Yamane-Ohnuki et al., Biotech. Bioeng. 87: 614 (2004); Kanda, Y. et al., Biotechnol. Bioeng., 94(4):680-688 (2006); і WO2003/085107). Додатково представлені варіанти антитіл із розрізаними пополам олігосахаридами, наприклад, в яких 2-антенарний олігосахарид, приєднаний до ділянки Fc антитіла, розрізаний пополам на GlcNAc. Такі варіанти антитіла можуть мати знижене фукозилування і/або поліпшену функцію ADCC. Приклади таких варіантів антитіл описані, наприклад, в WO 2003/011878 (Jean-Mairet et al.); патенті США № 6602684 (Umana et al.); і US 2005/0123546 (Umana et al.). Варіанти антитіл принаймні із одним залишком галактози в олігосахариді, приєднаному до ділянки Fc, також розглянуті. Такі варіанти антитіл можуть мати поліпшену функцію CDC. Такі варіанти антитіл описані, наприклад, в WO 1997/30087 (Patel et al.); WO 1998/58964 (Raju, S.); і WO 1999/22764 (Raju, S.). c) Варіанти ділянки Fc У певних варіантах здійснення винаходу одна або декілька амінокислотних модифікацій можуть бути внесені в ділянку Fc антитіла, розглянутого в цьому документі, тим самим утворюючи варіант ділянки Fc. Варіант ділянки Fc може включати послідовність ділянки Fc людини (наприклад, ділянка Fc IgG1, IgG2, IgG3 або IgG4 людини), що містить амінокислотну модифікацію (наприклад, заміну) в одній або декількох амінокислотних позиціях. У певних варіантах здійснення винахід розглядає варіант антитіла, який має деякі, але не всі ефекторні функції, що робить його цільовим кандидатом для застосування, де час життя антитіла in vivo важливий, незважаючи на те, що певні ефекторні функції (такі як комплемент і ADCC) не є необхідними або шкідливо впливають. Аналізи цитотоксичності in vitro і in vivo можуть бути виконані для підтвердження зменшення/падіння активності CDC і/або ADCC. Наприклад, аналізи зв'язування Fc рецептора (FcR) можуть бути виконані, щоб пересвідчитися в тому, що у антитіла відсутня зв'язуюча FcγR активність (тим самим, мабуть, відсутня активність ADCC), але зберігається здатність зв'язування FcRn. Первинні клітини для опосередковування ADCC, клітини NK, експресують тільки FcRIII, в той час як моноцити експресують FcRI, FcRII і FcRIII. Дані по експресії FcR у гематопоетичних клітинах зведені в Таблицю 3 на сторінці 464 статті Ravetch і Kinet, Annu. Rev. Immunol. 9:457-492 (1991). Необмежені приклади аналізів in vitro за оцінкою активності ADCC являючої інтерес молекули описані в патенті США № 5500362 (див., наприклад, Hellstrom, I. et al. Proc. Nat'l Acad. Sci. USA 24 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 60 83:7059-7063 (1986)) і Hellstrom, I. et al. Proc. Nat'l Acad. Sci. USA 82:1499-1502 (1985); 5821337 (див. Bruggemann, M. et al., J. Exp. Med. 166:1351-1361 (1987)). Альтернативно можуть бути TM застосовані нерадіоактивні способи аналізу (див., наприклад, ACTI нерадіоактивний аналіз цитотоксичності для проточної цитометрії (Cell Technology, Inc. Mountain View, CA; і CytoTox 96® нерадіоактивний аналіз цитотоксичності (Promega, Madison, WI). Придатні ефекторні клітини для таких аналізів включають мононуклеарні клітини периферичної крові (PBMC) і клітини натуральних кілерів (NK). Альтернативно, або додатково, активність ADCC являючої інтерес молекули може бути оцінена in vivo, наприклад, в тваринній моделі, такій як описано в Clynes et al. Proc. Nat'l Acad. Sci. USA 95:652-656 (1998). Аналізи зв'язування C1q можуть бути також виконані для підтвердження того, що антитіло не здатне зв'язувати C1q і, отже, у нього відсутня активність CDC. Див., наприклад, ELISA зв'язування C1q і C3c в WO 2006/029879 і WO 2005/100402. Для оцінки активації комплемента може бути виконаний аналіз CDC (див., наприклад, Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996); Cragg, M.S. et al., Blood 101:1045-1052 (2003); і Cragg, M.S. і M.J. Glennie, Blood 103:2738-2743 (2004)). Зв'язування FcRn і визначення кліренсу/час життя in vivo можуть бути також виконані, використовуючи способи, відому в даній галузі техніки (див., наприклад, Petkova, S.B. et al., Int'l. Immunol. 18(12):17591769 (2006)). Антитіла із зниженою ефекторною функцією включають такі із заміною одного або декількох залишків ділянки Fc 238, 265, 269, 270, 297, 327 і 329 (патент США № 6737056). Такі мутанти Fc включають мутантів Fc із замінами в двох або більше амінокислотних позиціях 265, 269, 270, 297 і 327, включаючи так званий мутант Fc "DANA" із заміною залишків 265 і 297 на аланін (патент США № 7332581). Описані певні варіанти антитіла з поліпшеною або зниженою активністю зв'язування Fc (див., наприклад, патент США № 6737056; WO 2004/056312, і Shields et al., J. Biol. Chem. 9(2):6591-6604 (2001)). У певних варіантах здійснення винаходу варіант антитіла містить ділянку Fc із однією або декількома амінокислотними замінами, які поліпшують ADCC, наприклад, заміни в позиціях 298, 333 і/або 334 ділянки Fc (нумерація EU залишків). У деяких варіантах здійснення винаходу зміни внесені в ділянку Fc, що приводить до зміненого (тобто або поліпшеного, або зниженого) зв'язування C1q і/або комплемент-залежної цитотоксичності (CDC), наприклад, як описано в патенті США № 6194551, WO 99/51642 і Idusogie et al. J. Immunol. 164:4178-4184 (2000). Антитіла з підвищеними годинами життя і поліпшеним зв'язуванням із неонатальним рецептором Fc (FcRn), який відповідає за перенесення материнських IgG ембріону (Guyer et al., J. Immunol. 117:587 (1976) і Kim et al., J. Immunol. 24:249 (1994)) описані в US2005/0014934A1 (Hinton et al.). Ці антитіла включають ділянку Fc із однією або декількома замінами в ньому, що поліпшує зв'язування ділянки Fc з FcRn. Такі варіанти Fc включають такі із замінами в одному або декількох залишках ділянки Fc: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 або 434, наприклад, заміна залишку 434 ділянки Fc (патент США № 7371826). Див. також Duncan & Winter, Nature 322:738-40 (1988); патент США № 5648260; патент США № 5624821; і WO 94/29351 відносно інших прикладів варіантів ділянки Fc. d) Цистеїнові сконструйовані варіанти антитіла У певних варіантах здійснення потрібно створити цистеїнові сконструйовані антитіла, наприклад, "thioMAbs", в яких один або декілька залишків антитіла замінені залишками цистеїну. У приватних варіантах здійснення винаходу заміщені залишки знаходяться в доступних ділянках антитіла. Шляхом заміни цих залишків цистеїном реактивні тіолові групи, тим самим, розташовані в доступних ділянках антитіла і можуть бути використані для кон'югування антитіла зіншими молекулами, такими як молекули лікарських препаратів або зв'язаними із лінкером молекулами лікарських препаратів, для створення імунокон'югату, як описано далі в цьому документі. У певних варіантах здійснення винаходу будь-якого або декілька із нижченаведених залишків можуть бути замінені на цистеїн: V205 (нумерація Kabat) легкого ланцюга; A118 (нумерація EU) важкого ланцюга; і S400 (нумерація EU) ділянки Fc важкого ланцюга. Цистеїнові сконструйовані антитіла можуть бути створені, як описано, наприклад, в патенті США № 7521541. e) Похідні антитіл У певних варіантах здійснення винаходу представлене в цьому документі антитіло може бути додатково модифіковане з метою вмісту небілковоподібних молекул, відомих в даній галузі техніки і загальнодоступних. Молекули, придатні для отримання похідних антитіла, включають, крім іншого, водорозчинні полімери. Необмежені приклади водорозчиннних полімерів 25 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 включають, крім іншого, поліетиленгліколь (PEG), співполімери етиленгліколю/пропіленгліколю, карбоксиметилцелюлозу, декстран, полівініловий спирт, полівінілпіролідон, полі-1,3-діоксолан, полі-1,3,6-триоксан, співполімер етилену/малеїнового ангідриду, поліамінокислоти (або гомополімери, або випадкові співполімери), і декстран або полі(Nвінілпіролідон)поліетиленгліколь, гомополімери пропропіленгліколю, співполімери поліпропіленоксиду/етиленоксиду, поліоксіетилування поліоли (наприклад, гліцерол), полівініловий спирт і суміші вищепереліченого. Пропіональдегід поліетиленгліколю може мати переваги у виробництві внаслідок його стабільності у воді. Полімер може бути будь-якої молекулярної маси і може бути розгалуженим або нерозгалуженим. Число полімерів, прикріплених до антитіла, може варіювати, і якщо більше одного полімера приєднано, вони можуть бути однаковими або різними молекулами. У основному, число і/або тип полімерів, що використовуються для отримання похідних, можуть бути визначені, керуючись факторами, включаючи, крім іншого, певні властивості або функції антитіла, що підлягають удосконаленню, чи буде похідне антитіла використовуватися в терапії при певних умовах і т. п. У іншому варіанті здійснення винаходу розглянуті кон'югати антитіла і небілковоподібні молекули, які можуть бути селективно нагріті під дією радіаційного опромінення. У одному із варіантів здійснення винаходу небілковоподібною молекулою є вуглецева нанотрубка (Kam et al., Proc. Natl. Acad. Sci. USA 102:11600-11605 (2005)). Радіоактивне випромінювання може бути будь-якої довжини хвилі і містить, крім іншого, довжини хвиль, які не ушкоджують нормальні клітини, але які нагрівають небілковоподібні молекули до температури, при якій гинуть клітини, близькорозташовані до комплексу антитіло-небілковоподібна молекула. В. Рекомбінантні способи і композиції Антитіла можуть бути продуковані, використовуючи рекомбінантні способи і композиції, наприклад, як описано в патенті США № 4816567. У одному із варіантів здійснення винаходу представлена виділена нуклеїнова кислота, яка кодує антитіло проти мезотеліну, описане в цьому документі. Така нуклеїнова кислота може кодувати амінокислотну послідовність, що містить VL і/або амінокислотну послідовність, що містить VH антитіла (наприклад, легкий і/або важкий ланцюг антитіла). У додатковому варіанті здійснення винаходу представлений один або декілька векторів (наприклад, експресійні вектори), що містять таку нуклеїнову кислоту. У додатковому варіанті здійснення винаходу представлена клітина-хазяїн, що містить таку нуклеїнову кислоту. У одному із таких варіантів здійснення винаходу клітина-хазяїн містить (наприклад, була трансформована): (1) вектор, що містить нуклеїнову кислоту, яка кодує амінокислотну послідовність, що містить VL антитіла і амінокислотну послідовність, що містить VH антитіла, або (2) перший вектор, що містить нуклеїнову кислоту, яка кодує амінокислотну послідовність, що містить VL антитіла, і другий вектор, що містить нуклеїнову кислоту, яка кодує амінокислотну послідовність, що містить VH антитіла. У одному із варіантів здійснення винаходу клітина-хазяїн є еукаріотичною, наприклад, клітиною яєчника китайського хом'ячка (СНО) або лімфоїдною клітиною (наприклад, Y0, NS0, Sp20 клітиною). У одному із варіантів здійснення винаходу представлений спосіб створення антитіла проти мезотеліну, де спосіб містить культивування клітини-хазяїна, що містить нуклеїнову кислоту, що кодує антитіло, як розглянуто вище, в умовах, придатних для експресії антитіла, і в деяких випадках виділення антитіла із клітини-хазяїна (або із середовища культивування клітини-хазяїна). Для рекомбінантного продукування антитіла проти мезотеліну нуклеїнову кислоту, що кодує антитіло, наприклад, як описано вище, виділяють і вставляють в один або декілька векторів для подальшого клонування і/або експресії в клітині-хазяїні. Такі нуклеїнові кислоти можуть бути без особливих зусиль виділені і секвеновані, використовуючи загальноприйняті методики (наприклад, шляхом використання олігонуклеотидних зондів, які мають здатність специфічно зв'язуватися з генами, що кодують важкий і легкий ланцюг антитіла). Придатні клітини-хазяїни для клонування або експресії кодуючих антитіло векторів включають прокаріотичні або еукаріотичні клітини, описані вище. Наприклад, антитіла можуть бути продуковані в бактеріях, зокрема, коли немає необхідності в глікозилуванні і ефекторних функціях Fc. Для експресії фрагментів антитіла і поліпептидів в бактеріях див., наприклад, патенти США №№ 5648237, 5789199 і 5840523. (Див. також Charlton, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ, 2003), pp. 245-254, описуючі експресію фрагментів антитіла в Е. coli.) Після експресії антитіло може бути виділене із бактеріальної клітинної суспензії в розчинній фракції і може бути додатково очищено. Крім прокаріот еукаріотичні мікроби, такі як міцеліальні гриби або дріжджі, є придатними хазяїнами з точки зору клонування або експресії для кодуючих антитіло векторів, включаючи штами грибів і дріжджів, у яких шляхи глікозилування були "гуманізовані", зумовлюючи 26 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 60 продукування антитіла із частково або повністю патерном глікозилування людини. Див. Gerngross, Nat. Biotech. 22:1409-1414 (2004), і Li et al., Nat. Biotech. 24:210-215 (2006). Придатні клітини-хазяїни для експресії глікозилованого антитіла також отримують із багатоклітинних організмів (безхребетних і хребетних). Приклади клітин безхребетних включають клітини рослин і комах. Були ідентифіковані численні бакуловірусні штами, які можуть бути використані спільно з клітинами комах, зокрема, для трансфекції клітин Spodoptera frugiperda. Культури клітин рослин можуть також бути використані як хазяїни. Див., наприклад, патенти США №№ 5959177, 6040498, 6420548, 7125978 і 6417429 (що описують технологію TM PLANTIBODIES для продукування антитіл в трансгенних рослинах). Клітини хребетних можуть бути також використані як хазяїни. Наприклад, клітинні лінії ссавців, адаптовані для росту в суспензії, можуть бути придатними. Іншими прикладами придатних клітинних ліній-хазяїнів ссавців є трансформована SV40 лінія CV1 нирок мавпи (COS-7); лінія ембріональних нирок людини (293 або 293 клітини, як описано, наприклад, в Graham et al., J. Gen Virol. 36:59 (1977)); клітини нирок хом'ячків (BHK); мишачі клітини Сертолі (TM4 клітини, як описано, наприклад, в Mather, Biol. Reprod. 23:243-251 (1980)); клітини нирок мавпи (CV1); клітини нирок африканської зеленої мавпи (VERO-76); клітини карциноми шийки матки людини (HELA); клітини нирок собаки (MDCK); клітини печінки сірого щура (BRL 3A); клітини легені людини (W138); клітини печінки людини (HepG2); пухлина молочної залози миші (MMT 060562); клітини TRI, як описано, наприклад, в Mather et al., Annals N.Y. Acad. Sci. 383:4468 (1982); клітини MRC 5; і клітини FS4. Інші придатні клітинні лінії-хазяїни ссавців включають клітини яєчника китайського хом'ячка (СНО), включаючи клітини DHFR CHO (Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); і клітинна лінія мієломи, така як Y0, NS0 і Sp2/0. Для оглядового розгляду певних клітинних ліній-хазяїнів ссавців, придатних для продукування антитіл, див., наприклад, Yazaki and Wu, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ), pp. 255-268 (2003). С. Способи Антитіла проти мезотеліну, представлені в цьому документі, можуть бути ідентифіковані, відібрані або охарактеризовані за їх фізичними/хімічними властивостях і/або біологічними активностями за допомогою різних способів, відомих в даній галузі техніки. У одному із аспектів, антитіло за винаходом тестують на предмет його активності зв'язування антигену, наприклад, відомими способами, такими як ELISA, FACS або Вестернблот. У іншому аспекті, конкурентний аналіз може бути використаний для ідентифікації антитіла, яке конкурує із будь-яким із антитіл, описаних в цьому документі, за зв'язуванням із мезотеліном. У певних варіантах здійснення винаходу таке конкуруюче антитіло зв'язується із тим же самим епітопом (наприклад, лінійним або конформаційним епітопом), з яким зв'язується антитіло, описане в цьому документі. Докладні ілюстративні способи картування епітопу, з яким зв'язується антитіло, представлені в статті Morris (1996) "Epitope Mapping Protocols" Methods in Molecular Biology vol. 66 (Humana Press, Totowa, NJ). У типовому конкурентному аналізі іммобілізований мезотелін інкубують в розчині, що містить перше мічене антитіло, яке зв'язується із мезотеліном (наприклад, будь-яке із антитіл, описаних в цьому документі), і друге немічене антитіло, яке підлягає тестуванню на предмет його здатності конкурувати із першим антитілом за зв'язування з мезотеліном. Друге антитіло може знаходитися в супернатанті гібридоми. Як контроль іммобілізований мезотелін інкубують в розчині, що містить перше мічене антитіло, але не друге немічене антитіло. Після інкубації в умовах, що допускають зв'язування першого антитіла з мезотеліном, надлишок незв'язаного антитіла видаляють, і вимірюють кількість мітки, зв'язаної із іммобілізованим мезотеліном. Якщо кількість мітки, зв'язаної з іммобілізованим мезотеліном, істотно знижена в тестованому зразку відносно контрольного зразка, тоді це означає, що друге антитіло конкурує з першим антитілом за зв'язування з мезотеліном. Див. Harlow and Lane (1988) Antibodies: А Laboratory Manual ch.14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, NY). D. Імунокон'югати Винахід також являє імунокон'югати, що містять антитіло проти мезотеліну кон'юговане відповідно до цього документа із одним або декількома цитотоксичними агентами, такими як хіміотерапевтичні засоби або лікарські препарати, інгібітори росту, токсини (наприклад, білкові токсини, ферментативно активні токсини бактеріального, грибкового, рослинного або тваринного походження або їх фрагменти) або радіоактивні ізотопи. У одному із варіантів здійснення винаходу імунокон'югат являє собою кон'югат антитілалікарського препарату (ADC), в якому антитіло кон'юговане із одним або декількома лікарськими 27 UA 113838 C2 5 10 15 20 25 30 35 40 45 50 55 препаратами, включаючи, крім іншого, майтанзиноїд (див. патенти США №№ 5208020, 5416064 і Європейський патент EP 0 425 235 B1); ауристатин, такий як DE і DF групи лікарського препарату монометилауристатину (MMAE і MMAF) (див. патенти США №№ 5635483 і 5780588 і 7498298); доластатин; каліхеаміцин або його похідне (див. патенти США №№ 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001 і 5877296; Hinman et al., Cancer Res. 53:33363342 (1993); і Lode et al., Cancer Res. 58:2925-2928 (1998)); антрациклін, такий як дауноміцин або доксорубіцин (див., Kratz et al., Current Med. Chem. 13:477-523 (2006); Jeffrey et al., Bioorganic & Med. Chem. Letters 16:358-362 (2006); Torgov et al., Bioconj. Chem. 16:717-721 (2005); Nagy et al., Proc. Natl. Acad. Sci. USA 97:829-834 (2000); Dubowchik et al., Bioorg. & Med. Chem. Letters 12:1529-1532 (2002); King et al., J. Med. Chem. 45:4336-4343 (2002); і патент U.S. № 6630579); метотрексат; віндезин; таксан, такий як доцетаксел, паклітаксел, ларотаксел, тезетаксел і ортатаксел; трихотецен і СС1065. У іншому варіанті здійснення винаходу імунокон'югат включає антитіло, як описано в цьому документі, кон'юговане із ферментативно активним токсином або його фрагментом, включаючи, крім іншого, А-ланцюг дифтерійного токсину, які незв'язують активні фрагменти дифтерійного токсину, А-ланцюг екзотоксину (із Pseudomonas aeruginosa), А-ланцюг рицини, А-ланцюг абрину, А-ланцюг модецину, альфа-сарцин, білки Aleurites fordii, білки діантини, білки лаконосу американського (PAPI, PAPII і PAP-S), інгібітор момордики харантської, курцин, кротин, інгібітор Мильнянки лікарської, гелонін, мітогелін, рестриктоцин, феноміцин, еноміцин і трикотецени. У іншому варіанті здійснення винаходу імунокон'югат містить антитіло, як описано в цьому документі, кон'юговане із радіоактивним атомом з утворенням радіоактивного кон'югату. Цілий ряд радіоактивних ізотопів загальнодоступний для синтезу радіоактивних кон'югатів. Приклади 211 131 125 90 186 188 153 212 32 212 включають At , I , I , Y , Re , Re , Sm , Bi , P , Pb і радіоактивні ізотопи Lu. Коли радіоактивний кон'югат використовується для детекції, він може включати радіоактивний атом 123 для сцинтіографічних досліджень, наприклад, tc99m або I , або спінову мітку для ядерної магнітно-резонансної томографії (NMR) (також відомої як магнітно-резонансна томографія, mri), таку як йод-123, йод-131, індій-111, фтор-19, вуглець-13, азот-15, кисень-17, гадоліній, марганець або залізо. Кон'югати антитіла і цитотоксичного агента можуть бути створені, використовуючи біфункціональні білок-зшиваючі агенти, такі як N-сукцинімідил 3-(2-піридилдитіо)пропіонат (SPDP), сукцинімідил-4-(N-малеімідометил)циклогексан-1-карбоксилат (SMCC), імінотіолан (IT), біфункціональні похідні імідоефірів (такі як диметиладипімідат HCl), активні складні ефіри (такі як дисукцинімідилсуберат), альдегіди (такі як глутаральдегід), біс-азидо сполуки (такі як біс-(пазидобензоїл)гександіамін), похідні біс-діазонію (такі як біс-(п-діазонійбензоїл)етилендіамін), діізоціанати (такі як толуол-2,6-діізоціанат) і біс-сполуки активного фтору (такі як 1,5-дифтор-2,4динітробензол). Наприклад, рициновий імунотоксин можна отримувати, як описано в Vitetta et al., Science 238:1098 (1987). Ілюстративним хелатуючим агентом для кон'югації радіонукліда із антитілом є мічена по вуглецю-14 1-ізотіоціанатбензил-3-метилдіетилен триамінпентаоцтова кислота (MX-DTPA). Див. WO94/11026. Лінкер може бути "розщеплюваний лінкер", що полегшує вивільнення цитотоксичного лікарського препарату в клітину. Наприклад, кислотний лабільний лінкер, пептидаза-чутливий лінкер, фотолабільний лінкер, диметильний лінкер або дисульфідвмісний лінкер (Chari et al., Cancer Res. 52:127-131 (1992); патент США № 5208020) можуть бути використані. Імунокон'югати або ADC в цьому документі спеціально розглянуті, не обмежуючись такими кон'югатами, приготованими за допомогою перехресно-зшиваючих реагентів, включаючи, крім іншого, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфоSMCC і сульфо-SMPB і SVSB (сукцинімідил-(4-вінілсульфон)бензоат), які є комерційно доступними (наприклад, в Pierce Biotechnology, Inc., Rockford, IL., U.S.A). Імунокон'югати, які містять ауристатини і доластатини У деяких варіантах здійснення винаходу імунокон'югат містить антитіло за винаходом, кон'юговане з доластатином або пептидним аналогом або похідним доластатину, наприклад, ауристатином (патенти США №№ 5635483; 5780588). Показано, що доластатини і ауристатини перешкоджають динамічній активності мікротрубочок, гідролізу ГТФ і поділу ядра і клітини (Woyke et al. (2001) Antimicrob. Agents and Chemother. 45(12):3580-3584) і мають протипухлинну (патент США № 5663149)і протигрибкову активність (Pettit et al., (1998) Antimicrob. Agents Chemother. 42:2961-2965). Молекула лікарського засобу доластатину або ауристатину може бути приєднана до антитіла через N(аміно)кінець або С(карбоксильний)кінець пептидної групи лікарського засобу (WO 02/088172). 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAnti-mesothelin antibodies and immunoconjugates
Автори англійськоюDennis, Mark, Scales, Suzanna J., Spencer, Susan D., Zhang, Yin
Автори російськоюДеннис Марк, Скэйлс Сюзанна Дж., Спенсер Сьюзан Д., Чжан Инь
МПК / Мітки
МПК: A61K 39/395, C07K 16/30
Мітки: яке, мезотелін, зв'язує, антитіло, імунокон'югат
Код посилання
<a href="https://ua.patents.su/108-113838-antitilo-yake-zvyazueh-mezotelin-ta-imunokonyugat.html" target="_blank" rel="follow" title="База патентів України">Антитіло, яке зв’язує мезотелін, та імунокон’югат</a>
Попередній патент: Зубчастий механізм вимірювального приладу та електронно-механічний та механічний годинники з таким механізмом
Наступний патент: Очний розчин, який містить диквафозол, спосіб його отримання і спосіб інгібування утворення нерозчинного осаду
Випадковий патент: Польовий грунтовий твердомір конструкції тарасенка-бабицького












