Моноклональне антитіло, химерне антитіло, повністю гуманізоване антитіло, антитіло до антиідіотипічного антитіла або його фрагмент до рецептора ліпопротеїнів низької щільності (лпнщ) людини, спосіб їх одержання
Номер патенту: 78489
Опубліковано: 10.04.2007
Автори: Антонетті Франческо, Суісса Дані, Смоларскі Моше, Бельзер Ілана, Дреано Мішель, Йонах Начум
Формула / Реферат
1. Моноклональне антитіло, химерне антитіло, повністю гуманізоване антитіло, антитіло до антиідіотипічного антитіла або його фрагмент, що специфічно розпізнає і зв'язує розчинний рецептор ліпопротеїнів низької щільності (ЛПНЩ)людини і його фрагменти, а також здатне інгібувати реплікацію вірусу гепатиту С, і яке одержують шляхом імунізації тварин формою +291 розчинного рецептора ЛПНЩ людини, тобто формою розчинного рецептора людини, що містить амінокислотну послідовність від Asp+4 до Glu+291 послідовності розчинного рецептора ЛПНЩ людини, за винятком моноклонального антитіла С7.
2. Моноклональне антитіло за п. 1, де моноклональне антитіло продукується гібридомним клоном 12.6, депонованим у CNCM під № 1-2390, гібридомним клоном 28, депонованим у CNCM під № 1-2391, гібридомним клоном 29.8, депонованим у CNCM під № 1-2392.
3. Моноклональне антитіло за п. 1, яке експресується гібридомним клоном 12.6, депонованим у CNCM під № 1-2390.
4. Моноклональне антитіло за п.1, яке експресується гібридомним клоном 28, депонованим у CNCM під № 1-2391.
5. Моноклональне антитіло за п.1, яке експресується гібридомним клоном 29.8, депонованим у CNCM під № 1-2392.
6. Моноклональне антитіло за п.1, яке експресується гібридомним клоном 30, депонованим у CNCM під № 1-2393.
7. Моноклональне антитіло за п.1, яке експресується гібридомним клоном 50.30, депонованим у CNCM під № 1-2394.
8. Моноклональне антитіло за будь-яким з пп.1-7, яке належить до імуноглобуліну ізотипу IgG1 або IgM.
9. Гібридомний клон 12.6, депонований у CNCM під № 1-2390.
10. Гібридомний клон 2 8, депонований у CNCM під № 1 -2391.
11. Гібридомний клон 29.8, депонований у CNCM під № 1-2392.
12. Гібридомний клон 30, депонований у CNCM під № 1-2393.
13. Гібридомний клон 50.30, депонований у CNCM під № 1-2394.
14. Спосіб виявлення і/або кількісного визначення розчинного рецептора ЛПНЩ людини, який включає використання моноклонального антитіла за будь-яким з пп. 1-8.
15. Спосіб одержання моноклонального антитіла за п.1, що передбачає вирощування клонованої гібридоми за будь-яким з пп. 9-13, яка містить клітини селезінки ссавця, імунізованого високоочищеною формою +291 розчинного рецептора ЛПНЩ людини, тобто формою розчинного рецептора людини, що містить амінокислотну послідовність від Asp+4 до Glu+291 послідовності розчинного рецептора ЛПНЩ людини, і гомогенні або гетерогенні лімфоїдні клітини, у рідкому середовищі або черевній порожнині ссавця з одержанням гібридоми для продукції і накопичення моноклональних антитіл.
16. Спосіб очищення рецептора ЛПНЩ людини, що передбачає контактування матеріалу, який містить неочищений рецептор ЛПНЩ людини, і моноклонального антитіла за будь-яким з пп. 1-8 або моноклонального антитіла, одержаного способом за п.15.
17. In vitro спосіб інгібування реплікації вірусу гепатиту С, що передбачає контактування клітин з моноклональним антитілом за пп. 1-8 перед інфікуванням вірусом гепатиту С для інгібування реплікації вірусу гепатиту С в клітинах.
18. Застосування моноклонального антитіла за будь-яким з пп. 1-8 як лікарського засобу.
19. Застосування моноклонального антитіла за будь-яким з пп. 1-8 для одержання лікарського засобу для лікування інфекції, викликаної вірусом гепатиту С.
Текст
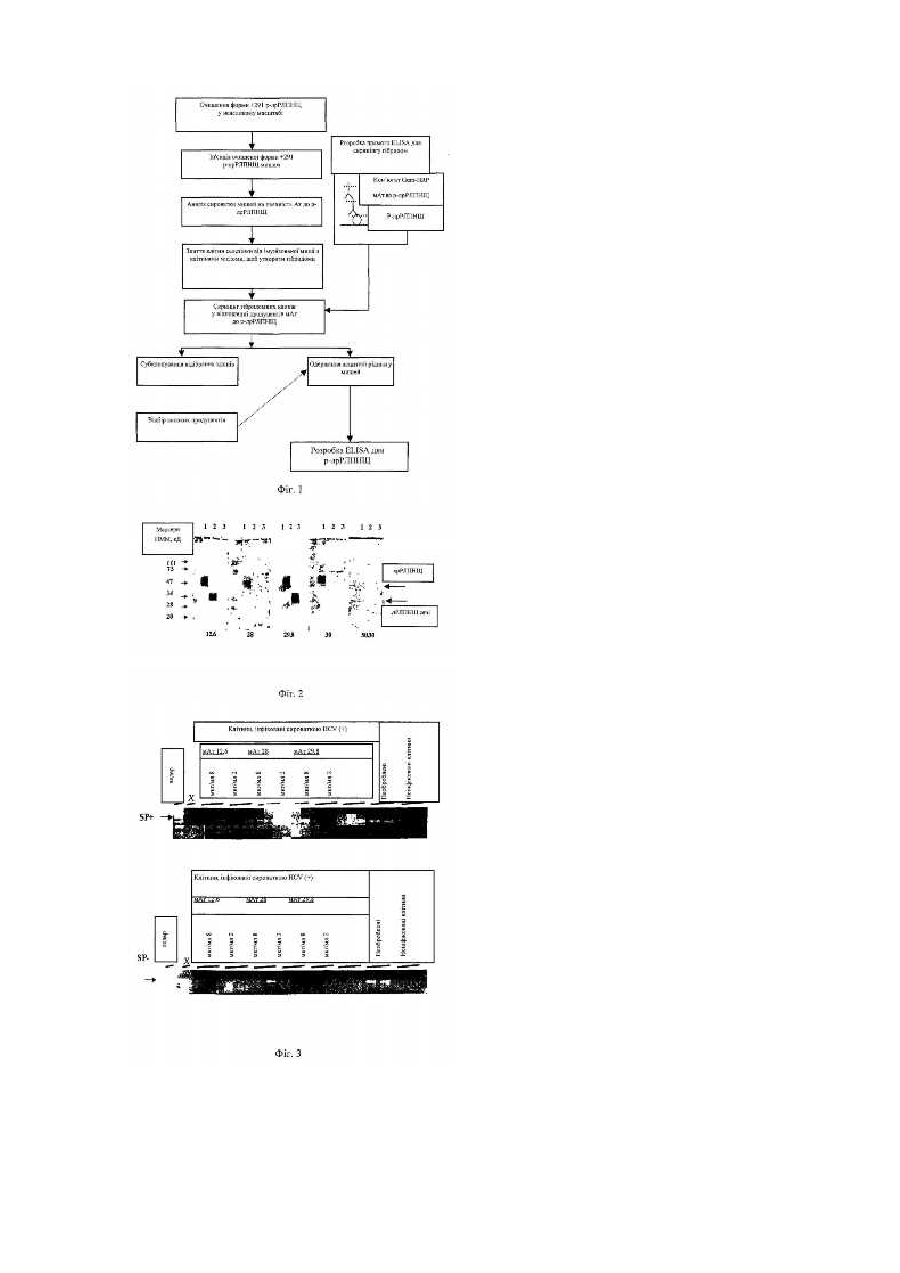
Даний винахід відноситься до моноклональних антитіл, які специфічно впізнають рецептор ліпопротеїдів низької щільності (РЛПНЩ) людини. Вказані антитіла застосовні, наприклад, для ідентифікації і очищення розчинного РЛПНЩ людини (лр-РЛПНЩ) в процесах одержання, а також при ідентифікації і лікуванні таких захворювань, як гепатит С (HCV). Холестерин, компонент всіх еукаріотичних плазматичних мембран, важливий для зростання і життєздатності клітин вищих організмів. Однак високі рівні холестерину в сироватці є причиною захворювання і смерті внаслідок участі в утворенні атеросклеротичних бляшок в артеріях по всьому організму. Основним місцем синтезу холестерину у ссавців є печінка. Істотні кількості холестерину також утворюються в кишечнику. На швидкість утворення холестерину цими органами у високій мірі впливає кількість холестерину, поглиненого з харчових джерел. Клітини поза печінкою і кишечником одержують холестерин з плазми, а не шляхом синтезу de novo. Холестерин і інші ліпіди транспортуються в рідинах організму ліпопротеїдами, які класифікують відповідно до зростання щільності. Ліпопротеїд являє собою частинку, що складається з кора гідрофобних ліпідів, оточеного оболонкою з полярних ліпідів і апопротеїнів. Вказані ліпопротеїди грають дві ролі: вони солюбілізують сильно гідрофобні ліпіди, і вони містять сигнали, які регулюють переміщення конкретних ліпідів в специфічні клітини-мішені і тканини і з них. Холестерин транспортується в рідинах організму ліпопротеїдами низької щільності (ЛПНЩ), які зв'язуються зі специфічним рецептором на плазматичній мембрані непечінкових клітин. Потім комплекс рецептор-ЛПНЩ інтерналізується в клітини внаслідок механізму транспорту, відомого як опосередкований рецепторами ендоцитоз (Goldstein et al. 1979). Рецептор ліпопротеїду низької щільності (ЛПНЩ) є прототипом сімейства структурно близьких рецепторів клітинної поверхні, які опосередковують ендоцитоз численних лігандів в клітинах ссавців. Рецептор ЛПНЩ складається з 822 амінокислотних залишків і має молекулярну масу 164000. Він побудований з декількох доменів, послідовності деяких з яких гомологічні послідовностям інших білків. NH2кінець зв'язуючого ліганд домену рецептора складається із 292 залишків, організованих в 7 багатих цистеїном неповних повторів. Кожний повтор складається їх шести залишків цистеїну, які пов'язані дисульфідними зв'язками за принципом перший з третім, другий з п'ятим і четвертий з шостим (Bieri et al. 1995). За вказаним доменом слідує чотири додаткових домени: перший складається з 400 амінокислотних залишків і гомологічний рецептору EGF, другий складається з 58 амінокислотних залишків, багатих О-пов'язаним цукром, третій являє собою окремий трансмембранний домен з 22 амінокислотних залишків і четвертий є цитоплазматичним доменом з 50 амінокислотних залишків (Sudhof et al. 1985), (Brown et al. 1986). Фізіологічне значення рецептора ЛПНЩ було показане в дослідженнях Brown and Goldstein на сімейній гіперхолестеринемії (FH). Було виявлено, що захворювання є наслідком молекулярно-генетичного дефекту, результатом якого є відсутність або недостатність функціональних рецепторів ЛПНЩ (Brown et al. 1976). Було охарактеризовано декілька класів FH-мутацій (Goldstein et al. 1975). Розчинна форма рРЛПНЩ, що виявляє антивірусну активність, була ідентифікована і виділена з надосаду культури індукованих інтерфероном клітин (Fischer et al. 1993) і в рідинах організму (Fischer et al. 1994). Було ідентифіковано декілька білків, що індукуються інтерфероном, які ефективні в індукції антивірусного стану за допомогою IFN. Один з таких білків, що виявляють антивірусну активність, продукували і накопичували в надосаді культури клітин WISH амніону людини. Вказаний білок очищали до гомогенності і ідентифікували як рРЛПНЩ (дивись ЕР 0553667 і Fischer et al. 1993). Виявлено, що рРЛПНЩ секретується в середовище клітинами ссавців, які переходять в антивірусний стан у відповідь на інтерферон. На відміну від інтерферону рРЛПНЩ не індукує антивірусний стан в клітинах, але є противірусним сам по собі. Виявлено, що рРЛПНЩ, мабуть, повинен бути присутнім в ході процесу вірусної реплікації, дозрівання і відділення від клітини верху, що свідчить про те, що він може бути залучений до складного процесу, який приводить до інгібування збирання вірусу або його відділення від клітини (неопубліковані дані). Нещодавно на клітинах, що культивуються, було показано, що ендоцитоз вірусу гепатиту С опосередкований рецепторами ЛІШЩ (Agnello et al. 1999). Вказані і інші дані свідчать про те, що сімейство рецепторів ЛПНЩ може служити як рецепторів вірусів. Тому антитіла, вироблені проти рецептора рРЛПНЩ, можуть блокувати вхід і відділенням від клітини вірусних частинок за допомогою скріплення з клітинним рецептором ЛПНЩ. Єдиним відомим антитілом моноклональним до РЛПНЩ, що є в цей час, є С7, антитіло до РЛПНЩ бика (Beisiegel et al. 1981, комерційно доступне з Amersham, UK), яке одержували імунізацією мишей РЛПНЩ кори надниркової залози бика, очищеній до гомогенності. Розчиняли мембрани кори надниркової залози бика, і рецептор частково очищали елююванням з колонки з DEAE-целюлозою (Beisiegel et al. 1981). Антитіло до РЛПНЩ бика тільки слабо перехресно реагує з РЛПНЩ людини. Насправді було виявлено, що мАт С7 до РЛПНЩ бика має істотні недоліки у разі застосування для виявлення і кількісної оцінки рекомбінантного РЛПНЩ людини: a) антитіло володіє дуже низькою спорідненістю до РЛПНЩ людини, b) воно значною мірою перехресно реагує з домішками, одержаними з культури клітин. Специфічні антитіла до РЛПНЩ людини раніше не були доступні. Це здається несподіваним, оскільки загально прийнято виробляти антитіла проти нових білків, використовувати їх для очищення, ідентифікації або з метою розробки аналізів. Можливо, що такі антитіла не були створені до цього часу, оскільки умовою для одержання моноклональних антитіл є наявність досить великих кількостей високо очищеного антигену, які дозволяють провести ефективну імунізацію мишей. Високо очищеним антигеном є антиген, який видний у вигляді окремого основного піка при ОФ-ВЕРХ. Крім того, важко було розробити способи ідентифікації і кількісної оцінки антигену в ході процесу очищення. Згідно з винаходом описаний тут аналіз антивірусної активності застосовували для ідентифікації РЛПНЩ в ході процесу очищення. Існує необхідність в створенні специфічних мАт до розчинного РЛПНЩ людини, щоб одержати засоби для розробки ефективного імуноаналізу (ELISA) і для ідентифікації білка на Вестерн-блоті. Вказані антитіла необхідні для моніторингу і кількісного аналізу рекомбінантного розчинного РЛПНЩ людини в ході розробки способів одержання і очищення рекомбінантного білка і для виявлення природного білка. Даний винахід дозволяє створювати лінії клітин гібридом, які продукують моноклональні антитіла, здатні специфічно впізнавати і зв'язувати рецептор ЛПНЩ людини, або їх фрагменти. Більш конкретно даний винахід дозволяє створювати лінії клітин гібридом, які продукують моноклональні антитіла, здатні специфічно впізнавати і зв'язувати розчинний рецептор ЛПНЩ людини. Таким чином, даний винахід відноситься в моноклонального антитіла, химерного антитіла, гуманізованого антитіла, анти-анти-Id-антитіла або його фрагмента, яке специфічно впізнає і зв'язує рецептор ЛПНЩ людини, і його фрагменти, за винятком моноклонального антитіла С7. Даний винахід відноситься до таких моноклональних антитіл, які впізнають і зв'язують розчинний РЛПНЩ людини і задовольняють наступним вимогам: 1. мАт, які можна використовувати як пари у ELISA, наприклад, ELISA (твердофазний імуноферментний аналіз) методом "сендвіча" для виявлення розчинного РЛПНЩ людини. 2. мАт, які можна використовувати для ідентифікації РЛПНЩ при аналізі Вестерн-блотів. 3. мАт, які можна використовувати для нейтралізації антивірусної біологічної активності розчинного РЛПНЩ людини. 4. мАт, які можна використовувати для інгібування вірусної інфекції, такої як HCV. Даний винахід, крім того, відноситься до способу виявлення і/або кількісної оцінки РЛПНЩ людини, який включає в себе застосування специфічних моноклональних антитіл згідно з винаходом способом, відомим для застосування у таких цілях. Даний винахід також відноситься до клонованої гібридоми, що містить клітину селезінки ссавця, імунізованого рекомбінантним РЛПНЩ людини, і гомологічну або гетерологічну лімфоїдну клітину. Моноклональне антитіло згідно з винаходом одержують традиційним способом, наприклад, вирощуванням клонованої гібридоми, що включає в себе клітину селезінки ссавця, імунізованого лрЛПНЩ, і гомологічну або гетерологічну лімфоїдну клітину, у рідкому середовищі або черевній порожнині ссавця, щоб забезпечити можливість для того, щоб гібридома продукувала і накопичувала моноклональне антитіло. У ще одному аспекті винахід відноситься до способу очищення РЛПНЩ людини, який включає в себе забезпечення контакту матеріалу, що містить неочищений РЛГШЩ , з моноклональним антитілом згідно з винаходом. Як стадію афінного очищення у способі очищення рекомбінантного білка можна використовувати колонку з адсорбованим моноклональним антитілом, специфічним по відношенню до РЛПНЩ. Спосіб виявлення і вимірювання рекомбінантного РЛПНЩ людини, який включає в себе застосування як антитіла моноклональних антитіл згідно з даним винаходом в аналізі ELISA, як описано в прикладі 5. Як РЛПНЩ або фрагмент РЛПНЩ для імунізації тварин можна використати будь-який РЛПНЩ, за умови, що він є РЛПНЩ теплокровного ссавця. Також можна використати мутеїн РЛПНЩ. Типовим прикладом такого розчинного РЛПНЩ ссавця людини є розчинна форма РЛПНЩ +291, яка містить амінокислотну послідовність, починаючи з амінокислоти Asp в положенні +4 і закінчуючи амінокислотою Glu в положенні +291 послідовності РЛПНЩ людини, а також можна використати іншу форму, таку як форма +292 і т.д. Короткий опис фігур На Фіг.1 показана схема послідовності операцій, що зображає розробку моноклональних антитіл до рлрРЛПНЩ. На Фіг.2 показаний Вестерн-блот-аналіз форми +291 р-лрРЛПНЩ на доріжці 1, лрРЛПНЩ сечі на доріжці 2 і рекомбінантного рецептора TNP р55 людини як негативний контроль (р-лТВР-1) на доріжці 3 за допомогою моноклональних антитіл, вказаних під кожною смужкою. Стрілки з лівого боку фігури вказують положення маркерів молекулярної маси, а стрілками з правого боку фігури відмічене положення форми лрРЛПНЩ, вказаної над кожною стрілкою. На Фіг.3 показаний вплив мАт 12.6, 28 і 29.8 на продукцію (+)- і (-)-ланцюгів HCV в культурі FT167. Клітини обробляли за 30 хвилин до інфекції мАт проти РЛПНЩ (8 або 2мкг/мл). Потім клітини протягом ночі інфікували 25мкл сироватки HCV(+) (№42; lb). Через день після інфекції проводили три промивання, і додавали нове середовище, і міняли його кожні 48 годин. Через п'ять днів після інфекції збирали гепатоцити, очищали РНК, і 1мкг клітинної РНК аналізували за допомогою rTth-OT-ПЛР (Perkin Elmer). Аналізи виконували в двох повторах. +SP: аналіз позитивного ланцюга РНК; - SP: аналіз негативного ланцюга РНК; X: пустий контроль. Одержали моноклональні антитіла (мАт) до розчинного РЛПНЩ людини (лрРЛПНЩ). Використовуючи одержані моноклональні антитіла розробили спосіб ELISA і Вестерн-блотингу для ідентифікації лрРЛПНЩ і аналізу на основі нейтралізації антивірусної активності лрРЛПНЩ. мАт виробляли у мишей, імунізованих рекомбінантною формою лрРЛПНЩ +291, яка складається з Nкінцевого зв'язуючого ліганд домену розчинної РЛПНЩ людини від Asp +4 до Glu +291. Рекомбінантну форму лрРЛПНЩ +291 продукували в клітинах СНО і очищали до гомогенності. Імунізовані миші продукували значні титри специфічних антитіл. Після скринінгу гібридом п'ять клонів були ідентифіковані як найбільш високопродуктивні продуценти антитіл (номери 12, 28, 29, 30 і 50). Вказані клони були вибрані для подальшого субклонування. Після субклонування виділили 29 субклонів, які мали високу продуктивність антитіл, і ампули вихідних клонів і субклонів заморожували. Вибирали пару моноклональних антитіл для ELISA р-лрРЛПНЩ. мАт 28 вибрали як покриваюче антитіло, і мАт 29.8, мічене біотином, вибрали як друге антитіло. Виявлено, що мАт 12.6 і 29.8 підходять для ідентифікації нативного і рекомбінантного лрРЛПНЩ у Вестерн-блот-аналізі, і виявлено, що мАт 28 і 30 підходять для ідентифікації рекомбінантного лрРЛПНЩ у Вестерн-блот-аналізі. Виявлено, що мАт 12.6 і 50.30 підходять для інгібування антивірусної активності лрРЛПНЩ. Згідно з винаходом також було виявлено, що мАт 12.6, 28 і 29.8 інгібують реплікацію генома вірусу гепатиту С (HCV) в первинних культурах гепатоцитів людини. Таким чином, вказані антитіла можна використати для лікування гепатиту С (Фіг.3). Визначили підкласи ізотипів мАт, продукованих клонами. Клони 12.6, 28, 29.8 і 30 ідентифікували як IgG1тоді як виявлено, що клон 50.30 являє собою IgM. мАт, вироблені проти форми лрРЛПНЩ +291, в ELISA і Вестерн-блот-аналізі також впізнавали інші форми лрРЛПНЩ, а саме форму р-лрРЛПНЩ +292 і форму +331, продуковані в рекомбінантних клітинах СНО. Форма +292 містить N-кінцеву частину рецептора від амінокислотного залишку Asp +4 до Cys +292, а форма +331 містить N-кінцеву частину рецептора від амінокислотного залишку Asp +4 до Cys +331. Антиген, що використовується для імунізації мишей для того, щоб одержати моноклональні антитіла, являв собою форму р-лрРЛПНЩ +291, яка була одержана в клітинах СНО. Продукування р-лрРЛПНЩ виконували в біореакторах, використовуючи систему матриці Fibracel, в стаціонарній фазі. р-лрРЛПНЩ очищали до гомогенного стану і використовували для імунізації мишей. Імунні клітини селезінки найкращим чином реагуючої миші використовували для злиття і створення гібридом. Що стосується антитіл, що згадуються протягом даного опису, мається на увазі, що термін «моноклональне антитіло» включає в себе моноклональні антитіла, химерні антитіла, повністю гуманізовані антитіла, антитіла до анти-ідіотипових антитіл (анти-анти-Іd-антитіло), які можна мітити в розчинній або пов'язаній формі, а також їх фрагменти, що одержуються будь-яким відомим способом, таким як ферментативне розщеплення, пептидний синтез або рекомбінантні технології, але не обмежені вказаними способами. Моноклональне антитіло містить в основному гомогенну популяцію антитіл, специфічних по відношенню до антигенів, і ці популяції містять в основному схожі сайти скріплення епітопу. мАт можна одержати способами, відомими фахівцям в даній області. Дивись, наприклад, [Kohler and Milstein, Nature, 256: 495-497 (1975); патент США №4376110; Ausubel et al., eds., Harlow and Lane ANTIBODIES: A LABORATORY MANUAL, Cold Spring Harbor Laboratory (1988); і Colligan et al., eds., Current Protocols in Immunology, Greene Publishing Assoc. and Wiley Interscience N. Y., (1992-1996)], зміст яких повністю включений тут у вигляді посилання. Такими антитілами можуть бути імуноглобуліни будь-якого класу, включаючи IgG, IgM, IgE, IgA, GILD і будьякого їх підкласу. Гібридому, яка продукує мАт згідно з даним винаходом, можна культивувати in vitro, in situ або in vivo. Одержання високих титрів мАт in vivo або in situ робить цей спосіб переважним в цей час способом одержання. Химерні антитіла є молекулами, різні частини яких одержані від різних видів тварин, такими як молекули, що мають варіабельну область, одержану з мишачого мАт і константну область імуноглобуліну людини. Химерні антитіла головним чином використовують для зменшення імуногенності при застосуванні і для збільшення виходу продукції, наприклад, в тих випадках, коли мишачі мАт мають більш високі виходи з гібридом, але більш високу імуногенність у людей, використовують таких химерні людина/миша мАт. Химерні антитіла і способи їх одержання відомі в даній області [Cabilly et al., Proc. Natl. Acad. Sci. USA 81:3273-3277 (1984); Morrison et al., Proc. Natl. Acad. Sci. USA 81: 6851-6855 (1984); Boulianne et al., Nature 312: 643-646 (1984); Cabilly et al., Європейська заявка на патент 125023 (опублікована 14 листопада 1984); Neuberger et al., Nature 314: 268-270 (1985); Taniguchi et al., Європейська заявка на патент 171496 (опублікована 19 лютого 1985); Morrison et al., Європейська заявка на патент 173494 (опублікована 5 березня 1986); Neuberger et al., заявка РСТ WO 8601533 (опублікована 13 березня 1986); Kudo et al., Європейська заявка на видачу патенту 184187 (опублікована 11 червня 1986); Sahagan et al., J. Immunol. 137: 1066-1074 (1986); Robinson et al., міжнародна заявка на патент № W08702671 (опублікована 7 травня 1987); Liu et al., Proc. Natl. Acad. Sci USA 84: 3439-3443 (1987); Sun et al., Proc. Natl. Acad. Sci USA 84: 214-218 (1987); Better et al., Science 240: 10411043 (1988); Riechmann et al., Nature 332: 323-327, і Harlow and Lane, ANTIBODIES: A LABORATORY MANUAL], вище. Вказані публікації включені тут у вигляді посилання в повному обсязі. «Повністю гуманізовані антитіла» являють собою молекули, що містять як варіабельну, так і константну області імуноглобуліну людини. Повністю гуманізовані антитіла потенційно можна використати для терапевтичного застосування, при якому потрібні повторні обробки у разі хронічних і рецидивуючих захворювань, таких як аутоімунні хвороби. Один спосіб одержання повністю гуманізованих антитіл складається в «гуманізації» мишачої гуморальної імунної системи, тобто в одержанні ліній мишей, здатних продукувати Ig людини (ксеномиші), шляхом введення локусів імуноглобулінів (Ig) людини мишам, у яких інактивовані ендогенні гени Ig. Локуси Ig є надзвичайно складними за своєю фізичною структурою, і необхідні процеси перебудови генів і експресії для того, щоб в кінцевому результаті продукувати широку імунну відповідь. Різноманітність антитіл головним чином створюється внаслідок заснованої на комбінованій перебудові різних генів V, D і J, присутніх в локусах Ig. Вказані локуси також містять розсіяні регуляторні елементи, які контролюють експресію антитіл, алельне виключення, перемикання класів і розвиток афінності. Введення мишам неперебудованих трансгенів Ig людини показало, що апарат рекомбінації у мишей сумісний з генами людини. Крім того, гібридоми, які секретують специфічні для антигену hu-мАт різних ізотипів, можна одержати шляхом імунізації ксеномишей антигеном. Повністю гуманізовані антитіла і способи їх одержання відомі в даній області [Mendez et al.. Nature Genetics 15: 146-156 (1997); Buggemann et al., Eur. J. Immunol. 21: 1323-1326 (1991); Tomizuka et al., Proc. Natl. Acad. Sci. USA 97: 722-727 (2000), заявка на патент WO 98/24893]. Антиідіотипове (анти-Id) антитіло являє собою антитіло, яке впізнає унікальні детермінанти, як правило, пов'язані з антигензв'язуючим сайтом антитіла, Id-антитіло можна одержати імунізацією тварини того ж виду і генетичного типу (наприклад, лінія мишей), що і джерело мАт, до якого одержують анти-Id-антитіло. Імунізована тварина буде розпізнавати і відповідати на ідіотипові детермінанти імунізуючого антитіла продукцією антитіла до даних ідіотипових детермінантів (анти-Id-антитіла). Дивись, наприклад, [патент США №4699880], який включений тут у вигляді посилання в повному обсязі. Анти-ld-антитіло також можна використати як «імуноген», щоб індукувати імунну відповідь ще і у іншої тварини, яка продукує так зване анти-анти-Id-антитіло. Анти-анти-ld-антитіло за епітопами може бути ідентичне вихідному мАт, яке індукувало анти-Id-антитіло. Таким чином, використовуючи антитіла до ідіотипових детермінантів мАт, можна ідентифікувати інші клони, які експресують антитіла ідентичної специфічності. Таким чином, мАт, створені проти РЛПНЩ, їх ізоформи, аналоги, фрагменти або похідні згідно з винаходом можна використати для індукції анти-Id-антитіл у відповідних тварин, таких як миші BALB/c. Клітини селезінки таких імунізованих мишей використовують для одержання анти-Id-гібридом, які секретують анти-IdмАт. Крім того, анти-Id-мАт можна зв'язати з носієм, таким як гемоціанін морського блюдця «замкова щілина» (KLH), і використати для імунізації наступних мишей BALB/c. Сироватка таких мишей буде містити анти-антиId-антитіла, які володіють зв'язуючими властивостями вихідного мАт, специфічного по відношенню до епітопу вказаного вище білка РЛПНЩ, або його аналогів, фрагментів і похідних. Таким чином, анти-Id-мАт мають свої власні ідіотипові епітопи, або «ідіотопи», структурно схожі з епітопом, що оцінюється. Також мається на увазі, що термін «моноклональне антитіло» включає в себе як інтактні молекули, так і його фрагменти, наприклад, такі як Fab і F(ab')2, які здатні зв'язувати антиген. Фрагменти Fab і F(ab')2 не мають Fc-фрагмента інтактного антитіла, швидше виводяться з циркуляції і можуть менше зазнавати неспецифічного скріплення в тканинах, ніж інтактне антитіло [Wahl et al., J. Nuncl. Med. 24: 316-325 (1983)]. Буде зрозуміло, що Fab і F(ab')2 і інші фрагменти антитіл, застосовних в даному винаході, можна використати для виявлення і кількісного аналізу білка РЛПНЩ згідно з описаними тут способами для інтактних молекул антитіл. Такі фрагменти звичайно одержують протеолітичним розщепленням з використанням таких ферментів, як папаїн (щоб одержати Fab-фрагменти) або пепсин (щоб одержати Р(аЬ')2-фрагменти). Кажуть, що моноклональне антитіло «здатне до скріплення» молекули, якщо воно здатне специфічно вступати в реакцію з молекулою, тим самим зв'язуючи молекулу з антитілом. Мається на увазі, що термін «епітоп» відноситься до тієї частини якої-небудь молекули, яка може зв'язуватися антитілом, яке також може упізнаватись таким антитілом. Епітопи або «антигенні детермінанти» звичайно складаються з хімічно активних поверхневих груп молекул, таких як бічні ланцюги амінокислот або цукрів, і володіють специфічними характеристиками третинної структури, а також специфічними характеристиками заряду. «Антиген» є молекулою або частиною молекули, яка може зв'язуватися антитілом, і цей антиген, крім того, здатний індукувати тварину до продукції антитіла, здатного зв'язуватися з епітопом даного антигену. Антиген може мати один або декілька епітопів. Мається на увазі, що вищезгадана специфічна реакція означає, що антиген буде реагувати з високою мірою вибірковості з епітопом на відповідному йому антитілі, але не з множиною інших антитіл, які можуть бути викликані іншими антигенами. Антитіла, включаючи фрагменти антитіл, застосовні в даному винаході, можна використати для кількісного або якісного виявлення в зразку білків РЛПНЩ або для виявлення наявності клітин, які експресують білки РЛПНЩ згідно з даним винаходом. Це можна виконати імунофлуоресцентними способами із застосуванням флуоресцентно міченого антитіла (дивись далі), разом з флуоресцентною мікроскопією, проточною цитометрією або флуориметричним визначенням. Антитіла (або їх фрагменти), застосовні в даному винаході, можна використати в гістологічних дослідженнях, як наприклад, при імунофлуоресцентній або імуноелектронній мікроскопії, для виявлення білків РЛПНЩ згідно з даним винаходом in situ. Виявлення in situ можна виконати за допомогою витягання гістологічного зразка з організму пацієнта і внесення в такий зразок міченого антитіла згідно з даним винаходом. Антитіло (або фрагмент) переважно вносять шляхом нанесення або покриття біологічного зразка міченим антитілом (або фрагментом). Завдяки застосуванню такого способу можна визначити не тільки наявність білків РЛПНЩ, але і їх розподіл в тканині, що досліджується. Використовуючи даний винахід, фахівці в даній області легко зрозуміють, що можна модифікувати будь-який з широкої множини гістологічних способів (таких як способи фарбування), для того, щоб досягнути такого виявлення in situ. Такі аналізи білків РДПНП згідно з даним винаходом звичайно включають в себе Інкубацію біологічного зразка, такого як біологічна рідина, тканинний екстракт, свіжозібрані клітини, такий як лімфоцити або лейкоцити, або клітини, які були інкубовані в культурі тканини, в присутності міченого антитіла, що дозволяє ідентифікувати білки РЛГТНЩ, і виявлення антитіла будь-яким з множини способів, добре відомих в даній області. Біологічний зразок можна зв'язувати з твердофазною підкладкою або носієм, таким як нітроцелюлоза, або інша тверда підкладка або носій, який дозволяє іммобілізувати клітини, клітинні частинки або розчинні білки. Потім підкладку або носій можна промити відповідними буферами з подальшою обробкою міченим антитілом згідно з даним винаходом, як указано вище. Потім твердофазну підкладку або носій можна промити буфером другий раз, щоб видалити антитіло, що не зв'язалося. Потім кількість пов'язаної мітки на вказаній твердій підкладці або носії можна визначити стандартними способами. Під «твердофазною підкладкою», «твердофазним носієм», «твердою підкладкою», «твердим носієм», «підкладкою» або «носієм» мають на увазі будь-яку підкладку або носій, здатний зв'язувати антиген або антитіла. Добре відомі підкладки або носії включають скло, полістирол, поліпропілен, поліетилен, декстран, нейлон, амілози, природні і модифіковані целюлози, поліакриламіди, габро і магнетит. З метою даного винаходу носій за своїй природою може бути або розчинним в деякій мірі, або нерозчинним. Насправді матеріал підкладки може мати будь-яку можливу структурну конфігурацію за умови, що пов'язана молекула володіє здатністю зв'язуватися з антигеном або антитілом. Таким чином, конфігурація підкладки або носія може бути сферичною, як в кульці, циліндричною, як на внутрішній поверхні пробірки або зовнішній поверхні стрижня. У альтернативному випадку поверхня може бути плоскою, такою як лист, смужка, що тестується, і т.д. Переважні підкладки або носіїв включають кульки з полістиролу. Фахівці в даній області будуть знати інші відповідні носії для скріплення антитіла або антигену, або зможуть з'ясувати це з використанням звичайних експериментів. Зв'язуючу активність даної партії антитіла згідно з винаходом, як указано вище, можна визначити згідно з добре відомими способами. Фахівці в даній області зможуть визначити робітники і оптимальні умови аналізу для кожного визначення, використовуючи стандартні експерименти. Як звичайно або необхідно в конкретній ситуації до аналізів можуть бути додані інші стадії, такі як промивання, перемішування, струшування, фільтрування і тому подібне. Одним зі способів, якими можна мітити антитіло згідно з даним винаходом, є спосіб його скріплення з ферментом і використання у імуноферментному аналізі (ІФА). Вказаний фермент в свою чергу, в тому випадку, коли останній зазнає впливу відповідного субстрату, буде реагувати з субстратом таким чином, при якому утвориться хімічний компонент, який можна зареєструвати, наприклад, спектрофотометричними, флуорометричними або візуальними способами. Ферменти, які можна використати для того, щоб помітити антитіло міткою, що реєструється, включають, але не обмежені вказаним, малатдегідрогеназу, стафілококову нуклеазу, ізомеразу дельта-5-стероїду, алкогольдегідрогеназу дріжджів, альфа-гліцерофосфатдегідрогеназу, триозофосфатізомеразу, пероксидазу хрону, лужну фосфатазу, аспарагіназу, глюкозоксидазу, бетагалактозидазу, рибонуклеазу, уреазу, каталазу, глюкоза-6-фосфатдегідрогеназу, глюкоамілазу і ацетилхолінестеразу. Реєстрацію можна проводити колориметричними способами, в яких використовують хромогенний субстрат для ферменту. Реєстрацію також можна виконувати візуальним порівнянням міри ферментативної реакції субстрату зі стандартами, приготованими схожим чином. Реєстрацію також можна виконувати з використанням будь-якого з множини інших способів імуноаналізу. Наприклад, при радіоактивному міченні антитіл або фрагментів антитіл можна виявити R-PTP-азу із застосуванням радіоімуноаналізу (РІА). Хороший опис РФА можна знайти в [Laboratory Techniques and Biochemistry in Molecular Biology, by Work, T. S. et al., North Holland Publishing Company, NY (1978) особливо звертаючись до розділу, озаглавленого «An Introduction to Radioimmune Assay and Related Techniques» by Chard, T.], включеної тут у вигляді посилання. Радіоактивний ізотоп можна реєструвати такими способами, як із застосуванням гамма-лічильника або сцинтиляційного лічильника або авторадіографії. Антитіло згідно з даним винаходом також можна мітити флуоресцентною сполукою. Коли флуоресцентно мічене антитіло піддають впливу світла відповідної довжини хвилі, його присутність потім можна виявити завдяки флуоресценції. Серед сполук флуоресцентних міток, що найбільш широко використовуються є ізотіоціанат флуоресцеїну, родамін, фікоеритрин, пікоціанін, алофікоціанін, о-фтальальдегід і флуоресцамін. Антитіло також можна мітити міткою, що реєструється, з використанням металів, що випускають флюоресценцію, таких як 152Е або інші представники ряду лантанідів. Вказані метали можна зв'язувати з антитілом за допомогою таких хелатуючих метали груп, як діетилентриамінпентаоцтова кислота (ЕТРА). Антитіло також можна мітити міткою, що реєструється, за допомогою його скріплення з хемілюмінесцентною сполукою. Присутність хемілюмінесцентно міченого антитіла потім визначають, реєструючи наявність люмінесценції, яка виникає в ході хімічної реакції. Прикладами особливо придатних сполук хемілюмінесцентних міток є люмінол, ізолюмінол, ароматичний складний ефір акридинію, імідазол, сіль акридинію і складний ефір оксалат. Також можна використати біолюмінесцентну сполуку для того, щоб мітити антитіло згідно з даним винаходом. Біолюмінесценція є різновидом хемілюмінесценції, виявленим в біологічних системах, в яких каталітичний білок збільшує ефективність хемілюмінесцентної реакції. Присутність біолюмінесцентного білка визначають за допомогою реєстрації наявності люмінесценції. Важливими біолюмінесцентними сполуками в цілях мічення є люциферин, люцифераза і акворин. Молекулу антитіла згідно з даним винаходом можна адаптувати для застосування в імунеметричному аналізі, також відомому як «двосайтовий» аналіз або аналіз за типом «сендвіча». У звичайному імунометричному аналізі деяку кількість неміченого антитіла (або фрагмента антитіла) зв'язують з твердою підкладкою або носієм і додають деяку кількість міченого розчинного антитіла, що реєструється, щоб забезпечити можливість виявлення і/або кількісної оцінки потрійного комплексу, утвореного між антитілом на твердій фазі, антигеном і міченим антитілом. Звичайні і переважні імунометричні аналізи включають «прямі» аналізи, при яких антитіло, пов'язане з твердою фазою, є першим антитілом, що контактується із зразком, що тестується, щоб екстрагувати антиген із зразка завдяки формуванню подвійного комплексу антитіло на твердій фазі-антиген. Після відповідного інкубаційного періоду тверду підкладку або носій промивають для того, щоб видалити залишок рідкого зразка, включаючи антиген, що не прореагував, якщо такий є, і потім піддають контакту з розчином, що містить невідому кількість міченого антитіла (яке функціонує як «репортерна молекула»). Після другого інкубаційного періоду, щоб забезпечити утворення комплексу між міченим антитілом і антигеном, пов'язаним з твердою підкладкою або носієм через немічене антитіло, тверду підкладку або носій промивають другий раз, щоб видалити мічене антитіло, яке не прореагувало. У іншому типі «сендвіч»-аналізу, який також можна застосовувати по відношенню до антигенів згідно з даним винаходом, використовують так звані «одночасний» і «зворотний» аналізи. Одночасний аналіз включає в себе єдину стадію інкубації, на якій і антитіло, пов'язане з твердою підкладкою або носієм, і мічене антитіло додають до зразка, що тестується в один і той же час. Після завершення інкубації тверду підкладку або носій промивають, щоб врідалити залишок рідкого зразка і мічене антитіло, що не утворило комплекси. Потім визначають наявність міченого антитіла, пов'язаного з твердою підкладкою або носієм, як це робили б при звичайному «прямому» аналізі типу «сендвіча». У «зворотному» аналізі використовують поетапне додавання першого розчину міченого антитіла до рідкого зразка з подальшим додаванням неміченого антитіла, пов'язаного з твердою підкладкою або носієм, після відповідного періоду інкубації. Після другої інкубації тверду фазу промивають звичайним чином, щоб звільнити його від залишку зразка, що тестується, і розчину міченого антитіла, що не прореагувало. Реєстрацію міченого антитіла, пов'язаного з твердою підкладкою або носієм, потім проводять як в «одночасному» і «прямому» аналізах. Винахід далі буде проілюстрований наступними не обмежуючими прикладами. Приклади Приклад 1. Одержання р-лрРЛПНЩ СНО. Стабільні рекомбінантні клітини СНО, що експресують розчинний РЛПНЩ людини, одержували співтрансфекцією клітин CHO-DUKX, у яких відсутній ген дигідрофолатредуктази (DHFR) [Urlaub. G. et al., 1980], двома експресуючими векторами: psLDLROl, що містить N-кінцевий зв'язуючий ліганд домен РЛПНЩ, починаючи з амінокислотного залишку Asp (+4) до Glu 291 (+291), і pDHFR, що містить мишачий ген DHFR, обидва під контролем промотору і елементів термінації транскрипції раннього району SV40. Трансфекцію проводили катіонними ліпосомами, використовуючи LipofectAmine (Gibco BRL), згідно з протоколом, описаним виробником. Через сімдесят дві години після трансфекції клітини переносили в селективне середовище, в якій відсутні дезокси- і рибонуклеозиди, з додаванням 10% діалізованої FCS. Клітини, що експресують активність DHFR, володіли здатністю формувати колонії, які виділяли відшаруванням клітин за допомогою змочених в трипсині паперових дисків. Клітини вирощували і проводили скринінг відносно активності р-лрРЛПНЩ. Потім трансфіковані клітини піддавали ампліфікації генів за допомогою МТХ з подальшим субклонуванням і відбором стабільних клонів продуцентів. р-лрРЛПНЩ (форма +291) одержували за допомогою клітин СНО стабільного клону продуцента, позначеного №33-10-29-21, в біореакторі CelliGen об'ємом 5 літрів у безсироватковому середовищі [Gibco CHO-A-SFM катал. №95-0091 DJ]. Неочищений зібраний матеріал очищали фільтруванням через патронний фільтр 0,8-2,0 мкм [Gelman катал. №CSS92DSCCK] і концентрували в 100 разів над мембраною з відсіканням 5 кД. Форму +291 р-лрРЛПНЩ, використану для перших імунізацій, очищали з використанням способу очищення в невеликому масштабі. У цьому способі використовували катіонобмінну колонку з DEAEсефарозою, після чого слідувала стадія гідрофобної взаємодії на колонці бутил-TSK, потім слідувала колонка НТР і стадія ексклюзійної хроматографії за розміром (SEC) на колонці з Сефакрилом 100. Вибирали фракцію №27 SEC, оскільки вона містила матеріал зі специфічною антивірусною активністю 780 одиниць/мкг, виявлена в аналізі на антивірусну активність, описаному нижче в прикладі 9. Білок у вказаній фракції ідентифікували як р-лрРЛПНЩ за допомогою аналізу N-кінця. Очищали другу партію р-лрРЛПНЩ +291 СНО і використовували для бустер-ін'єкцій мишей. Р-лрРЛПНЩ очищали, використовуючи вдосконалений спосіб, що дає підвищений вихід, який включав в себе наступні стадії: а) освітлення і концентрування х100 неочищеного зібраного матеріалу; b) аніонообмінну колонку HQ POROS і с) дві стадії гідрофобного взаємодії (НІС): уловлювання на колонці бутил-TSK і пропущення через колонку феніл-SPW. Фракцію, що не зв'язалася, з останньої стадії НІС діалізували і очищали на катіонобмінній колонці HS-POROS. Остання стадія являла собою колонку з гідроксіапатитом (НТР). Отже, одержаний рлрРЛПНЩ очищали приблизно до 90%, елююючи у вигляді єдиного основного піка при ОФ-ВЕРХ. Приклад 2. Імунізація мишей. 10мкг очищеного р-лрРЛПНЩ фракції №27, одержаної з колонки SEC в прикладі 1, вказаному вище, при концентрації 100мкг/мл гомогенізували з повним ад'ювантом Френда (CFA, 50% об./об.) і ін'єкували в подушечку стопи кожної з п'яти самиць мишей Balb/C 7-тижневого віку. Через чотири тижні після першої імунізації мишей повторно імунізували внутрішньом'язово 10мкг тих же фракції очищеного р-лрРЛПНЩ в 50% (об./об.) розчині CFA. Через два тижні після другої ін'єкції тестували сироватку мишей відносно антитіл до р-лрРЛПНЩ, використовуючи прямий спосіб ELISA, описаний далі в прикладі 3. Двох мишей М-1 і М-2 з найбільш значною специфічною імунореактивністю до р-лрРЛПНЩ далі піддавали бустер-імунізації через 10 тижнів після другої ін'єкції 10 мкг очищеного р-лрРЛПНЩ, одержаного вдосконаленим способом очищення, описаним вище в прикладі 1. Через 14 тижнів у мишей брали кров і тестували відносно антитіл до р-лрРЛПНЩ. Потім вони одержували дві додаткові бустер-імунізації 50мкг р-лрРЛПНЩ в PBS: першу внутрішньоочеревинно, а другу два дні опісля як внутрішньоочеревинно, так і внутрішньовенно. Через два тижні після другої ін'єкції у мишей брали кров і антисироватки тестували у відношенні анти-рлрРЛПНЩ-активності прямим способом ELISA, як в прикладі 3 далі. Кожну антисироватку серійно розводили 1:100 - 1:32000 і вносили в повторах в 96-ямковий планшет, покритий 10 U/ямку р-лрРЛПНЩ, очищеного з використанням вдосконаленого способу очищення, описаного вище в прикладі 1. В першій ямці кожного ряду як пусті контролі використовували буфер для аналізу і DMEM + PBS, що містить 10% HS + 1% БСА або желатину + 0,05% Твіну 20 +0,05% тимерозалу. Нормальну сироватку миші (NMS) вносили в таких же межах розведень в останні два ряди як негативні контролі. Оптичну щільність ферментативної реакційної суміші вимірювали на зчитувальному пристрої для ELISA при 492 і 405нм. Результати даного тесту показали, що сироватка миші М-1 мала більш високу специфічну імунореактивність по відношенню до р-лрРЛТШЩ, і тому мишу забивали і збирали клітини селезінки для злиття з клітинами мієломи [Eshhar Z, 1985]. Приклад 3. Прямий ELISA для тестування антисироватки і скринінгу клонів гібридом. Прямий ELISA для скринінгу позитивної антисироватки виконували таким чином: 96-ямкові планшети покривали 100мкл р-лрРЛПНЩ (очищеного вдосконаленим способом очищення згідно з прикладом 1), 100 одиниць/мл (lOU/ямку) в PBS + 1% желатин (Sigma, катал. №G-7765) + 0,9мМ Са+2 і 0,5мМ Mg+2-, pH 5,6, в тому, що в подальшому іменується буфером для аналізу, протягом 90хв. при 37°С при струшуванні. Планшети шість разів промивали в PBS + 0,05% Твін 20 [монолаурат поліксіетиленсорбітану - Sigma P-1379], в подальшому званому розчином для промивання. Зразки антисироватки від імунізованих мишей, серійно розведені 1:100 -1:32000, або надосад культур клітин гібридоми додавали в ямку і інкубували протягом 90хв. при 37°С при струшуванні, після чого шість разів промивали в розчині для промивання. У ямки додавали 100 мкл антитіла кози проти Fab мишей, кон'югованого з пероксидазою хрону (HRP)-APA [Sigma-катал. № 4601-1], розведеного 1:1200, і інкубували протягом 90хв. при 37°С при струшуванні, і потім шість разів промивали розчином для промивання. У ямки додавали 100мкл розчину субстрату (одержаного розчиненням однієї таблетки OPD і однієї таблетки Н2О2 в 20мл води) і інкубквали при КТ протягом 30хв. Ферментативну реакцію зупиняли додаванням 100мкл/ямку 4N НС1. Оптичну щільність в 96-ямкових планшетах реєстрували, використовуючи зчитувальний пристрій для ELISA, при 492 і 405нм, і результати розраховували, використовуючи логітичний алгоритм за чотирма параметрами за допомогою комп'ютерної програми MultiCalc PC-комп'ютера, з'єднаного зі зчитувальним пристроєм для ELISA. Приклад 4. Злиття, одержання гібридом, селекція клонів і очищення антитіл з асцитних рідин. Процес злиття і селекцію клітин гібридом проводили згідно з протоколами, описаними в [Eshhar Z, 1985]. Коротко, клітини селезінки миші М-1, яку піддавали бустер- імунізації за 2-4 дні до злиття, зливали з клітинами мієломи при короткій інкубації з ПЕГ. ПЕГ спочатку повільно розбавляли DMEM, а потім повністю видаляли центрифугуванням. Клітини знов суспендували в середовищі DMEM-НАТ, розподіляли в 96-ямкові планшети при концентрації приблизно 3,4 х 10-4 клітин/ямку і інкубували протягом 10-14 днів в інкубаторі з 8° СО2 при 37°С. Середовище у всіх ямках з гібридомами замінювали на DMEM з додаванням 10% сироватки коня (HS) в 10-дневний період часу. Проводили скринінг зразків надосаду культури гібридом на наявність мАт до рлрРЛПНЩ прямим ELISA, описаним вище в прикладі 3. Як пусті контролі використовували буфер для аналізу і DMEM -t - 10% HS, як позитивні контролі використовували мАт С7 (комерційно доступне з Amersham) і антисироватку миші М-1, в той час як моноклональне антитіло до розчинного рецептора TNF р55 використовували як негативний контроль. Клітини з тих ямок, в яких в надосадах культур виявили наявність антитіл, переносили в 24-ямкові планшети і потім в Т-флакони об'ємом 25см2. Збільшені в об'ємі культури перевіряли відносно секреції мАт до р-лрРЛПНЩ. Ампули клітин позитивних культур заморожували і зберігали в рідкому азоті. Всього перевірили приблизно 1000 культур для виявлення антитіл до р-лрРЛПНЩ. 54 культури з найвищою імунною активністю перевіряли декілька разів. П'ять культур (12, 28, 29, 30 і 50) з найвищою активністю клонували методом лімітуючого розведення в 96-ямкових планшетах. Надосади зростаючих клонів перевіряли декілька разів на наявність антитіл до р-лрРЛПНЩ прямим ELISA. Клітини позитивних клонів гібридом вирощували у флаконах для культури тканини в DMEM, що містить 15% сироватки коня, і ампули з частиною культур заморожували. У паралелі клітини різних клонів гібридом ін'єкували кожній з 2-4 мишей, щоб одержати асцитні рідини. Антитіла очищали з асцитної рідини або осадженням сульфатом амонію, або на колонці з білком G. Коротко, 7,5мл асцитної рідини розбавляли 1:3 в 20мМ фосфатному буфері, рН 7, і наносили на колонку з білком G об'ємом 5мл (СІ0/10). Колонку промивали 20мМ фосфатним буфером, рН 7, і мАт елюювали 100мМ гліциновим буфером, рН 2,7. Значення рН елюйованої фракції доводили до 7-7,5 1М трис-буфером, рН 9,3. Приклад 5: Скринінг пар мАт, яку потрібно використати в ELISA, і оптимізація параметрів ELISA. мАт, очищені з асцитних рідин, як описано вище в прикладі 4, використовували для виконання серії експериментів в матричній формі, щоб вибрати найкращу відповідну пару мАт, які потрібно використати як перше і друге антитіло в ELISA за типом «сендвіча» для р-лрРЛПНЩ, описаному далі в прикладі 6. Коротко, 96-ямковІ планшети покривали асцитними рідинами, одержаними з п'яти гібридом (№12, 28.28, 29.08, 30 і 50.05), очищеними або осадженням сульфатом амонію, або на колонці з білком G. Проводили скринінг антитіл з використанням як антигенів форми +291, а також форм +292 (від амінокислотного залишку Asp +4 до Cys +292) і +331 (від амінокислотного залишку Asp +4 до Cys +331) р-лрРЛПНЩ, одержаних в клітинах СНО. Один мл кожного з вказаних вище частково очищених мАт мітили біотином для швидкого скринінгу їх застосовності як других антитіл в ELISA за типом «сендвіча». Коротко, 1,5мг очищених осадженням сульфатом амонію мАт доводили до рН 8,5 за допомогою 30мкл 0,5М NaHCO3. 0,75мг біотину-OSu N-гідроксисукцинімідобіотин [Biotin-OSu, Sigma, катал. № Н1759], з розчину 5мг в 200мкл ДМСО) додавали до розчину антитіла і інкубували протягом двох годин при кімнатній температурі при обережному струшуванні, після чого інкубували протягом ночі при 2-8°С. Реакційний розчин наносили на колонку PD10 з Сефадексом G-25M [Pharmacia катал. №170851-01], щоб розділити біотинільовані мАт і надлишок біотину-Osu, який не прореагував. Перші попередні експерименти показали, що мАт 29.08 і 30 давали найвищій сигнал над фоном при використанні як других антитіл в ELISA. Реакцію вказаних двох клонів як других антитіл знов перевіряли з антитілами 12, 28, 29.08 і 50, що використовуються для покриття планшетів. Результати цього експерименту чітко показали, що мАт 28 було найбільш відповідним антитілом для покриття. Найкращі результати відносно інтенсивності сигналу і специфічності були одержані з мАт 28, використаним для покриття планшета для мікротитрування, і мАт 29.08, мічений біотином, як друге антитіло. Використовуючи вказані мАт, одержали хороші результати з всіма трьома формами (+291, +292 і +331) рлрРЛПНЩ. Зі всіма формами оптична щільність при 492/405 нм становила приблизно 1,3 OD. Три форми антигену р-лрРЛПНЩ аналізували в серійному розведенні в межах концентрацій 0,91000нг/мл. Криву «доза-відповідь» одержували з використанням мАт 28 для покриття і біотинільованого мАт 29.08 як другого антитіла. Вказана комбінація давала лінійну відповідь в межах концентрацій р-лрРЛПНЩ 110нг/мл. Оптимізували різні параметри, які можуть впливати на тест ELISA, такі як концентрація реагентів, періоди інкубації, вибір буферів і планшетів, за допомогою тестування наступних параметрів: Покриття ямок планшета для мікротитрування 5-10мкг/мл мАт 28 в PBS. - Склад буфера: a) PBS + Твін 20 b) Тріс + Са+2 + NaCI + Твін 20 - Розчини для блокування: a) 1% желатин в PBS, 0,05% Твін, 0,005% Тимерозал b) 1% БСА в PBS, 0,05% Твін, 0,005% Тимерозал c) 1% FBS в PBS, 0,05% Твін, 0,005% Тимерозал d) 1% молоко в PBS, 0,05% Твін, 0,005% Тимерозал e) І Block, Ну Pep і Ну Yeast. - Друге мАт 29.08, мічене біотином, при концентраціях 1:500, 1:1000, 1:2000, 1:4000, 1:8000, 1:10000, еквівалентних межі концентрацій 10,74-0,537мкг/мл. Концентрації екстравідину: 1:500, 1:1000, 1:2000, 1:4000, 1:8000, 1:10000, еквівалентні межі концентрацій 4-0,2мкг/мл. На основі вказаних експериментів була розроблена остаточна процедура для тесту ELISA за типом «сендвіча», описана далі в прикладі 6. Приклад 6. Розробка ELISA за типом «сендвіча» для р-лрРЛПНЩ. Розробили ELISA за типом «сендвіча» для р-лрРЛПНЩ з використанням мАт 28 і 29.08. Коротко, 96ямковий планшет покривали 100 мкл очищеного за допомогою білка G мАт 28 (5мкг/мл) протягом ночі при 28°С або протягом 3 годин при 37°С. Потім планшети п'ять разів промивали PBS + 0,05% Твін 20. Планшети інкубували з 200мкл блокуючого розчину ((PBS+1% БСА або желатин + 0,05% Твін 20 + тимерозал 0,05% протягом однієї год. при 37°С або протягом ночі при 4°С і п'ять разів промивали PBS + 0,05% Твін 20. У ямки додавали 100мкл зразків або антигену для калібрувальної кривої (р-лрРЛПНЩ +291 СНО, 0,5-32нг/мл, розведений в блокуючому розчині) і інкубували протягом 90хв. при 37°С зі струшуванням. Потім планшети п'ять разів промивали PBS + 0,05% Твін 20. Додавали 100мкл/ямку біотинільованого мАт 29.08 (0,67мкг/мл) в блокуючому розчині і інкубували при струшуванні протягом однієї години при 37°С. Планшети п'ять разів промивали PBS + 0,05% Твін 20. У ямки додавали 100мкл комерційного кон'югату екстравідину-пероксидази [ExtrAvidin TM-Peroxidase BioMakor, катал. №0645-1], розведеного 1:10000, і інкубували при струшуванні протягом однієї години при 37°С. Потім планшети п'ять разів промивали PBS + 0,05% Твін 20. У кожну ямку додавали 125мкл вищезгаданого розчину субстрату і інкубували приблизно протягом 10 хвилин до розвитку забарвлення до необхідної інтенсивності. Реакцію зупиняли додаванням 125мкл 4N НСl. Оптичну щільність в 96-ямкових планшетах реєстрували з використанням зчитувального пристрою для ELISA при довжинах хвиль 492 і 405нм, і результати розраховували за допомогою комп'ютерної програми MultiCalc на PC-комп'ютері, з'єднаному зі зчитувальним пристроєм для ELISA. Приклад 7. Ізотип моноклональних антитіл. Ig-ізотип моноклональних антитіл визначали, використовуючи комерційний набір для ізотипування (PharMingen International) відповідно до способу аналізу виробника. Клони 12.6, 28, 29.8 і 30 ідентифікували як IgGb в той час як виявлено, що клон 50.30 є Ig класу IgM. Приклад 8. Вестерн-блот-аналіз SDS-ПААГ. Форму +291 очищеного р-лрРЛПНЩ і нативний РЛПНЩ, очищений з сечі людини, аналізували Вестернблот-аналізом з використанням моноклональних антитіл, вироблених до р-лрРЛПНЩ. Коротко, на 12% SDSполіакриламідний гель наносили 100нг/доріжку форми +291 р-лрРЛПНЩ СНО або нативного лрРЛПНЩ сечі або неочищеного зібраного матеріалу ТВР-1 (як негативний контроль) при відновлювальних умовах (40мМ ДТТ). На одну доріжку наносили маркери низької молекулярної маси (НММ). Вказаний набір зразків розганяли п'ять разів. Білки, розділені в гелі, переносили електроелююванням на нітроцелюлозні мембрани. Мембрани інкубували протягом 16год. в PBS, що містить 10% знежиреного молока, 0,1% Твіну 20. Мембрани розрізали на смужки, і кожну смужку інкубували протягом 2 годин при кімнатній температурі з одним з п'яти відібраних мАт: 12.6, 30, 50.30, 28 або 29.08 (асцитна рідина, розведена 1:4000). Смужки мембран промивали PBS, що містить 0,1% Твін 20 (3 х 15хв.) і інкубували протягом однієї години з другим антитілом - антимишачим антитілом кози, кон'югованим з пероксидазою хрону - лужною фосфатазою (розбавленим 1:10000, ВіоМаког) протягом 2 годин при кімнатній температурі. Смужки промивали PBS, що містить 0,1% Твін 20 (3 х 15хв.). Позитивні смуги реєстрували за допомогою посиленої хемілюмінесценції (ECL, Amersham). Моноклональні антитіла №12,6 і №29.8 впізнавали як білок сечі, так і форму +291 очищеного р-лрРЛПНЩ при Вестерн-блот-аналізі (Фіг.2). мАт 28 і 30 впізнавали форму +291 очищеного р-лрРЛПНЩ. Приклад 9. Інгібування антивірусної активності р-лрРЛПНЩ моноклональними антитілами. Поводили тестування мАт, які специфічно реагують з р-лрРЛПНЩ, за їх здатністю блокувати антивірусну активність р-лрРЛПНЩ (форми +291) in vitro, використовуючи аналіз інгібування цитопатичної дії (ЦПД) в системі VSV/WISH. Клітини WISH (що походять з амніону людини) культивували в MEM з додаванням 10% FBS і 4мМ глутаміну при 37°С в інкубаторі з 5% СО2. Експонентно зростаючі клітини висівали в 96-ямкові планшети для культури тканини при щільності 40000клітин/ямку за двадцять чотири години до початку аналізу. Зразки, які піддавали тестуванню, і стандарт розбавляли і розносили в ямки, що містять клітини. У ямки відразу ж додавали VSV при множинності інфекції (МОl), що дорівнює 0,5БУО/клітину. Планшети інкубували 16-18 годин при 37°С і потім промивали етанолом. Моношар клітин, що вижили, оцінювали при забарвленні кристалічним фіолетовим за Грамом. Кількісний аналіз цитопатичної дії відносно стандарту проводили за допомогою нанесення щільності забарвлення проти стандартної концентрації. Для аналізу нейтралізуючої дії антитіл р-лрРЛПНЩ заздалегідь інкубували протягом 30хв. при 37°С із зростаючими концентраціями асцитної рідини з тестованим мАт. Потім вказані розчини додавали до культур клітин WISH в 96-ямкові планшети для мікротитрування, після чого додавали вірус везикулярного стоматиту (VSV). Через 18 годин інкубації визначали опосередкований VSV лізис клітин шляхом фарбування клітин, що залишилися, кристалічним фіолетовим. Напівкількісний аналіз цитопатичної дії відносно стандарту виконували, відкладаючи інтенсивність забарвлення (визначену зчитувальним пристроєм для ELISA) проти концентрації стандарту. Оцінювали дію мАт при зростаючих концентраціях р-лрРЛПНЩ. Як показано в таблиці 1, було виявлено, що два мАт (12.6 і 50.30) виявляють нейтралізуючу активність. У експерименті, показаному в Таблиці 1, інгібуючу дія двох мАт тестували при розведенні асцитних рідин 1:40. При даному розведенні мАт 12.6 виявляло трохи більш високу активність, ніж мАт 50.30. Це може бути наслідком властивостей мАт, а також відмінностей в їх концентрації в асцитній рідині. Інгібуючу дію мАт можна ослабити збільшенням концентрації р-лрРЛПНЩ в порівнянні з концентрацією мАт. Насправді при концентраціях р-лрРЛПНЩ 62,5 U/мл жодне з мАт не надавало дії на активність рлрРЛПНЩ при концентрації антитіла, що аналізується. Таблиця №1 Інгібування антивірусної активності р-лрРЛПНЩ клонами 12.6 і 50.30* VSV/mAt -V5V +VSV +VSV+KЛOH 50.30 +VSV+клон 12.6 0 1.5 (0.25) 6(0.4) 5(0.5) Концентрація РЛПНЩ (U/мл) 2.5 12.5 1.2 1.6 1 7(1.7) 0.83 (1.25) 0.77 7(0.7) 62.5 1.5 1.7 1.62 1.67 *Інгібування антивірусної активності р-лрРЛПНЩ відносно опосередкованого VSV лізису клітин WISH. Інгібуючу дію мАт визначали при розведенні асцитної рідини 1:40. Кількість життєздатних клітин представлена в таблиці значеннями OD. Числа в дужках представляють результати повторного дослідження, виконаного при концентраціях РЛПНЩ 0 і 12,5і/мл. Інгібування антивірусної активності р-лрРЛПНЩ визначали з використанням зростаючих концентрацій мАт 12.6 і 50.30. мАт 12.6 інгібувало антивірусну активність р-лрРЛПНЩ на -60% при розведенні 1:40 (асцитної рідини) і на ~35% при розведенні 1:20500. Клон 50.30 інгібував активність р-лрРЛПНЩ на ~45% при розведенні 1:40 і на ~15% при розведенні 1:20500. Крива «доза-відповідь», одержана з обома мАт, і спостереження того, що інгібуюча дія знижувалася при надлишку р-лрРЛПНЩ, свідчить про те, що мАт надають свою дію за допомогою скріплення з р-лрРЛПНЩ. Приклад 10. Інгібування реплікації HCV моноклональними антитілами. Тестували мАт, специфічні для р-лрРЛПНЩ, відносно їх здатності інгібувати реплікацію HCV в первинній культурі гепатоцитів людини. Культуру клітин FT 167 одержували від пацієнта чоловічої статі 57-літнього віку, потребуючого резекції -лобектомії за медичними показаннями (метастаз пухлини товстого кишечника, права частка). Первинні культури гепатоцитів людини одержували способом двостадійної перфузії з колагеназою [Maurel P. Adv. Drug Del. Rev. 22: 105-132 (1996), Pichard L. et al. Мої. Pharmacol. 41: 1047-1055 (1992), Ferrini JB. Et al. Chem-Biol Interactions 107: 31-45 (1997)]. Життєздатність клітин перед посівом визначали, використовуючи тест виключення з трипановим синім. Чотири мільйони клітин в 3 мл культурального середовища висівали в пластикові чашки діаметром 60мм, заздалегідь покриті колагеном. Культуральне середовище без сироватки для довгострокового культивування складалося з середовища Е Вільямса з добавками, які опубліковані [Lanford R. et al. In Vitro Cell Dev. Bio. 25: 174-182 (1989)]. Це середовище згодом оновлювали кожні 48 годин. Культури підтримували при 37°С у вологій атмосфері повітря і 5% діоксиду вуглецю. При вказаних умовах культивування гепатоцити людини зберігають свій диференційований фенотип протягом, щонайменше, 35 днів [Ferrini JB. Et al. Chem-Biol Interactions 107: 31-45 (1997)] і чутливі до інфекції HCV і дозволяють реплікуватись вірусному геному [Fournier С. et al. J. Gen Virol. 79: 2367-2374 (1998)]. Зразок HCV-позитивної сироватки: Заснований банк сироватки людини від пацієнтів, які були оцінені в тесті з ЕІА HCV 3.0 і Chiron RIBA HCV 3.0 SIA як позитивні за анти-Id-антитілами. Жоден з вказаних пацієнтів не був одночасно інфікований HBV або HIV. У кожному зразку сироватки кількісно оцінювали РНК HCV за допомогою набору Roche monitor і генотипували потоковим аналізом проб (Inno-Lipa HCV II, Innogenetics). Зразки сироватки зберігали при -80°С невеликими аліквотами для того, щоб уникнути циклів заморожуваннявідтавання. У вказаних експериментах використовували зразок S42 (генотип 1b; вірусне навантаження: 410000 піків/мл). Для інфікування і подальших обробок культури гепатоцитів в стерильних умовах переносили в лабораторію РЗ (з високою мірою ізоляції для інфекційних для людини мікроорганізмів). Через три дні після посіву, коли клітини відновлювалися після пошкодження при ізоляції, проводили інфікування гепатоцитів in vitro за допомогою інкубації протягом ночі з 25мкл зразка HCV-позитивної сироватки (S42) в 3мл середовища. Після інфекції клітини три рази промивали 3мл свіжого середовища, і продовжували культивування при нормальних умовах в середовищі для довготривалого культивування. Клітини обробляли 3 різними мАт проти р-лрРЛПНЩ, мАт12.6, мАт28 і мАт29.8. За тридцять хвилин до інфекції клітини експонували 2 або 8мкг/мл різних мАт. Потім клітини інфікували, як описано вище. Контрольні культури інфікували в схожих умовах, але у відсутності антивірусної обробки. У паралельних експериментах такі ж культури обробляли 5000U/мл IFNa у схожих умовах для порівняння (IFNa сильно інгібує реплікацію HCV в еталонних клітинах). Всі обробки проводили в повторах. На 5 день після інфекції середовище видаляли, і культури 3 рази промивали холодним фосфатносольовим буфером. РНК очищали з 4х106 гепатоцитів, використовуючи спосіб кислої фенольної екстракції з ізотіоціанатом гуанідинію [Chomczynski PN. and Sacchi N. Analyt. Biochem. 162: 156-159 (1987)]. Преципітовану РНК розчиняли в 50мкл води, обробленої діетилпірокарбонатом (DEPC), і оцінювали кількість. Один мкг клітинної РНК аналізували в специфічному для нитки rTth-OT-ПЛР-аналізі. Щоб уникнути можливого забруднення ниткоспеціфичний ЗТ-ПЛР-аналіз проводили послідовно, використовуючи три різних приміщення: приміщення для пре-ПЛР, приміщення для ПЛР і приміщення для пост-ПЛР. РНК, розчинену в 10мкл води, обробленої DEPC, покривали мінеральним маслом і нагрівали до 95°С протягом 1хв. Температуру знижували до 70°С і додавали 10мкл заздалегідь нагрітої реакційної суміші для кДНК. Потім температуру знижували до 60°С протягом 2хв. для відпалу, і реакцію утворення кДНК виконували протягом 20хв. при 70°С, використовуючи ДНК-полімеразу rTth (Perkin-Elmer). Під час додавання 40мкл заздалегідь нагрітого буфера, що містить EGTA як хелатуючий агент для Мn2+, для того, щоб супресувати активність rTth-OT, температуру підтримували на рівні 70°С. Реакційні пробірки тримали при 70°С поки додавали 40мкл попередньої нагрітої суміші ПЛР. Умови ПЛР, що проводиться в системі для ПЛР Gene Amp® 9600 (Perkin- Elmer), складалися з початкового циклу при 94°С протягом 1хв., 50 циклів при 94°С протягом 15сек.; 58°С протягом 30сек., 72°С протягом 30сек. і кінцевої стадії елонгації при 72°С протягом 7хв. Для аналізу позитивного ланцюга РНК HCV нуклеотидна послідовність зворотного праймера Р3 являє собою: 5'- TGG/ATGCACGGTCTACGAGACCTC-3', (нуклеотиди 342-320), а послідовність прямого праймера Р4: 5'CACTCCCCTGTGAGGAACT-3', (нуклеотиди: 38-56), [Laskus T. et al. J. Gen. Virol. 78: 2747-2750 (1997)]. Такі ж праймери використовували у зворотному порядку, щоб виявити негативний ланцюг. Одну десяту частину ампліфікованого продукту аналізували гель-електрофорезом в агарозі (2%) з подальшим фарбуванням BET і фотографуванням в УФ-світлі. У всіх серіях експериментів робили розведення (4-)- і (-) -ланцюгів синтетичної РНК HCV, і додавали 1мкг сумарної РНК печінки, щоб імітувати умови для аналізу гепатоцитів, що культивуються. Вказані суміші використовували як позитивні контролі для дослідження ЗТ-ПЛР і аналізу. На Фіг.3 показано, що продукція негативного ланцюга HCV в присутності мАт проти РЛПНЩ повністю інгібувалась в культурі FT 167. Отже, реплікація вірусного генома була суворо інгібована. Результати відповідали точці зору про те, що РЛПНЩ може бути рецептором HCV. Приклад 11. Одержання химерних антитіл до РЛПНЩ. мРНК очищають з лінії гібридом, які продукують мАт, специфічні по відношенню до РЛПНЩ. Синтезують специфічну кДНК з використанням олігонуклеотидів, комплементарних 5'-кінцю екзону СНІ варіабельного домену важкого ланцюга (олігонуклеотид 1) і 5'-кінцю екзону Сk варіабельного домену легкого ланцюга (олігонуклеотид 2), використовуючи очищену мРНК як матрицю. Одержують дві кДНК, одна з яких кодує варіабельну область (специфічну для РЛПНЩ) важкого ланцюга, а інша - варіабельну область (специфічну для РЛПНЩ) легкого ланцюга. кДНК клонують і секвенують. Для конструювання химерного важкого ланцюга варіабельну область клонованого гена важкого ланцюга Ig людини замінюють (використовуючи генетичні маніпуляції) клонованою ДНК, що кодує варіабельний домен (специфічний для РЛПНЩ) важкого ланцюга миші. Генетичні маніпуляції включають в себе вирізання варіабельної області Ig людини з використанням ферментів рестрикції і лігування варіабельної області миші. Таку ж процедуру виконують для того, щоб одержати химерний легкий ланцюг. Конструюють дві експресуючі плазміди ссавців, при цьому одна містить ген химерного важкого ланцюга, а інша містить ген химерного легкого ланцюга. Обидва вектори використовують для котрансфекції лінії клітин гібридоми (SP6). Продукцію Ig, специфічного для РЛПНЩ, тестують в ELISA або на Вестерн-блотах, використовуючи культуральний бульйон трансфікованих клітин як друге антитіло. Афінність химерного антитіла до його ліганду контролюють за допомогою Віасоге. Приклад 12. Одержання трансгенних мишей, яких конструюють так, щоб вони містили локуси генів імуноглобулінів людини (ксеномиші), і одержання людських мАт проти лРЛПНЩ. Одержання ксеномишей описане в [WO 98/24893 і Mendez M, J. et al., Nature genetics 15: 146-56(1997)]. Проводять скринінг бібліотек штучних хромосом людина-дріжджі (YAC) у відношенні YAC, що містять варіабельну область важкого ланцюга людини (приблизно 1000т.п. н.) (спосіб клонування YAC являє собою спосіб відбору, коли потрібні розміри вставок більше 100т.п.н.). YAC характеризують Саузерн-блот-аналізом і електрофорезом в імпульсному полі (PFGE). YAC повинні містити райони Сm, Сd, Dh і Vh в конфігурації гаметичного типу. Завдяки використанню послідовностей, що перекриваються, що знаходяться в YAC, YAC рекомбінують в ДНК дріжджів за допомогою стратегії поетапної рекомбінації. Перед рекомбінацією 3'-кінець YAC (з районом V) лігують з селектованим маркером HPRT. Структуру рекомбінантної YAC підтверджують за допомогою PFGE і Саузерн-блот-аналізу (наявність локусу важкого ланцюга людини бід С-району до Vh-району в конфігурації гаметичного типу). Ацентричне плече YAC є мішенню вектора, що несе повний константний район g2, мишачий енхансер, ген стійкості до неоміцину, щоб одержати кінцевий важкий ланцюг, що містить повну варіабельну область, тобто 82 гени Vh, 6 генів Jh і 3 різних константних райони Сm, Сd, Сg з відповідними ним регуляторними послідовностями. Вказану YAC означають уН2. Дану конструкцію використовують для одержання ксеномиші. Стратегію, подібну стратегії, що використовується вище, застосовують для реконструкції локусів каппа, за винятком того, що: маркер селекції неоміцином лігують з реконструйованої YAC, що містить повний локус каппа. Дану YAC означають уК2. YAC, що містять уН2, вводять в клітину ES за допомогою злиття сферопласту дріжджів, що містить YAC, з клітинами ES мишей E14.TG3B, дефіцитними за HPRT. Відбирають HPRT-позитивні клітини. Позитивні клони розмножають і аналізують за допомогою Саузерн-блотів і CHEF-блот-аналізом. Відбирають клони, що містять інтактну yH2-YAC. Введення і селекцію yK2-YAC в клітинах ES виконують схожим чином, як описано для yH2-YAC. Клітини ES, що містять уН2, мікроін'єкують в бластоцити миші C57BL/6J. Одержаних химерних самців оцінюють відносно передачі через гамети нащадкам. уН2- і/або уК2-трансгенних мишей схрещують з мишами DI (гомозиготними за цілеспрямовано інактивованими локусами важкого ланцюга каппа-ланцюга миші). Кожну з трансгенних ліній yH2; DI схрещують з трансгенною лінією yK2; DI, щоб одержати лінії ксеномишей. Відтворення розвитку В-клітин і продукції антитіл у ксеномиші оцінюють проточною цитометрією і ELISA. Імунізацію ксеномиші проводять, як описано в прикладі 2. Способи одержання гібридоми і скринінгу позитивних клонів подібні способам, описаним в прикладах 3 і 4. Клони гібридом 12.6, 28, 29.8, 30 і 50.30 депоновані в Collection Nationale de Culture de Microorganismes (CNCM), Institut Pasteur, Paris, за умовами Будапештського договору і відповідають депозитам №1-2390, 12391, 1-2392, 1-2393 і 1-2394, відповідно. Посилання Agnello, V., Abel, G., Elfahal, M., Knight, G. В., and Zhang, "Hepatitis C virus and other flaviviridae viruses enter cells via low density lipoprotein receptor [In Process Citation]." Proc Natl Acad Sci USA, 96(22), 12766-71. Beisiegel, U., Schneider, W.J., Goldstein, J.L., Anderson, R. G., and Brown, "Monoclonal antibodies to the low density lipoprotein receptor as probes for study of receptor-mediated endocytosis and the genetics of familial hypercholesterolemia." J Biol Chem, 256(22), 11923-31. Bieri, S., Djordjevic, J. T., Daly, N. L., Smith, R., and Kroon, "Bisulfide bridges-of a cysteine-rich repeat of the LDL receptor ligand-binding domain." Biochemistry, 34(40), 13059-65. Brown, M. S., and Goldstein, "Familial hypercholesterolemia: A genetic defect in the low-density lipoprotein receptor." N Engl J Med, 294(25), 1386-90. Brown, M. S., and Goldstein, "A receptor-mediated pathway for cholesterol homeostasis." Science, 232(4746), 34-47. Chomczynski, P.N., And Sacchi, N. (1987). "Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction". Analyt. Biochem. 162:156-9. Eshhar Z, 1985 "Monoclonal Antibody Strategy and Techniques" in Hybridoma technology in the bioscience and medicine", Edited by Timothy A. Springer (Plenum Publishing Corporation, 1985; Chapter 1). Fischer, D. G., Tal, N., Novick, D., Barak, S., and Rubinstein, M. (1993). "An antiviral soluble form of the LDL receptor induced by interferon". Science, 262 (5131), 250-3. Fischer, D.G., Novick, D., Cohen, B, Rubinstein, M. (1994). "Isolation and characterization of a soluble form of the LDL receptor, an interferon-induced antiviral protein". Proc Soc Exp Biol Med 206 (3), 228-32. Ferrini, J.B., Pichard, L., Domergue, J., and Maurel, P. (1997). "Long-term primary cultures of adult human hepatocytes". Chem-Biol Interactions 107:31-45. Fournier, C, Sureau, C, Ccste, J., Ducos, J., Pageaux, G., Larrey, D., Domergue, J., and Maurel, P. (1998). " In vitro infection of adult normal human hepatocytes in primary culture by hepatitis C virus". J. Gen Virol. 79:2367-74. Goldstein, J. L., Anderson, R. G., and Brown, "Coated pits, coated vesicles, and receptor-mediated endocytosis." Nature, 279 (5715), 679-85. Goldstein, J. L., Dana, S. E., Brunschede, G. Y., and Brown, "Genetic heterogeneity in familial hypercholesterolemia; evidence for two different mutations affecting functions of low-density lipoprotein receptor." Proc Natl Acad Sci USA, 72(3), 1092-6. Lanford R.E, Carey, K.D., Estlack, L.E., Smith, G.C., and Hay, R.V. (1989) "Analysis of plasma protein and lipoprotein synthesis in long-term primary cultures of baboon hepatocytes maintained in serum-free medium" In Vitro Cell Dev. Biol. 25:174-82. Laskus T., Radkowski, M., Wang, L.F., Cianciara, J., Vargas, H., and Rakela, J. (1997). "Hepatitis C virus negative strand RNA is not detected in peripheral blood mononuclear cells and viral sequences are identical to those in serum: a case against extrahepatic replication". J. Gen. Virol. 78:2747-50. Maurel P. (1996) "The use of adult human hepatocytes in primary culture and other in vitro systems to investigate drug metabolism in man". Adv.Drug Del.Rev. 22:105-132 Mendez, M.M., Green, L.L., Corvalan, J.R.F., Jia X-C, Maynard-Currie, E.E., Yang, X-D., Gallo, M.L., Louie, D.M., Lee, D.V., Erickson, K.L., Luna, J., Roy, C.M-N., Abderrahim, H., Kirshenbaum, F., Noguchi, M., Smith, D.M., Fukushima, A., Hales, J.F., Finer, M.H., Davis, C.G., Zsebo, K.M. and Jakobovits, A. (1997). "Functional transplant of megabase human immunoglobulin loci recapitulates human antibody response in mice". Nature Genetics, 15, 14656. Pichard, L., Fabre, I., Daujat, M, Domergue, J., Joyeux, H., and Maurel, P. (1992). "Effect of corticosteroids on the expression of cytochromes P450 and on cyclosporin A oxidase activity in primary cultures of human hepatocytes". Мої. Pharmacol. 41:1047-55. Riachmann, L., Clark, M., Waldmann, H., and Winter, G. (1988). "Reshaping human antibodies for therapy." Nature, 332, 323-27. Sudhof, T. C, Goldstein, J. L., Brown. M. S., and Russell. "The LDL receptor gene: a mosaic of exons shared with different proteins." Science, 228(4701), SIS-22. Urlaub, G. and Chasin, L.A. (1980) Isolation of Chinese Hamster Cell Mutants Deficient in Dihydrofolate Reductase Activity. Proc. Natl'. AcaU Sci. USA 77:4216-4220.
ДивитисяДодаткова інформація
Назва патенту англійськоюMonoclonal antibody, chimeric antibody, completely humanized antibody, antibody to antiidiotypic antibody or fragment thereof to receptor of lipoproteins of low density (lpld) of human, a method for obtaining and use thereof
Назва патенту російськоюМоноклональное антитело, химерное антитело, полностью гуманизированное антитело, антитело к антиидиотипичному антителу или его фрагмент к рецептору липопротеинов низкой плотности (лпнп) человека, способ их получения и применения
МПК / Мітки
МПК: G01N 33/68, C07K 16/28, C12P 21/08, G01N 33/577, C12N 5/20
Мітки: щільності, моноклональне, повністю, антитіло, спосіб, антиідіотипічного, гуманізоване, химерне, антитіла, одержання, фрагмент, ліпопротеїнів, людини, лпнщ, низької, рецептора
Код посилання
<a href="https://ua.patents.su/12-78489-monoklonalne-antitilo-khimerne-antitilo-povnistyu-gumanizovane-antitilo-antitilo-do-antiidiotipichnogo-antitila-abo-jjogo-fragment-do-receptora-lipoproteniv-nizko-shhilnosti-lpnshh.html" target="_blank" rel="follow" title="База патентів України">Моноклональне антитіло, химерне антитіло, повністю гуманізоване антитіло, антитіло до антиідіотипічного антитіла або його фрагмент до рецептора ліпопротеїнів низької щільності (лпнщ) людини, спосіб їх одержання</a>
Попередній патент: Рекурентний фільтр високих частот
Наступний патент: Вітроенергетична установка
Випадковий патент: Вулик для диких бджіл