Сухий порошковий препарат, який містить інгібітор фосфодіестерази
Номер патенту: 112296
Опубліковано: 25.08.2016
Автори: Ск'яретті Франческа, Кокконі Даніела, Більзі Роберто
Формула / Реферат
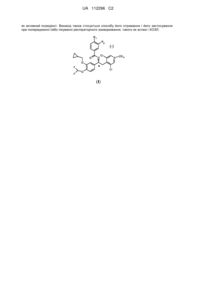
1. Інгальований сухий порошковий препарат, що містить мікронізовані частинки сполуки загальної формули (І) у вигляді (-)-енантіомера:
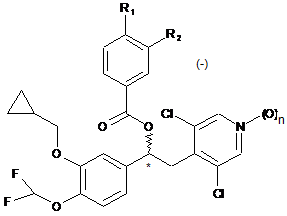 , (I)
, (I)
де:
n приймає значення 0 або 1;
R1 і R2 можуть бути однаковими або різними і вибрані з групи, що включає:
- лінійний або розгалужений (С1-С6)-алкіл, необов'язково заміщений одним або декількома атомами галогену;
- OR3, де R3 являє собою лінійний або розгалужений (С1-С6)-алкіл, необов'язково заміщений одним або декількома атомами галогену, або (С3-С7)-циклоалкільні групи; і
- HNSO2R4, де R4 являє собою лінійний або розгалужений (С1-С4)-алкіл, необов'язково заміщений одним або декількома атомами галогену;
де щонайменше один із замісників R1 і R2 являє собою HNSO2R4;
і грубі частинки носія, приготовані з фізіологічно прийнятного фармакологічно інертного матеріалу, які мають масовий діаметр, що складає від 150 до 400 мікронів, де вказану сполуку вводять в терапевтично ефективній однократній дозі, що містить від 300 до 1000 мкг.
2. Інгальований порошок за п. 1, де однократна доза складає від 300 до 600 мкг.
3. Інгальований порошок за п. 2, де однократна доза складає від 400 до 600 мкг.
4. Інгальований порошок за будь-яким з пп. 1-3, де сполука формули (І) являє собою 1-(3-циклопропілметокси-4-дифторметоксифеніл)-2-(3,5-дихлор-1-оксипіридин-4-іл)етиловий естер (-)-3-циклопропілметокси-4-метансульфоніламінобензойної кислоти (сполука С2).
5. Інгальований порошок за будь-яким з пп. 1-4, де фізіологічно прийнятний фармакологічно інертний матеріал являє собою кристалічний цукор, вибраний з групи, що включає глюкозу, арабінозу, мальтозу, сахарозу, декстрозу і лактозу, або поліспирт, вибраний з групи, що включає маніт, мальтит, лактит і сорбіт.
6. Інгальований порошок за п. 5, де цукор являє собою лактозу.
7. Інгальований порошок за п. 6, де цукор являє собою моногідрат α-лактози.
8. Інгальований порошок за будь-яким з пп. 1-7, де грубі частинки носія мають мас-медіанний діаметр (ММД), що складає від 212 до 355 мікронів.
9. Інгальований порошок за будь-яким з пп. 1-8, що додатково містить одну або декілька допоміжних речовин, вибраних з групи, що включає амінокислоти, розчинні у воді поверхнево-активні засоби, мастильні речовини і регулятори сипкості.
10. Інгальований порошок за п. 9, де допоміжною речовиною є мастильна речовина.
11. Інгальований порошок за п. 10, де допоміжною речовиною є стеарат магнію.
12. Інгальований порошок за п. 11, де стеарат магнію присутній в кількості, що складає від 0,01 до 2 % мас. з розрахунку на загальну масу препарату.
13. Інгальований порошок за п. 12, де кількість стеарату магнію складає від 0,02 до 1 % мас./мас.
14. Інгальований порошок за будь-яким з пп. 1-13, який додатково включає тонко подрібнені частинки фізіологічно прийнятного фармакологічно інертного матеріалу з ММД, що дорівнює або менший ніж 15 мікронів.
15. Сухий порошковий інгалятор, що містить інгальований сухий порошковий препарат за будь-яким з пп. 1-14.
16. Інгальований сухий порошковий препарат за будь-яким з пп. 1-14 для застосування для попередження і/або лікування респіраторного захворювання.
17. Інгальований сухий порошковий препарат за п. 16, де вказане захворювання являє собою астму і хронічне обструктивне захворювання легенів (ХОЗЛ).
18. Упаковка, що містить інгальований сухий порошковий препарат за будь-яким з пп. 1-14 і сухий порошковий інгалятор.
Текст
Реферат: Винахід стосується фармацевтичного препарату в формі інгальованого сухого порошку, що містить мікронізовані частинки сполуки загальної формули (І) у вигляді (-)-енантіомера R1 R2 (-) O O Cl N (O)n O * F F O Cl (I) UA 112296 C2 (12) UA 112296 C2 як активний інгредієнт. Винахід також стосується способу його отримання і його застосування при попередженні і/або лікуванні респіраторного захворювання, такого як астма і ХОЗЛ. UA 112296 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки Винахід стосується сухого порошкового препарату, прийнятного для інгаляційного введення за допомогою сухого порошкового інгалятора, що містить інгібітор фосфодіестерази-4 як активний інгредієнт. Винахід також стосується способу отримання препарату і його застосування при попередженні і/або лікуванні запального або обструктивного захворювання дихальних шляхів, такого як астма і хронічне обструктивне захворювання легенів (ХОЗЛ, COPD). Рівень техніки Порушення прохідності дихальних шляхів характеризується рядом серйозних респіраторних захворювань, що включають астму і хронічне обструктивне захворювання легенів (ХОЗЛ, COPD). Події, що приводять до порушення прохідності дихальних шляхів, включають набряк стінок дихальних шляхів, підвищене виділення слизу і запалення. Ліки для лікування респіраторних захворювань, таких як астма і ХОЗЛ, в цей час вводять за допомогою інгаляції. Однією з переваг інгаляційного способу введення в порівнянні з системним способом є можливість вивільнення ліків безпосередньо біля сайту дії, виключення будь-яких системних побічних ефектів, що забезпечує в результаті швидшу клінічну реакцію і вищий терапевтичний індекс. Важливий клас терапевтичних засобів, які досліджують з точки зору їх протизапальних ефектів для лікування запальних респіраторних захворювань, представлений інгібіторами ферментів фосфодіестерази (ФДЕ, PDE), зокрема фосфодіестерази 4 типу (що далі називається ФДЕ4, PDE4). Розкриті різні сполуки, які діють як інгібітори ФДЕ4. Однак практична значущість деяких інгібіторів ФДЕ4 першого покоління, таких як роліпрам і пікламіласт, обмежена через їх небажані побічні ефекти, такі як нудота, виділення шлункового соку і блювання, внаслідок їх дії на ФДЕ4 в центральній нервовій системі і внаслідок їх дії на ФДЕ4 в паріетальних клітинах в травному каналі. Причина вказаних побічних ефектів була широко досліджена. Встановлено, що ФДЕ4 існує в двох відмінних формах, що відповідають різним конформаціям, які позначають як високоафінний роліпрам-зв'язувальний сайт або HPDE4, особливо присутній в центральній нервовій системі і в паріетальних клітинах, і низькоафінний роліпрам-зв'язувальний сайт або LPDE4 (Jacobitz S. et al., Mol. Pharmacol., 1996, 50, 891-899), який виявлений в імунних і запальних клітинах. Хоча обидві форми, як виявляється, виявляють каталітичну активність, вони відрізняються по своїй чутливості до інгібіторів. Зокрема, сполуки з вищою афінністю для LPDE4, як виявляється, менш схильні давати побічні ефекти, такі як нудота, блювання і підвищене виділення шлункового соку. Отже, було б корисно створити селективні інгібітори форми LPDE4, терапевтично ефективні при введенні шляхом інгаляції. Сполуки з активністю селективного інгібування LDPE4 розкриті в публікації WO 2009/018909. Інші інгібітори ФДЕ4, що мають високу ефективність, є об'єктом заявки №, що знаходиться на одночасному розгляді РСТ/ЕР2010/000676, в якій несподівано встановлено, що присутність сульфонамідо-замісників на бензоатному залишку значно поліпшує ефективність і що (-)енантіомери більш ефективні, ніж відповідні (+)-енантіомери і рацемати. Більше того, встановлено, що вони могли б діяти синергетичним шляхом в комбінації з тривало діючими ß2-агоністами. Отже, такі сполуки можуть забезпечувати значну терапевтичну перевагу при лікуванні респіраторних захворювань, таких як астма і ХОЗЛ, при введенні шляхом інгаляції. Вказані лікарські засоби могли б бути введені в дихальні шляхи шляхом інгаляції в формі сухого порошку за допомогою прийнятних інгаляторів, відомих як сухі порошкові інгалятори (СПІ, DPI). Мета даного винаходу полягає в розробці інгальованої сухої порошкової композиції, що містить сполуку загальної формули (I), що діє як інгібітор ФДЕ4, як активний інгредієнт. Оптимально вказаний препарат буде виявляти хорошу текучість, хорошу рівномірність розподілу активного інгредієнта і адекватну хімічну і фізичну стабільність в пристосуванні перед застосуванням. Крім того, препарат буде давати хорошу респірабельну фракцію, а також буде випускати точну терапевтично активну дозу активного інгредієнта Суть винаходу В одному аспекті даний винахід пропонує фармацевтичний препарат в формі інгальованого сухого порошку, що містить мікронізовані частинки сполуки загальної формули (I) як активний інгредієнт і частинки фізіологічно прийнятного фармакологічно інертного твердого носія. 1 UA 112296 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до іншого аспекту даний винахід пропонує сухий порошковий інгалятор, що містить інгальований сухий порошок винаходу. У ще одному аспекті даний винахід стосується інгальованого сухого порошку винаходу для застосування для попередження і/або лікування запального або обструктивного захворювання дихальних шляхів, такого як астма або хронічне обструктивне захворювання легенів (ХОЗЛ). У ще одному аспекті даний винахід стосується способу попередження і/або лікування запального або обструктивного захворювання дихальних шляхів, такого як астма або хронічне обструктивне захворювання легенів (ХОЗЛ), який включає введення шляхом інгаляції терапевтично ефективної кількості інгальованого сухого порошку винаходу. І, нарешті, даний винахід стосується упаковки, що містить інгальований сухий порошковий препарат винаходу і сухий порошковий інгалятор. Визначення понять Визначення "активні ліки", "активний інгредієнт", "діюча речовина" і "активна речовина", "активна сполука" і "терапевтичний засіб" використовують як синоніми. Визначення "по суті чиста" означає активну сполуку, що має оптичну чистоту вищу ніж 90 % з розрахунку на масу вказаної сполуки, переважно вищу ніж 95 % мас./мас., переважно вищу ніж 97 % мас./мас., більш переважно вищу ніж 97,5 % мас./мас. Під "однократною терапевтично ефективною дозою" розуміють кількість активного інгредієнта, введеного за один раз шляхом інгаляції при приведенні в дію інгалятора. Вказана доза може бути випущена за одне або декілька приведень в дію, переважно за одне приведення в дію (впорскування) інгалятора. "Приведення в дію" означає вивільнення активного інгредієнта з пристосування шляхом однократного приведення в дію (наприклад, механічного або вдихом). Загалом розмір частинок кількісно визначають шляхом вимірювання характеристичного еквівалентного сферичного діаметра, відомого як об'ємний діаметр, за допомогою лазерної дифракції. Розмір частинок також може бути кількісно визначений шляхом вимірювання масового діаметра за допомогою відповідного відомого вимірювального приладу, такого як, наприклад, ситовий аналізатор. Об'ємний діаметр (ОД, VD) пов'язаний з масовим діаметром (МД, MD) щільністю частинок (передбачаючи для частинок незалежну від розміру щільність). У даний заявці розмір частинок виражають в значеннях масового діаметра (МД), а розподіл частинок по розмірах виражають в значеннях: i) мас-медіанного діаметра (ММД, MMD), який відповідає діаметру 50 % (масових або об'ємних, відповідно) частинок; і ii) МД в мікронах 10 % і 90 % частинок, відповідно. Поняття ММД і середній розмір частинок використовують як синоніми. Визначення "хороша текучість" стосується препарату, з яким легко працювати під час виробничого процесу і який здатний гарантувати точний і відтворюваний випуск терапевтично ефективної дози. Характеристики текучості можуть бути оцінені шляхом вимірювання індексу Кара; індекс Кара менший ніж 25, як звичайно приймають, вказує на хороші характеристики текучості. Вираз "хороша гомогенність" стосується препарату, де при змішуванні однорідність вмісту активного інгредієнта, виражена у вигляді відносного стандартного відхилення (ВСВ, RSD), складає менше ніж 7,5 %, переважно дорівнює або менша ніж 5,0 %. Вираз "хімічно стабільний" стосується препарату, який відповідає вимогам посібника ICH Guideline Q1А, що стосується випробувань стабільності нових активних речовин (і медичних продуктів) ("Stability Testing of new Active Substances (and Medicinal Products)»). Вираз "фізично стабільний в пристосуванні перед застосуванням" стосується препарату, де активні частинки по суті не піддаються сегрегації і/або не відділяються від поверхні частинок носія під час виготовлення сухого порошку і у випускаючому пристосуванні до застосування. Схильність до сегрегації може бути оцінена відповідно до публікації Staniforth et al., J. Pharm. Pharmacol. 34, 700-706, 1982, і її вважають прийнятною, якщо розподіл активного інгредієнта в порошковому препараті після випробування, виражений у вигляді відносного стандартного відхилення (ВСВ), не змінюється значно відносно ВСВ препарату перед випробуванням. Вираз "респірабельна фракція" стосується показника процента активних частинок, які могли б досягнути глибини легенів у хворого. Респірабельну фракцію, що також називається фракцією дрібнодисперсних частинок, оцінюють у відповідному приладі in vitro, такому як багатоступінчастий каскадний імпактор (Multistage Cascade Impactor) або багатоступінчастий рідинний імпінгер (МСРІ) (Multistage Liquid Impigner (MLSI)) відповідно до методик, представлених в звичайному збірнику Pharmacopeias. 2 UA 112296 C2 5 10 15 20 25 Респірабельну фракцію розраховують по відношеннях між випущеною дозою і масою дрібнодисперсних частинок (формально дозою дрібнодисперсних частинок). Випущену дозу розраховують з кумулятивного осаду в приладі, тоді як масу дрібнодисперсних частинок розраховують з осаду на рівнях від 3 (S3) і до фільтра (AF), що відповідає частинкам ≤4,7 мікрон. Респірабельна фракція вища ніж 30 % є показником хороших інгаляційних характеристик. Вираз "точна терапевтично ефективна доза активного інгредієнта" стосується препарату, де розкид між середньою випущеною добовою дозою і середньою виданою дозою дорівнює або менший ніж 15 %, переважно менший ніж 10 %. Докладний опис винаходу Композиції даного винаходу являють собою фармацевтичні препарати в формі інгальованого сухого порошку, що містить мікронізовані частинки сполуки загальної формули (I) у вигляді (-)-енантіомера: де: n приймає значення 0 або 1; R1 і R2 можуть бути однаковими або різними, і вибрані з групи, що включає: - лінійний або розгалужений (С1-С6)-алкіл, необов'язково заміщений одним або декількома атомами галогену; - OR3, де R3 являє собою лінійний або розгалужений (С1-С6)-алкіл, необов'язково заміщений одним або декількома атомами галогену, або (С3-С7)-циклоалкільні групи; і - HNSO2R4, де R4 являє собою лінійний або розгалужений (С1-С4)-алкіл, необов'язково заміщений одним або декількома атомами галогену; де щонайменше один із замісників R1 і R2 являє собою HNSO2R4; і частинки фізіологічно прийнятного фармакологічно інертного твердого носія. У контексті винаходу сполуки загальної формули (I) використовують в формі по суті чистого (-)-енантіомера. Відповідно до переважного варіанту здійснення сполуки загальної формули (I) вибирають зі сполук С1, С2, С3, С4, С5 і С6, представлених нижче. 30 Сполука С1 С2 С3 С4 С5 С6 Хімічна назва 1-(3-Циклопропілметокси-4-дифторметоксифеніл)-2-(3,5- дихлор-піридин-4іл)етиловий ефір (-)-3-циклопропілметокси-4-метан-сульфоніламінобензойної кислоти 1-(3-Циклопропілметокси-4-дифторметоксифеніл)-2-(3,5- дихлор-1-оксипіридин-4іл)етиловий ефір (-)-3- циклопропілметокси-4-метансульфоніламінобензойної кислоти 1-(3-Циклопропілметокси-4-дифторметоксифеніл)-2-(3,5- дихлор-1-оксипіридин-4іл)етиловий ефір (-)-4- циклопропілметокси-3-метансульфоніламінобензойної кислоти 1-(3-Циклопропілметокси-4-дифторметоксифеніл)-2-(3,5- дихлор-1-оксипіридин-4іл)етиловий ефір (-)-3,4-біс-метансульфоніл-амінобензойної кислоти 1-(3-Циклопропілметокси-4-дифторметоксифеніл)-2-(3,5- дихлор-1-оксипіридин-4іл)етиловий ефір (-)-3- метансульфоніламіно-4-метилбензойної кислоти 1-(3-Циклопропілметокси-4-дифторметоксифеніл)-2-(3,5дихлор-1-оксипіридин-4-іл)етиловий ефір (-)-4- метансульфоніламіно-3-метилбензойної кислоти 3 UA 112296 C2 5 10 15 20 25 30 35 40 45 50 55 60 У варіанті здійснення винаходу переважною сполукою є С1. В іншому варіанті сполукою є С2. В інших переважних варіантах здійснення сполукою може бути С3, С4, С5 або С6. Композиції відповідно до даного винаходу містять активний інгредієнт в такій кількості, що у випадку введення шляхом інгаляції з інгаляторів терапевтично ефективна однократна доза (що далі називається однократною дозою) сполуки загальної формули (I) переважно складає від 10 до 2000 мкг, більш переважно від 20 до 1000 мкг, переважно від 50 до 800 мкг, більш переважно від 80 до 700 мкг, і навіть більш переважно від 100 до 600 мкг. Відповідно до переважного варіанту здійснення однократна доза може містити від 100 до 300 мкг, тоді як в іншому переважному варіанті здійснення однократна доза може містити від 200 до 800 мкг, більш переважно від 300 до 600 мкг. В інших варіантах здійснення однократна доза може становити 100 мкг, 200 мкг, 400 мкг або 600 мкг. Однократна доза буде залежати від типу і серйозності захворювання і станів (вага, стать, вік) хворого і буде вводитися один або декілька разів на день, переважно один або два рази на день. Добова доза, при якій фармацевтична композиція, що містить сполуку загальної формули (I), буде складати від 100 до 1600 мкг, переважно від 200 до 800 мкг і більш переважно від 200 до 600 мкг. В одному переважному варіанті добова доза може бути досягнута за рахунок однократного або двократного введення. В іншому переважному варіанті добова доза може бути досягнута за рахунок однократного введення і випущена за одне приведення в дію інгалятора. В іншому переважному варіанті здійснення добова доза може бути досягнута за рахунок однократного введення і випущена за декілька приведень в дію інгалятора, переважно двох. В іншому переважному варіанті здійснення добова доза може бути досягнута за рахунок двократного введення і випущена за одне приведення в дію інгалятора. В іншому переважному варіанті здійснення добова доза може бути досягнута за рахунок двократного введення і випущена за декілька приведень в дію інгалятора, переважно двох. Частинки сполуки загальної формули (I) в препараті відповідно до винаходу повинні знаходитися в дрібнодисперсній (мікронізованій) формі, тобто, їх мас-медіанний діаметр звичайно повинен дорівнювати або бути меншим ніж 10 мікрон, переважно меншим ніж 6 мікрон, більш переважно складати від 1 до 6 мікрон. У деяких варіантах здійснення розмір частинок може задовольняти наступні вимоги: i) не більше ніж 10 % частинок має масовий діаметр менший ніж 0,8 мікрон; ii) не більше ніж 50 % частинок має масовий діаметр менший ніж 1,7 мікрон, переважно складає від 1,8 до 2,5 мікрон; і iii) щонайменше 90 % частинок має масовий діаметр менший ніж 6 мікрон. Активний інгредієнт може бути зроблений з бажаним розміром частинок з використанням відомих способів, наприклад, розмелюванням, прямим осадженням, розпилювальним сушінням, сушінням виморожування або надкритичними рідинами. Частинки носія можуть бути виготовлені з будь-якого фізіологічно прийнятного фармакологічно інертного матеріалу або комбінації матеріалів, прийнятного для інгаляційного застосування. Наприклад, частинки носія можуть складатися з одного або декількох матеріалів, вибраних з цукроспиртів; поліолів, наприклад, сорбіту, маніту або ксиліту, і кристалічних цукрів, включаючи моносахариди і дисахариди; неорганічних солей, таких як хлорид натрію і карбонат кальцію; органічних солей, таких як лактат натрію; і інших органічних сполук, таких як сечовина, полісахариди, наприклад, крохмаль і його похідні, олігосахариди, наприклад, циклодекстрини і декстрини. Переважно частинки носія отримують з кристалічного цукру, наприклад, моносахариду, такого як глюкоза або арабіноза, або дисахариду, такого як мальтоза, сахароза, декстроза або лактоза. Переважно частинки носія отримують з лактози, переважно з моногідрату альфа-лактози. У одному варіанті винаходу порошковий препарат може знаходитися в формі агломерованих сферонізованих частинок, також відомих як м'які гранули, де частинки сполуки загальної формули (I) і частинки носія знаходяться в дрібнодисперсній формі, тобто, їх масмедіанний діаметр звичайно складає менше ніж 10 мікрон, переважно від 1 до 6 мікрон. Вказані препарати можуть бути отримані відомими способами. Як правило, процес складається зі стадій: i) мікронізування разом активного інгредієнта і носія; 4 UA 112296 C2 5 10 15 20 25 30 35 40 45 50 55 ii) проведення агломерації і сфероїдизування отриманої співмікронізованої суміші. З іншого боку, процес включає наступні стадії: i) мікронізування окремо активного інгредієнта і носія; ii) змішування мікронізованих компонентів; і iii) проведення агломерації і сфероїдизування отриманої суміші. В іншому варіанті здійснення винаходу препарат містить грубі частинки носія разом з ліками в дрібнодисперсній формі, тип препарату, відомий в даній галузі як впорядкована суміш. Переважно грубі частинки вказаного носія мають масовий діаметр (МД) щонайменше 50 мікрон, більш переважно більше ніж 80 мікрон. Переважно МД складає від 90 до 500 мікрон. У деяких варіантах винаходу МД може складати від 90 до 150 мікрон. В інших варіантах здійснення МД може складати від 150 до 400 мікрон з ММД переважно більше ніж 175 мікрон, і більш переважно МД може складати від 210 до 355 мікрон. Бажаний розмір частинок може бути отриманий просіюванням відповідно до відомих способів. Коли МД складає від 150 до 400 мікрон, грубі частинки носія переважно мають відносно високо тріщинувату поверхню, тобто, на якій існують тріщини і борозни і інші заглиблені ділянки, що називаються в цьому випадку узагальнено тріщинами. "Відносно високо тріщинуваті" грубі частинки можуть бути описані в значеннях показника тріщинуватості або коефіцієнта шорсткості, як описано в публікаціях WO 01/78695 і WO 01/78693, які включені як посилання, і вони можуть бути охарактеризовані відповідно до представленого опису. Грубі частинки вказаного носія також можуть бути охарактеризовані в значеннях насипної густини після ущільнення або загальної пористості, виміряних, як представлено в публікації WO 01/78695. Насипна густина після ущільнення грубих частинок носія переважно складає менше ніж 0,8 3 3 г/см , переважно від 0,8 до 0,5 г/см . 3 3 Загальна пористість становить щонайменше 0,8 см , переважно щонайменше 0,9 см . Коли препарат винаходу знаходиться в формі вищеназваної впорядкованої суміші, він переважно може містити допоміжну речовину, здатну стимулювати вивільнення активних частинок з частинок носія при приведенні в дію інгалятора, і, отже, здатну поліпшувати респірабельну фракцію. Допоміжна речовина, яка переважно пов'язана з поверхнею грубих частинок носія, являє собою матеріал, відмінний від частинок носія. Переважно допоміжна речовина являє собою амінокислоту, переважно вибрану з групи, що включає лейцин, ізолейцин, лізин, валін, метіонін і фенілаланін. Добавка може являти собою сіль похідного амінокислоти, наприклад, аспартам або ацесульфам К. В одному варіанті винаходу частинки добавки по суті складаються з лейцину, переважно Lлейцину. З іншого боку, допоміжна речовина може включати або може складатися з однієї або декількох розчинних у воді поверхнево-активних речовин, наприклад, лецитину, особливо соєвого лецитину. У конкретному варіанті здійснення винаходу допоміжний матеріал може включати або може складатися з однієї або декількох мастильних речовин, вибраних з групи, що включає стеаринову кислоту і її солі, такі як стеарат магнію, лаурилсульфат натрію, стеарилфумарат натрію, стеариловий спирт, монопальмітат сахарози. Іншими можливими допоміжними речовинами є тальк, діоксид титану, діоксид алюмінію і діоксид кремнію. Переважно частинки добавки мають вихідний середній розмір частинок менший ніж 35 мікрон. Переважно вони мають середній розмір частинок не більший ніж 15 мікрон, більш переважно не більший ніж 10 мікрон. Оптимальна кількість допоміжної речовини буде залежати від хімічного складу і інших властивостей допоміжної речовини. Як правило, кількість добавки буде складати не більше ніж 10 % мас. з розрахунку на загальну масу препарату. Однак вважають, що для більшості добавок кількість допоміжної речовини повинна бути не більшою ніж 5 %, переважно не більшою ніж 2 % або навіть не більшою ніж 1 % мас. або не більшою ніж 0,5 % з розрахунку на загальну масу препарату. Звичайно кількість допоміжної речовини становить щонайменше 0,01 % мас. з розрахунку на загальну масу препарату. В одному переважному варіанті винаходу допоміжною речовиною є стеарат магнію. 5 UA 112296 C2 5 10 15 20 25 30 35 40 45 50 55 Кількість стеарату магнію звичайно складає від 0,01 до 2 %, переважно від 0,02 до 1 %, більш переважно від 0,1 до 0,5 % мас. з розрахунку на загальну масу препарату. У деяких варіантах здійснення стеарат магнію може покривати поверхню частинок носія таким чином, що ступінь покриття поверхні молекулами становить щонайменше 5 %, переважно більше ніж 10 %, більш переважно більше ніж 15 %, навіть більш переважно дорівнює або більше ніж 25 %. Міра покриття поверхні молекулами, що вказує на процент загальної поверхні частинок носія, покритої стеаратом магнію, може бути визначена з шляхом вимірювання кута контакту з водою, як представлено в публікації WO 00/53157 або в заявці №, що знаходиться на одночасному розгляді ЕР 10158951.3. У випадку дуже високих мір покриття поверхні, тобто, вищих ніж 60 %, покриття може бути досягнуте при використанні способу, розкритого в заявці №, що знаходиться на одночасному розгляді ЕР 10158951.3, процитованій вище. Міра, до якої стеарат магнію покриває поверхню частинок лактози, також може бути визначена за допомогою скануючої електронної мікроскопії (СЕМ, SEM), універсальної аналітичної методики, добре відомої в даній галузі техніки. Така мікроскопія може бути оснащена ЕДР-аналізатором (енергодисперсійним рентгенівським (ЕДР, EDX) аналізатором), який може давати зображення, селективне до деяких типів атомів, наприклад, атомів магнію. Таким способом можна отримувати чіткі дані, основані на розподілі стеарату магнію на поверхні частинок носія. З іншого боку, СЕМ може бути об'єднаний з ІЧ спектроскопією або спектроскопією комбінаційного розсіювання світла для визначення міри покриття відповідно до відомих методик. Іншою аналітичною методикою, яка може бути успішно використана, є фотоелектронний рентгенівська спектроскопія (ФЕРС, XPS), за допомогою якої можливо розрахувати як міру покриття, так і глибину плівки стеарату магнію навколо частинок лактози. Вимірювання ФЕРС можуть бути проведені за допомогою комерційно доступних приладів, таких як прилад Axis-Ultra (Kratos Analytical, Manchester, UK), як правило, з використанням монохроматованого А1 Кα випромінювання по відомих методиках. Препарати винаходу в формі впорядкованої суміші також можуть містити дрібнодисперсні частинки фізіологічно прийнятного фармакологічно інертного матеріалу з мас-медіанним діаметром (ММД), що дорівнює або менший ніж 15 мікрон, переважно дорівнює або менший ніж 10 мікрон, навіть більш переважно дорівнює або менший ніж 6 мікрон. Процент дрібнодисперсних частинок фізіологічно прийнятного фармакологічно інертного матеріалу переважно складає від 0,1 до 40 % від загальної кількості препарату. Переважно грубі частинки і дрібнодисперсні частинки складаються з одного і того ж фізіологічно прийнятного фармакологічно інертного матеріалу. У переважному варіанті здійснення, особливо коли однократна доза активного інгредієнта дорівнює або менша ніж 300 мкг, переважно дорівнює або менша ніж 200 мкг, препарат знаходиться в формі твердих гранул відповідно до вказівок публікації WO 01/78693. Вказаний препарат містить: i) частинки сполуки загальної формули (I) в мікронізованій формі; ii) фракцію мікрочастинок, що складається з суміші, яка складається із частинок фізіологічно прийнятного фармакологічно інертного матеріалу і частинок допоміжної речовини, причому вказані мікрочастинки мають ММД, що дорівнює або менший ніж 10 мікрон, переважно дорівнює або менший ніж 6 мікрон; і iii) фракцію частинок фізіологічно прийнятного фармакологічно інертного матеріалу, що має високотріщинувату поверхню і масовий діаметр (МД), що складає від 150 до 400 мікрон, переважно від 212 до 355 мікрон. Переважно фракція мікрочастинок складається з 90-99,5 % мас. фізіологічно прийнятного фармакологічно інертного матеріалу і 0,5-10 % мас. допоміжної речовини; і відношення між фракцією мікрочастинок і фракцією грубих частинок складають від 1:99 до 40:60 % мас., переважно від 5:95 до 30:70 % мас., навіть більш переважно від 10:90 до 20:80 % мас. Переважно фізіологічно прийнятний інертний матеріал являє собою моногідрат α-лактози, і допоміжною речовиною є стеарат магнію. У більш переважному варіанті здійснення фракція мікрочастинок містить від 98 до 99 % мас. моногідрату α-лактози і від 1 до 2 % мас. стеарату магнію, і відношення між фракцією мікрочастинок і фракцією грубих частинок, виготовлених з моногідрату α-лактози, становлять 10:90 % мас., відповідно. 6 UA 112296 C2 5 10 15 20 25 30 35 40 45 50 55 60 Кількість стеарату магнію в кінцевому препараті переважно складає від 0,01 до 1,0 % мас., переважно від 0,05 до 0,5 % мас., більш переважно від 0,1 до 0,4 % мас. з розрахунку на загальну масу препарату. Препарат в формі впорядкованої суміші відповідно до винаходу може бути приготований відомими способами. Вказані способи включають стадію змішування разом грубих частинок носія, необов'язкових дрібнодисперсних частинок носія і частинок добавки, і, нарешті, додавання до отриманої суміші дрібнодисперсної фармацевтично активної сполуки. Особливо переважний препарат відповідно до даного винаходу може бути приготований способами, представленими в публікації WO 01/78693. Зі способів, розкритих в публікації, препарат переважно отримують відповідно до процесу, який включає наступні стадії: а) отримання мікрочастинок, що складаються з суміші, яка складається з частинок, виготовлених з фізіологічно прийнятного фармакологічно інертного матеріалу і частинок добавки, причому інертний матеріал і добавку спочатку змішують разом і потім піддають співмікронізуванню; b) змішування мікрочастинок стадії а) з грубими частинками фізіологічно прийнятного фармакологічно інертного матеріалу так, що мікрочастинки прикріплюються в поверхні грубих частинок; с) додавання шляхом змішування частинок діючої речовини в мікронізованій формі до частинок стадії b). Стадія співмікронізування може бути проведена відомими способами, наприклад, як представлено в публікації WO 02/00197. Переважно вказану стадію проводять шляхом розмелювання, більш переважно з використанням струминного млина відповідно до умов, представлених в публікації WO 01/78693. У конкретному варіанті здійснення мікрочастинки стадії а), отримані шляхом співмікронізування, можуть бути піддані стадії кондиціонування відповідно до умов, розкритих в заявці №, що знаходиться на одночасному розгляді ЕР 10160565.7. Переважно під час стадії а) добавка може бути закладена в утворені мікрочастинки; або, з іншого боку, у випадку мастильної речовини, такої як стеарат магнію, добавка може покривати поверхню частинок носія таким чином, що міра покриття поверхні молекулами становить щонайменше 5 %, переважно більше ніж 10 %, більшпереважно більше ніж 15 %, навіть більш переважно більше ніж 35 %. Міра покриття поверхні молекулами вказує на процент загальної поверхні частинок носія, покритих стеаратом магнію. Присутність допоміжної речовини, закладеної в мікрочастинки, може бути визначена відомими способами, наприклад, за допомогою електронного скануючого мікроскопа, зв'язаного з мікрокалориметрією. Навпаки, як повідомлялося вище, міра покриття поверхні молекулами може бути визначена шляхом вимірювання кута контакту з водою, як це показано в публікації WO 00/53157 або іншими відомими інструментальними засобами. Препарати даного винаходу також можуть містити інші терапевтичні засоби, придатні для попередження і/або лікування респіраторних захворювань, наприклад, бета2-агоністи, такі як сальбутамол, сальметерол і вілантерол; кортикостероїди, такі як флутиказон пропіонат або фуроат, флунізолід, мометазон фуроат, рофлепонід і циклезонід; антихолінергічні або антимускаринові агенти, такі як іпратропію бромід, окситропію бромід, тіотропію бромід, оксибутинін, і їх комбінації. Сухий порошковий препарат, описаний у винаході, може бути використаний у всіх звичайних сухих порошкових інгаляторах, таких як однодозові або багатодозові інгалятори. Наприклад, препаратом винаходу можуть бути заповнені тверді желатинові капсули, в свою TM чергу, завантажені в однодозовий інгалятор, такий як Aerolizer . З іншого боку, препаратом у вигляді порошку може бути заповнений багатодозовий інгалятор, що включає порошковий резервуар, такий як резервуар, описаний в публікації WO 2004/012801. Введення препаратів даного винаходу може бути призначене для попередження і/або лікування слабких, помірних або серйозних гострих або хронічних симптомів або для профілактичного лікування запального або обструктивного захворюванні дихальних шляхів, такого як астма і хронічне обструктивне захворювання легенів (ХОЗЛ). Інші респіраторні захворювання, що характеризуються пригніченням прохідності периферичних дихальних шляхів внаслідок запалення і наявності слизу, такі як хронічний 7 UA 112296 C2 5 обструкційний бронхіоліт і хронічний бронхіт, також можуть бути полегшені за допомогою препарату даного винаходу. Винахід проілюстрований повніше за допомогою приведених нижче прикладів. ПРИКЛАДИ Приклад 1 - Інгальований сухий порошковий препарат, що містить сполуку С2 (препарат 1) Порошковий препарат відповідно до винаходу має склад, представлений в таблиці 1: Таблиця 1 Компоненти Кількості На впорскування інгалятора Однократна доза мг % мкг 0,2 1,0 200 17,82 89,1 1,98 9,9 20 Сполука С2 Моногідрат альфа-лактози 212-355 мкм Співмікронізування частинки Загальна маса 10 15 20 25 30 35 Партію розміром 1 кг сухого порошкового препарату готують, як описано далі. Кристалічний 1-(3-циклопропілметокси-4-дифторметокси-феніл)-2-(3,5дихлор-1оксипіридин-4-іл)етиловий ефір (-)-3-циклопропілметокси-4-метансульфоніламінобензойної кислоти (сполука С2) мікронізують способами, відомими в даній галузі техніки, з отриманням активної речовини в формі частинок, що мають типовий розмір частинок, прийнятних для інгаляції. Частинки моногідрату α-лактози, що мають середній розмір частинок менший ніж 250 мікрон, і частинки стеарату магнію, що мають середній розмір частинок менший ніж 35 мікрон, в співвідношенні 98:2 % мас. співмікронізують шляхом розмелювання в струминному млині, працюючому в атмосфері азоту, отримують фракцію співмікронізованих частинок, позначену як співмікронізовані частинки. Вказані співмікронізовані частинки змішують з тріщинуватими грубими частинками моногідрату α-лактози, що мають масовий діаметр, що складає 212-355 мікрон, і отриманими просіюванням, в співвідношенні 90:10 % мас. Змішування проводять в змішувачі Turbula протягом 4 годин. До частини отриманої суміші додають мікронізовану сполуку С2, і отриману суміш просівають через сито 250 мкм. Додають частину описаної вище суміші, що залишилася, і змішують в змішувачі Turbula протягом 90 хвилин при 32 об/хв з отриманням кінцевого препарату. Кінцевим препаратом заповнюють тверді желатинові капсули і завантажують в інгалятор TM Aerolizer . Характеристики аерозолю оцінюють з використанням багатоступінчастого рідинного nd імпінгеру (МСРІ) відповідно до методики, описаної в збірнику European Pharmacopoeia 2 edition, 1995, part V.5.9.1, pp. 15-17. Результати в значеннях випущеної дози (ВД), маса дрібнодисперсних частинок (МДЧ, FPM), фракції дрібнодисперсних частинок (ФДЧ, FPF) і мас-медіанного аеродинамічного діаметра (ММАД, MMAD), представлена в таблиці 2. Таблиця 2 ВД мкг 148,5 40 45 МДЧ мкг 105,7 ФДЧ % 71,1 ММАД мкм 1,5 Можна помітити, що препарат, який містить С2 як активний інгредієнт, здатний давати прекрасну дрібнодисперсну респірабельну фракцію (ФДЧ). Аналогічним чином можуть бути приготовані препарати, що містять сполуки С1, С3, С4, С5 або С6. Приклад 2 - Інгальований сухий порошковий препарат, що містить сполуку С2 (препарат 2) Готують порошковий препарат з композицією, аналогічною прикладу 1, але що має однократну композицію, тобто, композицію на одне впорскування інгалятора, представлену в таблиці 3. 8 UA 112296 C2 Таблиця 3 Компоненти Сполука С2 Моногідрат альфа-лактози 212-355 мкм Співмікронізовані частинки Загальна маса 5 Кількості На впорскування інгалятора мг % 0,1 1,0 8,91 89,1 0,99 9,9 10 Однократна доза мкг 100 Препаратом заповнюють багатодозовий сухий порошковий інгалятор, описаний в публікації WO 2004/012801. Характеристики аерозолю визначають, як показано в прикладі 1. Результати представлені в таблиці 4. Таблиця 4 ВД мкг 96,9 10 15 20 МДЧ мкг 65,1 ФДЧ % 67,2 ММАД мкм 1,2 У цьому випадку ФДЧ, як виявляється, також є прекрасною, показуючи, що вказаний тип препарату здатний забезпечувати хороші характеристики аерозолю, незалежно від використовуваного інгалятора. Приклад 3 - Інгальований сухий порошковий препарат, що містить сполуку С2 (препарати 3, 4, 5 і 6) Порошкові препарати з композицією, аналогічною прикладам 1 або 2, готують з використанням різної ефективності і процентного складу співмікронізованих частинок. Композиції представлені в таблиці 5. Кінцевими препаратами заповнюють тверді желатинові капсули і завантажують в інгалятор TM Aerolizer . Аналогічно, готують порошкові препарати з такою ж відносною процентною композицією, але з одиничною дозою 10 мг, і заповнюють багатодозовий порошковий інгалятор, описаний в публікації WO 2004/012801. Таблиця 5 Ефективність Моногідрат α-лактози 212-355 мкг(мг)) Моногідрат α-лактози 212-355 мкг(%)) Співмікронізовані частинки (мг) Співмікронізовані частинки (%) Сполука С2 (мг) Сполука С2 (%) Усього 25 20 мкг/ 20 мг 17,982 89,9 1,998 10 0,020 0,1 20 мг 20 мкг/ 20 мг 18,981 94,9 0,999 5 0,020 0,1 20 мг 200 мкг/ 20 мг 18,81 94,0 0,99 5 0,200 1,0 20 мг 400 мкг/ 20 мг 17,64 88,0 1,96 10 0,400 2,0 20 мг Аналогічним чином готують препарати, що містять сполуки С1, С3, С4, С5 або С6. Приклад 4 - Інгальовані сухі порошкові препарати, що містять сполуку С2 (препарати 7 і 8) Готують інші порошкові препарати відповідно до винаходу з композиціями, представленими в таблицях 6 і 7. Таблиця 6 Компоненти Сполука С2 Моногідрат альфа-лактози 90-150 мкм Кількості На впорскування інгалятора мг % 0,100 1,0 9,875 98,75 9 Однократна доза мкг 100 UA 112296 C2 Продовження таблиці 6 Стеарат магнію Загальна маса 0,025 10 0,25 Таблиця 7 Компоненти Кількості На впорскування інгалятора мг % 0,200 2,0 9,79 97,90 0,01 0,10 10 Сполука С1 Моногідрат альфа-лактози 90-150 мкм Стеарат магнію Загальна маса 5 10 15 20 Однократна доза мкг 200 Аналогічним чином готують препарати, що містять сполуки С1, С3, С4, С5 або С6. Приклад 5 - Оцінка протизапальної активності сполуки С2 Ефективність однієї з переважних сполук даного винаходу оцінюють in vivo в експериментальній моделі гострого запалення легенів, слідуючи методу, описаному в публікації Eur. J. Pharmacol., 2002, Feb. 22, 437(3):187-94, з незначними змінами. Стисло, самців щурів Brown-Norway (150-200 г) сенсибілізують внутрішньочеревинною ін'єкцією суспензії, що містить овальбумін (ОВА, OVA, 1 мг/щур) і Al(OH) 3 (100 мг/щур) в 1 мл фізіологічного розчину, протягом 3 послідовних днів. Через три тижні індукують запалення дихальних шляхів за допомогою інгальованого антигену (ОВА, 1 % в фізіологічному розчині). Оброблених носієм-контролем тварин піддають впливу аерозолю фізіологічного розчину. Аерозольна провокація за допомогою ОВА приводить до статистично значущого підвищення концентрації нейтрофілів, еозинофілів і лімфоцитів в бронхоальвеолярної лаважної рідини (БАЛР, BALF), всі критерії гостро протікаючого легеневого запалення. Для визначення інгібуючої ефективності мікронізовану сполуку С2 змішують з лактозою при різних концентраціях і вводять за допомогою інтратрахеального способу у вигляді однократної дози за дві години до аерозолю антигену. Отримують криву дозу-відгук інгібуючого ефекту випробуваної сполуки на індуковану ОВА еозинофілію в БАЛР і дозу ЕС50 сполуки С2 приймають за міру ефективності в даному біоаналізі. Величина дози ЕС50 сполуки С2 дорівнює 0,028 мкмоль/кг (0,016-0,051) маси тіла, що повинно відповідати дозі для людини 100-600 мкг на добу. ФОРМУЛА ВИНАХОДУ 25 1. Інгальований сухий порошковий препарат, що містить мікронізовані частинки сполуки загальної формули (І) у вигляді (-)-енантіомера: R1 R2 (-) O O Cl N (O)n O * F 30 F O Cl , (I) де: n приймає значення 0 або 1; R1 і R2 можуть бути однаковими або різними і вибрані з групи, що включає: 10 UA 112296 C2 5 10 15 20 25 30 35 40 - лінійний або розгалужений (С1-С6)-алкіл, необов'язково заміщений одним або декількома атомами галогену; - OR3, де R3 являє собою лінійний або розгалужений (С1-С6)-алкіл, необов'язково заміщений одним або декількома атомами галогену, або (С3-С7)-циклоалкільні групи; і - HNSO2R4, де R4 являє собою лінійний або розгалужений (С1-С4)-алкіл, необов'язково заміщений одним або декількома атомами галогену; де щонайменше один із замісників R1 і R2 являє собою HNSO2R4; і грубі частинки носія, приготовані з фізіологічно прийнятного фармакологічно інертного матеріалу, які мають масовий діаметр, що складає від 150 до 400 мікронів, де вказану сполуку вводять в терапевтично ефективній однократній дозі, що містить від 300 до 1000 мкг. 2. Інгальований порошок за п. 1, де однократна доза складає від 300 до 600 мкг. 3. Інгальований порошок за п. 2, де однократна доза складає від 400 до 600 мкг. 4. Інгальований порошок за будь-яким з пп. 1-3, де сполука формули (І) являє собою 1-(3циклопропілметокси-4-дифторметоксифеніл)-2-(3,5-дихлор-1-оксипіридин-4-іл)етиловий естер ()-3-циклопропілметокси-4-метансульфоніламінобензойної кислоти (сполука С2). 5. Інгальований порошок за будь-яким з пп. 1-4, де фізіологічно прийнятний фармакологічно інертний матеріал являє собою кристалічний цукор, вибраний з групи, що включає глюкозу, арабінозу, мальтозу, сахарозу, декстрозу і лактозу, або поліспирт, вибраний з групи, що включає маніт, мальтит, лактит і сорбіт. 6. Інгальований порошок за п. 5, де цукор являє собою лактозу. 7. Інгальований порошок за п. 6, де цукор являє собою моногідрат α-лактози. 8. Інгальований порошок за будь-яким з пп. 1-7, де грубі частинки носія мають мас-медіанний діаметр (ММД), що складає від 212 до 355 мікронів. 9. Інгальований порошок за будь-яким з пп. 1-8, що додатково містить одну або декілька допоміжних речовин, вибраних з групи, що включає амінокислоти, розчинні у воді поверхневоактивні засоби, мастильні речовини і регулятори сипкості. 10. Інгальований порошок за п. 9, де допоміжною речовиною є мастильна речовина. 11. Інгальований порошок за п. 10, де допоміжною речовиною є стеарат магнію. 12. Інгальований порошок за п. 11, де стеарат магнію присутній в кількості, що складає від 0,01 до 2 % мас. з розрахунку на загальну масу препарату. 13. Інгальований порошок за п. 12, де кількість стеарату магнію складає від 0,02 до 1 % мас./мас. 14. Інгальований порошок за будь-яким з пп. 1-13, який додатково включає тонко подрібнені частинки фізіологічно прийнятного фармакологічно інертного матеріалу з ММД, що дорівнює або менший ніж 15 мікронів. 15. Сухий порошковий інгалятор, що містить інгальований сухий порошковий препарат за будьяким з пп. 1-14. 16. Інгальований сухий порошковий препарат за будь-яким з пп. 1-14 для застосування для попередження і/або лікування респіраторного захворювання. 17. Інгальований сухий порошковий препарат за п. 16, де вказане захворювання являє собою астму і хронічне обструктивне захворювання легенів (ХОЗЛ). 18. Упаковка, що містить інгальований сухий порошковий препарат за будь-яким з пп. 1-14 і сухий порошковий інгалятор. Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 11
ДивитисяДодаткова інформація
Назва патенту англійськоюDry powder formulation comprising a phosphodiesterase inhibitor
Автори англійськоюCocconi, Daniela, Schiaretti, Francesca, Bilzi, Roberto
Автори російськоюКоккони Даниела, Скьяретти Франческа, Бильзи Роберто
МПК / Мітки
МПК: A61P 11/06, A61K 31/44, A61K 9/00
Мітки: препарат, порошковий, фосфодіестерази, містить, інгібітор, сухий
Код посилання
<a href="https://ua.patents.su/13-112296-sukhijj-poroshkovijj-preparat-yakijj-mistit-ingibitor-fosfodiesterazi.html" target="_blank" rel="follow" title="База патентів України">Сухий порошковий препарат, який містить інгібітор фосфодіестерази</a>
Попередній патент: Обробка альфа/бета-титанових сплавів
Наступний патент: Рекомбінантна мікобактерія як вакцина для застосування на людях
Випадковий патент: Спосіб безрозбірного визначення руйнувань закритих конструкцій опор стаціонарних роторних машин