Антитіло до cd20 людини та його застосування для лікування захворювання або стану опосередкованого сd20
Номер патенту: 100699
Опубліковано: 25.01.2013
Автори: Стівенс Шон, Еллісон Ерін М., Ван Лі-Сиень, Мартін Джоел Х.
Формула / Реферат
1. Антитіло людини або антигензв'язувальний фрагмент антитіла, яке специфічно зв'язується з CD20 людини і здатне індукувати комплементзалежну цитотоксичність (CDC), де антитіло або фрагмент антитіла містить:
(і) область 1, що визначає комплементарність, важкого ланцюга (HCDR1) з амінокислотною послідовністю SEQ ID NO:341;
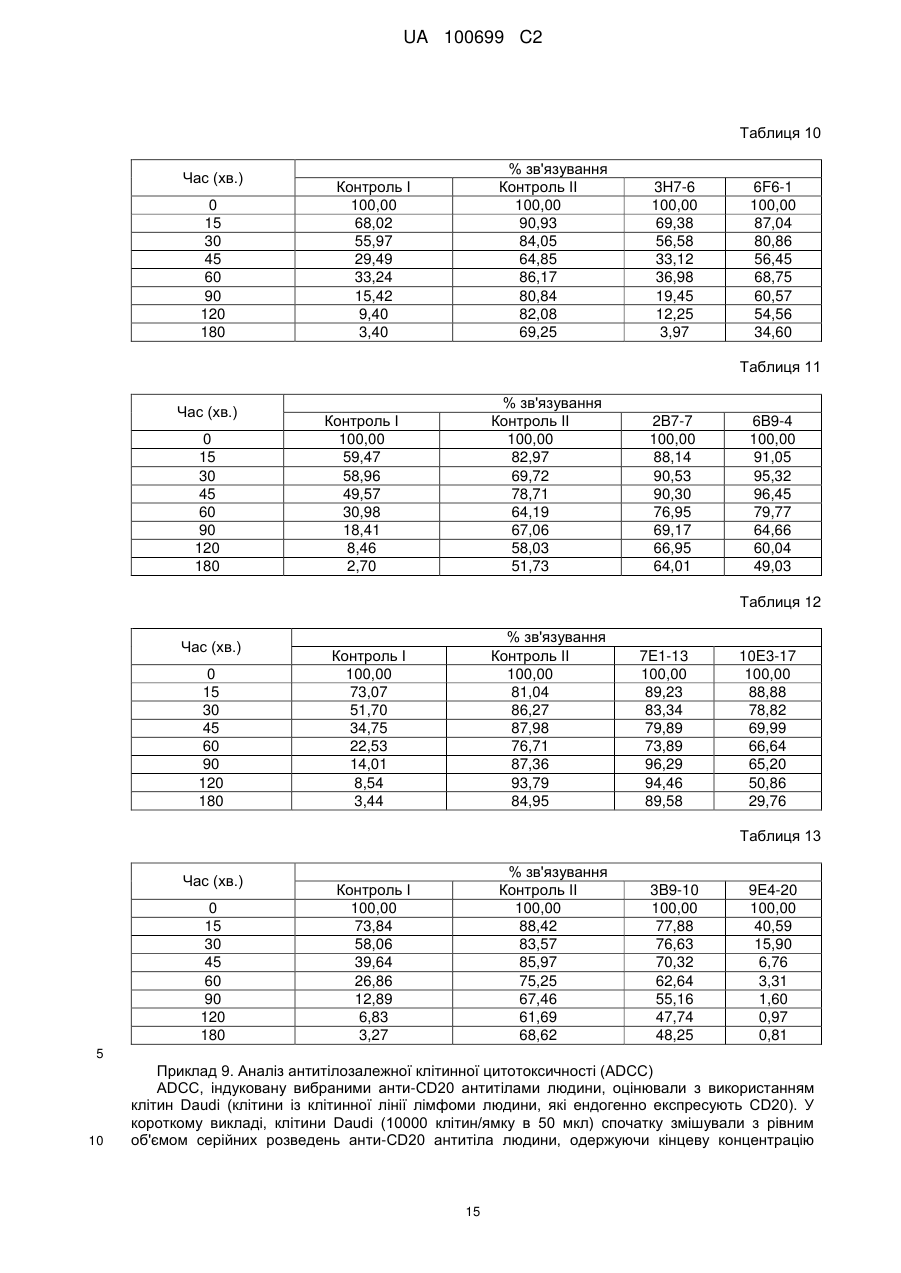
(іі) область 2, що визначає комплементарність, важкого ланцюга (HCDR2) з амінокислотною послідовністю SEQ ID NO:343;
(ііі) область 3, що визначає комплементарність, важкого ланцюга (HCDR3) з амінокислотною послідовністю SEQ ID NO:345;
(іv) область 1, що визначає комплементарність, важкого ланцюга (LCDR1) з амінокислотною послідовністю SEQ ID NO:349;
(v) область 2, що визначає комплементарність, важкого ланцюга (LCDR2) з амінокислотною послідовністю SEQ ID NO:351;
(vі) область 3, що визначає комплементарність, важкого ланцюга (LCDR3) з амінокислотною послідовністю SEQ ID NO:353.
2. Антитіло або його фрагмент за п. 1, де антитіло або його фрагмент забезпечують CDC із значенням ЕС50, що дорівнює 0,2 нМ або менше, як виміряно на клітинах Daudi, або ЕС50, що дорівнює 0,4 нМ, як виміряно за допомогою клітин RL.
3. Антитіло або його антигензв'язувальний фрагмент за п. 1, де антитіло або його фрагмент здатні збільшувати час безсимптомного виживання від 2-х до 9-ти разів або більше, в порівнянні з тваринами, які отримували контрольний Fc, на моделі лімфоми людини у миші.
4. Антитіло або його антигензв'язувальний фрагмент за п. 1, де антитіло або його фрагмент містить HCVR з амінокислотною послідовністю SEQ ID NO: 339, та LCVR з амінокислотною послідовністю SEQ ID NO: 347.
5. Застосування антитіла або його антигензв'язувального фрагмента за будь-яким з пп. 1-4 для одержання лікарського засобу для зменшення або інгібування захворювання або стану, опосередкованого CD20, у людини.
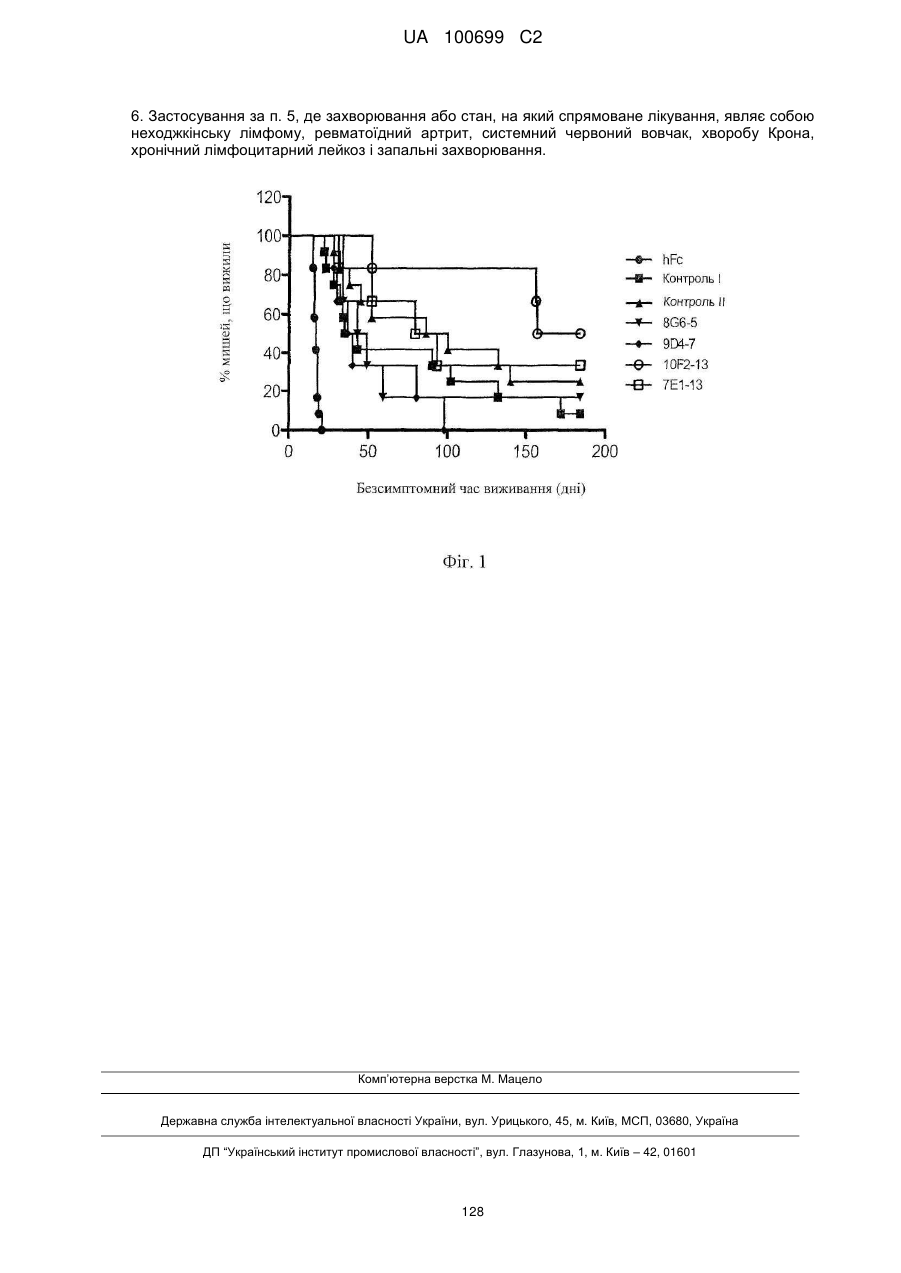
6. Застосування за п. 5, де захворювання або стан, на який спрямоване лікування, являє собою неходжкінську лімфому, ревматоїдний артрит, системний червоний вовчак, хворобу Крона, хронічний лімфоцитарний лейкоз і запальні захворювання.
Текст
Реферат: UA 100699 C2 (12) UA 100699 C2 Винахід належить до антитіла людини або його антигензв'язувального фрагмента, які специфічно зв'язуються з CD20 людини і здатні індукувати комплементзалежну цитотоксичність (CDC). Також винахід належить до застосування антитіла або його антигензв'язувальго фрагмента для лікування захворювання або стану, обумовленого CD20, такого як, наприклад, неходжкінська лімфома, ревматоїдний артрит, системний червоний вовчак, хвороба Крона, хронічний лімфоцитарний лейкоз і запальні захворювання. UA 100699 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої належить винахід Даний винахід стосується антитіл людини й фрагментів антитіл, специфічних відносно CD20 людини, фармацевтичних композицій, що їх містять, і способів лікування. Рівень техніки CD20 (також відомий як антиген обмеженого диференціювання B-лімфоцитів людини або Bp35; поверхневий антиген B-лімфоцитів B1, Leu-16, BM5 і LF5) являє собою гідрофобний трансмембранний білок з молекулярною масою ~35 кда, що експресується на пре-B- і зрілих Bлімфоцитах (Valentine et al. (1989) J Biol Chem 264:11282; Einfield et al. (1988) EMBO J 7:711717). Амінокислотна послідовність CD20 людини представлена як SEQ ID NO:1 (номер доступу в GenBank NP_690605). Анти-CD20 антитіла описані, наприклад, в US 5736137, WO 2004/056312 і US 2004/0167319. Способи створення антитіл, використовуваних у терапії людини, включають одержання химерних антитіл і гуманізованих антитіл (див., наприклад, US 6949245). Див. також, наприклад, WO 94/02602 і US 6596541, у яких описані способи одержання генетично модифікованих мишей, здатних до вироблення антитіл, використовуваних у терапії людини. Суть винаходу У першому аспекті винахід стосується антитіл людини, переважно рекомбінантних антитіл людини, які специфічно зв'язуються з CD20 людини. Ці антитіла характеризуються специфічним зв'язуванням з CD20 людини і опосередковують цитоліз клітин B-клітинної лімфоми, експресуючих CD20. Антитіла можуть бути повнорозмірними (наприклад, IgG1 або IgG4 антитіла) або можуть містити тільки антигензв'язувальну ділянку (наприклад, Fab-, F(ab')2- або scFv-фрагмент) і можуть бути модифіковані з ефектом на активність, наприклад, для усунення або посилення залишкових ефекторних функцій (Reddy et al. (2000) J. Immunol. 164:1925-1933). Антитіло або його антигензв'язувальний фрагмент специфічно зв'язуються з CD20 людини і здатні індукувати комплементзалежну цитотоксичність (CDC) відносно клітин, експресуючих CD20, у присутності комплементу, де антитіло в концентрації приблизно 10 нМ або менше індукує 50 % лізис клітин Daudi і RL у присутності 5 % нормальної сироватки людини з комплементом. У переважних варіантах здійснення концентрація антитіла, яка індукує 50 % лізис, становить приблизно 5 нМ або менше, приблизно 2 нМ або менше або приблизно 1 нМ або менше. В одному з варіантів здійснення антитіло або його фрагмент демонструють EC 50 0,2 нМ або менше, як виміряно на клітинах Daudi, або EC 50 0,4 нМ або менше, як виміряно за допомогою клітин RL. У різних варіантах здійснення антитіло або фрагмент антитіла здатні підвищувати безсимптомний час виживання від приблизно 2-х до приблизно 9-ти разів або більше, у порівнянні з контрольними тваринами на мишачій моделі лімфоми людини. Антитіло або його фрагмент специфічно зв'язуються з CD20 людини і здатні індукувати антитілозалежну клітинну цитотоксичність (ADCC) відносно клітин, експресуючих CD20, у присутності мононуклеарних клітин периферичної крові (PBMC), де антитіло демонструє EC 50 приблизно 1 нМ або менше, як виміряно на клітинах Daudi. У переважних варіантах здійснення антитіло демонструє EC50 приблизно 50 пМ або менше, приблизно 20 пМ або менше, приблизно 10 пМ або менше. У переважному варіанті здійснення антитіла, що демонструють підвищену активність ADCC, можуть містити знижені рівні фукозилювання, наприклад, приблизно 5 % фукози. В одному з варіантів здійснення антитіло або антигензв'язувальна ділянка антитіла за винаходом містять послідовність варіабельної області важкого ланцюга (HCVR), вибрану із групи, яка складається з SEQ ID NO:3, 19, 23, 27, 43, 47, 51, 67, 71, 75, 91, 95, 99, 115, 119, 123, 139, 143, 147, 163, 167, 171, 187, 191, 195, 211, 215, 219, 235, 239, 243, 259, 263, 267, 283, 287, 291, 307, 311, 315, 331, 335, 339, 355, 359, 363, 379, 383, 387, 395 і 403, або по суті подібну до неї послідовність. У переважному варіанті здійснення антитіло або фрагмент містять послідовність HCVR, вибрану із групи, яка складається з SEQ ID NO:339, 195 і 243. У конкретному варіанті здійснення антитіло або його антигензв'язувальний фрагмент додатково містять послідовність варіабельної області легкого ланцюга (LCVR), вибрану із групи, яка складається з SEQ ID NO:11, 21, 25, 35, 45, 49, 59, 69, 73, 83, 93, 97, 107, 117, 121, 131, 141, 145, 155, 165, 169, 179, 189, 193, 203, 213, 217, 227, 237, 241, 251, 261, 265, 275, 285, 289, 299, 309, 313, 323, 333, 337, 347, 357, 361, 371, 381 і 385, або по суті подібну до неї послідовність. У переважному варіанті здійснення антитіло або фрагмент містять LCVR, вибрану із групи, яка складається з SEQ ID NO:347, 203 і 251. У конкретному варіанті здійснення антитіло або його фрагмент містять пари послідовностей HCVR/LCVR, вибрані із групи, яка складається з SEQ ID NO:3/11, 19/21, 23/25, 27/35, 43/45, 47/49, 51/59, 67/69, 71/73, 75/83, 91/93, 95/97, 99/107, 115/117, 119/121, 123/131, 139/141, 143/145, 147/155, 163/165, 167/169, 171/179, 187/189, 191/193, 195/203, 211/213, 215/217, 1 UA 100699 C2 5 10 15 20 25 30 35 40 45 50 55 219/227, 235/237, 239/241, 243/251, 259/261, 263/265, 267/275, 283/285, 287/289, 291/299, 307/309, 311/313, 315/323, 331/333, 335/337, 339/347, 355/357, 359/361, 363/371, 379/381 і 383/385. У переважному варіанті здійснення антитіло або його фрагмент містять пари послідовностей HCVR/LCVR, вибрані із групи, яка складається з SEQ ID NO:339/347, 195/203 і 243/251. У другому аспекті винахід стосується виділеної молекули нуклеїнової кислоти, яка кодує антитіло або його фрагмент. У конкретних варіантах здійснення молекула нуклеїнової кислоти кодує HCVR, де нуклеотидна послідовність вибрана із групи, яка складається з SEQ ID NO:2, 18, 22, 26, 42, 46, 50, 66, 70, 74, 90, 94, 98, 114, 118, 122, 138, 142, 146, 162, 166, 170, 186, 190, 194, 210, 214, 218, 234, 238, 242, 258, 262, 266, 282, 286, 290, 306, 310, 314, 330, 334, 338, 354, 358, 362, 378, 382, 386, 394 і 402, або по суті подібну до неї послідовність. В іншому аспекті винахід стосується виділеної молекули нуклеїнової кислоти, яка кодує LCVR, де нуклеотидна послідовність вибрана із групи, яка складається з SEQ ID NO:10, 20, 24, 34, 44, 48, 58, 68, 72, 82, 92, 96, 106, 116, 120, 130, 140, 144, 154, 164, 168, 178, 188, 192, 202, 212, 216, 226, 236, 240, 250, 260, 264, 274, 284, 288, 298, 308, 312, 322, 332, 336, 346, 356, 360, 370, 380 і 384, або по суті подібну до неї послідовність. У переважному варіанті здійснення антитіло або фрагмент антитіла містять HCVR, яку кодує молекула нуклеїнової кислоти, вибрана із групи, яка складається з SEQ ID NO:338, 194 і 242, і LCVR, яку кодує молекула нуклеїнової кислоти, вибрана із групи, яка складається з SEQ ID NO:346, 202 і 250, відповідно. У третьому аспекті винахід стосується антитіла або його антигензв'язувального фрагмента, що містить CDR3 важкого ланцюга (HCDR3), яка, у свою чергу, містить амінокислотну послідовність, вибрану із групи, яка складається з SEQ ID NO:9, 33, 57, 81, 104, 129, 153, 177, 201, 225, 249, 273, 297, 321, 345, 369, 393, 401 і 409; і CDR3 легкого ланцюга (LCDR3), яка містить амінокислотну послідовність, вибрану із групи, яка складається з SEQ ID NO:17, 41, 65, 89, 113, 137, 161, 185, 209, 233, 257, 281, 305, 329, 353 і 377. У переважному варіанті здійснення антитіло або його фрагмент містять послідовності HCDR3 і LCDR3, вибрані з пар послідовностей HCDR3/LCDR3 SEQ ID NO:345/353, 201/209 і 249/257. У конкретному варіанті здійснення антитіло або його фрагмент додатково містять доменну послідовність CDR1 важкого ланцюга (HCDR1), вибрану із групи, яка складається з SEQ ID NO:5, 29, 53, 77, 101, 125, 149, 173, 197, 221, 245, 269, 293, 317, 341, 365, 389, 397 і 405; доменну послідовність CDR2 важкого ланцюга (HCDR2), вибрану із групи, яка складається з SEQ ID NO:7, 31, 55, 79, 103, 127, 151, 175, 199, 223, 247, 271, 295, 319, 343, 367, 391, 399 і 407; доменну послідовність CDR1 легкого ланцюга (LCDR1), вибрану із групи, яка складається з SEQ ID NO:13, 37, 61, 85, 109, 133, 157, 181, 205, 229, 253, 277, 301, 325, 349 і 373; і доменну послідовність CDR2 легкого ланцюга (LCDR2), вибрану із групи, яка складається з SEQ ID NO:15, 39, 63, 87, 111, 135, 159, 183, 207, 231, 255, 279, 303, 327, 351 і 375. У переважному варіанті здійснення антитіло або його фрагмент містять послідовності CDR важкого й легкого ланцюгів, вибрані із групи, яка складається з SEQ ID NO:341, 343, 345, 349, 351 і 353; 197, 199, 201, 205, 207 і 209; і 245, 247, 249, 253, 255 і 257, відповідно. У четвертому аспекті винахід стосується виділеної молекули нуклеїнової кислоти, яка кодує антитіло або антигензв'язувальні фрагменти за винаходом, де молекули нуклеїнової кислоти, які кодують домен HCDR3 і домен LCDR3, вибрані із групи, яка складається з SEQ ID NO:9 і 16; 33 і 41; 57 і 65; 81 і 89; 104 і 113; 129 і 137; 153 і 161; 177 і 185; 201 і 209; 225 і 233; 249 і 257; 273 і 281; 297 і 305; 321 і 329; 345 і 353; і 369 і 377, відповідно. У п'ятому аспекті винахід стосується антитіла або антигензв'язувального фрагмента, що містить домен HCDR3 і домен LCDR3, де домен HCDR3 містить амінокислотну послідовність по 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 формулі X -X -X -X -X -X -X -X -X -X -X -X -X -X -X -X -X -X -X (SEQ ID NO:412), де 1 2 3 4 5 6 7 8 9 X =A, V або T; X =K; X =D; X =P, F або G; X =S або H; X =Y; X =G; X =S або H; X =G або F; 10 11 12 13 14 15 X =S або Y; X =Y, N або S; X =Y, G або H; X =G, L або S; X =Y, M або D; X =Y, D або V; 16 17 18 19 X =G, V або відсутній; X =M або відсутній; X =D або відсутній; X =V або відсутній; і домен 1 2 3 4 5 6 7 8 9 LCDR3 містить амінокислотну послідовність по формулі X -X -X -X -X -X -X -X -X (SEQ ID 1 2 3 4 5 6 7 8 9 NO:415), де X =Q; X =Q; X =R або S; X =N, Y або F; X =N, D або Y; X =W; X =P; X =L; X =T. У конкретному варіанті здійснення антитіло або антигензв'язувальний фрагмент додатково містять домени важкого й легкого ланцюгів CDR1 і CDR2, де домен HCDR1 містить 1 2 3 4 5 6 7 8 1 2 амінокислотну послідовність по формулі X -X -X -X -X -X -X -X (SEQ ID NO:410), де X =G; X =F 3 4 5 6 7 8 або I; X =T; X =F; X =H, R або Y; X =D; X =Y; X =T або A; домен HCDR2 містить амінокислотну 1 2 3 4 5 6 7 8 1 2 3 4 послідовність по формулі X -X -X -X -X -X -X -X (SEQ ID NO:411), де X =I; X =S; X =W; X =N; 5 6 7 8 X =S; X =G або D; X =S, Y або T; X =I або L; домен LCDR1 містить амінокислотну послідовність 1 2 3 4 5 6 1 2 3 4 5 по формулі X -X -X -X -X -X (SEQ ID NO:413), де X =Q; X =S; X =V або I; X =S; X =S або R; 2 UA 100699 C2 6 5 10 15 20 25 30 35 40 45 50 55 60 1 2 3 X =Y або N; і домен LCDR2 містить амінокислотну послідовність по формулі X -X -X (SEQ ID 1 2 3 NO:414), де X =E, G або V; X =A; X =S. У шостому аспекті винахід стосується рекомбінантних експресійних векторів, які несуть молекули нуклеїнової кислоти за винаходом, і клітин-хазяїнів, у які введені такі вектори, а також способів одержання антитіл або їх фрагментів за винаходом шляхом культивування клітинхазяїнів за винаходом. Клітина-хазяїн може бути прокаріотичною або еукаріотичною клітиною; переважно клітина-хазяїн являє собою клітину E. coli або клітину ссавця, таку як клітина CHO. У переважному варіанті здійснення антитіло може бути одержане з різними рівнями фукозилювання. Наприклад, клітинна лінія CHO може бути вибрана для вироблення антитіла або фрагмента антитіла з рівнем фукозилювання від мінімального значення приблизно 5 % до максимального значення приблизно 95 %. У сьомому аспекті винахід стосується фармацевтичної композиції, яка містить анти-CD20 антитіло людини або його фрагмент і фармацевтично прийнятний носій. У восьмому аспекті винахід стосується повного антитіла людини або фрагмента антитіла, здатного зв'язуватися з CD20 людини, де значення EC50 становить менше приблизно 10 нМ, як виміряно в експериментах зв'язування із клітинами (описано нижче). У переважному варіанті 8 здійснення антитіло за винаходом має значення EC50, яке дорівнює приблизно від 10- до 12 8 9 приблизно 10M або вище, наприклад, щонайменше 10- M, щонайменше 10- M, 10 11 12 щонайменше 10- M, щонайменше 10- M або щонайменше 10- M, при вимірюванні зв'язування з антигеном, представленим на поверхні клітини. Даний винахід стосується анти-CD20 антитіл зі зміненою структурою глікозилування. У деяких варіантах застосування модифікація для видалення небажаних ділянок глікозилування може бути ефективна, або відсутність у антитіла фукозної частини є на олігосахаридному ланцюзі, наприклад, для посилення функції антитілозалежної клітинної цитотоксичності (ADCC) (див. Shield et al. (2002) JBC 277:26733). В інших варіантах застосування модифікація глікозилування може бути проведена для зміни комплементзалежної цитотоксичності (CDC). У дев'ятому аспекті винахід стосується антитіла або антигензв'язувального фрагмента антитіла, як описано вище, які використовують для полегшення перебігу або пригнічення захворювання або стану, опосередкованого CD20, у людини. У переважному варіанті здійснення захворювання або стан, на який спрямоване лікування, являє собою неходжкінську лімфому, ревматоїдний артрит, системний червоний вовчак, хворобу Крона, хронічний лімфоцитарний лейкоз і запальні захворювання. В іншому варіанті здійснення винахід стосується способу полегшення перебігу або пригнічення захворювання або стану, опосередкованого CD20, у людини, який включає введення терапевтично ефективної кількості антитіла або антигензв'язувального фрагмента антитіла, як описано вище. Крім того, винахід стосується застосування антитіла або антигензв'язувального фрагмента антитіла за винаходом для одержання лікарського засобу, який використовують для пом'якшення або пригнічення захворювання або стану, опосередкованого CD20, у людини. Інші об'єкти й переваги винаходу стануть очевидні з нижченаведеного докладного опису. Короткий опис креслень Фіг. 1. Крива безсимптомного виживання. Результати показані для контрольного Fc людини, контрольних антитіл I і II і антитіл: 8G6-5, 9D4-7, 10F2-13 і 7E1-13. Докладний опис Перед описом способів за даним винаходом варто мати на увазі, що даний винахід не обмежений окремими способами й описаними експериментальними умовами, оскільки такі способи й умови можуть змінюватися. Також варто мати на увазі, що термінологія використана в даному документі тільки з метою опису окремих варіантів здійснення й не є обмежувальною, оскільки обсяг даного винаходу може бути обмежений тільки формулою винаходу. Якщо не визначено інакше, всі використані в описі технічні й наукові терміни мають то ж саме значення, у якому вони звичайно розуміються фахівцем в галузі, якої стосується даний винахід. Хоча будь-які способи й матеріали, подібні або еквівалентні описаним у даному описі, можна використовувати в практичному здійсненні або тестуванні за даним винаходом, переважні способи й матеріали описані в даному документі. Визначення Термін "CD20" включає варіанти й ізоформи CD20 людини, які експресуються клітинами природно. Зв'язування антитіла за винаходом з антигеном CD20 опосередковує цитоліз клітин, експресуючих CD20 (наприклад, пухлинної клітини). Цитоліз клітин, експресуючих CD20, може відбуватися різними способами, включаючи комплементзалежну цитотоксичність (CDC) відносно клітин, експресуючих CD20, апоптоз клітин, експресуючих CD20, фагоцитоз ефекторними клітинами клітин, експресуючих CD20, або опосередковану ефекторними 3 UA 100699 C2 5 10 15 20 25 30 35 40 45 50 55 60 клітинами антитілозалежну клітинну цитотоксичність (ADCC) відносно клітин, експресуючих CD20. Як використовується в даному описі, термін "антитіло" означає молекулу імуноглобуліну, яка містить чотири поліпептидні ланцюги, два важкі (H) ланцюги й два легкі (L) ланцюги, взаємозв'язані дисульфідними зв'язками. Кожний важкий ланцюг містить варіабельну область важкого ланцюга (скорочену в даному описі як HCVR або VH) і константну область важкого ланцюга. Константна область важкого ланцюга містить три домени, CH1, CH2 і CH3. Кожний легкий ланцюг містить варіабельну область легкого ланцюга (скорочену в даному описі як LCVR або VL) і константну область легкого ланцюга. Константна область легкого ланцюга містить один домен (CL1). Області VH і VL можуть бути додатково підрозділені на області гіперваріабельності, названі областями (CDR), що визначають комплементарність, у які вкраплені більш консервативні області, названі каркасними областями (FR). Кожний VH і VL складається із трьох CDR і чотирьох FR, розташованих від амінокінця до карбоксикінця в наступному порядку: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Як використовується в даному описі, термін " антигензв'язувальна ділянка антитіла" (або просто "ділянка антитіла" або "фрагмент антитіла") стосується одного або декількох фрагментів антитіла, які зберігають здатність специфічно зв'язуватися з антигеном (наприклад, hCD20). Показано, що ці фрагменти повнорозмірного антитіла можуть виконувати антигенз'вязувальну функцію антитіла. Приклади зв'язувальних фрагментів, охоплених терміном "антигензв'язувальна ділянка антитіла", включають (i) фрагмент Fab, моновалентний фрагмент, що складається з доменів VL, VH, CL1 і CH1; (ii) фрагмент F(ab') 2, бівалентний фрагмент, що містить два фрагменти F(ab)', зв'язаних дисульфідним містком у шарнірної області; (iii) фрагмент Fd, що складається з доменів VH і CH1; (iv) фрагмент Fv, що складається з доменів VL і VH одного плеча антитіла; (v) фрагмент dAb (Ward et al. (1989) Nature 241:544-546), що складається з домену VH; і (vi) виділена область (CDR), що визначає комплементарність. Крім того, хоча два домени фрагмента Fv, VL і VH, кодуються різними генами, вони можуть бути об'єднані за допомогою рекомбінатних способів синтетичним лінкером, що забезпечує можливість їх одержання у вигляді єдиного суміжного ланцюга, у якому області VL і VH спарюються, утворюючи моновалентні молекули (відомі як одноланцюжковий Fv (scFv); див., наприклад, Bird et al. (1988) Science 242:423-426; і Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Такі одноланцюжкові антитіла також охоплюються терміном "антигензв'язувальна ділянка антитіла". Інші форми одноланцюжкових антитіл, такі як діатіла, також включені в термін (див., наприклад, Holliger et al. (1993) Proc. Natl. Acad Sci. USA 90:64446448). "CDR" або область, що визначає комплементарність, являє собою область гіперваріабельності, у яку вкраплені більш консервативні області, названі каркасними областями (FR). У різних варіантах здійснення анти-hCD20 антитіла або фрагмента за винаходом FR можуть бути ідентичні зародковій послідовності людини або можуть бути природно або штучно модифіковані. Як використовується в даному описі, термін "поверхневий плазмонний резонанс" стосується оптичного явища, яке дозволяє аналізувати взаємодії в реальному часі за рахунок виявлення змін у концентрації білків усередині біосенсорної матриці, наприклад, з використанням системи ТМ BIACORE (Pharmacia Biosensor AB). Термін "епітоп" стосується антигенної детермінанти, яка взаємодіє зі специфічною антигензв'язувальною ділянкою у варіабельній області молекули антитіла, відомій як паратоп. Один антиген може мати більше одного епітопа. Епітопи можуть бути або конформаційними, або лінійними. Конформаційний епітоп утворений шляхом випадкового накладання одна на одну амінокислот з різних сегментів одного (або більше) лінійного поліпептидного ланцюга (ланцюгів). Лінійний епітоп являє собою епітоп, утворений додатковими амінокислотними залишками в поліпептидному ланцюзі. У певних обставинах епітоп може включати інші частини, такі як сахариди, фосфорильні групи або сульфонільні групи антигену. Термін "по суті ідентичний", використовуваний стосовно нуклеїнової кислоти або її фрагмента, вказує, що, при оптимальному вирівнюванні відповідними нуклеотидними вставками або делеціями з іншою нуклеїновою кислотою (або її комплементарним ланцюгом), існує ідентичність нуклеотидної послідовності щонайменше приблизно 95 % і більш переважно щонайменше приблизно 96 %, 97 %, 98 % або 99 % нуклеотидних основ, як виміряно будь-яким добре відомим алгоритмом ідентичності послідовності, таким як FASTA, BLAST або GAP, що обговорюється нижче. Застосовно до поліпептидів термін "по суті подібний" означає, що дві пептидні послідовності при оптимальному вирівнюванні, такому як вирівнювання за допомогою програм GAP або 4 UA 100699 C2 5 10 15 20 25 30 35 40 45 50 55 60 BESTFIT, з використанням пропуску ваг за замовчуванням, розділяють щонайменше 95 % ідентичності послідовності, навіть більш переважно щонайменше 98 % або 99 % ідентичності послідовності. Переважно, положення залишків, які не є ідентичними, різняться консервативними амінокислотними замінами. "Консервативна амінокислотна заміна" являє собою заміну, при якій амінокислотний залишок заміщений іншим амінокислотним залишком, що має бічний ланцюг (R-групу) з подібними хімічними властивостями (наприклад, заряд або гідрофобність). Як правило, консервативна амінокислотна заміна по суті не змінює функціональні властивості білка. У випадку, якщо дві або більше амінокислотних послідовностей відрізняються одна від одної консервативними замінами, то відсоток або ступінь подібності можуть бути збільшені для корекції консервативної природної заміни. Способи проведення такого коректування добре відомі фахівцям у даній галузі. Див., наприклад, Pearson (1994) Methods Mol. Biol. 24: 307-331. Приклади амінокислотних груп, які мають бічні ланцюги з подібними хімічними властивостями, включають 1) аліфатичні бічні ланцюги: гліцин, аланін, валін, лейцин і ізолейцин; 2) аліфатичні гідроксильні бічні ланцюги: серин і треонін; 3) амідовмісні бічні ланцюги: аспарагін і глутамін; 4) ароматичні бічні ланцюги: фенілаланін, тирозин і триптофан; 5) основні бічні ланцюги: лізин, аргінін і гістидин; 6) кислотні бічні ланцюги: аспартат і глутамат; і 7) сірковмісні бічні ланцюги: цистеїн і метіонін. Переважними консервативними амінокислотними замінами є: валін-лейцин-ізолейцин, фенілаланін-тирозин, лізин-аргінін, аланін-валін, глутамат-аспартат і аспарагін-глутамін. Альтернативно, консервативна заміна являє собою будь-яку заміну, що має позитивне значення в PAM250 матриці логарифмічної правдоподібності, розкритій в Gonnet et al. (1992) Science 256: 1443 45. "Помірно консервативна" заміна означає будь-яку заміну з ненегативним значенням в PAM250 матриці логарифмічної правдоподібності. Подібність послідовності поліпептидів звичайно вимірюють за допомогою програмного забезпечення для аналізу послідовностей. Програмне забезпечення для аналізу білків підбирає подібні послідовності, використовуючи міри подібності, задані різним замінам, делеціям і іншим модифікаціям, включаючи консервативні амінокислотні заміни. Наприклад, програмне забезпечення GCG включає програми, такі як GAP і BESTFIT, які можна використовувати з параметрами за замовчуванням для визначення гомології послідовностей або ідентичності послідовностей між близькородинними поліпептидами, такими як гомологічні поліпептиди різних видів організмів, або між білком дикого типу і його мутантом. Див., наприклад, GCG Version 6.1. Поліпептидні послідовності також можна порівнювати, використовуючи FASTA з параметрами за замовчуванням або рекомендованими параметрами; програму в GCG Version 6.1. FASTA (наприклад, FASTA2 і FASTA3), що забезпечує вирівнювання й відсоток ідентичності послідовності областей з найкращим перекриттям між послідовністю за запитом й послідовністю пошуку (Pearson (2000) вище). Іншим переважним алгоритмом для порівняння послідовності за винаходом з базою даних, яка містить велику кількість послідовностей різних організмів, є комп'ютерна програма BLAST, особливо BLASTP або TBLASTN, з використанням параметрів за замовчуванням. Див., наприклад, Altschul et al. (1990) J. Mol. Biol. 215: 403 410 і Altschul et al. (1997) Nucleic Acids Res. 25:3389 402. Термін "ефективна кількість" означає концентрацію або кількість антитіла або антигензв'язувального фрагмента антитіла, яка приводить до досягнення конкретної заявленої мети. "Ефективна кількість" анти-CD20 антитіла або його антигензв'язувального фрагмента може бути визначена емпірично. Крім того, "терапевтично ефективна кількість" означає концентрацію або кількість анти-CD20 антитіла або його антигензв'язувального фрагмента, яка ефективна для досягнення заявленого терапевтичного ефекту. Ця кількість також може бути визначена емпірично. Одержання антитіл людини ТМ Способи одержання антитіл людини включають, наприклад, VelocImmune (Regeneron ТМ Farmaceuticals), технологію XenoMouse (Green et al. (1994) Nature Genetics 7:13-21; Abgenix), "мінілокусний" підхід і фаговий дисплей (див., наприклад, US 5545807, US 6787637). Технологія ТМ VelocImmune (US 6596541) включає спосіб створення високоспецифічних повністю людських антитіл до вибраного антигену. Ця технологія включає створення трансгенної миші з геномом, що містить варіабельні області важкого й легкого ланцюгів людини, функціонально зв'язані з ендогенними локусами константної області миші таким чином, що миша у відповідь на антигенну стимуляцію продукує антитіло, яке містить варіабельну область людини й константну область миші. ДНК, що кодує варіабельні області важких і легких ланцюгів антитіла, виділяли й функціонально зв'язували із ДНК, що кодує константні області важкого й легкого ланцюгів людини. ДНК потім експресувалися у клітинах, здатних до експресії повністю людського антитіла. У конкретному варіанті здійснення дані клітини являють собою клітини CHO. 5 UA 100699 C2 5 10 15 20 25 30 35 40 45 50 55 60 Антитіла можуть бути використані в терапії скоріше для блокування взаємодії лігандрецептор або інгібування взаємодії компонентів рецептора, ніж для цитолізу клітин шляхом фіксації комплементу (CDC) і участі в антитілозалежній клітинно-опосередкованій цитотоксичності (ADCC). Константна область антитіла важлива для здатності антитіла фіксувати комплемент і опосередковувати клітинозалежну цитотоксичність. Таким чином, ізотип антитіла може бути вибраний на підставі того, чи бажано для антитіла опосередковувати цитотоксичність. Імуноглобуліни людини можуть існувати у двох формах, що пов'язано з гетерогенністю шарнірної ділянки. В одній з форм молекула імуноглобуліну містить стабільну чотириланцюжкову конструкцію приблизно 150-160 кда, у якій димери утримуються разом за рахунок внутрішньоланцюжкового дисульфідного зв'язку важкого ланцюга. У другій формі димери не зв'язані за допомогою внутрішньоланцюжкових дисульфідних зв'язків, і молекула приблизно 75-80 кда сформована з ковалентно спарених легкого й важкого ланцюгів (напівантитіло). Ці форми дуже важко розділити навіть після афінного очищення. Частота появи другої форми в різних інтактних ізотипах IgG обумовлена, але ними не обмежена, структурними відмінностями, пов'язаними із шарнірною областю ізотипу антитіла. Одинична амінокислотна заміна в шарнірній області IgG4 людини може значно знизити появу другої форми (Angal et al. (1993) Molecular Immunology 30: 105) до рівнів, звичайно спостережуваних при використанні шарніра IgG1 людини. Даний винахід стосується антитіл з однією або декількома мутаціями в шарнірі, CH2 або CH3 області, які можуть бути бажані, наприклад, при виробленні, для поліпшення виходу бажаної форми антитіла. ТМ Антитіла за винаходом одержують переважно з використанням технології VelocImmune . Трансгенну мишу, у якої варіабельні області важкого й легкого ланцюгів ендогенного імуноглобуліну замінені відповідними варіабельними областями людини, стимулюють цікавлячим антигеном, і лімфатичні клітини (такі як B-клітини) витягають із мишей, які експресують антитіла. Ці лімфатичні клітини можуть бути злиті із клітинною лінією мієломи для одержання безсмертних гібридомних клітинних ліній, і такі гібридомні клітинні лінії скринують і відбирають для того, щоб визначити гібридомні клітинні лінії, які виробляють антитіла, специфічні до цікавлячого антигену. ДНК, що кодує варіабельні області важкого ланцюга й легкого ланцюгів, може бути виділена й зв'язана з бажаними ізотипічними константними областями важкого ланцюга й легкого ланцюгів. Такий антитільний білок може бути вироблений у клітинах, таких як клітини CHO. Альтернативно, ДНК, що кодує антигенспецифічні химерні антитіла або варіабельні домени легкого й важкого ланцюгів, може бути виділена безпосередньо з антигенспецифічних лімфоцитів. Як правило, антитіла за даним винаходом мають дуже високу афінність, звичайно маючи 8 12 значення KD або EC50 приблизно від 10- до приблизно 10- M або вище, наприклад, 8 9 10 11 щонайменше 10- M, щонайменше 10- M, щонайменше 10- M, щонайменше 10- M або 12 щонайменше 10- M, при вимірюванні зв'язування з антигеном, представленим на клітинній поверхні. На початковій стадії виділяють високоафінні химерні антитіла, які містять варіабельну область людини й константну область миші. Як описано нижче, антитіла характеризують і вибирають по бажаних характеристиках, включаючи афінність, селективність, епітоп і т. д. Константні області миші заміняють бажаними константними областями людини для одержання повністю людського антитіла за винаходом, наприклад, дикого типу або модифіковані IgG1 або IgG4 (наприклад, SEQ ID NO:416, 417, 418). У той час як вибрана константна область може відрізнятися відповідно до конкретного застосування, варіабельній області властиві високоафінна антигензв'язувальна й мішенеспецифічна характеристики. Картування епітопа й супутні технології Для скринінгу антитіл, які зв'язуються з певним епітопом, використовували стандартний аналіз перехресного блокування, такий як описаний в "Antibodies: A Laboratory Manual" 1988 Cold Spring Harbor Laboratory, Harlow and Lane, eds. Інші способи включають аланінове сканування мутантів, пептидний блотинг (Reineke (2004) Methods Mol Biol 248:443-63) або аналіз розщеплення пептидів, як описано в прикладах нижче. Крім того, можуть бути використані способи, такі як вирізання епітопа, екстракція епітопа й хімічна модифікація антигенів (Tomer (2000) Protein Science: 9: 487-496). Для аналізу зв'язувальних характеристик антитіла були сконструйовані мутантні білки CD20, які містять вибрані амінокислотні заміни. Мутантні білки CD20 містили заміни певних амінокислот, які зустрічаються в білку людини, відповідними амінокислотами, які зустрічаються в білку миші. Такий підхід допоміг переконатися в тому, що мутантні білки CD20 зберегли свою третинну структуру й, передбачувано, будь-які конформаційні епітопи. Зв'язування 6 UA 100699 C2 5 10 15 20 25 30 35 40 45 50 55 60 досліджуваних антитіл із цими мутантними білками CD20 порівнювали зі зв'язуванням контрольних (відомих) антитіл до CD20, як виміряно за допомогою FACS. Жодне з антитіл за винаходом не показало профіль зв'язування, який був ідентичний (відносно всіх без винятку мутантів) будь-якому з контрольних антитіл. Імунокон'югати Даний винахід стосується анти-CD20 моноклонального антитіла людини, кон'югованого з терапевтичною частиною ("імунокон'югат"), такою як цитотоксин, хіміотерапевтичний лікарський засіб, імуносупресант або радіоактивний ізотоп. Цитотоксичні засоби включають будь-який засіб, який шкідливий для клітин. Приклади придатних цитотоксичних засобів і хіміотерапевтичних засобів для утворення імунокон'югатів відомі в даній галузі, див., наприклад, WO 05/103081. Біспецифічність Антитіла за даним винаходом можуть бути моноспецифічними, біспецифічними або поліспецифічними. Поліспецифічні антитіла можуть бути специфічні до різних епітопів одного поліпептиду-мішені або можуть містити антигензв'язувальні домени, специфічні для більше ніж одного поліпептиду-мішені. Див., наприклад, Tutt et al. (1991) J. Immunol. 147:60-69. Анти-CD20 антитіла людини можуть бути зв'язані або коекспресовані з іншою функціональною молекулою, наприклад, іншим пептидом або білком. Наприклад, антитіло або його фрагмент можуть бути функціонально зв'язані (наприклад, шляхом хімічного спарювання, генетичного злиття, нековалентної асоціації або іншим чином) з однією або декількома іншими молекулярними субстанціями, такими як інше антитіло або фрагмент антитіла, для одержання біспецифічного або поліспецифічного антитіла із вторинною специфічністю зв'язування. Поліспецифічне антитіло за винаходом може специфічно зв'язуватися як із клітиною, експресуючою CD20, так і з ефекторною клітиною людини, експресуючою поліпептид, такий як Fc рецептор людини, і/або компоненти рецепторного комплексу T-клітини. В одному з варіантів здійснення поліспецифічне антитіло за винаходом містить CD20-зв'язувальну ділянку й цитокін. Терапевтичне застосування Антитіла людини, антигензв'язувальні фрагменти антитіл, імунокон'югати й біспецифічні молекули за винаходом можна використовувати в терапевтичних способах лікування захворювань людини, які стримуються або поліпшуються за рахунок інгібування росту клітин, експресуючих CD20, і/або цитолізу клітин, експресуючих CD20. Механізм дії, за допомогою якого успішно здійснюються терапевтичні способи за винаходом, включає цитоліз клітин, експресуючих CD20, у присутності ефекторних клітин, наприклад, за допомогою CDC, апоптозу, ADCC, фагоцитозу або шляхом комбінації двох або більше цих механізмів. Механізм досягнення терапевтичного ефекту молекул за винаходом може приводити до прямого цитолізу або інгібування клітин, експресуючих CD20, або опосередковано, за рахунок інгібування клітин, які не експресують CD20, наприклад, через експресію структурно подібних антигенів клітинної поверхні (тобто без перехресного реагування зі спорідненими, але функціонально різними антигенами клітинної поверхні). Клітини, експресуючі CD20, які можуть бути інгібовані або лізовані з використанням антитіл людини за винаходом, включають, наприклад, онкогенні Bклітини. Приклади захворювань і станів, на які може бути спрямоване лікування або перебіг яких може бути поліпшений за допомогою анти-CD20 антитіл і їх фрагментів, включають, але ними не обмежуються, онкогенні захворювання, такі як B-клітинна лімфома (NHL, лімфобластний лейкоз/лімфома попередників В-клітин, неоплазії зрілих В-клітин, B-клітинний хронічний лімфоцитарний лейкоз/мала лімфоцитарна лімфома, B-клітинний пролімфатичний лейкоз, лімфоплазматична лімфома, лімфома мантійних клітин, фолікулярна лімфома, шкірна фолікулярна лімфома, B-клітинна лімфома маргінальної зони, волосатоклітинний лейкоз, дифузійна B-великоклітинна лімфома, лімфома Беркітта, плазмоцитома, плазмоцитарна мієлома, посттрансплантаційне лімфопроліферативне порушення, макроглобулінемія Вальденстрома й анапластична великоклітинна лімфома); імунні захворювання, такі як аутоімунні захворювання (псоріаз, псоріатичний артрит, дерматит, системна склеродермія й склероз, запальне захворювання кишечнику, хвороба Крона, виразковий коліт, респіраторний дистрес-синдром, менінгіт, енцефаліт, увеїт, гломерулонефрит, екзема, астма, атеросклероз, дефіцит адгезії лейкоцитів, розсіяний склероз, синдром Рейно, синдром Шегрена, юнацький діабет, хвороба Рейтера, хвороба Бехчета, нефрит, викликаний імунними комплексами, IgАопосередкована нефропатія, IgМ-опосередковані полінейропатії); імуноопосередковані тромбоцитопенії, гостра ідіопатична тромбоцитопенічна пурпура й хронічна ідіопатична тромбоцитопенічна пурпура, гемолітична анемія, міастенія гравіс, вовчаковий нефрит, системний червоний вовчак, ревматоїдний артрит, атопічний дерматит, пухирчатка, хвороба 7 UA 100699 C2 5 10 15 20 25 30 35 40 45 50 55 60 Грейвса, тиреоїдит Хашимото, гранулематоз Вегенера, синдром Оменна, хронічна ниркова недостатність, гострий інфекційний мононуклеоз, ВІЛ і захворювання, пов'язані з вірусом герпесу; важкий гострий респіраторний дистрес-синдром і хореоретиніт; захворювання й порушення, пов'язані з інфікуванням B-клітини вірусом, таким як вірус Епштейна-Барра. У конкретному варіанті здійснення пацієнт, якому призначають антитіло, додатково одержує терапію радіацією, приймає хіміотерапевтичні засоби або речовину, яка модулює (поліпшує або інгібує) експресію або активність рецептора Fc, таку як цитокін. Звичайно, цитокіни для введення в процесі лікування включають гранулоцит-колонієстимулюючий фактор (G-CSF), гранулоцит-макрофагальний колонієстимулюючий фактор (GM-CSF), інтерферон-гамма (IFN-γ) і фактор некрозу пухлини (TNF). Звичайні терапевтичні засоби включають, серед інших, протипухлинні засоби, такі як доксорубіцин, цисплатин, блеоміцин, кармустин, хлорамбуцил і циклофосфамід. Терапевтичне введення й склади Винахід стосується терапевтичних композицій, які містять анти-CD20 антитіла людини або їх антигензв'язувальні фрагменти за даним винаходом. Терапевтичні композиції відповідно до винаходу призначають із придатними носіями, ексципієнтами й іншими засобами, які вводять у склади для того, щоб забезпечити поліпшене перенесення, доставку, стійкість і т. п. Як правило, носії, ексципієнти або інші засоби можуть включати, наприклад, олії (наприклад, каноли, бавовняного насіння, арахісу, сафлору, кунжуту, соєвих бобів), жирні кислоти і їх солі й складні ефіри (наприклад, олеїнову кислоту, стеаринову кислоту, пальмітинову кислоту), спирти (наприклад, етанол, бензиловий спирт), поліспирти (наприклад, гліцерин, пропіленгліколі й поліетиленгліколі, наприклад, PEG 3350), полісорбати (наприклад, полісорбат 20, полісорбат 80), желатин, альбумін (наприклад, сироватковий альбумін людини), солі (наприклад, хлорид натрію), бурштинову кислоту і її солі (наприклад, сукцинат натрію), амінокислоти й їх солі (наприклад, аланін, гістидин, гліцин, аргінін, лізин), оцтову кислоту або її сіль або складний ефір (наприклад, ацетат натрію, ацетат амонію), лимонну кислоту і її солі (наприклад, цитрат натрію), бензойну кислоту і її солі, фосфорну кислоту і її солі (наприклад, одноосновний фосфат натрію, двоосновний фосфат натрію), молочну кислоту і її солі, полімолочну кислоту, глутамінову кислоту і її солі (наприклад, глутамат натрію), кальцій і його солі (наприклад, хлорид кальцію, ацетат кальцію), фенол, цукри (наприклад, глюкозу, сахарозу, лактозу, мальтозу, трегалозу), еритрит, арабіт, ізомальт, лактит, мальтит, маніт, сорбіт, ксиліт, неіонні поверхнево-активні речовини (наприклад, TWEEN® 20, TWEEN® 80), іонні поверхнево-активні речовини (наприклад, додецилсульфат натрію), хлорбутанол, ДМСО, гідроксид натрію, гліцерин, мкрезол, імідазол, протамін, цинк і його солі (наприклад, сульфат цинку), тимеросал, метилпарабен, пропілпарабен, карбоксиметилцелюлозу, хлорбутанол і гепарин. Інші нетерапевтичні засоби описані в US 7001892, зокрема, у таблиці A. Велику кількість відповідних складів можна знайти в довіднику, відомому всім фармацевтам: Remington's Pharmaceutical Sciences (Mack Publishing Company, Easton, Pa). Ці склади включають, наприклад, пудри, пасти, мазі, желе, воски, масла, ліпіди, ліпідовмісні (катіонні або аніонні) везикули (такі як ТМ LIPOFECTIN ), ДНК кон'югати, безводні абсорбуючі пасти, емульсії масло-в-воді й вода-вмаслі, емульсійні карбовоски (поліетиленгліколі різної молекулярної маси), напівтверді гелі й напівтверді мікстури, які містять карбовіск. Будь-які із зазначених складів можуть бути придатними для лікування й терапії відповідно до даного винаходу, за умови, що активний інгредієнт у складі не інактивований складом, і склад фізіологічно переносимий й сумісний зі шляхом введення. Див. також Powell et al. PDA (1998) J Pharm Sci Technol. 52:238-311 і посилання в них для додаткової інформації, яка стосується ексципієнтів і носіїв, які добре відомі фармацевтам. Дози терапевтичних композицій можуть змінюватися залежно від віку й ваги пацієнта, якому їх призначають, захворювання-мішені, умов, шляху введення й т. п. Якщо антитіло за даним винаходом використовують у випадку дорослого пацієнта для лікування різних станів і захворювань, пов'язаних з активністю CD20, включаючи неходжкінську лімфому, ревматоїдний артрит, системний червоний вовчак, хворобу Крона, хронічний лімфоцитарний лейкоз, запальні захворювання й т. п., то переважним є внутрішньовенне введення антитіла за даним винаходом, звичайно в разовій дозі приблизно від 0,01 до приблизно 20 мг/кг маси тіла, переважно приблизно від 0,1 до приблизно 10 мг/кг маси тіла й більш переважно приблизно від 0,1 до приблизно 5 мг/кг маси тіла. Залежно від тяжкості стану або захворювання частота й тривалість лікування можуть бути скоректовані. При іншому парентеральному і пероральному введенні антитіло можна вводити в дозі, що відповідає дозі, зазначеній вище. Різні системи доставки відомі й можуть бути використані для введення фармацевтичної композиції за винаходом, наприклад, інкапсулювання в ліпосомах, мікрочастинки, мікрокапсули, 8 UA 100699 C2 5 10 15 20 25 30 35 40 45 50 55 60 рекомбінантні клітини, здатні експресувати мутантні віруси, рецептор-опосередкований ендоцитоз (див., наприклад, Wu et al. (1987) J. Biol. Chem. 262:4429-4432). Способи введення включають, але ними не обмежуються, внутрішньошкірне, внутрішньом'язове, інтраперитонеальне, внутрішньовенне, підшкірне, інтраназальне, епідуральне і пероральне введення. Композицію можна вводити будь-яким зручним шляхом, наприклад інфузією або болюсною ін'єкцією, абсорбцією через епітеліальну або шкірно-слизову оболонку (наприклад, слизову оболонку порожнини рота, ректальну і внутрішньоочеревинну слизову й т. д.), і можна вводити разом з іншими біологічно активними засобами. Введення може, переважно, бути системним або локальним. Фармацевтична композиція може бути також доставлена у везикулі, зокрема у ліпосомі (див. Langer (1990) Science 249:1527-1533). У певних ситуаціях фармацевтична композиція може бути доставлена за допомогою системи контрольованого вивільнення. В одному з варіантів здійснення може бути використаний насос (див. Langer, вище; Sefton (1987) CRC Crit. Ref. Biomed. Eng. 14:201). В іншому варіанті здійснення можуть бути використані полімерні матеріали (див. Medical Applications of Controlled Release, Langer і Wise (eds.), CRC Pres., Boca Raton, Florida (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984)). У ще одному варіанті здійснення система контрольованого вивільнення може бути поміщена поблизу від мішені композиції, таким чином, вимагаючи тільки частини системної дози (див., наприклад, Goodson, in Medical Applications of Controlled Release, вище, vol. 2, pp. 115-138, 1984). Препарати для ін'єкцій можуть включати лікарські форми для внутрішньовенних, підшкірних, внутрішньошкірних і внутрішньом'язових ін'єкцій, краплинних вливань і т. д. Ці препарати для ін'єкцій можуть бути одержані загальновідомими способами. Препарати для ін'єкцій можуть бути одержані, наприклад, розчиненням, суспендуванням або емульгуванням антитіла або його солі, описаних вище, у стерильному водному середовищі або масляному середовищі, звичайно використовуваних для ін'єкцій. Як водне середовище для ін'єкцій наявні, наприклад, фізіологічний сольовий розчин, ізотонічний розчин, що містить глюкозу й інші допоміжні речовини, і т. д., які можна використовувати в сполученні з придатним солюбілізуючим засобом, таким як спирт (наприклад, етанол), поліспирт (наприклад, пропіленгліколь, поліетиленгліколь), неіонна поверхнево-активна речовина [наприклад, полісорбат 80, HCO-50 (аддукт поліоксіетилену (50 моль) і гідрованої касторової олії)] і т. д. Як масляне середовище використовують, наприклад, кунжутну олію, соєву олію й т. д., які можна використовувати в сполученні з солюбілізуючим засобом, таким як бензилбензоат, бензиловий спирт і т. д. Ін'єкцією, одержаною таким чином, переважно заповнюють відповідну ампулу. Фармацевтичні композиції для перорального або парентерального застосування, описані вище, переважно одержують у лікарській формі в разовій дозі, придатній для точно відповідної дози активних інгредієнтів. Такі лікарські форми в разовій дозі включають, наприклад, таблетки, пігулки, капсули, ін'єкції (ампули), супозиторії й т. д. Кількість вищевказаного антитіла, що міститься в композиції, як правило, становить приблизно від 5 до 500 мг на лікарську форму в разовій дозі; особливо у формі ін'єкції, переважно, щоб вищевказане антитіло містилося в кількості приблизно від 5 до 100 мг і приблизно від 10 до 250 мг в інших лікарських формах. ПРИКЛАДИ Наступні приклади запропоновані для того, щоб забезпечити фахівців у даній галузі повним розкриттям і описом того, як створювати й застосовувати способи й композиції за винаходом, і не обмежені обсягом того, що автори винаходу відносять до свого винаходу. Були зроблені спроби забезпечити точність відносно використаних чисел (наприклад, кількості, температура й т. д.), але варто взяти до уваги деякі експериментальні помилки й відхилення. Якщо не зазначене інше, частини являють собою масові частини, молекулярна маса означає середню молекулярну масу, температура представлена в градусах Цельсія й тиск є атмосферним або близьким до атмосферного. Приклад 1. Одержання антитіл людини до CD20 людини Імунізація гризунів може бути проведена будь-яким відомим у даній галузі способом (див., наприклад, Harlow & Lane, eds. (1988) Antibodies: A Laboratory Manual, Cold Spring Harbor Press, New York; Malik and Lillehoj, Antibody techniques: Academic Press, 1994, San Diego). В одному з варіантів здійснення клітини, експресуючі CD20, безпосередньо вводять мишам, у яких є локуси ДНК, що кодують як варіабельні області важкого ланцюга імуноглобуліну людини, так і варіабельні області легкого ланцюга каппа (VelocImmune, Regeneron Pharmaceuticals Inc.; US 6596541), з ад'ювантом для стимуляції імунної відповіді. Такі ад'юванти можуть включати повний і неповний ад'ювант Фрейнда, систему ад'ювантів MPL+TDM (Sigma) або RIBI (мурамілдипептиди) (див. O'Hagan, Vaccine Adjuvant, by Human Press, 2000, Totawa, NJ). Для досягнення 9 UA 100699 C2 5 10 15 20 25 30 35 40 45 50 55 60 високих рівнів експресії CD20 людини на поверхні клітини клітинні лінії мишей, MG87 і/або NS/0 клітини, трансфікують плазмідою, що кодує CD20 людини, і клітини, експресуючі високі рівні CD20, збагачують з використанням технології FACS. В одному з варіантів здійснення CD20 вводять опосередковано у вигляді ДНК-плазміди, яка містить ген CD20, і експресують CD20 з використанням експресійної системи білків хазяїна для одержання антигенного білка in vivo. В обох підходах, для досягнення оптимальної антитільної імунної відповіді, миші одержують повторні ін'єкції кожні 3-4 тижні. Імунну відповідь перевіряють за допомогою клітинного імуноаналізу, як описано нижче, при якому зразки сироватки із серійними розведеннями від однократного до трикратного піддають імуноаналізу. Титр сироватки визначають як розведення зразка сироватки, що давало при аналізі сигнал, який двократно перевищує фон. Коли тварини досягають максимуму своєї імунної відповіді, B-клітини, експресуючі антитіла, збирають і зливають із мієломними клітинами миші для утворення гібридом. Приклад 2. Відбір антигенспецифічних гібридом У первинному скринінгу NS/0 клітини (ATCC) трансфікували геном CD20 людини, і високоекспресуючі клітини (NS/0-hCD20) об'єднували й культивували для використання у відбірному кондиційному для гібридоми середовищі, як правило, приблизно від 11 до 14 днів після злиття. NS/0-hCD20 клітини в середовищі RPMI 1640 з 10 % ембріональною телячою сироваткою поміщали із густиною 50000 клітин на ямку в 96-ямкові полі-D-лізинові планшети. Кондиційне для гібридоми середовище розводили в 5 разів і давали клітинам зв'язуватися протягом 30 хвилин. Клітини потім фіксували на планшетах протягом 20 хв. додаванням рівного об'єму 8 % формальдегіду, з наступним чотириразовим промиванням в PBST. Планшети інкубували з 5 % BSA протягом 2 годин при кімнатній температурі (RT). Після промивання антитіла, зв'язані з планшетом, інкубували з HRP-кон'югованими козячими Fcγ-специфічними поліклональними антитілами проти IgG миші протягом 30 хв. і планшети проявляли, використовуючи 3,3',5,5'-тетраметилбензидиновий (TMB) субстрат (BD Pharmigen), з наступним кінцевим промиванням. Реакцію HRP зупиняли рівним об'ємом 1 M фосфорної кислоти. Сигнали зв'язування антитіла вимірювали оптичною густиною при 450 нм. Батьківські клітини NS/0, без визначуваної експресії CD20, використовували як фоновий контроль, щоб виключити гібридомні супернатанти з неспецифічним зв'язуванням з поверхнею клітин. Ямки, позитивні як по батьківських клітинах NS/0, так і по клітинах, експресуючих CD20, виключали. Приклад 3. Секвенування антитіл людини проти CD20 Перед секвенуванням антигенспецифічні гібридомні клітини субклонували по одній клітині з ТМ використанням проточного цитометра MOFLO . Секвенування варіабельних областей легкого й важкого ланцюгів здійснювали стандартними способами (див., наприклад, US 2004/0167319A1). Загальну РНК одержували з кожної гібридомної клітинної лінії за допомогою ТМ набору RNEASY (Qiagen). кднк одержували з використанням набору для ампліфікації кднк ТМ SMART RACE (Clonetech). Послідовності ДНК HCVR і LCVR секвенували й прогнозовані амінокислотні послідовності для HCVR і LCVR надавали для вибраних антитіл (HCVR/LCVR SEQ ID NO): 3B9-10N (3/11); 3B9-10GSP (19/21); 3B9-10FGL (23/25); 9C11-14N (27/35); 9C1114GSP (43/45); 9C11-14FGL (47/49); 2B7-7N (51/59); 2B7-7GSP (67/69); 2B7-7FGL (71/73); 2C114N (75/83); 2C11-4GSP (91/93); 2C11-4FGL (95/97); 3H7-6N (99/107); 3H7-6GSP (115/117); 3H76FGL (119/121); 5H2-17N (123/131); 5H2-17GSP (139/141); 5H2-17FGL (143/145); 6B9-4N (147/155); 6B9-4GSP (163/165); 6B9-4FGL (167/169); 6F6-1N (171/179); 6F6-1GSP (187/189); 6F61FGL (191/193); 8G6-5N ("8G6-5") (195/203); 8G6-5GSP (211/213); 8G6-5FGL (215/217); 9C3-8N (219/227); 9C3-8GSP (235/237); 9C3-8FGL (239/241); 9D4-7N ("9D4-7") (243/251); 9D4-7GSP (259/261); 9D4-7FGL (263/265); 9E4-20N (267/275); 9E4-20GSP (283/285); 9E4-20FGL (287/289); 9H4-12N (291/299); 9H4-12GSP (307/309); 9H4-12FGL (311/313); 10E3-17N (315/323); 10E317GSP (331/333); 10E3-17FGL (335/337); 10F2-13N ("10F2-13") (339/347); 10F2-13GSP (355/357); 10F2-13FGL (359/361); 7E1-13N (363/371); 7E1-13GSP (379/381); 7E1-13FGL (383/385). Приклад 4. Антигензв'язувальна специфічність анти-CD20 антитіл Після того як химерні антитіла були перетворені в повністю людський IgG, специфічні антигензв'язувальні властивості визначали за допомогою протоколу ELISA, подібного до протоколу, описаного вище, за винятком того, що HRP-кон'юговані козячі анти-hIgG Fcспецифічні поліклональні антитіла використовували як антитіла детекції, а клітинну лінію Daudi (яка експресує ендогенний CD20) використовували як джерело антигену. Всі досліджені антитіла специфічно зв'язувалися із клітинами Daudi з величинами EC 50 у діапазоні приблизно від 0,4 нМ до приблизно 20 нМ. Антигенну специфічність зв'язування з повністю людськими анти-CD20 антитілами підтверджували, використовуючи проточну цитометрію, як описано нижче, із клітинами MG87, трансфікованими за допомогою CD20 людини. У короткому викладі, батьківські клітини MG87 і 10 UA 100699 C2 5 10 клітини MG87, трансфіковані за допомогою CD20 людини, інкубували протягом 30 хв. при 4 °C з кожним з 15 антитіл людини й двома контрольними антитілами, з наступною інкубацією з PEкон'югованими антитілами проти IgG людини. Зв'язування оцінювали за допомогою проточної цитометрії. Значення інтенсивності флуоресценції порівнювали зі зв'язуванням з батьківською клітинною лінією й контрольним зразком з придатним ізотипом. Результати підсумовані в таблиці 1. Всі антитіла зв'язалися з клітинами MG87, трансфікованими за допомогою CD20 людини, у той час як не спостерігалося ніякого зв'язування з батьківськими клітинами MG87, вказуючи на те, що антитіла CD20-специфічні. Контроль I: химерне (миша/людин) анти-CD20 mAb, ритуксимаб, (РИТУКСАН®, IDEC Pharmaceuticals Corp.); контроль II: анти-CD20 mAb людини, 2F2, описані в WO 2005/103081). Таблиця 1 Антитіло Незабарвлене Контроль I Контроль II 7E1-13 2B7-7 10F2-13 9H4-12 10E3-17 9D4-7 9C3-8 3B9-10 9E4-20 3H7-6 6B9-4 6F6-1 8G6-5 2C11-4 9C11-14 15 20 Загальна середня інтенсивність флуоресценції Трансфіковане за допомогою CD20 Нетрансфіковане людини 5,78 5,86 6,15 2955,71 6,08 3315,94 6,11 3076,88 6,08 3483,32 6,13 3396,69 6,06 2043,95 6,03 3071,01 6,66 3156,91 6,03 2913,87 6,07 2986,32 6,03 2908,67 6,1 3302,01 6,09 2933,36 6,05 3385,59 6,04 3407,87 6,02 2009,86 6,05 2751,56 Приклад 5. Зв'язування анти-CD20 антитіла людини з мутантним CD20 людини Мутантні CD20 людини були одержані шляхом заміщення амінокислотних послідовностей CD20 людини відповідними амінокислотами миші з використанням набору Strategene Mutagenesis (таблиця 2). Плазмідний вектор, що містить мутантний CD20 людини, CMV промотор і маркерний ген стійкості до гігроміцину IRES-GFP, був потім трансфікований у клітини MG87. Для кожного мутантного CD20 людини збирали сукупність гігроміцинстійких клітин, які демонстрували високу експресію GFP, і створювали стабільні лінії для аналізу зв'язування антитіла. Таблиця 2 Мутант #1 #2 #3 #4 #5 #6 #7 #8 #9 #10 Мутація Y77F N163D A170S N166D P172S Y77F Y77F Y77F N163D A157V P172S N166D N163D N163D N166D 11 N166D UA 100699 C2 6 5 10 У короткому викладі, приблизно 1×10 клітин з кожної стабільно трансфікованої клітинної лінії, експресуючої мутантний CD20 людини, збирали й інкубували з кожним анти-антитілом людини, 10 мкг/мл, на льоду протягом 1 год., з наступною інкубацією з APC-кон'югованими козячими антитілами проти IgG людини (Jackson Immunolabs), 10 мкг/мл, на льоду протягом 45 хв. Для кожного антитіла зв'язування з кожним мутантним CD20 людини визначали за допомогою проточної цитометрії. Середні рівні інтенсивності флуоресценції оцінювали, у той час як пропускали невелику (приблизно 20 %) популяцію клітин, які показали середній рівень експресії GFP, щоб мінімізувати ефекти, пов'язані з різними рівнями експресії мутантів CD20 усередині кожної клітинної лінії. Для кожного мутантного CD20, антитіло, яке показало найвищу середню інтенсивність флуоресценції, позначали як 100 % зв'язування. У таблиці 3 показаний відсоток зв'язування кожного анти-CD20 антитіла з кожним мутантним CD20 людини. Таблиця 3 Антитіло Контроль II 3B9-10 9C11-14 7E1-13 6F6-1 8G6-5 10F2-13 2B7-7 10E3-17 2C11-4 9D4-7 6B9-4 3H7-6 9C3-8 9H4-12 9E4-20 Контроль I 15 20 #1 60 56 89 94 100 86 79 100 61 35 67 74 28 36 19 14 96 Відсоток зв'язування з мутантним CD20 людини (%) #2 #3 #4 #5 #6 #7 #8 #9 30 70 51 84 1 1 0 4 6 67 40 72 1 1 0 4 83 0 87 29 87 96 100 100 49 95 84 85 1 1 0 4 74 100 85 100 16 2 0 4 45 65 70 76 5 1 0 4 54 55 60 69 1 2 0 4 40 87 100 88 12 2 0 4 1 6 1 49 1 1 0 4 0 11 31 30 1 1 0 3 2 70 5 66 0 2 0 4 3 64 3 67 1 2 0 3 1 43 4 45 0 1 0 3 0 84 22 76 0 1 0 3 0 0 0 2 1 2 0 4 0 57 8 57 1 1 0 3 100 0 96 2 100 100 93 97 #10 79 79 83 92 98 96 87 83 87 68 75 75 80 77 52 76 100 Приклад 6. Ефективність в комплементзалежній цитотоксичності (CDC) Антитіла людини проти CD20 людини були перевірені на їх здатність стимулювати комплементзалежну цитотоксичність (CDC) з використанням клітинних ліній лімфоми людини Daudi і RL як клітинних ліній-мішеней. Використовували серійні розведення антитіл у середовищі (діапазон кінцевих концентрацій від 50 нм до 0,85 пм плюс контроль із буфером) і додавали до клітин-мішеней, висіяних у форматі 96-ямкового планшета. Сироватку людини з компонентами комплементу (Quidel) додавали в кожну ямку для одержання кінцевої концентрації сироватки 5 %. Клітини інкубували при 37 °C протягом 2 годин з досліджуваними антитілами й сироваткою людини з компонентами комплементу, а потім аналізували виживання ТМ клітин, що виявляли за допомогою ALAMARBLUE . Флуоресценцію вимірювали з використанням довжини хвилі збудження 560 нм і довжини хвилі емісії 590 нм (таблиця 4). 25 Таблиця 4 Антитіло 10F2-13 8G6-5 9D4-7 2B7-7 Контроль II 6B9-4 3H7-6 6F6-1 10E3-17 Контроль I Daudi EC50 (нМ) 0,17±0,08 0,21±0,08 0,22±0,21 0,24±0,09 0,28±0,11 0,34±0,25 0,44±0,27 0,56±0,35 0,59±0,24 0,84±0,60 12 n 3 3 4 4 5 3 2 3 2 6 RL EC50 (нМ) 0,36±0,10 1,06±0,43 0,83±0,60 1,03±0,40 0,77±0,41 0,97±0,32 3,66±3,85 1,20±0,43 7,80±8,64 >50 N 4 4 5 5 6 4 2 4 3 4 UA 100699 C2 Продовження таблиці 4 Антитіло 9E4-20 7E1-13 3B9-10 9C3-8 9C11-14 9H4-12 2C11-4 5 10 15 Daudi EC50 (нМ) 1,53±0,87 1,59±0,71 1,86±0,96 2,22±1,62 7,14±6,63 51,10±38,4 >50 n 3 3 3 2 3 2 2 RL EC50 (нМ) 1,70±1,80 5,81±3,77 8,84±6,94 11,13±9,29 12,01±6,61 29,60±23,76 5,19±3,10 N 4 4 4 2 4 2 3 Приклад 7. Функціональна швидкість дисоціації анти-CD20 антитіл людини Швидкості дисоціації анти-CD20 mAb аналізували в тесті CDC. Експерименти проводили трьома окремими серіями. Усередині кожної серії визначали відсоток лізису клітин для 5 антитіл одноразово в порівнянні з контролями I і II при 0, 1 і 6 год. Антитіло зв'язували із клітинами 6 шляхом інкубування 2 мкг кожного антитіла з 10 клітин Daudi протягом 45 хв. (RT). Для нульової часової точки клітини промивали й негайно ресуспендували в 100 мкл середовища, що містить 20 % нормального сироваткового комплементу людини, потім інкубували протягом 45 6 хв. при 37 °C, 5 % CО2. Для часових точок 1 год. і 6 год. 10 клітин промивали після зв'язування антитіл, ресуспендували в 12 мл свіжого середовища в 15 мл пробірках Falcon і інкубували на механічному інвертері протягом 1 год. і 6 год., відповідно. При досягненні вибраної часової точки й завершенні інкубації в середовищі, що містить 20 % нормального сироваткового комплементу людини, клітини промивали й інкубували протягом 45 хв. Після інкубації із сироваткою до кожного зразка додавали 7-аміноактиноміцин D (7AAD) і інкубували протягом 15 хв. при кімнатній температурі для оцінки життєздатності клітин. Відсоток цитотоксичності визначали в кожній часовій точці, задаючи області як пряме розсіювання, у порівнянні із двовимірною діаграмою розсіювання 7AAD, яка представляє 7AAD-позитивні й негативні клітини, з дебрисом, виключеним з обох областей. Відсоток цитотоксичності був виведений для кожної часової точки як 100 мінус відсоток 7AAD-гегативних клітин (таблиці 5-7). 20 Таблиця 5 Антитіло Контроль I Контроль II 10F2-13 8G6-5 9D4-7 2B7-7 9C11-14 0 годин 98,5 99,6 99,6 99,6 99,4 99,4 55,8 % цитотоксичності 1 година 86,9 99,1 99,2 99,2 99,0 99,4 22,3 6 годин 16 98,5 98,5 97,7 96,0 98,3 12,9 Таблиця 6 Антитіло Контроль I Контроль II 6B9-4 3H7-6 6F6-1 10E3-17 9E4-20 0 годин 91,9 98,3 98,1 97,5 97,1 97 67,4 13 % цитотоксичності 1 година 65,3 98,6 98,5 94,0 97,1 96,2 31,2 6 годин 52,1 97,7 97,5 67,6 76,4 79,2 49,9 UA 100699 C2 Таблиця 7 Антитіло 0 годин 98,3 99,1 98,1 98,4 98,7 43,2 29,1 Контроль I Контроль II 7E1-13 3B9-10 9C3-8 9H4-12 2C11-4 5 10 15 % цитотоксичності 1 година 81,1 99,2 98,5 97,9 98,5 17,4 14 6 годин 20,5 98,7 89,3 82,2 76,9 23,1 22,4 Приклад 8. Біохімічні швидкості дисоціації анти-CD20 антитіл людини Біохімічні швидкості дисоціації вибраних для перевірки анти-CD20 антитіл визначали й порівнювали з контрольними антитілами I і II. Два вибрані антитіла людини, контроль I або II 6 (кожний 2 мкг/мл), інкубували з CD20-експресуючими клітинами Raji, 10 /мл, протягом 2 годин при кімнатній температурі. Потім клітини промивали, видаляли надлишок антитіла, ресуспендували в середовищі, що містить 1 % сироватки, і інкубували при 37 °C. У часовій точці 0, 15, 30, 45, 60, 90, 120 і 180 хв. відбирали аліквоту клітин в 1 мл, промивали, забарвлювали за допомогою PE-міченого анти-hFc антитіла й аналізували за допомогою FACS. Середню інтенсивність флуоресценції (MFI) використовували як індикатор кількості антитіла, яке зв'язалося із клітинною поверхнею. Біохімічні швидкості дисоціації розраховували, приймаючи відсоток зв'язування в нульовій точці за 100 %. Експеримент повторювали додатково 5 разів і біохімічні швидкості дисоціації для 12 досліджуваних антитіл визначали й порівнювали з контролем I і II (таблиці 8-13). Таблиця 8 Час (хв.) 0 15 30 45 60 90 120 180 % зв'язування Контроль II 100,00 69,04 72,03 74,00 61,38 54,43 51,33 52,73 Контроль I 100,00 58,36 47,04 33,77 22,96 11,82 6,89 2,73 9C11-14 100,00 50,86 42,22 28,77 17,49 9,66 5,11 2,06 10F2-13 100,00 74,85 73,99 70,77 54,30 51,12 47,40 51,65 Таблиця 9 Час (хв.) 0 15 30 45 60 90 120 180 % зв'язування Контроль II 100,00 80,54 81,20 85,86 85,44 81,30 73,68 51,57 Контроль I 100,00 67,11 51,18 41,97 31,17 15,53 13,08 2,42 14 8G6-5 100,00 86,48 73,09 86,95 83,93 73,26 67,93 47,96 9D4-7 100,00 81,00 82,76 80,73 74,50 62,59 45,99 22,34 UA 100699 C2 Таблиця 10 Час (хв.) 0 15 30 45 60 90 120 180 % зв'язування Контроль II 100,00 90,93 84,05 64,85 86,17 80,84 82,08 69,25 Контроль I 100,00 68,02 55,97 29,49 33,24 15,42 9,40 3,40 3H7-6 100,00 69,38 56,58 33,12 36,98 19,45 12,25 3,97 6F6-1 100,00 87,04 80,86 56,45 68,75 60,57 54,56 34,60 Таблиця 11 Час (хв.) 0 15 30 45 60 90 120 180 % зв'язування Контроль II 100,00 82,97 69,72 78,71 64,19 67,06 58,03 51,73 Контроль I 100,00 59,47 58,96 49,57 30,98 18,41 8,46 2,70 2B7-7 100,00 88,14 90,53 90,30 76,95 69,17 66,95 64,01 6B9-4 100,00 91,05 95,32 96,45 79,77 64,66 60,04 49,03 Таблиця 12 Час (хв.) 0 15 30 45 60 90 120 180 % зв'язування Контроль II 100,00 81,04 86,27 87,98 76,71 87,36 93,79 84,95 Контроль I 100,00 73,07 51,70 34,75 22,53 14,01 8,54 3,44 7E1-13 100,00 89,23 83,34 79,89 73,89 96,29 94,46 89,58 10E3-17 100,00 88,88 78,82 69,99 66,64 65,20 50,86 29,76 Таблиця 13 Час (хв.) 0 15 30 45 60 90 120 180 % зв'язування Контроль II 100,00 88,42 83,57 85,97 75,25 67,46 61,69 68,62 Контроль I 100,00 73,84 58,06 39,64 26,86 12,89 6,83 3,27 3B9-10 100,00 77,88 76,63 70,32 62,64 55,16 47,74 48,25 9E4-20 100,00 40,59 15,90 6,76 3,31 1,60 0,97 0,81 5 10 Приклад 9. Аналіз антитілозалежної клітинної цитотоксичності (ADCC) ADCC, індуковану вибраними анти-CD20 антитілами людини, оцінювали з використанням клітин Daudi (клітини із клітинної лінії лімфоми людини, які ендогенно експресують CD20). У короткому викладі, клітини Daudi (10000 клітин/ямку в 50 мкл) спочатку змішували з рівним об'ємом серійних розведень анти-CD20 антитіла людини, одержуючи кінцеву концентрацію 15 UA 100699 C2 5 10 антитіла в діапазоні від 0,169 пМ до 10 нМ, і інкубували протягом 10 хв. при кімнатній температурі в 96-ямковому планшеті (контроль = ямки без антитіла). Роздільно готувили мононуклеарні клітини периферичної крові людини (PBMC, ефекторні клітини), додержуючись звичайної методики збагачення із градієнтним центрифугуванням у середовищі Ficoll-Hypaque. Збагачені PBMC збирали, промивали й поміщали в середовище RPMI 1640, що містить 10 % FBS, інактивованої нагріванням, 2 мМ глутамін і 50 нМ бета-меркаптоетанол. Клітини потім стимулювали за допомогою 5 нг/мл IL-2 людини протягом 3 днів, один раз промивали середовищем, потім використовували безпосередньо для аналізу ADCC. Приблизно 300000 PBMC додавали до кожної суміші антитіла й клітини-мішені для одержання кінцевого відношення ефектора до клітин-мішеней приблизно 30:1. 96-ямкові планшети потім інкубували протягом 4 год. і центрифугували при 250 × g. Супернатанти збирали й аналізували на активність лактатдегідрогенази (LDH) з використанням CYTOTOX 96® Non-Radioactive Cytotoxicity Assay system (Promega) (таблиця 14). Таблиця 14 Антитіло 9C11-14 9E4-20 3B9-10 8G6-5 10F2-13 6F6-1 7E1-13 9D4-7 2C11-4 10E3-17 2B7-7 6B9-4 9C3-8 3H7-6 9H4-12 EC50 (пМ) 10,22 2,37 6,77 14,83 6,68 5,15 2,14 1,53 1,45 1,20 1,99 4,27 11,02 11,11 33,82 N 4 3 2 5 7 4 3 3 1 3 3 3 3 3 1 15 20 25 30 35 Приклад 10. Терапевтична активність анти-CD20 антитіл з використанням мишачої моделі ксенотрансплантата лімфоми людини In vivo дослідження ефективності вибраних анти-CD20 антитіл проводили з використанням ксенотрансплантата неходжкінської B-клітинної лімфоми людини на моделі миші. Самок мишей з важким комбінованим імунодефіцитом (SCID) придбавали в 6-тижневому віці. Після одного тижня акліматизації 2,5 мільйона свіжозібраних клітин Raji (клітини із клітинної лінії неходжкінської B-клітинної лімфоми людини) вводили внутрішньовенно кожній миші. Кожну мишу, щеплену клітинами Raji, потім піддавали дії FC людини (hFC), контролю I, контролю II, 8G6-5, 9D4-7, 10F2-13 або 7E1-13, кожний у дозі 10 мг/кг, за допомогою внутрішньовенної ін'єкції в латеральну частину хвоста на 3, 6 і 9 дні після щеплення. За мишами спостерігали протягом періоду до 180 днів. Мишей, які демонструють ознаки захворювання, включаючи параліч задніх кінцівок, кахексію й велику локальну пухлинну масу у випадковому місці, піддавали евтаназії шляхом задушливої дії CO2. Криві безсимптомного виживання будували з використанням способу Kaplan-Meier (фіг. 1). Результати представлені у вигляді відсотка виживання як функції безсимптомного часу виживання. Дані результати показують, що антитіло 10F2-13 значно збільшує час виживання на моделі тварин, приблизно від 20 днів (контрольні тварини, на яких впливали hFc) до приблизно 180 днів (більше ніж дев'ятикратне збільшення рівня виживаності) (50 % тварин, підданих впливу, виживали приблизно 20 днів (hFc контроль), приблизно 40 днів (контроль I), приблизно 85 днів (контроль II) і більше ніж 180 днів (10F2-13)). Цей збільшений час виживання щонайменше у два рази більше (відносно контролю II), приблизно в 4,5 рази більше (відносно контролю I) або щонайменше приблизно в 9 разів або більше відносно тварин, на яких впливали hFc. 16 UA 100699 C2 17 UA 100699 C2 18 UA 100699 C2 19 UA 100699 C2 20 UA 100699 C2 21 UA 100699 C2 22 UA 100699 C2 23 UA 100699 C2 24 UA 100699 C2 25 UA 100699 C2 26 UA 100699 C2 27 UA 100699 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibody to human cd20 and using thereof for the treatment cd20-mediated disease or condition
Автори англійськоюMartin Joel H., Wang, Li-Hsien, Stevens, Sean, Allison, Erin, M.
Назва патенту російськоюАнтитело к cd20 человека и его применение для лечения заболевания или состояния опосредованного cd20
Автори російськоюМартин Джоел Х., Ван Ли-Сиень, Стивенс Шон, Эллисон Эрин М.
МПК / Мітки
МПК: A61P 35/00, C07K 16/28, A61K 39/395
Мітки: захворювання, опосередкованого, людини, антитіло, застосування, сd20, лікування, стану
Код посилання
<a href="https://ua.patents.su/130-100699-antitilo-do-cd20-lyudini-ta-jjogo-zastosuvannya-dlya-likuvannya-zakhvoryuvannya-abo-stanu-oposeredkovanogo-sd20.html" target="_blank" rel="follow" title="База патентів України">Антитіло до cd20 людини та його застосування для лікування захворювання або стану опосередкованого сd20</a>
Попередній патент: Поверхнево модифіковані діоксиди кремнію, одержані пірогенним шляхом
Випадковий патент: Пневматичний мембранний виконавчий пристрій