Система подачі нев’язкого полімерного розчину на основі простагландину, який не містить консерванта
Формула / Реферат
1. Офтальмологічний розчин, який містить на 100 мл:
- карбомер - 0,1 г;
- сорбітол - 3,5 г;
- поліетиленгліколь - 1,0 г;
- ЕДТА - 0,05 г;
- гідроксид натрію 1н - до рН 7,0;
- латанопрост - 0,005 г;
- макрогол гліцерилгідроксистеарат 40 - 5,0 г;
- вода для ін'єкцій - до 100 мл;
причому вищезазначений розчин має в'язкість по Брукфельду при 25 °С в діапазоні від 8 до 20 мПа·сек.
2. Розчин за п. 1, який відрізняється тим, що розчин є стабільним протягом періоду не менше 18 місяців при кімнатній температурі (25 або 30 °С).
3. Розчин за будь-яким з пп. 1, 2, який відрізняється тим, що він сумісний з флаконами одноразового або багаторазового користування, виконаними з ПЕНГ без добавок.
4. Розчин за будь-яким з пп. 1-3, призначений для лікування глаукоми і/або зниження внутрішньоочного тиску.
5. Розчин за п. 4 для введення людині або тварині топічним шляхом по одній краплі на добу згаданого розчину в кожне око.
6. Флакон для одноразового або багаторазового користування, виконаний з ПЕНГ без добавок, що містить офтальмологічний розчин за п. 1.
Текст
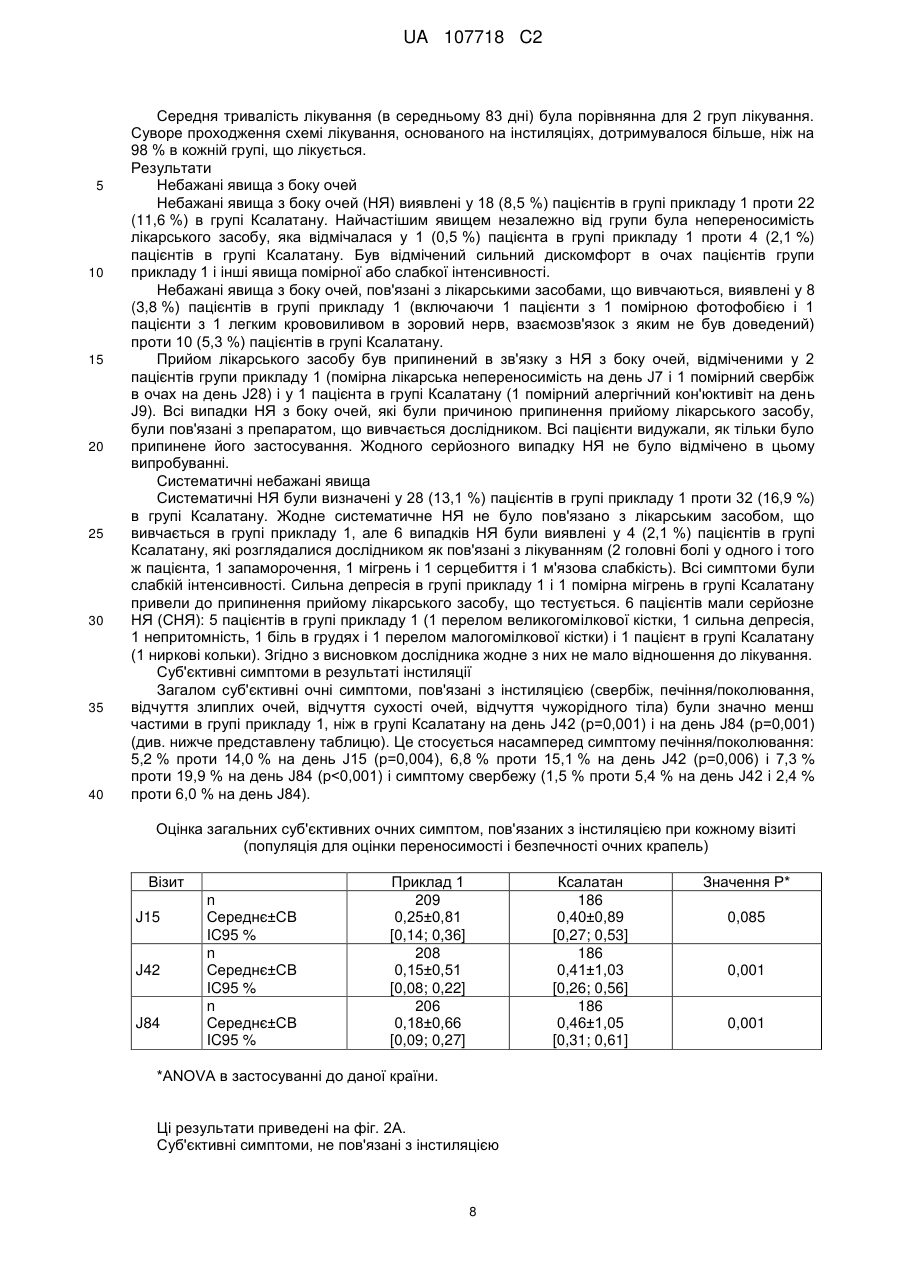
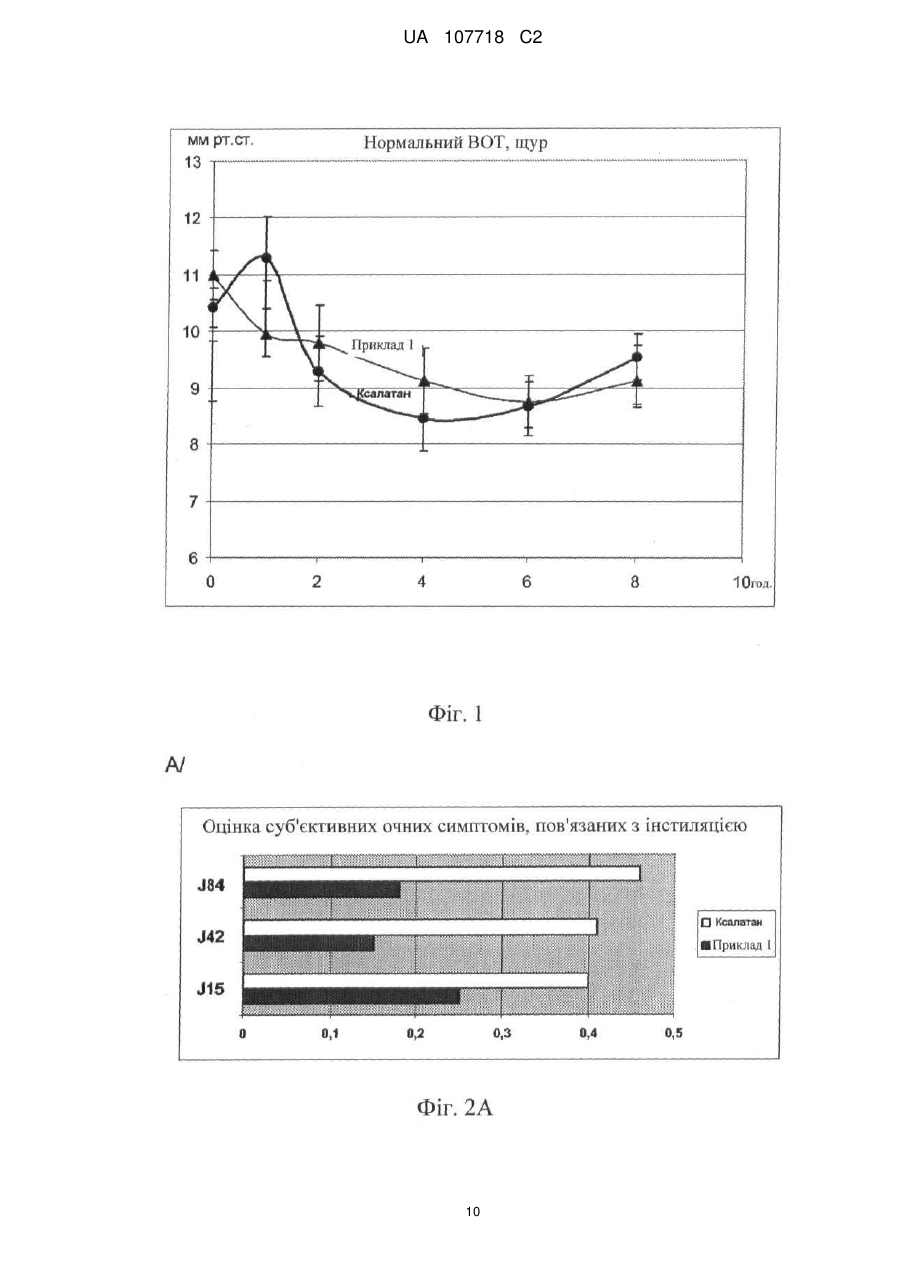
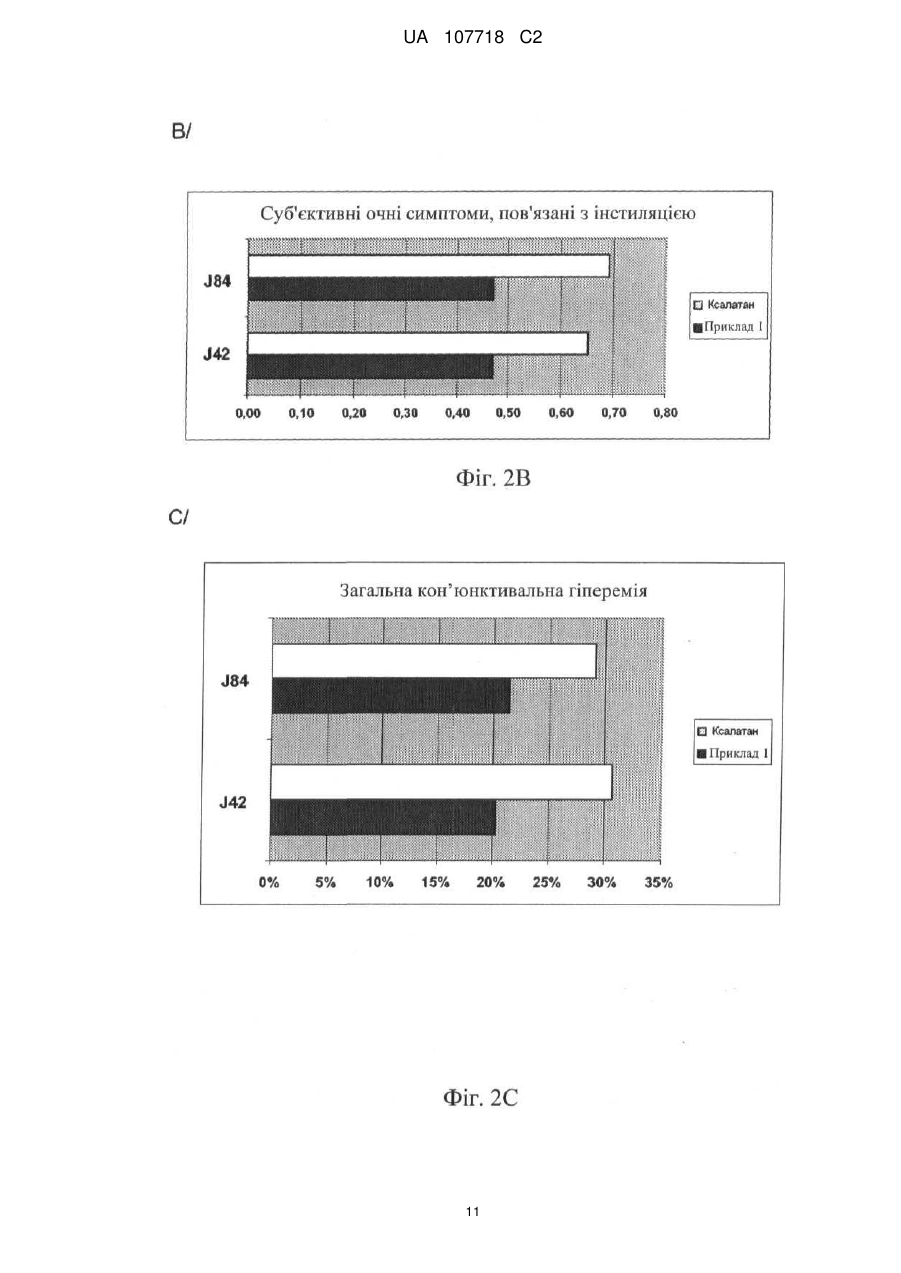
Реферат: Винахід стосується офтальмологічного розчину, який містить на 100 мл: карбомер - 0,1 г; сорбітол - 3,5 г; поліетиленгліколь - 1,0 г; ЕДТА - 0,05 г; гідроксид натрію 1н - до рН 7,0; латанопрост - 0,005 г; макрогол гліцерилгідроксистеарат 40-5,0 г; вода для ін'єкцій - до 100 мл; UA 107718 C2 (12) UA 107718 C2 причому вищезазначений розчин має в'язкість по Брукфельду при 25 °С в діапазоні від 8 до 20 мПа·сек. UA 107718 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь техніки Винахід стосується очних крапель або очного розчину, що містить як діючу речовину щонайменше один простагландин, причому згаданий розчин не містить консерванту антимікробного типу, зокрема, типу четвертинного амонію (наприклад, бензалконію хлориду (ВАК)). Більш конкретно, в рамках даного винаходу розроблена система подачі полімеру, що дозволяє розчину простагландину зберігати таку ж ефективність, як і розчин, що містить ВАК, але не мати недоліків, пов'язаних з токсичністю і алергенністю. Рівень техніки Простагландини є добре відомими діючими речовинами, які вводять людині або тварині топічним шляхом у вигляді крапель для лікування глаукоми. Звичайне дозування цих препаратів становить 1 крапля/добу в обидва ока, з урахуванням того, що простагландини можуть використовуватися у вигляді асоціацій з другим антиглаукомним агентом, таким, наприклад, як бета-блокатор, інгібітор карбоангідрази або альфа-адренергічний агоніст. Перший недолік простагландинів полягає в тому, що вони не розчиняються у воді, тому для розчинення їх всередині крапель необхідно здійснити попередній етап солюбілізації. Крім того, інша вимога для готувача полягає в тому, щоб офтальмологічний розчин був би хімічно стабільним у часі при кімнатній температурі, практично, протягом періоду від 18 до 24 місяців. Інша характеристика, яка пред'являється до офтальмологічного розчину, стосується стабільності розчину відносно упаковки, в якій він зберігається, зокрема, відносно упаковки з полімерного матеріалу типу поліетилену низької густини (ПЕНГ). Нарешті, останньою вимогою, яка може бути пред'явлена, є усунення забрудненості офтальмологічного розчину антимікробними агентами, зокрема, у випадку, коли упаковка, в якій знаходиться розчин, є багатодозовою. Однак ця остання проблема вирішується за допомогою однодозової упаковки або пристрою, передбаченого для цієї мети (наприклад, система ABAK® або COMOD®). Таким чином, досі більшість офтальмологічних розчинів на основі простагландинів, що випускаються на ринок, містять консервант, який, крім своїх антимікробних властивостей, забезпечує також солюбілізацію діючої речовини, і частково її стабільність. Це стосується, наприклад, продукту, що випускається фірмою PFIZER під найменуванням Ксалатан®, що містить в своєму складі латанопрост і ВАК на рівні 0,02 % мас. Однак потрібно зазначити, що, незважаючи на присутність ВАК, ці очні краплі нестабільні при кімнатній температурі і повинні зберігатися на холоді при температурі близько 5 °C. Крім того, фірмою ALLERGAN випускаються очні краплі під найменуванням Люміган®, що містять в своєму складі біматопрост і ВАК на рівні 0,005 % мас. Однак в численних публікаціях не рекомендується використовувати консервант антимікробного типу, зокрема, ВАК, в офтальмологічних цілях у випадку тривалого лікування, як, зокрема, глаукоми, через проблеми переносимості (див. The New Class of Ophthalmic Agents: "Here's how to choose the right prostaglandin for the each patient" авторів J. JAMES THIMONS, O.D., F.A.A.O. - Optometric management, випуск травень 2002). Відтоді встановлено, що консерванти антимікробного типу є токсичними при тривалому застосуванні і тому в цей час існує намагання обмежити їх використання шляхом максимального зменшення їх концентрації в очних краплях і навіть виключити їх зі складу. Ця проблема була, наприклад, розглянута в документі WO 97/29752, в якому розкрите використання неіонного агента типу Кремофор® замість частини ВАК. У запропонованому складі концентрація ВАК обмежена вмістом 0,01 % мас., при цьому концентрація Кремофору® EL становить 0,05 % мас. На ринку існує продукт під найменуванням Траватан®, що випускається фірмою ALCON, що містить в своєму складі травопрост, ВАК і Кремофор®. Запропонований також полісорбат 80 для використання в офтальмологічних розчинах з метою часткового зниження концентрації ВАК, як, наприклад, продукт, що випускається фірмою NOVARTIS під найменуванням РЕСКУЛА®, що містить в своєму складі унопростон і суміш ВАК з полісорбатом 80, що становить 0,015 % мас. від розчину. У документі US2004/0082660 описаний офтальмологічний розчин, що не містить ВАК, але що містить суміш латанопросту із полісорбатом 80. Таким чином, задача, яку пропонує вирішити винахід, полягає в розробці складу на основі простагландину, який повинен виконувати щонайменше наступні умови: - він не повинен містити антимікробного консерванту; - він повинен бути стабільний у часі в формі розчину при кімнатній температурі (мінімум протягом періоду від 18 до 24 місяців); 1 UA 107718 C2 5 10 15 20 25 30 35 40 45 50 55 - він повинен бути сумісним з пластиковим матеріалом упаковки, в якій він звичайно зберігається, зокрема, упаковки з ПЕНГ; - він повинен мати практично таку ж ефективність відносно зниження внутрішньоочного тиску (ВОТ), що і ефективність використовуваного складу на основі ВАК. Інша мета винаходу полягає в тому, щоб запропонувати достатньо текучий склад, придатний для упакування по технології асептичної упаковки типу "Blow-Fill-Seal" (однодозова). Опис винаходу Таким чином, заявником розроблена нова система подачі, яка дозволяє простагландину діяти з ефективністю, схожою з ефективністю, яка досягається в присутності ВАК. Дійсно, крім своєї ролі консерванту, ВАК і, більш широко, сполука четвертинного амонію, мають так званий ефект "мила", який дозволяє молекулам діючої речовини широко проникати в тканини ока, однак при цьому вони надають токсичний ефект (подразнення, сухість ока, запалення…). Тому система подачі, розроблена в рамках винаходу, дозволяє досягнути еквівалентного проникнення і еквівалентної активності завдяки відмінному механізму дії. Як би там не було, склад не має недоліків, властивих класичним консервантам типу ВАК. Більш конкретно, даний винахід стосується офтальмологічного розчину, який містить: - щонайменше один простагландин; - солюбілізуючий агент; - желатинізуючий агент типу карбомера; - агент, інгібуючий полімеризацію карбомера; - спів-желатинізуючий/спів-солюбілізуючий агент. Як говорилося вище, в такому розчині переважно відсутній консервант антимікробного типу, переважно консервант типу четвертинного амонію, ще більш переважно, бензалконію хлорид (ВАК). Далі в описі під терміном "консервант антимікробного типу або антимікробний консервант" позначають консервант, що має антимікробні властивості, тобто сполуку, здатну гарантувати захист офтальмологічного розчину від можливого мікробного зараження. Такий агент згідно з винаходом потрібно відрізняти від консервантів, що впливають на хімічну консервацію розчину, таких, наприклад, як антиоксиданти, такі як ЕДТА. Заявлений розчин містить як діючу речовину щонайменше один простагландин. На практиці, простагландини знаходяться в розчині в кількості не менше одного і їх вибирають з групи, що включає ізопропіловий ефір 17-феніл-13,14-дигдротринорпростагландину F 2α (латанопрост), 20етилпростагландин F2α, (+)-флупростенолу ізопропіловий ефір (травопрост), 17фенілтринорпростагландин F2α амід, 17-феніл-13,14-дигідротринорпростагландин F2α етиламід (біматопрост), тафлупрост простагландин F2α етаноламід, біматопрост (вільна кислота)-d4, біматопрост-d4, латанопростетиламід, 13,14-дигідро-15-кето-20-етилпростагланідин F2α (унопростон), 13,14-дигідро-15-кето-20-етилпростагланідину F2α ізопропіловий ефір (унопростону ізопропіловий ефір). Переважно, використовують латанопрост. Згідно з іншою характеристикою концентрація простагландину в розчині становить 0,0020,15 % (маса/об'єм). Загальновідомо, що простагландин або простагландини можуть бути скомбіновані з другою діючою речовиною, зокрема, з антиглаукомними агентами інших класів, здатними взаємодіяти з утворенням синергічного ефекту. Можна використовувати, наприклад, бета-блокатори, вибирані з групи, яка містить тимололмалеат і картеололхлорид, інгібітори карбоангідрази, такі, наприклад, як продукти, вибирані з групи, що містить хлорид дорзоламіду, або альфаадренергічні агоністи, такі як, наприклад, тартрат бримонідину. Прикладами комбінацій простагландинів і бета-блокаторів можуть бути, наприклад: Xalacom® - Pfizer: Латанопрост 0,005 % + Тимолол 0,5 %, Ganfort® - Allergan: Біматопрост 0,03 % + Тимолол 0,5 % Duotrav® - Alcon: Травопрост 0,004 % + Тимолол 0,5 %. На практиці, антиглаукомний агент знаходиться в розчині в кількості від 0,1 до 0,5 % (маса/об'єм). Як говорилося вище, такий розчин повинен містити агент, що називається солюбілізуючий, здатний солюбілізувати простагландин або простагландини. Цей солюбілізуючий агент, переважно неіонний, має переважно поверхнево-активні властивості. Переважно, це гліцерилгідроксистеарат макроголу (гідрована і етоксилована рицинова олія або ПЕГ-40 Hydrogenated Castor Oil; номер CAS 61788-85-0). Іншим можливим представником є поліоксил15-гідроксистеарат або макрогол-15-гідроксистеарат (номер CAS 70142-34-6), а також полісорбат-20 (номер CAS 9005-64-5), полісорбат-60 (номер CAS 9005-67-8) або полісорбат-80 2 UA 107718 C2 5 10 15 20 25 30 35 40 (номер CAS 9005-65-6). Концентрація солюбілізуючого агента в розчині звичайно складає від 0,1 до 20 % (маса/об'єм), переважно, від 0,5 до 5 % (маса/об'єм). Іншою важливою характеристикою офтальмологічного розчину є в'язкість. Так, в'язкість переважно складає від 8 до 20 мПа·сек (сп), більш переважно, від 10 до 14 мПа·сек (сп), коли вимірювання в'язкості відбувається за допомогою віскозиметра з обертовим шпинделем марки BROOKFIELD RVDV III при 25 °C. Отже, мова йде про розчин, який відрізняється від водного гелю, що характеризується звичайно величиною в'язкості від 400 до 800 мПа·сек (сп), і являє собою лікарську ретард форму для досягнення пролонгованого вивільнення діючої речовини. Таким чином, даний винахід полягає в розробці адаптованої гелеутворювальної системи, основаної на комбінації двох желатинізуючих агентів і здатній створити систему подачі нев'язкого полімеру: - першого желатинізуючого агента, в цьому випадку карбомера, що полімеризується в звичайних умовах з утворенням гелю, але полімеризація якого, розширення або збереження форми гелю інгібується так званим агентом обриву ланцюга. Вищезазначений агент, інгібуючий полімеризацію карбомера, може служити джерелом іонів натрію, переважно, це ЕДТА натрію, ацетат натрію або хлорид натрію. Як варіант, мова може йти про поліол з низькою молекулярною вагою, такий як гліцерин (див. FR 2604906). Крім того, карбомер знаходиться в розчині в контрольованій концентрації, переважно, в діапазоні 0,05-0,2 % (маса/об'єм). Очевидно, що відносна концентрація інгібуючого агента також є високою: 0,01-1 % (маса/об'єм) у випадку іонів натрію, наприклад, 0,02-0,1 % у випадку ЕДТА натрію, або 0,5-3 % (маса/об'єм) у випадку поліолів, наприклад, гліцерину; - другого агента, що називається спів-желатинізуючий/спів-солюбілізуючий, який призначений для того, щоб досягти заданого рівня в'язкості і потенціювати солюбілізацію діючої речовини простагландину. Звичайно мова йде про полімер типу поліетиленгліколю (ПЕГ) або типу вінілових похідних як полівініловий спирт (ПВС) або полівінілпіролідон (ПВП). Переважно, його концентрація складає від 0,5 до 2,5 % (маса/об'єм). Характеристика карбомера згідно з винаходом дана в Європейській фармакопеї, а саме: "зшитий полімер акрилової кислоти з дуже високою відносною молекулярною масою і великим вмістом карбоксильних груп", під номером Cas 9003-01-4. Існують різні типи карбомерів, що використовуються згідно з винаходом: 910/934/934Р/940/941/971 і 974Р, переважно, 974Р. Характеристика ПЕГ або макроголу згідно з винаходом дана в Європейській фармакопеї, а саме: "суміш полімерів загальної формули Н-(ОСН2-СН2)n-ОН, де n означає середнє число оксіетиленових груп". Тип макроголу характеризується числом, що вказує на середню відносну молекулярну масу. Переважно, це ПЕГ 4000, який має номер CAS 25322-68-3. Зрозуміло, композиція згідно з винаходом може містити звичайні добавки, за винятком антимікробних консервантів. Можна використовувати, наприклад, ізотонічні агенти неіонного типу, такі як поліоли (наприклад, сорбітол). Можна також використовувати антиоксиданти або буферні системи (наприклад, гідроксид натрію як нейтралізуючий агент). Відповідно до конкретного варіанту здійснення композиція згідно з винаходом складається з інгредієнтів, перерахованих в нижчеприведений таблиці, переважно згідно зі вказаним процентним складом: Продукти Карбомер 974 Р Сорбітол ПЕГ 4000 ЕДТА Гідроксид натрію Вода для ін'єкцій Простагландин F2α Макроголу гліцерилгідроксистеарат 40 45 Функція Желатинізуючий агент Ізотонічний агент Спів-желатинізуючий/спів-солюбілізуючий агент Інгібітор желатинізуючого агента Нейтралізуючий агент Носій Діюча речовина Солюбілізуючий агент Процентний склад (г/100 мл) 0,1 3,5 1,0 0,05 до рН=7,0 до 100 мл 0,005 5,0 Композиція згідно з винаходом може знаходитися у флаконах для одноразового використання (однодозовий) або в багатодозових флаконах, наприклад, типу Abac® або Comod® або еквівалентного типу, такі флакони дозволяють здійснювати подачу очних крапель без консервантів протягом декількох днів. 3 UA 107718 C2 5 10 15 20 25 30 35 Таким чином, винахід стосується одноразового (однодозового) або багатодозового (багаторазового) флакона, що містить офтальмологічний розчин, описаний вище, і виконаного з ПЕНГ європейської якості (ЕР), що не містить добавок. Дійсно, текучість розчину в поєднанні зі стабільністю продукту, якщо він упакований в контейнери з ПЕНГ, робить його виготовлення сумісним з технологією BFS. Крім того, розчин згідно з винаходом є стабільним щонайменше протягом 18 місяців, навіть щонайменше протягом 24 місяців при кімнатній температурі (25 °C-30 °C). Винахід стосується також застосування офтальмологічного розчину, описаного вище, для отримання лікарського засобу, призначеного для лікування глаукоми у людини або тварин, зокрема, в зв'язку з його здатністю знижувати внутрішньоочний тиск і/або забезпечувати нейрозахист тканин сітківки. Таким чином, в рамках даного винаходу було доведено, що ця система подачі є менш агресивною для тканин ока, ніж системи солюбілізації згідно з рівнем техніки, оскільки зниження внутрішньоочного тиску відбувається більш рівномірно і лінійно після введення розчину. Практично, очні краплі вводять з розрахунку одна крапля на добу в кожне око. Винахід стосується також терапевтичного способу лікування глаукоми у людини або тварини, що полягає в інстиляції офтальмологічного розчину, описаного вище, з розрахунку одна крапля на добу в кожне око. Було виявлено, що на відміну від розчинів, що пропонуються згідно з рівнем техніки, введення композиції згідно з винаходом супроводжується рівномірним і поступовим зниженням внутрішньоочного тиску (ВОТ), без проміжного збільшення початкового транзиторного ВОТ. При використанні композиції згідно з винаходом зниження ВОТ починається швидше і досягається щонайменше однаковий або навіть поліпшений ефект. Не зв'язуючи себе якою-небудь теорією, цей ефект відносно ВОТ можна було б пояснити наявністю матриці подачі розчину, здатної виключити або щонайменше послабити агресивний характер солюбілізуючого агента. Крім того, композиція згідно з винаходом є надзвичайно толерантною. Винахід і переваги, що витікають з нього, краще усього пояснюють приклади його здійснення з посиланням на прикладені фігури. Фіг. 1 ілюструє ефект від 2 рецептур очних крапель, що містить 0,005 % латанопросту (композиція прикладу 1, помічена суцільним трикутником, і Ксалатан®, поміченим суцільними кружками) на внутрішньоочний тиск (ВОТ) у щурів. Фіг. 2 показує клінічні дані, що стосується переносимості композиції ПРИКЛАДУ 1 проти Ксалатану®: А/ суб'єктивні очні симптоми, пов'язані з інстиляцією розчину; В/ суб'єктивні очні симптоми, не пов'язані з інстиляцією; С/ загальна кон'юктивальна гіперемія. 1. Композиція згідно з винаходом: 1а. Композиція прикладу 1: Продукти Карбомер/желатинізуючий агент Сорбітол/ізотонічний агент ПЕГ/спів-желатинізуючий/спів-солюбілізуючий агент ЕДТА/джерело іонів Na+ Гідрогксид натрію 1н/нейтралізуючий агент Латанопрост/діюча речовина Макроголу гліцерилгідроксистеарат 40/солюбілізуючий агент Вода для ін'єкцій/носія Процентний склад (г/100 мл) 0,10 г 3,50 г 1,00 г 0,05 г до рН=7,0 0,005 г 5,00 г до 100 мл 1b. Композиція прикладу 2 40 Продукти Карбомер/желатинізуючий агент Сорбітол/ізотонічний агент ПВП/спів-желатинізуючий/спів-солюбілізуючий агент Ацетат натрію/джерела іонів Na+ Гідрогксид натрію 1н/нейтралізуючий агент Латанопрост/діюча речовина Макроголу гліцерилгідроксистеарат 40/солюбілізуючий агент Вода для ін'єкцій/носія 1с. Композиція прикладу 3 4 Процентний склад (г/100 мл) 0,10 г 3,50 г 2,00 г 0,8 г до рН=7,0 0,005 г 5,00 г до 100 мл UA 107718 C2 Продукти Карбомер/желатинізуючий агент Сорбітол/ізотонічний агент ПВС/спів-желатинізуючий/спів-солюбілізуючий агент Хлорид натрію/джерела іонів Na+ Гідроксид натрію 1н/нейтралізуючий агент Травопрост/діюча речовина Макрогол-15-гідроксистеарат/солюбілізуючий агент Вода для ін'єкцій/носія 5 10 15 20 25 30 35 40 45 50 Процентний склад (г/100 мл) 0,15 г 2,25 г 0,50 г 0,25 г до рН=7,0 0,004 г 0,50 г до 100 мл 2. Характеристика складу прикладу 1: Отриманий розчин опалесцентний, без видимих частинок, з рН від 6,6 до 7,2 (склад з нейтральним рН) і з осмоляльністю 270-340 мосмолей/кг (склад ізотонічний). В'язкість розчину, виміряна за допомогою віскозиметра Брукфільда з обертовим шпинделем (шпиндель n° 00/камера вимірювання UL) становить 8,0-14,0 мПа·сек при 25 °C. Крім того, розчин показав себе стабільним протягом щонайменше 24 місяців при кімнатній температурі (25 або 30 °C). 3. Ефективність композиції прикладу 1: Оцінка ефективності зниження внутрішньоочного тиску в результаті введення в очі нормотензивним щурам-альбіносам Ефективність очних крапель складу Прикладу 1 на внутрішньоочний тиск оцінювалася на нормотензивному щурі і порівнювалася з очними краплями, що використовуються в клініках, а саме, з продуктом Ксалатан®, причому кожний з продуктів містив латанопрост в концентрації ® 0,005 %. Важливо те, що Ксалатан містить антимікробний агент безалконію хлорид (ВАК), а формула прикладу 1 не містить його. У цьому експерименті було використано 16 щурів-самців альбіносів (Wistar). Щурів розподіляли на 2 групи, кожна з яких включала 8 тварин, що отримували відповідно склад прикладу 1 і референсний продукт Ксалатан®. Всіх тварин лікували на рівні правого ока шляхом введення 4 інстиляцій по 10 мкл кожна, що проводяться кожні 2 хвилини, при загальному вмісті латанопросту 2 мкг. Вимірювання внутрішньоочного тиску (ВОТ) проводили за допомогою пристрою "Tonolab rebound tonometer" на обох очах через 1 годину, 2 години, 4 години, 6 годин і 8 годин після введення препарату. Результати цього випробування показані на фіг. 1. У щура Wistar введена доза Ксалатану® спричиняла двофазну зміну ВОТ, а саме, збільшення початкового тиску (+11,4 %) з піком на рівні 1 години після введення з подальшою тривалою гіпотензивною відповіддю в проміжку від 2 до 8 годин після лікування з піком зниження ВОТ в момент t=4 години (- 18,4 %). Така ж доза (2 мкг) латанопросту в складі прикладу 1 постійно і поступово знижувала ВОТ і досягла в момент t=4 часу зниження на 16 % після топічного введення. Цей ефект продовжувався від 4 до 8 годин з піком максимального зниження ВОТ (-20 %) в момент t=6 годин. На закінчення потрібно зазначити, що: - була початкова гіпертензивна фаза, що спостерігається з Ксалатаном®, але відсутня при використанні складу прикладу 1 у нормотензивного щура; - склад прикладу 1 спричиняв зниження ВОТ, яке відносно близьке по значенню тиску, що спостерігається з референсним продуктом, що використовується в клініках, а саме, з Ксалатаном®; - відсутність ВАК в розчині прикладу 1 не позначалася на ефекті зниження ВОТ. 4. Переносимість композиції прикладу 1 тканинами ока: Переносимість продукту прикладу 1 тканинами ока в порівнянні з переносимістю Ксалатану® досліджувалася протягом 28 днів шляхом проведення двох щоденних інстиляцій (50 мкл) пігментованим кроликам. Дослідження привело до наступних результатів: - На рівні загальної переносимості всі тварини мали нормальне збільшення ваги тіла, хороше здоров'я і не виявили яких-небудь особливих симптомів. Споживання води і корму також протікало нормально. - На рівні переносимості тканинами ока введення продукту прикладу 1 не чинило ефекту на очі, за винятком легкого і тимчасового почервоніння у 1 тварини з 10. Що стосується Ксалатану®, то він не чинив ефекту на очі, за винятком легкого і тимчасового почервоніння у 2 тварин з 10. Незалежно від способу лікування спостерігалося забарвлення рогівки у деяких тварин: 1. Приклад 1: від легкого до помірного у 6 тварин з 10; 2. Ксалатан®: легке у 4 тварин з 10; 5 UA 107718 C2 5 10 15 20 25 30 35 40 45 50 3. Контрольна група: від легкого до помірного у 7 тварин з 10. Такий ефект на очі відстежувався в ході дослідження на переносимість, коли здійснювали щоденні топічне введення, що повторюються в очі протягом послідовних 28 днів. - Ніякого іншого ефекту на очі не було виявлено в ході цього дослідження. - Введення складу прикладу 1 або Ксалатану® не чинило макроскопічної дії на органи. - Гістологічний аналіз тканин 2 очей (оброблений і не оброблений) не показав ніяких ознак патології незалежно від способу лікування. - Як введення Ксалатану®, так і введення складу прикладу 1 не чинило мікроскопічної дії на очі. На закінчення можна сказати, що в результаті двох щоденних інстиляцій по 50 мкл склади прикладу 1 (латанопрост 0,005 %) протягом 28 днів в праве око пігментованих кроликів спостерігався дуже легкий вплив на очі і близький до того, що спостерігалося в контрольній групі, обробленій очними краплями Ксалатан® 0,005 %. Вплив на очі, що спостерігається, розглядався як неспецифічний і обумовлювався головним чином повторенням щоденних інстиляцій протягом 28 послідовних днів. Отже, в цих умовах експерименту введення продукту прикладу 1 було високо толерантним на макроскопічному і мікроскопічному рівні, як і продукту Ксалатан®. 5. Клінічні дослідження композиції прикладу 1: 5-1. Ефективність Вступ Пілотне рандомізоване, просте сліпе, багатоцентрове, перехресне клінічне дослідження II фази, проведене протягом 3 місяців за участю 30 пацієнтів, було здійснено з метою порівняння фармакокінетики, ефективності і безпеки офтальмологічного складу прикладу 1 (латанопрост 0,005 %) з препаратом, що також містить латанопрост в концентрації 0,005 % (Ксалатан®), на пацієнтах, у яких була діагностована первинна відкритокутова глаукома або очна гіпертензія. Мета цього дослідження полягала в порівнянні результатів, отриманих після одноразової інстиляції офтальмологічного препарату, що містить латанопрост (без консерванту), і очних крапель Ксалатан® (з хлоридом бензалконію як консервантом) через 6 тижнів після лікування одним з 2 вибраних препаратів і 6 тижнів після лікування другим вибраним препаратом, у пацієнтів, у яких була діагностована первинна відкритокутова глаукома або очна гіпертензія. Це дослідження проводили відповідно до прийнятих правил якісної клінічної практики (Good Clinical Praсtice або GCP), при необхідності, відповідно до специфічних вимог і Хельсінкської декларації (2004) і з місцевими нормативними вимогами. Протокол Під час першого візиту (Візит 1) пацієнтів відбирали випадковим чином для проведення одного з 2 наступних способів лікування: • Склад на основі латанопросту 0,005 %, що містить консервант (багатодозовий [MD], Ксалатан®), що вводиться один раз на добу в 20 годин в обидва ока протягом 6 тижнів, • Склад на основі латанопросту 0,005 % без консерванту (однодозовий [SDU], приклад 1), що вводиться один раз на добу в 20 годин в обидва ока протягом 6 тижнів. По закінченні згаданих 6 тижнів суб'єктів випробувань змінили і призначили їм інші досліджувані ліки (без періоду промивання), тобто ті пацієнти, які отримували перший склад з консервантом, протягом другого періоду отримували склад без консерванту і навпаки. Тривалість другого періоду дослідження становила також 6 тижнів. Всі пацієнти здійснили 3 візити в дослідницький центр в процесі проведення дослідження: візит для включення пацієнта в дослідження (день 0), подальший візит (день 42) і завершальний візит (день 84). Показник ВОТ оцінювали в кожному оці на день 0, день 42 і день 84 в 8 годин (±30 хв.), 12 годин (±30 хв.), 16 годин (±30 хв.) і 20 годин (±30 хв.). Загальна ефективність також оцінювалася дослідником. Безпека і переносимість препарату оцінювалися одночасно пацієнтами і дослідниками. Результати Результати представлені в наступній таблиці: Середнє значення ВОТ, отримане після лікування Ксалатаном® або продуктом прикладу 1 6 UA 107718 C2 ВОТ середнє 8 год. 12 год. 16 год. 20 год. Середньодобове 5 10 15 20 25 30 35 40 45 50 Базове значення 22,63 23,56 22,55 21,62 22,59 Ксалатан® 16,20 16,43 16,47 16,71 16,45 Після 6 тижнів лікування Приклад 1 Ксалатан® - Приклад 1 16,91 -0,71 16,85 -0,42 16,28 0,19 16,43 0,27 16,65 -0,20 Відмінності між середніми значеннями ВОТ двох продуктів не є статистично значними, незалежно від часу їх вимірювання. Середньодобове значення ВОТ знизилося на 6,14 мм рт. ст. (27,2 %) після 6 тижнів терапевтичного лікування за допомогою Ксалатану® і на 5,94 мм рт. ст. (26,3 %) після 6 тижнів терапевтичного лікування за допомогою продукту прикладу 1. Отже, ефективність зниження ВОТ від двох способів лікування є порівнянною, при цьому досягалося "нормальне" значення ВОТ в результаті двох способів лікування. Враховуючи дані вимірювань в момент фізіологічного піка ВОТ в 8 годин можна відмітити: Ксалатан® надавав ефект зниження ВОТ дещо кращий, приблизно на 0,7 мм рт. ст. Однак ця різниця не має статистичного значення (р=0,118). Крім того, ця тенденція знижується протягом всього дня і інверсується у другій половині дня і увечері, ілюструючи таким чином ефект продукту прикладу 1 протягом цілого дня, що вже спостерігалося під час дослідження зміни зниження ВОТ у нормотензивних щурів-альбіносів. Таким чином, склад прикладу 1 є ефективним відносно ВОТ, починаючи з 8 годин ранку, і залишається таким же ефективним протягом цілого дня, незважаючи на відсутність консерванту. На закінчення можна сказати, що середньодобові значення ВОТ після 6 тижнів лікування 2 способами статистично не розрізнюються, при цьому відмічається ефективність з боку продукту прикладу 1, що не містить консерванту, що характеризується підтримуванням значення ВОТ, який називається "нормальним", протягом всього дня. 5-2. Переносимість Вступ Метою фази III клінічних досліджень, крім оцінки ефективності препарату відносно зниження внутрішньоочного тиску, є оцінка переносимості і безпеки очних крапель згідно з Прикладом 1 (латанопрост 0,005 % однодозові очні краплі без консерванту) в порівнянні з Ксалатаном® (латанопрост 0,005 % багатодозові очні краплі, що містять консерванти) на пацієнтах, які страждають на очну гіпертонію або глаукому, що отримували лікування шляхом щоденної інстиляції очних крапель протягом 3 місяців. Протокол Міжнародне багатоцентрове, рандомізоване, просте сліпе дослідження з участю 2 паралельних груп було проведене відносно референсного продукту на 360 обстежених пацієнтах, які отримували лікування протягом 3 місяців. Були запрограмовані: відбірний візит (J42 для дня 42), візит для включення пацієнта в дослідження (J0) і 3 подальші візити J15, J42 і J84. Усього було відібрано 463 пацієнти, 404 пацієнти були включені в дослідження і рандомізовані і 402 пацієнтам було призначено цільове лікування: 213 пацієнтів знаходилися в групі прикладу 1 і 189 пацієнтів в групі Ксалатану. У результаті закінчили дослідження 392 пацієнта: 206 в групі прикладу 1 і 189 в групі Ксалатану. Популяція пацієнтів, відібрана для оцінки переносимості і безпеки очних крапель, складалася з 213 пацієнтів в групі прикладу 1 і 189 пацієнтів в групі Ксалатану. Вибірка mITTT (для "модифікованого аналізу з наміром застосувати втручання" "modified intent-to-treat") складалася з 353 пацієнтів: 189 в групі прикладу 1 і 164 в групі Ксалатану. Вибірка РР (для аналізу "Per Protocol") складалася з 177 пацієнтів в групі прикладу 1 і 153 в групі Ксалатану. Популяція, відібрана для оцінки переносимості і безпеки очних крапель, не розрізнювалася значно за демографічними або іншими вихідними характеристиками, за винятком небагато вищого процентного вмісту пацієнтів жіночої статі в групі прикладу 1 (53,5 %) в порівнянні з групою Ксалатану (45,5 %). Вік варіював в діапазоні від 24 до 93 років при середньому значенні ± стандартне відхилення (СВ) 64,7±11,5 років. Популяція, відібрана для оцінки переносимості і безпеки очних крапель, мала товщину рогівки, що варіює від 500 до 610 мкм при середньому значенні ± СВ, що становить 542±22 мкм в групі прикладу 1 і 543±22 мкм в групі Ксалатану. 7 UA 107718 C2 5 10 15 20 25 30 35 40 Середня тривалість лікування (в середньому 83 дні) була порівнянна для 2 груп лікування. Суворе проходження схемі лікування, основаного на інстиляціях, дотримувалося більше, ніж на 98 % в кожній групі, що лікується. Результати Небажані явища з боку очей Небажані явища з боку очей (НЯ) виявлені у 18 (8,5 %) пацієнтів в групі прикладу 1 проти 22 (11,6 %) в групі Ксалатану. Найчастішим явищем незалежно від групи була непереносимість лікарського засобу, яка відмічалася у 1 (0,5 %) пацієнта в групі прикладу 1 проти 4 (2,1 %) пацієнтів в групі Ксалатану. Був відмічений сильний дискомфорт в очах пацієнтів групи прикладу 1 і інші явища помірної або слабкої інтенсивності. Небажані явища з боку очей, пов'язані з лікарськими засобами, що вивчаються, виявлені у 8 (3,8 %) пацієнтів в групі прикладу 1 (включаючи 1 пацієнти з 1 помірною фотофобією і 1 пацієнти з 1 легким крововиливом в зоровий нерв, взаємозв'язок з яким не був доведений) проти 10 (5,3 %) пацієнтів в групі Ксалатану. Прийом лікарського засобу був припинений в зв'язку з НЯ з боку очей, відміченими у 2 пацієнтів групи прикладу 1 (помірна лікарська непереносимість на день J7 і 1 помірний свербіж в очах на день J28) і у 1 пацієнта в групі Ксалатану (1 помірний алергічний кон'юктивіт на день J9). Всі випадки НЯ з боку очей, які були причиною припинення прийому лікарського засобу, були пов'язані з препаратом, що вивчається дослідником. Всі пацієнти видужали, як тільки було припинене його застосування. Жодного серйозного випадку НЯ не було відмічено в цьому випробуванні. Систематичні небажані явища Систематичні НЯ були визначені у 28 (13,1 %) пацієнтів в групі прикладу 1 проти 32 (16,9 %) в групі Ксалатану. Жодне систематичне НЯ не було пов'язано з лікарським засобом, що вивчається в групі прикладу 1, але 6 випадків НЯ були виявлені у 4 (2,1 %) пацієнтів в групі Ксалатану, які розглядалися дослідником як пов'язані з лікуванням (2 головні болі у одного і того ж пацієнта, 1 запаморочення, 1 мігрень і 1 серцебиття і 1 м'язова слабкість). Всі симптоми були слабкій інтенсивності. Сильна депресія в групі прикладу 1 і 1 помірна мігрень в групі Ксалатану привели до припинення прийому лікарського засобу, що тестується. 6 пацієнтів мали серйозне НЯ (СНЯ): 5 пацієнтів в групі прикладу 1 (1 перелом великогомілкової кістки, 1 сильна депресія, 1 непритомність, 1 біль в грудях і 1 перелом малогомілкової кістки) і 1 пацієнт в групі Ксалатану (1 ниркові кольки). Згідно з висновком дослідника жодне з них не мало відношення до лікування. Суб'єктивні симптоми в результаті інстиляції Загалом суб'єктивні очні симптоми, пов'язані з інстиляцією (свербіж, печіння/поколювання, відчуття злиплих очей, відчуття сухості очей, відчуття чужорідного тіла) були значно менш частими в групі прикладу 1, ніж в групі Ксалатану на день J42 (р=0,001) і на день J84 (р=0,001) (див. нижче представлену таблицю). Це стосується насамперед симптому печіння/поколювання: 5,2 % проти 14,0 % на день J15 (р=0,004), 6,8 % проти 15,1 % на день J42 (р=0,006) і 7,3 % проти 19,9 % на день J84 (р
ДивитисяДодаткова інформація
Назва патенту англійськоюPolymeric system for delivering a preservative-free prostaglandin-based nonviscous solution
Автори англійськоюMercier, Fabrice
Автори російськоюМерсье Фабрис
МПК / Мітки
МПК: A61P 27/06, A61K 47/14, A61K 49/00, A61K 31/5575, A61K 9/08
Мітки: основі, простагландину, нев'язкого, консерванта, подачі, розчину, містить, полімерного, система
Код посилання
<a href="https://ua.patents.su/14-107718-sistema-podachi-nevyazkogo-polimernogo-rozchinu-na-osnovi-prostaglandinu-yakijj-ne-mistit-konservanta.html" target="_blank" rel="follow" title="База патентів України">Система подачі нев’язкого полімерного розчину на основі простагландину, який не містить консерванта</a>
Попередній патент: Комбінований біоокислювач
Наступний патент: Спосіб балансування гнучкого двоопорного ротора пасивними автобалансирами
Випадковий патент: Спосіб окислювального лужного рафінування чорнового свинцево-сурм'янистого сплаву