Спосіб одержання модифікованого на n-кінці хемотаксину
Номер патенту: 83661
Опубліковано: 11.08.2008
Автори: Зайдлер Рандольф, Дудс Генрі, Вандль Роберт, Несіна Роман, Лентер Мартін
Формула / Реферат
1. Спосіб одержання білка pyroGlu-MCP-1 з отриманого рекомбінантним шляхом білка Gln-MCP-1, який полягає в тому, що білок Gln-MCP-1 інкубують при температурі в інтервалі від 30 до 80 °С у буферному розчині з концентрацією в ньому солі в інтервалі від 10 до 160 мМ і зі значенням рН у межах від 2 до 7,5 доти, поки принаймні 90 % білка МСР-1 не будуть представлені у формі білка pyroGlu-MCP-1.
2. Спосіб за п. 1, у якому буферний розчин являє собою фосфатний буфер з концентрацією в інтервалі від 20 до 50 мМ і зі значенням рН у межах від 3,5 до 6,5.
3. Спосіб за п. 1 або 2, у якому буферний розчин додатково містить детергент, антиоксидант, консервант, стабілізатор, антимікробний агент та/або комплексоутворювач.
4. Спосіб одержання препарату білка pyroGlu-MCP-1, який полягає у виконанні принаймні наступних стадій:
- одержання препарату білка Gln-MCP-1 за рахунок експресії генної конструкції, яка кодує білок МСР-1, у клітині-хазяїні,
- необов'язкове концентрування та/або очищення білка Gln-MCP-1, який міститься в його препараті,
- конверсія білка Gln-MCP-1, який міститься в його препараті, у препарат білка pyroGlu-MCP-1 способом за будь-яким з пп. 1-3 й
- необов'язково перезабуферування та/або додаткове очищення препарату білка pyroGlu-MCP-1,
при цьому на частку білка pyroGlu-MCP-1 у перерахунку на весь вміст білка МСР-1 в отриманому препараті білка pyroGlu-MCP-1 припадає принаймні 90 %.
Текст
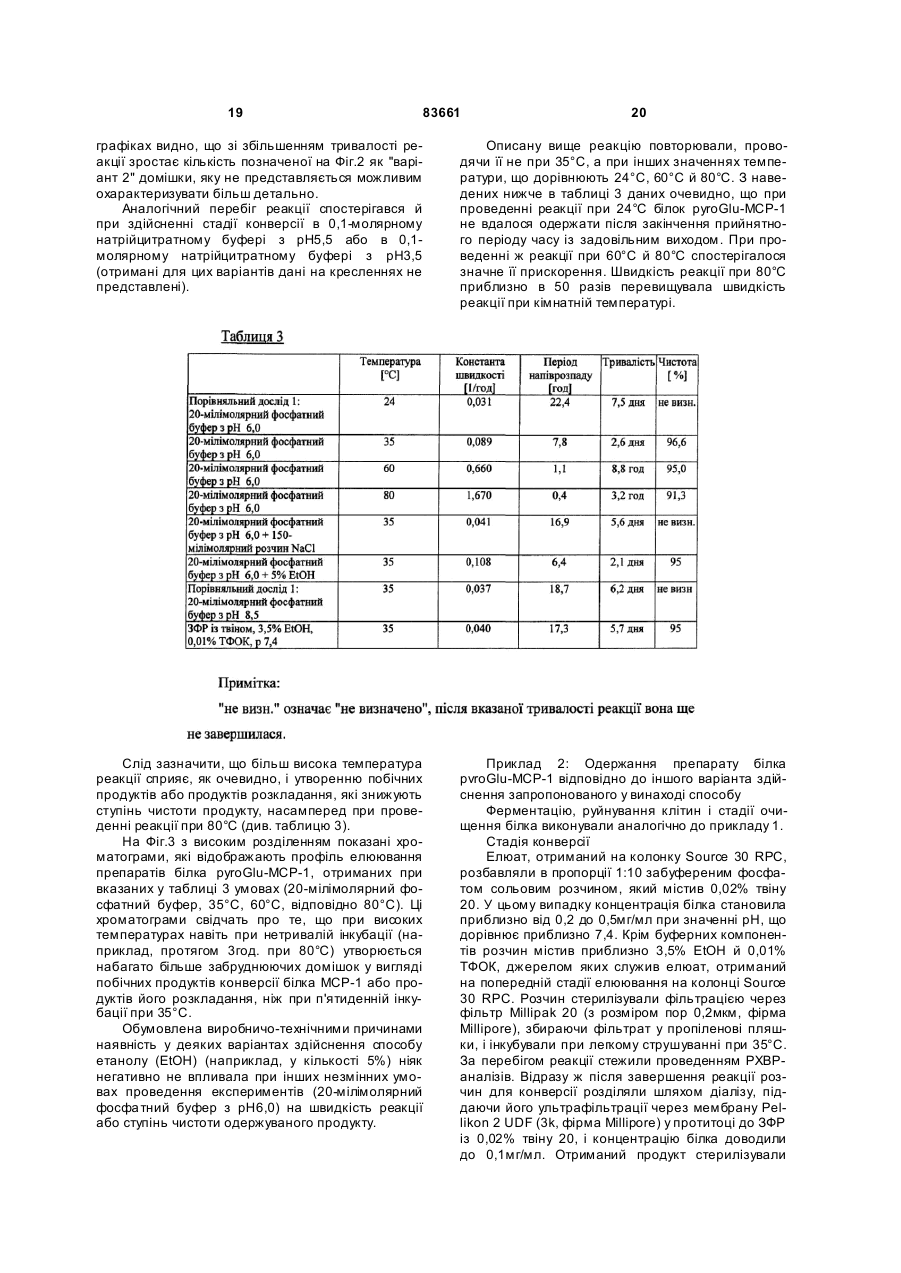
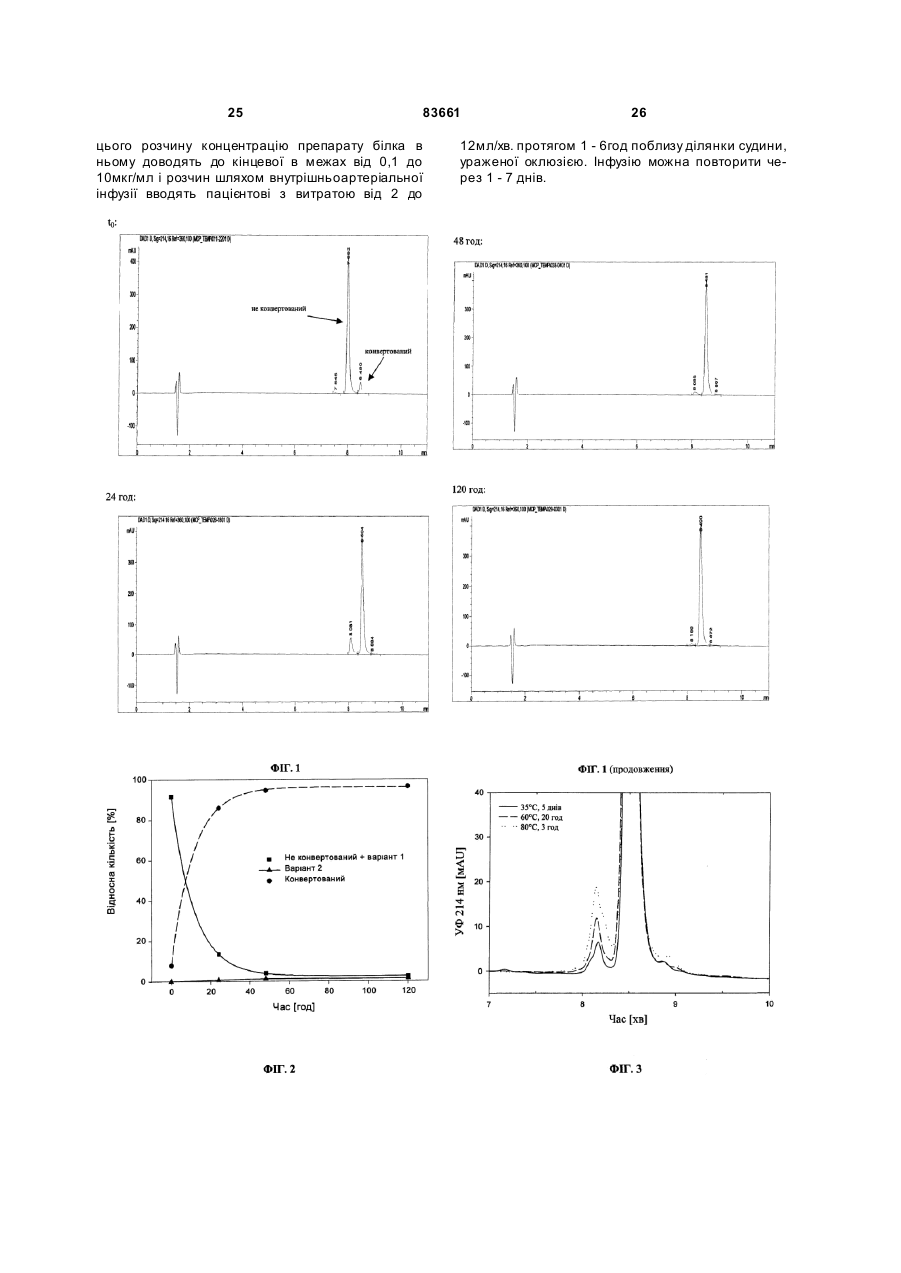
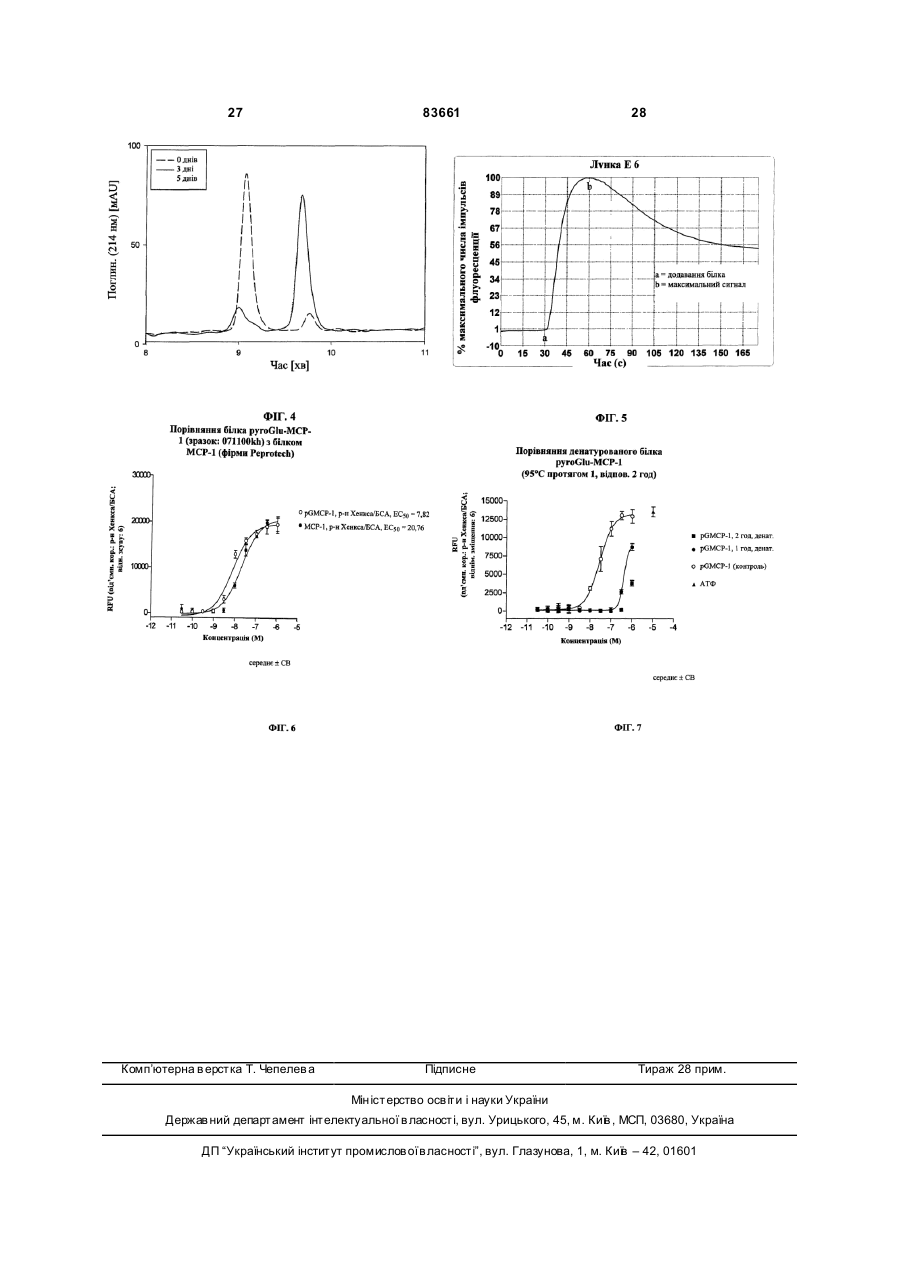
1. Спосіб одержання білка pyroGlu-MCP-1 з отриманого рекомбінантним шляхом білка GlnMCP-1, який полягає в тому, що білок Gln-MCP-1 інкубують при температурі в інтервалі від 30 до 80 °С у буферному розчині з концентрацією в ньому солі в інтервалі від 10 до 160 мМ і зі значенням рН у межах від 2 до 7,5 доти, поки принаймні 90 % білка МСР-1 не будуть представлені у формі білка pyroGlu-MCP-1. 2. Спосіб за п. 1, у якому буферний розчин являє собою фосфатний буфер з концентрацією в інтервалі від 20 до 50 мМ і зі значенням рН у межах від 3,5 до 6,5. 3. Спосіб за п. 1 або 2, у якому буферний розчин додатково містить детергент, антиоксидант, консервант, стабілізатор, антимікробний агент та/або комплексоутворювач. 4. Спосіб одержання препарату білка pyroGluMCP-1, який полягає у виконанні принаймні наступних стадій: - одержання препарату білка Gln-MCP-1 за рахунок експресії генної конструкції, яка кодує білок МСР-1, у клітині-хазяїні, - необов'язкове концентрування та/або очищення білка Gln-MCP-1, який міститься в його препараті, - конверсія білка Gln-MCP-1, який міститься в його препараті, у препарат білка pyroGlu-MCP-1 способом за будь-яким з пп. 1-3 й - необов'язково перезабуферування та/або додаткове очищення препарату білка pyroGlu-MCP-1, при цьому на частку білка pyroGlu-MCP-1 у перерахунку на весь вміст білка МСР-1 в отриманому препараті білка pyroGlu-MCP-1 припадає принаймні 90 %. UA (21) a200511327 (22) 13.04.2004 (24) 11.08.2008 (86) PCT/EP2004/003856, 13.04.2004 (31) 03010014.3 (32) 02.05.2003 (33) EP (46) 11.08.2008, Бюл.№ 15, 2008 р. (72) ВАНДЛЬ РОБЕРТ, НЕСІНА РОМАН, ЗАЙДЛЕР РАНДОЛЬФ, DE/US, ЛЕНТЕР МАРТІН, ДУДС ГЕНРІ (73) БЬОРІНГЕР ІНГЕЛЬХАЙМ ІНТЕРНАЦІОН АЛЬ ГМБХ (56) VOSKUIL M ET AL.: "Modulation of collateral artery growth in a porcine hindlimb ligation model using MCP-1" AMERICAN JOURNAL OF PHYSIOLOGY, Bd. 284, Nr. 2(2), April 2003 (200304), Seiten H1422-H1428 VAN COILLIE E ET AL.: "Functional Comparision of Two Human Monocyte Chemotactic Protein-2 Isoforms, Role of the Amino-Terminal Pyroglutamic Acid and Processing by CD26/Dipeptidyl Peptidase IV" BIOCHEMISTR Y, Bd. 37, 1998, Seiten 1267212680 BLASZCZYK J ET AL.: "Complete Crystal Structure of Monocyte Chemotactic Protein-2, a CC Chemokine that Interacts with Multiple Receptors" BIOCHEMISTRY, Bd. 39, 2000, Seiten 14075-14081 SHII K ET AL.: "Full active baculovirus-expressed human monocyte chemoattractant protein 1 with the intact N-terminus" BIOCHEMICAL AND BIOPHYSICAL RESEARCH COMMUNICATIONS, Bd. 206, Nr. 3, 1995, Seiten 955-961 US 5714578, 03.02.1998 US 6090795, 18.07.2000 C2 2 (19) 1 3 "monocyte chemotactic and activating factor"), фактор хемотаксису макрофагів "MCF" (від англ. "macrophage chemotactic factor"), ген-8 "TSG-8", "HC-H", який стимулюється фактором некрозу пухлини (від англ. "tumor necrosis factor stimulated gene-8"), хемотаксичний фактор клітин гладеньких м'язів "SMC-CF" (від англ. "smooth muscle cell chemotactic factor"), лімфоцитарний хемотаксичний фактор "LDCF" (від англ. "lymphocyte derived chemotactic factor"), а також гліомний хемотаксичний фактор "GDCF" (від англ. "glioma derived chemotactic factor")] є представником сімейства хемокінів CC. Білок MCP-1 людини спочатку був описаний у [патенті US 5714578]. Цей білок синтезується в природних умовах в організмі (нативно) у вигляді білка-попередника довжиною 99 амінокислот, який потім у результаті його процесингу перетворюється в пептид з 76 амінокислотними залишками. Зрілий людський білок MCP-1 (hMCP-1) являє собою глікопротеїд, молекулярна маса якого дорівнює 14кДа і який секретирується клітинами 83661 4 різних типів, наприклад, клітинами гладеньких м'язів судин й ендотеліальними клітинами [Leonard й Yoshimura, Immology Today, 11, 1990, стор.97-101]. Цей глікопротеїд містить два внутрішньомолекулярні дисульфидні містки й при нативній експресії О-глікозильований і сіалільований [J. Yan Ling й ін., Journal of Biological Chemistry, 265, 1990, стор.18318-18321]. Вказаний білок являє собою продукт гена JE із хромосомною локалізацією 17q11.2-q21.1. Цей генний локус відомий також за назвою SCY А2 (від англ. "small inducible cytokine А2", малий індуцибельний цитокін А2). Людський ген вперше був описаний у [патенті US 5212073]. Експресія цього гена може індукуватися різноманітними цитокінами, наприклад, фактором-альфа некрозу пухлини, але також, наприклад, імуноглобуліном G. Послідовність цього гена, а також інша інформація про нього і його продукт доступні в банку даних NCBI за номером М37719 (див. таблицю 1). 5 У згаданому вище [патенті US 5714578] уже йшлося про те, що у випадку виділеного із природного джерела білка MCP-1 його N-кінець блоко 83661 6 ваний. Лише пізніше було встановлено, що це зумовлено посттрансляційною модифікацією, при якій "оголений" після відщеплення лідерної послі 7 83661 довності на N-кінці зрілого протеїну глутамін циклізується до піроглутаматного залишку з видаленням однієї молекули NH3. Ідентифікація відкритих рамок зчитування, які кодують білок MCP-1, в [патенті US 5212073] забезпечила можливість рекомбінантної експресії цього білка. Білок MCP-1, отриманий рекомбінантним шляхом, наприклад, в E. соli, не має типової для нативного білка MCP-1 моделі N-, відповідно О-глікозилування. Отриманий таким шляхом білок MCP-1 не здатний на відміну від виділеного із природного матеріалу білка протистояти розщепленню за Едманом, тобто містить неблоковані N-кінці (глутаміни). За результатами експериментів на клітинах, заснованих на хемотаксичному впливі на макрофаги, спочатку не вдалося виявити відмінностей у біологічній активності нативних й отриманих рекомбінантним шляхом білків MCP-1. В фізіологічних умовах білок MCP-1 проявляє дію агоніста бета-хемокінових рецепторів CCR2 й CCR4, обидва типи яких експресуються переважно на поверхні моноцитів й обидва типи яких були виявлені, крім того, на поверхні базофілів, а також T- і В-лімфоцитів. Білок MCP-1 індукує хемотаксис моноцитів уже в субнаномолярних концентраціях. Рецептори CCR2 й CCR4 являють собою спряжені з G-білком рецептори із сімома трансмембранними доменами, які активують моноцити й посилюють адгезію інтегринів. Цей процес приводить в остаточному підсумку до "причалювання" моноцитів до ендотеліальних клітин і наступного виходу моноцитів із судинної системи. У [заявці WO 98/44953] йдеться про вплив білка MCP-1 на артеріогенез, тобто на ріст колатеральних та/або інших артерій виходячи із уже існуючих артеріолярних сполук. З урахуванням цього факту в вказаній заявці було запропоновано використовувати білок MCP-1 у терапевтичних цілях, а саме: для лікування оклюзійних захворювань судин, які можна полегшити, ініціювавши новоутворення судин. До подібних окюзійних захворювань судин належать насамперед ішемічна хвороба серця (IXC), оклюзійні захворювання периферичних артерій (ОЗПА), оклюзійні захворювання церебральної й брижової артерій і т.д. Щоб уникнути ж новоутворення судин з метою боротьби таким шляхом насамперед з ростом пухлин, обумовленим достатнім кровопостачанням пухлинної тканини й тим самим її інтенсивною васкуляризацією, у цій же заявці було запропоновано також застосовувати агенти, які нейтралізують білок MCP-1, такі, наприклад, як антитіла до білка MCP-1. 8 Для можливості застосування білка MCP-1 в описаних вище терапевтичних цілях для стимуляції васкуляризації тканин необхідні достатні кількості цього білка з досить високим для його використання у фармацевтиці ступенем чистоти. Спочатку людський MCP-1 виділяли в нативній формі з культур людських гліомних клітин лінії U105MG або з людських одноядерних лейкоцитів периферичної крові. Однак виділенню призначеного для застосування в терапевтичних цілях білка із цих джерел перешкоджає вже той факт, що одержання білка таким шляхом у досить великих кількостях у будь-якому разі можливо було б лише при неприйнятно високих витратах та/або неприйнятно високій витраті вихідного матеріалу через неможливість одержання людських лейкоцитів у необхідних кількостях. Гліомні клітини незважаючи на можливість їх практично необмеженого розмноження не придатні для культивування в біотехнологічних ферментерах і крім цього потребують для їх культивування застосування, наприклад, фетальної телячої сироватки з усіма проблемами, які виникають внаслідок цього. Тому замість природної (нативної) експресії білка MCP-1 більш доцільним представляється його одержання рекомбінантним шляхом. Фактично отриманий рекомбінантним шляхом людський MCP-1 уже є на ринку, зокрема постачається фірмами R&D Systems [каталожний №279-МС] і Peprotech [каталожний №300-04, див. таблицю 2, наведені в якій каталожні номери вказані за станом на січень 2003р.]. Відповідно до опису продукту білок MCP-1, який міститься в його комерційно доступних отриманих рекомбінантним шляхом препаратах, містить амінокислоту глутамін (Q) на N-кінці. Крім цього в описі продукту вказується на те, що такий препарат білка має винятково високу чутливість насамперед у відновленому, рідкому стані (рекомендований час при 4°С становить максимум 1 тиждень). Фактично ж за результатами проведених авторами даного винаходу експериментів (внутрішній рівень техніки) було встановлено, що при зберіганні традиційних препаратів білка MCP-1 у розчиненому вигляді насамперед при температурах ви ще 4°С біологічно активний препарат білка починає дуже швидко проявляти ознаки його забруднення продуктами розкладу (про що можна судити за появою побічних смуг на хроматограмах, отриманих за допомогою аналітичної PXBP). 9 83661 Звичайний спосіб рекомбінантного одержання людського білка MCP-1 полягає в термоіндукованій експресії білка у вигляді злитого білка, очищенню внутрішньоклітинних тілець, які утворилися в результаті (включень), переведенні білка в розчин і його ренатурації з наступним ферментативним вивільненням білка hMCP-1 зі злитого протеїну. При рекомбінантному одержанні людського білка MCP-1 традиційним способом виникає проблема частого одержання як побічного продукт білка, який на N-кінці вкорочений на одну або більше амінокислот. Подібні побічні продукти можуть проявляти в біологічних системах дію антагоністів рецепторів білка MCP-1. В [Van Coillie й ін. в Biochemistry, 37, 1998, стор.12672, 12673 (наприкінці)], в описі експериментів з дослідження впливу N-кінцевих модифікацій на біологічну активність білка МСР-2 згадується спосіб, відповідно до якого отриманий рекомбінантним шляхом препарат білка МСР-2 протягом 24 год інкубують при 37°C в 0,01молярному Na2HPO4 з рН8,0. Білок МСР-2 має на рівні амінокислотної послідовності 62%-ну ступінь гомології з білком MCP-1 і відрізняється від нього також тим, що не модифікований на N-кінці білок MCP-1 є на відміну від білка МСР-2 біологічно активним (див. рядок "Biological Activity" у таблиці 2). Ступінь конверсії N-кінцевого глутамінового залишку в піроглутаматний залишок, що відбувається при вказаних вище умовах, авторами вказаної публікації не визначалася. Використання порівнянних умов щодо білка MCP-1 у кожному разі приводить відповідно до накопиченого авторами даного винаходу досвіду (вн утрішній рівень техні 10 ки) лише до часткової циклізації N-кінцевої амінокислоти (див. таблицю 3, порівняльний дослід 2). Враховуючи наведені вище пояснення, одна з покладених в основу винаходу задач полягала в розробці способу, що дозволяв би одержувати препарат білка MCP-1 (композицію, яка містить білок MCP-1), який (а) у відношенні своєї біологічної активності був би придатний для застосування в терапевтичних цілях й (б) мав би переваги з погляду законодавчих процедур допущення лікарських засобів до застосування, які у випадку біофармацевтичних препаратів пред'являють особливо високі й винятково складні в дотриманні вимоги, наприклад, до ступеня чистоти лікарського засобу й відтворюваності параметрів процесу його приготування, і який насамперед (в) мав би високу стабільність при зберіганні. Пов'язана із цим ще одна задача винаходу полягала в розробці композицій, відповідно препаратів, які містять отриманий рекомбінантним шляхом білок MCP-1 і придатних для застосування в вказані вище цілях, відповідно які мають вказані вище переваги. Ці задачі вирішуються за допомогою представлених у винаході способів й композицій, які містять білок MCP-1. Так, зокрема, у винаході пропонується спосіб одержання білка pyroGlu-MCP-1 з отриманого рекомбінантним шляхом білка GIn-MCP-1, який полягає в тому, що білок GIn-MCP-1 інкубують при температурі в інтервалі від 30 до 80°C, переважно від 30 до 70°C, більш переважно від 35 до 60°C, у буферному розчині, концентрація солі в якому становить від 10 до 160мМ, переважно від 10 до 100мМ, і значення рН якого знаходиться в інтервалі від 2 до 7,5, переважно від 3,5 до 7,5, більш переважно від 3,5 до 6,5, переважніше від 5 до 6,5, 11 83661 ще більш переважно від 5,5 до 6,5, найбільш переважно становить близько 6. Інкубацію при цьому проводять доти, поки принаймні 90%, переважно принаймні 95%, більш переважно принаймні 96%, від усієї кількості білка MCP-1, що міститься в буферному розчині для інкубації, не будуть представлені у вигляді білка pyroGlu-MCP-1. Під "білком MCP-1" згідно із даним описом мається на увазі білок MCP-1 (без передпослідовності), який залежно від контексту має на N-кінці глутаміновий залишок (білок "GIn-MCP-1", див. представлену в таблицях 1 й 2 амінокислотну послідовність) або вже підданий конверсії/циклізації до піроглутаматного залишку N-кінець (білок "pyroGlu-MCP-1"). Очевидно, однак, що модифікації білка MCP-1, які не впливають на його біологічну функцію (насамперед на притягаючу моноцити дію або дію на рецептор CCR) і які не викликають такої зміни його структури, при якому описані вище реакційні параметри не приводять більше до одержання необхідного результату (тобто білок стає неможливо перевести запропонованим у винаході способом у його варіант із залишком pyroGlu на Nкінці), не виходять за обсяг винаходу. Так, зокрема, запропонований у винаході спосіб застосовний і щодо білка MCP-1, у якого відбулася консервативна заміна амінокислот, наприклад, серину на треонін або лейцину на ізолейцин, за умови, що така заміна не впливає ні на біологічну функцію або активність одержуваного в результаті білка, ні на здатність конверсії N-кінцевого глутаміну в піроглутамат описаним вище способом. Запропонований у винаході спосіб застосовний також відносно білків MCP-1 інших ссавців, наприклад, щура, миші, морської свинки, кролика й тхора-альбіноса (а також деяких інших). Як буферний розчин, у якому проводиться описаний вище спосіб, переважно використовувати забуферений фосфатом (фосфатом натрію та/або калію) водний розчин низької або фізіологічної молярності, а саме: в інтервалі від 10 до 160мМ, від 10 до 80мМ, від 10 до 50мМ, від 20 до 40мМ або близько 20мМ або 40мМ. При збільшенні тривалості інкубації її відповідно до особливого варіанта здійснення винаходу можна також проводити при фізіологічних значеннях молярності, наприклад, при концентрації солі близько 150мМ, при цьому подібну молярність переважно забезпечувати за рахунок застосування забуференого фосфа том сольового розчину або "ЗФР". Недолік збільшення тривалості інкубації, а тим самим і небезпека зростання частки продуктів розкладання, побічних продуктів або продуктів окислення компенсується в цьому особливому варіанті здійснення винаходу перевагою, зв'язаною з можливістю одержання препарату білка відразу у вигляді розчину з фізіологічною концентрацією солі. Буферний розчин, у якому проводиться стадія модифікації білка, може також містити, наприклад, (м'який) детергент, антиоксидант, консервант, комплексоутворювач, стабілізатори, антимікробні агенти й т.д. Температуру інкубації вибирають в інтервалі від 30 до 80°C, тобто вище кімнатної температури. При більш низьких температурах стадія конверсії 12 відбувається порівняно повільно. У цьому випадку для досягнення все ж таки практично повної конверсії потрібно було б істотно збільшити тривалість інкубації до більше одного тижня. Подібне збільшення тривалості інкубації привело б до неприйнятного в біотехнологічному процесі часу очікування до завершення реакції й крім цього значно підвищило б ризик забруднення розчину білка іншими домішками (продуктами розкладання або окислення, бактеріями, вірусами й іншими мікроорганізмами). Проведення ж інкубації при температурах, що перевищують 80°C, хоча й дозволило б істотно прискорити перебігу реакції конверсії, привело б, однак, і до більш інтенсивного утворення небажаних побічних продуктів і продуктів розкладання (порівн. приклади 1 й 2). Якщо час очікування до завершення реакції, що становить до 6 днів, розглядається як прийнятний, то в цьому випадку інкубацію найбільш переважно проводити при температурі в інтервалі від 35 до 40°C. В інших же випадках, коли тривалість інкубації потрібно істотно скоротити до мінімально можливої, інкубацію можна проводити також в інтервалі температур, наприклад, від 50 до 60, 70 або 80°C. Очевидно, що й інкубація при температурі в інтервалі від 40 до 50°C приводить до одержання необхідного результату. Значення рН буферного розчину для інкубації повинно знаходитися в інтервалі від 2 й 7,5, тобто в інтервалі від нейтрального до кислого. У переважному варіанті значення рН буферного розчину для інкубації повинно становити від 3,5 до 7,5, більш переважно від 3,5 до 6,5, переважніше від 5 до 6,5, ще більш переважно від 5,5 до 6,5, найбільш переважно близько 6. При відповідному, більш докладно описаному, наприклад, у прикладах виборі вказаних вище параметрів білок pyroGlu-MCP-1 можна одержувати зі ступенем чистоти, який у будь-якому випадку становить 90%, однак може бути й вище, наприклад, може становити 95%, 96% або 98%, при цьому таке виражене у відсотках число відповідає кількості білка pyroGlu-MCP-1 (визначеній, наприклад, у вигляді площі під елюційною кривою, отриманою при PXBP) у перерахунку на всю присутню в розчині кількість білка MCP-1 (тобто включаючи кількість білка GIn-MCP-1, що все ще залишається за певних умов, і кількість можливих продуктів окислення й інших побічних продуктів або продуктів розкладання). Відповідно до іншого варіанта здійснення винаходу в ньому пропонується спосіб одержання препарату білка pyroGlu-MCP-1, який полягає у виконанні принаймні наступних стадій: - одержання рекомбінантним шляхом препарату білка GIn-MCP-1 за рахунок експресії генної конструкції, яка кодує білок MCP-1, у клітиніхазяїні, - необов'язкове концентрування та/або очищення білка GIn-MCP-1, який міститься в його препараті, і на завершення - конверсія білка GIn-MCP-1, який міститься в його препараті, відповідно який містився в ньому перед концентруванням та/або очищенням, у препарат білка pyroGlu-MCP-1, який містить його біо 13 83661 молекулярні частинки, причому цю стадію проводять відповідно до описаного вище "способу одержання білка pyroGlu-MCP-1 з отриманого рекомбінантним шляхом білка GIn-MCP-1". Запропонований у цьому варіанті здійснення винаходу спосіб необов'язково може, крім того, включати також стадію, наприклад, перезабуферування препарату білка pyroGlu-MCP-1 або стадію подальшого його очищення, наприклад, шляхом наступної колонкової хроматографії, діалізу, ультрафільтрації й т.д. Методи біотехнологічного одержання рекомбінантних білків відомі. Всі ці методи складаються насамперед зі стадій ферментації, очищення, концентрування й інших стадій. Розглянуту вище стадію конверсії можна проводити в рамках подібного "багатостадійного методу" перед різними його стадіями, тобто, наприклад, використовувати як вихідний розчин ще практично неочищений або ж вже повністю очищений розчин білка MCP-1. Так, зокрема, в одному з можливих технологічних циклів ще не (повністю) конвертований білок GIn-MCP-1 з метою поліпшення його стійкості при зберіганні можна в більш, менш або практично повністю очищеній формі ліофілізувати у ще неконвертованому вигляді й знову переводити в розчин у необхідний момент часу, а потім переводити описаним вище способом у білок pyroGlu-MCP-1. Очевидно, що ліофілізації можна піддавати й розчин, отриманий після завершення конверсії вихідного білка в білок pyroGlu-MCP-1. Вміст білка pyroGlu-MCP-1 в одержуваному запропонованим у винаході способом продукті, тобто препараті підданого N-кінцевій модифікації (конверсії) білка pyroGlu-MCP-1, становить відповідно до винаходу в перерахунку на загальний вміст білка MCP-1 (що складається з кількості конвертованого й неконвертованого білка й кількості утворених, наприклад, у результаті окислення, побічних продуктів) принаймні 90%, переважно принаймні 95%, більш переважно принаймні 96%. Термін "препарат" (білка GIn-, відповідно pyroGlu-MCP-1) означає, що на різних стадіях технологічного процесу білок MCP-1 присутній у розчиненому вигляді в (буферному) розчині й що тим самим у ньому разом з білком MCP-1 можуть бути присутніми й іншими компонентами, до яких у будь-якому випадку належать іони використовуваної буферної солі, а також у деяких випадках інші солі, антиоксиданти, стабілізатори, антимікробні агенти, детергенти, консерванти, комплексоутворювачі й т.д. Ще одним об'єктом винаходу є запропонована в ньому композиція, яка містить білок pyroGluMCP-1 або препарат білка pyroGlu-MCP-1, отриманий описаним вище способом, і в якій принаймні 90% від усієї кількості білка MCP-1, який міститься в ній (що складається з кількості конвертованого й неконвертованого білка й кількості побічних продуктів, тобто визначеного за "площею під кривою", наприклад, на проявній хроматограмі, отриманій за допомогою PXBP) припадає на білок pyroGluMCP-1. Відповідно до цього ще одним об'єктом винаходу є отриманий рекомбінантним шляхом насам 14 перед у прокаріотах, найбільш переважно в E. соli, препарат білка MCP-1, у якому (препараті) принаймні 90% білка MCP-1 представлено у вигляді білка pyroGlu-MCP-1. При одержанні в загальновживаних експресійних клітинах білок на відміну від його природного продукування часто не буде мати природної моделі глікозилування. Білок pyroGlu-MCP-1, відповідно його препарат при його одержанні насамперед у прокаріотах, наприклад, в E. соli, не буде на відміну від форми, яка зустрічається при нативній експресії в організмі людини, глікозильований та/або сіалілований і цим буде відрізнятися від подібного нативного білка, відповідно від його отриманого із природного джерела препарату. Подібна запропонована у винаході композиція може являти собою насамперед лікарський засіб або фармацевтичну композицію, яка разом з білком pyroGlu-MCP-1, на частку якого припадає принаймні 90%, 95% або 96% від усієї кількості білка MCP-1 (що складається з кількості конвертованого й неконвертованого білка й кількості побічних продуктів), містить також звичайні допоміжні речовини й носії, солі, антиоксиданти, стабілізатори, протимікробні агенти, детергенти, консерванти, комплексутворювачі й т.д. Запропонована у винаході композиція може використовуватися для лікування пацієнтів, які страждають від оклюзійних захворювань судин, насамперед ОЗПА або IXC. Таке лікування полягає у введенні в організм пацієнта подібної композиції в терапевтично ефективній кількості одним із прийнятних методів, наприклад, шляхом внутрішньоартеріальної інфузії або у вигляді гелю, який поміщають періартеріально, з якого білок MCP-1 вивільняється протягом більш тривалого періоду часу. При створенні винаходу несподівано було встановлено також, що інкубація отриманого рекомбінантним шляхом препарату білка MCP-1 у водному розчині й при підвищеній температурі не приводить всупереч очікуванням до його розкладання й біологічної інактивації, а, навпаки, наявність цієї нетрадиційної з біотехнологічної точки зору й звичайно небажаної стадії дозволяє при відповідному виборі багатьох параметрів її проведення одержувати несподівано гомогенний, біологічно повністю активний препарат білка pyroGluMCP-1, який, крім того, у цьому випадку у свою чергу зберігає свою гомогенність навіть при більш тривалому зберіганні, тобто має більш високу стабільність, ніж (вихідний) препарат білка GIn-MCP1. Фармацевтичний препарат для успішного проходження законодавчої процедури з одержання дозволу на його комерційне застосування, що визначається відповідними органами влади, наприклад, Управлінням з контролю за якістю харчових продуктів, медикаментів і косметичних засобів (Food and Drug Administration) у США або EMEA у Європі, повинен відповідати численним, спрямованим в остаточному підсумку на захист пацієнтів вимогам, дотримання яких покладено на виробників фармацевтичних препаратів. Так, зокрема, кожен конкретний виробник фармацевтичних препаратів повинен надавати докази, що містять, 15 83661 наприклад, дані про ступінь чистоти фармацевтичного продукту, про його стабільність при зберіганні й про можливості його відтвореного виготовлення. Ці три вказані аспекти становлять лише малу частину тієї інформації, яку повинен надавати виробник фармацевтичних препаратів, однак саме вони відіграють центральну роль при одержанні дозволу на застосування біофармацевтичних препаратів, тобто лікарських засобів, які містять макромолекулярні діючі речовини, які складаються із природних речовин або які є їх похідними, (білків, нуклеїнових кислот, протеогліканів, полісахаридів і т.д.). Часто подібні процедури з одержання дозволу на застосування лікарських засобів пред'являють до (біо)фармацевтичного препарату винятково складні в дотриманні вимоги. Так, наприклад, діючі речовини на основі білка необхідно після їх продукування в більш або менш складному клітинному організмі піддавати інтенсивному й складному, багатостадійному очищенню, при якому їх стр уктура не повинна зазнавати ніяких неконтрольованих змін, наприклад, у результаті реакцій окислення або інших спонтанних хімічних реакцій. Крім цього кінцевий продукт повинен мати прийнятну стабільність при зберіганні для уникнення необхідності створення складних і дорогих систем доставки лікарських засобів від виробника до практикуючого лікаря або пацієнта або в медичну установу, у зв'язку із чим дотримання подібної вимоги насамперед у випадку білків, у яких повинна зберігатися їх правильна вторинна структура (укладання поліпептидних ланцюгів), звичайно можна забезпечити, лише доклавши значних зусиль. У випадку білка MCP-1 якості комерційно доступних препаратів часто виявляється в багатьох відносинах достатньо, наприклад, для проведення дослідів in vitro. Однак авторами даного винаходу в процесі робіт, які проводилися ними, було встановлено, що ті ж самі препарати зовсім не настільки ж добре придатні для приготування медикаментозного засобу, здатного пройти процедуру з одержання дозволу на його застосування. Уже навіть нетривале стояння в розчині при кімнатній температурі перед введенням в організм пацієнта, можливість чого ніколи не можна повністю виключити, наприклад, у лікарській практиці або в лікарнях, приводить за досвідом авторів даного винаходу до появи в препаратах білка MCP-1 початково розглянутих як домішки продуктів "розкладання". Незважаючи на те, що більш ретельне очищення початково передбаченого для застосування як діючої речовини білка GIn-MCP-1 дозволила короткочасно відновити високий ступінь його чистоти, однак і цей препарат не був стабільний при нетривалому його зберіганні в розчині при кімнатній температурі. Одержання дозволу на застосування настільки нестабільного препарату діючої речовини відповідно до законодавчої процедури пов'язано з величезними труднощами або навіть взагалі є безперспективним. Відповідно до запропонованого у винаході рішення ці проблеми несподівано вдалося подати, інтегрувавши у власне процес одержання й очищення білка нетрадиційну, на перший погляд най 16 вищою мірою непродуктивну те хнологічну стадію, а саме: стадію інкубації при підвищеній температурі (яка відповідно до існуючої раніше думки сприяла саме негомогенності препарату білка). Іншими словами, подібна інкубація, проведена в підданих авторами даного винаходу детальному аналізу й оптимізації умовах, дозволяє забезпечити майже кількісну конверсію білка GIn-MCP-1, який початково представляє собою власне діючу речовину, у білок pyroGlu-MCP-1, який спочатку розглядався як забруднююча домішка. Остання із вказаних форм білка має винятково високу стійкість до впливів, які денатур ують білок, таких як інкубація при підвищеній температурі або аналогічні впливи. Відповідно до цього вдалося одержати препарат білка MCP-1, який завдяки своєму високому ступеню чистоти й гомогенності, можливості точного відтворення параметрів процесу його одержання й високої стабільності при зберіганні придатний для застосування як лікарська діюча речовина й має хороші шанси на успішне проходження відповідних процедур з одержання дозволу на його застосування, які пред'являють до фармацевтичних препаратів подібного роду вказані вище строгі вимоги, і який тим самим надає нові, засновані на дії білка MCP-1 можливості в терапії. Ще одним, конкретним об'єктом винаходу є застосування отриманого описаним вище й представленим у формулі винаходу способом препарату білка pyroGlu-MCP-1 - для терапевтичного лікування оклюзійних захворювань судин, насамперед ішемічної хвороби серця (IXC), оклюзійних захворювань периферичних артерій (ОЗПА), оклюзійних захворювань церебральної й брижової артерій, або - для одержання лікарського засобу, призначеного для лікування оклюзійних захворювань судин, насамперед ішемічної хвороби серця (IXC), оклюзійних захворювань периферичних артерій (ОЗПА), оклюзійних захворювань церебральної й брижової артерій. Даний винахід надає також можливість лікування пацієнта, який страждає від одного з вищевказаних оклюзійних захворювань судин, шляхом введення в його організм, наприклад, ін'єкцією або інфузією, отриманого шляхом конверсії препарату білка pyroGlu-MCP-1 або лікарського засобу, отриманого з використанням такого препарату білка pyroGlu-MCP-1. У відношенні окремих оптимізованих параметрів запропонованого у винаході способу слід також зазначити, що інкубація препарату білка протягом більш тривалого періоду часу, що становить за певних умов декілька днів, при підвищених температурах, наприклад, 60°C, потребує від біотехнологів витрат певних зусиль. Створення в розчині для інкубації вказаного вище як оптимального значення рН в інтервалі від нейтрального до кислого в принципі суперечить хімічній логіці, оскільки конверсія глутаміну в циклічний піроглутамат являє собою реакцію нуклеофільного заміщення, при якій вільна пара електронів в атакуючого атома азоту С-альфа-аміногрупи глутамату атакує Сатом С-гамма-амідогрупи. Кисле значення рН привело б до посиленого протонування С-альфа 17 83661 аміногрупи й тому негативно позначилося б на швидкості реакції. Однак за даними авторів даного винаходу цього саме й не відбувається. Можливе пояснення цього факту, яке не повинне інтерпретуватися як обмежувальне, полягає в тому, що згорнутий ланцюг білка MCP-1 утворює для Nкінця свого роду захисну мікрооболонку, всередині якої незважаючи на кисле значення рН навколишнього водного розчину аміногрупа присутня у непротонованому вигляді, тобто є вільна пара електронів для нуклеофільної атаки. Приклади Приклад 1: Одержання препарату білка pvroGlu-MCP-1 запропонованим у винаході способом Ферментація Для ферментації використовували штам Escherichia coli K12 (W3110). Цей штам був трансформований плазмідою CoIE1 (похідною від неї плазмідою pBR322), яка містила наступні елементи: геномну послідовність білка hMCP-1 під контролем широко використовуваного промотору (фосфатази, pPhoA), реплікатор плазміди CoIE1 і ген стійкості до тетрацикліну. Для ферментації штампродуцент попередньо інкубували в струшуваних колбах у середовищі LB, яке містило тетрациклін. Інкубацію проводили при 37°C до досягнення оптичної щільності (ОГ), що дорівнювала 1. Первинну культуру переносили у ферментер і продовжували культивувати в ньому при перемішуванні при температурі 37°С і при підведенні повітря. Середовище у ферментері містило глюкозу, різні солі, мікроелементи, дріжджовий екстракт, амінокислоти й тетрациклін. Значення рН підтримували за допомогою аміаку на рівні 6,8. Відразу ж після витрачання всієї початково завантаженої у ферментер кількості глюкози шляхом її подавання у ферментер вміст розчиненого в культуральному середовищі кисню (показник рО2) постійно підтримували на рівні заданого значення, що дорівнює 40%. Індукція фосфатази, яка служила промотором, відбувалася автоматично відразу ж після витрачання всього присутнього в культуральному середовищі фосфату. Через 39год. біомасу збирали в тр убчастій центрифузі (СЕРА) і зберігали при -70°C. Руйнування клітин і стадії очищення білка Заморожений осад, що містить клітини, отриманий після центрифугування, ресуспендували за допомогою гомогенізатора Ultraturrax у чотирикратній кількості буфера для лізису (200мМ трис, 55мМ NaCl, 5мМ ЕДТК, рН7,5). Клітини руйн ували у дві стадії за допомогою гомогенізатора при тиску 460 бар. Уламки клітин видаляли центрифугуванням у центрифузі СЕРА. Надосадову рідину додатково фільтрували через фільтри Polysep II (з розміром пор 1,2мкм, фірма Мillipore) і потім завантажували в систему колонок, яка складалася зі колонки з Q Sepharose FF і колонки з SP Sepharose FF. Обидві колонки були зрівноважені буфером для лізису. Після завершення завантаження суміші в систему колонок їх промивали буфером для лізису й колонку з Q Sepharose заглушали, перетискаючи затискачем її вихідну тр убку. Колонку ж з SP 18 Sepharose продовжували промивати буфером для лізису, потім 5-молярною сечовиною (у буфері для лізису) і знову буфером для лізису. Продукт елюювали при лінійному градієнті NaCl. До елюату додавали сульфат амонію до кінцевої концентрації, що дорівнює 1,3 моля/л, і центрифугували протягом 15хв. при 3200g. Надосадову рідину завантажували в колонку з фенілсефарозою, зрівноважену 1,3-молярним сульфатом амонію (у буфері для лізису). Елюат, отриманий на колонці з фенілсефарозою, завантажували в колонку Source 30 RPC, зрівноважену буфером для лізису. Надалі колонку промивали буфером для лізису, водою й буфером А (5% EtOH, 0,1% ТФОК). Продукт елюювали при лінійному градієнті зі зміною з 20% буфера Б (95% EtOH, 0,1% ТФОК) до 70% буфера Б у об'ємі, що дорівнював 10-ти об'ємам колонки. Стадія конверсії Елюат розводили в різних буферах, наприклад, фосфатному буфері, з 10-40-мілімолярною концентрацією й з рН6,0-7,4 у пропорції, що досягала 1:10. Як кінцеве значення рН розчину для конверсії це значення відповідно до переважного варіанта прагнули підтримувати в межах від 6,0 до 6,5. Концентрація білка становила від 0,2 до 1,0мг/мл. Розчин стерилізували фільтрацією й інкубували при легкому струшуванні (60об./хв.) при температурах, які становили (у різних сумішах) від 35 до 80°C. За перебігом реакції стежили проведенням РХВР-аналізів. Стадії остаточного очищення Відразу ж після завершення реакції розчин для конверсії завантажували в колонку з SP Sepharose HP, зрівноважену буфером А (40-мілімолярний розчин фосфату, рН6,0). Елюювання здійснювали при лінійному градієнті NaCl. Концентрація NaCl в елюаті становила приблизно 350мМолів/л, а концентрація білка - приблизно 3мг/мл. Елюат розводили буфером А до величини електропровідності, що відповідає 250-мілімолярному розчину NaCl. Після цього елюат розбавляли 40-мілімолярним розчином фосфату з рН6,0 й 250-мілімолярним розчином NaCl доти, поки концентрація білка не стала рівною 1мг/мл. Отриманий таким шляхом розчин основного об'єму стерилізували фільтрацією й зберігали при 4°C або -70°C до переробки у фармацевтичну композицію. Аналіз За перебігом описаної вище стадії конверсії стежили за допомогою ОФ-PXBP (рідинна хроматографія високого розділення зі оберненою фазою). Хроматограми, які відображають профіль елюювання білка, записували перед початком реакції конверсії (момент t0), а також у моменти t=24год., t=48год. i t=120год. Із чотирьох показаних на Фіг.1 хроматограм видно, що при температурі інкубації, що дорівнює 35°C, конверсія вихідного білка в білок pyroGlu-MCP-1 після закінчення 48 год становила близько 90%. Дані PXBP-аналізів вказували на правильне утворення обох дисульфідних містків. На Фіг.2 показані графіки, які відображають кінетику перетворення білка GIn-MCP-1 у білок pyroGlu-MCP-1 в описаних вище умовах. На цих 19 83661 20 графіках видно, що зі збільшенням тривалості реакції зростає кількість позначеної на Фіг.2 як "варіант 2" домішки, яку не представляється можливим охарактеризувати більш детально. Аналогічний перебіг реакції спостерігався й при здійсненні стадії конверсії в 0,1-молярному натрійцитратному буфері з рН5,5 або в 0,1молярному натрійцитратному буфері з рН3,5 (отримані для цих варіантів дані на кресленнях не представлені). Описану вище реакцію повторювали, проводячи її не при 35°С, а при інших значеннях температури, що дорівнюють 24°С, 60°C й 80°C. З наведених нижче в таблиці 3 даних очевидно, що при проведенні реакції при 24°C білок pyroGlu-MCP-1 не вдалося одержати після закінчення прийнятного періоду часу із задовільним виходом. При проведенні ж реакції при 60°C й 80°C спостерігалося значне її прискорення. Швидкість реакції при 80°C приблизно в 50 разів перевищувала швидкість реакції при кімнатній температурі. Слід зазначити, що більш висока температура реакції сприяє, як очевидно, і утворенню побічних продуктів або продуктів розкладання, які знижують ступінь чистоти продукту, насамперед при проведенні реакції при 80°C (див. таблицю 3). На Фіг.3 з високим розділенням показані хроматограми, які відображають профіль елюювання препаратів білка pyroGlu-MCP-1, отриманих при вказаних у таблиці 3 умовах (20-мілімолярний фосфатний буфер, 35°С, 60°C, відповідно 80°C). Ці хроматограми свідчать про те, що при високих температурах навіть при нетривалій інкубації (наприклад, протягом 3год. при 80°C) утворюється набагато більше забруднюючих домішок у вигляді побічних продуктів конверсії білка MCP-1 або продуктів його розкладання, ніж при п'ятиденній інкубації при 35°C. Обумовлена виробничо-технічними причинами наявність у деяких варіантах здійснення способу етанолу (EtOH) (наприклад, у кількості 5%) ніяк негативно не впливала при інших незмінних умовах проведення експериментів (20-мілімолярний фосфа тний буфер з рН6,0) на швидкість реакції або ступінь чистоти одержуваного продукту. Приклад 2: Одержання препарату білка pvroGlu-MCP-1 відповідно до іншого варіанта здійснення запропонованого у винаході способу Ферментацію, руйнування клітин і стадії очищення білка виконували аналогічно до прикладу 1. Стадія конверсії Елюат, отриманий на колонку Source 30 RPC, розбавляли в пропорції 1:10 забуференим фосфатом сольовим розчином, який містив 0,02% твіну 20. У цьому випадку концентрація білка становила приблизно від 0,2 до 0,5мг/мл при значенні рН, що дорівнює приблизно 7,4. Крім буферних компонентів розчин містив приблизно 3,5% EtOH й 0,01% ТФОК, джерелом яких служив елюат, отриманий на попередній стадії елюювання на колонці Source 30 RPC. Розчин стерилізували фільтрацією через фільтр Millipak 20 (з розміром пор 0,2мкм, фірма Мillipore), збираючи фільтрат у пропіленові пляшки, і інкубували при легкому струшуванні при 35°С. За перебігом реакції стежили проведенням РХВРаналізів. Відразу ж після завершення реакції розчин для конверсії розділяли шляхом діалізу, піддаючи його ультрафільтрації через мембрану Pellikon 2 UDF (3k, фірма Millipore) у протитоці до ЗФР із 0,02% твіну 20, і концентрацію білка доводили до 0,1мг/мл. Отриманий продукт стерилізували 21 83661 фільтрацією через фільтр Millipore GV (з розміром пор 0,22мкм), збираючи його порціями по 1мл у скляні посудини. Аналіз За перебігом описаної вище стадії конверсії стежили за допомогою ОФ-PXBP. Як видно з наведених на Фіг.4 гра фіків, конверсія вихідного білка в білок pyroGlu-MCP-1 після закінчення 5 днів перевищила 90%, при цьому незважаючи на більшу тривалість інкубації отриманий білок несподівано мав дуже високий ступінь чистоти, що дорівнював 95% (див. таблицю 3). Порівнявши між собою дані, отримані при конверсії в суміші, яка містила 20-мілімолярний фосфатний буфер, і в суміші, яка містила 20-мілімолярний фосфатний буфер й 150-мілімолярний розчин солі (приклад 1, таблиця 3, рядки 3 й 5 відповідно), можна відзначити, що порівняно низька константа швидкості реакції в сумішах, які містили ЗФР як розчин для інкубації, швидше за все обумовлена підвищеною концентрацією солі, іонною силою або осмомолярністю. Приклад 3: Одержання лікарського засобу на основі отриманого відповідно до прикладу 1 або прикладу 2 препарату білка MCP-1 Отриманий у прикладі 1 або прикладі 2 препарат білка pyroGlu-MCP-1 розводили в ЗФР (хлорид натрію, динатрійгідрофосфат, хлорид калію, дигідрофосфат калію, рН7,0), які містили також 0,02% твіну 20, до концентрації 0,1мг/мл й отриманий розчин порціями по 1мл розливали в скляні посудини. Готовий лікарський розчин, який був прозорим і безбарвним і не мав запаху, можна вводити в організм шляхом ін'єкції або інфузії. Приклад 4: Порівняння біологічної активності білка pyroGlu-MCP-1 і білка GIn-MCP-1 Принцип вимірювання Білок MCP-1 зв'язується зі своїм рецептором CCR2b й активує його. Активування цього рецептора приводить до припливу кальцію в цитозоль. Подібний приплив кальцію в цитозоль можна виміряти за допомогою флуоресцентного спектрофотометра для прочитання планшетів Fluorescence Imaging Plate Reader (FLIPR, фірма Molecular Devices). Із цією метою в клітини, які експресують на своїй поверхні рецептор hCCR2b, вводили неактивний флуоресцентний барвник Fluo-4 AM у вигляді його ефіру, який у цьому випадку розщеплюється внутрішньоклітинними естеразами. У такій формі подібний флуоресцентний барвник зв'язує іони Ca2+. Флуоресцентний барвник при його збудженні випромінюванням з довжиною хвилі 488нм починає випускати випромінювання флуоресценції, максимум якого припадає на довжину хвилі 528нм. Інтенсивність випромінювання флуоресценції залежить від концентрації кальцію в цитозолі. Відповідно до цього зміна інтенсивності випромінювання флуоресценції взаємозв'язана з концентрацією кальцію в цитозолі, яка у свою чергу залежить від ступеня активування рецептора. Характеристичний, дозволений у часі вимірювальний сигнал, отриманий після додавання білка 22 MCP-1, показаний на Фіг.5. Форма цього сигналу свідчить про те, що після додавання білка MCP-1 відбувається швидке вивільнення кальцію, з яким (вивільненням) зв'язане різке наростання інтенсивності випромінювання флуоресценції. Максимум інтенсивності (b) досягається при цьому вже через декілька секунд після додавання білка (а). Проміжок часу від моменту додавання білка (а) до досягнення максимальної стимуляції (b) становить приблизно 20 - 30с. У наступному описі експериментів розглядаються обробка й аналіз даних на основі максимальних значень, оскільки вони в меншому ступені піддаються впливу вторинних ефектів, таких, наприклад, як індукований кальцієм його приплив у цитозоль, і тим самим дозволяють одержати більш точні результати вимірювань. Одержання стабільно експресуючих клітин CHO/hCCR2B-K1 Кодувальну ділянку людського рецептора CCR2b (номер доступу в банку генів: D29984) ампліфікували шляхом полімеразної ланцюгової реакції (ПЛР). Після цього фрагмент BamHI-Xbal довжиною 1,08т.п.н. вбудовували в експресуючий вектор і клонували в ньому. Цієї плазмідою, яка служила експресуючим вектором, трансфектували клітини CHO-K1. Клітини культивували в культуральному середовищу на основі середовища Хема F12 і регулярно пересівали. У день напередодні вимірювання 5000 клітин висівали в 384-лункові аналітичні планшети (фірми Corning Costar) з 40мкл культурального середовища й для прикріплення до субстрату залишали на ніч (близько 24год.) при 37°C, 5%-ному вмісті CO2 й 95%-ній відносній вологості. У всіх дослідах експерименти повторювали по чотири рази. У день проведення експериментів спочатку підготовляли планшети з тестованою речовиною. Як буфер для розведення різних препаратів білка MCP-1 використали збалансований сольовий розчин Хенкса з 0,1% бичачого сироваткового альбуміну (БСА, без протеаз). Як "холостий" контроль служив збалансований сольовий розчин Хенкса з 0,1% БСА. Після цього до клітин додавали барвник Fluo-4 з розрахунку по 40мкл на лунку й суміші інкубували протягом 45хв. при 37°C, 5%-ному вмісті CO2 й 95%-ній відносній вологості. Потім пофарбовані клітини чотири рази промивали 60мкл промивального буфера, після завершення чого в кожній лунці залишалося по 25мкл промивального буфера. Далі клітини інкубували ще протягом 5хв. при кімнатній температурі в присутності промивального буфера. Для вимірювання флуоресценції спектрофотометр FLIPR настроювали таким чином, щоб відмінність між лунками з пофарбованими й непофарбованими клітинами становили принаймні 1:5, а число імпульсів флуоресценції в лунок з пофарбованими клітинами дорівнювало приблизно 11000. Інші настройки спектрофотометра FLIPR були наступними: 23 83661 довжина хвилі збудження: 488нм довжина хв илі в ипромінюв ання: 510-570нм (смуга пропускання) в ід'ємна корекція: розчин Хенкса/БСА (в ідпов ідає корекції з в иправ ленням на "холостий" контроль) в іднімання зміщення: 6 (в ідпов ідає нів елюв анню на 0 всіх лунок перед додав анням тестов аної речов ини) Попереднє просочення 25мкл в ідпов ідного розчину наконечників : тестов аної речов ини з планшета, який його містить (в ідпов ідають мінімізації обумов леного прикріпленням до субстрату артефакту) Процес вимірювання складався з наступних стадій: 6 інтервалів з 5-секундним тактом, додавання 15мкл тестованої речовини, 60 інтервалів з 1-секундним тактом, 18 інтервалів з 5-секундним тактом. Для обробки використовували сигнал максимальної по 78 інтервалам після додавання тестованої речовини інтенсивності. Як контрольні суміші служили наступні: "холостий" контроль: для в ід'ємної корекції, Позитив ний контроль для перев ірки фарбув ання, (АТФ): порів няльний контроль контроль експресії рецеп("стандарт"): тора на поверхні клітин, основ а розрахунків для в изначення актив ності нев ідомих зразків . Тестовані зразки піпетували паралельно з порівняльною контрольною сумішшю з розведенням у ти х же пропорціях. Концентрації, які використовувалися в дослідах, вибирали з таким розрахунком, щоб вони знаходилися в діапазоні ЕС 50значень порівняльної контрольної суміші. Порівняння запропонованих у винаході препаратів білка MCP-1 й препаратів білка MCP-1, які не відповідають винаходу Приклад 5: Теплочутливість білка pyroGluMCPl Білок PyroGlu-MCP-1 інкубували протягом 1, відповідно 2год. при 56°С або 95°C. Ще збережену після цього біологічну активність білка потім визначали на основі тест-системи, описаної в прикладі 4. При цьому було встановлено, що ні одногодинна, ні двогодинна інкубація препарату білка pyroGlu-MCP-1 при 56°С не викликає його денату 24 За описаною вище методикою досліджували й порівнювали між собою два отриманих запропонованим у винаході способом препарати білка pyroGlu-MCP-1 ("зразок 071100kh" й "зразок 0141921") і отриманий рекомбінантним шляхом препарат білка MCP-1, N-кінцевий глутаміновий залишок якого не був конвертований відповідно до описаної вище, запропонованої у винаході стадії в піроглутаматний залишок (препарати білка MCP-1, які випускають фірмою Peprotech). Ha основі експериментально знятих описаним вище шляхом кривих визначали значення EC50 (див. Фіг.6). Для обох препаратів білка pyroGlu-MCP-1 були отримані практично ідентичні значення EC50, тоді як значення, отримані для не модифікованого на N-кінці препарату білка MCP-1, який не відповідає винаходу, істотно відрізнялися від них (Фіг.6). Значення EC50 останнього із вказаних препаратів було гірші в 2 - 3 рази (білок pyroGlu-MCP-1: EC50=7,82нМ, препарат білка MCP-1 фірми Peprotech: EC 50=20,76нМ). Біологічну активність обох препаратів на основі цих даних розраховували наступним шляхом. Спочатку виконували позитивну корекцію, вносячи виправлення на білок pyroGlu MCP-1 при концентрації, що дорівнює 10-8M, тобто значення, отримане при 10-наномолярній концентрації білка, приймали за 100%. Цей інтервал значень відповідає ділянці кривої, яка майже прямолінійно піднімається. На основі цієї вираженої у відсотках інтенсивності сигналу потім відповідно до наведеної нижче формули розраховували активність інших препаратів, наприклад, препарату білка MCP-1 фірми Peprotech: RFU( зразка при 10 -8 М) % активності(зразка ) = ´ 100% RFU( зразка при 10 -8 М) Звідси видно, що в розглянутому вище прикладі розраховане на основі наведених у таблиці даних значення активності не модифікованого на N-кінці препарату білка MCP-1 становить 48% від значення активності препарату білка pyroGlu-MCP1. рації. Інкубація ж цього препарату білка при 95°C викликала, як видно з наведених на Фіг.7 графіків, чітко виражену денатурацію. Приклад 6: Лікування пацієнтів, які страждають від оклюзійних захворювань артерій Для лікування пацієнтів з ОЗПА готують розчин отриманого описаним вище способом препарату білка pyroGlu-MCP-1 з концентрацією від 1,2 й 120мкг/мл. Безпосередньо перед застосуванням 25 83661 цього розчину концентрацію препарату білка в ньому доводять до кінцевої в межах від 0,1 до 10мкг/мл і розчин шляхом внутрішньоартеріальної інфузії вводять пацієнтові з витратою від 2 до 26 12мл/хв. протягом 1 - 6год поблизу ділянки судини, ураженої оклюзією. Інфузію можна повторити через 1 - 7 днів. 27 Комп’ютерна в ерстка Т. Чепелев а 83661 Підписне 28 Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for the production of an n-terminally modified chemotactic factor
Автори англійськоюWandl Robert, Necina Roman, Seidler Randolph, Lenter Martin, Doods Henri
Назва патенту російськоюСпособ получения модифицированного на n-конце хемотаксина
Автори російськоюВандль Роберт, Несина Роман, Зайдлер Рандольф, Лентер Мартин, Дудс Генри
МПК / Мітки
МПК: C12N 15/19, A61K 38/19, C07K 14/52, A61P 9/00
Мітки: хемотаксину, одержання, модифікованого, n-кінці, спосіб
Код посилання
<a href="https://ua.patents.su/14-83661-sposib-oderzhannya-modifikovanogo-na-n-kinci-khemotaksinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання модифікованого на n-кінці хемотаксину</a>
Попередній патент: Спосіб створення осьового навантаження на долото та пристрій для його здійснення
Наступний патент: Спосіб отримання (4-гідроксі-6-оксотетрагідропіран-2-іл)ацетонітрилу і його похідних
Випадковий патент: Комплексний пристрій для ліквідування аварій