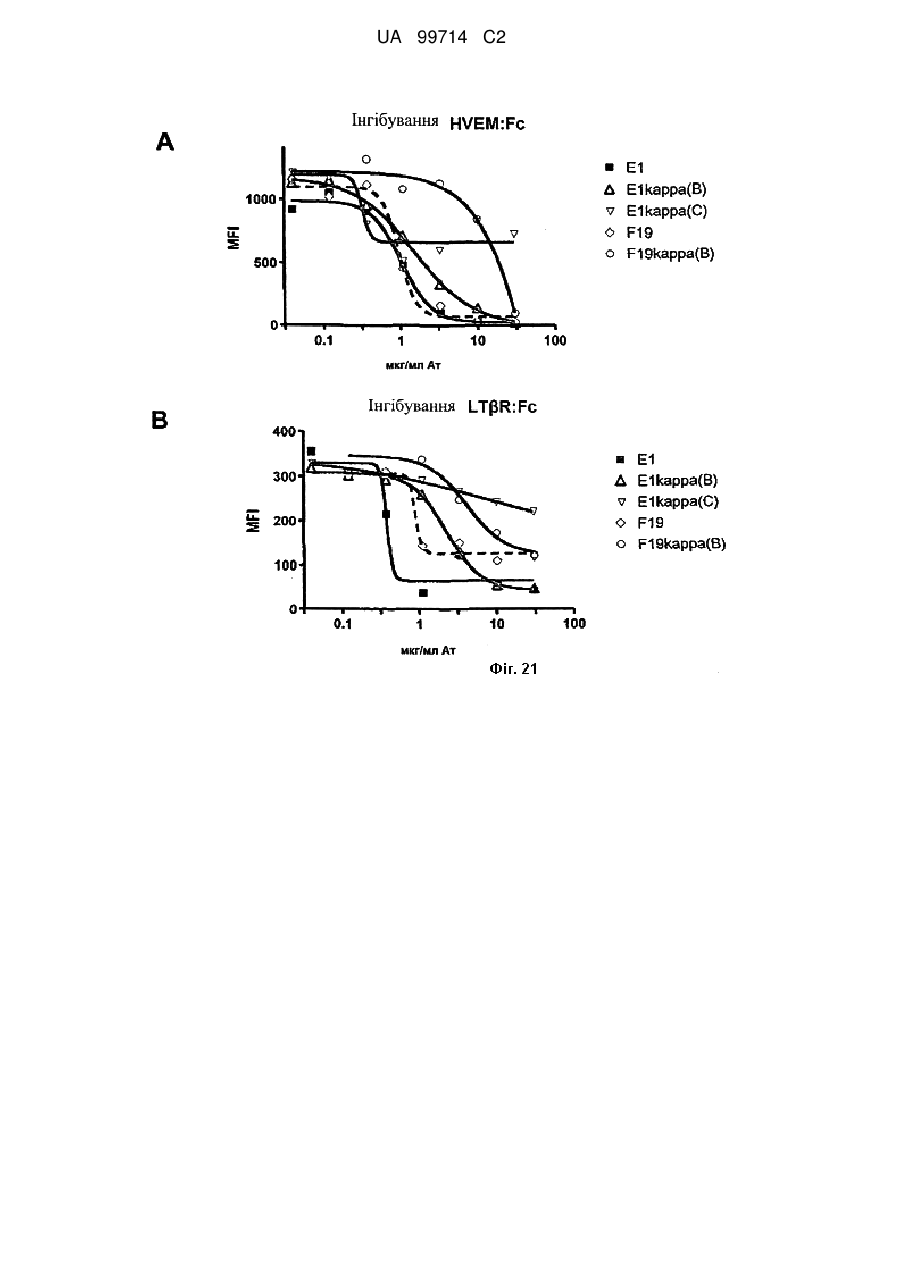
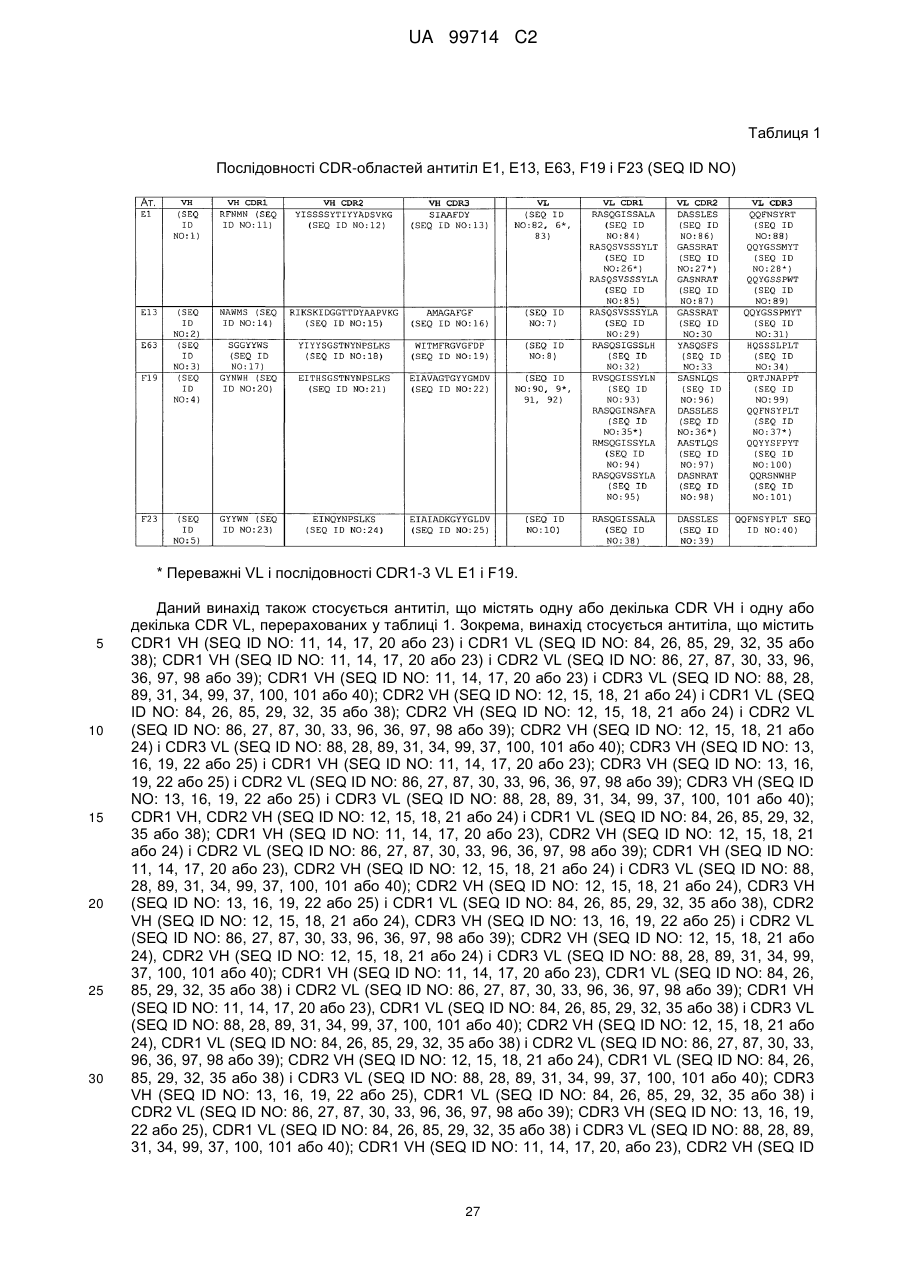
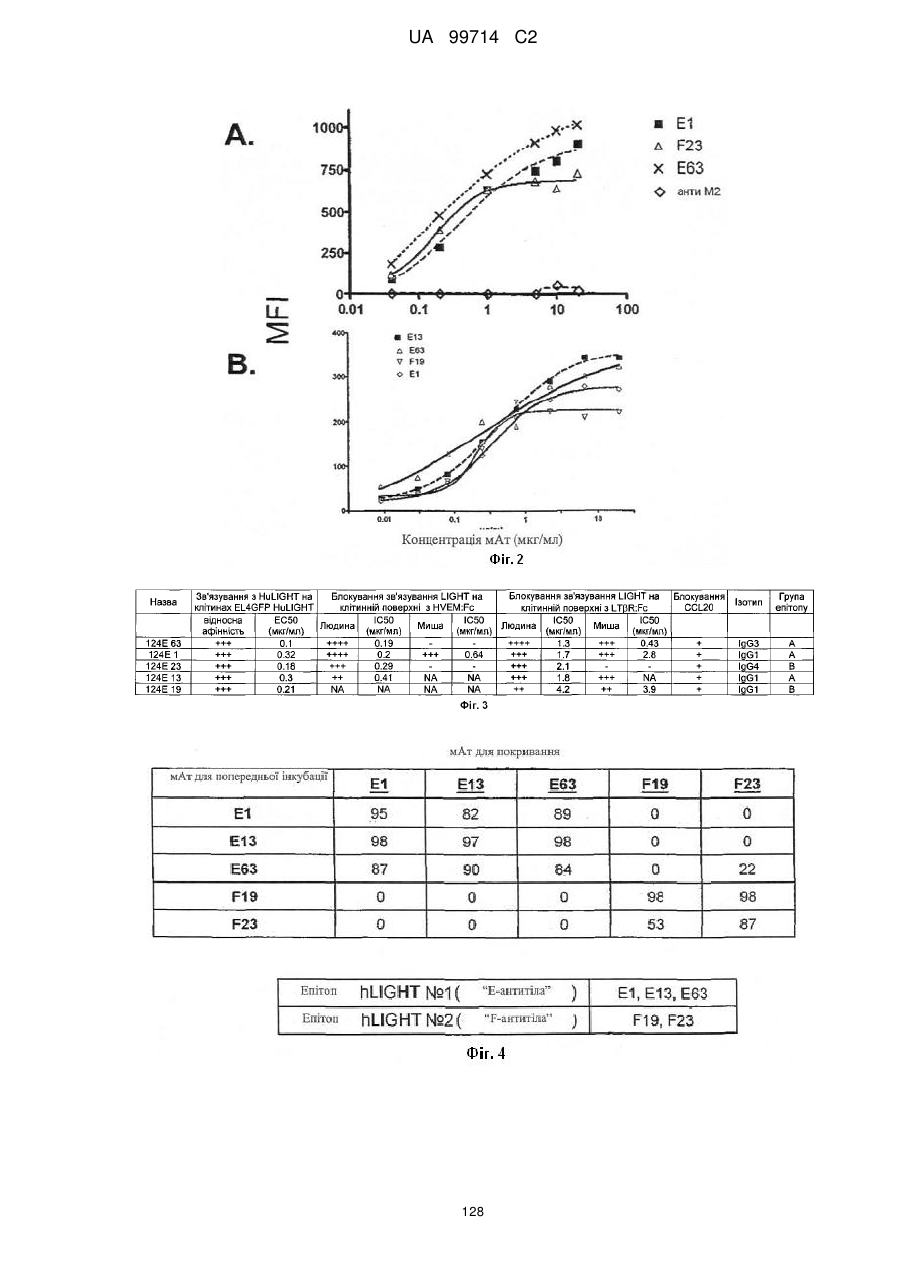
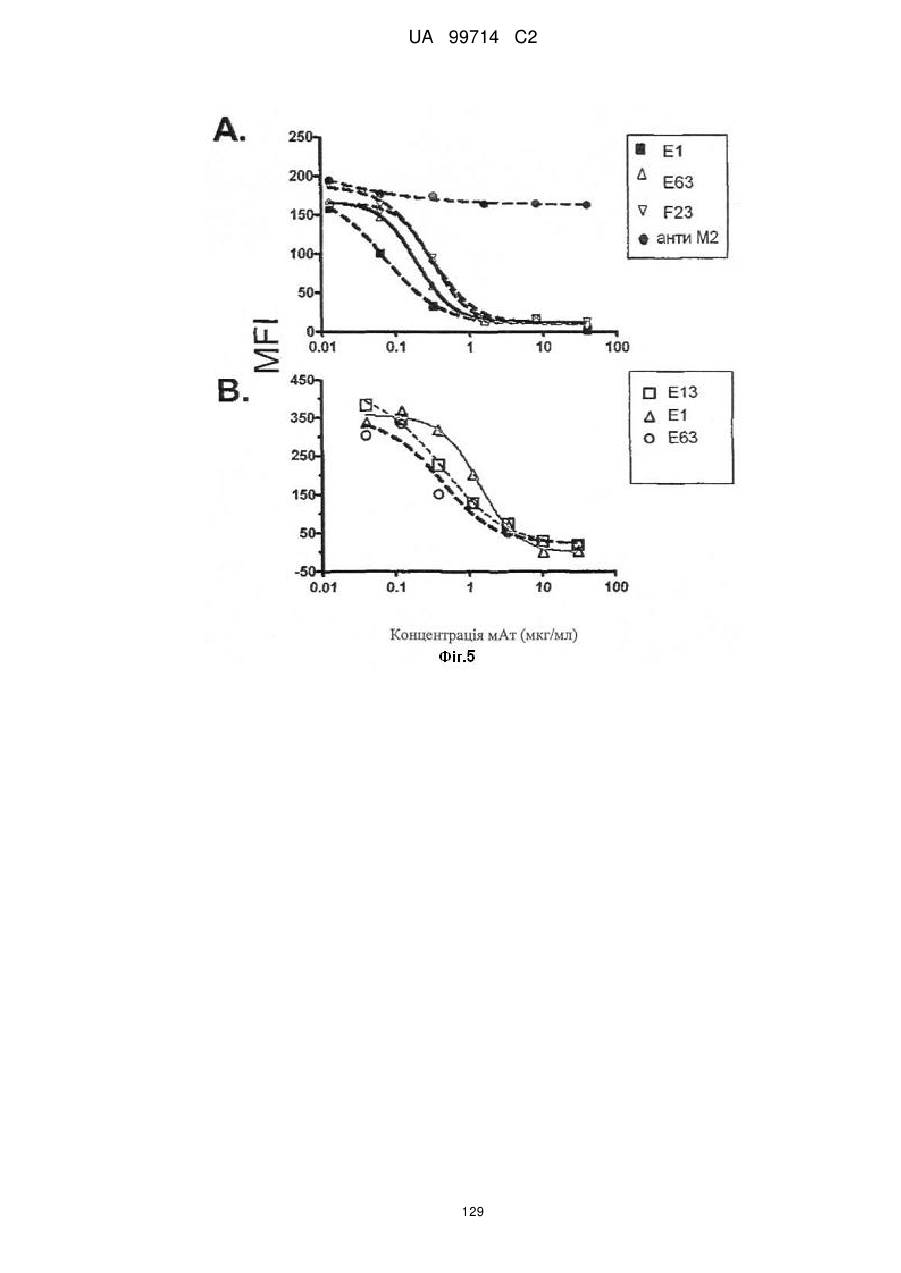
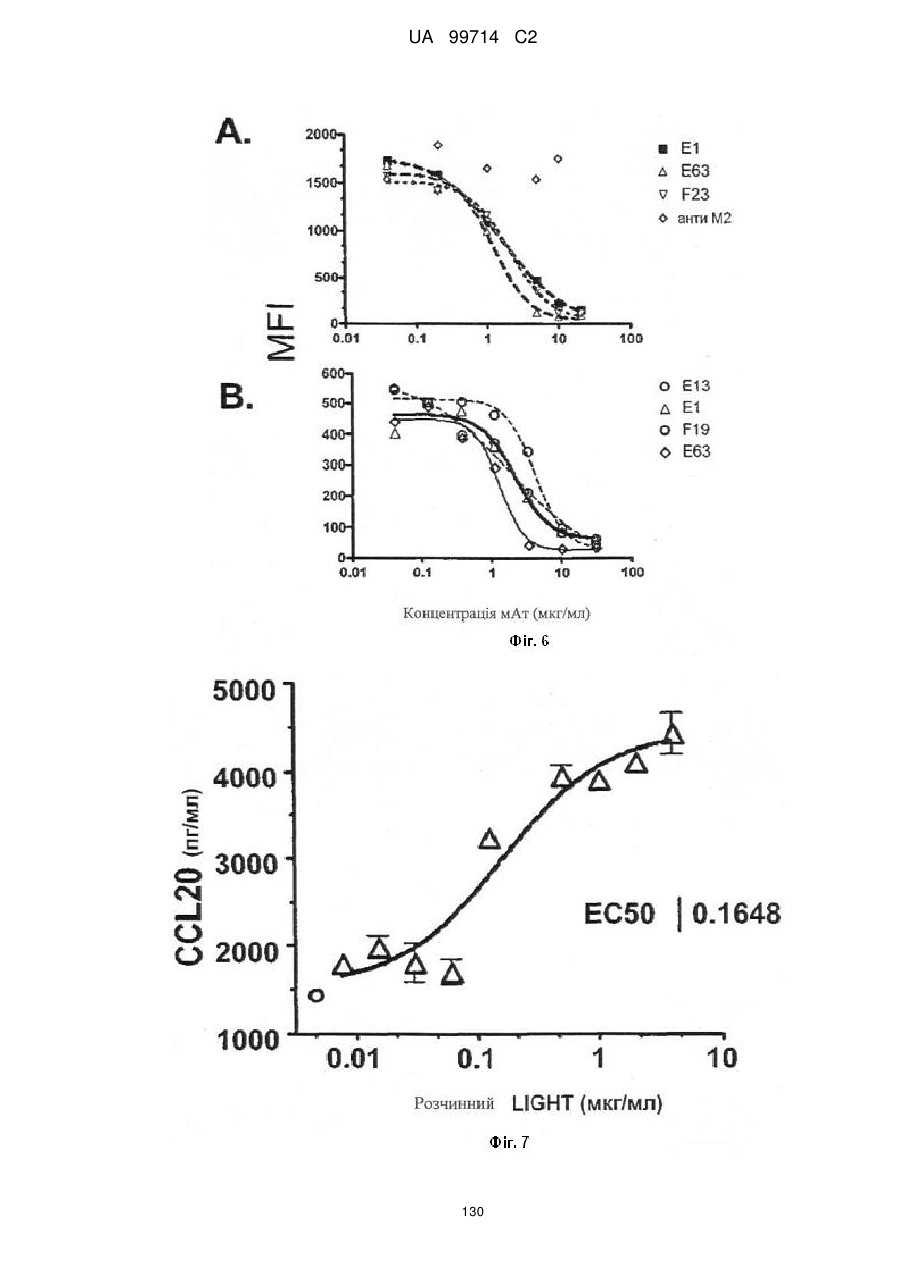
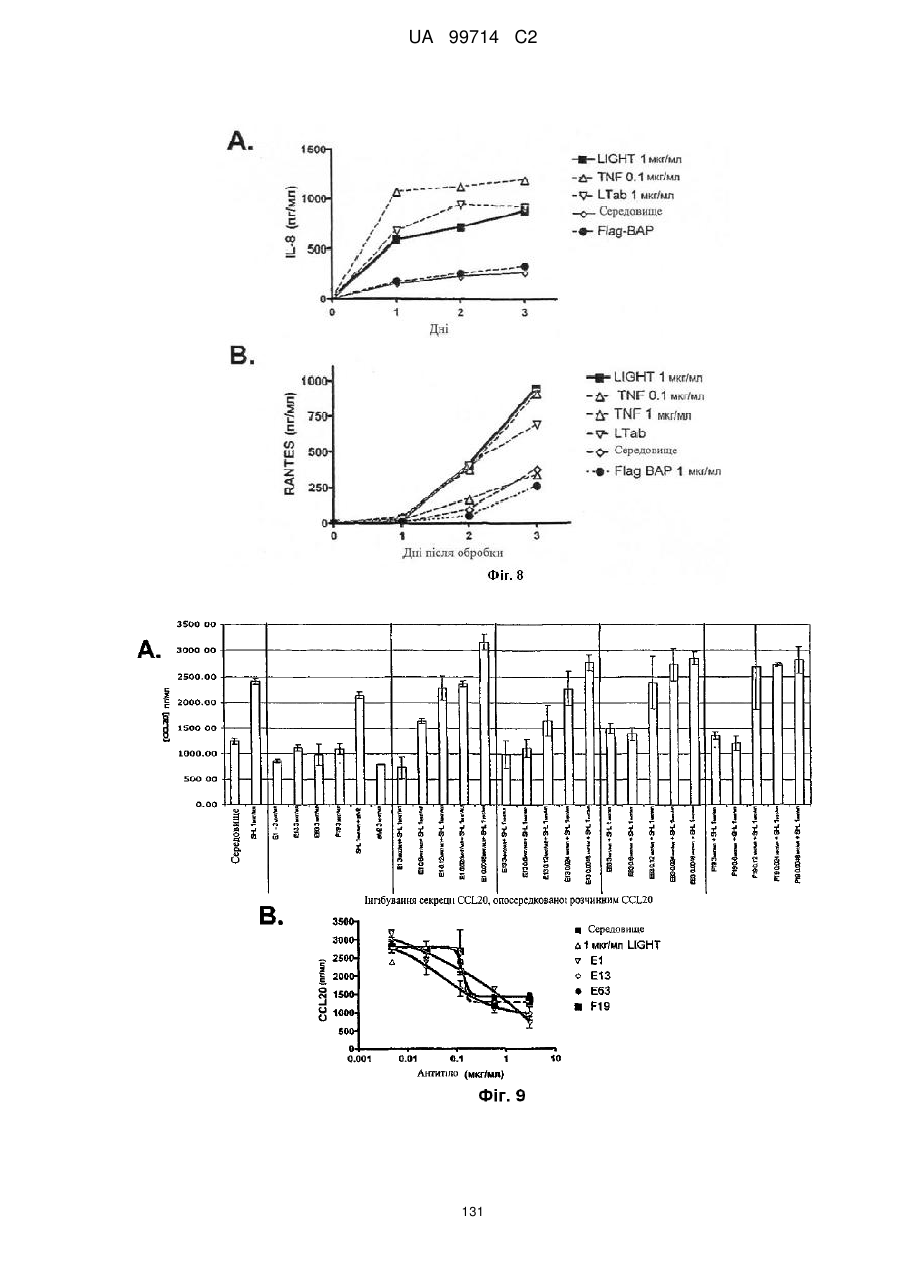
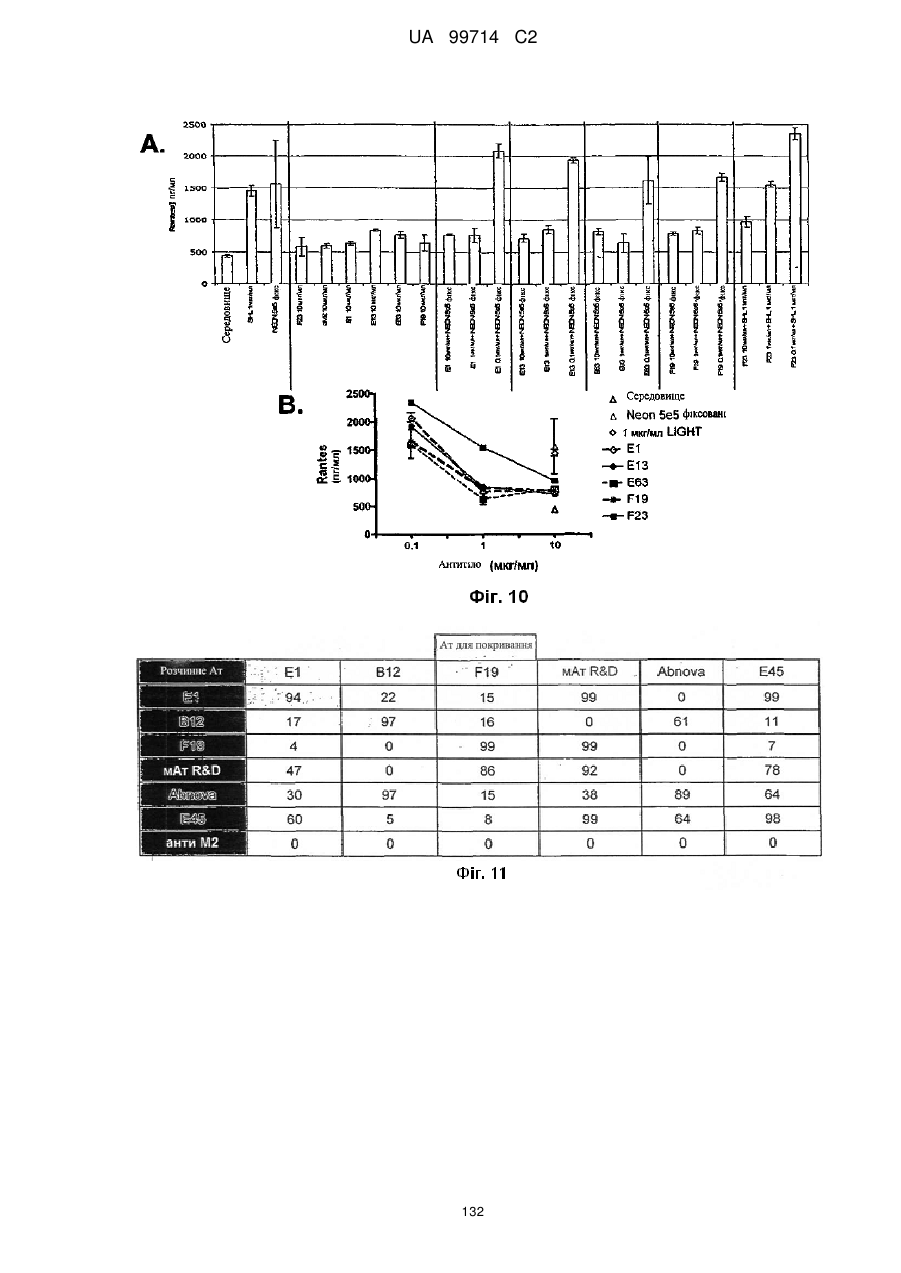
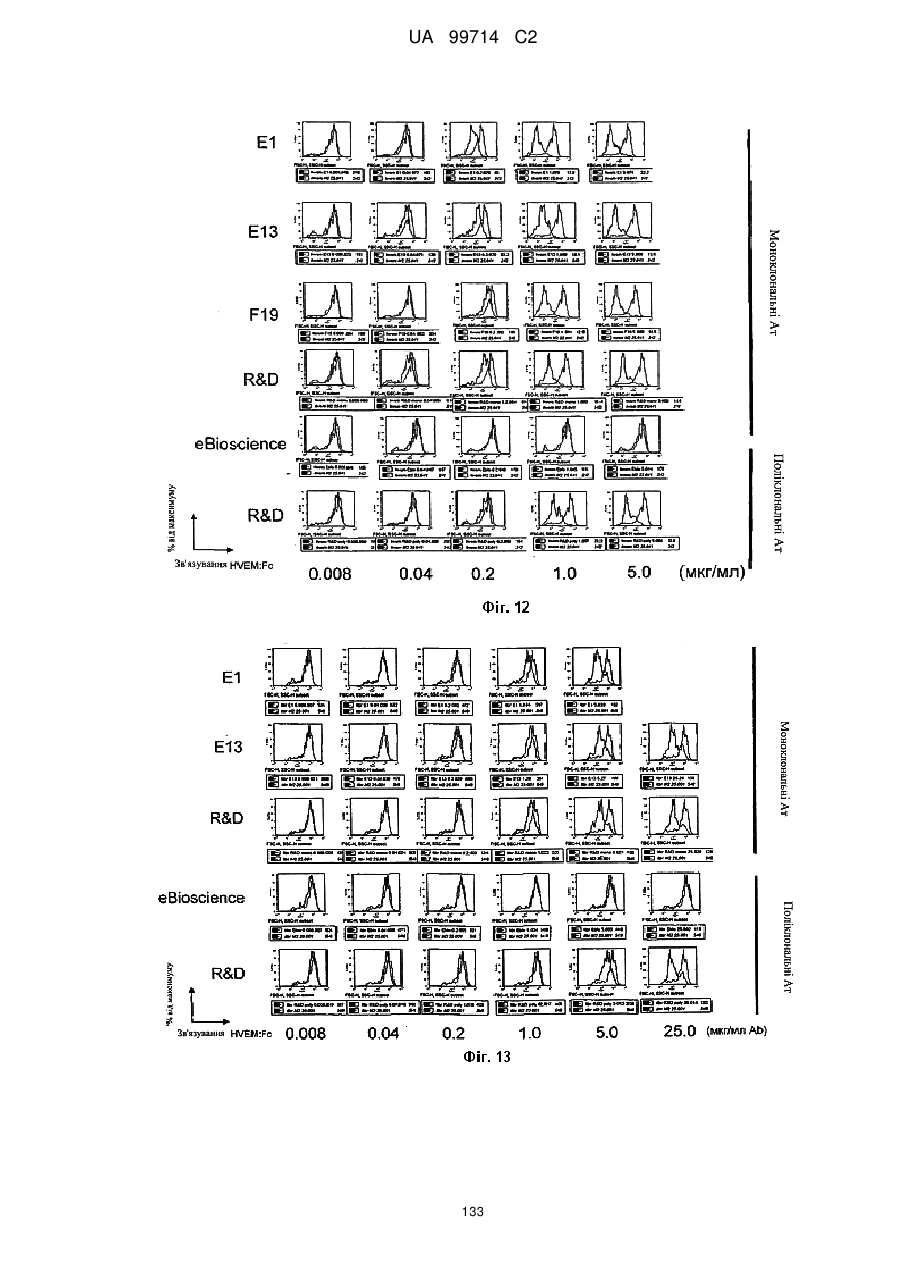
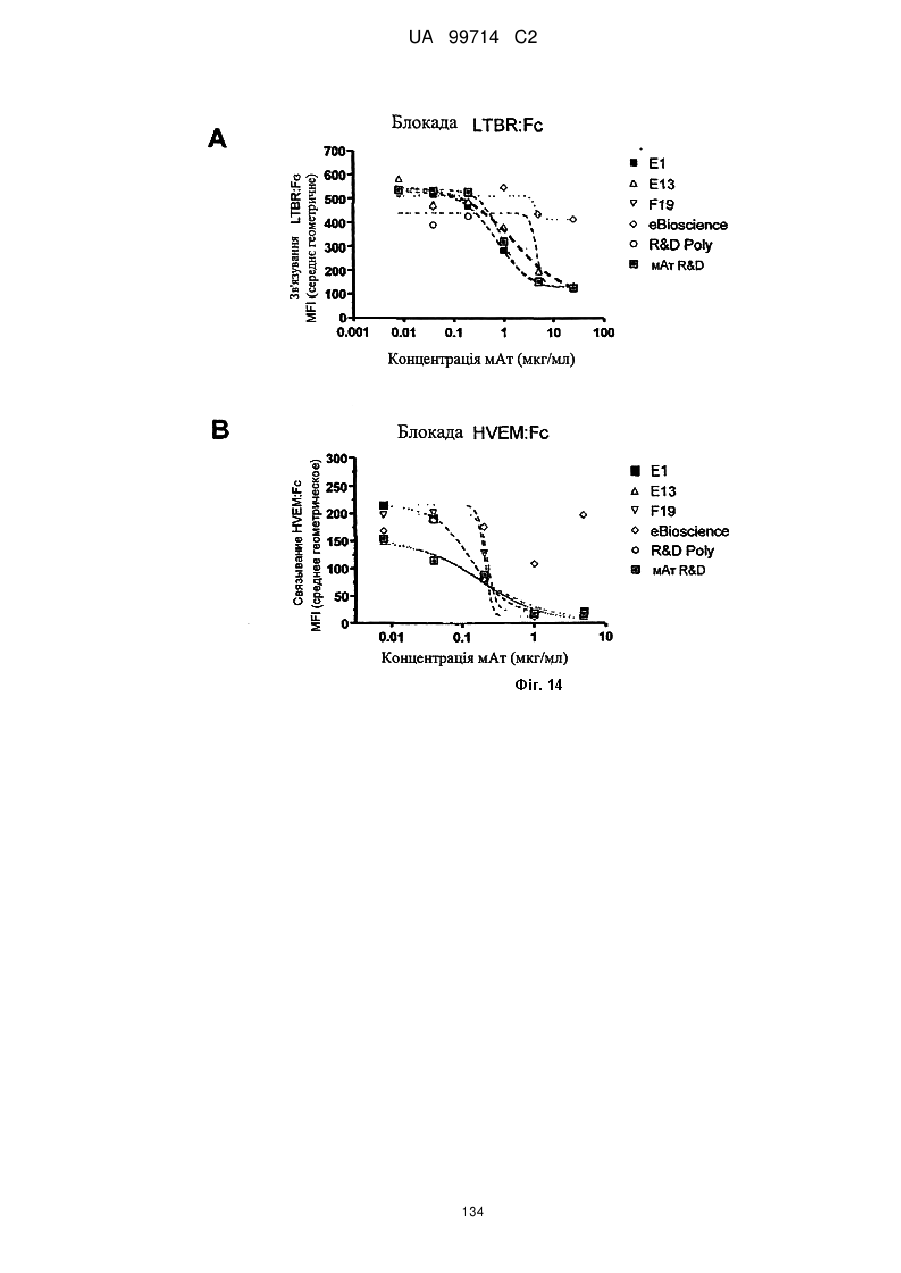
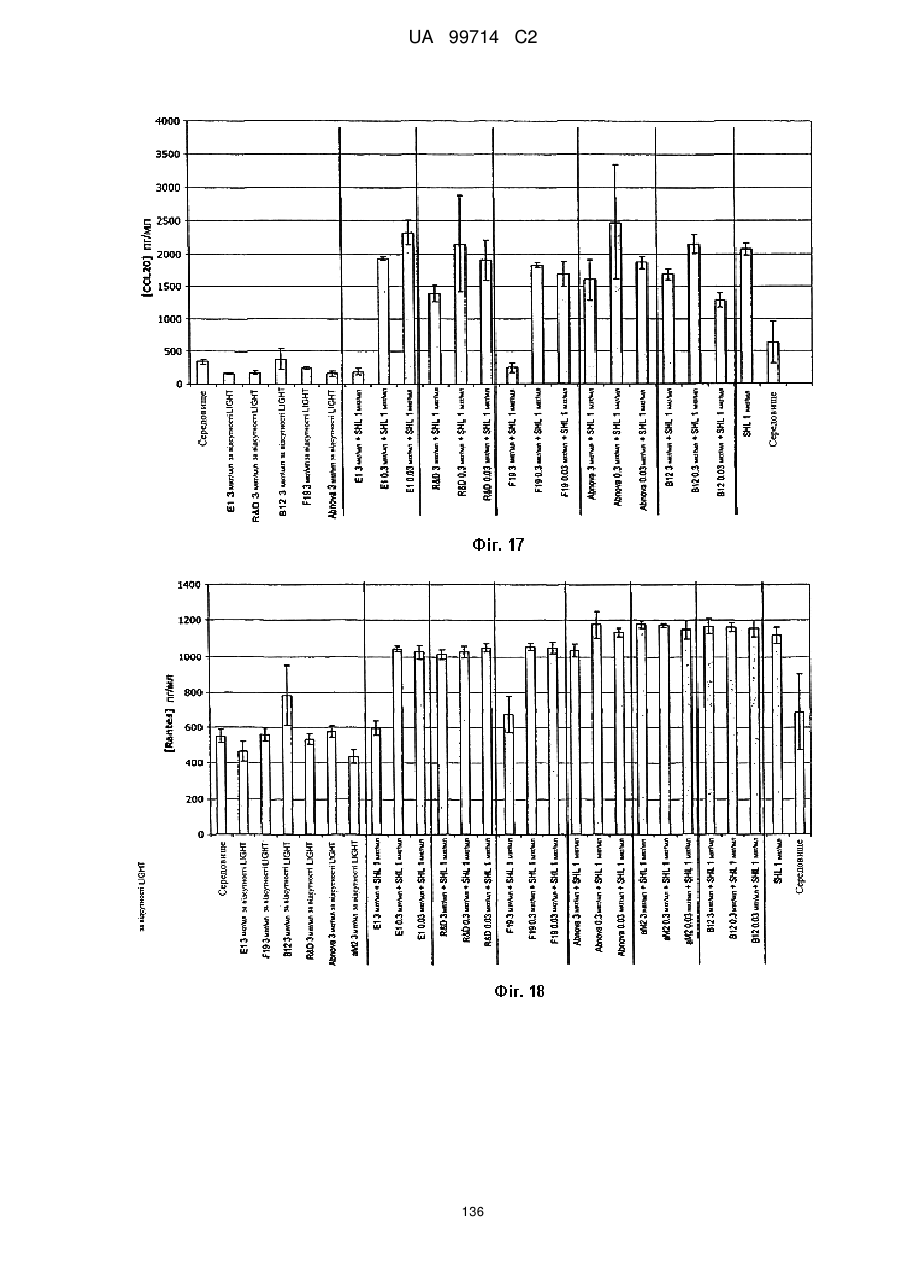
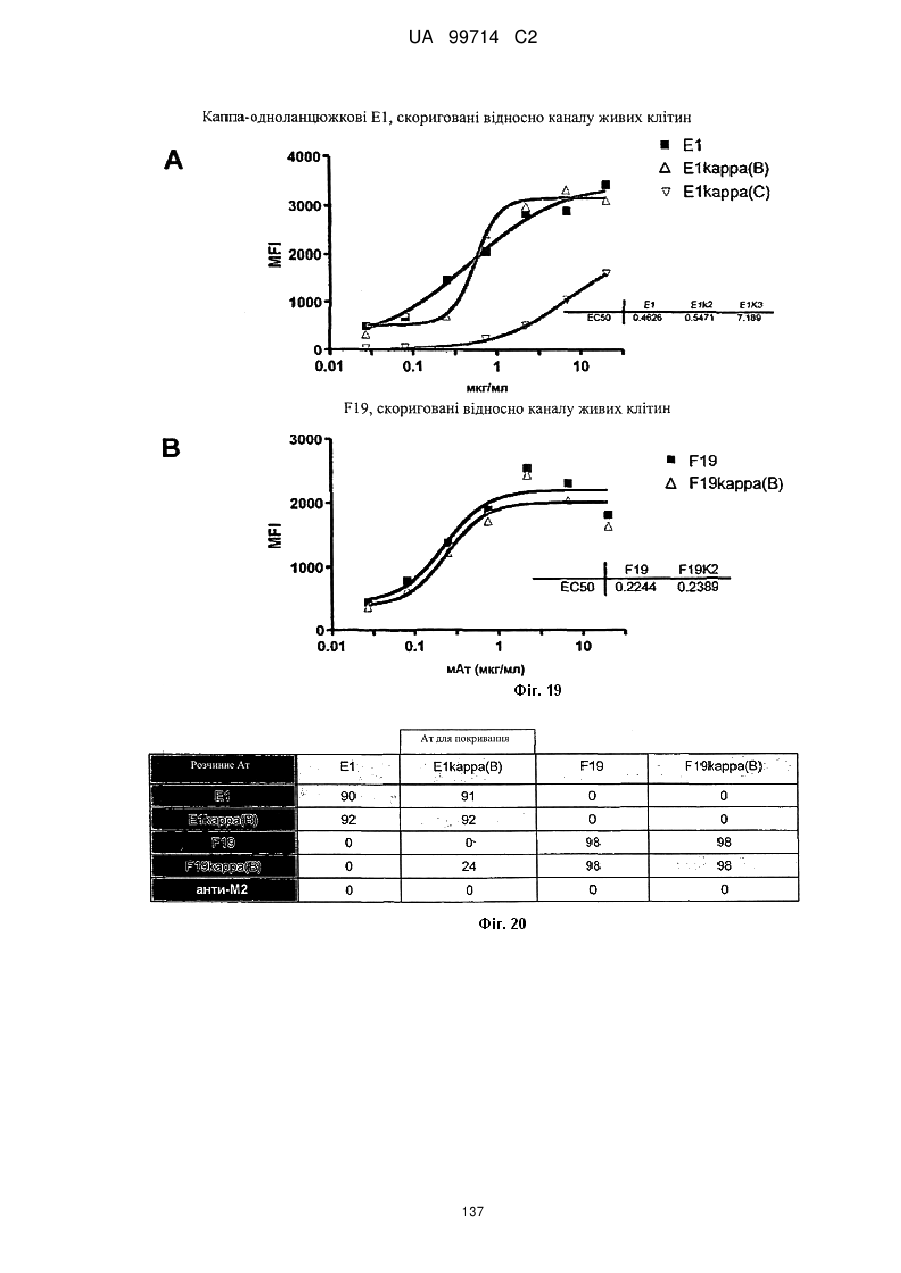
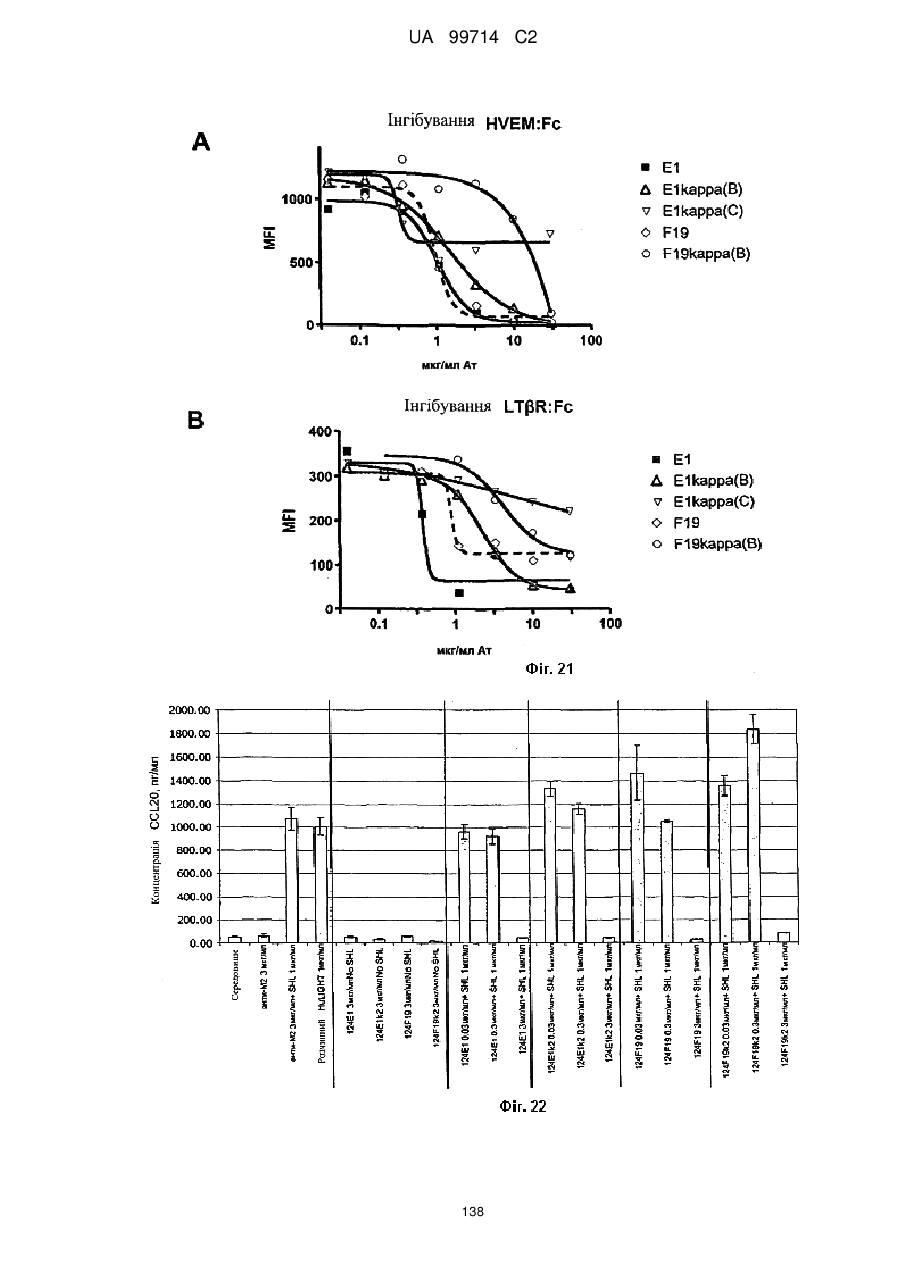
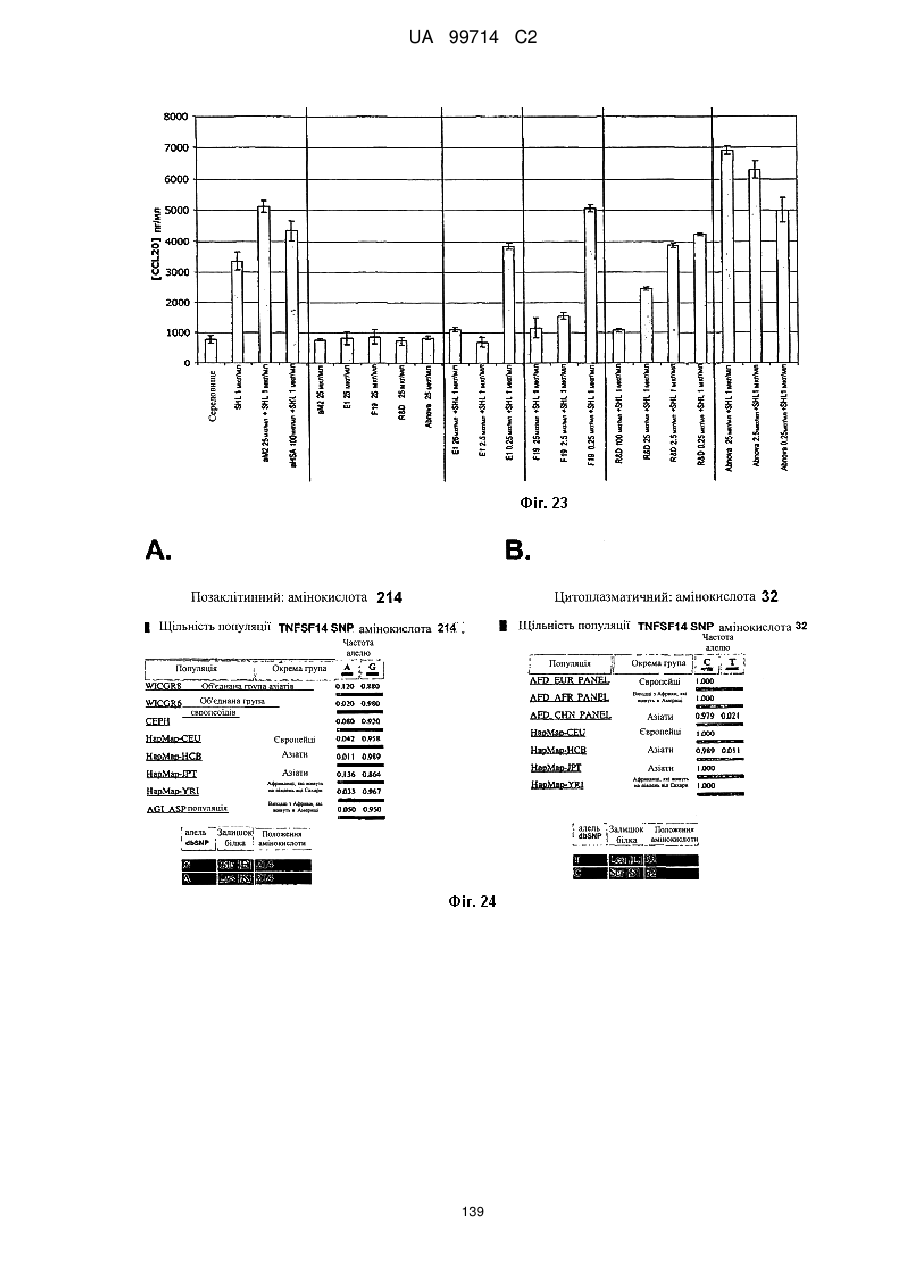
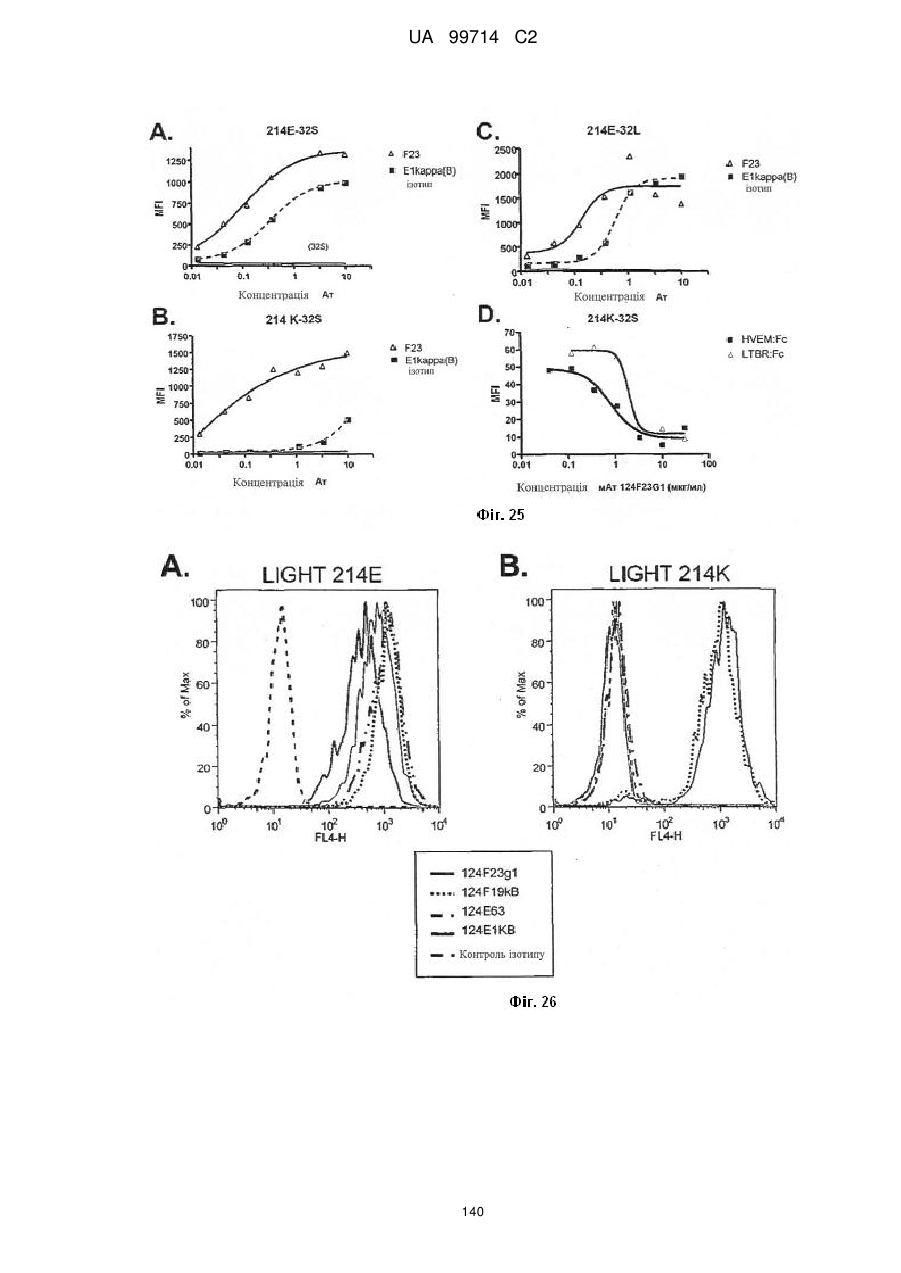
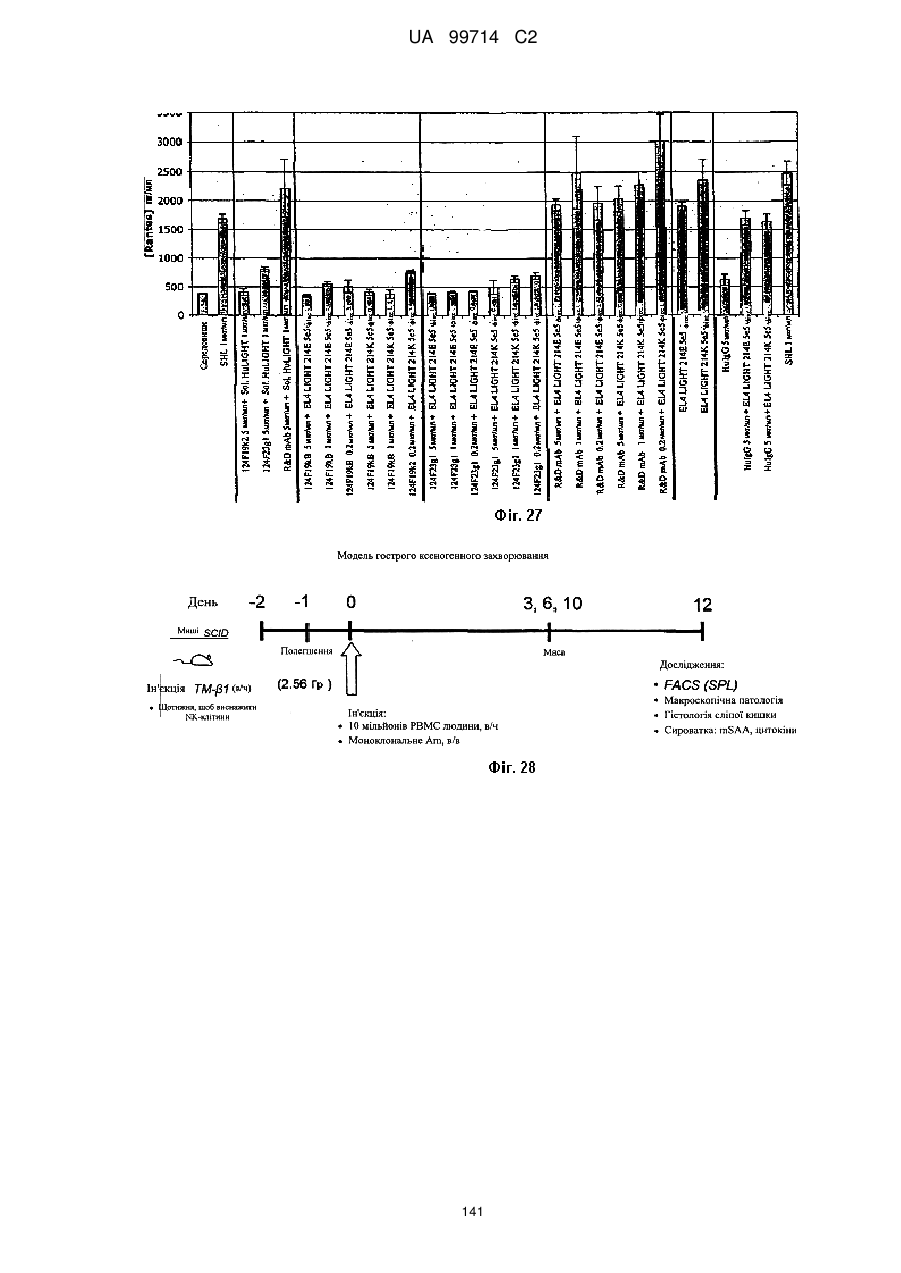
Моноклональне антиtіло, яке специфічно зв’язується з light
Номер патенту: 99714
Опубліковано: 25.09.2012
Автори: Гренджер Стівен В., Уер Карл Ф., Като Сінітіро
Формула / Реферат
1. Ізольоване антитіло, що імуноспецифічно зв'язується з LIGHT людини (hLIGHT), де антитіло містить: область, що визначає комплементарність (CDR) 1 варіабельної області важкого ланцюга (VH), яка містить амінокислотну послідовність GYNWH (SEQ ID NO: 20), VH CDR2, яка містить амінокислотну послідовність EITHSGSTNYNPSLKS (SEQ ID NO: 21); і VH CDR3, яка містить амінокислотну послідовність EIAVAGTGYYGMDV (SEQ ID NO: 22); і CDR1 варіабельної області легкого ланцюга (VL), яка містить амінокислотну послідовність RASQGINSAFA (SEQ ID NO: 35); VL CDR2, яка містить амінокислотну послідовність DASSLES (SEQ ID NO: 36); і VL CDR3, яка містить амінокислотну послідовність QQFNSYPLT (SEQ ID NO: 37).
2. Антитіло за п. 1, де антитіло містить домен VH, який містить амінокислотну послідовність SEQ ID NO: 4.
3. Антитіло за п. 1, де антитіло містить домен VL, який містить амінокислотну послідовність SEQ ID NO: 9.
4. Антитіло за будь-яким з пп. 1-3, що містить константний домен IgG1 або IgG4.
5. Антитіло за будь-яким з пп. 1-3, що є повністю людським антитілом.
6. Антитіло за будь-яким з пп. 1-3, що є химерним або гуманізованим антитілом.
7. Антитіло за будь-яким з пп. 1-3, що є моноклональним антитілом.
8. Антитіло за будь-яким з пп. 1-3, що є рекомбінантним антитілом.
9. Антитіло за будь-яким з пп. 1-3, що являє собою антигензв'язувальний фрагмент.
10. Антитіло за будь-яким з пп. 1-3, що являє собою Fab-фрагмент, F(ab')2-фрагмент, одноланцюжковий Fv (sFv), діантитіло, триантитіло або міні-антитіло.
11. Композиція, що містить антитіло за будь-яким з пп. 1-10.
12. Ізольована молекула нуклеїнової кислоти, що кодує антитіло за будь-яким з пп. 1-10.
13. Вектор, що містить молекулу нуклеїнової кислоти за п. 12.
14. Клітина-хазяїн, що містить вектор за п. 13.
15. Спосіб одержання антитіла за будь-яким з пп. 1-10, де спосіб включає культивування клітини-хазяїна за п. 14 в умовах, які стимулюють продукування антитіла.
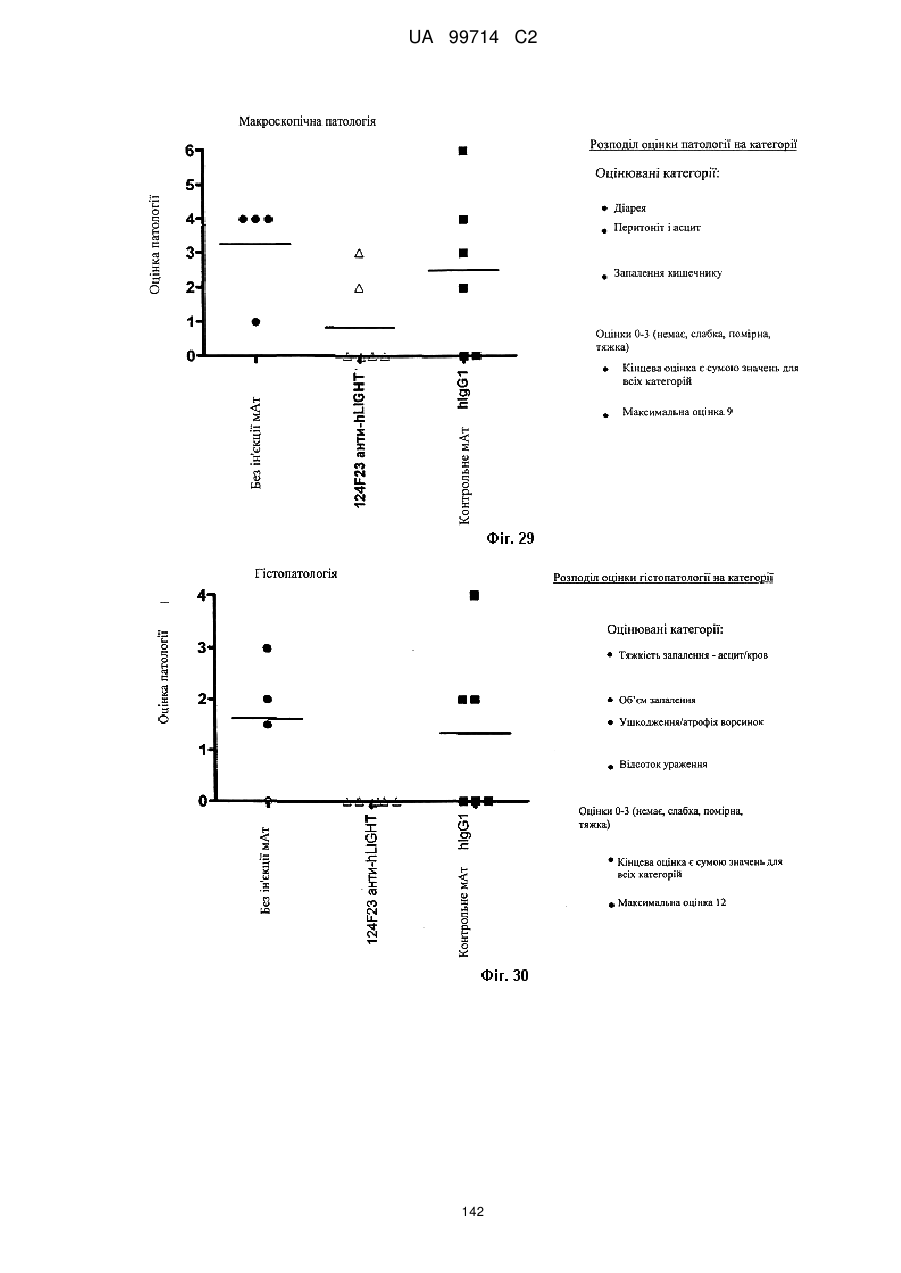
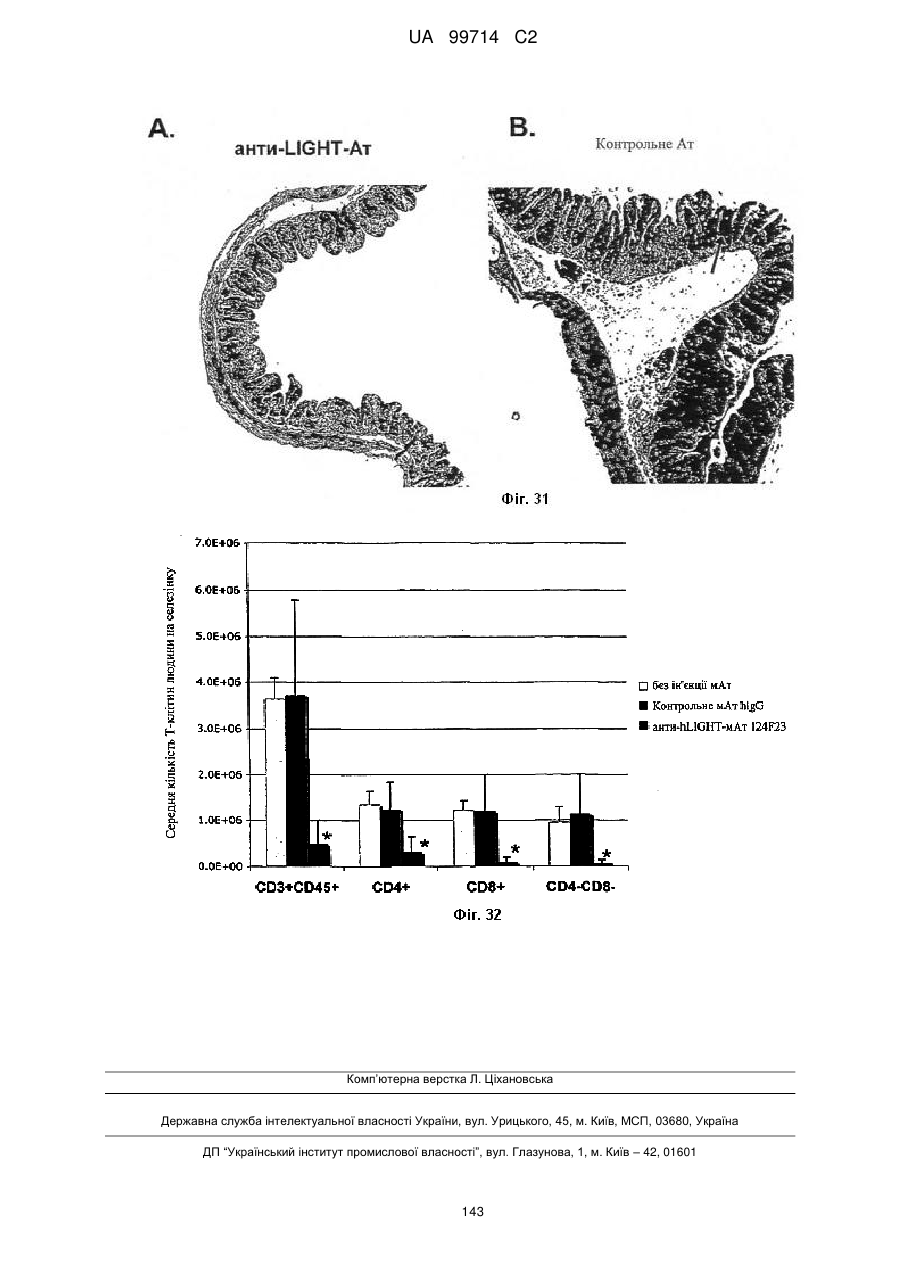
16. Спосіб ослаблення одного або більше симптомів запального захворювання кишечнику (IBD) у людини, яка потребує такого ослаблення, що включає введення людині ефективної кількості композиції за п. 11.
17. Спосіб ослаблення одного або більше симптомів хвороби "трансплантат проти хазяїна" (GVHD) у людини, яка потребує такого ослаблення, що включає введення людині ефективної кількості композиції за п. 11.
18. Набір, що містить антитіло за будь-яким з пп. 1-10.
19. Набір, що містить композицію за п. 11.
Текст
Реферат: Винахід належить до ізольованого антитіла, що специфічно зв'язується з LIGHT (hLIGHT), молекули нуклеїнової кислоти, що його кодує, вектора, клітини-хазяїна, одержання антитіла, композиції, що його містить. Винахід також належить до ослаблення одного або більше симптомів запального захворювання кишечнику (IBD) у яка потребує такого ослаблення, та способу ослаблення одного або більше симптомів "трансплантат проти хазяїна" (GVHD) у людини. людини способу способу людини, хвороби UA 99714 C2 (12) UA 99714 C2 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 У даному винаході запропоновані антитіла, які імуноспецифічно зв'язуються з поліпептидом LIGHT людини (hLIGHT) (лімфотоксин-подібний, проявляє експресію, що індукується, і конкурує з глікопротеїном D HSV за HVEM, рецептор, що експресується T-лімфоцитами), фрагментом поліпептиду hLIGHT або іншим епітопом hLIGHT. У деяких варіантах антитіла є повністю людськими антитілами, переважно, повністю людськими моноклональними антитілами, які імуноспецифічно зв'язуються з поліпептидом hLIGHT, фрагментом поліпептиду hLIGHT або епітопом hLIGHT. Також запропоновані ізольовані нуклеїнові кислоти, що кодують антитіла, які імуноспецифічно зв'язуються з поліпептидом hLIGHT, фрагментом поліпептиду hLIGHT або епітопом hLIGHT. Винахід, крім того, стосується векторів і клітин-хазяїнів, що містять нуклеїнові кислоти, що кодують антитіла, які імуноспецифічно зв'язуються з поліпептидом hLIGHT, фрагментом поліпептиду hLIGHT або епітопом hLIGHT, а також способів одержання антитіл, які імуноспецифічно зв'язуються з поліпептидом hLIGHT, фрагментом поліпептиду hLIGHT або епітопом hLIGHT. Також запропоновані способи застосування анти-hLIGHT-антитіл, пропонованих у даному винаході, для інгібування біологічної активності hLIGHT in vivo і/або для лікування або іншого впливу на hLIGHT-опосередковане захворювання у пацієнта. РІВЕНЬ ТЕХНІКИ LIGHT (лімфотоксин-подібний, проявляє експресію, що індукується, і конкурує з глікопротеїном D HSV за HVEM, рецептор, що експресується T-лімфоцитами) є однією з можливих мішеней цитокінів, що залучена до процесів хронічних запальних аутоімунних захворювань (Mauri et al. 1998 Immunity 8: 21-30). Як представник суперсімейства лігандів TNF (TNFSF), пептид LIGHT також відомий як TNFSF14 або CD258. LIGHT експресується на поверхні T-клітин при активації строго регульованим чином, з'являючись у межах 4 годин, досягаючи піку до 12-24 годин і зникаючи до 48 годин (Castellano et al. 2002 J. Biol. Chem. 277: 42841-51). Однак, LIGHT також конститутивно є присутнім на рівні, що реєструється, на поверхні незрілих дендритних клітин (Tamada et al. 2000 J. Immunol. 164: 4105-10) і на T-клітинах і клітинахприродних кілерах (NK) у кишечнику (Cohavy et al. 2005 J. Immunol. 174: 646-53). LIGHT опосередковує свої біологічні ефекти завдяки зв'язуванню з трьома рецепторами суперсімейства TNF, включаючи рецептор лімфотоксину β (LTβR) (Crowe et al. 1994 Science 264: 707-10, Browning et al. 1997 J. Immunol. 159: 3288-98), медіатор проникнення вірусу герпесу (HVEM) (Montgomery et al. 1996 Cell 87(3): 427-36) і рецептор-пастку 3 (DcR3) (Yu et al. 1999 J. Biol. Chem. 274: 13733-6). У мишей, яких лікували інгібуючим злитим білком LTβR-Fc, знижувалися симптоми high запалення у моделі коліту на основі перенесення T-клітин CD4+CD45RB , патології, опосередкованої T-клітинами CD4+ (Mackay et al. 1998 Gastroenterology 115 1464-75). Також показано, що конститутивна специфічна для трансгенних T-клітин експресія LIGHT також приводить до тяжкого запалення кишечнику з аутоімуно-подібною патологією, подібною до запального захворювання кишечнику (IBD) у людини (Wang et al. 2005 J. Immunol. 174: 8173-82, Shaikh et al. 2001 J. Immunol. 167: 6330-7, Wang et al. 2001 J. Immunol. 167: 5099-105, Wang et al. 2004 J. Clin. Invest. 113: 826-35). Лімфоцити, що експресують LIGHT, можуть індукувати IBDподібні симптоми (наприклад, профілі цитокінів, що відповідають хворобі Крона, виразки, що розтріскуються, ілеїт і підвищення IFN-γ і TNF в ободовій кишці) у тому випадку, коли клітини кишкових лімфатичних вузлів від трансгенних за LIGHT тварин переносять RAG-/- (Wang et al. 2005 J. Immunol. 174: 8173-82). У випадку захворювання людини збільшення експресії LIGHT спостерігали у пацієнтів з хворобою Крона в активній стадії (Cohavy et al. 2005 J. Immunol. 174: 646-53, Wang et al. 2005 J. Immunol. 174: 8173-82, Wang et al. 2004 J. Clin. Invest. 113: 826-35, Cohavy et al. 2004 J. Immunol. 173 251-8). Також показано, що рівень LIGHT підвищений у Tклітинах кишечнику у пацієнтів з IBD (Cohavy et al. 2004 J. Immunol. 173: 251-8). Генетичні дані також свідчать про роль LIGHT в IBD (Granger et al. 2001 J. Immunol. 167: 5122-8); (Rioux et al. 2000 Am. J. Hum. Genet. 66: 1863-70; Low et al. 2004 Inflamm. Bowel Dis. 10: 173-81; Bonen and Cho 2003 Gastroenterology 124: 521-36). Крім того, показано, що передача сигналу CCL20-CCR6 залучена до IBD, і LIGHT індукує секрецію CCL20 з епітеліальних клітин ободової кишки людини лінії HT29.14s. У дослідженнях на людині виявлено, що епітеліальні клітини ободової кишки є основним джерелом CCL20 у пацієнтів з IBD, і експресія CCL20 зростає у людей, хворих на IBD (Kwon et al. 2002 Gut 51: 81826, Kaser et al. 2004 J. Clin. Immunol. 24: 74-85). hLIGHT також залучений до хвороби "трансплантат проти хазяїна" (GVHD). Наприклад, показано, що LIGHT забезпечує сильну костимулюючу активність для T-клітин, підсилюючи проліферацію і продукування цитокінів Th1, незалежні від шляху B7-CD28 (див., наприклад, Tamada et al. 2000 J. Immunol. 164: 4105-4110). Блокування костимуляції LIGHT-HVEM або моноклональними анти-HVEM-антитілами, HVEM-Ig, або злитим білком LTβR інгібує відповіді 1 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 алогенних T-клітин (див., наприклад, Tamada et al. 2000 J. Immunol. 164: 4105-4110, Harrop et al. 1998 J. Immunol. 161: 1786). Крім того, введення in vivo LTβR-Ig або мишачих анти-LIGHTантитіл інгібує відповіді цитотоксичних T-лімфоцитів проти хазяїна (CTL) у моделі гострого GVHD у мишей (Tamada et al. 2000 Nat. Med. 6: 283-289). Хоча спостереження, такі як спостереження, обговорювані вище, свідчать про роль LIGHT у запальних розладах, таких як IBD або GVHD, поки що не одержані антитіла людини проти LIGHT людини і не показано, що які-небудь анти-hLIGHT-антитіла людини або моноклональні анти-hLIGHT-антитіла є антагоністичними стосовно біологічної активності hLIGHT. По суті продовжує існувати необхідність у виявленні способів терапії, таких як анти-LIGHT-терапія, застосовних для лікування запальних захворювань у людини. Цитування або обговорення посилань у даному описі не слід розцінювати як допущення того, що зазначене є попереднім рівнем техніки стосовно даного винаходу. СУТЬ ВИНАХОДУ У даному винаході запропоновані антитіла, такі як повністю людські антитіла, які імуноспецифічно зв'язуються з поліпептидом hLIGHT, фрагментом поліпептиду hLIGHT або епітопом hLIGHT. Також запропоновані ізольовані нуклеїнові кислоти, що кодують антитіла, такі як повністю людські антитіла, які імуноспецифічно зв'язуються з поліпептидом hLIGHT, фрагментом поліпептиду hLIGHT або епітопом hLIGHT. Крім того, запропоновані вектори і клітини-хазяїни, що містять нуклеїнові кислоти, що кодують антитіла, такі як повністю людські антитіла, які імуноспецифічно зв'язуються з поліпептидом hLIGHT, фрагментом поліпептиду hLIGHT або епітопом hLIGHT. Запропоновані також способи одержання антитіл, таких як повністю людські антитіла, які імуноспецифічно зв'язуються з поліпептидом hLIGHT, фрагментом поліпептиду hLIGHT або епітопом hLIGHT. У даному винаході запропонований також спосіб лікування опосередкованого hLIGHT захворювання, що включає в себе введення антитіла, такого як повністю людське антитіло, що імуноспецифічно зв'язується з поліпептидом hLIGHT, фрагментом поліпептиду hLIGHT або епітопом hLIGHT. У переважних варіантах антиhLIGHT-антитіла, пропоновані у даному описі, є антагоністичними антитілами, які ослаблюють, нейтралізують або іншим чином інгібують біологічну активність hLIGHT in vivo (наприклад, опосередковані hLIGHT продукування або секрецію CCL20, IL-8 або RANTES з клітин, що експресують ліганд hLIGHT, такий як рецептор hLIGHT (наприклад, HVEM, LTβR і/або DcR3)). Антитіло відповідно до винаходу може являти собою повнорозмірне антитіло або антигензв'язувальний фрагмент антитіла. Антитіла відповідно до винаходу також застосовні для виявлення hLIGHT, а також для ослаблення, нейтралізації або інгібування іншим чином активності hLIGHT, наприклад, у людини, яка страждає від розладу, при якому шкідлива активність hLIGHT. Таким чином, в одному аспекті даного винаходу запропоноване ізольоване антитіло, що імуноспецифічно зв'язується з поліпептидом hLIGHT (наприклад, hLIGHT, що експресується на клітинній поверхні, або розчинним hLIGHT), фрагментом поліпептиду hLIGHT або епітопом hLIGHT. У деяких варіантах антитіло імуноспецифічно зв'язується з (a) тримерним (або нативним) епітопом hLIGHT, (b) мономерним (або денатурованим) епітопом hLIGHT, (c) як з тримерним епітопом hLIGHT, так і з мономерним епітопом hLIGHT, (d) тримерним епітопом hLIGHT, але не з мономерним епітопом hLIGHT, або (e) мономерним епітопом hLIGHT, але не з тримерним епітопом hLIGHT. У переважних варіантах антитіло імуноспецифічно зв'язує тримерний епітоп hLIGHT, але не мономерний епітоп hLIGHT людини. У переважних варіантах антитіло являє собою антитіло E1, антитіло E13, антитіло E63, антитіло F19 або антитіло F23. Гібридоми, які продукують кожне з антитіл E1, E13, E63, F19 і F23, депонували за умовами Будапештського договору в Американській колекції типових культур (ATCC, 10801 University Blvd., Manassas, VA 20110-2209) 12 липня 2006 (номери доступу ATCC PTA-7729 (гібридома 124 E1) і PTA-7728 (гібридома 124 F23), відповідно), 17 серпня 2006 (номери доступу ATCC PTA7818 (гібридома 124 E63) і PTA-7819 (гібридома 124 F19)) і 23 серпня 2006 (номер доступу ATCC PTA-7842 (гібридома 124 E13)) і включені у даний опис у вигляді посилання. Антитіла, що продукуються кожною з гібридом 124 E1, 124 E13, 124 E63, 124F19 і 124 F23, також можуть бути названі у даному описі E1, E13, E63, F19, F23, відповідно, і/або зазначені під номерами доступу в ATCC PTA-7729, PTA-7842, PTA-7818, PTA-7819 і PTA-7728, відповідно. Зазначені антитіла, гібридоми, способи одержання антитіл і способи застосування таких антитіл включені в обсяг винаходу. У конкретних варіантах антитіло відповідно до винаходу являє собою антитіло, що конкурентно блокується (наприклад, залежним від дози чином) антитілом E1, антитілом E13 і/або антитілом E63 стосовно зв'язування з поліпептидом hLIGHT (наприклад, hLIGHT, що експресується на клітинній поверхні, або розчинним hLIGHT), фрагментом hLIGHT або епітопом 2 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 hLIGHT. В інших варіантах антитіло конкурентно блокується (наприклад, залежним від дози чином) антитілом F19 і/або антитілом F23 стосовно зв'язування з поліпептидом hLIGHT (наприклад, hLIGHT, що експресується на клітинній поверхні, або розчинним hLIGHT), фрагментом hLIGHT або епітопом hLIGHT. У конкретних варіантах антитіло конкурентно блокується (наприклад, залежним від дози чином) антитілом E1, антитілом E13 і/або антитілом E63, але конкурентно не блокується (наприклад, залежним від дози чином) антитілом F19 і/або антитілом F23 стосовно зв'язування з поліпептидом hLIGHT (наприклад, hLIGHT, що експресується на клітинній поверхні, або розчинним hLIGHT), фрагментом hLIGHT або епітопом hLIGHT. В інших варіантах антитіло конкурентно блокується (наприклад, залежним від дози чином) антитілом F19 і/або антитілом F23, але конкурентно не блокується (наприклад, залежним від дози чином) антитілом E1, антитілом E13 і/або антитілом E63 стосовно зв'язування з поліпептидом hLIGHT (наприклад, hLIGHT, що експресується на клітинній поверхні, або розчинним hLIGHT), фрагментом hLIGHT або епітопом hLIGHT. Приклади тестів стосовно конкурентного блокування наведені у даному описі у розділі "Приклади". У даному винаході запропоновані також антитіла або антигензв'язувальні фрагменти антитіл, які імуноспецифічно зв'язуються з поліпептидом hLIGHT (наприклад, hLIGHT, що експресується на клітинній поверхні, або розчинним hLIGHT), фрагментом поліпептиду hLIGHT або епітопом hLIGHT. У деяких варіантах антитіло або антигензв'язувальний фрагмент містить ланцюг VH, ланцюг VL, домен VH, домен VL, CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL і/або CDR3 VL антитіл E1, E13, E63, F19 або F23. У деяких варіантах антитіло або його антигензв'язувальний фрагмент містить менше шести CDR. У деяких варіантах антитіло або його антигензв'язувальний фрагмент містить або складається з однієї, двох, трьох, чотирьох або п'яти CDR, вибраних з групи, що складається з CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL і/або CDR3 VL. У конкретних варіантах антитіло або його антигензв'язувальний фрагмент містить або складається з однієї, двох, трьох, чотирьох або п'яти CDR, вибраних з групи, що складається з CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL і/або CDR3 VL антитіл E1, E13, E63, F19 або F23. У даному винаході запропоновані також фармацевтичні композиції, що містять анти-hLIGHTантитіло відповідно до винаходу, таке як E1, E13, E63, F19 або F23. У конкретних варіантах антитіло відповідно до винаходу являє собою повністю людське антитіло, моноклональне антитіло, рекомбінантне антитіло, антагоністичне антитіло або будьяку їх комбінацію. У конкретних варіантах антитіло являє собою повністю людське антитіло, таке як повністю людське моноклональне антитіло або його антигензв'язувальний фрагмент, що імуноспецифічно зв'язується з hLIGHT. У переважних варіантах антитіло є антагоністичним антитілом. У деяких варіантах антитіло конкурує (наприклад, залежним від дози чином) з HVEM, LTβR, DcR3 або їх злитими білками (наприклад, Fc:HVEM, Fc:LTβR або Fc:DcR3) за зв'язування з поліпептидом hLIGHT, таким як поліпептид hLIGHT, що експресується на клітинній поверхні, або розчинний поліпептид hLIGHT, фрагмент поліпептиду hLIGHT або епітоп hLIGHT. Приклади тестів стосовно блокування наведені у даному описі у розділі "Приклади". У другому аспекті даного винаходу запропоновані ізольовані нуклеїнові кислоти, що кодують антитіла, які імуноспецифічно зв'язуються з поліпептидом hLIGHT (наприклад, hLIGHT, що експресується на клітинній поверхні, або розчинним hLIGHT), фрагментом поліпептиду hLIGHT або епітопом hLIGHT. У деяких варіантах нуклеїнова кислота кодує VH-ланцюг, VL-ланцюг, VHдомен, VL-домен, CDR1 VH, CDR2 VH, CDR3 VH, CDR1 VL, CDR2 VL і/або CDR3 VL антитіл E1, E13, E63, F19 або F23. У третьому аспекті даного винаходу запропоновані вектори і клітини-хазяїни, що містять нуклеїнові кислоти, що кодують антитіла, які імуноспецифічно зв'язуються з поліпептидом hLIGHT, фрагментом поліпептиду hLIGHT або епітопом hLIGHT. У четвертому аспекті даного винаходу запропоновані способи одержання антитіл, які імуноспецифічно зв'язуються з поліпептидом hLIGHT, фрагментом поліпептиду hLIGHT або епітопом hLIGHT. У деяких варіантах антитіло імуноспецифічно зв'язується з варіантом поліпептиду hLIGHT, обумовленим однонуклеотидним поліморфізмом (SNP), таким як 214E32S, 214K-32S, 214E-32L і/або 214K-32L. У даному винаході запропоновані також гібридоми, які продукують антитіла, які імуноспецифічно зв'язуються з поліпептидом hLIGHT або його SNPваріантом. У переважних варіантах гібридома являє собою гібридому, що продукує E1, E13, E63, F19 або F23. У п'ятому аспекті даного винаходу запропоновані способи лікування або іншим чином ослаблення одного або декількох симптомів hLIGHT-опосередкованого захворювання у суб'єкта (наприклад, у людини), що включають в себе введення суб'єкту ефективної кількості антитіла, 3 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 що імуноспецифічно зв'язується з поліпептидом hLIGHT (наприклад, hLIGHT, що експресується на клітинній поверхні, або розчинним hLIGHT), при цьому активність hLIGHT інгібується антитілом. У деяких варіантах hLIGHT-опосередкованим захворюванням є IBD, таке як хвороба Крона або виразковий коліт. В інших варіантах hLIGHT-опосередкованим захворюванням є GVHD. У шостому аспекті даного винаходу запропоновані способи зниження або інгібування зв'язування hLIGHT з HVEM, LTβR і/або DcR3 у суб'єкта (наприклад, у людини), що включають в себе введення суб'єкту ефективної кількості антитіла, що імуноспецифічно зв'язується з поліпептидом hLIGHT (наприклад, hLIGHT, що експресується на клітинній поверхні, або розчинним hLIGHT). У сьомому аспекті даного винаходу запропоновані способи зниження або інгібування біологічної активності hLIGHT, такої як секреція CCL20, IL8 і/або RANTES у суб'єкта (наприклад, у людини), що включають в себе введення суб'єкту ефективної кількості антитіла, що імуноспецифічно зв'язується з поліпептидом hLIGHT (наприклад, hLIGHT, що експресується на клітинній поверхні), при цьому біологічна активність hLIGHT знижується або інгібується антитілом. У восьмому аспекті даного винаходу запропоновані способи зниження або інгібування зв'язування hLIGHT з HVEM, LTβR і/або DcR3 у клітині, що має експресований на клітинній поверхні hLIGHT, здійснюючи контактування клітини з ефективною кількістю антитіла, що імуноспецифічно зв'язується з поліпептидом hLIGHT (наприклад, hLIGHT, що експресується на клітинній поверхні, або розчинним hLIGHT), таким як поліпептид hLIGHT, фрагмент поліпептиду hLIGHT або епітоп hLIGHT. У дев'ятому аспекті даного винаходу запропоновані способи зниження або інгібування біологічної активності hLIGHT, такої як секреція CCL20, IL8 і/або RANTES, у клітині, що має експресований на клітинній поверхні рецептор hLIGHT (такий як HVEM, LTβR і/або Dc3R), здійснюючи контактування клітини з ефективною кількістю антитіла, що імуноспецифічно зв'язується з поліпептидом hLIGHT (наприклад, hLIGHT, що експресується на клітинній поверхні, або розчинним hLIGHT, або його SNP-варіантом), при цьому біологічна активність hLIGHT знижується або інгібується антитілом. У десятому аспекті даного винаходу запропоноване антитіло, що імуноспецифічно зв'язується з поліпептидом hLIGHT, фрагментом поліпептиду hLIGHT або епітопом hLIGHT, при цьому зазначене антитіло додатково містить мітку, що реєструється. У деяких варіантах антиhLIGHT-антитіла, які містять мітку, що реєструється, використовують у способі реєстрації hLIGHT у зразку, при цьому зазначений спосіб включає в себе здійснення контакту зразка з анти-hLIGHT-антитілом. У конкретних варіантах зразок містить клітину, що експресує hLIGHT на поверхні клітини. В одинадцятому аспекті даного винаходу запропоновані набори, що містять антитіло, яке імуноспецифічно зв'язується з поліпептидом hLIGHT, фрагментом поліпептиду hLIGHT або епітопом hLIGHT. ТЕРМІНОЛОГІЯ Якщо не зазначено особливо, всі технічні і наукові терміни, використовувані у даному описі, мають таке ж значення, що звичайно має на увазі фахівець у даній галузі. Всі патенти, заявки, опубліковані заявки та інші публікації включені у вигляді посилання у повному обсязі. У тому випадку, коли існує множина визначень для використовуваного у даному описі терміну, переважають ті, які наведені у даному розділі, якщо не зазначено інше. Термін "близько" або "приблизно" означає у межах 20 %, переважно у межах 10 % і більш переважно у межах 5 % (або 1 % або менше) від заданого значення або діапазону. У використовуваному у даному описі значенні "вводити" або "введення" стосується акту ін'єкції або іншої фізичної доставки речовини, що існує поза організмом (наприклад, антиhLIGHT-антитіло, пропоноване у винаході) пацієнту, наприклад, через слизову оболонку, інтрадермальної, внутрішньовенної, внутрішньом'язової доставки і/або будь-якого іншого способу фізичної доставки, описаного у даній публікації або відомого у даній галузі. При лікуванні захворювання або його симптому, введення речовини звичайно здійснюють після прояву захворювання або його симптомів. У випадку профілактики захворювання або його симптомів введення речовини звичайно здійснюють до прояву захворювання або його симптомів. У контексті поліпептиду термін "аналог" у використовуваному у даному описі значенні стосується поліпептиду, що має функцію, подібну до або ідентичну функції поліпептиду hLIGHT, фрагмента поліпептиду hLIGHT або анти-hLIGHT-антитіла, але не обов'язково містить амінокислотну послідовність, подібну до або ідентичну амінокислотній послідовності 4 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 поліпептиду hLIGHT, фрагмента поліпептиду hLIGHT або анти-hLIGHT-антитіла, або має структуру, подібну до або ідентичну структурі поліпептиду hLIGHT, фрагмента поліпептиду hLIGHT або анти-hLIGHT-антитіла. Поліпептид, що має подібну амінокислотну послідовність, стосується поліпептиду, який відповідає, щонайменше, одному з наступних поліпептидів: (a) поліпептид, що має амінокислотну послідовність, яка щонайменше на 30 %, щонайменше на 35 %, щонайменше на 40 %, щонайменше на 45 %, щонайменше на 50 %, щонайменше на 55 %, щонайменше на 60 %, щонайменше на 65 %, щонайменше на 70 %, щонайменше на 75 %, щонайменше на 80 %, щонайменше на 85 % і переважно щонайменше на 90 %, більш переважно щонайменше на 95 % або найбільш переважно щонайменше на 99 % ідентична амінокислотній послідовності поліпептиду hLIGHT (наприклад, SEQ ID NO: 52), фрагмента поліпептиду hLIGHT або анти-hLIGHT-антитіла, описаного у даній публікації; (b) поліпептид, що кодується нуклеотидною послідовністю, яка гібридизується у жорстких умовах з нуклеотидною послідовністю, що кодує поліпептид hLIGHT, фрагмент поліпептиду hLIGHT або анти-hLIGHTантитіло (або його VH- або VL-область), описані у даній публікації, щонайменше з 5 амінокислотних залишків, щонайменше з 10 амінокислотних залишків, щонайменше з 15 амінокислотних залишків, щонайменше з 20 амінокислотних залишків, щонайменше з 25 амінокислотних залишків, щонайменше з 40 амінокислотних залишків, щонайменше з 50 амінокислотних залишків, щонайменше з 60 амінокислотних залишків, щонайменше з 70 амінокислотних залишків, щонайменше з 80 амінокислотних залишків, щонайменше з 90 амінокислотних залишків, щонайменше зі 100 амінокислотних залишків, щонайменше зі 125 амінокислотних залишків або щонайменше зі 150 амінокислотних залишків (див., наприклад, Sambrook et al. (2001) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; Maniatis et al. (1982) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press, Cold Spring Harbor, NY); і (c) поліпептид, що кодується нуклеотидною послідовністю, яка щонайменше на 30 %, щонайменше на 35 %, щонайменше на 40 %, щонайменше на 45 %, щонайменше на 50 %, щонайменше на 55 %, щонайменше на 60 %, щонайменше на 65 %, щонайменше на 70 %, щонайменше на 75 %, щонайменше на 80 %, щонайменше на 85 % і переважно щонайменше на 90 %, більш переважно щонайменше на 95 % або найбільш переважно щонайменше на 99 % ідентична нуклеотидній послідовності, що кодує поліпептид hLIGHT, фрагмент поліпептиду hLIGHT або анти-hLIGHT-антитіло (або його VH- або VL-область), описані у даній публікації. Поліпептид зі структурою, подібною до структури поліпептиду hLIGHT, фрагмента поліпептиду hLIGHT або анти-hLIGHT-антитіла, описаних у даній публікації, стосується поліпептиду, що має вторинну, третинну або четвертинну структуру, подібну до відповідної структури поліпептиду hLIGHT, фрагмента hLIGHT або hLIGHT-антитіла, описаних у даній публікації. Структуру поліпептиду можна визначити способами, відомими фахівцям у даній галузі, включаючи без обмеження рентгенівську кристалографію, ядерно-магнітний резонанс і кристалографічну електронну мікроскопію. Щоб визначити ідентичність у відсотках двох амінокислотних послідовностей або двох послідовностей нуклеїнової кислоти, послідовності вирівнюють з метою оптимального порівняння (наприклад, можуть бути введені пробіли у послідовність першої амінокислотної послідовності або послідовності нуклеїнової кислоти для оптимального вирівнювання з другою амінокислотною послідовністю або послідовністю нуклеїнової кислоти). Потім порівнюють амінокислотні залишки або нуклеотиди у відповідних положеннях амінокислот або положеннях нуклеотидів. Коли положення у першій послідовності зайняте таким же амінокислотним залишком або нуклеотидом, що і у відповідному положенні у другій послідовності, то молекули ідентичні за таким положенням. Ідентичність у відсотках між двома послідовностями є функцією кількості ідентичнихположень, наявних в обох послідовностях (тобто % ідентичності = кількість ідентичних положень, що сполучаються/загальна кількість положень х 100 %). В одному варіанті дві послідовності мають однакову довжину. Визначення ідентичності у відсотках між двома послідовностями (наприклад, амінокислотними послідовностями або послідовностями нуклеїнових кислот) також можна здійснити з використанням математичного алгоритму. Переважним необмежувальним прикладом математичного алгоритму, застосовуваним для порівняння двох послідовностей, є алгоритм Karlin and Altschul, 1990, Proc. Natl. Acad. Sci. U.S.A. 87: 2264-2268, модифікований, як описано у Karlin and Altschul, 1993, Proc. Natl. Acad. Sci. U.S.A. 90: 5873 5877. Такий алгоритм включений у програми NBLAST і XBLAST Altschul et al., 1990, J. Mol. Biol. 215: 403. Пошуки нуклеотидів у BLAST можна здійснити, використовуючи установки параметрів програми для нуклеотидів NBLAST, наприклад, рахунок = 100, довжина слова = 12, щоб одержати нуклеотидні послідовності, гомологічні молекулам нуклеїнових кислот відповідно до даного винаходу. Пошук 5 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 білків BLAST можна здійснити, використовуючи установки параметрів програми XBLAST, наприклад, рахунок = 50, довжина слова = 3, щоб одержати амінокислотні послідовності, гомологічні молекулі білка відповідно до даного винаходу. Щоб одержати вирівнювання з пробілами з метою порівняння можна використовувати Gapped BLAST, що описаний в Altschul et al., 1997, Nucleic Acids Res. 25: 3389-3402. Альтернативно, можна використовувати PSI BLAST, щоб здійснити ітераційний пошук, що виявляє віддалені взаємозв'язки між молекулами (там же). При використанні програм BLAST, Gapped BLAST і PSI BLAST можна використовувати параметри відповідних програм (наприклад, XBLAST і NBLAST) за умовчанням (див., наприклад, National Center for Biotechnology Information (NCBI) в Інтернеті ncbi.nlm.nih.gov). Іншим переважним необмежувальним прикладом математичного алгоритму, використовуваного для порівняння послідовностей, є алгоритм Myers and Miller, 1988, CABIOS 4: 11-17. Такий алгоритм включений у програму ALIGN (версія 2.0), що є частиною пакета комп'ютерних програм з вирівнювання послідовностей GCG. У випадку застосування програми ALIGN для порівняння амінокислотних послідовностей можна використовувати матрицю зважених залишків PAM120, штраф за довжину пробілу 12 і штраф за пробіл 4. Ідентичність у відсотках між двома послідовностями можна визначити, використовуючи методики, подібні до методик, описаних вище, допускаючи або не допускаючи пробіли. При розрахунку ідентичності у відсотках звичайно враховують тільки точні збіги. У використовуваному у даному описі значенні "антагоністичний" або "інгібуючий" hLIGHT стосується молекули, яка здатна інгібувати або іншим чином знижувати одну або декілька біологічних активностей hLIGHT, наприклад, у клітині, що експресує hLIGHT, або у клітині, що експресує ліганд hLIGHT, такий як рецептор hLIGHT. Наприклад, у деяких варіантах антитіла відповідно до винаходу є антагоністичними антитілами, які інгібують або іншим чином зменшують секрецію CCL20, IL-8 і/або RANTES з клітини, що має експресований на клітинній поверхні рецептор hLIGHT (наприклад, HVEM, LTβR і/або DcR3), у тому випадку, коли зазначене антитіло контактує із зазначеною клітиною. У деяких варіантах антагоніст hLIGHT (наприклад, антагоністичне антитіло відповідно до винаходу) може, наприклад, діяти за допомогою інгібування або зниження іншим чином активації і/або клітинних шляхів передачі сигналу у клітині, що експресує рецептор hLIGHT, тим самим інгібуючи hLIGHT-опосередковану біологічну активність клітини у порівнянні з hLIGHT-опосередкованою біологічною активністю за відсутності антагоніста. У деяких варіантах антитіла, пропоновані у винаході, є повністю людськими антагоністичними анти-hLIGHT-антитілами, переважно повністю людськими моноклональними антагоністичними анти-hLIGHT-антитілами. Термін "антитіло" та "імуноглобулін" або "Ig" можуть бути використані у даному описі взаємозамінно. Терміни "антитіла, які імуноспецифічно зв'язуються з антигеном hLIGHT", "антитіла, які імуноспецифічно зв'язуються з епітопом hLIGHT", "анти-hLIGHT-антитіла" і аналогічні терміни також використовуються у даному описі взаємозамінно і стосуються антитіл і їх фрагментів, які специфічно зв'язуються з поліпептидом hLIGHT, таким як антиген або епітоп hLIGHT. Антитіло або його фрагмент, що імуноспецифічно зв'язується з антигеном hLIGHT, може перехресно реагувати зі спорідненими антигенами. Переважно антитіло або його фрагмент, що імуноспецифічно зв'язується з антигеном hLIGHT, перехресно не реагує з іншими антигенами. Антитіло або його фрагмент, що імуноспецифічно зв'язується з антигеном hLIGHT, може бути ідентифіковане, наприклад, за допомогою імуноаналізів, BIAcore, або інших способів, відомих фахівцям у даній галузі. Антитіло або його фрагмент специфічно зв'язується з антигеном hLIGHT у тому випадку, коли воно зв'язується з антигеном hLIGHT з більш високою афінністю, ніж з будь-яким перехресно реагуючим антигеном, що визначають, використовуючи експериментальні методики, такі як радіоімуноаналізи (RIA) і твердофазові імуноферментні аналізи (ELISA). Звичайно специфічна або вибірна взаємодія буде давати сигнал, що перевищує фоновий сигнал або шум, щонайменше, у два рази і більш звичайно перевищує фон більш ніж у 10 разів. Обговорення, що стосується специфічності антитіл, див., наприклад, у Paul, ed., 1989, Fundamental Immunology Second Edition, Raven Press, New York, 332-336. Антитіла відповідно до винаходу включають без обмеження синтетичні антитіла, моноклональні антитіла, рекомбінантно одержані антитіла, поліспецифічні антитіла (включаючи біспецифічні антитіла), людські антитіла, гуманізовані антитіла, химерні антитіла, внутрішньоклітинні антитіла, одноланцюжкові Fv (scFv) (наприклад, включаючи моноспецифічні, біспецифічні і т.д.), верблюдизовані антитіла, Fab-фрагменти, F(ab')-фрагменти, зв'язані дисульфідним зв'язком Fv (sdFv), анти-ідіотипічні (анти-Id) антитіла і фрагменти, що зв'язують епітопи, будь-якого із зазначених вище антитіл. Зокрема, антитіла відповідно до даного винаходу включають молекули імуноглобулінів та імунологічно активні частини молекул імуноглобулінів, тобто антигензв'язувальні домени або молекули, які містять 6 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 антигензв'язувальний сайт, що імуноспецифічно зв'язується з антигеном hLIGHT (наприклад, одну або декілька областей, що визначають комплементарність (CDR) анти-hLIGHT-антитіла). Антитіла відповідно до винаходу можуть належати до будь-якого типу (наприклад, IgG, IgE, IgM, IgD, IgA і IgY), будь-якого класу (наприклад, IgG1, IgG2, IgG3, IgG4, IgA1 і IgA2) або будь-якого підкласу (наприклад, IgG2a і IgG2b) молекули імуноглобуліну. У переважних варіантах hLIGHTантитіла є повністю людськими, такими як повністю людські моноклональні hLIGHT-антитіла. У деяких варіантах антитіла відповідно до винаходу є IgG-антитілами або належать до його класу (наприклад, IgG1 або IgG4 людини) або підкласу. Термін "антигензв'язувальний домен", "антигензв'язувальна область", "антигензв'язувальний фрагмент" і подібні терміни стосуються такої частини антитіла, що містить амінокислотні залишки, які взаємодіють з антигеном і надають зв'язувальному агенту специфічність і афінність стосовно антигену (наприклад, області, що визначають комплементарність (CDR)). Антигензв'язувальна область може бути одержана від будь-якого виду тварини, такого як гризуни (наприклад, кролик, щур або хом'ячок) і людина. Переважно антигензв'язувальна область може мати людське походження. У використовуваному у даному описі значенні мається на увазі, що термін "композиція" охоплює продукт, що містить специфічні інгредієнти (наприклад, антитіло відповідно до винаходу) необов'язково у конкретній кількості, а також будь-який продукт, що прямо або опосередковано є результатом комбінації конкретних інгредієнтів необов'язково у конкретних кількостях. Термін "константна область" або "константний домен" стосується розташованої на карбоксильному кінці частини легкого і важкого ланцюга, які безпосередньо не залучені до зв'язування антитіла з антигеном, але виконують різні ефекторні функції, такі як взаємодія з рецептором Fc. Терміни стосуються частини молекули імуноглобуліну, що має більш консервативну амінокислотну послідовність у порівнянні з іншою частиною імуноглобуліну, варіабельним доменом, що містить антигензв'язувальну ділянку. Константний домен містить домени CH1, CH2 і CH3 важкого ланцюга і домен CHL легкого ланцюга. У контексті поліпептиду термін "похідне", у використовуваному у даному описі значенні, стосується поліпептиду, що містить амінокислотну послідовність поліпептиду hLIGHT, фрагмента поліпептиду hLIGHT або антитіла, що імуноспецифічно зв'язується з поліпептидом hLIGHT, що був змінений введенням амінокислотних замін, делецій або приєднань. Термін "похідне" у використовуваному у даному описі значенні також стосується поліпептиду hLIGHT, фрагмента поліпептиду hLIGHT або антитіла, що імуноспецифічно зв'язується з поліпептидом hLIGHT, які були хімічно модифіковані, наприклад, ковалентним зв'язуванням будь-якого типу молекули з поліпептидом. Як приклад, але не з метою обмеження, поліпептид hLIGHT, фрагмент поліпептиду hLIGHT або hLIGHT-антитіло можуть бути хімічно модифіковані, наприклад, за допомогою глікозилювання, ацетилювання, пегілювання, фосфорилування, амідування, дериватизації відомими захисними/блокуючими групами, протеолітичного розщеплення, зв'язування з клітинним лігандом або іншим білком і т.д. Похідні модифікують таким чином, що вони відрізняються від таких, що зустрічаються у природі, або вихідних пептидів або поліпептидів або за типом, або за положенням зв'язаних молекул. Похідні додатково мають делецію однієї або декількох хімічних груп, які присутні у природному пептиді або поліпептиді. Похідне поліпептиду hLIGHT, фрагмента поліпептиду hLIGHT або hLIGHTантитіла можна хімічно модифікувати, використовуючи хімічні модифікації, способами, відомими фахівцям у даній галузі, включаючи без обмеження специфічне хімічне розщеплення, ацетилювання, формілування, метаболічний синтез тунікаміцину і т.д. Крім того, похідне поліпептиду hLIGHT, фрагмента поліпептиду hLIGHT або hLIGHT-антитіла може містити одну або декілька некласичних амінокислот. Похідне поліпептиду має функцію, подібну до або ідентичну функції поліпептиду hLIGHT, фрагмента поліпептиду hLIGHT або hLIGHT-антитіла, описаного у даній публікації. Термін "ефективна кількість" у використовуваному у даному описі значенні стосується кількості терапевтичного засобу (наприклад, антитіла або фармацевтичної композиції, пропонованої у даному винаході), що є достатньою для зниження і/або ослаблення тяжкості і/або тривалості даного захворювання, і/або пов'язаного з ним симптому. Зазначений термін також охоплює кількість, необхідну для зниження або ослаблення розвитку або прогресування даного захворювання, зниження або ослаблення рецидиву, розвитку або прояву даного захворювання і/або для поліпшення або посилення профілактичного або терапевтичного ефекту (ефектів) іншого терапевтичного засобу (наприклад, іншого терапевтичного засобу, відмінного від анти-hLIGHT-антитіла, пропонованого у даному винаході). У деяких варіантах ефективна кількість антитіла відповідно до винаходу складає приблизно від 0,1 мг/кг (мг 7 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 антитіла на кг маси тіла суб'єкта) до приблизно 100 мг/кг. У деяких варіантах ефективна кількість антитіла, пропонованого у даному винаході, складає приблизно 0,1 мг/кг, приблизно 0,5 мг/кг, приблизно 1 мг/кг, приблизно 3 мг/кг, приблизно 5 мг/кг, приблизно 10 мг/кг, приблизно 15 мг/кг, приблизно 20 мг/кг, приблизно 25 мг/кг, приблизно 30 мг/кг, приблизно 35 мг/кг, приблизно 40 мг/кг, приблизно 45 мг/кг, приблизно 50 мг/кг, приблизно 60 мг/кг, приблизно 70 мг/кг, приблизно 80 мг/кг, приблизно 90 мг/кг або приблизно 100 мг/кг (або значення у зазначеному діапазоні). У деяких варіантах "ефективна кількість", у використовуваному у даному описі значенні, також стосується кількості антитіла відповідно до винаходу, необхідної для досягнення конкретного результату (наприклад, інгібування біологічної активності hLIGHT клітини, такого як інгібування секреції CCL20, IL-8 або RANTES з клітини). Термін "епітоп" у використовуваному у даному описі значенні стосується локалізованої області на поверхні антигену, такого як поліпептид hLIGHT або фрагмент поліпептиду hLIGHT, яка може бути зв'язана з однією або декількома антигензв'язувальними областями антитіла і яка має антигенну або імуногенну активність у тварини, переважно ссавця і найбільш переважно у людини, що здатна викликати імунну відповідь. Епітоп, що має імуногенну активність, є частиною поліпептиду, що викликає гуморальну відповідь у тварини. Епітоп, що має антигенну активність, є частиною поліпептиду, з яким антитіло імуноспецифічно зв'язується, що визначають будь-яким способом, добре відомим у даній галузі, наприклад, за допомогою імуноаналізів, описаних у даній публікації. Антигенні епітопи необов'язково повинні бути імуногенними. Епітопи звичайно складаються з хімічно активних поверхневих угрупувань молекул, таких як амінокислоти або бічні ланцюги цукрів, і мають специфічні тривимірні структурні характеристики, а також специфічні характеристики стосовно заряду. Область поліпептиду, що здійснює внесок в епітоп, може являти собою амінокислоти поліпептиду, які безперервно йдуть одна за одною, або епітоп може являти собою об'єднання двох або більше несуміжних областей поліпептиду. Епітоп може бути тривимірною поверхневою ознакою антигену або не бути таким. У деяких варіантах епітоп hLIGHT є тривимірною поверхневою ознакою поліпептиду hLIGHT (наприклад, у тримерній формі поліпептиду hLIGHT). В інших варіантах епітоп hLIGHT є лінійною ознакою поліпептиду hLIGHT (наприклад, у тримерній формі або мономерній формі поліпептиду hLIGHT). Антитіла, пропоновані у даномувинаході, можуть імуноспецифічно зв'язуватися з епітопом мономерної (денатурованої) форми hLIGHT, епітопом тримерної (нативної) форми hLIGHT або з обома формами - мономерною (денатурованою) формою і тримерною (нативною) формою hLIGHT. У конкретних варіантах антитіла, пропоновані у даному винаході, імуноспецифічно зв'язуються з епітопом тримерної форми hLIGHT, але не імуноспецифічно зв'язуються з мономерною формою hLIGHT. Термін "ексципієнт" у використовуваному у даному описі значенні стосується інертних речовин, які звичайно використовують як розріджувач, наповнювач, консерванти, зв'язувальні речовини або стабілізуючий агент для лікарських засобів, і включає без обмеження білки (наприклад, сироватковий альбумін і т.д.), амінокислоти (наприклад, аспарагінову кислоту, глутамінову кислоту, лізин, аргінін, гліцин, гістидин і т.д.), жирні кислоти і фосфоліпіди (наприклад, алкілсульфонати, каприлати і т.д.), поверхнево-активні речовини (наприклад, SDS, полісорбат, неіоногенну поверхнево-активну речовину і т.д.), сахариди (наприклад, сахарозу, мальтозу, трегалозу і т.д.) і поліоли (наприклад, маніт, сорбіт і т.д.). Також див. публікацію Remington's Pharmaceutical Sciences (1990) Mack Publishing Co., Easton, PA, що включена у даний опис у вигляді посилання у повному обсязі. У контексті пептиду або поліпептиду термін "фрагмент" у використовуваному у даному описі значенні стосується пептиду або поліпептиду, що містить амінокислотну послідовність, меншу, ніж повнорозмірна. Такий фрагмент може бути, наприклад, результатом укорочення на амінокінці, укорочення на карбоксильному кінці і/або внутрішньої делеції залишку (залишків) з амінокислотної послідовності. Фрагменти можуть виникати, наприклад, у результаті альтернативного сплайсингу РНК або у результаті протеазної активності in vivo. У деяких варіантах фрагменти hLIGHT включають в себе поліпептиди, що містять амінокислотну послідовність, щонайменше, з 5 сусідніх амінокислотних залишків, щонайменше, з 10 сусідніх амінокислотних залишків, щонайменше, з 15 сусідніх амінокислотних залишків, щонайменше, з 20 сусідніх амінокислотних залишків, щонайменше, з 25 сусідніх амінокислотних залишків, щонайменше, з 40 сусідніх амінокислотних залишків, щонайменше, з 50 сусідніх амінокислотних залишків, щонайменше, з 60 сусідніх амінокислотних залишків, щонайменше, з 70 сусідніх амінокислотних залишків, щонайменше, з 80 сусідніх амінокислотних залишків, щонайменше, з 90 сусідніх амінокислотних залишків, щонайменше, зі 100 сусідніх амінокислотних залишків, щонайменше, зі 125 сусідніх амінокислотних залишків, щонайменше, зі 150 сусідніх амінокислотних залишків, щонайменше, зі 175 сусідніх амінокислотних залишків, щонайменше, 8 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 з 200 сусідніх амінокислотних залишків або, щонайменше, з 250 сусідніх амінокислотних залишків амінокислотної послідовності поліпептиду hLIGHT або антитіла, що імуноспецифічно зв'язується з поліпептидом hLIGHT. У конкретному варіанті фрагмент поліпептиду hLIGHT або антитіла, що імуноспецифічно зв'язується з антигеном hLIGHT, зберігає щонайменше 1, щонайменше 2 або щонайменше 3 функції поліпептиду або антитіла. Терміни "повністю людське антитіло" або "антитіло людини" використовуються у даному описі взаємозамінно і стосуються антитіла, що містить варіабельну область людини і найбільш переважно константну область людини. У конкретних варіантах терміни стосуються антитіла, що містить варіабельну область і константну область людини. "Повністю людські" анти-hLIGHTантитіла у деяких варіантах також можуть охоплювати антитіла, які зв'язують поліпептиди hLIGHT і кодуються послідовностями нуклеїнових кислот, які являють собою соматичні варіанти, що зустрічаються у природі, послідовності нуклеїнової кислоти імуноглобуліну людини зародкової лінії. У конкретному варіанті анти-hLIGHT-антитіла, пропоновані у даному винаході, є повністю людськими антитілами. Термін "повністю людське антитіло" включає антитіла, що мають варіабельні і константні області, які відповідають послідовностям імуноглобулінів людини зародкової лінії, які описані у Kabat et al. (Див. Kabat et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Приклади способів одержання повністю людських антитіл наведені, наприклад, у даному описі у розділі "Приклади", але можна використовувати будь-який спосіб, відомий у даній галузі. Термін "рекомбінантне антитіло людини" означає антитіла людини, які одержані, експресовані, створені або виділені способами, що базуються на рекомбінації, наприклад, антитіла, експресовані з використанням рекомбінантного експресуючого вектора, трансфікованого у клітину-хазяїна, антитіла, виділені з комбінаторної бібліотеки рекомбінантних антитіл людини, антитіла, виділені з організму тварини (наприклад, миші або корови), яка є трансгенною і/або трансхромосомною за генами імуноглобуліну людини (див., наприклад, Taylor, L. D. et al. (1992) Nucl. Acids Res. 20: 6287-6295), або антитіла, одержані, експресовані, створені або виділені будь-яким іншим способом, що полягає у зрощуванні послідовностей генів імуноглобулінів людини з іншими послідовностями ДНК. Такі рекомбінантні антитіла людини можуть мати варіабельні і константні області, одержані з послідовностей імуноглобулінів зародкової лінії людини (див. Kabat, E. A. et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Однак, у деяких варіантах такі рекомбінантні антитіла людини піддають мутагенезу in vitro (або, у випадку використання тварини, трансгенної за послідовностями Ig людини, соматичному мутагенезу in vivo), і, відповідно амінокислотні послідовності VH- і VL-областей рекомбінантних антитіл являють собою послідовності, які, незважаючи на те, що вони одержані і є спорідненими з послідовностями VH і VL зародкової лінії людини, можуть не бути присутніми у репертуарі антитіл зародкової лінії людини in vivo. Термін "злитий білок" у використовуваному у даному описі значенні стосується поліпептиду, що містить амінокислотну послідовність антитіла і амінокислотну послідовність гетерологічного поліпептиду або білка (тобто поліпептиду або білка, що не є у нормі частиною антитіла (наприклад, не є антитілом проти антигену hLIGHT)). Термін "злиття" при використанні стосовно hLIGHT або анти-hLIGHT-антитіла стосується з'єднання пептиду або поліпептиду або його фрагмента, варіанта і/або похідного з гетерологічним пептидом або поліпептидом. Переважно, злитий білок зберігає біологічну активність hLIGHT або анти-hLIGHT-антитіла. У деяких варіантах злитий білок містить VH-домен, VL-домен, CDR VH (одну, дві або три CDR VH) і/або CDR VL (одну, дві або три CDR VL) hLIGHT-антитіла, при цьому злитий білок імуноспецифічно зв'язується з епітопом hLIGHT. Термін "важкий ланцюг" при використанні стосовно антитіла стосується п'яти різних типів, називаних альфа (α), дельта (δ), епсилон (ε), гамма (γ) і мю (μ), на підставі амінокислотної послідовності константного домену важкого ланцюга. Такі різні типи важких ланцюгів добре відомі і визначають утворення п'яти класів антитіл, IgA, IgD, IgE, IgG і IgM, відповідно, включаючи чотири підкласи IgG, а саме IgG1, IgG2, IgG3 і IgG4. Переважно важкий ланцюг є важким ланцюгом людини. Термін "хазяїн" у використовуваному у даному описі значенні стосується тварини, переважно ссавця і найбільш переважно людини. Термін "клітина-хазяїн" у використовуваному у даному описі значенні стосується конкретної клітини, трансфікованої молекулою нуклеїнової кислоти, і потомства або можливого потомства такої клітини. Потомство такої клітини може бути неідентичним батьківській клітині, трансфікованій молекулою нуклеїновою кислоти, внаслідок мутацій або впливу навколишнього 9 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 середовища, які можуть мати місце у наступних поколіннях, або внаслідок інтеграції молекули нуклеїнової кислоти у геном клітини-хазяїна. Термін "імуномодулюючий засіб" і його варіанти, включаючи без обмеження імуномодулюючі засоби, у використовуваному у даному описі значенні стосується засобу, що модулює імунну систему хазяїна. У деяких варіантах імуномодулюючий засіб є імунодепресантом. У деяких інших варіантах імуномодулюючий засіб є імуностимулятором. Відповідно до винаходу імуностимулюючий засіб, використовуваний у комбінованій терапії відповідно до винаходу, не містить анти-hLIGHT-антитіла або антигензв'язувального фрагмента. Імуномодулюючі засоби включають без обмеження малі молекули, пептиди, поліпептиди, білки, злиті білки, антитіла, неорганічні молекули, міметики і органічні молекули. У використовуваному у даному описі значенні термін "у комбінації" у контексті введення інших терапевтичних засобів стосується застосування більш ніж одного терапевтичного засобу. Використання терміну "у комбінації" не обмежує порядок, в якому терапевтичні засоби вводять суб'єкту, який має інфекцію. Перший терапевтичний засіб може бути введений до (наприклад, за 1 хвилину, 45 хвилин, 30 хвилин, 45 хвилин, 1 годину, 2 години, 4 години, 6 годин, 12 годин, 24 години, 48 годин, 72 години, 96 годин, 1 тиждень, 2 тижні, 3 тижні, 4 тижні, 5 тижнів, 6 тижнів, 8 тижнів або 12 тижнів), одночасно або після (наприклад, через 1 хвилину, 45 хвилин, 30 хвилин, 45 хвилин, 1 годину, 2 години, 4 години, 6 годин, 12 годин, 24 години, 48 годин, 72 години, 96 годин, 1 тиждень, 2 тижні, 3 тижні, 4 тижні, 5 тижнів, 6 тижнів, 8 тижнів або 12 тижнів) введення другого терапевтичного засобу суб'єкту, який мав, має або є сприйнятливим до hLIGHT-опосередкованого захворювання. Будь-який додатковий терапевтичний засіб може бути введений разом з іншими додатковими терапевтичними засобами у будь-якому порядку. У деяких варіантах антитіла відповідно до винаходу можуть бути введені у комбінації з одним або декількома терапевтичними засобами (наприклад, терапевтичними засобами, які не є антитілами відповідно до винаходу, які вводять у наш час для профілактики, лікування, надання допомоги і/або ослаблення захворювання, опосередкованого hLIGHT). Необмежувальними прикладами терапевтичних засобів, які можна вводити у комбінації з антитілом відповідно до винаходу, є анальгетики, анестетики, антибіотики або імуномодулюючі засоби або будь-який інший засіб, перерахований у Фармакопеї США і/або настільному довіднику лікаря. Термін "неорганічна сіль" у використовуваному у даному описі значенні стосується будьяких сполук, що не містять вуглецю, які є результатом заміни частини або всіх атомів водню кислоти металом або групою, що діє подібно до металу, і які часто використовують як засіб для коригування тонічності у фармацевтичних композиціях і препаратах біологічних матеріалів. Найпоширенішими неорганічними солями є NaCl, KCl, NaH2PO4 і т.д. "Ізольоване" або "очищене" антитіло по суті не містить клітинного матеріалу або інших забруднюючих білків з клітинного або тканинного джерела, з якого одержане антитіло, або по суті не містить хімічних попередників або інших хімічних речовин у тому випадку, коли воно синтезоване хімічно. Вираз "по суті не містить клітинного матеріалу" означає препарати антитіла, в яких антитіло відділене від клітинних компонентів клітин, з яких воно виділене або рекомбінантно одержане. Таким чином, антитіло, що по суті не містить клітинного матеріалу, включає препарати антитіла, які містять менш ніж приблизно 30 %, 20 %, 10 % або 5 % (сухої маси) гетерологічного білка (також називаного у даному описі "забруднюючим білком"). У тому випадку, коли антитіло одержують рекомбінантно, воно також переважно по суті не містить культурального середовища, тобто об'єм культурального середовища становить менш ніж приблизно 20 %, 10 % або 5 % від об'єму препарату білка. Коли антитіло одержують хімічним синтезом, воно переважно по суті не містить хімічних попередників або інших хімічних речовин, тобто воно відділене від хімічних попередників або інших хімічних речовин, які використовуються у синтезі білка. Відповідно, такі препарати антитіла містять менш ніж приблизно 30 %, 20 %, 10 %, 5 % (сухої маси) хімічних попередників або інших сполук, відмінних від антитіла, що представляє інтерес. У переважному варіанті антитіла відповідно до винаходу є ізольованими або очищеними. "Ізольована" молекула нуклеїнової кислоти являє собою молекулу, що відділена від інших молекул нуклеїнових кислот, які присутні у природному джерелі молекули нуклеїнової кислоти. Крім того, "ізольована" молекула нуклеїнової кислоти, така як молекула кДНК, по суті може не містити іншого клітинного матеріалу або культурального середовища, у тому випадку, коли її одержують способами, що базуються на рекомбінації, або по суті не містить хімічних попередників або інших хімічних речовин у тому випадку, коли її синтезують хімічно. У конкретному варіанті молекула (молекули) нуклеїнової кислоти, що кодує антитіло відповідно до винаходу, є ізольованою або очищеною. 10 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "LIGHT людини", "hLIGHT" або "поліпептид hLIGHT" і подібні терміни стосуються поліпептидів ("поліпептиди", "пептиди" і "білки" використовують у даному описі взаємозамінно), що містять амінокислотну послідовність SEQ ID NO: 52, і споріднених поліпептидів, включаючи їх SNP-варіанти. Споріднені поліпептиди включають алельні варіанти (наприклад, SNPваріанти); варіанти, одержані при сплайсингу; фрагменти; похідні; варіанти із замінами, делеціями та інсерціями; злиті поліпептиди; і гомологи з різних видів, переважно такі, які зберігають активність hLIGHT і/або достатні для того, щоб викликати імунну відповідь проти hLIGHT. Приклади несинонімічних SNP-варіантів включають без обмеження поліпептиди hLIGHT, що містять 214E-32S (глутамінову кислоту у положенні 214 і серин у положенні 32 поліпептиду hLIGHT (наприклад, поліпептиду hLIGHT, представленого у вигляді SEQ ID NO: 52)), 214K-32S, 214E-32L і 214E-32L. Також приклади включають розчинні форми hLIGHT, які достатні для того, щоб викликати імунну відповідь проти hLIGHT (див., наприклад, SEQ ID NO: 53 і SEQ ID NO: 54). Як буде зрозуміло фахівцям у даній галузі, анти-hLIGHT-антитіло відповідно до винаходу може зв'язуватися з поліпептидом hLIGHT, фрагментом поліпептиду, антигеном і/або епітопом, тому що епітоп є частиною більшого антигену, що є частиною більшого фрагмента поліпептиду, що у свою чергу є частиною більшого поліпептиду. hLIGHT може існувати у тримерній (нативній) або мономерній (денатурованій) формі. Терміни "нумерація за Кабатом" і подібні терміни відомі у даній галузі і стосуються системи нумерації амінокислотних залишків, які є більш варіабельними (тобто гіперваріабельними), ніж інші амінокислотні залишки у варіабельних областях важкого і легкого ланцюга антитіла або його антигензв'язувальної частини (Kabat et al. (1971) Ann. NY Acad. Sci. 190: 382-391 і Kabat et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). У випадку варіабельної області важкого ланцюга гіперваріабельна область звичайно знаходиться у межах положень амінокислот 31-35 для CDR1, положень амінокислот 50-65 для CDR2 і положень амінокислот 95-102 для CDR3. У випадку варіабельної області легкого ланцюга гіперваріабельна область звичайно знаходиться у межах положень амінокислот 24-34 для CDR1, положень амінокислот 50-56 для CDR2 і положень амінокислот 89-97 для CDR3. Термін "легкий ланцюг" при використанні стосовно антитіла стосується двох різних типів, називаних каппа (κ) або лямбда (λ), на підставі амінокислотної послідовності константних доменів. Амінокислотні послідовності легкого ланцюга добре відомі у даній галузі. У переважних варіантах легкий ланцюг є легким ланцюгом людини. У використовуваному у даному описі значенні терміни "надати допомогу", "надання допомоги" і "ведення хворого" стосуються корисних ефектів, які суб'єкт одержує у результаті терапії (наприклад, профілактично або терапевтичним засобом), що не приводить до зцілення від інфекції. У деяких варіантах суб'єкту вводять один або декілька терапевтичних засобів (наприклад, профілактичних або терапевтичних засобів, таких як антитіло відповідно до винаходу), щоб "надати допомогу" у випадку hLIGHT-опосередкованого захворювання (наприклад, IBD або GVHD), за наявності одного або декількох його симптомів для того, щоб запобігти прогресуванню або погіршенню стану при захворюванні. Термін "моноклональне антитіло" стосується антитіла, одержаного з популяції гомогенних або по суті гомогенних антитіл, і кожне моноклональне антитіло звичайно буде пізнавати один епітоп антигену. У переважних варіантах "моноклональне антитіло" у використовуваному у даному описі значенні означає антитіло, що продукується однією гібридомою або іншою клітиною, при цьому антитіло імуноспецифічно зв'язується тільки з епітопом hLIGHT, що визначають, наприклад, шляхом ELISA або шляхом іншого аналізу зв'язування антигену або конкурентного зв'язування, відомого у даній галузі або описаного у наведених у даному описі прикладах. Термін "моноклональне" не обмежений яким-небудь конкретним способом одержання антитіла. Наприклад, моноклональні антитіла відповідно до винаходу можуть бути одержані способом, що базується на гібридомах, що описаний у Kohler et al., Nature, 256: 495 (1975), або можуть бути виділені з фагових бібліотек з використанням методики, описаної, наприклад, у даній публікації. Інші способи одержання моноклональних клітинних ліній і моноклональних антитіл, що експресуються ними, добре відомі у даній галузі (див., наприклад, th главу 11 в: Short Protocols in Molecular Biology, (2002) 5 Ed., Ausubel et al., eds., John Wiley and Sons, New York). Інші приклади способів одержання інших моноклональних антитіл наведені у розділі "Приклади" у даному описі. Термін "такий, що зустрічається у природі" або "нативний" при використанні у зв'язку з біологічними матеріалами, такими як молекули нуклеїнових кислот, поліпептиди, клітинихазяїни і тому подібне, стосується матеріалів, які зустрічаються у природі і не створені людиною. 11 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 Термін "фармацевтично прийнятний" у використовуваному у даному описі значенні означає схвалений контролюючим органом федерального уряду або уряду штату або зазначений у списку у фармакопеї США, Європейській фармакопеї або інших загальновідомих фармакопеях для застосування на тваринах і більш конкретно на людині. Термін "поліклональні антитіла" у використовуваному у даному описі значенні стосується популяції антитіл, що виробляються при імунній відповіді на білок, що має багато епітопів, і, отже, означає множину різних антитіл, направлених до того самого і до різних епітопів білка. Способи одержання поліклональних антитіл відомі у даній галузі (див., наприклад, главу 11 в: th Short Protocols in Molecular Biology, (2002) 5 Ed., Ausubel et al., eds., John Wiley and Sons, New York). У використовуваному у даному описі значенні термін "полінуклеотид", "нуклеотид", "нуклеїнова кислота", "молекула нуклеїнової кислоти" та інші подібні терміни використовують взаємозамінно, і терміни охоплюють ДНК, РНК, мРНК і тому подібні. У використовуваному у даному описі значенні терміни "запобігати", "запобігання" і "профілактика" стосуються повного або часткового інгібування розвитку, рецидиву, появи або поширення hLIGHT-опосередкованого захворювання і/або пов'язаного з ним симптому, що є результатом введення терапевтичного засобу або комбінації терапевтичних засобів, пропонованих у даному винаході (наприклад, комбінації профілактичних або терапевтичних засобів, таких як антитіло відповідно до винаходу). У використовуваному у даному описі значенні термін "профілактичний засіб" стосується будь-якого засобу, що може повністю або частково інгібувати розвиток, рецидив, появу або поширення hLIGHT-опосередкованого захворювання і/або пов'язаного з ним симптому у суб'єкта. У деяких варіантах термін "профілактичний засіб" стосується антитіла відповідно до винаходу. У деяких інших варіантах термін "профілактичний засіб" стосується іншого засобу, відмінного від антитіла відповідно до винаходу. Переважно, профілактичним засобом є засіб, який, як відомо, є корисним або застосовувався, або застосовується у наш час для профілактики hLIGHT-опосередкованого захворювання і/або пов'язаного з ним симптому, або перешкоджає появі, розвитку, прогресуванню і/або знижує тяжкість hLIGHT-опосередкованого захворювання і/або пов'язаного з ним симптому. У конкретних варіантах профілактичним засобом є повністю людське анти-hLIGHT-антитіло, таке як повністю людське моноклональне анти-hLIGHT-антитіло. У деяких варіантах відповідно до винаходу "профілактично ефективний титр у сироватці" означає титр у сироватці суб'єкта, переважно людини, що повністю або частково інгібує розвиток, рецидиви, появу або поширення hLIGHT-опосередкованого захворювання і/або пов'язаного з ним симптому у зазначеного суб'єкта. Термін "антиген hLIGHT" стосується такої частини поліпептиду hLIGHT, з якою імуноспецифічно зв'язується антитіло. Антиген hLIGHT також стосується аналога або похідного поліпептиду hLIGHT або його фрагмента, з якими імуноспецифічно зв'язується антитіло. У деяких варіантах антиген hLIGHT є мономерним антигеном hLIGHT або тримерним антигеном hLIGHT. Область поліпептиду hLIGHT, що здійснює внесок в епітоп, може являти собою область, утворену сусідніми амінокислотами поліпептиду, або епітоп може бути утворений двома або більше областями поліпептиду, які не є сусідніми одна відносно одної. Епітоп може бути тривимірною поверхневою ознакою антигену. Локалізована область на поверхні антигену hLIGHT, що здатна викликати імунну відповідь, являє собою епітоп hLIGHT. Епітоп може бути тривимірною поверхневою ознакою антигену або не бути таким. Терміни "захворювання, опосередковане hLIGHT" і "розлад, опосередкований hLIGHT" використовують взаємозамінно, і вони стосуються будь-якого захворювання, яке повністю або частково викликане або є результатом впливу hLIGHT. У деяких варіантах hLIGHT аномально (наприклад, у високому ступені) експресується на поверхні клітини. У деяких варіантах hLIGHT може піддаватися аномальній підвищувальній регуляції у конкретному типі клітин. В інших варіантах нормальна, аномальна або надлишкова передача сигналів у клітині викликана зв'язуванням hLIGHT з лігандом hLIGHT. У деяких варіантах лігандом hLIGHT є рецептор hLIGHT (наприклад, HVEM, LTβR або DcR3), наприклад, рецептор, що експресується на поверхні клітини, такої як епітеліальна клітина ободової кишки. У деяких варіантах захворюванням, опосередкованим hLIGHT, є запальне захворювання кишечнику (IBD), таке як хвороба Крона (CD) або виразковий коліт (UC). В інших варіантах захворюванням, опосередкованим hLIGHT, є хвороба "трансплантат проти хазяїна" (GVHD). "Ліганд hLIGHT" стосується молекули, що зв'язується або іншим способом взаємодіє з hLIGHT. У переважних варіантах лігандом hLIGHT є рецептор hLIGHT. 12 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 Терміни "рецептор hLIGHT" або "рецептор, що зв'язує hLIGHT" використовують у даному описі взаємозамінно, і терміни стосуються рецепторного поліпептиду, що зв'язується з hLIGHT. У конкретних варіантах рецептором hLIGHT є HVEM, FcβR або DcR3. У деяких варіантах рецептор hLIGHT експресується на поверхні клітини, такої як епітеліальна клітина ободової кишки. Термін "сахарид" у використовуваному у даному описі значенні стосується класу молекул, які є похідними багатоатомних спиртів. Сахариди звичайно називають вуглеводами, і вони можуть містити різні кількості одиниць цукру (сахариду), наприклад, моносахариди, дисахариди і полісахариди. Термін "титр у сироватці" у використовуваному у даному описі значенні стосується середнього титру у сироватці у популяції щонайменше 10, переважно щонайменше 20 і найбільш переважно щонайменше 40 суб'єктів, приблизно до 100, 1000 або більше. У використовуваному у даному описі значенні термін "побічні ефекти" охоплює небажані і несприятливі ефекти терапії (наприклад, профілактичним або терапевтичним засобом). Небажані ефекти не обов'язково є шкідливими. Несприятливий ефект терапії (наприклад, профілактичним або терапевтичним засобом) може бути шкідливим або неприємним, або небезпечним. Приклади побічних ефектів включають діарею, кашель, гастроентерит, хрипи, нудоту, блювання, анорексію, спастичні болі у животі, підвищену температуру, біль, втрату маси тіла, зневоднювання, алопецію, віддишку, безсоння, запаморочення, мукозит, нервові і м'язові ефекти, втому, сухість у роті і втрату апетиту, висип або набрякання у місці введення, симптоми, подібні до грипу, такі як підвищення температури, озноб і втома, проблеми травного тракту і алергійні реакції. Додаткові небажані ефекти, які можуть виникати у суб'єктів, численні і th відомі у даній галузі. Багато з них описані у Physician's Desk Reference (60 ed., 2006). Термін "мала молекула" і аналогічні терміни включають без обмеження пептиди, пептидоміметики, амінокислоти, аналоги амінокислот, полінуклеотиди, аналоги полінуклеотидів, нуклеотиди, аналоги нуклеотидів, органічні або неорганічні сполуки (тобто включаючи гетероорганічні і металоорганічні сполуки), що мають молекулярну масу менш ніж приблизно 10000 грамів/моль, органічні або неорганічні сполуки, що мають молекулярну масу менш ніж приблизно 5000 грамів/моль, органічні або неорганічні сполуки, що мають молекулярну масу менш ніж приблизно 1000 грамів/моль, органічні або неорганічні сполуки, що мають молекулярну масу менш ніж приблизно 500 грамів/моль, і солі, складні ефіри та інші фармацевтично прийнятні форми таких сполук. Терміни "стабільність" і "стабільний" у використовуваному у даному описі значенні у контексті рідкого препарату, що містить антитіло, яке імуноспецифічно зв'язується з антигеном hLIGHT, стосується резистентності антитіла у препараті до термічного і хімічного розгортання структури, агрегації, руйнування або фрагментації у даних умовах виробництва, приготування, транспортування і зберігання. "Стабільні" препарати відповідно до винаходу зберігають біологічну активність, що дорівнює або більш висока ніж 80 %, 85 %, 90 %, 95 %, 98 %, 99 % або 99,5 %, у даних умовах виробництва, приготування, транспортування і зберігання. Стабільність антитіла можна оцінити за ступенем агрегації, руйнування або фрагментації способами, відомими фахівцям у даній галузі, включаючи без обмеження капілярний гель-електрофорез у відновлювальних умовах (rCGE), електрофорез у поліакриламідному гелі з додецилсульфатом натрію (SDS-PAGE) і HPSEC, у порівнянні з еталонним антитілом. Загальну стабільність препарату, що містить антитіло, яке імуноспецифічно зв'язується з антигеном hLIGHT, можна оцінити у різних імунологічних аналізах, включаючи, наприклад, ELISA і радіоімуноаналіз, використовуючи специфічний епітоп hLIGHT. У використовуваному у даному описі значенні терміни "суб'єкт" і "пацієнт" використовують взаємозамінно. У використовуваному у даному описі значенні суб'єктом переважно є ссавець, такий як ссавець, що не належить до приматів (наприклад, корови, свині, коні, коти, собаки, щури і т.д.), або примат (наприклад, мавпа і людина), найбільш переважно людина. В одному варіанті суб'єктом є ссавець, переважно людина, що має опосередковане hLIGHT захворювання. В іншому варіанті суб'єктом є ссавець, переважно людина, для якого існує ризик розвитку опосередкованого hLIGHT захворювання. У використовуваному у даному описі значенні "по суті" стосується, щонайменше, приблизно 60 %, щонайменше, приблизно 70 %, щонайменше, приблизно 75 %, щонайменше, приблизно 80 %, щонайменше, приблизно 85 %, щонайменше, приблизно 90 %, щонайменше, приблизно 95 %, щонайменше, приблизно 98 %, щонайменше, приблизно 99 % або приблизно 100 %. Термін "по суті не містить поверхнево-активної речовини" у використовуваному у даному описі значенні стосується препарату антитіла, що імуноспецифічно зв'язується з антигеном hLIGHT у тому випадку, коли зазначений препарат містить менш ніж 0,0005 %, менш ніж 13 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 0,0003 % або менш ніж 0,0001 % поверхнево-активних речовин і/або менш ніж 0,0005 %, менш ніж 0,0003 % або менш ніж 0,0001 % поверхнево-активних речовин. Термін "по суті не містить солі" у використовуваному у даному описі значенні стосується препарату антитіла, що імуноспецифічно зв'язується з антигеном hLIGHT, у тому випадку, коли зазначений препарат містить менш ніж 0,0005 %, менш ніж 0,0003 % або менш ніж 0,0001 % неорганічних солей. Термін "поверхнево-активна речовина" у використовуваному у даному описі значенні стосується органічних речовин, що мають амфіпатичні структури; а саме, вони складаються з груп з протилежною тенденцією до розчинності, звичайно маслорозчинним вуглеводневим ланцюгом і водорозчинною іоногенною групою. Поверхнево-активні речовини можна класифікувати в залежності від заряду поверхнево-активного залишку на аніоногенні, катіоногенні і неіоногенні поверхнево-активні речовини. Поверхнево-активні речовини часто використовують як зволожувачі, емульгатори, солюбілізатори і диспергуючі засоби для різних фармацевтичних композицій і препаратів біологічних матеріалів. У використовуваному у даному описі значенні термін "мітка" стосується будь-якого типу залишку, який зв'язують, наприклад, з поліпептидом і/або полінуклеотидом, що кодує hLIGHT або hLIGHT-антитіло або його антигензв'язувальний фрагмент. Наприклад, полінуклеотид, що кодує hLIGHT, hLIGHT-антитіло або його антигензв'язувальний фрагмент, може містити одну або декілька нуклеотидних послідовностей, що кодують мітку, які кодують, наприклад, залишок, що реєструється, або залишок, що сприяє здійсненню афінного очищення. При транслюванні мітка і антитіло можуть бути у формі злитого білка. Термін "що реєструється" або "реєстрація" у зв'язку з міткою стосується будь-якої мітки, яку можна візуалізувати, або коли наявність мітки можна визначити і/або виміряти іншим способом (наприклад, кількісним аналізом). Необмежувальним прикладом мітки, що реєструється, є флуоресціююча мітка. У використовуваному у даному описі значенні термін "терапевтичний засіб" стосується будьякого засобу, який можна використовувати для лікування, надання допомоги або ослаблення hLIGHT-опосередкованого захворювання і/або пов'язаного з ним симптому. У деяких варіантах термін "терапевтичний засіб" стосується антитіла відповідно до винаходу. У деяких інших варіантах термін "терапевтичний засіб" стосується іншого засобу, відмінного від антитіла відповідно до винаходу. Переважно терапевтичним засобом є засіб, який, як відомо, корисний або був використаний, або використовується у наш час для лікування, надання допомоги або ослаблення hLIGHT-опосередкованого захворювання або одного, або декількох пов'язаних з ним симптомів. У конкретних варіантах терапевтичним засобом є повністю людське антиhLIGHT-антитіло, таке як повністю людське моноклональне анти-hLIGHT-антитіло. Комбінована терапія (наприклад, застосування комбінації профілактичних або терапевтичних засобів) є більш ефективною, ніж адитивні ефекти двох або декількох окремих терапевтичних засобів. Наприклад, синергетична дія комбінації профілактичних і/або терапевтичних засобів дозволяє застосовувати більш низькі дози одного або декількох засобів і/або менш часто вводити зазначені засоби суб'єкту із захворюванням, опосередкованим hLIGHT. Можливість використання більш низьких доз профілактичних або терапевтичних засобів і/або введення зазначених засобів менш часто зменшує токсичність, пов'язану з введенням зазначених терапевтичних засобів суб'єкту, без зниження ефективності зазначених засобів для профілактики, надання допомоги, лікування або ослаблення захворювання, опосередкованого hLIGHT. Крім того, синергетична дія може приводити до більш високої ефективності терапевтичних засобів для профілактики або надання допомоги, лікування або ослаблення захворювання, опосередкованого hLIGHT. Нарешті, синергетична дія комбінації засобів терапії (наприклад, профілактичних або терапевтичних засобів) дозволяє уникати або зменшувати несприятливі або небажані побічні ефекти, пов'язані із застосуванням будь-якого окремого засобу терапії. У деяких варіантах здійснення винаходу "терапевтично ефективний титр у сироватці" означає титр у сироватці суб'єкта, переважно людини, що зменшує тяжкість, тривалість і/або симптоми, пов'язані з опосередкованим hLIGHT захворюванням у зазначеного суб'єкта. У використовуваному у даному описі значенні термін "терапія" стосується будь-якого протоколу, способу і/або засобу, які можна використовувати для профілактики, надання допомоги, лікування і/або ослаблення захворювання, опосередкованого hLIGHT (наприклад, IBD або GVHD). У деяких варіантах терміни "засоби терапії" і "терапія" стосуються біологічної терапії, підтримуючої терапії і/або інших способів терапії, застосовних для профілактики, надання допомоги, лікування і/або ослаблення захворювання, опосередкованого hLIGHT, відомих фахівцеві у даній галузі, наприклад, медичному персоналу. 14 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 У використовуваному у даному описі значенні терміни "лікувати" і "лікування" стосуються зменшення або ослаблення прогресування, тяжкості і/або тривалості опосередкованого hLIGHT захворювання (наприклад, IBD або GVHD) у результаті введення одного або декількох засобів лікування (включаючи без обмеження введення одного або декількох профілактичних або терапевтичних засобів, таких як антитіло відповідно до винаходу). У конкретних варіантах такі терміни стосуються зменшення або інгібування зв'язування hLIGHT з HVEM, зменшення або інгібування зв'язування hLIGHT з LTβR, зменшення або інгібування зв'язування hLIGHT з DcR3, зменшення або інгібування продукування або секреції CCL20 з клітини суб'єкта, що експресує рецептор hLIGHT, зменшення або інгібування продукування або секреції IL-8 з клітини суб'єкта, що експресує рецептор hLIGHT, зменшення або інгібування продукування або секреції RANTES з клітини суб'єкта, що експресує рецептор hLIGHT, і/або інгібування або зменшення одного або декількох симптомів, пов'язаних із захворюванням, опосередкованим hLIGHT, таким як IBD або GVHD. У конкретних варіантах профілактичним засобом є повністю людське анти-hLIGHTантитіло, таке як повністю людське моноклональне анти-hLIGHT-антитіло. Термін "варіабельна область" або "варіабельний домен" стосується частини легких і важких ланцюгів, звичайно амінокінцевих приблизно 120-130 амінокислот у важкому ланцюзі і приблизно 100-110 амінокислот у легкому ланцюзі, які сильно відрізняються за послідовністю у різних антитілах і використовуються у зв'язуванні і забезпеченні специфічності кожного конкретного антитіла стосовно конкретного антигену. Варіабельність послідовностей сконцентрована в областях, називаних областями, що визначають комплементарність (CDR), тоді як більш консервативні області у варіабельному домені називають каркасними областями (FR). CDR легких і важких ланцюгів головним чином відповідальні за взаємодію антитіла з антигеном. Нумерація положень амінокислот, використовувана у даному описі, відповідає EU Index, як у Kabat et al. (1991) Sequences of proteins of immunological interest. (U.S. Department of th Health and Human Services, Washington, D. C.) 5 ed. ("Kabat et al."). У переважних варіантах варіабельна область є варіабельною областю людини. Термін "варіант" при використанні стосовно hLIGHT або hLIGHT-антитіла стосується пептиду або поліпептиду, що містить одну або декілька (наприклад, від приблизно 1 до приблизно 25, від приблизно 1 до приблизно 20 і переважно від приблизно 1 до приблизно 15, більш переважно від приблизно 1 до приблизно 10 і найбільш переважно від приблизно 1 до приблизно 5) замін, делецій і/або додатків в амінокислотній послідовності у порівнянні з нативною або немодифікованою послідовністю. Наприклад, варіант hLIGHT може виникати у результаті однієї або декількох (наприклад, від приблизно 1 до приблизно 25, від приблизно 1 до приблизно 20 і переважно від приблизно 1 до приблизно 15, більш переважно від приблизно 1 до приблизно 10 і найбільш переважно від приблизно 1 до приблизно 5) змін амінокислотної послідовності нативного hLIGHT. Також як приклад варіант анти-hLIGHT-антитіла може виникати у результаті однієї або декількох (наприклад, від приблизно 1 до приблизно 25, від приблизно 1 до приблизно 20 і переважно від приблизно 1 до приблизно 15, більш переважно від приблизно 1 до приблизно 10 і найбільш переважно від приблизно 1 до приблизно 5) змін амінокислотної послідовності нативного або раніше немодифікованого анти-hLIGHT-антитіла. Варіанти можуть бути варіантами, що зустрічаються у природі, такими як алельні варіанти або варіанти сплайсингу, або можуть бути сконструйовані штучно. Поліпептидні варіанти можуть бути одержані з використанням відповідних молекул нуклеїнових кислот, що кодують такі варіанти. У переважних варіантах варіант hLIGHT або варіант hLIGHT-антитіла зберігає функціональну активність hLIGHT або hLIGHT-антитіла, відповідно. У конкретних варіантах здійснення винаходу варіант hLIGHT-антитіла імуноспецифічно зв'язує hLIGHT і/або є антагоністичним стосовно активності hLIGHT. У деяких варіантах здійснення винаходу варіант кодується варіантом hLIGHT, обумовленим однонуклеотидним поліморфізмом (SNP). Приклад SNP-варіанту hLIGHT кодує або глутамінову кислоту (E), або лізин (K) у положенні амінокислоти 214. Інший приклад SNP-варіанту hLIGHT кодує або серин (S), або лейцин (L) у положенні амінокислоти 32. КОРОТКИЙ ОПИС КРЕСЛЕНЬ На фіг. 1A-1B зображений цитометричний аналіз ендогенно експресованого hLIGHT з використанням анти-hLIGHT-антитіл людини. (A) Лінію T-клітин людини II-23.D7 активували PMA та іономіцином протягом ночі і забарвлювали відносно маркера активації CD69 у комбінації з різними анти-hLIGHT-антитілами. CD69-позитивні клітини пропускали і аналізували стосовно забарвлювання hLIGHT (жирна лінія) у порівнянні з контрольним IgG1 людини проти вірусу грипу (пунктирна лінія) або забарвлювання неактивованих клітин II23.D7 анти-hLIGHTантитілами (сіра лінія). Зв'язування виявляли, використовуючи друге антитіло кози проти IgG людини-APC. (B) Забарвлювання активованої лінії T-клітин людини II-23.D7 анти-hLIGHT 15 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 антитілами людини є насичуваним. Активовані клітини II-23.D7 мітили анти-hLIGHT-антитілами людини у різних концентраціях і виявляли з використанням анти-IgG людини-APC. Показано графіки середніх геометричних значень інтенсивності флуоресценції поряд з нелінійною регресією. На фіг. 2A-2B зображене забарвлювання рекомбінантного hLIGHT на лінії клітин EL4-hLIGHT анти-hLIGHT-антитілами людини. На фіг.(A) і (B) ступінчасто змінювані кількості анти-hLIGHTантитіл використовували для забарвлювання клітин EL4-hLIGHT, виявляли з використанням анти-IgG людини-APC і аналізували проточною цитометрією. Визначали середнє геометричне значення інтенсивності флуоресценції (MFI) і застосовували нелінійний регресійний аналіз. У всіх експериментах антитіло людини проти білка M2 вірусу грипу використовували як негативний контроль. Дані, одержані у результаті такого аналізу, представлені на фіг. 3. На фіг. 3 зображені характеристики моноклональних анти-hLIGHT-антитіл людини. На фіг. 4 зображене перехресне блокування антитілами, виявлене шляхом ELISA. У такому аналізі визначають дві групи на підставі конкуренції за зв'язування з hLIGHT в ELISA. Окремими антитілами покривали ямки 96-ямкового планшета. Розчинний FLAG-hLIGHT попередньо інкубували з розчинними анти-hLIGHT-антитілами і потім додавали у покриті ямки. Зв'язування FLAG-hLIGHT з нанесеним у вигляді покриття антитілом виявляли з використанням анти-FLAGIgG-HRP. Інгібування у відсотках визначали, використовуючи OD кожного зразка у наступній формулі: % інгібування = (максимум - зразок/максимум) х 100. На фіг. 5A-5B зображена блокада зв'язування HVEM:Fc людини з нативним hLIGHT на клітинній поверхні моноклональними анти-hLIGHT-антитілами людини. У випадку (A) і (B) ступінчасто змінювані кількості антитіл інкубували з клітинами EL4-hLIGHT, додавали біотинільований HVEM:Fc людини у субнасичувальній концентрації і виявляли, використовуючи SA-APC. Як показано на фіг.(A), антитіло людини проти M2 вірусу грипу використовували як контроль. На фіг. 6A-6B зображена блокада зв'язування LTβR:Fc людини з нативним hLIGHT на клітинній поверхні моноклональними анти-hLIGHT-антитілами людини. У випадку (A)-(B) ступінчасто змінювані кількості антитіл інкубували з клітинами EL4-hLIGHT, додавали полі-Hisмічений LTβR:Fc людини у субнасичувальній концентрації і виявляли, використовуючи анти-HisAPC. Як показано на фіг.(A), антитіло людини проти M2 вірусу грипу використовували як контроль. На фіг. 7 зображена опосередкована hLIGHT секреція CCL20 з епітеліальних клітин ободової кишки людини. Рекомбінантний розчинний hLIGHT додавали у середовище росту клітин HT29.14s у зростаючих концентраціях. Ростове середовище збирали на 3 день після обробки і визначали рівні CCL20, використовуючи ELISA. Відрізки, що характеризують погрішність, зазначені на підставі двох незалежних обробок. На фіг. 8 зображена опосередкована hLIGHT секреція IL-8 і секреція RANTES з епітеліальних клітин ободової кишки людини. Рекомбінантний розчинний hLIGHT, TNF, LTα 1β2 і FLAG-BAP (як негативний контроль) додавали у середовище росту клітин HT29.14s. Ростове середовище збирали з різних ямок у 1, 2 і 3 дні після обробки. Рівні IL-8 і RANTES визначали шляхом ELISA. FLAG-мічену бактеріальну лужну фосфатазу (FLAG-BAP) використовували як мічений нерелевантний білок для негативного контролю. На фіг. 9A-9B показано, що анти-hLIGHT-антитіла людини інгібують опосередковану hLIGHT секрецію CCL20 з епітеліальних клітин ободової кишки людини. (A) Рекомбінантний розчинний hLIGHT (1 мкг/мл) попередньо інкубували з анти-hLIGHT-антитілами і додавали у середовище росту клітин HT29.14s. Ростове середовище збирали з двох ямок у випадку кожної обробки на 3 день. Рівні CCL20 визначали шляхом ELISA. Середовище окремо, розчинний hLIGHT окремо, розчинний hLIGHT, інкубований з антитілом проти M2 вірусу грипу, і кожне анти-hLIGHTантитіло окремо включали як контролі. (B) Нелінійний регресійний аналіз даних, представлених на панелі A. На фіг. 10A-10B показано, що анти-hLIGHT-антитіла людини інгібують опосередковану hLIGHT, що експресується на клітинній поверхні, секрецію RANTES з епітеліальних клітин ободової кишки людини. (A) Фіксовані клітини EL4-hLIGHT попередньо інкубували з антиhLIGHT-антитілами і додавали у середовище росту клітин HT29.14s. Ростове середовище збирали з двох ямок у випадку кожної обробки на 3 день. Рівні RANTES визначали шляхом ELISA. Середовище окремо, клітини EL4-hLIGHT окремо, розчинний hLIGHT окремо і кожне анти-hLIGHT-антитіло окремо включали як контролі. (B) Графік даних, представлених на панелі (A). На фіг. 11 зображені результати експериментів з конкурентного блокування зв'язування з hLIGHT. 16 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 На фіг. 12 зображена блокуюча активність антитіл стосовно зв'язування HVEM:Fc з клітинами 293-hLIGHT. Моноклональні анти-hLIGHT-антитіла людини E1, E13, F19, мАт R&D і комерційно доступні поліклональні антитіла кози проти hLIGHT (R&D Systems), і кролячі поліклональні анти-hLIGHT-антитіла (eBioscience) тестували стосовно їх здатності блокувати зв'язування HVEM:Fc з клітинами 293, що експресують hLIGHT. На фіг. 13 зображена блокуюча активність антитіл стосовно зв'язування LTβR:Fc з клітинами 293-hLIGHT. Моноклональні анти-hLIGHT-антитіла людини E1 і E13, мАт R&D і комерційно доступні поліклональні антитіла кози проти hLIGHT (R&D Systems) і кролячі поліклональні антиhLIGHT-антитіла (eBioscience) тестували стосовно їх здатності блокувати зв'язування LTβR:Fc з клітинами 293, що експресують hLIGHT. На фіг. 14 зображена блокуюча активність антитіл стосовно зв'язування (A) LTβR:Fc і (B) HVEM:Fc з клітинами 293-hLIGHT, і фігура є графічним представленням даних, показаних на фіг. 12 і 13. На фіг. 15A-15B зображене зв'язування різних анти-hLIGHT-антитіл з нативним або денатурованим розчинним hLIGHT. П'ять мікрограмів розчинного LIGHT людини або кип'ятили в 2 х буфері для зразків з SDS (денатурований), або не обробляли (нативний), і потім в обох випадках серійно розбавляли, щоразу 6-кратно. 5 мкл кожного розведення hLIGHT одночасно наносили плямами на гідратовані мембрани PVDF з порами 0,2 мкм (Invitrogen, Carlsbad, CA), використовуючи 8-канальну піпетку. Блотам давали можливість висохнути на повітрі, потім повторно гідратували, блокували (1 х TBST (Тріс-сольовий буфер з твіном-20) + 2,5 % знежиреного молока + 0,02 % азиду натрію). Кожний блот аналізували, використовуючи як зонд 5 мкг/мл кожного першого антитіла. Блоти 3 рази промивали в 1х TBST, потім додавали біотинільовані другі Ат (біотин-антитіло кози проти Ig людини (Vector Labs, Burlingame, CA), біотин-антитіло кози проти Ig миші (Jackson labs, Bar Harbor, ME), біотин-антитіло проти Ig кози (Sigma-Aldrich corp., St. Louis, MO)) у концентрації 5 мкг/мл. Блоти 3 рази промивали в 1х TBST, потім додавали SA-HRP (Amersham Biosciences, Piscataway, NJ). Для реєстрації застосовували хемілюмінесценцію, використовуючи набір для реєстрації ECL (Amersham Biosciences, Piscataway, NJ), і сигнал візуалізували, експонуючи з візуалізуючою плівкою X-OMAT AR (Kodak, Rochester, New York). (A) Результати дот-блот-аналізу з використанням анти-hLIGHT-мАт людини E1, E13, E63, F19, F23 або двох мишачих моноклональних анти-hLIGHT-антитіл, комерційно доступних з R&D Systems ("мишачі мАт R&D") і Abnova ("мишачі мАт Abnova"). Антитіло проти M2 (нерелевантний антиген) використовували як негативний контроль. (B) Результати дот-блот-аналізу з використанням комерційного препарату поліклональних антитіл кози проти hLIGHT (R&D Systems, "пАт кози R&D") або двох комерційних препаратів поліклональних кролячих анти-hLIGHT-антитіл (eBioscience ("кролячі пАт eBioscience") і Peprotech ("кролячі пАт Peprotech")). На фіг. 16 зображене зв'язування різних анти-hLIGHT-антитіл з нативним або денатурованим розчинним hLIGHT, і підсумовані дані, представлені на фіг. 15, у формі таблиці. На фіг. 17 показано, що анти-LIGHT-антитіла людини відповідно до винаходу інгібують опосередковану LIGHT секрецію CCL20 з епітеліальних клітин ободової кишки людини, тоді як комерційно доступні мишачі анти-hLIGHT-антитіла не викликають інгібування. Рекомбінантний розчинний LIGHT людини (1 мкг/мл) попередньо інкубували з анти-LIGHT-антитілами і додавали у середовище росту клітин HT29.14s. Ростове середовище збирали з двох ямок у випадку кожної обробки на 3 день. Рівні CCL20 визначали шляхом ELISA. Середовище окремо, розчинний LIGHT окремо, розчинний LIGHT, інкубований з антитілом проти M2 вірусу грипу, неблокуюче анти-LIGHT-Ат B12 і кожне анти-LIGHT-антитіло окремо інкубували як контролі. E1 і F19 є типовими представниками кожної групи, що перехресно блокує зв'язування з епітопом. На фіг. 18 показано, що анти-LIGHT-антитіла людини відповідно до винаходу інгібують опосередковану LIGHT секрецію RANTES з епітеліальних клітин ободової кишки людини, тоді як комерційно доступні мишачі анти-hLIGHT-антитіла не викликають інгібування. Рекомбінантний розчинний LIGHT людини (1 мкг/мл) попередньо інкубували з анти-LIGHT-антитілами і додавали до середовища росту клітин HT29.14s. Ростове середовище збирали з двох ямок у випадку кожної обробки на 3 день. Рівні RANTES визначали шляхом ELISA. Середовище окремо, розчинний LIGHT окремо, розчинний LIGHT, інкубований з антитілом проти M2 вірусу грипу, неблокуючий анти-LIGHT-Ат B12 і кожне анти-LIGHT-антитіло окремо включали як контролі. E1 і F19 є типовими представниками кожної групи, що перехресно блокує зв'язування з епітопом. На фіг. 19A-19B зображений цитометричний аналіз зв'язування експресованого на клітинній поверхні hLIGHT анти-hLIGHT-антитілами людини (A) E1 або (B) F19 у порівнянні з їх рекомбінантними аналогами - каппа-одноланцюжковими антитілами. Клітини 293, що стабільно експресують hLIGHT, інкубували зі зростаючими кількостями анти-LIGHT-антитіл, зазначеними у 17 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 підписі. Зв'язування реєстрували з використанням другого антитіла проти IgG людини-APC. Антитіла очищали або з культур гідридом, або з клітин 293F, тимчасово трансфікованих експресуючими векторами ссавців, що кодують різні кДНК каппа-ланцюга, спарені з геном важкого ланцюга. Показано графіки середніх геометричних значень інтенсивності флуоресценції поряд з нелінійною регресією. На фіг. 20 зображене перехресне блокування в аналізі ELISA, в якому порівнювали каппаодноланцюжкові антитіла з їх вихідними аналогами. У такому аналізі визначають дві групи на основі конкуренції за зв'язування з hLIGHT з використанням аналізу ELISA. Окремими антитілами покривали ямки 96-ямкового планшета. Розчинний FLAG-hLIGHT попередньо інкубували з розчинними анти-hLIGHT-антитілами і потім додавали у покриті ямки. Зв'язування FLAG-hLIGHT з нанесеним у вигляді покриття антитілом визначали, використовуючи антиFLAG-IgG-HRP. Інгібування у відсотках визначали, використовуючи OD кожного зразка у наступній формулі: % інгібування = (максимум - зразок/максимум) х 100. На фіг. 21A-21B зображена блокада зв'язування (A) HVEM:Fc людини або (B) LTβR:Fc людини з нативним hLIGHT на клітинній поверхні моноклональними анти-hLIGHT-антитілами людини і їх рекомбінантними каппа-одноланцюжковими аналогами. Ступінчасто змінювані кількості антитіл інкубували з клітинами EL4-hLIGHT, біотинільованим HVEM:Fc людини або полі-His-міченим LTβR:Fc людини у субнасичувальній концентрації, і потім виявляли, використовуючи SA-APC або анти-His-APC. Антитіла очищали або з культур гібридом, або з клітин 293F, тимчасово трансфікованих експресуючими векторами ссавців, що кодують різні кДНК каппа-ланцюга, спарені з геном важкого ланцюга. На фіг. 22 зображене інгібування опосередкованої hLIGHT секреції CCL20 з епітеліальних клітин ободової кишки людини рекомбінантними каппа-одноланцюжковими анти-LIGHTантитілами людини у порівнянні з антитілами, що продукуються вихідною гібридомою. Рекомбінантний розчинний LIGHT людини (1 мкг/мл) попередньо інкубували з анти-LIGHTантитілами і додавали до середовища росту клітин HT29.14s. Ростове середовище збирали з двох ямок у випадку кожної обробки на 3 день. Рівні CCL20 визначали шляхом ELISA. Середовище окремо, розчинний LIGHT окремо (SHL), розчинний LIGHT, інкубований з антитілом проти M2 вірусу грипу, або кожне антитіло за відсутності розчинного LIGHT, включали як контролі. Антитіла, називані "Elk2", містять E1kappa(B) і "F19k2" містять F19kappa(B). На фіг. 23 показано, що анти-LIGHT-антитіла людини відповідно до винаходу інгібують опосередковану LIGHT секрецію CCL20 з епітеліальних клітин ободової кишки людини, тоді як комерційно доступні мишачі анти-hLIGHT-антитіла або не інгібують (Abnova), або інгібують тільки у дуже високих концентраціях (100 мкг/мл) (R&D). Рекомбінантний розчинний LIGHT людини (1 мкг/мл) попередньо інкубували з анти-LIGHT-антитілами і додавали у середовище росту клітин HT29.14s. Ростове середовище збирали з двох ямок у випадку кожної обробки на 3 день. Рівні CCL20 визначали, використовуючи ELISA. Середовище окремо, розчинний LIGHT окремо (SHL), розчинний LIGHT, інкубований з нерелевантним антитілом проти M2 вірусу грипу, антитіло проти сироваткового альбуміну людини або кожне антитіло за відсутності розчинного LIGHT, включали як контролі. E1 і F19 є типовими представниками кожної групи, що перехресно блокує зв'язування з епітопом. На фіг. 24A-24B зображена частота алелів деяких несинонімічних варіантів hLIGHT, обумовлених однонуклеотидним поліморфізмом (SNP), (A) що кодують глутамінову кислоту (E) або лізин (K) у положенні амінокислоти 214; або (B) що кодують лейцин (L) або серин (S) у положенні амінокислоти 32, у різних етнічних популяціях. Фіг. 25A-25D. На фіг. 25A-25C зображене титрування дозами при забарвлюванні клітинних ліній, що експресують несинонімічні SNP-варіанти LIGHT людини, анти-hLIGHT-антитілами людини 124F23 і 124E1kappa(B). Ступінчасто змінювані кількості анти-hLIGHT-антитіл використовували для забарвлювання клітин EL4-hLIGHT, що експресують SNP-варіант (A) 214E-32S, (B) 214K-32S або (C) 214E-32L, виявляли з використанням анти-IgG людини-APC і аналізували проточною цитометрією. На фіг.(D) зображене титрування дозами у випадку опосередкованої анти-LIGHT-антитілом людини блокади зв'язування HVEM:Fc людини (квадрати) або LTBR:Fc (трикутники) з експресованим на клітинній поверхні SNP-варіантом LIGHT 214K-32S, здійснюваної, як описано на фіг. 5. У випадку (A)-(D) визначали середні геометричні значення інтенсивності флуоресценції (MFI) і застосовували нелінійний регресійний аналіз. На фіг. 26A-26B зображений проточно-цитометричний аналіз клітинних ліній, які експресують несинонімічні SNP-варіанти, з використанням анти-hLIGHT-антитіл людини. (A) Лінію клітин EL4-LIGHT SNP 214E і (B) лінію клітин EL4 SNP 214K забарвлювали, використовуючи одну концентрацію (10 мкг/мл) кожного з анти-hLIGHT-антитіл. Зв'язування 18 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 виявляли за допомогою другого козячого анти-IgG людини-APC антитіла. Контроль ізотипу IgG людини використовували як негативний контроль. На фіг. 27 зображене інгібування анти-hLIGHT-антитілом людини секреції RANTES з епітеліальних клітин ободової кишки людини, опосередкованої експресованим на клітинній 5 поверхні SNP-варіантом hLIGHT. Рекомбінантний розчинний hLIGHT (SHL) (1 мкг/мл) або 510 клітин EL4-hLIGHT з SNP-варіантом 214K або 214E попередньо інкубували з анти-hLIGHTантитілами і додавали у середовище росту клітин HT29.14s. Ростове середовище збирали з двох клітин у випадку кожної обробки на 3 день. Рівні RANTES визначали шляхом ELISA. Середовище окремо, клітини EL4-hLIGHT окремо, розчинний hLIGHT окремо і кожне антиhLIGHT-антитіло окремо включали як контролі. На фіг. 28 зображене схематичне представлення моделі гострого ксеногенного захворювання GVHD. Мишам SCID ін'єктували IL2Rβ-антитіло (TM-β1) у день -2, щоб зменшити кількість клітин NK. У день -1 миші одержували сублетальну дозу опромінення 2,5 Гр. У день 0 миші одержували 10 мільйонів PBMC людини за допомогою внутрішньочеревинної ін'єкції, після якої відразу ж проводили внутрішньовенну ін'єкцію антитіла людини проти LIGHT людини або негативного контрольного антитіла. Мишей зважували з інтервалами у 3-4 дні, і на 12 день мишей умертвляли, і оцінювали макроскопічну патологію. Витягували селезінки для аналізу проточною цитометрією, витягували сліпу кишку для проведення гістології, і збирали сироватку для аналізу цитокінів і антитіл. На фіг. 29 зображена оцінка макроскопічної патології, що спостерігається у моделі гострого ксеногенного захворювання GVHD. Представлена оцінка патології у випадку без ін'єкції моноклонального антитіла (кружечки), у випадку ін'єкції моноклонального анти-hLIGHT-антитіла 124F23 (трикутники) і у випадку контрольного моноклонального IgG1-антитіла людини (квадрати). Оцінки 0, 1, 2 або 3 (немає, слабка, помірна або тяжка, відповідно) застосовують для кожної з трьох категорій: діарея, запалення очеревини/асцити і запалення кишечнику (максимальна загальна оцінка 9). На фіг. 30 зображена оцінка гістопатології, що спостерігається у моделі гострого ксеногенного захворювання GVHD у мишей. Представлена оцінка патології у випадку відсутності ін'єкції мАт (кружечки), у випадку ін'єкції анти-hLIGHT-мАт 124F23 (трикутники) і у випадку контрольного мАт hIgG1 (квадрати). Оцінки 0, 1, 2 або 3 (немає, слабка, помірна або тяжка, відповідно) давали для кожної з чотирьох категорій: тяжкість запалення, об'єм запалення, ушкодження/атрофія ворсинок і відсоток ураження (максимальна загальна оцінка 12). На фіг. 31A-31B зображені типові гістологічні зрізи, забарвлені гематоксиліном і еозином (H&E), сліпої кишки мишей у дослідженні GVHD. (A) Зріз сліпої кишки миші, обробленої антиLIGHT-мАт, і (B) миші, обробленої IgG людини. Інволюція підслизової оболонки свідчить про асцит, пунктирні стрілки вказують області крові, і суцільна стрілка вказує область інфільтрату з лімфоцитів. На фіг. 32 зображена загальна кількість T-клітин у селезінці миші у дослідженні ксеногенного захворювання GVHD. Зірочками вказані значення t-критерію Стьюдента менше 0,05 для порівняння між тваринами, обробленими анти-LIGHT-мАт, і контролями. ДОКЛАДНИЙ ОПИС У даному винаході запропоновані антитіла, які імуноспецифічно зв'язуються з поліпептидом hLIGHT, фрагментом поліпептиду hLIGHTабо епітопом hLIGHT. Запропоновані також ізольовані нуклеїнові кислоти, що кодують антитіла, які імуноспецифічно зв'язуються з поліпептидом hLIGHT, фрагментом поліпептиду hLIGHT або епітопом hLIGHT. Крім того, запропоновані вектори і клітини-хазяїни, що містять нуклеїнові кислоти, що кодують антитіла, які імуноспецифічно зв'язуються з поліпептидом hLIGHT, фрагментом поліпептиду hLIGHT або епітопом hLIGHT. Запропоновані також способи одержання антитіл, які імуноспецифічно зв'язуються з поліпептидом hLIGHT, фрагментом поліпептиду hLIGHT або епітопом hLIGHT. У даному винаході запропонований також спосіб лікування або надання допомоги при hLIGHTопосередкованому захворюванні, що включає в себе введення антитіла, що імуноспецифічно зв'язується з поліпептидом hLIGHT, фрагментом поліпептиду hLIGHT або епітопом hLIGHT. АНТИТІЛА Антитіла відповідно до винаходу включають без обмеження синтетичні антитіла, моноклональні антитіла, рекомбінантно одержані антитіла, поліспецифічні антитіла (включаючи біспецифічні антитіла), людські антитіла, гуманізовані антитіла, химерні антитіла, внутрішньоклітинні антитіла, одноланцюжкові Fv (scFv) (наприклад, включаючи моноспецифічні, біспецифічні і т.д.), верблюдизовані антитіла, Fab-фрагменти, F(ab')-фрагменти, зв'язані 19 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 дисульфідним зв'язком Fv (sdFv), анти-ідіотипічні (анти-Id) антитіла і фрагменти, що зв'язують епітопи, будь-якого з зазначених вище антитіл. Зокрема, антитіла відповідно до даного винаходу включають молекули імуноглобулінів та імунологічно активні частини молекул імуноглобулінів, тобто молекули, які містять антигензв'язувальний сайт, що імуноспецифічно зв'язується з антигеном hLIGHT. Молекули імуноглобулінів відповідно до винаходу можуть належати до будь-якого типу (наприклад, IgG, IgE, IgM, IgD, IgA і IgY), будь-якого класу (наприклад, IgG1, IgG2, IgG3, IgG4, IgA1 і IgA2) або будь-якого підкласу молекули імуноглобуліну. У конкретному варіанті антитіло, пропоноване у винаході, є Ig-антитілом, переважно IgG1 або IgG4. Варіанти і похідні антитіл включають фрагменти антитіл, які зберігають здатність специфічно зв'язуватися з епітопом. Переважні фрагменти включають Fab-фрагменти (фрагмент антитіла, що містить антигензв'язувальний домен і містить легкий ланцюг і частину важкого ланцюга, зв'язаного містком, утвореним дисульфідним зв'язком); Fab" (фрагмент антитіла, що включає в себе один антигензв'язувальний домен, що складає Fab, і додаткову частину важкого ланцюга протягом шарнірної області); F(ab")2 (дві молекули Fab", зв'язані міжланцюжковими дисульфідними зв'язками у шарнірних областях важких ланцюгів; молекули Fab' можуть бути направлені до того самого або до різних епітопів); біспецифічний Fab (молекула Fab, що має два антигензв'язувальних домени, кожний з яких може бути направлений до різних епітопів); одноланцюжковий Fab-ланцюг, що містить варіабельну область, також відому як sFv (варіабельна область, що визначає зв'язування з антигеном, одного легкого і важкого ланцюга антитіла, зв'язаних разом ланцюгом з 10-25 амінокислот); зв'язаний дисульфідним зв'язком Fv або dsFv (варіабельна область, що визначає зв'язування с антигеном, одного легкого і важкого ланцюга антитіла, зв'язаних разом дисульфідним зв'язком); верблюдизовані VH (варіабельна область, що визначає зв'язування антигену, одного важкого ланцюга антитіла, в якому деякі амінокислоти на межі контакту VH являють собою амінокислоти, знайдені у важкому ланцюзі антитіл верблюда, що зустрічаються у природі); біспецифічний sFv (молекула sFv або dsFv, що має два антигензв'язувальних домени, кожний з яких направлений до різних епітопів); діантитіло (димеризований sFv, утворений у результаті утворення комплексу між VH-доменом першого sFv і VL-доменом другого sFv і утворення комплексу між VL-доменом першого sFv і VHдоменом другого sFv; дві антигензв'язувальних області діантитіла можуть бути направлені до того самого або до різних епітопів); і триантитіло (тримеризованний sFv, утворений подібно до діантитіла, але в якому утворюються три антигензв'язувальних домени в одному комплексі; три антигензв'язувальних домени можуть бути направлені до того самого або до різних епітопів). Похідні антитіл також містять одну або декілька послідовностей CDR антигензв'язувальної ділянки антитіла. Послідовності CDR можуть бути зв'язані разом на каркасі у тому випадку, коли присутні дві або більше послідовностей CDR. У деяких варіантах антитіло, застосовуване у винаході, містить одноланцюжковий Fv ("scFv"). scFv являють собою фрагменти антитіл, що містять VH- і VL-домени антитіла, при цьому такі домени знаходяться в одному поліпептидному ланцюзі. Загалом, поліпептид scFv додатково містить поліпептидний лінкер між VH- і VLдоменами, що дозволяє scFv утворювати необхідну структуру для зв'язування антигену. Огляд scFv див. у Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 1 13, Rosenburg and Moore eds. Springer-Verlag, New York, pp. 269-315 (1994). Антитіла відповідно до винаходу можуть бути від будь-якої тварини, включаючи птахів і ссавців (наприклад, людину, мишу, осла, вівцю, кролика, козу, морську свинку, верблюда, коня або курку). У деяких варіантах антитіла відповідно до винаходу є людськими або гуманізованими моноклональними антитілами. У використовуваному у даному описі значенні "людські" антитіла включають антитіла, що мають амінокислотну послідовність імуноглобуліну людини, і включають антитіла, виділені з бібліотеки імуноглобулінів людини або з мишей, які експресують антитіла з генів людини. У переважних варіантах антитіла відповідно до винаходу є повністю людськими антитілами, такими як повністю людські антитіла, які імуноспецифічно зв'язують поліпептид hLIGHT, фрагмент поліпептиду hLIGHT або епітоп hLIGHT. Такі повністю людські антитіла можуть мати переваги у порівнянні з повністю мишачими (або іншими антитілами, що є повністю або частково антитілами інших видів, відмінних від людини), гуманізованими антитілами або химерними антитілами, щоб мінімізувати розвиток небажаних або непотрібних побічних ефектів, таких як імунні відповіді, направлені до не повністю людських антитіл (наприклад, анти-hLIGHTантитіл, одержаних з інших видів) при введенні в організм суб'єкта. Антитіла відповідно до даного винаходу можуть бути моноспецифічними, біспецифічними, триспецифічними або мати більшу поліспецифічність. Поліспецифічні антитіла можуть бути специфічними стосовно різних епітопів поліпептиду hLIGHT або можуть бути специфічними як 20 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 до поліпептиду hLIGHT, так і до гетерологічного епітопу, такого як гетерологічний поліпептид або матеріал твердої основи. У переважних варіантах антитіла, пропоновані у даному винаході, є моноспецифічними стосовно даного епітопу поліпептиду hLIGHT і імуноспецифічно зв'язуються з іншими епітопами. У переважних варіантах антитіла у композиціях, що містять антитіла, і у способах застосування антитіл відповідно до даного винаходу включають антитіло E1, E13, E63, F19 або F23 (номери доступу ATCC PTA-7729, PTA-7842, PTA-7818, PTA-7819 або PTA-7728, відповідно). Також у даному винаході запропоновані гібридоми, які продукують антитіла E1, E13, E63, F19 або F23 (номери доступу ATCC PTA-7729, PTA-7842, PTA-7818, PTA-7819 або PTA7728, відповідно), і/або інші моноклональні анти-hLIGHT-антитіла, описані у даній публікації. У деяких варіантах у винаході запропоноване ізольоване антитіло, що імуноспецифічно зв'язується з епітопом hLIGHT, при цьому зв'язування антитіла з епітопом hLIGHT конкурентно блокується (наприклад, залежним від дози чином): (a) антитілом E1, антитілом E13 або антитілом E63, або (b) антитілом F19 або антитілом F23; за умови, що зв'язування з епітопом hLIGHT не блокується обома антитілами: (a) антитілом E1 і антитілом F19, (b) антитілом E1 і антитілом F23, (c) антитілом E13 і антитілом F19, (d) антитілом E13 і антитілом F23, (e) антитілом E63 і антитілом F19 або (f) антитілом E63 і антитілом F23. Антитіло може бути повністю людським антитілом або може не бути таким. У переважних варіантах антитіло є повністю людським моноклональним анти-hLIGHT-антитілом і ще більш переважно повністю людським моноклональним антагоністичним анти-hLIGHT-антитілом. Приклади тестів конкурентного блокування, які можна використовувати, наведені у розділі "Приклади" у даному описі. В інших варіантах у даному винаході запропоноване ізольоване антитіло, переважно повністю людське антитіло, що імуноспецифічно зв'язується з епітопом hLIGHT, при цьому зв'язування антитіла з епітопом hLIGHT конкурентно блокується (наприклад, залежним від дози чином): (a) антитілом E1, антитілом E13 або антитілом E63, або (b) антитілом F19 або антитілом F23. Антитіло може бути повністю людським антитілом або не бути таким. У переважних варіантах антитіло є повністю людським моноклональним анти-hLIGHT-антитілом, і ще більш переважно повністю людським моноклональним антагоністичним анти-hLIGHT-антитілом. Приклади тестів конкурентного блокування, які можна використовувати, наведені у розділі "Приклади" у даному описі. У деяких варіантах антитіла, пропоновані у даному винаході, конкурують (наприклад, залежним від дози чином) з HVEM, LTβR і/або DcR3 (або їх злитим білком (білками)) за зв'язування з експресованим на клітинній поверхні hLIGHT. В інших варіантах антитіла, пропоновані у винаході, конкурують (наприклад, залежним від дози чином) з HVEM, LTβR і/або DcR3 (або їх злитим білком (білками)) за зв'язування з розчинним hLIGHT. Приклади аналізів конкурентного зв'язування, які можна використовувати, наведені у розділі "Приклади" у даному описі. В одному варіанті антитіло частково або повністю інгібує зв'язування HVEM, LTβR і/або DcR3 з експресованим на клітинній поверхні hLIGHT, таким як hLIGHT. В іншому варіанті антитіло частково або повністю інгібує зв'язування HVEM, LTβR і/або DcR3 з розчинним hLIGHT. У деяких варіантах антитіла, пропоновані у даному винаході, частково або повністю інгібують секрецію CCL20 IL-8, і/або RANTES з клітини, що має експресований на клітинній поверхні ліганд hLIGHT, такий як рецептор hLIGHT (наприклад, HVEM, LTβR і/або DcR3). У деяких варіантах клітиною, що експресує рецептор hLIGHT, є епітеліальна клітина ободової кишки. Антитіла відповідно до даного винаходу включають антитіла і антигензв'язувальні фрагменти наступних антитіл: антитіло E1 (номер доступу ATCC PTA-7729), антитіло E13 (номер доступу ATCC PTA-7842) або антитіло E63 (номер доступу ATCC PTA-7818), антитіло F19 (номер доступу ATCC PTA-7819) або антитіло F23 (номер доступу ATCC PTA-7728), описані у розділі "Приклади" і в інших розділах даної заявки. У конкретному варіанті антитілом відповідно до даного винаходу є антитіло E1, E13, E63, F19 або F23. В іншому варіанті антитіло відповідно до винаходу містить антигензв'язувальний фрагмент (наприклад, Fab-фрагмент) E1, E13, E63, F19 або F23. Переважно антитіла відповідно до винаходу є повністю людськими моноклональними антитілами, такими як повністю людські моноклональні антагоністичні антитіла, які імуноспецифічно зв'язуються з hLIGHT. У деяких варіантах антитіла, пропоновані у даному винаході, зв'язуються з епітопом hLIGHT, що є тривимірною поверхневою ознакою поліпептиду hLIGHT (наприклад, у тримерній формі поліпептиду hLIGHT). Область поліпептиду hLIGHT, що здійснює внесок в епітоп, може являти собою ділянку з амінокислот поліпептиду, що йдуть одна за одною, або епітоп може бути утворений двома або більше областями поліпептиду, що не йдуть одна за одною. Епітоп 21 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 hLIGHT може бути в (a) тримерній формі ("тримерний епітоп hLIGHT") hLIGHT, (b) мономерній формі ("мономерний епітоп hLIGHT") hLIGHT, (c) і у тримерній, і у мономерній формі hLIGHT, (d) у тримерній формі, але не у мономерній формі hLIGHT, або (e) у мономерній формі, але не у тримерній формі hLIGHT. Наприклад, у деяких варіантах епітоп є присутнім або доступний для зв'язування антиhLIGHT-антитілом тільки у тримерній (нативній) формі, але не є присутнім або не доступний для зв'язування анти-hLIGHT-антитілом у мономерній (денатурованій) формі. В інших варіантах епітоп hLIGHT є лінійною ознакою поліпептиду hLIGHT (наприклад, у тримерній формі або мономерній формі поліпептиду hLIGHT). Антитіла, пропоновані у даному винаході, можуть імуноспецифічно зв'язуватися (a) з епітопом мономерної форми hLIGHT, (b) з епітопом тримерної форми hLIGHT, (с) з епітопом мономерної, але не тримерної форми hLIGHT, (d) з епітопом тримерної, але не мономерної форми hLIGHT, або (e) з обома, мономерною формою і тримерною формою hLIGHT. У переважних варіантах антитіла, пропоновані у даному винаході, імуноспецифічно зв'язуються з епітопом тримерної форми hLIGHT, але імуноспецифічно не зв'язуються з епітопом мономерної форми hLIGHT. У конкретному варіанті даний винахід стосується одного або декількох антитіл, які імуноспецифічно зв'язуються з епітопом hLIGHT, при цьому зазначені антитіла містять VHланцюг і/або VL-ланцюг, що мають амінокислотні послідовності VH-ланцюга і/або VL-ланцюга антитіла E1, E13, E63, F19 і/або F23; або антитіла, що продукується гібридомою, що має номери доступу ATCC PTA-7729, PTA-7842, PTA-7818, PTA-7819 або PTA-7728. В іншому варіанті даний винахід стосується одного або декількох антитіл, які імуноспецифічно зв'язуються з епітопом hLIGHT, при цьому зазначені антитіла містять VHдомен і/або VL-домен, що мають амінокислотні послідовності VH-домену і/або VL-домену антитіла E1, E13, E63, F19 і/або F23; або антитіла, що продукується гібридомою, що має номери доступу ATCC PTA-7729, PTA-7842, PTA-7818, PTA-7819 або PTA-7728. В іншому варіанті даний винахід стосується антитіл, які імуноспецифічно зв'язуються з епітопом hLIGHT, при цьому зазначені антитіла містять одну, дві, три або більше CDR, що мають амінокислотну послідовність однієї, двох, трьох або більше CDR антитіла E1, E13, E63, F19 і/або F23; або антитіла, що продукується гібридомою, що має номери доступу ATCC PTA7729, PTA-7842, PTA-7818, PTA-7819 або PTA-7728. В одному варіанті даний винахід стосується одного або декількох антитіл, які імуноспецифічно зв'язуються з епітопом hLIGHT, при цьому зазначені антитіла містять комбінацію CDR VH і/або CDR VL, що мають амінокислотну послідовність CDR VH і/або CDR VL антитіла E1, E13, E63, F19 і/або F23; або антитіла, що продукується гібридомою, що має номери доступу ATCC PTA-7729, PTA-7842, PTA-7818, PTA-7819 або PTA-7728. Даний винахід стосується антитіл, які імуноспецифічно зв'язуються з епітопом hLIGHT, при цьому зазначені антитіла містять VH-ланцюг і/або VL-ланцюг, що має амінокислотну послідовність VH-ланцюга і/або VL-ланцюга, відповідно, антитіла, що імуноспецифічно зв'язується з епітопом hLIGHT, при цьому зв'язування антитіла з епітопом hLIGHT конкурентно блокується залежним від дози чином: (a) антитілом E1, E13 або E63, або (b) антитілом F19 або F23; за умови, що зв'язування з епітопом hLIGHT не блокується обома антитілами: (a) антитілом E1 і F19, (b) антитілом E1 і F23, (c) антитілом E13 і F19, (d) антитілом E13 і F23, (e) антитілом E63 і F19 або (f) антитілом E63 і F23. Даний винахід також стосується повністю людських антитіл, які імуноспецифічно зв'язуються з епітопом hLIGHT, при цьому зазначені антитіла містять VH-ланцюг і/або VL-ланцюг, що має амінокислотну послідовність VH-ланцюга і/або VL-ланцюга, відповідно, антитіла, що імуноспецифічно зв'язується з епітопом hLIGHT, при цьому зв'язування антитіла з епітопом hLIGHT конкурентно блокується залежним від дози чином: (a) антитілом E1, антитілом E13 або антитілом E63, або (b) антитілом F19 або антитілом F23. Переважно повністю людське антитіло є повністю людським моноклональним антитілом і/або антагоністичним hLIGHT-антитілом. Даний винахід стосується антитіл, які імуноспецифічно зв'язуються з епітопом hLIGHT, при цьому антитіла містять VH-домен і/або VL-домен, що має амінокислотну послідовність VHдомену і/або VL-домену, відповідно, антитіла, що імуноспецифічно зв'язується з епітопом hLIGHT, при цьому зв'язування антитіла з епітопом hLIGHT конкурентно блокується залежним від дози чином: (a) антитілом E1, E13 або E63, або (b) антитілом F19 або F23; за умови, що зв'язування з епітопом hLIGHT не блокується обома антитілами: (a) антитілом E1 і F19, (b) антитілом E1 і F23, (c) антитілом E13 і F19, (d) антитілом E13 і F23, (e) антитілом E63 і F19 або (f) антитілом E63 і F23. Даний винахід також стосується повністю людських антитіл, які імуноспецифічно зв'язуються з епітопом hLIGHT, при цьому зазначені антитіла містять VH-домен і/або VL-домен, що має 22 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 амінокислотну послідовність VH-домену і/або VL-домену, відповідно, антитіла, що імуноспецифічно зв'язується з епітопом hLIGHT, при цьому зв'язування антитіла з епітопом hLIGHT конкурентно блокується залежним від дози чином: (a) антитілом E1, антитілом E13 або антитілом E63, або (b) антитілом F19 або антитілом F23. Переважно повністю людське антитіло є повністю людським моноклональним антитілом і/або антагоністичним hLIGHT-антитілом. Даний винахід стосується антитіл, які імуноспецифічно зв'язуються з епітопом hLIGHT, при цьому зазначені антитіла містять одну, дві або три CDR VH (тобто CDR1 VH, CDR2 VH і/або CDR3 VH), що мають амінокислотну послідовність однієї, двох або трьох CDR VH, відповідно, антитіла, що імуноспецифічно зв'язується з епітопом hLIGHT, при цьому зв'язування антитіла з епітопом hLIGHT конкурентно блокується залежним від дози чином: (a) антитілом E1, E13 або E63, або (b) антитілом F19 або F23; за умови, що зв'язування з епітопом hLIGHT не блокується обома антитілами: (a) антитілом E1 і F19, (b) антитілом E1 і F23, (c) антитілом E13 і F19, (d) антитілом E13 і F23, (e) антитілом E63 і F19 або (f) антитілом E63 і F23. Даний винахід також стосується повністю людських антитіл, які імуноспецифічно зв'язуються з епітопом hLIGHT, при цьому зазначені антитіла містять одну, дві або три CDR VH (тобто CDR1 VH, CDR2 VH і/або CDR3 VH), що мають амінокислотну послідовність однієї, двох або трьох CDR VH, відповідно, антитіла, що імуноспецифічно зв'язується з епітопом hLIGHT, при цьому зв'язування антитіла з епітопом hLIGHT конкурентно блокується залежним від дози чином: (a) антитілом E1, антитілом E13 або антитілом E63, або (b) антитілом F19 або антитілом F23. Переважно повністю людське антитіло є повністю людським моноклональним антитілом і/або антагоністичним hLIGHT-антитілом. Даний винахід стосується антитіл, які імуноспецифічно зв'язуються з епітопом hLIGHT, при цьому зазначені антитіла містять одну, дві або три CDR VL (тобто CDR1 VL, CDR2 VL і/або CDR3 VL), що мають амінокислотну послідовність однієї, двох або трьох CDR VL, відповідно, антитіла, що імуноспецифічно зв'язується з епітопом hLIGHT, при цьому зв'язування антитіла з епітопом hLIGHT конкурентно блокується залежним від дози чином: (a) антитілом E1, E13 або E63, або (b) антитілом F19 або F23; за умови, що зв'язування з епітопом hLIGHT не блокується обома антитілами: (a) антитілом E1 і F19, (b) антитілом E1 і F23, (c) антитілом E13 і F19, (d) антитілом E13 і F23, (e) антитілом E63 і F19 або (f) антитілом E63 і F23. Даний винахід також стосується повністю людських антитіл, які імуноспецифічно зв'язуються з епітопом hLIGHT, при цьому зазначене антитіло містить одну, дві або три CDR VL (тобто CDR1 VL, CDR2 VL і/або CDR3 VL), що мають амінокислотну послідовність однієї, двох або трьох CDR VL, відповідно, антитіла, що імуноспецифічно зв'язується з епітопом hLIGHT, при цьому зв'язування антитіла з епітопом hLIGHT конкурентно блокується залежним від дози чином: (a) антитілом E1, антитілом E13 або антитілом E63, або (b) антитілом F19 або антитілом F23. Переважно повністю людське антитіло є повністю людським моноклональним антитілом і/або антагоністичним hLIGHT-антитілом. Даний винахід також стосується антитіл, які імуноспецифічно зв'язуються з епітопом hLIGHT, при цьому зазначені антитіла містять одну або декілька CDR VH (тобто CDR1 VH, CDR1 VH і/або CDR3 VH), що мають амінокислотну послідовність будь-якої з CDR VH (тобто CDR1 VH, CDR2 VH і/або CDR3 VH) антитіла E1, E13, E63, F19 і/або F23; або антитіла, що продукується гібридомою, що має номери доступу ATCC PTA-7729, PTA-7842, PTA-7818, PTA-7819 або PTA7728; або їх комбінацію. В одному варіанті антитіла, які імуноспецифічно зв'язуються з епітопом hLIGHT, містять домен VH, що має амінокислотну послідовність домену VH, зазначеного у будь-якій з послідовностей SEQ ID NO: 1, 2, 3, 4 або 5, і/або домен VL, що має амінокислотну послідовність домену VL, зазначеного у будь-якій з послідовностей SEQ ID NO: 82, 6, 83, 7, 8, 90, 9, 91 або 10. У деяких варіантах антитіло, що імуноспецифічно зв'язується з епітопом hLIGHT, містить (a) домен VH, що має амінокислотну послідовність, зазначену у SEQ ID NO: 1, і домен VL, що має амінокислотну послідовність, зазначену у будь-якій з SEQ ID NO: 82, 6 або 83; (b) домен VH, що має амінокислотну послідовність, зазначену у SEQ ID NO: 2, і домен VL, що має амінокислотну послідовність, зазначену у SEQ ID NO: 7; (c) домен VH, що має амінокислотну послідовність, зазначену у SEQ ID NO: 3, і домен VL, що має амінокислотну послідовність, зазначену у SEQ ID NO: 8; (d) домен VH, що має амінокислотну послідовність, зазначену у SEQ ID NO: 4, і домен VL, що має амінокислотну послідовність, зазначену у будь-якій з SEQ ID NO: 90, 9, 91 або 92; або (e) домен VH, що має амінокислотну послідовність, зазначену у SEQ ID NO: 5, і домен VL, що має амінокислотну послідовність, зазначену у SEQ ID NO: 10. Переважно антитіло є повністю людським антитілом, таким як повністю людське моноклональне антитіло і/або антагоністичне hLIGHT-антитіло. 23 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 В іншому варіанті антитіла, які імуноспецифічно зв'язуються з епітопом hLIGHT, містять домен VH, що має амінокислотну послідовність домену VH антитіла, що має номери доступу ATCC PTA-7729, PTA-7842, PTA-7818, PTA-7819 або PTA-7728 (E1, E13, E63, F19 або F23, відповідно), і/або домен VL, що має амінокислотну послідовність домену VL антитіла, що має номери доступу ATCC PTA-7729, PTA-7842, PTA-7818, PTA-7819 або PTA-7728 (E1, E13, E63, F19 або F23, відповідно). У деяких варіантах антитіло, що імуноспецифічно зв'язується з епітопом hLIGHT, містить (a) домен VH, що має амінокислотну послідовність антитіла, що має номер доступу ATCC PTA7729 (E1), і домен VL, що має амінокислотну послідовність антитіла, що має номер доступу ATCC PTA-7729 (E1); (b) домен VH, що має амінокислотну послідовність антитіла, що має номер доступу ATCC PTA-7842 (E13), і домен VL, що має амінокислотну послідовність антитіла, що має номер доступу ATCC PTA-7842 (E13); (c) домен VH, що має амінокислотну послідовність антитіла, що має номер доступу ATCC PTA-7818 (E63), і домен VL, що має амінокислотну послідовність антитіла, що має номер доступу ATCC PTA-7818 (E63); (d) домен VH, що має амінокислотну послідовність антитіла, що має номер доступу ATCC PTA-7819 (F19), і домен VL, що має амінокислотну послідовність антитіла, що має номер доступу ATCC PTA-7819 (F19); або (e) домен VH, що має амінокислотну послідовність антитіла, що має номер доступу ATCC PTA7728 (F23), і домен VL, що має амінокислотну послідовність антитіла, що має номер доступу ATCC PTA-7728 (F23). Переважно антитіло є повністю людським антитілом, таким як повністю людське моноклональне антитіло і/або антагоністичне hLIGHT-антитіло. У деяких варіантах антитіла відповідно до винаходу містять CDR1 VH, що має амінокислотну послідовність CDR1 VH будь-якої з областей VH, зазначених у SEQ ID NO: 1, 2, 3, 4 або 5. В іншому варіанті антитіла відповідно до винаходу містять CDR2 VH, що має амінокислотну послідовність CDR2 VH будь-якої з областей VH, зазначених у SEQ ID NO: 1, 2, 3, 4 або 5. В іншому варіанті антитіла відповідно до винаходу містять CDR3 VH, що має амінокислотну послідовність CDR3 VH будь-якої з областей VH, зазначених у SEQ ID NO: 1, 2, 3, 4 або 5. У деяких варіантах антитіла відповідно до винаходу містять CDR1 VH і/або CDR2 VH, і/або CDR3 VH, незалежно вибрані з CDR1 VH, CDR2 VH, CDR3 VH, які вказані у вигляді будьякої з областей VH у SEQ ID NO: 1, 2, 3, 4 або 5. Даний винахід також стосується антитіл, які імуноспецифічно зв'язуються з епітопом hLIGHT, при цьому зазначені антитіла містять одну або декілька CDR VL (тобто CDR1 VL, CDR2 VL і/або CDR3 VL), що мають амінокислотну послідовність будь-якої з CDR VL (тобто CDR1 VL, CDR2 VL і/або CDR3 VL) антитіла E1, E13, E63, F19 і/або F23; або антитіла, що продукується гібридомою, що має номери доступу ATCC PTA-7729, PTA-7842, PTA-7818, PTA-7819 або PTA-7728 (E1, E13, E63, F19 або F23, відповідно); або будь-яку їх комбінацію. У деяких варіантах антитіло, що імуноспецифічно зв'язується з епітопом hLIGHT, містить (1) домен VH, що має (a) CDR1 VH, CDR2 VH і/або CDR3 VH, що мають амінокислотну послідовність, зазначену у SEQ ID NO: 11, 12 і/або 13, відповідно, (b) CDR1 VH, CDR2 VH і/або CDR3 VH, що мають амінокислотну послідовність, зазначену у SEQ ID NO: 14, 15 і/або 16, відповідно, (c) CDR1 VH, CDR2 VH і/або CDR3 VH, що мають амінокислотну послідовність, зазначену у SEQ ID NO: 17, 18 і/або 19, відповідно, (d) CDR1 VH, CDR2 VH і/або CDR3 VH, що мають амінокислотну послідовність, зазначену у SEQ ID NO: 20, 21 і/або 22, відповідно, або (e) CDR1 VH, CDR2 VH і/або CDR3 VH, що мають амінокислотну послідовність, зазначену у SEQ ID NO: 23, 24 і/або 24, відповідно, і/або (2) домен VL, що має (a) CDR1 VL, що має амінокислотну послідовність, зазначену у будь-якій з SEQ ID NO: 84, 26 або 85; CDR2 VL, що має амінокислотну послідовність, зазначену у будь-якій з SEQ ID NO: 86, 27 або 87; і/або CDR3 VL, що має амінокислотну послідовність, зазначену у будь-якій з SEQ ID NO: 88, 28 або 89, (b) CDR1 VL, CDR2 VL і/або CDR3 VL, що мають амінокислотну послідовність, зазначену у SEQ ID NO: 29, 30 і/або 31, відповідно, (c) CDR1 VL, CDR2 VL і/або CDR3 VL, що мають амінокислотну послідовність, зазначену у SEQ ID NO: 32, 33 і/або 34, відповідно, (d) CDR1 VL, що має амінокислотну послідовність, зазначену у будь-якій з SEQ ID NO: 93, 35, 94 або 95; CDR2 VL, що має амінокислотну послідовність, зазначену у будь-якій з SEQ ID NO: 96, 36, 97 або 98; і/або CDR3 VL, що має амінокислотну послідовність, зазначену у будь-якій з SEQ ID NO: 6, 36, 97 або 98, або (e) CDR1 VL, CDR2 VL і/або CDR3 VL, що мають амінокислотну послідовність, зазначену у SEQ ID NO: 38, 39 і/або 40, відповідно. Переважно антитіло є повністю людським антитілом, таким як повністю людське моноклональне антитіло і/або антагоністичне hLIGHT-антитіло. У деяких варіантах антитіло, що імуноспецифічно зв'язується з епітопом hLIGHT, містить (1) домен VH, що має (a) CDR1 VH, CDR2 VH, і/або CDR3 VH, що мають амінокислотну послідовність CDR1 VH, CDR2 VH, і/або CDR3 VH антитіла, що має номер доступу ATCC PTA7729 (E1), (b) CDR1 VH, CDR2 VH, і/або CDR3 VH, що мають амінокислотну послідовність CDR1 24 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 VH, CDR2 VH і/або CDR3 VH антитіла, що має номер доступу ATCC PTA-7842 (E13), (c) CDR1 VH, CDR2 VH і/або CDR3 VH, що мають амінокислотну послідовність CDR1 VH, CDR2 VH і/або CDR3 VH антитіла, що має номер доступу ATCC PTA-7818 (E63), (d) CDR1 VH, CDR2 VH, і/або CDR3 VH, що мають амінокислотну послідовність CDR1 VH, CDR2 VH і/або CDR3 VH антитіла, що має номер доступу ATCC PTA-7819 (F19), або (e) CDR1 VH, CDR2 VH і/або CDR3 VH, що мають амінокислотну послідовність CDR1 VH, CDR2 VH і/або CDR3 VH антитіла, що має номер доступу ATCC PTA-7728 (F23), і/або (2) домен VL, що має (a) CDR1 VL, CDR2 VL і/або CDR3 VL, що мають амінокислотну послідовність CDR1 VL, CDR2 VL і/або CDR3 VL антитіла, що має номер доступу ATCC PTA-7729 (E1), (b) CDR1 VL, CDR2 VL і/або CDR3 VL, що мають амінокислотну послідовність CDR1 VL, CDR2 VL і/або CDR3 VL антитіла, що має номер доступу ATCC PTA-7842 (E13), (c) CDR1 VL, CDR2 VL і/або CDR3 VL, що мають амінокислотну послідовність CDR1 VL, CDR2 VL і/або CDR3 VL антитіла, що має номер доступу ATCC PTA7818 (E63), (d) CDR1 VL, CDR2 VL і/або CDR3 VL, що мають амінокислотну послідовність CDR1 VL, CDR2 VL і/або CDR3 VL антитіла, що має номер доступу ATCC PTA-7819 (F19), або (e) CDR1 VL, CDR2 VL і/або CDR3 VL, що мають амінокислотну послідовність CDR1 VL, CDR2 VL і/або CDR3 VL антитіла, що має номер доступу ATCC PTA-7728 (F23). Переважно антитіло є повністю людським антитілом, таким як повністю людське моноклональне антитіло і/або антагоністичне hLIGHT-антитіло. У деяких варіантах антитіло, що імуноспецифічно зв'язується з епітопом hLIGHT, містить (1) (a) домен VH, що має CDR1 VH, CDR2 VH і/або CDR3 VH, що мають амінокислотну послідовність, зазначену у SEQ ID NO: 11, 12 і/або 13, відповідно, і (b) домен VL, що має CDR1 VL, що має амінокислотну послідовність, зазначену у будь-якій з SEQ ID NO: 84, 26 або 85; CDR2 VL, що має амінокислотну послідовність, зазначену у будь-якій з SEQ ID NO: 86, 27 або 87; і/або CDR3 VL, що має амінокислотну послідовність, зазначену у будь-якій з SEQ ID NO: 88, 28 або 89; (2) (a) домен VH, що має CDR1 VH, CDR2 VH і/або CDR3 VH, що мають амінокислотну послідовність, зазначену у SEQ ID NO: 14, 15 і/або 16, відповідно, і (b) CDR1 VL, CDR2 VL і/або CDR3 VL, що мають амінокислотну послідовність, зазначену у SEQ ID NO:29, 30 і/або 31, відповідно; (3) (a) домен VH, що має CDR1 VH, CDR2 VH і/або CDR3 VH, що мають амінокислотну послідовність, зазначену у SEQ ID NO: 17, 18, і/або 19, відповідно, і (b) домен VL, що має CDR1 VL, CDR2 VL і/або CDR3 VL, що мають амінокислотну послідовність, зазначену у SEQ ID NO: 32, 33 і/або 34, відповідно; (4) (a) домен VH, що має CDR1 VH, CDR2 VH і/або CDR3 VH, що мають амінокислотну послідовність, зазначену у SEQ ID NO: 20, 21 і/або 22, відповідно, і (b) домен VL, що має CDR1 VL, що має амінокислотну послідовність, зазначену у будь-якій з SEQ ID NO: 93, 35, 94 або 95; CDR2 VL, що має амінокислотну послідовність, зазначену у будьякій з SEQ ID NO: 96, 36, 97 або 98; і/або CDR3 VL, що має амінокислотну послідовність, зазначену у будь-якій з SEQ ID NO: 96, 36, 97 або 98; або (5) (a) домен VH, що має CDR1 VH, CDR2 VH і/або CDR3 VH, що мають амінокислотну послідовність, зазначену у SEQ ID NO: 23, 24 і/або 24, відповідно, і (b) домен VL, що має CDR1 VL, CDR2 VL і/або CDR3 VL, що мають амінокислотну послідовність, зазначену у SEQ ID NO: 38, 39 і/або 40, відповідно. Переважно антитіло є повністю людським антитілом, таким як повністю людське моноклональне антитіло і/або антагоністичне hLIGHT-антитіло. У деяких варіантах антитіло, що імуноспецифічно зв'язується з епітопом hLIGHT, містить (1) (a) домен VH, що має CDR1 VH, CDR2 VH і/або CDR3 VH, що мають амінокислотну послідовність CDR1 VH, CDR2 VH і/або CDR3 VH антитіла, що має номер доступу ATCC PTA7729 (E1), і (b) домен VL, що має CDR1 VL, CDR2 VL і/або CDR3 VL, що мають амінокислотну послідовність CDR1 VL, CDR2 VL і/або CDR3 VL антитіла, що має номер доступу ATCC PTA7729 (E1); (2) (a) домен VH, що має CDR1 VH, CDR2 VH і/або CDR3 VH, що мають амінокислотну послідовність CDR1 VH, CDR2 VH і/або CDR3 VH антитіла, що має номер доступу ATCC PTA-7842 (E13), і (b) домен VL, що має CDR1 VL, CDR2 VL і/або CDR3 VL, що мають амінокислотну послідовність CDR1 VL, CDR2 VL і/або CDR3 VL антитіла, що має номер доступу ATCC PTA-7842 (E13); (3) (a) домен VH, що має CDR1 VH, CDR2 VH, і/або CDR3 VH, що мають амінокислотну послідовність CDR1 VH, CDR2 VH і/або CDR3 VH антитіла, що має номер доступу ATCC PTA-7818 (E63), і (b) домен VL, що має CDR1 VL, CDR2 VL і/або CDR3 VL, що мають амінокислотну послідовність CDR1 VL, CDR2 VL і/або CDR3 VL антитіла, що має номер доступу ATCC PTA-7818 (E63); (4) (a) домен VH, що має CDR1 VH, CDR2 VH і/або CDR3 VH, що мають амінокислотну послідовність CDR1 VH, CDR2 VH і/або CDR3 VH антитіла, що має номер доступу ATCC PTA-7819 (F19), і CDR1 VL, CDR2 VL і/або CDR3 VL, що мають амінокислотну послідовність CDR1 VL, CDR2 VL і/або CDR3 VL антитіла, що має номер доступу ATCC PTA-7819 (F19); або (5) (a) домен VH, що має CDR1 VH, CDR2 VH і/або CDR3 VH, що мають амінокислотну послідовність CDR1 VH, CDR2 VH і/або CDR3 VH антитіла, що має номер 25 UA 99714 C2 5 10 15 20 25 30 35 40 доступу ATCC PTA-7728 (F23), і (b) домен VL, що має CDR1 VL, CDR2 VL і/або CDR3 VL, що мають амінокислотну послідовність CDR1 VL, CDR2 VL і/або CDR3 VL антитіла, що має номер доступу ATCC PTA-7728 (F23). Переважно антитіло є повністю людським антитілом, таким як повністю людське моноклональне антитіло і/або антагоністичне hLIGHT-антитіло. У деяких варіантах антитіла відповідно до винаходу містять CDR1 VL, що має амінокислотну послідовність CDR1 VL будь-якої з областей VL, зазначених у SEQ ID NO: 82, 6, 83, 7, 8, 90, 9, 91, 92 або 10; або антитіла, що продукується гібридомою, що має номери доступу ATCC PTA7729, PTA-7842, PTA-7818, PTA-7819 або PTA-7728 (E1, E13, E63, F19 або F23, відповідно). В іншому варіанті антитіла відповідно до винаходу містять CDR2 VL, що має амінокислотну послідовність CDR2 VL будь-якої з областей VL, зазначених у SEQ ID NO: 82, 6, 83, 7, 8, 90, 9, 91, 92 або 10; або антитіла, що продукується гібридомою, що має номери доступу ATCC PTA7729, PTA-7842, PTA-7818, PTA-7819 або PTA-7728 (E1, E13, E63, F19 або F23, відповідно). В іншому варіанті антитіла відповідно до винаходу містять CDR3 VL, що має амінокислотну послідовність CDR3 VL будь-якої з областей VL, зазначених у SEQ ID NO: 82, 6, 83, 7, 8, 90, 9, 91, 92 або 10; або антитіла, що продукується гібридомою, що має номери доступу ATCC PTA7729, PTA-7842, PTA-7818, PTA-7819 або PTA-7728 (E1, E13, E63, F19 або F23, відповідно). У деяких варіантах антитіла відповідно до винаходу містять CDR1 VL і/або CDR2 VL, і/або CDR3 VL, незалежно вибрані з CDR1 VL, CDR2 VL, CDR3 VL, які зображені у будь-якій з областей VL, зазначених у SEQ ID NO: 82, 6, 83, 7, 8, 90, 9, 91, 92, або 10; або антитіла, що продукується гібридомою, що має номери доступу ATCC PTA-7729, PTA-7842, PTA-7818, PTA-7819 або PTA7728 (E1, E13, E63, F19 або F23, відповідно). У деяких варіантах антитіла відповідно до винаходу містять (1) домен або ланцюг VH, що має одну або декілька (a) CDR1 VH, що має амінокислотну послідовність CDR1 VH будь-якої з областей VH, зазначених у SEQ ID NO: 1, 2, 3, 4 або 5; або антитіла, що продукується гібридомою, що має номери доступу ATCC PTA-7729, PTA-7842, PTA-7818, PTA-7819 або PTA7728 (E1, E13, E63, F19 або F23, відповідно), (b) CDR2 VH, що має амінокислотну послідовність CDR2 VH будь-якої з областей VH, зазначених у SEQ ID NO: 1, 2, 3, 4 або 5; або антитіла, що продукується гібридомою, що має номери доступу ATCC PTA-7729, PTA-7842, PTA-7818, PTA7819 або PTA-7728 (E1, E13, E63, F19 або F23, відповідно), або (c) CDR3 VH, що має амінокислотну послідовність CDR3 VH будь-якої з областей VH, зазначених у SEQ ID NO: 1, 2, 3, 4 або 5; або антитіла, що продукується гібридомою, що має номери доступу ATCC PTA-7729, PTA-7842, PTA-7818, PTA-7819 або PTA-7728 (E1, E13, E63, F19 або F23, відповідно); і/або (2) домен або ланцюг VL, що має одну або декілька (a) CDR1 VL, що має амінокислотну послідовність CDR1 VL будь-якої з областей VL, зазначених у SEQ ID NO: 82, 6, 83, 7, 8, 90, 9, 91, 92 або 10; або антитіла, що продукується гібридомою, що має номери доступу ATCC PTA7729, PTA-7842, PTA-7818, PTA-7819 або PTA-7728 (E1, E13, E63, F19 або F23, відповідно), (b) CDR2 VL, що має амінокислотну послідовність CDR2 VL будь-якої з областей VL, зазначених у SEQ ID NO: 82, 6, 83, 7, 8, 90, 9, 91, 92 або 10; або антитіла, що продукується гібридомою, що має номери доступу ATCC PTA-7729, PTA-7842, PTA-7818, PTA-7819 або PTA-7728 (E1, E13, E63, F19 або F23, відповідно), і/або (c) CDR3 VL, що має амінокислотну послідовність CDR3 VL будь-якої з областей VL, зазначених у SEQ ID NO: 82, 6, 83, 7, 8, 90, 9, 91, 92 або 10; або антитіла, що продукується гібридомою, що має номери доступу ATCC PTA-7729, PTA-7842, PTA-7818, PTA-7819 або PTA-7728 (E1, E13, E63, F19 або F23, відповідно). 26 UA 99714 C2 Таблиця 1 Послідовності CDR-областей антитіл E1, E13, E63, F19 і F23 (SEQ ID NO) * Переважні VL і послідовності CDR1-3 VL E1 і F19. 5 10 15 20 25 30 Даний винахід також стосується антитіл, що містять одну або декілька CDR VH і одну або декілька CDR VL, перерахованих у таблиці 1. Зокрема, винахід стосується антитіла, що містить CDR1 VH (SEQ ID NO: 11, 14, 17, 20 або 23) і CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38); CDR1 VH (SEQ ID NO: 11, 14, 17, 20 або 23) і CDR2 VL (SEQ ID NO: 86, 27, 87, 30, 33, 96, 36, 97, 98 або 39); CDR1 VH (SEQ ID NO: 11, 14, 17, 20 або 23) і CDR3 VL (SEQ ID NO: 88, 28, 89, 31, 34, 99, 37, 100, 101 або 40); CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24) і CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38); CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24) і CDR2 VL (SEQ ID NO: 86, 27, 87, 30, 33, 96, 36, 97, 98 або 39); CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24) і CDR3 VL (SEQ ID NO: 88, 28, 89, 31, 34, 99, 37, 100, 101 або 40); CDR3 VH (SEQ ID NO: 13, 16, 19, 22 або 25) і CDR1 VH (SEQ ID NO: 11, 14, 17, 20 або 23); CDR3 VH (SEQ ID NO: 13, 16, 19, 22 або 25) і CDR2 VL (SEQ ID NO: 86, 27, 87, 30, 33, 96, 36, 97, 98 або 39); CDR3 VH (SEQ ID NO: 13, 16, 19, 22 або 25) і CDR3 VL (SEQ ID NO: 88, 28, 89, 31, 34, 99, 37, 100, 101 або 40); CDR1 VH, CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24) і CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38); CDR1 VH (SEQ ID NO: 11, 14, 17, 20 або 23), CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24) і CDR2 VL (SEQ ID NO: 86, 27, 87, 30, 33, 96, 36, 97, 98 або 39); CDR1 VH (SEQ ID NO: 11, 14, 17, 20 або 23), CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24) і CDR3 VL (SEQ ID NO: 88, 28, 89, 31, 34, 99, 37, 100, 101 або 40); CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24), CDR3 VH (SEQ ID NO: 13, 16, 19, 22 або 25) і CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38), CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24), CDR3 VH (SEQ ID NO: 13, 16, 19, 22 або 25) і CDR2 VL (SEQ ID NO: 86, 27, 87, 30, 33, 96, 36, 97, 98 або 39); CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24), CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24) і CDR3 VL (SEQ ID NO: 88, 28, 89, 31, 34, 99, 37, 100, 101 або 40); CDR1 VH (SEQ ID NO: 11, 14, 17, 20 або 23), CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38) і CDR2 VL (SEQ ID NO: 86, 27, 87, 30, 33, 96, 36, 97, 98 або 39); CDR1 VH (SEQ ID NO: 11, 14, 17, 20 або 23), CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38) і CDR3 VL (SEQ ID NO: 88, 28, 89, 31, 34, 99, 37, 100, 101 або 40); CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24), CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38) і CDR2 VL (SEQ ID NO: 86, 27, 87, 30, 33, 96, 36, 97, 98 або 39); CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24), CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38) і CDR3 VL (SEQ ID NO: 88, 28, 89, 31, 34, 99, 37, 100, 101 або 40); CDR3 VH (SEQ ID NO: 13, 16, 19, 22 або 25), CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38) і CDR2 VL (SEQ ID NO: 86, 27, 87, 30, 33, 96, 36, 97, 98 або 39); CDR3 VH (SEQ ID NO: 13, 16, 19, 22 або 25), CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38) і CDR3 VL (SEQ ID NO: 88, 28, 89, 31, 34, 99, 37, 100, 101 або 40); CDR1 VH (SEQ ID NO: 11, 14, 17, 20, або 23), CDR2 VH (SEQ ID 27 UA 99714 C2 5 10 15 20 25 30 35 40 45 50 55 60 NO: 12, 15, 18, 21 або 24), CDR3 VH (SEQ ID NO: 13, 16, 19, 22 або 25) і CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38); CDR1 VH (SEQ ID NO: 11, 14, 17, 20 або 23), CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24), CDR3 VH (SEQ ID NO: 13, 16, 19, 22 або 25) і CDR2 VL (SEQ ID NO: 86, 27, 87, 30, 33, 96, 36, 97, 98 або 39); CDR1 VH (SEQ ID NO: 11, 14, 17, 20 або 23), CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24), CDR3 VH (SEQ ID NO: 13, 16, 19, 22 або 25) і CDR3 VL (SEQ ID NO: 88, 28, 89, 31, 34, 99, 37, 100, 101 або 40); CDR1 VH (SEQ ID NO: 11, 14, 17, 20 або 23), CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24), CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38) і CDR2 VL (SEQ ID NO: 86, 27, 87, 30, 33, 96, 36, 97, 98 або 39); CDR1 VH (SEQ ID NO: 11, 14, 17, 20 або 23), CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24), CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38) і CDR3 VL (SEQ ID NO: 88, 28, 89, 31, 34, 99, 37, 100, 101 або 40); CDR1 VH (SEQ ID NO: 11, 14, 17, 20 або 23), CDR3 VH (SEQ ID NO: 13, 16, 19, 22 або 25), CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38) і CDR2 VL (SEQ ID NO: 86, 27, 87, 30, 33, 96, 36, 97, 98 або 39); CDR1 VH (SEQ ID NO: 11, 14, 17, 20 або 23), CDR3 VH (SEQ ID NO: 13, 16, 19, 22 або 25), CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38) і CDR3 VL (SEQ ID NO: 88, 28, 89, 31, 34, 99, 37, 100, 101 або 40); CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24), CDR3 VH (SEQ ID NO: 13, 16, 19, 22 або 25), CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38) і CDR2 VL (SEQ ID NO: 86, 27, 87, 30, 33, 96, 36, 97, 98 або 39); CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24), CDR3 VH (SEQ ID NO: 13, 16, 19, 22 або 25), CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38) і CDR3 VL (SEQ ID NO: 88, 28, 89, 31, 34, 99, 37, 100, 101 або 40); CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24), CDR3 VH (SEQ ID NO: 13, 16, 19, 22 або 25), CDR2 VL (SEQ ID NO: 86, 27, 87, 30, 33, 96, 36, 97, 98 або 39) і CDR3 VL (SEQ ID NO: 88, 28, 89, 31, 34, 99, 37, 100, 101 або 40); CDR1 VH (SEQ ID NO: 11, 14, 17, 20 або 23), CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24), CDR3 VH (SEQ ID NO: 13, 16, 19, 22 або 25), CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38) і CDR2 VL (SEQ ID NO: 86, 27, 87, 30, 33, 96, 36, 97, 98 або 39); CDR1 VH (SEQ ID NO: 11, 14, 17, 20 або 23), CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24), CDR3 VH (SEQ ID NO: 13, 16, 19, 22 або 25), CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38) і CDR3 VL (SEQ ID NO: 88, 28, 89, 31, 34, 99, 37, 100, 101 або 40); CDR1 VH (SEQ ID NO: 11, 14, 17, 20 або 23), CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24), CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38), CDR2 VL (SEQ ID NO: 86, 27, 87, 30, 33, 96, 36, 97, 98 або 39), і CDR3 VL (SEQ ID NO: 88, 28, 89, 31, 34, 99, 37, 100, 101 або 40); CDR1 VH (SEQ ID NO: 11, 14, 17, 20 або 23), CDR3 VH (SEQ ID NO: 13, 16, 19, 22 або 25), CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38), CDR2 VL (SEQ ID NO: 86, 27, 87, 30, 33, 96, 36, 97, 98 або 39) і CDR3 VL (SEQ ID NO: 88, 28, 89, 31, 34, 99, 37, 100, 101 або 40); CDR2 VH (SEQ ID NO: 12, 15, 18, 21 або 24), CDR3 VH (SEQ ID NO: 13, 16, 19, 22 або 25), CDR1 VL (SEQ ID NO: 84, 26, 85, 29, 32, 35 або 38), CDR2 VL (SEQ ID NO: 86, 27, 87, 30, 33, 96, 36, 97, 98 або 39) і CDR3 VL (SEQ ID NO: 88, 28, 89, 31, 34, 99, 37, 100, 101 або 40); або будь-яку їх комбінацію CDR VH (SEQ ID NO: 11-25) і CDR VL (SEQ ID NO: 26-40), перерахованих у таблиці 1. Відповідні CDR VH і CDR VL антитіл з номерами доступу ATCC PTA-7729, PTA-7842, PTA-7818, PTA-7819 або PTA7728 (E1, E13, E63, F19 або F23) також можна використовувати у будь-яких комбінаціях, зазначених вище. Переважно антитіло є повністю людським антитілом, таким як повністю людське моноклональне антитіло і/або антагоністичне hLIGHT-антитіло. Даний винахід також стосується антитіл, які імуноспецифічно зв'язуються з епітопом hLIGHT, антитіл, що містять похідні доменів VH, CDR VH, доменів VL і CDR VL, описаних у даній публікації, які імуноспецифічно зв'язуються з антигеном hLIGHT. Даний винахід також стосується антитіл, що містять похідні E1, E13, E63, F19 і/або F23, при цьому зазначені антитіла імуноспецифічно зв'язуються з епітопом hLIGHT. Стандартні способи, відомі фахівцям у даній галузі, можна використовувати для введення мутацій у нуклеотидну послідовність, що кодує молекулу відповідно до винаходу, включаючи, наприклад, сайт-специфічний мутагенез і ПЛРопосередкований мутагенез, що приводить до амінокислотних замін. Переважно похідні містять менше 25 амінокислотних замін, менше 20 амінокислотних замін, менше 15 амінокислотних замін, менше 10 амінокислотних замін, менше 5 амінокислотних замін, менше 4 амінокислотних замін, менше 3 амінокислотних замін або менше 2 амінокислотних замін у порівнянні з вихідною молекулою. У переважному варіанті похідні містять консервативні амінокислотні заміни в одному або декількох попередньо обчислених неістотних амінокислотних залишках. "Консервативна амінокислотна заміна" являє собою заміну, при якій амінокислотний залишок заміняють амінокислотним залишком, що має бічний ланцюг з подібним зарядом. Сімейства амінокислотних залишків, що мають бічні ланцюги з подібними зарядами, визначені у даній галузі. Такі сімейства включають амінокислоти з основними бічними ланцюгами (наприклад, лізин, аргінін, гістидин), кислотними бічними ланцюгами (наприклад, аспарагінова кислота, глутамінова кислота), незарядженими полярними бічними ланцюгами (наприклад, гліцин, аспарагін, глутамін, серин, треонін, тирозин, цистеїн), неполярними бічними ланцюгами 28
ДивитисяДодаткова інформація
Назва патенту англійськоюMonoclonal antibody that specifically binds to light
Автори англійськоюGranger, Steven, W., Kato, Shinichiro, Ware, Carl, F.
Назва патенту російськоюМоноклональное антитело, которое специфически связывается с light
Автори російськоюГренджер Стивен В., Като Синитиро, Уэр Карл Ф.
МПК / Мітки
МПК: A61P 37/06, A61K 39/395, C12N 15/13, C07K 16/28
Мітки: зв'язується, специфічно, моноклональне, антитіло, яке, light
Код посилання
<a href="https://ua.patents.su/145-99714-monoklonalne-antitilo-yake-specifichno-zvyazuehtsya-z-light.html" target="_blank" rel="follow" title="База патентів України">Моноклональне антиtіло, яке специфічно зв’язується з light</a>
Попередній патент: Спосіб виготовлення теплоізоляційної панелі і теплоізоляційна панель
Наступний патент: Спосіб і пристрій для виготовлення панелі великої поверхні, велика поверхнева панель і набір індивідуальних панелей
Випадковий патент: Спосіб хірургічного лікування деформації діафізу довгої трубчастої кістки у дітей зі збереженим ростом