Комбіноване застосування похідних холестанолу для протиракової терапії
Формула / Реферат
1. Хіміотерапевтичний засіб проти раку, що містить, в комбінації, похідне холестанолу, представлене формулою (1)
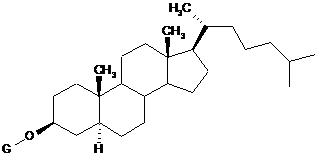 , (1)
, (1)
де G являє собою GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-, або його сполуку включення з циклодекстрином і протираковий засіб.
2. Хіміотерапевтичний засіб проти раку за п. 1, де в формулі (1) G являє собою GlcNAc-Gal- або GlcNAc-.
3. Хіміотерапевтичний засіб проти раку за п. 1 або 2, де протираковий засіб являє собою один або декілька видів засобів, вибраних з групи, яка складається з протиракового засобу, що являє собою таксан, протиракового засобу, що являє собою комплекс платини, сполуки пеметрекседу і фторурацилу.
4. Хіміотерапевтичний засіб проти раку за п. 3, де протираковий засіб являє собою один або декілька видів засобів, вибраних з групи, яка складається з паклітакселу, доцетакселу, алімти, 5-FU, цисплатину і оксаліплатину.
5. Хіміотерапевтичний засіб проти раку за будь-яким з пп. 1-4, який являє собою змішаний засіб.
6. Хіміотерапевтичний засіб проти раку за будь-яким з пп. 1-4, який знаходиться в формі набору, що включає лікарський засіб, який містить похідне холестанолу, і лікарський засіб, який містить протираковий засіб.
7. Хіміотерапевтичний засіб проти раку за п. 6, де лікарський засіб, який містить похідне холестанолу, являє собою ліпосомальну композицію.
8. Застосування, в комбінації, похідного холестанолу, представленого формулою (1)
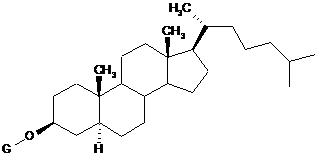 , (1)
, (1)
де G являє собою GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-, або його сполуки включення з циклодекстрином і протиракового засобу для отримання хіміотерапевтичного засобу проти раку.
9. Протиракова хіміотерапія, що характеризується введенням пацієнту, який потребує цього, похідного холестанолу, представленого формулою (1)
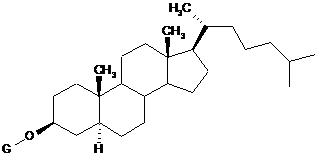 , (1)
, (1)
де G являє собою GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-, або його сполуки включення з циклодекстрином і протиракового засобу в комбінації.
10. Протиракова хіміотерапія за п. 9, де похідне холестанолу або його сполуку включення з циклодекстрином і протираковий засіб вводять пацієнту, який потребує цього, одночасно або окремо з інтервалами.
Текст
Реферат: Винахід належить до хіміотерапевтичного засобу проти раку, який має більш слабку побічну дію і чудову ефективність. Хіміотерапевтичний засіб проти раку за винаходом включає похідне холестанолу, представлене формулою (1) UA 101831 C2 (12) UA 101831 C2 H3 C CH3 CH3 G O H , (1) де G являє собою GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal-або GlcNAc-, або його сполуку включення з циклодекстрином і протираковий засіб. UA 101831 C2 5 10 15 20 25 30 35 40 45 50 Даний винахід належить до хіміотерапевтичного засобу проти раку (який називається далі в даному описі "хіміотерапевтичний засіб проти раку") і конкретніше, до хіміотерапевтичного засобу проти раку, в якому використовуються похідне холестанолу і протираковий засіб в комбінації. Рівень техніки До цього часу розроблена і класифікована на основі структури, механізму дії і т. д. множина протиракових засобів, які використовуються в хіміотерапії проти раку, яка є одним з способів лікування раку. Однак ефективність таких протиракових засобів, що використовуються у вигляді окремого засобу, є незадовільною. Дійсно, в останні роки переважно здійснюють полілікарську терапію з використанням декількох протиракових засобів з точки зору пригнічення шкідливої побічної дії, і була визнана ефективність полілікарської терапії. У таких умовах бажані як розробка нової протиракової комбінованої терапії, яка має меншу побічну дію, ніж звичайна хіміотерапія, так і розробка нових хіміотерапевтичних засобів для застосування в хіміотерапії. Тим часом, раніше виявлено, що похідне холестанолу, в якому з холестанолом (сполука, в якому подвійний зв'язок в циклі В холестерину є насиченим) зв'язується цукровий ланцюг, такий як GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-, має виняткову протипухлинну активність (патентні документи 1-4). Однак, не повідомляється про випадки, коли вищезгадані похідні холестанолу і інший протираковий засіб використовувалися б в комбінації. Патентний документ 1 JP-A-2000-191685 Патентний документ 2 JP-A-1999-60592 Патентний документ З WO 2005/007172 (публікація) Патентний документ 4 WO 2007/026869 (публікація) Розкриття винаходу Проблеми, які вирішує винахід Таким чином, даний винахід належить до хіміотерапевтичного засобу проти раку, який має меншу побічну дія і чудову активність. Способи розв'язання проблеми З урахуванням вищеописаного, автори даного винаходу здійснили широкі дослідження і виявили, що істотно потенційованої протиракової дії можна досягти за допомогою використання в комбінації похідного холестанолу, представленого формулою (1), або його сполуки включення з циклодекстрином, і відомого хіміотерапевтичного засобу (протиракового засобу), і, відповідно до цього, комбіноване використання вказаних фармацевтичних засобів в хіміотерапії проти раку є дуже застосовним. Відповідно, даний винахід належить до вказаного далі в розділах (1) - (10). (1) Хіміотерапевтичний засіб проти раку, що включає в комбінації похідне холестанолу, представлене формулою (1) (1), (де G являє собою GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-), або його сполуку включення з цикл о декстрином і протираковий засіб. (2) Хіміотерапевтичний засіб проти раку згідно з розділом (1), викладеним вище, де в формулі (1) G являє собою GlcNAc-Gal- або GlcNAc-. (3) Хіміотерапевтичний засіб проти раку згідно з розділом (1) або (2), викладеним вище, де протираковий засіб являє собою один або декілька видів засобів, вибраних з групи, яка складається з протиракового засобу, що являє собою таксан, протиракового засобу, що являє собою комплекс платини, сполуки пеметрекседу і фторурацилу. (4) Хіміотерапевтичний засіб проти раку згідно з розділом (3), викладеним вище, де протираковий засіб являє собою один або декілька видів засобів, вибраних з групи, яка складається з паклітакселу, доцетакселу, алімти, 5-FU, цисплатину і оксаліплатину. (5) Хіміотерапевтичний засіб проти раку згідно з будь-яким з розділів (1)-(4), викладеним вище, який являє собою змішаний засіб. 1 UA 101831 C2 5 10 15 20 25 30 35 40 (6) Хіміотерапевтичний засіб проти раку згідно з будь-яким з розділів (1)-(4), викладеним вище, який знаходиться в формі набору, що включає лікарський засіб, який містить похідне холестанолу, і лікарський засіб, який містить протираковий засіб. (7) Хіміотерапевтичний засіб проти раку згідно з розділом (6), викладеним вище, де лікарський засіб, який містить похідне холестанолу, являє собою ліпосомальну композицію. (8) Застосування в комбінації похідного холестанолу, представленого формулою (1) (1), (де G являє собою GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-), або його сполуки включення з циклодекстрином і протиракового засобу для отримання хіміотерапевтичного засобу проти раку. (9) Протиракова хіміотерапія, що характеризується введенням пацієнту, який потребує цього, похідного холестанолу, представленого формулою (1) (1), (де G являє собою GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-), або його сполуки включення з циклодекстрином і протиракового засобу в комбінації. (10) Протиракова хіміотерапія згідно з розділом (9), викладеним вище, де похідне холестанолу або його сполуку включення з циклодекстрином і протираковий засіб вводять пацієнту, який потребує цього, одночасно або окремо з інтервалами. Ефекти винаходу При використанні хіміотерапевтичного засобу проти раку і протиракової хіміотерапії згідно з даним винаходом можна здійснювати профілактику або лікування раку безпечно і з високою ефективністю. Короткий опис креслень Фіг. 1 являє собою діаграму, що показує інгібуючу проліферацію клітин дію CDDP, GC-CD і CDDP+GC-CD на клітини colon26; фіг. 2 являє собою діаграму, що показує інгібуючу проліферацію клітин дію CDDP, GC-CD і CDDP+GC-CD на клітини MKN45, клітини NCIH226 або клітини colo201; фіг. 3 являє собою діаграму, що показує інгібуючу проліферацію клітин дію CDDP, GGC-CD і CDDP+GGC-CD на клітини colon26, клітини MKN45, клітини NCIH226 або клітини colo201; фіг. 4 являє собою діаграму, що показує протипухлинну дію одноразового введення CDDP, GC-CD і CDDP+GC-CD проти перитонеальної дисемінації, викликаної клітинами colon26, інокульованими мишам інтраперитонеально; фіг. 5 являє собою діаграму, що показує протипухлинну дію декількох введень CDDP, GCCD і CDDP+GC-CD проти перитонеальної дисемінації, викликаної клітинами colon26, інокульованими мишам інтраперитонеально; фіг. 6 являє собою діаграму, що показує протипухлинну дію одноразового відстроченого введення CDDP, GC-CD і CDDP+GC-CD проти перитонеальної дисемінації, викликаної клітинами colon26, інокульованими мишам інтраперитонеально, після підтвердження перитонеальної дисемінації на мезотелії мишей; фіг. 7 являє собою графік, що показує коефіцієнт виживаності мишей, яким інокульовані інтраперитонеально клітини colon26, після одноразового введення CDDP, GC-CD або CDDP+GC-CD (одноразового введення CDDP і подвійного введення GC-CD, відповідно); 2 UA 101831 C2 5 10 15 20 25 30 35 40 45 50 55 60 фіг. 8 являє собою графіки, що показують ефект пригнічення або зниження зростання пухлини у мишей, яким підшкірно інокульовані клітини colon26, після одноразового введення CDDP, GGC-CD або CDDP+GGC-CD; і фіг. 9 являє собою діаграму, що показує дію інгібування метастазування клітин colon26 в легеню після одноразового введення CDDP, GC-CD, GGC-CD, CDDP+GC-CD і CDDP+GGC-CD. Докладний опис переважних втілень Конкретними похідними холестанолу, представленими формулою (1) і використовуваними в даному винаході, є всі відомі сполуки. У похідних холестанолу, які представлені формулою (1), і в яких G являє собою GlcNAc-Gal-, G переважно являє собою GlcNAcβ1,3-Galβ- або GlcNAcβ1,4-Galβ-. В похідних холестанолу (1), в яких G являє собою GlcNAc-Gal-Glc-, G переважно являє собою GlcNAcβ1,3- Galβ31,4- Glc-. В похідних холестанолу (1), в яких G являє собою Fuc-Gal-, G переважно являє собою Fucα1,3Gal. В похідних холестанолу (1), в яких G являє собою Gal-Glc-, G переважно являє собою Galβ1,4Glcβ-. В похідних холестанолу (1), в яких G являє собою Gal-, G переважно являє собою Galβ-. В похідних холестанолу (1), в яких G являє собою GlcNAc-, G переважно являє собою GlcNAcβ-. Зі вказаних сполук більш переважні види, в яких G являє собою GlcNAc-Gal-і GlcNAc-, причому ще більш переважними є сполуки, в яких G являє собою GlcNAcβ1,4- Galβ- і GlcNAcβ-. Вищезгадані похідні холестанолу можна отримати, наприклад, способом, який розкритий у вищезазначених патентних документах 1-4, або подібним способом. Похідне холестанолу, представлене формулою (1), легко утворює комплекс включення з циклодекстрином або його похідним. Таким чином, похідне холестанолу, що використовується в даному винаході, може являти собою його сполуку включення з циклодекстрином. При утворенні таких сполук включення необхідно брати до уваги розмір молекули-гостя, ван-дерваальсову взаємодію між молекулою-гостем і циклодекстрином, і водневі зв'язки між гідроксильними групами циклодекстрину і молекули-гостя. Тому не завжди нерозчинні сполукигості утворюють відповідні сполуки включення. Однак похідне холестанолу за даним винаходом може утворювати з циклодекстрином прийнятні комплекси включення. Приклади циклодекстрину, який утворює сполуку включення з циклодекстрином за даним винаходом, включають такі циклодекстрини, як α-циклодекстрин, β-циклодекстрин і γциклодекстрин; і похідні циклодекстрину, такі як метил-β-циклодекстрин, 2-гідроксипропіл-βциклодекстрин, моноацетил-β-циклодекстрин і 2-гідроксипропіл-γ-циклодекстрин. З них переважний 2-гідроксипропіл-β-циклодекстрин для отримання поліпшеної розчинності. Сполуку включення з циклодекстрином можна отримати, наприклад, наступною процедурою: отримують водний розчин циклодекстрину або його похідного відповідної концентрації (наприклад, 20-40 %), і до водного розчину додають похідне холестанолу за даним винаходом з подальшим перемішуванням отриманої суміші. Певне обмеження по концентрації розчину похідного холестанолу (1) не ставиться доти, доки похідне холестанолу може утворювати сполуку включення з циклодекстрином. Як правило, концентрація складає від приблизно 1 до приблизно 50 мас. %, переважно, від приблизно 10 до приблизно 30 мас. %. Отримана таким чином сполука включення з циклодекстрином є високо водорозчинною і тому ефективно виявляє дію гостя in vivo. Іншою перевагою сполуки включення з циклодекстрином є забезпечення сумісності результатів випробувань in vitro. З іншого боку, похідне холестанолу (1) можна отримати в ліпосомальній композиції, за допомогою чого похідне холестанолу може бути ефективніше доставлене в місце впливу. Іншою перевагою сполуки включення з циклодекстрином є забезпечення сумісності результатів випробувань in vitro. Переважно, ліпосомальна композиція включає похідне холестанолу за даним винаходом, мембранний компонент і аліфатичний або ароматичний амін. Вміст похідного холестанолу в ліпосомальній композиції становить переважно 0,3-2,0 моль, переважніше, 0,8-1,5 моль на 1 моль мембранного компонента. Мембранний компонент може являти собою фосфоліпід. Конкретні приклади переважно використовуваних фосфоліпідів включають природні і синтетичні фосфоліпіди, такі як фосфатидилхолін, фосфатидилетаноламін, фосфатидилсерин, фосфатидилинозіт і фосфатидна кислота; їх суміші і модифіковані природні фосфоліпіди, такі як водний лецитин. Приклади більш переважних видів включають фосфатидилхолін (Іαдипальмітоїлфосфатидилхолін (DPPC)). Аліфатичний або ароматичний амін використовують, головним чином, для суміш способом, відомим в техніці, і отримуючи за допомогою цього рідини для підшкірної, внутрішньом'язової і 3 UA 101831 C2 5 10 15 20 25 30 35 40 45 50 55 60 внутрішньовенної ін'єкції. Приклади регулятора рН і буфера включають цитрат натрію, ЕДТК, тіогліколеву кислоту і тіолоцтову кислоту. Приклади місцевого анестезуючого засобу включають гідрохлорид прокаїну і гідрохлорид лідокаїну. Приклади засобу для регулювання тонічності включають хлорид натрію і глюкозу. Супозиторії можна отримати, змішуючи лікарські інгредієнти за даним винаходом з носієм для препарату, відомим в техніці, таким як поліетиленгліколь, ланолін, масло какао і тригліцерид жирної кислоти, і з необов'язковою поверхнево-активною речовиною, такою як твін (зареєстрований торговий знак), і формуючи суміш в супозиторії способом, відомим в техніці. Мазі можна отримати, змішуючи лікарські інгредієнти за даним винаходом з необов'язковими добавками, що звичайно використовуються в техніці, такими як основа, стабілізатор, зволожуюча речовина і консерванти, і формуючи суміш в мазі способом, відомим в техніці. Приклади основи включають рідкий парафін, білий вазелін, білий бджолиний віск, октилдодециловий спирт і парафін. Приклади консерванту включають метил-п-гідроксибензоат, етил-п-гідроксибензоат і пропіл-п-гідроксибензоат. Припарки можна отримати, наносячи вищезгадану мазь, гель, крем, пасту і т. д. на звичайно використовувану основу звичайним способом. Приклади відповідних основ включають ткані і неткані тканини, виготовлені з бавовни, штапельного волокна або хімічного волокна, і листовий пінопласт, виготовлений з м'якого полівінілхлориду, поліетилену, поліуретану і т. д. Як правило, композицію переважно отримують таким чином, щоб мати вміст похідного холестанолу і вміст протиракового засобу від 0,0001 до 80 мас. % (як ефективного інгредієнта). Коли хіміотерапевтичний засіб проти раку за даним винаходом надається у вигляді набору, набір може бути сконструйований для незалежної упаковки відповідної лікарської форми, в тому числі, окремо, похідного холестанолу, представленого формулою (1), або його сполуки включення з циклодекстрином і протиракового засобу, кожна з яких отримана вказаним вище способом, і використання кожної фармацевтичної композиції, взятої окремо з відповідної створення позитивного заряду на поверхні ліпідної мембрани. Приклади таких амінів включають аліфатичні аміни, такі як стеариламін і олеїламін, і ароматичні аміни, такі як флуореніламін. З них особливо переважним для використання є стеариламін. Переважно амін міститься в кількості 0,04-0,15 моль, переважніше, 0,1-0,15 моль на 1 моль мембранного компонента (фосфоліпіду). Крім вищезгаданих компонентів, при необхідності, ліпосома також може містити стабілізатор структури мембрани, такий як холестерин, жирну кислоту, діацетилфосфат і т. д. Водний розчин, що переважно використовується для диспергування мембранного компонента, являє собою, переважно, воду, фізіологічний розчин, буферний розчин, водний розчин цукру або їх суміш. Можна використовувати або органічний або неорганічний буфер, доти, доки буфер надає буферуючу дію поблизу концентрації іонів водню в рідині організму. Приклади таких буферів включають фосфатний буфер. Не ставиться особливого обмеження відносно способу отримання ліпосомальної композиції, і як правило, можна вибрати відомі способи. Приклади способу, який можна використовувати, включають способи, розкриті в JP-A-1982-82310, JP-A-1985-12127, JP-A-1985-58915, JP-A-1989117824, JP-A-1989-167218, JP-А-1992-29925 і JP-A-1997-87168; спосіб, розкритий в Methods of Biochemical Analysis (1988), 33, c.337; або спосіб, розкритий в "Liposome" (опубліковано Nankodo). Не ставиться особливого обмеження відносно протиракового засобу, який використовують в комбінації з похідним холестанолу, представленим формулою (1), або його сполукою включенням з циклодекстрином, і можуть бути використані відомі хіміотерапевтичні засоби проти раку. Переважно використовувати стандартні терапевтичні засоби, які встановлені відносно таргетної терапії раку. Конкретні приклади включають алкілуючі засоби, такі як циклофосфамід, іфосфамід, мелфалан (L-PAM), бусульфан і карбохіон; антагоністи метаболізму, такі як 6-меркаптопурин (6МР), метотрексат (МТХ), 5-фторурацил (5-FU), тегафур, еноцитабін (ВНАС) і антагоністи метаболізму фолієвої кислоти (сполука пеметрекседу (алімту, МТА), і т. д.); канцеростатичні антибіотики, такі як актиноміцин D, даунорубіцин, блеоміцин, пепломіцин, мітоміцин С, акларубіцин і неокарциностатин (NCS); рослинні алкалоїди, такі як вінкристин, віндезин, вінбластин, і таксанові протиракові засоби (таксотер (доцетаксел) і таксол (паклітаксел, TXL), і т. д.); і сполуки платини, такі як цисплатин (CDDP) і карбоплатин, оксаліплатин (L-OHP). Вказані протиракові засоби можна використовувати одні або в комбінації двох або більше засобів. Як показано в прикладах, описаних в даному описі нижче, коли похідне холестанолу, представлене формулою (1), або його сполуку включення з циклодекстрином використовують в комбінації з протираковим засобом, проліферація ракових клітин різних типів істотно 4 UA 101831 C2 5 10 15 20 25 30 35 40 45 50 55 пригнічується в порівнянні з випадком введення тільки одного засобу. Отже, така комбінована хіміотерапія може радикально посилити терапевтичну ефективність і ослабити побічну дію, і фармацевтичний продукт, який містить вказані інгредієнти, є застосовним хіміотерапевтичним засобом проти раку. Не ставиться особливого обмеження відносно раку, який можна ефективно лікувати за допомогою введення хіміотерапевтичного засобу проти раку за даним винаходом. Приклади раку як мішені включають злоякісні пухлини, такі як рак шлунка, рак товстої кишки, рак підшямкової залози, рак матки, рак яєчників, рак легень, рак жовчного міхура, рак стравоходу, рак печінки, рак молочної залози, мезотеліома і рак передміхурової залози. Форма хіміотерапевтичного засобу проти раку за даним винаходом може являти собою змішаний засіб, в якому вищезгадані інгредієнти змішані у відповідному відношенні, кожен в ефективній кількості, з утворенням єдиної лікарської форми (однокомпозиційний тип), або може являти собою набір, який складається з відповідних лікарських форм вищезгаданих інгредієнтів, кожна з яких сформована незалежно, причому кожна включає ефективну кількість, і який дає можливість вводити лікарські форми одночасно або роздільно з інтервалами (двокомпозиційний тип). Подібно до звичайних фармацевтичних композицій, не ставиться особливого обмеження відносно лікарської форми вищезгаданої композиції, і форма може являти собою будь-яку тверду форму, таку як таблетка, рідку форму, таку як ін'єкція, сухий порошок, який розчиняють перед застосуванням, і т. д. Композицію можна отримати способом, відомим в техніці. Також можна використати всі фармацевтично прийнятні носії (ексципієнти або розріджувачі, такі як наповнювач, речовина, яка додає об'єму, і зв'язувальна речовина), що звичайно використовуються в техніці. Наприклад, пероральну тверду форму можна отримати, змішуючи лікарські інгредієнти за даним винаходом з ексципієнтом і необов'язковою зв'язувальною речовиною, речовиною, яка сприяє розсипанню, змащувальною речовиною, барвником, коригентом, віддушкою і т. д., і формуючи суміш в таблетки, таблетки з покриттям, гранули, порошок, капсули і т. д. способом, відомим в техніці. Такі добавки можуть являти собою добавки, що звичайно використовуються в техніці. Приклади ексципієнта включають лактозу, сахарозу, хлориди натрію, глюкозу, крохмаль, карбонат кальцію, каоліну, мікрокристалічну целюлозу і кремнієву кислоту. Приклади зв'язувальної речовини включають воду, етанол, пропанол, звичайний сироп, розчин глюкози, розчин крохмалю, розчин желатину, карбоксиметилцелюлозу, гідроксипропілцелюлозу, гідроксипропілкрохмаль, метилцелюлозу, етилцелюлозу, шелак, фосфат кальцію і полівінілпіролідон. Приклади речовини, яка сприяє розсипанню, включають сухий крохмаль, альгінат натрію, порошок агару, гідрокарбонат натрію, карбонат кальцію, лаурилсульфат натрію, моногліцерилстеарат і лактозу. Приклади змащувальної речовини включають очищений тальк, стеарати, боракс і поліетиленгліколь. Приклади коригенту включають сахарозу, цедру апельсина, лимонну кислоту і винну кислоту. Пероральну рідку композицію можна отримати, змішуючи лікарські інгредієнти за даним винаходом з коригентом, буфером, стабілізатором, віддушкою і т. д., і формуючи суміш в рідину для внутрішнього застосування, сироп, еліксир і т. д. способом, відомим в техніці. Коригент, що використовується в препараті, може являти собою будь-який з вищеперелічених коригентів. Приклади буфера включають цитрат натрію. Приклади стабілізатора включають трагакант, аравійську камедь і желатин. Розчини для ін'єкції можна отримати, змішуючи лікарські інгредієнти за даним винаходом з такими добавками, як регулювальник рН, буфер, стабілізатор, засіб для регулювання тонічності і місцевий анестезуючий засіб, і т. д., і формуючи упаковки перед застосуванням. З іншого боку, кожна фармацевтична композиція може зберігатися в упаковці, яка підходить для кожного моменту комбінованого введення. Доза хіміотерапевтичного засобу проти раку за даним винаходом змінюється в залежності від маси тіла, віку, статі, симптомів у пацієнта, який його потребує, способу і частоти введення пацієнту, який його потребує, і т. д. Як правило, щодобова доза для дорослого становить приблизно 0,1-30 мг/кг похідного холестанолу (1), переважно 3-10 мг/кг. Доза протиракового засобу може знаходитися в інтервалі, встановленому відносно даного засобу, або може бути нижче такого інтервалу. Не ставиться особливе обмеження відносно частоти введення, і засіб можна вводити один або декілька разів на добу. Однократне введення переважне. Коли використовують набір, кожну з композицій, що включають окремі інгредієнти лікарського засобу, можна вводити одночасно або з перервою. 5 UA 101831 C2 5 10 15 20 25 30 35 40 45 50 55 Далі даний винахід буде описуватися детальніше за допомогою прикладів, які не треба розглядати як такі, що обмежують винахід. Приклади Приклад 1 Вплив додання лікарського засобу на інгібування проліферації ракових клітин 4 Клітини colon26 (мишачого раку товстої кишки) інокулюють в 96-ямковий планшет (1×10 клітин/50 мкл середовища 10 % FCS-RPMI/ямку) і інкубують при 37 °C протягом 16 годин.) В кожну ямку додають цисплатин (скорочено "CDDP") і/або сполуку включення з циклодекстрином (скорочено "GC-CD") похідного холестанолу, в якому G в формулі (1) являє собою ClcNAcβ(скорочено "GC") (багаторазове розбавлення середовищем FCS(-), кінцева концентрація 500≤ мкМ, 50 мкл), і потім інкубують при 37 °C протягом двох діб. GC-CD отримують згідно зі способом, розкритим в прикладі 1(2) в патентному документі 4. Конкретно, отримують 40 % водний розчин гідроксипропіл-β-циклодекстрину, до розчину додають GC, потім змішують за допомогою перемішування (80 °C протягом 30 хвилин) і за допомогою цього отримують GC-CD. Як контроль використовують ямки, в які додають тільки середовище FCS(-). Підрахунок життєздатних клітин здійснюють за допомогою набору для підрахунку клітин (продукт Dojin). Ступінь інгібування проліферації клітин (СРІ) (%) обчислюють за допомогою наведеного далі рівняння. Результати показує фіг. 1. OD 450 650 оброблених клітин 100 Ступінь CPI (%) 1 OD 450 650 необроблен их клітин Приклад 2 Дія інгібування проліферації різних ракових клітин Повторюють процедуру прикладу 1 за винятком того, що клітини colon26 замінюють на MKN45 (рак шлунка людини), NCIH226 (рак легень людини) і Соlо201 (рак товстої кишки людини). Ступінь СРІ (%) визначають подібним способом. Результати показує фіг. 2. У прикладі 2 також використовують сполуку включення з циклодекстрином (скорочено "GGCCD") похідного холестанолу, в якому G в формулі (1) являє собою ClcNAcβ1,4- Galβ- (скорочено "GGC"). GGC-CD отримують способом, схожим з вищезгаданим способом отримання GC-CD, за винятком того, що похідне холестанолу замінюють на GGC. Визначають ступінь СРІ відносно ракових клітин. Результати показує фіг. 3. Приклад 3 Вплив додання лікарського засобу на інгібування проліферації ракових клітин in vivo У приведених далі прикладах як піддослідних тварин використовують мишей Balb/c (6тижневі самиці). 4 (1) Мишам інокулюють інтраперитонеально клітини colon26 (1×10 клітин/миші) (день 0). На наступний день після інокуляції (день 1) CDDP і/або GC-CD доводять фізіологічним розчином (нормальний фізіологічний розчин Otsuka) до потрібної концентрації, і CDDP, GC-CD або CDDP+GC-CD (500 мкл) вводять мишам інтраперитонеально з подальшим відбором. В день 19 мишей розтинають, і визначають масу брижі і великого сальника. Контрольній групі вводять тільки фізіологічний розчин (500 мкл) (n=10; 10 мишей на групу). Результати показує фіг. 4. 4 (2) Мишам інокулюють інтраперитонеально клітини colon26 (1×10 клітин/миші) (день 0). В день 1, день 2, день 3, день 6, день 7 і день 8 CDDP і/або GC-CD доводять фізіологічним розчином (нормальний фізіологічний розчин Otsuka) до потрібної концентрації, і CDDP, GC-CD або CDDP+GC-CD (500 мкл) вводять мишам інтраперитонеально з подальшим відбором. В день 21 мишу розтинають, і визначають масу брижі і великого сальника. Контрольній групі вводять тільки фізіологічний розчин (500 мкл) (n=10; 10 мишей на групу). Результати показує фіг. 5. (3) Мишам інокулюють інтраперитонеально клітини colon26 (1×10 клітин/миші) (день 0). В день 7 CDDP і/або GC-CD доводять фізіологічним розчином (нормальний фізіологічний розчин Otsuka) до потрібної концентрації, і CDDP, GC-CD або CDDP+GC-CD (500 мкл) вводять мишам інтраперитонеально з подальшим відбором. В день 18 мишей розтинають, і визначають масу брижі і великого сальника. Контрольній групі вводять тільки фізіологічний розчин (500 мкл) (n=10; 10 мишей на групу). Результати показує фіг. 6. Приклад 4 Протипухлинна дія при введенні лікарського засобу Як піддослідних тварин використовують мишей Balb/c (6-тижневі самиці). Мишам 4 інокулюють інтраперитонеально клітини colon26 (1×10 клітин/миші) (день 0). В день 2 і/або день 6 UA 101831 C2 5 10 15 20 25 30 3 CDDP і/або GC-CD доводять фізіологічним розчином (нормальний фізіологічний розчин Otsuka) до потрібної концентрації, і вводять мишам інтраперитонеально CDDP (один раз в день 2), GC-CD (двічі, в день 2 і день 3) або CDDP (один раз в день 2) + GC-CD (двічі, в день 2 і день 3) (500 мкл) з подальшим відбором. Тривалість виживаності (дні) підраховують до дня 43. Контрольній групі вводять тільки фізіологічний розчин (500 мкл) (n=10; 10 мишей на групу). Результати показує фіг. 7. Приклад 5 Протипухлинна дія при введенні лікарського засобу Як піддослідних тварин використовують мишей Balb/c (6-тижневі самиці). Мишам 4 інокулюють інтраперитонеально клітини colon26 (5×10 клітин/миші) (день 0). Після підтвердження того, що пухлина досягла розміру приблизно 4 мм (день 7 - день 10 після інокуляції), CDDP і/або GGC-CD доводять фізіологічним розчином (нормальний фізіологічний розчин Otsuka) до потрібної концентрації, і CDDP, GGC-CD або CDDP+GGC-CD (200 мкл) вводять мишам в хвостову вену з подальшим відбором. Зміну розміру пухлини в залежності від часу перевіряють до дня 21, і визначають відповідний розмір пухлини. Контрольній групі вводять тільки фізіологічний розчин (200 мкл) (n=7; 7 мишей на групу). Результати показує фіг. 8. Приклад 6 Інгібуюча дія додання лікарського засобу на метастазування раку Як піддослідних тварин використовують мишей Balb/c (6-тижневі самиці). Мишам 4 інокулюють інтраперитонеально клітини colon26 (5×10 клітин/миші) (день 0). Відразу ж після інокуляції CDDP і/або GC-CD або GGC-CD доводять фізіологічним розчином (нормальний фізіологічний розчин Otsuka) до потрібної концентрації, і CDDP, GC-CD (або GGC-CD) або CDDP+GC-CD (або GGC-CD) (200 мкл) вводять мишам в каудальну вену з подальшим відбором. В день 14 мишей розтинають, і підраховують пухлинні потовщення в легенях. Контрольній групі речовину не вводять (n=10; 10 мишей на групу). Результати показує фіг. 9. Як описано в даному описі вище, за рахунок використання в комбінації похідного холестанолу за даним винаходом або його сполуки включення з циклодекстрином і протиракового засобу істотно інгібується проліферація різних ракових клітин, і можна отримати синергічний ефект і/або ефект потенціювання протипухлинної дії відомого протиракового засобу. ФОРМУЛА ВИНАХОДУ 35 1. Хіміотерапевтичний засіб проти раку, що містить, в комбінації, похідне холестанолу, представлене формулою (1) H3 C CH3 CH3 G 40 45 50 O H , (1) де G являє собою GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-, або його сполуку включення з циклодекстрином і протираковий засіб. 2. Хіміотерапевтичний засіб проти раку за п. 1, де в формулі (1) G являє собою GlcNAc-Gal- або GlcNAc-. 3. Хіміотерапевтичний засіб проти раку за п. 1 або 2, де протираковий засіб являє собою один або декілька видів засобів, вибраних з групи, яка складається з протиракового засобу, що являє собою таксан, протиракового засобу, що являє собою комплекс платини, сполуки пеметрекседу і фторурацилу. 4. Хіміотерапевтичний засіб проти раку за п. 3, де протираковий засіб являє собою один або декілька видів засобів, вибраних з групи, яка складається з паклітакселу, доцетакселу, алімти, 5-FU, цисплатину і оксаліплатину. 5. Хіміотерапевтичний засіб проти раку за будь-яким з пп. 1-4, який являє собою змішаний засіб. 7 UA 101831 C2 5 6. Хіміотерапевтичний засіб проти раку за будь-яким з пп. 1-4, який знаходиться в формі набору, що включає лікарський засіб, який містить похідне холестанолу, і лікарський засіб, який містить протираковий засіб. 7. Хіміотерапевтичний засіб проти раку за п. 6, де лікарський засіб, який містить похідне холестанолу, являє собою ліпосомальну композицію. 8. Застосування, в комбінації, похідного холестанолу, представленого формулою (1) H3 C CH3 CH3 G 10 O H , (1) де G являє собою GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-, або його сполуки включення з циклодекстрином і протиракового засобу для отримання хіміотерапевтичного засобу проти раку. 9. Протиракова хіміотерапія, що характеризується введенням пацієнту, який потребує цього, похідного холестанолу, представленого формулою (1) H3 C CH3 CH3 G 15 O H , (1) де G являє собою GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- або GlcNAc-, або його сполуки включення з циклодекстрином і протиракового засобу в комбінації. 10. Протиракова хіміотерапія за п. 9, де похідне холестанолу або його сполуку включення з циклодекстрином і протираковий засіб вводять пацієнту, який потребує цього, одночасно або окремо з інтервалами. 8 UA 101831 C2 9 UA 101831 C2 10 UA 101831 C2 11 UA 101831 C2 12 UA 101831 C2 Комп’ютерна верстка М. Ломалова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 13
ДивитисяДодаткова інформація
Назва патенту англійськоюCombined use of cholestanol derivative for antitumor therapy
Автори англійськоюYazawa, Shin, Nishimura, Toyo, Asao, Takayuki
Назва патенту російськоюКомбинированное применение производных холестанола для противораковой терапии
Автори російськоюЯзава Син, Нисимура Тойо, Асао Такаюки
МПК / Мітки
МПК: A61K 31/7072, A61K 45/00, A61K 31/282, A61K 31/704, A61P 43/00, A61P 35/00, A61K 33/24, A61K 31/337, C07J 9/00
Мітки: застосування, протиракової, комбіноване, похідних, терапії, холестанолу
Код посилання
<a href="https://ua.patents.su/15-101831-kombinovane-zastosuvannya-pokhidnikh-kholestanolu-dlya-protirakovo-terapi.html" target="_blank" rel="follow" title="База патентів України">Комбіноване застосування похідних холестанолу для протиракової терапії</a>
Попередній патент: Спосіб боротьби з водними бур’янами
Випадковий патент: Спосіб дегазації сталі від водню












