Димери похідних артемізиніну, їх одержання і їх застосування в терапії
Формула / Реферат
1. Протираковий засіб, який являє собою сполуку загальної формули (І):
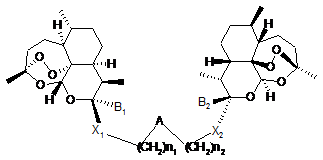 , (I)
, (I)
в якій:
a) А означає двовалентну групу, яку вибирають з S-, -SO-, -SO2-, -NH-, N(CH3)-, -N(CH2-C(O)O-CH2-CH3)-, -N(CH2-COOH)-, епоксиду, (C1-C6)-алкенілену, -NHCO-, -1,2,3-триазолу, -NHSO2-;
b) X1 і Х2 є однаковими або різними і їх вибирають з N, О, S;
c) В1 і В2 є однаковими і означають CF3;
d) n1 і n2 є однаковими або різними і мають значення 1, 2, 3 або 4;
у вигляді основи або у вигляді кислотно-адитивної солі, а також у вигляді гідрату або сольвату.
2. Засіб за п. 1, який відрізняється тим, що X1 і Х2 є однаковими і означають О.
3. Засіб за п. 1 або 2, який відрізняється тим, що n1 і n2 є однаковими і мають значення 2, 3 або 4.
4. Засіб за п. 1 або 2, який відрізняється тим, що А вибирають з -NH-, -N(CH2-C(O)O-CH2-CH3)- або -N(CH2-COOH)-, і n1 і n2 є однаковими і мають значення 2.
5. Засіб за п.1 або 2, який відрізняється тим, що А вибирають з (С1-С6)-алкенілену або епоксиду, і n1 і n2 є однаковими і мають значення 1.
6. Засіб за п. 1 або 2, який відрізняється тим, що А вибирають з -NHCO- або -1,2,3-триазолу, і n1 і n2 є різними і, незалежно, мають значення 1 або 2.
7. Засіб, який являє собою сполуку, вибрану з:
- (3S,5aS,6R,8aS,9R,10R,12R,12aR,3’S,5’aS,6’R,8’aS,9’R,10’R,12’R,12’aR)-10,10'-[тioбic(2,1-eтaндiiлoкcи)]бic[дeкaгiдpo-3,6,9-тpимeтил-10-(трифторметил)-3,12-епокси-12Н-пірано[4,3-j]-1,2-бензодіоксепіну];
- (3S,5aS,6R,8aS,9R,10R,12R,12aR,3’S,5’aS,6’R,8’aS,9’R,10’R,12’R,12’aR)-10,10'-[сульфінілбіс(2,1-етандіїлокси)]біс[декагідро-3,6,9-триметил-10-(трифторметил)-3,12-епокси-12H-пірано[4,3-j]-1,2-бензодіоксепіну];
- (3S,5aS,6R,8aS,9R,10R,12R,12aR,3’S,5’aS,6’R,8’aS,9’R,10’R,12’R,12’aR)-10,10'-[сульфонілбіс(2,1-етандіїлокси)]біс[декагідро-3,6,9-триметил-10-(трифторметил)-3,12-епокси-12Н-пірано[4,3-j]-1,2-бензодіоксепіну];
- (3S,5aS,6R,8aS,9R,10R,12R,12aR,3’S,5’aS,6’R,8’aS,9’R,10’R,12’R,12’aR)-10,10'-[тіобіс(3,1-пропандіїлокси)]біс[декагідро-3,6,9-триметил-10-(трифторметил)-3,12-епокси-12Н-пірано[4,3-j]-1,2-бензодіоксепіну];
- (3S,5aS,6R,8aS,9R,10R,12R,12aR,3’S,5’aS,6’R,8’aS,9’R,10’R,12’R,12’aR)-10,10'-[cyльфiнiлбic(3,l-пpoпaндiїлoкcи)]бic[дeкaгiдpo-3,6,9-тpимeтил-10-(трифторметил)-3,12-епокси-12H-пірано[4,3-j]-1,2-бензодіоксепіну];
- (3S,5aS,6R,8aS,9R,10R,12R,12aR,3’S,5’aS,6’R,8’aS,9’R,10’R,12’R,12’aR)-10,10'-[сульфонілбіс(3,1-пропандіїлокси)]біc[декагідро-3,6,9-триметил-10-(трифторметил)-3,12-епокси-12H-пірано[4,3-j]-1,2-бензодіоксепіну];
- (3S,5aS,6R,8aS,9R,10R,12R,12aR,3’S,5’aS,6’R,8’aS,9’R,10’R,12’R,12’aR)-10,10'-[тіобіс(4,1-бутандіїлокси)]біс[декагідро-3,6,9-триметил-10-(трифторметил)-3,12-епокси-12H-пірано[4,3-j]-1,2-бензодіоксепіну];
- 2-[[(3R,5aS,6R,8aS,9R,10R,12R,12aR)декагідро-3,6,9-триметил-10-(трифторметил)-3,12-епокси-12Н-пірано[4,3-j]-1,2-бензодіоксепін-10-іл]окси]-N-[2-[[(3R,5aS,6R,8aS,9R,10R,12R,12aR)декагідро-3,6,9-триметил-10-(трифторметил)-3,12-епокси-12H-пірано[4,3-j]-1,2-бензодіоксепін-10-іл]оксі]етил]-N-метилетанаміну;
- 2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(триформетил)декагідро-3,12-епокси[1,2]діоксепіно[4,3-і]ізохромен-10-іл]окси}-N-(2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(триформетил)декагідро-3,12-епокси[1,2]діоксепіно[4,3-і]ізохромен-10-іл]оксі}етил)етанаміну;
- етил-N,N-бic(2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(триформетил)декагідро-3,12-епокси[1,2]діоксепіно[4,3-і]ізохромен-10-іл]оксі}етил)гліцинату;
- N,N-бic(2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(триформетил)декагідро-3,12-епокси[1,2]діоксепіно[4,3-і]ізохромен-10-іл]оксі}етил)гліцину;
- 2-{[(3S,5aS,6R,8aS,9R,10R,12R,12аR)-3,6,9-триметил-10-(триформетил)декагідро-3,12-епокси[1,2]діоксепіно[4,3-і]ізохромен-10-іл]оксі}-N-(2-{[(3S,5aS,6R,8aS,9R,10R,12R,12аR)-3,6,9-триметил-10-(триформетил)декагідро-3,12-епокси[1,2]діоксепіно[4,3-і]ізохромен-10-іл]оксі}етил)ацетаміду;
- (3S,5aS,6R,8aS,9R,10R,12R,12aR,3’S,5’aS,6’R,8’aS,9’R,10’R,12’R,12’aR)-10,10'-[(2Е)-бут-2-ен-1,4-діїлбіс(окси)]-біс[3,6,9-триметил-10-(трифторметил)декагідро-3,12-епокси[1,2]діоксепіно[4,3-і]ізохромену];
- (3S,5aS,6R,8aS,9R,10R,12R,12aR,3’S,5’aS,6’R,8’aS,9’R,10’R,12’R,12’aR)-10,10'-[(2Z)-бут-2-eн-1,4-діїлбіс(окси)]біс[3,6,9-триметил-10-(трифторметил)декагідро-3,12-епокси[1,2]діоксепіно[4,3-і]ізохромену];
- (3S,5aS,6R,8aS,9R,10R,12R,12aR,3’S,5’aS,6’R,8’aS,9’R,10’R,12’R,12’aR)-10,10'-[(2R,3R)-оксиран-2,3-діїлбіс(метиленокси)]-бic[3,6,9-триметил-10-(трифторметил)декагідро-3,12-епокси[1,2]діоксепіно[4,3-і]ізохромену];
- 1-(2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-тpимeтил-10-(трифторметил)декагідро-3,12-епокси[1,2]діоксепіно[4,3-і]ізохромен-10-іл]оксі}етил)-4-({[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(трифторметил)декагідро-3,12-епокси[1,2]діоксепіно[4,3-і]ізохромен-10-іл]окси}метил)-1Н-1,2,3-триазолу;
- 1-(2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(трифторметил)декагідро-3,12-епокси[1,2]діоксепіно[4,3-і]ізохромен-10-іл]оксі}етил)-5-({[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9-триметил-10-(трифторметил)декагідро-3,12-епокси[1,2]діоксепіно[4,3-і]ізохромен-10-іл]оксі}етил)-1Н-1,2,3-триазолу.
8. Засіб загальної формули (І), як він визначений у будь-якому з пп. 1-7, який відрізняється тим, що він знаходиться в
1) нехіральній формі, або
2) рацемічній формі, або
3) збагаченій одним стереоізомером формі, або
4) збагаченій одним енантіомером формі;
і у випадку необхідності може бути перетворений в сіль.
9. Лікарський засіб, який відрізняється тим, що він містить сполуку формули (І) за будь-яким з пп. 1-8, або її фармацевтично прийнятну кислотно-адитивну сіль, або гідрат або сольват сполуки формули (І).
10. Фармацевтична композиція, яка відрізняється тим, що вона містить сполуку формули (І) за будь-яким з пп. 1-8, або фармацевтично прийнятну сіль, гідрат або сольват цієї сполуки, а також щонайменше один фармацевтично прийнятний ексципієнт.
11. Проміжний продукт, який являє собою сполуку загальної формули (II):
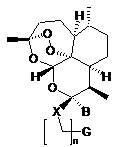 , (ІІ)
, (ІІ)
в якій X означає атом кисню, n має значення 1, 2, 3 або 4, В означає трифторметильну групу і G означає атом брому або групу -N3.
Текст
1. Протираковий засіб, який являє собою сполуку загальної формули (І): C2 2 (19) 1 3 94744 4 (трифторметил)-3,12-епокси-12H-пірано[4,3-j]-1,2іл]оксі}етил)-4бензодіоксепіну]; ({[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9- 2-[[(3R,5aS,6R,8aS,9R,10R,12R,12aR)декагідротриметил-10-(трифторметил)декагідро-3,123,6,9-триметил-10-(трифторметил)-3,12-епоксиепокси[1,2]діоксепіно[4,3-і]ізохромен-1012Н-пірано[4,3-j]-1,2-бензодіоксепін-10-іл]окси]-Nіл]окси}метил)-1Н-1,2,3-триазолу; [2-[[(3R,5aS,6R,8aS,9R,10R,12R,12aR)декагідро1-(2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,93,6,9-триметил-10-(трифторметил)-3,12-епокситриметил-10-(трифторметил)декагідро-3,1212H-пірано[4,3-j]-1,2-бензодіоксепін-10епокси[1,2]діоксепіно[4,3-і]ізохромен-10іл]оксі]етил]-N-метилетанаміну; іл]оксі}етил)-52-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9({[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9триметил-10-(трифторметил)декагідро-3,12триметил-10-(трифторметил)декагідро-3,12епокси[1,2]діоксепіно[4,3-і]ізохромен-10-іл]окси}-Nепокси[1,2]діоксепіно[4,3-і]ізохромен-10(2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9іл]оксі}етил)-1Н-1,2,3-триазолу. триметил-10-(трифторметил)декагідро-3,128. Засіб загальної формули (І), як він визначений у будь-якому з пп. 1-7, який відрізняється тим, що епокси[1,2]діоксепіно[4,3-і]ізохромен-10іл]оксі}етил)етанаміну; він знаходиться в етил-N,N-бic(21) нехіральній формі, або {[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,92) рацемічній формі, або триметил-10-(трифторметил)декагідро-3,123) збагаченій одним стереоізомером формі, або епокси[1,2]діоксепіно[4,3-і]ізохромен-104) збагаченій одним енантіомером формі; іл]оксі}етил)гліцинату; і у випадку необхідності може бути перетворений в N,N-бic(2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)сіль. 9. Лікарський засіб, який відрізняється тим, що 3,6,9-триметил-10-(трифторметил)декагідро-3,12епокси[1,2]діоксепіно[4,3-і]ізохромен-10він містить сполуку формули (І) за будь-яким з пп. іл]оксі}етил)гліцину; 1-8, або її фармацевтично прийнятну кислотно2-{[(3S,5aS,6R,8aS,9R,10R,12R,12аR)-3,6,9адитивну сіль, або гідрат або сольват сполуки триметил-10-(трифторметил)декагідро-3,12формули (І). 10. Фармацевтична композиція, яка відрізняється епокси[1,2]діоксепіно[4,3-і]ізохромен-10-іл]оксі}-N(2-{[(3S,5aS,6R,8aS,9R,10R,12R,12аR)-3,6,9тим, що вона містить сполуку формули (І) за будьтриметил-10-(трифторметил)декагідро-3,12яким з пп. 1-8, або фармацевтично прийнятну сіль, епокси[1,2]діоксепіно[4,3-і]ізохромен-10гідрат або сольват цієї сполуки, а також іл]оксі}етил)ацетаміду; щонайменше один фармацевтично прийнятний (3S,5aS,6R,8aS,9R,10R,12R,12aR,3’S,5’aS,6’R, ексципієнт. 8’aS,9’R,10’R,12’R,12’aR)-10,10'-[(2Е)-бут-2-ен-1,411. Проміжний продукт, який являє собою сполуку діїлбіс(окси)]-біс[3,6,9-триметил-10загальної формули (II): (трифторметил)декагідро-3,12H епокси[1,2]діоксепіно[4,3-і]ізохромену]; O (3S,5aS,6R,8aS,9R,10R,12R,12aR,3’S,5’aS,6’R, 8’aS,9’R,10’R,12’R,12’aR)-10,10'-[(2Z)-бут-2-eн-1,4O O діїлбіс(окси)]біс[3,6,9-триметил-10(трифторметил)декагідро-3,12H H O епокси[1,2]діоксепіно[4,3-і]ізохромену]; (3S,5aS,6R,8aS,9R,10R,12R,12aR,3’S,5’aS,6’R, X B 8’aS,9’R,10’R,12’R,12’aR)-10,10'-[(2R,3R)-оксиранG 2,3-діїлбіс(метиленокси)]-бic[3,6,9-триметил-10n , (ІІ) (трифторметил)декагідро-3,12в якій X означає атом кисню, n має значення 1, 2, 3 епокси[1,2]діоксепіно[4,3-і]ізохромену]; або 4, В означає трифторметильну групу і G 1-(2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9означає атом брому або групу -N3. тpимeтил-10-(трифторметил)декагідро-3,12епокси[1,2]діоксепіно[4,3-і]ізохромен-10 Даний винахід стосується димерів похідних артемізиніну, їх одержання і їх застосування в терапії. Більш конкретно, винахід стосується димерів похідних артемізиніну, що володіють протираковою активністю і, зокрема, активністю, що інгібує клітинну проліферацію. На сьогоднішній день, у випадку більшості комерційно доступних сполук, що використовуються в хіміотерапії, виникають значні проблеми відносно побічних дій, толерантності пацієнтами або резистентності. Таким чином, існує значна потреба в нових класах сполук, здатних діяти як протиракові засоби. З природних сполук, артемізинін являє собою ендопероксидний сесквітерпен, який виділений в 1971 р. з рослини Artemisia annua і володіє протималярійними властивостями. Одержані деякі прості похідні, такі, як гідроартемізинін або простий артемізиніновий ефір, і вони також володіють протималярійними властивостями. Крім цієї активності, показано, що деякі похідні і димери артемізиніну володіють протираковими властивостями (J. Med. Chem., 46, 987-994 (2003); патент США 6790863). Проблемою, яку мається намір вирішити згідно 5 94744 6 з даним винаходом, є одержання нових сполук в випадку яких В1 і В2 є однаковими і означають CF3. формі димерів артемізиніну, що володіють З сполук загальної формули (I) об'єктів даного протираковою активністю. винаходу можна також назвати сполуки загальної Об'єктом даного винаходу є сполуки, що формули (I), у випадку яких Х1 і Х2 є однаковими і відповідають загальній формулі (I): означають О. З цих сполук переважними сполуками є такі, у випадку яких А означає S-, -SO - або -SO2-. Іншими сполуками загальної формули (I) є такі, у випадку яких А означає -N(CH3)-. Згідно з даним винаходом, n1 і n2 є переважно однаковими і мають значення 2, 3 або 4. Іншими сполуками загальної формули (I) є такі, у випадку яких А вибирають з -NH-, -N(CH2C(О)O-CH2-CH3)- або -N(CH2-COOH)- і які, у разі необхідності, відрізняються тим, що n1 і n2 є однаковими і мають значення 2. Іншими сполуками загальної формули (I) є такі, у випадку яких А вибирають з (С1-С6)алкенілену або епоксиду і які, у разі необхідності, в якій: відрізняються тим, що n1 і n2 є однаковими і мають а) А означає двовалентну групу, яку значення 1. + вибирають з S-, -SO-, -SO2-, -NRa-, -N (О )Ra-, Іншими сполуками загальної формули (I) є CONRa-, -NRaSO2-, -CO-, -COO-, -NRaCONRb-, такі, у випадку яких А вибирають з -NHCO- або NRaSO2NRb-, OP(О)(ORa)O-, -OCONRa-, -OCOO-, 1,2,3-триазолу і які, у разі необхідності, O-, -С(=N-ORa)-, епоксидної групи, (С1-С6)відрізняються тим, що n1 і n2 є різними і, алкілену, (С1-С6)-алкенілену, (С1-С6)алкінілену, незалежно, мають значення 1 або 2. (С3-С8)-циклоалкілену, (С4-С8)-циклоалкенілену, Сполуки формули (I) можуть включати один арилену, гетероарилену, гетероциклілу, причому або декілька асиметричних атомів вуглецю. Отже, ці дев'ять останніх груп, у разі необхідності, вони можуть існувати в формі енантіомерів або можуть бути заміщені одним або декількома діастереоізомерів. Ці енантіомери, замісниками Ra або Rb; діастереоізомери, а також їх суміші, включаючи b) Х1 і Х2 є однаковими або різними і їх рацемічні суміші, становлять частину винаходу. вибирають з N, О, S; Сполуки формули (I) можуть існувати у вигляді с) В1 і В2 є однаковими або різними і основ або кислотно-адитивних солей. Такі означають групу -(CF2)p-Rc, в якій Rc являє собою, адитивні солі становлять частину винаходу. незалежно, F, (С1-С6)-алкіл, (С1-С6)-алкеніл, (С1Ці солі можуть бути одержані з С6)-алкініл, (С3-С8)-циклоалкіл, (С4-С8)фармацевтично прийнятними кислотами, однак, циклоалкеніл, арил, гетероарил, гетероцикліл, солі інших кислот, придатні, наприклад, для COR1, -COOR1, -CONR1R2, -OR1, -SR1, причому ці очищення або виділення сполук формули (I), групи, у разі необхідності, можуть бути заміщені також становлять частину винаходу. одним або декількома, однаковими або різними, Сполуки формули (I) також можуть існувати в замісниками Ra або Rb, і р має значення 1, 2 або 3; формі гідратів або сольватів, а саме, в формі d) n1 і n2 є однаковими або різними і мають асоціацій або комбінацій з однією або декількома значення 0, 1, 2, 3 або 4; молекулами води або з розчинником. Такі гідрати і е) Ra і Rb є однаковими або різними і їх, сольвати також становлять частину винаходу. незалежно, вибирають з атому водню, галогену, У рамках даного винаходу розуміють: (С1-С6)-алкілу, -(С1-С6)-алкіл-СOO-R1, -(С1-С6)- під атомом галогену: фтор, хлор, бром або алкіл-NR1R2, -(С1-С6)-алкіларилу, -(С1-С6)-алкенілу, йод; -(С1-С6)-алкінілу, арилу, гетероарилу, (С3-С8)- під алкільною групою: лінійну або циклоалкілу, (С4-С8)-циклоалкенілу, гетероциклілу, розгалужену насичену аліфатичну групу. Як -OR1, -OCOR1, -COR1, -COOR1, -CONR1R2, -NR1R2, приклади можна назвати метильну, етильну, -NR1COR2, -SR1, -SO2R1, -CN; пропільну, ізопропільну, бутильну, ізобутильну, f) R1 і R2 є однаковими або різними і їх, трет-бутильну, пентильну і т.д. групи; незалежно, вибирають з атому водню, (С1-С6)- під циклоалкільною групою: циклічну алкільну алкілу, (С1-С6)-алкенілу, (С1-С6)-алкінілу, (С3-С8)групу. Як приклади можна назвати циклопропільну, циклоалкілу, (С4-С8)-циклоалкенілу, арилу, метилциклопропільну, циклобутильну, гетероарилу, гетероциклілу; циклопентильну, циклогексильну і т.д. групи; у вигляді основи або у вигляді кислотно- під фторалкільною групою: алкільну групу, адитивної солі, а також у вигляді гідрату або один або декілька атомів водню якої замінені сольвату. атомом фтору; Жоден з цих димерів згідно з рівнем техніки (J. - під алкенільною групою: лінійну або Med, Chem., 46, 987-994 (2003); патент США розгалужену, моноабо поліненасичену 6790863) не заміщений групою В1 або В2, такою, як аліфатичну групу, що включає, наприклад, один вказана вище згідно з даним винаходом. або два етиленові зв'язки; З сполук загальної формули (I) об'єктів даного - під алкінільною групою: лінійну або винаходу можна, зокрема, назвати сполуки, у розгалужену, моноабо поліненасичену 7 94744 8 аліфатичну групу, що включає, наприклад, один замісник є моноциклічним і включає 4 або 5 атомів або два ацетиленові зв'язки; вуглецю і 1-3 гетероатоми. - під алкоксильною групою: -О-алкільний Зрозуміло, що двовалентна група А може бути радикал, де алкільною групою є така, як вказана пов'язана в двох можливих варіантах. Наприклад, вище; коли двовалентна група А означає -NHSO2-, - під арильною групою: циклічну ароматичну сполука загальної формули (I) може являти собою: групу, що включає 5-14 атомів вуглецю. Прикладами арильного замісника є замісники: феніл, нафт-1-ил, нафт-2-ил, антрацен-9-іл, 1,2,3,4-тетрагідронафт-5-ил і 1,2,3,4тетрагідронафт-6-ил; - під гетероарильною групою: циклічну ароматичну групу, що включає 1-13 атомів вуглецю і 1-4 гетероатоми. Прикладами гетероарильного замісника є замісники: пірол-1-іл, пірол-2-іл, пірол-3-іл, фурил, тієніл, імідазоліл, оксазоліл, тіазоліл, ізоксазоліл, ізотіазоліл, 1,2,4або триазоліл, оксадіазоліл, тіадіазоліл, тетразоліл, піридил, піримідил, піразиніл, 1,3,5-триазиніл, індоліл, бензо[b]фурил, бензо[b]тієніл, індазоліл, бензімідазоліл, азаіндоліл, хінолеїл, ізохінолеїл, карбазоліл і акридил. Термін «гетероатом», згідно з даним контекстом, стосується, щонайменше, двовалентного атому, відмінного від атома вуглецю. Прикладами гетероатому є N, О, S і Se; - під циклоалкільною групою: насичений або частково ненасичений, циклічний вуглеводневий замісник з 3-12 атомами вуглецю. Прикладами циклоалкільного замісника є замісники: Згідно з даним винаходом, сполуки загальної циклопропіл, циклобутил, циклопентил, формули (I) можуть бути одержані звичайними циклопентеніл, циклопентадієніл, циклогексил, способами органічної хімії. Приклади синтезу циклогексеніл, циклогептил, біцикло[2,2,1]гептил, проілюстровані на наведених нижче схемах 1-4, де циклооктил, біцикло[2,2,2]октил, адамантил і початкові сполуки і реагенти, коли спосіб їх пергідронафтил; одержання не описаний, є комерційно доступними - під гетероциклільною групою: насичений або або описуються в літературі або ж можуть бути частково ненасичений, циклічний вуглеводневий одержані відповідно до способів, які там описані замісник з 1-13 атомами вуглецю і 1-4 або які відомі фахівцеві в даній галузі. гетероатомами. Переважно, насичений або частково ненасичений, циклічний вуглеводневий Схема 1 9 94744 Схема 2 Схема 3 10 11 94744 12 Схема 4 Об'єктом даного винаходу є спосіб одержання сполуки загальної формули (I), відмінний тим, що сполуку наступної загальної формули (III): в якій В означає замісник В1 або В2, такий, як вказаний вище, піддають реакції заміщення атома брому з допомогою нуклеофілу, такого, як бромвмісний спирт, отримуючи сполуку наступної загальної формули (II): в якій Х означає замісник Х1 або Х2, такий, як вказаний вище, n означає n1 або n2, такий, як вказаний вище, і в якому або G означає групу, що видаляється, таку, як атом брому, і тоді цю сполуку загальної формули (II) піддають реакції нуклеофільного заміщення з метою одержання димера загальної формули (I) або попередника сполуки загальної формули (I), або G означає хімічну функціональну групу F1, яка може бути, у разі необхідності, активована шляхом реакції відновлення або окислення, і тоді цю сполуку загальної формули (II) вводять у взаємодію з іншою сполукою формули (II), де G означає групу, що видаляється, таку, як атом брому, або хімічну функціональну групу F2, яка може вступати у взаємодію з F1, з метою одержання димера загальної формули (I) або попередника сполуки загальної формули (I). Більш конкретно, об'єктом даного винаходу є сполуки загальної формули (II), в якій Х означає атом кисню, n має значення 0, 1, 2, 3 або 4, В означає трифторметильну групу і G означає атом брому, групу -N3, -NH2, алкеніл, алкініл або СООН. Ці сполуки придатні як проміжні сполуки для синтезу сполук загальної формули (I). Під групою, що видаляється, розуміють групу, яка може бути легко видалена з молекули шляхом розриву гетеролітичного зв'язку з видаленням електронної пари. Ця група також може бути легко замінена іншою групою, наприклад, під час реакції заміщення. Такими групами, що видаляються, є, наприклад, галогени або активована гідроксильна група, така, як метансульфонат, бензолсульфонат, птолуолсульфонат, трифлат, ацетат і т.д. Приклади груп, що видаляються, а також посилання на їх одержання, представлені в керівництві J. March «Advances in Organic Chemistry», третє видання, Wiley Interscience, стор. 310-316. У нижченаведених прикладах описується одержання деяких сполук згідно з винаходом. Ці приклади не є такими, що обмежують об'єм охорони винаходу і призначені тільки для 13 94744 14 пояснення даного винаходу. протягом 2 годин 15 хвилин, потім додають 10 мл Абревіатури: насиченого розчину гідрокарбонату натрію. °С = градус Цельсію; ССМ = тонкошарова Органічну фазу сушать над сульфатом магнію і хроматографія (ТШХ); δ = хімічний зсув; d = випаровують досуха при зниженому тиску. дублет (д); dd = розв'язаний дублет (дд); DMSOОдержаний маслянистий залишок 6 d = дейтерований диметилсульфоксид(ДМСОхроматографують на силікагелі, що попередньо d6); dt = дублет триплетів (дт); еq. = еквівалент кондиціонується з допомогою гептану, потім (екв.); ES+/- = іонізація електронним розпиленням елююється лінійним градієнтом 0-100% суміші В (методи утворення позитивних/негативних іонів); [(гептан/етилацетат), (90:10), (об'єм/об'єм)] в А g = грам (г); h = година; Hz = Гц; IC50 = константа (гептан). Отримують 217 мг (21%) очікуваної інгібування 50% активності; J = константа сполуки 2 у вигляді масла. взаємодії; m = мультиплет (м); mg = міліграм (мг); Rf=0,45 в системі (гептан/етилацетат), MHz = мегагерц (МГц); mL = мілілітр (мл); µL = (90:10), (об'єм/об'єм) + мікролітр (мкл); mm = міліметр (мм); µm = ES: m/z=481 (MNa ) 1 мікрометр (мкм); mmol = мілімоль (ммоль); ppm = Н-ЯМР (400 МГц; при використанні мільйонні часини (м.ч.); q = квадруплет (кв); Rf = спектрометра BRUKER AVANCE DRX-400; з 1 фронтальне співвідношення; RMN H = хімічними зсувами (δ в м.ч.) - в дейтерованому 1 протонний ядерний магнітний резонанс ( Н-ЯМР); хлороформі-d1 як розчинник (CDCl3-d1), s = синглет (с); sl = уширений синглет (уш.с); t = стандартизованому при 7,27, при температурі триплет (т); UV = ультрафіолет (УФ). 303 К): частково прихований 0,92 (м частково Приклад 1: прихований, 1H); 0,96 (д, J=6,5 Гц, 3H); 1,01 (д (3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R уш., J=7,5 Гц, 3H); від 1,21 до 1,58 (м, 4H); 1,42 (с, ,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[тіобіс(2,13H); від 1,65 до 2,08 (м, 5H); 2,38 (м, 1H); 2,88 (м, етандіілокси)]-біс[декагідро-3,6,9-триметил-101Н); від 3,45 до 3,57 (м, 2H); 4,02 (м, 1Н); 4,17 (м, (трифторметил)-3,12-епокси-12Н-пірано[4,3-j]-1,21Н); 5,57 (с, 1Н). бензодіоксепін] b) Стадія 2 Одержання сполуки за Прикладом 1 а) Стадія 1 Одержання (3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R,8'a S,9'R,10'R,12'R,12'aR)-10-(2брометокси)декагідро-3,6,9-триметил-10(трифторметил)-3,12-епокси-12Н-пірано[4,3-j]-1,2ібензодіоксепіну, 2 До розчину 942 мг (2,27 ммоль) (3S,5aS,6R,8aS,9R,10R,10S,12R,12aR)-10(бром)декагідро-3,6,9-триметил-10(трифторметил)-3,12-епокси-12Н-пірано[4,3-j]-1,2бензодіоксепіну 1 (що одержується згідно з Org. Lett., 4, 757-759 (2002)) в 20 мл дихлорметану послідовно додають, при кімнатній температурі, 1,2 мл гексафторпропанолу (5 екв.), потім 1,6 мл 2-брометанолу (10 екв.). Реакційну суміш після цього перемішують при кімнатній температурі До розчину 215 мг (0,47 ммоль) сполуки 2 в 16 мл безводного етанолу, в інертній атмосфері аргону і при температурі близько 20°С, протягом 10 хвилин додають 18 мг (0,234 ммоль) сульфіду натрію. Перемішування підтримують при цій температурі протягом приблизно 190 годин. Потім додають 20 мл насиченого розчину хлориду натрію. Суміш екстрагують 3 рази по 20 мл етилацетату. Органічні фази об'єднують, промивають за допомогою 20 мл насиченого розчину NaCl, сушать над сульфатом магнію і випаровують досуха при зниженому тиску. Одержаний маслянистий залишок хроматографують на силікагелі, що заздалегідь кондиціонується з допомогою гептана, потім елююється лінійним градієнтом 0-100% суміші В [(гептан/етилацетат), (85:15), (об'єм/об'єм)] в А (гептан). Отримують 60 мг (33%) очікуваної сполуки за Прикладом 1 у вигляді меренги. Rf=0,20 в системі (гептан/етилацетат), (90:10), (об'єм/об'єм) ES: m/z=835 (M+НСООН Н) 1 Н-ЯМР (400 МГц; при використанні спектрометра BRUKER AVANCE DRX-400; з хімічними зсувами (δ в м.ч.) - в дейтерованому диметилсульфоксиді-d6 як розчиннику (ДМСО-d6), стандартизованому при 2,50 м.ч., при температурі 303 К): 0,86 (м частково прихований, 2H); 0,90 (д, J=6,5 Гц1 6H); 0,93 (д уш., J=7,5 Гц, 6H); 1,22 (м, 2H); від 1,27 до 1,60 (м, 8H); 1,31 (с, 15 94744 16 6H); 1,66 (м, 2H); від 1,75 до 1,89 (м, 4H); 2,04 (м, бензодіоксепін; і 2H); 2,21 (м, 2H); 2,67 (м, 2H); від 2,71 до 2,87 (м, Приклад 3: 4H); 3,64 (м, 2H); 3,94 (м, 2H); 5,58 (с, 2H). (3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R Приклад 2: ,8'aS,9'R,10'R,12'R,12'aR)-10,10'(3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R [сульфонілбіс[2,1-етандіілокси)]-біс[декагідро,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[сульфінілбіс[2,13,6,9-триметил-10-(трифторметил)-3,12-епоксиетандіілокси)]-біс[декагідро-3,6,9-триметил-1012Н-пірано[4,3-j]-1,2-бензодіоксепін] (трифторметил)-3,12-епокси-12Н-пірано[4,3-j]-1,2 До розчину 35 мг (0,044 ммоль) сполуки за Прикладом 1 в 3 мл дихлорметану при температурі близько 20°С повільно додають 16,4 мг (0,066 ммоль) м-хлорнадбензойної кислоти. Перемішування підтримують при цій температурі протягом приблизно 3 годин, після чого додають 3 мл насиченого розчину гідрокарбонату натрію. Суміш екстрагують 3 рази по 10 мл етилацетату. Органічні фази об'єднують, промивають 2 рази по 10 мл водного насиченого розчину хлориду натрію, сушать над сульфатом магнію, відфільтровують і випаровують досуха при зниженому тиску. Одержаний маслянистий залишок хроматографують на силікагелі, що заздалегідь кондиціонується з допомогою гептану, потім елююється лінійним градієнтом 0100% етилацетату в гептані. Отримують 14,5 мг (40%) сполуки за Прикладом 3 у вигляді твердої речовини білого кольору: Rf=0,60 в системі (гептан/етилацетат), (50:50), (об'єм/об'єм) ES: m/z=867 (M+НСООН Н) 1 Н-ЯМР (500 МГц; при використанні спектрометра BRUKER AVANCE DRX-500; з хімічними зсувами (δ в м.ч.) - в дейтерованому диметилсульфоксиді-d6 як розчиннику (ДМСО-d6), стандартизованому при 2,50 м.ч., при температурі 298 К): 0,85 (м частково прихований, 2H); 0,89 (д, J=6,5 Гц, 6H); 0,92 (д уш., J=7,5 Гц, 6H); 1,18 (м, 2H); 1,32 (с, 6H); 1,36 (м, 2H); від 1,47 до 1,58 (м, 6H); 1,62 (м, 2H); 1,71 (м, 2H); 1,84 (м, 2H); 2,04 (м, 2H); 2,21 (м, 2H); 2,68 (м, 2H); 3,48 (м, 2H); 3,59 (м, 2H); 3,83 (м, 2H); 4,19 (м, 2H); 5,63 (с, 2H), а також 12,4 мг (35%) сполуки за прикладом 2 у вигляді меренги білого кольору: Rf=0,22 в системі (гептан/етилацетат), (50:50), (об'єм/об'єм) ES: m/z=851 (M+НСООН Н) 1 Н-ЯМР (500 МГц; при використанні спектрометра BRUKER AVANCE DRX-500; з хімічними зсувами (δ в м.ч.) - в дейтерованому диметилсульфоксиді-d6 як розчиннику (ДМСО-d6), стандартизованому при 2,50 м.ч., при температурі 298 К (суміш 50%-50% ізомерів)): 0,85 (м частково прихований, 2H); 0,88 (д, J=6,5 Гц, 3H); 0,90 (д, J=6,5 Гц, 3H); 0,93 (д уш., J=7,5 Гц, 6H); від 1,14 до 1,89 (м, 16H); 1,31 (с, 3H); 1,32 (с, 3H); 2,03 (м, 2H); 2,20 (м, 2H); 2,67 (м, 2H); 2,98 (м, 2H); 3,12 (м, 2H); 3,79 (м, 1Н); 3,87 (м, 1Н); від 4,11 до 4,20 (м, 2H); 5,58 (с, 1Н); 5,61 (с, 1Н). Приклад 4: (3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R ,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[тіобіс[3,1пропандіілокси)]-біс[декагідро-3,6,9-триметил-10(трифторметил)-3,12-епокси-12Н-пірано[4,3-j]-1,2бензодіоксепін] а) Стадія 1 Одержання (3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R,8'a S,9'R,10'R,12'R,12'aR)-10-(3бромпропокси)декагідро-3,6,9-триметил-10(трифторметил)-3,12-епокси-12Н-пірано[4,3-j]-1,2бензодіоксепіну, 3 17 До розчину 471 мг (1,14 ммоль) сполуки 1 в 7 мл дихлорметану послідовно додають, при кімнатній температурі, 0,607 мл гексафторпропанолу (5 екв.), потім 1,03 мл 3бромпропанолу (10 екв.). Реакційну суміш після цього перемішують при кімнатній температурі протягом 2 годин 30 хвилин, потім додають 5 мл насиченого розчину гідрокарбонату натрію, органічну фазу сушать над сульфатом магнію, відфільтровують і випаровують досуха при зниженому тиску. Одержаний маслянистий залишок хроматографують на силікагелі, що заздалегідь кондиціонується з допомогою До розчину 220 мг (0,46 ммоль) сполуки 3 в 16 мл безводного етанолу, в інертній атмосфері аргону і при температурі близько 20°С, протягом 10 хвилин додають 18,2 мг (0,23 ммоль) сульфіду натрію, перемішування підтримують при цій температурі протягом приблизно 80 годин, потім додають 20 мл насиченого розчину хлориду натрію. Суміш екстрагують 3 рази по 20 мл етилацетату. Органічні фази об'єднують, промивають за допомогою 20 мл водного насиченого розчину хлориду натрію, сушать над сульфатом магнію, відфільтровують і випаровують досуха при зниженому тиску. Одержаний маслянистий залишок хроматографують на силікагелі, що заздалегідь кондиціонується з допомогою гептану, потім елююється лінійним градієнтом 0-100% суміші В [(гептан/етилацетат), (85:15), (об'єм/об'єм)] в А (гептан). Отримують 103 мг (54%) очікуваної сполуки за Прикладом 4 у вигляді твердої речовини білого кольору. Rf=0,20 в системі (гептан/етилацетат), (90:10), (об'єм/об'єм) + ES: m/z=841 MNa 94744 18 гептану, потім елююється лінійним градієнтом 0100% суміші В [(гептан/етилацетат), (90:10), (об'єм/об'єм)] в А (гептан). Отримують 229 мг (43%) очікуваної сполуки 3 у вигляді масла. Rf=0,38 в системі (гептан/етилацетат), (90:10), (об'єм/об'єм) + IC (хімічна іонізація): m/z=490 (MNH4) ); + m/z=354 (m/z=490 BRCH2CH2CH2OH+2H) 1 Н-ЯМР (400 МГц; при використанні спектрометра BRUKER AVANCE DRX-400; з хімічними зсувами (δ в м.ч.) = в дейтерованому хлороформі-d1 як розчиннику (CDCl3-d1), стандартизованому при 7,27 м.ч., при температурі 303 К): 0,90 (м частково прихований, 1H); 0,97 (д, J=6,5 Гц, 3H); 1,00 (д уш., J=7,5 Гц, 3H); від 1,22 до 1,54 (м, 4H); 1,44 (с, 3H); від 1,60 до 1,73 (м, 2H); 1,82 (м, 1Н); 1,91 (м, 1Н); від 2,00 до 2,20 (м, 3H); 2,39 (м, 1Н); 2,87 (м, 1Н); від 3,45 до 3,55 (м, 2H); 3,80 (м, 1Н); 3,94 (м, 1Н); 5,41 (с, 1Н). b) Стадія 2 Одержання сполуки за Прикладом 4 1 Н-ЯМР (400 МГц; при використанні спектрометра BRUKER AVANCE DRX-400; з хімічними зсувами (δ в м.ч.) - в дейтерованому хлороформі-d1 як розчиннику (CDCl3-d1), стандартизованому при 7,27, при температурі 303 К): 0,93 (м частково прихований, 2H); 0,97 (д, J=6,5 Гц, 6H); 1,00 (д уш., J=7,5 Гц, 6H); від 1,22 до 1,38 (м, 4H); 1,43 (с, 6H); від 1,44 до 1,55 (м, 4H); від 1,63 до 1,74 (м, 12H); 2,04 (м, 2H); 2,38 (м, 2H); від 2,51 до 2,66 (м, 4H); 2,85 (м, 2H); 3,71 (м, 2H); 3,91 (м, 2H); 5,37 (с, 2H). Приклад 5: (3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R ,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[сульфінілбіс[3,1пропандіілокси)]-біс[декагідро-3,6,9-триметил-10(трифторметил)-3,12-епокси-12Н-пірано[4,3-j]-1,2бензодіоксепін; і Приклад 6: (3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R ,8'aS,9'R,10'R,12'R,12'aR)-10,10'[сульфонілбіс[3,1-пропандіілокси)]-біс[декагідро3,6,9-триметил-10-(трифторметил)-3,12-епокси12Н-пірано[4,3-j]-1,2-бензодіоксепін 19 До розчину 21,4 мг (0,026 ммоль) сполуки за Прикладом 4 в 2 мл дихлорметану при температурі близько 20°С повільно додають 9,1 мг (0,036 ммоль) м-хлорнадбензойної кислоти. Перемішування підтримують при цій температурі протягом приблизно 3 годин, після чого додають 3 мл насиченого розчину гідрокарбонату натрію. Суміш екстрагують 3 рази по 10 мл етилацетату. Органічні фази об'єднують, промивають 2 рази по 10 мл водного насиченого розчину хлориду натрію, сушать над сульфатом магнію, відфільтровують і випаровують досуха при зниженому тиску. Одержаний маслянистий залишок хроматографують на силікагелі, що заздалегідь кондиціонується з допомогою гептану, потім елююється лінійним градієнтом 0100% етилацетату в гептані. Отримують 7,7 мг (34%) сполуки за Прикладом 6 у вигляді твердої речовини білого кольору: Rf=0,68 в системі (гептан/етилацетат), (50:50), (об'єм/об'єм) + ES: m/z=873 MNa 1 Н-ЯМР (400 МГц; при використанні спектрометра BRUKER AVANCE DRX-400; з хімічними зсувами (δ в м.ч.) - в дейтерованому хлороформі-d1 як розчиннику (CDCl3-d1), стандартизованому при 7,27, при температурі 303 К: 0,92 (м частково прихований, 2H); 0,97 (д, J=6,5 Гц, 6H); 1,00 (д уш., J=7,5 Гц, 6H); від 1,23 до 1,38 (м, 4H); 1,43 (с, 6H); від 1,44 до 1,72 (м, 8H); 1,83 (м, 2H); 1,92 (м, 2H); 2,05 (м, 2H); 2,12 (м, 4H); 2,38 (м, 2H); 2,87 (м, 2H); 3,00 (м, 2H); 3,13 (м, 2H); 3,75 (м, 2H); 3,97 (м, 2H); 5,34 (с, 2H), а також 8,5 мг (39%) сполуки за прикладом 5 у вигляді меренги білого кольору: Rf=0,20 в системі (гептан/етилацетат), (50:50), (об'єм/об'єм) + ES: m/z=857 MNa 1 Н-ЯМР (400 МГц; при використанні спектрометра BRUKER AVANCE DRX-400; з хімічними зсувами (δ в м.ч.) - в дейтерованому хлороформі-d1 як розчиннику (CDCl3-d1), стандартизованому при 7,27, при температурі 303 К (суміш 50%-50% ізомерів)): 0,90 (м частково прихований, 2H); 0,97 (д, J=6,5 Гц, 6H); 1,00 (д уш., J=7,5 Гц, 6H); від 1,24 до 1,36 (м, 4H); 94744 20 1,43 (с, 6H); від 1,45 до 1,72 (м, 8H); 1,82 (м, 2H); 1,92 (м, 2H); від 2,00 до 2,11 (м, 6H); 2,38 (м, 2H); від 2,68 до 2,82 (м, 4H); 2,86 (м, 2H); 3,77 (м, 2H); 3,96 (м, 2H); 5,33 (с, 1Н); 5,35 (с, 1Н). Приклад 7: (3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R ,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[тіобіс[4,1бутандіілокси)]-біс[декагідро-3,6,9-триметил-10(трифторметил)-3,12-епокси-12Н-пірано[4,3-j]-1,2бензодіоксепін а) Стадія 1 Одержання (3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R,8'a S,9'R,10'R,12'R,12'aR)-10-(4бромбутокси)декагідро-3,6,9-триметил-10(трифторметил)-3,12-епокси-12Н-пірано[4,3-j]-1,2бензодіоксепіну, 4 До розчину 1,07 г (2,58 ммоль) сполуки 1 в 15 мл дихлорметану послідовно додають, при кімнатній температурі, 1,36 мл гексафторпропанолу (5 екв.), потім 2,5 г 4бромбутанолу (6,3 екв.). Реакційну суміш після цього перемішують при кімнатній температурі протягом 3 годин, потім додають 6 мл насиченого розчину гідрокарбонату натрію. Органічну фазу сушать над сульфатом магнію, відфільтровують і випаровують досуха при зниженому тиску. 21 94744 22 Одержаний маслянистий залишок хімічними зсувами (δ в м.ч.) - в дейтерованому хроматографують на силікагелі, що заздалегідь диметилсульфоксиді-d6 як розчиннику (ДМСО-d6), кондиціонується з допомогою гептану, потім стандартизованому при 2,50 м.ч., при елююється лінійним градієнтом 0-100% суміші В температурі 298 К: 0,92 (м частково прихований, [(гептан/етилацетат), (90:10), (об'єм/об'єм)] в А 1Н); 0,97 (д, J=6,0 Гц, 3H); 1,00 (д уш., J=7,5 Гц, (гептан). Отримують 90 мг (7%) очікуваної 3H); від 1,05 до 1,62 (м частково прихований, 6H); сполуки 4 у вигляді масла. 1,43 (с, 3H); від 1,65 до 2,10 (м, 7H); від 2,33 до Rf=0,40 в системі (гептан/етилацетат), (9:1), 2,45 (м, 1Н); 2,84 (м, 1Н); від 3,40 до 3,51 (м, 2H); (об'єм/об'єм) 3,63 (м, 1Н); 3,88 (м, 1Н); 5,32 (с, 1Н). + IC: m/z=504 MNН4 . b) Стадія 2 1 Н-ЯМР (400 МГц; при використанні Одержання сполуки за Прикладом 7 спектрометра BRUKER AVANCE DRX-400; з До розчину 90 мг (0,19 ммоль) сполуки 4 в 5 мл безводного етанолу, в інертній атмосфері аргону і при температурі близько 20°С, протягом 10 хвилин додають 5,7 мг (0,073 ммоль) сульфіду натрію. Перемішування підтримують при цій температурі протягом приблизно 42 годин, потім додають 5 мл насиченого розчину хлориду натрію. Суміш екстрагують 3 рази по 5 мл етилацетату. Органічні фази об'єднують, промивають за допомогою 5 мл водного насиченого розчину хлориду натрію, сушать над сульфатом магнію, відфільтровують і випаровують досуха при зниженому тиску. Одержаний маслянистий залишок хроматографують на силікагелі, що заздалегідь кондиціонується з допомогою гептану, потім елююється лінійним градієнтом 0-20% етилацетату в гептані. Отримують 33 мг (50%) очікуваної сполуки за Прикладом 7 у вигляді меренги. Rf=0,20 в системі (гептан/етилацетат), (9:1), (об'єм/об'єм) метилетанамін ES: m/z=891 (M+НСООН Н) 1 Н-ЯМР (400 МГц; при використанні спектрометра BRUKER AVANCE DRX-400; з хімічними зсувами (δ в м.ч.) - в дейтерованому диметилсульфоксиді-d6 як розчиннику (ДМСО-d6), стандартизованому при 2,50 м.ч., при температурі 298 К): 0,93 (м частково прихований, 2H); 0,97 (д, J=6,0 Гц, 6H); 1,00 (д уш., J=7,5 Гц, 6H); від 1,22 до 1,37 (м, 4H); 1,43 (с, 6H); 1,50 (м, 4H); від 1,62 до 1,86 (м, 14H); 1,91 (м, 2H); 2,04 (м, 2H); 2,38 (м, 2H); 2,54 (м, 4H); 2,84 (м, 2H); 3,62 (м, 2H); 3,85 (м, 2H); 5,33 (с, 2H). Приклад 8: 2-[[(3R,5aS,6R,8aS,9R,10R,12R,12aR)декагідро-3,6,9-триметил-10-(трифторметил)3,12-епокси-12Н-пірано[4,3-j]-1,2-бензодіоксепін10-іл]окси]-N-[2[(3R,5aS,6R,8aS,9R,10R,12R,12aR)-декагідро3,6,9-триметил-10-(трифторметил)-3,12-епокси12Н-пірано[4,3-j]-1,2-бензодіоксепін-10іл]окси]етил]-N До розчину 100 мг (0,218 ммоль) сполуки 2 в 0,6 мл тетрагідрофурану, в інертній атмосфері аргону і при температурі близько 20°С, послідовно додають 33 мг (0,218 ммоль) йодиду натрію і 0,545 мл (1,09 ммоль) 2 М розчину метиламіну в тетрагідрофурані. Перемішування підтримують при температурі 40°С протягом приблизно 20 годин. Реакційну суміш обробляють 23 94744 24 за допомогою 3 мл водного насиченого розчину Перемішування підтримують при температурі гідрокарбонату натрію, потім екстрагують 3 рази близько 20°С протягом 3 годин. Реакційну суміш по 3 мл дихлорметану. Органічні фази обробляють за допомогою 60 мл дистильованої об'єднують, потім сушать над сульфатом магнію, води, після чого екстрагують 2 рази по 100 мл відфільтровують і випаровують досуха при етилацетату. Органічну фазу промивають 2 рази зниженому тиску. Одержаний маслянистий по 80 мл водного насиченого розчину хлориду залишок хроматографують на силікагелі, що натрію, сушать над сульфатом магнію, заздалегідь кондиціонується з допомогою відфільтровують і випаровують досуха при гептану, потім елююється градієнтом 0-30% зниженому тиску. Отримують 527 мг (вихід етилацетату в гептані. Отримують 15 мг (18%) кількісний) очікуваної сполуки 5 у вигляді масла очікуваної сполуки за Прикладом 8 у вигляді жовтого кольору. твердої речовини білого кольору. Rf=0,43 в системі (гептан/етилацетат), (8:2), Rf=0,25 в системі (гептан/етилацетат), (7:3), (об'єм/об'єм) 1 (об'єм/об'єм) Н-ЯМР (CDCl3, 400 МГц) δ в м.ч.: 5,48 (с, + ES: m/z=788 MН 1H); 3,97 (м, 1H); 3,78 (м, 1H); 3,48 (м, 2H); 2,88 1 Н-ЯМР (400 МГц; при використанні (кв, 1Н); 2,39 (тд, 1H); 2,05 (дт, 1H); 197-1,88 (м, спектрометра BRUKER AVANCE DRX-400; з 1Н); 1,87-1,77 (м, 2H); 1,76-1,68 (м, 1Н); 1,53 (м, хімічними зсувами (δ в м.ч.) - в дейтерованому 1Н); 1,50 (м, 1Н); 1,43 (с, 3H); 1,39-1,25 (м, 2H); хлороформі-d1 як розчиннику (CDCl3-d1), 1,03 (д, 3H); 1,01-0,89 (м, 1Н); 0,98 (д, 3H). стандартизованому при 7,27, при температурі b) Стадія 2 303 К, після додання однієї краплі дейтерованої Одержання 2оцтової кислоти-d4 (CD3OD-d4)): 0,91 (м частково {[(3R,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9прихований, 2H); 0,95 (д, J=6,5 Гц, 6H); 0,98 (д триметил-10-(триформетил)декагідро-3,12уш., J=7,0 Гц, 6H); 1,28 (м, 2H); від 1,33 до 1,63 епокси[1,2]діоксепіно[4,3-i]-ізохромен-10(м, 8H); 1,39 (с, 6H); 1,69 (м, 2H); 1,78 (м, 2H); іл]окси}етанаміну, 6 1,89 (м, 2H); 2,02 (м частково прихований, 2H); 2,36 (м, 2H); 2,86 (м частково прихований, 2H); 2,89 (с, 3H); 3,38 (м, 4H); 4,19 (м, 4H); 5,38 (с, 2H). Приклад 9: 2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9триметил-10-(триформетил)декагідро-3,12епокси[1,2]діоксепіно[4,3-i]-ізохромен-10-іл]окси}N-(2-{(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9триметил-10-(триформетил)декагідро-3,12епокси[1,2]-діоксепіно[4,3-i]ізохромен-10До розчину 527 мг (1,25 ммоль) сполуки 5 в 7 іл]окси}етил)етанамін мл тетрагідрофурану, в інертній атмосфері аргону і при температурі близько 20°С, додають 328 мг (1,25 ммоль) трифенілфосфіну. Перемішування підтримують при температурі близько 20°С протягом приблизно 24 годин. Реакційну суміш обробляють за допомогою 1 мл дистильованої води, потім продовжують перемішування протягом приблизно 24 годин при тій же температурі. Реакційну суміш концентрують у вакуумі і таким чином одержаний залишок обробляють з допомогою 5 мл дихлорметану, промивають за допомогою 2 мл а) Стадія 1 водного насиченого розчину гідрокарбонату Одержання натрію, сушать над сульфатом магнію, (3R,5aS,6R,8aS,9R,10R,12R,12aR)-10-(2відфільтровують і випаровують досуха при азидоетокси)-3,6,9-триметил-10зниженому тиску. Одержаний маслянистий (триформетил)декагідро-3,12залишок хроматографують на силікагелі, що епокси[1,2]діоксепіно[4,3-i]ізохромену, 5 заздалегідь кондиціонується з допомогою дихлорметану, потім елююється лінійним градієнтом 0-100% суміші В [(дихлорметан/метанол), (90:10), (об'єм/об'єм)] в А (дихлорметан). Отримують 344 мг (70%) очікуваної сполуки 6 у вигляді порошку білого кольору. + + МС (мас-спектрометрія): ES : [M+Н] =396 1 Н-ЯМР-спектр (400 МГц; при використанні спектрометра BRUKER AVANCE DRX-400; з До розчину 574 мг (1,25 ммоль) сполуки 2 в хімічними зсувами (δ в м.ч.) - в дейтерованому 20 мл диметилформаміду, в інертній атмосфері хлороформі-d1 як розчиннику (CDCl3-d1), аргону і при температурі близько 20°С, додають стандартизованому при 7,27, при температурі 162,5 мг (2,5 ммоль) азиду натрію. 303 К): 0,94 (м частково прихований, 1H); 0,97 (д, 25 94744 26 J=6,5 Гц, 3H); 1,03 (д уш., J=7,0 Гц, 3H); 1,30 (м, 3,85 (м, 1Н); 5,42 (с, 1H). 2H); від 1,40 до 1,56 (м, 2H); 1,42 (с, 3H); від 1,63 с) Стадія 3 до 1,95 (м, 4H); 2,04 (м, 1Н); 2,38 (м, 1Н); 2,45 (м Одержання сполуки за Прикладом 9 ушир., 2H); 2,87 (м, 1Н); 2,94 (м, 2H); 3,75 (м, 1Н); До розчину 282 мг (0,534 ммоль) сполуки 2 в 7 мл диметилформаміду, в інертній атмосфері аргону і при температурі близько 20°С, послідовно додають 98 мг (0,593 ммоль) йодиду калію, 164 мг (1,19 ммоль) карбонату калію і 232 мг (0,587 ммоль) сполуки 6. Перемішування підтримують при температурі 70°С протягом приблизно 7 годин. Реакційну суміш концентрують досуха при зниженому тиску. Одержаний залишок обробляють з допомогою 10 мл дихлорметану, потім промивають з допомогою 6 мл дистильованої води, водну фазу знов екстрагують з допомогою 10 мл дихлорметану. Об'єднані органічні фази промивають за допомогою 6 мл водного насиченого розчину гідрокарбонату натрію, потім сушать над сульфатом магнію, відфільтровують і випаровують досуха при зниженому тиску. Одержаний залишок хроматографують на силікагелі, що заздалегідь кондиціонується за допомогою суміші (гептан/етилацетат), (9:1), (об'єм/об'єм), після чого елююється градієнтом 10-60% етилацетату в гептані. Отримують 116 мг (28%) очікуваної сполуки за Прикладом 9 у вигляді твердої речовини блідо-жовтого кольору. Rf=0,16 в системі (гептан/етилацетат), (8:2), (об'єм/об'єм) + + МС: ES : [M+Н] =774 + ES : [M+HCOOH+Н] =818 1 Н-ЯМР-спектр (400 МГц; при використанні спектрометра BRUKER AVANCE DRX-400; з хімічними зсувами (δ в м.ч.) - в дейтерованому хлороформі-d1 як розчиннику (CDCl3-d1), стандартизованому при 7,27, при температурі 303 К): 0,92 (м частково прихований, 2H); 0,98 (д, J=6,5 Гц, 6H); 1,00 (д уш., J=7,0 Гц, 6H); від 1,20 до 1,39 (м, 4H); 1,42 (с, 6H); від 1,40 до 1,83 (м, 11Н); 1,90 (м, 2H); 2,03 (м, 2H); 2,38 (м, 2H); від 2,73 до 2,91 (м, 6H); 3,75 (м, 2H); 3,91 (м, 2H); 5,47 (с, 2H). Приклад 10: етил-N, N-біс(2{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9триметил-10-(триформетил)декагідро-3,12епокси[1,2]діоксепіно-[4,3-i]ізохромен-10іл]окси}етил)гліцинат До розчину 37 мг (0,047 ммоль) сполуки за Прикладом 9 в 1 мл диметилформаміду, в інертній атмосфері аргону і при температурі близько 20°С, послідовно додають 15 мкл (0,133 ммоль) етилового ефіру бромоцтової кислоти, 8 мг (0,047 ммоль) йодиду калію, 10 мг (0,071 ммоль) карбонату калію. Перемішування підтримують при температурі 50°С протягом 1 години. Реакційну суміш концентрують досуха при зниженому тиску. Одержаний залишок обробляють з допомогою 5 мл етилацетату, потім промивають з допомогою 3 мл дистильованої води, водну фазу знов екстрагують 2 рази по 5 мл етилацетату. Об'єднані органічні фази промивають 2 рази по 5 мл водного насиченого розчину хлориду натрію, потім сушать над сульфатом магнію, відфільтровують і випаровують досуха при зниженому тиску. Одержаний залишок хроматографують на силікагелі, що заздалегідь кондиціонується, потім елююється за допомогою суміші (гептан/етилацетат), (80:20), (об'єм/об'єм), отримують 30 мг (74%) очікуваної сполуки за Прикладом 10 у вигляді безбарвної пастоподібної речовини. ТШХ: Rf=0,49 в системі (гептан/етилацетат), (7:3), (об'єм/об'єм) + + МС: ES : [M+Н] =860 27 94744 28 + ES : [M+HCOOH+Н] =904 2H); 2,02 (м, 2H); 2,36 (м, 2H); від 2,70 до 2,90 (м, 1 Н-ЯМР-спектр (400 МГц; при використанні 4H); 3,02 (м, 2H); 3,40 (д, J=17,5 Гц, 1Н ); 3,61 (м, спектрометра BRUKER AVANCE DRX-400; з 2H); 3,67 (д, J=17,5 Гц, 1Н); 3,98 (м, 2H); від 4,06 хімічними зсувами (δ в м.ч.) - в дейтерованому до 4,22 (м, 2H); 5,40 (с, 2H). хлороформі-d1 як розчиннику (CDCl3-d1), Приклад 11: стандартизованому при 7,27, при температурі N,N-біс(2303 К): від 0,80 до 1,00 (м, 14H); від 1,19 до 1,38 {[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9(м частково прихований, 4H); 1,28 (т, J=7,0 Гц, триметил-10-(триформетил)декагідро-3,123H); 1,40 (с, 6H); від 1,44 до 1,58 (м частково епокси[1,2]діоксепіно-[4,3-i]ізохромен-10прихований, 4H); від 1,61 до 1,82 (м, 6H); 1,89 (м, іл]окси}етил)гліцин До розчину 10 мг (0,011 ммоль) сполуки за Прикладом 10 в 0,5 мл метанолу при температурі близько 20°С додають 59 мкл (0,059 ммоль) 1н водного розчину гідроксиду натрію. Перемішування підтримують при тій же температурі протягом приблизно 6,5 годин. Реакційну суміш концентрують досуха при зниженому тиску. Одержаний залишок обробляють з допомогою 3 мл етилацетату, потім промивають за допомогою 1 мл водного насиченого розчину хлориду натрію. Водну фазу знов екстрагують з допомогою 3 мл етилацетату. Органічні фази об'єднують, сушать над сульфатом магнію, відфільтровують і випаровують досуха при зниженому тиску. Одержаний залишок хроматографують на силікагелі, що заздалегідь кондиціонується, потім елююється сумішшю (дихлорметан/метанол), (95:5), (об'єм/об'єм). Отримують 8 мг (81%) очікуваної сполуки за Прикладом 11 у вигляді безбарвної твердої речовини. + + МС: ES : [M+Н] =832 ES : [M-H] =830 1 Н-ЯМР-спектр (300 МГц; при використанні спектрометра BRUKER AVANCE DRX-300; з хімічними зсувами (δ в м.ч.) - в дейтерованому хлороформі-d1 як розчиннику (CDCl3-d1), стандартизованому при 7,27, при температурі 303 К): 0,92 (м частково прихований, 2H); 0,97 (д, J=6,5 Гц, 6H); 1,01 (д уш., J=7,0 Гц, 6H); від 1,20 до 1,38 (м частково прихований, 4H); 1,42 (с, 6H); від 1,44 до 1,75 (м, 8H); від 1,80 до 2,10 (м, 6H); 2,39 (м, 2H); від 2,80 до 3,02 (м, 6H); 3,38 (д, J=17,5 Гц, 1H); 3,55 (д, J=17,5 Гц, 1Н); від 3,77 до 3,98 (м, 4H); 5,32 (с, 2H). Приклад 12: 2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9триметил-10-(триформетил)декагідро-3,12епокси[1,2]діоксепіно[4,3-i]-ізохромен-10-іл]окси}N-(2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9триметил-10-(триформетил)декагідро-3,12епокси[1,2]-][діоксепіно[4,3-i]ізохромен-10іл]окси}етил)ацетамід а) Стадія 1 Одержання {[(3R,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9триметил-10-(триформетил)декагідро-3,12епокси[1,2]діоксепіно[4,3-i]-ізохромен-10іл]окси}оцтової кислоти, 8 До розчину 100 мг (0,255 ммоль) сполуки 7 (що отримується згідно з WO2003035651) в 2 мл ацетону послідовно додають, при кімнатній температурі, 117 мг (0,742 ммоль) перманганату калію, потім 11 мг (0,127 ммоль) гідрокарбонату натрію. Реакційну суміш потім перемішують при кімнатній температурі протягом 3 годин, після чого додають 1 екв. 1н водного розчину соляної кислоти. Перемішування продовжують при кімнатній температурі протягом приблизно 18 годин. Реакційне середовище відфільтровують, потім випаровують досуха при зниженому тиску. Одержаний залишок обробляють з допомогою 10 мл етилацетату. Органічну фазу промивають за допомогою 3 мл дистильованої води, водну фазу підкисляють за допомогою 2 мл 1н водного розчину соляної кислоти, потім екстрагують з 29 94744 30 допомогою 10 мл етилацетату. Органічну фазу (тд, 1Н); 2,19 (дкв, 1H); 2,04 (дт, 1Н); 1,90 (м, 1Н); сушать над сульфатом магнію, відфільтровують, 1,77 (м, 2H); 1,70 (м, 1Н); 1,59-1,48 (м, 1H); 1,48потім випаровують досуха при зниженому тиску. 1,45 (м, 1H); 1,42 (с, 3H); 1,40-1,24 (м, 2H); 1,05 Отримують 27 мг (26%) очікуваної сполуки 8 у (д, 3H); 0,98-0,87 (м, 1H); 0,96 (д, 3H). вигляді твердої речовини білого кольору. b) Стадія 2 1 Н-ЯМР (CDCl3, 300 МГц) δ в м.ч.: 5,47 (с, Одержання сполуки за Прикладом 12 1H); 4,67 (д, 1H); 4,26 (д, 1H1); 2,91 (кв, 1Н); 2,38 1 До розчину 37 мг (0,09 ммоль) сполуки 8 в 3 мл дихлорметану, в інертній атмосфері аргону і при температурі близько 20°С, послідовно додають 36 мг (0,27 ммоль) гідроксибензотриазолу і 52 мг (0,27 ммоль) 1-(3диметиламінопропіл)-3етилкарбодіімідгідрохлориду. Перемішування підтримують при температурі близько 20°С протягом приблизно 30 хвилин, потім додають 39 мг (0,099 ммоль) сполуки 6. Перемішування продовжують при цій температурі протягом 1 години. Реакційну суміш обробляють за допомогою 5 мл дистильованої води, потім екстрагують 3 рази по 20 мл етилацетату. Органічну фазу промивають 2 рази по 10 мл водного насиченого розчину хлориду натрію, сушать над сульфатом магнію, відфільтровують і випаровують досуха при зниженому тиску. Одержаний залишок хроматографують на силікагелі, що заздалегідь кондиціонується за допомогою суміші (гептан/етилацетат), (90:10), (об'єм/об'єм), потім елююється градієнтом 1020% етилацетату в гептані. Отримують 40 мг (56%) очікуваної сполуки за Прикладом 12 у вигляді в'язкої смолоподібної речовини. + + + МС: ES : [M+Н] =788; [M+Na] =810 + ES : [M-H]-=786; [M+HCOOH+Н] =832 Н-ЯМР-спектр (400 МГц; при використанні спектрометра BRUKER AVANCE DRX-400; з хімічними зсувами (δ в м.ч.) - в дейтерованому хлороформі-d1 як розчиннику (CDCl3-d1), стандартизованому при 7,27, при температурі 303 К): від 0,87 до 1,03 (м, 11H); 1,08 (д уш., 3H); від 1,21 до 1,40 (м, 4H); 1,43 (с, 6H); від 1,45 до 1,65 (м частково прихований, 6H); 1,69 (м, 2H); від 1,78 до 1,97 (м, 4H); 2,05 (м, 2H); від 2,32 до 2,43 (м частково прихований, 2H); від 2,82 до 2,98 (м, 2H); 3,37 (м, 1Н); від 3,65 до 3,81 (м, 2H); 3,95 (м, 1Н); 4,14 (д, J=16,0 Гц, 1Н); 4,43 (д, J=16,0 Гц, 1Н); 5,33 (с, 1H); 5,36 (с, 1Н); 6,52 (м, 1Н). Приклад 13: (3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R ,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[(2E)-бут-2-ен1,4-діілбіс(окси)]-біс[3,6,9-триметил-10(трифторметил)декагідро-3,12епокси[1,2]діоксепіно[4,3-i]ізохромен]; і Приклад 14: (3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R ,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[(2Z)-бут-2-ен1,4-діілбіс(окси)]біс[3,6,9-триметил-10(трифторметил)декагідро-3,12-епокси[1,2]діоксепіно[4,3-i]ізохромен] Суспензію 200 мг (0,51 ммоль) сполуки 7 і 43 мг (0,051 ммоль) бензиліденбіс(трициклогексилфосфін)дихлорруте нію в 1,3 мл дихлорметану перемішують протягом приблизно 7 годин при температурі близько 20°С. Додають розчин, що містить 633 мг (5,10 ммоль) трисгідроксиметилфосфіну і 1,43 мл (10,2 ммоль) триетиламіну в 3 мл дихлорметану. Енергійно перемішують при температурі близько 20°С протягом приблизно 10 хвилин, потім додають 6 мл води, перемішування продовжують протягом 1 години. Органічну фазу промивають 31 94744 32 за допомогою 3 мл дистильованої води, сушать (кв, 2H); 2,39 (тд, 2H); 2,04 (дт, 2H); 1,97-1,87 (м, над сульфатом магнію, відфільтровують і 2H); 1,85-1,75 (м, 2H); 1,75-1,62 (м, 4H); 1,57-1,49 випаровують досуха при зниженому тиску. (м, 2H); 1,47 (м, 2H); 1,43 (с, 6H); 1,37-1,20 (м, Одержаний маслянистий залишок 4H); 1,02 (д, 6H); 1,00-0,84 (м, 2H); 0,97 (д, 6H). хроматографують на силікагелі, що заздалегідь Приклад 14: кондиціонується, потім елююється за допомогою Rf=0,47 в системі (гептан/етилацетат), (8:2), суміші (гептан/етилацетат), (95:5), (об'єм/об'єм), (об'єм/об'єм) + + отримують 57,5 мг (38%) ізомеру Е за Прикладом МС: ES : [M+NН4] =774 1 13 у вигляді кристалів білого кольору. Отримують Н-ЯМР (CDCl3, 300 МГц) δ в м.ч.: 5,67 (т, 20 мг (10%) ізомеру Z за Прикладом 14 у вигляді 2H); 5,31 (с, 2H); 4,42 (дд, 2H); 4,25 (дд, 2H); 2,85 кристалів білого кольору. (кв, 2H); 2,38 (тд, 2H); 2,04 (дт, 2H); 1,96-1,84 (м, Приклад 13: 2H); 1,84-1,74 (м, 2H); 1,74-1,61 (м, 4H); 1,57-1,49 Rf=0,41 в системі (гептан/етилацетат), (8:2), (м, 2H); 1,47 (м, 2H); 1,43 (с, 6H); 1,37-1,20 (м, (об'єм/об'єм) 4H); 1,01 (д, 6H); 1,00-0,87 (м, 2H); 0,97 (д, 6H). -1 ІЧ-спектр: 983 см (характерна смуга трансПриклад 15: СН=СН) (3S,5aS,6R,8aS,9R,10R,12R,12aR,3'S,5'aS,6'R + + МС: ES : [M+Na] =779 ,8'aS,9'R,10'R,12'R,12'aR)-10,10'-[(2R,3R)-оксиран+ ES : [M+HCOOH+Н] =801 2,3-діілбіс(метиленокси)]-біс[3,6,9-триметил-101 Н-ЯМР (CDCl3, 300 МГц) δ в м.ч.: 5,79 ( т, (трифторметил)декагідро-3,122H); 5,32 (с, 2H); 4,37 (дд, 2H); 4,19 (дд, 2H); 2,87 епокси[1,2]діоксепіно[4,3-i]ізохромен] До розчину 158 мг (0,209 ммоль) сполуки за Прикладом 13 в 2,75 мл дихлорметану при температурі близько 20°С додають 103 мг (0,417 ммоль) м-хлорнадбензойної кислоти. При цій температурі перемішують протягом приблизно 8 годин. Реакційну суміш послідовно промивають 3 рази по 5 мл водного насиченого розчину гідрокарбонату натрію і за допомогою 13 мл водного насиченого розчину хлориду натрію. Органічну фазу сушать над сульфатом магнію, відфільтровують і випаровують досуха при зниженому тиску. Одержаний маслянистий залишок хроматографують на силікагелі, що заздалегідь кондиціонується, потім елююється за допомогою суміші (гептан/етилацетат), (95:5), (об'єм/об'єм), отримують 70 мг (43%) один з двох транс-ізомерів за Прикладом 15 у вигляді кристалів білого кольору. + + МС: ES : [M+Na] =795 1 Н-ЯМР-спектр (400 МГц; при використанні спектрометра BRUKER AVANCE DRX-400; з хімічними зсувами (δ в м.ч.) - в дейтерованому хлороформі-d1 як розчиннику (CDCl3-d1), стандартизованому при 7,27, при температурі 303 К): від 0,86 до 0,98 (м, 14H); від 1,20 до 1,39 (м, 4H); 1,42 (с, 6H); від 1,44 до 1,55 (м, 4H); від 1,62 до 1,77 (м, 6H); 1,89 (м, 2H); 2,04 (м, 2H); 2,37 (м, 2H); 2,85 (м, 2H); 3,11 (з уш., 2H); 3,69 (д уш., J=12,5 Гц, 2H); 4,31 (д, J=12,5 Гц, 2H); 5,39 (с, 2H). Приклад 16: (1-(2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)3,6,9-триметил-10-(трифторметил)декагідро-3,12епокси[1,2]діоксепіно[4,3-i]-ізохромен-10іл]окси}етил)-4({[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9триметил-10-(трифторметил)декагідро-3,12епокси[1,2]діоксепіно[4,3-i]ізохромен-10іл]окси}метил)-1Н-1,2,3-триазол; і Приклад 17: (1-(2-{[(3S,5aS,6R,8aS,9R,10R,12R,12aR)3,6,9-триметил-10-(трифторметил)декагідро-3,12епокси[1,2]діоксепіно[4,3-i]ізохромен-10іл]окси}етил)-5({[(3S,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9триметил-10-(трифторметил)декагідро-3,12епокси[1,2]діоксепіно[4,3-i]-ізохромен-10іл]окси}етил)-1Н-1,2,3-триазол 33 а) Стадія 1: Одержання (3R,5aS,6R,8aS,9R,10R,12R,12aR)-3,6,9триметил-10-(проп-2-ін-1-ілокси)-10(трифторметил)декагідро-3,12епокси[1,2]діоксепіно[4,3-i]ізохромену, 9 До розчину 0,206 г (0,5 ммоль) (3S,5aS,6R,8aS,9R,10R,12R,12aR)-10(бром)декагідро-3,6,9-триметил-10(трифторметил)-3,12-епокси-12Н-пірано[4,3-j]-1,2бензодіоксепіну 1 (що отримується згідно з Оrg. Lett., 4, 757-759 (2002)) в 5 мл дихлорметану при кімнатній температурі послідовно додають 0,266 мл гексафторпропанолу (5 екв.), потім 0,289 мл пропаргілового спирту (10 екв.). Реакційну суміш після цього перемішують при кімнатній температурі протягом 1 години 15 хвилин, потім додають 5 мл насиченого розчину гідрокарбонату натрію. Органічну фазу сушать над сульфатом До розчину 119 мг (0,305 ммоль) сполуки 9 в 2,5 мл етанолу при температурі близько 20°С додають 257 мг (0,610 ммоль) сполуки 5. Витримують при перемішуванні при кип’ятінні із зворотним холодильником протягом приблизно 48 годин. Реакційну суміш випаровують досуха в роторному випарнику і одержаний маслянистий залишок хроматографують на силікагелі, що заздалегідь кондиціонується з допомогою дихлорметану, потім елююється лінійним градієнтом 0-100% суміші В [(дихлорметан/етилацетат), (96:4), (об'єм/об'єм)] в А (дихлорметан). Отримують 43 мг (18%) очікуваної сполуки за Прикладом 16 у вигляді твердої речовини білого кольору і 17 мг (7%) очікуваної сполуки за Прикладом 17 у вигляді твердої речовини білого кольору. Приклад 16: Rf=0,26 в системі (дихлорметан/етилацетат), (96:4), (об'єм/об'єм) + + ES: m/z=834 MNa ; m/z=812 MH 1 Н-ЯМР-спектр (400 МГц; при використанні 94744 34 магнію і випаровують досуха при зниженому тиску. Одержаний маслянистий залишок хроматографують на силікагелі, що заздалегідь кондиціонується з допомогою гептану, потім елююється лінійним градієнтом 0-50% етилацетату в гептані. Отримують 0,064 г (34%) очікуваної сполуки 9 у вигляді масла. Rf=0,40 в системі (гептан/етилацетат), (85:15), (об'єм/об'єм) + + ES: m/z=391 MH ; m/z=335 MH -C3H4O 1 Н-ЯМР-спектр (400 МГц; при використанні спектрометра BRUKER AVANCE DRX-400; з хімічними зсувами (δ в м.ч.) - в дейтерованому диметилсульфоксиді-d6 як розчиннику (ДМСО-d6), стандартизованому при 2,50 м.ч., при температурі 303 К): 0,88 (м частково прихований, 1Н); 0,91 (д, J=6,5 Гц, 3H); 0,95 (д уш., J=7,5 Гц, 3H); 1,23 (м, 1Н); від 1,28 до 1,43 (м, 2H); 1,32 (с, 3H); від 1,50 до 1,63 (м, 2H); від 1,73 до 1,90 (м, 3H); 2,03 (м, 1Н); 2,21 (м, 1Н); 2,68 (м, 1H); 3,52 (т, J=2,5 Гц, 1Н); 4,30 (дд, J=2,5 і 16,0 Гц, 1Н); 4,51 (дд, J=2,5 і 16,0 Гц, 1Н); 5,57 (с, 1Н). b) Стадія 2 Одержання сполуки за Прикладом 16 і Прикладом 17 спектрометра BRUKER AVANCE DRX-400; з хімічними зсувами (δ в м.ч.) - в дейтерованому хлороформі-d1 як розчиннику (CDCl3-d1), стандартизованому при 7,27, при температурі 303 К): від 0,75 до 1,70 (м частково прихований, 16H); 0,92 (д уш., J=7,0 Гц, 9H); 0,98 (д уш., J=7,0 Гц, 3H); 1,41 (с, 3H); 1,43 (с, 3H);1,89 (м, 2H); 2,03 (м, 2H); 2,37 (м, 2H); 2,84 (м, 2H); 4,11 (м, 1Н); 4,32 (м, 1H); від 4,40 до 4,60 (м, 2H); 4,71 (д, J=12,5 Гц, 1Н); 5,04 (д, J=12,5 Гц, 1H); 5,20 (с, 1Н); 5,70 (с, 1Н); 7,53 (с, 1H). Приклад 17: ТШХ: Rf=0,32 в системі (дихлорметан/етилацетат), (96:4), (об'єм/об'єм) + + ES: m/z=834 MNa ; m/z=812 MH 1 Н-ЯМР-спектр (500 МГц; при використанні спектрометра BRUKER AVANCE DRX-500; з хімічними зсувами (δ в м.ч.) - в дейтерованому хлороформі-d1 як розчиннику (CDCl3-d1), стандартизованому при 7,27, при температурі 303 К): від 0,55 до 1,70 (м частково прихований, 16H); 0,90 (д уш., J=7,0 Гц, 9H); 1,01 (д уш., J=7,0 35 94744 Гц, 3H); 1,39 (с, 3H); 1,44 (с, 3H); від 2,30 до 2,43 (м, 2H); від 1,97 до 2,09 (м, 2H); від 2,28 до 2,42 (м, 2H); 2,80 (м, 1Н); 2,90 (м, 1Н); 4,11 (м, 1Н); від 4,42 до 4,63 (м, 3H); 4,40 (д, J=13,0 Гц, 1Н); 5,04 (д, J=13,0 Гц, 1H); 5,11 (с, 1Н); 5,24 (с, 1H); 7,61 (с, 1H). Антипроліферативна активність одержаних сполук Сполуки згідно з винаходом були об'єктом фармакологічних тестів, що дозволяють визначити їх антипроліферативну активність. Її встановлювали шляхом визначення інгібування клітинної проліферації клітин НСТ116. Проводили посів клітин на середовище для культивування клітин в концентрації 10000 клітин на ямку, при використанні 0,17 мл середовища, і додавали 20 мкл сполуки, що тестується, в різних концентраціях, і 10 мкл тимідин[метил-14С] (100 мкКі/мл - питома активність 47,90 мКі/ммоль; NEN Technologies, номер за каталогом NEC568, серія 3550-001), потім клітини інкубували при температурі 37°С і в атмосфері з 5% СО2. Середовище, що використовується для культивування клітин НСТ116: модифіковане за способом Дульбеко середовище Ігла, 2 мМ Lглутаміну, 200 Од/мл пеніциліну, 200 мкг/мл стрептоміцину і 10% (об'єм/об'єм) фетальної телячої сироватки (Life Technologies). Через 96 годин підраховували включення 14 С-тимідину при використанні рідинного сцинтиляційного лічильника 1450 Microbeta Wallac Triflux. Результати R виражали в імп./хв. (імпульсів за хвилину) і переводили в процент інгібування зростання G1%, здійснюючи спочатку віднімання середнього значення числа імп./хв. у випадку ямок без клітин В і потім розподіл на число імп./хв. у випадку ямок з необробленими клітинами С, що включають 20 мкл середовища розведення сполуки, що містить 1% етанолу (G1%=(R-B)100/C%). Значення IC50 розраховували з допомогою рівняння 205 програмного забезпечення XLFit (фірма IDBS, UK) шляхом нелінійного регресійного аналізу, використовуючи алгоритм Marquardt (Dоnald W. MARQUARDT, J. Soc. industry. appl., vol. 11, №2, червень 1963). Сполуки володіють IC50 відносно клітин НСТ116 звичайно нижче 10 мкМ і, переважно, нижче 100 нМ. Приклади IC50 (нМ)/НСТ116 Приклад 1 47 Приклад 2 23 Приклад 3 21 Приклад 8 30 Сполуки згідно з винаходом, отже, можуть бути використані для одержання лікарських засобів. Таким чином, згідно з іншим аспектом, об'єктом винаходу є лікарські засоби, які включають сполуку формули (I) або її фармацевтично прийнятну кислотно-адитивну сіль або її гідрати або сольват. Ці лікарські засоби знаходять своє застосування в терапії, зокрема, при лікуванні раку. Отже, даний винахід стосується застосування 36 сполуки формули (I) для одержання лікарського засобу, придатного для лікування патологічного стану, і, більш конкретно, застосуванню сполуки формули (I) для одержання лікарського засобу, придатного для лікування раку. Даний винахід також стосується застосування сполуки формули (I) для одержання лікарського засобу, придатного для лікування патологій, що характеризуються аномальною неоваскуляризацією або аномальним ангіогенезом, тобто, таких як ракові захворювання, в тому числі конкретні ракові захворювання, такі, як саркома Капоші або інфантильна гемоангіома, і також такі як ревматоїдний артрит, остеоартрит і/або пов'язані з ними болі, запальні захворювання кишечнику, такі, як геморагічний ректоколіт або хворобу Крона, патології ока, такі, як пов'язана з віком макулярна дегенерація, діабетична ретинопатія, хронічне запалення, псоріаз. Ангіогенез являє собою процес генерації нових капілярів з попередніх судин. Пухлинний ангіогенез (утворення нових кровоносних судин), необхідний для зростання пухлини, також є одним з істотних факторів метастатичної дисемінації (Oncogene, 22(20), 3172-3179 (2003, 19 травня); Nat. Med., 1(1), 27-31 (1995, січень)). Згідно з іншим аспектом, даний винахід стосується фармацевтичних композицій, що включають, як діюче начало, сполуку згідно з винаходом. Ці фармацевтичні композиції містять ефективну дозу, щонайменше, однієї сполуки згідно з винаходом або фармацевтично прийнятної солі, гідрату або сольвату вищезгаданої сполуки, а також, щонайменше, один фармацевтично прийнятний ексципієнт. Вищезгадані ексципієнти вибирають, в залежності від фармацевтичної форми і бажаного способу введення, із звичайних ексципієнтів, які відомі фахівцеві в даній галузі. У випадку фармацевтичних композицій згідно з даним винаходом для перорального, сублінгвального, підшкірного, внутрішньом'язового, внутрішньовенного, локального, інтратрахеального, інтраназального, черезшкірного або ректального введення, діюче начало вищенаведеної формули (I), або його сіль, сольват або гідрат, може бути введене в стандартній лікарській формі, у вигляді суміші з класичними фармацевтичними ексципієнтами, тваринам і людям для профілактики або лікування вищезгаданих порушень або захворювань. Відповідні стандартні форми введення включають форми для перорального введення, такі, як таблетки, м'які або тверді желатинові капсули, порошки, гранули і пероральні розчини або суспензії, форми для сублінгвального, букального, інтратрахеального, внутрішньоочного, інтраназального введення, введення шляхом інгаляції, форми для локального, черезшкірного, підшкірного, внутрішньом'язового або внутрішньовенного введення, форми для ректального введення і імплантати. Для локального застосування можна використати сполуки згідно з винаходом в 37 94744 кремах, гелях, мазях або лосьйонах. Як приклад, стандартна лікарська форма введення сполуки згідно з винаходом у вигляді таблетки може включати наступні компоненти: Сполука згідно з винаходом 50,0 мг Маніт 223,75 мг Натрійкроскармелоза 6,0 мг Кукурудзяний крохмаль 15,0 мг Гідроксипропілметилцелюлоза 2,25 мг Стеарат магнію 3,0 мг Можуть бути конкретні випадки, де використовують більш високе або більш незначне дозування; таке дозування не входить в рамки винаходу. Згідно із звичайною практикою, дозування, відповідне кожному пацієнту, визначається лікарем в залежності від способу введення, маси і реакції у відповідь вищезгаданого пацієнта. Даний винахід, згідно з іншим аспектом, також стосується способу лікування вищезгаданих патологій, який включає введення пацієнту ефективної дози сполуки згідно з винаходом або однієї(ого) з його фармацевтично прийнятних солей або гідратів або сольватів. Сполуки згідно з даним винаходом можуть бути введені індивідуально або у вигляді суміші з іншими протираковими засобами. З можливих комбінацій можна назвати: - алкілуючі агенти і, зокрема, циклофосфамід, мелфалан, іфосфамід, хлорамбуцил, бусульфан, тіотепа, преднімустин, кармустин, ломустин, семустин, стептозотоцин, декарбазин, темозоломід, прокарбазин і гексаметилмеламін; - платинові похідні, як, зокрема, цисплатин, карбоплатин або оксаліплатин; - антибіотики, як, зокрема, блеоміцин, мітоміцин, дактиноміцин; - антимікроканальцеві агенти, як, зокрема, Комп’ютерна верстка Л. Литвиненко 38 вінбластин, вінкристин, віндезин, вінорелбін, таксоїди (паклітаксел і доцетаксел); - антрацикліни, як, зокрема, доксорубіцин, даунорубіцин, ідарубіцин, епірубіцин, мітоксантрон, лозоксантрон; - інгібітори топоізомераз груп I і II, такі, як етопозид, теніпозид, амсакрин, іринотекан, топотекан і томудекс; - фторпіримідини, такі, як 5-фторурацил, UFT, флоксуридин; - аналоги цитидину, такі, як 5-азацитидин, цитарабін, гемцитабін, 6-меркаптомурин, 6тіогуанін; - аналоги аденозину, такі, як пентостатин, цитарабін або флударабінфосфат; - метотрексат і фолінова кислота; - ферменти і різні сполуки, такі, як Lаспарагіназа, гідроксисечовина, транс-ретиноєва кислота, сурамін, дексразоксан, аміфостин, герцептин, а також естрогенні, андрогенні гормони; - антиваскулярні агенти, такі, як похідні комбретастатину, наприклад, СА4Р, халконів або колхіцину, наприклад, ZD6126, і їх пролікарські форми; - інгібітори кіназ, такі, як ертоніліб або іматиніб; - біотерапевтичні засоби, як антитіла, такі, як ритуксимаб, бевацизумаб, цетуксимаб, трастузумаб або алемтузумаб; - інгібітори протеазоми, такі, як бортезоміб. З сполуками згідно з даним винаходом також можна комбінувати лікування шляхом опромінень. Ці лікування можуть бути здійснені одночасно, роздільно, послідовно. Лікування застосовується лікарем в залежності від захворювання, що піддається лікуванню. Підписне Тираж 24 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюDimers of artemisinin derivatives, preparation thereof and therapeutic use thereof
Автори англійськоюCommercon Alain, Zhang Jidong, Hittinger Augustin
Назва патенту російськоюДимеры производных артемизинина, их получение и их применение в терапии
Автори російськоюКоммерсон Ален, Чжан Цзидун, Иттенжер Огюстен
МПК / Мітки
МПК: C07D 493/22, A61P 35/00, A61K 31/357
Мітки: артемізиніну, одержання, димери, терапії, застосування, похідних
Код посилання
<a href="https://ua.patents.su/19-94744-dimeri-pokhidnikh-artemizininu-kh-oderzhannya-i-kh-zastosuvannya-v-terapi.html" target="_blank" rel="follow" title="База патентів України">Димери похідних артемізиніну, їх одержання і їх застосування в терапії</a>
Попередній патент: Спосіб одержання похідних лізобактину
Наступний патент: Фармацевтична композиція у формі гелю для лікування стоматологічних захворювань
Випадковий патент: Спосіб виробництва сплавів алюміній-кремній