Спосіб комплексного лікування есенціальної артеріальної гіпертензії препаратами з матеріалу ембріофетального походження та виділених з нього клітин
Номер патенту: 113235
Опубліковано: 26.12.2016
Автори: Клунник Марія Олексіївна, Сінельник Андрій Аркадійович, Скалозуб Марина Вікторівна, Матіящук Ірина Георгіївна, Іванкова Олена Віталіївна, Сорочинська Христина Ігорівна, Демчук Марія Петрівна, Сич Наталія Сергіївна
Формула / Реферат
1. Спосіб комплексного лікування есенціальної артеріальної гіпертензії, що включає приготування препаратів з матеріалу ембріофетального походження та виділених з нього клітин у вигляді суспензії, яка містить стовбурові клітини, та щонайменше одне введення вказаних кріоконсервованих суспензій стовбурових клітин, який відрізняється тим, що виготовляють та вводять щонайменше три препарати у вигляді розмороженої після кріоконсервовації суспензії стовбурових клітин, виділених з матеріалу фетуса людини 5-14 тижня гестації, одна з яких містить стовбурові клітини з фетальної печінки, друга суспензія містить стовбурові клітини з фетального головного мозку, а третя суспензія містить стовбурові клітини з фетального серця, причому суспензію стовбурових клітин з фетальної печінки вводять шляхом внутрішньовенного введення в об'ємі, не меншому за 0,1 мл, з кількістю ядровмісних клітин не менше за 41,28×106 в 1 мл за одне введення, суспензію стовбурових клітин фетального головного мозку вводять підшкірно в об'ємі, не меншому за 0,5 мл, з кількістю ядровмісних клітин не менше за 5,81×106 в 1 мл за одне введення, а суспензію стовбурових клітини фетального серця вводять підшкірно в об'ємі, не меншому за 0,6 мл, з кількістю ядровмісних клітин не менше за 2,73×106 в 1 мл за одне введення, причому вказані суспензії стовбурових клітин вводять одночасно з проведенням стандартної медикаментозної терапії, а перед введенням суспензії стовбурових клітин з фетальної печінки додатково виконують премедикацію.
2. Спосіб за п. 1, який відрізняється тим, що як стандартну медикаментозну терапію призначають сечогінні препарати, бета-адреноблокатори, антагоністи кальцію, інгібітори ангіотензинперетворюючого ферменту і/або антагоністи рецепторів до анготензину II, інгібітори реніну та інші гіпотензивні засоби.
3. Спосіб за п. 1, який відрізняється тим, що суспензію із стовбурових клітин з фетальної печінки вводять разом із фізіологічним розчином натрію хлориду зі швидкістю 20-40 крапель за хвилину.
4. Спосіб за п. 1, який відрізняється тим, що премедикацію виконують шляхом внутрішньовенного введення 10 мг димедролу і 30 мг преднізолону.
5. Спосіб за п. 1, який відрізняється тим, що перед введенням суспензії стовбурових клітин з фетальної печінки, суспензії стовбурових клітин з фетального мозку та суспензії стовбурових клітин з фетального серця додатково виконують клінічне, лабораторне та інструментальне обстеження стану хворого.
6. Спосіб за п. 1, який відрізняється тим, що перед проведенням лікування та через 1, 3 та 6 місяців після введення суспензії стовбурових клітин з фетальної печінки, суспензії стовбурових клітин з фетального мозку та суспензії стовбурових клітини з фетального серця здійснюють контроль активності патологічного процесу за клінічними, лабораторними та інструментальними показниками.
Текст
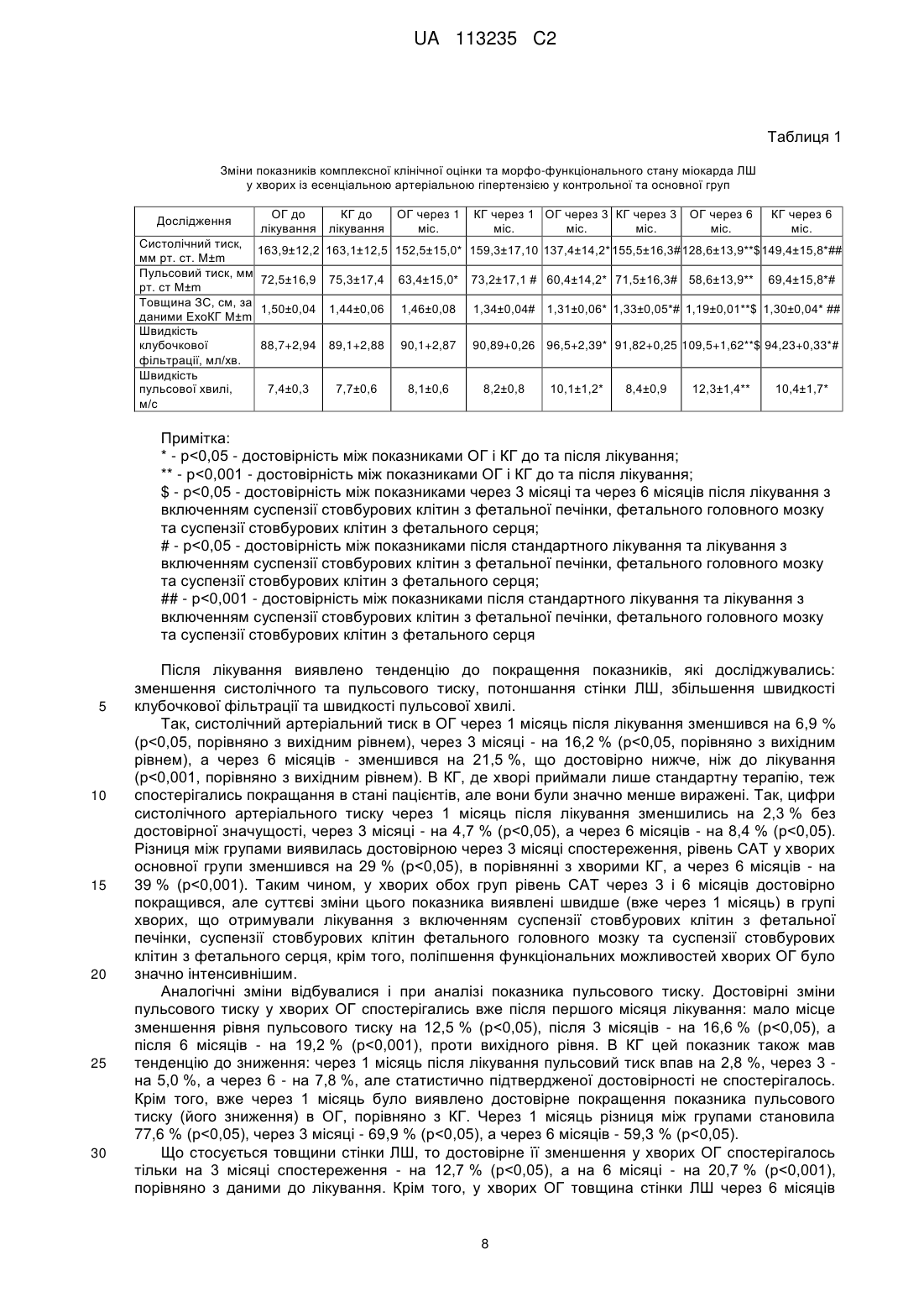
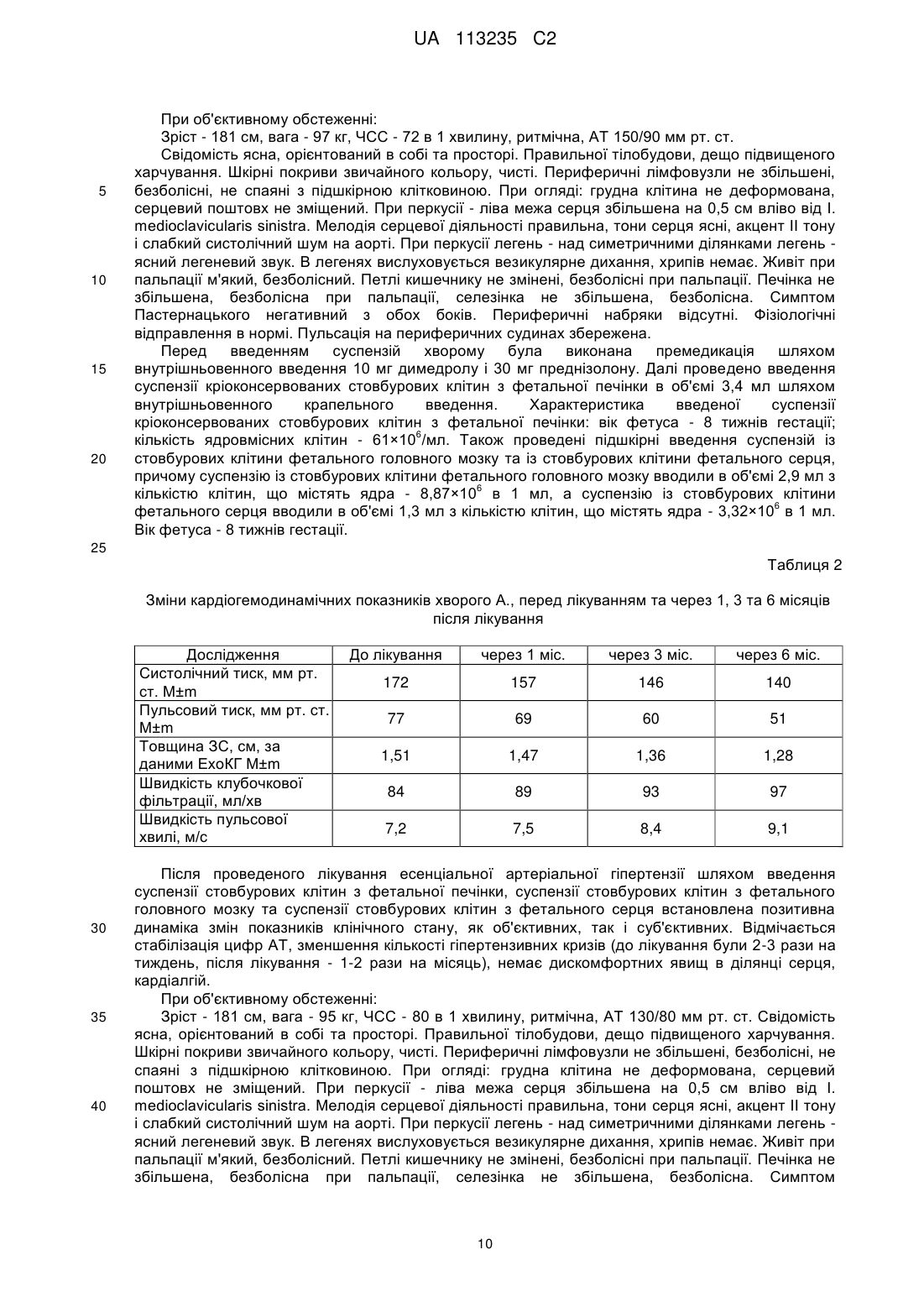
Реферат: Винахід стосується способу приготування препаратів у вигляді суспензії, яка містить стовбурові клітини, причому виготовляють три препарати у вигляді розмороженої після кріоконсервовації суспензії стовбурових клітин, виділених з матеріалу фетуса людини 5-14 тижня гестації, одна з яких містить стовбурові клітини з фетальної печінки, друга суспензія містить стовбурові клітини з фетального головного мозку, а третя суспензія містить стовбурові клітини з фетального серця, причому суспензію стовбурових клітин з фетальної печінки вводять шляхом внутрішньовенного введення в об'ємі, не меншому за 0,1 мл, з кількістю ядровмісних клітин не 6 менше за 41,28х10 в 1 мл за одне введення, а суспензію із стовбурових клітини фетального головного мозку вводять підшкірно в об'ємі, не меншому за 0,5 мл, з кількістю клітин не менше 6 за 5,81×10 в 1 мл за одне введення, а суспензію із стовбурових клітини фетального серця 6 вводять підшкірно в об'ємі, не меншому за 0,6 мл, з кількістю клітин не менше за 2,73×10 в 1 мл за одне введення, причому вказані суспензії стовбурових клітин вводять одночасно з проведенням стандартної медикаментозної терапії, а перед введенням суспензії стовбурових клітин з фетальної печінки додатково виконують премедикацію. UA 113235 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід належить до галузі медицини, а саме: до кардіології та клітинної терапії, та може бути використаний при лікуванні пацієнтів, хворих на есенціальну артеріальну гіпертензію (АГ) шляхом введення препаратів з матеріалу ембріофетального походження та виділених з нього клітин у вигляді суспензій, що містять стовбурові клітини, зокрема стовбурові клітини з фетальної печінки, фетального мозку і фетального серця, на фоні стандартної терапії. Відомо, що серцево-судинні захворювання займають перше місце серед причин смерті в загальній популяції людей та є однією з основних проблем закладів охорони здоров'я всіх економічно розвинених країн світу [1]. За оцінками Всесвітньої організації охорони здоров'я, в 2012 році від серцево-судинних захворювань померло 17,3 млн. людей, що становило 30 % всіх випадків смерті в світі. Ця проблема різною мірою торкається країн з низьким і високим рівнем доходів. Більше 80 % випадків смерті в країнах з високим прибутком припадає на серцевосудинні захворювання, причому рівень смертності від цих хвороб майже однаковий для жінок і чоловіків. До 2030 року близько 23,6 млн. осіб помиратиме щороку від серцево-судинних захворювань, головним чином, від хвороб серця та інсульту, які залишаються, за прогнозом, єдиними основними причинами смерті [3]. На сьогоднішній день близько 15 % населення Землі страждає АГ, тобто їх артеріальний систолічний тиск стабільно дорівнює 140 мм рт. ст. або перевищує ці цифри та/або діастолічний тиск складає мінімум 90 мм рт. ст. (без застосування гіпотензивних засобів). Порівняльних даних про розповсюдженість АГ та почасовій динаміці артеріального тиску (AT) в різних країнах Європи небагато. В цілому, розповсюдженість АГ знаходиться в діапазоні 30-45 % від загальної популяції, з різким зростанням за мірою старіння. Мабуть, в різних країнах також є помітні відмінності середніх значень AT, без якихось системних тенденцій до зміни AT за останні десять років. В зв'язку з труднощами в одержанні зіставних результатів в різних країнах і в різний час, була висловлена пропозиція опиратися на деякий сурогатний показник AT. Гарним кандидатом на роль такого показника є інсульт, тому що загальновизнано, що АГ є найважливішою його причиною. Описаний тісний зв'язок між розповсюдженню АГ та смертністю від інсульту [9]. Частота інсульту та динаміка смертності від нього в Європі були проаналізовані за статистичними даними Всесвітньої Організації Охорони Здоров'я (ВООЗ). В країнах Заходу відмічається тенденція до зниження цього показника, тоді як в східно-європейських країнах смертність від інсульту зростає [8]. Есенціальна АГ - хронічне захворювання, основною клінічною ознакою якого є тривале і стійке підвищення артеріального тиску (гіпертензія) з невстановлених причин. За рекомендаціями ВООЗ підвищеним вважається систолічний AT (CAT), що дорівнює або перевищує 140 мм рт.ст., діастолічний AT (ДАТ) - 90 мм рт. ст. Розвиток АГ пов'язують з наявністю низки чинників ризику: 1. Між AT і віком існує пряма залежність: CAT з віком постійно збільшується, а ДАТ підвищується до 55 років, а потім істотно не змінюється. 2. Існує також залежність між AT і статтю. Поширеність артеріальної гіпертензії і рівень AT у жінок молодого і середнього віку зазвичай нижчі, ніж у чоловіків. 3. Істотний вплив на розвиток АГ справляє спадковість, про що свідчить наявність підвищеного AT у найближчих родичів. 4. Аліментарні чинники, ожиріння та інсулінорезистентність. Зі стійким підвищення AT асоціюється насамперед надлишкове вживання кухонної солі. Певне значення має + 2+ 2+ недостатність у їжі K , Са і Mg ; надлишкове вживання тваринних жирів, холестерину і солодощів та недостатнє вживання овочів, фруктів і риби. АГ утричі частіше виникає в тих, хто вживає до 5 чашок кави на день. Підвищення AT корелює також з кількістю алкоголю, уживаного щодня. 5. Різко підвищує AT нікотин. У тих, хто палить, інсульт розвивається у 2-3 рази частіше, ніж у тих, хто не палить. Ефект кожної сигарети триває близько 30 хв. і спричинює підвищення CAT на 15-25 мм рт. ст. 6. Психосоціальні чинники, зокрема стрес, сприяють підвищенню AT. 7. Соціально-економічний статус. Досвід більшості країн свідчить про те, що зі зростанням економіки в суспільстві неухильно зростає поширеність АГ серед малозабезпечених верств населення. 8. Фізична активність. В осіб, які ведуть малорухомий спосіб життя, ризик розвитку АГ на 2025 % вищий, ніж у фізично активних осіб. Класичні концепції етіології і патогенезу АГ включають нейрогенну теорію Г.Ф. Ланга, об'ємно-сольову - А. Гайтона й об'ємну - Б. Фолкова. Нейрогенна теорія Г.Ф. Ланга. Відповідно до цієї теорії, АГ є класичною "хворобою регуляції", розвиток якої пов'язаний з тривалою психічною травматизацією негативними 1 UA 113235 C2 5 10 15 20 25 30 35 40 45 50 55 60 емоціями сфери вищої нервової діяльності. Це призводить до дисфункції регуляторів AT в кірковій речовині великих півкуль мозку і гіпоталамічних центрах зі збільшенням симпатичної вазо-констрикторної імпульсації по еферентних нервових волокнах і, як наслідок, - до підвищення судинного тонусу. Обов'язковою умовою реалізації впливу цих чинників середовища, на думку Г.Ф. Ланга, є наявність певних "конституційних особливостей", тобто спадкової схильності. Отже, розвиток АГ, за Лангом, визначається не одним, а двома чинниками. Об'ємно-сольова теорія А. Гайтона. Відповідно до цієї теорії, в основі розвитку АГ лежить + послаблення видільної функції нирок, що призводить до затримання в організмі Na і води, а отже, до збільшення об'єму циркулюючої крові (ОЦК) і хвилинного об'єму серця (ХОС). У відповідь на підвищення ХОС місцеві механізми саморегуляції кровотоку зумовлюють міогенне звуження артеріол, результатом якого є нормалізація ХОС за рахунок підвищення загального периферичного судинного опору (ЗПСО) і тим самим - AT. Збільшенню вираженості і стійкості цієї констрикторної реакції сприяє підвищення реактивності судин унаслідок набряку й + акумуляції Na в їхніх стінках. Відповідно до цієї теорії, з часом "гіпертензія викиду" із властивим їй гіперкінетичним типом змін гемодинаміки (збільшений ХОС і незмінений ЗПСО) трансформується в "гіпертензію опору" з гіпокінетичним гемодинамічним профілем (збільшений ЗПСО і нормальний або знижений ХОС). Ця теорія не розкриває причин "переключення" нирки на вищий рівень AT, але вона пояснює основний механізм підтримання стабільної АГ будь-якого походження. Можливо, етіологічними чинниками захворювання є надлишкове споживання солі і/або генетично зумовлене підвищення чутливості до неї. Роль надлишкового споживання солі в патогенезі АГ підтверджують дані епідеміологічних досліджень. Так, у деяких африканців і + бразильських індіанців, які вживали менше ніж 60 мекв Na на добу (норма споживання 150-250 мекв), АГ трапляється рідко, а AT з віком практично не підвищується. Навпаки, у жителів + Північної Японії, що вживали донедавна понад 300 мекв Na за добу, поширеність АГ значно вища, ніж у Європі. Роль спадкової схильності як найважливішого чинника АГ не викликає сумнівів. Однак механізми реалізації спадкової схильності остаточно не встановлені. Об'ємна теорія Б. Фолкова. Відповідно до цієї концепції, в основі розвитку АГ лежить гіперактивація симпатико-адреналової системи, що призводить до гіперфункції серця зі збільшенням ХОС (гіперкінетичного синдрому) і периферійної вазоконстрикції. Цьому станові сприяють: 1) стресові ситуації і схильність до їх акцентуації; 2) генетично зумовлене порушення функції вищих нервових регуляторів AT, що призводить до його надлишкового підвищення у відповідь на фізіологічні стимули; 3) вікова нейроендокринна перебудова з інволюцією статевих і підвищенням активності надниркових залоз. Припускають, що на етапі "закріплення" АГ важливу роль набуває локальний ефект посиленої адренергічної стимуляції - звуження аферентних ниркових артеріол - і, як наслідок, підвищене виділення реніну, що не супроводжується істотним збільшенням концентрації норадреналіну в загальному кровотоку. Підвищення активності реніну в плазмі крові (гіперренінова АГ) у майже 15 % хворих із АГ частіше спостерігається у відносно молодому віці і має тяжкий та злоякісний перебіг. У 25 % хворих, частіше літнього віку, активність реніну в плазмі крові знижена (гіпоренінова АГ). Причини цього явища залишаються нез'ясованими. Стійкість підвищення судинного тонусу визначається розвитком гіпертрофії середньої оболонки судинної стінки. При збільшенні співвідношення товщини стінки артеріоли і її внутрішнього радіуса відносно невелике вкорочення непосмугованих м'язових клітин призводить до значно більшого, ніж у нормі, підвищення судинного опору. Іншими словами, у подібних випадках різке підвищення судинного опору можна отримати у відповідь на відносно низький рівень симпатичної імпульсації або низьку концентрацію вазопресорної речовини. Патологічна анатомія. Патологоанатомічним субстратом АГ є поєднання адаптаційних і дегенеративних змін серця і судин. До адаптаційних змін відносять гіпертрофію лівого шлуночка (ЛШ), а також гіперплазію і гіпертрофію непосмугованих м'язових клітин внутрішньої і середньої оболонок судинної стінки. Дегенеративні зміни в серці пов'язані з розвитком дистрофії гіпертрофованого міокарда. Важливу роль відіграє також його коронарогенне ураження внаслідок прискореного розвитку супутнього атеросклерозу вінцевих артерій, що проявляється дифузійним міокардіосклерозом та інтерстиціальним фіброзом. Унаслідок цього виникає серцева недостатність (СН), що є однією з основних причин смерті таких хворих. Дегенеративні (дистрофічні) зміни артеріол пов'язані з реакцією на інфільтрацію судинної стінки білками плазми крові під дією підвищеного гідростатичного тиску і розвитком поширеного артеріолосклерозу. Значне звуження просвіту аферентних і еферентних ниркових артеріол 2 UA 113235 C2 5 10 15 20 25 30 35 40 45 50 55 60 спричинює порушення функції клубочків і канальців з поступовим запустінням і атрофією нефронів та розростанням сполучної тканини. Як наслідок розвивається нефросклероз (первинно-зморщена нирка), що є морфологічним субстратом хронічної ниркової недостатності (ХНН). У головному мозку часто виявляють мікроаневризми дрібних артерій, що є основною причиною геморагічних інсультів. Раннім проявом артеріолосклерозу сітківки є звуження всього артеріолярного русла зі збільшенням співвідношення діаметра венозних і артеріальних судин (більш як 3:2). У разі вищих показників гіпертензії калібр артеріол стає нерівномірним з чергуванням звужених і розширених ділянок. Навколо артеріол з'являються ексудати, що нагадують вату, а при порушенні цілості стінки - крововиливи. Клінічна картина. До розвитку ускладнень захворювання часто має безсимптомний перебіг, а єдиним його проявом є підвищення AT. Скарги відсутні або неспецифічні. Хворі відзначають періодичний головний біль, частіше в ділянці лоба або потилиці, запаморочення і шум у вухах. Нині доведено, що ці симптоми не можуть слугувати індикаторами підвищеного AT і, ймовірно, мають функціональне походження. Вони трапляються у хворих з АГ не частіше, ніж у населення в цілому, і не корелюють з рівнем AT. Симптоми й ознаки ураження серця пов'язані з: 1) гіпертрофією ЛШ; 2) супутньою ішемічною хворобою серця (ІХС); 3) СН як ускладненням обох патологічних процесів. Клінічне значення "гіпертензивного серця" пов'язують з порушенням діастолічної функції міокарда внаслідок підвищення його твердості і розвитком відносної коронарної недостатності. Зменшення діастолічної піддатливості ЛШ призводить до підвищення його тиску наповнення і венозного застою в легенях при незміненій систолічній функції. Хворі відзначають задишку в разі фізичного навантаження, що наростає з приєднанням систолічної міокардіальної недостатності. Якщо артеріальна гіпертензія задавнена, можна знайти симптоми ураження нирок - ніктурію і поліурію. У разі неускладненої АГ симптоми ураження центральної нервової системи переважно зумовлені супутнім атеросклерозом черепних і позачерепних артерій. До них належать запаморочення, порушення працездатності, пам'яті та ін. Під час клінічного обстеження найважливішою діагностичною ознакою є підвищення AT. Фізикальне дослідження серцево-судинної системи може виявити ознаки гіпертрофії ЛШ, ЛШ недостатності й атеросклерозу різних судинних басейнів. Клінічні ознаки ураження нирок з розгорнутою картиною ХНН характерні переважно для злоякісної АГ. Ознаки ураження центральної нервової системи (ЦНС) пов'язані здебільшого з ускладненнями АГ і супутнім церебральним атеросклерозом. Для хворих на АГ характерна гіпертензивна ретинопатія. При ранній стадії ретинопатії зір не страждає. Масивні ексудати і крововиливи можуть спричинити появу дефектів полів зору, а при ураженні макули - сліпоту. Цінною ознакою ураження серця як одного з органів-мішеней при вираженій АГ є розвиток гіпертрофії ЛШ, що визначається під час електрокардіографії і ехокардіографії. На рентгенограмі органів грудної клітки в частини хворих визначають заокруглення верхівки серця, особливо помітне в бічній проекції, як непряму ознаку концентричної гіпертрофії ЛШ. Про супутній атеросклероз грудної частини аорти свідчать подовження, розгорнення, розширення й ущільнення її дуги. Ехокардіографія є найчутливішим методом виявлення гіпертрофії ЛШ, оцінювання вираженості і характеру діастолічної дисфункції ЛШ. У задавнених випадках визначають дилатацію ЛШ і його систолічну дисфункцію. За наявності змін у сечі неінвазивні методи - ультразвукове дослідження, радіонуклідна рено- і сцинтиграфія, а також екскреторна урографія - дають змогу виявити дифузні ураження ниркової паренхіми з однаково вираженим зменшенням розмірів і порушенням функції нирок. Відомий спосіб терапії хворих на АГ, асоційовану з ожирінням, що включає призначення лізиноприлу у дозі 5 мг, при необхідності дозу повільно збільшують до 10-15 мг на добу під контролем динаміки артеріального тиску та рівнів лептину і інсуліну (патент України на корисну модель № 33187, дата публікації - 10.12.2008 р., кл. МПК А61K31/33), що призводить до підвищення симпатичної активності. Недоліком відомого способу є недостатня ефективність лікування АГ, обумовлена недостатнім впливом на регуляцію AT. Відомий спосіб лікування хворих на артеріальну гіпертензію з серцевою недостатністю та інсулінрезистентністю, у якому до призначення лікування визначають такі ознаки метаболічних порушень, як абдомінальний тип ожиріння, ступінь інсулінорезистентності, наявність чи 3 UA 113235 C2 5 10 15 20 25 30 35 40 45 50 55 60 відсутність дисліпідемії, оцінюють стан гемодинаміки за показниками добового моніторування артеріального тиску (патент України на корисну модель № 75849, дата публікації - 10.12.2012 р., кл. МПК А61В5/0402). Причому для лікування застосовують препарат телмісартан, який шляхом довготривалого антиппертензивного ефекту нормалізує стан гемодинаміки, покращує функціональний стан міокарда лівого шлуночка і одночасно, на відміну від інших антигіпертензивних препаратів, може знижувати ступінь інсулінорезистентності та коригувати дисліпідемію в терапевтично ефективних дозах по 40-80 мг 1 раз на добу, що забезпечує попередження ускладнень артеріальної гіпертензії та прогресування серцевої недостатності. Недоліком відомого способу є недостатня ефективність лікування АГ, обумовлена недостатнім впливом на регуляцію AT, що супроводжується ускладненнями з боку органів мішеней. Відомий спосіб лікування хворих на артеріальну гіпертензію з синдромом інсулінорезистентності, що включає поєднане використання антигіпертензивних препаратів (патент України на корисну модель № 38773, дата публікації - 12.01.2009 р., кл. МПК А61Р0/00). При цьому для корекції ендотеліальної дисфункції застосовують інгібітор ангіотензинперетворюючого ферменту еналаприлу малеат по 20-40 мг (1 таблетка 10-20 мг) на добу та агоніст імідазолінових рецепторів - моксонідин по 0,2 мг (1 таблетка 0,2 мг) один раз на добу, курс лікування 2 місяці. Відомий спосіб лікування дозволяє лікувати хворих на АГ з синдромом інсулінрезистентності. Проте недоліком відомого способу є недостатня ефективність лікування АГ, що обумовлена недостатнім впливом на регуляцію AT. Відомий спосіб лікування легеневої гіпертензії, що розвинулась, як ускладнення есенціальної артеріальної, при якому хворому внутрішньовенно крапельно вводять біотрансплантат у кількості від 50 до 500 млн. мезенхимальних стовбурових клітин в 50-100 мл фізіологічного розчину зі швидкістю 10 мл/ хв. (патент Російської Федерації на винахід № 2271817, дата публікації - 20.03.2006, кл. МПК А61K35/28). При чому біотрансплантат являє собою гомогенну не менше 80 % популяцію плюрипотентних мезенхимальних стовбурових клітин, що виділені із фетального, донорського або аутологічного матеріалу. Як фетальний матеріал використовують тканини: кістковий мозок, тимус, печінку, жирову тканину ембріонів 1го триместру вагітності. Недоліком відомого способу є те, що перед застосуванням фетальну тканину необхідно культивувати в живильному середовищі, що ускладнює та збільшує час проведення лікування хворого. Крім того, недоліком способу є недостатня ефективність лікування саме артеріальної гіпертензії, обумовленої недостатнім впливом на регуляцію AT. Найбільш близьким до способу лікування гіпертензії є спосіб лікування гіпертензії, зокрема портальної гіпертензії, в якому використовують біотрансплантат у вигляді суспензії у фізіологічному розчині з сумарною кількістю клітин біотрансплантата від 350 до 500 млн. (патент Російської Федерації на винахід № 2368384, дата публікації - 27.09.2009, кл. МПК А61K35/407). Причому біотрансплантат містить змішану популяцію клітин, у якій 40 % складають стовбурові клітини, включаючи мезенхимальні і печінкові біпотентні стовбурові клітини, а решта 60 % - прогеніторні клітини у різній стадії диференціації, включаючи гепатобласти і клітини-попередники еритроїдного ряду, гемопоетичні клітини. Недоліком способу є недостатня ефективність лікування саме артеріальної гіпертензії, обумовленої недостатнім впливом на регуляцію AT, що не дозволяє гармонізувати роботу всіх систем організму хворого та відновити всю судинну систему людського організму, зокрема, роботу судин в головному мозку та серці. В основу винаходу поставлена задача удосконалення способу лікування есенціальної АГ препаратами з матеріалу ембріофетального походження та виділених з нього клітин, в якому за рахунок запропонованої послідовності проведення лікування з використанням суспензій емпірично підібраного складу на фоні стандартної терапії забезпечується висока ефективність лікування хворих з есенціальною АГ та гармонізація роботи всіх систем організму при повному відновленні всієї судинної системи людського організму, зокрема, роботи судин у головному мозку і серці, підвищенні їх еластичної властивості та прохідності, та при підсиленні видільної функції нирок без необхідності підбору донора за антигенами гістосумісності. Це дозволяє відновити мікропошкодження судин на всіх рівнях та забезпечити проростання нових капілярів замість пошкоджених до всіх органів, які потребують додаткового харчування. В результаті стабілізується рівень AT, що сприяє покращенню функціональних можливостей хворих на есенціальну АГ та якості їх життя. Крім того, забезпечується врахування персональних особливостей хворих та забезпечується запобігання виникненню алергійних реакцій та запобігання відторгненню стовбурових клітин з фетальної печінки, стовбурових клітин з 4 UA 113235 C2 5 10 15 20 25 30 35 40 45 50 55 60 фетального головного мозку і стовбурових клітин з фетального серця організмом хворих на АГ при проведенні лікування. Поставлена задача вирішується тим, що запропонованим способом лікування есенціальної АГ, що включає приготування препаратів з матеріалу ембріофетального походження та виділених з нього клітин у вигляді суспензії, яка містить стовбурові клітини, та щонайменше одне введення вказаних кріоконсервованих суспензій стовбурових клітин, в якому виготовляють та вводять щонайменше три препарати у вигляді кріоконсервованої суспензії стовбурових клітин, виділених з матеріалу фетуса людини 5-14 тижня гестації, одна з яких містить стовбурові клітини з фетальної печінки, друга суспензія містить стовбурові клітини з фетального головного мозку, а третя суспензія містить стовбурові клітини з фетального серця, причому суспензію стовбурових клітин з фетальної печінки вводять шляхом внутрішньовенного введення в об'ємі, 6 не меншому за 0,1 мл, з кількістю ядровмісних клітин не менше за 41,28×10 в 1 мл за одне введення, суспензію стовбурових клітин фетального головного мозку вводять підшкірно в об'ємі, 6 не меншому за 0,5 мл, з кількістю ядровмісних клітин не менше за 5,81×10 в 1 мл за одне введення, а суспензію стовбурових клітини фетального серця вводять підшкірно в об'ємі, не 6 меншому за 0,6 мл, з кількістю ядровмісних клітин не менше за 2,73×10 в 1 мл за одне введення, причому вказані суспензії стовбурових клітин вводять одночасно з проведенням стандартної медикаментозної терапії, а перед введенням суспензії стовбурових клітин з фетальної печінки додатково виконують премедикацію. Причому як стандартну медикаментозну терапію призначають сечогінні, бетаадреноблокатори, антагоністи кальцію, інгібітори ангіотензинперетворюючого ферменту і/або антагоністи рецепторів до ангіотензину II, інгібітори реніну та інші гіпотензивні засоби. Суспензію стовбурових клітин з фетальної печінки, як правило, вводять разом із фізіологічним розчином натрію хлориду зі швидкістю 20-40 крапель за хвилину. При цьому премедикацію виконують шляхом внутрішньовенного введення 10 мг димедролу і 30 мг преднізолону. Перед введенням суспензії стовбурових клітин з фетальної печінки, суспензії стовбурових клітин з фетального головного мозку та суспензії стовбурових клітин з фетального серця додатково виконують клінічне, лабораторне, та інструментальне обстеження стану хворого. Перед проведенням лікування та через 1, 3 та 6 місяців після введення суспензії стовбурових клітин з фетальної печінки та суспензії стовбурових клітини з фетального серця здійснюють контроль активності патологічного процесу за клінічними, лабораторними та інструментальними показниками. Ми встановили, що за рахунок введення принаймні трьох суспензій стовбурових клітин ембріофетального походження, а саме внутрішньовенного введення суспензії стовбурових клітин з фетальної печінки людини 5-14 тижня гестації в об'ємі, не меншому за 0,1 мл, з кількістю ядровмісних клітин не менше за 41,28×10 в 1 мл за одне введення, суспензії із стовбурових клітини фетального головного мозку в об'ємі, не меншому за 0,5 мл, з кількістю 6 клітин не менше за 5,81×10 в 1 мл за одне введення і суспензії із стовбурових клітини 6 фетального серця в об'ємі, не меншому за 0,6 мл, з кількістю клітин не менше за 2,73 × 10 в 1 мл за одне введення, забезпечується цілеспрямований вплив на морфо-функціональний стан ЛШ серця, що дозволяє поліпшити регуляцію тонусу судин та скоротливу функцію серця, а також поліпшується систолічна функція міокарда ЛШ шляхом збільшення кількості скоротливих клітинних елементів в міокарді та/або шляхом підвищення функціонального резерву кардіоміоцитів реципієнта за рахунок стимуляції в них процесів внутрішньоклітинної регенерації. При цьому, підсилюється видільна функція нирок, внаслідок чого зменшується об'єм циркулюючої крові (ОЦК), хвилинний об'єм серця (ХОС) та загальний периферійний судинний опір (ЗПСО). Крім того, стовбурові клітини при потраплянні в організм починають виділяти антіогенні та протизапальні фактори, а також заміщують собою пошкоджені клітини судинної системи, відновлюють мікропошкодженя судин на всіх рівнях та забезпечують проростання нових капілярів замість пошкоджених до всіх органів, які потребують додаткового харчування, в результаті чого відбувається повне відновлення всієї судинної системи людського організму. Це дозволяє гармонізувати роботу всіх систем організму та відновити роботу судин в головному мозку та серці, поліпшити їх еластичні властивості та прохідність. В результаті - стабілізується рівень AT, що сприяє покращенню функціональних можливостей хворих на есенціальну АГ та якості їх життя. При цьому виключається необхідність підбору донора за антигенами гістосумісності та забезпечується можливість введення суспензії стовбурових клітин фетальної печінки повторно. Крім того, проведення премедикації перед введенням суспензії стовбурових клітин з фетальної печінки дозволяє запобігти виникненню алергічних реакцій хворих під час проведення лікування. Причому, введення вказаних трьох суспензій стовбурових клітин 5 UA 113235 C2 5 10 15 20 25 30 35 40 45 50 55 60 одночасно з проведенням стандартної медикаментозної терапії дозволяє підсилити ефективність лікування есенціальної АГ, в результаті чого зменшуються клінічні прояви АГ, розвиток її ускладнень та поліпшуються показники при додаткових методах дослідження. Причому використання саме фетальної печінки, фетального головного мозку та фетального серця для отримання стовбурових клітин з метою приготування лікувальних препаратів у вигляді суспензій обумовлено їх пластичністю, зокрема, здатністю таких клітин зазнавати змін та диференціації у відповідь на навколишній вплив або, відповідно до їх внутрішньої програми. Відомо, що клітини ембріофетального походження здатні до росту, розмноження, диференціації, міграції та встановлення зв'язків з іншими клітинами. Порівняно з клітинами зрілих тканин, вони мають кращу здатність до проліферації. їх введення є ефективнішим також з огляду на утворення великої кількості ростових факторів. Клітини фетальної печінки можуть виробляти значну кількість стимулюючих речовин, таких як ангіогенний і нейротрофічний фактори, що сприяють їх виживанню та росту, проліферації, диференціації та можуть стимулювати регенерацію за рахунок оточуючих клітин хазяїна. Крім цього, фетальні клітини мають здатність виживати при нижчому рівні кисню, ніж диференційовані клітини, що робить їх стійкими до ішемічного ушкодження як під час маніпуляцій in vitro, так і після внутрішньовенного введення. Проліферуючі або незрілі клітини фетальної печінки переважно не мають довгих відростків або сильної міжклітинної адгезії і, таким чином, зазнають менших пошкоджень під час приготування суспензії клітин. Ці властивості дозволяють вводити клітини фетальної печінки шляхом внутрішньовенної ін'єкції суспензії [2]. Вказані характеристики можуть пояснити і підвищене виживання фетальних клітин і тканин в порівнянні з дорослими після кріоконсервації. Спосіб комплексного лікування есенціальної АГ препаратами з матеріалу ембріофетального походження та виділених з нього клітин здійснюють таким чином. Виготовляють три препарати у вигляді суспензії кріоконсервованих стовбурових клітин, одна з яких містить стовбурові клітини з фетальної печінки, друга суспензія містить стовбурові клітини з фетального головного мозку, а третя суспензія містить стовбурові клітини з фетального серця. Для цього в умовах операційної, з дотриманням правил асептики та антисептики, одержують ембріофетальний матеріал, а саме тканину печінки, тканину мозку та тканину серця фетусів людини від 5 до 14 тижнів гестації, які загинули внаслідок медичного аборту в випадках, коли вагітність переривали за соціальними показниками, при відсутності патології розвитку чи інфікованості фетуса та інформованої згоди жінки - донора. Далі вилучені тканини ембріофетального походження поміщають в стерильне транспортне середовище розчину Хенкса з антибіотиком. В стерильних умовах тканини сепарують та гомогенізують в розчині Хенкса. Отриману суспензію клітин піддають фільтрації та кріоконсервують. Як кріопротектор використовують диметилсульфоксид. Далі готові суспензії стовбурових клітин розливають в кріопробірки об'ємом 0,3-1,0 мл. Кріоконсервування суспензії стовбурових клітин проводять у камері програмного заморожувана за визначеною програмою. Таке кріоконсервування забезпечує практично необмежене довгострокове зберігання вказаної суспензії, дозволяє протягом необхідного часу дослідити препарат у вигляді суспензії клітин на бактеріологічну та вірусологічну безпеку, визначити якісні та кількісні показники суспензії клітин, сформувати банк суспензій стовбурових клітин, відповідно до визначених вимог до клітинного препарату. При формуванні банку клітинних суспензій з тканин ембріофетального походження для лікування хворих на есенціальну АГ суспензія стовбурових клітин з фетальної печінки, суспензія стовбурових клітин з фетального мозку та суспензія стовбурових клітин з фетального серця повинна мати такі параметри: вміст ядровмісних клітин (підраховують загальну кількість ядровмісних клітин, в одиниці об'єму за допомогою клітинного аналізатора чи візуально під 6 мікроскопом в лічильній камері) повинен становити не менше за 41,28×10 в 1 мл суспензії для 6 клітин з фетальної печінки за одне введення, не менше 5,81×10 в 1 мл для клітин з фетального 6 головного мозку за одне введення та не менше за 2,73×10 в 1 мл за одне введення для клітин з фетального серця; вміст живих клітин після кріоконсервування - не менше 70 %. Суспензії, що містять стовбурові клітини з фетальної печінки, фетального головного мозку та стовбурові клітини з фетального серця, зберігають в кріобанку в рідкому азоті при температурі -196 °C. Пробірки, що містять суспензію кріоконсервованих стовбурових клітин з фетальної печінки, фетального головного мозку та суспензію кріоконсервованих стовбурових клітин з фетального серця, безпосередньо перед введенням виймають з рідкого азоту, занурюють у водяну баню при температурі +37 °C та витримують до появи рідкої фази. Подальші маніпуляції проводять при кімнатній температурі з суворим дотриманням правил асептики. Час перебування розмороженої суспензії стовбурових клітин з фетальної печінки, фетального головного мозку та 6 UA 113235 C2 5 10 15 20 25 30 35 40 45 50 55 60 розмороженої суспензії стовбурових клітин з фетального серця при кімнатній температурі не повинен перевищувати 10 хвилин. При цьому перед введенням здійснюють додатковий контроль якості суспензії стовбурових клітин з фетальної печінки, фетального головного мозку та суспензії стовбурових клітин з фетального серця, зокрема, проводять мікроскопію та здійснюють підрахунок кількості життєздатних клітин за допомогою автоматичного клітинного аналізатора. Перед початком проведення комплексного лікування хворих на есенціальну АГ шляхом введення суспензії стовбурових клітин з фетальної печінки, суспензії стовбурових клітин з фетального головного мозку та суспензії стовбурових клітин з фетального серця виконують клінічне, лабораторне та інструментальне обстеження стану хворого та здійснюють контроль активності патологічного процесу за отриманими результатами. Одночасно з введенням суспензії стовбурових клітин з фетальної печінки, суспензії стовбурових клітин з фетального головного мозку та введенням суспензії стовбурових клітин з фетального серця проводять стандарту медикаментозну терапію, що включає призначення сечогінних, бета-адреноблокаторів, антагоністів кальцію, інгібіторів ангіотензинперетворюючого ферменту і/або антагоністів рецепторів до анготензину II, інгібіторів реніну та інших гіпотензивних засобів. Далі, перед введенням суспензії стовбурових клітин з фетальної печінки з метою запобігання виникненню алергічних реакцій під час лікування виконують премедикацію шляхом внутрішньовенного введення 10 мг димедролу і 30 мг преднізолону через систему для переливання крові. Після чого, разом із фізіологічним розчином натрію хлориду, вводять суспензію стовбурових клітин з фетальної печінки шляхом внутрішньовенного введення зі швидкістю 20-40 крапель за хвилину. При цьому об'єм лікувальної дози суспензії стовбурових клітин з фетальної печінки для одного введення підбирають індивідуально, але не менше за 0,1 6 мл, з кількістю ядровмісних клітин не менше за 41,28×10 в 1 мл за одне введення. Суспензію стовбурових клітини з фетального головного мозку вводять підшкірно в об'ємі, не меншому за 6 0,5 мл, з кількістю клітин не менше за 5,81×10 в 1 мл за одне введення. Суспензію стовбурових клітини з фетального серця вводять підшкірно в об'ємі, не меншому за 0,6 мл, з кількістю клітин 6 не менше за 2,73×10 в 1 мл за одне введення. Така кількість клітин забезпечує високу ефективності лікування хворих на есенціальну АГ. Після введення суспензії стовбурових клітин з фетальної печінки, суспензії стовбурових клітин з фетального головного мозку та суспензії стовбурових клітин з фетального серця хворий знаходиться під спостереженням. Причому, через 1 місяць після проведення лікування, а потім кожні три місяці здійснюють контроль проявів патологічного процесу за клінічними, лабораторними та інструментальними показниками. При цьому точки спостереження вибирають, згідно з протоколом клінічного застосування препарату з матеріалу ембріофетального походження та виділених з нього клітин, розробленим на основі клінічного досвіду. Ефективність лікування хворих з есенціальною АГ оцінюють на основі регулярного контролю рівня AT, лабораторних показників крові та сечі, проведеної електрокардіографії (ЕКГ) в 12 відведеннях, допплер ЕхоКГ, ультразвукового дослідження сонних артерій з вимірюванням товщини комплексу інтима-медіа (КІМ), визначення швидкості розповсюдження пульсової хвилі, дослідження очного дна, що проводили всім хворим перед лікуванням та через 1,3 та 6 місяців після лікування. З 2012 по 2014 роки у клініці клітинної терапії, відповідно до способу комплексного лікування хворих з есенціальною АГ, що заявляється, було проліковано 220 хворих з АГ, з них 109 страждали на есенціальну АГ. З них було відібрано 25, що увійшли до основної групи (ОГ). Розподіл хворих був наступним: 25 пацієнтів основної групи (ОҐ), які отримували лікування суспензією стовбурових клітин з фетальної печінки, суспензією стовбурових клітин з фетального головного мозку та суспензією стовбурових клітин з фетального серця на тлі стандартної медикаментозної терапії, та контрольна група (КГ) - 25 осіб, пролікованих лише стандартною медикаментозною терапією. У всіх хворих ОГ спостерігався синдром раннього післятрансфузійного покращення: відбувалося поліпшення загального стану, зменшення рівня артеріального тиску, набряків нижніх кінцівок. Спостерігалось покращення показників, які досліджувались: рівень пульсового тиску, вираженість гіпертрофії міокарда ЛШ, згідно з даними ЕКГ та ЕхоКГ, швидкість клубочкової фільтрації, товщина стінки сонної артерії, швидкість пульсової хвилі та огляд очного дна (таблиця 1). Після введення суспензії стовбурових клітин з фетальної печінки, суспензії стовбурових клітин з фетального головного мозку та суспензії стовбурових клітин з фетального серця в жодному випадку не спостерігались ускладнення чи побічні явища, в тому числі реакція "трансплантат проти хазяїна" (РТПГ). 7 UA 113235 C2 Таблиця 1 Зміни показників комплексної клінічної оцінки та морфо-функціонального стану міокарда ЛШ у хворих із есенціальною артеріальною гіпертензією у контрольної та основної груп Дослідження Систолічний тиск, мм рт. ст. М±m Пульсовий тиск, мм рт. ст М±m Товщина ЗС, см, за даними ЕхоКГ М±m Швидкість клубочкової фільтрації, мл/хв. Швидкість пульсової хвилі, м/с ОГ до лікування КГ до ОГ через 1 лікування міс. КГ через 1 ОГ через 3 КГ через 3 міс. міс. міс. ОГ через 6 міс. КГ через 6 міс. 163,9±12,2 163,1±12,5 152,5±15,0* 159,3±17,10 137,4±14,2* 155,5±16,3# 128,6±13,9**$ 149,4±15,8*## 72,5±16,9 75,3±17,4 63,4±15,0* 73,2±17,1 # 60,4±14,2* 71,5±16,3# 58,6±13,9** 1,50±0,04 1,44±0,06 1,46±0,08 1,34±0,04# 1,31±0,06* 1,33±0,05*# 1,19±0,01**$ 1,30±0,04* ## 88,7+2,94 89,1+2,88 90,1+2,87 90,89+0,26 96,5+2,39* 91,82+0,25 109,5+1,62**$ 94,23+0,33*# 7,4±0,3 7,7±0,6 8,1±0,6 8,2±0,8 10,1±1,2* 8,4±0,9 12,3±1,4** 69,4±15,8*# 10,4±1,7* Примітка: * - р
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 35/34, A61K 35/545, A61K 35/407
Мітки: спосіб, клітин, комплексного, лікування, нього, препаратами, виділених, походження, есенціальної, артеріальної, ембріофетального, гіпертензії, матеріалу
Код посилання
<a href="https://ua.patents.su/15-113235-sposib-kompleksnogo-likuvannya-esencialno-arterialno-gipertenzi-preparatami-z-materialu-embriofetalnogo-pokhodzhennya-ta-vidilenikh-z-nogo-klitin.html" target="_blank" rel="follow" title="База патентів України">Спосіб комплексного лікування есенціальної артеріальної гіпертензії препаратами з матеріалу ембріофетального походження та виділених з нього клітин</a>
Попередній патент: Спосіб лікування демодекозу шкіри обличчя за індріксоном
Наступний патент: Спосіб лікування хронічного вірусного гепатиту с препаратами з матеріалу ембріофетального походження та виділених з нього клітин
Випадковий патент: Спосіб приєднання відкривального пристрою до пакувального матеріалу та упаковка, отримана цим способом