Фторзаміщені циклоалканоіндоли, композиція, що їх містить
Номер патенту: 75520
Опубліковано: 17.04.2006
Автори: Бертелетт Карл, Ванг Заойін, Ляшанс Ніколя, Стуріно Клаудіо, Лі Ліанхай
Формула / Реферат
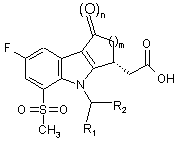
1. Сполука формули І:

і її фармацевтично прийнятні солі, де n дорівнює 0 або 1; m дорівнює 1, 2 або 3; R1 являє собою Н, С1-С3 алкіл, галогенований С1-С3 алкіл або циклопропіл; R2 являє собою 4-хлорфеніл або 2,4,6-трихлорфеніл.
2. Сполука за п. 1, що має стереоконфігурацію, показану нижче:
 .
.
3. Сполука за п. 2, де m дорівнює 1.
4. Сполука (-)-[4-(4-хлорбензил)-7-фтор-5-(метансульфоніл)-1,2,3,4-тетрагідроциклопента[b]індол-3-іл]оцтової кислоти і її фармацевтично прийнятні солі.
5. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-4 і фармацевтично прийнятний носій.
6. Композиція за п. 5, яка додатково містить другий активний інгредієнт, вибраний з антигістаміну, антагоніста лейкотриєну та інгібітора біосинтезу лейкотриєну.
7. Застосування сполуки або її солі за будь-яким з пп. 1-4 для виготовлення лікарського засобу для лікування захворювання, опосередкованого простагландином D2.
8. Застосування за п. 7, де вказаним захворюванням є застійна гіперемія носа, риніт або астма.
Текст
1. Сполука формули І: 2 3 75520 4 важливим медіатором в різних алергічних захворюваннях, таких як алергічний риніт, атонічна астма, алергічний кон'юнктивіт і атонічний дерматит". Зовсім нещодавно - у статті [Matsuoka et al. Science (2000), 287:2013-7], повідомлялось, що PGD2 є ключовим медіатором при алергічній астмі. Крім того, в патентах, таких як патент США №4808608, описані антагоністи простагландину, які можуть бути використані для лікування алергічі до їх фармацевтично прийнятних солей, де n них захворювань, а особливо алергічної астми. дорівнює 0 або 1; m дорівнює 1, 2 або 3; R1 являє Антагоністи PGD2 описані, наприклад, в європейсобою Н, С1-С3алкіл, галогенований С1-С3алкіл ській патентній заявці 837052 і в заявці РСТ WO або циклопропіл; R2 являє собою 4-хлорфеніл або 98/25919, а також у WO 99/62555. 2,4,6-трихлорфеніл. У патенті США №4808608 описані похідні тетВ одному з варіантів даний винахід відноситьрагідрокарбазол-1-алканової кислоти, що викорисся до сполук формули І, де n дорівнює 0. товуються як антагоністи простагландину. В іншому варіанті даний винахід відноситься У заявці РСТ WO 0179169 описані антагоністи до сполук формули І, де n дорівнює 1. PGD2, що мають формулу: В іншому варіанті даний винахід відноситься до сполук формули І, де m дорівнює 1. В іншому варіанті даний винахід відноситься до сполук формули І, де m дорівнює 2. В іншому варіанті даний винахід відноситься до сполук формули І, де R1 являє собою Н. В іншому варіанті даний винахід відноситься до сполук формули І, де R1 являє собою СН3. В іншому варіанті даний винахід відноситься У європейській патентній заявці 468785 описадо сполук формули І, де R2 являє собою 4на сполука, 4-[(4-хлорфеніл)метил]-1,2,3,4хлорфеніл. тетрагідро-7-(2В іншому варіанті даний винахід відноситься хінолінілметокси)циклопент[b]індол-3-оцтова кисдо сполук формули І, де R2 являє собою 2,4,6лота, яка є сполукою, що відноситься до типу спотрихлорфеніл. лук-інгібіторів біосинтезу лейкотриєну. В іншому варіанті даний винахід відноситься У патенті США № до сполук формули І, що мають показану нижче 3535326 описані протизапальні сполуки форстереоконфігурацію (тобто, де хіральний центр мули: має R-конфігурацію): Даний винахід відноситься до нових сполук, які являють собою антагоністи рецептора простагландину; більш конкретно, вони являють собою антагоністи рецептора простагландину D2 (рецептора DP). Сполуки даного винаходу можуть бути використані для лікування різних опосередкованих простагландином захворювань і розладів; відповідно до цього, даний винахід відноситься до способу лікування опосередкованих простагландином захворювань з використанням описаних тут нових сполук, а також до їх фармацевтично прийнятних композицій, що містять такі сполуки. Даний винахід відноситься до сполук формули І: В іншому аспекті даний винахід відноситься до фармацевтичних композицій, що містять сполуку формули І і фармацевтично прийнятний носій. В одному з варіантів здійснення винаходу фармацевтичні композиції, крім того, містять другий активний інгредієнт, вибраний з антигістаміну, антагоніста лейкотриєну, інгібітору біосинтезу лейкотриєну, антагоністів рецептора простагландину або інгібіторів біосинтезу простагландину, кортикостероїдів, модуляторів цитокінів, антитіл проти IgE, антитіл проти холінергічних рецепторів або НСПЗЗ. В іншому аспекті даний винахід відноситься до способу лікування або попередження захворювань, опосередкованих простагландином D2, де вказаний спосіб передбачає введення пацієнту, потребуючому такого лікування, терапевтично ефективної кількості сполуки формули І. В одному з варіантів даний винахід відноситься до способу лікування або попередження захво 5 75520 6 рювання, опосередкованого простагландином D2, використанням оптично активної кислоти або опде вказаний спосіб передбачає введення пацієнту тично активної основи як розділяючого агента, або ссавцеві, потребуючому такого лікування, сполуки методом хірального розділення, такого як роздіформули І у кількості, ефективній для лікування лення за допомогою ВЕРХ на хіральній колонці. або попередження захворювання, опосередковаАльтернативно, будь-який енантіомер сполуки ного простагландином D2, і де опосередкованими загальної формули І або Іа може бути одержаний простагландином захворюваннями є застійна гіпешляхом стереоспецифічного синтезу з викорисремія носа, риніт, включаючи сезонний алергічний танням оптично чистих вихідних матеріалів або риніт і хронічний алергічний риніт, і астма, вклюреагентів з відомою конфігурацією. чаючи алергічну астму. Солі В іншому варіанті даний винахід відноситься Термін "фармацевтично прийнятні солі" ознадо способу лікування застійної гіперемії носа у чає солі, одержані з фармацевтично прийнятних пацієнта, потребуючого такого лікування, де вканетоксичних основ, включаючи неорганічні основи заний спосіб передбачає введення вказаному паі органічні основи. Солями, одержаними з неоргацієнту терапевтично ефективної кількості сполуки нічних основ, є солі алюмінію, амонію, кальцію, формули І. міді, заліза (III), заліза (II), літію, магнію, марганцю, У ще одному варіанті даний винахід відномарганцева сіль (III), калію, натрію, цинку і т.п. ситься до способу лікування астми, включаючи Особливо переважними є солі амонію, кальцію, алергічну астму, у пацієнта, потребуючого такого магнію, калію і натрію. Солями, одержаними з фалікування, де вказаний спосіб передбачає введенрмацевтично прийнятних органічних нетоксичних ня вказаному пацієнту терапевтично ефективної основ, є солі первинних, вторинних і третинних кількості сполуки формули І. амінів, заміщених амінів, включаючи природні заУ ще одному варіанті даний винахід відноміщені аміни, циклічних амінів і основних іонообситься до способу лікування алергічного риніту мінних смол, таких як аргінін, бетаїн, кофеїн, холін, (сезонного і хронічного) у пацієнта, потребуючого Ν,Ν'-дибензилетилендіамін, діетиламін, 2такого лікування, де вказаний спосіб передбачає діетиламіноетанол, 2-диметиламіноетанол, етановведення вказаному пацієнту терапевтично ефекламін, етилендіамін, N-етилморфолін, Nтивної кількості сполуки формули І. етилпіперидин, глюкамін, глюкозамін, гістидин, Нумерація внутрішньої трициклічної системи, гідрабамін, ізопропіламін, лізин, метилглюкамін, де m дорівнює 1, здійснюється, як показано нижче: морфолін, піперазин, піперидин, поліамінові смоли, прокаїн, пурини, тіобромін, триетиламін, триметиламін, трипропіламін, трометамін і т.п. Якщо сполука даного винаходу є основною, то її солі можуть бути одержані з фармацевтично прийнятних нетоксичних кислот, включаючи неорганічні і органічні кислоти. Такими кислотами є оцтова, бензолсульфонова, бензойна, камфорсуНумерація внутрішньої трициклічної системи, льфонова, лимонна, етансульфонова, фумарова, де m дорівнює 2, здійснюється, як показано нижче: глюконова, глутамінова, бромистоводнева, хлористоводнева, ізетіонова, молочна, малеїнова, яблучна, мигдалева, метансульфонова, слизова, азотна, памова, пантотенова, фосфорна, янтарна, сірчана, винна, п-толуолсульфонова кислоти і т.п. Особливо переважними є лимонна, бромистоводнева, хлористоводнева, малеїнова, фосфорна, сірчана і винна кислоти. Оптичні ізомери - Діастереомери - Таутомери При цьому, потрібно зазначити, що якщо це не Сполуки формули І містять один або декілька обумовлено особливо, то при згадуванні сполуки асиметричних центрів, і, таким чином, вони можуть формули І мається на увазі також і її фармацевтибути присутніми у вигляді рацематів і рацемічних чно прийнятна сіль. сумішей, окремих енантіомерів, діастереомерних Застосування сумішей і окремих діастереомерів. Даний винахід Сполуки формули І є антагоністами простагвідноситься до всіх вказаних ізомерних форм споландину D2. Здатність сполук формули І взаємоділук формули І. яти з рецептором простагландину D2 дозволяє Деякі з описаних тут сполук можуть мати різні використати ці сполуки для попередження або положення приєднання водню, і такі сполуки назиусунення небажаних симптомів, що викликаються ваються таутомерами. Як приклад може служити простагландинами у ссавця, зокрема у людини. кетон або його енольна форма, відомі як кетоноАнтагонізм проти дії простагландину D2 дозволяє енольні таутомери. Сполуки формули І охоплюють використати дані сполуки і їх фармацевтичні комокремі таутомери, а також їх суміші. позиції для лікування, попередження або ослабСполуки формули І можуть бути розділені на лення симптомів захворювань у ссавців, а зокрема діастереомерні пари енантіомерів, наприклад, за у людини, таких як респіраторні захворювання, допомогою фракційної кристалізації у прийнятному алергічні стани, болі, запальні стани, порушення розчиннику, наприклад, в метанолі або в етилацевиділення секрету слизовою, захворювання кісток, таті або в їх суміші. Одержана таким чином пара розлади сну, порушення запліднюючої здатності, енантіомерів може бути розділена на окремі степорушення згортання крові, порушення зору, а реоізомери стандартними методами, наприклад, з 7 75520 8 також імунні і аутоімунні захворювання. Крім того, відповідь даного конкретного пацієнта. В основнотака сполука може інгібувати трансформацію кліму, добова доза складає приблизно від 0,001мг до тинних пухлин і метастатичне зростання пухлини, 100мг на кг, а переважно, приблизно від 0,01 до а тому вона може бути використана для лікування 10мг на кг масу тіла ссавця. З іншого боку, в дераку. Сполуки формули І можуть бути також викояких випадках, якщо це необхідно, то можуть бути ристані для лікування і/або попередження опосевикористані дози, що виходять за вищезгадані редкованих простагландином D2 проліферативних межі. розладів, таких, які можуть виникати при діабетичКількість активного інгредієнта, яка може бути ній ретинопатії і ангіогенезі пухлини. Сполуки фооб'єднана з матеріалами-носіями для приготуванрмули І можуть також інгібувати індуковане просня разової лікарської форми, буде варіюватись в таноїдом скорочення гладкого м'яза за допомогою залежності від конкретного хазяїна, що піддається придушення скорочувальних простаноїдів або імілікуванню, і від конкретного способу введення. тації релаксуючих простаноїдів, а тому вони моТак, наприклад, препарат, призначений для перожуть бути використані для лікування дисменореї і рального введення людині, може містити від запобігання передчасним пологам і розладам, 0,05мг до 5г активного агента, взятого разом з асоційованим з еозинофілами. прийнятною і стандартною кількістю матеріалуВідповідно до цього, в іншому аспекті даний носія, яка може варіюватись приблизно від 5 до винахід відноситься до способу лікування або по99,95 процентів від всієї композиції. Разові лікарпередження захворювання, опосередкованого ські форми, в основному, містять приблизно від простагландином D2, де вказаний спосіб передба0,1мг до 0,4г активного інгредієнта, звичайно чає введення пацієнту-ссавцеві, потребуючому 0,5мг, 1мг, 2мг, 5мг, 10мг, 25мг, 50мг, 100мг, 200мг такого лікування, сполуки формули І в кількості, або 400 г. ефективній для лікування або попередження вкаФармацевтичні композиції заного захворювання, опосередкованого простагВ іншому аспекті даний винахід відноситься до ландином D2. Захворюваннями, опосередкованифармацевтичних композицій, що містять сполуку ми простагландином D2, є, але не обмежуються формули І і фармацевтично прийнятний носій. ними, алергічний риніт, застійна гіперемія, риноТермін "композиція", як і фармацевтична композирея, хронічний риніт, запалення носової порожниція, означає продукт, що містить активний(і) інгрени, астма, включаючи алергічну астму, хронічна дієнт(и) та інертний(і) інгредієнт(и) (фармацевтичобструктивна хвороба легень та інші форми запано прийнятні наповнювачі), які входять до складу лення легень; легенева гіпотензія; розлади сну і носія, а також будь-який продукт, який утворюєтьпорушення циклу "сон-пробудження"; індуковане ся, прямо або опосередковано, внаслідок комбінапростаноїдами скорочення гладкого м'яза, асоціції, комплексоутворення або агрегації будь-яких йоване з дисменореєю і передчасними пологами; двох або більше інгредієнтів, або в результаті дирозлад, асоційований з еозинофілами; тромбоз; соціації одного або декількох інгредієнтів, або внаглаукома і порушення зору; оклюзійні судинні заслідок здійснення інших типів реакцій або взаємохворювання, такі як, наприклад, атеросклероз; дій одного або декількох інгредієнтів. Відповідно застійна серцева недостатність; захворювання або до цього, фармацевтичними композиціями даного стани, що вимагають лікування антикоагулянтами, винаходу можуть бути будь-які композиції, одертакі як посттравматичні стани або стани після хіжані шляхом змішування сполуки формули І, дорургічного втручання; ревматоїдний артрит та інші даткового(их) активного(их) інгредієнта(ів) і фарзапальні захворювання; гангрена; хвороба Рейно; мацевтично прийнятних наповнювачів. порушення виділення секрету слизовою, включаДля лікування будь-яких опосередкованих ючи порушення цитопротективних функцій; болі і простаноїдами захворювань сполуки формули І мігрень; захворювання, що вимагають регуляції можуть бути введені перорально, шляхом інгаляостеогенезу і резорбції кістки, таких як, наприклад, ції, місцево, парентерально або ректально у виостеопороз; інсульт; порушення терморегуляції, гляді разових лікарських форм, що містять станвключаючи підвищення температури; реакція віддартні нетоксичні фармацевтично прийнятні носії, торгнення при трансплантації органів і при операад'юванти і наповнювачі. Термін "парентерально", ції з шунтування, та імунні розлади або стани, при що використовується тут, означає введення, яких бажана імунорегуляція. Більш конкретним включаючи підшкірні ін'єкції, внутрішньовенні, внузахворюванням, що вимагає лікування, є одне із трішньом'язові, внутрішньогрудинні ін'єкції або захворювань, опосередкованих простагландином вливання. Крім лікування теплокровних тварин, D2, таких як застійна гіперемія носа, алергічний таких як миші, щури, коні, велика рогата худоба, риніт, застій легень і астма, включаючи алергічну вівці, собаки, кішки і т.п., сполуки даного винаходу астму. ефективні і для лікування людини. Інтервали доз Фармацевтичні композиції, що містять активОчевидно, що величина профілактичної або ний інгредієнт, можуть бути одержані у формі, терапевтичної дози сполуки формули І варіюється прийнятній для перорального використання, нав залежності від природи і тяжкості стану, що підприклад, у вигляді таблеток, пастилок, коржиків, дається лікуванню, від сполуки формули І, що конводних або масляних суспензій, диспергованих кретно використовується, і способу її введення. Ця порошків або гранул, емульсій, жорстких або м'ядоза також варіюється в залежності від ряду факких капсул, або сиропів або еліксирів. Композиції, торів, включаючи вік, масу, загальний стан здоропризначені для перорального введення, можуть в'я, стать, режим харчування, час введення, швидбути приготовані будь-яким методом, відомим факість екскреції, комбінацію лікарських засобів і хівцям в галузі фармацевтики, і такі композиції 9 75520 10 можуть містити один або декілька агентів, вибраМасляні суспензії можуть бути одержані шляних з групи, що складається з підсолоджувальних хом суспендування активного інгредієнта в олії, агентів, ароматизаторів, барвників і консервантів, наприклад, арахісовій олії, оливковій олії, кунжутдля надання ним фармацевтично естетичних і ній олії, кокосовій олії, або в мінеральному маслі, приємних смакових якостей. Таблетки містять актакому як вазелінове масло. Масляні суспензії тивний інгредієнт в суміші з нетоксичними фармаможуть містити загусник, наприклад, бджолиний цевтично прийнятними наповнювачами, які є привіск, твердий парафін або цетиловий спирт. Для йнятними для виробництва таблеток. Такими надання пероральному препарату приємних сманаповнювачами можуть бути, наприклад, інертні кових якостей в дану композицію можуть бути дорозріджувачі, такі як карбонат кальцію, карбонат дані підсолоджувані, такі як підсолоджувані, вказанатрію, лактоза, фосфат кальцію або фосфат нані вище, і ароматизатори. Для збереження цих трію; гранулюючі і дезінтегруючі агенти, наприкомпозицій в них можуть бути додані антиоксиданклад, кукурудзяний крохмаль або альгінова кислоти, такі як аскорбінова кислота. та; зв'язувальні агенти, наприклад, крохмаль, Дисперговані порошки і гранули, прийнятні для желатин або аравійська камедь, і замаслювальні одержання водної суспензії шляхом додавання агенти, наприклад, стеарат магнію, стеаринова води, містять активний інгредієнт в суміші з диспекислота або тальк. Ці таблетки можуть бути вигоргуючим або змочувальним агентом, суспендуютовлені без покриття, або, для уповільнення дезінчим агентом і з одним або декількома консервантеграції і абсорбції в шлунково-кишковому тракті, і тами. Приклади прийнятних або змочувальних таким чином для забезпечення їх пролонгованої агентів і суспендуючих агентів були вказані вище. дії протягом тривалого періоду часу, вони можуть Можуть також бути присутніми й інші наповнювачі, мати покриття, що наноситься відомими методанаприклад, підсолоджувачі, ароматизатори і барвми. Наприклад, для цих цілей може бути викорисники. таний матеріал пролонгованої дії, такий як гліцеФармацевтичні композиції даного винаходу рилмоностеарат або гліцерилдистеарат. Для можуть бути також одержані у вигляді емульсії одержання осмотичних терапевтичних таблеток типу "масло-у-воді". Масляна фаза може являти для регульованого вивільнення на них може бути собою олію, наприклад, оливкову олію або арахінанесене покриття способом, описаним в патентах сову олію, або мінеральне масло, наприклад ваСША 4256108, 4166452 і 4265874. зелінове масло, або їх суміші. Прийнятними емуПрепарати для перорального введення мольгаторами можуть бути природні фосфатиди, жуть бути також виготовлені у вигляді жорстких наприклад, соєві боби, лецитин і складні ефіри або желатинових капсул, де активний інгредієнт змінеповні складні ефіри, що походять від жирних шує з інертним твердим розріджувачем, наприкислот і ангідридів гекситу, наприклад сорбітанмоклад, карбонатом кальцію, фосфатом кальцію або ноолеат, і продукти конденсації вказаних неповних каоліном, або у вигляді м'яких желатинових капефірів з етиленоксидом, наприклад поліоксіетилесул, де активний інгредієнт змішують з розчиннинсорбітанмоноолеат. Вказані емульсії можуть таками, що змішуються з водою, такими як пропіленкож містити підсолоджувачі і ароматизатори. гліколь, ПЕГ і етанол, або з масляним У сиропи і еліксири можуть бути додані підсосередовищем, наприклад, з арахісовою олією, лоджувачі, наприклад, гліцерин, пропіленгліколь, вазеліновим маслом або з оливковою олією. сорбіт або сахароза. Такі препарати можуть також Водні суспензії містять активний матеріал в містити деемульгатор, консервант, віддушки і барсуміші з наповнювачами, прийнятними для одервники. Фармацевтичні композиції можуть бути прижання водних суспензій. Такими наповнювачами є готовані у формі стерильних водних або масляних суспендуючі агенти, наприклад, натрійвмісна карсуспензій для ін'єкцій. Така суспензія може бути боксиметилцелюлоза, метилцелюлоза, гідроксиподержана відомими методами з використанням ропілметилцелюлоза, альгінат натрію, полівінілпіприйнятних диспергуючих або змочувальних агенролідон, трагакантова камедь і аравійська камедь; тів і суспендуючих агентів, згаданих вище. Стеридиспергуючі або змочувальні агенти, які можуть льний препарат для ін'єкцій може також являти являти собою природний фосфатид, наприклад собою стерильний розчин або суспензію для ін'єклецитин, або продукти конденсації алкіленоксиду з цій в нетоксичному парентерально прийнятному жирними кислотами, наприклад поліоксіетиленсрозріджувачі або розчиннику, наприклад, розчин в теарат, або продукти конденсації етиленоксиду з 1,3-бутандіолі. Нарівні з прийнятними наповнювадовголанцюговими аліфатичними спиртами, начами і розчинниками можуть бути використані воприклад гептадекаетиленоксицетанол, або продуда, розчин Рінгера та ізотоничний розчин хлориду кти конденсації етиленоксиду з неповними складнатрію. Можуть бути також використані співрозними ефірами, що походять від жирних кислот і чинники, такі як етанол, пропіленгліколь або поліегекситу, таких як моноолеат поліоксіетиленсорбіту, тиленгліколі. Крім того, як розчинник або суспенабо продукти конденсації етиленоксиду з неповдуюче середовище звичайно використовуються ними складними ефірами, що походять від жирних стерильні малорухомі масла. Для цих цілей може кислот і ангідридів гекситу, наприклад поліетиленбути використана будь-яка суміш жирних масел, сорбітанмоноолеат. Водні суспензії можуть також включаючи синтетичні моно- або дигліцериди. Крім містити один або декілька консервантів, напритого, в препаратах для ін'єкцій можуть бути також клад, етил- або н-пропіл, п-гідроксибензоат, один використані жирні кислоти, такі як олеїнова кислоабо декілька барвників, один або декілька аромата. тизаторів і один або декілька підсолоджувачів, Сполуки формули І можуть бути також введені таких як сахароза, сахарин або аспартам. у формі супозиторіїв для ректального введення 11 75520 12 лікарського засобу. Ці композиції можуть бути цин і зомепірак), похідні фенамінової кислоти одержані шляхом змішування лікарського засобу з (флуфенамінова кислота, меклофенамінова кисприйнятним неподразнювальним наповнювачем, лота, мефенамінова кислота, ніфлумінова кислота який є твердим при кімнатній температурі і рідким і толфенамінова кислота), похідні біфенілкарбонопри температурі прямої кишки, де він розплавлявої кислоти (дифлунізал і флуфенізал), оксиками ється з вивільненням лікарського засобу. Такими (ізоксикам, піроксикам, судоксикам і теноксикан), матеріалами є масло какао і поліетиленгліколі. саліцилати (ацетилсаліцилова кислота, сульфасаДля місцевого застосування використовуються лазин) і піразолони (апазон, безпіперилон, фепракреми, мазі, гелі, розчини або суспензії, що місзон, мофебутазон, оксифенбутазон, фенілбутатять, наприклад, сполуку формули І. (Для такого зон); (11) інгібітори циклооксигенази-2 (СОХ-2), місцевого застосування можуть бути використані такі як целекоксиб, рофекоксиб, еторикоксиб і рідини для полоскання рота і для полоскання горвальдекоксиб; (12) інгібітори фосфодиестерази ла). Композиції для місцевого застосування мотипу IV (PDE-IV), наприклад, арифло, рофлуміжуть, в основному, складатись з фармацевтично ласт; (13) антагоністи рецепторів хемокінів, а зокприйнятного носія, співрозчинника, емульгатора, рема, CCR-1, CCR-2 і CCR-3; (14) агенти, що зниагента, поліпшуючого змочування, системи консежують рівень холестерину, такі як інгібітори HMGрвантів і пом'якшувача. CoA-редуктази (ловастатин, симвастатин і правасКомбінації з іншими лікарськими засобами татин, флувастатин, аторвастатин та інші статиДля лікування і попередження опосередковани), секвестранти (холестирамін і колестипол), них простагландином захворювань, сполука форнікотинова кислота, похідні фенофібринової кисмули І може бути введене разом з іншими терапелоти (гемфіброзил, клофібрат, фенофібрат і бенвтичними агентами. Таким чином, в іншому зафібрат) і пробукол; (15) протидіабетичні засоби, аспекті, даний винахід відноситься до фармацевтакі як інсулін, сульфонілсечовини, бігуаніди (меттичних композицій для лікування опосередкованих формін), інгібітори -глюкозидази (акарбоза) і гліпростагландином D2 захворювань, що містять тазони (троглітазон, піоглітазон, енглітазон, розигтерапевтично ефективну кількість сполуки формулітазон і т.п. ); (16) препарати інтерферону-бета ли І і одного або декількох інших терапевтичних (інтерферон бета-la, інтерферон бета-1b); (17) агентів. Прийнятними терапевтичними агентами антихолінергічні агенти, такі як мускаринові антадля комбінованої терапії з використанням сполуки гоністи (бромід іпратропію і бромід тіотропію), а формули І є: (1) антагоніст рецептора простаглантакож селективні мускаринові антагоністи М3; (18) дину; (2) кортикостероїд, такий як ацетонід триамстероїди, такі як беклометазон, метилпреднізолон, цінолону; (3) -агоніст, такий як салметерол, форбетаметазон, преднізон, дексаметазон і гідрокормотерол, тербуталін, метапротеренол, альбутерол тизон; (19) триптани, що звичайно використовуі т.п.; (4) модифікатор лейкотриєнів, такий як антаються для лікування мігрені, такі як сумітриптан і гоніст лейкотриєнів або інгібітор ліпооксигенази, ризатриптан; (20) алендронат та інші засоби для такий як монтелукаст, зафірлукаст, пранлукаст або лікування остеопорозу; (21) інші сполуки, такі як 5зилейтон; (5) антигістамін (антагоніст гістаміну НІ), аміносаліцилова кислота і їх проліки, антиметаботакий як бромфенірамін, хлорфенірамін, дексхлоліти, такі як азатіоприн і 6-меркаптопурин, цитоторфенірамін, трипролідин, клемастин, дифенгідраксичні хіміотерапевтичні агенти для лікування зломін, дифенілпіралін, трипеленамін, гідроксизин, якісної пухлини, антагоністи брадикініну (ВК2 або метдилазин, прометазин, тримепразин, азатадин, ВК1), антагоністи рецептора ТР, такі як сератроципрогептадин, антазолін, фенірамін, піриламін, даст, антагоністи нейрокініну (NK1/NK2), антагоніастемізол, норастемізол, терфенадин, лоратадин, сти VLA-4, описані, наприклад, в патенті США цетиризин, левоцетиризин, фексофенадин, дес5510332, в WO 97/03094, WO 97/02289, WO лоратадин, і т.п.; (6) протизастійний лікарський 96/40781, WO 96/22966, WO 96/20216, WO засіб, включаючи фенілефрин, фенілпропанола96/01644, WO 96/06108, WO 95/15973 і WO мін, псевдофедрин, оксиметазолин, епінефрин, 96/31206. нафазолін, ксилометазолін, пропілгекседрин або Крім того, даний винахід відноситься до сполеводезоксіефедрин; (7) засіб проти кашлю, вклюсобу лікування захворювань, опосередкованих чаючи кодеїн, гідрокодон, караміфен, карбетапенпростагландином D2, де вказаний спосіб передбатан або декстраметорфан; (8) інший ліганд простачає введення пацієнту, потребуючому такого лікугландину, включаючи агоніст простагландину F, вання, терапевтично ефективної кількості сполуки такий як латанопрост; мізопростол, енпростил, формули І, що вводиться разом з одним або декіріопростил, орнопростол або розапростол; (9) діулькома вищепереліченими інгредієнтами. Активні ретик; (10) нестероїдні протизапальні засоби інгредієнти можуть бути введені в кількостях, які (НСПЗЗ), такі як похідні пропіонової кислоти (альзвичайно використовуються для кожного активного мінопрофен, беноксапрофен, буклоксинова кислоінгредієнта, що вводиться окремо, або в деяких та, карпрофен, фенбуфен, фенопрофен, флупровипадках при використанні комбінації активних фен, флурбіпрофен, ібупрофен, індопрофен, інгредієнтів доза одного або декількох активних кетопрофен, міропрофен, напроксен, оксапрозин, інгредієнтів може бути зменшена. пірпрофен, пранопрофен, супрофен, тіапрофеноСкорочення, що використовуються ва кислота і тіоксапрофен), похідні оцтової кислоти Ас ацетил (індометацин, ацеметацин, алклофенак, кліданак, АсОН оцтова кислота диклофенак, фенклофенак, фенклозинова кислоDDQ 2,3-дихлор-5,6-диціано-1,4-бензохінон та, фентіазак, фурофенак, ібуфенак, ізоксепак, ДМФ диметилформамід окспінак, суліндак, тіопінак, толметин, зидометаекв еквівалент(и) 13 75520 14 етил формули IIІ може бути одержана за допомогою етилацетат приєднання Y-CH2CO2R до відповідним чином заетанол міщеного енаміну VII у присутності енаміну Сторка високо ефективна рідинна хроматогабо в аналогічних умовах. рафія ІРА ізопропіловий спирт Схема 3 ІРАс ізопропілацетат Me метил MeOH метанол МГц мегагерц MTBE метил-трет-бутиловий ефір NMP N-метил-2-піролідинон ЯМР ядерний магнітний резонанс ТГФ тетрагідрофуран ТШХ тонкошарова хроматографія Способи синтезу Проміжні сполуки формули VIII можуть бути Сполуки формули І даного винаходу можуть одержані способом, описаним в схемі 4, з відповібути одержані способами синтезу, описаними в дним чином заміщеного індолу IV. Бромування схемах 1-5, і способами, описаними нижче. сполуки IV може бути здійснено з використанням Проміжні сполуки формули IV можуть бути брому або бромуючого агента, таким як трибромід одержані способом, описаним в схемі 1, з відповіпіридію, в основних умовах в полярному розчиннидним чином заміщеного фенілгідразину II. Внасліку, наприклад, шляхом проведення реакції в піридок взаємодії сполуки II з відповідним циклоалкадині або в розчиннику, такому як дихлорметан, у ноном IIІ (де R являє собою складноефірну групу, присутності піридину з подальшим моновідновтаку як алкільна група) у присутності індолу Фішеленням проміжної дибромсполуки у присутності ра або в аналогічних умовах одержують сполуку кислоти і в умовах відновлення металом, внасліIV. док чого одержують броміндол VIII. Схема 1 Схема 4 Et EtOAc EtOH ВЕРХ Альтернативно, сполуки формули IV можуть бути одержані способом, представленим на схемі 2, з відповідним чином заміщеного аніліну V. В результаті конденсації сполуки V з відповідним циклоалканоном IIІ і подальшої циклізації в умовах Хека або в аналогічних умовах каталізу у присутності металів одержують індол IV. Схема 2 Сполуки формули III можуть бути одержані способом, представленим на схемі 3, з відповідним чином заміщеного силілового ефіру енолу VI або з відповідним чином заміщеного енаміну VII. Після реакції приєднання відповідного електрофілу, такого як Y-CH2CO2R (де Υ являє собою галоген або відхідну групу) у присутності основи, такої як алкіллітій або кислота Льюїса, така як трифторацетат срібла, з силіловим ефіром енолу VI одержують циклоалканон III. Альтернативно, сполука Сполуки формули І можуть бути одержані способом, представленим на схемі 5, з відповідним чином заміщеного броміндолу VIII. Внаслідок алкілування сполуки VIII відповідним електрофілом, таким як (R1)(R2)CH-Y, у присутності основи і у прийнятному розчиннику, такому як ДМФ, одержують N-алкілований індол IX. Взаємодія сполуки IX з метансульфінатом, таким як метансульфінат натрію, у присутності солей Сu(l), приводить до утворення сполук формули І після гідролізу складним ефіром. Альтернативно, спочатку броміндолова кислота (IX, R=H) може бути піддана взаємодії з прийнятним металуючим агентом, таким як нBuLi, з подальшим захопленням електрофілом, таким як метилдисульфід, внаслідок чого утворюється відповідний метилсульфід, який піддають, наприклад, окисленню пероксидом водню/тунгстатом натрію, з одержанням сполуки ІА. Стадії алкілування броміндолу VIII з подальшим сульфуванням можуть бути також оборотними, так, наприклад, в результаті реакції сульфування броміндолу VIII одержують сполуку X, яку алкілують в умовах, аналогічних описаним раніше, або в реакційних умовах Мітцунобу, і після гідролізу складним ефіром одержують сполуку формули ІА. 15 Схема 5 Сполука IB може бути одержана із захищеної сполуки ІА, наприклад складного ефіру ІА, шляхом окислення відповідним окислювачем з подальшим гідролізом, як проілюстровано на схемі 6. Схема 6 Альтернативно, сполука IB може бути одержана, як проілюстровано на схемі 7, шляхом окислення сполуки IX прийнятним окислювачем, таким як DDQ, з подальшим метилсульфуванням, як показано на схемі 5, і з подальшим гідролізом. Схема 7 Аналізи для визначення біологічної активності Сполуки формули І можуть бути проаналізовані за допомогою нижченаведених аналізів для визначення їх активності як антагоністів або агоністів простаноїдів in vitro та in vivo і їх селективності. Продемонстрованою активністю рецепторів простагландинів є DP, ЕР1, ЕР2, ЕР3, ЕР4, FP, IP і ТР. Стабільна експресія простаноїдних рецепторів в ембріональній клітинній лінії нирки людини (НЕК) 293(ebna) 75520 16 кДНК простаноїдного рецептора, які відповідабть повнорозмірним кодуючим послідовностям, субклонували у відповідні сайти експресуючих векторів ссавців і трансфекували в клітини НЕК 293(ebna). Клітини НЕК 293(ebna), які експресують окремі кДНК, культивували в селективних умовах і після 2-3-тижневого культивування окремі колонії виділяли методом з використанням клонзамикального кільця, а потім розмножати з одержанням клональних клітинних ліній. Аналізи на зв'язування з простаноїдним рецептором Клітини НЕК 293(ebna) підтримували в культурі, збирали і шляхом диференціального центрифугування одержували мембрани, після чого клітини лізували у присутності інгібіторів протеази для використання в аналізах на зв'язування з рецептором. Аналізи на зв'язування з простаноїдним рецептором здійснювали в 10мМ MES/KOH (pH 6,0) (ЕР, FP і ТР) або 10мМ HEPES/KOH (pH 7,4) (DP і IP), що містить 1мМ EDTA, 10мМ двовалентний катіон і відповідний радіоактивний ліганд. Реакцію ініціювали додаванням мембранного білка. Ліганди додавали в диметилсульфоксиді, який підтримували постійним при 1% (об./об.) протягом всього періоду інкубування. Рівень неспецифічного зв'язування визначали в присутності 1мкМ відповідного нерадіоактивного простаноїду. Інкубування проводили протягом 60 хвилин при кімнатній температурі або при 30°С і припиняли шляхом швидкої фільтрації. Специфічне зв'язування обчислювали шляхом віднімання неспецифічного зв'язування із загального зв'язування. Потім для побудови сигмоїдальної кривої "концентраціявідповідь" з метою визначення афінності ліганду, обчислювали залишкове специфічне зв'язування для кожної концентрації ліганду, яке виражали як функцію концентрації ліганду. Аналіз на агоністи і антагоністи простаноїдного рецептора Аналіз на вторинний месенджер в цілих клітинах, де оцінювали стимуляцію (ЕР2, ЕР4, DP і IP в клітинах НЕК 293(ebna)) або інгібування (ЕР3 в клітинах людського еритролейкозу (HEL)) накопичення внутрішньоклітинного сАМР або мобілізації внутрішньоклітинного кальцію (ЕР1, FP і ТР в клітинах НЕК 293(ebna), стабільно трансфекованих апоекворином) здійснювали для того, щоб визначити, чи є ліганди рецептора агоністами або антагоністами. Для аналізів на сАМР клітини збирали і ресуспендували в буфері HBSS, що містить 25мМ HEPES, pH 7,4. Суміш для інкубування містила 100мкМ RO-20174 (інгібітор фосфодіестерази типу IV, що поставляється фірмою Biomol), а у випадку аналізу тільки на інгібування ЕР3 вона містила 15мкМ форсколіну для стимуляції продукування сАМР. Зразки інкубували при 37°С протягом 10 хвилин, реакцію припиняли, а потім вимірювали рівні сАМР. Для аналізів на мобілізацію кальцію клітини навантажували кофакторами, відновленим глутатіоном і коелентерацином, збирали і ресуспендували в середовищі Хемса F12. Мобілізацію кальцію вимірювали шляхом моніторингу люмінесценції, індукованої зв'язуванням кальцію з внутрішньоклітинним фотопротеїном екворином. Ліганди додавали в диметилсульфоксиді, який підтримували постійним при 1% (об./об.) протягом 17 75520 18 всього періоду інкубування. Для агоністів відповідь ка), забезпеченому спеціально розробленим пакеу формі вторинного месенджера виражали як фунтом програм (Hood Laboratories, Mass, U.S.A.). кцію концентрації ліганду, і обчислювали величину Введення назальної провокаційної дози здійснюЕС50 і величину максимальної відповіді в поріввали безпосередньо в носову порожнину тварини нянні зі стандартним простаноїдом. Для антагоніс(об'єм 50мкл). Зміну в застійній гіперемії носових тів здатність ліганду інгібувати відповідь агоніста ходів реєстрували до введення провокаційної дози оцінювали за допомогою аналізу Шилда і обчисі протягом 60-120 хвилин після введення провокалювали величину КВ і кут нахилу кривої. ційної дози. Якщо має місце застійна гіперемія Попередження застійної гіперемії носа, що інноса, то на це буде вказувати зниження носового дукується PGD2 або алергеном, у овець з алергіоб'єму. єю. Біомеханіка легень у "навчених" білячих мавп Підготовка тварин: використовували дорослі Процедура цього тесту полягала в тому, що здорові вівці (18-50кг). Цих тварин відбирали, ви"навчених" білячих мавп вміщували на спеціальне ходячи з природної позитивної шкірної реакції на крісло в аерозольні камери. Для контролю пульвнутрішньошкірну ін'єкцію екстракту Ascaris suum. монально-механічні вимірювання параметрів диВизначення міри застійної гіперемії носа: цей хальних шляхів проводили протягом приблизно 30 експеримент здійснювали на не анестезованих хвилин з метою встановлення нормальних конттваринах. Цих тварин фіксували на столику в порольних значень для кожної мавпи на цей день. ложенні лежачи на животі з нерухомо закріпленою Для перорального введення сполуки розчиняли головою. Резистентність носових дихальних шляабо суспендували в розчині 1% метоцелу (метилхів (NAR) вимірювали методом ринометрії з викоцелюлози, 65HG, 400сп) і вводили в об'ємі 1мл/кг ристанням модифікованої маски. Для введення масу тіла. Для аерозольного введення сполук виназотрахеальної трубки носові ходи піддавали користовували ультразвуковий аерозольний інгамісцевій анестезії (2% лідокаїном). Максимальний лятор DeVilbiss. Періоди попередньої обробки вакінець цієї трубки приєднували до пневмотахограріювались від 5 хвилин до 4 годин, після якої фу і сигнал потоку і тиску реєстрували на осцилосмавпам вводили провокаційні аерозольні дози або копі, приєднаному до комп'ютера для обчислення PGD2, або антигену Ascaris suum при розведенні NAR в режимі реального часу. Назальну провока1:25. цію здійснювали шляхом введення аерозольного Після введення провокаційної дози через кожрозчину (10 впорскувань на ніздрю). Зміни в зану хвилину на комп'ютері обчислювали дані, вирастійній гіперемії носових ходів реєстрували до жені в процентах від контрольного значення для введення провокаційної дози і протягом 60-120 кожного параметра дихальних шляхів, включаючи хвилин після провокації. опір дихальних шляхів (RL) і динамічну податлиПопередження обструкції носа, що індукується вість (Cdyn). Після цього для кожної сполуки, що P6D2 або алергеном, у собакоподібних мавп тестується, одержували результати за період мініПідготовка тварин: використовували дорослих мум 60 хвилин після введення провокаційної дози, здорових самців собакоподібних мавп (4-10кг). Цих які потім порівнювали із заздалегідь виміряними тварин відбирали, виходячи з їх природної позитивихідними базальними контрольними значеннями вної шкірної реакції на внутрішньошкірну ін'єкцію для даної мавпи. Крім того, всі величини, одержані екстракту Ascaris suum. Перед початком кожного протягом 60 хвилин після введення провокаційної експерименту мавп, відібраних для дослідження, дози, для кожної мавпи (вихідні базальні значення тримали в умовах голодування протягом ночі з і тест-величини) окремо усереднювали і викорисвільним доступом до води. На наступний ранок товували для обчислення загального процента тваринам вводили кетамін (10-15мг/кг, в/м), а потім інгібування відповіді медіатора або антигену їх забирали з кліток, в яких вони містились. Мавп Ascaris сполукою, що тестується. Для статистичновміщували на нагрітий столик (36°С) та ін'єктували го аналізу використали парний т-критерій. [Роботи: ударну дозу (5-12мг/кг, в/в) пропофолу. Тваринам McFarlane, C.S. et al., Prostaglandins, 28, 173-182 інтубували ендотрахеальну трубку з надувною (1984) і McFarlane C.S. et al., Agents Actions, 22, манжетою (внутрішній діаметр 4-6мм) і анестезію 63-68 (1987) . підтримували шляхом безперервного внутрішньоПопередження індукованого бронхостенозу у венного вливання пропофолу (25-30мг/кг/год.). алергічних овець Протягом всього експерименту проводили монітоПідготовка тварин: використовували дорослі ринг параметрів життєвих функцій (частоти серцездорові вівці з середньою масою 35кг (в інтервалі вих скорочень, кров'яного тиску, частоти дихання, від 18 до 50кг). Всі тварини, що використовуються, температури тіла). задовольняли двом критеріям: а) вони давали Визначення міри застійної гіперемії носа: виприродну шкірну реакцію на розведення 1:1000 мірювання опору дихальних шляхів здійснювали або 1:10000 екстракту Ascaris suum (Greer, на пневмотахографі, приєднаному до ендотрахеаDiagnostics, Lenois, NC); і b) вони раніше виявляли льної трубки для гарантії її нормального функціореакцію на провокаційну інгаляцію екстракту нування. Для оцінки застійної гіперемії носа викоAscaris suum, що виражається гострим бронхостеристовували акустичний ринометр Ecovision. Ця нозом і пізньою обструкцією бронхів [W.M. техніка дозволяє одержувати неінвазивну 2Abraham et al., Am. Rev. Resp. Dis., 128, 839-44 розмірну ехограму внутрішньої порожнини носа. (1983)]. Носовий об'єм і площу поперечного перерізу по Вимірювання механічних параметрів: не анесвсій довжині носової порожнини обчислювали четезовану вівцю фіксували на столику в положенні рез 10 секунд на лептоп-комп'ютері (типу ноутбулежачи на животі з нерухомо закріпленою голо 19 75520 20 вою. Після місцевої анестезії носових ходів розчином 2% лідокаїну через одну ніздрю вставляли балонний катетер в нижній відділ стравоходу. Потім через іншу ніздрю тваринам інтубували ендотрахеальну трубку з надувною манжетою з використанням гнучкого фібробронхоскопу як хвилеводу. Плевральний тиск оцінювали за допомогою езофагального балонного катетера (наповненого одСтадія 1: Етиловий ефір (±)-(7-фтор-1,2,3,4ним мілілітром повітря), який був встановлений тетрагідроциклопента[Ь]індол-3-іл)оцтової кислоти так, щоб вдих давав зсув негативного тиску з явно помітними кардіогенними осциляціями. Латеральний тиск в трахеї вимірювали за допомогою катетера з бічним отвором (внутрішній діаметр 2,5мм), що проходить через назотрахеальну трубку і розташованого на певній відстані від кінця цієї назотрахеальної трубки. Транспульмонарний тиск, який Розчин 10,00г 4-фтор-2-іоданіліну, 6,57г етил визначається як різниця між трахеальним тиском і 2-(2-оксоциклопентил)ацетату і 121мг пплевральним тиском, вимірювали за допомогою толуолсульфонової кислоти в 100мл бензолу кидатчика диференціального тиску (DP45; Validyne п'ятили із зворотним холодильником з використанCorp., Northridge, СА). Для вимірювання резистенням пастки Діна-Старка в атмосфері N2 протягом тності легень (RL) максимальний кінець назотра24год. Після закінчення цього часу бензол видахеальної трубки приєднували до пневмотахографу ляли шляхом перегонки. Потім додавали 60мл (Fleish, Dyna Science, Blue Bell, PA). Сигнали потоДМФ і розчин дегазували, після чого послідовно ку і транспульмонарного тиску реєстрували на додавали 19мл основи Хьюніга і 405мг Pd(OAc)2. осцилоскопі (Model DR-12; Electronics for Medicine, Розчин нагрівали до 115°С протягом 3год., а потім White Plains, NY), який був приєднаний до цифроохолоджували до кімнатної температури. Реакцію вого комп'ютера PDP-11 (Digital Equipment Corp., гасили додаванням 300мл 1н НСl і 200мл етилаMaynard, MA.) для обчислення RL з транспульмоцетату, і суміш фільтрували через целіт. Фази ронарного тиску, дихального об'єму, одержаного зділяли і кислотну фазу два рази екстрагували шляхом інтегрування, і потоку в режимі реального 200мл етилацетату. Органічні шари об'єднували, часу. Для визначення RL використовували аналіз промивали насиченим розчином солі, сушили над 10-15 вдихів. Для одержання питомого опору лебезводним Na2SO4, фільтрували через целіт і конгень (SRL=RL·Vtg) вимірювали об'єм газу в грудній центрували. Потім неочищений продукт очищали клітці (Vtg) на плетизмографі. флеш-хроматографією, елююючи 100% толуолом, Для ілюстрації даного винаходу, нижче навоі одержували 5,36г вказаної в заголовку сполуки у дяться приклади, які не повинні розглядатись як вигляді жовтої твердої речовини. обмеження об'єму даного винаходу. Якщо це не 1 Н ЯМР (ацетон-d6) 9,76 (ушир.с, 1Н), 7,34 обумовлено особливо, то в цих прикладах: (дд, 1Н), 7,03 (д, 1Н), 6,78 (тд, 1Н), 4,14 (кв, 2Н), - всі кінцеві продукти сполуки формули І були 3,57 (м, 1Н), 2,85-2,55 (м, 5Н), 2,15 (м, 1Н), 1,22 (т, проаналізовані за допомогою ЯМР, ТШХ і елемен3Н). тного аналізу або мас-спектроскопії; Стадія 2: (±)-(7-фтор-1,2,3,4- проміжні сполуки аналізували за допомогою тетрагідроциклопента[b]індол-3-іл)оцтова кислота ЯМР і ТШХ; більшість сполук очищали флешхроматографією на силікагелі, перекристалізацією і/або заміною розчинника (суспензія в розчиннику з подальшою фільтрацією твердих речовин); - за ходом реакції стежили за допомогою тонкошарової хроматографії (ТШХ), а час реакції наводиться лише для ілюстрації; До розчину 1,24г складного ефіру, одержаного - енантіомерний надлишок вимірювали на на стадії 1, в 14мл тетрагідрофурану (ТГФ) при ВЕРХ з нормальною фазою і з використанням хікімнатній температурі додавали 7мл МеОН, а поральної колонки: ChiralPak AD; 250 4,6мм. тім 7мл 2н NaOH. Через 2,5год. реакційну суміш Нижченаведені проміжні сполуки одержували виливали в ділильну лійку, що містить етилацетат відповідно до процедур, описаних в літературі, або (EtOAc)/1н НСl. Фази розділяли і кислотну фазу закуповували у нижченаведених постачальників: два рази екстрагували EtOAc. Органічні шари етил-2-(2-оксоциклопентил)ацетат: об'єднували, промивали насиченим розчином солі, Acros/Fisher Scientific, сушили над безводним Na2SO4 i упарювали досу4-фтор-2-іоданілін: Beugelmans, R.; Chbani, M. ха з одержанням 1,08г неочищеного і нестабільноBull. Soc. Chim. Fr. 1995, 132, 306-313. го воскоподібного коричневого масла, яке викориПриклад 1 стовували в наступній стадії без очищення (-)-[4-(4-хлорбензил)-7-фтор-5(чистота >90%). 1 (метансульфоніл)-1,2,3,4Н ЯМР (ацетон-d6) 10,90 (ушир.с, 1Н), 9,77 тетрагідроциклопента[b]індол-3-іл]оцтова кислота (ушир.с, 1Н), 7,34 (дд, 1Н), 7,04 (дд, 1Н), 6,79 (тд, 1Н), 3,56 (м, 1Н), 2,90-2,50 (м, 5Н), 2,16 (м, 1Н). MS (-APCI) m/z 232,2 (М-Н)-. 21 75520 22 Стадія 3: (±)-(5-бром-7-фтор-1,2,3,4(д, Ш), 5,74 (д, 1Н), 3,61 (м, 1Н), 3,00-2,70 (м, ЗН), тетрагідроциклопента[b]індол-3-іл)оцтова кислота 2,65 (дд, 1Н), 2,39 (дд, 1Н), 2,26 (м, 1Н). MS (АРСІ) m/z 436,3, 434,5 (М-Н)-. Стадія 5: (+)-[5-бром-4-(4-хлорбензил)-7-фтор1,2,3,4-тетрагідроциклопента-[b]індол-3-іл]оцтова кислота До розчину 2,20г кислоти, одержаної на стадії 2 (чистота >90%), в 30мл піридину додавали 6,85г триброміду піридинію (чистота 90%) при -40°С. Суспензію перемішували протягом 10 хвилин при 0°С і нагрівали до кімнатної температури протягом 30 хвилин. Потім розчинник видаляли без нагрівання у високому вакуумі. Неочищений продукт розчиняли в 40мл АсОН і до холодного розчину при 0°С порціями додавали 2,88г цинкового пилу. Суспензію перемішували протягом 15 хвилин при 15°С і нагрівали до кімнатної температури ще 15 хвилин. Після закінчення цього часу, реакційну суміш гасили додаванням 1н HCl і суміш виливали в ділильну лійку, що містить насичений розчин солі/EtOAc. Шари розділяли і органічний шар промивали водою, насиченим розчином солі, сушили над безводним Na2SO4 і концентрували. Цей продукт використовували в наступній стадії без додаткового очищення. 1 Н ЯМР (ацетон-d6) 10,77 (ушир.с, 1Н), 9,84 (ушир.с, 1Н), 7,09 (м, 2Н), 3,60 (м, Ш), 2,95-2,65 (м, 4Н), 2,56 (дд, 1Н), 2,19 (м, 1Н). Стадія 4: (±)-[5-бром-4-(4-хлорбензил)-7-фтор1,2,3,4-тетрагідроциклопент[b]-індол-3-іл]оцтова кислота До розчину 2,13г кислоти, одержаної на стадії 3, в 10мл ТГФ додавали надлишок розчину діазометану в простому ефірі доти, доки ТШХ не вказувала на повне витрачення кислоти. Потім розчинники видаляли у вакуумі. До одержаного таким чином розчину неочищеного метилового ефіру в 20мл ДМФ при -78°С додавали 539мг суспензії NaH (60% в олії). Суспензію перемішували протягом 10 хвилин при 0°С, знов охолоджували до 78°С і обробляли 1,70г 4-хлорбензилброміду. Через 5 хвилин температуру підвищували до 0°С і суміш перемішували протягом 20 хвилин. Після закінчення цього часу реакцію гасили додаванням 2мл АсОН і цю суміш виливали в ділильну лійку, що містить 1н НСІ/EtOAc. Шари розділяли і органічний шар промивали насиченим розчином солі, сушили над безводним Na2SO4 i концентрували. Алкілований продукт гідролізували відповідно до процедури, описаної на стадії 2. Потім неочищений продукт очищали шляхом розтирання з сумішшю EtOAc/гексани, внаслідок чого одержували 2,35г вказаної в заголовку сполуки у вигляді світло-коричневої твердої речовини. 1 Н ЯМР (ацетон-d6) 10,70 (ушир.с, 1Н), 7,31 (д, 2Н), 7,18 (д, 1Н), 7,06 (д, 1Н), 6,92 (д, 2Н), 5,90 До розчину 2,35г кислоти, одержаної на стадії 4, в 130мл EtOH при 80°С додавали 780мкл (S)-(-)1-(1-нафтил)етиламіну. Розчин охолоджували до кімнатної температури і перемішували протягом ночі. Виділену сіль (1,7г) знов перекристалізовували з 200мл EtOH. Після фільтрації одержану сіль у вигляді білої твердої речовини нейтралізували 1н НСI і продукт екстрагували EtOAc. Органічний шар промивали насиченим розчином солі, сушили над безводним Na2SO4 і концентрували. Одержаний продукт фільтрували через шар SiO2, елююючи EtOAc, внаслідок чого одержували 500 мг вказаного в заголовку енантіомера у вигляді білої твердої речовини. Час утримування двох енантіомерів становив, відповідно, 7,5хв. і 9,4хв. [колонка ChiralPak AD, суміш гексан/2-пропанол/оцтова кислота (95:5:0,1)]. Більш полярний енантіомер мав енантіомерний надлишок (е.н.) 98%. е.н.=98%; час утримування=9,4хв. [колонка ChiralPak AD, 250 4,6мм, суміш гексани/2-пропанол/оцтова кислота (75:25:0,1)]; [ ]D21=+39,2° (с 1,0, МеОН). Стадія 6: (-)-[4-(4-хлорбензил)-7-фтор-5(метансульфоніл)-1,2,3,4тетрагідроциклопента[b]індол-3-іл1оцтова кислота і її натрієва сіль Кислоту, одержану на стадії 5 (15,4г), спочатку естерифікували діазометаном. Сульфування здійснювали шляхом змішування одержаного таким чином складного ефіру з 16,3г натрієвої солі метансульфінової кислоти і 30,2г CuI(I) в Nметилпіролідиноні. Суспензію дегазували в потоку N2, нагрівали до 150°С і перемішували протягом 3год., після чого її охолоджували до кімнатної температури. Реакцію гасили додаванням 500мл етилацетату і 500мл гексанів, і суміш фільтрували через шар SiO2, елююючи EtOAc. Органічні фази концентрували. Неочищену олію розчиняли в EtOAc, три рази промивали водою і один раз насиченим розчином солі, сушили над безводним Na2SO4, фільтрували і концентрували. Потім неочищений продукт очищали флешхроматографією, елююючи градієнтом 100% толуол 50% толуол в EtOAc, і одержували 14г сульфованого складного ефіру, який гідролізували згідно з процедурою, описаною зі стадії 2. Після двох послідовних перекристалізацій: з суміші ізопропілацетат/гептан, а потім з сумішей СH2СI2/гексани одержували вказану в заголовку сполуку (9,8г) у вигляді білої твердої речовини. 1 Н ЯМР (500МГц ацетон-d6) 10,73 (ушир.с, 1Н), 7,57 (д, 2Н, J=8,8Гц), 7,31 (м, 1Н), 7,29 (м, 1Н), 6,84 (д, 2Н, J=8,8Гц), 6,29 (д, 1Н, J=17,8Гц), 5,79 23 75520 24 (д, 1Н, JAB=17,8Гц), 3,43 (м, 1Н), 2,98 (с, 3Н), 2,94 мішували при кімнатній температурі протягом 1 (м, 1Н), 2,85-2,65 (м, 3Н), 2,42 (дд, 1Н, J1=16,1Гц, години. Реакційну суміш розбавляли водою (1,0 J2=10,3Гц), 2,27 (м, 1Н). 13С ЯМР (125МГц ацетоноб'єму) і промивали толуолом (3 0,75 об'єму). Воd6) 173,0, 156,5 (д, JCF=237Гц), 153,9, 139,2, дну фазу підкисляли 3н НСl до pH 1 і екстрагували 133,7, 133,3, 130,0 (д, JCF=8,9Гц), 129,6, 128,2, трет-бутилметиловим ефіром (2 0,75 об'єму). 127,5 (д, JCF=7,6Гц), 122,2 (д, JCF=4,2Гц), 112,3 (д, Об'єднані органічні фракції промивали водою (0,75 JCF=29,4Гц), 111,0 (д, JCF=22,6Гц), 50,8, 44,7,38,6, об'єми). До прозорого світло-коричневого розчину 36,6, 36,5,23,3. MS (-АРС1) m/z 436,1,434,1 (М-Н)-. додавали дициклогексиламін (1екв.) і розчин пее.н.=97%; час утримування=15,3хв. [колонка ремішували при кімнатній температурі протягом 16 ChiralCel OD: 250 4,6мм, суміш гексани/2годин. Сіль фільтрували, промивали етилацетапропанол/етанол/оцтова кислота (90:5:5:0,2)]; том, трет-бутилметиловим ефіром і залишали для сушіння, внаслідок чого одержували вказану в за[ ]D21=-29,3° (с 1,0, МеОН).Т.пл. 175,0°С. головку сполуку у вигляді коричнювато-жовтої Натрієву сіль одержували шляхом обробки твердої речовини. Аналіз: 94 А%. 6,45г (14,80ммоль) вищезгаданої кислотної сполу1 ки в EtOH (100мл) 14,80мл водного 1н розчину Н ЯМР (500МГц, СDСІ3): 9,24 (с, 1Н), 7,16NaOH. Органічний розчинник видаляли у вакуумі і 7,08 (м, 2H), 6,82 (т, 1Н), 6,2 (ушир., 2H), 3,6-3,5 (м, неочищену тверду речовину розчиняли в 1,2л ізо1Н), 3,04-2,97 (м, 2Н), 2,88-2,70 (м, 3Н), 2,66 (дд, пропілового спирту при кип'ятінні зі зворотним хо1Н), 2,45-2,37 (м, 1Н), 2,13-2,05 (м, 2,05), 1,83 (д, лодильником. Кінцевий об'єм знижували до 500мл 4Н), 1,67 (д, 2Н), 1,55-1,43 (м, 4Н) 1,33-1,11 (м, шляхом перегонки розчинника. Натрієву сіль крис6Н). талізували шляхом охолоджування до кімнатної Стадія 2: (±)-(5-бром-7-фтор-1,2,3,4температури. Кристалічну натрієву сіль суспендутетрагідроциклопента[b]індол-3-іл)оцтова кислота вали в Н2О, заморожували в бані з сухим льодом і Суспензію DCHA-солі, одержаної у вищеопиліофілізували у високому вакуумі з одержанням саній стадії 1, в дихлорметані (0,241Μ розчину) 6,00г вказаної в заголовку сполуки у вигляді натріохолоджували до температури від -20 до -15°С. євої солі. Потім однією порцією додавали піридин (2екв.) і 1 до цієї суспензії краплями додавали бром (2,5екв.) Н ЯМР (500МГц, ДМСО-d6) 7,63 (дд, 1Н, протягом 30-45 хвилин, підтримуючи температуру J1=8,5Гц, J2=2,6Гц), 7,47 (дд, 1Н, J1=9,7Гц, від -20 до -15°С. (При додаванні приблизно 1/3 J2=2,6Гц), 7,33 (д, 2Н, J=8,4Гц), 6,70 (д, 2Н, брому, реакційна суміш стає густою і потребує J=8,4Гц), 6,06 (д, 1Н, JAB=17,9Гц), 5,76 (д, 1Н, ефективного розмішування. Потім, при додаванні J=17,9Гц), 3,29 (м, 1Н), 3,08 (с, 3Н), 2,80 (м, 1Н), 1/2 брому, суміш знов стає "рихлою"). Після заве2,69 (м, 1Н), 2,55 (м, 1Н), 2,18 (м, 2Н), 1,93 (дд, 1Н, ршення додавання реакційну суміш залишали ще J2=14,4Гц, J1=9,7Гц). на одну годину при -15°С. Потім протягом 5 хвилин Приклад 1А додавали оцтову кислоту (3,04екв.) і порціями доАльтернативна процедура одержання (±)-[5давали цинковий пил (3,04екв.). (Порцію цинку бром-4-(4-хлорбензил)-7-фтор-1,2,3,4додавали при -15°С і суміш залишали приблизно тетрагідроциюіопента[b]індол-3-іл]оцтової кислоти на 5 хвилин для гарантії проходження екзотерміч(приклад 1, стадія 4) ної реакції (приблизно від -15°С до -10°С)). Цю Стадія 1: Дициклогексиламінова (DCHA) сіль процедуру повторювали з додаванням 5 порцій (±)-(7-фтор-1,2,3,4-тетрагідроциклопента[b]індолцинку протягом приблизно 30 хвилин. Якщо екзо3-іл)оцтової кислоти 0,526Μ розчин 2-бром-4термічна реакція більше не спостерігалась, то фтораніліну в ксилолі разом з етил-(2швидко додавали цинк, який залишився. Вся прооксоциклопентил)ацетатом (1,5екв.) і сірчаною цедура займала приблизно 30-45 хвилин. кислотою (0,02екв.) нагрівали до температури деПісля завершення додавання цю партію нагріфлегмації протягом 20 годин. Потім здійснювали вали до кімнатної температури, витримували проазеотропне видалення води на апараті Старка. За тягом 1 години і концентрували. Реакційну суміш ходом реакції стежили за допомогою ЯМР, і через переводили в метил-трет-бутиловий ефір (МТВЕ, 20 годин звичайно спостерігалось 80-85% перет0,8 об'єму) і додавали 10% водний розчин оцтової ворення в потрібну імінову проміжну сполуку. Реакислоти (0,8 об'єми). Суміш (після кристалізації кційну суміш промивали 1М бікарбонатом натрію солей, наприклад піридію) залишали на 1 годину (0,2 об'єми) протягом 15 хвилин і органічну фракпри кімнатній температурі і фільтрували через цію випаровували. Залишковий сироп піддавали solka-flос. Шар solka-flос промивали МТВЕ (прибвакуумній перегонці (0,5мм рт.ст.). Залишковий лизно 0,2 об'єму) і фільтрат (двофазний, ксилол піддавали перегонці при 30°С, потім надміМТВЕ/вода) переносили в екстракційний апарат. рний кетон і анілін, який не прореагував, виділяли Органічну фазу промивали водою (0,8 об'єму). при температурі в межах 50-110°С; при цьому імін МТВЕ-екстракт концентрували і переводили в ізовиділяли в 110-180°С-фракції у вигляді світлопропіловий спирт (ІРА, 0,25 об'єму) для кристалікоричневої прозорої рідини з чистотою 83%. зації сполуки. Після цього додавали воду (0,25 Потім імінову проміжну сполуку додавали до об'єму) і партію залишали на 1 годину. Потім продегазованої суміші ацетату калію (3екв.), моногідтягом 1 години знов додавали воду (0,33 об'єму). рату хлориду тетра-н-бутиламонію (1екв.), ацетату Після завершення додавання води партію залипаладію (0,03екв.) і Ν,Ν-диметилацетаміду (кінцешали ще на одну годину, фільтрували і промивали ва концентрація іміну=0,365М). Реакційну суміш сумішшю IPА/вода, 30/70 (0,15 об'єму). Кристалінагрівали до 115°С протягом 5 годин і залишали зовану бромкислоту сушили в печі при +45°С. для охолоджування до кімнатної температури. Стадія 3: (±)-[5-бром-4-(4-хлорбензил)-7-фторПісля цього додавали 3н КОН (3екв.) і суміш пере 25 75520 26 1,2,3,4-тетрагідроциклопента-[b]індол-3-іл]оцтова 30% EtOAc/гексан, внаслідок чого одержували 1,0г кислота сульфованого продукту. Цей продукт гідролізували Бромкислоту, одержану на стадії 2, розчиняли при кімнатній температурі протягом 3 годин до в диметилацетаміді (0,416Μ розчин) і однією порвідповідної кислоти з використанням 10мл 2н цією додавали карбонат цезію (2,5екв.). До зависі NaOH в суміші розчинників, що складається з однією порцією додавали 4-хлорбензилхлорид 10мл ТГФ і 10мл МеОН. Реакційну суміш нейтралі(2,5екв.) і партію нагрівали до 50°С протягом зували водним розчином 1M HCl і екстрагували 20год. Цю партію охолоджували до кімнатної темEtOAc. Відділену органічну фазу сушили над безператури і протягом 5 хвилин додавали 5н гідрокводним сульфатом натрію, фільтрували і упарюсид натрію (4,00екв.) (температура підвищувалась вали з одержанням неочищеної кислоти. Два діасдо +40°С). Реакційну суміш витримували при 50°С тереомери розділяли з використанням протягом приблизно 3 годин, охолоджували до препаративної ВЕРХ (Zobax, 30% EtOАс/гексан з кімнатної температури і переносили в екстракцій0,2% АсОН) і одержували 300мг діастереомера А ний апарат місткістю 1л. Розчин розбавляли ізоп(більш короткий час утримування) і 210мг діастеропілацетатом (ІРАс, 2 об'єми) і охолоджували до реомера В (більш тривалий час утримування). +15°С. Розчин підкисляли 5н HCl до рН-2. Шари Діастереомер В: 1Н ЯМР (ацетон-d6) 10,70 розділяли і органічний шар промивали водою (2 2 (ушир.с, 1Н), 7,66 (дд, 1Н), 7,56 (дд, 1Н), 7,32 (д, об'єми). Розчин ІРАс концентрували і переводили 2Н), 6,95 (д, 2Н), 6,91 (кв, 1Н), 3,39 (с, 3Н), 3,05в ІРА (0,8 об'єми) для кристалізації продукту. Після 3,00 (м, 1Н), 2,90-2,75 (м, 2Н), 2,70 (дд, 1Н), 2,44 цього протягом 2 годин додавали воду (8л) і цю (дд, 1Н), 2,43-2,34 (м, 1Н), 2,21 (дд, 1Н), 2,11 (д, партію фільтрували з одержанням вказаної в заго3Н). MS (-АРСІ) m/z 448,0 (М-Н)-. ловку сполуки з виходом 88%. Одержана партія Приклад 2А може бути піддана сушінню в печі при +40°С проАльтернативний синтез (±)-(4-[1-(4тягом 24 годин. хлорфеніл)етил]-7-фтор-5-метансульфоніл-1,2,3,4Приклад 2 тетрагідроциклопента[b]індол-3-іл}оцтової кислоти (±)-(4-[1-(4-хлорфеніл)етил]-7-фтор-5До розчину 6,52г метилового ефіру кислоти метансульфоніл-1,2,3,4прикладу 1 (стадія 3) (який був одержаний шляхом тетрагідроциклопента[b]індол-3-іл}оцтова кислота етерифікації відповідної кислоти з використанням діазометану в тетрагідрофурані) в 160мл NMP послідовно додавали 10,2г натрієвої солі метансульфінової кислоти і 19г Cul. Одержану суспензію дегазували в потоку N2, нагрівали до 150°С і ретельно перемішували протягом 4год. Потім реакційну суміш охолоджували до кімнатної температури і розбавляли 500мл етилацетату і 500мл гексану. Одержану суміш фільтрували через шар силікагелю, а потім елюювали EtOAc. Фільтрат концентруДо розчину 1,5г метилового ефіру кислоти вали до об'єму приблизно 300мл і промивали воприкладу 1 (стадія 3) (який був одержаний шляхом дою і насиченим розчином солі. Органічну фазу етерифікації відповідної кислоти з використанням відділяли, сушили над безводним Na2SO4, фільтдіазометану в тетрагідрофурані) додавали 2,03г 1рували і концентрували. Неочищений продукт (1-брометил)-4-хлорбензолу в 50мл ацетонітрилу і очищали флеш-хроматографією на силікагелі, 6,01г карбонату цезію. Одержану суміш кип'ятили елююючи 30% EtOAc/гексан, внаслідок чого одерзі зворотним холодильником протягом 3 годин при жували 4,7г сульфованого продукту, які розчиняли ретельному перемішуванні. Потім реакційну суміш в 200мл дихлорметану. До одержаного розчину охолоджували до кімнатної температури, розбавдодавали 3,39г 4-хлорфенілметилкарбінолу і 5,68г ляли 50мл етилацетату, фільтрували і розчинник трифенілфосфіну, а потім порціями додавали випаровували. Залишок очищали флеш4,99г ди-трет-бутил азодикарбоксилату. Реакційну хроматографією (силікагель, 4% EtOАс/гексан) з суміш перемішували при кімнатній температурі одержанням 1,41г потрібного продукту Nпротягом 3год., а потім концентрували. Залишок бензилування у вигляді суміші діастереомерів завантажували на колонку з силікагелем і елююприблизно 1:1, на що вказував 1Н ЯМР-аналіз. вали сумішшю 5% EtOAc/гексан з одержанням 5,1г До одержаного, як описано вище, складного метилового ефіру вказаної в заголовку сполуки у ефіру (1,2г), розчиненого в 80мл NMP, послідовно вигляді суміші діастереомерів приблизно 1:1, на додавали 2, 63г натрієвої солі метансульфінової що вказував 1Н ЯМР-аналіз. Після проведення кислоти і 3,7 Cu(I)Br. Одержану суспензію дегазустадій гідролізу і очищення, описаних в прикладі 2, вали в потоку N2, нагрівали до 140°С і ретельно одержували вказану в заголовку кислоту. перемішували протягом 8год. Потім реакційну суПриклад 3 міш охолоджували до кімнатної температури і роз(±)-[9-(4-хлорбензил)-6-фтор-8бавляли 500мл етилацетату і 500мл гексану. Одеметансульфоніл-2,3,4,9-тетрагідро-1Н-карбазол-1ржану суміш фільтрували через шар силікагелю, а іл]оцтова кислота потім елюювали EtOAc. Фільтрат концентрували до об'єму приблизно 300мл і промивали водою і насиченим розчином солі. Органічну фазу відділяли, сушили над безводним Na2SO4, фільтрували і концентрували. Неочищений продукт очищали флеш-хроматографією на силікагелі, елююючи 27 75520 28 метансульфоніл-2,3,4,9-тетрагідро-1Н-карбазол-1іл]оцтова кислота До розчину 478мг складного ефіру, одержаного на стадії 2 в 8мл NMP, послідовно додавали 510мг натрієвої солі метансульфінової кислоти і 950мг Cul(I). Одержану суміш дегазували в потоку N2, потім нагрівали при 140°С протягом 8год. при ретельному перемішуванні. Реакційну суміш охоСтадія 1: (±)-етил-(8-бром-6-фтор-2.3 А9лоджували до кімнатної температури і розбавляли тетрагідро-1Н-карбазол-1-іл)ацетат мінімальною кількістю суміші EtOAc/гексан, 1:1. Одержану суміш фільтрували через шар силікагелю, а потім елюювали EtOAc. Фільтрат концентрували до об'єму приблизно 50мл і промивали водою і насиченим розчином солі. Органічну фазу збирали, сушили над безводним сульфатом натрію, фільтрували і випаровували. Залишок очищали флеш-хроматографією на силікагелі (30% До суспензії 7,24г гідрохлоридної солі (2-бромEtOАс/гексан) з одержанням 320мг потрібного су4-фторфеніл)гідразину в 100мл оцтової кислоти льфованого продукту, який розчиняли в 5мл додавали 5,5г етил 2-(2-оксоциклогексил)ацетату. ТГФ+5мл метанолу. До одержаного розчину додаОдержану суміш нагрівали до температури дефлевали 5мл 2н NaOH і одержану суміш перемішувагмації протягом 1год. Потім додавали 10мл етаноли при кімнатній температурі протягом 6год. Реаклу і реакційну суміш кип'ятили зі зворотним холоційну суміш нейтралізували 1М водним розчином дильником протягом ночі. Розчинник НСI і екстрагували EtOAc. Відділену органічну фавипаровували, залишок розбавляли EtOAc, а потім зу сушили над безводним сульфатом натрію, фіпослідовно промивали насиченим водним розчильтрували і випаровували. Залишок кип'ятили зі ном NаНСО3, водою і насиченим розчином солі. зворотним холодильником в гексані при ретельОрганічний шар відділяли, сушили над безводним ному перемішуванні протягом 0,5 години. Одержасульфатом натрію, фільтрували і упарювали. Зану суміш охолоджували до кімнатної температури лишок очищали флеш-хроматографією на силікапри ретельному перемішуванні і фільтрували з гелі (5% EtOAc/гексан) і одержували 3,12г потрібодержанням 278мг потрібної кислоти. 1 ної сполуки. Н ЯМР (500МГц, ацетон-d6) 10,73 (ушир.с, 1 Н ЯМР (ацетон-d6) 9,97 (ушир.с, 1Н), 7,34 1Н), 7,57 (д, 1Н), 7,56 (д, 1Н), 7,29 (д, 1Н), 6,67 (д, (дд, 1Н), 7,13 (дд, 1Н), 7,09 (дд, 1Н), 4,16 (кв, 2Н), 2Н), 6,47 і 5,61 (AB кв, 2Н), 3,27-3,21 (м, 1Н), 2,98 3,43-3,35 (м, 5Н), 3,05-2,88 (м, 1Н), 2,76-2,53 (м, (с, 3Н), 2,85 (дд, 1Н), 2,76-2,55 (м, 3Н), 2,00-1,84 ЗН), 2,10-2,00 (м, 1Н), 1,96-1,87 (м, 1Н), 1,82-1,72 (м, 3Н), 1,82-1,73 (м, 1Н). MS (-APCI) m/z 448,0 (М(м, Н), 1,72-1,64 (м, 1Н), 1,23 (т, 3Н). Н)-. Стадія 2: (±)-етил [8-бром-9-(4-хлорбензил)-6Приклад 4 фтор-2,3,4,9-тетрагідро-1Н-карбазол-3-іл]ацетат [4-(4-хлорбензил)-7-фтор-5-метансульфоніл-1оксо-1,2,3,4-тетрагідроциклопента[b]індол-3іл]оцтова кислота До розчину 3,12г складного ефіру, одержаного на стадії 1, і 3,62г 1-бромметил-4-хлорбензолу в 30мл ацетонітрилу, додавали 5,74г карбонату цезію. Одержану суміш ретельно перемішували при кип'ятінні зі зворотним холодильником протягом 3год. Потім її охолоджували до кімнатної температури, розбавляли мінімальною кількістю EtOAc, фільтрували і випаровували. Залишок очищали флеш-хроматографією на силікагелі (50% толуол/гексан) з одержанням 4,1г вказаної в заголовку сполуки. 1 Н ЯМР (ацетон-d6) 7,32 (д, 2Н), 7,24 (дд, 1Н), 7,13 (дд, 1Н), 6,86 (д, 2Н), 6,00 і 5,65 (AB кв, 2Н), 4,15-4,05 (м, 2Н), 3,44-3,35 (м, 1Н), 2,88-2,76 (м, 1Н), 2,65-2,52 (м, 3Н), 2,00-1,80 (м, 4Н), 1,22 (т, 3Н). Стадія 3: (+)-[9-(4-хлорбензил)-6-фтор-8 Стадія 1: метиловий ефір [5-бром-4-(4хлорбензил)-7-фтор-1-оксо-1,2,3,4тетрагідроциклопента[b]індол-3-іл]оцтової кислоти Метиловий ефір сполуки прикладу 1, стадії 5 (1,00г, одержаного шляхом обробки відповідної кислоти надлишком діазометану) в 10мл розчину 29 75520 30 ТГФ/Н2О, 9:1, обробляли 2,52г DDQ. Реакційну Одержану олію очищали флеш-хроматографією, суміш залишали на ніч з перемішуванням при кімелююючи сумішшю 30% EtOAc/гексан, і одержуванатній температурі. Після закінчення цього часу ли 54мг відповідного метилсульфону у вигляді не реакційну суміш виливали в ділильну лійку, що зовсім білої твердої речовини. містить EtOAc і насичений розчин солі. Об'єднані Метиловий ефір, одержаний як описано вище, органічні шари промивали водою, насиченим розв 5мл розчину ТГФ/Н2О (1:1) і 5мл МеОН оброблячином солі, сушили над безводним MgSO4 і концели 1мл 1н розчину HCI. Цю суміш перемішували нтрували. Потім одержаний продукт очищали при кімнатній температурі протягом двох годин. флеш-хроматографією, елююючи сумішшю 30% Після закінчення цього часу реакційну суміш підкиEtOAc/гексан. Цю процедуру хроматографії повтосляли 1н розчином HCI і виливали в ділильну лійрювали ще два рази. Таким чином, було одержано ку, що містить воду і EtOAc. Шари розділяли і вод350мг вищезгаданого кетону у вигляді сірої тверний шар екстрагували EtOAc. Об'єднані органічні дої речовини. шари промивали водою, насиченим розчином солі, Стадія 2: [4-(4-хлорбензил)-7-фтор-5сушили над безводним Na2SO4 і концентрували. метансульфоніл-1-оксо-1,2,3,4Потім одержаний продукт очищали флештетрагідроциклопента[b]індол-3-іл]оцтова кислота хроматографією, елююючи 100% EtOAc, що місБромід, одержаний, як описано на стадії 1 тить 1% АсОН, внаслідок чого одержували 26мг (200мг), в 4мл NMP, обробляли 320мг Cul і 175мг вказаної в заголовку кислоти у вигляді не зовсім CH3SO2Na. Через реакційну суміш протягом приббілої твердої речовини. 1 лизно однієї хвилини барботували азот, а потім Н ЯМР (500МГц, ацетон-d6) 11,0 (ушир., 1Н), суміш нагрівали протягом шести годин при 130°С. 7,85 (м, 1Н), 7,80 (м, 1Н), 7,38 (д, J=8Гц, 2Н), 7,04 Після закінчення цього часу реакційну суміш охо(д, J=8Гц, 2Н), 6,42 (д, JAB=18Гц, 1Н), 6,08 (д, лоджували до кімнатної температури, розбавляли JAB=18Гц, 1Н), 3,78 (м, 1Н), 3,28 (м, 1Н), 3,10 (м, EtOAc і фільтрували через шар силікагелю, після 1Н), 3,05 (с, 3Н), 2,65 (м, 2Н). MS (-APCI) m/z 448,2 чого залишок знов промивали EtOAc. Органічні (М-Н)-. шари промивали водою, насиченим розчином солі, сушили над безводним MgSO4 і концентрували. Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюFluorosubstituted cycloalkanoindoles, a composition containing them
Назва патенту російськоюФторзамещенные циклоалканоиндолы, композиция, которая их содержит
Автори російськоюLachance, Nicolas
МПК / Мітки
МПК: C07D 209/94, A61P 11/06, A61P 27/16, A61P 37/08, A61P 43/00, C07D 209/80, A61K 45/00, A61K 31/404, C07D 209/88
Мітки: фторзаміщені, композиція, містить, циклоалканоіндоли
Код посилання
<a href="https://ua.patents.su/15-75520-ftorzamishheni-cikloalkanoindoli-kompoziciya-shho-kh-mistit.html" target="_blank" rel="follow" title="База патентів України">Фторзаміщені циклоалканоіндоли, композиція, що їх містить</a>