Спосіб одержання естерів (5-фтор-2-метил-3-хінолін-2-ілметиліндол-1-іл)-оцтової кислоти
Формула / Реферат
1. Спосіб одержання сполуки формули (І)
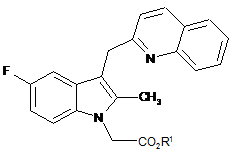 , (І)
, (І)
де R1 - С1-С6алкіл або бензил; причому спосіб включає:
і) введення в реакцію сполуки формули (II)
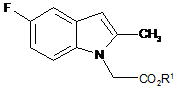 , (II)
, (II)
де R1 - як це визначено для формули (І);
з 2-хінолінкарбоксальдегідом в умовах кислого середовища і при температурі ≤10 °C;
з одержанням кислої адитивної солі сполуки формули (III):
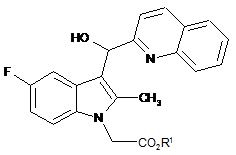 , (III)
, (III)
де R1 - як це визначено для формули (І);
іі) після фактичного завершення реакції на стадії (і), обробку кислої адитивної солі основою, з одержанням спирту формули (III), одночасно підтримуючи температуру ≤10 °C; і
ііі) введення в реакцію сполуки формули (III) з відновлювальним агентом з одержанням сполуки формули (І).
2. Спосіб за п. 1, який відрізняється тим, що R1 - С1-С4алкіл.
3. Спосіб за п. 2, який відрізняється тим, що R1 - етил.
4. Спосіб за будь-яким з пунктів 1-3, який відрізняється тим, що реакцію на стадії (і) здійснюють в дихлорметані.
5. Спосіб за будь-яким з пунктів 1-4, який відрізняється тим, що умови кислого середовища на стадії (і) забезпечують за допомогою трифтороцтової кислоти (TFA).
6. Спосіб за п. 5, який відрізняється тим, що TFA присутня в кількості ≥2 моля кислоти на моль сполуки формули (II).
7. Спосіб за будь-яким з пунктів 1-6, який відрізняється тим, що реакцію на стадії (і) здійснюють при температурі приблизно 0-5 °C.
8. Спосіб за будь-яким з пунктів 1-7, який відрізняється тим, що молярне співвідношення між 2-хінолінкарбоксальдегідом і сполукою формули (II) становить приблизно 1,1:1.
9. Спосіб за будь-яким з пунктів 1-8, який відрізняється тим, що стадія (іі) включає видалення домішок зі сполуки формули (III).
10. Спосіб за будь-яким з пунктів 1-9, який відрізняється тим, що на стадії (іі) сполуку формули (III) одержують з її кислої адитивної солі шляхом нейтралізації реакційної суміші основою.
11. Спосіб за п. 10, який відрізняється тим, що він додатково включає видалення домішок шляхом промивання реакційної суміші водою або водним розчинником перед і/або після нейтралізації реакційної суміші.
12. Спосіб за будь-яким з пунктів 1-9, який відрізняється тим, що стадія (іі) включає
видалення продукту, одержаного на стадії (і) у вигляді кислої солі, з реакційної суміші після фактичного завершення реакції на стадії (і); і обробку відокремленої кислої солі основою, в результаті чого одержують спирт загальної формули (III).
13. Спосіб за будь-яким з пунктів 10-12, який відрізняється тим, що основою є водний гідроксид натрію або калію.
14. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що на стадії (ііі) відновлення здійснюють з використанням триетилсилану.
15. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що він додатково включає додаткову стадію:
(iv) відокремлення і очищення сполуки формули (І).
16. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що він додатково включає додаткову стадію
(v) перетворення сполуки формули (І) на (5-фтор-2-метил-3-хінолін-2-ілметиліндол-1-іл)-оцтову кислоту, причому спосіб включає гідролізацію сполуки формули (І).
17. Спосіб за п. 16, який відрізняється тим, що гідроліз являє собою основний гідроліз.
18. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що він додатково включає, перед початком стадії (і), одержання сполуки формули (II) з використанням процесу, який включає
введення в реакцію 5-фтор-2-метиліндолу зі сполукою формули (IV):
X-CH2-COOR1, (IV)
де X - відщеплювана група, наприклад галогрупа, така як бромогрупа, a R1 - як це визначено для формули (І).
19. Спосіб за п. 18, який відрізняється тим, що реакція має місце в присутності карбонату цезію в ацетонітрилі.
20. Спосіб за п. 18 або 19, який відрізняється тим, що вміст розчинника становить приблизно 10 об'ємів розчинника на грам 5-фтор-2-метиліндолу.
21. Спосіб за будь-яким з пунктів 18-20, який відрізняється тим, що він додатково включає відокремлення і очищення сполуки формули (II) перед початком стадії (і).
22. Відокремлена і очищена сполука формули (III):
 , (III)
, (III)
де R1 - С1-С6алкіл або бензил.
Текст
Реферат: Винахід стосується способу одержання сполуки формули (І): N F CH3 N CO2R1 , (І) 1 де R - С1-С6алкіл або бензил; шляхом введення в реакцію сполуки формули (II): F CH3 N CO2R1 , (II) UA 111868 C2 (12) UA 111868 C2 1 де R - як це визначено для формули (І); з 2-хінолінкарбоксальдегідом. Спосіб доцільно використовувати у промисловому масштабі. UA 111868 C2 5 10 15 20 25 30 Даний винахід відноситься до способу приготування складних ефірів (5-фтор-2-метил-3хінолін-2-ілметил-індол-1-іл)-оцтової кислоти, зокрема, до високопродуктивного способу, який доцільно використовувати в промисловому масштабі. WO 2005/044260 відноситься до сполук, які являють собою антагоністи CRTH2 і які, таким чином, є корисними при лікуванні захворювань і станів, опосередкованих дією PGD2 у СРТН2рецепторі. Однією особливо корисною сполукою, розкритою в WO 2005/044260, є (5-фтор-2метил-3-хінолін-2-ілметил-індол-1-іл)-оцтова кислота, і над цією сполукою було проведено декілька досліджень, включаючи клінічні випробування на людині, які продемонстрували, що вона є ефективною при лікуванні алергічного риніту і астми, особливо еозинофільної астми і атопічної астми. Складні ефіри (5-фтор-2-метил-3-хінол ін-2-ілметил-індол-1 -іл)-оцтової кислоти є проміжними продуктами при приготуванні (5-фтор-2-метил-3-хінолін-2-ілметил-індол-1-іл)оцтової кислоти. Крім того, складні ефіри (5-фтор-2-метил-3-хінолін-2-ілметил-індол-1-іл)оцтової кислоти є корисними як проліки для (5-фтор-2-метил-3-хінолін-2-ілметил-індол-1-іл)оцтової кислоти і, таким чином, є корисними в медицині. Вперше (5-фтор-2-метил-3-хінолін-2-ілметил-індол-1-іл)-оцтова кислота була описана в WO 2005/044260 одночасно з низкою інших аналогічних сполук. В цьому документі наведені приклади здійснення способу приготування {3-[1-(4-хлор-феніл)-етил]-5-фтор-2-метил-індол-1іл}-оцтової кислоти і пояснюється, що інші сполуки з цієї групи були приготовані аналогічними способами. Згідно прикладу 1, наведеного в WO 2005/044260, {3-[1-(4-хлор-феніл)-етил]-5-фтор-2метил-індол-1-іл}-оцтову кислоту отримували з використанням наступного двостадійного процесу: і. етиловий ефір (5-фтор-2-метил-індол-1-іл)-оцтової кислоти і 4-ацетилхлорбензол вводили в обопільну реакцію в присутності трифтороцтової кислоти і тріетилсилану у розчині 1,2дихлоретану, в результаті чого отримували етиловий ефір {3-[1 -(4-хлор-феніл)-етил]-5-фтор-2метил-індол-1-іл}-оцтової кислоти; іі. цей ефір піддавали гідролізу з використанням гідроксиду літію у змішаному розчиннику тетрагідрофурану і води, в результаті чого отримували цільовий продукт. WO 2006/092579 відноситься до мікрокристалічної форми (5-фтор-2-метил-3-хінолін-2ілметил-індол-1-іл)-оцтової кислоти. У цьому документі пояснюється, що ця сполука може бути приготована відповідно до способу, показаному на схемі 1. Схема 1 - Спосіб приготування (5-фтор-2-метил-3-хінолін-2-ілметил-індол-1-іл)-оцтової кислоти 1 UA 111868 C2 5 10 15 20 Проте, цей спосіб являє собою спосіб лабораторного масштабу і дає дуже низький вихід цільових сполук. Якщо (5-фтор-2-метил-3-хінолін-2-ілметил-індол-1-іл)-оцтова кислота призначається для продажу як фармацевтичний препарат, необхідно розробити економічно життєздатний спосіб для її виробництва в промисловому масштабі. Такий спосіб має бути високопродуктивним і здатним бути здійснюваним в межах вагової шкали від 100 кг і вище. Як можна побачити зі схеми 1, спосіб відповідно до WO 2006/092579 являє собою процес, який виконується у три етапи. Етап 2 цього процесу звертає на себе особливу увагу, оскільки супроводжується низьким виходом: в прикладі 1, наведеним в WO 2006/092579, пояснюється, що етап 2, на якому етиловий ефір (5-фтор-2-метил-індол-1-іл)-оцтової кислоти вводили в реакцію з хінолін-2-карбоксальдегідом, забезпечив вихід цільового продукту на рівні 134 % від теоретично розрахованого, оскільки продукт був забруднений скльованими побічними продуктами. Продукти, одержані як на етапі 2 процесу, описаного в WO 2006/092579, так і на етапі 2 процесу, аналогічного описаному в WO 2005/044260, містять декілька домішок, яки важко видалити. Оскільки (5-фтор-2-метил-3-хінолін-2-ілметил-індол-1-іл)-оцтова кислота погано розчиняється у більшості розчинників і, таким чином, її важко очистити шляхом кристалізації, було б надзвичайно доцільно, щоб складний ефір, як попередник, можна було приготувати у чистій формі. Етап 2 способу схеми 1 передбачає наявність двох різних хімічних реакцій: по-перше, реакції складного ефіру індолу з хінолінкарбоксальдегідом в умовах кислого середовища, в результаті чого отримують проміжний спирт (який фактично являє собою рацемічну суміш двох енантіомерних спиртів); і, по-друге, відновлення отриманогоспирту, в результаті чого одержують цільовий продукт етапу 2, як показано на схемі 2. Схема 2 - Етап 2 способу схеми 1 2 UA 111868 C2 5 10 15 20 В способі, описаному в WO 2006/092579, ці два процеси здійснюють шляхом виконання однієї операції, в якій відновлювальний агент тріетилсилан і трифтороцтову кислоту послідовно по краплинах додають до розчину вихідного складного ефіру і 2-хінолінкарбоксальдегіду в дихлорметані при 0-5 °C і потім при 0-10 °C; після чого реакційну суміш перемішують протягом 3 годин в умовах дефлегмації. Технологічний процес, описаний в WO 2005/044260, є дуже схожим, і знову обидва етапи цієї реакції здійснюють шляхом виконання однієї операції. У даному випадку тріетилсилан і трифтороцтову кислоту послідовно по краплинах додають до перемішаного розчину етилового ефіру (5-фтор-2-метил-індол-1-іл)-оцтової кислоти і відповідного альдегіду або кетону в 1,2дихлоретані при 0 °C. Потім суміші дозволяють нагрітися до кімнатної температури, після чого її перемішують протягом 16 годин. В прикладі 1, наведеному в WO 2005/044260, вихід складного ефіру як цільового продукту становив лише 37 %. Проте, автори даного винаходу виявили, що багато проблем, пов'язаних з цим способом проведення етапу 2 цього способу, виникають через низьку стійкість проміжного спирту в умовах, описаних в WO 2005/044260 і WO 2006/092579, і низьку реактивність проміжного спирту по відношенню до відновлювального агента. Автори цього винаходу дослідили властивості цього спирту і розробили удосконалений спосіб для проведення етапу 2 схеми 1. Таким чином, в даному винаході запропоновано спосіб приготування сполуки формули (І): 1 де R - С1-С6 алкіл або бензил; при цьому спосіб включає і. введення в реакцію сполуки формули (II) 25 (II) 1 де R - як це визначено для формули (І); з 2-хінолінкарбоксальдегідом в умовах кислого середовища і при температурі 10°С; в результаті чого отримують кислу адитивну сіль сполуки формули (III): 3 UA 111868 C2 1 5 10 15 20 25 30 35 40 45 50 де R - як це визначено для формули (І); іі. після фактичного завершення реакції на стадії (і), обробку кислої адитивної солі основою, в результаті чого отримують спирт формули (III), одночасно підтримуючи температуру 10 °C; і ііі. введення в реакцію сполуки формули (III) з відновлювальним агентом, в результаті чого отримують сполуку формули (І). Спосіб відповідно до даного винаходу є значно більш продуктивнішим ніж спосіб, описаний в WO 2005/044260, причому вихід становить, як правило, приблизно 70-80 % після завершення процесу на стадії (ііі). Крім того, отримують більш чистий продукт, що є важливим чинником, оскільки сполука загальної формули (І) є проміжним фармацевтичним продуктом. Використовуючи спосіб відповідно до даного винаходу, стає можливим послідовно отримувати продукт загальної формули (І), в якому загальний вміст домішок знаходиться на рівні 1,0 % площі, визначеної методом рідинної хроматографії високої роздільності (HPLC), причому вміст сполуки формули (III) присутній на рівні 0,5 % площі (як сума двох енантіомерів), а в деяких випадках навіть нижче за нього. Як описано вище, сполука загальної формули (І) являє собою попередник карбонових кислот, який виявляє дію антагоніста CRTH2. Проміжний продукт загальної формули (III) дуже важко видалити шляхом кристалізації з продукту індолілоцтової кислоти і, таким чином, надзвичайно важливо мінімізувати вміст сполуки загальної формули (III) в продукті загальної формули (І). В описаному вище способі, де значення вмісту різних сполуки виражені у процентах площі, це відноситься до процентного значення площі піка, який відображає конкретну молекулу на HPLC хроматограмі. Таким чином, загальний вміст домішок в продукті загальної формули (І) знаходиться на рівні 1,0 % площі, визначеної методом HPLC, коли сумарне значення площі всіх інших піків хроматограми становить менше 1,0 % загальної площі HPLC хроматограми. Метод HPLC, за допомогою якого визначався процент площі сполук загальних формул (І), (II) і (III) в способі згідно даного винаходу, детально описаний в наведених нижче прикладах. 1 В описаному вище способі група R являє собою, як правило, С1-С4 алкіл, більш переважно метил або етил, а головним чином, етил. Реакція на стадії (і) може бути проведена в органічному розчиннику, наприклад, в галогенезованому розчиннику або ацетаті, такому як, наприклад, етилацетат, в ароматичному розчиннику, такому як, наприклад, толуол або ацетонітрил, або в комбінації цих розчинників. До більш придатних розчинників відносяться галогенезовані розчинники, такі як, наприклад, дихлорметан або 1,2-дихлоретан, причому особлива перевага надається дихлорметану. Умови кислого середовища, необхідні для здійснення процесу на стадії (і), можуть бути забезпечені будь-якою кислотою, якою може бути або кислота Бренстеда-Лоурі, або кислота Льюїса, але особлива перевага надається сильній кислоті. Було виявлено, що особливо придатною кислотою є трифтороцтова кислота (TFA). Сильна кислоти, така як TFA, має, як правило, бути присутньою у надлишку, наприклад, у молярному надлишку 1,5 моля, а більш переважно 2 моля кислоти на моль сполуки формули (II). Як зазначалося вище, температура реакції на стадії (і) становить 10 °C. Проте, більш доцільно, щоб ця температура становила 5 °C, переважно 0-5 °C. Важливо переконатися, щоб перед переходом до стадії (іі) реакція на стадії (і) була фактично завершеною. Це тому, що будь-які залишкові сполуки формули (II) є присутніми протягом усього процесу на стадії (ііі), і проміжний спирт формули (III) може також вступати в реакцію з утворенням біс-індолілової сполуки, яка, в свою чергу, призводить до появи низки інших домішок, які важко відокремити від сполуки формули (І). Вихід сполуки загальної формули (III) можна збільшити і, таким чином, зменшити вміст залишкової сполуки загальної формули (II) шляхом використання на стадії (і) надлишкової молярної концентрації 2 4 UA 111868 C2 5 10 15 20 25 30 35 40 45 50 55 60 хінолінкарбоксальдегіда. Число еквівалентів 2-хінолінкарбоксальдегіда має, як правило, деякий надлишок, і, наприклад, число еквівалентів 2-хінолінкарбоксальдегіда по відношенню до сполуки формули (II) може становити приблизно від 1,05:1 до 1,5:1, як правило, приблизно 1,1:1. Оскільки важливо переконатися, що реакція на стадії (і) є фактично завершеною, тобто що вміст вихідного матеріалу залишився мінімальним, перед початком процесу нейтралізації на стадії (іі), вміст вихідного матеріалу, який залишився в реакційній суміші, можна відстежувати, переважно методом HPLC. Для фахівця в даній галузі техніки цілком в межах можливого розробити метод HPLC, придатний для відстежування цієї реакції. Реакція на стадії (і) може вважатися фактично завершеною, коли вміст вихідного матеріалу формули (II), що залишився в реакційній суміші, становить 2 % площі, визначеної методом HPLC, більш переважно 1,5 % площі, визначеної методом HPLC, і, зокрема, не більш ніж 1,0 % площі, визначеної методом HPLC. Придатний метод HPLC для відстежування цієї реакції описаний в наведених нижче прикладах. Продукт, отримуваний на стадії (і), являє собою кислу адитивну сіль проміжного спирту формули (III). Наприклад, коли на стадії (і) як кислоту використовують TFA, кислою адитивною сіллю буде трифторацетатна сіль. Метою процесу на стадії (іі) є отримання нейтральної форми сполуки формули (III). Причиною цього є те, що сполука формули (III) є нестійкою в умовах кислого середовища, і коли робились спроби здійснити на стадії (ііі) відновлення без стадії нейтралізації, було виявлено, що сполука загальної формули (III) розщеплювалася і що в значних кількостях утворювалися різноманітні побічні продукти. Побічні продукти включали продукт окиснення - складний ефір кетокислоти і різноманітні димерні сполуки. Спирт формули (III) є, проте, стійким в умовах нейтрального середовища. Таким чином, незважаючи на те, що відновлення на стадії (ііі) здійснюють, як правило, в умовах кислого середовища, спирт формули (III) відповідним чином додають до відновлювальної суміші повільно, наприклад, протягом кількох годин, з тим, щоб забезпечити цілковиту відсутність надлишку спирту формули (III). Саме таким чином можна уникнути розщеплення спирту формули (III) в умовах кислого середовища, використовуваних для стадії відновлення. Основним продуктом є цільовий продукт формули (І) з лише незначною кількістю продукту окиснення -складного ефіру кетокислоти і мінімальними кількостями димерних домішок. Крім того, реакція відбувається значно швидше. Було виявлено, що відновлення нейтральної форми спирту формули (III) відбувається більш задовільно, якщо спирт формули (III) є суттєво чистим. Дійсно, коли спирт-сирець формули (III) обробляють тріетилсиланом, через кілька годин перемішування при 0 °C спостерігається лише невелика реакція. Коли температуру збільшують до кімнатної температури, реакція дає вихід головним чином продукту окиснення - складного ефіру кетокислоти, хоча також присутні невеликі кількості високомолекулярних домішок. Проте, в цьому випадку сполуку формули (І) не одержують. В протилежність цьому, нейтральний спирт формули (III) в очищеній формі реагує з відновлювальним агентом так само, як і тріетилсилан в умовах кислого середовища, як це описано вище, що забезпечує високий вихід сполуки формули (І) з лише зовсім незначними кількостями продукту окиснення - складного ефіру кетокислоти і без жодних інших домішок. Крім того, реакція триває до повного завершення і, таким чином, є надзвичайно високопродуктивною. Таким чином, важливо забезпечити умови, при яких продукт, отримуваний на стадії (іі), має таку чисту форму, наскільки це можливо, з метою забезпечення повного завершення процесу на стадії (ііі) і виходу чистого продукту. Таким чином, з тим, щоб забезпечити одержання фактично чистої сполуки формули (III), стадія (іі) може включати видалення домішок зі сполуки формули (III). На стадії (іі) сполука формули (III) може бути отримана з її кислої адитивної солі шляхом нейтралізації реакційної суміші. Для нейтралізації сполуки загальної формули (III) на стадії (іі) може бути використана будь-яка придатна для цього основа, але, як правило, використовують водну основу, наприклад, гідроксид натрію, калію або амонію. Водний гідроксид калію виявився особливо зручним вибором основи, оскільки він легко доступний при відносно низькій вартості. В даному варіанті здійснення винаходу видалення домішок можна забезпечити шляхом промивання реакційної суміші водою або водним розчином, наприклад, неорганічної солі, з метою видалення будь-яких водорозчинних домішок, які залишаються в реакційній суміші. Це може бути зроблено до і/або після, однак більш переважно після, нейтралізації реакційної суміші. В альтернативному варіанті здійснення винаходу проміжний спирт загальної формули (III) може бути відокремлений перед тим, як перейти до стадії (ііі). Відокремлення спирту може бути 5 UA 111868 C2 5 10 15 20 25 30 35 40 45 50 55 60 здійснено шляхом видалення продукту, отриманого на стадії (і) у вигляді кислої солі, з реакційної суміші, наприклад, шляхом фільтрування, коли реакція на стадії (і) є фактично завершеною. Фахівець у відповідній галузі техніки знайшов би достатню кількість методів відстежування цієї реакції, щоб визначити час, коли її можна вважати фактично завершеною. Одним з таких методів є HPLC, і, як це зазначалося вище, реакція на стадії (і) може вважатися фактично завершеною, коли вміст сполуки формули (II), яка залишилася в реакційній суміші від процесу на стадії (і), становить 1,0 % площі HPLC хроматограми. Відокремлену кислу сіль можна потім обробити основою, в результаті чого отримують спирт загальної формули (III) у вільній формі, який можна потім розчинити у відповідному розчиннику для використання на стадії (ііі). Можна використати будь-яку придатну для цього основу, але, як правило, використовують водну основу, наприклад, гідроксид натрію, калію або амонію, більш переважно водний гідроксид натрію або калію. Водний гідроксид калію виявився особливо зручним вибором основи, оскільки він легко доступний при відносно низькій вартості. Придатні для здійснення процесу на стадії (ііі) розчинники описані нижче. Як в тому, так і в іншому варіантах доцільно підтримувати низьку температуру на стадіях нейтралізації і відокремлення і/або промивання з метою запобігання руйнування проміжного спирту формули (III) і/або обмеження побічних реакцій до того, як нейтралізацію буде завершено. Було виявлено, що тріетилсилан на стадії (ііі) є найбільш придатним відновлювальним агентом, і, у даному випадку, реакцію проводять в умовах кислого середовища, наприклад, в присутності трифтороцтової кислоти. Відновлення на стадії (ііі) доцільно здійснювати в умовах температури дефлегмації розчинника, яким є переважно галогенезований органічний розчинник, такий як, наприклад, дихлорметан або 1,2-дихлоретан. Можуть також бути застосовані й інші способи відновлення, наприклад, гідрогенізація, в якій, як правило, використовують металевий каталізатор, такий як, наприклад, паладієвий або платиновий. Коли як відновлювальний агент використовують тріетилсилан, молярне співвідношення між тріетилсиланом і сполукою формули (II) може становити від 3:1 до 6:1, наприклад, від 3,5:1 до 5:1, переважно від 4:1 до 5:1, і, як правило, приблизно 4,4:1. Відновлення тріетилсиланом здійснюють, як правило, в умовах кислого середовища, які можна забезпечити, наприклад, шляхом додавання трифтороцтової кислоти, як правило, з надлишком цього реагенту у порівнянні зі сполукою загальної формули (II). Наприклад, число еквівалентів трифтороцтової кислоти по відношенню до сполуки формули (II) може становити від приблизно 2:1 до 4:1, наприклад, від 2,9:1 до 3,5:1. Реакція може бути проведена в умовах дефлегмації і у такому ж самому розчиннику як і на попередніх стадіях. Як зазначалося вище, важливо, щоб сполуку формули (III) додавали до відновлювального агента повільно, і тому процес додавання триватиме, як правило, кілька годин, наприклад, приблизно 4-10 годин, переважно 5-8 годин, а більш переважно приблизно 6 годин. На стадії (ііі) спирт формули (III) доцільно додавати до відновлювальної суміші повільно. Це дозволяє запобігти накопиченню спиртового проміжного продукту в реакційній суміші і зменшити ризик небажаних побічних реакцій. Сполуку формули (III) важко видалити шляхом кристалізації, і, таким чином, бажано переконатися, що реакція відновлення на стадії (ііі) триває до її повного завершення так, щоб перед переходом до остаточної обробки фактично не залишилось жодного спирту загальної формули (III). Як і на інших стадіях реакції, проходження реакції можна відстежувати будь-яким зручним способом, наприклад, з використанням метода хроматографії, такого як метод HPLC, наприклад, метод, приведений в наведених нижче прикладах. На стадії (ііі) реакція вважається фактично завершеною, коли перед переходом до остаточної обробки рівень залишкового спирту становить не більш ніж 0,5 % площі, визначеної методом HPLC. В деяких випадках можуть бути досягнуті і більш низькі рівні ніж цей, наприклад, 0,3, 0,25 %, 0,2 %, 0,15 % або навіть 0,1 % площі, визначеної методом HPLC. Як зазначалося вище, процес на стадії (ііі) можна здійснити з використанням розчину сполуки формули (III), отриманого після нейтралізації, і, необов'язково, промиванням водою. Проте в іншому варіанті здійснення винаходу спирт формули (III) відокремлюють і очищають як це описано перед здійснення процесу на стадії (ііі). У відповідності до додаткового аспекту винаходу, запропонована відокремлена і очищена сполука формули (III), як її визначено вище. Спосіб у відповідності до даного винаходу може включати додаткову стадію: (iv) відокремлення і очищення сполуки формули (І). 6 UA 111868 C2 5 10 15 20 25 30 35 40 45 50 Було виявлено, що більшість основних домішок після завершення процесу можна видалити з реакційної суміші просто шляхом остаточної обробки, яка включає водні промивання з подальшою кристалізацією. Таким чином, стадія (iv) способу може включати стадію промивання реакційної суміші, отримуваної на стадії (ііі), водою або водним розчинником для видалення водорозчинних домішок після завершення процесу відновлення. Стадія (iv) може також включати стадію кристалізації сполуки формули (І) у придатному для цього розчиннику, як правило, у такому розчиннику як, наприклад, етанол або толуол, або їхня суміш. Етанол є особливо придатним розчинником для перекристалізації. Загальний вихід процесу, включаючи стадію кристалізації, становить, як правило, приблизно 65-70 %. Як зазначалося вище, сполука формули (І) являє собою проміжний продукт у виробництві (5-фтор-2-метил-3-хінолін-2-ілметил-індол-1-іл)-оцтової кислоти, і, таким чином, у відповідності до додаткового аспекту даного винаходу, спосіб включає додаткову стадію: (v) перетворення сполуки формули (І) на (5-фтор-2-метил-3-хінолін-2-ілметил-індол-1-іл)оцтову кислоту, причому спосіб включає гідролізацію сполуки формули (І). Може бути використаний або кислотний, або основний гідроліз сполуки формули (І), хоча особлива перевага віддається основному гідролізу. Як правило, гідроліз треба проводити у водному розчині з використанням сильної основи, такої як, наприклад, гідроксид літію, натрію, калію або амонію, більш переважно гідроксид літію, натрію або калію. Проте особливо придатним вважається гідроксид калію. Доцільно, щоб основа являла собою 50 % водний розчин гідроксиду калію. Вміст використовуваної основи становить, як правило, від 1,5 до 4 молярних еквівалентів сполуки формули (І). Доцільно, щоб молярне співвідношення між основою і сполукою формули (І) становило приблизно 2:1. Процес на стадії (v) може бути проведений при підвищеній температурі, наприклад, при температурі від 50 °C до 75 °C, більш переважно від 55 °C до 65 °C, і, як правило, приблизно при 60 °C. Після завершення гідролізу рН реакційної суміші може бути відрегульована до приблизно рН = 6,5-7,5 з метою осадження продукту. Якщо використовують основний гідроліз, реакційну суміш можна підкислити з використанням будь-якої придатної для цього кислоти, наприклад, мінеральних кислот, таких як, наприклад, хлористоводнева, сірчана або фосфорна кислота, органічні кислоти, такі як, наприклад, мурашина кислота або подібна аліфатична карбонова кислота. Хлористоводнева і мурашина кислоти є особливо придатними для цієї цілі. Твердий продукт може бути відокремлений будь-яким придатним для цьогоспособом, наприклад, фільтруванням. Крім того, спосіб може необов'язково включати стадію промивання реакційної суміші органічним розчинником перед підкисленням. Придатні для цього розчинники включають, наприклад, хлоровані розчинники, такі як, наприклад, дихлорметан, і нехлоровані розчинники, такі як, наприклад, 2-метилтетрагідрофуран. Ця стадія є особливо корисною для видалення нейтральних або основних органічних домішок, які не розчинюються в розчині гідроксиду калію. Було виявлено також, що вона є корисною для видалення складного ефіру загальної формули (І), який не прореагував. Було виявлено, що услід удосконаленням до етапу 2, привнесеним способом у відповідності до даного винаходу, продукт стадії (v) можна отримати у формі, яка є достатньо чистою для використання як фармацевтичний продукт, завдяки чому додаткове очищення не потрібно. З метою отримання вихідного матеріалу загальної формули (II), спосіб може включати перед початком стадії (і) додаткові стадії. Таким чином, у відповідності до додаткового аспекту, даний винахід включає, перед стадією (і), процес приготування сполуки формули (II), який включає: введення в реакцію 5-фтор-2-метил-індолу зі сполукою формули (IV): 1 55 де X - відщеплювана група, наприклад, гало-група, така як бромо-група, a R - як це визначено для формули (І). Ця реакція може відбуватися в присутності слабкої основи, такої як, наприклад, карбонат калію або цезію, більш переважно карбонат цезію, в полярному органічному розчиннику, такому як, наприклад, ацетонітрил. 7 UA 111868 C2 5 10 15 20 Доцільно, щоб вміст використовуваного розчинника становив від 7 до 30 л розчинника на 1 кг 5-фтор-2-метил-індолу, більш переважно від 7 до 20 л, наприклад, приблизно від 7 до 15 л, і переважно приблизно 10 л розчинника на 1 кг 5-фтор-2-метил- індолу. Реакція може бути проведена при температурі від приблизно 15 до 30°С, більш переважно при 20-25 °C протягом 10-36 годин, як правило, протягом 18-30 годин, наприклад, приблизно протягом 24 годин, а хід реакції можна відстежувати, наприклад, методом хроматографії, такої як, наприклад, газова хроматографія (GC). Після завершення реакції, сполука формули (II) може бути відокремлена і/або очищена з метою видалення домішок, таких як, наприклад, 5-фтор-2-метил-індол і сполука формули (IV). В альтернативному варіанті здійснення винаходу, достатнім може бути очищення на стадії (iv). Присутність неорганічних солей, отримуваних з вихідного матеріалу загальної формули (IV) як вторинний продукт, є небажаною. Ці неорганічні солі можуть бути видалені шляхом промивання реакційної суміші водою при одночасному підтримуванні продукту формули (II) в органічній фазі. Коли як реакційний розчинник використовують такий розчинник, як, наприклад, ацетонітрил, може бути доцільним замінити його на цій стадії альтернативним, менш полярним розчинником, таким як, наприклад, толуол. Нижче наданий більш детальний опис даного винаходу з посиланням на приклади. В прикладах використані наступні скорочення: TFA Трифтороцтова кислота TES Тріетилсилан Et Етил DCM Дихлорметан В наведених нижче прикладах, а також в усьому описі значення вмісту різних сполук виражені у вигляді % площі, визначеної методом HPLC. Це відноситься до процентного вмісту площі піка, який представляє конкретну молекулу на HPLC хроматограмі. Параметри HPLC узагальнені нижче. Колонка: YMC basic 150 мм 4,6 мм, 5 мкм Об'єм вприскування: 5 мкл Виявлення: УФ @ 220 нм Рухома фаза: Рухома фаза А: 0,1 н. розчин: формат амонію рН 4,0: вода: метанол (1:6:3) Рухома фаза В: 0,1 н. розчин: формат амонію рН 4,0: метанол (1:9) Градієнт: 25 30 35 Швидкість потоку: 1 мл/хв. Температура: 40 °C Час виконання: 37 хв. (включаючи 5- хвилинну стадію відновлення рівноваги) Розріджувач зразка: Ацетонітрил Кількісний аналіз: % площі Приклад 1 - Дослідження способу приготування етилового ефіру (5-фтор-2-метил-3-хінолін2-ілметил-індол-1-іл)-оцтової кислоти, описаного в WO 2005/044260 Як показано вище на схемі 2, етап 2 способу приготування (5-фтор-2-метил-3-хінолін-2ілметил-індол-1-іл)-оцтової кислоти передбачає проведення двох хімічних реакцій: по-перше, реакцію індолацетату з хінолінкарбоксальдегідом в умовах кислого середовища, в результаті чого отримують проміжний спирт формули (III); потім відновлення спирту формули (III) з 1 використанням TFA/TES. Це показано на наведеній нижче схемі реакції, де R - етил, а продукт, отримуваний на етапі 2, являє собою етиловий ефір (5-фтор-2-метил-3-хінолін-2-ілметил-індол1-іл)-оцтової кислоти. 8 UA 111868 C2 5 10 15 20 25 30 35 Згідно способу, описаному в WO 2005/044260, всі реагенти, за виключенням TFA, завантажують у реакційну посудину, після чогоповільно додають кислоту, що призводить до конденсування індолацетату хінолінкарбоксальдегідом. Отриманий спирт потім повільно відновлюють. Нами було виявлено, що основні проблеми цього способу пов'язані з низькою стійкістю проміжного спирту при кімнатній температурі в умовах кислого середовища і його низькою реактивністю по відношенню до реакції відновлення з використанням TES. Під час відновлення відповідно до способу, описаному в WO 2006/092579 або WO 2005/044260 (умови відновлювальної ванни), проміжний спирт знаходиться протягом тривалого часу при кімнатній температурі в умовах кислого середовища, що призводе до утворення домішок, які розщеплюють спирт. Для того, щоб розв'язати цю проблему, була досліджена можливість реалізації альтернативного способу. Приготування проміжного спирту формули (III) Цю сполуку легко приготували шляхом повільного додавання TFA (2 еквіваленти) при приблизно 0 °C до суміші 5-фтор-2-метил-індол-М-етилацетату (у 2 об'ємах толуолу) і розчину хінолінкарбоксальдегіду в метиленхлориді. Незважаючи на той факт, що ця реакція теоретично являє собою реакцію кислотного каталізу, використання TFA у кількості менше ніж 2 еквіваленти призвело до незавершення реакції навіть після подовження часу реакції. Кристалізація проміжного спирту відбувалася під час додавання TFA або на початку часу утримування. Тривалість кристалізації може варіюватися в залежності від якості індолацетату (неочищеного або очищеного), який завантажують, а також від вмісту толуолу в неочищеному розчині індолацетату. Фільтрування суспензії забезпечили 79 % виходу спирту. Цей відокремлений матеріал містив 1 еквівалент TFA і являв собою, можливо, спиртову сіль. Чистий спирт, який не містить солей, може бути отриманий шляхом нейтралізації заздалегідь відокремленого розведеним гідроксидом калію, з подальшою екстракцією в метиленхлориді і випарюванням. Стійкість проміжного спирту З метою визначення стійкості цього спирту було проведено кілька досліджень. Його поведінка була дуже різною в залежності від його чистоти, температури і кислотності суміші. А. Чистий спирт, відокремлений як сіль TFA Чистий спирт (сіль TFA), завантажений в 9 об'ємів DCM, при 0 °C не розчиняється, і суміш являє собою суспензію. Реакцію відстежували методом HPLC, який показав, що розщеплення відбувається повільно, призводячи, головним чином, через 6 годин перемішування до утворення димера (1,7 %), деякої кількості складного ефіру кетокислоти і деякої кількості продукту, отримуваного на етапі 2. Складний ефір кетокислоти має наступну структуру: 9 UA 111868 C2 5 10 15 20 25 30 35 40 45 50 Збільшення вмісту TFA (додатковий 1 еквівалент) призвело до повного розчинення спирту, який розщеплювався трохи швидше, приводячи через 6 годин до утворення іншої димерної домішки (від 2 до 3 %) і деякої кількості складного ефіру кетокислоти + продукту, отримуваного на етапі 2 (від 2 до 3 % кожного). Чистий спирт (сіль TFA) при кімнатній температурі розщеплювався швидше, призводячи через 6 годин до утворення другої димерної домішки (від 5 до 6 %) і деякої кількості складного ефіру кетокислоти + продукту, отриманого на етапі 2 (від 8 до 10 % кожного). Збільшення вмісту TFA призвело до швидшого розчинення з декількома пізніше вимитими домішками і невеликим вмістом складного ефіру кетокислоти і продукту, отримуваного на етапі 2. На сам кінець, можна зробити висновок, що в у мовах кислого середовища (TFA) спирт розщеплюється, призводячи до утворення певних кількостей домішок у 25-28 хвилинному вікні часу елюювання (HPLC). Також можуть бути виявлені (в залежності від умов) деякі кількості складного ефіру кетокислоти і продукту, отримуваного на етапі 2. Швидкість розщеплення збільшується з підвищенням температури і збільшенням вмісту TFA в суміші. В. Неочищений спирт, відокремлений як нейтральний розчин дихлорметану При 0 °C через кілька годин перемішування жодної зміни в профілі HPLC не спостерігали. При кімнатній температурі через 16 годин основною домішкою був складний ефір кетокислоти (11 %), проте жодного сліду продукту, отримуваного на етапі 2, не спостерігали. Спостерігався дуже малі кількості пізніше вимитих домішок ( 98 %). Наступні приклади відносяться до протоколу експериментів лабораторного масштабу, які, проте, були проведені у більшому масштабі. Приклад 3 - Приготування 5-фтор-2-метил-індол-N-етилацетату (технологічний етап 1) Протокол експериментів В реакційну суміш 1,0 кг 5-фтор-2-метиліндолу (1,0 еквівалент, 6,70 моля) і 0,99 кг карбонату цезію (3,02 моля - 0,45 еквівалента) з 9 л ацетонітрила додають при 20-25 °C протягом ~12 годин розчин 1,34 кг етилбромацетату (8,04 моля -1,2 еквівалента) в 1 л ацетонітрила. Через 4 години і через 8 годин проходження реакції здійснюють відповідно два додаткових завантаження карбонату цезію у кількості 0,99 кг кожного (3,02 моля - 0,45 еквівалента). Потім здійснюють остаточне завантаження 0,33 кг карбонату цезію (1,01 моля - 0,15 еквівалента), а через 18 годин додають 0,056 кг етилбромацетату (0,335 моля - 0,15 еквівалента). Реакційну суміш підтримують в умовах перемішування при 20-25 °C до моменту фактичного завершення реакції. З метою розчинення неорганічних солей додають 5 л води. Перемішування підтримують при 20-25 °C до моменту повного розчинення неорганічної солі, після чого реакційну залишають відстоюватися. Органічну фазу випарюють до 3 л. Потім додають толуол (5 л), після чого суміш випарюють до 3 л. Потім до реакційної суміші додають толуол (5 л), після чого її промивають водою (3 л) 11 UA 111868 C2 5 10 15 20 25 30 35 40 45 50 55 для видалення залишкових солей і випарюють до 3 л під вакуумом. Очікуваний вихід: 1,3-1,5 кг (90±5 %). Спосіб у збільшеному масштабі Описаний вище спосіб був здійснений з розміром партій 234 кг 5-фтор-2-метиліндолу. Кількість регенерованого етилового ефіру (5-фтор-2-метиліндол-1-іл)-оцтової кислоти становила 337 кг, а вихід становив 91,3 %, що добре відповідає очікуваному виходу 90±5 %. Приклад 4 - Приготування етилового ефіру (5-фтор-2-метил-3-хінолін-2-ілметил-індол-1-іл)оцтової кислоти (технологічний етап 2) Протокол експериментів До 0,73 кг хінолінкарбоксальдегіду (1,10 еквівалента) і 6,0 л метиленхлориду додають 1,00 кг етилового ефіру (5-фтор-2-метиліндол-1-іл)-оцтової кислоти в 1,83 кг толуолу. Отриманий розчин охолоджують до температури нижче 5 °C, після чого протягом приблизно 2 годин додають 0,97 кг TFA (2 еквіваленти). Після фактичного завершення реакції отриману суспензію нейтралізують до рН = 6-8, підтримуючи температуру нижче 5 °C, шляхом додавання водного розчину КОН в кількості приблизно 10 % маса/маса. Після відстоювання органічну фазу, утримувану при прохолодній температурі, відокремлюють і промивають 2,0 л деіонізованої води. Отриману органічну фазу додають протягом приблизно 6 годин до розчину 2,17 кг тріетилсилану (TES) (4,4 еквівалента) з 1,50 кг трифтороцтової кислоти (TFA) (3,1 еквівалента) в 2,0 л DCM в умовах дефлегмації. Після прополіскування посудини 1,0 л DCM реакційну суміш підтримують в умовах дефлегмації до фактичного завершення процесу. Отриманий розчин охолоджують до 0-5 °C і додають 5,0 л деіонізованої води (5,0 об'ємів). Після відстоювання водну фазу промивають 1,0 л DCM, а рН об'єднаних органічних екстрактів відрегульовують до 6-7 за допомогою розчину КОН (10 % маса/маса) при температурі 0-5 °C. Після досягнення бажаної рН додають 1,0 л розчину К2СО3 (25 % маса/маса), і отриману двохфазну суміш фільтрують крізь целіт. Після прополіскування обладнання 1,0 л DCM суміш залишають відстоюватися, після чого водну фазу випаровують 2,0 л DCM при 0-5 °C. Об'єднані органічні фази промивають 2 × 3,0 л деіонізованої води при 0-25 °C. Органічну фазу випарюють в умовах атмосферного тиску до залишкового об'єму 3,5 л, підтримуючи температуру нижче 80 °C. Після розведення в 3,5 л етанолу суміш випарюють в умовах атмосферного тиску до залишкового об'єму 3,5 л, підтримуючи температуру нижче 80 °C. Потім реакційну суміш знов розводять в 3,5 л етанолу, після чого суміш випарюють в умовах атмосферного тиску до залишкового об'єму 3,5 л, підтримуючи температуру нижче 80 °C. Після підтвердження того, що вміст толуолу не перевищує 5 % маса/маса, суміш охолоджують до 0-5 °C, після чого її утримують при цій температурі протягом 1-2 годин. Потім суміш фільтрують і тричі промивають 2,0 л етанолу (заздалегідь охолодженого до 0-5 °C). Після підтвердження того, що вміст залишкового силану не перевищує 1 % маса/маса, неочищений продукт висушують при 45 °C під вакуумом. Неочищений продукт розчиняють в 12 л етанолу в умовах дефлегмації, освітлюють фільтруванням крізь целіт при температурі не менш ніж 65 °C, а обладнання прополіскують 1,0 л етанолу в умовах дефлегмації (1,0 об'єм). Отриманий розчин охолоджують до 60-65 °C, запалюють і утримують при цій температурі протягом 1 години. Потім суміш охолоджують до 05 °C і утримують при цій температурі протягом 2 годин. Отриману суспензію фільтрують і промивають в 2 × 1,0 л етанолу, охолоджують до 0-5 °C, після чого отриманий продукт просушують під вакуумом при 45 °C. Маса сухого продукту коливалася в межах від 1,04 до 1,28 кг (вихід: 65-80 %). Спосіб у збільшеному масштабі Описаний вище спосіб був здійснений з розміром партій 300 кг етилового ефіру (5-фтор-2метиліндол-1-іл)-оцтової кислоти. Маса регенерованого неочищеного етилового ефіру (5-фтор2-метил-3-хінолін-2-ілметил-індол-1-іл)-оцтової кислоти становила 359 кг. Відповідний вихід становив 74,8 %. Отриманий продукт перекристалізували з етанолу (12 об'ємів) з одночасним високотемпературним фільтруванням крізь целіт при температурі не менш ніж 65 °C. Маса регенерованого продукту становила 334,4 кг - вихід 93,1 % для стадії перекристалізації. Загальний вихід для відновлювального алкілування становив, таким чином, 70 %. Приклад 5 - Приготування (5-фтор-2-метил-3-хінолін-2-ілметил-індол-1-іл)-оцтової кислоти (технологічний етап 3) 12 UA 111868 C2 5 10 Продукт, отриманий в прикладі 2, піддали гідролізу з метою отримання 5-фтор-2-метил-3хінолін-2-ілметил-індол-1-іл)-оцтової кислоти з використанням процесу, аналогічного описаному в WO2005/044260, який здійснювали наступним чином. До 0,598 кг 50 % водного розчину гідроксиду калію (2 еквіваленти з посиланням на етиловий ефір (5-фтор-2-метил-3-хінолін-2-ілметил-індол-1-іл)-оцтової кислоти) додають 9 л очищеної води. В цей розчин додають 1 кг етилового ефіру (5-фтор-2-метил-3-хінолін-2-ілметил-індол-1іл)-оцтової кислоти (2,656 моля). Потім реакційну суміш нагрівають до 60 °C і утримують до моменту завершення реакції гідролізу складного ефіру. В кінці реакції реакційна суміш є однорідною (розчин є мутним). Після остаточної обробки продукт - (5-фтор-2-метил-3-хінолін-2-ілметил-індол-1-іл)-оцтову кислоту - відокремили і виявили, що вміст домішок становить 1,5 % площі HPLC хроматограми. Вихід для етапу 3 коливався в межах приблизно від 91 до 99,5 %. Загальний вихід для етапів 1-3 процесу становив 56 %, що значно більше ніж вихід, отриманий з використанням процесів попереднього етапу 2. 15 ФОРМУЛА ВИНАХОДУ 1. Спосіб одержання сполуки формули (І) N F CH3 N CO2R1 20 , (І) 1 де R - С1-С6алкіл або бензил; причому спосіб включає: і) введення в реакцію сполуки формули (II) F CH3 N CO2R1 25 , (II) 1 де R - як це визначено для формули (І); з 2-хінолінкарбоксальдегідом в умовах кислого середовища і при температурі ≤10 °C; з одержанням кислої адитивної солі сполуки формули (III): HO N F CH3 N CO2R1 30 35 , (III) 1 де R - як це визначено для формули (І); іі) після фактичного завершення реакції на стадії (і), обробку кислої адитивної солі основою, з одержанням спирту формули (III), одночасно підтримуючи температуру ≤10 °C; і ііі) введення в реакцію сполуки формули (III) з відновлювальним агентом з одержанням сполуки формули (І). 1 2. Спосіб за п. 1, який відрізняється тим, що R - С1-С4алкіл. 1 3. Спосіб за п. 2, який відрізняється тим, що R - етил. 4. Спосіб за будь-яким з пунктів 1-3, який відрізняється тим, що реакцію на стадії (і) здійснюють в дихлорметані. 5. Спосіб за будь-яким з пунктів 1-4, який відрізняється тим, що умови кислого середовища на стадії (і) забезпечують за допомогою трифтороцтової кислоти (TFA). 13 UA 111868 C2 5 10 15 20 25 30 35 40 6. Спосіб за п. 5, який відрізняється тим, що TFA присутня в кількості ≥2 моля кислоти на моль сполуки формули (II). 7. Спосіб за будь-яким з пунктів 1-6, який відрізняється тим, що реакцію на стадії (і) здійснюють при температурі приблизно 0-5 °C. 8. Спосіб за будь-яким з пунктів 1-7, який відрізняється тим, що молярне співвідношення між 2хінолінкарбоксальдегідом і сполукою формули (II) становить приблизно 1,1:1. 9. Спосіб за будь-яким з пунктів 1-8, який відрізняється тим, що стадія (іі) включає видалення домішок зі сполуки формули (III). 10. Спосіб за будь-яким з пунктів 1-9, який відрізняється тим, що на стадії (іі) сполуку формули (III) одержують з її кислої адитивної солі шляхом нейтралізації реакційної суміші основою. 11. Спосіб за п. 10, який відрізняється тим, що він додатково включає видалення домішок шляхом промивання реакційної суміші водою або водним розчинником перед і/або після нейтралізації реакційної суміші. 12. Спосіб за будь-яким з пунктів 1-9, який відрізняється тим, що стадія (іі) включає видалення продукту, одержаного на стадії (і) у вигляді кислої солі, з реакційної суміші після фактичного завершення реакції на стадії (і); і обробку відокремленої кислої солі основою, в результаті чого одержують спирт загальної формули (III). 13. Спосіб за будь-яким з пунктів 10-12, який відрізняється тим, що основою є водний гідроксид натрію або калію. 14. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що на стадії (ііі) відновлення здійснюють з використанням триетилсилану. 15. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що він додатково включає додаткову стадію: (iv) відокремлення і очищення сполуки формули (І). 16. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що він додатково включає додаткову стадію (v) перетворення сполуки формули (І) на (5-фтор-2-метил-3-хінолін-2-ілметиліндол-1-іл)-оцтову кислоту, причому спосіб включає гідролізацію сполуки формули (І). 17. Спосіб за п. 16, який відрізняється тим, що гідроліз являє собою основний гідроліз. 18. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що він додатково включає, перед початком стадії (і), одержання сполуки формули (II) з використанням процесу, який включає введення в реакцію 5-фтор-2-метиліндолу зі сполукою формули (IV): 1 X-CH2-COOR , (IV) 1 де X - відщеплювана група, наприклад галогрупа, така як бромогрупа, a R - як це визначено для формули (І). 19. Спосіб за п. 18, який відрізняється тим, що реакція має місце в присутності карбонату цезію в ацетонітрилі. 20. Спосіб за п. 18 або 19, який відрізняється тим, що вміст розчинника становить приблизно 10 об'ємів розчинника на грам 5-фтор-2-метиліндолу. 21. Спосіб за будь-яким з пунктів 18-20, який відрізняється тим, що він додатково включає відокремлення і очищення сполуки формули (II) перед початком стадії (і). 22. Відокремлена і очищена сполука формули (III): HO N F CH3 N CO2R1 45 1 , (III) де R - С1-С6алкіл або бензил. Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of (5-fluoro-2-methyl-3-quinolin-2-ylmethyl-indol-1-yl)-acetic acid esters
Автори англійськоюTonnel, Jacques, Pintus, Tony, Burgos, Alain
Автори російськоюТоннел Жакуэс, Пинтус Тони, Бургос Алаин
МПК / Мітки
МПК: C07D 401/06
Мітки: спосіб, 5-фтор-2-метил-3-хінолін-2-ілметиліндол-1-іл)-оцтової, кислоти, одержання, естерів
Код посилання
<a href="https://ua.patents.su/16-111868-sposib-oderzhannya-esteriv-5-ftor-2-metil-3-khinolin-2-ilmetilindol-1-il-octovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання естерів (5-фтор-2-метил-3-хінолін-2-ілметиліндол-1-іл)-оцтової кислоти</a>
Попередній патент: Фармацевтична композиція і спосіб застосування похідних 4-прегнен-11b-17-21-тріол-3,20-діону
Наступний патент: Сполуки 2-(заміщений феніл)-циклопентан-1,3-діону та їх похідні
Випадковий патент: Вихровий пилоуловлювач












