Фармацевтична композиція і спосіб застосування похідних 4-прегнен-11b-17-21-тріол-3,20-діону
Формула / Реферат
1. Спосіб лікування розладу, пов'язаного з модулюванням глюкокортикоїдного і/або мінералокортикоїдного рецептора, який включає введення пацієнтові, який потребує цього, фармацевтичної композиції, що містить терапевтично ефективну кількість щонайменше однієї сполуки, вибраної з:
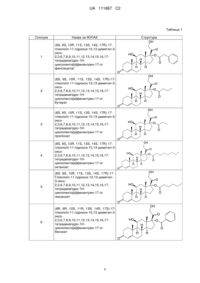
(8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу фенілацетату;
(8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу бутирату;
(8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу пропіонату;
(8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу октаноату;
(8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу гексаноату;
(8R,9R,10S,11R,13R,14R,17S)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу бензоату;
(8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу гептаноату;
(8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу 2-метилпропаноату і
(8R,9R,10S,11R,13R,14R,17S)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу rel-циклопентанкарбоксилату.
2. Спосіб за п. 1, який відрізняється тим, що вказаним розладом є очне захворювання, вибране з підвищеного внутрішньоочного тиску, глаукоми, увеїту, оклюзії вени сітківки, дегенерації жовтої плями, діабетичної ретинопатії, різних форм макулярного набряку, післяопераційного запалення, запальних станів кон'юнктиви вій і кон'юнктиви очного яблука, рогівки і переднього сегменту очного яблука, таких як алергічні кон'юнктивіти, рожеві вугри на очах, сухість очей, блефарити, відшарування сітківки, дисфункції мейбомієвої залози, точкового поверхневого кератиту, кератиту з оперізувальним герпесом, іриту, цикліту, деяких інфекційних кон'юнктивітів, травми рогівки через хімічний, радіаційний або термічний опік, проникнення чужорідних тіл, алергії та їх комбінацій.
3. Спосіб за п. 1, який відрізняється тим, що вказаним розладом є очне захворювання, вибране з: рожевих вугрів на очах, сухості очей, блефариту, дисфункції мейбомієвої залози.
4. Фармацевтична композиція, що містить носій і сполуку, вказану в п. 1.
5. Фармацевтична композиція за п. 4, яка відрізняється тим, що призначена для локального офтальмічного застосування.
6. Спосіб за п. 1, який відрізняється тим, що вказана сполука є (8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1H-циклопента[а]фенантрен-17-ілу бензоатом.
7. Спосіб за п. 1, який відрізняється тим, що вказана сполука є (8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу гексаноатом.
8. Спосіб за п. 1, який відрізняється тим, що вказана сполука є (8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу октаноатом.
9. Спосіб за п. 1, який відрізняється тим, що вказана сполука є (8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу фенілацетатом.
10. Спосіб за п. 1, який відрізняється тим, що вказана сполука є (8S,9S,10R,11S,13S,14S,17R)-17-глiкoлoїл-11-гiдpoкcи-10,13-димeтил-3-oкco-2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1H-циклопента[а]фенантрен-17-ілу бутиратом.
11. Спосіб за п. 1, який відрізняється тим, що вказана сполука є (8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу пропіонатом.
12. Спосіб за п. 1, який відрізняється тим, що вказана сполука є (8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу гептаноатом.
13. Спосіб за п. 1, який відрізняється тим, що вказана сполука є (8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу 2-метилпропаноатом.
14. Спосіб за п. 1, який відрізняється тим, що вказана сполука є (8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу rel-циклопентанкарбоксилатом.
Текст
Реферат: Даний винахід стосується фармацевтичних композицій, що містять похідні 4-прегнен-11β-17-21тріол-3,20-діону, способів їх одержання і їх застосування як фармацевтичних засобів як модуляторів глюкокортикоїдних рецепторів (GR) і/або мінералокортикоїдних рецепторів (MR). Даний винахід стосується, зокрема, застосування цих сполук і їх фармацевтичних композицій для лікування станів, пов'язаних з глюкокортикоїдними рецепторами (GR) і/або мінералокортикоїдними рецепторами (MR). UA 111867 C2 (12) UA 111867 C2 UA 111867 C2 5 10 15 20 25 30 35 40 45 50 55 СПОРІДНЕНА ЗАЯВКА У даній заявці заявляється пріоритет за попередньою заявкою на видачу патенту США з серійним номером 61/558775, поданої 11 листопада 2011 року, повний опис якої включений у цей документ шляхом посилання. ОБЛАСТЬ ТЕХНІКИ Даний винахід відноситься до фармацевтичних композицій, що містять похідні 4-ПРЕГНЕН11β-17-21-триол-3,20-діона, і до їх застосування як фармацевтичних засобів як модуляторів глюкокортикоїдних рецепторів (GR) і∕або мінералокортикоїдних рецепторів (MR). Даний винахід відноситься, зокрема, до застосування цих сполук і їх фармацевтичних композицій для лікування станів, пов'язаних з модуляцією глюкокортикоїдними рецепторами (GR) і∕або мінералокортикоїдних рецепторів (MR). РІВЕНЬ ТЕХНІКИ Агоністи глюкокортикоїду (GC) є класом протизапальних сполук, придатних для лікування багаточисельних очних хвороб, включаючи підвищений внутрішньоочний тиск, глаукому, увеїт, оклюзію вени сітківки, дегенерацію жовтої плями, діабетичну ретинопатію, різні форми макулярного набряку, післяопераційне запалення, запальні стани кон'юнктиви вій і кон'юнктиви очного яблука, рогівки і переднього сегменту очного яблука, такі як алергічні кон'юнктивіти, рожеві вугрі на очах, сухість очей, блефарити, відшаровування сітківки, дисфункцію мейбомієвої залози (MGD), точковий поверхневий кератит, кератит з опоясуючим герпесом, ірит, цикліт, деякі інфекційні кон'юнктивіти, травму рогівки через хімічний, радіаційний або термічний опік, проникнення чужорідних тіл, алергію або їх комбінації. Обмеженням потенційного застосування і побічний ефект загрози втрати зору для традиційних терапій GC агоністами (наприклад, флуоцинолона ацетонідом) є очна гіпертензія, яка, ймовірно, створюється за рахунок підвищеного опору потоку водянистої вологи очей через трабекулярну мережу. Механізм опору витоку, викликаного GC агоністом, і подальшої очної гіпертензії зрозумілий не до кінця. Таким чином, у даної області існує необхідність модулювання GC за рахунок дії агоніста або антагоніста GC рецепторів, яке не призводить до підвищення внутрішньоочного тиску або інших побічних ефектів, і вона описана у цьому документі. КОРОТКИЙ ОПИС ВИНАХОДУ Було відкрито застосування групи похідних 4-ПРЕГНЕН-11β-17-21-триол-3,20-діона як сильнодіючих і селективних глюкокортикоїдних рецепторів (GR) та∕або мінералокортикоїдних рецепторів (MR). У зв'язку з цим, сполуки, описані у цьому документі, застосовні для лікування широкого ряду розладів, пов'язаних з модулюванням глюкокортикоїдних рецепторів (GR) або мінералокортикоїдних рецепторів (MR). Термін "модулятор", що використовується у цьому документі, включає, але не обмежуючись цим: агоніст, антагоніст, зворотний агоніст, зворотний антагоніст, частковий агоніст, частковий антагоніст рецептора. Даний винахід відноситься до фармацевтичної композиції, що містить похідні 4-ПРЕГНЕН11β-17-21-триол-3,20-діона, придатної при лікуванні одного або більше очних захворорювань. Описані також способи лікування одного або більше очних захворювань. Очні захворювання, що підлягають лікуванню за допомогою сполук і/або композицій, описаних у цьому документі, включають, але не обмежуючись цим, підвищений внутрішньоочний тиск, глаукому, увеїт, оклюзію вени сітківки, дегенерацію жовтої плями, діабетичну ретинопатію, різні форми макулярного набряку, післяопераційне запалення, запальні стани кон'юнктиви вій і кон'юнктиви очного яблука, рогівки і заднього сегменту очного яблука, такі як алергічні кон'юнктивіти, рожеві угрі на очах, сухість очей, блефарити, відшаровування сітківки, дисфункцію мейбомієвої залози (MGD), точковий поверхневий кератит, кератит з опоясуючим герпесом, ірит, цикліт, деякі інфекційні кон'юнктивіти, травму рогівки через хімічний, радіаційний або термічний опік, проникнення чужорідних тіл, алергію або їх комбінації. Даний винахід відноситься до способу лікування розладу, пов'язаного з модулюванням глюкокортикоїдних рецепторами (GR) та∕або мінералокортикоїдних рецепторів (MR), якийвключає введення терапевтично ефективної кількості композиції, що містить похідну 4ПРЕГНЕН-11β-17-21-триол-3,20-діона. Отже, сполуки за даним винаходом є застосовними у медицині, наприклад, при лікуванні людей із захворюваннями і станами, які полугшуються модулюванням глюкокортикоїдних або мінералокортикоїдних рецепторів. В одному аспекті даного винаходу представлена фармацевтична композиція похідного 4ПРЕГНЕН-11β-17-21-триол-3,20-діона, вибраного із групи сполук з Таблиці 1: 1 UA 111867 C2 Таблиця 1 Сполука Назва за ІЮПАК 1 (8S, 9S, 10R, 11S, 13S, 14S, 17R)-17гліколоїл-11-гідрокси-10,13-диметил-3оксо2,3,6,7,8,9,10,11,12,13,14,15,16,17тетрадекагідро-1Hциклопента[a]фенантрен-17-іл фенілацетат 2 (8S, 9S, 10R, 11S, 13S, 14S, 17R)-17гліколоїл-11-гідрокси-10,13-диметил-3оксо2,3,6,7,8,9,10,11,12,13,14,15,16,17тетрадекагідро-1Hциклопента[a]фенантрен-17-іл бутират 3 (8S, 9S, 10R, 11S, 13S, 14S, 17R)-17гліколоїл-11-гідрокси-10,13-диметил-3оксо2,3,6,7,8,9,10,11,12,13,14,15,16,17тетрадекагідро-1Hциклопента[a]фенантрен-17-іл пропіонат 4 (8S, 9S, 10R, 11S, 13S, 14S, 17R)-17гліколоїл-11-гідрокси-10,13-диметил-3оксо2,3,6,7,8,9,10,11,12,13,14,15,16,17тетрадекагідро-1Hциклопента[a]фенантрен-17-іл октаноат 5 6 Структура (8S, 9S, 10R, 11S, 13S, 14S, 17R)-17 Гліколоїл-11-гідрокси-10,13-диметил3-оксо2,3,6,7,8,9,10,11,12,13,14,15,16,17тетрадекагідро-1Hциклопента[a]фенантрен-17-іл гексаноат (8R, 9R, 10S, 11R, 13R, 14R, 17S)-17гліколоїл-11-гідрокси-10,13-диметил-3оксо2,3,6,7,8,9,10,11,12,13,14,15,16,17тетрадекагідро-1Hциклопента[a]фенантрен-17-іл бензоат 2 UA 111867 C2 Сполука 7 15 20 25 30 (8S, 9S, 10R, 11S, 13S, 14S, 17R)-17гліколоїл-11-гідрокси-10,13-диметил-3оксо2,3,6,7,8,9,10,11,12,13,14,15,16,17тетрадекагідро-1Hциклопента[a]фенантрен-17-іл 2метилпропаноат 9 10 (8S, 9S, 10R, 11S, 13S, 14S, 17R)-17гліколоїл-11-гідрокси-10,13-диметил-3оксо2,3,6,7,8,9,10,11,12,13,14,15,16,17тетрадекагідро-1Hциклопента[a]фенантрен-17-іл гептаноат 8 5 Назва за ІЮПАК Структура (8R, 9R, 10S, 11R, 13R, 14R, 17S)-17гліколоїл-11-гідрокси-10,13-диметил-3оксо2,3,6,7,8,9,10,11,12,13,14,15,16,17тетрадекагідро-1Hциклопента[a]фенантрен-17-іл relциклопентанкарбоксилат Термін "фармацевтично прийнятні солі" відноситься до солей або комплексів, які зберігають задану біологічну активність описаних вище сполук і мають мінімальні небажані токсикологічні ефекти або не мають їх. "Фармацевтично прийнятні солі", згідно даного винаходу, включають терапевтично активні нетоксичні сольові форми основ або кислот, які можуть утворювати сполуки Таблиці 1. Сольова форма приєднання кислоти для сполуки за даним винаходом, яка зустрічається у вільній формі у вигляді основи, може бути одержана обробкою вказаної вільної основи відповідною кислотою, такою як неорганічна кислота, така як, наприклад, хлороводнева кислота, бромоводнева кислота, сірчана кислота, фосфорна кислота, азотна кислота і тому подібні; або органічна кислота, така як, наприклад, оцтова, гідроксіоцтова, пропанова, молочна, піровиноградна, малонова, фумарова кислота, малеїнова кислота, щавлева кислота, винна кислота, бурштинова кислота, яблучна кислота, аскорбінова кислота, бензойна кислота, дубильна кислота, памоєва кислота, лимонна, метилсульфонова, етансульфонова, бензолсульфонов, мурашина і тому подібні (Handbook of Pharmaceutical Salts, P.Heinrich Stahal& Camille G. Wermuth (ред.), Verlag Helvetica Chemica Acta-Zьrich, 2002 р., 329-345). Сольова форма приєднання основи сполуки за даним винаходом, яка знаходиться у своїй кислотній формі, може бути одержана обробкою цієї кислоти відповідною основою, такою як неорганічна основа, наприклад, гідроксид натрію, гідроксид магнію, гідроксид калію, гідроксид кальцію, аміак і тому подібними; або органічною основою, таким як, наприклад, L-аргінін, етаноламін, бетаїн, бензатин, морфолін і тому подібними. (Handbook of Pharmaceutical Salts, P.Heinrich Stahal& Camille G. Wermuth (ред.), Verlag Helvetica Chemica Acta-Zьrich, 2002 р., 329345). Сполуки за даним винаходом і їх солі можуть бути у формі сольвата, яка включена у рамки даного винаходу. Такі сольвати включають, наприклад, гідрати, алкоголяти і тому подібні. Сполуки, описані у даному документі, придатні для лікування різних очних захворювань, включаючи, але не обмежуючись цим, підвищений внутрішньоочний тиск, глаукому, увеїт, оклюзію вени сітківки, дегенерацію жовтої плями, діабетичну ретинопатію, різні форми макулярного набряку, післяопераційне запалення, запальні стани кон'юнктиви вій і кон'юнктиви очного яблука, рогівки і переднього сегменту очного яблука, такі як алергічні кон'юнктивіти, 3 UA 111867 C2 5 10 15 20 25 30 35 40 45 50 55 60 рожеві вугрі на очах, сухість очей, блефарити, відшаровування сітківки, дисфункцію мейбомієвої залози (MGD), точковий поверхневий кератит, кератит з опоясуючим герпесом, ірит, цикліт, деякі інфекційні кон'юнктивіти, травму рогівки через хімічний, радіаційний або термічний опік, проникнення чужорідних тіл, алергію або їх комбінації. В іншихваріантах реалізації даного винаходу представлені способи лікування розладів, пов'язаних з модулюванням глюкокортикоїдних рецепторів (GR) і/або мінералокортикоїдних рецепторів (MR). Такі способи можуть бути здійснені, наприклад, введенням суб'єктові, який потребує цього, терапевтично ефективної кількості, щонайменше, однієї сполуки Таблиці 1 або будь-якої її комбінації, або її фармацевтично прийнятних солей. У іншому варіанті реалізації представлені фармацевтичні композиції, що містять щонайменше одну сполуку Таблиці 1 у фармацевтично прийнятному носієві. Сполуки, описані у даному документі, можуть бути введені у фармацевтично ефективних дозах. Такі дози зазвичай є мінімальною дозою, необхідною для досягнення заданого терапевтичного ефекту. Як правило, такі дози знаходяться у діапазоні від близько 1 мг/день до близько 1000 мг/день; бажаніше, у діапазоні від близько 10 мг/день до близько 500 мг/день. У іншому ілюстративному варіанті реалізації сполука або сполуки можуть бути присутніми у композиції або рецептурі в діапазоні від близько 0,5 мг/кг/день до близько 100 мг/кг/день або від близько 1 мг/кг/день до близько 100 мг/кг/день. Проте фактична кількість сполуки, що підлягає введенню, у будь-якому конкретному випадку визначає лікар, який лікує, і бере до уваги релевантні обставини, такі як вік і маса пацієнта, загальний фізичний стан пацієнта, важкість очного захворювання і спосіб введення. У деяких випадках дозу підвищують в індивідуальному порядку. В іншому ілюстративному варіанті реалізації представлені фармацевтичні композиції, що містять щонайменше одну сполуку у фармацевтично прийнятному носієві. Фармацевтичні композиції можуть бути використані у формі твердої речовини, розчину, емульсії, дисперсії, міцели, ліпосоми і тому подібного, де одержана композиція містить одну або більше сполук, описаних у даному документі, як активний компонент, у суміші з органічним або неорганічним носієм або допоміжною речовиною, придатною для ентерального або парентерального застосування. Одна або більше сполук можуть бути змішані, наприклад, із звичайними нетоксичними, фармацевтично прийнятними носіями для пігулок, гранул, капсул, супозиторіїв, розчинів, емульсій, суспензій і будь-яких інших форм, придатних для застосування. Носії, що можуть бути використані, включають глюкозу, лактозу, гуміарабік, желатин, маніт, крохмальний клейстер, трисилікат магнію, тальк, кукурудзяний крохмаль, кератин, колоїдний діоксид кремнію, картопляний крохмаль, сечовину, тригліцериди середньої довжини ланцюга, декстрани та інші носії, придатні для використання у виробництві препаратів у твердій, напівтвердій, або рідкій формі. Крім того, можуть бути використані допоміжні речовини, стабілізуючі, згущуючі і фарбувальні засоби і віддушки. Сполуки, описані у даному документі, включають у фармацевтичні композиції у кількостях, достатніх для одержання заданого ефекту в процесі або стані захворювання. У іншому варіанті реалізації сполуки, описані у даному документі, можуть бути введені перорально у будь-якій прийнятній формі, такій як пігулки, рідина, капсули, порошок і тому подібні. Проте можуть бути бажані або необхідні інші способи, зокрема, якщо пацієнт страждає нудотою. Такі інші шляхи можуть включати, без виключення, трансдермальний, парентеральний, підшкірний, інтраназальний, інтратекальний, внутрішньом'язовий, внутрішньовенний і внутрішньоректальний способи доставки. Додатково, можуть бути розроблені композиції для сповільненого вивільнення активної сполуки протягом заданого періоду часу, або для ретельного контролю кількості вивільнених ліків на заданий час протягом курсу терапії. Композиції, призначені для перорального застосування, можуть бути отримані відповідно до будь-якого способу, відомого у даній області для виробництва фармацевтичних композицій, і такі композиції можуть містити один або більше агентів, вибраних з групи, що складається з підсолоджувачів, таких як сахароза, лактоза або сахарин, смакових добавок, таких як перцева м'ята, масло гаультерії або вишні, барвники і консервуючі агенти, з метою одержання фармацевтично простих і приємних на смак композицій. Пігулки, що містять сполуки, описані у даному документі, у суміші з нетоксичними фармацевтично прийнятними допоміжними речовинами також можуть бути вироблені відомими способами. Фармацевтичні композиції можуть бути у формі стерильної суспензії для ін'єкцій. Ця суспензія може бути складена у композицію відповідно до відомих способів, з використанням прийнятних диспергуючих або змочуючих агентів і суспендуючих засобів. Стерильні препарати для ін'єкцій можуть також бути стерильним розчином або суспензією у нетоксичному, 4 UA 111867 C2 5 10 15 20 25 30 35 40 45 50 55 60 прийнятному для парентерального введення розчиннику або розчиннику, наприклад, у вигляді розчину в 1,3-бутандіолі. Як розчинник або суспендуюче середовище зазвичай використовують стерильні нелеткі масла. З цією метою може бути використане будь-яке позбавлене смаку нелетке масло, включаючи синтетичні моно- або дигліцериди, жирні кислоти (включаючи олеїнову кислоту), рослинні олії природного походження, такі як кунжутна олія, кокосова олія, арахісова олія, бавовняна олія і так далі, або синтетичний жирний наповнювач, такий як етилолеат або тому подібні. За необхідності можуть бути включені буферні розчини, консерванти, антіоксиданти і тому подібні. Сполуки за винаходом можна також вводити у формі супозиторіїв для ректального введення лікарського засобу. Ці композиції можуть бути одержані за допомогою змішування сполук за винаходом з прийнятним не дратівливим наповнювачем, таким як масло какао, синтетичні гліцеридні ефіри поліетиленгліколей, які є твердими при звичайних температурах, але розріджуються і/або розчиняються у ректальній порожнині з вивільненням лікарського засобу. Фактична кількість сполуки, що підлягає введенню, у будь-якому конкретному випадку визначає лікар, який лікує і бере до уваги релевантні обставини, такі як важкість стану, вік і маса пацієнта, загальний фізичний стан пацієнта, причина стану і спосіб введення. У цьому документі описані сполуки, здатні модулювати глюкокортикоїдні рецептори (GR) і/або мінералокортикоїдні рецептори (MR). Сполуки, описані у цьому документі, можуть мати вищу активацію GR і/або зв'язуючу силу, у порівнянні з такою сполукою, як кортизол. Отже, ці сполуки можуть ефективно лікувати очні показання. Ці сполуки можуть бути додатково метаболізовані ферментами естерази в очах з утворенням природного агоніста кортизолу, зменшуючи за допомогою цього ризик очної гіпертензії. Кортизол, що залишився в очах і в організмі, далі метаболізується до неактивних сполук природними дегідроксилазами і іншими ферментами, забезпечуючи безпечний терапевтичний підхід. У пацієнтів природний ендогенний агоніст GC кортизол (гідрокортизон) має мінімальну дію на внутрішньоочний тиск при локальному нанесенні у вигляді очних крапель, у порівнянні з синтетичними GC, такими як дексаметазон, преднізолон і флуорометолон (Cantrill et al., 1975 р.). Додаткове підкріплення загальної чудової безпеки кортизолу як терапевтичного засобу є тим фактом, що різні місцеві гідрокортизонові композиції на даний час продаються безпосередньо споживачам, без рецепту. Не обмежуючись якою-небудь конкретною теорією, було несподівано виявлено, що описані у цьому документі сполуки можуть мати вище модулювання глюкокортикоїдного рецептора, ніж кортизол, завдяки модифікації у 17-положенні молекули кортизолу. При використанні у даному документі, термін "терапевтично ефективна кількість" означає кількість фармацевтичної композиції, що викликає біологічну або медичну реакцію у пацієнта, який потребує цього, видиму для дослідника, ветеринара, лікаря або іншого клініциста. У деяких варіантах реалізації суб'єкт, який потребує цього, є ссавцем. У деяких варіантах реалізації ссавець є людиною. Допоміжні речовини можуть бути, наприклад, (1) інертними розчинниками, такими як карбонат кальцію, лактоза, фосфат кальцію або фосфат натрію; (2) гранулюючими засобами і засобами для покращення розпадаємості пігулок, такими як кукурудзяний крохмаль, картопляний крохмаль або альгінова кислота; (3) зв'язуючими агентами, такими як трагакантова камедь, кукурудзяний крохмаль, желатин або гуміарабік, і (4) змащуючими агентами, такими як стеарат магнію, стеаринова кислота або тальк. Пігулки можуть бути без оболонки або вони можуть бути вкриті за допомогою відомих методів, щоб уповільнити дезінтеграцію і абсорбцію у шлунково-кишковому тракті і, тим самим, забезпечити пролонговану дію протягом тривалішого періоду. Наприклад, для тимчасової затримки може бути використаний такий матеріал, як гліцерилмоностеарат або гліцерилдистеарат. У деяких випадках композиції для перорального застосування можуть бути у формі твердих желатинових капсул, де сполуки змішані з інертним твердим розчинником, наприклад, карбонатом кальцію, фосфатом кальцію або каоліном. Вони можуть бути також у формі м'яких желатинових капсул, де сполуки змішаніз водним або масляним середовищем, наприклад, арахісовою олією, рідким парафіном або оливковою олією. Сполуки, описані у даному документі, також можуть бути введені у вигляді офтальмічно прийнятних рецептур або композицій. Офтальмічно прийнятну рідину змішують таким чином, щоб її можна було наносити локально на очі. Слід по можливості максимізувати комфорт, не дивлячись на те, що інколи з міркувань складу композиції (наприклад, стабільності) може знадобитись нижчий рівень комфорту, ніж оптимальний. Якщо комфорт не можна максимізувати, то рідку композицію слід складати так, щоб рідина була прийнятною для пацієнта для місцевого офтальмічного застосування. Додатково, офтальмічно прийнятна рідина 5 UA 111867 C2 5 10 15 20 має бути упакована для разового використання або містити консервант для запобігання забрудненню при багатократному застосуванні. Для офтальмічних застосувань, розчини або лікарські засоби часто випускають з використанням фізіологічного сольового розчину як основного носія. рН офтальмічних розчинів повинен бажано підтримуватися на зручному рівні за допомогою відповідної буферної системи. Композиції можуть також містити звичайні фармацевтично прийнятні консерванти, стабілізатори і поверхнево-активні речовини. Консерванти, які можуть бути використані в офтальмічних композиціях, описаних у цьому документі, включають, але не обмежуючись цим, бензалконію хлорид, хлорбутанол, тимерозал, фенілртуті ацетат і фенілртуті нітрат. Прийнятна поверхнево-активна речовина включає, наприклад, Tween 80. Так само, в офтальмічних препаратах, описаних у цьому документі, можуть бути використані різні придатні рідкі носії. Ці носії включають, але не обмежуючись цим, полівініловий спирт, повідон, гідроксипропілметилцелюлозу, полоксамери, карбоксиметилцелюлозу, гідроксіетилцелюлозу і очищену воду. Регулювальники тонічності можуть бути додані за потреби або для зручності. Вони включають, але не обмежуючись цим, солі, зокрема, хлорид натрію, хлорид калію, маніт і гліцерин, або інші придатні офтальмічно прийнятні регулювальники тонічності. Різні буфери і середовища для регулювання рН можуть бути використані у тих межах, в яких одержана композиція залишається офтальмічно прийнятною. Відповідно, буфери включають ацетатні буфери, цитратні буфери, фосфатні буфери і буфери борату. Для регулювання рН цих композиції за необхідності можуть бути використані кислоти або основи. В одному з ілюстративних варіантів реалізації офтальмічна композиція, описана у даному документі, може містити компоненти, використані у наступних кількостях, які перераховані у Таблиці 2. 25 Таблиця 2 Інгредієнт активний інгредієнт консервант середовище регулювальник тонічності буфер регулювальник pH Антіоксидант поверхнево-активна речовина очищена вода 30 35 40 Кількість (% мас./об.) близько 0,001-5 0-0,10 0-40 1-10 0,01-10 по мірі необхідності до pH 4,5-7,5 по мірі необхідності по мірі необхідності по мірі необхідності до 100 % В інших варіантах реалізації офтальмічно прийнятна рідина може бути складена в композицію для внутрішньоочної ін'єкції. Сполуки, описані у цьому документі, можуть бути складені в композиції у вигляді рідини, гелевидної пасти або подібних форм для внутрішньоочної ін'єкції. Додатково, ці сполуки можуть бути складені у композиції зі стійким вивільненням або контрольованим вивільненням внутрішньоочних імплантатів, що містять біорозкладані полімери, такі як полімолочна кислота, полігліколева кислота, їх комбінації і тому подібні. Деякі ілюстративні композиції можуть містити комбінацію двох або більше сполук, описаних у цьому документі. Залежно від конкретного очного захворювання або набору захворювань, що підлягають лікуванню, можуть бути складені композиції з різними співвідношеннями сполук. Оскільки індивідуальні пацієнти можуть знаходитися в широкому діапазоні важкості симптомів, і кожна композиція має власні унікальні терапевтичні характеристики, то точний спосіб введення і використане дозування для кожного пацієнта залишається на розсуд лікаря, який лікує. ДЕТАЛЬНИЙ ОПИС Слід розуміти, що викладений вище загальний опис і наступний детальний опис є лише прикладними і поясненювальними, і не обмежують заявлений винахід. При використанні у цьому документі, застосування однини включає множину, якщо спеціально не обумовлене інше. 6 UA 111867 C2 5 10 15 20 25 30 Наступні приклади представлені лише для ілюстративних цілей і не призначені і не мають тлумачитися як такі, що обмежують даний винахід яким-небудь чином. Фахівцям у даній області зрозуміло, що можуть бути зроблені різні зміни і модифікації наступних прикладів, не виходячи за межі загальної ідеї або рамок даного винаходу. Фахівцям у даній області вочевидь, що індивідуальні ізомерні форми можуть бути одержані розділенням їх сумішей звичайним способом. Наприклад, у разі діастереоізомерних ізомерів може бути використане хроматографічне розділення. Приклад 1 Активність трансактивації глюкокортикоїдного рецептора для кортизолу і 17-ефірних похідних Активуючу активність відносно глюкокортикоїдного рецептора (GR) оцінили за допомогою клітинної лінії HeLa, що містить MMTV-bla репортер (MMTV-bla HeLa CELLSENSOR®, Invitrogen Corp., Карлсбад, штат Каліфорнія). Клітинну лінію стійко трансфікували експресійним конструктом, що містить кДНК β-лактамази, керованим чутливим елементом, раніше ідентифікованим як чутливий елемент глюкокортикоїдного рецептора. Результати одного з експериментів, виконаного у двох екземплярах для 9 сполук і контрольної сполуки, дексаметазону, представлені у Таблиці 3. Усі аналізи виконали у 10точкових дозозалежних ефектах, використовуючи серії напівлогарифмічних розбавлень, починаючи з максимальної концентрації сполуки 100 нМ. Сполуки інкубували протягом 5 годин. Активація ендогенного GR призводить до експресії репортерної β-лактамази, яку виявляють перетворенням субстрата FRET у форматі логометричного аналізу. Цей функціональний аналіз дозволяє вимірювати рецепторний агонізм сполук і може бути використаний для визначення активності і селективності сполуки. Відтворюваність аналізу визначили розрахунком значень Z' для необроблених зразків у порівнянні з максимальним стимулюванням. Значення Z' було більше 0,6, вказуючи на хорошу відтворюваність даного аналітичного формату. Декілька сполук продемонстрували дозозалежне стимулювання сигнального шляху GR (Таблиця 3). Сполуки Таблиці 1 продемонстрували приблизно у 30 разів вищу активність, у порівнянні з первинною молекулою кортизолу. Таблиця 3: Активність глюкокортикоїдного рецептора. Представлені значення EC 50 (нМ) і Z' для контрольної сполуки, дексаметазону, і сполук, випробуваних у режимі агоністів. Таблиця 3: Сполука EC50 GR (нМ) % Активації при 100 нМ Z’ Дексаметазон 1,05 1,35 7 Контрольна сполука 88 0,87 0,87 UA 111867 C2 EC50 GR (нМ) Z’ 85 0,87 1,97 86 0,87 3,25 65 0,87 6,04 47 0,87 6,31 8 % Активації при 100 нМ 1,41 Сполука 85 0,87 UA 111867 C2 EC50 GR (нМ) % Активації при 100 нМ Z’ 7,07 84 0,87 41,6 43 0,87 >100 15 0,87 >100 Сполука 5 0,87 кортизол 5 10 15 Приклад 2 Активність трансактивації мінералокортикоїдного рецептора для кортизолу і 17-ефірних похідних Активуючу активність відносно мінералокортикоїдного рецептора (MR) оцінили за допомогою клітинної лінії HEK 293T, що містить UAS-bla репортер (UAS-bla HEK 293T CELLSENSOR®). Цю клітинну лінію стійко котрансфікували з експресійним конструктом, що містить кДНК β-лактамази під керуванням активуючої послідовності (UAS) і іншого експресійного конструкта, кодуючого для гібридного білка GAL4(DBD)-MR(LBD). Результати одного з експериментів, виконаного у двох екземплярах для 9 сполук і контрольної сполуки, альдостерону, у режимі агоністів, представлені у Таблиці 4. Усі аналізи виконали в 10-точкових дозозалежних ефектах, використовуючи серії напівлогарифмічних розбавлень, починаючи з максимальної концентрації сполуки 100 нМ. Сполуки інкубували протягом 16 годин. Активація гібридного білка GAL4(DBD)-MR(LBD) призводить до експресії репортерної β-лактамази, яку виявляють перетворенням субстрата FRET у форматі логометричного аналізу. Цей функціональний аналіз дозволяє вимірювати рецепторний агонізм сполук і може бути використаний для визначення активності і селективності сполуки. Відтворюваність аналізу визначили розрахунком значень Z' для необроблених зразків у порівнянні з максимальним 9 UA 111867 C2 5 стимулюванням. Значення Z' було більше 0,6, вказуючи на хорошу відтворюваність даного аналітичного формату. Декілька сполук продемонстрували дозозалежне стимулювання сигнального шляху MR (Таблиця 4) Таблиця 4. Активність мінералокортикоїдного рецептора. Представлені значення EC50 (нМ) і Z' для контрольної сполуки, альдостерону, і сполук, випробуваних у режимі агоністів. Таблиця 4. Сполука EC50 GR (нМ) 0,47 % Активації при 100 нМ Контрольна сполука Z’ 0,77 Альдостерон 2,85 81 0,77 2,90 75 0,77 2,94 77 0,77 Кортизол 10 UA 111867 C2 EC50 GR (нМ) Z’ 76 0,77 5,27 72 0,77 5,68 64 0,77 7,46 62 0,77 9,29 11 % Активації при 100 нМ 3,17 Сполука 56 0,77 UA 111867 C2 EC50 GR (нМ) 10 15 20 25 30 35 Z’ 62 0,77 >100 5 % Активації при 100 нМ 15,6 Сполука 27 0,77 Приклад 3 Лікування підвищеного внутрішньоочного тиску 58-річний чоловік прийшов до офтальмолога для звичайного огляду. Лікар виявив, що у пацієнта спостерігається підвищений внутрішньоочний тиск і існує високий ризик подальших ускладнень. Пацієнтові прописали застосування місцевої рідкої композиції, що містить одну зі сполук у Таблиці 1, один раз на день у кожне око. Пацієнт повернувся для наступного огляду через три місяці. При вимірі внутрішньоочного тиску було відмічено, що у пацієнта спостерігається понижений внутрішньоочний тиск. Приклад 4 Лікування очного роздратування 38- річний чоловік звернувся до офтальмолога із скаргою на розлад у правому оці. Лікар виявив, що праве око пацієнта запалене і почервоніло. Пацієнтові прописали застосування місцевої рідкої композиції, що містить одну зі сполук у Таблиці 1, двічі на день у праве око. Пацієнт повернувся для наступного огляду через тиждень. При огляді правого ока було відмічено, що почервоніння зникло, а пацієнт указав, що роздратування прошло. Якщо не вказане інше, всі числа, що виражають кількості компонентів, властивості, такі як молекулярна маса, умови реакції і так далі, використані в описі і формулі винаходу, слід розуміти як змінені у всіх випадках терміном "близько". Відповідно, якщо не вказане інше, числовими параметрами, представленими в описі і прикладеній формулі винаходу, є наближення, які можуть варіюватися залежно від заданих властивостей, які можуть бути одержані за допомогою даного винаходу. Принаймні, але не як спроба обмежити застосування принципу еквівалентів до рамок формули винаходу, кожен числовий параметр повинен тлумачитися щонайменше у світлі числа представлених значущих цифр і шляхом застосування звичайних стандартних методик. Не дивлячись на те, що числові діапазони і параметри, представлені вище у широкому описі даного винаходу, є наближеннями, числові значення, представлені вище в конкретних прикладах, записані максимально точно. Проте будь-яке числове значення, по суті, містить певні помилки, що неминуче виникають із стандартних відхилень, що містяться в їх відповідних випробувальних вимірюваннях. Терміни в однині, використані у контексті опису даного винаходу (особливо у контексті наступної формули винаходу) слід тлумачити як такі, що включають однину і множину, якщо у даному документі не вказане інше, або вочевидь не спростовується контекстом. Перерахування діапазонів значень у цьому документі служить лише як скорочений спосіб індивідуального згадування кожного окремого значення, що входить у цей діапазон. Якщо у цьому документі не вказане інше, то кожне окреме значення є включеним у цей опис так, якщо б воно було згадане індивідуально. Усі способи, описані у цьому документі, можуть бути виконані будь-яким відповідним чином, якщо у цьому документі не вказане інше, або якщо вочевидь не 12 UA 111867 C2 5 10 15 20 25 30 спростовується контекстом. Застосування будь-якого або всіх прикладів, або ілюстративного формулювання (наприклад, "такий як"), представлених у цьому документі, призначене лише для кращого освітлення цього винаходу і не призначене для обмеження рамок цього винаходу, заявлених іншим чином. Жодні формулювання цього опису не слід тлумачити як такі, що вказують на не заявлений елемент, суттєвий для практичного здійснення даного винаходу. Угрупування альтернативних елементів або варіантів реалізації даного винаходу, описаних у цьому документі, не слід тлумачити як обмеження. Кожен член групи може бути згаданий і заявлений індивідуально або у будь-якій комбінації з іншими членами цієї групи або іншими елементами, представленими у цьому документі. Передбачається, що один або більше членів групи можуть бути включені або виключені з групи з міркувань зручності і/або патентоспроможності. При виникненні будь-якого такого включення або виключення, мається на увазі, що цей опис містить цю групу у модифікованому вигляді, здійснюючи, таким чином, письмовий опис всіх груп Маркуша, що використовуються в прикладеній формулі винаходу. У даному документі описані деякі варіанти реалізації даного винаходу, включаючи найкращий спосіб, відомий авторам винаходу для здійснення цього винаходу. Звичайно, при прочитанні вищевикладеного опису фахівцям у даної області стануть очевидні варіанти цих описаних варіантів реалізації. Автори винаходу очікують, що досвідчені фахівці здійснять такі варіанти належним чином, і автори винаходу вважають, що цей винахід може бути здійснений на практиці іншим способом, ніж конкретно описаний у цьому документі. Відповідно, даний винахід включає всі модифікації і еквіваленти предмету обговорення, викладеного у формулі винаходу, прикладеній до цього документа, наскільки допускається застосовними правовими нормами. Більше того, будь-які комбінації описаних вище елементів у всіх можливих варіаціях є включеними у даний винахід, якщо у цьому документі не вказане інше, або якщо це вочевидь не спростовується контекстом. На завершення, слід розуміти, що варіанти реалізації даного винаходу, описані у цьому документі, є ілюстраціями принципів даного винаходу. Інші модифікації, які можуть бути використані, входять у рамки даного винаходу. Так, як приклад, але не обмеження, альтернативні конфігурації даного винаходу можуть бути використані відповідно до вказівок, представлених у даному документі. Відповідно, даний винахід не обмежується у точності тим, що показано і описано у даному документі. ФОРМУЛА ВИНАХОДУ 35 40 45 50 55 1. Спосіб лікування розладу, пов'язаного з модулюванням глюкокортикоїдного і/або мінералокортикоїдного рецептора, який включає введення пацієнтові, який потребує цього, фармацевтичної композиції, що містить терапевтично ефективну кількість щонайменше однієї сполуки, вибраної з: (8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу фенілацетату; (8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу бутирату; (8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу пропіонату; (8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу октаноату; (8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу гексаноату; (8R,9R,10S,11R,13R,14R,17S)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу бензоату; (8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу гептаноату; (8S,9S,10R,11S,13S,14S,17R)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу 2метилпропаноату і 13 UA 111867 C2 5 10 15 20 25 30 35 40 (8R,9R,10S,11R,13R,14R,17S)-17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо2,3,6,7,8,9,10,11,12,13,14,15,16,17-тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу relциклопентанкарбоксилату. 2. Спосіб за п. 1, який відрізняється тим, що вказаним розладом є очне захворювання, вибране з підвищеного внутрішньоочного тиску, глаукоми, увеїту, оклюзії вени сітківки, дегенерації жовтої плями, діабетичної ретинопатії, різних форм макулярного набряку, післяопераційного запалення, запальних станів кон'юнктиви вій і кон'юнктиви очного яблука, рогівки і переднього сегменту очного яблука, таких як алергічні кон'юнктивіти, рожеві вугри на очах, сухість очей, блефарити, відшарування сітківки, дисфункції мейбомієвої залози, точкового поверхневого кератиту, кератиту з оперізувальним герпесом, іриту, цикліту, деяких інфекційних кон'юнктивітів, травми рогівки через хімічний, радіаційний або термічний опік, проникнення чужорідних тіл, алергії та їх комбінацій. 3. Спосіб за п. 1, який відрізняється тим, що вказаним розладом є очне захворювання, вибране з: рожевих вугрів на очах, сухості очей, блефариту, дисфункції мейбомієвої залози. 4. Фармацевтична композиція, що містить носій і сполуку, вказану в п. 1. 5. Фармацевтична композиція за п. 4, яка відрізняється тим, що призначена для локального офтальмічного застосування. 6. Спосіб за п. 1, який відрізняється тим, що вказана сполука є (8S,9S,10R,11S,13S,14S,17R)17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17тетрадекагідро-1H-циклопента[а]фенантрен-17-ілу бензоатом. 7. Спосіб за п. 1, який відрізняється тим, що вказана сполука є (8S,9S,10R,11S,13S,14S,17R)17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу гексаноатом. 8. Спосіб за п. 1, який відрізняється тим, що вказана сполука є (8S,9S,10R,11S,13S,14S,17R)17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу октаноатом. 9. Спосіб за п. 1, який відрізняється тим, що вказана сполука є (8S,9S,10R,11S,13S,14S,17R)17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу фенілацетатом. 10. Спосіб за п. 1, який відрізняється тим, що вказана сполука є (8S,9S,10R,11S,13S,14S,17R)17-глiкoлoїл-11-гiдpoкcи-10,13-димeтил-3-oкco-2,3,6,7,8,9,10,11,12,13,14,15,16,17тетрадекагідро-1H-циклопента[а]фенантрен-17-ілу бутиратом. 11. Спосіб за п.1, який відрізняється тим, що вказана сполука є (8S,9S,10R,11S,13S,14S,17R)17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу пропіонатом. 12. Спосіб за п. 1, який відрізняється тим, що вказана сполука є (8S,9S,10R,11S,13S,14S,17R)17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу гептаноатом. 13. Спосіб за п. 1, який відрізняється тим, що вказана сполука є (8S,9S,10R,11S,13S,14S,17R)17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу 2-метилпропаноатом. 14. Спосіб за п. 1, який відрізняється тим, що вказана сполука є (8S,9S,10R,11S,13S,14S,17R)17-гліколоїл-11-гідрокси-10,13-диметил-3-оксо-2,3,6,7,8,9,10,11,12,13,14,15,16,17тетрадекагідро-1Н-циклопента[а]фенантрен-17-ілу rel-циклопентанкарбоксилатом. 45 Комп’ютерна верстка М. Мацело Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical compositions and methods of use of 4-rpegenen-11b-17-21-triol-3,20-dione derivatives
Автори англійськоюEdelman, Jeffrey L., Nehme, Alissar
Автори російськоюЭдэльман Джэффри Л., Нэхмэ Алиссар
МПК / Мітки
МПК: A61P 27/02, A61K 31/575
Мітки: фармацевтична, застосування, композиція, 4-прегнен-11b-17-21-тріол-3,20-діону, спосіб, похідних
Код посилання
<a href="https://ua.patents.su/16-111867-farmacevtichna-kompoziciya-i-sposib-zastosuvannya-pokhidnikh-4-pregnen-11b-17-21-triol-320-dionu.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція і спосіб застосування похідних 4-прегнен-11b-17-21-тріол-3,20-діону</a>