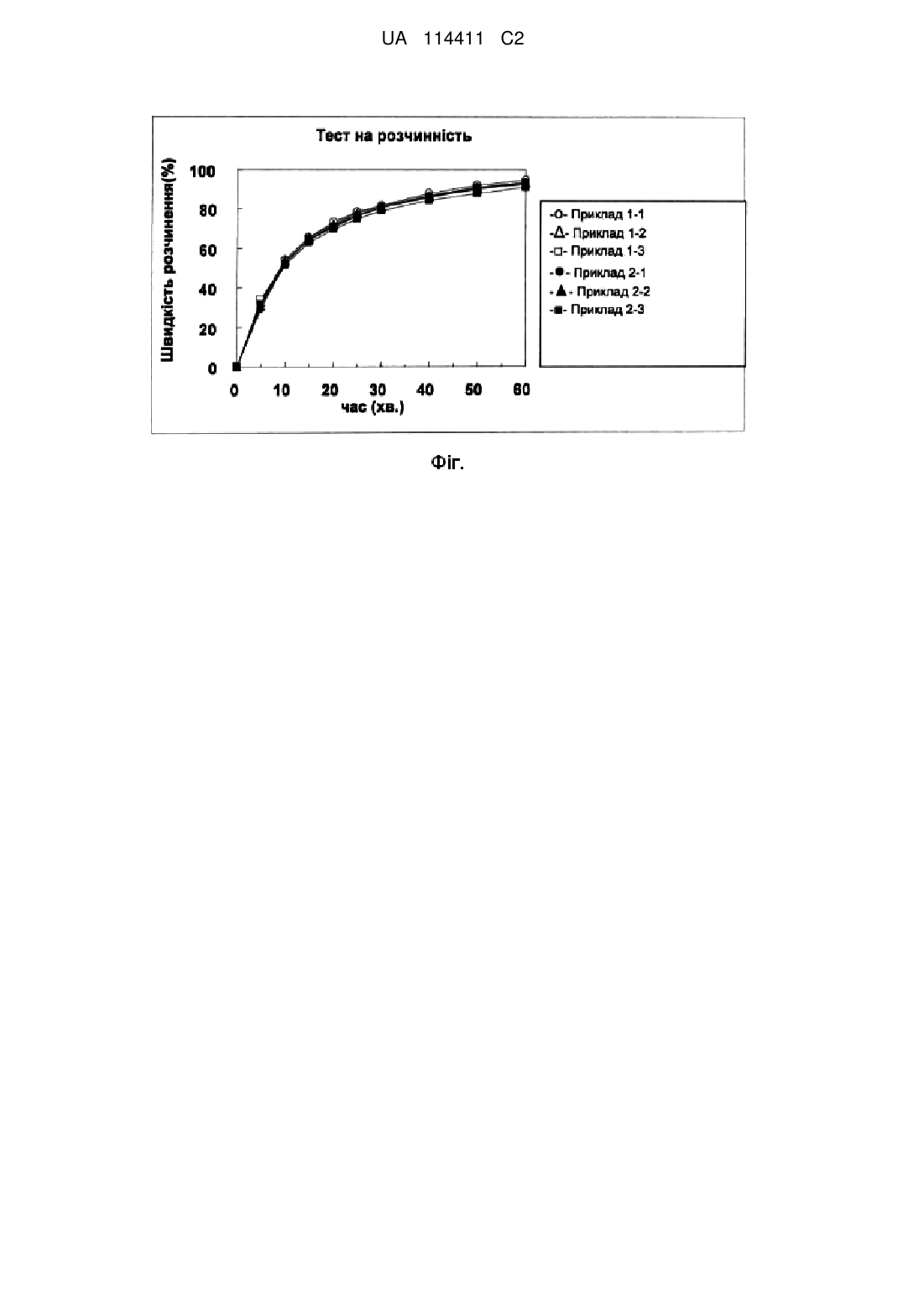
Таблетка, що містить 7-[4-(4-бензо[b]тіофен-4-іл-піперазин-1-іл)бутокси]-1н-хінолін-2-он або його сіль
Формула / Реферат
1. Таблетка, що містить 7-[4-(4-бензо[b]тіофен-4-іл-піперазин-1-іл)бутокси]-1Н-хінолін-2-он або його сіль як активний інгредієнт, ексципієнт (а), зв'язуючу речовину (b), дезінтегруючий агент (с) та змащувальну речовину (d),
де ексципієнт (а) є щонайменше однією складовою, вибраною з групи, що включає лактозу, кукурудзяний крохмаль та мікрокристалічну целюлозу;
зв'язувальна речовина (b) є гідроксипропілцелюлозою;
дезінтегрувальний агент (с) є щонайменше однією складовою, вибраною з групи, що включає низькозаміщену гідроксипропілцелюлозу, кроскармелозу натрію та карбоксиметилкрохмаль натрію; та
змащувальна речовина (d) є стеаратом магнію.
2. Таблетка за п. 1, де таблетка є таблеткою без покриття, що містить:
0,05-25 мас. % 7-[4-(4-бензо[b]тіофен-4-іл-піперазин-1-іл)бутокси]-1Н-хінолін-2-ону або його солі;
10-98,5 мас. % ексципієнта (а);
0,1-20 мас. % зв'язувальної речовини (b);
1-25 мас. % дезінтегрувального агента (с); та
0,1-10 мас. % змащувальної речовини (d), відносно до маси таблетки без покриття.
3. Таблетка за п. 1 або 2, де на 1 мас. частину 7-[4-(4-бензо[b]тіофен-4-іл-піперазин-1-іл)бутокси]-1Н-хінолін-2-ону або його солі, таблетка містить:
1-2000 мас. частин ексципієнта (а);
0,01-100 мас. частин зв'язувальної речовини (b);
0,1-500 мас. частин дезінтегрувального агента (с); та
0,01-50 мас. частин змащувальної речовини (d).
4. Таблетка за будь-яким одним з пп. 1-3, яка додатково містить шар покриття на її поверхні.
5. Таблетка за п. 4, яка додатково містить барвник (e) у шарі покриття, де барвник (e) містить оксид заліза і таблетка містить 0,1-50 мас. % барвника (e) відносно до маси шару покриття.
6. Таблетка за будь-яким одним з пп. 1-5, яку одержують формуванням у таблетку гранульованої речовини, одержаної за допомогою вологого гранулювання.
7. Таблетка за будь-яким одним з пп. 1-6, де таблетка не містить повідону або кросповідону.
8. Спосіб одержання таблетки, який включає стадії:
(1) гранулювання суміші, що містить 7-[4-(4-бензо[b]тіофен-4-іл-піперазин-1-іл)бутокси]-1Н-хінолін-2-он або його сіль, ексципієнт (а), зв'язувальну речовину (b) та дезінтегрувальний агент (с), та наступне примішування до суміші змащувальної речовини (d); та
(2) формування одержаної суміші у таблетку,
де ексципієнт (а) є щонайменше однією складовою, вибраною з групи, що включає лактозу, кукурудзяний крохмаль та мікрокристалічну целюлозу;
зв'язувальна речовина (b) є гідроксипропілцелюлозою;
дезінтегрувальний агент (с) є щонайменше однією складовою, вибраною з групи, що включає низькозаміщену гідроксипропілцелюлозу, кроскармелозу натрію та карбоксиметилкрохмаль натрію; та
змащувальна речовина (d) є стеаратом магнію.
9. Спосіб одержання таблетки за п. 8, який додатково включає стадію:
(3) змішування покривної речовини, барвника (e) та рідкого середовища з одержанням суміші, і нанесення покриття на поверхню таблетки з використанням суміші для покриття.
Текст
Реферат: Винахід стосується таблетки, що містить як активний інгредієнт 7-[4-(4-бензо[b]тіофен-4-ілпіперазин-1-іл)бутокси]-1Н-хінолін-2-он або його сіль як активний інгредієнт, ексципієнти, такі як лактоза, кукурудзяний крохмаль і мікрокристалічна целюлоза; дезінтегрувальні агенти, такі як низькозаміщена гідроксипропілцелюлоза, кроскармелоза натрію та карбоксиметилкрохмаль натрію; зв'язувальну речовину, таку як гідроксипропілцелюлоза; змащувальну речовину, таку як стеарат магнію; та що додатково містить шар покриття. UA 114411 C2 (12) UA 114411 C2 UA 114411 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки Представлений винахід стосується таблетки, що містить 7-[4-(4-бензо[b]тіофен-4-ілпіперазин-1-іл)бутокси]-1H-хінолін-2-он або його сіль як активний інгредієнт. Попередній рівень техніки 7-[4-(4-Бензо[b]тіофен-4-іл-піперазин-1-іл)бутокси]-1H-хінолін-2-он (надалі згадується як Сполука (I)) або її сіль, відомий своєю дією як частковий агоніст дофамінового рецептора D2, антагоніст серотонінового рецептора 5-HT2A та антагоніст адренергічного рецептора α1, а також як інгібітор захоплення серотоніну (або інгібітор зворотного захоплення серотоніну) (Патентний документ 1), і має широкий терапевтичний спектр у лікуванні захворювань центральної нервової системи (зокрема, шизофренії). Перелік документів Патентна література Патентний документ 1: Не розглянута Японська патентна заявка № 2006-316052 Скорочений опис винаходу Проблеми, що вирішує винахід Ціль представленого винаходу полягає у забезпеченні таблетки, що містить Сполуку (I) або її сіль як активний інгредієнт і має надзвичайну здатність до дезінтегрування, стабільність при зберіганні та високу світлостійкість. Вирішення проблеми Винахідники представленого винаходу здійснили різноманітні дослідження у спробах вирішити вищезазначену проблему і виявили, що таблетка, що містить Сполуку (I) або її сіль як активний інгредієнт і додатково, що містить лактозу, кукурудзяний крохмаль, мікрокристалічну целюлозу або подібний ексціпієнт; низькозаміщену гідроксипропілцелюлозу, натрію кроскармелозу, карбоксиметилкрохмаль натрію або подібний дезінтегрувальний агент; і гідроксипропілцелюлозу або подібну зв'язувальну речовину, проявляє надзвичайні здатність до дезінтегрування і стабільність при зберіганні. Винахідники представленого винаходу також виявили, що можна досягти підвищеної світлостійкості за допомогою нанесення шару покриття, що містить барвник. Представлений винахід був завершений через додаткові дослідження на основі отриманих даних, і стосується наступних пунктів. Пункт 1. Таблетки, що містить 7-[4-(4-бензо[b]тіофен-4-іл-піперазин-1-іл)бутокси]-1H-хінолін2-он або його сіль як активний інгредієнт. Пункт 2. Таблетки відповідно до Пункту 1, що додатково містить: ексціпієнт (a), зв'язувальну речовину (b), дезінтегрувальний агент (c) та змащувальну речовину (d), де ексціпієнт (a) є щонайменше однією складовою, вибраною з групи, що включає цукри, цукрові спирти, крохмалі та целюлози; зв'язувальна речовина (b) є похідною целюлози; дезінтегрувальний агент (c) є щонайменше однією складовою, вибраною з групи, що включає похідні целюлози та похідні крохмалю; та змащувальна речовина (d) є стеаратом. Пункт 3. Таблетки відповідно до Пункту 2, де ексціпієнт (a) є щонайменше однією складовою, вибраною з групи, що включає лактозу, кукурудзяний крохмаль та мікрокристалічну целюлозу; зв'язувальна речовина (b) є гідроксипропілцелюлозою; дезінтегрувальний агент (c) є щонайменше однією складовою, вибраною з групи, що включає низькозаміщену гідроксипропілцелюлозу, натрію кроскармелозу та карбоксиметилкрохмаль натрію; і змащувальна речовина (d) є стеаратом магнію. Пункт 4. Таблетки відповідно до Пункту 2 або 3, де таблетка є таблеткою без покриття, що містить: 0,05 - 25 мас. % 7-[4-(4-бензо[b]тіофен-4-іл-піперазин-1-іл)бутокси]-1H-хінолін-2-ону або його солі; 10 - 98,5 мас. % ексціпієнта (a); 0,1 - 20 мас. % зв'язувальної речовини (b); 1 - 25 мас. % дезінтегрувального агента (c); та 0,1 - 10 мас. % змащувальної речовини (d), по відношенню до маси таблетки без покриття. Пункт 5. Таблетки відповідно до будь-якого одного із Пунктів 2 - 4, де на 1 мас. частину 7-[4(4-бензо[b]тіофен-4-іл-піперазин-1-іл)бутокси]-1H-хінолін-2-ону або його солі, таблетка містить: 1 - 2000 мас. частин ексціпієнта (a); 1 UA 114411 C2 5 10 15 20 25 30 35 40 45 50 55 60 0,01 - 100 мас. частин зв'язувальної речовини (b); 0,1 - 500 мас. частин дезінтегрувального агента (c); та 0,01 - 50 мас. частин змащувальної речовини (d). Пункт 6. Таблетки відповідно до будь-якого одного із Пунктів 1 - 5, яка додатково містить шар покриття на її поверхні. Пункт 7. Таблетки відповідно до Пункту 6, яка додатково містить барвник (e) у шарі покриття, де барвник (e) містить оксид заліза, і таблетка містить 0,1 - 50 мас. % барвника (e) по відношенню до маси шару покриття. Пункт 8. Таблетки відповідно до будь-якого одного із Пунктів 1 - 7, яку одержують шляхом формування у таблетку, гранульованої речовини, одержаної шляхом вологого гранулювання. Пункт 9. Таблетки відповідно до будь-якого одного із Пунктів 1 - 8, де таблетка не містить повідону або кросповідону. Пункт 10. Способу одержання таблетки, що містить стадії: (1) гранулювання суміші, що містить 7-[4-(4-бензо[b]тіофен-4-іл-піперазин-1-іл)бутокси]-1Hхінолін-2-он або його сіль, ексціпієнт (a), зв'язувальну речовину (b) і дезінтегрувальний агент (c), та наступне змішування цієї суміші зі змащувальною речовиною (d); і (2) формування одержаної суміші у таблетку, де ексціпієнт (a) є щонайменше однією складовою, вибраною з групи, що включає цукри, цукрові спирти, крохмалі та целюлози; зв'язувальна речовина (b) є похідною целюлози; дезінтегрувальний агент (c) є щонайменше однією складовою, вибраною з групи, що включає похідні целюлози і похідні крохмалю; та змащувальна речовина (d) є стеаратом. Пункт 11. Способу одержання таблетки відповідно до Пункту 10, що додатково містить стадію: (3) змішування покривного агента, барвника (e) і рідкого середовища, з одержанням суміші, і нанесення покриття на поверхню таблетки, використовуючи суміш. Корисний ефект винаходу Таблетка представленого винаходу проявляє надзвичайну здатність до дезінтегрування, стабільність при зберіганні та високу світлостійкість, таким чином, що вона може бути ефективно використовуватись у галузі медицини. Короткий опис фігур Фіг. є графіком, що ілюструє результати тесту на розчинення таблеток, одержаних у Прикладах від 1-1 до 1-3 і Прикладах від 2-1 до 2-3. Опис втілень Таблетка представленого винаходу містить Сполуку (I) або її сіль як активний інгредієнт. В цьому документі, таблетка представленого винаходу може бути таблеткою без покриття, що не має нанесеного на неї шару покриття, або таблеткою з покриттям, що має шар покриття на її поверхні. Крім того, таблетка представленого винаходу може використовуватись як таблетка, що розпадається у ротовій порожнині. Сполука (I) або її сіль можуть бути одержані за допомогою відомого способу, наприклад, того, що описаний у Японській не розглянутій Патентній заявці № 2006-316052, або способу на основі цього. Солі Сполуки (I) особливим чином не обмежуються, за умови, що вони є фармакологічно прийнятними. Переважні приклади солей включають: солі металів, такі як солі лужних металів (наприклад, солі натрію та солі калію), солі лужно-земельних металів (наприклад, солі кальцію та солі магнію), солі неорганічних основ, такі як солі амонію, карбонати лужних металів (наприклад, карбонат літію, карбонат калію, карбонат натрію та карбонат цезію), гідрокарбонати лужних металів (наприклад, гідрокарбонат літію, гідрокарбонат натрію та гідрокарбонат калію), та гідроксиди лужних металів (наприклад, гідроксид літію, гідроксид натрію, гідроксид калію та гідроксид цезію); солі органічних основ, такі як три(нижчі)алкіламіни (наприклад, триметиламін, триетиламін та N-етилдіізопропіламін), піридин, хінолін, піперидин, імідазол, піколін, диметиламінопіридин, диметиланілін, N-(нижчий)алкіл-морфолін (наприклад, Nметилморфолін), 1,5-діазабіцикло[4.3.0]нон-5-ен (DBN), 1,8-діазабіцикло[5.4.0]ундец-7-ен (DBU), 1,4-діазабіцикло[2.2.2]октан (DABCO); солі неорганічних кислот, такі як гідрохлорид, гідробромід, сульфат, нітрат і фосфат; солі органічних кислот, такі як форміат, ацетат, пропіонат, оксалат, малонат, сукцинат, фумарат, малеат, лактат, малат, цитрат, тартрат, карбонат, пікрат, метансульфонат, етансульфонат, п-толулсульфонат і глутамат; та подібні. Сполука (I) або її сіль у наведених вище формах може використовуватись окремо або у комбінації двох або декількох. 2 UA 114411 C2 5 10 15 20 25 30 35 40 45 50 55 60 Вміст Сполуки (I) або її солі переважно складає приблизно 0,05 - 25 мас. %, та більш переважно приблизно 0,1 - 15 мас. % по відношенню до маси таблетки (маси таблетки без покриття до нанесення покриття, коли таблетка є таблеткою з покриттям). Таблетка представленого винаходу переважним чином містить добавки, такі як ексціпієнт (a), зв'язувальну речовину (b), дезінтегрувальний агент (c) і змащувальну речовину (d). Приклади ексціпієнтів (a) включають, наприклад, цукор, такий як фруктоза, м'який білий цукор, цукроза, порошкоподібна цукроза, лактоза, порошкоподібний гідрогенізований мальтозний крохмальний сироп, і мальтоза; цукрові спирти, такі як D-маніт, D-сорбіт, ксиліт, еритрит, мальтит; крохмаль, такий як пшеничний крохмаль, кукурудзяний крохмаль і картопляний крохмаль; похідні крохмалю, такі як декстрин, бета-циклодекстрин; целюлозу або її похідну, таку як мікрокристалічна целюлоза, порошкоподібна целюлоза, етилцелюлоза, карбоксиметилцелюлоза (кармелоза), натрію карбоксиметилцелюлоза (натрію кармелоза) і натрію мікрокристалічна целюлоза/кармелоза; кремнієву кислоту або її сіль, таку як слабка безводна кремнієва кислота, водний діоксид кремнію, діоксид кремнію, силікат кальцію, силікат магнію та алюмінометасилікат магнію; каолін; оксид титану; оксид магнію; тальк; осаджений карбонат кальцію; безводний двоосновний фосфат кальцію. Ці ексціпієнти (a) можуть використовуватись окремо або у комбінації двох або декількох. Серед них, перевага надається цукру, цукровому спирту, крохмалю і целюлозі і більша перевага надається лактозі, мікрокристалічній целюлозі і кукурудзяному крохмалю. Вміст ексціпієнта (a) особливим чином не обмежується, і переважно складає приблизно 10 98,5 мас. % по відношенню до маси таблетки (коли таблетка з покриттям, маси таблетки без покриття), більш переважно приблизно 20 - 95 %, і найбільш переважно приблизно 30 - 90 мас. % . Кількість ексціпієнта (a) особливим чином не обмежується, і переважно складає приблизно 1 - 2000 мас. частин на 1 мас. частину Сполуки (I) або її солі, і більш переважно приблизно 3 1800 мас. частин. Встановлюючи вміст та кількість ексціпієнта (a), які описані вище, можна покращити продуктивність. Приклади зв'язувальної речовини (b) включають цукрозу; м'який білий цукор; прежелатинізований крохмаль; частково прежелатинізований крохмаль; целюлозу або її похідні, такі як мікрокристалічна целюлоза, метилцелюлоза, етилцелюлоза, натрію карбоксиметилцелюлоза (натрію кармелоза), гідроксиетилцелюлоза, гідроксиетилметилцелюлоза, гідроксипропілцелюлоза, низькозаміщена гідроксипропілцелюлоза, гідроксипропілметилцелюлоза (гіпромелози, такі як гіпромелоза 2208, гіпромелоза 2906 і гіпромелоза 2910); інші полісахариди, такі як аравійська камедь, порошкоподібна аравійська камедь, агар, порошкоподібний агар, гуарова смола, трагакант, порошкоподібний трагакант, пулулан і пектин; полімери на основі акрилової кислоти, такі як спів-полімер L метакрилової кислоти, спів-полімер LD метакрилової кислоти, спів-полімер S метакрилової кислоти, дисперсія спів-полімера етилакрилату-метилметакрилату, спів-полімер E аміноалкілметакрилату та спів-полімер RS аміноалкілметакрилату; альгінат натрію; очищений желатин; порошок гідролізованого желатину; карбоксивініловий полімер; кополівідон; повідон; полівініловий спирт. Ці зв'язувальні речовини (b) можуть використовуватись окремо або у комбінації двох або декількох. Серед них, перевага надається похідній целюлози і більша перевага надається гідроксипропілцелюлозі. Слід зазначити, що якщо до складу як зв'язувальна речовина (b) входить повідон, одержана таблетка проявляє тенденцію до зниженої світлостійкості і стабільності при зберіганні. Таким чином, більш бажано, щоб цей компонент практично не входив до складу. Вміст зв'язувальної речовини (b) особливим чином не обмежений, і переважно складає приблизно 0,1 - 20 мас. % по відношенню до маси таблетки (коли таблетка з покриттям, до маси таблетки без покриття), і більш переважно приблизно 0,5 - 5 мас. % . Кількість зв'язувальної речовини (b) особливим чином не обмежується, і переважно складає приблизно 0,01 - 100 мас. частин на 1 мас. частину Сполуки (I) або її солі, і більш переважно приблизно 0,1 - 50 мас. частин. Встановлюючи вміст і кількість зв'язувальної речовини (b), як описано вище, можна покращити продуктивність і здатність до дезінтегрування. Приклади дезінтегрувальних агентів (c) включають крохмаль або його похідні, такі як пшеничний крохмаль, кукурудзяний крохмаль, картопляний крохмаль, частково прежелатинізований крохмаль, карбоксиметилкрохмаль натрію і гідроксипропілкрохмаль; целюлоза або її похідні, такі як мікрокристалічна целюлоза, карбоксиметилцелюлоза (кармелоза), карбоксиметилцелюлоза кальцію (кармелоза кальцію), кроскармелоза натрію і низькозаміщена гідроксипропілцелюлоза; кросповідон; альгінову кислоту; і бентоніт. Ці 3 UA 114411 C2 5 10 15 20 25 30 35 40 45 50 55 дезінтегрувальні агенти (c) можуть використовуватись окремо або у комбінації двох або декількох. Серед них, перевага надається крохмалю або його похідним, і целюлозі або її похідним, і більша перевага надається карбоксиметилкрохмалю натрію, кармелозі кальцію, кроскармелозі натрію і низькозаміщеній гідроксипропілцелюлозі. Слід зазначити, що коли до складу входить кросповідон, одержана таблетка проявляє тенденцію до зниженої світлостійкості і стабільності при зберіганні. Таким чином, більш бажано, щоб цей компонент практично не входив до складу. В представленому описі цього документу, термін "низькозаміщена гідроксипропілцелюлоза" означає похідну целюлози, що включає гідроксипропоксильні групи кількістю приблизно від 5 до 16 %. Кількість гідроксипропоксильних груп у низькозаміщеній гідроксипропілцелюлозі може бути виміряна за допомогою способу, наведеного, наприклад, у Японській Фармакопеї. Низькозаміщену гідроксипропілцелюлозу можна одержати за допомогою відомого у цій галузі способу, або можна також використати її комерційно доступний продукт. Приклади комерційно доступних продуктів низькозаміщеної гідроксипропілцелюлози включають, але не обмежуються ними, "серії LH" і "серії NBD", виробництва Shin-Etsu Chemical Co., Ltd. Крім того, у представленому описі, термін "гідроксипропілцелюлоза" означає похідну целюлози, що включає гідроксипропоксильні групи, кількістю приблизно від 50 до 85 %. Кількість гідроксипропоксильних груп у гідроксипропілцелюлозі може бути виміряна за допомогою способу, наведеного, наприклад, у Японській Фармакопеї. Гідроксипропілцелюлозу можна одержати за допомогою відомого у цій галузі способу, або можна також використати її комерційно доступний продукт. Приклади комерційно доступних продуктів гідроксипропілцелюлози включають, але не обмежуються ними, "серії HPC", виробництва Nippon Soda Co., Ltd.; і "серії Klucel", виробництва Hercules Inc. У представленому описі, термін "карбоксиметилкрохмаль натрію" означає похідну крохмалю, що включає натрій у кількості приблизно від 6 до 11 %. Вміст дезінтегрувального агента (c) особливим чином не обмежується, і переважно складає приблизно 1 - 25 мас. % по відношенню до маси таблетки (якщо таблетка з покриттям, до маси таблетки без покриття), більш переважно приблизно 2 - 20 мас. %, і найбільш переважно приблизно 3 - 15 мас. % . Крім того, кількість дезінтегрувального агента (c) особливим чином не обмежується, і переважно складає приблизно 0,1 - 500 мас. частин на 1 мас. частину Сполуки (I) або її солі, більш переважно приблизно 1 - 500 мас. частин, і найбільш переважно приблизно 1 - 250 мас. частин. Встановлюючи вміст і кількість дезінтегрувального агента (c), як описано вище, можна покращити здатність до дезінтегрування. Приклади змащувальних речовин (d) включають стеаринову кислоту або її сіль, такі як стеаринова кислота, стеарат алюмінію, стеарат кальцію і стеарат магнію; карнаубський віск; гліцериновий естер жирної кислоти; гідрогенезовану олію; жовтий бджолиний віск; білий бджолиний віск; тальк; стеарилфумарат натрію; і поліетиленгліколь (макроголі, такі як макрогол 400, макрогол 600, макрогол 1500, макрогол 4000 і макрогол 6000). Ці змащувальні речовини (d) можуть використовуватись окремо або у комбінації двох або декількох. Серед них, перевага надається стеарату, естеру цукрози і жирної кислоти, та гідрогенізованій олії, і більша перевага надається стеарату магнію. Вміст змащувальної речовини (d), особливим чином не обмежується, і переважно складає приблизно 0,1 - 10 мас. % по відношенню до маси таблетки (якщо таблетка з покриттям, до маси таблетки без покриття), більш переважно приблизно 0,2 - 8 мас. % , і найбільш переважно приблизно 0,3 - 7 мас. % . Кількість змащувальної речовини (d), особливим чином не обмежується, і переважно складає приблизно 0,01 - 50 мас. частин на 1 мас. частину Сполуки (I) або її солі, і більш переважно приблизно 0,02 - 30 мас. частин. Встановлюючи вміст і кількість змащувальної речовини (d), як описано вище, можна покращити здатність до таблетування. Таблетка представленого винаходу на додаток до ексціпієнта (a), зв'язувальної речовини (b), дезінтегрувального агента (c) і змащувальної речовини (d) може містити інші компоненти. Приклади інших компонентів включають різноманітні добавки, придатні для таблеток, такі як барвники, засоби для регулювання рівня pH, консерванти, речовини, що сприяють абсорбції, підсилювачі смаку, антиоксиданти, буфери, хелатоутворювальні агенти, абразиви, розчинники, агенти, що підвищують твердість, поверхнево-активні речовини, підсолоджувачі, засоби, що сприяють текучості, вибілювальні речовини та кориґенти смаку і аромату. Ці компоненти можуть використовуватись в кількості, при якій не проявляється негативна дія на представлений винахід. 4 UA 114411 C2 5 10 15 20 25 30 35 40 45 50 55 60 Таблетка представленого винаходу може використовуватись як таблетка без покриття, що містить наведенівище компоненти, але не має нанесеного на неї шару покриття. Таблетка з покриттям (таблетка з плівковим покриттям), що має шар покриття є переважною для забезпечення довготривалої стабільності при зберіганні і запобігання розкладання через дію світла або подібних чинників. Шар покриття може містити фармацевтичні добавки, такі як покривна речовина, пластифікатор, диспергувальний агент, протиспінювальний агент та їм подібні, які стандартно використовуються для нанесення покриття (для забезпечення плівки для) фармацевтичних препаратів, що вводяться оральним шляхом. Приклади добавок включають целюлози, такі як мікрокристалічна целюлоза, метилцелюлоза, етилцелюлоза, кармелоза натрію, гідроксипропілцелюлоза та гідроксипропілметилцелюлоза (гіпромелоза) та їх похідні; поліетиленгліколь (макрогол); полівініловий спирт; оксид титану; і тальк. Ці добавки може використовуватись окремо або у комбінації двох або декількох. Серед них, перевага надається комбінації гідроксипропілметилцелюлози (гіпромелози), тальку та оксиду титану, які є компонентами для покривного агента . Слід зазначити, коли у шарі покриття присутній поліетиленгліколь (макрогол), одержана таблетка проявляє тенденцію до зниженої світлостійкості і стабільності при зберіганні. Таким чином, більш бажано, щоб поліетиленгліколь (макрогол) практично не входив до складу. Крім того, щодо таблетки з покриттям, забарвленням покривного агента , можна забезпечити світлостійкість таблетки з покриттям. Таким чином, перевага надається додаванню барвника (e) до покривного агента для нанесення на таблетку покриття . Приклади барвників (e) включають: оксиди заліза, такі як оксид заліза червоний, оксид заліза жовтий та оксид заліза чорний; оксид титану; бета-каротин; барвник харчовий синій № 2; алюмінієвий лак з барвником харчовим синім № 2; і рибофлавін. Серед них, більша перевага надається тим, що містять оксид заліза, з точки зору, не тільки надавання таблетці забарвлення, але також і додаткового покращення світлостійкості таблетки. Барвник (e) може бути вибраний належним чином або використаний у комбінації, у залежності від того, який колір таблетки необхідно одержати. Наприклад, для одержання таблетки з покриттям білого кольору використовують оксид титану; для одержання таблетки з покриттям червоного кольору використовують комбінацію оксиду титану та оксиду заліза червоного; для одержання таблетки з покриттям жовтого кольору використовують комбінацію оксиду титану та оксиду заліза жовтого; для одержання таблетки з покриттям синього кольору використовують комбінацію оксиду титану та алюмінієвого лаку з барвником харчовим синім № 2; для одержання таблетки з покриттям оранжевого кольору використовують комбінацію оксиду титану та оксиду заліза червоного, та оксиду заліза жовтого; для одержання таблетки з покриттям зеленого кольору використовують комбінацію оксиду титану та оксиду заліза жовтого, та оксиду заліза чорного, або комбінацію оксиду титану, оксиду заліза жовтого та алюмінієвого лаку з барвником харчовим синім № 2; для одержання таблетки з покриттям пурпурового кольору використовують комбінацію оксиду титану, оксиду заліза червоного та оксиду заліза чорного, або комбінацію оксиду титану, оксиду заліза червоного та алюмінієвого лаку з барвником харчовим синім № 2. Як описано вище, таблетка з покриттям може бути виготовлена у різноманітних кольорах. Вміст барвника (e) переважно складає приблизно 0,1 - 3 мас. % по відношенню до загальної маси таблетки з покриттям, та приблизно 5 - 50 мас. % по відношенню до маси шару покриття таблетки з покриттям. Кількість шару покриття в таблетці, на яку наносять покриття, використовуючи покривний агент і барвник (e), який входить до складу якщо це необхідно, переважно складає приблизно 1 - 10 мас. частин на 100 мас. частин таблетки (таблетки без покриття) до нанесення на неї покриття. Конкретні переважні приклади добавок, що містяться у таблетці представленого винаходу включають: як ексціпієнт (a), щонайменше один компонент, вибраний з групи, що включає цукри, цукрові спирти, крохмалі та целюлози; як зв'язувальну речовину (b), похідні целюлози; як дезінтегрувальний агент (c), щонайменше один компонент, вибраний з групи, що включає похідні целюлози і похідні крохмалю; та як змащувальну речовину (d), стеарати. З точки зору продуктивності і здатності до дезінтегрування, ці добавки переважно використовують у комбінації: як ексціпієнта (a), щонайменше одного компонента, вибраного з 5 UA 114411 C2 5 10 15 20 25 30 35 40 45 50 55 групи, що включає лактозу, кукурудзяний крохмаль та мікрокристалічну целюлозу; як зв'язувальної речовини (b), гідроксипропілцелюлози; як дезінтегрувального агента (c), щонайменше одного компонента, вибраного з групи, що включає низькозаміщену гідроксипропілцелюлозу, кроскармелозу натрію та карбоксиметилкрохмаль натрію; та як змащувальної речовини (d), стеарату магнію. Таблетка представленого винаходу переважно містить кожен з компонентів у вмісті та кількості, наведених нижче. Вміст кожного з компонентів у таблетці Сполука (I) або її сіль: 0,05 - 20 мас. % Цукор та/або цукровий спирт: 20 - 80 мас. % Крохмаль: 5 - 50 мас. % Целюлоза: 1 - 30 мас. % Гідроксипропілцелюлоза: 0,1 - 20 мас. % Щонайменше один компонент, вибраний з групи, що включає низькозаміщену гідроксипропілцелюлозу, кроскармелозу натрію та похідні крохмалю: 1 - 25 мас. % Стеарат: 0,1 - 10 мас. % Кількість кожного з компонентів у таблетці на 1 мас. частину Сполуки (I) або її солі Цукор та/або цукровий спирт: 1 - 1000 мас. частин Крохмаль: 1 - 400 мас. частин Целюлоза: 0,1 - 200 мас. частин Гідроксипропілцелюлоза: 0,01 - 100 мас. частин Щонайменше один компонент, вибраний з групи, що включає низькозаміщену гідроксипропілцелюлозу, кроскармелозу натрію та похідні крохмалю: 0,1 - 500 мас. частин Стеарат: 0,01 - 50 мас. частин Вміст і кількість кожного з компонентів у ще одному переважному варіанті таблетки представленого винаходу наведені нижче. Вміст кожного з компонентів у таблетці Сполука (I) або її сіль: 0,1 - 15 мас. % Лактоза: 30 - 60 мас. % Кукурудзяний крохмаль: 10 - 30 мас. % Мікрокристалічна целюлоза: 5 - 20 мас. % Гідроксипропілцелюлоза: 0.5 - 10 мас. % Щонайменше один компонент, вибраний з групи, що включає низькозаміщену гідроксипропілцелюлозу, кроскармелозу натрію та карбоксиметилкрохмаль натрію: 2 - 15 мас. % Стеарат магнію: 0,1 - 10 мас. % Кількість кожного з компонентів у таблетці на 1 мас. частину Сполуки (I) або її солі Лактоза: 2 - 500 мас. частин Кукурудзяний крохмаль: 2 - 200 мас. частин Мікрокристалічна целюлоза: 0.5 - 100 мас. частин Гідроксипропілцелюлоза: 0,05 - 50 мас. частин Щонайменше один компонент, вибраний з групи, що включає низькозаміщену гідроксипропілцелюлозу, кроскармелозу натрію та карбоксиметилкрохмаль натрію: 1 - 250 мас. частин Стеарат магнію: 0,05 - 30 мас. частин Коли таблетка представленого винаходу є таблеткою з покриттям, переважні приклади добавок, що містяться у таблетці з покриттям включають, як компоненти для таблетки без покриття до нанесення покриття: як ексціпієнт (a), щонайменше один компонент, вибраний з групи, що включає цукри, цукрові спирти, крохмалі та целюлози; як зв'язувальну речовину (b), похідні целюлози; як дезінтегрувальний агент (c), щонайменше один компонент, вибраний з групи, що включає похідні целюлози і похідні крохмалю; та як змащувальну речовину (d), стеарати, та як компоненти для шару покриття: похідні целюлози, тальк, оксиди титану та оксиди заліза як барвник (e). 6 UA 114411 C2 5 10 15 20 25 30 35 40 45 50 55 60 Крім того, коли таблетка представленого винаходу є таблеткою з покриттям, більш переважною комбінацією є рецептура, одержана нанесенням шару покриття на не покриту таблетку; де, не покрита таблетка містить Сполуку (I) або її сіль, лактозу, кукурудзяний крохмаль, мікрокристалічну целюлозу, низькозаміщену гідроксипропілцелюлозу, гідроксипропілцелюлозу і стеарат магнію, і шар покриття містить гіпромелозу, тальк, оксид титану та щонайменше один барвник (e) (оксид заліза), вибраний з групи, що включає оксид заліза червоний, оксид заліза жовтий та оксид заліза чорний. Переважні вміст і кількість кожного з компонентів, і більш переважні вміст та кількість кожного з компонентів у переважному варіанті таблетки з покриттям наведені нижче. Вміст кожного з компонентів у таблетці без покриття Сполука (I) або її сіль: 0,05 - 20 мас. % Цукор та/або цукровий спирт: 20 - 80 мас. % Крохмаль: 5 - 50 мас. % Целюлоза: 1 - 30 мас. % Гідроксипропілцелюлоза: 0,1 - 20 мас. % Щонайменше один компонент, вибраний з групи, що включає низькозаміщену гідроксипропілцелюлозу, кроскармелозу натрію, та похідні крохмалю: 1 - 25 мас. % Стеарат: 0,1 - 10 мас. % Вміст кожного з компонентів у шарі покриття (на цілу таблетку з покриттям) Похідна целюлози: 1 - 6 мас. % Тальк: 0,1 - 1 мас. % Оксид титану: 0,1 - 2 мас. % Оксид заліза: 0,01 - 1 мас. % Кількість кожного з компонентів у таблетці з покриттям на 1 мас. Сполуки (I) або її солі Лактоза: 1 - 1000 мас. частин Крохмаль: 1 - 400 мас. частин Целюлоза: 0,1 - 200 мас. частин Гідроксипропілцелюлоза: 0,01 - 100 мас. частин Щонайменше один компонент, вибраний з групи, що включає низькозаміщену гідроксипропілцелюлозу, кроскармелозу натрію, та похідні крохмалю: 0,1 - 500 мас. частин Стеарат: 0,01 - 50 мас. частин Гіпромелоза: 0,1 - 50 мас. частин Тальк: 0,01 - 10 мас. частин Оксид титану: 0,01 - 20 мас. частин Оксид заліза: 0,0005 - 5 мас. частин Вміст і кількість кожного з компонентів у ще одному переважному варіанті таблетки з покриттям наведені нижче. Вміст кожного з компонентів у таблетці без покриття Сполука (I) або її сіль: 0,1 - 15 мас. % Лактоза: 30 - 60 мас. % Кукурудзяний крохмаль: 10 - 30 мас. % Мікрокристалічна целюлоза: 5 - 20 мас. % Гідроксипропілцелюлоза: 0,5 - 10 мас. % Щонайменше один компонент, вибраний з групи, що включає низькозаміщену гідроксипропілцелюлозу, кроскармелозу натрію та карбоксиметилкрохмаль натрію: 2 - 15 мас. % Стеарат магнію: 0,1 - 10 мас. % Вміст кожного з компонентів у шарі покриття (на цілу таблетку з покриттям) Гіпромелоза: 1,5 - 4 мас. % Тальк: 0,2 - 0,5 мас. % Оксид титану: 0,2 - 1 мас. % Оксид заліза: 0,02 - 0,5 мас. % Кількість кожного з компонентів у таблетці з покриттям на 1 мас. Сполуки (I) або її солі Лактоза: 2 - 500 мас. частин 7 UA 114411 C2 5 10 15 20 25 30 35 40 45 50 55 60 Кукурудзяний крохмаль: 2 - 200 мас. частин Мікрокристалічна целюлоза: 0,5 - 100 мас. частин Гідроксипропілцелюлоза: 0,05 - 50 мас. частин Щонайменше один компонент, вибраний з групи, що включає низькозаміщену гідроксипропілцелюлозу, кроскармелозу натрію та карбоксиметилкрохмаль натрію: 1 - 250 мас. частин Стеарат магнію: 0,05 - 30 мас. частин Гіпромелоза: 0,2 - 40 мас. частин Тальк: 0,02 - 8 мас. частин Оксид титану: 0,02 - 15 мас. частин Оксид заліза: 0,001 - 2,5 мас. частин Спосіб одержання таблетки представленого винаходу особливим чином не обмежується; наприклад, таблетка представленого винаходу може бути одержана за допомогою стадії формування у таблетку суміші, що містить Сполуку (I) або її сіль, та компонентів, інших ніж Сполука (I) або її сіль, необхідних для утворення таблетки (тобто, ексціпієнта (a), зв'язувальної речовини (b), дезінтегрувального агента (c), змащувальної речовини (d) та їм подібних). Альтернативно, таблетка представленого винаходу може бути одержана за допомогою способу, що включає: гранулювання суміші, що містить Сполуку (I) або її сіль, ексціпієнт (a), зв'язувальну речовину (b) та дезінтегрувальний агент (c), і з подальшим примішуванням до неї змащувальної речовини (d); та формування одержаної суміші у таблетку. Спосіб гранулювання, використовуваний для формування гранульованої речовини у таблетку, особливим чином не обмежується. Приклади його включають способи сухого гранулювання та способи вологого гранулювання (наприклад, спосіб гранулювання у псевдозрідженому шарі та спосіб гранулювання розтиранням). Серед них для продукування, перевага надається використанню способів вологого гранулювання, з точки зору забезпечення здатності до однорідного змішування активного та інших компонентів у таблетці, та забезпечення одержання таблетки, компоненти якої однорідно розподілені в ній. Приклади способів формування таблетки включають таблетування, таке як таблетування прямим пресуванням, сухе таблетування, вологе таблетування та таблетування зі зовнішнім змащуванням. Таблетка з покриттям представленого винаходу може бути одержана за допомогою змішування покривної речовини, барвника (e) та рідкого середовища; розпилення одержаної рідкої суміші на поверхню таблетки без покриття, одержаної за допомогою способу, описаного вище; та наступного її сушіння. Приклади рідкого середовища (наприклад, диспергувального середовища), використовуваного у описаній вище стадії включають: воду; метанол, етанол, ізопропанол і подібні нижчі спирти; ацетон, метилетилкетон і подібні кетони; дихлорметан, дихлоретан, хлороформ, тетрахлорид вуглецю і подібні галогеновані вуглеводні; та суміші цих розчинників. Таблетка представленого винаходу переважним чином містить Сполуку (I), яка є активним інгредієнтом, або її сіль у кількості приблизно 0,05 - 25 мг у перерахунку на Сполуку (I). Дозу таблетки представленого винаходу вибирають належним чином, відповідно до передбачуваного використання; віку пацієнта, статі та інших умов; серйозності захворювання; і т.п.. Дозу переважним чином вибирають в такий спосіб, що кількість Сполуки (I) (тобто, активного інгредієнта) або її солі приймалась приблизно 0,05 - 6 мг на добу у перерахунку на Сполуку (I). Приклади Представлений винахід детально пояснюється нижче, посиланням на Приклади. Однак, обсяг представленого винаходу не обмежується цими Прикладами. Слід зауважити, що в усіх Прикладах, описаних нижче, Сполукою (I) був "7-[4-(4-бензо[b]тіофен-4-іл-піперазин-1іл)бутокси]-1H-хінолін-2-он." Приклад 1 Таблетки без покриття (на таблетку не наносився шар покриття) Сполуки (I) одержували, використовуючи компоненти і кількості, наведені у Таблиці 1, за допомогою наступних процедур, описаних нижче. Приклад 1-1 Сполуку (I), лактозу, кукурудзяний крохмаль, мікрокристалічну целюлозу (CEOLUS PH-301), та низькозаміщену гідроксипропілцелюлозу (LH-11, виробництва Shin-Etsu Chemical Co., Ltd., з вмістом гідроксипропоксильних груп: 10,0 - 12,9 %) зважували і перемішували. До порошкоподібної суміші додавали окремо приготований водний розчин гідроксипропілцелюлози, з наступним вологим гранулюванням розтиранням. Після сушіння і сортування за розміром, до 8 UA 114411 C2 5 10 15 20 суміші додавали стеарат магнію і перемішували. Одержану суміш піддавали пресуванню, використовуючи окрему таблетувальну машину, оснащену пуансоном діаметром 6,5 мм в такий спосіб, що маса таблетки становила 100 мг, одержуючи таблетки без покриття, що містять 10 мг Сполуки (I) на таблетку. Приклад 1-2 Сполуку (I), лактозу, кукурудзяний крохмаль, мікрокристалічну целюлозу та кроскармелозу натрію зважували і перемішували. До порошкоподібної суміші додавали окремо приготований водний розчин гідроксипропілцелюлози, з наступним вологим гранулюванням розтиранням. Після сушіння і сортування за розміром, до суміші додавали стеарат магнію і перемішували. Одержану суміш пресували, використовуючи окрему таблетувальну машину, оснащену пуансоном діаметром 6,5 мм в такий спосіб, що маса таблетки становила 100 мг, одержуючи таблетки без покриття, що містять 10 мг Сполуки (I) на таблетку. Приклад 1-3 Сполуку (I), лактозу, кукурудзяний крохмаль, мікрокристалічну целюлозу і карбоксиметилкрохмаль натрію зважували і перемішували. До порошкоподібної суміші додавали окремо приготований водний розчин гідроксипропілцелюлози, з наступним вологим гранулюванням розтиранням. Після сушіння і сортування за розміром, до суміші додавали стеарат магнію і перемішували. Одержану суміш пресували, використовуючи окрему таблетувальну машину, оснащену пуансоном діаметром 6,5 мм в такий спосіб, що маса таблетки становила 100 мг, одержуючи таблетки без покриття, що містять 10 мг Сполуки (I) на таблетку. Таблиця 1 Приклад 1-1 10,0 48,2 20,0 10,0 10,0 1,0 0,8 100,0 Компоненти (мг) Сполука (I) Лактоза Кукурудзяний крохмаль Мікрокристалічна целюлоза Низькозаміщена гідроксипропілцелюлоза Кроскармелоза натрію Натрій карбоксиметилкрохмаль Гідроксипропілцелюлоза Стеарат магнію Маса таблетки без покриття (мг) 25 Приклад 1-2 10,0 53,2 20,0 10,0 5,0 1,0 0,8 100,0 Приклад 1-3 10,0 53,2 20,0 10,0 5,0 1,0 0,8 100,0 Таблиця 2 ілюструє властивості таблетки для таблеток без покриття, одержаних у Прикладах 1-1 - 1-3. Таблиця 2 Властивості таблетки Міцність на роздавлювання (Kp, n=3) Товщина (мм, n=3) Час дезінтегрування (мм:сек., n=6) 30 35 Приклад 1-1 5,4 2,78 Приклад 1-2 5,6 2,77 Приклад 1-3 4,7 2,82 1:18-1:36 2:00-2:16 1:09-1:35 Результати вимірювання часу дезінтегрування (тест на дезінтегрування) демонструють результати вимірювання шістьох таблеток кожного з Прикладів. Тест здійснювали, використовуючи воду як рідину для тесту, відповідно до тесту на дезінтегрування Японської Фармакопеї (без допоміжного диску). Приклади 2-1 - 2-3 На кожну з таблеток без покриття, одержаних у Прикладах 1-1 - 1-3, що має масу 100 мг і містить 10 мг Сполуки (I), наносили покриття, шляхом розпилення рідини для покриття, що містить компоненти шару покриття, кількість яких наведена у Таблиці 3, таким чином одержуючи таблетки з покриттям. 9 UA 114411 C2 Таблиця 3 Компоненти (мг) Таблетка без покриття Маса таблетки без покриття (мг) Шар покриття (мг) Гіпромелоза Макрогол 6000 Тальк Оксид титану Оксид заліза жовтий Маса шару покриття (мг) Маса таблетки з покриттям (мг) 5 Приклад 2-1 Приклад 1-1 100,0 Приклад 2-2 Приклад 1-2 100,0 Приклад 2-3 Приклад 1-3 100,0 2,07 0,30 0,30 0,30 0,03 3,0 103,0 2,07 0,30 0,30 0,30 0,03 3,0 103,0 2,07 0,30 0,30 0,30 0,03 3,0 103,0 Вимірювання часу дезінтегрування (тести на дезінтегрування) здійснювали для таблеток з покриттям, одержаних у Прикладах 2-1 - 2-3 в той самий спосіб, як і у Прикладі 1-1. Результати наведені у Таблиці 4. Затримки у часі дезінтегрування через нанесене покриття у таблетках з покриттям, одержаних у Прикладах 2-1 - 2-3 не спостерігалось. Таблиця 4 Приклад 2-1 10 15 20 25 Приклад 2-2 Приклад 2-3 1:35-1:50 Час дезінтегрування (мм:сек., n=6) 2:22-2:40 1:26-1:44 Тести на розчинення здійснювали для таблеток без покриття, одержаних у Прикладах 1-1 1-3, і таблеток з покриттям, одержаних у Прикладах 2-1 - 2-3. Результати продемонстровані на Фіг. Результати тесту на розчинення демонструють середні значення результатів вимірювання двох таблеток кожного Прикладу. Тест на розчинення здійснювали відповідно до методики проведення тесту на розчинення (з використанням лопатевої бовтниці; швидкість обертання50 об./хв.) Японської Фармакопеї, використовуючи як рідину для тесту буферний розчин гідрофосфат динатрію-лимонна кислота (900 мл) зі значенням pH 4,5. Результати тесту на розчинення підтверджують чудові профілі розчинності таблеток без покриття, одержаних у Прикладах 1-1 - 1-3 і таблеток з покриттям, одержаних у Прикладах 2-1 2-3. Крім того, здійснювали тест на стабільність для таблеток без покриття, одержаних у Прикладах 1-1 - 1-3 і таблеток з покриттям, одержаних у Прикладах 2-1 - 2-3, за умов зберігання при світловому випромінюванні (випромінювання видимої області спектра:повна освітленість 6 при 1,8 × 10 люкс-год.; ультрафіолетове випромінювання: повна інтенсивність при 300 Вт 2 од./м ) і за умов герметизованої системи при 40 °C (у закоркованих пляшечках протягом одного або трьох місяців). Вимірювали вміст Сполуки (I) і продуктів розкладання після зберігання за кожних умов. Результати наведені у Таблиці 5. Слід зазначити, що після зберігання за описаних вище умов світлового випромінювання, у таблеток без покриття, одержаних у Прикладах 1-1 - 1-3 спостерігалось жовте забарвлення. Таблиця 5 Приклад № Вихідний Світлове випромінювання 40 °C - 1 місяць 40 °C -3 місяці 1-1 98,1 98,3 99,6 98,0 1-2 1-3 2-1 2-2 Вміст Сполуки (I) ( %, n=3) 99,4 99,7 99,6 101,5 99,3 99,8 100,0 101,7 101,4 100,8 102,2 103,5 100,5 100,0 100,1 102,8 30 10 2-3 101,9 102,3 103,4 103,5 UA 114411 C2 Продовження таблиці 5 Приклад № Вихідний Світлове випромінювання 40 °C - 1 місяць 40 °C - 3 місяці 5 1-1 1-2 1-3 2-1 2-2 Вміст продуктів розкладання ( %, n=1) 0,362 0,371 0,373 0,367 0,634 0,592 0,477 0,500 0,378 0,376 0,370 0,393 0,373 0,401 0,385 0,409 0,365 0,662 0,354 0,409 2-3 0,374 0,463 0,411 0,419 Приклад 3-1 При використанні компонентів і кількості, наведених у Таблиці 6, таблетки без покриття, що містили 0,25 мг Сполуки (I) на таблетку, одержували у спосіб подібний до описаного у Прикладі 1-1, за винятком того, що для одержання таблеток без покриття, кожна з яких має масу 90 мг, використовували роторну таблетувальну машину, оснащену пуансоном діаметром 6,0 мм. Таблиця 6 Приклад 3-1 0,25 48,15 20,0 10,0 Компоненти (мг) Сполука (I) Лактоза Кукурудзяний крохмаль Мікрокристалічна целюлоза Низькозаміщена гідроксипропілцелюлоза Гідроксипропілцелюлоза Стеарат магнію Маса таблетки без покриття (мг) 10 10,0 1,0 0,6 90,0 Приклади 3-2 - 3-9 На кожну з таблеток без покриття, одержаних у Прикладі 3-1, що має масу 90 мг і містить 0,25 мг Сполуки (I), наносили покриття шляхом розпилення рідини для нанесення покриття, що містить компоненти шару покриття, кількість яких наведена у Таблиці 7, одержуючи таким чином таблетки з покриттям. 15 Таблиця 7 Приклад № Таблетка без покриття Маса таблетки без покриття (мг) Шар покриття (мг) Гіпромелоза Макрогол 6000 Тальк Оксид титану Оксид заліза червоний Оксид заліза жовтий Алюмінієвий лак (3-5 %) з барвником харчовим синім №2 Маса шару покриття (мг) Маса таблетки з покриттям (мг) 3-2 3-3 3-4 3-5 3-6 3-7 3-8 3-9 Приклад 3-1 90,0 1,8 0,3 0,3 0,6 2,1 0,3 0,6 1,8 0,3 0,3 0,54 0,06 2,1 0,3 0,54 0,06 1,8 0,3 0,3 0,54 0,06 2,1 0,3 0,54 0,06 1,8 0,3 0,3 0,54 2,1 0,3 0,54 0,06 0,06 3,0 3,0 3,0 3,0 3,0 3,0 3,0 3,0 93,0 93,0 93,0 93,0 93,0 93,0 93,0 93,0 Крім того, тест на стабільність здійснювали для таблеток без покриття, одержаних у Прикладі 3-1 і таблеток з покриттям, одержаних у Прикладах 3-2 - 3-9 за умов зберігання при 11 UA 114411 C2 5 світловому випромінюванні (випромінювання видимої області спектра:повна освітленість при 6 2 1,8 × 10 люкс-год.; ультрафіолетове випромінювання: повна інтенсивність при 300 Вт - од./м ) і за умов відкритої системи при 40 °C/75 % відносній вологості (три місяці, шість місяців), тобто, за більш стресових умов, ніж для Прикладів 1-1 - 1-3 та Прикладів 2-1 - 2-3. Вимірювали вміст продуктів розпадання після зберігання за кожних умов. Результати наведені у Таблиці 8. Навіть після піддавання світловому випромінюванню, у таблеток Прикладів 3-5 та 3-7, не спостерігалось підвищення кількості продуктів розкладання. Таблиця 8 Приклад № Вихідний Світлове випромінювання 40 °C/75 % відносна вологість - 3 місяці 40 °C/75 % відносна вологість - 6 місяців 10 3-1 3-2 0,687 3-3 3-4 3-5 3-6 3-7 3-8 (Вміст продуктів розкладання: %, n=1) 0,772 0,773 0,683 0,713 0,677 0,805 0,951 3-9 0,909 4,142 2,069 1,469 1,401 0,676 1,493 0,675 2,573 1,186 0,980 1,820 0,900 1,613 1,093 1,483 1,112 2,055 1,393 1,140 2,264 1,672 2,232 1,232 1,766 1,247 2,130 1,783 Приклади 4-1 - 4-13 Таблетки з покриттям Сполуки (I) Прикладів 4-1 - 4-13, що містять компоненти і кількість, наведені у Таблиці 9, одержували у спосіб подібний до описаного у Прикладі 3-2. Таблиця 9 Компоненти (мг) 4-1 Сполука (I) 0,05 Лактоза 48,35 Кукурудзяний крохмаль 20,0 Мікрокристалічна 10,0 целюлоза Низькозаміщена 10,0 гідроксипропілцелюлоза Гідроксипропілцелюлоза 1,0 Стеарат магнію 0,6 Маса таблетки без 90,0 покриття (мг) Гіпромелоза 2,1 Тальк 0,3 Оксид титану 0,54 Оксид заліза червоний 0,06 Оксид заліза жовтий Оксид заліза чорний Маса шару покриття (мг) 3,0 Маса таблетки з 93,0 покриттям (мг) Приклад № 4-7 4-8 4,0 5,0 44,4 43,4 20,0 20,0 4-2 0,25 48,15 20,0 4-3 0,5 47,9 20,0 4-4 1,0 47,4 20,0 4-5 2,0 46,4 20,0 4-6 3,0 45,4 20,0 4-9 6,0 42,4 20,0 4-10 4-11 4-12 0,25 0,25 0,25 48,15 48,15 48,15 20,0 20,0 20,0 4-13 1,0 47,4 20,0 10,0 10,0 10,0 10,0 10,0 10,0 10,0 10,0 10,0 10,0 10,0 10,0 10,0 10,0 10,0 10,0 10,0 10,0 10,0 10,0 10,0 10,0 10,0 10,0 1,0 0,6 1,0 0,6 1,0 0,6 1,0 0,6 1,0 0,6 1,0 0,6 1,0 0,6 1,0 0,6 1,0 0,6 1,0 0,6 1,0 0,6 1,0 0,6 90,0 90,0 90,0 90,0 90,0 90,0 90,0 90,0 90,0 90,0 90,0 90,0 2,1 0,3 0,54 0,06 3,0 2,1 0,3 0,54 0,06 3,0 2,1 0,3 0,54 0,06 3,0 2,1 0,3 0,54 0,06 3,0 2,1 0,3 0,54 0,06 3,0 2,1 0,3 0,54 0,06 3,0 2,1 0,3 0,54 0,06 3,0 2,1 0,3 0,54 0,06 3,0 2,1 0,3 0,54 0,06 3,0 2,1 0,3 0,54 0,04 0,02 3,0 2,1 0,3 0,54 0,02 0,04 3,0 2,1 0,3 0,57 0,01 0,02 3,0 93,0 93,0 93,0 93,0 93,0 93,0 93,0 93,0 93,0 93,0 93,0 93,0 15 20 Промислова придатність Таблетка представленого винаходу, що містить бензотіофен (I) або його сіль, має надзвичайну здатність до дезінтегрування, стабільність при зберіганні, та до світлостійкості. Таким чином, таблетка представленого винаходу є надзвичайно придатною для використання у галузі медицини. ФОРМУЛА ВИНАХОДУ 25 1. Таблетка, що містить 7-[4-(4-бензо[b]тіофен-4-іл-піперазин-1-іл)бутокси]-1Н-хінолін-2-он або його сіль як активний інгредієнт, ексципієнт (а), зв'язуючу речовину (b), дезінтегруючий агент (с) та змащувальну речовину (d), 12 UA 114411 C2 5 10 15 20 25 30 35 40 де ексципієнт (а) є щонайменше однією складовою, вибраною з групи, що включає лактозу, кукурудзяний крохмаль та мікрокристалічну целюлозу; зв'язувальна речовина (b) є гідроксипропілцелюлозою; дезінтегрувальний агент (с) є щонайменше однією складовою, вибраною з групи, що включає низькозаміщену гідроксипропілцелюлозу, кроскармелозу натрію та карбоксиметилкрохмаль натрію; та змащувальна речовина (d) є стеаратом магнію. 2. Таблетка за п. 1, де таблетка є таблеткою без покриття, що містить: 0,05-25 мас. % 7-[4-(4-бензо[b]тіофен-4-іл-піперазин-1-іл)бутокси]-1Н-хінолін-2-ону або його солі; 10-98,5 мас. % ексципієнта (а); 0,1-20 мас. % зв'язувальної речовини (b); 1-25 мас. % дезінтегрувального агента (с); та 0,1-10 мас. % змащувальної речовини (d), відносно до маси таблетки без покриття. 3. Таблетка за п. 1 або 2, де на 1 мас. частину 7-[4-(4-бензо[b]тіофен-4-іл-піперазин-1іл)бутокси]-1Н-хінолін-2-ону або його солі, таблетка містить: 1-2000 мас. частин ексципієнта (а); 0,01-100 мас. частин зв'язувальної речовини (b); 0,1-500 мас. частин дезінтегрувального агента (с); та 0,01-50 мас. частин змащувальної речовини (d). 4. Таблетка за будь-яким одним з пп. 1-3, яка додатково містить шар покриття на її поверхні. 5. Таблетка за п. 4, яка додатково містить барвник (e) у шарі покриття, де барвник (e) містить оксид заліза і таблетка містить 0,1-50 мас. % барвника (e) відносно до маси шару покриття. 6. Таблетка за будь-яким одним з пп. 1-5, яку одержують формуванням у таблетку гранульованої речовини, одержаної за допомогою вологого гранулювання. 7. Таблетка за будь-яким одним з пп. 1-6, де таблетка не містить повідону або кросповідону. 8. Спосіб одержання таблетки, який включає стадії: (1) гранулювання суміші, що містить 7-[4-(4-бензо[b]тіофен-4-іл-піперазин-1-іл)бутокси]-1Нхінолін-2-он або його сіль, ексципієнт (а), зв'язувальну речовину (b) та дезінтегрувальний агент (с), та наступне примішування до суміші змащувальної речовини (d); та (2) формування одержаної суміші у таблетку, де ексципієнт (а) є щонайменше однією складовою, вибраною з групи, що включає лактозу, кукурудзяний крохмаль та мікрокристалічну целюлозу; зв'язувальна речовина (b) є гідроксипропілцелюлозою; дезінтегрувальний агент (с) є щонайменше однією складовою, вибраною з групи, що включає низькозаміщену гідроксипропілцелюлозу, кроскармелозу натрію та карбоксиметилкрохмаль натрію; та змащувальна речовина (d) є стеаратом магнію. 9. Спосіб одержання таблетки за п. 8, який додатково включає стадію: (3) змішування покривної речовини, барвника (e) та рідкого середовища з одержанням суміші, і нанесення покриття на поверхню таблетки з використанням суміші для покриття. 13 UA 114411 C2 Комп’ютерна верстка Л. Ціхановська Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
Назва патенту англійськоюTablet including 7-[4-(4-benzo[b]thiophen-4-yl-piperazin-1-yl)butoxy]-1h-quinolin-2-one or salt thereof
Автори англійськоюInoue, Yoshiharu
Автори російськоюИноуе Йошихару
МПК / Мітки
МПК: A61K 47/10, A61K 47/12, A61K 31/496, A61K 9/28, A61K 9/20, A61K 47/38, A61K 47/26
Мітки: сіль, 7-[4-(4-бензо[b]тіофен-4-іл-піперазин-1-іл)бутокси]-1н-хінолін-2-он, містить, таблетка
Код посилання
<a href="https://ua.patents.su/16-114411-tabletka-shho-mistit-7-4-4-benzobtiofen-4-il-piperazin-1-ilbutoksi-1n-khinolin-2-on-abo-jjogo-sil.html" target="_blank" rel="follow" title="База патентів України">Таблетка, що містить 7-[4-(4-бензо[b]тіофен-4-іл-піперазин-1-іл)бутокси]-1н-хінолін-2-он або його сіль</a>