Швидкорозчинна таблетка, яка вміщує галантамінову сіль бромоводневої кислоти та спосіб її виготовлення
Номер патенту: 62930
Опубліковано: 15.01.2004
Автори: де Конде Валентин Флорент Віктор, Гіліс Поль Марі Віктор
Формула / Реферат
1. Таблетка, яка містить достатню для лікувального ефекту кількість гідроброміду галантаміну (1:1) як активного інгредієнта, та фармацевтичнo прийнятну основу, яка відрізняється тим, що вказана основа містить висушену розпиленням суміш моногідрату лактози та мікрокристалічну целюлозу (75:25) як розчинник, та дезінтегруючий агент.
2. Таблетка за п. 1, яка відрізняється тим, що дезінтегруючий агент це кросполівідон або кроскармелоза.
3. Таблетка за п. 1 або 2, яка відрізняється тим, що основа також містить емульгатор та мастило.
4. Таблетка за п. 3, яка відрізняється тим, що емульгатор це колоїдний безводний розчин діоксиду кремнію, а мастило це стеарат магнію.
5. Таблетка за одним із пп. 1, 2, 3 або 4, яка відрізняється тим, що у ваговому співвідношенні складових частин до загальної ваги містить:
(a) від 2 до 10 % гідроброміду галантаміну (1:1);
(b) від 83 до 93 % висушеної розпиленням суміші моногідрату лактози та мікрокристалічної целюлози (75:25);
(c) від 0,1 до 0,4 % емульгатора;
(d) від 3 до 8 % дезінтегруючого агента із нерозчинного полімеру з поперечними зв'язками; та
(e) від 0,2 до 1 % мастила.
6. Таблетка за п. 5, яка відрізняється тим, що містить
(a) приблизно від 2 до 10 % гідроброміду галантаміну (1:1);
(b) приблизно від 83 до 93 % висушеної розпиленням суміші моногідрату лактози та мікрокристалічної целюлози (75:25);
(c) приблизно 0,2 % колоїдного безводного розчину діоксиду кремнію;
(d) приблизно 5 % кросполівідону; та
(e) приблизно 0,5 % стеарату магнію.
7. Таблетка за одним із пп. 1, 2, 3, 4, 5 або 6, яка відрізняється тим, що має плівкове покриття.
8. Таблетка за п. 7, яка відрізняється тим, що покриття містить плівкоутворюючий полімер та пластифікатор.
9. Таблетка за п. 8, яка відрізняється тим, що вагові співвідношення плівкового покриття до непокритого ядра таблетки становлять приблизно від 3 до 8 %.
10. Спосіб виготовлення таблетки за одним із пп. 1-9, який відрізняється тим, що включає етапи:
(і) сухого змішування активного інгредієнта, дезінтегруючого агента та необов’язкового емульгатора з розчинником;
(іі) змішування мастила із сумішшю, отриманою на етапі (і) (необов'язково);
(ііі) пресування суміші, отриманої на етапі (і) або (іі), в сухому стані у форми таблеток; та
(iv) покриття облатками таблеток, виготовлених на етапі (ііі) (необов'язково).
Текст
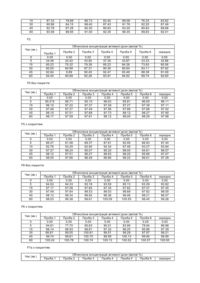
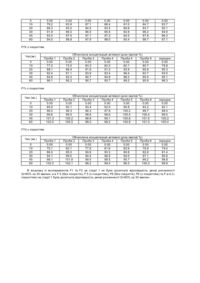
Цей винахід належить до швидкорозчинних таблеток для внутрішнього призначення, які містять гідробромид галантаміну як активний інгредієнт (1:1) у обсязі, достатньому для терапевтичного ефекту, та фармацевтично сприйнятливу основу, яка складається із висушеної розпиленням суміші моногідрату лактози та мікрокристалічної целюлози (75:25) як розчинника га дезінтегруючого агента; та до способів виготовлення таких швидкорозчинних таблеток прямим пресуванням. Галангамін, третичний алкалоїд, виділений із цибулин Кавказьких пролісків Galanianus woronowi (Проскуріна Н.Ф. та Яковлева А.П. 1952, Алкалоїди із Galanthus woronowi II. Виділення (отримання) нового алкалоїду (на російській мові). Основи заіаііької хімії (J. Gen. Chem.) 22, 1899-1902, Він також може бути виділений із звичайного проліску Galanthus nivalis (Boit, 1954). Хімічна назва галантаміну - [4aS- (4aa, 6b, 8aR*)]-4a, 5, 9, 10, 11, 12-гексагідро-3-метокси-11-метил-6Н-бензофуро [3а, 3, 2-ef] [2] бензаценіл-6-ол; як основна сполука, так і його гідробромид мають ліве обертання площини поляризації. Галантамін це широко відомий інгибітор ацетилхоліностерази, який показує активність в центрах нікотинових , а не мускаринічних рецепторів. Призначаючи людині терапевтично ефективні дози цього препарату, можна пройти гемоенцефалічний бар'єр у людини без важких побічних ефектів. Галантамін широко використовувався як зворотній агент кураре (екстракт різних рослин) в країнах Європейської Співдружності в області анестезії, (див. огляд Паскова, 1986), а також експериментально на Заході (див. Бретань і Валетта, 1965р.; Вісліцкі, 1967p.; Консанітіс, 1971р.) Галантамін був введений Вальдхаймом в ринок під назвою Nivalinä у Германії та Австрін з 1970 року і рекомендований для лікування лицевої невралгії. Використання галантаміну або його аналогу або солі фармацевтично ісприйнятливої кислотної добавки для виготовлення медикаментів для лікування недоумства Альцгеймера (НА) та відповідних недоумств було описано в ЕР-0,236,684 (US-4,663,318). Цей патент має тільки загальний опис можливого дозування галантаміну. Використання галаитаміну для лікування алкоголізму та призначення через трансдермальну систему переносу (ТСП) (TTS) або бляшки було описано в Європейському патенті ЕР-0,449,247. Подібним чином, у патенті WO-94/16708 було описано використання галантаміну для лікування від паління призначенням його через трансдермальну систему переносу (ТСП) (TTS) або бляшки. В ряді заявок Е.Снорасона було описано використання галантоміну, його аналогів та фармацевтично сприйнятливих солей для виготовлення медикаментів для лікування маніакального синдрому (US5,336,675), синдрому постійної втомленності (СПВ) (CPS) (ЕР-0,515,302; US-5,312,817),та засобів для компенсації негагивних ефектів при прийомі беизодіазепину (ЕР-0,515,301)· В цих заявках та патентах, зокрема в US-5,312,817, наданий ряд визначених рецептур для виготовлення таблеток галантамін гідробромиду. Зокрема, нижче наведені наступні рецептури: Склад 1 таблетки (60мг) містить 1мг гідроброміду талант аміну Гідробромід галантаміну 0,001г Фосфат кальцію 0,032г Лактоза 0,005г Пшеничний крохмаль 0,0056г Мікрокристалічна целюлоза 0,015г Тальк 0,0007г Стеарат магнію 0,0007г Склад 1 таблетки (80мг) містить 5 мг гідроброміду галантаміну; композиція із плівковим покриттям невідома [Nivalinä, Вальдхайм лтд.» Вена, Австрія] (F3) Галантамін гідробромид 0,005г Фосфат кальцію 0,024г Лактоза 0,004г Пшеничний крохмаль 0,004г Мікрокристалічна целюлоза 0,04г Тальк 0,002г Стеарат магнію 0,001г Склад 1 таблетки (120мг) містить 10мг гідроброміду галантаміну Гідробромід галантаміну 0,010г Лактоза 0,040г Пшеничний крохмаль 0,0234г Мікрокристалічна целюлоза 0,00374г Тальк 0,0036г Стеарат магнію 0,0012г Желатин 0,0044г Запропоновані склади таблеток можуть бути виго товлені за технологією вологої грануляції. Розчинність Nivalinä (USP 23, Розчинність, ст.ст. 1791-1793, апарат 2 (змішування, 50об/хв.; 500мл води або водний буферний розчин при 37°С)), розповсюдженого в торговельній мережі у виді таблетки 5мг з плівковим покриттям (F3) має наступні етапи: Час(хв.) 0 5 15 30 Н2О 0.00 6.23 51.75 80.88 Обчислена концентрація (вагові %) активної дози , рH 4,5 USP рН 6,5 USP рН 7,5 USP 0,00 0.00 0.00 21.38 5,25 12.80 86.33 43.88 37.70 97,63 79.78 66.18 0,1 NНСІ 0.00 41.95 91.05 98.88 45 60 93.28 100.75 98.60 99.20 87.88 90.70 82.70 90.93 102.08 101.63 Для отримання урядового дозволу на продаж ліків, необхідно не тільки показати, що їх активні інгредієнти мають стабільну активність та є безпечними при використанні, але необхідно доказати, що їх склад викличе позитивний результат у різних пацієнтів. Наприклад, у випадку виготовлення твердої субстанції у виді таблетки попередньою умовою є дезінтеграція та розчинність таблеток до визначеного рівня за певний період часу. В цьому винаході пропонуються нові таблетки гідроброміду галантаміну, які розчиняються при наймі до 80% за 30 хвилин (Q=80% за 30’) (USP 23, Розчинність, ст.ст.1791-1793. Апарат 2 (змішування. 50об/хв.; 500 мл дистильованої води при 37°С)). Згідно з технічними умовами розчинності можна використовувати розчинник із одного або двох дезинтегруючих агентів. Таким чином, цей винахід належить до таблеток, які містять гідробромід галантаміну як активний інгредієнт (1:1) у обсязі, достатньому для терапевтичного ефекту, та фармацевтично сприйнятливу основу, яка складається із висушеної розпиленням суміші моногідрату лактози та мікрокристалічної целюлози (75:25) як розчинника та дезінтегруючого агента. Запропоновані таблетки розчиняються при наймі до 80% за 30 хвилин (Q=80% за 30’) (USP 23, Розчинність, ст.ст.1791-1793, Апарат 2 (змішування. 50об/хв.)). Перші експерименти почалися з використанням розчинника у виді твердої (кристалічної) або моногідратної лактози та дезінтегруючого агента у виді порошку або мікрокристалів целюлози (див. рецептури F1 та F2 в експериментальній частині). Особливою проблемою, яка зустрічалась під час подачі осушеної суміші для таблетки в прес для прямого пресування, була сегрегація (розділення) наповнювачів таблетки, що викликало різний склад таблеток. Крім того, рецептури F1 та F2 не відповідали на стадії 1 умовам розчинності Q=80% за 30. Для вирішення важливих проблем розчинник був замінений на висушен у розпиленням суміш моногідрату лактози та мікросталічної целюлози (75:25), відомими у торговельній мережі під назвою Мікроцелакä (Місrосеlасä ). Крім того, маючи знижену тенденцію до сегрегації під час подачі в прес для таблеток, суха суміш, яка містить вищевказаний розчинник, крім того, показала блискучі реологічні властивості (текучість), а також легкість змішування з активними інгредієнтами та іншими сприйнятливими добавками у складі таблеток. Однак, умови розчинності не виконувались без подрібнювача, який має високий коефіцієнт розширення, особливо при застосуванні нерозчинного або слабо розчинного полімера із поперечними зв'язками, наприклад, кросполівідин або кроскармелоза. Міст вказаних дезінтегруючих агентів у швидкорозчинних таблетках згідно з цим винаходом знаходиться в діапазоні 3-8 вагових % (w/w), перевалено приблизно 5 вагових % (w/w). З метою полегшення виконання процесу змішування та прямого пресування основа додатково^мютидьи..емульшор да^масіида. Переважно емульгатор це колоїдний безводний розчин діоксиду кремнію, а мастило це стеарат магнію. В ході перших експериментів (див. F1 та F2) тальк використовується як емульгатор, а лаурил сульфат натрію - як зволожувальна добавка/мастило. Перший показав зворотній ефект на властивість розчинення таблеток (відносно розчинення активних інгредієнтів), а наступний виявив здатність до повного та легкого розчинення таблеток до кінця. Швидко рочинні таблетки згідно з цим винаходом у ваговому співвідношенні складових частин до повної чистої ваги містять: (a) від 2 до 10% гідроброміду галантаміну (1:1); (b) від 83 до 93% висушеної розпиленням суміші моногідрату лактози та мікрокристалічної целюлози (75:25); (c) від 0,1 до 0,4 % емульгатора; (d) від 3 до 8% дезінтегуючого агента; та (є) від 0,2 до 1% мастила. Зокрема, таблетка містить: (a) приблизно від 2 до 10% гідроброміду галантаміну (1:1); (b) приблизно від 83 до 93% висушеної розпиленням суміші моногідрату лактози та мікрокристалічної целюлози (75:25); (c) приблизно 0,2 % колоїдного безводного розчину кремнія; (d) приблизно 5% кросполівідону; та (є) приблизно 0,5% стеарату магнію. Швидко розчинні таблетки гідроброміду галантаміну (1:1) згідно з цим винаходом можуть, крім того, містити інші альтернативні сприйнятливі добавки, наприклад, ароматизатори, підсолоджувані та барвники. Таблетки гідроброміду галантаміну (1:1) виготовляють з плівковим покриттям за відомою технологією. Такі покрити плівкою таблетки легше проковтнути ніж таблетки в чистому виді, та легше відрізнити від інших таблеток, особливо, коли покриття містить барвник або пігмент, крім того, має поліпшену стабільність (термін зберігання). В даному випадку суміш , яка містить полімер та пластифікатор (пом’якшувач) для виготовлення плівки, зокрема гідроксипропил метилцелюлози та поліетиленгліколь, а саме макрогол 6000, може використовуватись для покриття таблеток, описаних тут. У швидко розчинних таблетках дуже важливою вимогою є недопущення зворотного ефекту дезінтеграції та розчинення, іншими словами, зникнення активних інгредієнтів із таблетки, У зв'язку з цим, вага плавкового покриття оптимально вибрана в діапазоні 3-8%, зокрема 4-7,5% ваги непокритих таблеток. Як показано експериментами (F5, F6, F7) як покриті, так і непокриті таблетки, згідно з цим винаходом, задовольняють вимогам розчинності Q=80 % за 30’ (USP). Згідно з цим винаходом таблетки придатні для внутрішнього призначення пацієнтам в дозованій формі при лікуванні галантаміном. Для зручності використання таблетки містять від 2 до 20мг галантаміну (2,56325,63мг гідроброміду галантаміну (1:1), зокрема від 4 до 16мг галантаміну (5,026-20,506мг гідроброміду галантамін (1:1)). Переважне вони призначаються для прийому тричі на день (t.i.d.), приблизно кожні вісім годин, або двічі на день (b.i.d.), приблизно кожні 12 годин, оскільки при цих режимах дозування виробляються терапевтично ефективні плазмові рівні активних інгредієнтів протягом дня. Цей винахід також належить до способу виробництва швидко розчинних таблеток гідроброміду галантаміну (1:1), який мас етапи: (і) сухого змішування активного інгредієнта, подрібнювана та будь-якого емульгатора з розчинником; (іі) змішування мастила із сумішшю, о триманою на етапі (і) (необов'язково); (ііі) Пресування суміші, отриманої на етапі (і) або (іі), в сухому стані у форми таблеток; та (iv) покриття плівкою таблеток, виготовлених на етапі (ііі) (необов'язково). Етап сухого змішування легше виконувати в планетарній мішалці: пряме пресування в пресі для таблеток: та покриття таблеток плівкою у спеціальному пристрої. Експериментальна частина Приклад 1: Виготовлення таблеток прямим пресуванням (F1) Інгредієнти: Гідробромід галантаміну 5мг Лактоза (безводний розчин) 70мг Порошкоподібна целюлоза 19мг Тальк 4мг Лауриловий сульфат натрію 1мг Колоїдний безводний розчин діоксиду кремнія 0,5мг Стеарат магнія 0,5мг Загальна вага 100мг Виготовлення: Інгредієнти змішувались у герметичній планетарній мішалці та спресовувались в пресі для таблеток, в якому виготовлялись таблетки вагою 100мг кожна. Приклад 2: Виготовлення таблеток прямим пресуванням (F2) Інгредієнти: 5,13мг (4мг Гідробромід галантаміну галантаміну) Моногідрат лактози 55,11мг Мікрокристалічна целюлоза 15,2мг Тальк 3,2мг Лауриловий сульфат натрію 0,8мг Колоїдний безводний розчин діоксидукремнія 0,16мг Стеарат магнію 4мг чиста вага без покриття 80мг гіпромелоза 2910 5mPa s 1,8мг тальк 8мг діоксид тітана (Ε 171) 0,1мг Макрогол 6000 0,3мг Дистильована вода* 17мг Вага покриття 3мг Загальна вага 83мг * Цей компонент відсутній у кінцевому продукті Виготовлення: Інгредієнти змішувались у планетарній мішалці та пресувались в пресі для таблеток, в якому виготовлялись таблетки вагою 80мг кожна. Ядро таблетки потім було покрито полівкою в спеціальному пристрої. Приклад 3: Виготовлення таблеток прямим пресуванням (F5) Інгредієнти: 5,126мг (4мг Гідробромід галантаміну галантаміну) Висушена розпиленням суміш моногідрату лактози 221,194мг Та мікрокристалічна целюлоза (75:25) Кросполівідон 12мг Колоїдний безводний розчин діоксиду кремнію 0,48мг Стеарат магнію 1,2мг чиста вага без покриття 240мг гіпромелоза 2910 5 mPa. S 5,4мг тальк 2,4мг діоксид тітану (Е 171) 0,3мг Макрогол 6000 0,9мг Дистильована вода* 51мг Вага покриття 9мг Загальна вага 249мг * Цей компонент відсутній у кінцевому продукті Виготовлення: Інгредієнти змішувались у герметичній планетарній мішалці та пресувались в пресі для таблеток, в якому виготовлялись таблетки вагою 240мг кожна. Ядро таблетки потім було покрито плівкою в спеціальному резервуарі. Приклад 4: Виготовлення таблеток прямим пресуванням (F6) Інгредієнти: 23,069мг Гідробромід галантаміну (18мг галантаміну) Висушена розпиленням суміш моногідрату лактози 203,251мг Та мікрокристалічна целюлоза (75:25) Кросполівідон 12мг Колоїдний безводний розчин діоксиду кремнія 0,48мг Стеарат магнія 1,2мг чиста вага без покриття 240мг гіпромелоза 2910 5 mPa. S 5,4мг тальк 2,4мг діоксид тітана (Е 171) 0,3мг Макрогол 6000 0,9мг Дистильована вода* 51мг Вага покриття 9мг Загальна вага 249мг * Цей компонент відсутній у кінцевому продукті. Виготовлення: Інгредієнти змішувались у планетарній мішалці та пресувались в пресі для таблеток, в якому виготовлялись таблетки вагою 240мг кожна. Ядра таблеток потім були покриті плівкою в спеціальному пристрої. Приклад 5: Виготовлення таблеток прямим пресуванням під різним тиском (F7a, F7b, F7c, F7d) Інгредієнти (в мг, якщо іншого не обумовлено): Гідробромід талантам іну (галантамін) Висушена розпиленням суміш моногідрату лактози Та мікрокристалічна целюлоза (75:25) Кросполівідон Колоїдний безводний розчин діоксиду кремнію Стеарат магнія чиста вага без покриття гіпромелоза 2910 5 mPa. s пропілен гліколь (мл) тальк діоксид тітана (Е 171) барвник(и) Дистильована вода* Вага покриття Загальна вага F7a 5,126 (4) F7b 10,253 (8) 51,454 3 0,12 0,3 60 2,5 0,603 0,5 0,75 0,0032 26,875 4.3562 64,3562 102,907 6 0,24 0,6 120 4 0,965 0,8 1,2 0,013 43 6,978 126,978 F7c 15,379 (12) 0 154,361 9 0,36 0,9 180 5 1,207 1 1,5 0,505 53.75 9,212 189,212 F7d 20,506 (16) 205,814 12 0,48 1,2 240 6 1,448 1,2 1,8 0,130 64,5 10,578 250,578 * Цей компонент відсутній у кінцевому продукті Виготовлення: Інгредієнти змішувались у герметичній планетарній мішалці та пресувались в пресі для таблеток, в якому виготовлялись таблетки вагою 60, 120, 180 та 240мг. Ядро таблетки потім були покриті плівкою в спеціальному пристрої. Приклад 6. В штучни х умовах були виконані порівняльні дослідження розчинності таблеток по рецептурах F1, F2, F5 (без покриття), F5 (з покриттям), F6 (з покриттям), F6 (без покриття), F7 a-d (з покриттям). Середовищем досліду була дистильована вода при 37°С в апараті 2 (USP 23, Розчинність, ст.ст. 1791-1793) (змішування, 50об/хв) Були отримані наступні результати: F1 Обчислена концентрація активної дози (вагові %) Час (хв.) 0 5 Проба 1 0.00 77.85 Проба 2 Проба 3 Проба 4 Проба 5 Проба 6 середнє 0.00 59.10 0.00 72.46 0.00 74.48 0.00 76.23 0.00 61.35 0.00 70.23 15 30 45 60 87.33 90.98 92.78 93.58 78.88 84.15 87.28 88.95 86.73 88.40 90.30 91.00 83.40 87.43 89.83 92.35 89.08 91.78 93.30 96.35 76.33 82.20 85.83 89,83 83.62 87.49 89.88 92.01 F2 Обчислена концентрація активної дози (вагові %) Час (хв.) 0 5 15 30 45 60 Проба 1 0.00 34.48 85.23 90.55 92.84 94.40 Проба 2 Проба 3 Проба 4 Проба 5 Проба 6 середнє 0.00 24.42 75.32 84.99 8.89 90.69 0.00 33.92 79.39 87.31 90.45 92.28 0.00 37.35 85.23 90.30 92.47 93.91 0.00 33.67 84.26 90.64 93.49 94.62 0.00 33.33 73.93 83.11 88.38 89.74 0.00 32.86 80.56 87.82 91.09 92.60 F5 без покриття Час (хв.) 0 5 15 30 45 60 Проба 1 0.00 95.5*9 96.15 97.46 98.10 98.17 Обчислена концентрація активної дози (вагові %) Проба 2 Проба 3 Проба 4 Проба 5 Проба 6 0.00 0.00 0.00 0.00 0.00 96.71 95.10 96.63 95.81 96.85 97.22 97.37 97.29 97.27 97.39 97.27 97.49 97.56 97.66 97.68 97.51 97.68 97.73 98.12 98.27 97.59 97.61 98.12 98,00 98.29 середнє 0.00 96.11 97.11 97.52 97.90 97.96 Проба 1 0.00 86.27 92.76 97.27 98.12 98.05 Обчислена концентрація активної дози (вагові %) Проба 2 Проба 3 Проба 4 Проба 5 Проба 6 0.00 0.00 0.00 0.00 0.00 81.08 89.37 87.81 92.95 86.93 93.29 92.90 93.34 97.46 93.27 96.24 95.07 95.20 98.05 94.61 97.51 96.27 96.63 98.20 95.68 97.66 96.49 96.66 98.22 96.61 середнє 0.00 87.40 93.84 96.07 97.07 97.28 Проба 1 0.00 94.02 97.17 97.49 98.12 98.53 Обчислена концентрація активної дози (вагові %) Проба 2 Проба 3 Проба 4 Проба 5 Проба 6 0.00 0.00 0.00 0.00 0.00 94.33 93.18 93.59 95.13 93.29 97.08 97.84 97.34 97.82 97.47 97.64 98.53 98.03 98.68 97.62 98.34 98.92 98.36 99.46 98.21 98.38 99.61 100.09 100.55 98.40 середнє 0.00 93.92 97.45 98.00 98.57 99.26 Проба 1 0.00 94.61 98.14 98.81· 99.74 100.24 Обчислена концентрація активної дози (вагові %) Проба 2 Проба 3 Проба 4 Проба 5 Проба 6 0.00 0.00 0.00 0.00 0.00 77.70 95.63 90.51 83.90 78.94 96.93 99.81 97.32 96.25 95.86 99.05 100.61 99.51 99.29 97.97 99.61 100.70 99.59 100.13 99.90 100.76 100.74 100.13 100.52 100.57 середнє 0.00 86.88 97.39 99.21 99.95 100.50 Обчислена концентрація активної дози (вагові %) Проба 2 Проба 3 Проба 4 Проба 5 Проба 6 середнє F5 з покриттям Час (хв.) 0 5 15 30 45 60 F6 без покриття Час (хв.) 0 5 15 30 45 60 F6 з покриттям Час (хв.) 0 5 15 30 45 60 F7a з покриттям Час (хв.) Проба 1 0 10 20 30 45 60 0.00 79.2 88.3 91.9 93.5 94.0 0.00 83.9 93.0 96.0 97.5 98.8 0.00 87.1 94.5 96.5 97.1 97.9 0.00 86.4 93.4 95.9 97.2 98.0 0.00 81.0 89.8 92.8 94.5 95.4 0.00 84.7 93.7 96.2 97.8 98.7 0.00 83.7 92.1 94.9 96.3 97.1 F7b з покриттям Час(хв.) 0 10 20 30 45 60 Проба 1 0.00 77.2 88.1 92.4 94.8 96.1 Обчислена концентрація активної дози (вагові %) Проба 2 Проба 3 Проба 4 Проба 5 Проба 6 0.00 0.00 0.00 0.00 0.00 73.0 83.3 82.3 82.1 80.7 86.4 91.6 91.2 93.9 90.6 91.1 93.9 93.4 96.4 93.7 93.3 94.7 94.9 98.2 95.0 95.2 95.7 95.7 99.2 95.9 середнє 0.00 79.8 90.3 93.5 95.1 96.3 Обчислена концентрація активної дози (вагові %) Проба 2 Проба 3 Проба 4 Проба 5 Проба 6 0.00 0.00 0.00 0.00 0.00 92.1 93.4 92.0 95.8 93.2 98.3 98.3 97.8 100.2 99.7 99.5 98.6 98.6 100.4 100.4 100.2 98.8 99.1 100.8 101.0 100.5 99.0 99.2 100.8 101.0 середнє 0.00 92.1 98.4 99.5 100.2 100.4 Обчислена концентрація активної дози (вагові %) Проба 2 Проба 3 Проба 4 Проба 5 Проба 6 0.00 0.00 0.00 0.00 0.00 82.1 77.8 81.6 82.6 79.9 95.0 90.6 93.3 90.8 92.6 99.0 94.4 96.9 94.0 97.1 101.8 99.5 98.5 95.7 99.2 102.1 98.2 99.4 96.5 100.3 середнє 0.00 79.0 91.4 95.9 98.8 99.8 F7c з покриттям Час (хв.) 0 10 20 30 45 60 Проба 1 0.00 85.9 96.0 99.6 101.3 102.0 F7d з покриттям Час (хв.) 0 10 20 30 45 60 Проба 1 0.00 70.1 86.0 94.1 98.1 102.3 В жодному із експериментів F1 та F2 на стадії 1 не була досягнута відповідність умові розчинності Q=80% за 30 хвилин; а в F 5 (без покриття), F 5 (з покриттям), F6 (без покриття), F6 (з покриттям) та F a-d (ч покриттям) на стадії 1 була досягнута відповідність умові розчинності Q=80% за 30 хвилин.
ДивитисяДодаткова інформація
Назва патенту англійськоюFast-dissolving tablets comprising galanthamine hydrobromide and method for their manufacture
Назва патенту російськоюБыстрорастворимые таблетки, содержащие галантаминовую соль бромистоводородной кислоты, и способ их изготовления
МПК / Мітки
МПК: A61K 9/20, A61K 31/55
Мітки: виготовлення, спосіб, кислоти, сіль, таблетка, швидкорозчинна, вміщує, бромоводневої, яка, галантамінову
Код посилання
<a href="https://ua.patents.su/6-62930-shvidkorozchinna-tabletka-yaka-vmishhueh-galantaminovu-sil-bromovodnevo-kisloti-ta-sposib-vigotovlennya.html" target="_blank" rel="follow" title="База патентів України">Швидкорозчинна таблетка, яка вміщує галантамінову сіль бромоводневої кислоти та спосіб її виготовлення</a>
Наступний патент: Опорний пристрій для обертального барабана і обертальний барабан
Випадковий патент: Теплонасосна установка