Рослинний екстракт з імуномодуляторною дією, отриманий з rosa sp., urtica dioica та tanacetum vulgare
Номер патенту: 94082
Опубліковано: 11.04.2011
Автори: арібдоуст Фагад, Мограс Міноо, Новітскій Юрій Алексевіч, Форсамфар Бардіа, Фагаді Могаммад, Мадані Гессамедін
Формула / Реферат
1. Спосіб одержання рослинного екстракту, який полягає в тому, що
а) застосовують рослинний матеріал, отриманий з листя і стебла Urtica dioica і Tanacetum vulgare та плодів Rosa sp.;
б) сушать рослинний матеріал;
в) додають органічний розчинник;
г) витримують суміш рослинного матеріалу та органічного розчинника в інкубаторі;
ґ) отримують рослинний екстракт;
д) додають селен та/або його органічну та неорганічну сіль; та/або
е) додають сечовину та
є) піддають рослинний екстракт дії імпульсного електричного поля.
2. Спосіб за п. 1, в якому імпульс електромагнітного поля має синусоїдальну, прямокутну та/або стохастичну форму.
3. Спосіб за п. 1 або 2, в якому імпульсне електромагнітне поле має частоту приблизно 5-750 кГц, переважно 50-350 кГц, найбільш переважно близько 250 кГц.
4. Спосіб за будь-яким з попередніх пунктів, в якому імпульсне електромагнітне поле має потужність приблизно 10-200 Вт, переважно 20-100 Вт, найбільш переважно близько 45 Вт.
5. Спосіб за будь-яким з попередніх пунктів, в якому імпульсне електромагнітне поле має напруженість 100-150 мкТ.
6. Спосіб за будь-яким з пп. 1-5, в якому рослинний екстракт піддають дії імпульсного електромагнітного поля протягом приблизно 2-5 хвилин.
7. Спосіб за будь-яким з пп. 1-6, в якому рослинний екстракт піддають дії імпульсного електромагнітного поля повторно і переважно три рази.
8. Застосування рослинного екстракту, одержаного способом за будь-яким з пунктів 1-7, для виготовлення фармацевтичної композиції для лікування суб’єкта від ВІЛ-інфекції та/або СНІДу.
9. Застосування за п. 8, в якому суб’єктом лікування є хребетна тварина, переважно ссавець, найбільш переважно людина.
10. Застосування за п. 8 або 9, в якому суб’єкт лікування не є вагітним.
Текст
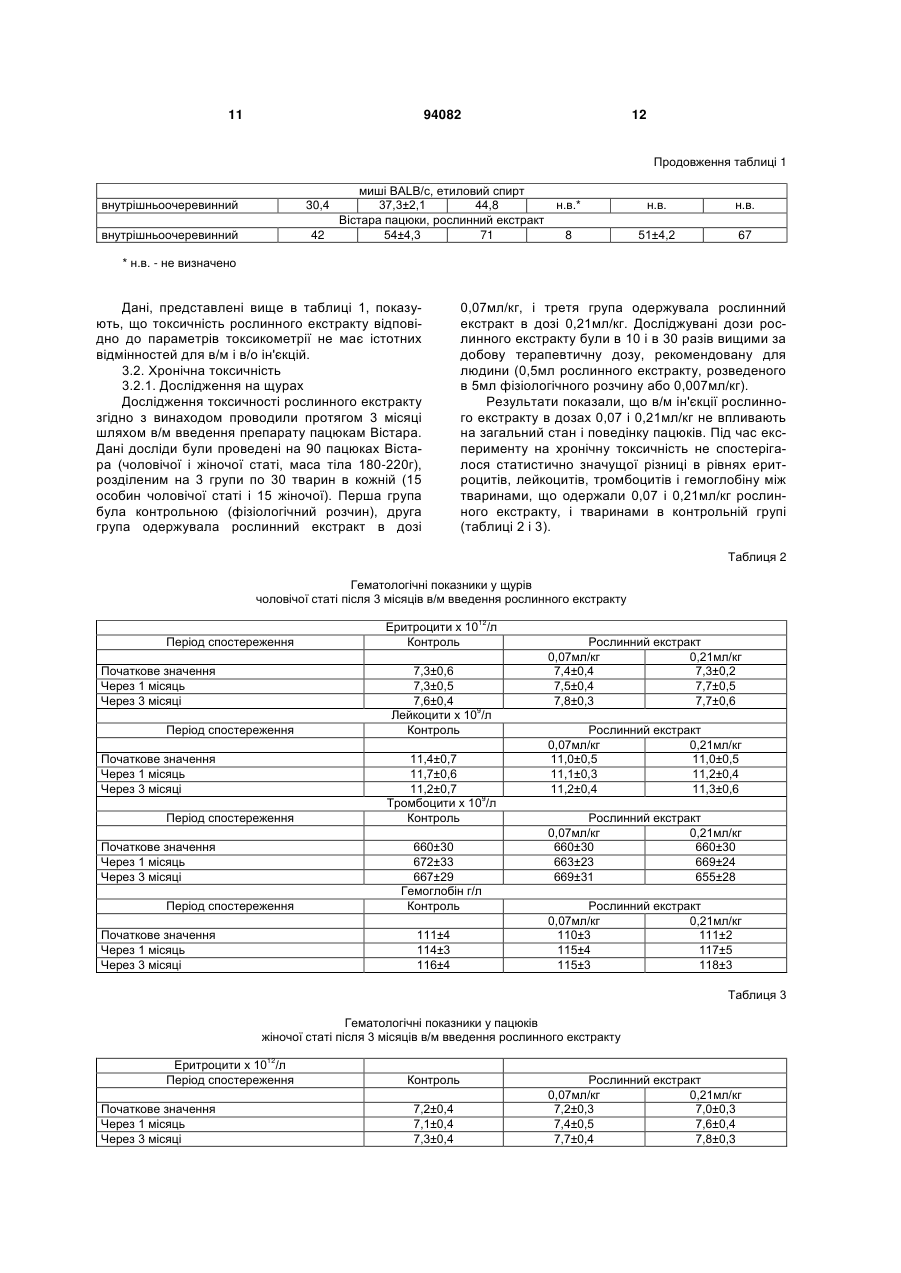
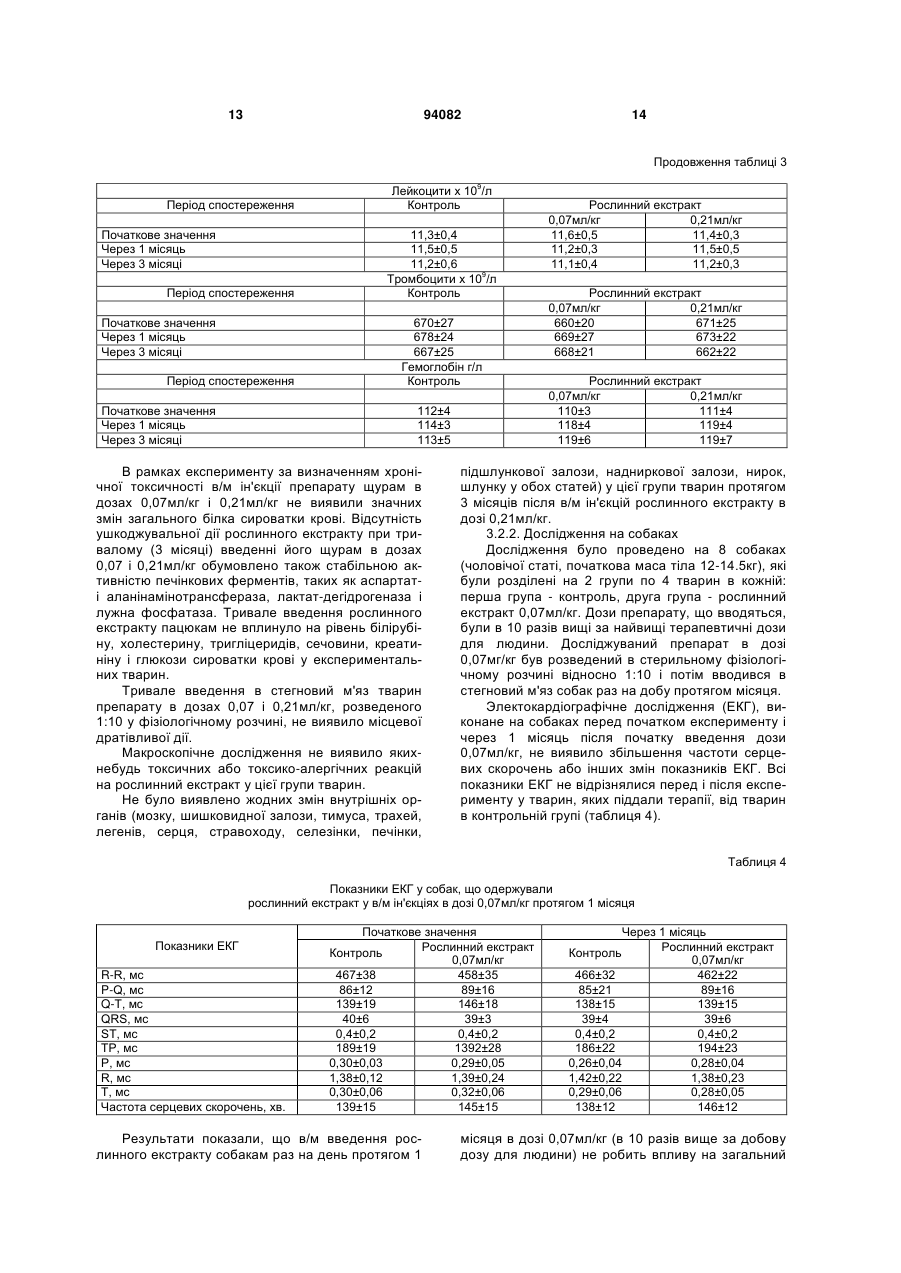
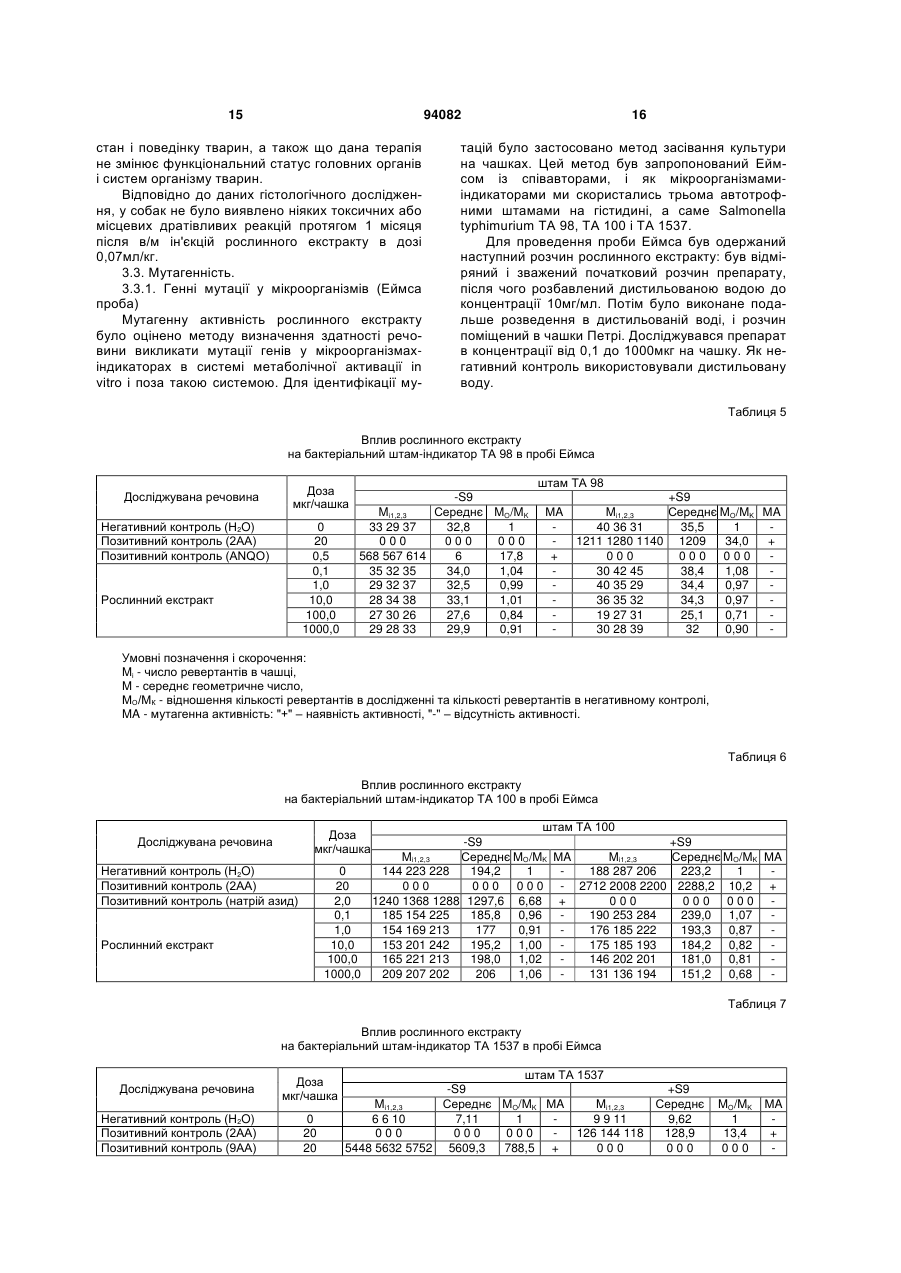
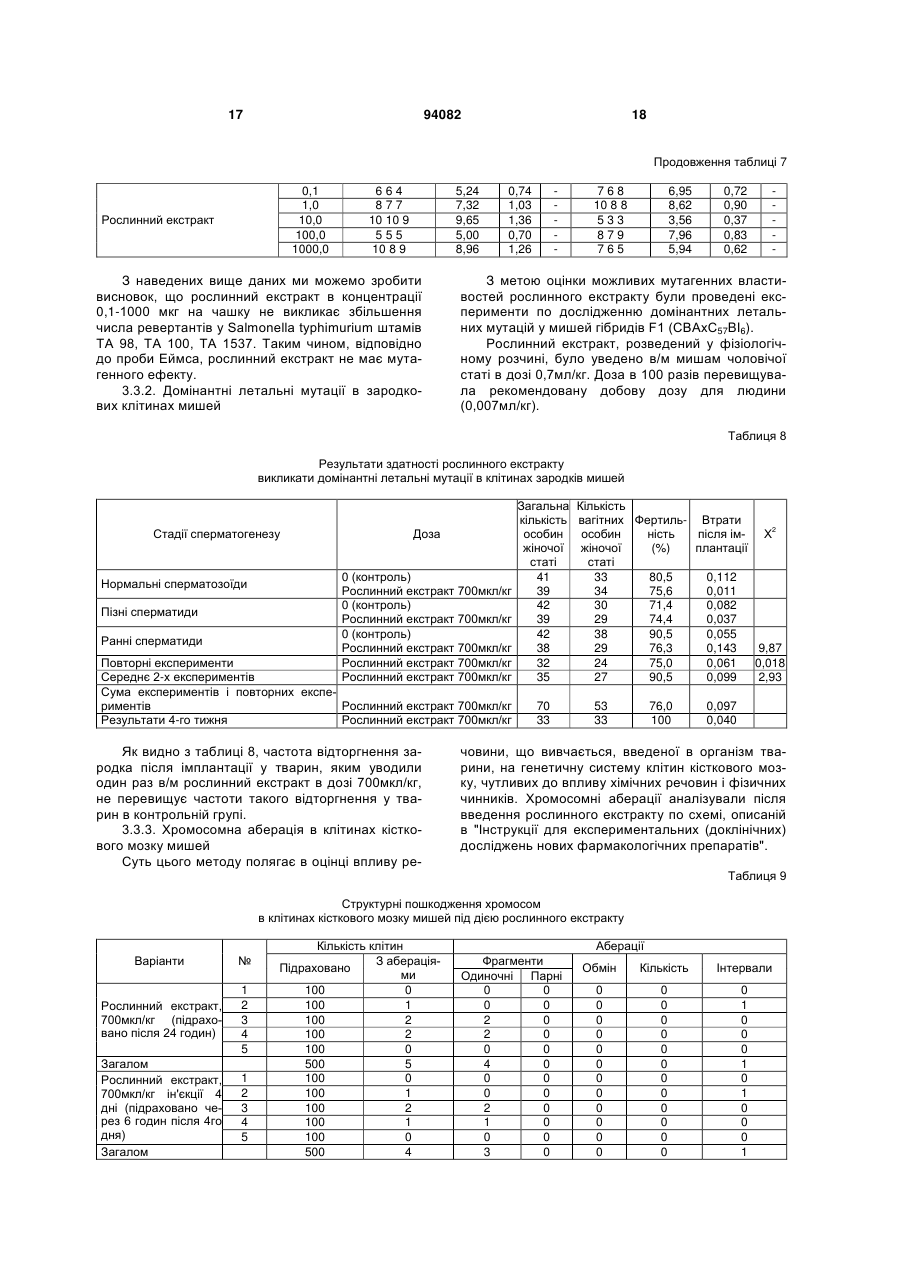
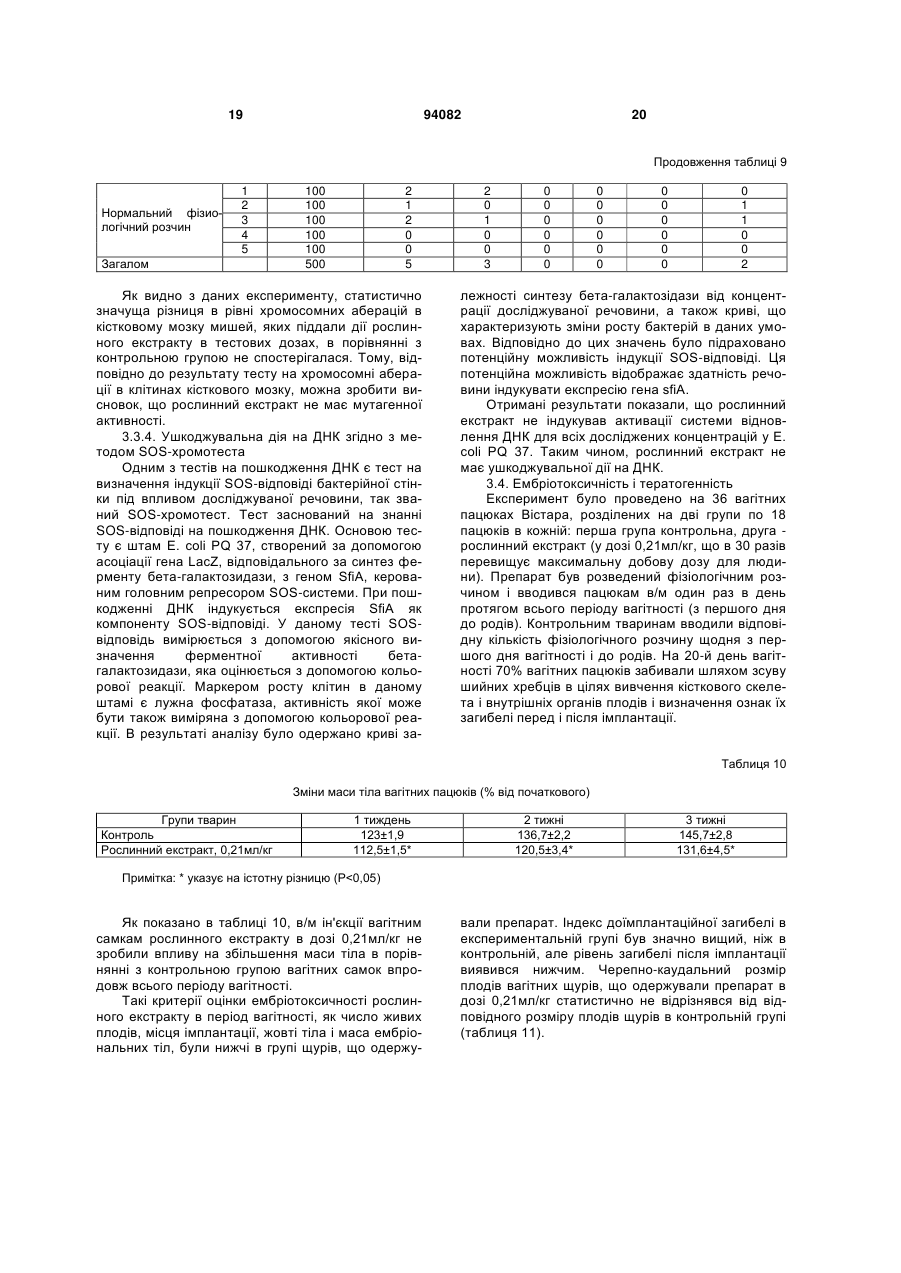
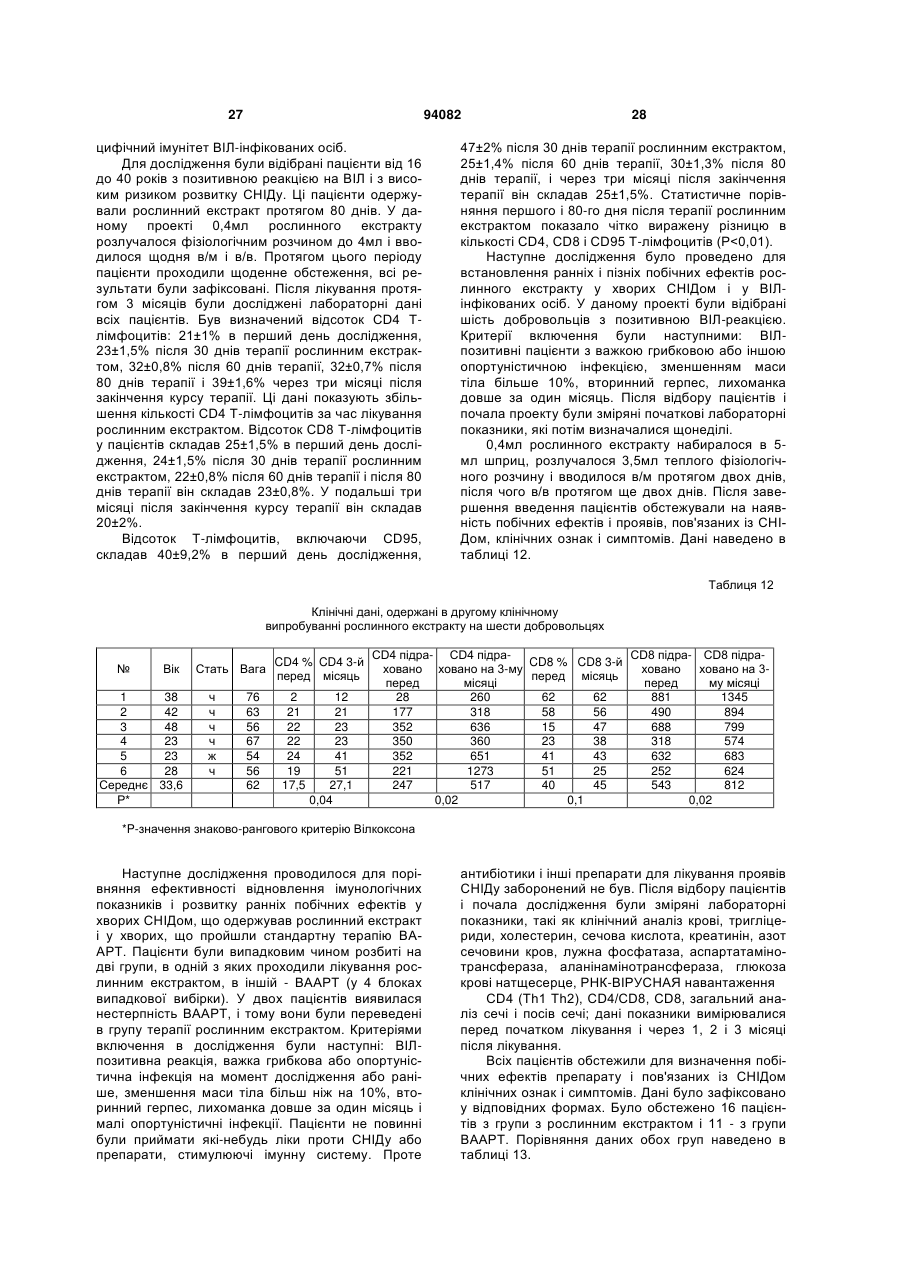
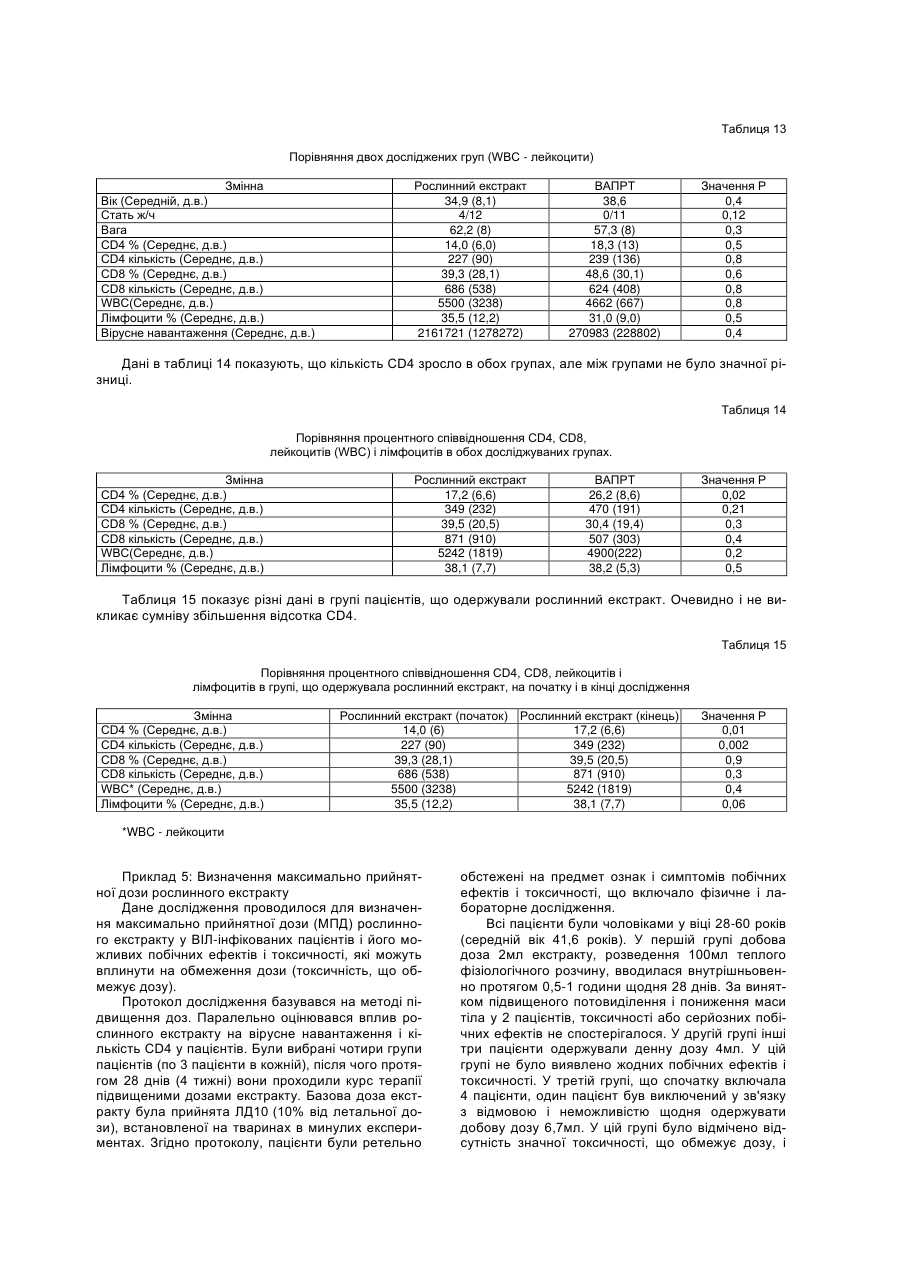
1. Спосіб одержання рослинного екстракту, який полягає в тому, що а) застосовують рослинний матеріал, отриманий з листя і стебла Urtica dioica і Tanacetum vulgare та плодів Rosa sp.; б) сушать рослинний матеріал; в) додають органічний розчинник; г) витримують суміш рослинного матеріалу та органічного розчинника в інкубаторі; ґ) отримують рослинний екстракт; д) додають селен та/або його органічну та неорганічну сіль; та/або е) додають сечовину та є) піддають рослинний екстракт дії імпульсного електричного поля. C2 2 (19) 1 3 Більш докладно, СНІД характеризується низкою симптомів, що виявляються на пізніх стадіях ВІЛ-інфекції. Без будь-якого лікування, інкубаційний період, тобто час між проникненням ВІЛінфекції в організм і клінічним проявом СНІДу, складає близько 10 років. ВІЛ-інфекція викликає прогресуючу недостатність імунної системи, що врешті призводить до імунодефіциту. Таким чином, найбільш важливими клінічними симптомами СНІДу суть умовно-патогенні інфекції та, крім того, характерні злоякісні новоутворення, наприклад, саркома Капоші, енцефалопатія, асоційована зі СНІДом і виснажливий синдром, асоційований зі СНІДом. Основу імунодефіциту складає зменшення кількості CD4+ Т-клітин, що мають важливе значення як для клітинного, так і для гуморального імунітету. З часу виникнення епідемії, кількісний аналіз CD4+ T-лімфоцитів в циркулюючій крові є критичним методом виявлення і оцінки ВІЛінфекції і СНІДу. Частка CD4+ T-лімфоцитів у відсотках і їх зміни з часом (зниження) слугують важливими показниками для визначення тяжкості захворювання, прогнозу і терапевтичного спостереження. Перші випадки СНІДу було зареєстровано на початку вісімдесятих років минулого століття. З того часу СНІД широко розповсюдився по всьому світу і, крім того, в деяких регіонах, особливо в країнах, що розвиваються, досяг розмірів епідемії. На сьогодні ВІЧ-інфіковано приблизно 40 мільйонів чоловік, з них приблизно 2,2 мільйонів дітей. У 2004р. було відмічено близько п'яти мільйонів нових випадків інфікування, і близько 3,1 мільйонів чоловік померли від СНІДу, з них 510000 дітей (за даними Всесвітньої Організації Охорони здоров'я ВОЗ). З 1995 р кількість препаратів для лікування СНІДу збільшилася втричі. В даний час широкого поширення набула комбінована терапія як найбільш ефективна і така, що супроводжується найменшими побічними ефектами. Розробка нових активних препаратів і ліків, а також терапевтичних схем змогла значно уповільнити прогресування хвороби, надати зворотного розвитку симптомів пізньої стадії захворювання і запобігти зараженню новонароджених від інфікованих матерів. Стандартом стала так звана "високоактивна протиретровірусная терапія" (ВАПРТ), комбінована терапія, що включає три або більш препаратів. Було показано, що ВАПРТ уповільнює прогресування СНІДу і знижує смертність. Як правило, два препарати, включені у ВАПРТ, впливають на зворотну транскриптазу, і один препарат - на вірусну протеазу. Інгібітори зворотної транскриптази, що добре себе зарекомендували, суть аналогами нуклеозидів, серед яких зидовудин (АZТ, Retrovir®), ламівудин (Epivir®) і діданозин (Videx®). Такі інгібітори транскриптази вбудовуються в ланцюжок ДНК, що росте, унаслідок чого блокується її подальший синтез. Відомі інші інгібітори зворотної транскриптази, наприклад, Viramune®, який пригнічує дію ферменту іншими механізмами. Інгібітори протеаз блокують вірусну протеазу, так що білки, необхідні для скупчення нових вірусів, не можуть відщеплюватися від крупнішого білкового попередника. При 94082 4 кладами таких ліків суть індинавір (Crixivan®), саквінавір (Invirase®), рітонавір (Norvir®) і нельфінавір мезілат (Viracept®). Мало того, в терапії застосовують такі препарати, як інгібітори злиття, напри® клад, енфувіртид (Fuzeon ) та інгібітори інтегрази. Не зважаючи на значні досягнення в терапії ВІЛ-інфекції та СНІДу, вона ще має деякі недоліки і вади. Препарати, вживані в даний час, вельми дорогі, отже вони не тільки виснажують бюджет багатих країн, але і стають просто недоступними в багатьох бідних країнах, де лютує епідемія. Вони дають багато неприємних побічних ефектів (наприклад, нудота, діарея), а деякі – тяжкі побічні ефекти (наприклад, ураження печінки і підшлункової залози, іноді із смертельним наслідком). Вони вимагають дуже складного режиму дозування, наприклад, призначення більше десяти пігулок на день (не беручи до уваги тих, що необхідні для боротьби з супутніми умовно-патогенними інфекціями). Зрештою, вони часто перестають бути ефективними, оскільки вони викликають появу стійких до ліків віріонів в організмі пацієнта. Отже, існує потреба в альтернативних, вдосконалених або кращих фармацевтичних засобах, що забезпечують зменшення інтенсивності симптомів СНІДу, сповільнення його проявів і/або корекцію ВІЛ-інфекції. До того ж, існує необхідність в дешевших фармацевтичних засобах. Таким чином, метою цього винаходу є створення фармакологічно активної композиції для лікування хворих, що страждають на вірусні інфекції та пов'язані з ними симптоми та стани, переважно на ВІЛ-інфекцію та СНІД. Згідно з винаходом запропоновано спосіб готування рослинного екстракту, який полягає в тому, що а) застосовують рослинний матеріал, отриманий від Rosa sp., Urtica dioica та/або Tanacetum vulgare; б) сушать рослинний матеріал; в) додають органічний розчинник; г) витримують суміш рослинного матеріалу та органічного розчинника в інкубаторі; ґ) отримують рослинний екстракт; У одному з варіантів рослинний матеріал отримано від Rosa sp., Urtica dioica і Tanacetum vulgare. В іншому варіанті рослинний матеріал, отриманий від Rosa sp. отримано від Rosa canina. У одному з варіантів рослинний матеріал від Rosa sp. одержано з плодів. У одному з варіантів рослинний матеріал від Urtica dioica та/або Tanacetum vulgare одержано з листків і/або стеблинок. У одному з варіантів сушіння в операції (б) виконують при температурі в межах від 20 до 50°C, переважно від 37 до 45°C, більш переважно близько 42°C. У одному з варіантів сушіння рослинного матеріалу в операції (б) здійснюють близько 3-4 дні. У одному з варіантів органічним розчинником є етанол у кількості переважно 60-96% (об'ємних), переважно 80-96%, більш переважно 96%. У одному з варіантів інкубацію в операції (г) здійснюють протягом приблизно від 20 до 40 днів, 5 переважно від 22 до 38 днів, більш переважно від 25 до 35 днів. У одному з варіантів інкубацію в операції (г) здійснюють при температурі в межах від 20 до 50°C, переважно від 37 до 45°C, більш переважно близько 42°C. У одному з варіантів спосіб додатково має наступну операцію: д) додають селен та/або його органічну чи неорганічну сіль; У одному з варіантів селен додають до отримання концентрації вільного селену від 1 до 100мг/л, переважно від 5 до 50мг/л, більш переважно від 10 до 20мг/л. У одному з варіантів спосіб додатково має таку операцію: е) до рослинного екстракту додають сечовину. У одному з варіантів спосіб додатково має таку операцію: є) піддають рослинний екстракт дії імпульсного електромагнітного поля. У одному з варіантів імпульс електромагнітного поля має синусоїдальну, прямокутну або стохастичну форму. У одному з варіантів імпульсне електромагнітне поле має частоту в межах від 5 до 750кГц, переважно від 50 до 350Мгц, більш переважно близько 250Мгц. У одному з варіантів імпульсне електромагнітне поле має потужність в межах від 10 до 200Вт, переважно від 20 до 100Вт, більш переважно близько 40Вт. У одному з варіантів імпульсне електромагнітне поле має силу в межах від 100 до 150мкТ. У одному з варіантів рослинний екстракт піддають дії імпульсного електромагнітного поля протягом приблизно від 2 до 5 хвилин. У одному з варіантів рослинний екстракт піддають дії імпульсного електромагнітного поля повторно, переважно тричі. Мети цього винаходу досягнуто шляхом застосування рослинного екстракту, виготовленого способом згідно з винаходом. Мети цього винаходу досягнуто шляхом застосування рослинного екстракту згідно з винаходом, виготовленого способом згідно з винаходом, для стимуляції імунної системи пацієнта. Мети цього винаходу досягнуто шляхом застосування рослинного екстракту згідно з винаходом, виготовленого способом згідно з винаходом, для лікування захворювань, пов'язаних з ослабленням імунної системи пацієнта. Мети цього винаходу досягнуто шляхом застосування рослинного екстракту згідно з винаходом, виготовленого способом згідно з винаходом, для виробництва фармацевтичного препарату для лікування захворювань, пов'язаних з ослабленням імунної системи пацієнта. У одному з варіантів захворюванням є ВІЛінфекція та/або СНІД. У одному з варіантів застосування, пацієнт є хребетним, переважно ссавцем, більш переважно людиною. У одному з варіантів пацієнт не є вагітною. Мети цього винаходу досягнуто шляхом засто 94082 6 сування рослинного екстракту згідно з винаходом, виготовленого способом згідно з винаходом, для лікування вірусних захворювань у пацієнта. Мети цього винаходу досягнуто шляхом застосування рослинного екстракту згідно з винаходом, виготовленого способом згідно з винаходом, для виробництва фармацевтичного препарату для лікування вірусних захворювань у пацієнта. У одному з варіантів захворюванням є вірусна інфекція РНК, переважно ретровірусна інфекція, більш переважно ВІЛ-інфекція. У одному з варіантів застосування, пацієнт є хребетним, переважно ссавцем, більш переважно людиною. У одному з варіантів пацієнт не є вагітною. Мети цього винаходу досягнуто шляхом застосування фармацевтичного препарату, що включає рослинний екстракт згідно з винаходом, виготовлений способом згідно з винаходом. У одному з варіантів фармацевтичний препарат додатково включає фармацевтично прийнятний носій. У одному з варіантів фармацевтичний препарат призначено для перорального приймання. Мети цього винаходу досягнуто шляхом застосування набору, що включає фармакологічний препарат згідно з винаходом. Термін "стохастична форма" означає, що імпульс електромагнітного поля має вид шуму. Імпульс електромагнітного поля має переважно прямокутну форму із синусоїдальною хвилею всередині. "Потужність" (Вт) імпульсного електромагнітного поля, наприклад, означає ефективну потужність. Значення "напруженість магнітного поля" (Т) імпульсного електромагнітного поля вимірюють за подвоєною амплітудою. Ефект "стимуляції імунної системи" і стану "ослаблення імунної системи" можна визначити, користуючись методами і параметрами, добре відомими в цій галузі. Таке визначення може стосуватись будь-якого компонента клітинної і гуморальної імунної системи, наприклад, Т-лімфоцитів (CD4 та/або CD8 T-лімфоцитів), В-лімфоцитів, антитіл і компонентів комплементної системи. Прикладом методу визначення є сортування флуоресцентно-активованих клітин (FACS). CD4 Тлімфоцити визначають переважно кількісно або у відсотках, більш переважно залежно від часу. Термін "СНІД" означає тут клінічний стан, що має характеристичні симптоми, пов'язані з пізніми стадіями ВІЛ-інфекції. Термін "вірусна інфекція РНК" означає тут інфекцію РНКовим вірусом, переважно ретровірусом. Прикладами РНКових вірусів, що мають відношення до винаходу, суть вірус поліомієліту, коксакі-вірус, каліцивірус, віруси гепатиту А, гепатиту С, гепатиту D, гепатиту E, ентеровірус, ріновірус, вірус краснухи, вірус центральноєвропейського енцефаліту, вірус грипу, респіраторно-синцитіальні віруси, вірус парагрипу, вірус кору, вірус епідемічного паротиту, коронавіруси, аренавіруси, Ласса вірус, Бунья вірус, ханта віруси, рабдовіруси, філовіруси, Борна хвороби вірус, вірус Т-клітинної лейкемії людини і ротавіруси. Термін "фармацевтичний препарат" означає 7 тут рослинний екстракт згідно з винаходом. Це також фармацевтичний препарат, що включає принаймні один фармацевтично активний компонент рослинного екстракту згідно з винаходом і/або принаймні одне похідне або аналог вказаного активного компонента і відповідних його солей. Фармацевтичний препарат може мати форму рідини, наприклад, розчину, сиропу, еліксиру, емульсії або суспензії, або тверду форму, наприклад, капсули, капсульної таблетки, таблетки, пігулки, порошку та супозиторія. Придатні для застосування також гранули, напіврідкі форми і капсули, вкриті желатиною. Якщо фармацевтичний препарат є рідиною або порошком, дозу можна визначити, наприклад, чайною ложкою. На додаток до рослинного екстракту або фармацевтично активного компонента фармацевтичний препарат може мати в своєму складі такі компоненти, як ароматизатори, підсолоджувачі, барвники, консерванти, стабілізатори, розріджувачі, суспендуючі речовини, гранулюючі речовини, змащувачі, зв'язувальні речовини та дезінтегратори. Наприклад, таблетка може бути покрита оболонкою. Рідина для ін'єкцій повинна бути стерильною. Також передбачається трансдермальна система доставки і ліпосомна система. Всі згадані форми можуть бути негайного, відстроченого і сповільненого вивільнення. Термін "фармацевтично прийнятний", як він використовується в цьому документі, означає, принаймні, не токсичний. "Фармацевтично прийнятне несуче середовище", згадане в цьому документі, може бути представлене великою різноманітністю форм залежно від бажаного способу введення. Термін включає загальновживані фармакологічні розчинники, такі як вода або етанол, і загальновживані компоненти таблетованих форм, такі як кукурудзяний крохмаль, лактоза, сахароза, сорбітол, тальк, стеаринова кислота, стеарат магнію, дикальцийфосфат або декстрин. Введення фармакологічного препарату, відповідного даному винаходу, може бути здійснено різними шляхами, такими як пероральний, сублінгвальний, парентеральний, внутрішньовенний, внутрішньоперитонеальний, назальний, вагінальний, ректальний, підшкірний, внутрішньошкірний, внутрішньом'язовий і ін. Кожна доза може бути введена за один або кілька разів за день, тиждень або місяць. Введення також може бути постійним краплинним або, наприклад, через систему повільного трансдермального введення. Таким чином, справжній винахід є комбінованим рослинним екстрактом Rosa sp., Urtica dioica та/або Tanacetum vulgare, підданий дії електромагнітного поля. Клінічні дані показали позитивний лікувальний ефект екстракту в лікуванні СНІДу. Дослідження, проведені in vitro і в експериментальній моделі на лабораторних тваринах виявили відсутність у екстракту токсичності, мутагенності або онкогенності. Проте він протипоказаний при вагітності. Винахід буде описано в докладніших деталях з приведенням прикладів, як це показано нижче. Даними прикладами, проте, не обмежуються права на власність винаходу і межі захисту цих прав. Приклад 1: Приготування свіжих рослинних 94082 8 екстрактів Листя і тонкі стебла кропиви (Urtica dioica) і пижма (Tanacetum vulgare) збираються в дикорослому вигляді. Після відбору придатного до використання матеріалу і первинної промивки матеріал висушується на дерев'яній сітці в темному місці протягом 3-4 днів, переважно при 42°C. У висушеному стані рослинний матеріал повинен мати зелене забарвлення без якої-небудь зміни кольору, листя і стебла повинні легко кришитися. Для виготовлення екстракту використовуються герметичні скляні судини. Висушений рослинний матеріал подрібнюється на дрібні частини (2-5см) і поміщається в скляну судину так, щоб заповнити його без залишку. Після ущільнення (трамбування) матеріалу він заливається етанолом (96%; у даному документі відсоток розчину етанолу має на увазі його відсоток в об'ємному відношенні) так, щоб в судині не залишилося вільного місця. Судини поміщаються в інкубатор (37-45°C, переважно 42°С) на 20-40 днів до тих пір, поки не вийде розчин темнозеленого кольору. Для отримання екстракту дикої троянди (Роза canina) використовуються її висушені плоди. У іншому варіанті замість дикої троянди або на додаток до неї можуть використовуватися інші види роду Rosa. Плоди поміщаються в герметичні судини так, щоб заповнити їх до половини, і додається етанол. Судини поміщаються в інкубатор (37-45°C, переважно 42°С) на 20-40 днів до тих пір, поки не вийде розчин червоно-оранжевого кольору. Після витримки в інкубаторі, коли рослинний матеріал повністю втрачає забарвлення, екстракт відділяється від рослинного матеріалу шляхом пропускання через матерчатий фільтр. Приклад 2: Обробка електромагнітним полем Екстракт Rosa canina поміщають в електромагнітне поле на 3хв. Потім по 50-70мл опроміненого екстракту Rosa canina додають окремо до 2 л екстракту Urtica dioica і екстракту Tanacetum vulgare. До кожного літра комбінованого екстракту Urtica/Rosa і Tanacetum/Rosa додають по 16 міліграм селену і по 150 міліграм сечовини. У іншому варіанті додають або тільки селен, або тільки сечовину. Потім судини запечатують знову і поміщають в інкубатор при 42°C на 24 години. Після інкубації судини поміщають чотирикратно в електромагнітне поле, кожного разу по три хвилини, і після цього їх вміст з'єднують. Екстракт, що вийшов в результаті, пропускають послідовно через фільтр в 5мкм, 0,45мкм і 0,22мкм, і розливають в стерильні флакони. Після маркування і пакування рослинний екстракт готовий до застосування. Електромагнітне поле, в яке поміщають екстракт, є імпульсним, потужним і монополярним, при якому напрям електричного струму, що згенерував генератором магнітних імпульсів, залишається незмінним. Імпульсне магнітне поле має дуже широкий діапазон частот, від 5кГц до 750кГц. У даному прикладі використовують імпульс прямокутної форми. Проте, в інших варіантах можливо використовувати імпульс синусоїдальної або випадкової форми. Переважно використання імпульсу прямокутної форми з вписаною в нього синусоїдальною хвилею. Не дивлячись на те, що це не пов'язано ні 9 94082 з якою теорією, є гіпотеза, що особливий вид імпульсів, що генеруються, викликає деякі зміни у фізичній конфігурації атомів в молекулах та/або в розташуванні молекул в просторі, що веде до зміни їх хімічних властивостей. В процесі приготування рослинного екстракту використовується 3-4-хкратноє опромінювання електромагнітними імпульсами високої частоти по 2-5хв. Електрична потужність (ефективна потужність) імпульсів близько 20-100Вт, якнайкращий ефект досягається при значенні в 45Вт. Приклад 3: Доклінічне дослідження У доклінічному дослідженні рослинний екстракт, відповідний даному винаходу, випробовувався на наявність гострої і хронічної токсичності. При дослідженні на гостру токсичність препарату мишам лінії Balb/c і щурам лінії Вістара виконувалися одиничні внутрішньом'язові (в/м) ін'єкції. Хронічну токсичність препарату досліджували протягом 3 місяців на щурах лінії Вістара і протягом 1 місяця на собаках. Було досліджено можливий мутагенний, ембріотоксичний, тератогенний, алергенний, імунотоксичний ефекти рослинного екстракту, а також його дія на репродуктивну систему. В результаті проведених експериментів було доведено, що рослинний екстракт, відповідний справжньому винаходу, є малотоксичним препаратом при разовому введенні в/м мишам Balb/c і щурам Вістара. В умовах експерименту на гостру токсичність інтраперитонеальне введення екстракту, розведеного у фізіологічному розчині 1:5, виявило значення ЛД50 51-54мл/кг для щурів і 56/59мл/кг для мишей. При введенні мишам BАLB/c і щурам Вістарf рослинного екстракту в/м або в/п не спостерігалося ніяких специфічних або статевих відмінностей в чутливості лабораторних тварин до токсичного ефекту екстракту. Характер інтоксикації мишей BALB/с і щурів Вістара в дозах ЛД50 був схожий з отруєнням етиловим спиртом; при приготуванні рослинного екстракту етанол у високій концентрації застосовували як розчинник. При дослідженні хронічної токсичності рослинного екстракту після в/м введення щурам в дозах 0,07 і 0,21мл/кг раз на добу протягом 3 місяців (в 10 і 30 разів вище за добову дозу для людини) і собакам в дозі 0,07мг/кг (в 10 разів вище за добову дозу для людини) раз на добу протягом 1 місяця не спостерігалося будьякого пошкодження головних органів і організму тварин. Рослинний екстракт, відповідний справжньому винаходу, не володіє мутагенністю і не впливає на 10 репродуктивну функцію тварин. При введенні щурам рослинного екстракту в/м один раз в добу протягом вагітності (з першого дня до родів) в дозі 0,21мл/кг препарат виявив ембріотоксичні та тератогенні властивості. У зв'язку з цим він протипоказаний при вагітності. Крім того, при використанні в дозах 0,07 і 0,14мл/кг, що вводили морським свинкам щодня протягом 10 діб, рослинний екстракт не виявив алергічних або імунотоксичних властивостей. Як висновок необхідно відзначити, що результати токсикологічних досліджень показали, що рослинний екстракт згідно з винаходом, може бути використаний в систематичних клінічних випробуваннях з урахуванням його протипоказання при вагітності. 3.1. Гостра токсичність Дослідження проводили на 128 мишах BALB/с (чоловічої і жіночої статі, маса тіла 18-20г) і на 47 пацюках Вістара (чоловічої і жіночої статі, маса тіла 180-220г) при в/м введенні рослинного екстракту мишам і в/п введенні мишам і пацюкам. Рослинний екстракт розводили в стерильному фізіологічному розчині 1:10 і 1:5, піддослідним тваринам вводили різні кількості отриманого розчину. Для того, щоб визначити токсичний ефект препарату, лабораторних тварин спостерігали протягом 14 днів. Токсичність рослинного екстракту після одноразового введення лабораторним тваринам визначали двоступінчатим методом: спочатку приблизне значення ЛД50 встановлювали методом Даймана і Лебланка, потім встановлювали точні значення ЛД16, ЛД50±д.в. і ЛД84 пробіт-аналізом по Літчфілду і Вілкоксону. Проведені експерименти виявили, що одноразова в/м ін'єкція рослинного екстракту, розведеного 1:10 у фізіологічному розчині в дозах 25-50мл/кг мишам BALB/с не викликає інтоксикації і смерті тварин. Коли дози збільшують до 75-100мл/кг, спостерігається пониження рухової активності, але без смерті тварини. Ін'єкції рослинного екстракту, розведеного 1:5 у фізіологічному розчині в дозах 25-50мл/кг, викликали біль, виражений пригноблюваний стан і через декілька годин смерть тварин. Характер інтоксикації рослинним екстрактом у мишей був схожий з отруєнням етиловим спиртом (37,3мл/кг), який присутній в рослинному екстракті у високій концентрації як носій. Результати, одержані на пацюках Вістара, були схожі з тими, що спостерігалися у мишей BALB/с. Таблиця 1 Параметри гострої токсичності рослинного екстракту і етанолу (96%), розведених у відношенні 1:5 у фізіологічному розчині в різних концентраціях після введення лабораторним тваринам в/м і в/о Спосіб застосування внутрішньом'язовий внутрішньоочеревинний ЛД16 53 46 Показники токсичності [мл/кг] ЛД50±д.в. ЛД84 ЛД16 ЛД50±д.в. Чоловіча стать Жіноча стать миші BALB/с,рослинний екстракт 66±4,6 82 49 62±4,3 59±3,8 75 43 56±3,7 ЛД84 78 72 11 94082 12 Продовження таблиці 1 внутрішньоочеревинний 30,4 внутрішньоочеревинний 42 миші BALB/с, етиловий спирт 37,3±2,1 44,8 н.в.* Вістара пацюки, рослинний екстракт 54±4,3 71 8 н.в. н.в. 51±4,2 67 * н.в. - не визначено Дані, представлені вище в таблиці 1, показують, що токсичність рослинного екстракту відповідно до параметрів токсикометрії не має істотних відмінностей для в/м і в/о ін'єкцій. 3.2. Хронічна токсичність 3.2.1. Дослідження на щурах Дослідження токсичності рослинного екстракту згідно з винаходом проводили протягом 3 місяці шляхом в/м введення препарату пацюкам Вістара. Дані досліди були проведені на 90 пацюках Вістара (чоловічої і жіночої статі, маса тіла 180-220г), розділеним на 3 групи по 30 тварин в кожній (15 особин чоловічої статі і 15 жіночої). Перша група була контрольною (фізіологічний розчин), друга група одержувала рослинний екстракт в дозі 0,07мл/кг, і третя група одержувала рослинний екстракт в дозі 0,21мл/кг. Досліджувані дози рослинного екстракту були в 10 і в 30 разів вищими за добову терапевтичну дозу, рекомендовану для людини (0,5мл рослинного екстракту, розведеного в 5мл фізіологічного розчину або 0,007мл/кг). Результати показали, що в/м ін'єкції рослинного екстракту в дозах 0,07 і 0,21мл/кг не впливають на загальний стан і поведінку пацюків. Під час експерименту на хронічну токсичність не спостерігалося статистично значущої різниці в рівнях еритроцитів, лейкоцитів, тромбоцитів і гемоглобіну між тваринами, що одержали 0,07 і 0,21мл/кг рослинного екстракту, і тваринами в контрольній групі (таблиці 2 і 3). Таблиця 2 Гематологічні показники у щурів чоловічої статі після 3 місяців в/м введення рослинного екстракту 12 Період спостереження Початкове значення Через 1 місяць Через 3 місяці Період спостереження Початкове значення Через 1 місяць Через 3 місяці Період спостереження Початкове значення Через 1 місяць Через 3 місяці Період спостереження Початкове значення Через 1 місяць Через 3 місяці Еритроцити х 10 /л Контроль 7,3±0,6 7,3±0,5 7,6±0,4 9 Лейкоцити х 10 /л Контроль 11,4±0,7 11,7±0,6 11,2±0,7 9 Тромбоцити х 10 /л Контроль 660±30 672±33 667±29 Гемоглобін г/л Контроль 111±4 114±3 116±4 Рослинний екстракт 0,07мл/кг 0,21мл/кг 7,4±0,4 7,3±0,2 7,5±0,4 7,7±0,5 7,8±0,3 7,7±0,6 Рослинний екстракт 0,07мл/кг 0,21мл/кг 11,0±0,5 11,0±0,5 11,1±0,3 11,2±0,4 11,2±0,4 11,3±0,6 Рослинний екстракт 0,07мл/кг 0,21мл/кг 660±30 660±30 663±23 669±24 669±31 655±28 Рослинний екстракт 0,07мл/кг 0,21мл/кг 110±3 111±2 115±4 117±5 115±3 118±3 Таблиця 3 Гематологічні показники у пацюків жіночої статі після 3 місяців в/м введення рослинного екстракту 12 Еритроцити х 10 /л Період спостереження Початкове значення Через 1 місяць Через 3 місяці Контроль 7,2±0,4 7,1±0,4 7,3±0,4 Рослинний екстракт 0,07мл/кг 0,21мл/кг 7,2±0,3 7,0±0,3 7,4±0,5 7,6±0,4 7,7±0,4 7,8±0,3 13 94082 14 Продовження таблиці 3 9 Період спостереження Початкове значення Через 1 місяць Через 3 місяці Період спостереження Початкове значення Через 1 місяць Через 3 місяці Період спостереження Початкове значення Через 1 місяць Через 3 місяці Лейкоцити х 10 /л Контроль 11,3±0,4 11,5±0,5 11,2±0,6 9 Тромбоцити х 10 /л Контроль 670±27 678±24 667±25 Гемоглобін г/л Контроль 112±4 114±3 113±5 В рамках експерименту за визначенням хронічної токсичності в/м ін'єкції препарату щурам в дозах 0,07мл/кг і 0,21мл/кг не виявили значних змін загального білка сироватки крові. Відсутність ушкоджувальної дії рослинного екстракту при тривалому (3 місяці) введенні його щурам в дозах 0,07 і 0,21мл/кг обумовлено також стабільною активністю печінкових ферментів, таких як аспартаті аланінамінотрансфераза, лактат-дегідрогеназа і лужна фосфатаза. Тривале введення рослинного екстракту пацюкам не вплинуло на рівень білірубіну, холестерину, тригліцеридів, сечовини, креатиніну і глюкози сироватки крові у експериментальних тварин. Тривале введення в стегновий м'яз тварин препарату в дозах 0,07 і 0,21мл/кг, розведеного 1:10 у фізіологічному розчині, не виявило місцевої дратівливої дії. Макроскопічне дослідження не виявило якихнебудь токсичних або токсико-алергічних реакцій на рослинний екстракт у цієї групи тварин. Не було виявлено жодних змін внутрішніх органів (мозку, шишковидної залози, тимуса, трахей, легенів, серця, стравоходу, селезінки, печінки, Рослинний екстракт 0,07мл/кг 0,21мл/кг 11,6±0,5 11,4±0,3 11,2±0,3 11,5±0,5 11,1±0,4 11,2±0,3 Рослинний екстракт 0,07мл/кг 0,21мл/кг 660±20 671±25 669±27 673±22 668±21 662±22 Рослинний екстракт 0,07мл/кг 0,21мл/кг 110±3 111±4 118±4 119±4 119±6 119±7 підшлункової залози, надниркової залози, нирок, шлунку у обох статей) у цієї групи тварин протягом 3 місяців після в/м ін'єкцій рослинного екстракту в дозі 0,21мл/кг. 3.2.2. Дослідження на собаках Дослідження було проведено на 8 собаках (чоловічої статі, початкова маса тіла 12-14.5кг), які були розділені на 2 групи по 4 тварин в кожній: перша група - контроль, друга група - рослинний екстракт 0,07мл/кг. Дози препарату, що вводяться, були в 10 разів вищі за найвищі терапевтичні дози для людини. Досліджуваний препарат в дозі 0,07мг/кг був розведений в стерильному фізіологічному розчині відносно 1:10 і потім вводився в стегновий м'яз собак раз на добу протягом місяця. Электокардіографічне дослідження (ЕКГ), виконане на собаках перед початком експерименту і через 1 місяць після початку введення дози 0,07мл/кг, не виявило збільшення частоти серцевих скорочень або інших змін показників ЕКГ. Всі показники ЕКГ не відрізнялися перед і після експерименту у тварин, яких піддали терапії, від тварин в контрольній групі (таблиця 4). Таблиця 4 Показники ЕКГ у собак, що одержували рослинний екстракт у в/м ін'єкціях в дозі 0,07мл/кг протягом 1 місяця Показники ЕКГ R-R, мс P-Q, мс Q-T, мс QRS, мс ST, мс TP, мс P, мс R, мс T, мс Частота серцевих скорочень, хв. Початкове значення Рослинний екстракт Контроль 0,07мл/кг 467±38 458±35 86±12 89±16 139±19 146±18 40±6 39±3 0,4±0,2 0,4±0,2 189±19 1392±28 0,30±0,03 0,29±0,05 1,38±0,12 1,39±0,24 0,30±0,06 0,32±0,06 139±15 145±15 Результати показали, що в/м введення рослинного екстракту собакам раз на день протягом 1 Через 1 місяць Рослинний екстракт Контроль 0,07мл/кг 466±32 462±22 85±21 89±16 138±15 139±15 39±4 39±6 0,4±0,2 0,4±0,2 186±22 194±23 0,26±0,04 0,28±0,04 1,42±0,22 1,38±0,23 0,29±0,06 0,28±0,05 138±12 146±12 місяця в дозі 0,07мл/кг (в 10 разів вище за добову дозу для людини) не робить впливу на загальний 15 94082 стан і поведінку тварин, а також що дана терапія не змінює функціональний статус головних органів і систем організму тварин. Відповідно до даних гістологічного дослідження, у собак не було виявлено ніяких токсичних або місцевих дратівливих реакцій протягом 1 місяця після в/м ін'єкцій рослинного екстракту в дозі 0,07мл/кг. 3.3. Мутагенність. 3.3.1. Генні мутації у мікроорганізмів (Еймса проба) Мутагенну активність рослинного екстракту було оцінено методу визначення здатності речовини викликати мутації генів у мікроорганізмахіндикаторах в системі метаболічної активації in vitro і поза такою системою. Для ідентифікації му 16 тацій було застосовано метод засівання культури на чашках. Цей метод був запропонований Еймсом із співавторами, і як мікроорганізмамиіндикаторами ми скористались трьома автотрофними штамами на гістидині, а саме Salmonella typhimurium TA 98, TA 100 і TA 1537. Для проведення проби Еймса був одержаний наступний розчин рослинного екстракту: був відміряний і зважений початковий розчин препарату, після чого розбавлений дистильованою водою до концентрації 10мг/мл. Потім було виконане подальше розведення в дистильованій воді, і розчин поміщений в чашки Петрі. Досліджувався препарат в концентрації від 0,1 до 1000мкг на чашку. Як негативний контроль використовували дистильовану воду. Таблиця 5 Вплив рослинного екстракту на бактеріальний штам-індикатор ТА 98 в пробі Еймса Досліджувана речовина Доза мкг/чашка Негативний контроль (H2O) Позитивний контроль (2AA) Позитивний контроль (ANQO) 0 20 0,5 0,1 1,0 10,0 100,0 1000,0 Рослинний екстракт штам ТА 98 -S9 Mi1,2,3 Середнє MO/MK 33 29 37 32,8 1 000 000 000 568 567 614 6 17,8 35 32 35 34,0 1,04 29 32 37 32,5 0,99 28 34 38 33,1 1,01 27 30 26 27,6 0,84 29 28 33 29,9 0,91 МA + +S9 Mi1,2,3 Середнє MO/MK МA 40 36 31 35,5 1 1211 1280 1140 1209 34,0 + 000 000 000 30 42 45 38,4 1,08 40 35 29 34,4 0,97 36 35 32 34,3 0,97 19 27 31 25,1 0,71 30 28 39 32 0,90 Умовні позначення і скорочення: Mі - число ревертантів в чашці, M - середнє геометричне число, МО/МК - відношення кількості ревертантів в дослідженні та кількості ревертантів в негативному контролі, MA - мутагенна активність: "+" – наявність активності, "-" – відсутність активності. Таблиця 6 Вплив рослинного екстракту на бактеріальний штам-індикатор ТА 100 в пробі Еймса штам ТА 100 -S9 +S9 Mi1,2,3 Середнє MO/MK МA Mi1,2,3 Середнє MO/MK МA 0 144 223 228 194,2 1 188 287 206 223,2 1 20 000 0 0 0 0 0 0 - 2712 2008 2200 2288,2 10,2 + 2,0 1240 1368 1288 1297,6 6,68 + 000 000 000 0,1 185 154 225 185,8 0,96 190 253 284 239,0 1,07 1,0 154 169 213 177 0,91 176 185 222 193,3 0,87 10,0 153 201 242 195,2 1,00 175 185 193 184,2 0,82 100,0 165 221 213 198,0 1,02 146 202 201 181,0 0,81 1000,0 209 207 202 206 1,06 131 136 194 151,2 0,68 Доза мкг/чашка Досліджувана речовина Негативний контроль (H2O) Позитивний контроль (2AA) Позитивний контроль (натрій азид) Рослинний екстракт Таблиця 7 Вплив рослинного екстракту на бактеріальний штам-індикатор ТА 1537 в пробі Еймса Досліджувана речовина Негативний контроль (H2O) Позитивний контроль (2AA) Позитивний контроль (9АА) Доза мкг/чашка 0 20 20 штам ТА 1537 -S9 +S9 Mi1,2,3 Середнє MO/MK МA Mi1,2,3 Середнє 6 6 10 7,11 1 9 9 11 9,62 000 000 000 126 144 118 128,9 5448 5632 5752 5609,3 788,5 + 000 000 MO/MK 1 13,4 000 МA + 17 94082 18 Продовження таблиці 7 0,1 1,0 10,0 100,0 1000,0 Рослинний екстракт 664 877 10 10 9 555 10 8 9 5,24 7,32 9,65 5,00 8,96 З наведених вище даних ми можемо зробити висновок, що рослинний екстракт в концентрації 0,1-1000 мкг на чашку не викликає збільшення числа ревертантів у Salmonella typhimurium штамів ТА 98, ТА 100, ТА 1537. Таким чином, відповідно до проби Еймса, рослинний екстракт не має мутагенного ефекту. 3.3.2. Домінантні летальні мутації в зародкових клітинах мишей 0,74 1,03 1,36 0,70 1,26 768 10 8 8 533 879 765 6,95 8,62 3,56 7,96 5,94 0,72 0,90 0,37 0,830,62 З метою оцінки можливих мутагенних властивостей рослинного екстракту були проведені експерименти по дослідженню домінантних летальних мутацій у мишей гібридів F1 (CBAxC57BI6). Рослинний екстракт, розведений у фізіологічному розчині, було уведено в/м мишам чоловічої статі в дозі 0,7мл/кг. Доза в 100 разів перевищувала рекомендовану добову дозу для людини (0,007мл/кг). Таблиця 8 Результати здатності рослинного екстракту викликати домінантні летальні мутації в клітинах зародків мишей Стадії сперматогенезу Нормальні сперматозоїди Пізні сперматиди Ранні сперматиди Доза 0 (контроль) Рослинний екстракт 700мкл/кг 0 (контроль) Рослинний екстракт 700мкл/кг 0 (контроль) Рослинний екстракт 700мкл/кг Рослинний екстракт 700мкл/кг Рослинний екстракт 700мкл/кг Повторні експерименти Середнє 2-х експериментів Сума експериментів і повторних експериментів Рослинний екстракт 700мкл/кг Результати 4-го тижня Рослинний екстракт 700мкл/кг Як видно з таблиці 8, частота відторгнення зародка після імплантації у тварин, яким уводили один раз в/м рослинний екстракт в дозі 700мкл/кг, не перевищує частоти такого відторгнення у тварин в контрольній групі. 3.3.3. Хромосомна аберація в клітинах кісткового мозку мишей Суть цього методу полягає в оцінці впливу ре Загальна кількість особин жіночої статі 41 39 42 39 42 38 32 35 70 33 Кількість вагітних Фертиль- Втрати 2 особин ність після імХ жіночої (%) плантації статі 33 80,5 0,112 34 75,6 0,011 30 71,4 0,082 29 74,4 0,037 38 90,5 0,055 29 76,3 0,143 9,87 24 75,0 0,061 0,018 27 90,5 0,099 2,93 53 33 76,0 100 0,097 0,040 човини, що вивчається, введеної в організм тварини, на генетичну систему клітин кісткового мозку, чутливих до впливу хімічних речовин і фізичних чинників. Хромосомні аберації аналізували після введення рослинного екстракту по схемі, описаній в "Інструкції для експериментальних (доклінічних) досліджень нових фармакологічних препаратів". Таблиця 9 Структурні пошкодження хромосом в клітинах кісткового мозку мишей під дією рослинного екстракту Варіанти № Рослинний екстракт, 700мкл/кг (підраховано після 24 годин) 1 2 3 4 5 Загалом Рослинний екстракт, 700мкл/кг ін'єкції 4 дні (підраховано через 6 годин після 4го дня) Загалом 1 2 3 4 5 Кількість клітин З абераціями 100 0 100 1 100 2 100 2 100 0 500 5 100 0 100 1 100 2 100 1 100 0 500 4 Підраховано Аберації Фрагменти Одиночні Парні 0 0 0 0 2 0 2 0 0 0 4 0 0 0 0 0 2 0 1 0 0 0 3 0 Обмін Кількість Інтервали 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 1 0 1 0 0 0 1 19 94082 20 Продовження таблиці 9 Нормальний фізиологічний розчин 1 2 3 4 5 Загалом 100 100 100 100 100 500 2 1 2 0 0 5 Як видно з даних експерименту, статистично значуща різниця в рівні хромосомних аберацій в кістковому мозку мишей, яких піддали дії рослинного екстракту в тестових дозах, в порівнянні з контрольною групою не спостерігалася. Тому, відповідно до результату тесту на хромосомні аберації в клітинах кісткового мозку, можна зробити висновок, що рослинний екстракт не має мутагенної активності. 3.3.4. Ушкоджувальна дія на ДНК згідно з методом SOS-хромотеста Одним з тестів на пошкодження ДНК є тест на визначення індукції SOS-відповіді бактерійної стінки під впливом досліджуваної речовини, так званий SOS-хромотест. Тест заснований на знанні SOS-відповіді на пошкодження ДНК. Основою тесту є штам E. coli PQ 37, створений за допомогою асоціації гена LacZ, відповідального за синтез ферменту бета-галактозидази, з геном SfiA, керованим головним репресором SOS-системи. При пошкодженні ДНК індукується експресія SfiA як компоненту SOS-відповіді. У даному тесті SOSвідповідь вимірюється з допомогою якісного визначення ферментної активності бетагалактозидази, яка оцінюється з допомогою кольорової реакції. Маркером росту клітин в даному штамі є лужна фосфатаза, активність якої може бути також виміряна з допомогою кольорової реакції. В результаті аналізу було одержано криві за 2 0 1 0 0 3 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 1 0 0 2 лежності синтезу бета-галактозідази від концентрації досліджуваної речовини, а також криві, що характеризують зміни росту бактерій в даних умовах. Відповідно до цих значень було підраховано потенційну можливість індукції SOS-відповіді. Ця потенційна можливість відображає здатність речовини індукувати експресію гена sfiA. Отримані результати показали, що рослинний екстракт не індукував активації системи відновлення ДНК для всіх досліджених концентрацій у E. coli PQ 37. Таким чином, рослинний екстракт не має ушкоджувальної дії на ДНК. 3.4. Ембріотоксичність і тератогенність Експеримент було проведено на 36 вагітних пацюках Вістара, розділених на дві групи по 18 пацюків в кожній: перша група контрольна, друга рослинний екстракт (у дозі 0,21мл/кг, що в 30 разів перевищує максимальну добову дозу для людини). Препарат був розведений фізіологічним розчином і вводився пацюкам в/м один раз в день протягом всього періоду вагітності (з першого дня до родів). Контрольним тваринам вводили відповідну кількість фізіологічного розчину щодня з першого дня вагітності і до родів. На 20-й день вагітності 70% вагітних пацюків забивали шляхом зсуву шийних хребців в цілях вивчення кісткового скелета і внутрішніх органів плодів і визначення ознак їх загибелі перед і після імплантації. Таблиця 10 Зміни маси тіла вагітних пацюків (% від початкового) Групи тварин Контроль Рослинний екстракт, 0,21мл/кг 1 тиждень 123±1,9 112,5±1,5* 2 тижні 136,7±2,2 120,5±3,4* 3 тижні 145,7±2,8 131,6±4,5* Примітка: * указує на істотну різницю (P
ДивитисяДодаткова інформація
Назва патенту англійськоюHerbal extract of immunomodulatory action from rosa sp., urtica dioica and/or tanacetum vulgare
Автори англійськоюNovitsky Yury Alexevich, Madani Hessamedin, Gharibdoust Farhad, Farhadi Mohammad, Farzamfar Bardia, Mohraz Minoo
Назва патенту російськоюРастительный экстракт с иммуномодулирующим действием, полученным из rosa sp., urtica dioica и tanacetum vulgare
Автори російськоюНовитский Юрий Алексевич, Мадани Гессамедин, Гарибдоуст Фагад, Фагади Могаммад, Форсамфар Бардиа, Мограс Миноо
МПК / Мітки
МПК: A61P 31/18, A61K 36/185, A61K 36/28, A61K 36/738, A61K 41/00
Мітки: отриманий, dioica, імуномодуляторною, рослинній, екстракт, дією, tanacetum, vulgare, urtica
Код посилання
<a href="https://ua.patents.su/16-94082-roslinnijj-ekstrakt-z-imunomodulyatornoyu-diehyu-otrimanijj-z-rosa-sp-urtica-dioica-ta-tanacetum-vulgare.html" target="_blank" rel="follow" title="База патентів України">Рослинний екстракт з імуномодуляторною дією, отриманий з rosa sp., urtica dioica та tanacetum vulgare</a>
Наступний патент: Нетканий волокнистий матеріал (варіанти) та електроди, виготовлені з нього
Випадковий патент: Спосіб визначення твердості металу та пристрій для його здійснення