Нанорозмірний паладієвий гетерогенний каталізатор для проведення реакцій крос-сполучення
Номер патенту: 110043
Опубліковано: 10.11.2015
Автори: Огенко Володимир Михайлович, Шаранда Людмила Федорівна, Бумагін Микола Олександрович, Волков Сергій Васильович
Формула / Реферат
1. Композиційний матеріал, що відповідає формулі Pd-C(N)/Al2O3, де вміст вуглецю на Аl2О3 становить від 5 до 30 мас. % та вміст азоту становить від 0,5 до 7 мас. %; причому вуглець є оболонкою, ковалентно зв'язаною з поверхнею оксиду алюмінію; Аl2О3 є непористим, вміст паладію становить від 1 до 10 мас. %.
2. Композиційний матеріал, за п. 1, де ядро-оксид алюмінію має розміри від 1 до 100 нм.
3. Композиційний матеріал, за пунктом 1 або 2, в якому частинки паладію мають розміри від 0,1 до 10,0 нм.
4. Спосіб одержання композиційного матеріалу за будь-яким з пп. 1-3, який включає стадії за якими:
• поверхню оксиду алюмінію обробляють органічним 4,4-метилдифенілдіізоціанатом, попередньо розчиненим в органічному розчиннику,
• проводять піроліз одержаного продукту при температурі 600-1000 °С з утворенням ковалентно зв'язаної вуглецевої оболонки,
• до синтезованого оксиду алюмінію з вуглецевим покриттям додають розчин сполуки паладію в органічному розчиннику.
5. Спосіб за п. 4, де сполукою паладію є біс(дибензиліденацетон) паладію (Pd(dba)2).
6. Застосування композиційного матеріалу за будь-яким з пп. 1-3 як каталізатора в реакціях крос-сполучення, зокрема реакцій Хека, Негіші, Сузукі, Кумади, Соногашири.
Текст
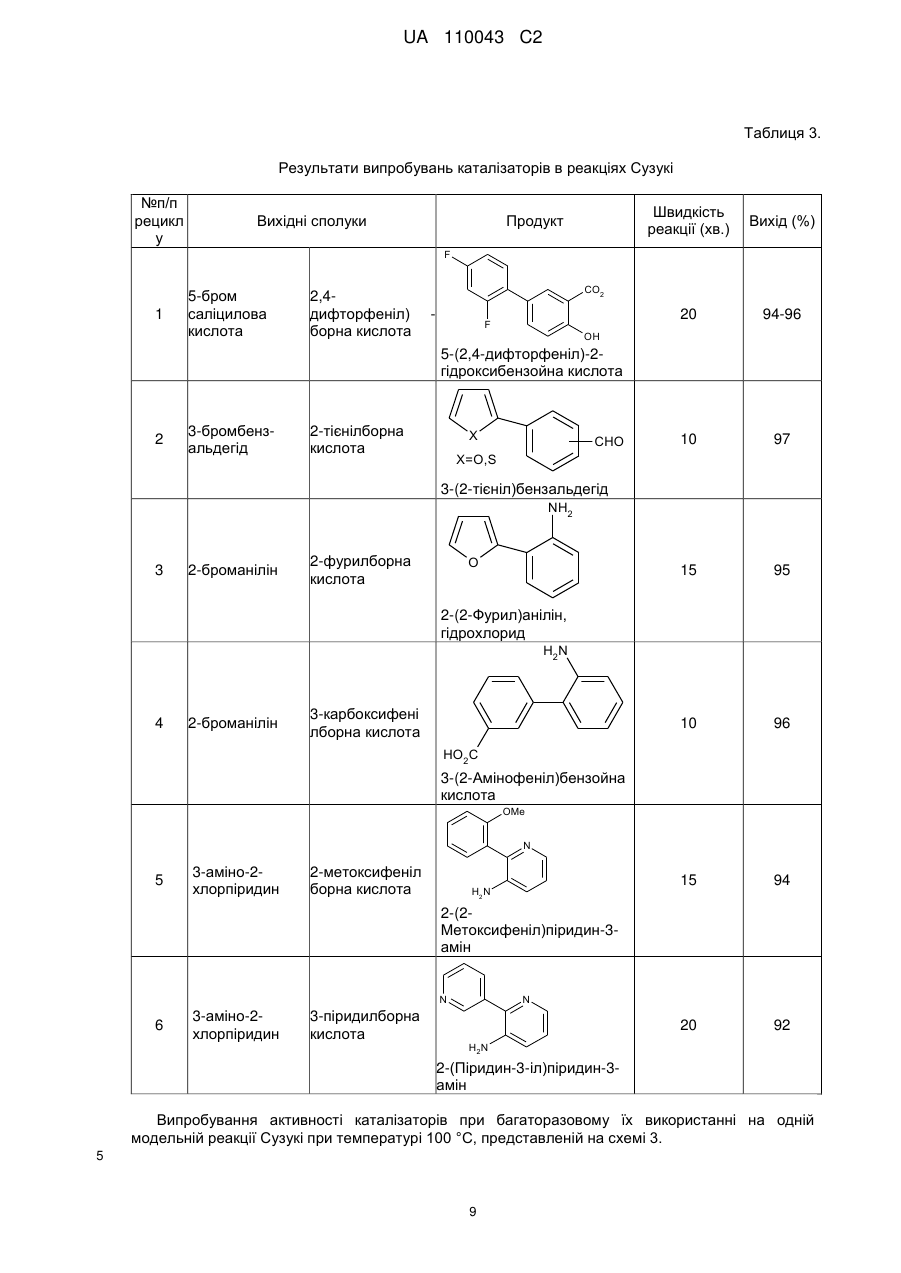
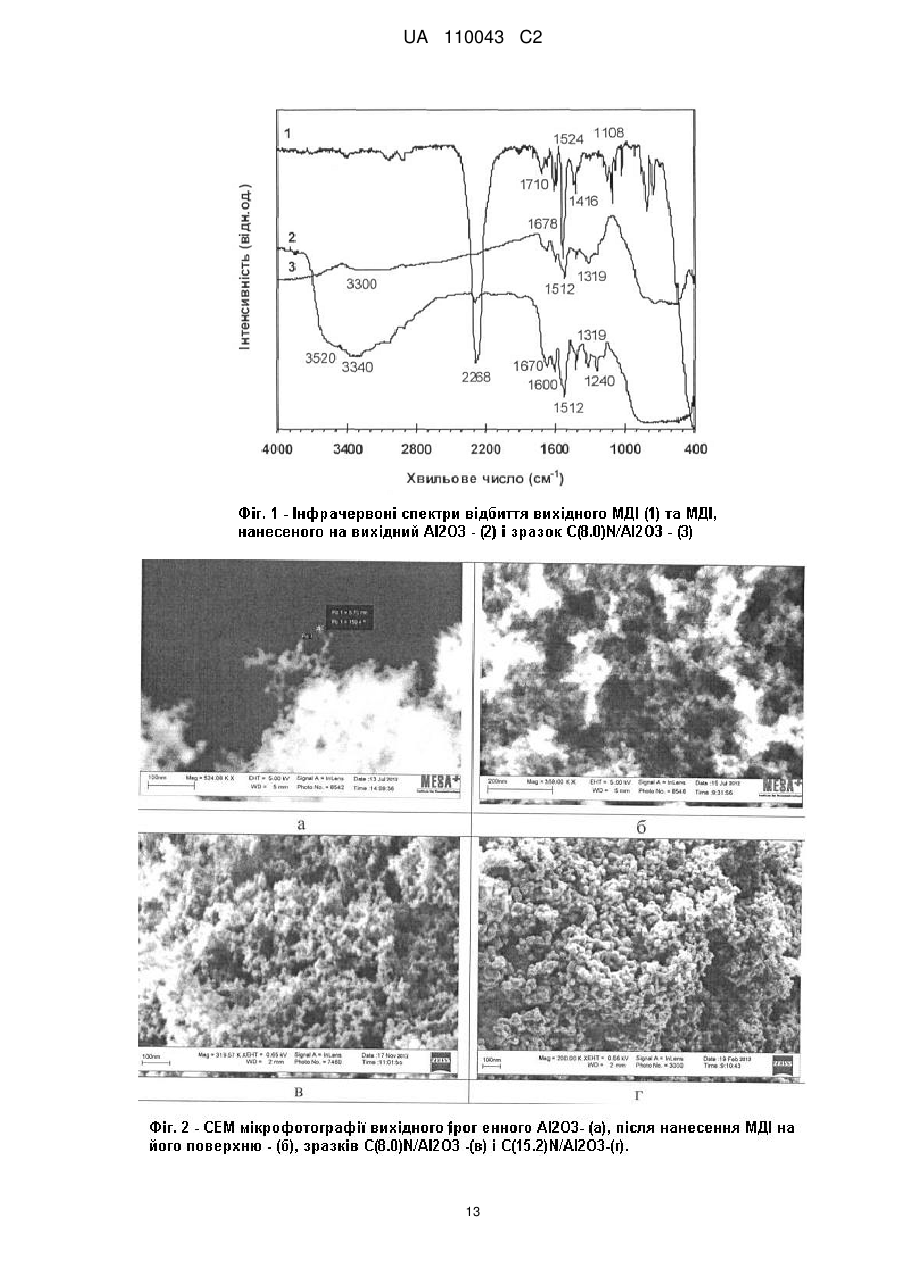
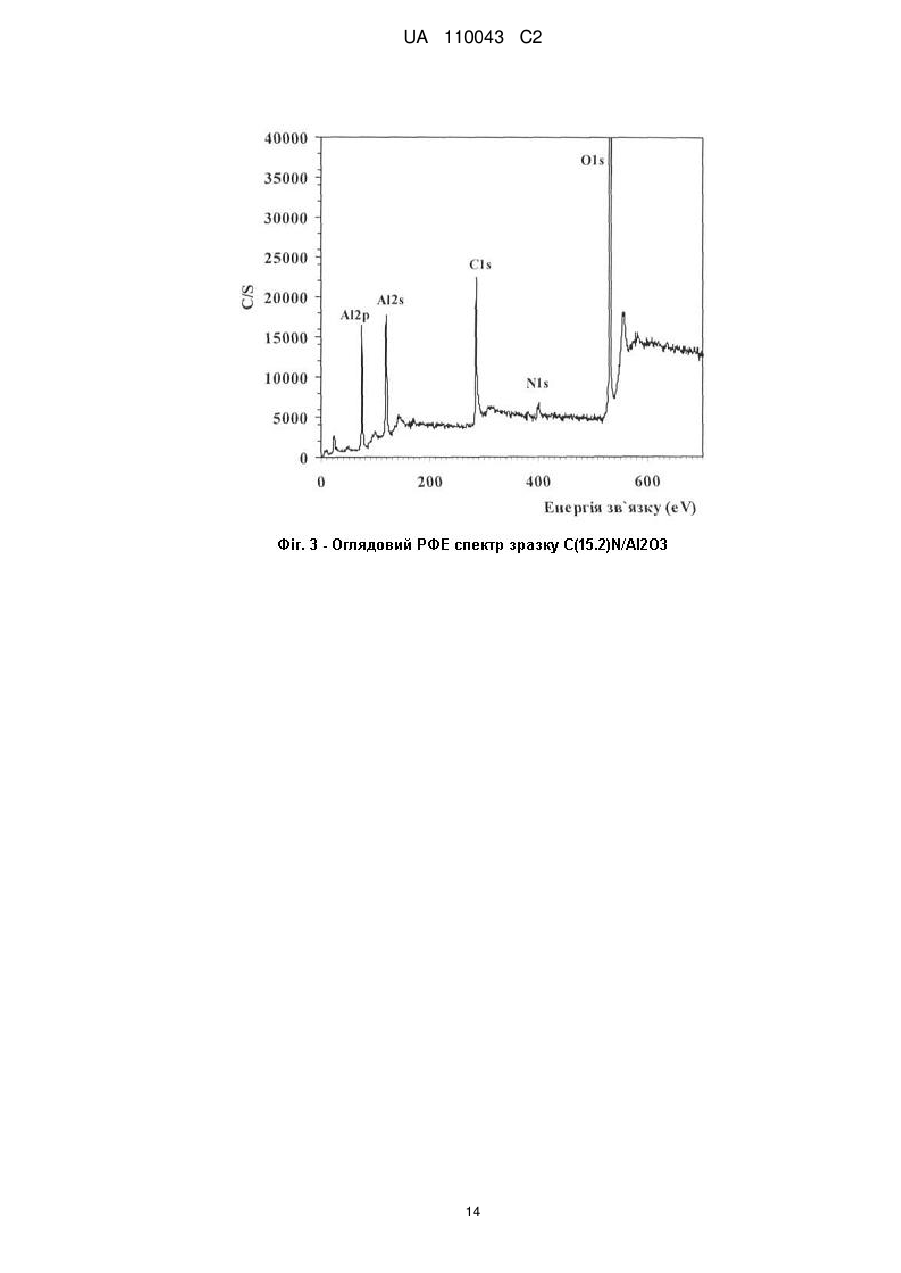
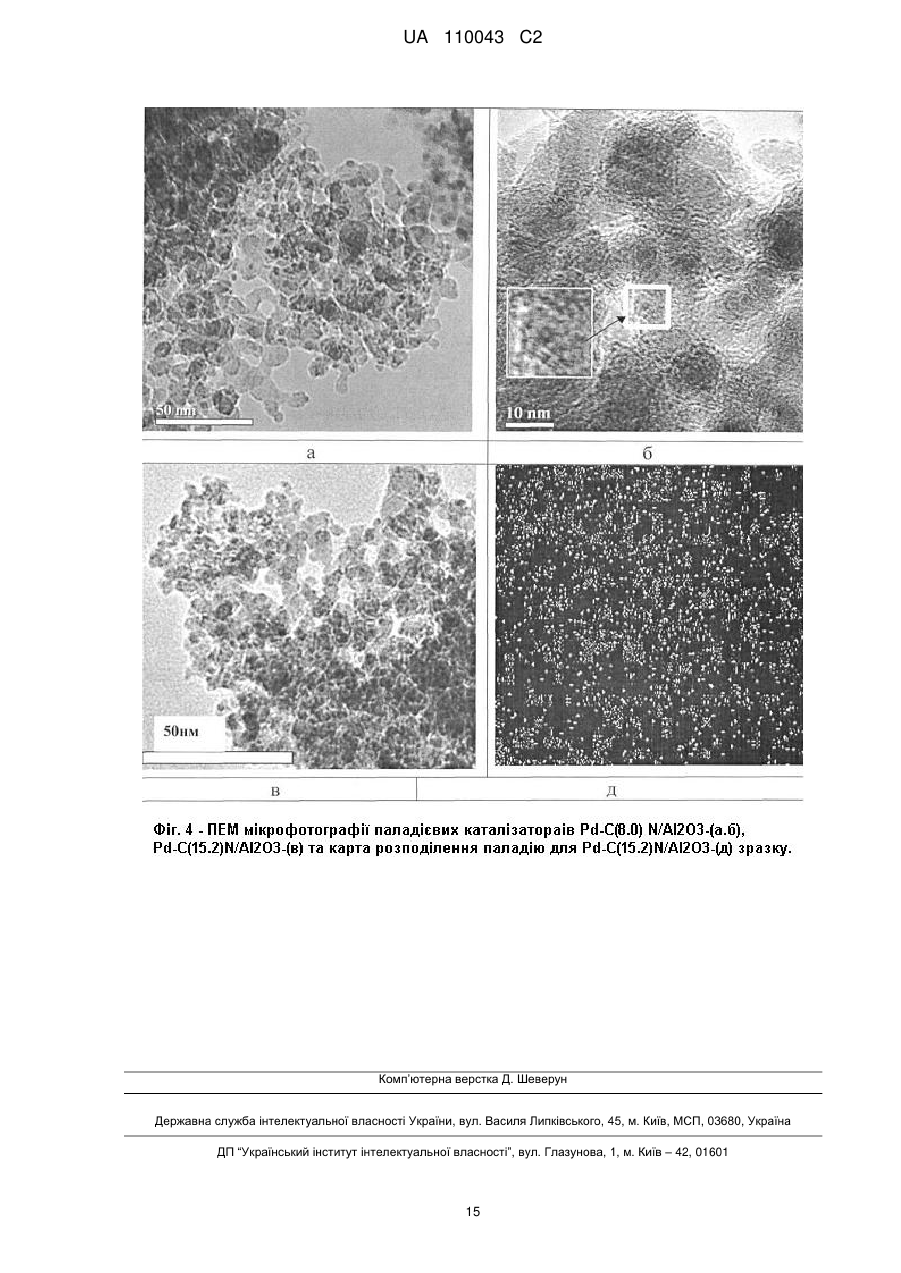
Реферат: Винахід належить до галузі органічної хімії, а саме стосується створення нових нанорозмірних непористих багаторазового застосування гетерогенних паладієвих каталізаторів зі структурою "ядро-вуглецева оболонка-паладій", способу їх синтезу та їх застосування в реакціях кроссполучення, зокрема реакцій Хека, Негіші, Сузукі, Кумади, Соногашири, де вони проявляють високу каталітичну активність. UA 110043 C2 (12) UA 110043 C2 UA 110043 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід належить до галузі органічної та каталітичної хімії, а саме стосується створення нових каталізаторів та їх застосування в реакціях крос-сполучення, зокрема реакцій Хека, Негіші, Сузукі, Кумади, Соногашири. Утворення зв'язку вуглець-вуглець (С-С) є надзвичайно важливим процесом, який відіграє ключову роль в синтезі органічних сполук. Реакції крос-сполучення використовуються в органічному синтезі для одержання поліфункціональних біарилів, арильованих олефінів та ацетиленів, а також їх гетероциклічних аналогів. Сполуки такого типу є структурними елементами сучасних лікарських препаратів, складовими рідкокристалічних композитів, електропровідних полімерів тощо (Miyaura К; Suzuki A. Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds // Chem. Rev. - 1995. - Vol. 95. - P. 2457-2483, Lunxiang Yin, Jürgen Liebscher. Carbon-carbon coupling reactions catalyzed by heterogeneous palladium catalysts. // Chem. Rev. - 2007. - Vol. 107. - P. 133-173; John D. Aiken III, Richard G. Finke. A review of modern transition-metal nanoclusters: their synthesis, characterization, and applications in catalysis // J. of Моl. Catal. A. Chem. - 1999. - Vol. 145. - P. 1-44; Martin H.G. Prechtl, Jackson D. Scholten, Jairton Dupont, Carbon-Carbon Cross Coupling Reactions in Ionic Liquids Catalysed by Palladium Metal Nanoparticles // Molecules. - 2010. - V. 15. - P. 3441-3461; B.B. Афанасьев, Н.Б. Беспалова, И.П. Белецкая, Перспективы использования палладий катализируемых реакций в тонком органическом синтезе: создание связи углерод-углерод // Рос. хим. ж. - 2006. - Т. L, № 4. - Р. 8193; Gerhard Ertl. Reactions at Surfaces: From Atoms to Complexity (Nobel Lecture) // Angewandte Chemie. - 2008. - Vol. 47. - P. 3524-3535; О. Костюк. Паладієвий каталізатор // Вісн. HAH України - 2010. № 12. - P. 60-65). В гомогенному каталізі реакції крос-сполучення проводяться із застосуванням Pd(II)/Pd(0) комплексів як ліганди яких можуть бути фосфіни, гетероциклічні карбени, оксазоліни, піридини, гідразони, піразоли, фенантроліни, хіноліни, карбазони, тетразоли, амінокислоти, аміни, тіоли, дендримери. Проте, внаслідок високої вартості, низької стабільності, високої токсичності, легкого окиснення, необхідності застосування органічних розчинників та інертної атмосфери, труднощів з відокремленням каталізатора, лише невеликий відсоток гомогенних паладієвих каталізаторів застосовуються в процесах тонкого органічного синтезу (Bellina F., Carpita A., Rossi R. Palladium Catalysts for the Suzuki Cross-Coupling Reaction: An Overview of Recent Advances // Synthesis. - 2004. - Vol.15. - P. 2419-2440; Chu-Hua Lu, Feng-Chih Chang Polyhedral oligomeric silsesquioxane-encapsulating amorphous palladium nanoclusters as catalysts for Heck reactions // ACS Catal. - 2011. - Vol. 1. - P. 481-488; Didier Astruc, Catia Ornelas, Abdou K. Diallo, Jaime Ruiz. Extremely Efficient Catalysis of Carbon-Carbon Bond Formation Using "Click" DendrimerStabilized Palladium // Molecules - 2010. - Vol. 15. - P. 4947-4960). Гетерогенні каталізатори можуть бути більш стабільними, дешевшими, легко відділятися від продуктів реакцій, використовуватися багаторазово. Головним недоліком гетерогенних каталізаторів є те, що дуже часто паладій розчиняється в реакційній суміші, що призводить до падіння активності при повторному використанні. Крім того, спостерігається агрегація частинок нанесеного паладію на поверхні носія та значного збільшення (>1 мкм) їх розміру, що також призводить до втрати каталітичної активності. На даний час, зусилля багатьох лабораторій спрямовані на розроблення ефективних багаторазових каталітичних систем з оптимальними структурними та енергетичними властивостями, які б могли забезпечити високу активність та селективність каталітичних реакцій у водному середовищі (Polshettiwar К, Decottignies A., Len С, Fihri A., Suzuki-Miyaura Cross-Coupling Reactions in Aqueous Media: Green and Sustainable Syntheses of Biaryls // ChemSusChem. - 2010. - Vol. 3, № 5. - p. 502-522; J.M. Thomas, W.J. Thomas Principles and practice of heterogeneous catalysis. - Weinheim: VCH, 1997. VCH-669p; Beatrix Roldan Cuenya Synthesis and catalytic properties of metal nanoparticles: Size, shape, support, composition, and oxidation state effects // Thin Solid Films. - 2010. - Vol. 518. - P. 31273150; Wagner M., Kohler K., Djakovitch L., Weinkauf S., Hagen V., Muhler M. Heck reactions catalyzed by oxide-supported palladium-structure-activity relationships // Topics in catalysis - 2000. Vol. 13, № 3 - Vol. P. 319-326). Відомим способом одержання паладієвого каталізатора формули [[M(II)1-xM(III)x(OH)2] [Pd(0)], є синтез його шляхом взаємодії тетрахлорпаладату натрію Na2PdCl4 з носієм загальної x+ n2+ 2+ 2+ формули [M(II)1-xM(III)x(OH)2 ] [А ], де М(ІІ) це двовалентні катіони групи Mg , Mn , Fe , СО2+, 2+ 2+ 2+ 2+ 3+ 3+ 3+ 3+ n-1 Ni , Cu , Zn , Са ; М(III) - тривалентні катіони Аl , Сr , Mn , Fe ; А - нітрат, карбонат, хлорид аніони. Наприклад, суміш солей хлоридів магнію та алюмінію розчиняють в воді та осаджують розчином лугу NaOH в інертному середовищі (потоці азоту) протягом 24 годин, після висушування додають паладат натрію, перемішують 12 годин і відновлюють паладій до металічного Pd(0) стану гідразином протягом трьох годин. Недоліками каталізаторів є: великий вміст паладію (1 мол. %), невелика швидкість каталітичних реакцій (8-48 годин), необхідність 1 UA 110043 C2 5 10 15 20 25 30 35 40 45 50 55 60 наявності інертної атмосфери та проведення реакцій в органічних розчинниках (1,4 діоксані, тетрагідрофурані). (Дивись: Pat. ЕР 1 464 394 В1. Supported nanopalladium catalyst for C-C coupling reactions of haloarenes / Choudary Boyapati Manoranjan, Naidu Madhi Sateesh, Chowdari Sreenivasa, Kantam Mannepalli Lakshmi, Sreedhar Bojjaackie Y. Ying, Nandaman Erathodiyil. Publ. September 05, 2007). Відомими є паладієві комерційні каталізатори марки Е 105 NN/W 5 % Pd, E105 R/W 5 % Pd, E 105 RO / W 5 % Pd, E 105 KR / W 5 % Pd, E 105 Y / W 5 % Pd (продукти компанії "Degussa AG", Німеччина), які одержують з використанням таких носіїв як деревне вугілля, активоване вугілля 2 або графіт з питомою поверхнею SБЕТ(N2)=800-1120 м /г, розміром частинок 23 мкм, з розвиненою мікро-, мезо-, та макропористою структурою. Вуглецеві носії модифікують азотовмісними сполуками, фтором, бромом, хлором, карбонатами лужних або лужноземельних металів. Далі вуглецеві матеріали просочують паладійхлористоводневою кислотою з наступним відновленням паладію до металічного стану формальдегідом або гідразином. Вміст паладію в таких каталізаторах складає 1-10 мас. %. Недоліками каталізатора є: необхідність створення інертної атмосфери; висока температура реакції 100-140 °C, зниження якої до 80 °C призводить до розчинення паладію до 28.6 % в реакційній суміші; реакції відбуваються в органічних розчинниках (N,N-диметилацетамід, N-метилпіролідон, толуол), невелика швидкість каталітичної дії (1-4 годин); спостерігається розчинення паладію в реакційній суміші, що призводить до втрати каталітичної активності при повторному використанні каталізаторів.(Дивись: Pat. US 7102045 В2. Method for carrying out-CC-coupling reaction / Jurgen Kraute, Jorg Pietschm, Peter Panster, Klaus Kohler Roland Heidenreich. Publ. September 05, 2006.; Roland G. Heidenreich, Klaus Kohler, Jurgen G E. Krauter, Jorg Pietsch. Pd/C as a highly active catalyst for Heck, Suzuki, Sonogashira reactions. // Synlett. - 2002. - Vol. 7. - P. 1118-1122.; Klaus Kohler, Roland G. Heidenreich, Jtirgen G E. Krauter, Jorg Pietsch. Highly Active Palladium/Activated Carbon Catalysts for Heck Reactions: Correlation of Activity, Catalyst Properties, and Pd Leaching. // Chem. Eur. J. - 2002. - Vol. 8, № 3. - P. 622-631.) Відомим способом одержання паладієвого каталізатора є спосіб, за яким спочатку синтезують мезоструктурований оксид кремнію зі стільниковою структурою (MCF), з використанням як пороутворювача Pluronic P123 в середовищі триметилбензену, потім додають тетраортосилікат, хлористоводневу кислоту, витримують 24 години та прогрівають при 550 °C. Синтезований MCF має тривимірну пористу структуру зі стільникоподібними порами розміром 20-50 нм, які зв'язані між собою вікнами розміром 9-22 нм та питомою поверхнею SБЕТ(N2)=1002 1000 м /г. Потім проводять функціоналізацію MCF сполуками типу (RO)3Si(CH2)3NHCONH2, (RO)3Si(CH2)3NHCSNH2, (RO)3Si(CH2)3NHCONH(CH2)3Si(OR)3, (RO)3Si(CH2)3NHCSNH(CH2)3Si(OR)3, які містять аміно, тіольні, сечовинні, спиртові групи протягом 24 годин при температурі 80 °C. Потім до функціоналізованого MCF додають хлорид чи ацетат паладію, який попередньо розчиняють в органічному розчинникові (діоксані, дихлоретані, хлороформі, чотирихлористому вуглеці), витримують протягом 6-60 годин при температурі 40-100 °C, висушують і відновлюють за допомогою метилового спирту. Недоліками каталізатора є: великий вміст паладію (1 мол. %), невелика швидкість каталітичних реакцій (824 годин), вимога до наявності інертної атмосфери та проведення реакцій в органічних розчинниках. (Дивись: Pat. US 8227640 В2, Palladium catalysts, Jackie Y. Ying, Nandanan Erathodiyil. July, 24 2012). Відомим є спосіб одержання паладієвого каталізатора за яким до розширеного графіту, який синтезують шляхом модифікування графіту сірчаною та фосфорною кислотами перманганатом калію, пероксидом водню, додають поверхнево-активну речовину (ПАР) – додецилсульфат натрію (SDS), обробляють суміш ультразвуком та додають ацетат паладію з наступним кип'ятінням при 110 °С протягом чотирьох годин. Недоліками каталізатора є: великий вміст паладію (1,1 мол. %); каталітична активність в реакції Сузукі на 10 циклі каталізу падає на 21 %; каталітичні випробування проводять за умови присутності поверхнево-активної речовини додецилсульфату натрію, що може приводити до забруднення продуктів реакції. (Дивись: Yang Li, Xiaobin Fan, Junjie Qi, Junyi Ji, Shulan Wang, Guoliang Zhang, Fengbao Zhang. Palladium Nanoparticle-Graphene Hybrids as Active Catalysts for the Suzuki // Nano Res. - 2010. - Vol.3. - P. 429-437). Найближчим аналогом є паладієвий каталізатор, який одержують на основі мезопористого вуглецю (СМК-3), який синтезують наступним чином: спочатку одержують (SBA-15) мезопористий оксид кремнію з гексагональною структурою шляхом гідротермальної обробки суміші ортосилікату кремнію, пороуворювача Pluronic P123, хлористоводневої кислоти при температурі 550 °C. Далі SBA-15 обробляють розчином сахарози, нагрівають при температурі 950 °C в вакуумі та розчиняють оксид кремнію в фтористоводневій кислоті та одержують 2 UA 110043 C2 5 10 15 20 25 30 35 40 45 50 55 60 мезопористий вуглець СМК-3, на поверхню якого наносять біс(ацетилацетонат) паладію. Недоліками каталізатора є: висока енергоємність процесу, необхідність створення інертної атмосфери, реакції з достатньо високим виходом (93.1 %) можна одержати тільки в середовищі органічного розчинника - о-ксилолі та тільки за рахунок дії мікрохвильового випромінення з частотою 2.45 ГГц, обмеженість об'ємів синтезу продуктів реакції, складність контролю параметрів процесу. Даних по активності синтезованих каталізаторів при проведенні рециклів каталітичних реакцій не наведено. (Дивись: Satoshi Inagaki, Kenzo Onodera, Kensaku Tani, Yoshihiro Kubota. Selective Heating of Pd-Modified Ordered Mesoporous Carbon CMK-3 by Microwave Irradiation // Bull. Chem. Soc. Jpn. - 2011. - Vol. 84, № 10. - P. 622-631). Крім того, нами раніше повідомлялося про розробку алюмовуглецевого паладієвого каталізатора, який одержують модифікуванням поверхні оксиду алюмінію арилізоціанатом з наступним його піролізом та нанесенням комплексу Pd(0). В публікаціях не розкрито склад каталізатора. Вуглецеве покриття на поверхні Аl2О3 синтезують шляхом прищеплення 2,4діізоціанаттолуолу та наступним його піролізом в інертній атмосфері. Вміст вуглецю і паладію в каталізаторі склав 4,3 та 1,0 мас. %, відповідно. Недоліками каталізатора є: великий вміст паладію (1.0 мол. %); невелика швидкість каталітичних реакцій (1-1.5 години); при проведенні реакцій крос-сполучення за участю арилбромідів, які є більш дешевими і доступнішими реагентами, ніж арилйодиди, швидкість реакції сповільнюється і становить 2-3 год. (Дивись тези доповідей на конференціях: Бумагин Н.А., Шаранда Л.Ф., Голицына Н.Е., Огенко В.М., Волков С.В. Высокоэффективные палладиевые катализаторы для тонкого органического синтеза на основе пирогенного оксида алюминия с углеродным покрытием // Российский конгресс по катализу "Роскатализ" (3-7 октября 2011 г). - Москва РФ 2011. - С. 156; Огенко В.М., Бумагин Н.А., Шаранда Л.Ф., Голицына Н.Е., Волков С.В., Ливанцов М.В. Алюмоуглеродные нанокомпозиты в разработке палладиевых катализаторов для экологически безопасных процессов тонкого органического синтеза // Программа и Тезизы Международной конференции " Прикладная физико-неорганическая химия" (2-7 октября 2011 р.) - Севастополь 2011. - С. 34; Н.А. Бумагин, Л.Ф. Шаранда, Н.Е. Голицина, В.М. Огенко, С.В. Волков Н.Е. Голанцов Многоразовые палладиевые катализаторы на основе алюмоуглеродных нанокомпозитов для каталитических процессов в воде. //V Международная научно-практическая заочная конференция. "Реактив-2011" (6-8 декабря 2011 г.). г.Уфа, РФ. 2011. - С. 163). Задачею винаходу є створення нового високоефективного паладієвого каталізатора та розробка способу синтезу нанорозмірного, непористого, паладієвого каталізатора зі структурою "ядро(Аl2О3)-вуглецева оболонка-паладій" на основі оксиду алюмінію вкритого суцільною вуглецевою плівкою з азотовмісними группами та наступним формуванням на його поверхні наночастинок нуль-валентного паладію. Технічний результат полягає в створенні нового паладієвого каталізатора з високою каталітичною активністю для багаторазового застосування, який забезпечує швидке та безпечне проведення каталітичних реакцій за екологічно-чистою, безвідходною технологією без втрати паладію, за відсутністю органічних розчинників, інертної атмосфери, при низьких енергозатратах, каталітичні реакції можуть проходити при кімнатній температурі, а також в розробці способу синтезу нанорозмірного, непористого, паладієвого каталізатора на основі пірогенного оксиду алюмінію вкритого суцільною вуглецевою плівкою з азотвмісними группами та наступним формуванням на його поверхні наночастинок нуль-валентного паладію та застосування його в реакціях крос-сполучення, зокрема, реакцій Хека, Негіші, Сузукі, Кумади, Соногашири. Фіг. 1 - Інфрачервоні спектри вихідного МДІ - (1) та МДІ, нанесеного на вихідний Аl2О3 - (2) і зразок C(8.0)N/Al2O3 - (3). На фігурі 1 показано, що відбувається хімічна взаємодія 4,4-метилендифенілдіізоціанату (МДІ) з поверхнею вихідного пірогенного оксиду алюмінію та оксиду алюмінію з вуглецевим покриттям внаслідок реакції N=C=O групи з гідроксильними групами та активними центрами вуглецевого покриття, в результаті чого формуються прищеплені метилендифенілдіізоціанатні комплекси на поверхні. Фіг. 2 - СЕМ мікрофотографії вихідного пірогенного Аl2О3- (а), після нанесення МДІ на його поверхню - (б), зразків C(8.0)N/Al2O3 - (в) і C(15.2)N/Al2O3-(г) На фігурі 2 представлені мікрофотографії, які одержали за допомогою скануючого електронного мікроскопа: вихідного пірогенного оксиду алюмінію, оксиду алюмінію після взаємодії його з МДІ та оксиду алюмінію з вуглецевим покриттям. Із мікрофотографій видно, що вуглецева плівка формується на поверхні пірогенного оксиду алюмінію вже після проведення першого циклу "прищеплення МДІ-піроліз". Фіг. 3 - Оглядовий РФЕ спектр зразка C(15.2)N/Al2O3 3 UA 110043 C2 5 10 15 20 25 30 35 40 Методом рентгенівської фотоелектронної спектроскопії показано, що оксид алюмінію з вуглецевим покриттям характеризується наявністю С, N, О та Аl елементів. Фіг. 4 ПЕМ мікрофотографії паладієвих каталізаторів Pd-C(8.0)N/Al2O3 (а, б), PdNC(15.2)N/Al2O3-(b) та карта розподілення паладію для Pd-C(15.2)N/Al2O3 - (д) зразка. На фігурі 4 представлені мікрофотографії, які одержали за допомогою просвічуючого електронного мікроскопа для паладієвих каталізаторів. Із мікрофотографій можна бачити, що паладій на поверхні паладієвих каталізаторів розподілений рівномірно та знаходиться в високодисперсному стані з середнім розміром частинок 0.5-2.0 нм. Відомості, які підтверджують можливість здійснення винаходу. Запропонований спосіб синтезу паладієвого каталізатора проводиться в дві стадії. І стадія. Синтез алюмовуглецевого носія зі структурою "ядро-оболонка". 2 Непористий оксид алюмінію (SБЕТ(N2)=150 м /г), з розміром частинок 1-100 нм використовують як ядро для алюмовуглецевого носія. Ізоціанати (RNCO), загальною формулою R-N=C=O, які містять одну чи дві ізоціанатні групи використовують як вуглецьформуючу сполуку, так як, ізоціанатні N=C=O групи взаємодіють гідроксильними групами Аl2О3, внаслідок чого утворюють ковалентні зв'язані метилендифенілдіізоціанатні комплекси на поверхні оксиду алюмінію. Оксид алюмінію додають до ізоціанату, який наперед розчиняють в органічному розчиннику та витримують при кімнатній температурі протягом доби. Далі, оксид алюмінію з нанесеним ізоціанатом фільтрують і висушують при температурі 20-100 °C. Подальше нагрівання таких прищеплених поверхневих МДІ комплексів при температурі 600-1000 °C, в інертному середовищі або в вакуумі, призводить до формування вуглецевої плівки з азотовмісними групами. Товщину вуглецевої плівки збільшують шляхом повторення циклу "прищеплення RNCO - піроліз". Для приготування на поверхні оксиду алюмінію більш товстої вуглецевої плівки, цикл "прищеплення RNCO - піроліз" повторюють. Схема взаємодії -NCO груп та ізоціанатів з гідроксильними групами оксиду алюмінію наведена нижче. Схема 1. Взаємодія -NCO груп 4,4-метилендифенілдіізоціанату з гідроксильними групами на поверхні оксиду алюмінію II стадія. Синтез паладієвих каталізаторів на основі алюмовуглецевого носія зі структурою "ядро (Аl2О3)-вуглецева оболонка-паладій". Друга стадія синтезу полягає в тому, що до синтезованого оксиду алюмінію з вуглецевим покриттям додають розчин біс(дибензиліденацетону) паладію (Pd(dba)2) в органічному розчинникові, і перемішують суміш при кімнатній температурі або при 60 °C, протягом 10-30 хвилин, що призводить до формування наночастинки паладію на поверхні носія. В результаті такої взаємодії змінюється колір суміші: винно-червоний колір комплексу переходить в світложовтий колір ліганду. Синтезований паладієвий каталізатор відокремлюють від розчину простим фільтруванням або центрифугуванням, промивають чистим розчинником та висушують до постійної ваги при кімнатній температурі або нагріванні до 100 °C. Загальна схема синтезу наночастинок паладію на поверхні алюмовуглецевого носія наведена нижче. 4 UA 110043 C2 5 10 15 20 25 30 35 Схема 2. Нанесення наночастинок паладію на оксид алюмінію з вуглецевим покриттям Приклад. 2 Непористий пірогенний оксид алюмінію (SБЕТ(N2)=150 м /г), з розміром частинок 10 нм, синтезований високотемпературним гідролізом хлориду алюмінію на Калуському дослідноекспериментальному заводі, м. Калуш, використовують як ядро алюмовуглецевий носій. 4,4метилендифенілдіізоціанат (МДІ), одержали від фірми Байер (Німеччина). До 10 г оксиду алюмінію додають 300 мл. 1 % розчину 4,4-метилендифенілдіізоціанату в ксилолі. Далі суміш перемішують протягом доби. Після фільтрування зразок промивають чистим ксилолом і просушують при температурі 60 °C протягом двох годин. Далі зразок поміщають в -2 кварцову кювету та ваукуумують при тиску 1×10 Па зі швидкістю нагрівання 1 град./хв. до -2 700 °C при постійній відкачці. Зразок витримують при цій температурі й тиску 1×10 Па протягом двох години для завершення піролізу адсорбованого 4,4-метиленбіс(фенілізоціанату) та видалення летких продуктів розкладу. Для приготування зразку оксиду алюмінію з більшим вмістом вуглецю цикл "прищеплення МДІ-піроліз" повторюють. Вищеописана процедура призводить до одержання зразків з вмістом вуглецю 8,0 та 15,2 мас. %, позначених далі як C(8.0)N/Al2O3 та C(15.2)N/Al2O3 відповідно. Далі, 100 мг C(8.0)N/Al2O3 або C(15.2)N/Al2O3 та 2 мл хлороформу диспергують за допомогою ультразвукової бані протягом 10 хвилин. Потім до суміші додають розчин 0.0054 г біс(дибензиліденацетону) паладію (Pd(dba)2) в 2 мл хлороформу та перемішують протягом 10 хв. при температурі 60 °C. В результаті, винно-червоний колір комплексу переходить в світложовтий колір ліганду. Далі зразки центрифугують, промивають чистим хлороформом 5 разів по 5 мл та висушують на повітрі при 50 °C. Синтезовані таким чином паладієві каталізатори позначені далі як Pd-C(8.0)N/Al2O3 та PdC(15.2)N/Al2O3. Термічні дослідження синтезованих C(8.0)N/Al2O3 та С(15.2)N/Аl2О3 алюмовуглецевих носіїв. Експериментальні дані підтвердили високу реакційну здатність МДІ відносно до поверхні пірогенного оксиду алюмінію. При контакті вихідного оксиду алюмінію з розчином МДІ, зразок миттєво забарвився в жовтий колір і не змінився після промивання його чистим о-ксилолом, що є непрямим доказом незворотної адсорбції МДІ на поверхні оксиду алюмінію. З метою визначення кількості адсорбованого МДІ та вуглецю, який утворився внаслідок піролізу, був використаний метод ТГ/ДТГ-ДТА. Дані, представлені в таблиці 1, ілюструють формування вуглецевого покриття на поверхні пірогенного оксиду алюмінію внаслідок піролізу хемосорбованого МДІ. Можна бачити, що кількість прищепленого МДІ на вихідній поверхні пірогенного оксиду алюмінію складає 20,2 мас. % (таблиця 1). Такий високий ступінь адсорбції та її незворотний характер пов'язані з наявністю на поверхні оксиду алюмінію активних центрів, здатних до сильної взаємодії з групами -NCO. 5 UA 110043 C2 Таблиця 1 Результати термічних досліджень формування вуглецевого покриття на поверхні пірогенного Аl2О3 Зразок Аl2О3 C(8.0)N/Al2O3 C(15.2)N/Al2O3 5 10 15 20 25 30 35 40 45 Вміст С, мас. % 0 8,0 15,2 Кількість Піроліз адсорбованого МДІ 2 адсорбованого МДІ, S (N ), м /г Вихід С, мас. % Вміст С, мас. % БЕТ 2 мас. % 20,2 57,8 8,0 150,0 13,5 78,8 15,2 150,0 150,0 Слід відмітити, що спостерігалось миттєве знебарвлення розчину МДІ і після контакту зі зразком C(8.0)N/Al2O3. Такий високий ступінь адсорбції МДІ та високий вихід вуглецю показує, що на поверхні оксиду алюмінію з вуглецевим покриттям є достатньо реакційноздатні центри, які можуть взаємодіяти з групами -NCO. Дослідження методом низькотемпературної адсорбції азоту вихідного пірогенного оксиду алюмінію та оксиду алюмінію з вуглецевим покриттям показали, що форма ізотерм адсорбції азоту подібні для всіх зразків і є типовими для непористих матеріалів. Це означає, що структурні характеристики пірогенного оксиду алюмінію не змінились після нанесення вуглецевого покриття. Із одержаних даних також видно, що величина питомої поверхні для всіх досліджуваних зразків є однаковою і складає 150 м/г (табл. 1). Хімічний аналіз показав, що вміст азоту в зразках C(8.0)N/Al2O3 та C(15.2)N/Al2O3 складає 1,5 і 2,4 мас. %, відповідно. Дослідження взаємодії 4,4-метилендифенілдіізоціанату з поверхнею вихідного пірогенного оксиду алюмінію та оксиду алюмінію з вуглецевим покриттям методом інфрачервоної спектроскопії. З метою вивчення взаємодії 4,4-метилендифенілдіізоціанату з поверхнею пірогенного оксиду алюмінію був використаний метод інфрачервоної спектроскопії. ІЧ спектр чистого МДІ -1 характеризуються наявністю інтенсивної смуги поглинання при 2268 см (рис. 1(1)), яка належить до коливань ізоціонатної (-NCO) групи. З фігури 1 (крива 2) видно, що після взаємодії МДІ, як з вихідним Аl2О3, так і з зразком -1 C(8.0)N/Al2O3, смуга поглинання при 2268 см , яка належить до коливань ізоціанатної (-NCO) -1 групи, не спостерігається, в той час присутні нові смуги при 1670 см та плече в області 1545 -1 см , які вказують на формування (NH-CO) зв'язків та належать до так званих коливань Аміда І -1 та Аміда II відповідно. Крім того, з'являється нова смуга поглинання при 1319 см , яка належить до коливань (N-H) + (C-N) зв'язків. Можна бачити також широкі інтенсивні смуги поглинання при -1 3520 та 3340 см , які належать до вільних та зв'язаних водневими зв'язками N-H груп. Таким чином, ІЧ спектральні дослідження показали, що відбувається хімічна взаємодія МДІ з поверхнею пірогенного оксиду алюмінію та зразком C(8.0)N/Al2O3 внаслідок реакції N=C=O групи з гідроксильними групами і, як результат, формуються прищеплені метилендифенілдіізоціанатні комплекси на його поверхні. Дослідження синтезованих матеріалів методом скануючої електронної мікроскопії Дослідження методом скануючої електронної мікроскопії вихідного пірогенного оксиду алюмінію, оксиду алюмінію після взаємодії його з 4,4-метилендифенілдиізоціонатом та синтезованих Pd-C(8.0)N/Al2O3 або Pd-C(15.2)N/Al2O3 зpaзків представлені на фігурі 2. Із мікрофотографії вихідного пірогенного оксиду алюмінію можна бачити окремі його частинки з середнім розміром 5-10 нм, а також агломерати розміром 50-100 нм (фіг. 2(а)). У порівнянні з вихідним пірогенним оксидом, морфологія Аl2О3 після хемосорбції 4,4метилендифенілдіізоціанату істотно відрізняється (фіг. 2(б)). Можна бачити сферичні, не агломеровані наночастинки з чіткими границями між ними, що вказує на формування метилендифенілдіізоціанатних комплексів, які вкривають кожну індивідуальну наночастинку. Після піролізу нанесеного МДІ ми також бачимо сферичні, не агломеровані наночастинки з середнім розміром 8-10 нм та чіткими границями між ними. Це означає, що вуглецева плівка формується на поверхні пірогенного оксиду алюмінію вже після проведення першого циклу "прищеплення МДІ-піроліз" (фіг. 2(в)). Повторення циклу "прищеплення МДІ-піроліз" приводить до подальшого нарощування вуглецевого покриття на поверхні пірогенного оксиду алюмінію (фіг. 2 (г)). Дослідження синтезованих алюмовуглецевих носіїв методом фотоелектронної спектроскопії. 6 UA 110043 C2 5 З метою оцінки хімічного складу синтезованих алюмовуглецевих носіїв зразки були досліджені методом рентгенівської фотоелектронної мікроскопії. На фігурі 3 представлений оглядовий РФЕ спектр зразку Pd-C(15.2)N/Al2O3, який показує присутність С, N, О та Аl елементів. Кількісний аналіз елементів був зроблений при допущенні, що інтенсивність фотоелектронних ліній елементу пропорційна його концентрації на поверхні і що вуглецеве покриття рівномірно розподілене на поверхні пірогенного оксиду алюмінію (таблиця 2). Таблиця 2. РФЕ аналіз елементного складу зразків C(8.0)N/Al2O3 і C(15.2)N/Al2O3 Зразок C Вихідний Al2O3 Al2O3-MDI C(8.0)N/Al2O3 C(15.2)N/Al2O3 10 15 20 25 30 35 40 45 0.314 2,9 36,8 20,4 31,8 Елемент, ат. % N O ASF (коефіцієнт елементної чутливості) 0,499 0,733 61,4 5,5 36,7 1,6 50,2 2,5 42,8 Аl 0,256 35,7 21,0 27,8 22,9 Результати аналізу показують, що після взаємодії МДІ з поверхнею пірогенного оксиду алюмінію співвідношення елементів C:N складає 6,7 і є близьким до теоретичної величини елементів в МДІ (6.4). Важливо зазначити, що співвідношення C:N для обох зразків C(8.0)N/Al2O3 або C(15.2)N/Al2O3 є однаковим і складає 12,7. Ці результати погоджуються з ІЧспектральними даними і вказують про вбудовування азоту в вуглецеву структуру покриття. Дослідження паладієвих каталізаторів методом електронної просвічуючої мікроскопії. Електронна просвічуюча мікроскопія (ПЕМ) була використана для дослідження розподілення та розмірів паладієвих частинок на поверхні. На фігурі 4 представлені ПЕМ мікрофотографії паладієвих каталізаторів Pd-C(8.0)N/Al2O3 та Pd-C(15.2)N/Al2O3. Із мікрофотографій Pd-C(8.0)N/Al2O3 та Pd-C(15.2)N/Al2O3 каталізаторів можна бачити, що паладій на поверхні паладієвих каталізаторів знаходиться в високодисперсному стані з середнім розміром частинок 0,5-2,0 нм. Застосування локального енергодисперсійного аналізу ПЕМ показало, що наночастинки паладію на поверхні синтезованих Pd-C(8.0)N/Al2O3 або PdC(15.2)N/Al2O3 каталізаторів розподілені рівномірно (фіг. 4(д)). Каталітичні випробування паладієвих каталізаторів Каталітичні випробування в реакції Сузукі. Каталітичні випробування паладієвих Pd-C(8.0)N/Al2O3 або Pd-C(15.2)N/Al2O3 в реакції Сузукі проводили на одній порції каталізатора на 0,1 мол. % Pd в водному середовищі. Всі реакції проходили за короткий проміжок часу (10-30 хв.) з виходом 92-97 %. Результати показали, що активність розроблених гетерогенних каталізаторів перевищує активність кращих гомогенних каталізаторів. Додаткової оптимізації умов реакції не було потрібно. Всі експерименти виконувалися на повітрі при відсутності інертної атмосфери, хоча, зазвичай, реакції цього типу проводять в атмосфері аргону або азоту. У реакцію було введене широке коло субстратів, включаючи галогеніди і борні кислоти гетероциклічних сполук, що дозволило синтезувати арильовані саліцилові кислоти, тіофени, фурани, піридини і піримідини. Всі вивчені реакції проходили з високими виходами, тому для виділення продуктів реакцій не потрібні хроматографічні методи. Після завершення реакції каталізатор легко відділявся від продуктів реакції декантацією, фільтруванням або центрифугуванням. Загальна методика: Синтез 5-(2,4-дифторфеніл)-2-гідроксибензойної кислоти: Суміш 0,217 г (1 ммоль) 5бромсаліцилової кислоти, 0,1895 г (1,2 ммоль) (2,4-дифторфеніл)борної кислоти, 0,414 г (3 ммоль) К2СО3, 3,2 мг (0,01 ммоль, 1 мол. %) Bu4NBr та 10 мг (0,1 мол. % Pd) Pd-C(8.0)N/Al2O3 або Pd-C(15.2)N/Al2O3 каталізатора в 5 мл води кип'ятили 20 хвилин при інтенсивному перемішуванні на повітрі при відсутності інертної атмосфери. Контроль за ходом реакції проводили хроматографічним методом на пластинках Силуфол УФ-254 (елюент гексан - ефір, 5:1). Після завершення реакції суміш перенесли в поліпропіленову пробірку, центрифугували при швидкості 3000 об/хв., протягом 5 хвилин, безбарвний розчин відокремили від осаду каталізатора, розбавили водою (5 мл), нагріли до кипіння і профільтрували не охолоджуючи. До фільтрату додали 1,5 мл спирту, нагріли до кипіння і повільно підкислили 10 % НСl при 7 UA 110043 C2 5 10 15 20 25 30 35 40 перемішуванні. Випав дрібнокристалічний осад, який відфільтрували та висушили. Вихід 1 продукту 0.235-0.240 г (94-96 %). Білі кристали, т.пл. 212-213 °C, Н NMR (400 МГц, ДМСО-d6): δ 7.91 (с, 1Н), 7.66 (д, J=8.09 Гц, 1Н), 7.56 (дд, J=8.82, 15.44 Гц, 1Н), 7.33 (ддд, J=2.20, 9.93, 9.93 13 Hz, 1Н), 7.16 (ддд, J=2.20, 8.09, 8.09 Гц, 1Н), 7.06 (д, J=8.82 Hz, 1H). C NMR (100 MHz, DMSOd6): δ 171.6, 161.8 (дд, JC-F=12.48, 224.72 Гц), 160.7, 158.9 (дд, JC-F=12.48, 226.10 Гц), 135.8 (д, JCFf=2.77 Гц), 131.5 (дд, JC-F=4.16, 9.71 Гц), 130.3 (д, JC-F=2.77 Гц) 125.1, 123.7 (д.д., JC-F=4.16, 12.48 Гц), 117.6, 113.2, 112.1 (д.д., JC-F=2.77, 20.81 Гц), 105.1 (д.д., J=26.35, 26.35 Гц). Осад каталізатора промили декантацією 2 раза по 1 мл води і використали в наступній реакції. У всіх представлених прикладах використовувалася одна порція каталізатора, регенерована із попередньої реакції. При масштабуванні реакції (більше 10 ммоль реагентів) каталізатор легко відділяється фільтруванням. Синтез 3-(2-тієніл) бензальдегіду: із 3-бромбензальдегіду та 2-тієнілборної кислоти, 0.1 мол. 1 % Pd (2 рецикл каталізатора), 10 хв., вихід 97 %. Світло-жовте масло. Н ЯМР (400 МГц, CDCl3): δ 7.13 (дд, J=4.0, 5.0 Гц, 1 Н), 7.35 (д, J=5.0 Гц, 1 Н), 7.40 (д, J=4.0 Гц, 1 Н), 7.55 (дд, J = 8.0, 8.0Гц, 1 Н), 7.78 (д, J=8.0 Гц, 1 Н), 7.86 (d, J=8.0 Гц, 1 Н), 8.11 (s, 1H), 10.06 (s, 1 H); MS, m/z (%) + -1 188 (M , 100), 187 (44), 159 (33), 115 (37), 69 (31). ІЧ-спектроскопія (плівка, см ): 2830, 2720, 1700, 1598, 1582, 1477. Синтез 2-(2-фурил)анілін, гідрохлориду: із 2-броманіліну та 2-фурилборної кислоти, 0.1 мол% Pd (3 рецикл каталізатора), 15 хв., вихід 95 %. Знайдено, %: С, 61.32; Н, 5.35; Сl, 18.27; N, 1 7.28. C10H10NOCl, %: С, 61.39; Н, 5.15; Сl, 18.12; N, 7.16; О, 8.18. Н ЯМР (400 МГц, ДМСO-d6): δ 7.8 (д, 1Н, ), 7.72 (, д, 1Н), 7.54 (т, 1Н), 7.34 (м, 2Н), 7.06 (, уш.с, 1Н) 6.63 (уш.с, 1Н). Синтез 3-(2-амінофеніл)бензойної кислоти: із 2-броманіліну та 3-карбоксифенілборної кислоти, 0.1 мол. % Pd (4 рецикл каталізатора), 10 хв., вихід 96 %. Тпл. 177-178 °C. Знайдено, %: С, 73.37; Н, 5.31; N, 6.53. С13Н11NO2, %: С, 73.23; Н, 5.20; N, 6.57; О, 15.01 С: 73.31 %, Н: 5.28 %. 1 Н ЯМР (400 МГц, ДMCO-d6): δ 7.97 (с, 1Н), 7.90 (д, J=7.2 Гц, 1H), 7.65 (д, J=7.2 Гц, 1Н), 7.56 (т, J=7.6 Гц, 1H), 7.07 (т, J=7.5 Гц, 1Н), 7.01 (д, J=7.4 Гц, 1Н), 6.79 (д, J=8.0 Гц, 1Н), 6.66 (т, J=7.4 Гц, 1Н). Синтез 2-(2-метоксифеніл)піридин-3-аміну: із 3-аміно-2-хлорпіридину та 2метоксифенілборної кислоти, 0.1 мол. % Pd (5 рецикл каталізатора), 15 хв., вихід 94 %. Світложовтий порошок. Т.пл. = 97-98 °C. Знайдено, %: С, 71.88; Н, 6.17; N, 13.84. C12H12N2O, %: С, 1 71.98; Н, 6.04; N, 13.99; О, 7.99. Н ЯМР (400 МГц, CDCl3) δ: 8.12 (дд, J=1.2 Гц, J=4.4 Гц, 1Н), 13 7.36-7.40 (м, 2H), 7.04-7.09 (м, 2Н), 6.99-7.01 (м, 2Н), 3.79 (с, 3Н), 3.76 (уш.с, 2Н). С ЯМР (100 МГц, CDCl3) δ: 156.6, 144.1, 141.2, 139.8, 131.7, 129.9, 127.8, 123.1, 122.5, 121.5, 111.4, 55.9. ІЧ-1 спектроскопія (масло, см ): 3452, 3325, 3200, 3056, 3009, 2964, 2934, 2836, 1632, 1600, 1580, 1494, 1456, 1310, 1273, 1238, 1179, 1140, 1123, 1070, 1052, 1018, 796, 755. Синтез 2-(Піридин-3-ил)піридин-3-аміну; 3-аміно-2-хлорпіридина та 3-піридилборної кислоти, 0.1 мол. % Pd (6 рецикл каталізатора), 20 хв., вихід 92 %. Тверда речовина світло-сірого 1 кольору. Н ЯМР (400 МГц, CDCl3): δ 8.96 (с, 1Н), 8.63 (д, J=4.0 Гц, 1Н), 8.15 (д, J=3.5 Гц, 1Н), 13 8.03 (д, J=7.5 Гц, 1Н), 7.40-7.42 (м, 1Н), 7.05-7.17 (м, 2Н), 3.79 (уш.с, 2Н). С ЯМР (100 МГц CDCl3): δ 147.2, 146.9, 139.0, 138.1, 138.1, 133.9, 132.2, 121.4, 121.3, 120.8. Отримані результати наведені в таблиці 3. 8 UA 110043 C2 Таблиця 3. Результати випробувань каталізаторів в реакціях Сузукі №п/п рецикл у Швидкість реакції (хв.) 20 94-96 10 97 15 95 96 15 94 20 Продукт Вихід (%) 10 Вихідні сполуки 92 F 1 5-бром саліцилова кислота 2,4дифторфеніл) борна кислота CO2 F OH 5-(2,4-дифторфеніл)-2гідроксибензойна кислота 2 3-бромбензальдегід 2-тієнілборна кислота X CHO X=O,S 3-(2-тієніл)бензальдегід NH2 3 2-броманілін O 2-фурилборна кислота 2-(2-Фурил)анілін, гідрохлорид H2N 4 2-броманілін 3-карбоксифені лборна кислота HO2C 3-(2-Амінофеніл)бензойна кислота OMe N 5 3-аміно-2хлорпіридин 2-метоксифеніл борна кислота H2N 2-(2Метоксифеніл)піридин-3амін N 6 3-аміно-2хлорпіридин 3-піридилборна кислота N H2N 2-(Піридин-3-іл)піридин-3амін Випробування активності каталізаторів при багаторазовому їх використанні на одній модельній реакції Сузукі при температурі 100 °C, представленій на схемі 3. 5 9 UA 110043 C2 CO2H O CO2H 0,1 мол. % Pd + H2O,100oC,10 хв. Br B(OH)2 5 10 O Схема 3. Модельна реакція Сузукі 3-бромбензойної кислоти з 4-метоксифенілборною кислотою. Дослідження можливості повторного використання синтезованих каталізаторів проводилося на модельній реакції 3-бромбензойної кислоти з 4-метоксифенілборною кислотою у воді при температурі 100 °C в присутності 0,1 мол. % Pd-C(8.0)N/Al2O3 або Pd-C(15.2)N/Al2O3 та К2СО3 як основи на повітрі при відсутності інертної атмосфери. Як видно з отриманих даних (табл. 4) випробувані каталітичні матеріали проявляють у вивчених умовах близьку каталітичну активність, яка зберігається незмінною протягом 10 рециклів. Отримані результати наведені в таблиці 4. Таблиця 4 Результати багаторазового випробування в реакції Сузукі: 3-бромбензойної кислоти з 4а метоксифеніл борною кислотою Рецикл 1 2 3 4 5 6 7 8 б каталізатор Вихід , % Pd-C(8.0)/Al2O3 92 95 91 95 94 93 95 97 Pd-C(15.2)/Al2O3 94 93 93 98 96 97 97 95 а 1 ммоль Аr-Вr, 1,2 ммоль Аr'В(ОН)2, 2.5 ммоль К2СО3, 5 мл води, 100 °C, 15 хв. б 1 Препаративні виходи (виходи по даним Н ЯМР спектроскопії ~100 %). 15 20 25 9 10 94 98 96 97 Випробування активності каталізаторів при багаторазовому їх використанні на одній модельній реакції Сузукі при кімнатній температурі. Були проведені каталітичні випробування синтезованих зразків в реакції Сузукі в водному та водно-спиртових середовищах при кімнатній температурі у присутності 0.1 мол. % PdC(8.0)N/Al2O3 або Pd-C(15.2)N/Al2O3 каталізатора та К2СО3 в реакції за участі арилйодидів. Реакції проводилися на повітрі у водному метанолі або етанолі (1:1 за об'ємом) при кімнатній температурі (20-25 °C). У цих умовах, крос-сполучення 3- і 4-йодбензойних кислот з арилборними кислотами повністю протікає протягом 1.5-2 годин і призводить до отримання відповідних арилбензойних кислот з кількісними виходами. З практичної точки зору важливо відзначити, що каталізатор після завершення реакції легко виділяється з реакційного середовища фільтруванням або центрифугуванням. Одна порція каталізатора була використана в 6 реакціях крос-сполучення, при цьому активність каталізатора повністю зберігалася Результати каталітичних досліджень представлені в таблиці 5. Таблиця 5. Реакції йодбензойних кислот з арилборними кислотами на багаторазовому каталізаторі PdC(8.0)N/Al2O3 при кімнатній температурі. № досліду Аr-І Аr'-В(ОН)2 1 2 3 4 5 6 3-НО2СС6Н4-І 3-НО2СС6Н4-І 3-НО2СС6Н4-І 4-НО2СС6Н4-І 4-НО2СС6Н4-І 4-НО2СС6Н4-І Ph-B(OH)2 4-МеОС6Н4-В(ОН)2 4-ОНСС6Н4-В(ОН)2 Ph-B(OH)2 4-МеОС6Н4-В(ОН)2 4-ОНСС6Н4-В(ОН)2 10 швидкість реакції, год. 1.5 1.5 2 1.5 1.5 2 Вихід Аr-Аr', % 96 94 97 98 93 95 UA 110043 C2 5 10 Бромбензойні кислоти з використанням Pd-C(8.0)N/Al2O3 або Pd-C(15.2)N/Al2O3 каталізаторів також реагують при кімнатній температурі, але тривалість реакції при цьому збільшується з 1.52 год. до 24 год. Наприклад, реакція 3-бромбензойної кислоти з 4-метоксифенілборною кислотою завершується за 24 год., даючи 4'-метокси-[1,1'-біфеніл]-3-карбонову кислоту з виходом 95 %. Слід зазначити, що у вивчених умовах Pd-NC(8.0)/Al2O3 або Pd-NC(15.2)/Al2O3 каталізатори, які вирізняються різним вмістом вуглецю виявляють практично однакову каталітичну активність. Каталітичні випробування в реакції Хека. Розроблені Pd-C(8.0)N/Al2O3 або Pd-C(15.2)N/Al2O3 кaтaлiзaтopи були випробувані в реакції Хека, представленій на схемі: CO2H CO2H + 0,1 мол% Pd CO2H Br 15 H2O,100oC,20 хв. CO2H Схема 4. Модельна реакція 3-бромбензойної кислоти з акриловою кислотою Випробування каталізаторів в реакції Хека проводили на модельній реакції 3-бромбензойної кислоти з акриловою кислотою в присутності 0.1 мол. % каталізатора, при 100 °C на повітрі, при використанні як основи К2СО3. Всі реакції завершувались за 20 хв. з високими виходами продуктів арилювання - 3-[(Е)-2-карбоксивініл] бензойної кислоти. Результати тестування показують, що каталізатори не втрачають своєї активності при повторних рециклах (табл. 6). 20 Таблиця 6 Результати багаторазового випробування в реакції Хека: 3-бромбензойної кислоти з акриловою а кислотою Рецикл каталізатор Pd-C(8.0)/Al2O3 Pd-C(15.2)/Al2O3 а б 25 30 1 2 3 4 98 100 98 97 96 99 97 96 5 6 б Вихід , % 95 96 93 97 7 8 9 10 94 99 98 97 95 95 95 94 Аr-Вr (1 ммоль), СН2=СНСО2Н (1.2 ммоль), К2СО3 (2.5 ммоль), 5 мл Н2О. 1 Вихід по данным Н ЯМР. На одній порції каталізатора також були проведені 8 реакцій акрилової кислоти з арилбромідами, з виходами по реакціях 93-96 %. Всі реакції проводили при використанні 0.1 мол. % каталізатора, при температурі 100 °C, на повітрі, в водному середовищі. Тривалість реакцій становила від 20 до 50 хв. У відомих протоколах проведення реакції Хека тривалість процесу становить кілька годин при температурі 120-150 °C. З високими виходами були синтезовані функціонально заміщені коричні кислоти і їх гетероциклічні аналоги, що містять як тіофенові, піразольні, піридинові і піримідинові замісники. Каталітичні випробування в реакції Соногашири Розроблені Pd-C(8.0)N/Al2O3 або Pd-C(15.2)N/Al2O3 каталізатори були випробувані в реакції Соногашири представлені на схемі. 11 UA 110043 C2 HO2C HO2C 0,1 мол% Pd + H2O,100oC,10 хв. Br H 5 Схема 5. Модельна реакція 3-бромбензойної кислоти з фенілацетиленом. Каталітичну активність каталізаторів в реакції Соногашири досліджували на прикладі модельної реакції 3-бромбензойної кислоти з фенілацетиленом в присутності 0,1 мол% каталізатора та 1 мол% йодиду срібла (AgI) при використанні в основи К2СО3 та 20 мол% трибутиламіну (Bu3N) в воді при 100 °C. Активність розробленої каталітичної систем виявилась достатньо високою, всі реакції повністю завершувались за 10 хвилин (табл. 7). При повторних рециклах активність каталізаторів не змінювалась. 10 Таблиця 7 Результати багаторазового випробування в реакції Соногашири: 3-бромбензойної кислоти з а фенілацетиленом Рецикл каталізатор Pd-C(8.0)/Al2O3 Pd-C(15.2)/Al2O3 а б 1 2 3 4 97 98 99 97 92 95 97 99 5 6 б Вихід , % 98 98 96 97 7 8 9 10 96 95 97 94 96 94 93 98 Ar-Br (1 ммоль), PhС≡CH (1.2 ммоль), К2СО3 (2.5 ммоль), Bu3N (0.2 ммоль), 5 мл Н2О. 1 Вихід по данным Н ЯМР. ФОРМУЛА ВИНАХОДУ 15 20 25 30 1. Композиційний матеріал, що відповідає формулі Pd-C(N)/Al2O3, де вміст вуглецю на Аl2О3 становить від 5 до 30 мас. % та вміст азоту становить від 0,5 до 7 мас. %; причому вуглець є оболонкою, ковалентно зв'язаною з поверхнею оксиду алюмінію; Аl2О3 є непористим, вміст паладію становить від 1 до 10 мас. %. 2. Композиційний матеріал за п. 1, де ядро-оксид алюмінію має розміри від 1 до 100 нм. 3. Композиційний матеріал за пунктом 1 або 2, в якому частинки паладію мають розміри від 0,1 до 10,0 нм. 4. Спосіб одержання композиційного матеріалу за будь-яким з пп. 1-3, який включає стадії за якими: • поверхню оксиду алюмінію обробляють органічним 4,4-метилдифенілдіізоціанатом, попередньо розчиненим в органічному розчиннику, • проводять піроліз одержаного продукту при температурі 600-1000 °С з утворенням ковалентно зв'язаної вуглецевої оболонки, • до синтезованого оксиду алюмінію з вуглецевим покриттям додають розчин сполуки паладію в органічному розчиннику. 5. Спосіб за п. 4, де сполукою паладію є біс(дибензиліденацетон) паладію (Pd(dba)2). 6. Застосування композиційного матеріалу за будь-яким з пп. 1-3 як каталізатора в реакціях крос-сполучення, зокрема реакцій Хека, Негіші, Сузукі, Кумади, Соногашири. 12 UA 110043 C2 13 UA 110043 C2 14 UA 110043 C2 Комп’ютерна верстка Д. Шеверун Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 15
ДивитисяДодаткова інформація
Назва патенту англійськоюNanoscale palladium heterogeneous catalyst for performing cross-coupling reactions
Автори англійськоюSharanda Liudmyla Fedorivna, Bumahin Mykola Oleksandrovych, Ohenko Volodymyr Mykhailovych, Volkov Serhii Vasyliovych
Назва патенту російськоюНаноразмерный палладиевый гетерогенный катализатор для проведения реакций кросс-сочетания
Автори російськоюШаранда Людмила Федоровна, Бумагин Николай Александрович, Огенко Владимир Михайлович, Волков Сергей Васильевич
МПК / Мітки
МПК: B01J 21/18, B01J 37/025, B01J 21/04, B01J 23/44, B01J 35/08
Мітки: нанорозмірний, крос-сполучення, каталізатор, проведення, гетерогенний, реакцій, паладієвий
Код посилання
<a href="https://ua.patents.su/17-110043-nanorozmirnijj-paladiehvijj-geterogennijj-katalizator-dlya-provedennya-reakcijj-kros-spoluchennya.html" target="_blank" rel="follow" title="База патентів України">Нанорозмірний паладієвий гетерогенний каталізатор для проведення реакцій крос-сполучення</a>
Попередній патент: Звукоізоляційний блок
Наступний патент: Система накладного накатного башмака
Випадковий патент: Звукоізоляційна панель газотурбінного двигуна