Низькотемпературний нанорозмірний каталізатор структури шпінелі mefe2o4 (me-co, ni, mn) для глибокого окислення вуглеводнів
Номер патенту: 71394
Опубліковано: 15.11.2004
Автори: Гавриленко Костянтин Сергійович, Орлик Світлана Микитівна, Канцерова Марина Рашидівна, Павліщук Віталій Валентинович, Ільїн Володимир Георгійович, Космамбетова Гульнара Радіївна
Формула / Реферат
1. Низькотемпературний нанорозмірний каталізатор структури шпінелі MeFe2О4 (Ме-Со, Ni, Mn) для глибокого окислення вуглеводнів, який відрізняється тим, що розмір часток активного компонента (шпінелі) знаходиться в оптимальному для перебігу даної реакції нанометровому діапазоні 5-20 нм.
2. Низькотемпературний нанорозмірний каталізатор структури шпінелі MeFe2О4 (Ме-Со, Ni, Mn) для глибокого окислення вуглеводнів по п. 1, який відрізняється тим, що додатково вводять добавки ПАР.
3. Низькотемпературний нанорозмірний каталізатор структури шпінелі MeFe2О4 (Ме-Со, Ni, Mn) для глибокого окислення вуглеводнів по п. 1, який відрізняється тим, що проводять прямий синтез феритів в поруватій матриці носія Аl2О3.
4. Низькотемпературний нанорозмірний каталізатор структури шпінелі MeFe2О4 (Ме-Со, Ni, Mn) для глибокого окислення вуглеводнів по п. 3, який відрізняється тим, що як носій використовують діоксид цирконію.
Текст
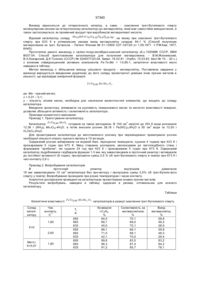
1. Низькотемпературний нанорозмірний каталізатор структури шпінелі MeFe2О4 (Ме-Со, Ni, Mn) для глибокого окислення вуглеводнів, який відрізняється тим, що розмір часток активного компонента (шпінелі) знаходиться в оптимальному для 3 71394 4 85мас. %). Каталізатор виявляє невисоку активв склад шпінелі МеСо 2O4 (Me-Zn, Cu) підвищує ність по відношенню до окислення вуглеводнів термічну стійкість каталізатора до 720°С. середньої термодинамічної стійкості - швидкість Ефективними каталізаторами глибокого окислення вуглеводнів, зокрема найбільш термодинареакції окислення бутану 0,39×102см 3/с×г [8]. мічно стійкого метану, представляються ферити Відомий каталізатор - кобальт-хромова шпіструктури шпінелі MeFe2O4 (Me=Mn, Co, Ni, Zn). До нель (5,1мас. %) на носії з пінистої кераміки переваг феритів шпінельної структури відноситься (94,9мас. %), розроблений для глибокого окислення вуглеводнів в установках для каталітичного те, що вони більш активні в досліджуваній реакції, ніж алюмінати, мають меншу токсичність та варспалювання палив промислового призначення, а тість, ніж хроміти і більшу стійкість в окислювальтакож для очистки промислових газів. Каталізатор них умовах в порівнянні з кобальтитами. характеризується порівняно невисокою активністю Відомий каталізатор шпінельної структури в реакції повного окислення пропану - швидкість реакції при температурі 400°С становить MeFe2O 4 (Me=Co, Ni) для глибокого окислення метану, який вибрано як аналог [2], синтезований 1,35×102см 3/с×г [9]. шляхом співосадження з розчинів азотнокислих Традиційними методами приготування вищесолей відповідних металів водним розчином гідрозгаданих каталізаторів структури алюмінієвої і ксиду натрію при певному значенні рН, з наступхромової шпінелей, - співосадженням гідроксидів, ним витримуванням суспензії при кімнатній темперозкладом гідроксидів і солей відповідних металів, ратурі [12]. Отримані суспензії відфільтровували, - важко приготувати складні гомогенні оксиди. При осади відмивали до від'ємної реакції на NO3- (реавикористанні методу співосадження виникають кція з дифеніламіном), сушили при температурі певні труднощі, пов'язані з тим, що в залежності 110°С на повітрі, після чого прожарювали 7год. від природи металу осадження гідроксидів відбупри температурі 700°С. Значення рН осадження вається при різних значеннях рН, і це призводить гідроксиду заліза і гідроксидів кобальту, нікелю до неоднорідності складу осадів після їх прожарю(2,0 і 6,8; 6,7 відповідно) суттєво відрізняються, вання. Недоліком методу розкладу гідроксидів і відповідно, можлива низька ступінь гомогенності солей є те, що розклад сполук починається при отриманих зразків шпінелей. різних температурах і відбувається з різними Недоліками каталізатора є низька дисперсшвидкостями, в результаті отримують суміші оксиність (розмір часток шпінелі більше 50нм), і відподів, нерівномірно розподілених в го товому каталівідно невисока питома поверхня (15-16м 2/г); недозаторі. Шпінелі, синтезовані такими способами, статньо висока активність - температури початку неоднорідні і містять ряд домішок, які погіршують реакції і досягнення 100% конверсії метану склали їх фізико-хімічні і каталітичні властивості. До недо410-425° і 600°С, відповідно. Для усунення цих ліків традиційних методів отримання шпінелей недоліків необхідним є пошук способів досягнення відносяться також їх праце- і енергоємність. оптимального стану каталізатора або його промоАналогом [1] є каталізатор для глибокого окитування благородними металами. слення вуглеводнів, який містить активну фазу у Реакція глибокого окиснення метану є струквигляді сполук магнію і хрому на оксидах алюмінію турно-чутливою, її швидкість залежить від розміру і магнію, в яких відповідно до даних рентгенофачасток активного компоненту, тому перспективним зового аналізу, активна фаза містить Сr2О3 і є використання нанорозмірних оксидних каталіза85мас. % шпінелі MgCr2O4 , одержаній в режимі торів шпінельної структури. саморозповсюджуючого високотемпературного Задачею винаходу є одержання нанорозмірносинтезу (СВС) з екзотермічної суміші при наступго низькотемпературного каталізатора структури ному вмісту компонентів, мол. %: Mg 3-7, Сr2 O3 3шпінелі MeFe2O4 (Me=Mn, Co, Ni) для реакції гли8, СrО3 20-25, Аl2О3 23-39, MgO 30-42. бокого окиснення метану. Недоліками каталізатора є низька питома поПоставлена задача вирішується синтезом феверхня (16,3-17,4м 2/г), висока температура початку ритів структури шпінелі шляхом термічного розреакції (550°С), недостатньо висока активність, яка кладу поліядерних комплексів, зокрема, різномезабезпечує 100%-у конверсію метану в СО2 при тальних карбоксилатних комплексів перехідних температурі 700°С. Крім того, метод СВС, який металів. Цим методом можна одержати оксиди застосовується для приготування каталізатора, визначеного стехіометричного складу, оскільки достатньо енергоємкісний. Висока вартість кольостехіометрія задається співвідношенням іонів мерових металів обмежує застосування хромітів як талів в каркасі вихідного поліядерного комплексу. каталізаторів. До недоліків хромітів слід віднести і Крім зазначеного, газоподібні продукти, що утвоте, що в ци х каталізаторах частина іонів хрому рюються в процесі термічної деструкції комплексможе знаходитися у вигляді канцерогенних іонів них сполук, можуть перешкоджати утворенню круСr6+, що робить використання хромвмісних каталіпних часток складних оксидів. заторів проблематичним. Задачею винаходу є також збільшення диспеЗастосування кобальтитів ускладнено їх нерсності і термічної стійкості феритів структури шпістійкістю в окислювальному середовищі. Так, вінелі. Поставлена задача досягається модифікудомі кобальтвмісні каталізатори структури шпінелі ванням каталізаторів добавками поверхневоМеСо2O4 (Me-Zn, Си) для окислення СО і вуглевоактивних речовин (ПАР), прямим синтезом фериднів [10]. Недоліком каталізаторів є їх низька тертів в порувати х матрицях носіїв. мічна стійкість. При температурах вище 500°С Запропонований каталізатор характеризується відбувається дезактивація каталізаторів, пов'язана високою дисперсністю (розмір часток шпінелі стаз руйнуванням кобальтової шпінелі на сладові новить 7-15нм); питомою поверхнею (от 27 до оксиди. В роботі [11] показано, що введення Fе2О3 5 71394 6 54м 2/г); активністю, яка забезпечує 100%-ву конМетод приготування каталізатора такий самий, версію метану в СО2 при температурах 500-650°С. як і в прикладі № 1, але замість мараганецьвмісого Активність каталізатора, який відповідає винаходу, триядерного ацетатного комплексу заліза був виспівставна з активністю модифікованого добавкакористаний кобальтвмісний триядерний ацетатний ми лужноземельних, рідкісноземельних елементів комплекс заліза [Fe2IIICoIIO(CH3COO) 6(H2O)3 ]×2H2O. і промотованого паладієм алюмомарганцевого Приклад №3 каталізатора [13]. Моди фікування добавками ПАР, Метод готування каталізатора той самий, як і в використання носія приводить до підвищення дисприкладі № 1, але замість мараганецьвмісного персності і термостабільності каталізатора, що триядерного ацетатного комплексу заліза був випропонується. користаний нікельвмісний триядерний ацетатний Гетерометальні трьох’ядерні ацетатні комплекомплекс заліза [Fe2IIINiIIO(CH3COO) 6(H2O)3 ]×2H2O. III II кси заліза [Fe2 Me O(CH3COO)6(H2 O)3 ]×2H2O (де Приклади №№4 і 5 демонструють можливість MeII - Mn, Co, Ni) були синтезовані по методиці [14] підвищення дисперсності та термічної стійкості з комерційно доступних солей (гідрати нітратів каталізаторів шляхом їх модифікації добавками заліза (III), марганцю (II), кобальту (II) і нікелю (II), ПАР. тригідрат ацетату натрію, оксид заліза (III)) марок Приклад №4 "х.ч" і "ч.д.а". Прожарювання проводили у муфеКаталізатор готували за методикою, яка навельній печі ПМ-40В. Відповідно даних рентгенодена в прикладі №2, але на стадії, що передує фазового аналізу (РФА), дериватографії та ІЧрозкладанню кобальтвмісного триядерного ацетаспектроскопії, при температурі 400°С відбувається тного комплексу заліза, вводили добавки ПАР (до повний розклад комплексів з утворенням нанороз6мас. %). Збільшення вмісту ПАР більше 6мас. % мірних шпінелей MeFe2O4. Вміст металів визначапризводить до блокування пористого простору, та, ли за допомогою трилонометричного титрування, відповідно, до зниження активності каталізатора типові значення наведено для шпінелей, одержавнаслідок того, що поверхня часток виявляється них при 400°С (знайдено/обчислено, мас. %): недоступною для молекул СН 4 та СO2, що адсорMnFe2O 4 (Mn-23,7/23,8; Fe-48,6/48,5), NiFe2O 4 (Niбуються. Як ПАР використовувався розчин карбо25,0/25,1; Fe-47,4/47,7), CoFe2O4 (Co-25,2/25,1; Feксиметилцелюлози (КМЦ). 2г ацетатного комплек48,4/48,5). су [Fe2IIICoII O(CH3COO)6(H2 O)3]×2H2O розчиняли в Вивчення фазового складу носіїв і феритних 40мл дистильованої води, потім додавали 10мл каталізаторів проводили з використанням дифракводного розчину КМЦ при інтенсивному перемішуванні. Отриманий розчин витримували при кімнаттометра ДРОН-3М ( CuK a - випромінення, відфіній температурі та піддавали випарюванню. Потім o¢ зразок прожарювали при температурі 400°С на льтроване нікелем, l = 1,54184 A ). Середній розпротязі 5 годин. мір зерен кристалітів (областей когерентного Приклад №5 розсіювання) визначали за рівнянням Шеррера Метод готування каталізатора той самий, як і в [15]. Питому поверхню зразків (Sуд.) визначали по прикладі №4, але замість кобальтвмісного триядетепловій десорбції аргону з хроматографічним рного ацетатного комплексу заліза був використаконтролем. ний нікельвмісний триядерний ацетатний комплекс Каталітичну активність зразків в реакції глибозаліза [Fe2IIINiIIO(CH3COO) 6(H2O)3 ]×2H2O. кого окислення метану характеризували конверсіПриклади №6-9 демонструють можливості єю СН4 в СO2, яку визначали в проточному кварзменшення вмісту активної фази в каталізаторі, цевому реакторі при атмосферному тиску і підвищення його термічної стабільності і поліпоб’ємній швидкості газової суміші 6000год.-1, що шення експлуатаційних характеристик при синтезі містила 1% СН4 в повітрі, і температурою досягферитів зі структурою шпінелей в пористій матриці нення визначеної конверсії метану (Т10% , Т50%, носія. Т100%). Аналіз вихідних речовин і продуктів реакції Приклад №6 (СН4, СО2, СО) проводили хроматографічно (дете1,43г кобальтвмісного триядерного ацетатного ктор по теплопровідності). Термічну стійкість катакомплексу заліза лізаторів оцінювали по зміні їх активності після [Fe2IIICoII O(CH3COO)6(H2 O)3]×2H2 O розчиняли на високотемпературного прогріву при 900°С протяводяній бані при 70-75°С у 3,6мл дистильованої гом 5 годин. води при інтенсивному перемішуванні до повного Суть винаходу пояснюється наступними прикладами: розчинення. 5г носія - гранульованого c - Al 2O3 Приклади №№1-3 ілюструють отримання фе(питома поверхня 120м 2/м, вологоємність при 50°С ритів структури шпінелі складу MeFe204, (де Me - 70%, діаметр гранул - 1-2мм) висушують при теMn, Co, Ni): мпературі 200°С 4год., охолоджують до темпераПриклад №1 тури 50-60°С та просочують розчином кобальтвміШпінель MnFe2O4 отримана шляхом термічносного ацетатного комплексу заліза (70-75°С) при го розкладу гетерометалічного триядерного ацетаінтенсивному перемішуванні протягом 15хв. до тного комплексу заліза повітряно-сухого стану каталізатора. Після просо[Fe2III MnIIO(CH3COO) 6(H2O)3 ]×2H2O у керамічному чування каталізатор прожарюють на повітрі при тиглі в муфельній печі при температурі 400°С протемпературі 400°С протягом 5год. Отримують катягом 5 годин. талізатор наступного складу, мас. %: СоFе2O 4 - 7Приклад №2 8, носій - інше. Приклад №7 7 71394 8 Метод приготування каталізатора той самий, випарювали при температурі 50-60°С. Після випаяк і в прикладі № 6, але замість кобальтвмісного рювання каталізатор прожарюють на повітрі при триядерного ацетатного комплексу заліза був витемпературі 400°С протягом 5год. Отримують какористаний нікельвмісний триядерний ацетатний талізатор наступного складу, мас. %: CoFe2O4 - 7-8, носій - інше. комплекс заліза [Fe2IIINiIIO(CH3COO) 6(H2O) 3]×2H2O. Приклад №9 Одержують каталізатор наступного складу, мас. %: Метод приготування каталізатора той самий, NiFe2O4 - 7-8, носій - інше. Приклади №№8-9 демонструють можливість як і в прикладі №8, але замість кобальтвмісного триядерного ацетатного комплексу заліза був визбільшення активності нанесених шпінельних какористаний нікельвмісний триядерний ацетатний талізаторів при використанні діоксиду цирконію як носія. комплекс заліза [Fe2IIINiIIO(CH3COO) 6(H2O) 3]×2H2O. Приклад №8 Отримують каталізатор наступного складу, мас. %: Метод приготування каталізатора такий самий, NiFe2O4 - 7-8, носій - інше. як і в прикладі №6, але як носій був використаний У таблиці наведено структурні характеристики діоксид цирконію, модифікований оксидом ітрію (фазовий склад, розмір кристалітів, Sуд.) і актив(7% мас. Y2О3). Y2О 3 вводили в носій для низьконість (температури досягнення 10; 50 та 100% температурної стабілізації кубічної модифікації конверсії метану) каталізаторів. Для порівняння ZrO2, що характеризується більшою дисперсністю наведено дані про активність модифікованого в порівнянні з моноклінною. 1,43г кобальтвмісного алюмомарганцевого каталізатора, промотованого триядерного ацетатного комплексу заліза 0,1% мас. Pd [13]. З даних таблиці видно, що активність каталі[Fe2IIICoII O(CH3COO)6(H2 O)3]×2H2 O розчиняли на заторів, які описано в прикладах №№1-9 перевиводяній бані при 70-75°С у 3,6мл дистильованої щує активність аналогів [1], [2]. Порівняння питоводи при інтенсивному перемішуванні до повного мої каталітичної активності нанорозмірних розчинення ацетатного комплексу. 5г носія - ZrO2 шпінелей (приклади №№1-4) і аналогу [2] при від(питома поверхня 33м 2/г, вологоємність при 50°С носно низьких температурах (до 400°С) свідчить 45%) висушують при температурі 100°С 4год., про вплив розмірного фактора на активність катаохолоджують до температури 50-60°С та просочулізаторів: ють розчином кобальтвмісного ацетатного комплексу заліза (70-75°С) при інтенсивному перемішуванні протягом 15хв. Отриманий зразок Каталізатор CoFe2O Приклад №2 NiFe2O4 Приклад №3 w×103(400°С)мл СН 4 м 2×хв.- 1 6,3 9,1 Найбільш активні феріти нікелю та кобальту з розміром часток 8-9нм. Збереження розміру часток каталізаторів в оптимальному для протікання даної реакції нанометровому діапазоні забезпечує їхню високу активність у реакції глибокого окиснення метану [16]. Приклади №№4-5 показують позитивний ефект при введенні добавок ПАР. Моди фікування каталізаторів добавками ПАР призводить до збільшення дисперсності феріту кобальту, в наслідок чого збільшується його активність. При цьому, модифіковані каталізатори виявили велику термічну стійкість у порівнянні з аналогічними немодифікованими зразками (див. приклади №№2, 3). Результати іспитів активності нанесених ферітних каталізаторів показали, що зразки, отримані розкладом поліядерних комплексів у порах носія ( c - Al 2O3 ) (приклади №№6, 7), виявляють велику термостабільність у порівнянні з масивними зразками шпінелей (приклади №№2, 3). Пориста матриця носія є структурним обмежувачем в процесі спікання шпінелі при високих температурах, що сприяє збереженню каталітичної активності зразків при високотемпературній обробці. Слід зазначити, що навіть після високотемпературної обробки (900°С протягом 5 годин) активність нанесених каталізаторів вище активності аналогу [1]. Використання як носія діоксиду цирконію сприяє збіль СоFe2O4 NiFe2O4 CoFe2O4+ПАР При(з неорг. солей) (з неорг. солей) клад №4 Аналог [2] Аналог [2] 0 3,4 8,0 шенню активності каталізаторів (приклади №№8, 9) у порівнянні зі зразками, нанесеними на АІ2О3 (приклади №№6, 7). Більш висока активність каталізаторів на основі ZrO2 може бути обумовлена декількома факторами: 1. як показало дослідження каталізаторів методом термодесорбції аміаку, феріти, нанесені на діоксид цирконію, характеризується наявністю більш сильних кислотних центрів (температура максимуму десорбції NН3 Тmax=300°С) у порівнянні з аналогічними зразками на основі АІ 2О3 (Тmax=160°С). На сильних кислотних центрах каталізатора може здійснюватися активація метану [17]. 2. відповідно до результатів дослідження методом температурно-програмованого відновлення, каталізатори на основі ZrO2 характеризуються більшою кількістю та рухливістю кисню в порівнянні з каталізаторами, нанесеними на АІ2 О3. Таким чином, підтверджується висока активність і термостійкість запропонованого каталізатора, яка забезпечується ознаками, перерахованими вище. Використання запропонованого каталізатора має на увазі зниження його питомої витрати за рахунок підвищеної активності, а також вартості, внаслідок того, що до його складу не входять рідкі та дорогоцінні метали. Застосування нанесеного каталізатора демонструє можливість зменшення 9 71394 10 витрати активного компонента, збільшення терміну використання, збереження експлуатаційних характеристик в екстремальних умовах. Таблиця Структурні характеристики та активність каталізаторів Приклад Каталізатор 1 1 MnFe2O 4 2 СоFe2O4 3 NiFe2O4 4 CoFe2O4+ПАВ 5 NiFe2O4+ПАВ 6 СоFe2O4/ АІ2O 3 7 NiFe2O4/ Аl2 О3 8 2 СоFe2O4/ ZrO2 NiFe2O4/ ZrO2 9 Мn-РЗЕ, ЛЗЕ/ АІ 2O 3+0,1% Рd Аналог [1] MgCr2O 4, Сr2 O3 / MgO, Аl2О 3 Аналог [2] СоFe2O4 (з неорг. солей) Аналог [2] NiFe2O4 (з неорг. солей) Температура, °С Проіндексовані фази L (ОКР), Sпит., м 2/г досягнення конверсії метану (модифікації) нм Т10% Т50% Т100% 3 4 5 6 7 8 MnFe2O 4 15 27,0*/ 450 515 650 0,4 600 ~ ~ СоFe2O4 9 47,0
ДивитисяДодаткова інформація
Назва патенту англійськоюA low temperature nano-sized catalyst of spinel structure mefe2o4 (me-co, ni, mn) for a deep oxidation of hydrocarbons
Автори англійськоюOrlyk Svitlana Mykytivna, Havrylenko Kostiantyn Serhiiovych, Kosmambetova Hulnara Radiivna, Pavlischuk Vitalii Valentynovych, Illin Volodymyr Heorhiiovych
Назва патенту російськоюНизкотемпературный наноразмерный катализатор структуры шпинели mefe2o4 (me-co, ni, mn) для глубокого окисления углеводородов
Автори російськоюОрлик Светлана Никитична, Гавриленко Константин Сергеевич, Космамбетова Гульнара Радиивна, Павлищук Виталий Валентинович, Ильин Владимир Георгиевич
МПК / Мітки
МПК: B01J 37/00, B01J 23/74, C07B 33/00
Мітки: нанорозмірний, каталізатор, низькотемпературний, окислення, mefe2o4, структури, шпінелі, me-co, глибокого, вуглеводнів
Код посилання
<a href="https://ua.patents.su/6-71394-nizkotemperaturnijj-nanorozmirnijj-katalizator-strukturi-shpineli-mefe2o4-me-co-ni-mn-dlya-glibokogo-okislennya-vuglevodniv.html" target="_blank" rel="follow" title="База патентів України">Низькотемпературний нанорозмірний каталізатор структури шпінелі mefe2o4 (me-co, ni, mn) для глибокого окислення вуглеводнів</a>
Попередній патент: Спосіб оцінки ступеня тяжкості енцефалопатії
Наступний патент: Спосіб оксигенації легких алканів
Випадковий патент: Багатошарова еластомерна труба