Бета-галактозидаза з трансгалактозилуючою активністю
Номер патенту: 94605
Опубліковано: 25.05.2011
Автори: Цорціс Георгіос, Гоулас Атанасіос К., Гоулас Теодорос
Формула / Реферат
1. Послідовність ДНК, що кодує β-галактозидазу, де послідовність вибрана з послідовності, представленої в SEQ ID NO:1, або її фрагмента, або виродженої послідовності, де вказана вироджена послідовність має гомологію від 75 % до 95 %.
2. Послідовність ДНК за п. 1, де вищезазначена послідовність містить заміни, вставки або видалення нуклеотидів, що приводять до менше ніж 25 % замін в амінокислотній послідовності, представленій в SEQ ID NO:2.
3. Послідовність ДНК за п. 1 або 2, де вищезазначена послідовність містить заміни нуклеотидів, що приводять до консервативних амінокислотних замін.
4. Фермент β-галактозидаза, яка кодується будь-якою з послідовностей ДНК за будь-яким з пп. 1-3.
5. Фермент β-галактозидаза, яка містить амінокислотну послідовність, представлену в SEQ ID NO:2.
6. Рекомбінантний вектор, що містить послідовність за будь-яким з пп. 1-3.
7. Вектор за п. 6, де вказаний вектор є експресійним вектором.
8. Клітина-хазяїн, яка є клітиною бактерій, дріжджів або грибів, що вибрана з групи, яка складається з Lactococcus, Lactobacillus, Escherichia, Bacillus і Aspergillus, що містить послідовність ДНК за будь-яким з пп. 1-3.
9. Клітина-хазяїн, що містить вектор за п. 6 або 7.
10. Клітина-хазяїн за п. 8 або 9, де вказана клітина вибирана з групи, яка складається з Bacillus subtilis, Bacillus circulans і Aspergillus niger.
11. Застосування ферменту за п. 4 або 5 або клітини за будь-яким з пп. 8-10, для продукування суміші олігосахаридів.
12. Застосування ферменту за п. 4 або 5 або клітини за будь-яким з пп. 8-10, для продукування суміші олігосахаридів, що є частиною продукту, вибраного з групи, що складається з молочних продуктів, таких як рідке молоко, порошкове молоко, молоко для дитячого харчування, суміш для дитячого харчування, морозиво, йогурт, сир, ферментовані молочні продукти, напоїв, таких як фруктовий сік, дитячого харчування, каші, хліба, печива, кондитерських виробів, тістечок, харчових добавок, дієтичних добавок, пробіотичних харчових продуктів, пребіотичних харчових продуктів, кормів для тварин, кормів для птиці і медикаментів.
13. Застосування клітини-хазяїна за будь-яким з пп. 8-10 для виробництва продукту, вибраного з групи, що складається з молочних продуктів, таких як рідке молоко, порошкове молоко, молоко для дитячого харчування, суміш для дитячого харчування, морозиво, йогурт, сир, ферментовані молочні продукти, напоїв, таких як фруктовий сік, дитячого харчування, каші, хліба, печива, кондитерських виробів, тістечок, харчових добавок, дієтичних добавок, пробіотичних харчових продуктів, пребіотичних харчових продуктів, кормів для тварин, кормів для птиці і медикаментів.
14. Спосіб продукування ферменту за п. 4 або 5, що включає культивування клітини-хазяїна за будь-яким з пп. 8-10 у прийнятному культуральному середовищі в умовах, що допускають експресію вказаного ферменту і виділення отриманого ферменту з культури.
Текст
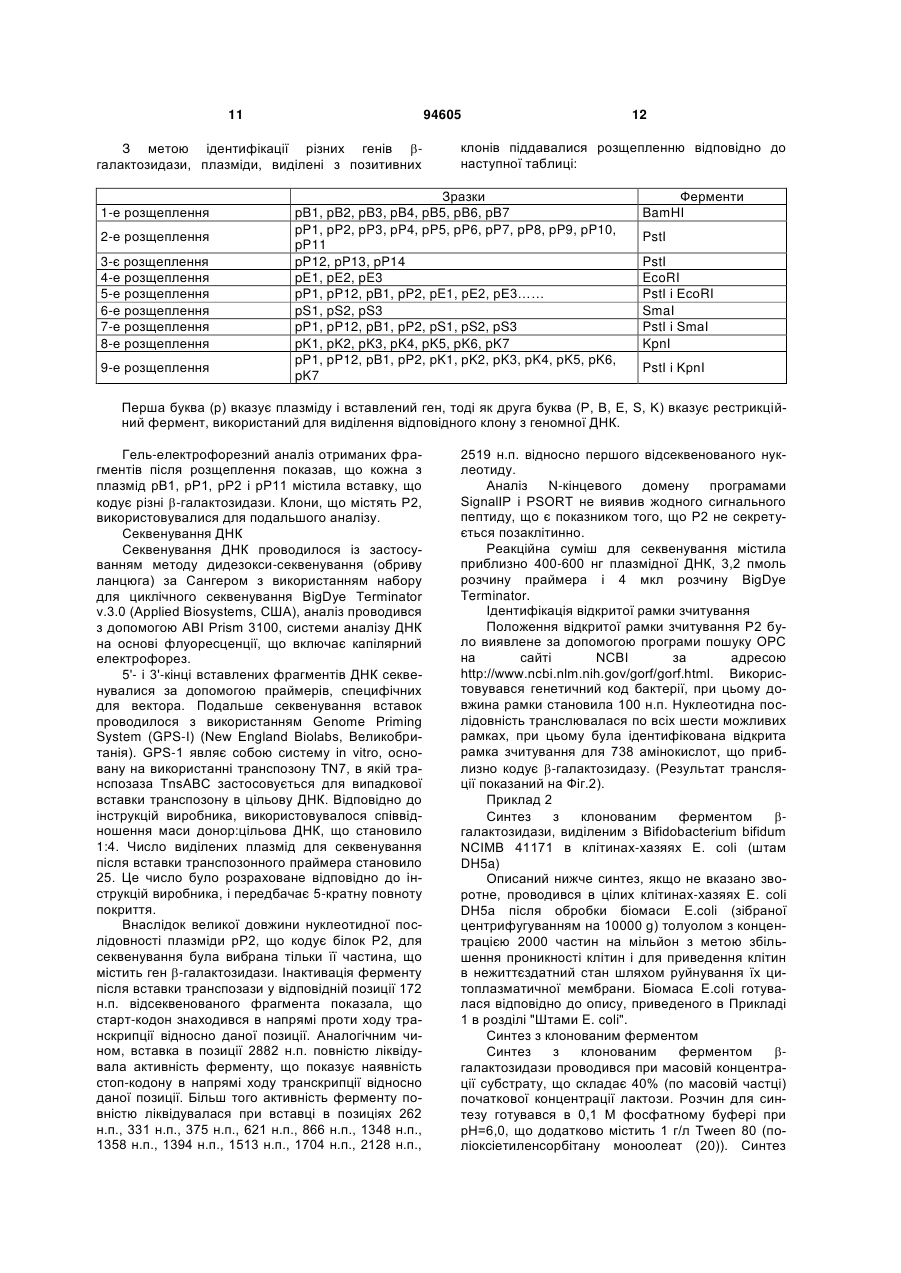
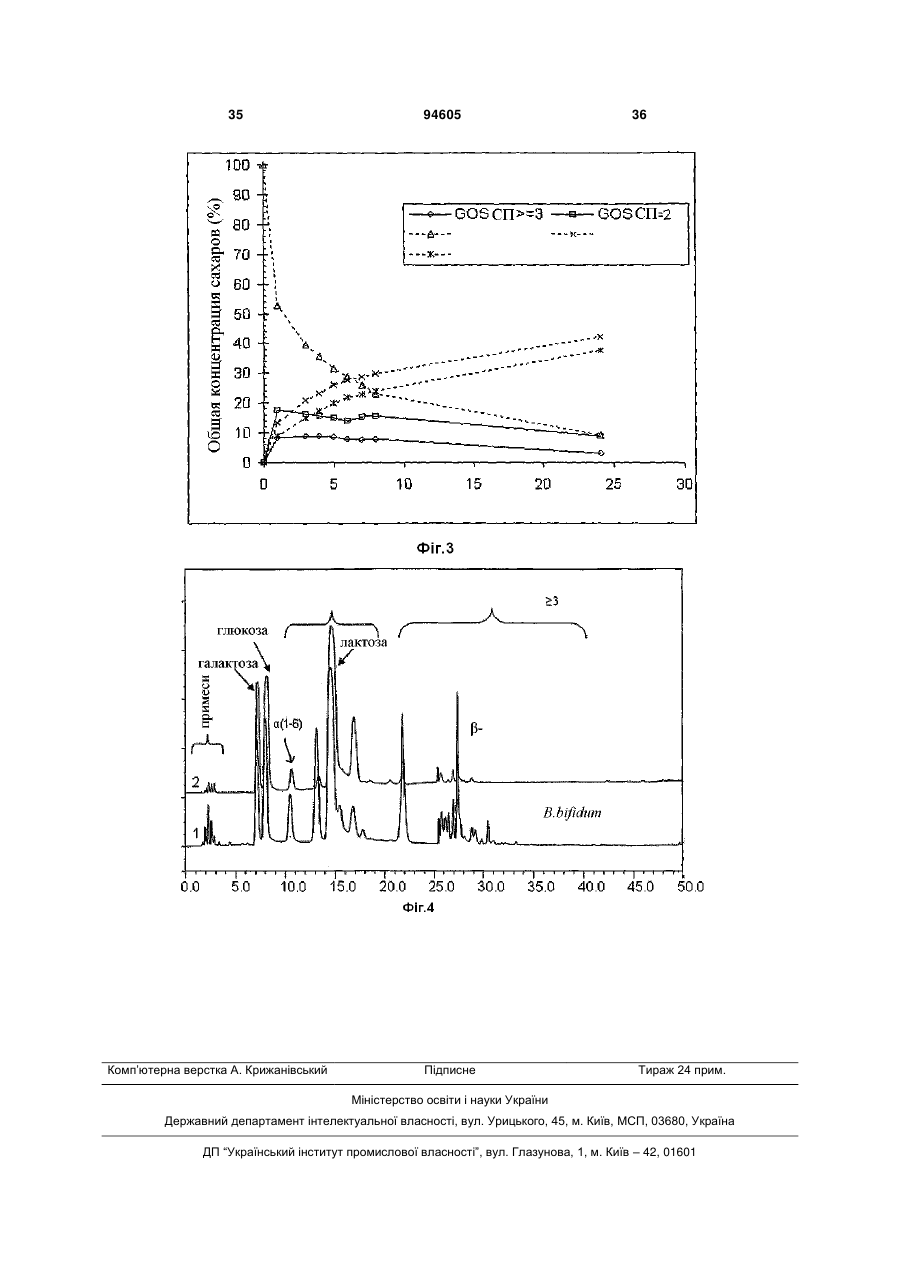
1. Послідовність ДНК, що кодує βгалактозидазу, де послідовність вибрана з послідовності, представленої в SEQ ID NO:1, або її фрагмента, або виродженої послідовності, де вказана вироджена послідовність має гомологію від 75 % до 95 %. 2. Послідовність ДНК за п. 1, де вищезазначена послідовність містить заміни, вставки або видалення нуклеотидів, що приводять до менше ніж 25 % замін в амінокислотній послідовності, представленій в SEQ ID NO:2. 3. Послідовність ДНК за п. 1 або 2, де вищезазначена послідовність містить заміни нуклеотидів, що приводять до консервативних амінокислотних замін. 4. Фермент β-галактозидаза, яка кодується будьякою з послідовностей ДНК за будь-яким з пп. 1-3. 5. Фермент β-галактозидаза, яка містить амінокислотну послідовність, представлену в SEQ ID NO:2. 6. Рекомбінантний вектор, що містить послідовність за будь-яким з пп. 1-3. 7. Вектор за п. 6, де вказаний вектор є експресійним вектором. 8. Клітина-хазяїн, яка є клітиною бактерій, дріжджів або грибів, що вибрана з групи, яка складається з Lactococcus, Lactobacillus, Escherichia, Bacillus і 2 (19) 1 3 94605 4 пресію вказаного ферменту і виділення отримано го ферменту з культури. Представлений винахід стосується нової галактозидази з трансгалактозилуючою активністю, здатною перетворювати лактозу в суміш галактоолігосахаридів. Зокрема, він стосується галактозидази, виділеної з недавно відкритого штаму Bifidobacterium bifidum. Винахід, зокрема, стосується послідовностей ДНК, що кодують виділений новий фермент галактозидази, ферменту, що кодується такими послідовностями ДНК, і до клітин-хазяїв, що містять послідовності ДНК або включають рекомбінантний вектор, до складу якого входять такі послідовності ДНК. Винахід також стосується застосування ферменту, що кодується послідовністю ДНК, або клітини-хазяїна, що містить послідовність ДНК або рекомбінантний вектор, виробництва галактоолігосахаридів. У природному стані біфідобактерії оселяються в нижніх відділах шлунково-кишкового тракту, які є середовищем, бідним на моно- і дисахариди, оскільки ці цукри переважно споживаються організмом-хазяїном і мікробами, присутніми у верхніх відділах шлунково-кишкового тракту. Для того, щоб вижити в нижньому шлунково-кишковому тракті, біфідобактерії продукують різні види екзо- і ендоглікозидаз в поверхневозв’язаній і/або позаклітинній формі, за допомогою яких вони можуть використовувати різноманітні вуглеводи. Крім гідролазної активності, деякі ферменти біфідобактерій демонструють трансферазну активність. Ця трансглікозилуюча активність глікозидаз широко застосовується для ферментативного синтезу різних олігосахаридів, відносно яких було доведено, що вони виступають як стимулятори росту біфідобактерій. Відомо, що представники роду біфідобактерій продукують ферменти -галактозидази, які залучені до процесу бактерійного метаболізму лактози. Мелер і співавт. [Moller, P.L. et al. in Appl & Environ. Microbial, (2001), 62, (5), 2276-2283] описали виділення і дослідження трьох генів -галактозидази з штаму Bifidobacterium bifidum. Вони виявили, що всі три -галактозидази були здатні каталізувати утворення бета-пов'язаних галактоолігосахаридів за допомогою трансгалактозилування. Дюмортьє і співавт. [Dumortier et al. in Carbohydrate Research. 201. (1990), 115-123] описали утворення бета-пов'язаних галактоолігосахаридів за допомогою реакції трансгалактозилування під час гідролізу лактози штамом Bifidobacterium bifidum DSM 20456. Проведений ними аналіз структури суміші продукованих олігосахаридів показав, що мали місце зв'язки -(13), -(16) і -(14)D-галактозил. Дюмортьє передбачив, що сполуки, продуковані Bifidobacterium bifidum, залучені в адгезію бактерії в товстому кишечнику. У документі WO 01/90317 описана нова галактозидаза з Bifidobacterium bifidum, а саме, укорочена версія ферменту, яка володіє високою трансгалактозилуючою активністю. Був виявлений штам Bifidobacterium bifidum, здатний до продукування ферменту галактозидази, що володіє активністю в перетворенні лактози в нову суміш галактоолігосахаридів, яка несподівано містила аж до 35% дисахаридів, включаючи галабіозу (Gal ( 1-6) - Gal). Відомо (див. Paton, JC and Paton, AW (1998), Clin. Microbiol. Revs., 11, 450-479; Carlsson, KA (1989), Ann. Reviews Biochem., 58, 309-350), що цей дисахарид володіє антиадгезійними властивостями, і може перешкоджати адгезії токсинів, наприклад, токсину Шига, і патогенних мікроорганізмів, такого як Е. coli, до стінки кишки. Даний штам В. bifidum був депонований під інвентарним номером NCIMB 41171 в Національну колекцію промислових і морських бактерій, Абердін, Великобританія, 31 березня 2003. Він також описується в патенті США № 2 412 380. На даний момент виявлено, що даний штам В. bifidum продукує декілька -галактозидаз, включаючи нову -галактозидазу. Даний фермент продукує ряд різних олігосахаридів, які є -зв’язаними. Відповідно до винаходу, представлена послідовність ДНК, що кодує білок з амінокислотною послідовністю, відповідною представленій в SEQ ID NO:2, або така, що гібридизується в жорстких умовах з послідовністю ДНК, що кодує даний білок. Послідовність ДНК представлена в SEQ ID NO:1 або може містити фрагмент цієї послідовності або вироджену послідовність, отриману з неї. Термін "вироджена" має на увазі послідовність ДНК, що володіє щонайменше 50% гомологією в SEQ ID NO:1, переважно гомологією на рівні від 50 до 98%, і найбільш переважно гомологією на рівні від 75 до 95%. Така послідовність ДНК може містити нуклеотидні заміни, вставки і делеції, результатом яких є зміна менше 60%, переважно менше 45%, і найбільш переважно - менше 25% амінокислотної послідовності, наведеної в SEQ ID NO:2. Слідством нуклеотидних замін можуть бути консервативні амінокислотні заміни. Відповідно до другого аспекту винаходу, представлений фермент, що кодується послідовністю ДНК, як визначено вище. Даний фермент може містити амінокислотну послідовність, представлену в SEQ ID NO:2, або її фрагмент. Відповідно до третього аспекту винаходу, представлений рекомбінантний вектор, переважно, експресійний вектор, що містить послідовність ДНК, як визначено вище. Даний вектор може бути вбудований в клітину хазяїна, наприклад, клітину бактерій, дріжджів або грибів. Як альтернатива, послідовність ДНК може бути вбудована в подібну клітину хазяїна. Відповідна клітина-хазяїн може бути вибрана з групи, що включає Bifidobacterium, Lactococcus, Lactobacillus, Bacillus, наприклад, Bacillus subtilus або Bacillus circulans, Escherichia і Aspergillus, наприклад, Aspergillus niger. Використовуючи лактозу як субстрат, фермент, що кодується послідовністю ДНК, визначе 5 ною вище, продукує суміш олігосахаридів, що містить дисахариди, такі як Gal(1-3)Glc, Gal(1-3)Gal, Gal(1-6)Gal і Gal(1-6)Gal, трисахариди і тетрасахариди, такі як Gal(1-6)Gal(1-4)Glc, Gal(13)Gal(1-4)Glc і Gal(1-6)Gal(1-6)Gal(1-4)Glc. Фермент або клітина-хазяїн, описаний вище, можуть застосовуватися для продукування суміші галактоолігосахаридів, які можуть служити складовою частиною продуктів, поліпшуючих стан кишечнику. Такі продукти можуть бути вибрані з групи, що складається з молочних продуктів (наприклад, рідке молоко, порошкове молоко, таке як цільне сухе молоко, знежирене сухе молоко, сухе молоко, насичене жирами, суха молочна сироватка, молоко для дитячого харчування, суміш для дитячого харчування, морозиво, йогурт, сир, ферментовані молочні продукти), напоїв, таких як фруктовий сік, дитячого харчування, каші, хліба, печива, кондитерських виробів, тістечок, харчових добавок, дієтичних добавок, кормів для тварин, кормів для птиці або фактично з будь-яких інших продуктів харчування або напоїв. Присутність галактоолігосахаридів в таких продуктах дає перевагу у вигляді посилення росту корисних для здоров'я біфідобактерій в продуктах або в кишковій флорі споживача після прийому, або і в тому, і в іншому. Як альтернатива, олігосахариди, продуковані таким способом, можуть застосовуватися для приготування медикаментів, наприклад, в формі таблеток або капсул, для запобігання адгезії патогенних мікроорганізмів або токсинів, продукованих патогенними мікроорганізмами, до стінки кишечника. Медикамент може вводитися пацієнту, наприклад, після курсу лікування антибіотиками, який часто змінює або навіть знищує нормальну здорову флору кишечника. Відповідно до ще одного аспекту винаходу, представлений спосіб продукування описаного вище ферменту, який включає культивування клітин-хазяїв, визначених вище, у відповідному культуральному поживному середовищі в умовах, що допускають експресію ферменту, і виділення отриманого внаслідок ферменту або ферментних продуктів з культури. Винахід також орієнтований на спосіб продукування суміші галактоолігосахаридів, який включає поєднання вищевизначеного ферменту з матеріалом, що містить лактозу, в умовах, що приводять до утворення суміші галактоолігосахаридів. Відповідний матеріал, що містить лактозу, може бути вибраний з комерційно доступної лактози, цільного молока, напівзнежиреного молока, знежиреного молока, молочної сироватки, насиченого жирами молока і фільтратів молочної сироватки. Дані молочні продукти можуть бути отримані від корів, буйволів, овець або кіз. Насичене жирами молоко визначено як цільне молоко, піддане знежиренню з метою видалення молочних жирів, які потім замінюються шляхом додавання рослинних жирів або рослинної олії. Короткий опис креслень На Фіг.1 показана нуклеотидна послідовність (SEQ ID NO:1) -галактозидази Bifidobacterium bifidum, представленої у винаході. 94605 6 На Фіг.2 показана амінокислотна послідовність (SEQ ID NO:2), відповідна нуклеотидній послідовності, поданої на Фіг.1. На Фіг.3 представлений графік, що показує, в залежності від часу, реакцію, що відбувається при синтезі галактоолігосахаридів за допомогою галактозидази в 40% (по масовій частці) розчині лактози в 0,1 М фосфатному буфері при pH 6,0, що використовується як субстрат. На Фіг.4 показана хроматограма високоефективної аніонообмінної хроматографії суміші галактоолігосахаридів, синтезованих за допомогою галактозидази з В. bifidum NCIMB 41171 з використанням 40% (по масовій частці) розчину лактози в 0,1 М фосфатному буфері при pH 6,0 як субстрат (Glc = глюкоза, Gal = галактоза, Lac = лактоза, (1-6) = галактобіоза, DP = міра полімеризації). Геномна ДНК була виділена з штаму Bifidobacterium bifidum (NCIMB 41171) з використанням методу Лоусона і співавт. (Lawson et al. (1989) Fems Microbiol Letters, 65, (1-2), 41-45). ДНК була розщепленням за допомогою рестрикційних ферментів, і фрагменти, максимальний розмір яких становив 15 т.п.н., лігувалися з вектором pSP72, розщепленим за допомогою тих же рестрикційних ферментів. Клітини E. coli були трансформовані вектором, що містить вставки, що складаються з хромосомної ДНК В. Bifidum, розщепленої за допомогою PstI, EcoRI, BamHI, KpnI, SmaI або HindIII. Клони, що володіють -галактозидазною активністю, були відібрані на чашках з агаровим середовищем Луріа-Бертані, що містить рнітрофеніл, X--Gal (5-бромо-4-хлоро-3-індоліл-D-галактозид) і ізопропіл--D-тіогалактозид (IPTG). Суміші для лігування хромосомної ДНК з Pst I послужили джерелом тринадцяти позитивних клонів -галактозидази, один з яких був ідентифікований як pP2. Секвенування вставленого фрагмента ДНК P2 проводилося із застосуванням методу дидезоксисеквенування (обриву ланцюга) за Сангером (Russel Р., 2002 iGenetics, Pearson Education, Inc., San Francisco, 187-189) з використання набору для циклічного секвенування BigDye Terminator V.3.0 (Applied Biosystems, США). Послідовність ДНК P2 показана на Фіг.1 (SEQ ID NO:1). Відкрита рамка зчитування (ОРС) була виявлена з використанням програми пошуку ОРС з сайту NCBI (Національний центр біотехнологічної інформації). Нуклеотидна послідовність, показана на Фіг.1, транслювалася за допомогою всіх шести можливих рамок зчитування, при цьому була ідентифікована одна відкрита рамка зчитування, з якою транслювалися 738 амінокислот, що приблизно кодують -галактозидазу. Результат трансляції показаний на Фіг.2 (SEQ ID NO:2). Далі представлений винахід буде описаний за допомогою звернення до наступного прикладу. Приклад 1 Матеріали і Методи Всі реактиви і заготовки середовищ, використані в даному дослідженні, були отримані від компаній Sigma (Дорсет, Великобританія), Invitrogen (Пейслі, Великобританія), Oxoid (Бейсигсток, Великобританія), Qiagen (Західний Суссекс, Велико 7 британія) і Promega (Саутгемптон, Великобританія). Штами бактерій Штам Bifidobacterium bifidum (NCIMB 41171) утримувався в кріогенних гранулах в трубках Microbank при -70°C. Для подальших експериментів, штам був відновлений на агарі УїлкінсонаЧалгрена (Oxoid, Великобританія) і TPYсередовищі (середовище з дріжджовим екстрактом фітона триптикази) і вирощувався в анаеробних умовах (вміст CO2 і N2 - 80% і 20%, відповідно) при 37°С протягом 48 годин. Морфологія колонії і відсутність забруднень перевірялися фарбуванням по методу Грама. Штами E. coli Штам Escherichia coli DH5a, використаний в даному дослідженні, звичайно інкубувався в аеробний умовах при 37°С на агарі або в поживному середовищі Луріа-Бертані (Sambrook J. і Russell W. D. (2001). Molecular Cloning: А Laboratory Manual. Cold Spring Harbor Laboratory Press, New York), при цьому у разі необхідності додавалися антибіотики (100 мкг/мл ампіциліну і/або 15 мкг/мл хлороміцетину) і 40 мкл 2% X--Gal, 7 мкл 20% IPTG (ізопропіл--D-тіогалактозида), які наносилися на поверхню заздалегідь підготовленої 90 мм чашки з агаровим середовищем. Штам DH5a E. coli (Invitrogen, Пейслі, Великобританія) (генотип: F 80lacZM(lacZYAargF)U169 recA1 endA1 hsdR17(rk , mk )phoA supE44 thi-1 gyrA96 relA1 ) є позитивним штамом для -галактозидази, і застосовувався в експериментах по експресії і для інших генетичних маніпуляцій. Витягання геномної ДНК з Bifidobacterium bifidum Геномна ДНК виділялася з штаму Bifidobacterium bifidum (NCIMB 41171) за допомогою застосування наступного методу, в якому хромосомна ДНК була заготовлена з клітинного дебрису, зібраного з 100 мл анаеробного поживного середовища Уїлкінсона-Чалгрена. Клітини ресуспендувалися в 10 мл TES-буфера (10 ммоль TrisHCl, 10 ммоль EDTA, 10 ммоль NaCl, pH=8) і оброблялися 200 мкл суміші лізоцим/мутанолізин (4:1, лізоцим - 10 мг/мл мутанолізин 1 мг/мл) протягом 30 хвилин при 37°С. Потім клітини оброблялися 200 мкл протеїнази K (при 20 мг/мл) і 200 мкл РНКази (обидві - 10 мг/мл) і інкубувалися протягом однієї години при 65°С. У кінці клітини оброблялися 2 мл 10%-ного SDS і інкубувалися протягом 15 хвилин при 65°С. Було додано 12 мл фенолу/хлороформу, і витягання повторювалося доти, поки не стало можливим легко розділити водну фазу і інтерфазу. Геномна ДНК осаджувалася ізопропанолом і ресуспендувалася в 10 ммоль TrisHCl - 1 ммоль EDTA (pH=8). Потім геномна ДНК розщеплювалася ферментами рестрикції, лігувалася з pSP72, розщепленим тими ж ферментами, і оброблялася лужною фосфатазою. Розщеплення геномної ДНК B. bifidum проводилося за допомогою EcoRI, PstI, BamHI, SmaI і KpnI. Ліговані суміші застосовувалися для трансформації Е. coli DH5a, і клони, позитивні по -галактозидазі, ідентифікува 94605 8 лися як блакитні колонії на чашках, що містять XGal. Приготування векторної ДНК У даному дослідженні клонувався і експресувався вектор pSP72 (Promega, Великобританія) (Krieg, P.A. and Melton, D.A. (1987). In vitro RNA synthesis with SP6 RNA polymerase. Methods in Enzymology. 155: 397-415). Даний вектор був вибраний внаслідок відсутності комплементарної активності -фрагмента галактозидази, який не закодований в pSP72. Даний вектор не несе короткого сегмента ДНК E. coli, що містить регуляторну послідовність, і кодуючої інформації для перших 146 амінокислот галактозидази, яка, в комбінації з штамами Е. coli (наприклад, DH5a), що експресують карбоксилкінцеву частину даної -галактозидази, утворює активну -галактозидазу (-комплементація). Вектор розщеплювався за допомогою наступних рестрикційних ферментів: PstI, BamHI, HindIII, SmaI, KpnI і EcoRI відповідно до інструкцій виробника, при десятиразовому перевищенні кількості ферментів відносно кількості ДНК (одиниць ферментів: мкг ДНК, що відповідає десяти одиницям ферменту на один мкг плазмідної ДНК або десяти одиницям ферменту на 0,5 пмоль плазмідної ДНК). Після теплового інактивування ферментів (20 хв. при 65°С), рестрикційні карти аналізувалися за допомогою горизонтального гельелектрофорезу. Наявність єдиного фрагмента в гелі вказувала на повне розщеплення вектора і його єдине розщеплення за допомогою рестрикції. Достатність розщеплення вектора також перевірялася за допомогою трансформації нелігованих молекул в компетентні клітини Е. coli DH5a. Число колоній, що утворилися на чашках з агаром ЛуріаБертані з доданням ампіциліну (100 мкг/мл) було індикатором нерозщеплених молекул і очікуваного фонового рівня при послідовних експериментах. Потім вектори дефосфорилювалися за допомогою лужної фосфатази з кишечнику телят CIAP (Promega, Саутгемптон, Великобританія) відповідно до інструкцій виробника. Ефективність обробки перевірялася за допомогою лігування (за допомогою ДНК-лігази бактеріофага T4 відповідно до інструкцій виробника) після трансформації в клітини DH5a. Число колоній, що утворилися, відповідало числу рециркульованих молекул (неклонованих векторів), і внаслідок віднімання даного числа з кількості колоній, що утворилися, без проведення обробки векторів за допомогою CIAP визначалося число векторів, що не піддалися дефосфорилюванню. Побудова бібліотеки геномної ДНК Геномна ДНК піддавалася частковому розщепленню за допомогою шести ферментів рестрикції, що розпізнають гексануклеотидні послідовності в прокаріотичній ДНК, що часто з’являються. EcoRI, BamHI, PstI, KpnI, SmaI і HindIII є рестрикційними ендонуклеазами типу II, що специфічно розпізнають послідовності 5'G/AATTC'3, 5'G/GATCC'3, 5'CTGCA/G'3, 5'GGTAC/C3', 5'CCC/GGG3' і 5А/AGCTT3', відповідно, і утворюючими двохланцюжкові розриви в межах даних послідовностей, генеруючи 5'-«залипання» чотирьох нуклеотидів, 9 AATT, GATC, AGCT у випадку EcoRI, BamHI і Hind III, відповідно, 3'-«залипання», ACGT і GTAC, у випадку PstI і KpnI, відповідно, і тупі кінці у випадку SmaI. Всі ці ферменти були активними і могли розщеплювати ДНК тільки в присутності двовалентних іонів магнію. Дані іони були єдиним необхідним кофактором. Рестрикційне розщеплення ДНК Всі розщеплені ділянки зразків геномної ДНК інкубувалися протягом 2 годин при 37°С, і в кінці піддавалися тепловому інактивуванню при 65°С протягом 20 хвилин. Потім реагенти охолоджувалися при кімнатній температурі, додавалася необхідна кількість завантажувального буфера, після чого проводилося слабке перемішування герметичною скляною капілярною трубкою. Потім розчини були вміщені в резервуар з 0,8% агарозним гелем (джерело живлення - 4-5 В/см протягом 16 годин), і 94605 10 розмір розщепленої ДНК оцінювався відповідно до стандартів 1 т.п.н. ДНК (Promega, Великобританія) (Sambrook J. Molecular Cloning: А Laboratory Manual (2002)). Очищення фрагментів, вироблених в результаті рестрикційного розщеплення Очищення фрагментів з реакційних сумішей і агарозних гелів проводилося з використанням набору для витягання з гелю QIAEX виробництва Qiagen (Західний Суссекс, Великобританія). Протоколи детально описані в інструкції виробника. Лігування і трансформація ДНК Після очищення фрагментів ДНК за допомогою набору для витягання з гелю, вони були піддані лігуванню з вектором pSP72, обробленим CIAP. Для проведення лігування необхідна кількість ДНК переносилася в стерильні 0,5 мл мікроцентрифужні пробірки, як показано в Таблиці 1. Таблиця 1 Суміші для лігування. У пробірці А показана кількість векторної ДНК, що самолігується, яка повинна бути віднята від сумарної кількості трансформантів після трансформації. У пробірці В показано лігування вектора з фрагментами ДНК, і в пробірці С показаний контроль з метою обчислення ефективності трансформації Пробірка А В С ДНК Вектор (15 фмоль [~ 29,7 нг]) Вектор (15 фмоль ~ 29,7 нг ДНК) плюс вставка (чужеродная ДНК, 15 фмоль ~ 69,3 нг) pUC-контроль (0,056 фмоль [~ 100 пг]) Молярна концентрація вектора плазмідної ДНК для вставки у фрагмент ДНК в реакції лігування повинна становити 1:1. Кінцева концентрація ДНК повинна становити ~10 нг/мкл. До проведення лігування фрагменти ДНК нагрівалися при 45°С протягом 5 хвилин для розплавлення всіх «липких» кінців, які піддавалися повторному відпалу під час підготовки фрагментів. Молярна концентрація вектора:вставленої ДНК, дорівнювала 1:1, була вибрана для всіх реакцій лігування, і підготовка реакційної суміші для реакції проводилася відповідно до інструкцій компанії Promega. У пробірки А і В був доданий 1,0 мкл 10х буферу для лігування і 0,5 одиниць Вейса ДНК-лігази T4 (Promega, Великобританія), і об'єм суміші для лігування доводився до 10 мкл шляхом додавання води для молекулярної біології. У пробірки С був доданий 1,0 мкл 10х буфер для лігування, і об'єм суміші для лігування доводився до 10 мкл шляхом додавання води для молекулярної біології. Фрагменти ДНК додавалися в пробірки разом з водою, і потім нагрівалися до 45°С протягом 5 хвилин для розплавлення всіх «липких» кінців, які піддавалися повторному відпалу під час підготовки. Перед доданням інших реагентів для лігування ДНК охолоджувалася до 0°С, після додавання реакційна суміш інкубувалася протягом ночі при 16°С (Sambrook and Russell, 2001). Після осадження і очищення лігованих фрагментів за допомогою етанолу (з метою видалення суміші для лігування, яка спричиняє зниження ефективності трансформації), проводилися трансформації згідно з інструкціями Hanahan. ~50нг лігованої ДНК в 5 мкл розчину було додано до 100 мкл компетентних клітин DH5a. Після теплової обробки і експресії гена стійкості до ампіциліну клітини розподілялися по поверхні чашок ЛуріаБертані, що містять ампіцилін (100 мкг/мл), X--Gal (40 мкл 2% X--Gal) і IPTG (7 мкл 20% IPTG). Вимірювалася кількість трансформантів для кожної реакції лігування. Звичайно число отриманих трансформантів для пробірки С становило 5 6 210 -110 КУЕ/мкг, тоді як для пробірки А - 500600 КУЕ/мкг. Число трансформантів в пробірці А служило показником ефективності обробки векторної ДНК. Число трансформантів в пробірці В зна4 ходилося в діапазоні 2-410 КУЕ/мкг. Число трансформантів Для суміші для лігування хромосомної ДНК з PstI було отримано 13 позитивних клонів галактозидази з ~2500 просканованих трансформантів, тоді як з BamHI було отримано 7 позитивних клонів (з ~1500 просканованих трансформантів), для EcoRI було отримано 3 позитивних клони (з ~1300 просканованих трансформантів), для KpnI було отримано 7 позитивних клонів (з ~2000 просканованих трансформантів), для SmaI було отримано 3 позитивних клони (з ~1600 просканованих трансформантів) і для HindIII було отримано 2 позитивних клони (з ~1200 просканованих трансформантів). Розщеплення позитивних клонів 11 94605 З метою ідентифікації різних генів галактозидази, плазміди, виділені з позитивних 1-е розщеплення 2-е розщеплення 3-є розщеплення 4-е розщеплення 5-е розщеплення 6-е розщеплення 7-е розщеплення 8-е розщеплення 9-е розщеплення 12 клонів піддавалися розщепленню відповідно до наступної таблиці: Зразки pB1, pB2, pB3, pB4, pB5, pB6, pB7 pP1, pP2, pP3, pP4, pP5, pP6, pP7, pP8, pP9, pP10, pP11 pP12, pP13, pP14 pE1, pE2, pE3 pP1, pP12, pB1, pP2, pE1, pE2, pE3…… pS1, pS2, pS3 pP1, pP12, pB1, pP2, pS1, pS2, pS3 pK1, pK2, pK3, pK4, pK5, pK6, pK7 pP1, pP12, pB1, pP2, pK1, pK2, pK3, pK4, pK5, pK6, pK7 Ферменти BamHI PstI PstI EcoRI PstI і EcoRI SmaI PstI і SmaI KpnI PstI і KpnI Перша буква (р) вказує плазміду і вставлений ген, тоді як друга буква (Р, В, Е, S, K) вказує рестрикційний фермент, використаний для виділення відповідного клону з геномної ДНК. Гель-електрофорезний аналіз отриманих фрагментів після розщеплення показав, що кожна з плазмід pB1, pP1, pP2 і pP11 містила вставку, що кодує різні -галактозидази. Клони, що містять P2, використовувалися для подальшого аналізу. Секвенування ДНК Секвенування ДНК проводилося із застосуванням методу дидезокси-секвенування (обриву ланцюга) за Сангером з використанням набору для циклічного секвенування BigDye Terminator v.3.0 (Applied Biosystems, США), аналіз проводився з допомогою ABI Prism 3100, системи аналізу ДНК на основі флуоресценції, що включає капілярний електрофорез. 5'- і 3'-кінці вставлених фрагментів ДНК секвенувалися за допомогою праймерів, специфічних для вектора. Подальше секвенування вставок проводилося з використанням Genome Priming System (GPS-I) (New England Biolabs, Великобританія). GPS-1 являє собою систему in vitro, основану на використанні транспозону TN7, в якій транспозаза TnsABC застосовується для випадкової вставки транспозону в цільову ДНК. Відповідно до інструкцій виробника, використовувалося співвідношення маси донор:цільова ДНК, що становило 1:4. Число виділених плазмід для секвенування після вставки транспозонного праймера становило 25. Це число було розраховане відповідно до інструкцій виробника, і передбачає 5-кратну повноту покриття. Внаслідок великої довжини нуклеотидної послідовності плазміди pP2, що кодує білок P2, для секвенування була вибрана тільки її частина, що містить ген -галактозидази. Інактивація ферменту після вставки транспозази у відповідній позиції 172 н.п. відсеквенованого фрагмента показала, що старт-кодон знаходився в напрямі проти ходу транскрипції відносно даної позиції. Аналогічним чином, вставка в позиції 2882 н.п. повністю ліквідувала активність ферменту, що показує наявність стоп-кодону в напрямі ходу транскрипції відносно даної позиції. Більш того активність ферменту повністю ліквідувалася при вставці в позиціях 262 н.п., 331 н.п., 375 н.п., 621 н.п., 866 н.п., 1348 н.п., 1358 н.п., 1394 н.п., 1513 н.п., 1704 н.п., 2128 н.п., 2519 н.п. відносно першого відсеквенованого нуклеотиду. Аналіз N-кінцевого домену програмами SignalIP і PSORT не виявив жодного сигнального пептиду, що є показником того, що P2 не секретується позаклітинно. Реакційна суміш для секвенування містила приблизно 400-600 нг плазмідної ДНК, 3,2 пмоль розчину праймера і 4 мкл розчину BigDye Terminator. Ідентифікація відкритої рамки зчитування Положення відкритої рамки зчитування P2 було виявлене за допомогою програми пошуку ОРС на сайті NCBI за адресою http://www.ncbi.nlm.nih.gov/gorf/gorf.html. Використовувався генетичний код бактерії, при цьому довжина рамки становила 100 н.п. Нуклеотидна послідовність транслювалася по всіх шести можливих рамках, при цьому була ідентифікована відкрита рамка зчитування для 738 амінокислот, що приблизно кодує -галактозидазу. (Результат трансляції показаний на Фіг.2). Приклад 2 Синтез з клонованим ферментом галактозидази, виділеним з Bifidobacterium bifidum NCIMB 41171 в клітинах-хазяях Е. coli (штам DH5a) Описаний нижче синтез, якщо не вказано зворотне, проводився в цілих клітинах-хазяях Е. coli DH5a після обробки біомаси E.coli (зібраної центрифугуванням на 10000 g) толуолом з концентрацією 2000 частин на мільйон з метою збільшення проникності клітин і для приведення клітин в нежиттєздатний стан шляхом руйнування їх цитоплазматичної мембрани. Біомаса E.coli готувалася відповідно до опису, приведеного в Прикладі 1 в розділі "Штами E. coli". Синтез з клонованим ферментом Синтез з клонованим ферментом галактозидази проводився при масовій концентрації субстрату, що складає 40% (по масовій частці) початкової концентрації лактози. Розчин для синтезу готувався в 0,1 M фосфатному буфері при pH=6,0, що додатково містить 1 г/л Tween 80 (поліоксіетиленсорбітану моноолеат (20)). Синтез 13 проводився при 40°С на водяній бані, що обертається на 150 об./хв. Оптимальне значення pH для конкретного ферменту вибиралося на основі вимірювань активності (з використанням о-нітрофеніл-D-галактопіранозиду як субстрату) конкретної ферментної композиції при різних значеннях pH. Для синтезу галактоолігосахариду використовувалося 2 мл супернатантного клітинного лізату (після руйнування клітин Е. coli французьким пресом) з 8 г 50%-ний (по масовій частці) лактози з метою отримання підсумкової концентрації субстрату, що дорівнювала 40% (по масовій частці). 94605 14 Ферментна композиції мала активність 735 одиниць/мл. Концентрації різних цукрів, що були присутні в суміші в процесі синтезу, показані на Фіг.3. Об'єднані хроматограми високоефективної аніонообмінної хроматографії і імпульсного амперометричного детектування (HPAEC-PAD) сумішей галактоолігосахаридів, синтезованих за допомогою галактозидази, клонованої з В. bifldum NCIMB 41171, показані на Фіг.4. Концентрації цукрів в суміші галактоолігосахаридів в оптимальній часовій точці синтезу показані в таблиці 2. Таблиця 2 Вуглеводний склад синтезованих галактоолігосахаридів (ГОС) при початковій 40%-ній масовій концентрації лактози в момент часу, в який спостерігалася максимальна концентрація олігосахаридів Початковий субстрат для синтезу ГОС DP>3 ГОС DP=2 лактоза глюкоза % (масова частка) концентрація (% від загальної кількості цукру) 40 8,82 16,25 39,40 20,76 DP: міра полімеризації. галактоза 14,85 15 94605 16 17 94605 18 19 94605 20 21 94605 22 23 94605 24 25 94605 26 27 94605 28 29 94605 30 31 94605 32 33 94605 34 35 Комп’ютерна верстка А. Крижанівський 94605 Підписне 36 Тираж 24 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюBeta-galactosidase with transgalactosylating activity
Автори англійськоюTZORTZIS GEORGIOS, GOULAS ATHANASIOS K, GOULAS THEODOROS
Назва патенту російськоюБета-галактозидаза с трансгалактозилирующей активностью
Автори російськоюЦорцис Георгиос, Гоулас Атанасиос К., Гоулас Теодорос
МПК / Мітки
МПК: C12N 15/63, C12R 1/125, C12N 5/10, A61K 39/40, C12R 1/685, C12R 1/09, C12N 9/38
Мітки: активністю, трансгалактозилуючою, бета-галактозидаза
Код посилання
<a href="https://ua.patents.su/18-94605-beta-galaktozidaza-z-transgalaktoziluyuchoyu-aktivnistyu.html" target="_blank" rel="follow" title="База патентів України">Бета-галактозидаза з трансгалактозилуючою активністю</a>
Попередній патент: Нейрозахисна сполука dlhw та її застосування
Наступний патент: Похідні тіоксантину, композиція, що їх містить, та їх застосування у терапії
Випадковий патент: Спосіб виробництва губчастого титану магнієтермічним відновленням тетрахлориду титану