Спосіб відновлення внутрішньоклітинних компонентів з ферментованих мікроорганізмів
Формула / Реферат
1. Спосіб відновлення внутрішньоклітинних компонентів із суспензії мікроорганізмів, який полягає у:
спільному завантаженні принаймні двох потоків у розпилювач, в якому перший потік містить призначену для лізису водну суспензію клітинних мікроорганізмів, та другий потік містить рідкий або газоподібний розчинник;
розпиленні суспензії у розпилювальній камері з підтриманням температури 120-180 °C таким чином, щоб отримати лізис клітинних стінок мікроорганізмів з утворенням суспензії, яка містить внутрішньоклітинні компоненти та клітинні залишки, які походять від лізису, та парової фази, під час якої застосовано органічний розчинник;
відокремленні внутрішньоклітинних компонентів від клітинних залишків, які походять від лізису.
2. Спосіб за п. 1, в якому розчинник є органічним розчинником, переважно полярним органічним розчинником.
3. Спосіб за п. 2, в якому полярний органічний розчинник є переважно вибрано зі спиртів, естерів, кетонів або їх сумішей, та навіть більш переважно є метанолом, етанолом, ізопропанолом та/або етилацетатом.
4. Спосіб за п. 1, в якому розчинник є органічним розчинником, переважно неполярним органічним розчинником.
5. Спосіб за п. 4, в якому неполярний органічний розчинник є вибраним з алканів, зокрема та переважно з гексану та/або ізооктану, фракцій переробки, які відрізняються кривою кипіння у нормальних умовах з 50-180 °C, переважно 100 °C, сумішей різних органічних речовин переробки, переважно петролейного етеру, продуктів бензинової фракції та/або алкілованих бензинів або їх сумішей.
6. Спосіб за п. 1, в якому розпилення суспензії культивованих мікроорганізмів відбувається у розпилювальній камері, яка містить інертний газ, переважним чином водну пару, вуглекислий газ або розчинник, призначений для розпилення, у газоподібній фазі.
7. Спосіб за п. 1, в якому температура розпилювальної камери коливається 120-160 °C, переважно 130-150 °C.
8. Спосіб за п. 1, в якому мікроорганізми є дріжджами, водоростями, бактеріями та/або мілд'ю.
9. Спосіб за п. 8, в якому культивовані мікроорганізми є дріжджами, переважно дріжджами, вибраними з: Lypomices, Rhodotorula та Cryptococcus.
10. Спосіб за п. 1, в якому внутрішньоклітинні компоненти є внутрішньоклітинними ліпідами, отриманими шляхом культивування мікроорганізмів після цукрового бродіння.
11. Спосіб за п. 1, в якому відокремлення внутрішньоклітинних компонентів від клітинних залишків, що походять від лізису, здійснюють гравіметрично або центрифугуванням.
12. Спосіб за п. 1, в якому суспензію, що містить внутрішньоклітинні компоненти та клітинні залишки, що походять від лізису, піддають принаймні одній додатковій операції лізису рециклінгом тієї ж суспензії.
13. Спосіб за п. 12, в якому рециклінг суспензії, що містить внутрішньоклітинні компоненти та клітинні залишки, які походять від лізису, здійснюють разом з призначеною для лізису початковою суспензією перед розпилювальною камерою.
14. Спосіб за п. 12, в якому рециклінг суспензії, що містить внутрішньоклітинні компоненти та клітинні залишки, що походять від лізису, здійснюють на шляху до секції лізису після розпилювальної камери.
Текст
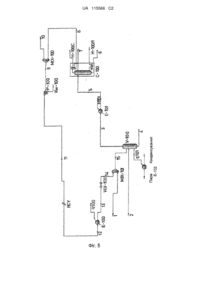
Реферат: Спосіб відновлення внутрішньоклітинних компонентів із суспензії мікроорганізмів полягає у спільному завантаженні принаймні двох потоків у розпилювач, в якому перший потік містить призначену для лізису водну суспензію клітинних мікроорганізмів та другий потік який містить рідкий або газоподібний розчинник, розпиленні суспензії у розпилювальній камері з підтриманням температури 120-180 °C для отримання лізису клітинних стінок мікроорганізмів з утворенням суспензії, яка містить внутрішньоклітинні компоненти та клітинні залишки, які походять від лізису, та парової фази, під час якої застосовано органічний розчинник, відокремленні внутрішньоклітинних компонентів від клітинних залишків, які походять від лізису. UA 115566 C2 (12) UA 115566 C2 UA 115566 C2 5 10 15 20 25 30 35 40 45 50 55 Винахід стосується способу відновлення внутрішньоклітинних компонентів матеріалів біологічного походження, як-то дріжджів, водоростей, бактерій та/або мілд'ю. Відомо, що суспензії клітинних мікроорганізмів можуть бути піддані лізису розривом та руйнуванням клітинної мембрани, наприклад змінень осмотичного тиску. Наприклад, просте зниження іонної сили рідкого середовища або додавання поверхнево-активної речовини з помірним перемішуванням суспензії веде до набряку клітин та надає можливість їх руйнації. З іншого боку, у інших випадках для руйнування клітинних мембран потрібно застосовувати ретельне перемішування суспензії разом з сильною тепловою, механічною або звуковою дією, що збільшує вартість лізису клітин. Наприклад, клітини бактерій, дріжджів та водоростей є значно більш стійкими, та їх лізис для відновлення внутрішньоклітинних компонентів є важким, отже для досягнення цієї мети існує потреба у отриманні більш ефективних, ніж осмотичні, способів. Головні способи руйнування клітинних стінок висвітлено у роботі "Disruption of microbial cells for intracellular products" ("Руйнування мікробних клітин для отримання внутрішньоклітинних продуктів"), Enzim. Microb. Tech., 1986, vol. 8 та полягають у наступному: а) Механічні способи, як-то: - із застосуванням сил тертя між клітинами та твердим матеріалом, наприклад з застосуванням бісерних млинів або пресів типу X-Press або пресів Хьюза; - способи з застосуванням сил тертя у суспензії клітин, наприклад з застосуванням джерел ультразвуку або гомогенізаторов високого тиску або так званих "френч-пресів". б) Немеханічні способи, як-то: - способи з застосуванням ферментативного, хімічного лізису (з детергентами, розчинниками або антибіотиками) або фізичного лізису (з допомогою осмотичного шоку або тиску). У промислових процесах, в яких вивільнення внутрішньоклітинного продукту наприкінці ферментації, передбачено можливість збирання мікроорганізмів та руйнування або лізису їх клітин, залишки цих клітин часто супроводжуються наявністю олійної та водної ферментативної фази. В промисловостідля екстракції олій з насіння застосовують технологічні агрегати (процес розм'якшення), які перемішують достатній об'єм з допомогою спіральних лопатей, які обертаються зі швидкістю 20-30 об./хв. та забезпечення часу перебування, достатнього для процесу руйнування для вивільнення олійних вакуолей (1-2 або більше годин). Цей процес відбувається при низькій температурі (20-30° C) у повітрі. Промисловий виробничий комплекс, як правило, може містити більше змішувачів розташованих послідовно (які у цьому разі розташовують один над одним з метою обмеження технологічної площі) або розташованих паралельно та механічно наповнених (з допомогою гідравлічної системи), причому олійна паста виходить з дробарки. Це викликає м'який тепловий лізис, який при поєднанні з повільним повторним перемішуванням цієї пасти, дозволяє вивільнятися олійній фазі, яку потім відокремлюють флотацією. Ця технологія є ефективною для мікроорганізмів, які мають розміри, більші, ніж кілька десятків мікрон, але вона не є ефективною для стійких мікроорганізмів, як-то для деяких видів Lypomyces, Rhodotorula та Cryptococcus, але не тільки для них. Зазначеними для цього процесу технічними параметрами є температура та тривалість операції. Головне значення для отримання продукту протягом наступної екстракції має температура та вона є стійко пов'язаною з фазою вивільнення клітинного вмісту. Параметр часу корелюють з робочим режимом. Іншим типом промислової машини, здатної здійснювати цю процедуру для випадків лізису клітин, які вимагають кардинальних умов температури та тиску, є прилад, який складається з фіксованого або обертового циліндра, обладнаного внутрішніми лезамиабо мішалками, здатними до перемішування, руйнування та супроводження клітин, які підлягають лізису. Цей пристрій застосовують у харчовій промисловості для термогідролізу та іноді також у кислих середовищах для сірчаних кислот (дивись, наприклад, машини від Anco-Eaglin Inc). У патентній заявці США 2010/0006515 A1 описано машину для термомеханічного клітинного лізису, яка працює як черв'ячний прес з тиском більше за 5 бар та температурою більше за 120 °C. У цьому описі зазначено, що ця машина протягом процесу теплового лізису також може здійснювати відокремлення клітинних ліпідів для клітинних продуктів з мембран, які відрізняються більшою термічно/механічною міцністю. Застосування скляних або керамічних кульових млинів дозволяє здійснювати енергійне струшування та руйнування клітин у складі пасти, які треба піддати лізису. Цей спосіб застосовують вже протягом багатьох років, та він вважається прийнятним для біологічної групи 1 UA 115566 C2 5 10 15 20 25 30 35 40 45 50 55 60 дріжджів та грибів, мікобактерій, спор та мікроводоростей. Зовсім нещодавно його також застосували до зразків грунту та невеликих зразків овочів та тваринних тканин. Хоча обидва способи, які засновані на застосуванні млинів та гвинтових барабанів є ефективними для деяких типів клітин, вони відрізняються високою вартістю експлуатації та обладнання. Останнє обумовлено часом, потрібним для здійснення лізису та, іноді, це також обумовлено хімічною агресивністю середовищ росту, які супроводжують клітинні мікроорганізми, а також хімічною агресивністю у випадку водоростей, де присутність хлору вимагає застосування високоміцних матеріалів, як-то сплавів, головним чином на основі нікелю та хрому. Зовсім недавно були застосовані способи на основі звукових або магнітних процесів лізису, які передбачають більш низьку кінцеву вартість енергії. Інтенсивна обробка ультразвуком рідин, наприклад, викликає звукові хвилі, які поширюються в рідких середовищах із зміною циклів високого та низького тиску. Під час циклу низького тиску у рідині з великою інтенсивністю виникають вакуумні бульбашки маленького розміру. Отже тут для імплозіі рідких бульбашок застосовують процес кавітації, який, таким чином, дозволяє виникати силам зсуву, які здатні до механічної руйнації клітинної структури. Цей ефект застосовують для екстракції ліпідів з морських водоростей. Для ефективного відокремлення олійної / ліпідної фази від водної фази та клітинних відходів також необхідно додавання розчинника, тому що в іншому випадку клітинні відходи будуть залишатися зануреними у олійну / ліпідну фазу. Інші способи охоплюють руйнування клітин їх проходженням під великим тиском (20 000–30 000 фунтів на квадратний дюйм або 140–210 MПа) через клапан, який має вузький отвір. Така рідина, отже, піддається дії високої сили зсуву з подальшою руйнацією клітин, та сила зсуву для оптимізації руйнування клітин визначається регулюванням тиску. Така система вимагає високих енергій та охолодження зразків, які, в свою чергу, вимагають багатоетапного проходження через систему. Ці механічні способи також полягають у механічній гомогенізації, яка відбувається в умовах високого тиску та з застосуванням високої густини енергії та в основі цих способів є застосування тиску та мікроклапанів для розділення частинок, доки вони не зменшуються до мінімальних розмірів (менше мікрону). Гомогенізаційні клапани розраховані для отримання бажаного тонкого подрібнення та ступеня дисперсності під мінімальним тиском в залежності від різних застосувань. Вони є промисловими машинами безперервного циклу, які також можуть обробляти великі швидкості потоку з застосуванням низьких питомих енергій (наприклад, 3 машина, яка здатна працювати зі швидкостями потоку рідини 6 м / год. з надлишковим тиском у 1500 бар, потребує потужності у 315 кВт). Інший підхід до теплового лізису описано у науковій літературі під назвою "гідротермічної обробки", яку експериментально застосовували для лізису водоростей, та застосування якої передбачено для екстракції ліпідів, які знаходяться у олійному насінні. Цей процес забезпечено експериментальними даними по вивільненню ліпідів з водоростей, та в основі його є механізм теплового лізису з суспензією, яка містить рідку та тверду фракції під тиском (200 атм.) та при температурі у діапазоні 250-300° C. Кінцеву екстракція ліпідів з твердої підданої лізису клітинної маси здійснюють з n-гексаном. Технологічний підхід до проблеми, розвинутий з допомогою цієї новітньої технології, як і ці застосування гомогенізаційної системи під тиском, вимагає дорогих промислових застосувань, насамперед стосовно матеріалів, застосування яких має гарантувати належну стійкість до фізико-хімічної системи, що складається з суспензії, яка підлягає обробці в умовах застосування цього способу лізису ("Hydrothermal processing of high-lipid biomass to fuels" ("Гідротермічна обробка біомаси з високим вмістом ліпідів на паливо") Johnson, Michael C., Ph. D. Massachusetts Institute of Technology. Dept. of Chemical Engineering Massachusetts Institute of Technology Issue Date: 2012). Міжнародна патентна публікація WO 99/15638 стосується способу змінення структури ліпідних мембран, як-то подвійних ліпідних шарів мікроорганізмів, еукаріотів або прокаріотів, ліпосом, везикул або живих клітин. Зокрема, цей спосіб створює нестабільність (збурення) структури ліпідів, яке дозволяє здійснити злиття ліпідних мембран без лізису залучених клітин. Спосіб, описаний в WO 99/15638, передбачає застосування низькотемпературної розпилювальної сушарки для розпилення на дрібні краплі рідкого середовища, як-то фізіологічного розчину, молока, крові, сироватки, ферментаційних бульйонів та води, яке містить ліпідну структуру, яку вводять з високою швидкістю до середовища, яке містить пару з контрольованою температурою. У способі за WO 99/15638, для суспендування призначених для злиття під час розпилення клітин або ліпідних структур застосовують рідке середовище, яке сприяє процесу злиття 2 UA 115566 C2 5 10 15 20 25 30 35 40 45 50 55 60 клітинних мембран лізисом їх частини, тому застосоване рідке середовище повинно сприяти агрегації цих мембран, а не їх руйнуванню. Метою наведеного у WO 99/15638 процесу є не руйнування мембран двох або кількох різних клітинних об'єктів, а збереження незмінних характеристик оригінальних клітин, таким чином дозволяючи часткове злиття клітинних мембран. Таким чином, застосування цього способу веде до отримання молекулярних агрегатів, які поєднують характеристики агрегованих клітин у мультиклітинній суміші. У лізисі клітин бажаною є екстракція продукту цього процесу від мікроорганізмів здопомогою ферментації або культивування, та процес лізису або руйнування повинен, поперше, бути здійсненим, наприклад, теплом, у об'ємі, прийнятному для здійснення цього процесу або у реакторі, прийнятному для отримання температури вище за 120° C з тиском принаймні 5 бар та протягом часу від 10 хвилин до 4-5 годин при помірному перемішуванні, тобто в умовах, необхідних для лізису мікроорганізмів. Це згодом буде необхідно для: початку охолодження реактора; вилучення маси з реактора у вигляді суспензії твердих залишків, олій, води та інших внутрішньоклітинних продуктів; та, нарешті, органічного або неорганічного розчинника, якого треба додати або їх сумішей, для отримання, з подальшими операціями солюбілізації та відокремлення рідких фракцій від твердих фракцій, клітинного вмісту, отриманого в процесі ферментації або культивування. Цей спосіб відрізняється тим, що понад 90 % потреб енергії загального процесу екстракції продукту процесу ферментації обумовлено тепловим лізисом ферментованих мікроорганізмів. Тому великий інтерес являє відкриття нового способу отримання внутрішньоклітинних компонентів ферментованих біологічних матеріалів, в якому енергетичні потреби для здійснення загального процесу будуть набагато меншими, ніж подібні потреби, необхідні для здійснення подібних загальноприйнятних процесів. Винахід стосується способу теплового лізису для відновлення (екстракції) внутрішньоклітинних компонентів матеріалів біологічного походження, як-то культивовані дріжджі, водорості, бактерії та/або грибки, які викликають мілд'ю або, зокрема, ферментованих продуктів, який дозволяє зменшити застосовані у цьому процесі лізису експлуатаційні витрати та витрати на обладнання. Спосіб згідно винаходу полягає у наступному: - спільне завантаження у розпилювач принаймні двох потоків, в якому перший потік містить суспензію призначених до лізису клітинних мікроорганізмів та другий потік містить рідкий або газоподібний розчинник (розчинник, призначений для розпилення); - розпилення суспензії, яка містить ці мікроорганізми, та їх тепловий клітинний лізис у середовищі, яке характеризується високою поверхнею обміну, отже відрізняється малим часом контакту у малому об'ємі, потрібному для обробки або у реакторі та яке звичайно веде до відносно зменшеної вартості обладнання; - відокремлення внутрішньоклітинних компонентів від клітинних залишків, які залишилися після лізису. Рідина суспензії клітин або розчинник, призначений для розпилення, звичайно єводою та/або іншою хімічною сполукою, яка сприяє процесу розриву клітинних мембран для вивільнення вмісту клітин. Застосований розчинник отже повинен сприяти руйнуванню цих мембран, а також сприяти відокремленню внутрішньоклітинних продуктів від позосталого твердого матриксу. Особливими прикладами призначених для розпилення розчинників є органічні розчини, як-то вуглеводні, спирти, естери та етери. Якщо розчинник, призначений для розпилення, є рідким водним розчином, то до нього також може бути додано неорганічні кислоти. Розпилення суспензії мікроорганізмів відбувається у розширювальній камері (камера розпилення або секція теплового лізису), яка містить інертний газ, водну пару, вуглекислий газ та/або органічний розчинник у газоподібній фазі з високими температурами. Температура у камері розпилення вже може дорівнювати температурі лізису, тобто 90 °C-180 °C, переважноо 120° C-160° C та навіть більш переважноо 130 °C-150 °C. Перевагою винаходу є те, що фактично стає можливим працювати при більш низьких температурах, ніж температури, які звичайно застосовують у відомих у цій галузі процесах лізису. Отримана взаємодія з великою поверхнею контакту, утвореного завдяки розпиленню, дозволяє робити швидке перенесення кінетичної енергії до розпиленої суспензії, яка викликає механічні пошкодження розширенням клітинної стінки та/або клітинних мембран мікроорганізмів, присутніх у розпиленій краплі, отже здійснюється вивільнення внутрішньоклітинного вмісту, отриманого культивуванням або ферментацією, яке потім може бути отримано екстракцією протягом виробничого процесу під час теплового лізису. 3 UA 115566 C2 5 10 15 20 25 30 35 40 45 50 55 60 Після першої розпилювальної камери розташовано наступні технологічні елементи, як-то контейнери для накопичування, циклонні сепаратори або поверхневі конденсатори, які знаходяться у режимі поступового температурного зменшення та з допомогою яких спостерігають розділення мультифазної суспензії, яка складається з внутрішньоклітинного вмісту, твердої фракції (клітинні відходи) та водної та олійної фракцій, які виникають внаслідок конденсації частини атмосферної пари камери розпилення через спільне завантаження розчинників разом з клітинною суспензією та внутрішньоклітинним вмістом або ліпідами. Водна фаза містить воду, залишки середовища для культивування або ферментації, солі, розчинники та кілька розчинних ліпідів. Ліпідна або олійна фаза містить органічні розчинники, жирні кислоти, ліпіди, воду та їх солі. Тверда фаза містить позосталі від клітинних агрегатів тверді залишки (клітинні відходи), які ще може містити неекстраговані ліпіди, та які вибірково можна піддати ще одній або кільком додатковим операціям лізису з застосуванням подальших операцій розпилення, з закінченням цих операцій на тому ж саме обладнанні переробкою отриманого матеріалу разом з основним матеріалом для завантаження у головну частину розпилювальної камери або у відповідну секцію для лізису. Компоненти цієї мультифазної суспензії, отриманої у розпилювальній камері, потім відокремлюють гравіметричноо або центрифугуванням з метою вилучення води та твердих частин від олійної фази, яка містить розчинники та ліпіди. Природа застосованого розчинника (початкового розчинника, призначеного для розпилення) також впливає на цю операцію, оскільки вона може призвести до отримання фаз у вигляді важких до обробки пінистих суспензій. Отже вибір призначеного для розпилення розчинника також повинен сприяти відокремленню компонентів отриманої після лізису суспензії. Етап відновлення призначеного для розпилення розчинника завжди відбувається після етапу відокремлення твердої фази від рідкої фази, аналогічно до хімічних процесів екстракції розчинника. Відновлені (екстраговані) ліпіди можуть самі бути застосовані або можуть бути надіслані на обробку, призначену для їх кінцевого застосування, наприклад, якяк біопалива, чи надіслані на обробку гідрогенізацією або переестерифікацією. Бажаний внутрішньоклітинний вміст відокремлюють від розчинника/водної фази гравіметрично або центрифугуванням. Позостала наприкінці низки відокремлень вода може залишатися частково у вигляді пари та частково у конденсованій формі. Ця вода є завжди присутньою, якщо вона походить з води, яка на початку процесу знаходилася всередині клітин. Спосіб згідно винаходу зокрема може бути застосованим у процесах отримання ліпідів, отриманих як внутрішньоклітинні сполуки дріжджів, які зростають на цукрових субстратах. Ці клітинні організми, як-то дріжджі Lypomyces, Rhodotorula та Cryptococcus мають клітинну стінку, яка також є частково стійкою до сильних механічних / термічних стресових дій, як-то тиску, навіть більшого за 1000 бар. Розпилення зменшує енергетичні витрати загального процесу, оскільки теплообмін на основі процесу лізису сприяє великій поверхні теплообміну, яка утворюється через розпилення та феномен кавітації, викликаний високими тепловими профілями у межах клітин. Вважаючи те, що спостерігається збільшення теплообміну між газоподібною та рідкою фазами, слід зазначити, що середовище, отримане завдяки розпиленню фактично відрізняється високим переносом енергії на клітинній поверхні. Цей теплообмін між газоподібною та рідкою фазами є пов'язаним з тим фактом, що у зв'язку зі збільшенням обернено пропорційній діаметру краплі поверхні контакту у атмосфері типу рідина/газ розділ між цими двома фазами є більшим при меншому діаметрі крапель суспензії рідкої-твердої фаз та значно збільшується швидкість передачі енергії через клітинні мембрани, отже, спостерігається збільшення ефективності на приблизно три одиниці вимірювання відносно випадків випаровування рідини з поверхні гравітаційного відокремлення. Типові значення коефіцієнта порогового конвективного 2 2 теплообміну h для води та повітря дорівнюють: h=10-100 W/m K; вода = 500-10 000 W/m K. Розчинники, застосовані для розпилення та наступної екстракції внутрішньоклітинних компонентів дріжджів, водоростей, бактерій та/або грибків, які викликають мілд'ю, переважно є полярними органічними розчинниками, як-то спиртами, естерами, кетонами, зокрема бажаними з них є метанол, етанол, ізопропанол та/або етилацетат, неполярними органічними розчинниками, як-то алканами, зокрема бажаними з них є гексан та/або ізооктан, фракціями переробки, які відрізняються кривою кипіння у нормальних умовах у межах 50-180° C, бажано 100° С, сумішами різних органічних речовин переробки, як-то петролейний етер нафти, продукти бензинової фракції та/або алкіловані бензини або суміші згаданих вище розчинників. Розпилювальна камера, до якої завантажують суспензію, що містить мікроорганізми, на додачу до водяної пари або насиченої або перегрітої пари органічних розчинників, зазначених 4 UA 115566 C2 5 10 15 20 25 30 35 40 45 50 55 вище у якості призначених для розпилення розчинників може також містити інертний газ, як-то азот, гелій, аргон та вуглекислий газ. Це робить можливим лізис мікроорганізмів та екстракцію у розчинник бажаних внутрішньоклітинних компонентів. Екстракції внутрішньоклітинних рідин з твердого матриксу мікроорганізмів сприяє розчинник, який знаходиться під тиском. Потім цю екстракцію збільшують застосуванням центрифугування, яке сприяє екстракції завдяки різниці показників щільності твердої та рідкої фаз отриманої суспензії. Для отримання теплового лізису температура у розпилювальній камері знаходиться у діапазоні 90-180 °C, переважно у діапазоні 120-160 °C та навіть більш переважно у діапазоні 130-150 °C (зокрема останній температурний діапазон є бажаним для дріжджів, особливо для дріжджів Lypomyces, Rhodotorula та Cryptococcus). Перемішування призначеного для розпилення розчинника з клітинною суспензією перед розпиленням може підвищити загальний вихід процесу лізису, оскільки воно може хімічно діяти на подвійний ліпідний шар, який утворює клітинну мембрану, як було спостережено у технічних розчинах попереднього рівня техніки. Фактично важливим фактором тут є подовжений час контакту між розчинником та призначеними до лізису клітинами разом з температурою та тиском, необхідними для досягнення лізису мікроорганізмів. Однак цей подовжений час контакту передбачає додаткові енергетичні витрати, тоді як метою винаходу є скорочення цих витрат, отже він відрізняється малим контактним часом перебування розчинника з призначеними до лізису клітинами, як у разі, коли розчинник контактує з клітинами перед введенням у розпилювач, так і коли розчинник знаходиться у розпилювальній камері, з якої треба буде розпилювати суспензію мікроорганізмів, яка не потребує попереднього додавання розчинника. Визначення розмірів обсягу розпилення для способу на основі винаходу є наслідком застосування концепції розділення суспензії, яка містить тверду та рідку фази та є результатом клітинного лізису від пари, яка утворюється після розпилення. Ця концепція також передбачає необхідне у певних випадках застосування різних сепараційних камер, розташованих послідовно по відношенню до потоку газу, які необхідні для сприяння розділення клітинного вмісту на додачу до твердих залишків підданих лізису клітин. Форма розпилювальної камері повинна сприяти відокремленню суспензії від пари та відтоку та збору її з нижньої частини цієї камери. Бажаними формами такої камери є циліндричні форми, які до того ж є прошарованими сітчастими або пластинчастими послаблювачами швидкості та мають усічений конічний кінчик для збору суспензії. Ситуація існування зростаючого температурного профілю між першою та наступною камерами не впливає на процес лізису, якщо ці температури знаходяться нижче передбачених цим способом значень температури та тиску. В цілому можна сказати, що більш високі температури в камерах, розташованих після розпилювальної камери, можуть мати контрпродуктивну дію з точки зору хімічного впливу на піддані лізису рідини. Температурний профіль по довжині технологічної лінії, яка починається від об'єму розпилення, який визначають отриманим на стіні теплообміном або з допомогою обміну вставок в об'ємах сепаратора, з іншого боку в цілому впливає на вивільнення розчинників з отриманої після лізису суспензії. Цей профіль визначають з допомогою дозволених для клітинного вмісту показників швидкості потоку вивільнених газів та захоплення, обумовлених фізико-хімічною рівновагою рідини / пари та дією швидкостей газу. Розпилювальна камера може заздалегідь мати температуру лізису або більш високі температури для сприяння високим швидкостям потоку при обробці протягом процесу лізису та може містити зазначені вище гази або пару при температурі, яка дорівнює або є вищою, ніж температура, при якій буде відбуватися лізис та екстракція. Суспензія, яка містить призначені для лізису мікроорганізми, може потрапляти у розпилювальну камеру з нижчою температурою, ніж температура здійснення лізису. У такому разі розчинник надходить з такими характеристиками потоку та теплового рівня, яких разом з призначеною для лізису суспензією буде достатньо для досягнення стану лізису у розпилювачі. Частина внутрішньо/зовнішньоклітинної води є наявною, та частина або весь розчинник, який можливо завантажити з суспензією мікроорганізмів, випаровується у розпилювальній камері зниженням температури, яка була у цій камері перед завантаженням суспензії мікроорганізмів з вивільненням рідких фракцій, киплячих при високих температурах, як-то фракцій внутрішньоклітинних ліпідів, які відокремлюються на стінках цієї камери разом з клітинними відходами. 5 UA 115566 C2 5 10 15 20 25 30 35 40 45 50 55 Можливе збільшення температури у відокремлених фракціях після розпилювальної камери негативно впливає на ліпіди, збільшуючи у суспензії частину жирних кислот. Однак це збільшення може сприяти екстракції з твердого матриксу. Після лізису цільові внутрішньоклітинні компоненти ліпідної природи, як-то тригліцериди, моно- та діацилгліцеридні жирні кислоти, фосфоліпіди, фітоли та холестерини, вивільнюються у суспензії киплячих при високих температурах олійних компонентів (ліпіди мають точку кипіння при кімнатній температурі, вище за 300 °C) разом з твердими клітинними залишками. Потім суспензію киплячих при високих температурах олійних компонентів відокремлюють від призначеного для розпилення розчинника за умови, що цей розчинник може бути відокремлено від зазначених олій, як-то за умови, що цей розчинник є водним або полярним та потім його надсилають до відокремлення твердих клітинних залишків (відходів). Як вже було попередньо зазначено, це відокремлення може бут здійснено гравіметрично, по щільності з допомогою центрифугування або фільтрації, наприклад з застосуванням гідроциклонів, декантерів або трикантерів або дистиляцією з допомогою мембран, або випарюванням продукту з розпилювального/екстракційного розчинника. Наявну у розширювальній камері воду, яка має внутрішньоклітинне походження або походить від суспензії клітин або від можливої доданої (окремо від призначеної до лізису суспензії або разом з нею) з метою теплообміну високотемпературної пари, переважно вилучають з суспензії для полегшення наступного відокремлення твердих/рідких фракцій та уникнення появи пін та суспензій, які негативно впливають на подальше відокремлення клітинних продуктів. Розчинник, призначений для розпилення вибірково завантажують разом з водяною парою, яка знаходиться під тиском для контролю температури лізису у розпилювачі. Цю робочу методологію застосовують у випадках наявності легкого відокремлення води/розчинника у рідкій фазі. У цих випадках пара, яка містить розчинник та воду, прямує до другої камери, та при відокремленні від води її знов можна застосувати у розпилювачі, в якому вона взаємодіє зі свіжим розчинником. Обладнання, яке може бути застосовано для розпилення головним чином аналогічне обладнанню, яке застосовують для операції розпилення рідкої суспензії твердої речовини (розпилювальна сушарка). Ця розпилювальна сушарка є поєднанням пристроїв, яке складається з подавальної помпи, яка подає рідину, що містить суспензію, неорганічну тверду фракцію або не містить такої фракції, джерела газу або пари, як-то носія теплової та механічної енергії, розпилювача, нагрівача, простору для розсіювання суміші пари/рідини/твердої фракції, яка залишає розпилювач або сушильну камеру на додачу до систем обробки/конденсації суміші пари/вихлопного газу та відновлення можливих отриманих порошків. Tверду сполуку отримують екстракцією у сухому стані при температурі сушильної камери. Приймаючи до уваги умови, необхідні для теплового лізису мікроорганізмів та умови екстракції продукту з клітинної субстанції, в якій він знаходиться, для лізису та відновлення твердих, рідких або солюбілізованих ліпідів у розчиннику за умови застосування розчинника можуть бути визначені серії режимів функціонування. Матеріали, які застосовують для лізису, повинні бути визначені в залежності від умов експлуатації, тобто в залежності від номінальної робочої температурі та тиску, а також в залежності від стійкості до умов агресивності навколишнього середовища, які в свою чергу залежать від розчинників та вмісту рідин, що беруть участь в процесі разом з клітинами. Спосіб застосування, який є предметом цієї патентної заявки дозволяє здійснити значну економію витрат, як-то змінних та капітальних витрат (витрат капіталу) на виробничі комплекси для здійснення операцій по лізису клітин та екстракції внутрішньоклітинних сполук, яка обумовлена тим, що, завдяки способу за винаходом існує значна економія енергії, оскільки зникає потреба у пристроях для теплового або механічного лізису клітин в першій фазі з наступною екстракцією ліпідних складових, яка має високу вартість. Стислий опис креслень. На Фіг. 1 показано залежність виходу екстракції ліпідів (у відсотках сухої ваги, (dw%)) до температури розпилення суспензій дріжджів Lypomyces (L), Rhodotorula (R) та Cryptococcus (C). На Фіг. 2 наведено порівняння термограм дріжджових клітин Lypomyces після розпилення, але перед екстракцією розчинником їх ліпідного вмісту з підвищенням температури розпилення. На Фіг. 3 наведено термограму дріжджових клітин Lypomyces, висушених у сушильній шафі при 105 °C; може бути спостережено криву залишкової ваги (у відсотках) (ліва шкала) та похідні криві (D%/DT). На Фіг. 4 наведено інфрачервоний спектр тріолеїну (Фіг. 4a) та екстракту SOX107 (при 150 °C) (Фіг. 4b). 6 UA 115566 C2 5 10 15 20 25 30 35 40 45 50 55 60 На Фіг. 5 наведено схему виробничого комплексу для втілення способу винаходу з застосуванням розчину з закритим циклом. На Фіг. 6 наведено Таблицю 4, в якій показано масовий та енергетичний баланси у порівняльному прикладі, в якому досліджували дріжджі Rhodotorula, оброблені цукровим бродінням. Приклади. Приклад 1. Для екстракції внутрішньоклітинних компонентів за способом винаходу у цих дослідженнях було застосовано три суспензії дріжджів типу Lypomyces, Rhodotorula або Cryptococcus (біомаса) у воді. Жодного іншого розчинника у фазі розпилення до суспензії не додавали. Метою цього прикладу було лише визначення можливості лізису у запропонованому процесі. Потім ефективність лізису оцінювали на основі досліду з допомогою класичного аналізу з застосуванням апарату Сокслета для екстракції твердої речовини рідиною. Для розпилення суспензії було застосовано розпилювальну сушарку MINI Spray Dryer 190 від BUCHI, яка у якості сушарки є здатною до випаровування приблизно 100-500 г/год. води з потоком N2 у 700-1000 нл/год. та яка може бути нагрітою до максимальної температури у 250 °C, отже є здатною до продукування приблизно 1-100 г/год. висушеного порошку з розміром частинок приблизно 0,2-10 мкм. Загальний час, потрібний біомасі для проходження наступної "гарячої частини" обігу до розпилювальної насадки, сягав 10-30 секунд. Повний обіг завантаженого до розпилювальної камери газу до етапу розпилення або до розпилювальної камери було здійснено в умовах слабкого вакууму, приблизно 0,97 атм. Як інертний газ у розпилювальній камері був присутнім азот, в якому було розпилено суспензію, яка підлягала обробці, температуру якої підтримували на приблизно тому ж саме рівні, як і температура на вході циклонного сепаратора (температура, якої зразок негайно досягав на виході з сопла випарюванням води з суспензії та яку постійно контролювали, як зазначено у Таблиці 1). Для екстракції ліпідів з клітинної твердої фракції у цих дослідженнях було застосовано апарат Сокслета. Паперовий ковпачок промили екстракційним розчином, та потім його вагу довели до сталого значення у сушильній шафі при 105 °C та завантажили в нього тверду фракцію, яка підлягала обробці (3-20 г). Екстракційний розчин (150-200 мл) налили у флакон, власна вага якого була точно виміряна. У випадках прикладів, описаних у Таблицях 1 та 2, було застосовано наступні продукти: гексан, який відрізнявся точкою кипіння у 69 °C, щільністю у 0,655г/мл та індексом полярності 2, етилацетат, який відрізнявся точкою кипіння у 77 °C та щільністю у 0,90 г/мл, етанол, який відрізнявся точкою кипіння у 79 °C, щільністю у 0,789г/мл та індексом полярності 24. Потім у флакон помістили кип'ятильники та нагріли його на масляній бані. Розчинник повторно конденсувався з водним конденсатором на нижній частині апарату Сокслета. Взагалі було здійснено приблизно десять циклів екстракції та у кінці останнього циклу ковпачок відокремили та помістили у сушильну шафу з температурою 105 °C до отримання значення сталої ваги. Для відокремлення екстракційного розчину від ліпідного екстракту апарат Сокслета замінили колбою Кляйзена та розчинник піддали дистиляції спочатку при атмосферному тиску, а потім у вакуумі при приблизно 0,005 абсолютних атмосфер. Ліпідний екстракт залишився у флаконі. Для визначення морфології частинок перед та після операції розпилення було застосовано оптичний мікроскоп та для аналізу рівня вологості та зольності отриманих порошків було застосовано термогравіметричний аналізатор Perkin-Elmer thermobalance. Для аналізу ліпідного екстракту було застосовано інфрачервону спектроскопію з перетворенням Фур'є (FT-IR). Отримані екстракти були охарактеризовані з допомогою FT-IR −1 аналізу (FT-IR спектрометр Nicolet Nexus 670) у діапазоні 4000 – 1000 см (з роздільністю 2 −1 см ) з передачею литтям екстракту на таблетки CaF2. Операції розпилення, зазначені у Таблиці 1 нижче були здійснені з застосуванням описаного вище способу. На відміну до інших тестів, тест SD100 було проведено з приблизно 1:3 розведенням матеріалу завантаження у демінералізованій воді. Три тести відрізнялися температурою розпилювальної камери (показник T вих. у Таблиці 1 нижче) та яка зокрема дорівнювала 95°, 130° та 150° C. Слід також зазначити, що показники для мікроорганізмів Cryptococcus, застосованих у тесті SD104 вказані у таблиці перед сушінням у розпилювальній сушарці та ці мікроорганізми було піддано діафільтрації з додаванням демінералізованої води та ультрафільтрації для відокремлення / збору дріжджових клітин та для того, щоб залишити 7 UA 115566 C2 цукри, які на початку тесту були присутніми з дріжджами у воді з метою вилучення залишкової глюкози від бродіння. Таблиця 1 – умови розпилення. Тест Суспензія Вага (г) Суха вага (dw%) SD100 Lypomyces 150 9,8 SD101 Lypomyces 19 29,5 SD102 Lypomyces 67 29,5 SD103 Rhodotorula 26,8 13,0 SD104 Cryptococcus 127,2 4,2 5 (продовження Таблиці 1) Тест SD100 SD101 SD102 SD103 SD104 10 15 20 25 Азот (л/год.) 550 550 551 551 500 Умови розпилення Задане Вакуум значення T вх. (атм) помпи (°C) 0,975 4 210 0,975 3 220 0,975 4 250 0,975 3 250 0,975 3 250 T вих. (°C) 95 130 150 130 150 Вага зібр. (г) 6,9 3,8 16,2 2,5 Оцінка відновлення (dw%) 47 % 67 % 82 % 73 % Ключові позначки до Таблиці 1: Tест - код тесту Вага (г) - кількість розпиленої суспензії дріжджів Суха вага (dw%) – кількість дріжджів у розпиленій суспензії Азот (л/год.) – швидкість потоку у гарячому газі, завантаженому у розпилювальну камеру. Вакуум (атм) - абсолютний тиск азоту після циклонного сепаратора, в якому здійснювалося відокремлення та збір підсушених дріжджів. Задане значення помпи – селектор швидкості потоку навантажувальної помпи для завантаження суспензії дріжджів у розпилювальну камеру (3 - низька, 4 - середня, 5 - висока). T вх. (°C) - температура азоту на вході розпилювальної камери, отже перед введенням призначеної до розпилення суспензії. T вих. (°C) - температура розпилювальної камери після введення суспензії дріжджів. Вага зібр. (г) – кількість висушених дріжджів, зібраних у циклонному сепараторі, розміщеному після розпилювальної камери. Оцінка відновлення (%) - вага дріжджів, зібраних у циклонному сепараторі відносно кількості дріжджів, завантажених у суспензії. Дріжджі, зібрані у розміщеному після розпилювальної камери циклонному сепараторі виявилися висушеними, оскільки вони мали вміст залишкової води менший, ніж 5 %. Ці висушені дріжджі були досліджені з допомогою термогравіметричного аналізу, який полягав у регістрації змінення ваги у між кімнатною температурою та 930 °C з градієнтом у 10 °C/хв. Піддані термогравіметричному аналізу зразки перелічені у Таблиці 2 нижче. Tаблиця 2. Термогравіметрія SD100 SD101 SD102 SD103 SD104 Ex 105 °C у сушильній шафі SOX104 - залишок зразка SD100, екстрагованого з розчинником гексаном SOX105 - залишок зразка SD101, екстрагованого з розчинником етанолом SOX107 - залишок зразка SD102, екстрагованого з розчинником етанолом SOX109 - залишок зразка SD103, екстрагованого з розчинником етилацетатом SOX110 - залишок зразка SD103, екстрагованого з розчинником етанолом SOX111 - залишок зразка SD104, екстрагованого з розчинником етилацетатом SOX112 - залишок зразка SD104, екстрагованого з розчинником етанолом 8 UA 115566 C2 5 10 15 20 25 30 35 40 45 50 55 60 Нормальна операція розпилення з допомогою зазначеного обладнання, застосованого у якості розпилювальної сушарки у температурному режимі до 95 °C веде до ефективного висушування суспензії цих дріжджів (з менш, ніж 5 % відсотком залишкової води у твердій фракції), але вона не є ефективною з одночасним процесом лізису клітинних мембран. Тільки починаючи з більш високої температури, коли зазначений зразок залишається протягом приблизно 10-20 сек. при температурі, яка перевищує або дорівнює 120° C, у наступному процесі екстракції з застосуванням апарату Сокслета було отримано значний вихід продукту (у відсотках екстракту), який поступово зростав зі зростанням температури розпилення. Стисло кажучи, існує помітна пряма та незаперечна кореляція між збільшенням температури розпилення та ефективним лізисом мікроорганізму. Протягом перевірочних тестів екстрагованих ліпідів було фактично показано, що ефект лізису збільшується зі збільшенням температури процесу розпилення через значення температури та швидкість збільшення температури у розпилювачі, що викликає руйнування мембран зразка. На Фіг. 1 показано залежність виходу екстракції (dw%) ліпідів від температури розпилення суспензій дріжджів Lypomyces (L), Rhodotorula (R) та Cryptococcus (C). Як можна побачити На Фіг. 1, при застосуванні однакового розчинника відсоток виходу екстракції зростає з підвищенням температури розпилення мікроорганізмів. На Фіг. 2 наведені термограми з результатами, отриманими при застосуванні способу винаходу, зокрема наведено порівняння між термограмами, отриманими при дослідженні дріжджових клітин Lypomyces після їх розпилення зі зростаючими температурами розпилення, тобто температурами, які дорівнювали 95 °C, 130 °C та 150 °C, але перед сольвентною екстракцією ліпідів зі складу цих клітин. Наведені на Фіг. 2 термограми також являють собою криві відсоткових показників залишкової ваги (ліва шкала) та похідні криві (D%/DT), отримані нагріванням розпилених зразків у повітряній атмосфері з профілем нагрівання у 10° C/хв. при температурах 95 °C, 130 °C та 150 °C. Температура, при якої спостерігалася найбільша втрата ваги на термограмі знаходилася у діапазоні 280-380 °C. Ця втрата ваги свідчить про руйнування мембрани та корелює на графіку з температурою, при якої зразок має бути розпиленим. Зокрема це можна спостережити з порівнянням того, що більш висока температура розпилення початкових суспензій (як зазначено у Таблиці 1, зразок SD100 розпилювали при 95 °C (T out=95 °C), зразок SD101 - при 130 °C та зразок SD102 при 150 °C) призводить до більш низької температури відносно втрати ваги (руйнування мембрани) досліджуваного зразка. З порівняльною метою на Фіг. 3 наведено термограму суспензії дріжджів Lypomyces, висушених у сушильній шафі при температурі 105 °C. При застосуванні цієї температури можна зробити висновок, що втрата ваги, тобто вимірювання гіпотетичного лізису, спричиненого виключно дією теплового сушіння, при застосуванні цих температур, які звичайно застосовують у технології сушіння з допомогою розпилювальної сушарки, є відсутньою. Тільки при застосуванні більш високих температур та більш тривалого часу обробки з величиною, яка відрізняється на кілька порядків, тобто приблизно 10 мікросекунд, тепловий лізис веде до руйнування мембран дріжджів, застосованих у цьому прикладі розпилення. Термограми на Фіг. 2 також демонструють, що залишковий вологовміст отриманих з застосуванням розпилення зразків був меншим, ніж 5 % (тобто втрата ваги при температурі 105 °C, була меншою, ніж 5 %) та наявність помірного показника зольності, який був меншим, ніж 4 % (залишкова вага при температурі 600 °C). Показником початку значного явища руйнування була втрата ваги, яку спостерігали при температурі приблизно 220 °C. Втрата ваги у температурному діапазоні 280 °C-380 °C починалася при менших температурах зі збільшенням температури розпилення зразка, що вказує на велику можливість вивільнення ендоклітинних субстанцій до зовнішнього середовища. Інші втрати ваги, які спостерігали зокрема при температурах приблизно у 250 °C, 420 °C та 500 °C, навпаки, при обробці зразка розпиленням схоже не вплинули на інші клітинні компоненти, як-то наприклад, вуглеводи. На Фіг. 4 наведено криву інфрачервоного спектру екстракту SOX107 (при 150 °C) (знову з посиланням на зразки, зазначені у Таблицях 1 та 2) та для безпосереднього порівняння також надано інфрачервоний спектр еталонного тригліцериду, тобто з тріолеїном (Фіг. 4a). З цього порівняння можна зробити висновок, що отримані з допомогою способу винаходу спектри є -1 спектрами тригліцеридів з характерною для карбонілу смужкою при 1750 cм . Також відмічено -1 присутність вільних жирних кислот (смуга при 1705 cм ), отриманих внаслідок гідролізу ліпідів (тригліцеридів). Приклад 2. 9 UA 115566 C2 5 10 Нижче наведено схему виробничого комплексу для застосування способу винаходу з екстракцією ліпідів, які знаходяться у складі дріжджів родини Rhodotorula. У цьому прикладі речовину, яка підлягає лізису та знаходиться у суспензії у ферментованій воді оброблюють для лізису разом з n-гексаном у якості розчинника, необхідного для екстракції ліпідів з твердої фракції. На Фіг. 5 наведено схему виробничого комплексу з застосуванням розчину з замкнутим циклом, в якому розпилення здійснюють з допомогою звичайної промислової розпилювальної сушарки, в якій характеристики операцій знаходяться у відповідності з даними, переліченими у Прикладі 1 та змінюються стосовно температурних умов та застосованого розчинника у залежності від призначеного для лізису продукту. У відповідному каталозі можна знайти широкий вибір розпилювальних камер та систем закачування відповідно до певної технології сушіння розпилюванням. У Таблиці 3 нижче надані ключові позначки символів, наведених у схемі виробничого комплексу на Фіг. 5: 15 Таблиця 3: E-100 E-101 q100 VLV-100 MIX-101 V-100 E-102 C-500-2 X-100 MIX-102 P-100 RCY-2 20 25 30 35 40 45 Кожухотрубні теплообмінники Енергія для опалення з допомогою рідини з зовнішнім підведенням Клапан для пошарового нанесення Розпилювач або розпилювач Розпилювальна камера Теплообмінник з пристінною парою камери V-100 Колонка для відокремлення води та розчинника Сепаратор для відокремлення олійної та твердої фракцій Процес заповнення розчинника Помпа для відсмоктування розчинника Рециклінг Складовою частиною наведеної на Фіг. 5 схеми є помпа P-100, яка постачає розчинник для екстракції внутрішньоклітинного продукту, який знаходиться під тиском та має прийнятну кількість для здійснення теплообміну та операції лізису у розпилювальній камері. У цьому процесі застосовано певне значення температури, необхідної для руйнування клітин мікроорганізмів та необхідним є досягнення часу перебування розпиленої суспензії у діапазоні 5-300 сек., переважно приблизно 10 сек. Рідина (потік "12") проходить крізь обмінник без зміни фази та потім надходить до нерухомого сітчастого змішувача, в якому вона зустрічає и несе призначену для лізису суспензію або суспензійний розчин (потік "1") до розпилювальної сушарки (розпилювача). Турбулентний радіальний змішуючий механізм у мішалці зменшує радіальні компоненти швидкостей та розміри призначених для змішування монофазних агрегатів, збільшує поверхню контакту та стимулює теплообмін та обмін концентрації хімічних речовин з покращенням перемішування. Довжина розпилювачів обов'язково залежить від потрібного часу контакту. Для процесів масообміну, в яких швидко досягають стану рівноваги, як правило, достатньою буде довжина, яка дорівнює 5 діаметрам. У цій галузі існує велика кількість пневматичних розпилювачів різних типів для застосувань відповідно до характеристик концентрації та/або в'язкості матеріалу завантаження. Нижче можна зазначити, наприклад, наступні з них: - Концентричні трубчасті розпилювачі - Розпилювачі поперечного потоку - DIN (розпилювач прямого впорскування) - Розпилювачі з перфорованим диском - Розпилювачі Бабінгтона (версії з V-подібним пазом та конусного розпилення) - Розпилювачі "паралельного потоку". Розпилення продуктів у промислових системах здійснюють з допомогою різних розпилювальних сушарок з контрольованими температурними умовами та умовами повітряного потоку, який може обертатися для підвищення гомогенізації вмісту камери V-100. Введений у мішалку потрібний для умов експлуатації рідкий або зріджений газ виходить з сопла та розпилюється з допомогою дифузора у вигляді аерозолю. Для контролю над температурою у розпилювальній камері V-100 у даному прикладі суспензію розділяють на 10 UA 115566 C2 5 10 15 20 25 розпилені краплі, які контактують з водяною парою та розповсюджуються. Температуру у цій камері підтримують вище порога лізису з допомогою потоку додаткової та пристінної пари. Випаровування частини або всього рідкого розчинника та води, яке супроводжує призначений для лізису продукт вивільнює клітини у суспензію олійних сполук з високою температурою кипіння (як вже було зазначено, у нормальних умовах ліпіди мають точку кипіння, яка перевищує 300 °C). Пара залишає камеру V-100 з контрольованими умовами температури та потоку. Суспензію твердих залишків та ліпідів постійно вилучають з допомогою сили тяжіння та тиску з розпилювальної камери та потім її можна спрямувати для відокремлення клітинних залишків (цей потік позначено на схемі Фіг 5, як "4"). Потік "2" є потоком водяної пари, призначеним для контролю температури розпилювальної камери. Після охолодження до температури нижче 100 °C пара надходить до колонки відновлення розчинника C-100, який потім відновлюється та разом з додатковим потоком прямує до помпи P-100. Відокремлена вода (потік "6" та "7") перед усуненням надходить до водоочисної станції. Таблиця 4 (Фіг. 6) присвячена матеріалу та енергетичному балансу у прикладі з дріжджами Rhodotorula, обробленими ферментацією цукру. Ця схема розроблена для концентрації призначених для лізису твердих частин на 30 % за вагою у непрозорому розчині, якій підлягає обробці. Умови специфікації для операції лізису зазначені у Таблиці 4. У зв'язку з цим, на один кілограм призначеного до лізису непрозорого розчину буде потрібно 52 кг пари при тиску у 30 бар та 21 кг охолоджуючої води. Інші обмінні процеси компенсуються внутрішнім чином. Операцію екстракції далі здійснюють на трикантері з застосуванням гексану. Якщо отриманий після фільтрації матеріал завантаження є непрозорим розчином з часткою мікроорганізмів, яка становить 70 % за вагою, то типові потреби споживання зменшаться до дуже зручних 0,37 кг пари та 4,25 кг колоночної води на кілограм непрозорого призначеного до лізису розчину. ФОРМУЛА ВИНАХОДУ 30 35 40 45 50 55 60 1. Спосіб відновлення внутрішньоклітинних компонентів із суспензії мікроорганізмів, який полягає у: спільному завантаженні принаймні двох потоків у розпилювач, в якому перший потік містить призначену для лізису водну суспензію клітинних мікроорганізмів, та другий потік містить рідкий або газоподібний розчинник; розпиленні суспензії у розпилювальній камері з підтриманням температури 120-180 °C таким чином, щоб отримати лізис клітинних стінок мікроорганізмів з утворенням суспензії, яка містить внутрішньоклітинні компоненти та клітинні залишки, які походять від лізису, та парової фази, під час якої застосовано органічний розчинник; відокремленні внутрішньоклітинних компонентів від клітинних залишків, які походять від лізису. 2. Спосіб за п. 1, в якому розчинник є органічним розчинником, переважно полярним органічним розчинником. 3. Спосіб за п. 2, в якому полярний органічний розчинник є переважно вибрано зі спиртів, естерів, кетонів або їх сумішей, та навіть більш переважно є метанолом, етанолом, ізопропанолом та/або етилацетатом. 4. Спосіб за п. 1, в якому розчинник є органічним розчинником, переважно неполярним органічним розчинником. 5. Спосіб за п. 4, в якому неполярний органічний розчинник є вибраним з алканів, зокрема та переважно з гексану та/або ізооктану, фракцій переробки, які відрізняються кривою кипіння у нормальних умовах з 50-180 °C, переважно 100 °C, сумішей різних органічних речовин переробки, переважно петролейного етеру, продуктів бензинової фракції та/або алкілованих бензинів або їх сумішей. 6. Спосіб за п. 1, в якому розпилення суспензії культивованих мікроорганізмів відбувається у розпилювальній камері, яка містить інертний газ, переважним чином водну пару, вуглекислий газ або розчинник, призначений для розпилення, у газоподібній фазі. 7. Спосіб за п. 1, в якому температура розпилювальної камери коливається 120-160 °C, переважно 130-150 °C. 8. Спосіб за п. 1, в якому мікроорганізми є дріжджами, водоростями, бактеріями та/або мілдью. 9. Спосіб за п. 8, в якому культивовані мікроорганізми є дріжджами, переважно дріжджами, вибраними з: Lypomices, Rhodotorula та Cryptococcus. 11 UA 115566 C2 5 10 10. Спосіб за п. 1, в якому внутрішньоклітинні компоненти є внутрішньоклітинними ліпідами, отриманими шляхом культивування мікроорганізмів після цукрового бродіння. 11. Спосіб за п. 1, в якому відокремлення внутрішньоклітинних компонентів від клітинних залишків, що походять від лізису, здійснюють гравіметрично або центрифугуванням. 12. Спосіб за п. 1, в якому суспензію, що містить внутрішньоклітинні компоненти та клітинні залишки, що походять від лізису, піддають принаймні одній додатковій операції лізису рециклінгом тієї ж суспензії. 13. Спосіб за п. 12, в якому рециклінг суспензії, що містить внутрішньоклітинні компоненти та клітинні залишки, які походять від лізису, здійснюють разом з призначеною для лізису початковою суспензією перед розпилювальною камерою. 14. Спосіб за п. 12, в якому рециклінг суспензії, що містить внутрішньоклітинні компоненти та клітинні залишки, що походять від лізису, здійснюють на шляху до секції лізису після розпилювальної камери. 12 UA 115566 C2 13 UA 115566 C2 14 UA 115566 C2 15 UA 115566 C2 16 UA 115566 C2 Комп’ютерна верстка Г. Паяльніков Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 17
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for recovering intracellular components from fermented microorganisms
Автори англійськоюMiglio, Roberta, Montini, Alfredo
Назва патенту російською11122013
Автори російськоюМильйо Роберта, Монтини Альфрэдо
МПК / Мітки
Мітки: внутрішньоклітинних, компонентів, мікроорганізмів, відновлення, ферментованих, спосіб
Код посилання
<a href="https://ua.patents.su/19-115566-sposib-vidnovlennya-vnutrishnoklitinnikh-komponentiv-z-fermentovanikh-mikroorganizmiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб відновлення внутрішньоклітинних компонентів з ферментованих мікроорганізмів</a>
Попередній патент: Сигналізація довгострокових еталонних зображень при кодуванні відео
Наступний патент: Спосіб дифузійно-конденсаційного отримання конденсату води із атмосферного повітря та дифузійно-конденсаційний пристрій
Випадковий патент: Спосіб очистки стічних вод