Комбінована терапія топіраматом та триптаном мігрені або нудоти, фотофобії і фонофобії, пов’язаних з мігренозним головним болем
Формула / Реферат
1. Застосування сполуки формули (І):
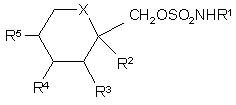 ,
,
де
Х означає СН2 чи оксиген;
R1 означає гідроген чи алкіл; і
R2, R3, R4 та R5 незалежно означають гідроген чи нижчий алкіл і, якщо Х означає СН2, то R4 та R5 можуть бути алкеновими групами, з'єднаними з утворенням бензольного кільця і, якщо Х означає оксиген, то R2 та R3 та/або R4 та R5 разом можуть бути метилендіоксигрупою такої формули (ІІ):
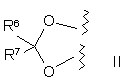 ,
,
де
R6 та R7 є однаковими чи різними і означають гідроген, нижчий алкіл або означають алкіл і є з'єднаними з утворенням циклопентильного чи циклогексильного кільця для виробництва ліків для лікування мігрені у пацієнта, який потребує такого лікування, де ліки містять терапевтично ефективну кількість триптану або ліки вводять у комбінації з терапевтично ефективною кількістю триптану.
2. Застосування за п. 1, яке відрізняється тим, що сполука формули (І) є топіраматом.
3. Застосування за п. 2, яке відрізняється тим, що кількість топірамату становить від приблизно 10 до приблизно 650 мг за добу.
4. Застосування за п. 3, яке відрізняється тим, що кількість топірамату становить від 25 до 325 мг один раз або двічі на добу.
5. Застосування за п. 1, яке відрізняєтьсятим, що триптан вибирають з суматриптану, наратриптану, ризатриптану, золмітриптану, елетриптану, фроватриптану та алмотриптану.
6. Застосування сполуки формули (І):
 ,
,
де
Х означає СН2 чи оксиген;
R1 означає гідроген чи алкіл; і
R2, R3, R4 та R5 незалежно означають гідроген чи нижчий алкіл і, якщо Х означає СН2, то R4 та R5 можуть бути алкеновими групами, з'єднаними з утворенням бензольного кільця і, якщо Х означає оксиген, то R2 та R3 та/або R4 та R5 разом можуть бути метилендіоксигрупою такої формули (ІІ):
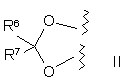 ,
,
де
R6 та R7 є однаковими чи різними і означають гідроген, нижчий алкіл або означають алкіл і є з'єднаними з утворенням циклопентильного чи циклогексильного кільця для виробництва ліків для лікування нудоти, фотофобії або фонофобії, асоційованих з мігренозним головним болем, у пацієнта, який потребує такого лікування, де ліки містять терапевтично ефективну кількість триптану або ліки вводять у комбінації з терапевтично ефективною кількістю триптану.
7. Застосування за п. 6, яке відрізняється тим, що сполука формули (І) є топіраматом.
8. Застосування за п. 7, яке відрізняється тим, що кількість топірамату становить від приблизно 10 до приблизно 650 мг за добу.
9. Застосування за п. 8, яке відрізняється тим, що кількість топірамату становить від 25 до 325 мг один раз або двічі на добу.
10. Застосування за п. 6, яке відрізняється тим, що триптан вибирають з суматриптану, наратриптану, ризатриптану, золмітриптану, елетриптану, фроватриптану та алмотриптану.
11. Застосування сполуки формули (І):
 ,
,
де
Х означає СН2 чи оксиген;
R1 означає гідроген чи алкіл; і
R2, R3, R4 та R5 незалежно означають гідроген чи нижчий алкіл і, якщо Х означає СН2, то R4 та R5 можуть бути алкеновими групами, з'єднаними з утворенням бензольного кільця і, якщо Х означає оксиген, то R2 та R3 та/або R4 та R5 разом можуть бути метилендіоксигрупою такої формули (ІІ):
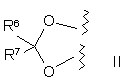 ,
,
де
R6 та R7 є однаковими чи різними і означають гідроген, нижчий алкіл або означають алкіл і є з'єднаними з утворенням циклопентильного чи циклогексильного кільця для виробництва ліків для запобігання мігрені у пацієнта, який потребує такого лікування, де ліки містять терапевтично ефективну кількість триптану або ліки вводять у комбінації з терапевтично ефективною кількістю триптану.
12. Застосування за п. 11, яке відрізняється тим, що сполука формули (І) є топіраматом.
13. Застосування за п. 12, яке відрізняється тим, що кількість топірамату становить від приблизно 10 до приблизно 650 мг за добу.
14. Застосування за п.13, яке відрізняється тим, що кількість топірамату становить від 25 до 325 мг один раз або двічі на добу.
15. Застосування за п. 11, яке відрізняється тим, що триптан вибирають з суматриптану, наратриптану, ризатриптану, золмітриптану, елетриптану, фроватриптану та алмотриптану.
Текст
1. Застосування сполуки формули (І): X CH OSO NHR1 2 2 2 O R7 O R6 II O R7 , де R6 та R7 є однаковими чи різними і означають гідроген, нижчий алкіл або означають алкіл і є з'єднаними з утворенням циклопентильного чи циклогексильного кільця для виробництва ліків для лікування мігрені у пацієнта, який потребує такого лікування, де ліки містять терапевтично ефективну кількість триптану або ліки вводять у комбінації з терапевтично ефективною кількістю триптану. O C2 , де Х означає СН2 чи оксиген; R1 означає гідроген чи алкіл; і R2, R3, R4 та R5 незалежно означають гідроген чи нижчий алкіл і, якщо Х означає СН2, то R4 та R5 можуть бути алкеновими групами, з'єднаними з утворенням бензольного кільця і, якщо Х означає оксиген, то R2 та R3 та/або R4 та R5 разом можуть бути метилендіоксигрупою такої формули (ІІ): (13) де Х означає СН2 чи оксиген; R1 означає гідроген чи алкіл; і R2, R3, R4 та R5 незалежно означають гідроген чи нижчий алкіл і, якщо Х означає СН2, то R4 та R5 можуть бути алкеновими групами, з'єднаними з утворенням бензольного кільця і, якщо Х означає оксиген, то R2 та R3 та/або R4 та R5 разом можуть бути метилендіоксигрупою такої формули (ІІ): R3 81110 , (11) R3 R2 R4 II , де R6 та R7 є однаковими чи різними і означають гідроген, нижчий алкіл або означають алкіл і є з'єднаними з утворенням циклопентильного чи циклогексильного кільця для виробництва ліків для лікування нудоти, фотофобії або фонофобії, асоційованих з мігренозним головним болем, у пацієнта, який потребує такого лікування, де ліки містять терапевтично ефективну кількість триптану або ліки вводять у комбінації з терапевтично ефективною кількістю триптану. UA R2 R4 R6 2 R5 (19) R5 2. Застосування за п. 1, яке відрізняється тим, що сполука формули (І) є топіраматом. 3. Застосування за п. 2, яке відрізняється тим, що кількість топірамату становить від приблизно 10 до приблизно 650 мг за добу. 4. Застосування за п. 3, яке відрізняється тим, що кількість топірамату становить від 25 до 325 мг один раз або двічі на добу. 5. Застосування за п. 1, яке відрізняється тим, що триптан вибирають з суматриптану, наратриптану, ризатриптану, золмітриптану, елетриптану, фроватриптану та алмотриптану. 6. Застосування сполуки формули (І): X CH OSO NHR1 3 81110 7. Застосування за п. 6, яке відрізняється тим, що сполука формули (І) є топіраматом. 8. Застосування за п. 7, яке відрізняється тим, що кількість топірамату становить від приблизно 10 до приблизно 650 мг за добу. 9. Застосування за п. 8, яке відрізняється тим, що кількість топірамату становить від 25 до 325 мг один раз або двічі на добу. 10. Застосування за п. 6, яке відрізняється тим, що триптан вибирають з суматриптану, наратриптану, ризатриптану, золмітриптану, елетриптану, фроватриптану та алмотриптану. 11. Застосування сполуки формули (І): X CH OSO NHR1 2 2 R5 R2 R4 R3 , де Х означає СН2 чи оксиген; R1 означає гідроген чи алкіл; і R2, R3, R4 та R5 незалежно означають гідроген чи нижчий алкіл і, якщо Х означає СН2, то R4 та R5 можуть бути алкеновими групами, з'єднаними з утворенням бензольного кільця і, якщо Х означає оксиген, то R2 та R3 та/або R4 та R5 разом можуть бути метилендіоксигрупою такої формули (ІІ): Ця заявка заявлена с пріоритетом тимчасової [заявки США №60/359894, поданої 26 лютого 2002p.], яку цілком включено сюди за посиланням. Мігрень є хронічним, епізодичним та виснажуючим клінічним станом, який діагностують за присутністю пульсуючих однобічних головних болей, від помірних до тяжких, що тривають від 4 до 72год. Крім того, головний біль інколи асоційований з тимчасовими сенсорними (фотофобія та фонофобія) та/або шлунковокишковими (нудота, блювота) розладами. Мігренозні головні болі можуть бути з аурою чи без неї. Мігрень без аури визначається як щонайменше п'ять нападів, що задовольняють таким критеріям: (а) напади головного болю, що тривають 4-72 години, причому головний біль має щонайменше дві з таких ознак: однобічне розташування, пульсуючий характер, інтенсивність від помірної до тяжкої з безпосереднім впливом на повсякденну діяльність, погіршується при підніманні сходами чи аналогічних вправах; (b) під час головного болю виникає щонайменше одне з такого: нудота та/або блювота, фотофобія чи фонофобія [Classification and diagnostic criteria for headache disorders, cranial neuralgias and facial pain. Headache Classification Committee of the International Headache Society. Cephalalgia 1988; 8 Suppl. 7: 1-96]. Мігрень з аурою визначається за щонайменше двома нападами, які супроводжуються щонайменше 3 з таких 4 ознак: (а) один чи кілька повністю оборотних симптомів аури; (b) 4 R6 O R7 O II , де R6 та R7 є однаковими чи різними і означають гідроген, нижчий алкіл або означають алкіл і є з'єднаними з утворенням циклопентильного чи циклогексильного кільця для виробництва ліків для запобігання мігрені у пацієнта, який потребує такого лікування, де ліки містять терапевтично ефективну кількість триптану або ліки вводять у комбінації з терапевтично ефективною кількістю триптану. 12. Застосування за п. 11, яке відрізняється тим, що сполука формули (І) є топіраматом. 13. Застосування за п. 12, яке відрізняється тим, що кількість топірамату становить від приблизно 10 до приблизно 650 мг за добу. 14. Застосування за п.13, яке відрізняється тим, що кількість топірамату становить від 25 до 325 мг один раз або двічі на добу. 15. Застосування за п. 11, яке відрізняється тим, що триптан вибирають з суматриптану, наратриптану, ризатриптану, золмітриптану, елетриптану, фроватриптану та алмотриптану. щонайменше один симптом аури, який розвивається поступово протягом більш ніж чотирьох хвилин або два чи більше симптомів, які виникають послідовно; (с) відсутність симптомів аури, що тривають більш ніж 60 хвилин; (d) головний біль починається перед, одночасно з, чи після аури, причому вільний інтервал між аурою та головним болем складає менш ніж приблизно 60 хвилин (Classification and diagnostic criteria for headache disorders, cranial neuralgias and facial pain. Heanlache Classification Committee of the International Headache Society. Cephalalgia 1988: 8 Suppl. 7: 1-96]. Клінічні профілі пацієнтів з мігренозними головними болями представлені мігренню без аури (приблизно 70% хворих) та мігренню з аурою (приблизно 30%). Мігрень без аури відома також як звичайна мігрень і типово має середню тривалість приблизно 18-24 години. Біль є звичайно однобічним, але може чергуватися чи бути двобічним під час нападу. Мігрень з аурою може бути асоційована з візуальними розладами, а аура звичайно розвивається поступово протягом 5-20хв. і звичайно триває менш ніж 60 хвилин. Мігрень з аурою може бути послідовно асоційована з нападами без аури. Найбільш звичайною формою мігрені з аурою є мігрень з типовою аурою, відома також як класична мігрень. Головний біль розпочинається протягом 60 хвилин після закінчення аури. Існують інші, менш звичайні типи мігренозного головного болю, що включають, без обмеження, мігрень з пролонгованою аурою, яка асоційована із симптомами аури, що тривають 5 більш ніж 60 хвилин; мігренозну ауру без головного болю; мігрень з раптовим виникненням аури; базилярну мігрень, яка може бути асоційована із запамороченням, розладами ходи та/або втратою свідомості; офтальмофлегічну мігрень, асоційовану з паралічем очних м'язів, диплопією та птозом; ретинальну мігрень; та спадкову геміплегічну мігрень, асоційовану з геміпарезом чи геміплегією (Migraine. Cognos. Decision Resources, 2000). Фармакологічне втручання для терапевтичного лікування мігрені може бути розділене на дві загальні стратегії: профілактичні заходи і лікування з метою полегшення болю та асоційованої симптоматики або абортивна терапія. Метою попереджувальної (профілактичної) терапії є зниження частоти нападів мігрені, зменшення тяжкості та/або скорочення тривалості нападів. Профілактичне лікування мігрені включає антиконвульсанти, антидепресанти, бетаблокатори, блокатори кальцієвих каналів, нестероїдні протизапальні лікарські засоби (NSAIDs) та антагоністи серотонінового рецептора. Багато з цих агентів використовуються для профілактики мігрені без офіційно затверджених рекомендацій (Міgraine. Соgnos. Decision Resources. 2000). На основі клінічних випробувань було показано, що певні агенти з класів антидепресантів та бета-блокаторів мають найвищу ефективність та найкращий профіль небажаних побічних ефектів. Антиконвульсанти, використовувані у профілактиці мігрені, включають, без обмеження, топірамат (ТОРАМАХ виробництва фірми OrthoMcNeil), валпроєву кислоту (DEPAKENE виробництва фірми Abbott), дівалпроекс-натрій (DEPAKOTE виробництва фірми Abbott) та габапентин (NEURONTIN виробництва фірми Warner-Lambert). Антидепресанти, використовувані у профілактиці мігрені, включають, без обмеження, трициклічні антидепресанти, такі як амітриптилін (ETRAFON виробництва фірми Schering, LIMBITROL виробництва фірми ICN, TRYPTANOL виробництва фірми Banyu, SAROTEN виробництва фірми Bayer, LAROXYL виробництва фірми Roche, ELAVIL виробництва фірми Astra Zeneca та інші лікарські засоби цього типу), нортриптилін (PAMELOR виробництва фірми Novartis та інші лікарські засоби цього типу), кломіпрамін (ANAFRANIL виробництва фірми Novartis та інші лікарські засоби цього типу), іміпрамін (TOFRANIL виробництва фірми Novartis та інші лікарські засоби цього типу), доксепін (SINEQUAN виробництва фірми Pfizer та інші лікарські засоби цього типу); інгібітори моноаміноксидази, такі як фенелзин (NARDIL виробництва фірми ParkeDavis); селективні інгібітори повторного поглинання серотоніну, такі як флуоксетин (PROZAC, SARAFEM виробництва фірми Eli Lilly та інші лікарські засоби цього типу), флувоксамін (LUVOX виробництва фірми Solvay), циталопрам (CIPRAMIL виробництва фірми Lundbeck та 81110 6 CELEXA виробництва фірми Forest); і селективні інгібітори повторного поглинання серотонінунорадреналіну, такі як венлафаксин (EFFEXOR XR виробництва фірми Wyeth-Ayerst). Бета-блокатори, що використовуються у профілактиці мігрені, включають, без обмеження, метопролол (TOPROL-XR виробництва фірми Astra-Zeneca, LOPRESSOR виробництва фірми Novartis та інші лікарські засоби цього типу), атенолол (NENORMIN, TEMORETIC виробництва фірми Astra Zeneca in інші лікарські засоби цього типу), пропанолол (INDERAL виробництва фірми Wycth-Ayerst та інші лікарські засоби цьоіо типу), тімолол (BLOCADREN виробництва Merck, Sharp and Dohme, TIMOLOL виробництва фірми Falcon та інші лікарські засоби цього типу) і надолол (CORGARD/SOLGOL виробництва Bristol-Myers Squibb's Monarch, NADlC виробництва фірми Dainippon та інші лікарські засоби цього типу). Блокатори кальцієвих каналів, використовувані у профілактиці мігрені, включають, без обмеження, верапаміл (ISOPTIN виробництва фірми Knoll, Verelan виробництва фірми Schwarz, Covera та CALAN виробництва фірми Searle та інші лікарські засоби цього типу), ломеризин (TERRANAS виробництва фірми Nippon Organon), флунаризин (SIBELIUM виробництва фірми Janssen Pharmaceutica), ділтіазем (CARDIZEM виробництва фірми Biovail та інші лікарські засоби цього типу), німодипін (Bayer, NIMOTOP та ESTEVE), нукапсаїцин (Civamide виробництва фірми Winston Laboratories) та дотаризин (виробництва фірми Mylan/Ferrer). Нестероїдні протизапальні лікарські засоби, використовувані у профілактиці мігрені, включають, без обмеження, напроксен (Naprosyn виробництва фірми Roche Laboratories та інші лікарські засоби цього типу) і кетопрофен (ORUDIS та ORUVAIL виробництва фірми Wyeth-Ayerst та інші лікарські засоби цього типу). Антагоністи серотонінового рецептора, використовувані у профілактиці мігрені, включають, без обмеження, пізотифен (SANOMIGRAN/PIZOTYLINE виробництва фірми Novartiss), метисергід (SANSERT/DESERIL виробництва фірми Novartis та інші лікарські засоби цього типу) та ципрогептадин (PERIACTIN виробництва фірми Merck). Абортивні методи лікування мігренозного головного болю (полегшення болю та/або асоційованої симптоматики нападів мігрені) включають використання анальгетиків та їхніх комбінацій, протиблювотних засобів, похідних алкалоїдів ріжків, нестероїдних протизапальних лікарських засобів та триптанів. Проводилися також дослідження нейропептидних антагоністів (Migraine. Cognos. Decision Resources, 2000). Анальгетики та їхні комбінації (включаючи комбінації з іншими лікарськими засобами, такими як протиблювотні засоби) для абортивного лікування мігрені включають, без обмеження, аспірин, ацетамінофен, парацетомол, меперидин, кодеїн, гідрокодон, FIORICET виробництва фірми Novartis чи ESGIC виробництва фірми Forests або 7 інші лікарські засоби цього типу (комбінація ацетамінофену та буталбіталу і кофеїну), FIORINAL або інші лікарські засоби цього типу (комбінація аспірину, буталбіталу та кофеїну, Novartis), M1GPRIV або інші лікарські засоби цього типу (комбінація аспірину та метоклопраміду; Sanofi-Synthelabo), M1DRIN/MIDRID або інші лікарські засоби цього типу (комбінація ацетамінофену та дихлоралфеназону; Carnick), PARAMAX виробництва фірми Sanofi-Synthelabo чи MIGRAENERTON виробництва фірми Dolorgiet або інші лікарські засоби цього типу (комбінація парацетомолу та метоклопраміду), VICODIN виробництва фірми Abbott або інші лікарські засоби цього типу (комбінація ацетамінофену та гідрокодону), STADOL NS (назальний спрей буторфанолу; Bristol-Myers Squibb), LONARID виробництва фірми Boehringer Ingelheim чи MIGRALEVE виробництва фірми Pfizer або інші лікарські засоби цього типу (комбінація парацетомолу та кодеїну). Протиблювотні засоби для абортивного лікування мігрені включають, без обмеження, метоклопрамід (MAXOLON виробництва фірми SmithKline Beecham, REGLAN виробництва фірми Robin та інші лікарські засоби цього типу), домперидон (MOTILIUM виробництва фірми Janssen Pharmaceutica та інші лікарські засоби цього типу), прохлорперазин (виробництва фірдіи SmithKline Beecham COMPAZINE та інші лікарські засоби цього типу) та прометазин (PHENERGAN/MEPERGAN виробництва фірми Wyeth-Ayerst та інші лікарські засоби цього типу). Похідні алкалоїдів ріжків для абортивного лікування мігрені включають, без обмеження, дигідроерготамін (Novartis DHE-45, назальний спрей MIGRANAL), ерготамін (ERGOMAR виробництва фірми Lotus Biochemical та інші лікарські засоби цього типу) і комбінацію ерготаміну з кофеїном (CAFERGOT виробництва фірми Novartis, WIGRAINE виробництва фірми Organon та інші лікарські засоби цього типу). Нестероїдні протизапальні лікарські засоби для абортивного лікування мігрені включають, без обмеження, аспірин, ібупрофен, диклофенак (VOLTAREN виробництва фірми Novartis та інші лікарські засоби цього типу), напроксен (NAPROSYN виробництва фірми Roche та інші лікарські засоби цього типу) і кетопрофен (ORUDIS та ORUVAIL виробництва фірми Wyeth-Ayerst та інші лікарські засоби цього типу). Триптани для абортивного лікування мігрені включають, без обмеження, суматриптан (IMITREX/IMIGRAN, Glaxo Wellcome), наратриптан (AMERGE виробництва фірми Glaxo Wellcome), ризатриптан (MAXALT виробництва фірми Merck), золмітриптан (ZOMIG виробництва фірми Astra Zeneca), елетриптан (RELPAX виробництва фірми Pfizer), фроватриптан (MIGUARD виробництва фірми Vernalis/Elan/Menarini) та алмотриптан (AXERT виробництва фірми Pharmacia). Нейропептидні антагоністи, що можуть бути корисними як у . профілактичній, так і у абортивній терапії мігрені, включають, без обмеження, такі агенти: антагоніст пептиду, спорідненого з геном 81110 8 кальцитоніну (BIBN 4096 виробництва фірми Boehringer lngelheim) та антагоністи речовини Р, такі як дапітант (ERISPANT виробництва фірми Aventis), ланепітант (LY-303870 виробництва фірми Lilly) та FK-888 виробництва фірми Fujisawa. Лікарські засоби для профілактичного лікування мігрені треба приймати щодня, і багато з них асоційовані з небажаними побічними ефектами. Наприклад, застосування метисергіду несе небезпеку ретроперитонеального фіброзу. Для нестероїдних протизапальних лікарських засобів недоліком є необхідність високих доз для забезпечення ефективності. Трициклічні антидепресанти асоційовані з численними побічними ефектами, включаючи седацію, збільшення ваги тіла та антихолінергічні ефекти, включаючи сухість у роті, помутніння зору, запор, розлади пізнавальної функції та затримання сечі. Інгібітори моноаміноксидази часто асоційовані з побічними ефектами, які включають ортостатичну гіпотензію, гіпертензивний криз, збільшення ваги тіла, безсоння та розлади сексуальної функції. Побічні ефекти селективних інгібіторів повторного поглинання серотоніну включають нудоту, понос, запор, порушення сну, розлади сексуальної функції та тривожний стан і ризик серотонінового синдрому. Венлафаксин може бути асоційований з небажаними серцево-судинними ефектами, седацією, антихолінергічними ефектами, шлунково-кишковими розладами та розладами сексуальної функції. Побічні ефекти валпроєвої кислоти включають сонливість, нудоту, втому, тремтіння та збільшення ваги тіла. У багатьох випадках саме побічні ефекти є причиною недотримання схеми та припинення лікування. Крім того, за даними оцінки, імовірність успіху для будь-якого одного з існуючих профілактичних протимігренозних лікарських засобів становить приблизно 60-70% [Harrison's Principles of Internal Medicine, eds. lsselbacher et al., McGraw-Hill, Inc., New York, 1994, p.69]. Сполуки формули (І): (I) є структурно новими протиепілептичними сполуками, які виявилися високоефективними антиконвульсантами у випробуваннях на тваринах [MARYANOFF, В.Е, NORTEY, S.O., GARDOCKI, J.F., SHANK, R.P. AND DODGSON, S.P. J. Med Chem. 1987, 30, 880-887; MARYANOFF, B.E., COSTANZO, M.J., SHANK, R.P., SCHUPSKY, J.J, ORTEGON, M.E., AND VAUGHT J.L. Bioorg. Med Chem. Lett. 1993, 3, 2653-2656; SHANK, R.P., GARDOCKI, J.F., VAUGHT, J.L., DAVIS, СВ., SCHUPSKY, J.J., RAFFA, R.B., DODGSON, S.J., NORTEY, S.O., MARYANOFF, B.E. Epilepsia 1994, 35, 450-460; MARYANOFF B.E, COSTANZO .M.J, NORTEY S.O., GRECO M.N., SHANK R.P., SCHUPSKY J.J., ORTEGON M.P., VAUGHT J.L. J. Med. Chem. 1998, 41, 1315-1343]. Ці сполуки захищені трьома [патентами США: №4513006, №5242942 та №5384327]. Одна з цих сполук 9 81110 сульфамат 2,3:4,5-біс-О-(1-метилетиліден)-β-Dфруктопіранози, відомий як топірамат, виявилася ефективним засобом допоміжної терапії чи монотерапії при лікуванні простих та психомоторних парціальних нападів та вторинних генералізованих нападів за результатами клінічних випробувань при людській епілепсії [Е. FAUGHT, B.J. WILDER, R.E. RAMSEY, R.A. REIFE, L.D. KRAMER, G.W. PLEDGER, R.M. KARIM et. al., Epilepsia 1995, 36 (S4), 33; S.K. SACHDEO, R.C. SACHDEO, R.A. REIFE, P. LIM and G. PLEDGER, Epilepsia 1995, 36 (S4), 33; Τ.A. GLAUSER, Epilepsia 1999, 40 (S5), S71-80; R.C. SACHDEO, Clin. Pharmacokinel. 1998, 34, 335-346], і зараз с в продажу для лікування епілептичних нападів у пацієнтів з простою та психомоторною епілепсією та епілептичних нападів у пацієнтів з первинною чи вторинною генералізованою епілепсією у США, Європі та на більшості інших ринків світу. Спочатку було знайдено, що сполуки формули (І) виявляють антиконвульсивну активність у традиційному тесті на максимальні електрошокові судоми (MES) на мишах [SHANK, R.P., GARDOCKI, J.F., VAUGHT, J.L, DAVIS, СВ., SCHUPSKY, J.J., RAFFA, R.B., DODGSON, S.J., NORTEY, S.O., and MARYANOFF, B.E., Epilepsia 1994, 35, 450-460]. Подальші дослідження показали, що сполуки формули (І) мають також високу ефективність у випробуваннях методом MES на пацюках. Було також знайдено, що топірамат ефективно блокує напади у кількох моделях епілепсії на гризунах [J. NAKAMURA, S. TAMURA, Т. KANDA, A. ISHII, K. ISHIHARA, Т. SERIKAWA, J. YAMADA, and Μ. SASA, Eur. J. Pharmacol. 1994, 254, 83-89], та у тваринній моделі рефлекторної епілепсії [А. WAUQUIER and S. ZHOU, Epilepsia Res. 1996, 24, 73-77]. [Ehrenberg et al., у патенті США №5999380] розкривають використання сполуки формули (І) для лікування мігреней у неепілептичних пацієнтів. Конкретніше, Ehrenberg et al. розкривають використання сполуки формули (І) для зниження частоти чи тяжкості мігренозних епізодів у неепілептичних пацієнтів. Було несподівано знайдено, що комбінована терапія з використанням одного чи кількох похідних антиконвульсанта, сполук формули (І) та одного чи кількох лікарських засобів, використовуваних для профілактики та/або лікування мігрені, є придатною для лікування та/або профілактики мігрені. Даний винахід стосується лікування та/або профілактики мігрені шляхом комбінованої терапії, що включає введення терапевтично ефективної кількості одного чи кількох протимігренозних агентів та однієї чи кількох сполук формули (І) (I) дe X позначає СН2 чи оксиген; R1 позначає гідроген чи алкіл; і R2, R3, R4 та R5 незалежно позначають гідроген чи нижчий алкіл і, якщо X позначає 10 СН2, R4 та R5 можуть бути алкеновими групами, з'єднаними з утворенням бензольного кільця і, якщо X позначає оксиген, R2 та R3 та/або R4 та R5 разом можуть бути метилендіоксигрупою такої формули (II): (ІI) де R6 та R7 є однаковими чи різними і позначають гідроген, нижчий алкіл або позначають алкіл і з'єднані з утворенням циклопентильного чи циклогексильного кільця. Даний винахід далі стосується методу лікування нудоти, блювоти, фотофобії та/або фонофобії, краще, нудоти, фотофобії та/або фонофобії, асоційованих з мігренозними головними болями у особи, що потребує цього, який включає комбіновану терапію з використанням терапевтично ефективної кількості сполуки формули (І) та протимігренозного агента. Краще, сполука формули (І) є топіраматом, а протимігренозний агент є абортивним агентом. Ще краще, сполука формули (І) є топіраматом, а протимігренозний агент є триптаном. У варіанті втілення даного винаходу сполука формули (І) є топіраматом. У варіанті втілення даного винаходу, протимігренозний агент є профілактичним агентом. В іншому варіанті втілення даного винаходу, протимігренозний агент є абортивним агентом. У варіанті втілення даного винаходу протимігренозний агент є триптаном. Краще триплан вибирають з групи, що складається з суматринптану (IMITREX/lMIGRAN, Glaxo Wellcome), паратриптану (AMERGE виробництва фірми Glaxo Wellcome), ризатриптану (MAXALT виробництва фірми Merck), золмітриптану (ZOMIG виробництва фірми Astra Zeneca), елетриптану (RELPAX виробництва фірми Pfizer), фроватриптану (MIGUARD виробництва фірми Vernalis/Elan/Menarini) та алмотриптану (AXERT виробництва фірми Рhаrmасіа). У варіанті втілення даний винахід є методом лікування та/або профілактики мігрені, що включає комбіновану терапію з використанням терапевтично ефективної кількості топірамату та протимігренозного агента, у якому протимігренозний агент є профілактичним агентом. В іншому варіанті втілення даний винахід є методом лікування та/або профілактики мігрені, який включає комбіновану терапію з використанням терапевтично ефективної кількості топірамату та протимігренозного агента, у якому протимігренозний агент є абортивним агентом. У варіанті втілення даний винахід є методом лікування та/або профілактики мігрені, який включає комбіновану терапію з використанням терапевтично ефективної кількості топірамату та сполуки, вибраної з групи, що складається з анальгетиків, протиблювотних засобів, похідних алкалоїдів ріжків, нестероїдних протизапальних лікарських засобів, триптанів, антагоніста нейропептиду, антиконвульсантів, 11 антидепресантів, бета-блокаторів, блокаторів кальцієвих каналів та антагоністів серотонінового рецептора. У варіанті втілення даний винахід є методом лікування мігрені, який включає комбіновану терапію з використанням терапевтично ефективної кількості топірамату та сполуки, вибраної з групи, що складається з анальгетиків, протиблювотних засобів, похідних алкалоїдів ріжків, нестероїдних протизапальних лікарських засобів, триптанів та антагоністів нейропептиду. У варіанті втілення даний винахід є методом профілактики мігрені, який включає комбіновану терапію з використанням терапевтично ефективної кількості топірамату та сполуки, вибраної з групи, що складається з антиконвульсантів, антидепресантів, бетаблокаторів, блокаторів кальцієвих каналів, нестероїдних протизапальних лікарських засобів та антагоністів серотонінового рецептора. У варіанті втілення даний винахід є методом лікування та/або профілактики мігрені, який включає комбіновану терапію з використанням терапевтично ефективної кількості топірамату та сполуки, вибраної з групи, що складається з антидепресантів, бета-блокаторів та триптанів. В тому значенні, що використовується тут, термін "мігрень" має позначати хронічний, епізодичний та виснажуючий клінічний стан, який діагностують за присутністю пульсуючих однобічних головних болів від помірних до тяжких, що тривають від 4 до 72год., які включають мігрень без аури та мігрень з аурою. В тому значенні, що використовується тут, "мігрень без аури" має позначати щонайменше п'ять нападів, що задовольняють таким критеріям: (а) напади головного болю тривають 4-72 годин, причому головний біль має щонайменше дві з таких ознак: однобічне розташування, пульсуючий характер, інтенсивність від помірної до тяжкої з безпосереднім впливом на буденну діяльність, та погіршення при підніманні сходами чи виконанні аналогічних вправ; і (b) під час головного болю виникає щонайменше одне з такого: нудота та/або блювота, і фотофобія та фонофобія. В тому значенні, що використовується тут, "мігрень з аурою" має позначати щонайменше два напади, які супроводжуються щонайменше 3 з 4 таких ознак: (а) один чи кілька повністю оборотних симптомів аури; (b) щонайменше один симптом аури, який розвивається поступово протягом більш ніж чотирьох хвилин або два чи більше симптомів, що виникають послідовно; (с) відсутність симптомів аури, що тривають більше 60 хвилин; (d) головний біль виникає перед, одночасно з, чи після аури, причому інтервал часу між аурою та головним болем становить менш ніж приблизно 60 хвилин. В тому значенні, що використовується тут, термін "профілактика" має включати профілактику нападів мігрені, зниження частоти нападів мігрені, зниження тяжкості нападів мігрені та/або зменшення тривалості нападів мігрені. В тому значенні, що використовується тут, термін "профілактичний агент" має позначити 81110 12 будь-який фармацевтичний агент, що може бути використаний для попередження чи профілактики мігрені. Придатні приклади включають, без обмеження, фармацевтичні агенти з класів антиконвульсантів, антидепресантів, бетаблокаторів, блокаторів кальцієвих каналів, нестероїдних протизапальних лікарських засобів (NSAIDs) та антагоністів серотонінового рецептора. В тому значенні, що використовується тут, термін "абортивний агент" має позначати будьякий фармацевтичний агент, що може бути використаний для лікування мігрені. Придатні приклади включають, без обмеження, фармацевтичні агенти з класів анальгетиків та їхні комбінації, протиблювотні засоби, похідні алкалоїдів ріжків, нестероїдні протизапальні лікарські засоби (NSAIDs), триптани та антагоністи нейропептидів. В тому значенні, що використовується тут, термін "суб'єкт" стосується тварини, краще, ссавця, найкраще, людини, що є об'єктом лікування, спостереження чи експерименту. Термін "терапевтично ефективна кількість" в тому .значенні, що використовується тут, означає таку кількість активної сполуки чи фармацевтичного агента, що викликає біологічну чи лікувальну відповідь у тканинній системі, тварині чи людині, бажану для дослідника, ветеринара, лікаря чи іншого клініциста, яка включає профілактику та/або полегшення симптомів хвороби чи розладу, що лікуються. У тих випадках, коли даний винахід стосується комбінованої терапії, що включає введення однієї чи кількох сполук формули (І) та одного чи кількох протимігренозних агентів, "терапевтично ефективна кількість" має позначати таку кількість комбінації агентів, узятих разом, щоб спільний ефект викликав бажану біологічну чи лікувальну відповідь. Наприклад, терапевтично ефективна кількість для комбінованої терапії, що включає введення сполуки формули (І) та протимігренозного агента, буде такою кількістю сполуки формули (І) та кількістю протимігренозного агента, щоб при їхньому введенні разом чи послідовно сумарний ефект був терапевтично ефективним. Крім того, фахівцю в цій області зрозуміло, що у випадку комбінованої терапії з використанням терапевтично ефективної кількості, як у наведеному вище прикладі, кількість сполуки формули (І) та/або кількість протимігренозного агента, узятих окремо, може бути чи не бути терапевтично ефективною. В тому значенні, що використовується тут, термін "комбінована терапія" має позначати лікування суб'єкта, що потребує цього, шляхом введення однієї чи кількох сполук формули (І) з одним чи кількома протимігренозними агентами, у якому сполука (сполуки) формули (І) та протимігренозний агент (агенти) вводяться будьякими придатними засобами, одночасно, послідовно, роздільно чи у єдиній фармацевтичній композиції. У тих випадках, коли сполука (сполуки) формули (І) та протимігренозний агент (агенти) вводяться в роздільних дозованих формах, 13 81110 кількість доз, що вводиться за день, для кожної сполуки може бути однаковою чи різною. Сполука (сполуки) формули (І) та протимігренозний агент (агенти) можуть бути введені однаковим чи різними шляхами. Приклади придатних методів введення включають, без обмеження, оральний, внутрішньовенний (iv), внутрішньом'язовий (іm), підшкірний (sc), трансдермальний та ректальний. Сполуки можуть також бути введені безпосередньо до нервової системи, включаючи, без обмеження, інтрацеребральний, інтравентрикулярний, інтрацеребровентрикулярний, інтратекальний, інтрацистернальний, інтраспінальний та/або периспінальний шляхи введення з доставкою за допомогою інтракраніальних чи інтравертебральних голок та/або катетерів з помповими пристроями чи без них. Сполука (сполуки) формули (І) та протимігренозний агент (агенти) можуть бути введені за одночасною чи поперемінною схемами, в однакові чи різні проміжки часу протягом курсу лікування, одночасно у вигляді розділених чи разових дозованих форм. Оптимальні дози та схеми введення доз можуть бути легко визначені фахівцями в цій області, і будуть змінюватися у залежності від способу введення, активності препарату та розвитку хворобливого стану. Крім того, фактори, асоційовані з конкретним пацієнтом, що одержує лікування, включаючи стать, вік, вагу пацієнта, дієту, фізичну активність, час введення та супутні хвороби, спричинюватимуть необхідність регулювання доз та/або режимів. Похідні антиконвульсанта за винаходом мають таку формулу (І): (I) де X позначає СН2 чи оксиген; R1 позначає гідроген чи алкіл; і R2, R3, R4 та R5 незалежно позначають гідроген чи нижчий алкіл і, якщо X позначає СH2, R4 та R5 можуть бути алкеновими групами, з'єднаними з утворенням бензольного кільця і, якщо X позначає оксиген, R2 та R3 та/або R4 та R5 разом можуть бути метилендіоксигрупою такої формули (II): (ІI) де R6 та R7 є однаковими чи різними і позначають гідроген, нижчий алкіл чи є алкілами, з'єднаними з утворенням циклопентильного чи циклогексильного кільця. R1, зокрема, позначає гідроген чи алкіл, що містить приблизно 1-4 атомів карбону, такий як метил, етил та ізопропіл. Алкіл в цьому описі включає лінійні та розгалужені алкільні ланцюги. Алкільні групи у визначеннях R2, R3, R4, R5, R6 та R7 містять приблизно 1-3 атоми карбону і 14 включають метил, етил, ізопропіл та н-пропіл. Якщо X позначає СН2, R4 та R5 можуть бути об'єднані з утворенням бензольного кільця, конденсованого з 6-членним Х-вмісним кільцем, тобто, R4 та R5 позначають алкатриєнільну групу = С-СН= СН-СН=. Особливою групою сполук формули (І) є та, у якій X позначає оксиген, a R2 та R3 і R4 та R5 разом позначають метилендіоксигрупи формули (II), у якій R6 та R7 обидва позначають гідроген чи алкіл або з'єднані з утворенням спіро-циклопентильного чи циклогексильного кільця, зокрема, у якій R6·та R7 обидва позначають алкіл, такий як метил. Другою групою сполук є та, у якій X позначає СН2, a R4 та R5 з'єднані з утворенням бензольного кільця. Третьою групою сполук формули (І) є та, у якій R2 та R3 обидва позначають гідроген. Сполуки формули (І) можуть бути синтезовані такими способами: (a) Реакція спирту формули RCH2OH з хлорсульфаматом формули ClSO2NH2 чи ClSO2NHR1 у присутності основи, такої як тбутоксид калію чи гідрид натрію при температурі приблизно від -20 до 25°С та у розчиннику, такому як толуол, ТГФ чи диметилформамід, де R позначає фрагмент такої формули (III): (IІI) (b) Реакція спирту формули RCH2OH з сульфурилхлоридом формули SO2Cl2 у присутності основи, такої як триетиламін чи піридин, при температурі приблизно від -40 до 25°С у розчиннику, такому як діетиловий ефір чи метиленхлорид, з утворенням хлорсульфату формули RCH2OSO2Cl. Хлорсульфат формули RCH2OSO2Cl може бути згодом введений до реакції з аміном формули R1NH2 при температурі приблизно від -40 до 25°С у розчиннику, такому як метиленхлорид чи ацетонітрил, з утворенням сполуки формули (І). Умови проведення реакції (b) описані також [Т. Tsuchiya et al. у Tetrahedron Lett., 1978, 3365]. (c) Реакція хлорсульфату RCH2OSO2Cl з азидом металу, таким як азид натрію у розчиннику, такому як метиленхлорид чи ацетонітрил, дає азидосульфат формули RCH2OSO2N3, як описано [М. Hedayatullah у Tetrahedron Lett., 1975, 2455]. Азидосульфат потім відновлюють до сполуки формули (І), у якій R1 позначає гідроген, методом каталітичного гідрування, наприклад, з використанням благородного металу та Н2 чи шляхом нагрівання з металевою міддю у розчиннику, такому як метанол. Вихідні матеріали формули RCH2OH можуть бути придбані на ринку чи одержані відомими фахівцям методами. Наприклад, вихідні матеріали формули RCH2OH, де R2 та R3 і R4 та R5 є ідентичними і відповідають формулі (II), можуть бути одержані за методом R.F. Brady, описаним у [Carbohydr. Res., 1970, 14, 35], чи за реакцією триметилсиліленольного ефіру кетону чи альдегіду R6COR7 з фруктозою при температурі 15 близько 25°С у розчиннику, такому як галоїдзаміщений вуглеводень, наприклад, метиленхлорид, у присутності протонної кислоти, такої як хлористоводнева кислота чи кислота Льюїса, така як хлорид цинку. Реакція триметилсиліленольного ефіру описана [G.L. Larson et al. у J. Org. Chem., 1973, 38, 3935]. Далі, карбонові кислоти та альдегіди формул RCOOH та RCHO можуть бути відновлені до сполуки формул RCH2OH за стандартними методиками відновлення, наприклад, за реакцією з гідридом літію-алюмінію, борогідридом натрію чи комплексом боран-ТГФ у інертному розчиннику, такому як диглім, ТГФ чи толуол, при температурі приблизно від 0 до 100°С, наприклад, як описано [Н.О. House у "Modern Synthetic Reactions", 2nd Ed., сторінки 45-144 (1972)]. Сполуки формули (І) можуть також бути одержані у спосіб, розкритий [у патентах США №4513006 №5242942 та №5384327], які включені сюди за посиланням. Сполуки формули (І) включають різні індивідуальні ізомери, а "також рацемати, наприклад, з різними замісниками R2, R3, R4 та R5 в альфа- та бета-положеннях 6-членного кільця, тобто, вище та нижче площі креслення. Краще, оксиген метилендіоксигрупи формули (II) приєднаний з одного боку 6-членного кільця. В тому значенні, що використовується тут, термін "протимігренозний агент" повинен включати будь-які фармакологічні агенти, що можуть бути використані для лікування чи попередження нападів мігрені (тобто, будь-який фармакологічний агент, який може бути використаний для лікування чи профілактики мігрені). Придатні приклади включають, без обмеження, фармакологічні агенти з класів антиконвульсантів, антидепресантів, бетаблокаторів, блокаторів кальцієвих каналів, нестероїдних протизапальних агентів, антагоністів серотонінового рецептора, інгібіторів повторного поглинання серотоніну, інгібіторів повторного поглинання серотоніну-норадреналіну, анальгетиків, протиблювотних засобів, похідних алкалоїдів ріжків, триптанів, антагоністів нейропептидів та рибофлавін (вітамін В2). В тому значенні, що використовується тут, антиконвульсанти включають, без обмеження, валпроєву кислоту (звичайна добова оральна доза 10-60мг) (DEPAKENE виробництва фірми Abbott), дівалироекс-натрій (звичайна добова оральна доза 10-60мг) (DEPAKOTE виробництва фірми Abbott) та габапентин (звичайна добова оральна доза 300-1800мг для дорослих, з нижчими рівнями дозування для дітей) (NEURONTIN виробництва фірми Warner-Lambert). В тому значенні, що використовується тут, антидепресанти включають, без обмеження, трициклічні антидепресанти, такі як амітриптилін (звичайний інтервал терапевтичних добових оральних доз 150-300мг) (ETRAFON виробництва фірми Schcring, LIMBITROL виробництва фірми ICN, TRYPTANOL виробництва фірми Banyu. SAROTEN виробництва фірми Bayer, LAROXYL виробництва фірми Roche. ELAVIL виробництва фірми Astra Zeneca та інші лікарські засоби цього 81110 16 типу), нортриптилін (звичайний інтервал терапевтичних добових оральних доз 50-150мг) (PAMELOR виробництва фірми Novartis та інші лікарські засоби цього типу), кломіпрамін (звичайний інтервал терапевтичних добових оральних доз 100-250мг) (ANAFRANIL виробництва фірми Novartis та інші лікарські засоби цього типу), іміпрамін (звичайний інтервал терапевтичних добових оральних доз 150-300мг) (TOFRANIL виробництва фірми Novartis та інші лікарські засоби цього типу), доксепін (звичайний інтервал терапевтичних добових оральних доз 150-300мг) (SINEQUAN виробництва фірми Pfizer та інші лікарські засоби цього типу); інгібітори моноаміноксидази, такі як фенелзин (звичайний інтервал терапевтичних добових оральних доз 4590мг) (NARDIL виробництва фірми Parke-Davis); селективні інгібітори повторного поглинання серотоніну, такі як флуоксетин (звичайний інтервал терапевтичних добових оральних доз 2060мг) (PROZAC, SARAFEM виробництва фірми Eli Lilly та інші лікарські засоби цього типу), флувоксамін (звичайний інтервал терапевтичних добових оральних доз 100-300мг) (LUVOX виробництва фірми Solvay), циталопрам (звичайний інтервал терапевтичних добових оральних доз 20-40мг) (CIPRAMIL виробництва фірми Lundbeck та CELEXA виробництва фірми Forest); і селективні інгібітори повторного поглинання серотоніну-норадреналіну, такі як венлафаксин (звичайний інтервал терапевтичних добових оральних доз 125-375мг) (EFFEXOR виробництва фірми Wyeth-Ayerst). Бета-блокатори включають, без обмеження, метопролол (звичайна терапевтична добова оральна доза приблизно 200мг) (TOPOL-XL виробництва фірми Astra-Zeneca, LOPRESSOR виробництва фірми Novartis та інші лікарські засоби цього типу), атенолол (звичайна терапевтична добова оральна доза приблизно 100мг) (TENORMIN та TEMORETIC виробництва фірми Astra Zeneca та інші лікарські засоби цього типу), пропанолол (звичайна терапевтична добова оральна доза приблизно 160мг) (INDERAL виробництва фірми Wyelh-Ayerst та інші лікарські засоби цього типу), тімолол (звичайна терапевтична добова оральна доза приблизно 20мг) (BLOCADREN виробництва Merck, Sharp and Dohme's, TIMOLOL виробництва фірми Falcon та інші лікарські засоби цього типу) і надолол (звичайна терапевтична добова оральна доза приблизно 160мг) (CORGARD/SOLGOL виробництва Bristol-Myers Squibb's-Monarch's, NADIC виробництва фірми Dainippon та інші лікарські засоби цього типу). Блокатори кальцієвих каналів включають, без обмеження, верапаміл (звичайна добова оральна доза 120-480мг) (ISOPTIN виробництва фірми Knoll, Verelan виробництва фірми Schwarz, Covera та CALAN виробництва фірми Searle та інші лікарські засоби цього типу), ломеризин (TERRANAS виробництва фірми Nippon Organon), флунаризин (SIBELIUM виробництва фірми Janssen Pharmaceutica), ділтіазем (звичайна добова оральна доза 120-360мг) (CARDIZEM 17 виробництва фірми Biovail та інші лікарські засоби цього типу), німодипін (звичайна добова оральна доза 60-240мг) (NIMOTOP та ESTEVE фірми Bayer), нукапсаїцин (Civamide виробництва фірми Winston Laboratories) та дотаризин (виробництва Mylan/Ferrer). Нестероїдні протизапальні лікарські засоби включають, без обмеження, аспірин, ібупрофен, диклофенак (звичайна добова оральна доза 50200мг) (VOLTAREN виробництва фірми Novartis та інші лікарські засоби цього типу), налроксен (звичайна добова оральна доза 500-1000мг) (NAPROSYN виробництва фірми Roche та інші лікарські засоби цього типу) та кетопрофен (звичайна добова оральна доза 150-300мг) (ORUDIS та ORUVAIL виробництва фірми WyethAyerst та інші лікарські засоби цього типу). В тому значенні, що використовується тут, антагоністи серотонінового рецептора включають, без обмеження, пізотифен (SANOMIGRAN/PIZOTYLINE виробництва фірми Novartiss), мстисергід (SANSERT/DESERIL виробництва фірми Novartis та інші лікарські засоби цього типу) та ципрогeптадин (звичайна добова оральна доза 4-20мг) (PERIACTIN виробництва фірми Меrck). Анальгетики та їхні комбінації (включаючи комбінації з іншими лікарськими засобами, такими як протиблювотні засоби) включають без обмеження, аспірин, ацетамінофеи, парацетамол, меперидин, кодеїн, гідрокодон, FIORICET виробництва фірми Novartis чи ESGIC виробництва фірми Forests або інші лікарські засоби цього типу (комбінація ацетамінофену з буталбіталом та кофеїном), FIORJNAL або інші лікарські засоби цього типу (комбінація аспірину, буталбіталу та кофеїну, Novartis), MIGPRIV або інші лікарські засоби цього типу (комбінація аспірину та метоклопраміду; Sanofi-Synthelabo), MIDRIN/MIDRID або інші лікарські засоби цього типу (комбінація ацетамінофену та дихлоралфеназону; Carnick), PARAMAX виробництва фірми Sanofi-Synthelabo чи MIGRAENERTON виробництва фірми Dolorgiet або інші лікарські засоби цього типу (комбінація парацетомолу та метоклопраміду), VICODIN виробництва фірми Abbott або інші лікарські засоби цього типу (комбінація ацетамінофену та гідрокодону), STADOL NS (назальний спрей буторфанолу; Bristol-Myers Squibb), LONARID виробництва фірми Boehringer Ingelheim чи MIGRALEVE виробництва фірми Pfizer або інші лікарські засоби цього типу (комбінація парацетомолу та кодеїну). В тому значенні, що використовується тут, протиблювотні засоби включають, без обмеження, метоклопрамід (звичайна оральна доза 10-15мг чотири рази на день) (MAXOLON виробництва фірми SmithKline Beecham, REGLAN виробництва фірми Robin та інші лікарські засоби цього типу), домперидон (MOTILIUM виробництва фірми Janssen Pharmaceutica та інші лікарські засоби цього типу), прохлорперазин (звичайна схема дозування при оральному введенні - від 5 до 20мг чотири рази на день) (COMPAZINE виробництва 81110 18 фірми SmithKline Beecham та інші лікарські засоби цього типу) і прометазин (звичайна оральна доза 12,5-50мг) (PHENERGAN/MEPERGAN виробництва фірми Wyeth-Ayerst та інші лікарські засоби цього типу). Похідні алкалоїдів ріжків включають, без обмеження, дигідроерготамін (DHE-45, назальний спрей MIGRANAL виробництва фірми Novartis), ерготамін (ERGOMAR виробництва фірми Lotus Biochemical та інші лікарські засоби цього типу) та комбінацію ерготаміну з кофеїном (CAFERGOT виробництва фірми Novartis, WIGRAINE виробництва фірми Organon та інші лікарські засоби цього типу). Триптани включають, без обмеження, суматриптан (звичайна терапевтична оральна доза приблизно 50мг) (IMITREX/IMIGRAN, Glaxo Wellcome), наратриптан (звичайна терапевтична оральна доза приблизно 2,5мг) (AMERGE, Glaxo Wellcome), ризатриптан (звичайна терапевтичне оральна доза 5-10мг) (MAXALT, Merck), золмітриптан (звичайна терапевтична оральна доза приблизно 2,5мг) (ZOMIG, Astra Zeneca), і новіші триптани включають, без обмеження, елетриптан (RELPAX, Pfizer), фроватриптан (MIGUARD, Vernalis/Elan/Menarini) та алмотриптан (AXERT виробництва фірми Pharmacia). В тому значенні, що використовується тут, антагоністи нейропептидів включають, без обмеження, такі агенти: антагоніст пептиду, спорідненого з геном кальцитоніну (BIBN 4096 виробництва фірми Boehringer lngelheim) та антагоністи речовини Р, такі як дапітант (ERISPANT виробництва фірми Aventis), ланепітант (LY-303870 виробництва фірми Lilly) і FK-888 виробництва фірми Fujisawa. Терапевтично ефективні рівні доз та схеми дозування для антиконвульсантів, антидепресантів, бета-блокаторів, блокаторів кальцієвих каналів, нестероїдних протизапальних лікарських засобів, антагоністів серотонінового рецептора, анальгетиків, протиблювотних засобів, похідних алкалоїдів ріжків, триптанів, антагоністів нейропептидів та інших фармацевтичних агентів, розкритих тут, можуть бути легко визначені пересічним фахівцем в цій області. Наприклад, величини терапевтичних доз та схеми введення фармацевтичних агентів, дозволених для продажу, є доступними для широкої публіки, наприклад, наведені на вкладишах до упаковок, у стандартних рекомендаціях щодо дозування, у стандартних посібниках з дозування, таких як Physician's Desk Reference (Medical Economics Company чи в інтернеті за адресою http://www.pdrel.com) та в інших джерелах. Ефективність комбінованої терапії, яка включає введення терапевтично ефективної кількості одного чи кількох протимігренозних агентів, з одним чи кількома сполуками формули (І) для лікування чи попередження мігрені, основана на дослідженнях конкретних історій хвороб та результатах клінічних випробувань, які детальніше описані далі. Історія хвороби 1 19 Пацієнт жіночої статі, у віці 15 років, з постійним щоденним головним болем з мігренозними ознаками. Стандартні неврологічні тести, включаючи магнітно-резонансну томографію (MRI scan) давали нормальні результати. Пацієнт не реагував на PERIACTIN (ципрогептадин-НСІ), нортриптилін та INDERAL (пропранолол-НСІ). Її тяжкий головний біль не реагував на наратриптан. Пацієнту почали вводити топірамат з 25мг/добу, із збільшенням до 75мг/добу, що привело до значного поліпшення та припинення щоденних головних болів і зниження частоти мігренозного головного болю до приблизно одного разу на тиждень. Поліпшення спостерігалося при лікуванні з використанням топірамату в дозі 75мг/добу та INDERAL в дозі 20мг/добу. Історія хвороби 2 Пацієнт чоловічої статі, у віці 41 року, з довічним анамнезом резистентної мігрені (мігрень без аури), у середньому 8 нападів мігрені за місяць. Пацієнт не реагував на CORGARD (надолол) у комбінації з PROZAC (флуоксетинНСІ) чи CELEXA (циталопрам-НСІ) чи тразодоном. Додаткове введення рибофлавіну (вітамін В2) в дозі 400мг/добу також не дало поліпшення. Пацієнту почали вводити топірамат в дозі 25мг/добу, з підвищенням дози до 75мг/добу. Одночасно, дозу бета-блокатора CORGARD зменшили до 20мг/добу, з триваючим прийманням CELEXA 20мг/добу. При 75мг/добу топірамату, 20мг/добу CORGARD та 20мг/добу CELEXA пацієнт повідомив про значне зменшення частоти головного болю, з тривалістю періодів без головного болю до чотирьох тижнів. Історія хвороби 3 Пацієнт жіночої статі, у віці 51 року, в анамнезі двадцять років тяжкої резистентної мігрені з аурою та без неї. Пацієнт мав помірну симптоматичну реакцію на DEPAKOTE (валпроєва кислота), курс лікування якою був припинений через збільшення ваги тіла. Лише помірна реакція спостерігалася для INDERAL 120мг/добу у комбінації з трициклічними антидепресантами; а при часто повторюваному застосуванні суматриптану спостерігалася симптоматична реакція. Пацієнту почали вводити топірамат в дозі 50мг/добу зі збільшенням до 100мг ранком та 100мг вечором, у комбінації з INDERAL в дозі 160мг/добу. Пацієнт повідомив про початкову позитивну реакцію, але головний біль відчувався. Через приблизно 6 місяців, пацієніу прописали EFFEXOR XR (ванлафаксин-ІІСІ) в дозі 37мг/добу, збільшення дози топірамату до 125мг ранком та 150мг вечором, та 160мг/добу INDERAL. Для цієї комбінації спостерігалося помірне, але стійке поліпшення. Дослідження за клінічними протоколами №1 та №2: Подвійно-сліпі дослідження доза-відповідь з контролем по плацебо та паралельними групами Головною метою цих досліджень була оцінка безпеки та ефективності трьох доз топірамату (50, 100 та 200мг/добу) порівняно з плацебо при профілактиці мігрені, визначуваної за зміною 81110 20 частоти епізодів мігрені за місячний період (28 днів) у подвійно-сліпій фазі порівняно з очікуваним базовим періодом. Вторинними цілями досліджень була оцінка співвідношення доза-відповідь та оцінка впливу профілактичного лікування топіраматом (50, 100 та 200мг/добу) порівняно з плацебо на зв'язаний зі станом здоров'япоказник якості життя (HRQL). Випробування проводилися за рандомізованою подвійно сліпою багатоцентровою схемою з контролем по плацебо та паралельними групами. Суб'єктів чоловічої та жіночої статі рандомізували порівну до чотирьох груп лікування. Суб'єкти повинні були мати встановлену історію хвороби, що співпадає з діагнозом мігрені протягом щонайменше шести місяців, з аурою чи без неї, визначуваним на основі критеріїв Міжнародного товариства головного болю (IHS). Критерії IHS використовувалися для встановлення діагнозу при включенні у випробування, але оцінка ефективності була основана на періодичності мігрені. Період мігрені визначався як період часу між виникненням та припиненням болісних симптомів мігрені. Цей період міг тривати до 24 годин, але не більше. Якщо болючі симптоми тривали більш ніж 24 години після їхнього виникнення, то це вважалося потім окремим періодом мігрені. Якщо симптоми повторювалися протягом 24 годин від початку періоду, то це вважалося частиною того самого вихідного періоду. Якщо виникала аура, але успішне абортивне лікування запобігало виникненню головного болю, то ця клінічна ситуація враховувалася як період мігрені. Ці дослідження мали п'ять фаз: базову, подвійно-сліпу, сліпу перехідну, додаткову відкриту та поступового зменшення дози/виходу, які детальніше описані нижче. Базова фаза: Базова фаза тривала до 42 днів (включаючи період виведення тривалістю максимум 14 днів) та включала два періоди: виведення та очікуваної базової лінії. Під час Відвідування базової лінії 1 (скринінг), суб'єктів оглядали для того, щоб впевнитися, що вони задовольняють критеріям включення/виключення. Крім того, записували тримісячну ретроспективну історію головного болю. На протязі трьох місяців перед Відвідуванням 1, суб'єкти повинні були мати у середньому не більш ніж 8 нападів мігрені та загалом не більш ніж 15 днів головного болю (мігренозного плюс немігренозного) на місяць. Придатні для включення суб'єкти потім проходили інші процедури досліджень і для них заводили журнал запису головних болів/медикаментозного лікування. Суб'єкти вели записи головних болів починаючи з Відвідування 1 протягом участі у дослідженнях, реєструючи вияви будь-яких головних болів чи аури, а також тривалість, тяжкість та симптоматику будь-яких нападів головного болю. Суб'єкти також реєстрували використання будь-яких абортивних/швидкодіючих лікарських засобів, що приймаються для полегшення мігрені чи головного болю та 21 асоційованих симптомів, чи під час аури для запобігання мігренозного болю чи полегшення симптомів. Крім того, для кожного нападу мігрені, суб'єкти відповідали на запитання у журналі реєстрації головного болю стосовно втрати працездатності та продуктивності. Якщо на початку випробувань придатні для включення суб'єкти приймали будь-які лікарські засоби для профілактичного лікування мігрені, то вони проходили Період виведення тривалістю до 14 днів для поступового припинення приймання цих засобів. Цей період виведення закінчувався (тобто, профілактичні лікарські засоби цілком втрачали ефект) к тому часу, коли суб'єкт переходив до Періоду очікуваної базової лінії, за 28 днів перед Відвідуванням 2. Придатні для включення суб'єкти, що не приймали ніяких профілактичних лікарських засобів для лікування мігрені, не проходили Період виведення, а починали одразу з Періоду очікуваної базової лінії. Під час Базового Відвідування 2 (День 1) аналізували зареєстровану інформацію про головний біль/лікування. Для того, щоб бути придатними для рандомізації для участі у випробуваннях, суб'єкти повинні були мати під 3 до 12 періодів мігрені, але не більш ніж 15 днів (мігренозного та немігренозного) головного болю протягом 28 днів перед Відвідуванням 2. День головною болю визначався як календарний день, протягом якого суб'єкт щонайменше 30 хвилин відчував головний біль. Подвійно-сліпа фаза: Суб'єктів, що закінчили Базову фазу та відповідали критеріям включення, рандомізували до однієї з чотирьох груп лікування: 50мг/добу топірамату, 100мг/добу топірамату, 200мг/добу топірамату чи плацебо. Подвійно-сліпа фаза мала два періоди: Титрування та Підтримання, які детальніше описані далі. Період титрування: Період титрування йшов негайно за Базовою фазою та тривав вісім тижнів (56 днів). Протягом цього періоду суб'єкти, рандомізовані до груп топірамату, починали приймати ліки з дози 25мг/добу і добову дозу збільшували на 25мг щотижня, поки вона не досягала встановленої для них величини дози (або максимальної стерпної дози, залежно від того, яка з них є меншою). Починаючи з третього тижня Титрування до кінця Періоду, підтримання було дозволено зробити максимум два зниження рівня дози при виникненні проблем непереносимості. Якщо суб'єкт після зниження дози знаходився ще у Періоді титрування, то могла робитися спроба повторного збільшення дози з метою досягнення призначеної для . суб'єкта дози і, якщо ця спроба була невдачною, доза могла знов знижуватися до початкової зниженої дози. Суб'єкти, яким було двічі зменшено передбачену у дослідженнях дозу лікарського засобу, і які все ще мали неприйнятні проблеми непереносимості, що вимагали додаткового зниження дози, виходили з досліджень. Відвідування клініки відбувалися в День 29 (Відвідування 3) та День 57 (Відвідування 4/Кінець титрування). 81110 22 Період підтримання: Протягом цього 18-тижневого періоду суб'єкт залишалися на дозі лікарського засобу, досягнутій на кінець Періоду титрування (призначена доза чи максимальна переносима доза). Якщо у суб'єкта виникали неприйнятні проблеми непереносимості, дозу зменшували, причому при підтриманні було дозволено лише одне зниження дози. Повторне збільшення дози протягом Періоду підтримання не було дозволено, так що суб'єкт продовжував одержувати зменшену дозу протягом решти періоду. Суб'єкти, для яких дозу дослідного засобу вже було знижено на два рівня, і які все ще мали неприйнятні проблеми непереносимості; що вимагали додаткового зниження дози, виходили з випробувань. Клінічні відвідування відбувалися в День 85 (Відвідування 5), День 113 (Відвідування 6), День 141 (Відвідування 7) та День 183 (Відвідування 8/Останнє відвідування подвійносліпої фази чи Достроковий вихід). Вважалося, що суб'єкти закінчили Подвійносліпу фазу, якщо вони завершили всі 26 тижнів Фази (8 тижнів Титрування та 18 тижнів Підтримання) без дострокового припинення дослідного курсу лікування. Лише суб'єкти, які завершили всі 26 тижнів Подвійно-сліпої фази та/або вийшли з Подвійносліпої фази через недостатню ефективність (після завершення щонайменше 4 тижнів Фази підтримання), одержували можливість вступити до Додаткової відкритої фази. Тим суб'єктам, які вирішили не вступати до Додаткової відкритої фази, пропонувалося завершити Фазу зменшення дози/виходу. Суб'єкти, що вийшли з Подвійносліпої фази з інших причин (недостатня ефективність до завершення 4 тижнів Періоду підтримання, рішення суб'єкта, небажані ефекти), не мали можливості вступу до Додаткової відкритої фази, і їм пропонувалося завершити Фазу зменшення дози/виходу. Сліпа перехідна фаза: Перед тим, як придатні для включення суб'єкти вступали до Додаткової відкритої фази, вони спочатку закінчували Сліпу перехідну фазу. Під час цієї фази, суб'єктам поступово зменшували дозу дослідного курсу подвійносліпого періоду випробувань у сліпий спосіб при одночасному титруванні відкритого курсу лікування топіраматом. Рекомендованою швидкістю титрування відкритого курсу лікування було щотижневе збільшення добової дози на 25мг. Ця фаза тривала до семи тижнів у залежності від дози, досягнутої під час Подвійно-сліпої фази. Клінічне відвідування було заплановане на наступний день після закінчення поступового зменшення дози сліпого курсу лікування (Відвідування 1 О/Кінець сліпого перехідного періоду). Під час Перехідної фази періодично проводилися телефонні перевірки (наприклад, кожні два тижня) для оцінки клінічних результатів та/або регулювання відкритої схеми дозування. Додаткова відкрита фаза: Ця фаза йшла негайно після Сліпої перехідної фази. Суб'єкти одержували топірамат у відкритий спосіб протягом до шести місяців, або до виходу 23 суб'єкта з випробувань. Відкрита доза могла бути відрегульована на розсуд дослідника, причому добова доза не перевищувала 1600мг. Під час цієї фази були дозволені численні корекції дози дослідного курсу лікування з метою підвищення ефективності чи зниження побічних ефектів. Протягом цієї фази суб'єкти проходили огляд щоквартально (Відвідування 11 та 12/Останнє відвідування додаткової відкритої фази). Періодично проводився телефонний контроль для оцінки клінічних результатів та/або регулювання дози. Вважалося, що суб'єкти завершили Додаткову відкриту фазу, якщо вони закінчили всі шість місяців цієї Фази без передчасного припинення дослідного курсу лікування. Фаза зменшення дози/виходу: Всім суб'єктам, що виходили з досліджень, рекомендували поступово зменшувати дозу дослідних ліків. Якщо суб'єкти виходили з досліджень протягом Подвійно-сліпої фази (Періоди титрування чи підтримання), їм зменшували дозу дослідних ліків у сліпий спосіб. Тривалість періоду зменшення дози змінювалася у залежності від досягнутої для суб'єкта дози. Суб'єктам, що виходили з випробувань протягом Сліпої перехідної фази, поступово зменшували дозу відкритого лікарського засобу згідно з рекомендованим режимом зменшення дози 50-100мг/тиждень при одночасному зменшенні сліпої дози ліків. Для Суб'єктів, які виходили з досліджень протягом Додаткової відкритої фази, дотримувались рекомендованого графіка зменшення дози 50-100мг/тиждень. Контрольні Відвідування (Відвідування 9 у Подвійно-сліпій фазі та Відвідування 13 у Додатковій відкритій фазі) проводилися протягом одного тижня після припинення приймання всіх дослідних ліків. Схема дозування та введення Суб'єкти були рандомізовані до однієї з чотирьох дослідних груп: а) плацебо, b) 50мг/добу тонірамату, с) 100мг/добу топірамату чи d) 200мг/добу топірамату. Всі суб'єкти одержували дослідні ліки за схемою введення двічі на день (b.i.d.), за винятком першого тижня Титрування, протягом якого вони приймали разові дози вечором. Супутня терапія Ідеально, в ході цих досліджень не використовувалися ніякі лікарські засоби, крім дослідних ліків та дозволених лікарських засобів, вказаних у протоколі. Через можливий підвищений ризик утворення ниркових каменів від приймання таких лікарських засобів: ацетазоламід, зонісамід та триамтрен, було рекомендовано не застосовувати їх у поєднанні з курсом лікування топіраматом. Рекомендувалося також не використовувати в цих дослідженнях основних транквілізаторів (нейролептиків) трициклічних антидепресантів, інгібіторів моноаміноксидази (МАО) чи симпатоміметиків центральної дії (наприклад, декстроамфетамінсульфат [Dexedrine]). 81110 24 Абортивні/швидкодіючі лікарські засоби Відповідно до належної практики гамування болю, суб'єктам, залученим до цих випробувань, було дозволено приймати абортивні/швидкодіючі лікарські засоби, показані для лікування болю під час мігрені/нападів головного болю. Тип та кількість використовуваних ліків реєструвалися суб'єктами у журналі реєстрації епізодів головного болю/лікарських засобів. Дозволені лікарські засоби для лікування болю під час мігрені/нападів головного болю включають такі, з рекомендованою частотою приймання доз: Не більш ніж 15 епізодів лікування за місяць: ацетилсаліцилова кислота, ацетамінофен, нестероїдні протизапальні агенти, ізометептанмукат та ацетамінофен, буталбітал з аспірином та кофеїном, буталбітал з ацетамінофеном та кофеїном. Не більш ніж 8 епізодів лікування/місяць: дигідроерготамінмезилат, ерготамінтартрат, кодеїн, похідні кодеїну та триптани (при введенні ін'єкцією, орально чи за допомогою назального спрею). Не більш ніж 6 епізодів лікування/місяць: сильнодіючі опіоїди, такі як меперидин/оксикодон. Не більш ніж 2 епізоди лікування/місяць: кортикостероїди при виявах мігренозного стану. Епізод лікування визначався як використання певного лікарського засобу протягом календарного дня (дозволені дози згідно з вкладишем до упаковки лікарського засобу). Якщо використання швидкодіючих лікарських засобів перевищувало вказану частоту, розглядалася можливість виходу суб'єкта з досліджень через недостатню ефективність та погану відповідність режиму випробувань. Застосування лікарських засобів, призначених для полегшення інших симптомів мігрені (наприклад, блювота, нудота) було дозволено з урахуванням обставин (р.r.n.) і реєструвалося у журналі спостереження головного болю. Огляди під час випробувань Фізичний огляд (включаючи ріст) та неврологічний огляд проводилися на початку та наприкінці досліджень. На початку досліджень також записували базову електрокардіограму. Основні показники стану організму та вагу реєстрували при кожному клінічному відвідуванні. Небажані ефекти реєстрували після початку приймання дослідних лікарських засобів і відстежували до їхнього зникнення чи до досягнення клінічно стабільної кінцевої точки. Клінічні лабораторні тести для всіх суб'єктів та тести сечі для виявлення вагітності у жінок дітородного віку проводили з визначеними інтервалами часу протягом досліджень. Оцінку якості життя здійснювали під час Відвідувань 2 (День 1), 4 (День 57/Кінець титрування), 6 (День 113) та 8 (День 183/Останнє відвідування Подвійно-сліпої фази/Достроковий вихід з досліджень). Інформацію щодо Користування ресурсами системи охорони здоров'я реєстрували під час Відвідувань з 3 по 8. Випадки будь-якого головного болю чи аур, тяжкість та симптоматику будь-яких головних болів і використання 25 абортивних/швидкодіючих лікарських засобів переносили з журналів спостереження за головним болем суб'єктів до їхніх історій хвороби при кожному відвідуванні. Після Базового відвідування 1, суб'єкти поверталися для запланованих відвідувань у межах вікна розміром +/- 3 дня до початку щоквартальних відвідувань (Додаткова відкрита фаза), коли розмір вікна становив +/- 2 тижні. Оцінка ефективності була основана на інформації, занесеній до журналів реєстрації головного болю/лікування суб'єктів та результатах визначення показника якості життя, зв'язаної зі станом здоровья (HRQL). В журналах реєстрації головного болю/лікування суб'єкти протягом участі у дослідженнях документували таке: випадки та тривалість головного болю (та аур, якщо головний біль не виникав), тяжкість головного болю та асоційовані симптоми, а також використання лікарських засобів, прийнятих для полегшення головного болю чи симптомів (або прийнятих під час аури для полегшення симптомів чи попередження мігренозного болю). Оцінки HRQL проводилися з визначеними інтервалами протягом досліджень (див. Календарний план та графік подій) суб'єктами, що досягли віку 18 років чи старше на момент включення до випробувань. Для оцінки HRQL використовували два інструменти. Запитальник мігреньспецифічної якості життя (MSQ), та Коротка форма-36 (SF-36) досліджень медичних наслідків. SF-36 є найчастіше застосовною загальною мірою HRQL у пацієнтів з мігренню і використовувалася у кількох дослідженнях мігрені. SF-36 є запитальником з 36 пунктами, що охоплюють вісім областей. Було показано, що SF36 дає надійні та достовірні результати для різноманітних популяцій пацієнтів, у тому числі для пацієнтів з мігренню. MSQ, розроблений фірмою Glaxo Wellcome, також був застосований в цих клінічних випробуваннях. Він є хвороба-специфічним інструментом, розробленим для оцінки якості життя застосовно до мігрені. Поточна версія (2.1) включає 14 пунктів у трьох областях. MSQ найчастіше використовувався в опублікованих клінічних випробуваннях способів лікування мігрені і продемонстрував свою надійність, достовірність та чутливість. Критерії ефективності Первинною кінцевою точкою ефективності була зміна місячної частоти (28 днів) періодів мігрені для Подвійно-сліпої фази порівняно з Очікуваним базовим періодом. Вторинні кінцеві точки ефективності включали частку суб'єктів, що реагували на лікування (зменшення частоти випадків мігрені за місяць на 50% чи більше), зміну кількості щомісячних нападів мігрені (за критеріями IHS) у Подвійносліпій Фазі порівняно з Очікуваним базовим періодом, зміну числа щомісячних днів мігрені у Подвійно-сліпій фазі порівняно з Очікуваним базовим періодом, зміну числа днів за місяць, що потребували застосування швидкодіючих ліків у 81110 26 Подвійно-сліпій фазі порівняно з Очікуваним базовим періодом, і результати визначення HRQL. Критерії ефективності були основані у першу чергу на перевазі однієї чи кількох доз топірамату порівняно з плацебо за показниками статистично значущої різниці для первинної кінцевої точки. Вторинні кінцеві точки використовувалися для підтвердження висновків, основаних на первинній кінцевій точці, та для оцінки ефекту лікування на якість життя суб'єктів. Оцінки ефективності Первинною кінцевою точкою ефективності була зміна щомісячної (28 днів) частоти періодів мігрені у Подвійно-сліпій фазі порівняно з Очікуваним базовим періодом. Вторинні кінцеві точки ефективності включають: частку суб'єктів, що реагують на лікування (зменшення частоти періодів мігрені за місяць на 50% чи більше у Подвійно-сліпій фазі порівняно з Очікуваним базовим періодом), зміна числа щомісячних нападів мігрені (згідно з критеріями IHS) у Подвійно-сліпій фазі порівняно з Очікуваним базовим періодом, зміна щомісячного числа днів мігрені у Подвійно-сліпій фазі порівняно з Очікуваним базовим періодом, і зміна числа днів за місяць, коли потребувалося застосування швидкодіючих засобів у Подвійно-сліпій фазі порівняно з Очікуваним базовим періодом. Інші вторинні змінні ефективності включали мігреньспецифічні показники якості життя з урахуванням стану здоров'я (MSQ) та показники якості життя SF-36. Всі статистичні критерії були двобічними при значенні рівня значущості р, меншому ніж чи рівному 0,05, якщо не вказано інше. Статистичні аналізи були основані у першу чергу на принципі наміру лікування. Популяція аналізу за наміром лікування включає всіх рандомізованих суб'єктів, які надавали дані протягом Подвійно-сліпої фази. Відсутні дані заповнювали шляхом перенесення значення уперед (LVCF). Якщо кількість суб'єктів з великими порушеннями протоколу не була незначною, то проводився аналіз за протоколом з виключенням суб'єктів зі значними порушеннями протоколу для оцінки стійкості результатів. Всі порушення протоколу ідентифікувалися, і рішення про необхідність аналізу на відповідність протоколу приймалося перед розкриттям бази даних. Перелік великих порушень протоколу включали до плану формального аналізу даних. Первинну кінцеву точку ефективності - зміну частоти щомісячних періодів мігрені у Подвійносліпій фазі порівняно з Очікуваним базовим періодом - оцінювали за лінійною моделлю з використанням коефіцієнтів для базового значення, лікування та дослідного центра. Порівняння доз топірамату з плацебо здійснювали з використанням перевірки на тренд за ТукіЦімінера-Гейзе (Tukey-Ciminera-Heyse), яка є процедурою пошагового знижування, що включає всі дози та плацебо на першій стадії. Якщо був виявлений значущий тренд у відповідь на дозу, то доза 200мг вважалася значущо відмінною від плацебо і виключалася з перевірки на тренд для дози 100мг, що включала дози 100мг, 50мг та 27 плацебо. Якщо доза 100мг була значущо відмінною від плацебо за результатами перевірки на тренд, то дозу 50мг порівнювали з плацебо. Ця перевірка на тренд дозволяє виявляти помилки першого роду загального порівняння при визначенні рівня мінімально ефективної дози. Додаткове уточнення α-рівня було непотрібним, оскільки була лише одна первинна кінцева точка. Результати визначення вторинних кінцевих точок ефективності використовувалися для підтвердження висновку, основаного на первинній кінцевій точці ефективності, і тому поправки на множинність не застосовувалися. Взаємодію лікування-центри аналізували шляхом графічного відображення результатів для окремих центрів та з використанням однакової лінійної моделі з додатковим коефіцієнтом взаємодії лікуванняцентр, що мав рівень значущості 0,10. перевіряли припущення нормальності та гомогенності. Для визначення співвідношення доза-відповідь та сприяння обговоренню вибору дози, крім описаного вище аналізу трендів проводився вторинний аналіз з метою порівняння доз топірамату між собою. Крім того, довірчі інтервали та графічні методи використовувалися для оцінки співвідношення між дозою та первинною кінцевою точкою, а також вторинними кінцевими точками. Частку суб'єктів, що реагують на лікування, аналізували з використанням процедури перевірки на тренд за Кохраном-Армітейджем (CochranArmitage). Зміну числа щомісячних нападів мігрені (за критеріями IHS) та щомісячних днів мігрені у порівнянні з базовими значеннями і зміну числа днів за місяць, що потребували застосування швидкодіючих засобів, оцінювали у такий саме спосіб, як і дані для первинної кінцевої точки. Поправки на множинність не застосовувалися до множинних вторинних порівнянь, оскільки результати для цих вторинних кінцевих точок використовувалися для підтвердження висновку, основаного на первинній кінцевій точці ефективності. Дані для всіх типів головного болю, тривалості мігрені, тяжкості мігренозного головного болю та тяжкості мігрень-асоційованих симптомів об'єднували та/або аналізували у разі потреби. Первинними кінцевими точками аналізу HRQL були три області MSQ: Обмеження поведінки, Перешкоди у поведінці та Емоціональна функція. Вторинні кінцеві точки HRQL включали вісім областей SF-36: фізичне функціонування, тип поведінки-фізичний, тілесний біль, загальний стан здоров'я, життєздатність, соціальне функціонування, емоційний тип поведінки та розумовий стан здоров'я, а також Резюме фізичного компонента SF-36 та Резюме розумового компонента SF-36. Порівняння груп лікування здійснювали для всіх тестів, HRQL. Поправки імовірності для множинних порівнянь здійснювалися лише для первинних кінцевих точок HRQL (три області MSQ) з використанням процедури внесення поправок за Бонферонні (Bonferonni) з послідовним відкиданням. 81110 28 Перевірялися такі гіпотези HRQL: 1) профілактичний курс лікування топіраматом асоційований з поліпшенням HRQL у порівнянні з плацебо; і 2) поліпшення HRQL асоційовані зі зменшенням частоти мігрені. Первинна аналітична методика перевірки міжгрупових відмінностей була основана на аналізі HRQL у різні моменти часу до закінчення подвійносліпої фази лікування (День 183). Аналіз у різні моменти часу використовував кусково-лінійну модель регресії, яка дозволяє зміну кута нахилу кривої HRQL після закінчення титрування (День 57). Аналіз площі під кривою від рандомізації до Дня 183 включав первинний аналіз з порівнянням груп лікування. Аналізи чутливості проводили для перевірки різних припущень щодо відсутніх даних HRQL (тобто, дані відсутні у випадковий спосіб чи дані відсутні у невипадковий спосіб). Зв'язок між зміною частоти мігрені та HRQL аналізували з використанням кореляційних методів. Зміни HRQL визначали як абсолютну зміну в області HRQL в інтервалі від базової лінії до останнього визначення HRQL. Зміну у частоті мігреней вимірювали як різницю між числом мігреней протягом передрандомізаційного періоду (від Дня - 28 до Дня 1) та числом мігреней протягом останнього 28-денного періоду суб'єкта у подвійно-сліпій фазі досліджень. Поправки на множинне порівняння робили лише для трьох первинних кінцевих точок HRQL. Визначення розміру вибірки Розмір вибірки 120 суб'єктів у групі забезпечував 95% імовірність виявлення 1,19кратної відмінності у зміні частоти періодів мігрені порівняно з базовою лінією між будь-якими двома групами лікування, при спільному стандартному відхиленні 2,50. Вважається, що 2,50 є обґрунтованою оцінкою верхньої межі мінливості зміни частоти періодів мігрені порівняно з базовою лінією в даних дослідженнях. Результати двох клінічних випробувань, описаних вище, були проаналізовані на виявлення ефекту топірамагу у комбінації з гострою чи невідкладною терапією, конкретніше, з невідкладною триптановою терапією, на тяжкість та тривалість головних болів, а також тяжкість будь-яких асоційованих симптомів нудоти, фотофобії та/або фонофобії. Тяжкість. головного болю та асоційованих симптомів оцінювалася учасниками клінічних випробувань по категоризованій шкалі під 0 до 3 (0= відсутні, 1= слабкі, 2= помірні, 3= тяжкі). Тривалість, головного болю вимірювалася у годинах. Контрольна група плацебо потім порівнювалася з групами, що одержували лікування топіраматом 50мг, 100мг та 200мг; результати наведені у Таблицях 1-5 нижче. Статистичну значущість розраховували для відмінностей між групою, що одержувала плацебо, та групою топірамату 100мг і усіма об'єднаними групами, що одержували топірамат. Статистично значущими відмінностями вважалися такі, що мали значення р не більше 0,05. 29 Базова лінія Подвійно-сліпа фаза Різниця Значення р 81110 30 Тяжкість мігренозного головнимиболю головного болями, при застосуванні засобів гострої чи невідкладної терапії класу триптанів. Плацебо ТПМ 50мг Ефект був численно вимірним (і більшим, ніж ТПМ 100мг ТПМ 200мг ТПМ Загалом 2,27 2,32 для плацебо) при дозах 100мг та 200мг. 2,33 2,26 2,23 2,18 Статистично значуща різниця у тяжкості нудоти 2,14 2,16 -0,04 -0,13 спостерігалася для пацієнтів, що приймають 100мг -0,19 -0,10 н/о топірамату. 0,007 н/о 0,082 н/о вказує, що значення р не обчислювалося Тяжкість фотофобія-асоційованих мігренозних Таблиця 2 Плацебо ТПМ 50мг ТПМ Базова лінія 1,73 1,83 1 Тривалість мігренозного головного болю (у годинах) Подвійно-сліпа фаза 1,65 1,68 1 -0,08 -0 Плацебо ТПМ 50мг Різниця 100мг ТПМ ТПМ 200мг ТПМ Загалом -0,14 н/о 0, Базова лінія 13,48 12,77 Значення р 14,75 10,84 Подвійно-сліпа фаза 12,65 11,60 13,17 12,05 н/о вказує, що значення р не обчислювалося Різниця -0,82 -1,17 -1,59 +1,21 * Зміна тяжкості фотофобії у порівнянні з базовою лінією дл Значення р н/о 0,998 н/о 0,815 значущості для Випробувань 1 (р=0,011), але не для Випробуван н/о вказує, що значення р не обчислювалося Наведені вище результати показують, що топірамат у комбінації з невідкладною триптановою терапією приводив до зниження тяжкості мігренозних головних болів у порівнянні з лікуванням самими лише засобами невідкладної терапії. Числові відмінності були вимірними для пацієнтів у групах, що одержували 50мг, 100мг та 200мг топірамату. Статистично значущі результати були одержані для групи пацієнтів, що приймали 100мг топірамату. Результати далі свідчать, що топірамат у комбінації із засобами триптанової невідкладної терапії приводив до численно вимірного зниження тривалості мігренозного головного болю в групах пацієнтів, що одержували 50мг та 100мг топірамату. На даний час винахідники на мають обґрунтованої теорії, яка б пояснювала, чому тривалість головних болів зростає при лікуванні 200мг топірамату. Вважається, що, як би дослідження були розроблені спеціально для оцінки ефекту комбінації лікарських засобів, такого б не спостерігалося. Наведені вище результати свідчать, що лікування топіраматом у комбінації з невідкладною триптановою терапією знижувало тяжкість асоційованої фотофобії (чутливості до світла) у порівнянні з лікуванням самими лише засобами триптанової невідкладної терапії. Ефект був численно вимірним (і більшим, ніж для плацебо) в групах пацієнтів, що приймали 50мг та 100мг топірамату. Статистично значущу різницю у тяжкості нудоти було виявлено у пацієнтів, що приймали 100мг топірамату у Випробуваннях 1. Тяжкість фонофобії, асоційованої з мігренозними Базова лінія Подвійно-сліпа фаза Різниця Значення р Плацебо 1,56 1,53 -0,03 ТПМ 50 мг 1,65 1,59 -0,06 н/о ТПМ 1 1,7 1,5 -0,1 0,25 н/о вказує, що значення р не обчислювалося * Зміна тяжкості фотофобії у порівнянні з базовою лінією дл Таблиця 3 значущості для Випробувань 1 (р=0,018), але не для Випробуван Тяжкість нудота-асоційованих мігренозних головних болів Наведені вище результати свідчать, що лікування топіраматом у комбінації зТПМ Загалом невідкладною Плацебо ТПМ 50мг ТПМ 100мг ТПМ 200мг знижувало тяжкість Базова лінія 1,16 1Д7 триптановою 1,22 терапією 1,12 (чутливості до звуків) у Подвійно-сліпа фаза 1,25 1,17 асоційованої фонофобії 1,09 1,12 з лікуванням -0,03 самими лише засобами Різниця +0,09 -0,01 порівнянні-0,10 Значення р н/о триптанової невідкладної терапії. Ефект був 0,045 н/о 0,201 численно вимірним (і більшим, ніж для плацебо) в групах пацієнтів, що приймали 50мг та 100мг н/о вказує, що значення р не обчислювалося топірамату. Статистично значущу різницю у тяжкості нудоти було виявлено у пацієнтів, що приймали 100мг топірамату у Випробуваннях 1. Наведені вище результати свідчать, що курс Зараз тривають додаткові аналізи результатів, лікування топіраматом приводив до зниження зібраних в описаних вище дослідних тяжкості нудоти, асоційованої з мігренозними випробуваннях №1 та №2. Дослідження за клінічними протоколами №3: 31 Рандомізовані подвійно-сліпі дослідження доза-відповідь з контролем по плацебо та паралельними групами Головною метою досліджень була оцінка безпеки та ефективності двох доз топірамату (100 та 200мг/добу) порівняно з плацебо при профілактиці рецидивуючих епізодів мігрені на основі зміни частоти епізодів мігрені за місячний період (28 днів) у подвійно-сліпій фазі порівняно з базовою фазою. Вторинними цілями були: а) оцінка ефекту профілактичного лікування топіраматом (100 та 200мг/добу) порівняно з плацебо у пацієнтів з мігренню, на процентну частку суб'єктів, що реагують на лікування (зниження частоти щомісячних епізодів мігрені на 50% чи більше) та зміни у подвійно-сліпій фазі порівняно з базовою фазою за показниками b) числа днів мігрені за місяць, с) середньої тривалості мігрені, d) використання засобів невідкладного лікування, e) середньої тяжкості мігренозного головного болю, f) середньої тяжкості мігрень-асоційованих симптомів (нудота, блювота, фотофобія, фонофобія); одержання даних щодо безпеки та ефективності для порівняння топірамату (100 та 200мг/добу) з пропанололом (160мг/добу) при профілактичному лікуванні мігрені; і оцінка ефекту профілактичного лікування топіраматом (100 та 200мг/добу) порівняно з плацебо у пацієнтів з мігренню на мігрень-специфічні показники пов'язаної зі станом здоров'я якості життя (HRQL) та показники якості життя SF-36, а також кореляції між HRQL та частотою мігреней. Випробування проводилися за рандомізованою подвійно сліпою багатоцентровою схемою з контролем по плацебо та паралельними групами з метою оцінки ефективності та безпеки двох доз топірамату порівняно з плацебо та пропанололом у профілактиці мігрені. П'ятсот сімдесят п'ять суб'єктів чоловічої та жіночої статі були рандомізовані на чотири групи лікування. Суб'єкти повинні були мати встановлений діагноз мігрені, з аурою чи без неї, згідно з визначенням Міжнародного товариства головного болю (IHS), протягом щонайменше дванадцяти місяців. Діагностичні критерії IHS відрізнялися від визначення періоду мігрені, використаного в цих дослідженнях для оцінки ефективності. В цілях даного дослідження період мігрені був визначений як період часу у двадцять чотири години, який починається з появою болісних симптомів мігрені або аури з успішним абортивним/невідкладним лікуванням. Будь-які рецидиви протягом двадцятичотирьохгодинного періоду вважалися частиною вихідного епізоду. Якщо тривалість мігренозного болю перевищувала двадцятичотирьохгодинний період, то в цілях даного дослідження це вважалося новим епізодом. Ці дослідження мали чотири фази: базову, головну подвійно-сліпу, додаткову сліпу та поступового зменшення дози/виходу, які детальніше описані далі. Базова фаза: 81110 32 Базова фаза тривала до 42 днів та включала два періоди: виведення та очікуваної базової лінії. При Відвідуванні базової лінії 1 (скринінг), суб'єктів оглядали для того, щоб впевнитися, що вони задовольняють критеріям включення/виключення. Крім того, записували тримісячну ретроспективну історію головного болю. Па протязі .кожного з трьох місяців перед Відвідуванням 1 суб'єкти повинні були мати не більше 8 нападів мігрені та загалом не більше 15 днів головного болю (мігренозного плюс немігренозного). Придатні для включення суб'єкти потім проходили інші процедури досліджень і для них заводили журнал реєстрації головних болів/невідкладного лікування. Суб'єкти вели цей журнал починаючи з Відвідування 1 протягом участі у дослідженнях, реєструючи вияви будьяких головних болів чи аури, а також тривалість, тяжкість та симптоматику будь-яких нападів головного болю. Суб'єкти також реєстрували використання будь-яких абортивних/швидкодіючих лікарських засобів, прийнятих для полегшення мігренозного болю та асоційованих симптомів, чи під час аури для запобігання мігренозного болю чи полегшення симптомів. Крім того, для кожного нападу мігрені, суб'єкти відповідали на запитання у журналі реєстрації головного болю стосовно втрати працездатності та продуктивності. Якщо на початку випробувань придатні для включення суб'єкти приймали які-небудь засоби для профілактичного лікування мігрені, то вони проходили Період виведення тривалістю до 14 днів для поступового припинення приймання цих засобів. Цей період виведення закінчувався (тобто, профілактичні лікарські засоби цілком втрачали ефект) к тому часу, коли суб'єкт переходив до Періоду очікуваної базової лінії, за 28 днів перед Відвідуванням 2 (рандомізація). Придатні для включення суб'єкти, що не приймали ніяких профілактичних лікарських засобів для лікування своєї мігрені, не мали потреби проходили Період виведення, а починали одразу з Періоду очікуваної базової лінії. Під час Базового Відвідування 2 (День 1) аналізували зареєстровану інформацію про головний біль/лікування. Для того, щоб бути придатними для рандомізації для участі у випробуваннях, суб'єкти повинні були мати від 3 до 12 епізодів мігрені, але не більш ніж 15 днів (мігренозного та немігренозного) головного болю протягом 28 днів перед Відвідуванням 2. Головна подвійно-сліпа фаза: Суб'єктів, що закінчили Базову фазу та відповідали критеріям включення, рандомізували до однієї з чотирьох груп лікування: 50мг/добу топірамату, 100мг/добу топірамату, 200мг/добу топірамату чи плацебо. Головна подвійно-сліпа фаза мала два періоди: Титрування та Підтримання, які описані далі: Період титрування: Період титрування йшов негайно за Базовою фазою та тривав вісім тижнів (56 днів). Протягом цього періоду суб'єкти, рандомізовані до груп топірамату, починали приймати ліки з дози 25мг/добу, і добову дозу збільшували на 25мг 33 щотижня, поки вони не досягали встановленої для них дози (або максимальної стерпної дози, залежно від того, яка з них є меншою). Суб'єкти, рандомізовані до групи пропанололу, починали з дози 20мг/добу і збільшували добову дозу на 20мг щотижня, поки вони не досягали встановленої для них дози (або максимальної стерпної дози, залежно від того, яка з них є меншою). Починаючи з третього тижня Титрування до кінця Періоду підтримання було дозволено зробити максимум два зниження рівня дози при виникненні проблем непереносимості. Якщо суб'єкт після зниження дози знаходився ще у Періоді титрування, то робилася спроба повторного збільшення дози з метою досягнення призначеної для суб'єкта дози і, якщо ця спроба була невдачною, дозу знов знижували до початкової зниженої дози. Суб'єкти, яким було двічі зменшено передбачену у дослідженнях дозу лікарського засобу, і які все ще мали неприйнятні проблеми непереносимості, що вимагали додаткового зниження дози, виходили з досліджень, або переходили до додаткової фази відкритого лікування, на якій проводилося подальше регулювання їхньої дози. Відвідування клініки відбувалися в День 29 (Відвідування 3) та День 57 (Відвідування 4/Кінець титрування). Період підтримання: Протягом цього 18-тижневого періоду суб'єкти залишалися на дозі дослідного лікарського засобу, досягнутій на кінець Періоду титрування (призначена доза чи максимальна переносима доза). Якщо у суб'єкта виникали неприйнятні проблеми непереносимості, дозу зменшували, але для Головної фази в цілому (Титрування плюс Підтримання) було дозволено не більш ніж два зниження дози. Повторне збільшення дози протягом Періоду підтримання не було дозволено, тобто, суб'єкт продовжував одержувати зменшену дозу протягом решти періоду. Суб'єкти, для яких дозу дослідного засобу вже було знижено на два рівня, і які все ще мали неприйнятні проблеми непереносимості, що вимагали додаткового зниження дози, виходили з випробувань. Клінічні відвідування відбувалися в День 83 (Відвідування 5), День 113 (Відвідування 6), День 141 (Відвідування 7) та День 183 (Відвідування 8/Останнє відвідування головної подвійно-сліпої фази чи Достроковий вихід). Вважалося, що суб’єкти закінчили Головну подвійно-сліпу фазу, якщо вони завершили всі 26 тижнів Фази (8 тижнів Титрування та 18 тижнів Підтримання) без дострокового припинення дослідного курсу лікування. Лише суб'єкти, які завершили всі 26 тижнів Головної фази, одержували можливість перейти до Додаткової сліпої фази. Суб'єкти, що з будь-якої причини вийшли з Головної фази або вирішили не переходити до Додаткової сліпої фази, завершували Фазу поступового зменшення дози/виходу. Додаткова сліпа фаза: Під час цієї фази суб'єкти залишалися на своєму дослідному курсі лікування, на тій самій дозі, що була досягнута ними у Головний фазі, протягом шести місяців, або до їхнього виходу з 81110 34 випробувань, або до припинення досліджень. Протягом цієї фази суб'єктам не дозволялося змінювати дозу дослідного курсу лікування. У цій фазі суб'єкти проходили огляд щоквартально (Відвідування 10 та 11/Останнє відвідування додаткової сліпої фази). Вважалося, що суб'єкти закінчили Головну подвійно-сліпу фазу, якщо вони завершили всі шість місяців Фази без дострокового припинення дослідного курсу лікування. Фаза поступового зменшення дози/виходу: Суб'єктам, що виходять з досліджень, поступово зменшували дозу дослідних ліків. Якщо суб'єкти виходили з досліджень протягом Головної подвійно-сліпої фази (Періоди титрування чи підтримання), їм зменшували дозу дослідних ліків у сліпий спосіб. Тривалість періоду зменшення дози складала до семи тижнів, але змінювалася у залежності від досягнутої для суб'єкта дози. Суб'єктам, які виходили з досліджень під час Додаткової сліпої фази, дозу лікарського засобу зменшували згідно з рекомендованим графіком зниження дози. Досліднику було дозволено прискорювати зменшення дози, якщо для цього були клінічні показання у окремих суб'єктів. Контрольне відвідування (Відвідування 9 Головної фази та Відвідування 12 Додаткової сліпої фази) відбувалося протягом одного тижня після припинення всіх дослідних курсів лікування. Схема дозування та введення Суб'єкти були рандомізовані до однієї з чотирьох дослідних груп: 100мг/добу топірамату, 200мг/добу топірамату, 160мг/добу пропанололу чи плацебо. Всі суб'єкти одержували дослідні ліки за схемою введення двічі на день (b.i.d.), за винятком першого тижня Титрування, протягом якого вони приймали разові дози вечором. Супутня терапія Ідеально, в ході цих досліджень не повинні були використовуватися ніякі лікарські засоби, крім дослідних ліків та дозволених лікарських засобів, вказаних у протоколі. Через можливий підвищений ризик утворення ниркових каменів від приймання таких лікарських засобів: ацетазоламід, зонісамід та триамтрен, було рекомендовано не застосовувати їх у поєднанні з курсом лікування топіраматом. Було також рекомендовано не використовувати в цих дослідженнях основних транквілізаторів (нейролептиків) трициклічних антидепресантів, інгібіторів моноаміноксидази (МАО) чи симпатоміметиків центральної дії (наприклад, декстроамфетамінсульфат [Dexedrine]). Засоби невідкладного лікування Відповідно до належної практики гамування болю, суб'єктам, залученим до цих випробувань, було дозволено приймати абортивні/швидкодіючі лікарські засоби, показані для лікування епізодів мігрені. Тип та кількість використовуваних засобів невідкладного лікування реєструвалися суб'єктами у журналі запису головного болю/невідкладного лікування. 35 Дозволені засоби для лікування гострих симптомів включають такі, з рекомендованою частотою приймання доз: Протиблювотні засоби (при необхідності) (р.r.n.) Не більш ніж 15 днів за місяць: ацетилсаліцилова кислота (крім випадків, коли її призначено для профілактики серцево-судинної хвороби), ацетамінофен, нестероїдні протизапальні агенти, ізометептанмукат та ацетамінофен, буталбітал з аспірином та кофеїном, буталбітал з ацетамінофеном та кофеїном. Не більш ніж 8 днів/місяць: кодеїн, похідні кодеїну та триптани (при введенні ін'єкцією, орально чи за допомогою назального спрею). Не більш ніж 6 днів/місяць: сильнодіючі наркотичні засоби, такі як демерол/морфін. Не більш ніж 2 дня/місяць: кортикостероїди при виявах мігренозного стану. Не більш ніж 8 днів/місяць: дигідроерготамінмузилат, ерготамінтартрат (менше 10/тиждень чи 3/день). Якщо використання швидкодіючих лікарських засобів перевищувало вказану частоту, розглядалася можливість виходу суб'єкта з досліджень через недостатню ефективність (якщо суб'єкт завершив всі вісім тижнів титрування, він мав можливість вступити до Додаткової відкритої фази). Недозволені засоби абортивного/невідкладного лікування включали такі: інші антиконвульсанти, трициклічні засоби, селективні інгібітори повторного поглинання серотоніну (SSRI) (могли використовуватися лише в постійній дозі для лікування діагностованої депресії), основні транквілізатори, черезшкірні стимулятори, бета-блокатори, заборонені наркотичні засоби, пропанолол, .блокатори кальцієвих каналів, метисергід, препарати рослинного походження, гадано придатні для терапії головного болю (приклади: Fever Few, St. John's Wort), кортикостероїди, місцеві анестетики, ін'єкції ботулотоксину, використовувані для повсякденного лікування головного болю, та рибофлавін. Огляди під час випробувань Фізичний огляд (включаючи ріст) та неврологічний огляд проводилися на початку та наприкінці досліджень. На початку досліджень також записували базову електрокардіограму. Основні показники стану організму та вагу реєстрували при кожному клінічному відвідуванні. Небажані ефекти реєстрували після початку приймання дослідних лікарських засобів і контролювали до їхнього зникнення чи до досягнення клінічно стабільної кінцевої точки. Клінічні лабораторні тести для всіх суб'єктів та тести сечі на виявлення вагітності у жінок дітородного віку проводили з визначеними інтервалами часу протягом досліджень. Оцінку якості життя здійснювали під час Відвідувань 2 (День 1), 4 (День 57/Кінець титрування), 6 (День 113) та 8 (День 183/Останнє відвідування Головної подвійно-сліпої фази/Достроковий вихід з 81110 36 досліджень). Інформацію щодо Користування ресурсами системи охорони здоров'я реєстрували під час Відвідувань з 3 по 8. Випадки будь-якого головного болю чи аур, тяжкість та симптоматику будь-яких мігренозних болів і використання засобів невідкладного лікування переносили з журналів спостереження за головним болем суб'єктів до їхніх історій хвороби при кожному відвідуванні. Після Базового відвідування 1, суб'єкти поверталися для запланованих відвідувань у межах вікна розміром +/-3 дні до початку щоквартальних відвідувань (Додаткова сліпа фаза), коли розмір вікна становив +/-2 тижні. Оцінки ефективності Оцінки ефективності були основані на інформації, записаній у журналах реєстрації головного болю/невідкладного лікування суб'єктів, та результатах оцінки зв'язаної зі станом здоровья якості життя (HRQL). В журналах реєстрації головного болю/невідкладного лікування суб'єкти протягом його/її участі у дослідженнях документували таке: епізоди та тривалість головного болю (та аур, якщо головний біль не виникав), тяжкість мігренозного болю та асоційованих симптомів, а також використання лікарських засобів, прийнятих для полегшення мігренозного болю чи симптомів (або прийнятих під час аури для полегшення симптомів чи попередження мігренозного болю). Оцінки зв'язаної зі станом здоровья якості життя (HRQL) проводилися з визначеними інтервалами протягом досліджень (див. Календарний план та графік подій, сторінка 9) суб'єктами, що досягли віку 18 років чи старше на момент включення до випробувань. Для оцінки HRQL використовували два інструменти Запитальник мігреньспецифічної якості життя (MSQ), та Коротка форма-36 (SF-36) досліджень медичних наслідків. Критерії ефективності Первинним критерієм ефективності було зниження числа епізодів мігрені за місяць (28 днів) під час Головної подвійно-сліпої фази у порівнянні з 28-денним Очікуваним базовим періодом. Вторинні критерії ефективності включали процент суб'єктів, що реагували на лікування (зниження частоти щомісячних (за 28 днів) епізодів мігрені на 50% чи більше) та зниження у Головній подвійно-сліпій фазі порівняно з Очікуваним базовим періодом а) днів мігрень за місяць, b) щомісячної частоти всіх типів головного болю, с) середньої тривалості мігрені, d) використання засобів невідкладного лікування, с) середньої тяжкості мігренозного головного болю і f) середньої тяжкості мігрень-асоційованих симптомів (нудота, блювота, фотофобія, фонофобія). До вторинних критеріїв ефективності також був включений ефект профілактичного лікування топіраматом порівняно з плацебо на мігрень-специфічні показники зв'язаної зі станом здоров'я якості життя (HRQL) та показники якості життя SF-36, а також кореляція між HRQL та частотою мігреней. В ході досліджень були також одержані дані з безпеки та ефективності для порівняння 37 топірамату (100 та 200мг/добу) і пропанололу (160мг/добу) при профілактичному лікуванні мігрені. Коротка форма-36 досліджень медичних наслідків (SF-36) є найчастіше застосовною загальною мірою HRQL у пацієнтів з мігренню і використовувалася у кількох дослідженнях мігрені. SF-36 є запитальником з 36 пунктами, розбитими на вісім областей. Було показано, що SF-36 дає надійні та достовірні результати для різноманітних популяцій пацієнтів, а також для пацієнтів з мігренню. Запитальник щодо мігрень-специфічної якості життя (MSQ), розроблений фірмою Glaxo Wellcome, також був застосований в цих клінічних випробуваннях. MSQ є хвороба-специфічним інструментом, розробленим для оцінки якості життя застосовно до мігрені. Поточна версія (2.1) має 14 пунктів, розбитих на три області. MSQ найчастіше використовувався в опублікованих клінічних випробуваннях способів лікування мігрені і продемонстрував свою надійність, достовірність та чутливість. Завершення Вважалося, що суб’єкти завершили Головну подвійно-сліпу фазу, якщо вони закінчили всі 26 тижнів Фази (8 тижнів Титрування плюс 18 тижнів Підтримання) без дострокового припинення дослідного курсу лікування. Суб’єкти, які вийшли з досліджень з будь-яких причин до закінчення цієї фази, вважалися такими, що не завершили курс. Вважалося, що суб'єкти закінчили Додаткову сліпу фазу, якщо вони завершили всі шість місяців фази без дострокового припинення дослідного курсу лікування. Участь суб'єкта у дослідженнях могла бути припинена до закінчення Головної подвійно-сліпої фази через будь-яку з таких причин: небажані ефекти, рішення суб'єкта, втрата супроводження, недостатня ефективність, або інше. Якщо суб'єкт виходив з випробувань до їхнього закінчення, то причина виходу документувалася у CRF та у вихідному документі. Параметри оцінки ефективності Первинною кінцевою точкою ефективності була зміна частоти щомісячних (за 28 днів) епізодів мігрені у Головній подвійно-сліпій фазі порівняно з Очікуваним базовим періодом. Подвійно-сліпа фаза включала Періоди титрування та підтримання. Вторинні кінцеві точки ефективності включали процентну частку суб'єктів, що відповідали на лікування (визначено як зниження частоти щомісячних епізодів мігрені у Головній подвійносліпій фазі порівняно з Очікуваним базовим періодом на 50% чи більше); зміну числа днів мігрені за місяць (28 днів) у Головній подвійносліпій фазі порівняно з Очікуваним базовим періодом; зміну щомісячної (28 днів) частоти всіх типів головного болю у Головній подвійно-сліпій фазі порівняно з Очікуваним базовим періодом; зміну середньої тривалості епізодів мігрені у Головній подвійно-сліпій фазі порівняно з Очікуваним базовим періодом; зміну числа днів за місяць (28 днів), що потребували застосування 81110 38 засобів невідкладного лікування у Головній подвійно-сліпій фазі порівняно з Очікуваним базовим періодом; зміну середньої тяжкості мігренозного головного болю у Головній подвійносліпій фазі порівняно з Очікуваним базовим періодом; і зміну середньої тяжкості мігреньасоційованих симптомів (нудота, блювота, фотофобія, фонофобія) у подвійно-сліпій фазі порівняно з базовою фазою. Інші вторинні змінні ефективності включали мігрень-специфічні показники зв'язаної зі станом здоров'я якості життя (MSQOL) та показники якості життя SF-36. Оцінка ефективності: Ефективність топірамату у профілактиці рецидивуючих епізодів мігрені було спочатку продемонстровано тим, що групи, які одержували дози топірамату (100мг та/або 200мг/добу) мали кращі за групу плацебо показники зміни частоти щомісячних (за 28 днів) епізодів мігрені у подвійносліпій фазі порівняно з базовою фазою. Крім того, було включено групу лікування пропранололом з метою одержання даних для оцінки відносної ефективності курсів лікування топіраматом та пропранололом. Аналізи для оцінки ефективності топірамату 100мг та 200мг порівняно з плацебо: Статистичні аналізи були основані у першу чергу на принципі наміру лікування. Такі аналізи наміру лікування включали всіх рандомізованих суб'єктів, які щонайменше один раз надали дані та приймали лікарській засіб протягом Подвійносліпої фази. Відсутні дані заповнювали шляхом перенесення уперед останнього значення (LVCF). Первинну кінцеву точку ефективності - зміну частоти щомісячних епізодів мігрені у Головній подвійно-сліпій фазі порівняно з Очікуваним базовим періодом - оцінювали за лінійною моделлю з використанням коефіцієнтів для базового значення, лікування, дослідного центра та взаємодії лікування-центр. Порівняння доз топірамату з плацебо здійснювали з використанням перевірки на тренд за ТукіЦімінера-Гейзе (Tukey-Ciminera-Heyse), яка є процедурою пошагового знижування, що включає на першій стадії всі дози топірамату та плацебо. Якщо був виявлений значущий тренд у відповідь на дозу, то доза 200мг вважалася значущо відмінною від плацебо і виключалася з перевірки на тренд для дози 100мг, яка включала дози 100мг та плацебо. Ця перевірка на тренд дозволяє виявляти помилки першого роду загального порівняння при визначенні рівня мінімально ефективної дози для кожної кінцевої точки ефективності. Результати визначення вторинних кінцевих точок ефективності використовувалися для підтвердження висновку, основаного на первинній кінцевій точці ефективності. Взаємодію лікування-центри аналізували при рінні значущості 0,10. Всі вторинні кіпцеві точки (за винятком процентної частки суб'єктів, що реагували на лікування) оцінювали у такий саме спосіб, як і первинні кінцеві точки. Процентну частку суб'єктів, що реагували на лікування, аналізували з використанням процедури перевірки на тренд за 39 Кохраном-Армітейджем (Cochran-Armitage). Аналізували несуперечливість доза-асоційованих ефектів лікування топіраматом для різних підгруп (стать, вік і т.д.). Порівняння пропранололу та плацебо з метою визначення чутливості аналізу: Групу пропранололу порівнювали з групою плацебо на основі даних для первинних кінцевих точок на підтвердження чутливості аналізу даних досліджень. Оцінка ефективності топірамату 100мг та 200мг порівняно з пропранололом 160мг/добу: Підсумкові статистичні дані щодо зміни частоти щомісячних епізодів мігрені та 95% довірчий інтервал для різниці між групою топірамату (100мг та 200мг) і групою пропранололу були одержані для оцінки подібності ефективності. Визначення розміру вибірки Розмір вибірки у 120 суб'єктів в групі забезпечував 95% потужність виявлення 1,19кратної відмінності у зміні частоти епізодів мігрені порівняно з базовою лінією між будь-якими двома групами лікування, при спільному стандартному відхиленні 2,50. Використання значення 2,50 було результатом оцінки стандартного відхилення величини зміни частоти епізодів мігрені порівняно з базовою лінією. Таким чином, для лікування та/або попередження мігрені та/або будь-якої асоційованої нудоти, блювоти, фотофобії, фонофобії чи інших симптомів, одна чи кілька сполук формули (І) можуть бути введені як комбінована терапія з одним чи кількома протимігренозними агентами. Краще, комбінована терапія включає введення терапевтично ефективної кількості сполуки, вибраної з групи, що складається з антидепресантів, бета-блокаторів та триптанів, з топіраматом. Ще краще, комбінована терапія включає введення терапевтично ефективної кількості топірамату та триптану. Якщо сполука формули (І) є топіраматом, то топірамат, краще, вводять у кількості в інтервалі від приблизно 10 до приблизно 650мг за добу, ще краще, у кількості в інтервалі від приблизно 25 до приблизно 325мг один чи два рази на день. Топірамат зараз випускається у вигляді разових дозованих форм по 15мг, 25мг, 100мг та 200мг. Хоч наведений вище опис розкриває принципи даного винаходу, а приклади наведені для ілюстрації, слід розуміти, що практика за винаходом охоплює всі звичайні варіанти, адаптації та/або модифікації, що входять до обсягу наведених нижче пунктів формули винаходу та їхніх еквівалентів. 81110 40
ДивитисяДодаткова інформація
Назва патенту англійськоюCo-therapy with a topiramate and triptan for the treatment of migraine or nausea, photophobia, phonophobia associated with migraine
Автори англійськоюLivingstone Ian R.
Назва патенту російськоюКомбинированная терапия топираматом и триптаном мигрени или дурноты, фотофобии и фонофобии, связанных с мигренозной головной болью
Автори російськоюЛивингстон Иан Р.
МПК / Мітки
МПК: A61K 31/405, A61P 25/06, A61K 31/35
Мітки: нудоти, триптаном, мігренозним, мігрені, головним, пов'язаних, топіраматом, фонофобії, терапія, фотофобії, болем, комбінована
Код посилання
<a href="https://ua.patents.su/20-81110-kombinovana-terapiya-topiramatom-ta-triptanom-migreni-abo-nudoti-fotofobi-i-fonofobi-povyazanikh-z-migrenoznim-golovnim-bolem.html" target="_blank" rel="follow" title="База патентів України">Комбінована терапія топіраматом та триптаном мігрені або нудоти, фотофобії і фонофобії, пов’язаних з мігренозним головним болем</a>
Попередній патент: Сигаретний фільтр з кулястим вугіллям
Наступний патент: Застосування інгібітора мікроглії для одержання засобу, який проявляє інгібуючу активність щодо продукування інтерлейкіну 12 і g-інтерферону (варіанти)
Випадковий патент: Турбосиловий витратомір












