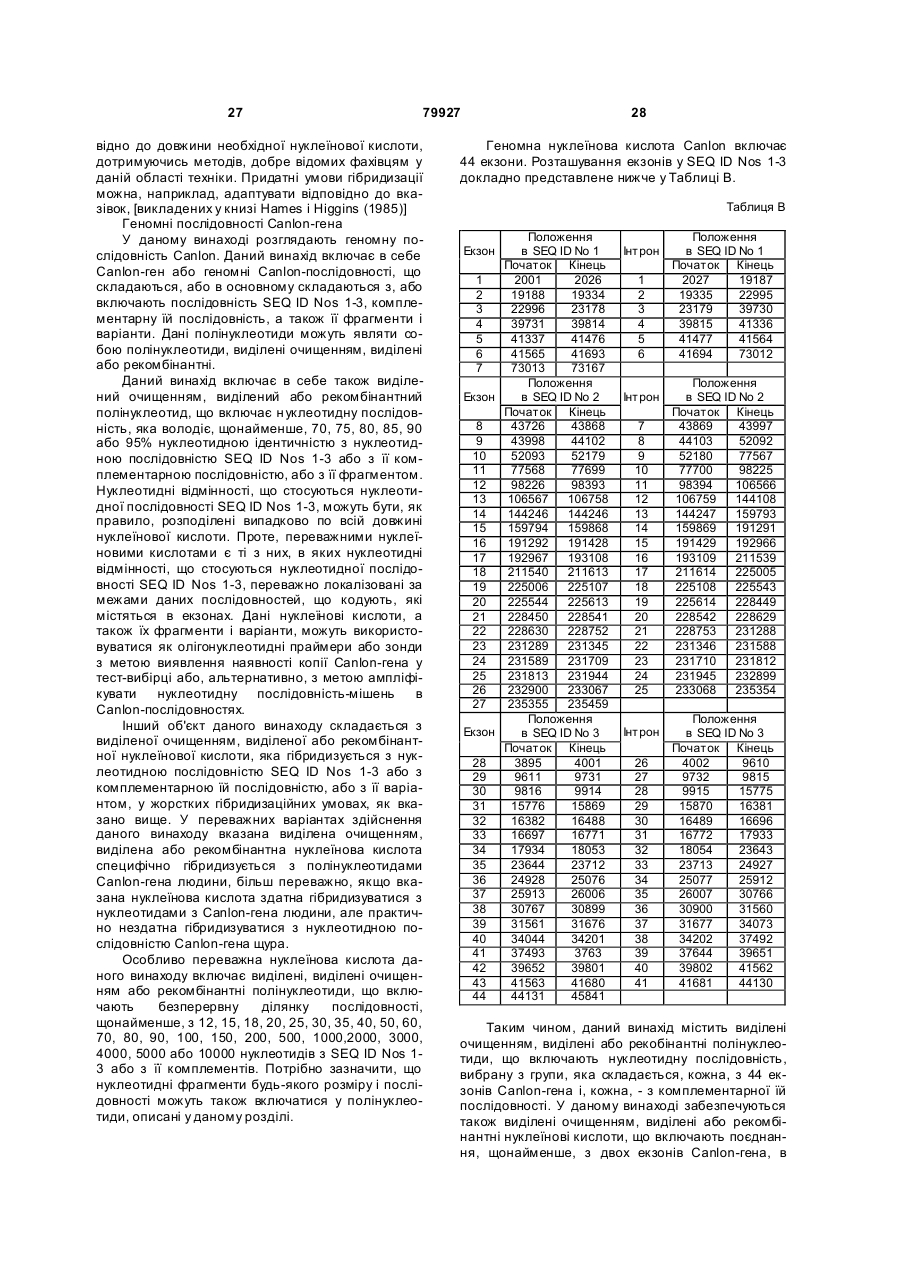
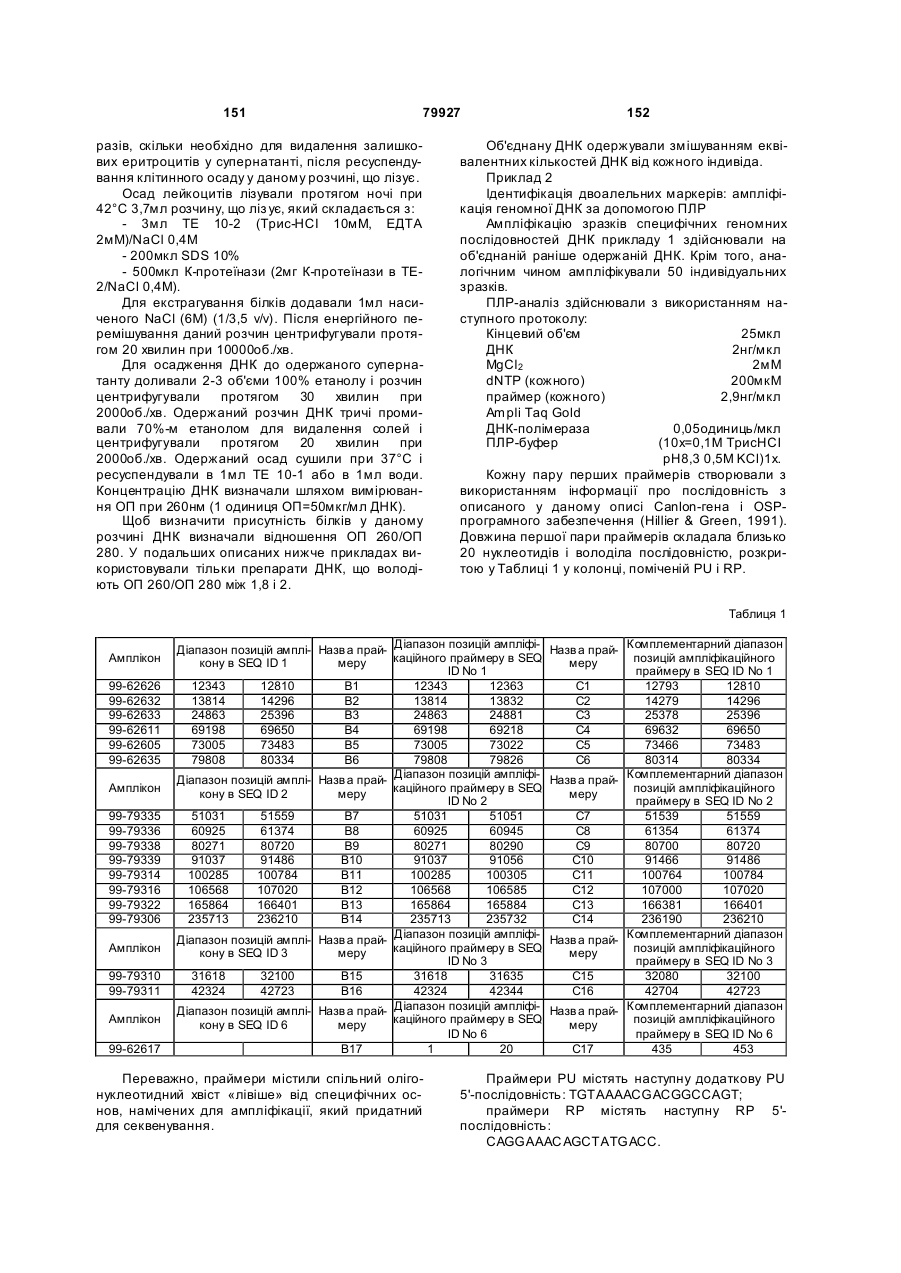
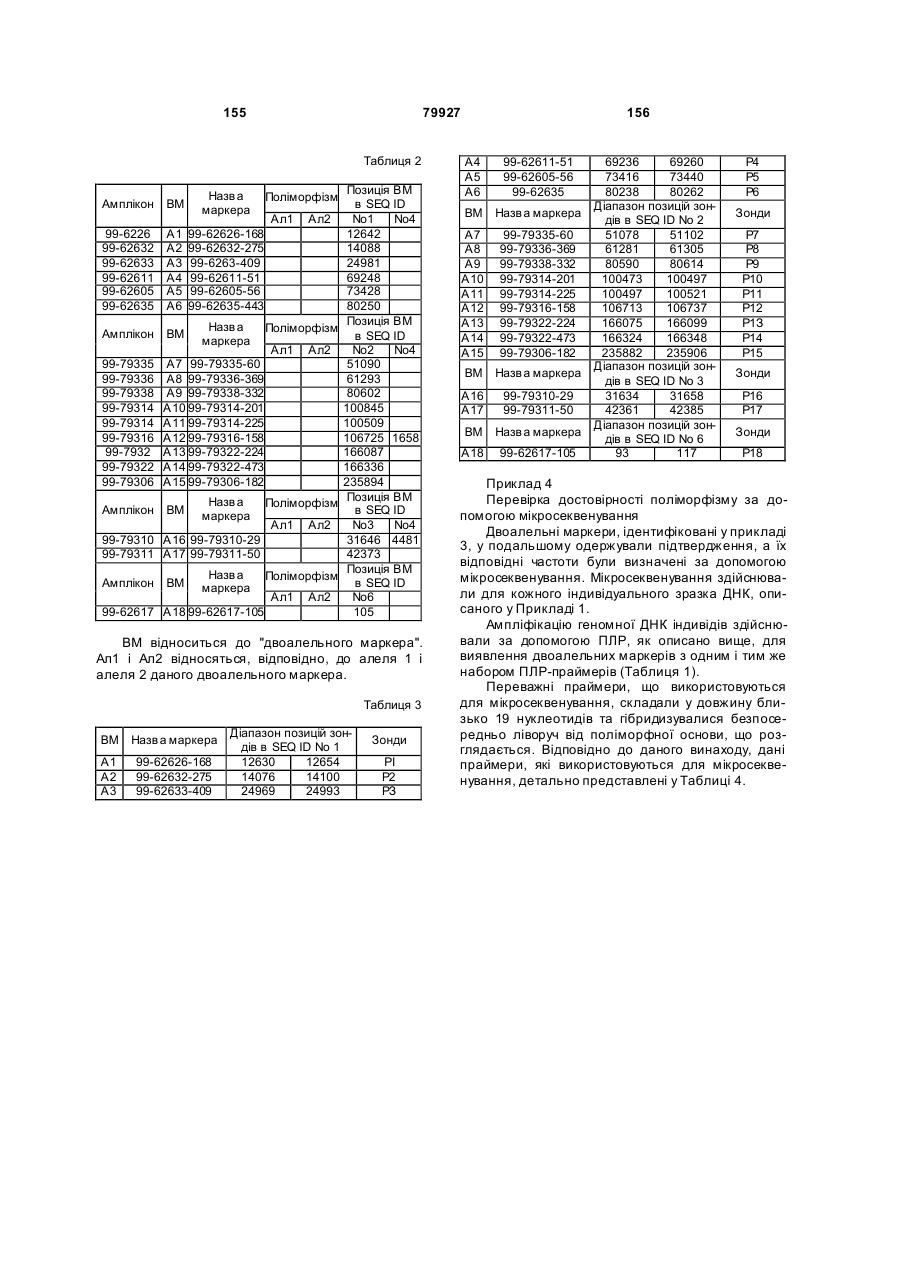
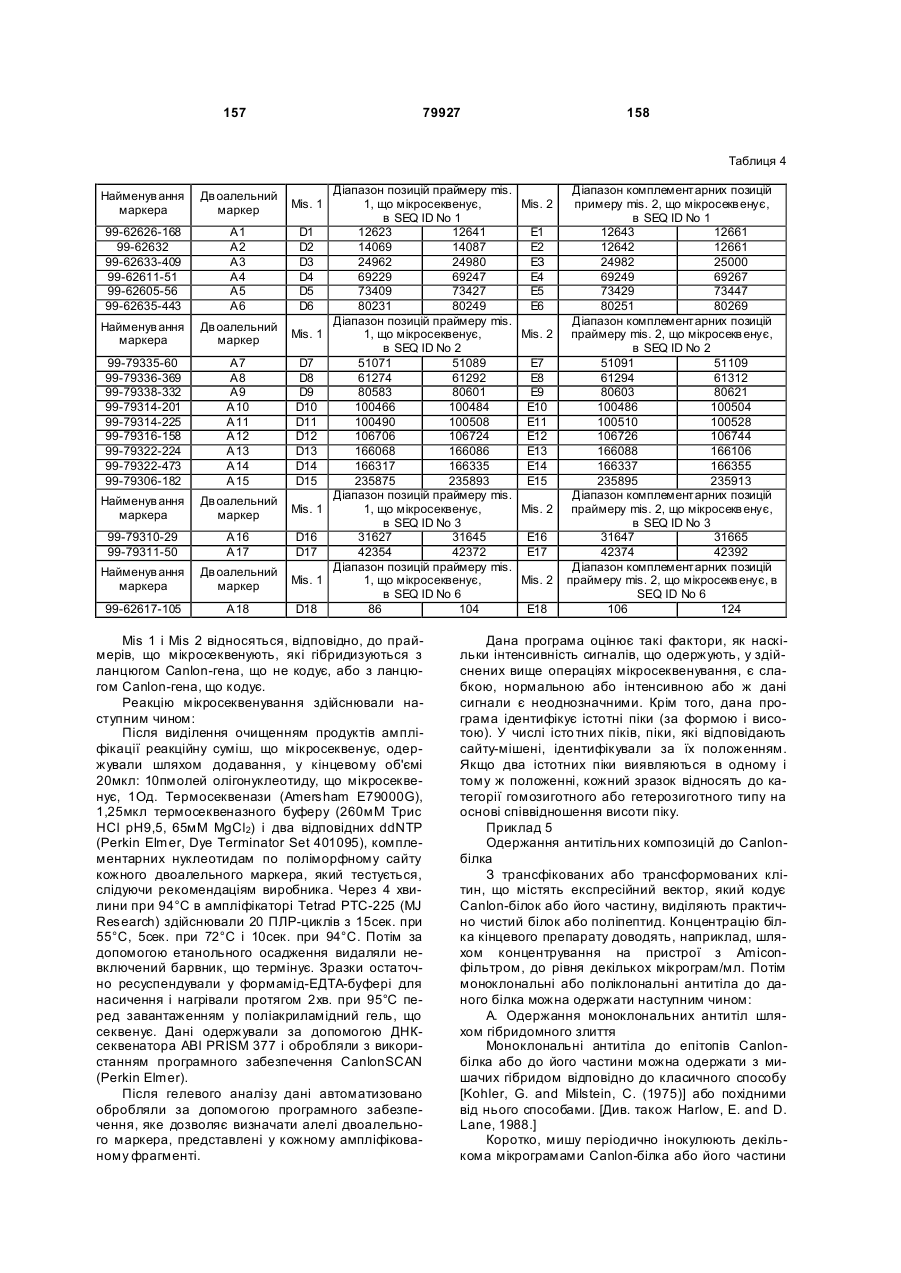
Полінуклеотид, що кодує поліпептид потенціалзалежного ворітного іонного каналу людини (canion), поліпептид, антитіло, спосіб ідентифікації кандидатного модулятора canion-поліпептиду, спосіб лікування біполярног
Номер патенту: 79927
Опубліковано: 10.08.2007
Автори: Коен Даніель, Чумаков Ілья, Абдеррахім Хаді, Сімон Анн-Марі
Формула / Реферат
1. Виділений, очищений або рекомбінантний полінуклеотид, який кодує поліпептид потенціалзалежного ворітного іонного каналу людини (CanIon),
a) що складається з будь-якої з нуклеотидних послідовностей, представлених як SEQ ID NO: 1-3; або
b) що складається з:
і) нуклеотидної послідовності, представленої як SEQ ID NO: 4,
іі) послідовності, комплементарної будь-якій з послідовностей (а); або
ііі) полінуклеотиду, що кодує поліпептид, який містить амінокислотну послідовність SEQ ID NO: 5.
2. Полінуклеотид за п.1, прикріплений до твердого носія та/або мітки.
3. Рекомбінантний вектор, що включає полінуклеотид за п. 1
4. Клітина-хазяїн, яка включає рекомбінантний вектор за п. 3.
5. Тварина-хазяїн, що не є людиною, що включає рекомбінантний вектор за п. 3, де твариною-хазяїном, зокрема, є ссавець.
6. Клітина ссавця-хазяїна, що не є людиною, що включає СаnIon-ген, який відповідає послідовностям SEQ ID NO: 1-3 або 4, розірваний гомологічною рекомбінацією за допомогою нокаутного вектора.
7. Виділений, очищений або рекомбінантний поліпептид потенціалзалежного ворітного іонного каналу людини, який включає амінокислотну послідовність SEQ ID NO 5.
8. Спосіб одержання поліпептиду, який включає:
a) створення популяції клітин, які включають полінуклеотид, що кодує поліпептид за п. 7, функціонально приєднаний до промотору;
b) культивування вказаної популяції клітин в умовах, придатних для одержання у вказаних клітинах вказаного поліпептиду; і
c) виділення очищенням вказаного поліпептиду з вказаної популяції клітин.
9. Антитіло або його антигензв'язуючий фрагмент, що специфічно зв'язують поліпептид за п. 7.
10. Антитіло за п. 9, яке є химерним, гуманізованим або людським моноклональним антитілом.
11. Спосіб ідентифікації кандидатного модулятора СаnIon-поліпептиду, що включає:
a) контактування поліпептиду за п. 7 з тест-сполукою; і
b) визначення специфічного зв'язування вказаної сполуки з вказаним поліпептидом;
де виявлення того, що вказана сполука специфічно зв'язується з вказаним поліпептидом свідчить про те, що вказана сполука є кандидатним модулятором вказаного СаnIon-поліпептиду.
12. Спосіб за п.11, що включає, крім того, тестування активності іон-каналу вказаного СаnIon-поліпептиду у присутності вказаного кандидатного модулятора, де відмінність в активності вказаного СаnIon-поліпептиду у присутності вказаного кандидатного модулятора у порівнянні з активністю за відсутності вказаного кандидатного модулятора свідчить про те, що даний кандидатний модулятор являє собою модулятор вказаного СаnIon-поліпептиду.
13. Спосіб за п. 11, де спосіб придатний для ідентифікації модулятора для лікування шизофренії або біполярного розладу.
14. Спосіб ідентифікації модулятора СаnIon-поліпептиду, що включає:
a) контактування поліпептиду за п. 7 з тест-сполукою; і
b) виявлення активності іон-каналу вказаного поліпептиду в присутності і за відсутності вказаної сполуки;
де виявлення відмінності у вказаній активності в присутності вказаної сполуки у порівнянні з активністю за відсутності вказаної сполуки свідчить про те, що вказана сполука являє собою модулятор вказаного СаnIon-поліпептиду.
15. Спосіб за п. 14, де спосіб придатний для ідентифікації модулятора для лікування шизофренії або біполярного розладу.
16. Застосування антитіла за будь-яким з пп. 9, 10 для виробництва ліків для лікування шизофренії або біполярного розладу.
17. Спосіб лікування біполярного розладу або шизофренії, що включає введення антитіла за будь-яким з пп. 9, 10 пацієнту, який цього потребує.
Текст
1. Виділений, очищений або рекомбінантний полінуклеотид, який кодує поліпептид потенціалзалежного ворітного іонного каналу людини (CanIon), 2 (19) 1 3 79927 4 c) виділення очищенням вказаного поліпептиду з вказаної популяції клітин. 9. Антитіло або його антигензв'язуючий фрагмент, що специфічно зв'язують поліпептид за п.7. 10. Антитіло за п.9, яке є химерним, гуманізованим або людським моноклональним антитілом. 11. Спосіб ідентифікації кандидатного модулятора СаnIon-поліпептиду, що включає: a) контактування поліпептиду за п.7 з тестсполукою; і b) визначення специфічного зв'язування вказаної сполуки з вказаним поліпептидом; де виявлення того, що вказана сполука специфічно зв'язується з вказаним поліпептидом свідчить про те, що вказана сполука є кандидатним модулятором вказаного СаnIon-поліпептиду. 12. Спосіб за п.11, що включає, крім того, тестування активності іон-каналу вказаного СаnIonполіпептиду у присутності вказаного кандидатного модулятора, де відмінність в активності вказаного СаnIon-поліпептиду у присутності вказаного кандидатного модулятора у порівнянні з активністю за відсутності вказаного кандидатного модулятора свідчить про те, що даний кандидатний модулятор являє собою модулятор вказаного СаnIonполіпептиду. 13. Спосіб за п.11, де спосіб придатний для ідентифікації модулятора для лікування шизофренії або біполярного розладу. 14. Спосіб ідентифікації модулятора СаnIonполіпептиду, що включає: a) контактування поліпептиду за п.7 з тестсполукою; і b) виявлення активності іон-каналу вказаного поліпептиду в присутності і за відсутності вказаної сполуки; де виявлення відмінності у вказаній активності в присутності вказаної сполуки у порівнянні з активністю за відсутності вказаної сполуки свідчить про те, що вказана сполука являє собою модулятор вказаного СаnIon-поліпептиду. 15. Спосіб за п.14, де спосіб придатний для ідентифікації модулятора для лікування шизофренії або біполярного розладу. 16. Застосування антитіла за будь-яким з пп.9, 10 для виробництва ліків для лікування шизофренії або біполярного розладу. 17. Спосіб лікування біполярного розладу або шизофренії, що включає введення антитіла за будьяким з пп.9, 10 пацієнту, який цього потребує. Даний винахід відноситься до гена і білка потенціал-залежного ворітного іонного каналу та до їх ролі у захворюванні. Даний винахід відноситься до полінуклеотидів, які кодують поліпептид Canlon, а також до регуляторних ділянок, локалізованих на 5'- і 3'-кінці вказаної ділянки, що кодує. Даний винахід відноситься також до поліпептидів, які кодуються Canlon-геном. У даному винаході розроблені способи скринування модуляторів, тобто антагоністів Canlon-каналу, і способи використання таких модуляторів для лікування або попередження різних порушень або станів. У даному винаході розглядаються також антитіла, специфічні проти таких поліпептидів, які придатні як діагностичні реагенти. Крім того, даний винахід включає двоалельні маркери Canlon-гена, придатні для генетичного аналізу. Досягнення у те хнічному оснащенні лабораторій, які займаються фундаментальними та клінічними дослідженнями, великою мірою сприяли більш глибокому вивченню впливу головного мозку і нервової системи на здоров'я та хвороби. Запропонований ряд нейробіологічних і фармакологічних гіпотез по відношенню до нейрохімічних і генетичних механізмів, які мають місце при порушеннях центральної нервової системи (ЦНС), що включають психічні порушення та нейродегенеративні захворювання. Однак порушення ЦНС характеризуються складним і недостатнім розумінням етіології, а також симптоми, які перекриваються, погано описані, і важкі для вимірювання. У результаті, майбутні схеми лікування та зусилля по створенню ліків потребують вдосконалення і зосередження уваги на мультигенних причинах, а це вимагає проведення нових демографічних досліджень захворювань і одержання більш точної діагностичної і прогностичної інформації про пацієнтів, які страждають порушеннями ЦНС. Порушення ЦНС охоплюють широкий ряд розладів і відповідну широку гр упу генетичних факторів. Приклади розладів ЦНС включають нейродегенеративні порушення, психотичні розлади, розлади в емоційному стані, аутизм, залежність від хімічних речовин і алкоголізм, порушення больових відчуттів, епілепсію, затримку психічного розвитку та інші психічні захворювання, включаючи когнітивну функцію, страх, порушення функції приймання їжі, порушення функції мотивації і аномалії характеру. Порушення можна визначити, використовуючи класифікацію Diagnosis and Statistical Manual of Mental Disorders fourth edition (Діагностичний і Статистичний Довідник Психічних Порушень) (DSM-IV). Навіть при розгляді всього лише невеликої підгрупи порушень ЦНС очевидно, що через нестачу адекватного лікування і для осмислення молекулярної основи порушень при шизофренії та біполярному розладі, потрібні нові цілі для терапевтичної винахідливості і вдосконалення способів лікування. Що стосується шизофренії та біполярного розладу, всі зараз відомі молекули, які використовуються для їх лікування, володіють побічними ефектами і діють тільки проти симптомів даного захворювання. Існує, таким чином, дуже велика потреба у нових молекулах, не зв'язаних з побічними ефектами і направлених проти мішеней, які залучені до причинних механізмів шизофренії та біполярного розладу. Тому, інстр умента 5 79927 льні засоби, які полегшують відкриття і характеристику даних цілей, необхідні та корисні. Потенціал-залежні ворітні іонні канали Потенціал-залежні ворітні іонні канали є частиною великого сімейства макромолекул, функції яких включають контроль і підтримку електричного потенціалу клітинних мембран, виділення і трансдукцію сигналу. Ці білки-канали беруть участь у контролі вивільнення нейромедіаторів з нейронів і грають істотну роль у регуляції різноманітних клітинних функцій, включаючи мембранну збудливість, м'язове скорочення та синаптичну передачу. Основні альфа-субодиниці Nа+-каналів і альфа-1субодиниці Са+-каналів складаються, приблизно, з 2000 амінокислот і складають шлях протікання іонів. У біохімічному аналізі виявлено, що фізіологічно активний іонний канал складений з декількох різних субодиниць. Існує дві допоміжні субодиниці, бета-1- і бета-2-субодиниця, які очищуються спільно з альфа-субодиницею Nа+-каналів. Що стосується Са+-каналів, для них ідентифіковані додаткові субодиниці (альфа-2, бета, гамма та сигма) з модуляторною дією. Субодиниці альфа-2 і бета, схоже, посилюють функціональну активність альфа-1-субодиниці Са +-каналів. Альфа-субодиниці K+-каналів асоціюються з бета-субодиницями у співвідношенні 1:1, що приводить до ускладнення K+-каналів, які проявляють (альфа)4(бета)4 стехіометрію [Terlau і співавт., Naturwissenschaften 85: 437-444 (1998)]. Базова структура і приклади кальцієвих і натрієвих іонних каналів розглядаються, крім того, [наприклад, у Williams, і співавт., Science 257: 389-395 (1992); Mori, і співавт., Nature 350:398-402 (1991); і Koch, і співавт., J. Biol. Chem. 265 (29): 17786-17791 (1990)]. Нуклеотидна послідовність Са +- і Na+-іонного каналу щура володіє високим рівнем гомології з послідовністю Canlonканалу, потім описаного у [Lee і співавт., FEBS Lett. 445:231-236 (1999)]. Альфа-субодиниця володіє послідовністю, характерною для всіх потенціал-залежних катіонних каналів, і використовує один і той же структурний мотив, який включає пучок з 6 спіралей у доменах, що можливо пронизують мембрану. І у натрієвих, і у кальцієвих каналах даний мотив повторюється у вказаній послідовності 4 рази, утворюючи пучок з 24 спіралей. Дані амінокислотні послідовності висококонсервативні у видів (наприклад, людини і Drosophila), а також у різних іонних каналів. Існує декілька тканинноспецифічних ізоформ кальцієвих каналів, які фармакологічно та електрофізіологічно розрізняються, що кодуються окремими генами мультигенного сімейства. У скелетному м'язі кожна група з щільно зв'язаних альфа-, бета-і гамма-субодиниць асоційована з 4 іншими з утворенням п'ятичленної макромолекули. Наприклад, альфа-1-субодиниці кальцієвого каналу нейрона є продуктом, щонайменше, семи різних генів, які іменуються від А до Н. В імуноцитохімічних дослідженнях показаний різний розподіл альфа-1 6 субодиниць кальцієвого каналу. Аль фа-1А і альфа-1В експресуються головним чином у дендритах і пресинаптичних закінченнях, і альфа-1А звичайно концентрується у більшому числі нервових закінчень, в альфа-1B. У нервово-м'язовому з'єднанні щура і людини альфа-1А локалізується пресинаптично, тоді як альфа-1В, так і альфа-1А представлені в асоційованих з аксоном шванівських клітинах. Альфа-IE локалізується головним чином у клітинних тілах, у деяких випадках - у проксимальних дендритах, а також у дистальних відгалуженнях клітин Пуркін'є. Аль фа-1С і альфа-1D локалізуються у клітинних тілах і у проксимальних дендритах центральних нейронів. Нативні кальцієві канали класифікуються на основі їх фармакологічних і/або електрофізіологічних властивостей. Класифікація потенціалзалежних кальцієвих каналів розподіляє їх на канали, що активуються високим потенціалом (HVA), які включають типи L, Ν, Ρ і О; проміжні (IVA, Rтип); і ті, що активуються низьким потенціалом (LVA, Т-тип). [Morena і співавт., Annals NY Acad. Sci. 102-117 (1999)]. Основні субодиниці (альфа-1) відносяться до генного сімейства, члени якого можуть самі утворювати функціональні канали при експресії у гетерологічних експресійних системах [Zhang і співавт., Neuropharmacology 32(11): 1075-1088 (1993)], включений у даний опис за допомогою посилання). У нативних клітинах альфа-1субодиниці експресуються у вигляді мультисубодиничних комплексів разом з допоміжними субодиницями, які модифікують функціональні характеристики альфа-1-субодиниці. У багатьох випадках коекспресія допоміжних субодиниць впливає на біофізичні властивості даних каналів. Бета-субодиниці, зокрема, мають тенденцію до істотного впливу на альфа-1-субодиниці; було показано, що бета-субодиниці змінюють активаційні властивості, стаціонарну інактивацію, кінетику інактивації та максимальне протікання струму. Велику молекулярну різноманітність каналів одержують завдяки існуванню численних форм альфа-1-субодиниць. Наприклад, було показано, що по-різному сплайсовані форми кальцієвих каналів і експресуються по-різному і володіють різною чутливістю до фосфорилювання серинтреоніновими кіназами. [Hell і співавт., Annals NY Acad. Sci. 747:282-293 (1994)]. Встановлено, що мутації генів іонних каналів залучені до цілого ряду захворювань, включаючи деякі захворювання центральної нервової системи. Приклади мутацій іонних каналів, що викликають ряд епізодичних порушень, включаючи періодичний параліч, епізодичну атаксію, гемікранію, синдром подовження від інтервалу QT, пароксизмальну дискінезію, розглядаються в огляді [Bulman і співавт., Hum. Моl. Gen. 6(10): 1679-1685 (1997)]. Деякі порушення, зв'язані з мутацією Са +-каналу, представлені, наприклад, у Таблиці А (з Moreno, ви ще). 7 79927 8 Таблиця А Захворюв ання Сімейна геміплегічна мігрень Епізодична атаксія, тип 2 Спінально-церебелярна атаксія, тип 6 Фенотипи п'яного і безпорадного Синдром Ламберт-Ітона Гіпокаліємічний періодичний параліч Мишача дисплазія Діабетичні жиров і фенотипи Цукер Летаргічний фенотип 1 Злоякісна гіпотермія Неув ажність Модулятори кальцієвих і натрієвих каналів звичайно використовуються для лікування різних захворювань і станів. Наприклад, було показано, що блокатори кальцієвого і/або натрієвого каналу, придатні для лікування або попередження одного або декількох симптомів, зв'язаних з різними захворюваннями або станами, такими як різні захворювання і стани серця (наприклад, стенокардія, аритмія), гіпертензія, мігрені, неврологічні ефекти порушень мозкового кровообігу, манія, нейролептично індукована пізня дискінезія стінок міокарда, біполярний розлад, біль, епілепсія та інші. Було показано, що між різними іонними каналами нервової системи є істотні функціональні відмінності. Крім того, істотні відмінності є між різними мутаціями в одному і тому ж гені іонного каналу, а також між варіантами сплайсингу одного і того ж іонного каналу. Таким чином, незважаючи на причетність іонних каналів до захворювань ЦНС, то, що стосується конкретного захворювання, важко визначити який іонний канал може являти собою ефективну мішень для терапевтичного втр учання. Першочергова задача полягає у тому, щоб надати ген іонного каналу, причетний до шизофренії, біполярного розладу або захворювань, пов'язаних з ними. Даний винахід призначається для розв'язання цих та інши х задач. Даний винахід відноситься до молекул нуклеїнової кислоти, що включають геномну послідовність нового гена людини, який кодує білок потенціал-залежного ворітного іонного каналу, що називається Canlon. Геномна послідовність Canlon включає також регуляторну послідовність, розташовану ліворуч (5'-кінець) і праворуч (3'-кінець) від ділянки, що транскрибується, вказаного гена, причому такі регуляторні послідовності є також частиною даного винаходу. У даному винаході забезпечується також повна кДНК-послідовність, що кодує Canlon-білок, а також відповідний продукт трансляції. Олігонуклеотидні зонди або праймери, які специфічно гібридизуються з геномною послідовністю Canlon або з кДНК-послідовністю Canlon, як і способи ампліфікації ДНК і способи детекції з використанням вказаних праймерів і зондів, також є частиною даного винаходу. Додатковий об'єкт даного винаходу складається з рекомбінантних векторів, які включають будьяку з описаних вище послідовностей нуклеїнових Субодиниця кальцієв ого каналу Альфа-1А Альфа-1А Альфа-1А Альфа-1А Альфа-1А,α-1В Альфа-1S Альфа-1S α-1C; α-1D Бета-4 Альфа-2/d Гамма Модель Людина Людина Людина Миша Людина Людина Миша Щур Миша Людина Миша кислот і, зокрема, рекомбінантних векторів, що включають регуляторну послідовність Canlon або послідовність, що кодує Canlon-білок, а також клітин-хазяїв і трансгенних тварин, виключаючи людину, які включають вказані послідовності нуклеїнових кислот або рекомбінантні вектори. Даний винахід розглядає також двоалельні маркери Canlon-гена та їх використання. Нарешті, даний винахід стосується способів скринування речовин або молекул, які модулюють експресію або активність Canlon, а також способів скринування речовин або молекул, які взаємодіють з Canlon-поліпептидом. Розроблені також способи використання речовин, ідентифікованих для даних способів. Наприклад, розроблені способи лікування або попередження захворювань або станів, включаючи шизофренію або біполярний розлад, з використанням антагоністів Canlonканалу. Відповідно до цього, першою метою даного винаходу є забезпечення виділеного, виділеного очищенням або рекомбінантного полінуклеотиду, що включає будь-яку з нуклеотидних послідовностей, представлених у вигляді SEQ ID No 1-4 або 6, або послідовності, комплементарної будь-якій з даних послідовностей. Іншою метою даного винаходу є забезпечення виділеного, виділеного очищенням або рекомбінантного полінуклеотиду, що включає безперервну ділянку SEQ ID No 4, щонайменше, з 50 нуклеотидів, причому вказаний полінуклеотид кодує біологічно активний Canlon-поліпептид. Ще однією метою даного винаходу є забезпечення виділеного, виділеного очищенням або рекомбінантного полінуклеотиду, який кодує Canlonполіпептид людини, що включає амінокислотну послідовність SEQ ID No 5, або його біологічно активний фрагмент. У першому варіанті здійснення даного винаходу будь-який з описаних у даному описі полінуклеотидів приєднується до твердого носія. В іншому варіанті здійснення даного винаходу даний полінуклеотид включає мітку. Ще однією метою даного винаходу є створення набору полінуклеотидів, який включає, щонайменше, один з описаних у даному описі полінуклеотидів. В одному з варіантів здійснення даного винаходу даний набір є адресним. Наступною метою даного винаходу є створення рекомбінантного вектора, що включає будь 9 79927 який з описаних у даному описі полінуклеотидів, функціонально приєднаний до промотору. Ще однією метою даного винаходу є створення полінуклеотиду, присутність якого у клітині обумовлює зміну у рівні експресії Canlon-гена. В одному з варіантів даного винаходу даний полінуклеотид вбудовують у Canlon-ген або у геномну ділянку Canlon. В одному з варіантів здійснення даного винаходу даний полінуклеотид вбудовують у промотор гена Canlon. В одному з варіантів здійснення даного винаходу даний полінуклеотид вбудовують за допомогою гомологічної рекомбінації, наприклад, шляхом заміни одного або декількох елементів ендогенного промотору Canlon або енхансерної ділянки. Наступною метою даного винаходу є створення клітини-хазяїна або тварини-хазяїна, що не належить до людського роду, що включає будь-який з описаних у даному описі рекомбінантних векторів або полінуклеотидів. Ще однією метою даного винаходу є створення клітини-хазяїна ссавця або ссавця-хазяїна, що не належить до людського роду, що включає Canlon-ген, зруйнований гомологічною рекомбінацією за допомогою нокаутного вектора. В одному з варіантів здійснення даного винаходу дана клітина-хазяїн включає будь-який з описаних у даному описі полінуклеотидів. Наступною метою даного винаходу є створення виділеного, виділеного очищенням або рекомбінантного поліпептиду, що включає амінокислотну послідовність, представлену у вигляді SEQ ID No 5, або його біологічно активний фрагмент. Ще однією метою даного винаходу є розробка способу одержання поліпептиду, що включає а) створення популяції клітин, які включають полінуклеотид, що кодує поліпептид за п.13, функціонально приєднаний до промотору; b) культивування вказаної популяції клітин в умовах, які сприяють одержанню вказаного поліпептиду у вказаних клітинах; і с) виділення очищенням вказаного поліпептиду з вказаної популяції клітин. Наступною метою даного винаходу є розробка способу зв'язування антитіла до Canlon з Canlonполіпептидом, що включає контактування вказаного антитіла з будь-яким з описаних у даному описі Canlon-поліпептидів в умовах, при яких дане антитіло може специфічно зв'язуватися з вказаним поліпептидом. Ще однією метою даного винаходу є також одержання антитіл або їх імунологічно активних фрагментів, які специфічно розпізнають Canlon-білок або епітоп. Наступною метою даного винаходу є розробка способу виявлення експресії Canlon-гена у клітині, причому вказаний спосіб включає наступні стадії: а) контактування вказаної клітини або екстракту з вказаної клітини або з: і) полінуклеотидом, який гібридизується у жорстких умовах з будь-яким з описаних у даному описі Canlon-полінуклеотидів; або іі) поліпептидом, який специфічно зв'язується з будь-яким з описаних у даному описі Canlonполіпептидів; і b) виявлення наявності або відсутності гібридизації між вказаним полінуклеотидом і видами РНК у вказаній клітині або в екстракті, або наявності або відсутності зв'язування вказаного 10 поліпептиду з білком у вказаній клітині або у вказаному екстракті; де виявлення наявності вказаної гібридизації або вказаного зв'язування свідчить про те, що вказаний Canlon-ген експресується у вказаній клітині. В одному з варіантів здійснення даного винаходу вказаний полінуклеотид являє собою праймер, а вказана гібридизація виявляється шляхом виявлення наявності продукту ампліфікації, що включає послідовність вказаного праймеру. В іншому варіанті здійснення даного винаходу вказаний поліпептид являє собою антитіло, наприклад, антитіло до Canlon. Ще однією метою даного винаходу є розробка способу ідентифікації кандидатного модулятора Canlon-поліпептиду, причому вказаний спосіб включає: а) контактування будь-якого з описаних у даному описі Canlon-поліпептидів з тест-сполукою; і b) визначення чи дійсно вказана сполука специфічно зв'язується з вказаним поліпептидом; при цьому виявлення вказаної сполуки, специфічно зв'язаної з вказаним поліпептидом, свідчить про те, що вказана сполука є модуляторомкандидатом вказаного Canlon-поліпептиду. В одному з варіантів здійснення даного винаходу даний спосіб крім того включає тестування біологічної активності вказаного Canlonполіпептиду в присутності вказаного модуляторакандидата, де зміна біологічної активності вказаного Canlon-поліпептиду в присутності вказаного модулятора-кандидата, у порівнянні з біологічною активністю за відсутності вказаного модуляторакандидата, свідчить про те, що даний модуляторкандидат являє собою модулятор вказаного Canlon-поліпептиду. Наступною метою даного винаходу є створення способу ідентифікації модулятора Canlonполіпептиду, причому вказаний спосіб включає: а) контактування будь-якого з описаних у даному описі Canlon-поліпептидів з тест-сполукою; і Ь) виявлення біологічної активності вказаного поліпептиду в присутності і за відсутності вказаної сполуки; де виявлення різниці у вказаній активності в присутності вказаної сполуки, у порівнянні з активністю за відсутності вказаної сполуки, свідчить про те, що вказана сполука є модулятором вказаного Canlon-поліпептиду. В одному з варіантів здійснення даного винаходу представлені способи, де вказаний поліпептид присутній у клітині або у клітинній мембрані, а вказана біологічна активність включає активність потенціал-залежного ворітного іонного каналу. Ще однією метою даного винаходу є створення способу одержання фармацевтичної композиції, що включає а) ідентифікацію модулятора Canlon-поліпептиду з використанням будь-якого з описаних у даному описі способів; і b) об'єднання вказаного модулятора з фізіологічно прийнятним носієм. Розроблені також способи використання фармацевтичних композицій. Розроблене також використання будь-якого з описаних у даному описі Canlon-модуляторів, поліпептидів, полінуклеотидів, або антитіл для одержання лікарського засобу, наприклад, для лікування організму людини або для лікування будь-якого з описаних у даному описі захворювань або станів. 11 79927 Створені також набори для використання і детектування, in vitro або in vivo, представлених Canlon-полінуклеотидів і поліпептидів. Короткий опис креслень На Фіг.1 зображена діаграма, що представляє ВАС-карту ділянки хромосоми 13q, яка містить Canlon-ген. На Фіг.2 зображений блок діаграм типової комп'ютерної системи. На Фіг.3 зображена структурна схема, яка ілюструє один з варіантів здійснення процесу 200 по порівнянню нової нуклеотидної або білкової послідовності з базою даних послідовностей з метою встановлення рівнів гомології між новою послідовністю і відповідною послідовністю бази даних. На Фіг.4 зображена схема послідовності операцій, яка ілюструє один з варіантів здійснення процесу 250 у комп'ютері, щоб визначити чи дійсно дві послідовності є гомологічними. На Фіг.5 зображена схема послідовності операцій, яка ілюструє один з варіантів процесуідентифікатора 300 для виявлення у послідовності наявності характерної особливості. Короткий опис послідовностей, представлених у списку послідовностей SEQ ID No 1 містить геномну послідовність Canlon, яка включає 5'-регуляторну ділянку ("ліва" ділянка, що не транскрибується) та екзони 1-7. SEQ ID No 2 містить геномну послідовність Canlon, яка включає екзони 8-27. SEQ ID No 3 містить геномну послідовність Canlon, яка включає екзони 28-44, а також 3'регуляторну ділянку ("права" ділянка, що не транскрибується). SEQ ID No 4 містить кДНК-послідовність Canlon. SEQ ID No 5 містить амінокислотну послідовність, що кодується кДНК SEQ ID No 4. SEQ ID No 6 містить нуклеотидну послідовність амплікону, який включає двоалельний маркер А18. SEQ ID No 7 містить праймер, що включає додаткову 5'-послідовність PU, нижче описану у Прикладі 2. SEQ ID No 8 містить праймер, що містить додаткову 5'-послідовність RP, нижче описану у Прикладі 2. Відповідно до правил, що відносяться до Списків Послідовностей, у даному Списку Послідовностей використовуються коди, які вказують розташування двоалельних маркерів у даних послідовностях і які ідентифікують кожний з алелів, представлений по поліморфній основі. Код "r" для даної послідовності свідчить про те, що один алель по даній поліморфній основі являє собою гуанін, а інший алель являє собою аденін. Код "у" для даних послідовностей свідчить про те, що один алель по даній поліморфній основі являє собою тимін, тоді як інший алель являє собою цитозин. Код "m" для даних послідовностей свідчить про те, що один алель по даній поліморфній основі являє собою аденін, а інший алель являє собою цитозин. Код "k" для даних послідовностей свідчить про те, що один алель по даній поліморфній основі являє собою гуанін, а інший алель являє 12 собою тимін. Код "s" для даних послідовностей свідчить про те, що один алель по даній поліморфній основі являє собою гуанін, а інший алель являє собою цитозин. Код "w" для даних послідовностей свідчить про те, що один алель по даній поліморфній основі являє собою аденін, а інший алель являє собою тимін. Нуклеотидний код вихідного алеля для кожного двоалельного маркера наступний: Двоалельний маркер Вихідний алель 5-124-273 А (наприклад) У деяких випадках поліморфні основи двоалельних маркерів змінюють ідентичність амінокислот у поліпептиді, що кодується. Це вказано у доданому Списку Послідовностей з використанням елемента VARIANT, розміщення Хаа у положенні даної поліморфної амінокислоти і визначення Хаа у вигляді двох альтернативних амінокислот. Наприклад, якщо один алель двоалельного маркера являє собою кодон САС, який кодує гістидин, а інший алель двоалельного маркера являє собою САА, який кодує глутамін, то Список Послідовностей для поліпептиду, що кодується, буде містити Хаа у положенні поліморфної амінокислоти. У цьому випадку Хаа повинен визначатися у вигляді гістидину або глутаміну. В інших випадках Хаа може означати амінокислоту, ідентичність якої невідома, внаслідок невизначеності нуклеотидної послідовності. У цьому випадку використання елемента UNSURE розміщує Хаа у положення невідомої амінокислоти і значення Хаа вважається будь-яким з 20 амінокислот або обмеженим числом амінокислот, підказаних генетичним кодом. Асоціація шизофренії та біполярного розладу у сім'ях, доведена при вивченні близнюків і усиновлення, хоча мінливість по всьому світу відсутня, свідчить про те, що шизофренія та біполярний розлад насамперед являють собою генетичні стани, хоча фактори ризику навколишнього середовища також до деякого ступеня розглядаються як необхідні, достатні або такі, що впливають одна на одну причини. Наприклад, шизофренія зустрічається у 1% від загальної чисельності населення. Але за наявності шизофренії у одного з дідусів або бабусь ризик виникнення даної хвороби зростає до приблизно 3%; якщо ж шизофренією страждає один з батьків, цей ризик зростає до приблизно 10%. Якщо обидва батьки хворі шизофренією, тоді ризик зростає, приблизно, до 40%. Ідентифікація генів, зв'язаних з характерною ознакою, такою як специфічне порушення центральної нервової системи, подібне до шизофренії, може бути здійснена за допомогою двох основних підходів, які використовуються у наш час для генетичного картування: аналізу зчеплення та асоціативних досліджень (дослідження співтовариств). Аналіз зчеплення потребує вивчення сімей, в яких захворюванням уражено багато їх членів, і у наш час придатний для виявлення моно- та олігогенних спадкових ознак. І навпаки, в асоціативних дослідженнях аналізують частоту маркерних алелів ознаки (Т+) у незв'язаних спорідненням індивідів, що порівнюються з негативним за даною ознакою 13 79927 контролем (Т-) і звичайно використовуються для виявлення полігенного успадковування. Генетичний зв'язок або зчеплення базується на аналізі, в якому дві сусідні послідовності на хромосомі містять, щонайменше, рекомбінації у результаті кросинговеру під час мейозу. Щоб здійснити це хромосомні маркери, подібні мікросателітним маркерам, ретельно локалізують у даному геномі. В аналізі генетичного зчеплення розраховують ймовірність рекомбінацій у даному генімішені з використанням хромосомних маркерів, відповідно до генеалогічного дерева, передачі даного захворювання і передачі даних маркерів. Таким чином, якщо окремий алель даного маркера передається разом із захворюванням більш часто, а не випадково (рівень рекомбінації знаходиться між 0 і 0,5), то можна зробити висновок про те, що ген-мішень, про який йде мова, виявляється поблизу від даного маркера. При використанні даного методу можна локалізувати декілька генів, що демонструють генетичну схильність сімейних злоякісних пухлин. Для того щоб мати можливість включитися у вивчення генетичного зчеплення, сім'ї, уражені спадковою формою даного захворювання, повинні задовольняти критерію "інформативності": декілька чоловік (конституційна ДНК яких доступна) на покоління, повинні бути уражені даним захворюванням, і щонайбільше, володіти великим числом сибсів. Результати досліджень по зчепленню підтверджують гіпотезу про те, що хромосома 13, очевидно, містить локус схильності до шизофренії на 13q32 [Blouin JL і співавт., 1998, Nature Genetics, 20:70-73; Lin MW і співавт., Hum. Genet., 99(3) (1997):417-420; Brzustowicz і співавт., Am. J. Hum. Genet. 65:1096-1103 (1999)]. Однак, незважаючи на те, що аналіз зчеплення являє собою потужний метод виявлення генів і зв'язаної з ними ознаки, розв'язання часто неможливе без рівня даної мегабази даних, а відповідні дослідження часто потребують уточнення аналізу ділянок, які спочатку ідентифіковані за допомогою даного способу. ВАС-контиг, що покриває передбачувану геномну ділянку локусу хромосоми 13q-31-q33, конструйований з використанням загальнодоступних STS, розташованих у даній ділянці хромосомного локусу 13q-31-q33, для скринування запатентованої окремої ВАС-бібліотеки, еквівалентної 7геномам. За даними матеріалами одержували нові STS, що дозволяють конструювати компактну фізичну карту даної ділянки. Визначали розмір всіх ВАС і картували за допомогою хромосомної гібридизації in situ для верифікації. Ідентифікували мінімальну груп у ВАС і повністю секвенували по декількох контигах, що приводило до одержання кінцевого контигу, який перевищує 4млн.п.н. Створення даної карти дозволяє ідентифікувати Canlon-ген, який локалізується у геномній ділянці, що демонструє істотне зчеплення з шизофренією. Амінокислотна послідовність Canlon характерна для CACHANNEL, 7-елементного фінгерпринту, який характеризує альфа-1-субодиниці кальцієвих каналів (Ref. PR00167, BLOCK+база даних). Даний фінгерпринт одержували, ви ходячи з первинного вирівнювання 6 послідовностей: мотиви витягува 14 ли з консервативних ділянок петлі, що піддаються розрізненню між цими та іншими катіонними каналами; мотиви 1 і 2 кодують послідовності між трансмембранними сегментами 4 і 5, а також 5 і 6 (перший внутрішній повтор); мотив 3 відповідає послідовності між сегментом 6 повтору 1 і сегментом 1 повтору 2; мотив 4 кодує послідовність між сегментами 5 і 6 повтору 2; мотив 5 відповідає послідовності між сегментом 6 повтору 3 і сегментом 1 повтору 4; а мотиви 6 і 7 кодують послідовності між сегментами 4 і 5, а також між сегментами 5 і 6 повтору 4. На Фіг.1 представлені ВАС-контиги, які покривають ділянку хромосоми 13, що представляє інтерес, яка включає Canlon-ген, і показане геномне розташування Canlon-гена відносно генетичних маркерів, що демонструють найвищу значимість у дослідженнях по зчепленню. Зокрема, Blouin і співавт. (1998) здійснили широке дослідження геному на предмет виявлення локусів схильності до шизофренії, у 54 комплексних родоводах, з використанням 452 мікросателітних маркерів. Найбільш значиме зчеплення між шизофренією у сім'ях виявлялося на хромосомі 13q32 поблизу маркера D13S174. Brzustowicz і співавт. (1999) дали оцінку мікросателітним маркерам, що охоплюють хромосоми 8 і 13 в 21 великій Канадській сім'ї. Маркери для хромосомної ділянки 13q дають позитивні оцінки LOD у кожній аналітичній моделі, що використовується: аутосомно-домінантній і аутосомнорецесивній, з вузьким або широким визначенням шизофренії. Максимальні триточкові LOD-оцінки були одержані з маркером D13S793 у рецесивноширокій моделі: 3,92 у рекомбінантній фракції (θ) 0,1 при гомогенності і 4,42 з α=0,65 і θ=θ при гетерогенності. На вказаній Фіг.1 Canlon-ген локалізований частково у контигу, позначеному 'Region Ε' і частково у контигу, позначеному С0001А10. Даний Canlon-ген фланкований двома маркерами, що демонструють найвищу значимість у дослідженнях по зчепленню. Маркер D13S174 також знаходиться у контигу С0001А10, а маркер D13S793 локалізований, приблизно 3,5млн.п.н. центромірніше до Canlon-гена. Існує дуже велика потреба в ідентифікації генів, зв'язаних з шизофренією, біполярним розладом та іншими ЦНС, а також серцево-судинними захворюваннями і станами. Існує також необхідність в ідентифікації нових іонних каналів, зв'язаних із захворюваннями. Такі гени і білки можуть відкрити нові перспективи у лікуванні шизофренії, біполярного розладу або інших ЦНС-станів, а також інших станів, таких як, наприклад, стани серця та гіпертензія, і дозволяють крім того вивчати і характеризувати Canlon-ген і зв'язані з ним біологічні шляхи. Пізнання таких генів і зв'язаних з ними біологічних шляхів, залучених до даних захворювань і станів, дозволить дослідникам зрозуміти етіологію, наприклад, шизофренії та біполярного розладу, і приведе до розробки лікарських засобів і лікарських препаратів, націлених проти причини даних захворювань. Наприклад, сполуки, які блокують Canlon-канали, можуть використовуватися для лікування будь-яких захворювань і станів, переважно шизофренії або біполярного розладу, і 15 79927 включають також больові порушення, епілепсію та різні серцево-судинні порушення, такі як серцева аритмія, стенокардія і гіпертензія. Існує також велика необхідність у нових способах виявлення схильності до шизофренії, біполярного розладу та інших станів, а також для запобігання або для спостереження за розвитком будь-якого з даних захворювань. Діагностичні засоби могли б також виявитися дуже корисними. Дійсно, як приклад, рання ідентифікація у людей з ризиком розвитку шизофренії зробить можливим раннє і/або профілактичне здійснення лікування. Крім того, точні оцінки ефективності лікарського засобу, а також толерантності пацієнта, дадуть можливість лікареві-клініцисту поліпшити співвідношення між вигодою і ризиком, що стосується схем лікування шизофренії та біполярного розладу. У даному винаході розглядаються полінуклеотиди і поліпептиди, що відносяться до Canlon-гена. Олігонуклеотидні зонди і праймери, які специфічно гібридизуються з геномною або кДНКпослідовністю Canlon, також є частиною даного винаходу. Ще одна мета даного винаходу включає створення рекомбінантних векторів, що включають будь-яку з послідовностей нуклеїнових кислот, описаних у даному винаході, і, зокрема, рекомбінантних векторів, що включають регуляторну ділянку Canlon-послідовності або послідовність, яка кодує Canlon-білок, а також клітини-хазяїна, що включають вказані послідовності нуклеїнових кислот або рекомбінантні вектори. Даний винахід включає також способи скринування молекул, здатних модулювати експресію або активність Canlonгена або білка, а також способи використання таких молекул для лікування або попередження шизофренії, біполярного розладу або будь-якого захворювання з числа інших захворювань або станів. У даному винаході розглядаються також антитіла, специфічно націлені проти поліпептидів, які придатні як діагностичні реагенти. У даному винаході розглядаються також двоалельні маркери, зв'язані з Canlon, та їх використання у генетичному аналізі, включаючи вивчення зчеплення у сім'я х, вивчення зчеплення при порушенні рівноваги у популяціях і асоціативні дослідження у популяціях хворих і здорових. Важливий аспект даного винаходу полягає у тому, що двоалельні маркери дозволяють здійснювати асоціативні дослідження для ідентифікації ролі генів, залучених до контролю складних ознак. Визначення Перед більш докладним описом даного винаходу формулюються визначення, що йдуть нижче, які ілюструють і задають значення та рамки термінів, що використовуються для опису представленого у даному описі винаходу. Термін "Canlon-ген", що використовується у даному описі, включає в себе геномні, мРНК і кДНК послідовності, що кодують Canlon-білок, у тому числі і регуляторні ділянки, які не транслюються, геномної ДНК. Термін "гетерологічний білок", що використовується у даному описі, призначений для позначення будь-якого білка або поліпептиду, який відрізняється від Canlon-білка. Наприклад, 16 гетерологічний білок може являти собою сполуку, яку можна використовувати як маркер у додаткових експериментах з регуляторною ділянкою Canlon. Термін "виділений" вимагає, щоб матеріал був видалений зі свого первинного навколишнього середовища (наприклад, природного навколишнього середовища, якщо він є таким, що зустрічається у природі). Наприклад полінуклеотид або поліпептид, що зустрічається у природі, представлений у живому організмі тварини, не є виділеним, але той же полінуклеотид або ДНК, або поліпептид, відділений від деяких або від усіх співіснуючих речовин у даній природній системі, є виділеним. Такий полінуклеотид може бути частиною вектора і/або такий полінуклеотид або поліпептид може бути частиною композиції, і все ж бути виділеним, вектор або композиція не є частиною його природного оточення. Наприклад полінуклеотид, що зустрічається у природі, представлений у живому організмі тварини, не є виділеним, але той же полінуклеотид, відділений від деяких або з усіх супровідних речовин у природній системі, є виділеним. Зокрема, виключеними з визначення "виділений" є: хромосоми (такі як хромосомні розподіли), що зустрічаються у природі, бібліотеки штучних хромосом, геномні бібліотеки і кДНК-бібліотеки, які існують або у вигляді in vitro препарату нуклеїнової кислоти, або у вигляді препарату трансфікованої/трансформованої клітини-хазяїна, де дані клітини-хазяї являють собою або гетерогенний in vitro препарат, або посіяні у ви гляді гетерогенної популяції з одиничних колоній. Виключаються також, зокрема, і вказані вище бібліотеки, в яких конкретний полінуклеотид складає менше 5% від числа вставок нуклеїнових кислот у векторні молекули. Крім того, виключаються, зокрема, препарати геномної ДНК цілих клітин або РНК цілих клітин (включаючи вказані вище препарати цілих клітин, які механічно нарізаються або ензиматично розщеплюються). Крім того, виключаються, зокрема, препарати вказаних вище цілих клітин у вигляді або in vitro препарату, або у вигляді гетерогенної суміші, розділеної за допомогою електрофорезу (включаючи блотинг), де полінуклеотид даного винаходу не був додатково відділений від гетерологічних полінуклеотидів в електрофоретичному середовищі (наприклад, додаткове відділення шляхом вирізання одиночної смуги з гетерогенної популяції смуг в агарозному гелі або у нейлоновому блоті). Термін "виділений очищенням" не вимагає абсолютного ступеня очищення; швидше він призначається як відносне визначення. Очищення вихідної речовини або природної речовини до, щонайменше, одного порядку величини, переважно двох або трьох порядків, і більш переважно чотирьох або п'яти порядків, безперечно передбачається. Як приклад, очищення з 0,1% концентрації до 10% концентрації є очищенням на два порядки. Як приклад, індивідуальні кДНК-клони, виділені з кДНК-бібліотеки, були традиційно очищені до електрофоретичної гомогенності. Послідовності, одержані з даних клонів, неможливо бу 17 79927 ло б одержати безпосередньо з даної бібліотеки або з тотальної ДНК людини. Дані кДНК-клони не є клонами, що зустрічаються у природі як такі, але швидше їх одержують за допомогою операції речовини (інформаційна РНК), що зустрічається у природі, яка частково виділяється очищенням. Перетворення мРНК у кДНК-бібліотеку включає в себе створення синтетичної речовини (кДНК), а очищені індивідуальні кДНК-клони можуть бути виділені з даної синтетичної бібліотеки за допомогою клональної селекції. Таким чином, створення кДНК-бібліотеки з інформаційної РНК і послідовне виділення індивідуальних клонів з даної бібліотеки приводить, приблизно, до 104-106-кратного очищення нативної РНК. Крім того, термін "виділений очищенням" використовують у даному описі для описання поліпептиду або полінуклеотиду даного винаходу, який був відділений від інших сполук, включаючи, але, не обмежуючись ними, поліпептиди або полінуклеотиди, вуглеводні, ліпіди і т.п.Термін "виділений очищенням" можна використовувати для конкретного відділення мономерних поліпептидів даного винаходу від олігомерних форм, таких як гомо- або гетеродимери, димери, тримери і т.п.Термін "виділений очищенням" можна також використовувати відносно специфічного відділення ковалентнозамкнених полінуклеотидів від лінійних полінуклеотидів. Будь-який полінуклеотид є у значному ступені чистим, якщо, щонайменше, близько 50%, переважно 60-75% зразка виявляє єдину полінуклеотидну послідовність і конформацію (наприклад, лінійну у порівнянні з ковалентнозамкненою). У значному ступені чистий поліпептид або полінуклеотид звичайно включає близько 50%, переважно 60-90% маса/маса поліпептидного або полінуклеотидного зразка, відповідно, переважно близько 95% і більш переважно близько 99% чистого продукту. Бездомішковість поліпептиду або полінуклеотиду або гомогенність показують за допомогою ряду способів, добре відомих у даній області техніки, таких, наприклад, як електрофорез зразка у гелі агарози або у гелі поліакриламіду, з подальшою візуалізацією єдиної смуги після забарвлювання гелю. Для деяких цілей найбільше розрізнення можна одержати з використанням ВЕРХ або інших способів, добре відомих у даній області техніки. Як альтернативний варіант здійснення даного винаходу, очищення поліпептидів і полінуклеотидів даного винаходу може бути виражене, щонайменше, у ви гляді процентів чистої речовини по відношенню до гетерологічних поліпептидів і полінуклеотидів (ДНК, РНК або обох). Як переважний варіант здійснення даного винаходу, поліпептиди і полінуклеотиди даного винаходу володіють, щонайменше, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96%, 98%, 99% або 100% чистоти (бездомішковості) відносно, відповідно, гетерологічних поліпептидів і полінуклеотидів. Як ще більш переважний варіант здійснення даного винаходу дані поліпептиди і полінуклеотиди володіють ступенем очищення, що коливається від будь-якого числа до тисячної частки, між 90% і 100% (наприклад, поліпептид або полінуклеотид, щонайменше, 99,995% чистоти) по відношенню, відповідно, до їх 18 гетерологічних поліпептидів і полінуклеотидів, або у вигляді співвідношення маса/маса по відношенню до всіх сполук і молекул, які відрізняються від тих, що існують у даному носії. Кожне число, що представляє процент чистоти, до тисячної частки, можна заявляти як індивідуальний вид чистоти. Термін "поліпептид" відноситься до полімеру амінокислот, не беручи до уваги довжину даного полімеру; тому пептиди, олігопептиди та білки включені без визначення поліпептиду. Даний термін також не визначає або виключає постекспресійні модифікації поліпептидів, наприклад, поліпептидів, які мають у своєму складі ковалентно приєднані глікозильні групи, ацетильні групи, фосфатні гр упи, ліпідні групи і до них подібні, що чітко підпадають під термін поліпептид. У дане визначення включені також поліпептиди, які містять один або декілька аналогів амінокислот (включаючи, наприклад, амінокислоти, що не зустрічаються у природі, амінокислоти, які зустрічаються у природі тільки у неспорідненій біологічній системі, модифіковані амінокислоти з систем ссавців і т.п.), поліпептиди із заміщеними зв'язками, а також інші модифікації, відомі у даній області техніки, як такі, що зустрічаються у природі, так і такі, що не зустрічаються у природі. Термін "рекомбінантний поліпептид", що використовується у даному описі, відноситься до поліпептиду, який штучно створюють і який включає, щонайменше, дві поліпептидні послідовності, які не виявляються у вигляді суміжних поліпептидних послідовностей в їх природному середовищі, або відноситься до поліпептидів, які експресуються з рекомбінантного полінуклеотиду. Термін "тварина, що не належить до людського роду", який використовується у даному описі, відноситься до будь-якого хребетного, що не належить до людського роду, пта хів і, більш переважно, ссавців, переважно приматів, сільськогосподарських тварин, таких як свині, кози, вівці, осли і коні, кролики або гризуни, більш переважно щури або миші. Термін "тварина", що використовується у даному описі, відноситься до будь-якого хребетного, переважно ссавця. Обидва терміни "тварина" і "ссавець" безперечно включають людські істоти, якщо не передує термін "такий, що не належить до людського роду". Термін "антитіло", що використовується у даному описі, відноситься до поліпептиду або до групи поліпептидів, які включають, щонайменше, один зв'язувальний домен, який відрізняється тим, що антитіло-зв'язувальний домен утворюється з упакованих варіабельних доменів молекули антитіла з утворенням тривимірного зв'язувального простору з формою внутрішньої поверхні і розподілом заряду, комплементарного особливостям антигенної детермінанти антигену, що дозволяє імунологічно реагувати з даним антигеном. Антитіла мають у своєму складі рекомбінантні білки, що включають зв'язувальні домени, а також фрагменти, які включають Fab, Fab', F(ab)2 і Р(аb')2фрагменти. Термін "антигенна детермінанта", що використовується у даному описі, являє собою частину молекули антигену, у даному випадку Canlon 19 79927 поліпептиду, яка визначає специфічність взаємодії антиген-антитіло. "Епітоп" відноситься до антигенної детермінанти поліпептиду. Епітоп може включати не менше З амінокислот для просторової конформації, яка є унікальною для даного епітопу. Як правило, епітоп включає, щонайменше, 6 таких амінокислот, але більш звичайно, щонайменше, 8Ю таких амінокислот. Способи визначення амінокислот, які складають епітоп, включають рентгенівську кристалографію, 2-вимірний ядерний магнітний резонанс та епітопне картування, наприклад, способом Pepscan, [описаним Geysen і співавт., 1984; Публікація РСТ No WO84/03564; і Публікація РСТ No WO84/03506]. Протягом всього даного опису експресія "нуклеотидної послідовності" може вживатися для позначення полінуклеотиду або нуклеїнової кислоти. Більш точно, експресія "нуклеотидної послідовності" охоплює власне матеріал нуклеїнової кислоти і, отже, не обмежується інформацією про послідовність (тобто, послідовність букв, вибрану з чотирьох букв основи), яка біохімічно характеризує специфічність молекули ДНК або РНК. Терміни "нуклеїнові кислоти", "олігонуклеотиди" і "полінуклеотиди", що використовуються у даному описі поперемінно, включають РНК, ДНК або гібридні послідовності РНК/ДНК з більш ніж однією послідовністю в одноланцюжковій або дуплексній формі. Термін "нуклеотид" використовують у даному описі як прикметник до опису молекул, що включають РНК, ДНК, або гібридних послідовностей РНК/ДНК будь-якої довжини в одноланцюжковій або дуплексній формі. Термін "нуклеотид", що також використовується у даному описі як іменник, відноситься до індивідуальних нуклеотидів або до великої кількості нуклеотидів, маючи на увазі молекулу або індивідуальний елемент у більшій молекулі нуклеїнової кислоти, що включає пурин або піримідин, цукрову складову рибози або дезоксирибози і фосфатн у гр уп у, або фосфодіефірний зв'язок у випадку нуклеотидів в олігонуклеотиді або полінуклеотиді. Хоча термін "нуклеотид", що використовується у даному описі, охоплює також "модифіковані нуклеотиди", які включають, щонайменше, одну з модифікацій (а) альтернативну зв'язувальну гр упу, (b) аналогову форму пурину, (с) аналогову форму піримідину або (d) аналоговий цукор, приклади аналогових зв'язувальних груп, п урину, піримідинів і цукру [див., наприклад, у публікації РСТ No WO95/04064]. Полінуклеотидні послідовності даного винаходу можуть бути одержані будь-яким відомим способом, включаючи синтетичний, рекомбінантний, ex vivo перетворення або їх поєднанням, а також використовуючи будьякі способи очищення, відомі у даній області техніки. Послідовність, яку "функціонально приєднують" до регуляторної послідовності, такої як промотор, означає, що вказаний регуляторний елемент знаходиться у правильному положенні та орієнтації по відношенню до нуклеїнової кислоти, для контролювання РНК-полімеразної ініціації та експресії нуклеїнової кислоти, що представляє інтерес. Термін "функціонально приєднаний", що використовується у даному описі, відноситься до 20 зв'язування полінуклеотидних елементів у функціональному взаємозв'язку. Наприклад, промотор або енхансер функціонально зв'язують з послідовністю, що кодує, якщо він впливає на транскрипцію даної послідовності, що кодує. Терміни "ознака" і "фенотип" використовуються у даному описі взаємозамінно і відносяться до будь-якої видимої, такої, що виявляється або інакше вимірюється властивості організму, такої, наприклад, як симптоми або схильність до захворювання. Звичайно терміни "ознака" або "фенотип", що використовуються у даному описі, відносять до симптомів або до схильності до захворювання, до позитивної відповіді або до побічних ефектів, зв'язаних з лікуванням. Переважно, вказана ознака може являти собою, без обмеження, психічні розлади, такі як шизофренія або біполярний розлад, інші ЦНС або нейрональні розлади, такі як епілепсія або порушення больових відчуттів, а також серцево-судинні стани, такі як стенокардія, гіпертензія і аритмія, а також будьякий аспект, особливість або характеристику будьякого з даних захворювань або станів. Термін "алель", що використовується у даному описі, відносять до варіантів нуклеотидної послідовності. Двоалельний поліморфізм має дві форми. Диплоїдні організми можуть бути гомозиготою або гетерозиготою за алельною формою. Термін "рівень гетерозиготності", що використовується у даному описі, відносять до частини індивідів у популяції, які є гетерозиготами по окремому алелю. У двоалельній системі рівень гетерозиготності дорівнює, у середньому, 2Ра(1-Ра), де Ра відповідає частоті найменш поширеного алеля. Для використання у генетичних дослідженнях генний маркер повинен володіти адекватним рівнем гетерозиготності, що допускає прийнятну ймовірність того, що випадково вибраний суб'єкт буде гетерозиготою. Термін "генотип", що використовується у даному описі, відносять до тотожності апелів, представлених у індивіда або у зразку. У контексті даного винаходу генотип переважно відносять до опису двоалельних маркерних апелів, представлених у індивіда або у зразку, наприклад, алелі двоалельних маркерів в Canlon-гені або у геномній ділянці. Термін "генотипування" зразка або індивіда по двоалельному маркеру включає в себе визначення конкретного алеля або конкретного нуклеотиду, що здійснюється по індивідуальному двоалельному маркеру. Термін "мутація", що використовується у даному описі, відносять до відмінності у ДНКпослідовності між або серед різних геномів або індивідів, які володіють частотою нижче 1%. Термін "гаплотип" відносять до поєднання алелів, представлених у індивіда або у зразку. У контексті даного винаходу гаплотип переважно відносять до поєднання двоалельних маркерних алелів, що виявляються у даного індивіда, і можуть бути асоційовані з фенотипом. Термін "поліморфізм", що використовується у даному описі, відносять до зустрічальності однієї або декількох альтернативних геномних послідовностей або алелів серед або у різних геномів або 21 79927 індивідів. "Поліморфний" відноситься до стану, в якому два або більше варіантів конкретної геномної послідовності можуть бути виявлені у популяції. "Поліморфний сайт" являє собою локус, по якому спостерігається мінливість. Поліморфізм єдиного нуклеотиду являє собою заміщення одного нуклеотиду іншим нуклеотидом у даному поліморфному сайті. Делеція одиничного нуклеотиду або вставка одиничного нуклеотиду також приводить до зростання поліморфізму єдиного нуклеотиду. У контексті даного винаходу "поліморфізм єдиного нуклеотиду" переважно відноситься до одиничної нуклеотидної заміни. Звичайно, у різних індивідів даний поліморфний сайт може бути зайнятий двома різними нуклеотидами. Терміни "двоалельний поліморфізм" і "двоалельний маркер" використовуються у даному описі взаємозамінно і відносяться до поліморфізму єдиного нуклеотиду, що володіє двома алелями з досить високою частотою у популяції. "Двоалельний маркерний алель" відноситься до нуклеотидних варіантів, представлених по сайту двоалельного маркера. Звичайно, частота малорозповсюдженого алеля двоалельних маркерів даного винаходу, як оцінка, складає більше ніж 1%, переважно його частота перевищує 10%, більш переважно його частота складає, щонайменше, 20% (тобто, рівень гетерозиготності складає, щонайменше, 0,32), ще більш переважно його частота дорівнює, щонайменше, 30% (тобто, рівень гетерозиготності досягає, щонайменше, 0,42). Двоалельний маркер, в якому частота малорозповсюдженого алеля дорівнює 30% або більше, називають "високоякісним двоалельним маркером". Положення нуклеотидів у полінуклеотиді відносно центра полінуклеотиду описується у даному описі наступним чином. Якщо полінуклеотид володіє непарним числом нуклеотидів, то вважають, що нуклеотид, рівновіддалений від 3' і 5' кінців у даному полінуклеотиді, знаходиться "у центрі" даного полінуклеотиду. і будь-який нуклеотид, що безпосередньо примикає до нуклеотиду у центрі, або ж сам нуклеотид у центрі, вважають таким, що знаходиться "в 1 н уклеотиді від центра". При непарному числі нуклеотидів у полінуклеотиді будьяку з п'яти нуклеотидних позицій у середині полінуклеотиду потрібно вважати такою, що знаходиться "в 2 нуклеотидах від центра", і так далі. Якщо полінуклеотид володіє парним числом нуклеотидів, то у центрі даного полінуклеотиду буде знаходитися зв'язок, а не нуклеотид. Таким чином, будь-який з двох центральних нуклеотидів потрібно вважати таким, що знаходяться "в 1 нуклеотиді від центра", а будь-який з чотирьох нуклеотидів у середині даного полінуклеотиду потрібно вважати таким, що знаходиться "в 2 нуклеотидах від центра", і так далі. Що стосується поліморфізму, який зв'язаний із заміною, вставкою або делецією 1 або більше нуклеотидів, то даний поліморфізм, алель або двоалельний маркер знаходиться "у центрі" полінуклеотиду, якщо різниця між відстанню від заміщених, вставлених або делетованих полінуклеотидів даного поліморфізму до 3'-кінця даного полінуклеотиду, відстанню від заміщених, вставлених або делетованих полінуклеотидів да 22 ного поліморфізму до 5'-кінця даного полінуклеотиду, дорівнює нулю або одному нуклеотиду. Якщо дана різниця дорівнює 0-3, тоді даний поліморфізм вважають таким, що знаходиться "в 1 нуклеотиді від центра". Якщо дана різниця складає 0-5, даний поліморфізм вважають таким, що знаходиться "в 2 нуклеотидах від центра". Якщо ж дана різниця складає 0-7, то даний поліморфізм вважають таким, що знаходиться "в 3 нуклеотидах від центра", і так далі. Термін "лівіше", що використовується у даному описі, відноситься до місця, яке знаходиться біля 5'-кінця даного полінуклеотиду від певної точки відліку, або, у випадку гена, у напрямі від послідовності, що кодує, до промотору. Терміни "спарені основи" і "спарені основи Уотсона і Крика", що використовуються у даному описі взаємозамінно, відносяться до нуклеотидів, які можуть бути зв'язані один з одним водневим зв'язком, завдяки ідентичності їх послідовностей, способом, подібним до того, який виявляє двоспіральна ДНК для залишків тиміну або урацилу, зв'язаних із залишками аденіну за допомогою двох водневих зв'язків, і залишків цитозину і гуаніну, зв'язаних за допомогою трьох водневих зв'язків [див. Stryer, L., Biochemistry, 4th edition, 1995]. Терміни "комплементарний" або "його комплемент", що використовуються у даному описі, відносяться до послідовностей полінуклеотидів, які здатні утворювати пари основ Уотсона і Крика з іншим конкретним полінуклеотидом по всій повністю комплементарній ділянці. Для даної мети даного винаходу перший полінуклеотид визнають комплементарним другому полінуклеотиду, якщо кожна основа першого полінуклеотиду спарюється зі своєю комплементарною основою. Комплементарними основами є, як правило, А і Τ (або А і U), або С і G. "Комплемент" використовується у даному описі як синонім "комплементарного полінуклеотиду", "комплементарної нуклеїнової кислоти" і "комплементарної нуклеотидної послідовності". Дані терміни, що застосовуються до пар полінуклеотидів, базуються виключно на їх послідовностях, а не на якій-небудь конкретній сукупності умов, при яких дані два полінуклеотиди були б фактично зв'язані. Варіанти і фрагменти 1 - Полінуклеотиди Даний винахід відноситься також, до варіантів і фрагментів описаних у даному описі полінуклеотидів, зокрема, Canlon-гена, що містить один або більше двоалельних маркерів. Варіанти полінуклеотидів, як термін, що використовується у даному описі, являють собою полінуклеотиди, які відрізняються від вихідного полінуклеотиду. Варіант полінуклеотиду може бути варіантом, що зустрічається у природі, таким, наприклад, як алельний варіант, що зустрічається у природі, або він може бути варіантом, який не відомий як такий, що зустрічається у природі. Такі варіанти даного полінуклеотиду, що не зустрічаються у природі, можна створити методами мутагенезу, у тому числі і тими, які застосовні до полінуклеотидів, клітин або організмів. Звичайно, відмінності є такими невеликими, що нуклеотидні 23 79927 послідовності вихідного і варіантного полінуклеотидів майже повністю співпадають, а по багатьох ділянках ідентичні. Варіанти полінуклеотидів, відповідно до даного винаходу, включають, без істотного обмеження, нуклеотидні послідовності, які, щонайменше, на 95% ідентичні полінуклеотиду, вибраному з групи, що складається з нуклеотидних послідовностей SEQ ID Nos 1-4, або полінуклеотидному фрагменту, щонайменше, з 12 послідовних нуклеотидів полінуклеотиду, вибраного з групи, що складається з нуклеотидних послідовностей SEQ ID Nos 1-4, і переважно, щонайменше, ідентичні на 99%, більш переважно, щонайменше, ідентичні на 99,5%, і найбільш переважно, щонайменше, ідентичні на 99,8% полінуклеотиду, вибраному з групи, яка складається з нуклеотидних послідовностей SEQ ID Nos 1-4, або будь-якому полінуклеотидному фрагменту, щонайменше, з 12 послідовних нуклеотидів полінуклеотиду, вибраного з групи, що складається з нуклеотидних послідовностей SEQ ID No 1-4. Нуклеотидні зміни, які присутні у варіантному полінуклеотиді, можуть бути такими, які мовчать, це означає, що вони не змінюють амінокислоти, які кодуються даним полінуклеотидом. Однак нуклеотидні зміни можуть також приводити і до амінокислотних замін, додавань, делецій, злиттів і укорочень у даному поліпептиді, що кодується початковою послідовністю. У даних замінах, делеціях або додаваннях можуть брати участь один або більше нуклеотидів. Дані варіанти можуть бути результатом змін у ділянці, що кодує або не кодує, або в обох. Зміни у ділянках, що кодують, можуть створювати консервативні або неконсервативні заміни, делеції або додавання. У контексті даного винаходу особливо переважними варіантами здійснення даного винаходу є ті, в яких дані полінуклеотиди кодують поліпептиди, які фактично зберігають ту ж біологічну функцію або активність, що і зрілий Canlon-білок, або ті, в яких дані полінуклеотиди кодують поліпептиди, які зберігають або підвищують основну біологічну активність, знижуючи у той же час допоміжну (вторинну) біологічну активність. Полінуклеотидний фрагмент являє собою полінуклеотид, що володіє послідовністю, яка абсолютно така ж, що і частина, але не вся дана нуклеотидна послідовність, переважно нуклеотидна послідовність Canlon-гена, та його варіанти. Даний фрагмент може являти собою ділянку інтрону або екзону Canlon-гена. Він може також являти собою яку-небудь частину з регуляторних ділянок Canlon. Переважно, такі фрагменти включають, щонайменше, один з двоалельних маркерів А1-А17 або його комплементів або двоалельний маркер, зчеплений при порушенні рівноваги з одним або декількома двоалельними маркерами А1-А17. Такі фрагменти можуть бути "автономними", тобто, не бути частиною або такими, що злилися з іншими, полінуклеотидами, або вони можуть бути включені в окремий великий полінуклеотид, в якому вони утворюють сегмент або ділянку. Дійсно, декілька таких фрагментів можуть бути представлені в окремому великому полінуклеотиді. 24 Факультативно, такі фрагменти можуть складатися або складатися в основному з безперервної ділянки послідовності, щонайменше, з 8, 10, 12, 15, 18, 20, 25, 35, 40, 50, 70, 80, 100, 250, 500 або 1000 нуклеотидів у довжину. Сукупність переважних фрагментів містить, щонайменше, один з двоалельних маркерів А1-А17 Canlon-гена, який описаний у даному описі, або його компле-менти. 2 - Поліпептиди Даний винахід відноситься також до варіантів, фрагментів, аналогів і похідних описаних у даному описі поліпептидів, включаючи мутантні Canlonбілки. Даний варіант може являти собою 1) варіант, в якому один або декілька амінокислотних залишків замінені консервативним або неконсервативним амінокислотним залишком, і такий заміщений амінокислотний залишок може кодуватися або може не кодуватися за допомогою генетичного коду, або 2) варіант, в якому один або декілька амінокислотних залишків включають заміщену груп у, або 3) варіант, в якому мутантний Canlon зливається з іншою сполукою, такою, наприклад, як сполука, яка збільшує час напівжиття даного поліпептиду (наприклад, поліетиленгліколь), або 4) варіант, в якому додаткові амінокислоти зливаються з мутантним Canlon, такою, наприклад, як лідерна або секреторна послідовність або послідовність, яку використовують для виділення очищенням мутантного Canlon, або препротеїнова послідовність. Ці варіанти вважаються такими, що знаходяться у компетенції фахівців у даній області техніки. Поліпептидний фрагмент являє собою поліпептид, що володіє послідовністю, яка ідентична частині, але не всій даній поліпептидній послідовності, переважно поліпептид, що кодується Canlon-геном і його варіантами. Що стосується амінокислотної заміни в амінокислотній послідовності поліпептиду, відповідно до даного винаходу, одн у або декілька амінокислот можна замінити "еквівалентними" амінокислотами. Вираз "еквівалентна" амінокислота використовують у даному описі для позначення будь-якої амінокислоти, яка може бути замінена однією або декількома амінокислотами, що володіють аналогічними властивостями, за умови, що фахівці в області хімії пептидів можуть передбачати вторинну структуру і гідропатичну природу даного поліпептиду, які будуть залишатися практично незміненими. Переважно наступні групи амінокислот відповідають еквівалентним змінам: (1) Ala, Pro, Gl y, Glu, Asp, Gln, Asn, Ser, Thr; (2) Cys, Ser, Tyr, Thr; (3) Val, Ile, Leu, Met, Ala, Phe; (4) Lys, Arg, His; (3) Phe, Tyr, Tip, His. Специфічний варіант здійснення модифікованої пептидної Canlon-молекули, що представляє інтерес, відповідно до даного винаходу, включає, але не обмежується вказаним, пептидну молекулу, яка стійка до протеолізу, в якій пептидний зв'язок CONH- модифікований і замінений відновленим зв'язком (CH2NH), зв'язком retro inverso (NHCO), метиленоксизв'язком (СН2-О), тіометиленовим зв'язком (CH2-S), карбозв'язком (СН2СН2), ацетометиленовим зв'язком (СО-СН2), гідроксіетилено 25 79927 вим зв'язком (СНОН-СН2), N-N-зв'язком, E-alcenзв'язком або –СН=СН-зв'язком . До даного винаходу включений Canlon-поліпептид людини або його фрагмент, або його варіант, в якому, щонайменше, один пептидний зв'язок був модифікований, як описано вище. Такі фрагменти можуть бути "автономними", тобто, не бути частиною або такими, що злилися з іншими поліпептидами, або вони можуть бути включені в окремий великий поліпептид, в якому вони утворюють сегмент або ділянку. Разом з тим, декілька фрагментів можна включити в один великий поліпептид. Як репрезентативні приклади поліпептидних фрагментів даного винаходу у даному описі можна вказати на фрагменти, які володіють довжиною приблизно 5, 6, 7, 8, 9 або 10-15, 10-20, 15-40 або 30-55 амінокислот. Переважними є фрагменти, що містять, принаймні, мутацію однієї амінокислоти у білок Canlon. Ідентичність нуклеїнових кислот або поліпептидів Терміни "процент ідентичності послідовностей" і "процент гомології", що використовуються у даному описі взаємозамінно, застосовують для порівняння полінуклеотидів або поліпептидів, і визначають за допомогою порівняння двох оптимально вирівняних послідовностей у вікні порівняння, де частина полінуклеотидної або поліпептидної послідовності у вікні порівняння може включати додавання або делеції (тобто, пропуски) при порівнянні з вихідною послідовністю (яка не включає додавання або делеції) для оптимального вирівнювання двох даних послідовностей. Вказаний процент обчислюють шляхом визначення числа позицій, по яких у обох послідовностей спостерігаються ідентичні основи нуклеїнових кислот або амінокислотні залишки, з одержанням відповідних позицій, діленням числа відповідних позицій на загальне число позицій у даному вікні порівняння і множенням одержаного результату на 100 з одержанням процента ідентичності послідовностей. Гомологію оцінюють з використанням будь-якого з великої кількості різноманітних алгоритмів порівняння послідовностей і програм, відомих у даній області техніки. Такі алгоритми і програми включають, але жодним чином не обмежуються, TBLASTN, BL ASTP, FASTA, TFASTA і CLUSTALW (Pearson and Lipman, 1988; Altschul і співавт., 1990; Thompson і співавт., 1994; Higgins і співавт., 1996; Altschul і співавт., 1990; Altschul і співавт., 1993). В особливо переважному варіанті здійснення даного винаходу гомології послідовностей білків і нуклеїнових кислот оцінюють з використанням Basic Local Alignment Search Tool ("BLAST"), що добре відомий у даній області техніки (див., наприклад, Karlin and Altschul, 1990; Altschul і співавт., 1990, 1993, 1997). Зокрема, п'ять специфічних BLASTпрограм використовуються для виконання наступної задачі: (1) BLASTP і BLAST3 порівнюють запитуван у амінокислотну послідовність з послідовністю білка бази даних; 26 (2) BLASTN порівнює запитуван у нуклеотидну послідовність з нуклеотидною послідовністю бази даних; (3) BLASTX порівнює уявні продукти трансляції шести рамок запитуваної н уклеотидної послідовності (обидва ланцюги) з послідовністю білка бази даних; (4) TBLASTN порівнює запитувану послідовність білка з нуклеотидною послідовністю бази даних, що транслюється з усіх шести відкритих рамок зчитування (обидва ланцюги); і (5) TBLASTX порівнює трансляцію шести рамок запитуваної нуклеотидної послідовності з трансляцією шести рамок нуклеотидної послідовності бази даних. BLAST-програми ідентифікують гомологічні послідовності шляхом ідентифікації схожих сегментів, які іменуються у даному описі як "високооцінювані пари сегментів", між амінокислотною або нуклеотидною послідовністю, що представляє інтерес, і тест-послідовністю, яку переважно одержують з послідовності білка або нуклеотидної послідовності бази даних. Високооцінювані пари сегментів переважно ідентифікують (тобто, розміщують) за допомогою способів оцінки матриці, багато з яких добре відомі у даній області техніки. Матриця оцінок, що переважно використовується, являє собою ВLOSUM62-матрицю [Connet і співавт., 1992; Henikoff and Henikoff, 1993]. З меншою перевагою можна також використовувати матриці РАМ або РАМ250 [див., наприклад, Schwartz and Dayhoff, eds., 1978]. BLAST-програми оцінюють статистичну значимість високооцінюваних пар сегментів, що ідентифікуються, і переважно відбирають ті сегменти, які задовольняють порогу значимості, що встановлюється користувачем, такому як процент, який встановлюється користувачем гомології. Переважно статистична значимість високооцінюваної пари сегментів оцінюється з використанням формули статистичної значимості Карліна [див., наприклад, Karlin and Altschul, 1990]. BLAST-програми можуть використовуватися зі значеннями параметрів за умовчанням або з модифікованими параметрами, створеними користувачем. Жорсткі умови гібридизації З метою охарактеризувати таку н уклеїнову кислоту, що гібридизується, відповідно до даного винаходу, жорсткі умови гібридизації є наступними: стадію гібридизації здійснюють при 65°С в присутності 6´SSC-буфера, 5´розчину Денхардта, 0,5% SDS і 100мкг/мл ДНК сперми лосося. Стадію гібридизації здійснюють з наступними чотирма стадіями відмивання: - два відмивання по 5хв., переважно при 65°С в 2´SSC і 0,1% SDS-буфері; - одне відмивання 30хв., переважно при 65°С в 2´SSC і 0,1% SDS-буфері, - одне відмивання 10хв., переважно при 65°С в 0,1´SSC і 0,1% SDS-буфері, дані умови гібридизації придатні для молекули нуклеїнової кислоти довжиною близько 20 нуклеотидів. Немає необхідності говорити про те, що описані вище умови гібридизації адаптують відпо 27 79927 відно до довжини необхідної нуклеїнової кислоти, дотримуючись методів, добре відомих фахівцям у даній області техніки. Придатні умови гібридизації можна, наприклад, адаптувати відповідно до вказівок, [викладених у книзі Hames і Higgins (1985)] Геномні послідовності Canlon-гена У даному винаході розглядають геномну послідовність Canlon. Даний винахід включає в себе Canlon-ген або геномні Canlon-послідовності, що складаються, або в основному складаються з, або включають послідовність SEQ ID Nos 1-3, комплементарну їй послідовність, а також її фрагменти і варіанти. Дані полінуклеотиди можуть являти собою полінуклеотиди, виділені очищенням, виділені або рекомбінантні. Даний винахід включає в себе також виділений очищенням, виділений або рекомбінантний полінуклеотид, що включає н уклеотидну послідовність, яка володіє, щонайменше, 70, 75, 80, 85, 90 або 95% нуклеотидною ідентичністю з нуклеотидною послідовністю SEQ ID Nos 1-3 або з її комплементарною послідовністю, або з її фрагментом. Нуклеотидні відмінності, що стосуються нуклеотидної послідовності SEQ ID Nos 1-3, можуть бути, як правило, розподілені випадково по всій довжині нуклеїнової кислоти. Проте, переважними нуклеїновими кислотами є ті з них, в яких нуклеотидні відмінності, що стосуються нуклеотидної послідовності SEQ ID Nos 1-3, переважно локалізовані за межами даних послідовностей, що кодують, які містяться в екзонах. Дані нуклеїнові кислоти, а також їх фрагменти і варіанти, можуть використовуватися як олігонуклеотидні праймери або зонди з метою виявлення наявності копії Canlon-гена у тест-вибірці або, альтернативно, з метою ампліфікувати нуклеотидну послідовність-мішень в Canlon-послідовностях. Інший об'єкт даного винаходу складається з виділеної очищенням, виділеної або рекомбінантної нуклеїнової кислоти, яка гібридизується з нуклеотидною послідовністю SEQ ID Nos 1-3 або з комплементарною їй послідовністю, або з її варіантом, у жорстких гібридизаційних умовах, як вказано вище. У переважних варіантах здійснення даного винаходу вказана виділена очищенням, виділена або рекомбінантна нуклеїнова кислота специфічно гібридизується з полінуклеотидами Canlon-гена людини, більш переважно, якщо вказана нуклеїнова кислота здатна гібридизуватися з нуклеотидами з Canlon-гена людини, але практично нездатна гібридизуватися з нуклеотидною послідовністю Canlon-гена щура. Особливо переважна нуклеїнова кислота даного винаходу включає виділені, виділені очищенням або рекомбінантні полінуклеотиди, що включають безперервну ділянку послідовності, щонайменше, з 12, 15, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 500, 1000,2000, 3000, 4000, 5000 або 10000 нуклеотидів з SEQ ID Nos 13 або з її комплементів. Потрібно зазначити, що нуклеотидні фрагменти будь-якого розміру і послідовності можуть також включатися у полінуклеотиди, описані у даному розділі. 28 Геномна нуклеїнова кислота Canlon включає 44 екзони. Розташування екзонів у SEQ ID Nos 1-3 докладно представлене нижче у Таблиці В. Таблиця В Положення в SEQ ID No 1 Початок Кінець 1 2001 2026 2 19188 19334 3 22996 23178 4 39731 39814 5 41337 41476 6 41565 41693 7 73013 73167 Положення Екзон в SEQ ID No 2 Початок Кінець 8 43726 43868 9 43998 44102 10 52093 52179 11 77568 77699 12 98226 98393 13 106567 106758 14 144246 144246 15 159794 159868 16 191292 191428 17 192967 193108 18 211540 211613 19 225006 225107 20 225544 225613 21 228450 228541 22 228630 228752 23 231289 231345 24 231589 231709 25 231813 231944 26 232900 233067 27 235355 235459 Положення Екзон в SEQ ID No 3 Початок Кінець 28 3895 4001 29 9611 9731 30 9816 9914 31 15776 15869 32 16382 16488 33 16697 16771 34 17934 18053 35 23644 23712 36 24928 25076 37 25913 26006 38 30767 30899 39 31561 31676 40 34044 34201 41 37493 3763 42 39652 39801 43 41563 41680 44 44131 45841 Екзон Інтрон 1 2 3 4 5 6 Інтрон 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Інтрон 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 Положення в SEQ ID No 1 Початок Кінець 2027 19187 19335 22995 23179 39730 39815 41336 41477 41564 41694 73012 Положення в SEQ ID No 2 Початок Кінець 43869 43997 44103 52092 52180 77567 77700 98225 98394 106566 106759 144108 144247 159793 159869 191291 191429 192966 193109 211539 211614 225005 225108 225543 225614 228449 228542 228629 228753 231288 231346 231588 231710 231812 231945 232899 233068 235354 Положення в SEQ ID No 3 Початок Кінець 4002 9610 9732 9815 9915 15775 15870 16381 16489 16696 16772 17933 18054 23643 23713 24927 25077 25912 26007 30766 30900 31560 31677 34073 34202 37492 37644 39651 39802 41562 41681 44130 Таким чином, даний винахід містить виділені очищенням, виділені або рекобінантні полінуклеотиди, що включають нуклеотидну послідовність, вибрану з групи, яка складається, кожна, з 44 екзонів Canlon-гена і, кожна, - з комплементарної їй послідовності. У даному винаході забезпечуються також виділені очищенням, виділені або рекомбінантні нуклеїнові кислоти, що включають поєднання, щонайменше, з двох екзонів Canlon-гена, в 29 79927 якому дані полінуклеотиди розміщені у нуклеїновій кислоті, від 5'-кінця до 3'-кінця вказаної нуклеїнової кислоти, у тому ж порядку, що і в SEQ ID No 1-3. Інтрон 1 відноситься до нуклеотидної послідовності, локалізованої між Екзоном 1 і Екзоном 2, і так далі. Положення інтронів детально представлене у Таблиці А. Таким чином, даний винахід містить виділені очищенням, виділені або рекобінантні долінуклеотиди, що включають нуклеотидну послідовність, вибрану з групи, яка складається з 43 інтронів Canlon-гена, або комплементарну їй послідовність. Хоча даний розділ називається "Геномні Послідовності Canlon", потрібно мати на увазі, що нуклеотидні фрагменти будь-якого розміру і послідовності можуть також включатися у полінуклеотиди, описані у даному розділі, фланкуючи дані геномні послідовності Canlon на будь-якій стороні або між двома або більше такими геномними послідовностями. кДНК-послідовності Canlon Показано, що експресія Canlon-гена приводить до продукування, щонайменше, одного з видів мРНК, послідовності нуклеїнової кислоти, яка приведена в SEQ ID No 4. Інший об'єкт даного винаходу являє собою виділену очищенням, виділену або рекомбінантну нуклеїнову кислоту, що включає нуклеотидну послідовність SEQ ID No 4, комплементарні їй послідовності, а також алельні варіанти, та її фрагменти. Крім того, переважні полінуклеотиди даного винаходу включають виділені очищенням, виділені або рекомбінантні кДНК Canlon, що складаються, в основному складаються з або включають послідовність SEQ ID No 4. Особливо переважні нуклеїнові кислоти даного винаходу включають виділені, виділені очищенням або рекомбінантні полінуклеотиди, що включають безперервну ділянку послідовності, щонайменше, з 12, 15, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 500, 1000, 2000, 3000, 4000, 5000 або 6000 нуклеотидів з SEQ ID No 4 або з її комплементів. У переважних варіантах здійснення даного винаходу вказана безперервна ділянка послідовності включає зв'язаний з Canlon двоалельний маркер; переважно вибраний з групи, що складається з А12 або А16. До даного винаходу відноситься також виділена очищенням або виділена нуклеїнова кислота, яка включає полінуклеотид, що володіє, щонайменше, 95% нуклеотидною ідентичністю з полінуклеотидом SEQ ID No 4, переважно 99% нуклеотидною ідентичністю, переважно 99,5% нуклеотидною ідентичністю і найбільш переважно 99,8% нуклеотидною ідентичністю з полінуклеотидом SEQ ID No 4, або комплементарна їй послідовність або її біологічно активний фрагмент. Інша мета даного винаходу має відношення до виділених очищенням, виділених або рекомбінантних н уклеїнових кислот, що включають полінуклеотид, який гібридизується у сформульованих у даному описі жорстких умовах гібридизації з полінуклеотидом SEQ ID No 4, або з комплементарною йому послідовністю або з його варіантом, або з його біологічно активним фрагментом. 30 Додаткова мета даного винаходу має відношення до виділеного, виділеного очищенням або рекомбінантного полінуклеотиду, який кодує Canlon-поліпептид, що включає безперервну ділянку послідовності, щонайменше, з 6 амінокислот SEQ ID No 5, в якому вказана безперервна ділянка послідовності включає, щонайменше, 1, 2, З, 5 або 10 амінокислотних позицій 277, 338, 574, 678, 680, 683, 691, 692, 695, 696, 697, 894, 1480, 1481, 1483, 1484, 1485, 1630, 1631, 1632, 1636, 1660, 1667, 1707, 1709 SEQ ID No 5. Включений також виділений, виділений очищенням або рекомбінантний полінуклеотид, який кодує Canlon-поліпептид, що включає амінокислотну послідовність SEQ ID No 5, або її похідні або біологічно активні фрагменти, а також виділений, виділений очищенням або рекомбінантний полінуклеотид, який кодує Canlonполіпептид, ідентичний, щонайменше, на 80, 85, 90, 95, 98, 99, 99,5 або 99% амінокислотній послідовності SEQ ID No 5. кДНК SEQ ID No 4 включає 5'-UTR-ділянку, що починається від нуклеотиду у положенні 1 і закінчується нуклеотидом у положенні 65 SEQ ID No 4. кДНК з SEQ ID No 4 включає 3'-UTR-ділянку, що починається від нуклеотиду у положенні 5283 і закінчується нуклеотидом у положенні 6799 SEQ ID No 4. Отже, у даному винаході розглядається виділена очищенням, виділена або рекомбінантна нуклеїнова кислота, що включає нуклеотидну послідовність 5'-UTR з кДНК Canlon, комплементарну їй послідовність, або її алельний варіант. У даному винаході розглядається також виділена очищенням, виділена або рекомбінантна нуклеїнова кислота, що включає н уклеотидну послідовність 3'UTR з кДНК Canlon, комплементарну їй послідовність, або її алельний варіант. Хоча даний розділ називається "кДНКпослідовності Canlon", потрібно мати на увазі, що нуклеотидні фрагменти будь-якого розміру і послідовність можуть бути також включені у полінуклеотиди, описані у даному розділі, фланкуючи геномні послідовності Canlon на будь-якій стороні або між двома або декількома такими геномними послідовностями. Ділянки, що кодують Відкрита рамка зчитування Canlon міститься у відповідній мРНК з SEQ ID No 4 кДНК. Точніше, ефективна послідовність (CDS), що кодує Canlon, включає ділянку між нуклеотидною позицією 66 (перший нуклеотид ATG-кодону) і нуклеотидною позицією 5282 (кінцевий нуклеотид TGA-кодону) з SEQ ID No 4. Даний винахід включає також виділені, виділені очищенням і рекомбінантні полінуклеотиди, які кодують поліпептиди, що включають безперервну ділянку послідовності, щонайменше, з 6 амінокислот, переважно, щонайменше, 8 або 10 амінокислот, більш переважно, щонайменше, 12, 15, 20, 25, 30, 40, 50, 100, 200, 300, 400, 500, 700 або 1000 амінокислот SEQ ID No 5. Розкритий вище полінуклеотид, який містить послідовність Canlon-гена, що кодує, може експресува тися у необхідній клітині-хазяїні або у необхідному організмі-хазяїні, якщо даний полінуклеотид помістити під контроль відповідних 31 79927 експресійних сигналів. Експресійні сигнали можуть являти собою або експресійні сигнали, що містяться у регуляторних районах Canlon-гена даного винаходу, або на противагу сигнали можуть являти собою екзогенні регуляторні послідовності нуклеїнових кислот. Такий полінуклеотид, поміщений під відповідні експресійні сигнали, можна також вбудувати у вектор для його експресії і/або ампліфікації. Регуляторні Canlon-послідовності Як відмічено, геномна послідовність Canlonгена містить регуляторні послідовності як у 5'фланкувальній ділянці, що не кодує, так і у 3'фланкувальній ділянці, що не кодує, які обмежують ділянку, що кодує Canlon, яка містить 44 екзони даного гена. Полінуклеотиди, одержані з 5'- і 3'регуляторних ділянок, придатні для того, щоб виявити наявність, щонайменше, копії нуклеотидної послідовності Canlon або її фрагмента у зразку, що тестується. Промоторну активність 5'-регуляторних ділянок, що містяться у Canlon, можна оцінити, як описано нижче. Для того щоб ідентифікувати релевантні біологічно активні полінуклеотидні фрагменти або варіанти SEQ ID No 1, фахівців у даній області техніки можна відіслати до Sambrook і співавт., 1989, які описують використання рекомбінантного вектора, що несе маркерний ген (тобто, бетагалактозидазу, хлорамфеніколацетилтрансферазу і т.п.), експресію якого можна виявити при поміщенні його під контроль біологічно активних полінуклеотидних фрагментів або варіантів SEQ ID No 1. Геномні послідовності, локалізовані «лівіше» першого екзону Canlon-гена, клонують у відповідний промоторний репортерний вектор, такий як доступні від Clontech Промоторні репортерні вектори pSEAP-Basic, pSEAP-Enhancer, pβgal-Basic, pβgal-Enhancer або pEGFPl, або безпромоторний репортерний вектор гена люциферази від Promega pGL2-basic або pGL3-basic. Коротко кажучи, кожний з цих промоторних репортерних векторів включає велику кількість сайтів клонування, позиціонованих «лівіше» репортерного гена, що кодує білок, який легко піддається аналізу, такий як лужна фосфатаза, що секретується, люцифераза, βгалактозидаза або зелений флуоресцентний білок. Послідовності, розташовані «лівіше» від ділянки, що кодує Canlon, вбудовують у сайти клонування «лівіше» даного репортерного гена в обох орієнтаціях і вводять у відповідну клітину-хазяїна. Аналізують рівень репортерного білка і порівнюють з рівнем, одержаним для вектора, у якого відсутня вставка у сайт клонування. Наявність підвищеного рівня експресії у векторі, що містить вставку, у порівнянні з рівнем для контрольного вектора, свідчить про наявність промотору у даній вставці. За необхідності розташовані ліворуч послідовності можуть бути клоновані у вектори, які містять енхансер для збільшення рівнів транскрипції під слабкими промоторними послідовностями. Істотний рівень підвищеної експресії, яка спостерігається для вектора, що не має вставки, свідчить про те, що промоторна послідовність присутня у вбудованій ліворуч послідовності. 32 Промоторну послідовність, що розташована «лівіше» геномної ДНК, можна також визначити шляхом створення згрупованих 5' і/або 3' делецій у розташованій ліворуч ДНК з використанням традиційних методик, таких як обробка Екзонуклеазою III або обробка відповідною ендонуклеазою рестрикції. Одержані делеційні фрагменти можна вбудувати у даний промоторний репортерний вектор, щоб визначити, чи дійсно дана делеція знижує або знищує промоторну активність, як це описано, наприклад, у Coles і співавт. (1998), розкриття якої включене у даний опис за допомогою посилання у всій її повноті. Таким способом можна визначити межі промоторів. За бажанням можна ідентифікувати потенційні індивідуальні регуляторні сайти всередині промотору з використанням сайт-направленого мутагенезу або лінкерного сканування, які анулюють сайти зв'язування потенційних транскрипційних факторів всередині промотору, індивідуально або у поєднанні. Вплив таких мутацій на рівень транскрипції можна визначити шляхом вбудовування мутацій у сайти клонування промоторних репортерних векторів. Даний вид аналізу добре відомий фахівцям у даній області техніки і [описаний у WO 97/17359, Патенті США №5374544; ЕР 582796; Патенті США №5698389; Патенті США №5643746; Патенті США №5502176; і Патенті США №5266488]; розкриття яких включене у даний опис за допомогою посилання у всій їх повноті. Силу і специфічність промотору Canlon-гена можна оцінити через рівні експресії полінуклеотиду, що детектується, функціонально приєднаного до даного Canlon-промотору, у різних типах клітин і тканинах. Даний полінуклеотид, що детектується, може являти собою полінуклеотид, який специфічно гібридизується із заздалегідь визначеним олігонуклеотидним зондом, або полінуклеотид, що кодує білок, який детектується, у тому числі Canlonполіпептид або фрагмент або його варіант. Даний вид аналізу добре відомий фахівцям у даній області те хніки і [описаний у Патенті США №5502176; і Патенті СІЛА №5266488]; розкриття яких включене за допомогою посилання у всій їх повноті. Деякі способи обговорюються більш детально нижче. Полінуклеотиди, що несуть регуляторні елементи, локалізовані на 5' або на 3'-кінці ділянки, що кодує Canlon, можна переважно використовувати для контролю транскрипційної і трансляційної активності гетерологічного полінуклеотиду, що представляє інтерес. Таким чином, у даному винаході розглядається також виділена очищенням або виділена нуклеїнова кислота, що включає полінуклеотид, який вибраний з групи, що складається з 5'- і 3'регуляторних ділянок, або комплементарну йому послідовність, або її біологічно активний фрагмент або варіант. У переважних варіантах здійснення даного винаходу "5'-регуляторна ділянка" локалізована у нуклеотидній послідовності, розташованій між позиціями 1 і 2000 SEQ ID No 1. "3'регуляторна ділянка" локалізована у нуклеотидній послідовності, розташованій між позиціями 45842 і 47841 SEQ ID No 3. 33 79927 Даний винахід відноситься також до виділеної очищенням або виділеної нуклеїнової кислоти, що включає полінуклеотид, який володіє, щонайменше, 95% нуклеотидної ідентичності з полінуклеотидом, вибраним з групи, яка складається з 5' і 3' регуляторних ділянок, переважно 99% нуклеотидної ідентичності, переважно 99,5% нуклеотидної ідентичності і найбільш переважно 99,8% нуклеотидної ідентичності з полінуклеотидом, вибраним з групи, що складається з 5' і 3' регуляторних ділянок, або комплементарною йому послідовністю або його варіантом, або його біологічно активним фрагментом. Інший об'єкт даного винаходу включає виділені очищенням, виділені або рекомбінантні нуклеїнові кислоти, що включають полінуклеотид, який гібридизується у встановлених у даному описі жорстких умовах гібридизації з полінуклеотидом, вибраним з групи, яка складається з нуклеотидних послідовностей 5і і 3' регуляторних ділянок, або з комплементарною йому послідовністю або з його варіантом, або з його біологічно активним фрагментом. Переважні фрагменти 5'-регуляторної ділянки володіють довжиною близько 1500 або 1000 нуклеотидів, переважно близько 500 нуклеотидів, більш переважно близько 400 нуклеотидів, ще більш переважно близько 300 нуклеотидів і найбільш переважно близько 200 нуклеотидів. Переважні фрагменти 3'-регуляторної ділянки володіють, щонайменше, 50, 100, 150, 200, 300 або 400п.н. у довжину. "Біологічно активні" полінуклеотидні похідні SEQ ID Nos 1-3 являють собою полінуклеотиди, що включають або ж складаються з фрагмента вказаного полінуклеотиду, який є таким, що функціонує як регуляторна ділянка для експресування рекомбінантного поліпептиду або рекомбінантного полінуклеотиду у рекомбінантній клітині-хазяїні. Він повинен діяти або як енхансер, або як репресор. Для мети даного винаходу нуклеїнова кислота або полінуклеотид є "функціональними" як регуляторна ділянка для експресії рекомбінантного поліпептиду або рекомбінантного полінуклеотиду, якщо вказаний регуляторний полінуклеотид містить нуклеотидні послідовності, які містять інформацію про регуляцію транскрипції і трансляції, і такі послідовності "функціонально зв'язані" з нуклеотидними послідовностями, які кодують необхідний поліпептид або необхідний полінуклеотид. Регуляторні полінуклеотиди даного винаходу можна одержати з нуклеотидної послідовності SEQ ID Nos 1 і 3 за допомогою розщеплення з використанням відповідних ферментів рестрикції, що описано, наприклад, у книзі Sambrook і співавт. (1989). Регуляторні полінуклеотиди можна також одержати шляхом обробки SEQ ID Nos 1 і 3 ферментом екзонуклеазою, такою як Ва131 (Wabiko і співавт., 1986). Такі регуляторні полінуклеотиди можна також одержати за допомогою хімічного синтезу нуклеїнових кислот, як описано в іншому місці у даному описі. Регуляторні полінуклеотиди, відповідно до даного винаходу, можуть являти собою частину ре 34 комбінантного експресійного вектора, який можна використовува ти для експресії послідовності, що кодує, у необхідній клітині-хазяїні або організміхазяїні. Рекомбінантні експресійні вектори, відповідно до даного винаходу, описані в іншому місці даного опису. Переважний 5'-регуляторний полінуклеотид даного винаходу включає ділянку 5', що не транслюється, (5'-UTR) кДНК Canlon, або її біологічно активний фрагмент або її варіант. Переважний 3'-регуляторний полінуклеотид даного винаходу включає ділянку 3 і, що не транслюється, (3'-UTR) кДНК Canlon, або її біологічно активний фрагмент або її варіант. Додаткова мета даного винаходу включає виділену очищенням або виділену нуклеїнову кислоту, що включає: a) нуклеїнову кислоту, що включає регуляторну нуклеотидну послідовність, вибрану з групи, яка складається з: (і) нуклеотидної послідовності, що включає полінуклеотид з 5'-регуляторної ділянки або комплементарну їй послідовність; (іі) нуклеотидної послідовності, що включає полінуклеотид, який володіє, щонайменше, 95% нуклеотидної ідентичності з нуклеотидною послідовністю з 5'-регуляторної ділянки або з комплементарною їй послідовністю; (ііі) нуклеотидної послідовності, що включає полінуклеотид, який гібридизується у жорстких гібридизаційних умовах з нуклеотидною послідовністю з 5'-регуляторної ділянки або з комплементарною їй послідовністю; і (iv) біологічно активного фрагмента або варіанта полінуклеотидів в (і), (іі) і (ііі); b) полінуклеотид, який кодує необхідний поліпептид або нуклеїнову кислоту, що представляє інтерес, функціонально приєднану до нуклеїнової кислоти, вказаної вище в (а); c) факультативно, нуклеїнову кислоту, що включає 3'-регуляторний полінуклеотид, переважно 3'-регуляторний полінуклеотид Canlon-гена. У конкретному варіанті здійснення даного винаходу вказана вище нуклеїнова кислота відрізняється тим, що вказана нуклеїнова кислота включає ділянку 5', що не транслюється, (5'-UTR) кДНК Canlon, або її біологічно активний фрагмент або її варіант. В іншому конкретному варіанті здійснення даного винаходу вказана вище нуклеїнова кислота відрізняється тим, що вказана нуклеїнова кислота включає ділянку 3', що не транслюється, (3'UTR) кДНК Canlon, або її біологічно активний фрагмент або її варіант. Регуляторний полінуклеотид 5'-регуляторної ділянки або його біологічно активні фрагменти або варіанти, функціонально приєднують по 5'-кінцю полінуклеотиду, що кодує необхідний поліпептид або полінуклеотид. Регуляторний полінуклеотид 3'-регуляторної ділянки, або його біологічно активні фрагменти або варіанти, переважно функціонально приєднують по 3'-кінцю полінуклеотиду, що кодує необхідний поліпептид або полінуклеотид. 35 79927 Необхідний поліпептид, що кодується вказаною вище нуклеїновою кислотою, може мати різну природу або походження, включаючи білки прокаріотичного або еукаріотичного походження. Поліпептиди, які експресуються під контролем Canlonрегуляторної ділянки, включають антигени бактерій, грибів або вірусів. Включені також еукаріотичні білки, такі як внутрішньоклітинні білки, подібні білки "домашнього господарства", зв'язані з мембраною білки, подібні рецепторам, і білки, що секретуються, подібні ендогенним медіаторам, таким як цитокіни. Необхідний білок може бути Canlonбілком, зокрема, білком з амінокислотною послідовністю SEQ ID No 5, або фрагментом або його варіантом. Необхідні нуклеїнові кислоти, що кодуються вказаним вище полінуклеотидом, звичайно РНКмолекулою, можуть бути комплементарні необхідному полінуклеотиду, що кодує, наприклад, послідовності, яка кодує Canlon, і таким чином використовуватися як антисмисловий полінуклеотид. Такий полінуклеотид може включатися у рекомбінантний експресійний вектор, щоб експресувати необхідний поліпептид або необхідну нуклеїнову кислоту у клітині-хазяїні або в організмі-хазяїні. Відповідні рекомбінантні вектори, які містять полінуклеотид, такий як описаний у даному описі, розглядаються в іншому місці даного опису. Полінуклеотидні конструкції Терміни "полінуклеотидна конструкція" і "рекомбінантний полінуклеотид", що використовуються у даному описі взаємозамінно, відносяться до лінійних або кільцевих, виділених очищенням або виділених полінуклеотидів, які були штучно створені і які включають, щонайменше, дві нуклеотидні послідовності, що не виявляються у вигляді безперервних нуклеотидних послідовностей в їх вихідному природному оточенні. ДНК-конструкція, яка забезпечує пряму часову і просторову експресію Canlon-гена у рекомбінантних клітинах-хазяях і у трансгенних тваринах Для того щоб дослідити фізіологічні і фенотипічні наслідки відсутності синтезу Canlon-білка, як на клітинному рівні, так і на рівні мультиклітинного організму, у даний винахід включені також ДНКконструкції та рекомбінантні вектори, що забезпечують обумовлену експресію конкретного алеля Canlon-геномної послідовності або кДНК, а також копії даної геномної послідовності або кДНК, які містять заміни, делеції або додавання з однієї або більше основ, що стосується Canlon-нуклеотидної послідовності SEQ ID Nos 1-4, або її фрагмента, причому дані заміни, делеції або додавання основ локалізовані в екзоні, інтроні або регуляторній послідовності, але переважно у 5'-регуляторній послідовності або в екзоні Canlon-геномної послідовності, або в CanIon-кДНК SEQ ID No 4. У переважному варіанті здійснення Canlonпослідовність включає двоалельний маркер даного винаходу. У переважному варіанті здійснення даного винаходу Canlon-послідовність включає двоалельний маркер даного винаходу, переважно один з двоалельних маркерів А1-А17. Даний винахід містить рекомбінантні вектори, що включають будь-який один з полінуклеотидів, 36 описаних у даному винаході. Зокрема, полінуклеотидні конструкції, відповідно до даного винаходу, можуть включати будь-який з полінуклеотидів, описаних у розділі "Геномні Послідовності Canlonгена", у розділі "кДНК-послідовності Canlon", у розділі "Ділянки, що кодують" та у розділі "Олігонуклеотидні Зонди і Праймери". Першу переважну ДНК-конструкцію створюють на основі оперону стійкості до тетрацикліну tet з транспозону Тn10 Е. соїі для контролю експресії Canlon-гена так, [як описано у Gossen і співавт. (1992, 1995) і у Furth і співавт. (1994)]. Така ДНКконструкція містить сім tet-операторних послідовностей з Тn10 (tetop), які зливаються з мінімальним промотором або з 5'-регуляторною послідовністю Canlon-гена, причому вказаний мінімальний промотор або вказану Canlon-регуляторну послідовність функціонально приєднують до полінуклеотиду, що представляє інтерес, який кодує смисловий або антисмисловий олігонуклеотид або поліпептид, включаючи Canlon-поліпептид або його пептидний фрагмент. Дана ДНК-конструкція є функціональною як умовна експресійна система нуклеотидної послідовності, що представляє інтерес, де одна і та ж клітина включає нуклеотидну послідовність, що кодує репресор дикого типу (tТА) або мутантний (rТА) репресор, злитий з активуючим доменом вірусного білка VP16 з вірусу простого герпесу, поміщеного під контроль промотору, такого як HCMVIE1 енхансер/промотор або MMTV-LTR. Фактично переважна ДНК-конструкція даного винаходу включає як полінуклеотид, що містить tet-операторну послідовність, так і полінуклеотид, що містить послідовність, яка кодує репресор tТА або rТА. У конкретному варіанті здійсненні даного винаходу умовна експресійна ДНК-конструкція містить послідовність, яка кодує мутантний тетрацикліновий репресор rТА, причому експресія полінуклеотиду, що представляє інтерес, є такою, що мовчить, за відсутності тетрацикліну та індукується в його присутності. ДНК-конструкції, що забезпечують гомологічну рекомбінацію: замінні вектори Друга переважна ДНК-конструкція включає, від 5'-кінця до 3'-кінця: (а) першу нуклеотидну послідовність, яка включена в Canlon-геномну послідовність; (b) нуклеотидну послідовність, що включає позитивний селективний маркер, такий як маркер стійкості до неоміцину (nео); і (с) другу н уклеотидну послідовність, яка включена в Canlon-геномну послідовність і локалізована у геномі праворуч від першої Canlon-нуклеотидної послідовності (а). У переважному варіанті здійснення даного винаходу дана ДНК-конструкція включає також негативний селективний маркер, розташований ліворуч від нуклеотидної послідовності (а) або праворуч від нуклеотидної послідовності (с). Переважно, якщо негативний селективний маркер включає ген тимідинкінази (tk) [Thomas і співавт., 1986], ген бета-гігроміцину [Ті Ride і співавт., 1990], hprt-ген [Van der Lught і співавт., 1991; Reid і співавт., 1990] або фрагмент гена дифтерійного токсину A (Dt-A) [Nada і співавт., 1993; Yagi і співавт., 1990]. Переважно, якщо позитивний селективний 37 79927 маркер локалізований в екзоні Canlonпослідовності так, що розриває дану послідовність, яка кодує Canlon-білок. Дані замінні вектори [описані, наприклад, у Thomas і співавт. (1986; 1987), Mansour і співавт. (1988) і у Koller і співавт. (1992)]. Не має значення де розташува ти першу і др угу нуклеотидні послідовності (а) і (с) - в Canlonрегуляторній послідовності, в інтронній послідовності, в екзонній послідовності або у послідовності, що містить і регуляторну і/або інтронну, і/або екзонну послідовності. Розмір нуклеотидних послідовностей (а) і (с) коливається від 1 до 50т.п.н., переважно від 1 до 10т.п.н., більш переважно від 2 до 6т.п.н. і найбільш переважно від 2 до 4т.п.н. ДНК-конструкції, що забезпечують гомологічну рекомбінацію: Cre-LoxP-система Такі нові ДНК-конструкції використовують у сайт-специфічній рекомбінаційний системі фага Р1. Фаг P1 володіє рекомбіназою, що іменується Сrе, яка специфічно взаємодіє з 34 парами нуклеотидів loxP-сайта. Даний loxP-сайт складений з двох паліндромних послідовностей з 13п.н., розділених 8п.н. консервативної послідовності [Hoess і співавт., 1986]. Рекомбінація між двома loxPсайтами, що володіють ідентичною орієнтацією, за допомогою·Cre-ферменту приводила до видалення ДНК-фрагмента. Сrе-lохР-система, що використовується у поєднанні з методом гомологічної рекомбінації, вперше була [описана Gu і співавт. (1993, 1994)]. Коротко, нуклеотидну послідовність, що представляє інтерес, вбудовують у намічене місце геному, який містить, щонайменше, два loxP-сайти в одній і тій же орієнтації і розташованих на відповідних кінцях нуклеотидної послідовності, яку вирізають з даного рекомбінантного геному. Дана екцизійна подія вимагає присутності в ядрі рекомбінантної клітинихазяїна ферменту рекомбінази (Сrе). Фермент рекомбіназу можна внести у потрібний час або за допомогою (а) інкубації даних рекомбінантних клітин-хазяїв у культуральному середовищі, що містить даний фермент, за допомогою ін'єкції Creферменту прямо у потрібну клітину так, [як описано у Araki і співавт. (1995)], або шляхом введення даного ферменту у клітини-хазяї за допомогою ліпосом так, [як описано у Baubonies і співавт. (1993)]; (b) трансфекції клітини-хазяїна за допомогою вектора, що включає послідовність, яка кодує Сrе, функціонально приєднану до функціонального у даній рекобінантній клітині-хазяїні промотору, який необов'язково є таким, що індукується, причому вказаний вектор вводять у дану рекомбінантну клітину-хазяїна так, [як описано у Gu і співавт. (1993) і у Sauer і співавт. (1988)]; (с) введення у геном клітини-хазяїна полінуклеотиду, що включає послідовність, яка кодує Сrе, функціонально приєднану до функціонального у даній рекомбінантній клітині-хазяїні промотору, який необов'язково є таким, що індукується, а вказаний полінуклеотид вбудовується у геном клітини-хазяїна або внаслідок випадкового вбудовування, або внаслідок гомологічної рекомбінації так, [як описано у Gu і співавт. (1994)]. 38 У конкретному варіанті здійснення даного винаходу векторну послідовність, що містить послідовність, яку вбудовують у Canlon-ген за допомогою гомологічної рекомбінації, конструюють таким чином, щоб селективні маркери фланкувалися б loxP-сайтами в одній і тій же орієнтації внаслідок обробки Cre-ферментом і можливо було здійснити видалення селективних маркерів, залишаючи Canlon-послідовності, що представляють інтерес, які були вбудовані за допомогою гомологічної рекомбінації. Знову необхідні два селективних маркери: позитивний селективний маркер - для відбору за рекомбінаційною подією, і негативний селективний маркер - для відбору за подією гомологічної рекомбінації. Вектори і способи з використанням Cre-loxP-системи [описуються у Zou і співавт. (1994)]. Відповідно до цього, третя переважна ДНКконструкція даного винаходу включає, від 5'-кінця до 3'-кінця: (а) першу н уклеотидну послідовність, яка включається в Canlon-геномну послідовність; (b) нуклеотидну послідовність, що включає полінуклеотид, який кодує позитивний селективний маркер, причому вказана нуклеотидна послідовність додатково включає дві послідовності, що визначають сайт, який пізнається рекомбіназою, такий як loxP-сайт, і дані два сайти розміщуються у тій же самій орієнтації; і (с) другу н уклеотидну послідовність, яка включається в Canlon-геномну послідовність і локалізується у даному геномі праворуч від першої Canlon-нуклеотидної послідовності (а). Послідовності, що визначають сайт, який пізнається рекомбіназою, такий як loxP-сайт, переважно розташовані у нуклеотидній послідовності (b) у відповідних місцях, що межують з нуклеотидною послідовністю, яку необхідно вирізати. В одному з конкретних варіантів здійснення даного винаходу два lохР-сайти розташовані з кожної сторони послідовності позитивного селективного маркера для того, щоб забезпечити її вирізання у потрібний час після проявлення події гомологічної рекомбінації. У переважному варіанті здійснення способу з використанням описаної вище третьої ДНКконструкції, вирізання полінуклеотидного фрагмента, обмеженого двома сайгами, які пізнаються рекомбіназою, переважно двома lохР-сайтами, здійснюють у потрібний момент, обумовлений наявністю у геномі рекомбінантної клітини-хазяїна послідовності, що кодує Cre-фермент, функціонально приєднаний до промоторної послідовності, промотору, що переважно індукується, більш переважно до тканинноспецифічної промоторної послідовності і найбільш переважно до промоторної послідовності, яка одночасно є і такою, що індукується, і тканинноспецифічною, [як це описано у Gu і співавт. (1994)]. Наявність Cre-ферменту у геномі рекомбінантної клітини-хазяїна може бути наслідком схрещування двох трансгенних тварин, де перша трансгенна тварина несе створену Canlonпослідовність, яка представляє інтерес, що містить описані вище loxP-сайти, а друга трансгенна тварина несе послідовність, що кодує Сrе, функціона 39 79927 льно приєднану до відповідної промоторної послідовності, [так як це описано у Gu і співавт. (1994)]. Просторово-часовий контроль експресії Creферменту можна також здійснити на основі аденовірусного вектора, який містить Cre-ген, забезпечуючи тим самим зараження клітин або in vivo зараження органів, для доставки Cre-ферменту, [так як це описано у Anton and Graham (1995) і у Kanegae і співавт. (1995)]. Описані вище ДНК-конструкції можна використовувати для введення необхідної нуклеотидної послідовності даного винаходу, переважно Canlonгеномної послідовності або кДНК-послідовності Canlon, але більш переважно - для введення зміненої копії геномної або кДНК-послідовності Canlon, у заздалегідь визначене місцеположення цільового геному, що приводить або до утворення зміненої копії цільового гена (нокаутна гомологічна рекомбінація), або до заміни копії цільового гена іншою копією, досить гомологічною, щоб забезпечити проходження гомологічної рекомбінації (гомологічна рекомбінація з вбиванням). У конкретному варіанті здійснення даного винаходу описані вище ДНК-конструкції можуть використовуватися для вбудовування Canlon-геномної послідовності або кДНК-послідовності Canlon, що включає, щонайменше, один двоалельний маркер даного винаходу, переважно, щонайменше, один двоалельний маркер, вибраний з групи, яка складається з А1-А17. Ядерні антисмислові ДНК-конструкції Інші композиції містять вектор даного винаходу, який включає олігонуклеотидний фрагмент нуклеотидної послідовності SEQ ID No 4, переважно фрагмент, що включає старт-кодон Canlonгена, як антисмисловий засіб, який пригнічує експресію відповідного Canlon-гена. Переважні способи з використанням антисмислового полінуклеотиду, відповідно до даного винаходу, представлені методиками, [описаними у Sczakiel і співавт. (1995) або методиками, описаними у РСТ-Заявці №WO 95/24223], розкриття яких включене у даний опис за допомогою посилання у всій їх повноті. Переважно, антисмислові засоби вибрані серед полінуклеотидів (довжиною 15-200п.н.), які є комплементарними 5'-кінцю мРНК Canlon. В одному з варіантів здійснення даного винаходу використовується поєднання різних антисмислових полінуклеотидів, які є комплементарними різним частинам необхідного цільового гена. Переважні антисмислові полінуклеотиди, відповідно до даного винаходу, є комплементарними послідовності багатьох мРНК Canlon, які містять або кодон ініціації трансляції ATG, або сайт сплайсингу. Крім того, переважні антисмислові полінуклеотиди, відповідно до даного винаходу, є комплементарними сайту сплайсингу мРНК Canlon. Переважно, якщо антисмислові полінуклеотиди даного винаходу володіють 3 і-сигналом поліаденілювання, який замінений рибозимною послідовністю, що саморозщеплюється, так, щоб транскрипти РНК-полімерази II виходили без полі(А) на їх 3'-кінцях, причому дані антисмислові полінуклеотиди виявляються нездатними вийти з 40 ядра, [що описано у Liu і співавт. (1994)]. У переважному варіанті здійснення даного винаходу ці Canlon-антисмислові полінуклеотиди включають також, у рибозимній касеті, гістонову шпилькову структур у, яка стабілізує транскрипти, що розщеплюються, від 3'-5'-екзонуклеолітичної деградації, [така структура описана у Eckner і співавт. (1991)]. Олігонуклеотидні зонди і праймери Полінуклеотиди, одержані з Canlon-гена, придатні для виявлення присутності у зразку, що тестується, щонайменше, копії нуклеотидної послідовності SEQ ID Nos 1-4 і 6, або її фрагмента, комплементу, або варіанта. Особливо переважні зонди і праймери даного винаходу включають виділені, виділені очищенням або рекомбінантні полінуклеотиди, що включають безперервну ділянку послідовності, щонайменше, з 12, 15, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80,90, 100, 150, 200, 500, 1000, 2000, 5000, 10000 або 20000 нуклеотидів SEQ ID Nos 1-3 або їх комплементів. Крім того, переважні зонди і праймери даного винаходу включають виділені, виділені очищенням або рекомбінантні полінуклеотиди, в яких вказана безперервна ділянка послідовності включає двоалельний маркер, вибраний з групи, що складається з А1-А17. Інша мета даного винаходу полягає в одержанні виділеної очищенням, виділеної або рекомбінантної нуклеїнової кислоти, яка включає нуклеотидну послідовність SEQ ID No 4, комплементарні їй послідовності, а також алельні варіанти та їх фрагменти. Крім того, переважні зонди і праймери даного винаходу включають виділену очищенням, виділену або рекомбінантну Canlon-кДНК, шо складається з, фактично складається з або включає послідовність SEQ ID No 4. Особливо переважні зонди і праймери даного винаходу включають виділені, виділені очищенням або рекомбінантні полінуклеотиди, що включають безперервну ділянку послідовності, щонайменше, з 12, 15, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 500, 1000, 2000, 3000, 4000, 5000 або 6000 нуклеотидів SEQ ID No 4 або їх комплементів. Крім того, переважні зонди і праймери даного винаходу включають виділені, виділені очищенням або рекомбінантні полінуклеотиди, що включають безперервну ділянку послідовності, щонайменше, з 12, 15, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 500, 1000, 2000, 3000, 4000, 5000 або 6000 нуклеотидів SEQ ID No 4 або їх комплементів, де вказана безперервна ділянка послідовності включає двоалельний маркер, вибраний з групи, яка складається з А12 і А16. У додаткових варіантах здійснення даного винаходу зонди і праймери даного винаходу включають виділені, виділені очищенням або рекомбінантні полінуклеотиди, що включають безперервну ділянку послідовності, щонайменше, з 12, 15, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 300 або 400 нуклеотидів SEQ ID No 6 або їх комплементів. У переважних варіантах здійснення даного винаходу вказана безперервна ділянка послідовності SEQ ID No 6 включає двоалельний маркер А18. 41 79927 Таким чином, даний винахід відноситься також до зондів нуклеїнових кислот, які відрізняються тим, що вони специфічно гібридизуються в описаних вище жорстких умовах з нуклеїновою кислотою, вибраною з групи, яка складається з Canlonнуклеотидних послідовностей SEQ ID No 1-3 людини, її варіантів або послідовності, комплементарної їй. В одному з варіантів здійснення даного винаходу включені виділені, виділені очищенням і рекомбінантні полінуклеотиди, які складаються або в основному складаються з безперервної ділянки послідовності з 8-50 нуклеотидів якої-небудь однієї SEQ ID Nos 1-4 або 6, або її комплементів, де вказана ділянка включає зв'язаний з Canlon двоалельний маркер у вказаній послідовності; де необов'язково вказаний зв'язаний з Canlon двоалельний маркер вибраний з групи, що складається з Α1Α18, та її комплементів, або, необов'язково, дані двоалельні маркери зчеплені при порушенні рівноваги. Де, необов'язково, вказана ділянка складає у довжину 18-35 нуклеотидів, а вказаний двоалельний маркер знаходиться у межах 4 нуклеотидів від центра вказаного полінуклеотиду; де необов'язково вказаний полінуклеотид складається з вказаної безперервної ділянки послідовності і вказана безперервна ділянка послідовності складає 25 нуклеотидів у довжину, а вказаний двоалельний маркер знаходиться у центрі вказаного полінуклеотиду; де необов'язково 3'-кінець вказаної ділянки безперервної послідовності представлений на 3'-кінці вказаного полінуклеотиду; і де необов'язково 3'-кінець вказаної безперервної ділянки послідовності розташований на 3'-кінці вказаного полінуклеотиду, а вказаний двоалельний маркер представлений на 3'-кінці вказаного полінуклеотиду. У переважному варіанті здійснення даного винаходу вказані зонди включають, складаються або в основному складаються з послідовності, вибраної з наступних послідовностей: Р1-Р18 та комплементарних їм послідовностей. В іншому варіанті здійснення даний винахід включає в себе виділені, виділені очищенням і рекомбінантні полінуклеотиди, які включають, складаються, в основному складаються з безперервної ділянки послідовності 8-50 нуклеотидів SEQ ID Nos 1-4, або їх комплементів, де 3'-кінець вказаної безперервної ділянки послідовності розташований на 3'-кінці вказаного полінуклеотиду, і де 3'-кінець вказаного полінуклеотиду розташований у межах 20 нуклеотидів ліворуч від зв'язаного з Canlon двоалельного маркера у вказаній послідовності; де, необов'язково, вказаний двоалельний маркер, зв'язаний з Canlon, вибраний з групи, яка складається з А1-А18, та їх комплементів, або необов'язково двоалельні маркери, до того ж, зчеплені при порушенні рівноваги; де необов'язково 3'-кінець вказаного полінуклеотиду розташований у вказаній послідовності 1 нуклеотидом «лівіше» від вказаного двоалельного маркера, зв'язаного з Canlon; і де, необов'язково, вказаний полінуклеотид складається, в основному, з послідовності, вибраної з наступних послідовностей: D1-D18 і Ε1-Е18. 42 Ще в одному варіанті здійснення даний винахід включає в себе виділені, виділені очищенням або рекомбінантні полінуклеотиди, які включають, складаються, в основному складаються, з послідовності, вибраної з наступних послідовностей: В1-В17 i С1-С17. У додатковому варіанті здійснення даний винахід включає в себе полінуклеотиди, що використовуються у гібридизаційному аналізі, аналізі, що секвенує, та в аналізі ферментного виявлення дефекту комплементарного спарювання для визначення нуклеотидної ідентичності двоалельного маркера, зв'язаного з Canlon, в SEQ ID Nos 1-4 і 6 або в їх комплементах, а також полінуклеотиди, що використовуються для ампліфікації нуклеотидних сегментів, які включають двоалельний маркер, зв'язаний з Canlon, в SEQ ID Nos 1-4 і 6 або в їх комплементах; де, необов'язково, вказаний двоалельний маркер, зв'язаний з Canlon, вибраний з групи, яка складається з А1-А18 та їх комплементів, або необов'язково двоалельні маркери зчеплені до того ж при порушенні рівноваги. У даному винаході розглядається використання полінуклеотидів, відповідно до даного винаходу, для визначення нуклеотидної ідентичності двоалельного маркера, зв'язаного з Canlon, переважно у гібридизаційному аналізі, аналізі, що секвенує, аналізі, що мікросеквенує, або методом ферментного виявлення дефекту комплементарного спарювання і ампліфікацією нуклеотидних сегментів, що включають двоалельний маркер, зв'язаний з Canlon. Зонд або праймер, відповідно до даного винаходу, володіє близько 8-1000 нуклеотидів у довжину або заданий, принаймні, 12, 15, 18, 20, 25, 35, 40, 50, 60, 70, 80, 100, 250, 500 або 1000 нуклеотидами у довжину. Більш переважно, довжина таких зондів і праймерів може коливатися від 8, 10, 15, 20 або 30-100 нуклеотидів, переважно від 10 до 50, більш переважно від 15 до 30 нуклеотидів. У коротких зондів і праймерів звичайно недостатньо специфічності для цільової послідовності нуклеїнової кислоти і, як правило, потрібні знижені температури для утворення досить стабільних гібридних комплексів з матрицею. Більш довгі зонди і праймери є такими, що дорого коштують у виготовленні і можуть іноді самогібридизуватися з утворенням шпилькових структур. Необхідну довжину для праймерів і зондів під конкретний комплекс аналітичних умов може емпірично визначити фа хівець у даній області техніки. Переважний зонд або праймер складається з нуклеїнової кислоти, що включає полінуклеотид, вибраний з групи нуклеотидних послідовностей Р1-Р18 та їх комплементарних послідовностей, В1-В17, С1-С17, D1-D18, Ε1-Е18, для яких відповідні місцеположення у списку послідовностей представлені у Таблицях 1, 2 і 3. Утворення стабільних гібридів залежить від температури плавлення (Тm) ДНК. Tm залежить від довжини праймеру або зонда, іонної сили даного розчину і вмісту G+C. Чим вище вміст G+C праймеру або зонда, тим вище температура плавлення, тому що G:C пари утримуються трьома Нзв'язками, тоді як А:Т пари утримуються тільки 43 79927 двома такими зв'язками. GC-вміст у зондах даного винаходу, як правило, коливається між 10 і 75%, переважно між 35 і 60%, і найбільш переважно між 40 і 55%. Праймери і зонди можна виготовити будь-яким відповідним способом, включаючи, наприклад, клонування та рестрикцію відповідних послідовностей, а також способом прямого хімічного синтезу, наприклад, таким як фосфодіефірний спосіб Narang і співавт. (1979), фосфодіефірний спосіб Brown і співавт. (1979), діетилфосфоамідитний спосіб Beaucage і співавт. (1981) і твердофазовий спосіб, [описаний в ЕР 0707592]. Зонди для детекції являють собою, як правило, послідовності нуклеїнових кислот або незаряджені аналоги нуклеїнових кислот, такі, наприклад, як пептидонуклеїнові кислоти, [які розкриті у Міжнародній Патентній Заявці WO 92/20702], морфолінові аналоги, [які описані у Патентах США №№5185444; 5034506 і 5142047]. Зонд може виявитися "таким, що не подовжується", оскільки додаткові dNTP неможливо додати до даного зонда. Всередині себе аналоги, як правило, не подовжуються, і зонди нуклеїнових кислот можуть виявлятися такими, що не подовжуються, через модифікацію 3'-кінця даного зонда, так що гідроксильна група вже не здатна брати участь в елонгації. Наприклад, 3'-кінець даного зонда може бути функціоналізований захопленням або детекцією мітки, щоб таким чином витратити або інакше блокувати дану гідроксильну груп у. З іншого боку, 3'гідроксильна група може просто відщепитися, заміститися або модифікуватися, [Патентна Заявка США, порядковий №07/049061, подана 19 квітня 1993p.], описує модифікації, які можуть використовуватися для надання зонду неподовжуваності. Будь-який полінуклеотид даного винаходу можна позначити за бажанням шляхом включення будь-якої мітки, відомої у даній області техніки, яка виявляється спектроскопічним, фото хімічним, біохімічним, імунохімічним або хімічним способом. Наприклад, мітки, що використовуються, включають радіоактивні речовини (у тому числі, Р32, S 35, Н3, І125), флуоресцентні барвники (у тому числі, 5бромдезоксиуридин, флуоресцеїн, ацетиламінофтор, дигоксигенін) або біотин. Переважно, полінуклеотиди мітять по їх 3'- і 5'-кінцях. Приклади нерадіоактивного мічення фрагментів нуклеїнових кислот [описані у Французькому патенті №FR7810975 або у Urdea і співавт. (1988), або у Sanchez-Pescador і співавт. (1988)]. Крім того, зонди, відповідно до даного винаходу, можуть мати структурні характеристики, які роблять можливим посилення сигналу, причому такими структурними характеристиками є, наприклад, розгалужені ДНКзонди, як ті, що [описані у Urdea і співавт. (1991) або в Європейському патенті №ЕР0225807 (Chiron)]. Мітку можна також використовувати для захоплення даного праймеру, з тим, щоб забезпечити іммобілізацію на твердому носії або даного праймеру, або подовженого продукту, такого як ампліфікована ДНК. Введена мітка приєднується до праймерів або до зондів і може являти собою зв'язувальний член, який утворює зв'язувальну пару 44 разом із специфічним зв'язувальним членом твердофазового реагенту (наприклад, біотин і стрептавідин). Тому, в залежності від типу мітки, що переноситься полінуклеотидом або зондом, її можна використовува ти для уловлювання або для виявлення ДНК-мішені. Крім того, потрібно мати на увазі, що створені у даному описі полінуклеотиди, праймери або зонди можуть, самі по собі, служити як мітка захоплення. Наприклад, у тому випадку, коли зв'язувальний член твердофазового реагенту являє собою послідовність нуклеїнової кислоти, його можна вибрати так, щоб він зв'язував комплементарну частину праймеру або зонда з тим, щоб іммобілізувати даний праймер або зонд на дану тверду фазу. У випадку якщо полінуклеотидний зонд сам служить як зв'язувальний член, фахівці повинні знати, що даний зонд буде містити послідовність або "хвіст", який не є комплементарним даній мішені. У тому випадку, якщо полінуклеотидний праймер сам служить як мітка захоплення, щонайменше, частина даного праймеру буде вільна для гібридизації з нуклеїновою кислотою на твердій фазі. Методи мічення ДНК добре відомі кваліфікованим фахівцям. Зонди даного винаходу придатні для багатьох цілей. Вони можуть, зокрема, використовуватися у Саузерн-гібридизації з геномною ДНК. Зонди можуть також використовуватися для виявлення продуктів ПЛР-ампліфікації. При використанні інших методик вони можуть також використовуватися для виявлення невідповідностей у Canlon-гені або мРНК. Вони можуть також використовуватися для виявлення експресії Canlon-гена, наприклад, у Нозерн-блоті. Будь-який полінуклеотид, праймер або зонд даного винаходу можна зручно іммобілізувати на твердий носій. Тверді носії добре відомі фахівцям у даній області техніки і включають стінки ямок реакційної кювети, пробірки, кульки з полістиролу, магнітні кульки, смужки нітроцелюлози, мембрани, мікрочастинки, такі як латексні частинки, еритроцити барана (або іншої тварини), duracytes та інші. Твердий носій не є ключовим і його може вибрати фа хівець у даній області техніки. Таким чином, латексні частинки, мікрочастинки, намагнічені і ненамагнічені кульки, мембрани, пластмасові пробірки, стінки ямок для мікротитрування, скляне або силіконове кришиво, еритроцити барана (або інших відповідних тварин) і duracytes (мозкові оболонки), всі, являють собою відповідні моделі. Відповідні способи іммобілізації нуклеїнових кислот на твердих фазах включають іонну, гідрофобну, ковалентну взаємодію і т.п.Твердий носій, що використовується у даному описі відноситься до будь-якого нерозчинного матеріалу, або його можна зробити нерозчинним у подальшій реакції. Твердий носій можна вибрати відповідно до його здатності притягувати та іммобілізувати реагент захоплення. Або ж, дана тверда фаза може утримувати додатковий рецептор, який володіє здатністю притягува ти та іммобілізувати реагент захоплення. Додатковий рецептор може включати заряджену речовину, яка протилежно заряджена по відношенню до власне реагенту захоплення або до зарядженої речовини, кон'югованоїз даним 45 79927 реагентом захоплення. Відповідно до ще однієї альтернативи, рецепторна молекула може являти собою будь-який специфічний зв'язувальний член, який іммобілізується на (приєднується до) твердому носії, і який володіє здатністю іммобілізувати реагент захоплення за допомогою специфічної реакції зв'язування. Рецепторна молекула робить можливим непряме зв'язування реагенту захоплення з матеріалом твердого носія перед здійсненням аналізу або протягом здійснення даного аналізу. Тверда фаза, таким чином, може бути представлена пластмасою, похідними пластмаси, намагніченим або ненамагніченим металом, скляною або силіконовою поверхнею пробірки, ямкою для мікротитрування, смужкою, кулькою, мікрочастинкою, кришивом, еритроцитами барана (або інших відповідних тварин), duracytes® та іншими формами, добре відомими середньому фахівцеві у даній області техніки. Полінуклеотиди даного винаходу можна приєднувати або іммобілізувати на твердому носії індивідуально або групами, щонайменше, з 2, 5, 8, 10, 12, 15, 20 або 25 різних полінуклеотидів даного винаходу з єдиним твердим носієм. Крім того, полінуклеотиди, які відрізняються від полінуклеотидів даного винаходу, можна приєднувати до того ж твердого носія, до якого приєднані один або декілька полінуклеотидів даного винаходу. Отже, даний винахід включає також спосіб для виявлення присутньої нуклеїнової кислоти, що включає нуклеотидну послідовність, вибрану з групи, яка складається з SEQ ID Nos 1-4 і 6, її фрагмента або варіанта, і комплементарну їй послідовність, у зразку, причому вказаний спосіб включає наступні стадії: a) приведення у контакт зонда нуклеїнової кислоти або сукупності зондів нуклеїнової кислоти, які можуть гібридизуватися з нуклеотидною послідовністю, що включена у н уклеїнову кислоту, вибрану з групи, яка складається з нуклеотидних послідовностей SEQ ID Nos 1-4 і 6, їх фрагмента або варіанта, і комплементарну їй послідовність, і зразка, що аналізується; і b) виявлення гібридного комплексу, утвореного між зондом і нуклеїновою кислотою даного зразка. Крім того, у даному винаході розглядається набір для детектування присутньої нуклеїнової кислоти, що включає нуклеотидну послідовність, вибрану з групи, що складається з SEQ ID Nos 1-4 і 6, її фрагмента або варіанта, і комплементарну їй послідовність, у зразку, причому вказаний набір включає: a) зонд нуклеїнової кислоти або велику кількість даних зондів нуклеїнової кислоти, які можуть гібридизуватися з нуклеотидною послідовністю, що включена у нуклеїнову кислоту, вибрану з групи, яка складається з нуклеотидних послідовностей SEQ ID Nos 1-4 і 6, її фрагмента або варіанта, і комплементарної їй послідовності; і b) необов'язково, реагенти, необхідні для здійснення реакції гібридизації. У першому переважному варіанті здійснення даного винаходу даний спосіб детекції та набір, відрізняються тим, що вказаний зонд нуклеїнової 46 кислоти або велику кількість даних зондів нуклеїнової кислоти мітять за допомогою молекули, що детектується. В іншому переважному варіанті здійснення даного винаходу вказаний спосіб і набір відрізняються тим, що вказаний зонд нуклеїнової кислоти або велика кількість даних зондів нуклеїнової кислоти були іммобілізовані на субстрат. У третьому переважному варіанті здійснення даного винаходу даний зонд нуклеїнової кислоти або велика кількість даних зондів нуклеїнової кислоти включають або послідовність, яка вибрана з групи, що складається з нуклеотидних послідовностей P1-Ρ18 і комплементарної їм послідовності, В1В17, С1-С17, D1-D18, Ε1-Е18, або двоалельний маркер, вибраний з групи, що складається з А1А18 та їх комплементів. Олігонуклеотидні набори Будь-який субстрат, що включає велику кількість олігонуклеотидних праймерів або зондів даного винаходу, може використовуватися або для детекції або ампліфікації послідовностей-мішеней Canlon-гена, або може також використовуватися для детекції мутацій у послідовностях Canlon-гена, що кодують і не кодують. Будь-який створений у даному описі полінуклеотид можна приєднати в ділянці перекриття або до випадкових місць даного твердого носія. Альтернативно, полінуклеотиди даного винаходу можна приєднати у вигляді впорядкованого набору, де кожний полінуклеотид приєднується до визначеної ділянки твердого носія, яка не перекривається з ділянкою приєднання будь-якого іншого полінуклеотиду. Переважно, такий впорядкований набір полінуклеотидів створюють "адресним", де окремі ділянки реєструються і можуть бути доступні як частина аналітичного методу. Адресні полінуклеотидні набори звичайно включають велику кількість різних олігонуклеотидних зондів, які зв'язані з поверхнею субстрату у різних відомих місцях. Знання точного розташування кожного полінуклеотиду робить дані "адресні" набори особливо придатними для методів гібридизації. Будь-яка технологія адресного набору, відома у даній області техніки, може використовуватися для полінуклеотидів даного винаходу. Один з конкретних варіантів здійснення даних полінуклеотидних наборів відомий як Genechips™, і в основному описаний у Патенті СІЛА №5143854; публікаціях РСТ WO 90/15070 і 92/10092. Дані набори звичайно можна одержати з використанням методів автоматизованого синтезу або методів світлонаправленого синтезу, які включають поєднання фотолітографічних способів і твердофазового олігонуклеотидного синтезу [Fodor і співавт., 1991]. Іммобілізація наборів олігонуклеотидів на твердих носіях представляється можливою завдяки розвитку технології, що звичайно ідентифікується як "Very Large Scale Immobilized Polymer Synthesis" (Великомасштабний синтез іммобілізованого полімеру) (VLSIPS™), в якій, як правило, зонди іммобілізуються у вигляді набору з високою щільністю на твердій поверхні чіпу. Приклади технологій VLSIPS™ представлені [у Патентах США №№5143854; і 5412087, а також у П ублікаціях РСТ WO 90/15070, WO 92/10092 і WO 95/11995], в яких описуються способи ство 47 79927 рення олігонуклеотидних наборів за допомогою таких методів, як методи з світлонаправленого синтезу. У розроблених методиках, призначених для створення наборів нуклеотидів, іммобілізованих на твердих носіях, додатково були розроблені методики представлення для приведення у порядок і представлення олігонуклеотидних наборів на чіпах у спробі одержати максимальну користь з патернів гібридизації та інформації про послідовність. Приклади таких методик представлення розкриті [у Публікаціях РСТ WO 94/12305, WO 94/11530, WO 97/29212 і WO 97/31256], розкриття яких включене за допомогою посилання у всій їх повноті. В іншому варіанті здійснення олігонуклеотидних наборів даного винаходу матриця олігонуклеотидного зонда може переважно використовуватися для виявлення мутацій, що зустрічаються у Canlon-гені і переважно в його регуляторній ділянці. Для цієї конкретної мети спеціально створюють зонди, які володіють нуклеотидною послідовністю, що забезпечує їх гібридизацію з генами, які несуть відомі мутації (у результаті делеції, вставки або заміни одного або декількох нуклеотидів). Для відомих мутацій це означає, що мутації у Canlon-гені були ідентифіковані відповідно до, наприклад, методу, що використовується [Huang і співавт. (1996) і Samson і співавт. (1996)]. В іншому методі, який використовується для виявлення мутацій у Canlon-гені, використовують набір ДНК високої щільності. Кожний олігонуклеотидний зонд, який складає одиничний елемент набору ДНК високої щільності, створюється для порівняння специфічної субпослідовності геномної ДНК або кДНК Canlon. Таким чином, набір, що складається з олігонуклеотидів, які є комплементарними субпослідовностям з послідовності генамішені, використовують для визначення ідентичності цільової послідовності з послідовністю природного гена, вимірювання його кількості, виявлення відмінностей між цільовою послідовністю і стандартною послідовністю природного гена з Canlon-гена. Одна така конструкція, що називається 4L-"плитковий" набір (4L tiled array), являє собою групу з чотирьох зондів (А, С, G, Т), переважно 15-нуклеотидних олігомерів. У кожній групі з чотирьох зондів повний комплемент буде гібридизуватися більш інтенсивно, ніж комплементарно неузгоджені зонди. Отже, цільова нуклеїнова кислота довжиною L сканується по мутаціях за допомогою «плиткового» набору, що містить 4L-зонди, причому весь набір зондів містить всі можливі мутації у відомій стандартній природній послідовності. Гібридизаційні сигнали групи 15-мірного зонда «плиткового» набору порушуються через єдину заміну основи у цільовій послідовності. Внаслідок цього відбувається характерна втрата сигналу або "футпринту" для зондів, які фланкують положення мутації. Даний метод [описаний Chee і співавт. (1996)]. Отже, у даному винаході розглядається набір молекул нуклеїнових кислот, які включають, щонайменше, один полінуклеотид, описаний вище як зонди і праймери. Переважно, у даному винаході розглядається набір нуклеїнової кислоти, яка 48 включає, щонайменше, два полінуклеотиди, описані вище як зонди і праймери. Додаткова мета даного винаходу полягає у створенні набору послідовностей нуклеїнових кислот, які включають, щонайменше, одну з послідовностей, вибрану з групи, що складається з Р1-Р18, В1-В17, С1-С17, D1-D18, Ε1-Е18, комплементарних їй послідовностей, її фрагментів, щонайменше, з 8, 10, 12, 15, 18, 20, 25, 30 або 40 послідовних нуклеотидів або, щонайменше, одну послідовність, яка включає двоалельний маркер, вибраний з групи, що складається з А1-А18, і його комплементів. Даний винахід відноситься також до набору послідовностей нуклеїнових кислот, які включають або, щонайменше, дві послідовності, вибрані з групи, що складається з Р1-Р18, В1-В17, С1-С17, D1-D18, Ε1-Е18, комплементарних їй послідовностей, її фрагмента, щонайменше, з 8 послідовних нуклеотидів, або, щонайменше, дві послідовності, які включають двоалельний маркер, вибраний з групи, що складається з А1-А18, і його комолементів. Canlon-білки та поліпептидні фрагменти Термін "Canlon-поліпептиди" використовується у даному описі для охоплення всіх білків і поліпептидів даного винаходу. Крім того, твірною частиною даного винаходу є поліпептиди, що кодуються полінуклеотидами даного винаходу, а також злиті поліпептиди, які включають такі поліпептиди. У даному винаході містяться Canlon-білки людей, включаючи виділені або виділені очищенням Canlon-білки, що складаються, складаються в основному або включають послідовність SEQ ID No 5. У даному винаході розглядається поліпептид, що кодується нуклеотидною послідовністю, вибраною з групи, яка складається з SEQ ID No 1-4 і 6, комплементарною їй послідовністю або її фрагментом. У даному винаході містяться виділені, виділені очищенням і рекомбінантні поліпептиди, які включають безперервну ділянку послідовності, щонайменше, з 6 амінокислот, переважно, щонайменше, 8-10 амінокислот, більш переважно, щонайменше, 12, 15, 20, 25, 30, 40, 50, 100, 150, 200, 300, 400, 500, 700, 1000, 1200, 1400, 1600 або 1700 амінокислот SEQ ID No 5. В інших переважних варіантах здійснення даного винаходу безперервна ділянка з амінокислот включає ділянку з мутацією або функціональною мутацією, що включає делецію, додавання, перестановку, укорочені амінокислоти у білковій послідовності Canlon. У переважних варіантах здійснення даного винаходу, даний винахід містить виділені, виділені очищенням і рекомбінантні поліпептиди, які включають безперервну ділянку послідовності, щонайменше, з 6 амінокислот, переважно, щонайменше, 8-Ю амінокислот, більш переважно, щонайменше, 12, 15, 20, 25, 30, 40, 50, 100, 150, 200, 300, 400, 500, 700, 1000, 1200, 1400, 1600 або 1700 амінокислот SEQ ID No 5, де безперервна ділянка включає, щонайменше, 1, 2, 3, 5 або 10 амінокислотних позицій 277, 338, 574, 678, 680, 683, 691, 692, 695, 696, 697, 894, 1480, 1481, 1483, 1484, 1485, 1630, 49 79927 1631, 1632, 1636, 1660, 1667, 1707, 1709 з SEQ ID No 5. Переважно, вказана безперервна ділянка SEQ ID No 5 включає залишок Аланіну у положенні 277; Серии у положенні 338; Валін у положенні 574; Лейцин у положенні 678; Серии у положенні 680; Треонін у положенні 683; Гістидин у положенні 691; Серии у положенні 692; Серии у положенні 695; Аланін у положенні 696; Ізолейцин у положенні 697; Ізолейцин у положенні 894; Лізин у положенні 1480; Аргінін у положенні 1481; Гліцин у положенні 1483; Валін у положенні 1484; Ізолейцин у положенні 1485; Аспарагін у положенні 1630; Серии у положенні 1631; Метіонін у положенні 1632; Треонін у положенні 1636; Аланін у положенні 1660; Фенілаланін у положенні 1667; Треонін у положенні 1707; і/або Аланін у положенні 1709. Забезпечені також полінуклеотиди, які кодують будь-який з даних поліпептидів. Даний винахід включає також в себе виділені очищенням, виділені або рекомбінантні поліпептиди, які включають амінокислотну послідовність, що володіє, щонайменше, 70, 75, 80, 85, 90, 95, 98 або 99% амінокислотною ідентичністю з амінокислотною послідовністю SEQ ID No 5 або з її фрагментом. Canlon-білки переважно виділяють з тканинних зразків людини або ссавців або експресують з генів людини або ссавців. Canlon-поліпептиди даного винаходу можуть бути одержані з використанням стандартних способів експресії, відомих у даній області техніки. Полінуклеотид, що кодує необхідний поліпептид, лігують в експресійний вектор, прийнятний для будь-якого зручного хазяїна. Еукаріотична і прокаріотична хазяйська система, та й інша, використовуються для створення рекомбінантних поліпептидів, при цьому коротко викладаються деякі найбільш поширені системи. Потім поліпептид виділяють з лізованих клітин або з культурального середовища і виділяють очищенням до ступеня, необхідного для його передбачуваного використання. Очищення здійснюють за допомогою будь-якого методу, відомого у даній області техніки, наприклад, диференційним екстрагуванням, сольовим фракціонуванням, хроматографією, центрифугуванням і т.п.Див., наприклад, Methods in Enzymology для різноманітних способів з виділення очищенням білків. Крім того, короткі білкові фрагменти одержують хімічним синтезом. Альтернативно, білки даного винаходу екстрагують з клітин або тканин людей або тварин, що не належать до людського роду. Способи виділення очищенням білків відомі у даній області техніки і включають використання детергентів або хаотропних агентів, які дезінтегрують (роз'єднують) частинки, за яким йде диференційне екстрагування та поділ поліпептидів за допомогою іонообмінної хроматографії, хроматографії за спорідненням, осадження відповідно до щільності і гель-електрофорезу. Будь-яка кДНК Canlon, включаючи SEQ ID No 4, може використовува тися для експресії Canlonбілків і поліпептидів. Нуклеїнову кислоту, яка кодує такий, що експресується Canlon-білок або поліпептид, функціонально приєднують до промотору в експресійному векторі з використанням традицій 50 ної техніки клонування. Canlon-вставка у даний експресійний вектор може включати повну послідовність, що кодує, для Canlon-білка або його частини. Експресійний вектор являє собою будь-яку експресійну систему ссавця, дріжджів, комахи або бактерії, відому у даній області техніки. Комерційно доступні вектори та експресійні системи можна одержати від різних постачальників, включаючи Genetics Institute (Cambridge, MA), Stratagene (La Jolla, California), Promega (Madison, Wisconsin) та Invitrogen (San Diego, California). За бажанням, для посилення експресії і забезпечення належного пакування білка, для конкретного експресійного організму, в який інтродукований експресійний вектор, оптимізують кодоновий фон і спарювання кодонів даної послідовності, відповідно до роз'яснень [Hatfield і співавт., Патент США №5082767], розкриття якого включене у даний опис за допомогою посилання у всій його повноті. В одному з варіантів здійснення даного винаходу повну послідовність кДНК Canlon, що кодує, включаючи поліА-сигнал кДНК, функціонально приєднують до промотору даного експресійного вектора. Альтернативно, якщо нуклеїнова кислота кодує частину Canlon-білка, в якому відсутній метіонін, що служить як сайт ініціації, метіонін, який ініціює, можна вбудувати поруч з першим кодоном даної нуклеїнової кислоти з використанням традиційних методів. Також, якщо у даній вставці з кДНК Canlon відсутній поліА-сигнал, дану послідовність можна додати у конструкцію, наприклад, шляхом вирізання поліА-сигналу з pSG5 (Stratagene) з використанням ендонуклеаз рестрикції Bgll і Sall та вбудовування в експресійний вектор рХТІ (Stratagene) ссавця. РХТІ містить LTR і частину gag-гена вірусу лейкозу мишей Молоні. Положення LTR у даній конструкції робить можливою ефективну стабільну трансфекцію. Даний вектор включає тимідинкіназний промотор вірусу простого герпесу і селективний ген неоміцину. Нуклеїнову кислоту, що кодує Canlon-білок або його частину, одержують за допомогою ПЛР з бактеріального вектора, що містить CanIon-кДНК SEQ ID No 5 з використанням олігонуклеотидних праймерів, які є комплементарними CanIon-кДНК або її частині і містять послідовність для рестриційованої ендонуклеази PstI, що вбудовується у 5'-праймер, і Bglll-послідовність, що вбудовується в 5'-кінець відповідного 3'-праймеру кДНК, забезпечуючи даній послідовності, яка кодує Canlon-білок або його частину, належне розташування відносно поліАсигналу. Виділений очищенням фрагмент, одержаний в остаточній ПЛР-реакції, розщеплюють за допомогою PstI, затуплюють на кінцях нуклеазою, розщеплюють за допомогою Bglll, виділяють очищенням та лігують з ХТ1, що містить поліА-сигнал і розщеплюють за допомогою Bglll. Даний лігований продукт можна трансфікувати у мишачі NIH3T3-клітини з використанням Lipofectin Life Technologies, Inc., Grand Island, New York в умовах, коротко викладених в описі до даного продукту. Позитивні трансфектанти відбира 51 79927 ють після вирощування трансфікованих клітин в 600ug/мл G418 (Sigma, St. Louis, Missouri). Приведені вище протоколи можна також використовувати для експресії мутантного Canlonбілка, відповідального за фенотип, що виявляється, або його частини. Експресований білок можна виділити очищенням з використанням традиційних методів очищення, таких як осадження сульфатом амонію або хроматографічним розподілом за розміром або зарядом. Білок, що кодується вбудованою нуклеїновою кислотою, можна також виділити очищенням з використанням стандартних імунохроматографічних методів. У таких протоколах розчин, такий як клітинний екстракт, що містить експресований Canlon-білок або його частину, наносять на колонку, яка містить антитіла до Canlon-білка або його частини, які приєднують до хроматографічного матриксу. Експресованому білку дають можливість зв'язатися імунохроматографічною колонкою. Потім колонку промивають для видалення білків, що неспецифічно зв'язалися. Після чого експресований білок, що специфічно зв'язався, вивільняють з колонки та дістають з використанням стандартних методів. Для підтвердження експресії Canlon-білка або його частини, білки, експресованні з клітин-хазяїв, що містять експресійний вектор, який містить вставку, що кодує Canlon-білок або його частину, можна порівняти з білками, експресованими з клітин-хазяїв, які містять експресійний вектор без вставки. Наявність смуги у зразках клітин, що містять експресійний вектор з вставкою, яка відсутня у зразках з клітин, що містять експресійний вектор без вставки, свідчить про те, що Canlon-білок або його частина експресуються. Як правило, дана смуга буде володіти рухомістю, очікуваною для Canlon-білка або його частини. Однак дана смуга може володіти рухомістю, яка відрізняється від очікуваної через модифікації, такі як глікозилування, убіхі тинізація або ферментативне розщеплення. Антитіла, здатні специфічно розпізнавати експресований Canlon-білок або його частину, описані нижче. Коли утворення антитіл неможливе, нуклеїнові кислоти, що кодують Canlon-білок або його частину, вбудовуються в експресійний вектор, створений для використання у схемах очищення, що використовують химерні поліпептиди. У таких методиках нуклеїнова кислота, що кодує Canlonбілок або його частину, вбудовується у відкриту рамку зчитування разом з геном, який кодує іншу половину даної химери. Інша половина химери являє собою послідовність β-глобіну або послідовність, що кодує поліпептид, який зв'язує нікель. Хроматографічний матрикс, що містить антитіло до β-глобіну або приєднаний до нього нікель, використовується для виділення очищенням химерного білка. Сайти протеазного розщеплення створюють генноінженерним способом між геном βглобіну або нікелезв'язувальним поліпептидом і Canlon-білком або його частиною. Таким чином, два поліпептиди химери відділяються один від одного за допомогою протеазного розщеплення. 52 Придатним експресійним вектором для утворення β-глобінових химерних білків є pSG5 (Stratagene), який кодує β-глобін кролика. Інтрон II кролячого гена β-глобін забезпечує сплайсинг транскрипту, що експресується, а сигнал поліаденілювання, що вбудовується у дану конструкцію, підвищує рівень експресії. Ці методи добре відомі у даній області молекулярної біології. Стандартні способи опубліковані у керівництвах, [як наприклад, Davies і співавт. (1986)], але багато способів є доступними від Stratagene, Life Technologies, Inc., або Promega. Поліпептид можна додатково одержати з конструкції з використанням in vivo трансляційних систем, таких як In vitro Express™ Translation Kit (Stratagene). Антитіла, які зв'язують Canlon-поліпептиди даного винаходу Будь-який Canlon-поліпептид або цілий білок можна використовувати для одержання антитіл, здатних специфічно зв'язуватися з Canlon-білком, що експресується, або його фрагментами, які описані. Антитільна композиція даного винаходу здатна специфічно або селективно зв'язуватися з варіантом Canlon-білка SEQ ID No 5. Для антитільної композиції, яка специфічно зв'язується з першим варіантом Canlon, необхідно продемонструвати в ELISA, RIA або іншому аналізі по зв'язуванню антитіл, щонайменше, на 5%, 10%, 15%, 20%, 25%, 50% або 100% більш високе зв'язування за спорідненням для повнорозмірного першого варіанта Canlon-білка, ніж для повнорозмірного другого варіанта Canlon-білка. У переважному варіанті здійснення даного винаходу антитільна композиція здатна специфічно зв'язувати Canlon-білок людини. У переважному варіанті здійснення даного винаходу розглядаються антитільні композиції, поліклональні або моноклональні, здатні селективно зв'язувати або селективно зв'язуватися з поліпептидом, що містить епітоп, який включає безперервну ділянку послідовності, щонайменше, з 6 амінокислот, переважно, щонайменше, 8-10 амінокислот, більш переважно, щонайменше, 12, 15, 20, 25, 30, 40, 50, 100, 200, 300, 400, 500, 700 або 1000 амінокислот SEQ ID No 5. У переважних варіантах здійснення даного винаходу вказана безперервна ділянка послідовності включає, щонайменше, 1, 2, 3, 5 або 10 амінокислотних позицій 277, 338, 574, 678, 680, 683, 691, 692, 695, 696, 697, 894, 1480, 1481, 1483, 1484, 1485, 1630, 1631, 1632, 1636, 1660, 1667, 1707, 1709 SEQ ID No 5. Будь-який Canlon-поліпептид або цілий білок можна використовувати для одержання антитіл, здатних, як описано, специфічно зв'язуватися з Canlon-білком, що експресується, або його фрагментами. Епітоп може включати не менше 3 амінокислот для просторової конформації, яка є унікальною для даного епітопу. Як правило, епітоп складається, щонайменше, з 6 таких амінокислот, але частіше, щонайменше, з 8-10 таких амінокислот. У переважному варіанті здійснення даного винаходу антигенні епітопи включають ряд амінокислот, які складають будь-яке ціле число між 3 і 50. Фрагме 53 79927 нти, які функціонують як епітопи можна одержати за допомогою будь-якого традиційного способу. Епітопи можна визначити в антигенному аналізі Jameson-Wolf, наприклад, застосовуючи комп'ютерну програму PROTEAN з використанням значень параметрів за умовчанням (Version 4.0 Windows, DNASTAR, Inc., 1228 South Park Street Madison, WI). У даному винаході розглядається також виділене очищенням або виділене антитіло, здатне специфічно зв'язуватися з мутантним Canlonбілком, його фрагментом або варіантом, що включає епітоп мутантного Canlon-білка. В іншому переважному варіанті здійснення даного винаходу розглядається антитіло, здатне зв'язуватися з поліпептидом, який включає, щонайменше, 10 послідовних амінокислот Canlon-білка і включає, щонайменше, одну з амінокислот, яка може кодуватися мутаціями, що визначають дану ознаку. Тварини або ссавці, які не належать до людського роду, природні або трансгенні, які експресують різні види Canlon, що відрізняються від Canlon, до якого потрібне зв'язування антитіла, а також тварини, які не експресують Canlon (тобто, Canlon-нокаутні тварини, які описані у даному описі), особливо придатні для одержання антитіл. Canlon-нокаутні тварини будуть розпізнавати всі або більшість ділянок Canlon-білка, що знаходяться на поверхні, як чужорідні антигени і, внаслідок цього, виробляти антитіла з більш широким набором Canlon-епітопів. Крім того, менші поліпептиди, всього лише з 10-30 амінокислотами, можуть бути придатні для одержання специфічного зв'язування з одним з Canlon-білків. До того ж, гуморальна імунна система тварин, яка продукує види Canlon, що мають схожість з антигенною послідовністю, буде переважно розпізнавати відмінності між нативними Canlon-видами тварини і даною антигенною послідовністю, і продукувати антитіла до цих унікальних сайтів у послідовності даного антигену. Такий метод особливо придатний для одержання антитіл, які специфічно зв'язуються з будь-яким окремим Canlon-білком. Препарати антитіл, одержані відповідно до будь-якого протоколу, придатні для кількісного імуноаналізу, в якому визначають концентрації речовин, що несуть антиген, у біологічних зразках; їх також використовують, напівкількісно або кількісно, для ідентифікації антигену, що присутній у біологічному зразку. Анти тіла можна також використовувати у терапевтичних композиціях для знищення клітин, які експресують даний білок, або для зниження рівня даного білка у даному організмі. Антитіла даного винаходу можна мітити радіоактивною, флуоресцентною або ферментною міткою, відомою у даній області техніки. Тому, даний винахід відноситься також до способу детектування специфічно присутнього у біологічному зразку Canlon-поліпептиду відповідно до даного винаходу, причому вказаний спосіб включає наступні стадії: a) приведення у контакт даного біологічного зразка з поліклональним або моноклональним 54 антитілом, яке специфічно зв'язує Canlonполіпептид, що включає амінокислотну послідовність SEQ ID No 5, або його пептидний фрагмент або варіант; і b) детектування утвореного комплексу антиген-антитіло. У даному винаході розглядається також діагностичний набір для детектування у біологічному зразку, відповідно до даного винаходу, наявності in vitro Canlon-поліпептиду, де вказаний набір включає: a) поліклональне або моноклональне антитіло, яке специфічно зв'язує Canlon-поліпептид, що включає амінокислотну послідовність SEQ ID No 5, або його пептидний фрагмент або варіант, необов'язково мічений; b) реагент, що забезпечує детекцію утворених комплексів антиген-антитіло, причому вказаний реагент необов'язково несе мітку або здатний розпізнавати самого себе за допомогою міченого реагенту, зокрема, у випадку, якщо вказане вище моноклональне або поліклональне антитіло саме не є міченим. Даний винахід відноситься, таким чином, до антитіл і Т-клітинних антигенних рецепторів (TCR), які специфічно зв'язують поліпептиди і, зокрема, епітопи поліпептидів даного винаходу, включаючи, але, не обмежуючись ними, IgG (у тому числі IgGl, IgG2, IgG3 і IgG4), IgA (у тому числі IgAl і IgA2), IgD, IgE або IgM і IgY. У переважному варіанті здійснення даного винаходу дані антитіла, що являють собою антитільні фрагменти даного винаходу, які зв'язують антиген людини, включають, але не обмежуються ними, Fab, Fab', F(ab)2 і F(ab')2, Fd, одноланцюжкові Fvs (scFv), одноланцюжкові антитіла, зв'язані дисульфідним зв'язком Fvs (sdFv) і фрагменти, що включають домен VL або VH. Антитіла можна одержати у будь-якої тварини, у тому числі у птахів і ссавців. Переважні антитіла людини, миші, кролика, кози, морської свинки, верблюда, коня або мавпи. Антиген-зв'язувальні антитільні фрагменти, включаючи одноланцюжкові антитіла, можуть включати варіабельну ділянку(и), окремо або у поєднанні з повною або частковою: шарнірною ділянкою, доменами СН1, СН2 і СН3. У даний винахід включені також будь-які поєднання варіабельної ділянки(ок) і шарнірної ділянки, доменів СН1, СН2 і СН3. Крім того, даний винахід включає химерні, гуманізовані, а також моноклональні і поліклональні антитіла людини, які специфічно зв'язують поліпептиди даного винаходу. Даний винахід до того ж включає антитіла, які є антиідіотиповими до антитіл даного винаходу. Антитіла даного винаходу можуть бути моноспецифічними, біспецифічними, триспецифічними або володіти більш високою мультиспецифічністю. Мультиспецифічні антитіла можуть бути специфічними для різних епітопів поліпептиду даного винаходу або можуть бути специфічними для поліпептиду даного винаходу, а також для гетерологічних композицій, таких як гетерологічний поліпептид або речовина твердого носія. [Див., наприклад, WO 93/17715; WO 92/08802; WO 91/00360; WO 92/05793; Tutt і співавт. (1991) J. Immunol. 147: 60 55 79927 69; Патенти №№5573920, 4474893, 5601819, 4714681, 4925648; Kostelny і співавт. (1992) J. Imminol. 148: 1547-1553.] Антитіла даного винаходу можуть бути описані або охарактеризовані у межах епітопу(ів) або частин(и), що несе епітоп, поліпептиду даного винаходу, які розпізнаються або специфічно зв'язуються з даним антитілом. У випадку білків даного винаходу, білків, що секретуються, антитіла можуть специфічно зв'язувати повнорозмірний білок, що кодується нуклеїновою кислотою даного винаходу, зрілий білок (тобто, білок, утворений внаслідок відщеплення сигнального пептиду), що кодується нуклеїновою кислотою даного винаходу, сигнальний пептид, що кодується нуклеїновою кислотою даного винаходу, або будь-який інший поліпептид даного винаходу. Тому, епітоп(и) або епітоп, що несе частину(и) поліпептиду, можна точно визначити, як описано у даному описі, наприклад, за N-кінцевим і С-кінцевим положенням, за розміром у контигу амінокислотних залишків або описати інакше (включаючи список послідовностей). Антитіла, які специфічно зв'язують будьякий епітоп або поліпептид даного винаходу, можна також виключити як індивідуальні види. Таким чином, даний винахід включає антитіла, які специфічно зв'язують визначені (задані) поліпептиди даного винаходу, і дозволяють виключити однакові. Антитіла даного винаходу можна також описати або точно визначити у межах їх перехресної реактивності. У даний винахід включені антитіла, які специфічно не зв'язують будь-який інший аналог, ортолог або гомолог поліпептидів даного винаходу. У даний винахід включені також антитіла, які не зв'язують поліпептиди менше ніж з 95%, менше ніж з 90%, менше ніж з 85%, менше ніж з 80%, менше ніж з 75%, менше ніж з 70%, менше ніж з 65%, менше ніж з 60%, менше ніж з 55%, менше ніж з 50% ідентичністю (що розраховано з використанням способів, відомих у даній області техніки і описаних у даному описі) з поліпептидом даного винаходу. Крім того, у даний винахід включені антитіла, які зв'язують лише поліпептиди, що кодуються полінуклеотидами, які гібридизуються з полінуклеотидом даного винаходу у жорстких гібридизаційних умовах (як описано у даному описі). Антитіла даного винаходу можуть бути також описані або точно визначені у термінах їх зв'язування за спорідненням. Переважне зв'язування за спорідненням проявляють антитіла з константою дисоціації або Kd менше 5Х10-6М, 10-6М, 5Х10-7М, 107 М, 5Х10-8 М, 10-8 М, 5 Х10-9М, 10-9М, 5 Х10-10 М, 1010 М, 5 Х10-11 М, 10-11 М, 5 Х10-12 М, 10-12 М, 5 Х10-13 М, 10-13М, 5Х10-14 М, 10-14 Μ, 5 Х10-15 М і 10-15 М. Антитіла даного винаходу, що використовуються, включаються, але не обмежуються ними, у відомі у даній області техніки способи по виділенню очищенням, виявленню і мішенуванню поліпептидів даного винаходу, у тому числі in vitro та in vi vo діагностичні і терапевтичні способи. Наприклад, в імуноаналізі антитіла використовують для якісного і кількісного вимірювання рівня поліпептидів даного винаходу у біологічних зразках. Див., наприклад, Harlow і співавт., ANTIBODIES: A 56 LABOR ATOR Y MANUAL, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988) (включений у даний опис за допомогою посилання у всій його повноті). Антитіла даного винаходу можуть використовуватися окремо або у поєднанні з іншими композиціями. Дані антитіла можна, крім того, рекомбінантно зливати з гетерологічним поліпептидом по N- або С-кінцю або хімічно кон'югувати (включаючи ковалентну і нековалентну кон'югацію) з поліпептидами або з іншими композиціями. Наприклад, антитіла даного винаходу можна рекомбінантно зливати або кон'югувати з молекулами, придатними як мітка для детекційних аналізів, і з ефекторними молекулами, такими як гетерологічні поліпептиди, лікарські засоби або токсини. [Див., наприклад, WO 92/08495; WO 91/14438; WO 89/12624; Патент США №5314995; і ЕР О 396387.] Антитіла даного винаходу можна одержати будь-яким відповідним способом, відомим у даній області техніки. Наприклад, поліпептид даного винаходу або його антигенний фрагмент можна вводити тварині для того, щоб індукувати утворення сироватки, що містить поліклональні антитіла. Термін "моноклональне антитіло" не обмежений антитілами, які одержують за допомогою гібридомної техніки. Термін "антитіло" відноситься до поліпептиду або до групи поліпептидів, які включають, щонайменше, один зв'язувальний домен, де зв'язувальний домен утворюється з упакованих варіабельних доменів антитільної молекули з утворенням тривимірного зв'язувального простору, причому форма і заряд внутрішньої поверхні є комплементарними елементам антигенної детермінанти антигену, що забезпечує імунологічну взаємодію з антигеном. Термін "моноклональне антитіло" відноситься до антитіла, яке одержують з окремого клону, у тому числі еукаріотичного, прокаріотичного або фагового клону, але не до способу, за допомогою якого його одержують. Моноклональні антитіла можна одержати з використанням досить різноманітних методів, відомих у даній області техніки, у тому числі з використанням гібридомної, рекомбінантної та фагової дисплейної технології. Гібридомні методи включають методи, відомі у даній області техніки [див., наприклад, Harlow і співавт. (1998); Hammerling і співавт. (1981) вказані посилання включені за допомогою посилання у всій їх повноті]. Фрагменти Fab і F(ab')2 можна одержати, наприклад, з гібридомно-одержаних антитіл внаслідок протеолітичного розщеплення, з використанням ферментів, таких як папаїн (для одержання Fab-фрагментів) або пепсин (для утворення Р(аb')2-фрагментів). Альтернативно, антитіла даного винаходу можна одержати шляхом застосування техніки рекомбінантних ДНК або за допомогою хімічного синтезу з використанням способів, відомих у даній області техніки. Наприклад, антитіла даного винаходу можна одержати з використанням різноманітних способів фагового дисплея, відомих у даній області техніки. У способах фагового дисплея функціональні антитільні домени представлені на поверхні фагової частинки, яка несе полінуклеотидні послідовності, що кодують їх. Фаг з необхідною 57 79927 зв'язувальною здатністю вибирають з набору або з комбінаторної бібліотеки антитіл (наприклад, людини або миші) шляхом прямого відбору по антигену, як правило, антигену, зв'язаному або захопленому твердою поверхнею або кулькою. Фаг, що використовується у цих способах, звичайно являє собою нитчастий фаг, що включає fd і М13 з Fab, Fv або стабілізовані дисульфідним зв'язком Fvдомени антитіла, рекомбінантно злиті з фаговим геном III фага або з білком гена VIII. Приклади способів фагового дисплея, які можна використовувати для створення антитіл даного винаходу, включають способи, [які описані у Brinkman і співавт. (1995); Ames і співавт. (1995); Kettleborough і співавт. (1994); Persic і співавт. (1997); Burton і співавт. (1994); PCT/GB91/01134; WO 90/02809; WO 91/10737; WO 92/01047; WO 92/18619; WO 93/11236; WO 95/15982; WO 95/20401; і Патенти США №№5698426, 5223409, 5403484, 5580717, 5427908, 5750753, 5821047, 5571698, 5427908, 5516637, 5780225, 5658727 і 5733743] (вказані посилання включені за допомогою посилання у всій їх повноті). Як описано у вказаних вище посиланнях, після фагової селекції ділянки, що кодують антитіло, можна виділити з даного фага і використовувати для утворення цілих антитіл, у тому числі і антитіл людини, або будь-якого іншого необхідного антигензв'язувального фрагмента і експресувати у будь-якому бажаному хазяїні, включаючи клітини ссавців, клітини комах, рослинні клітини, дріжджові та бактеріальні. Наприклад, методи для рекомбінантного виробництва фрагментів Fab, Fab', F(ab)2 і F(ab')2, можна також використовувати, використовуючи способи, відомі у даній області техніки, [способи, розкриті в WO 92/22324; Mullinax і співавт. (1992); а також Sawai і співавт. (1995); а також Better і співавт. (1998)] (вказані посилання включені за допомогою посилання у всій їх повноті). Приклади методик, які можна використовувати для одержання одноланцюжкових Fvs та антитіл, включають методики, [описані у Патентах США №№4946778 і 5258498; Huston і співавт. (1991); Shu і співавт. (1993); і Skerra і співавт. (1988)]. Для визначеного використання, включаючи in vivo використання антитіл у людей та in vitro детекційні аналізи, переважним може виявитися використання химерних, гуманізованих або антитіл людини. Способи одержання химерних антитіл добре відомі у даній області техніки. [Див. наприклад, Morrison (1985); Оі і співавт. (1986); Gillies, S.D. і співавт. (1989); і Патент США №5807715.] Антитіла можна гуманізувати з використанням різноманітних методів, включаючи CDR-трансплантацію [ЕР 0239400; WO 91/09967; Патент США №5530101; і №5585089], облицювання або перекладання [ЕР 0592106; ЕР 0519596; Padlan E.А. (1991); Studnicka G.M. і співавт. (1994); Roguska M.А. і співавт. (1994) і перестановку ланцюга Патент США №5565332]. Антитіла людини можна створити різноманітними способами, відомими у даній області техніки, включаючи описані вище способи фагового дисплея. [Див. також Патенти США №№4444887, 4716111, 5545806, і 5814318; WO 58 98/46645; WO 98/50433; WO 98/24893; WO 96/34096; WO 96/33735; і WO 91/10741] (вказані посилання включені за допомогою посилання у всій їх повноті). У даний винахід додатково включені рекомбінантно злиті антитіла або хімічно кон'юговані (включаючи ковалентну і нековалентну кон'югацію) з поліпептидом даного винаходу. Дані антитіла можуть виявитися специфічними для антигенів, що відрізняються від поліпептидів даного винаходу. Наприклад, антитіла можна використовувати для мішенування поліпептидів даного винаходу в окремих типах клітин або in vitro, або in vi vo, шляхом злиття або кон'югації поліпептидів даного винаходу з антитілами, специфічними до окремих рецепторів клітинної поверхні. Антитіла, злиті або кон'юговані з поліпептидами даного винаходу, можна також використовувати в імуноаналізі in vitro та у способах очищення з використанням способів, відомих у даній області техніки. [Див. наприклад, Harbor і співавт. вище і WO 93/21232; ЕР 0439095; Naramura, H. і співавт. (1994); Патент США №5474981; Gillies S.O. і співавт. (1992); Fell H.P. і співавт. (1991)] (вказані посилання включені за допомогою посилання у всій їх повноті). Даний винахід містить також композиції, що включають поліпептиди даного винаходу, злиті або кон'юговані з доменами антитіла, які відрізняються від варіабельних ділянок. Наприклад, поліпептиди даного винаходу можна з'єднати шляхом злиття або кон'югува ти з Fc-ділянкою антитіла або її частиною. Дана антитільна частина, з'єднана шляхом злиття з поліпептидом даного винаходу, може включати шарнірну ділянку, CH1-домен, СН2-домен і СН3-домен або будь-яке поєднання цілих доменів або їх частин. Поліпептиди даного винаходу можна з'єднати шляхом злиття або кон'югувати з вказаними вище частинами антитіла для підвищення in vivo часу напівжиття поліпептидів або для використання в імунному аналізі з використанням способів, відомих у даній області техніки. Поліпептиди можна також з'єднати шляхом злиття або кон'югувати з вказаними вище частинами антитіла з утворенням мультимерів. Наприклад, Fcсегменти, злиті з поліпептидами даного винаходу, можуть утворювати димери внаслідок дисульфідного зв'язування між Fc-сегментами. Великі мультимерні форми можна створити шляхом злиття поліпептидів з ділянками IgA або IgM. Способи злиття або кон'югації поліпептидів даного винаходу з ділянками антитіл добре відомі у даній області техніки. [Див. наприклад, Патенти США №№5336603, 5622929, 5359046, 5349053, 5447851, 5112946; ЕР 0307434, ЕР 0367166; WO 96/04388, WO 91/06570; Ashkenazi А і співавт. (1991); Zheng X.X. і співавт. (1995); і Vil H і співавт. (1992)] (вказані посилання включені за допомогою посилання у всій їх повноті). Крім того, даний винахід відноситься до антитіл, які діють як агоністи або антагоністи поліпептидів даного винаходу. Наприклад, даний винахід включає антитіла, які частково або повністю порушують рецептор/лігандні взаємодії з поліпептидами даного винаходу. Включені також рецепторспецифічні антитіла і лігандспецифічні антитіла. 59 79927 Включені також рецепторспецифічні антитіла, які не запобігають лігандному зв'язуванню, але запобігають рецепторній активації. Рецепторну активацію (тобто, сигналізацію) можна визначити описаними у даному описі методами або іншими методами, відомими у даній області техніки. Включені також рецепторспецифічні антитіла, які запобігають як лігандному зв'язуванню, так і рецепторній активації. Більш того включені нейтралізуючі антитіла, які зв'язують даний ліганд і запобігають зв'язуванню даного ліганду з даним рецептором, а також антитіла, які зв'язують даний ліганд і тим самим запобігають рецепторній активації, але не запобігають зв'язуванню даного ліганду з даним рецептором. Крім того, включені антитіла, які активують даний рецептор. Ці антитіла можуть діяти як агоністи у відношенні або всіх або не всіх біологічних активностей, що породжуються лігандопосередкованою рецепторною активацією. Антитіла можуть бути спеціалізованими як агоністи або антагоністи біологічних активностей, включаючи описані у даному описі специфічні активності. Вказані вище антитільні агоністи можна створити з використанням способів, відомих у даній області техніки. [Див. наприклад, WO 96/40281; Патент США №5811097; Deng В. і співавт. (1998); Chen Z. і співавт. (1998); Harrop J.A. і співавт. (1998); Zhu, Z. і співавт. (1998); Yoon, D.Y. і співавт. (1998); Prat, Μ. і співавт. (1998); Pitard, V. і співавт. (1997); Liautard, J. і співавт. (1997); Carlson, N.G. і співавт. (1997); Taryman, R.E. і співавт. (1995); Muller, Υ.А. і співавт. (1998); Bartunek, P. і співавт. (1996)] (вказані посилання включені за допомогою посилання у всій їх повноті). Як вказано вище, антитіла поліпептидів даного винаходу можуть, у свою чергу, утилізуватися з утворенням антиідіотипових антитіл, які "імітують" поліпептиди даного винаходу, з використанням методів, добре відомих фа хівцям у даній області техніки. [Див., наприклад, Greenspan and Bona (1989); Nissiniff (1991).] Наприклад, антитіла, які зв'язують і конкурентно інгібують поліпептидну мультимеризацію або зв'язування поліпептиду даного винаходу з лігандом, можуть використовуватися для одержання антиідіотипів, які "імітують" поліпептидну мультимеризацію або зв'язувальний домен і, як наслідок, зв'язують і нейтралізують поліпептид або його ліганд. Такі нейтралізуючі антиідіотипові антитіла можна використовувати для зв'язування поліпептиду даного винаходу або для зв'язування його лігандів/рецепторів, і таким чином блокувати їх біологічну активність. Двоалельні маркери, зв'язані з Canlon Перевага двоалельних маркерів даного винаходу Canlon-зв'язані двоалельні маркери даного винаходу забезпечують ряд істотних переваг у порівнянні з іншими генетичними маркерами, такими як RFLP (Поліморфізм довжини фрагментів рестрикції) і VNTR (Варіабельність числа тандемних повторів) маркери. Першим поколінням маркерів були RFPL, що являють собою варіації, які модифікують довжину рестрикційного фрагмента. Однак способи, що використовуються для ідентифікації і типування 60 RFLP, є досить неекономічними за матеріалами, зусиллями та часом. Другим поколінням генетичних маркерів були VNTR, які можна розподілити по категоріях як мінісателіти або мікросателіти. Мінісателіти являють собою послідовності ДНК, що тандемно повторюються, представлені блоками з 5-50 повторів, які розподіляються по ділянках хромосом людини у діапазоні довжини від 0,1 до 20т.п.н. Оскільки вони являють собою багато можливих алелів, їх інформативний зміст дуже високий. Мінісателіти оцінюють, здійснюючи Саузернблотування для ідентифікації числа тандемних повторів, що присутні у зразку нуклеїнової кислоти з окремого організму, який тестується. Однак існує лише 104 потенційних VNTR, які можна типувати Саузерн-блотуванням. Крім того, створення і аналіз RFLP-маркерів і VNTR-маркерів у великих кількостях є таким, що дорого коштує, і тр удомістким. Поліморфізм єдиного нуклеотиду або двоалельні маркери можна використовувати таким же чином, що і RFLP і VNTR, але він володіє деякими перевагами. SNP густо розподілені у геномі людини і являють собою найбільш частий тип мінливості. За наявними оцінками у геномі людини розсіяно більше 107-сайтів по 3´109 пар основ. Таким чином, SNP зустрічається з більшою частотою і з більшою однорідністю, ніж RFLP-маркери і VNTRмаркери, і це означає, що існує велика ймовірність виявлення такого маркера у безпосередній близькості від генетичного локуса, що представляє інтерес. SNP менш варіабельні, ніж VNTR-маркери, і мутаційно більш стабільні. Крім того, різні форми охарактеризованого поліморфізму єдиного нуклеотиду, такі як двоалельні маркери даного винаходу, часто легко помітні, внаслідок чого легше тип уються стандартними методами. Двоалельні маркери володіють алелями, відмінними єдиним нуклеотидом, і володіють тільки двома спільними алелями, що забезпечує паралельну детекцію та одержання автоматизованої оцінки. Двоалельні маркери даного винаходу забезпечують можливість швидкого, високопродуктивного генотипування великого числа індивідів. Двоалельні маркери густо розподілені у геномі, досить інформативні та можуть аналізуватися у великій кількості. Об'єднаний ефект цих переваг робить двоалельні маркери надзвичайно цінними у генетичних дослідженнях. Двоалельні маркери можуть використовуватися при вивченні зчеплення у сім'я х, у способах вивчення спільних алелів, у дослідженнях зчеплення при порушенні рівноваги у популяціях, у дослідженні асоціацій у популяціях хворих і здорових індивідів або у популяціях з позитивною ознакою і у популяціях з негативною ознакою. Істотний аспект даного винаходу полягає у тому, що двоалельні маркери дозволяють здійснювати асоціативні дослідження з ідентифікації генів, що беруть участь у комплексних ознаках. В асоціативних дослідженнях аналізують частоту маркерних алелів у незв'язаних (неродинних) популяціях хворих і здорових індивідів і, як правило, використовують для виявлення полігенних або одиничних ознак. Асоціативні дослідження можна здійснювати у спільній популяції і вони не обмежуються дослідженнями, що виконуються на ро
ДивитисяДодаткова інформація
Назва патенту англійськоюPolynucleotide, coding a polypeptide of potential-depending portal ionic human channel (canion), polypeptyde, antibody, method for identification of candidate modulator of canion-polypeptyde, method for treatment of bipolar disorder or schizophrenia and use of an antibody for production of drugs for treatment of schizophrenia or bipolar disorder
Назва патенту російськоюПолинуклеотид, кодирующий полипептид потенциалзависимого воротного ионного канала человека (canion), полипептид, антитело, способ идентификации кандидатного модулятора canion-полипептида, способ лечения биполярного расстройства или шизофрении и пременение антитела для производства лекарств для лечения шизофрении или биполярного расстройства
МПК / Мітки
МПК: A61K 39/395, C07K 14/705, G01N 33/50, C12N 15/63, A61P 25/00, C07K 16/28, C12N 15/12, A61P 25/18
Мітки: canion-поліпептиду, спосіб, кодує, лікування, поліпептид, каналу, біполярног, кандидатного, ворітного, людини, ідентифікації, потенціалзалежного, іонного, антитіло, полінуклеотид, модулятора, canion
Код посилання
<a href="https://ua.patents.su/200-79927-polinukleotid-shho-kodueh-polipeptid-potencialzalezhnogo-voritnogo-ionnogo-kanalu-lyudini-canion-polipeptid-antitilo-sposib-identifikaci-kandidatnogo-modulyatora-canion-polipeptidu.html" target="_blank" rel="follow" title="База патентів України">Полінуклеотид, що кодує поліпептид потенціалзалежного ворітного іонного каналу людини (canion), поліпептид, антитіло, спосіб ідентифікації кандидатного модулятора canion-поліпептиду, спосіб лікування біполярног</a>
Попередній патент: Пристрій для приготування бурових розчинів
Випадковий патент: Протез стегна