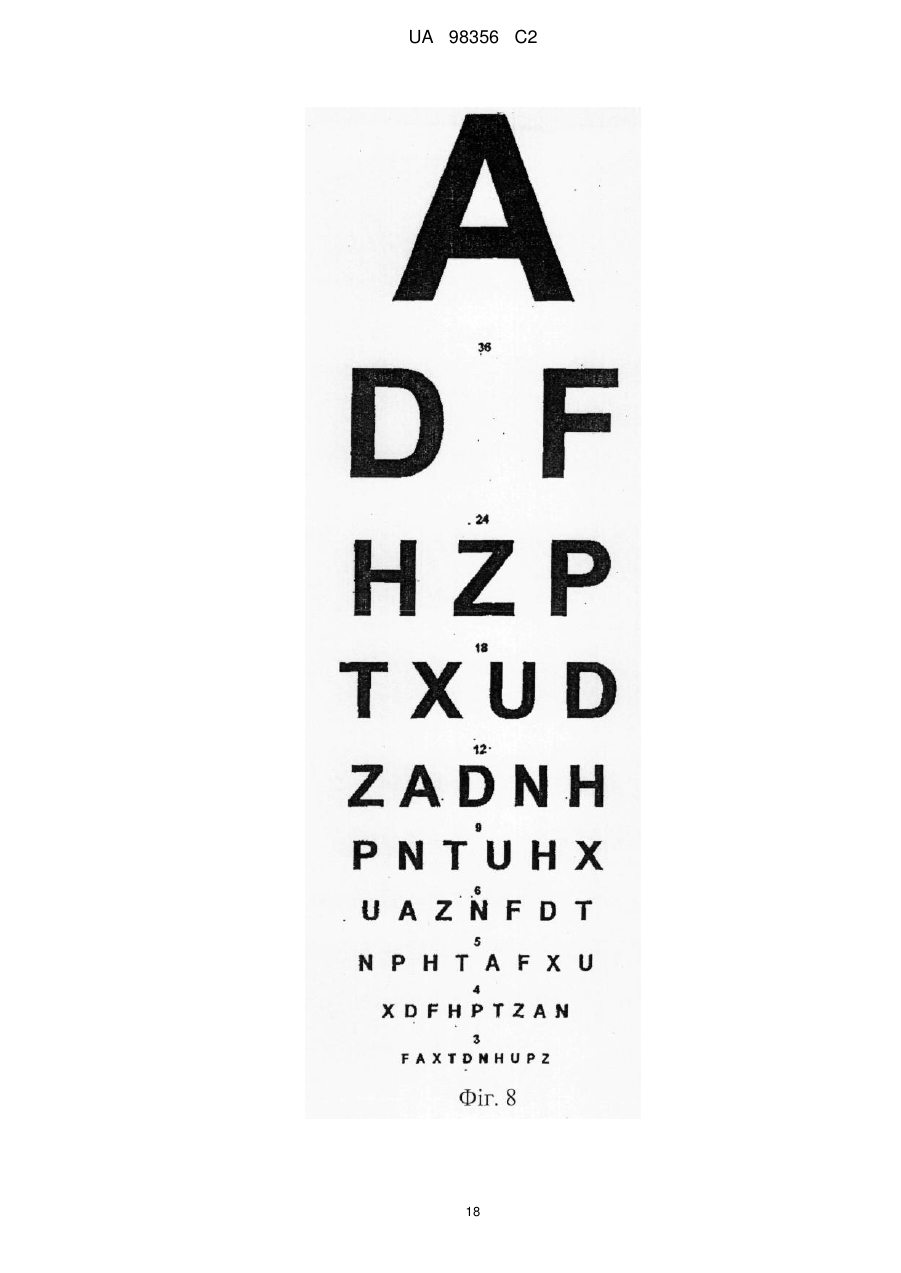
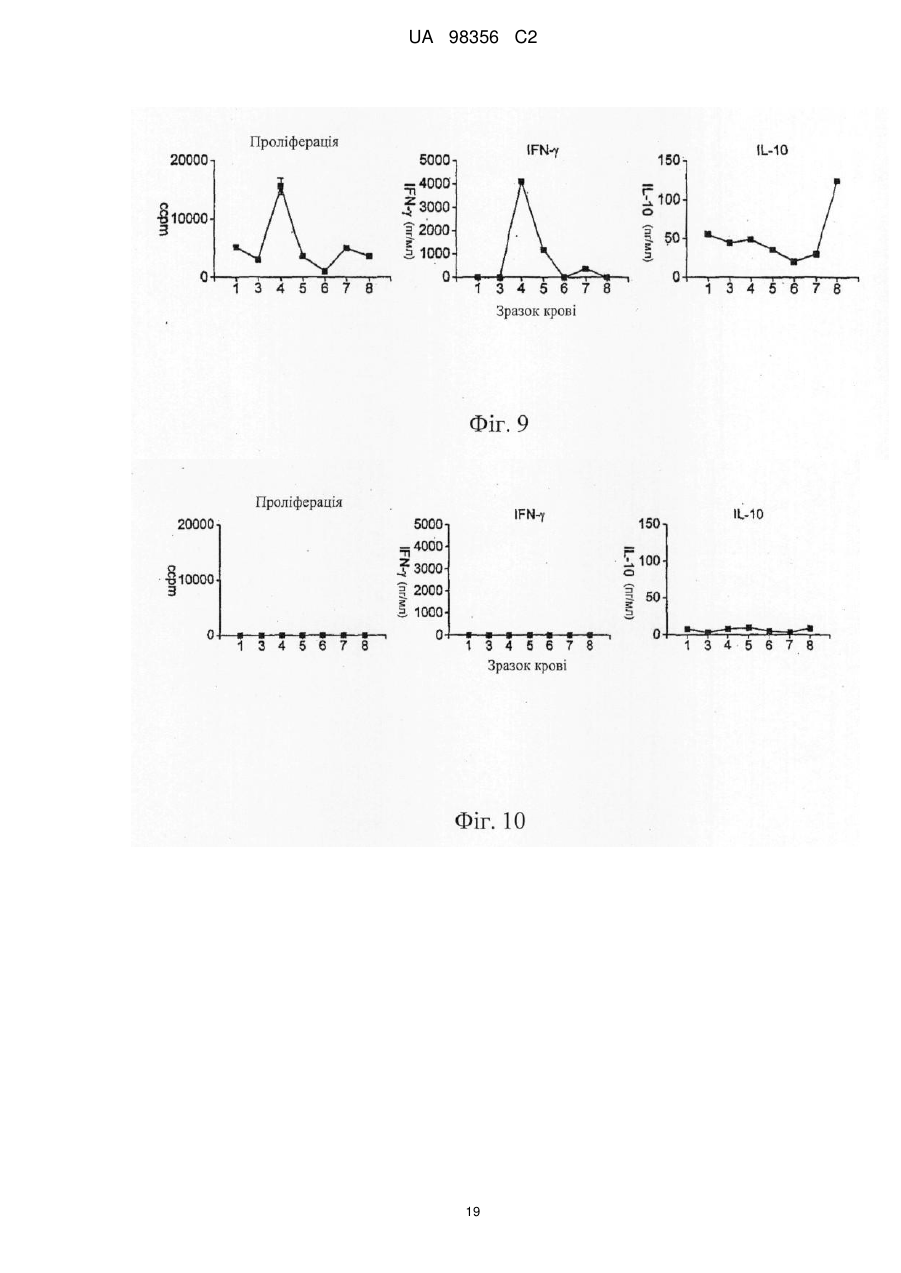
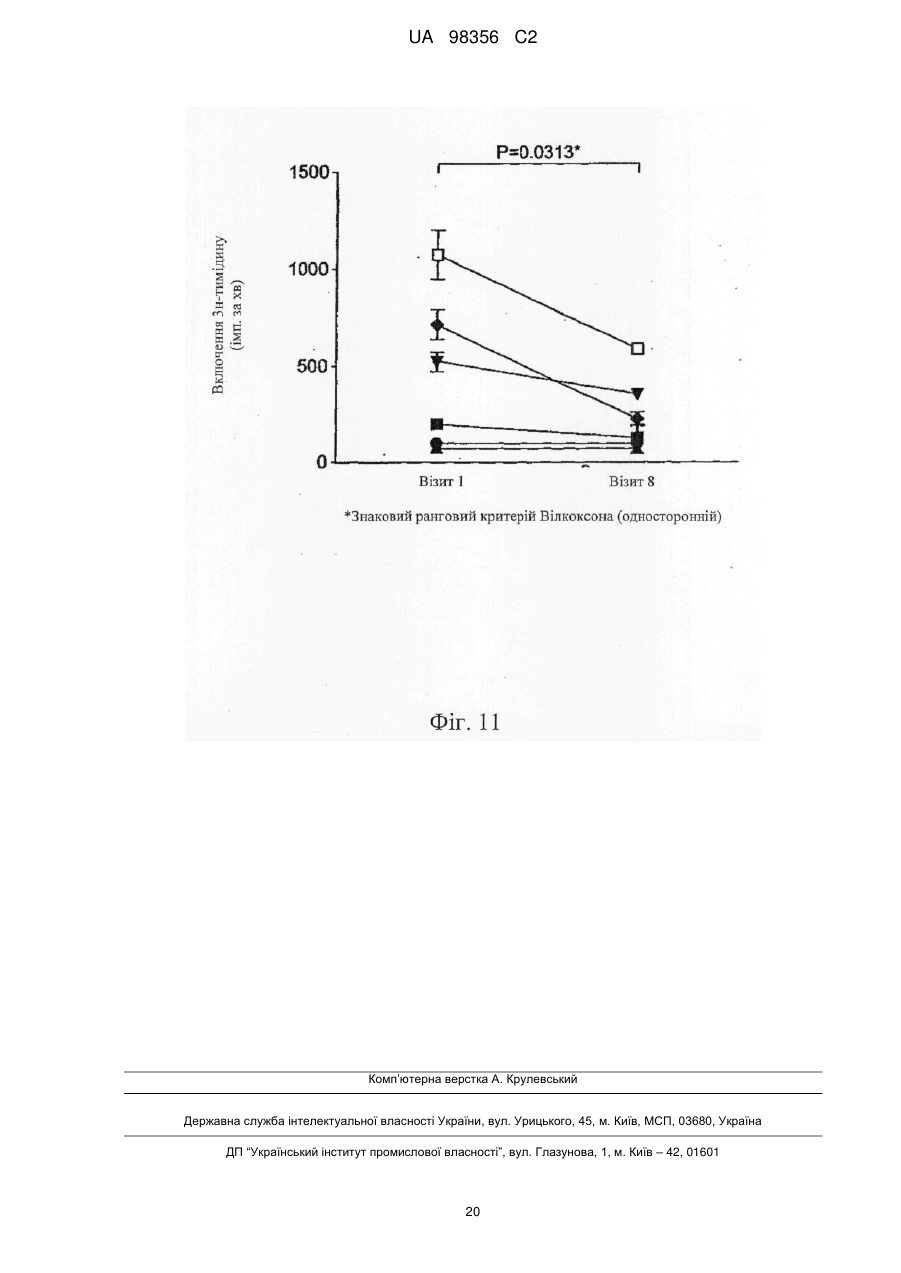
Композиція для лікування та профілактики розсіяного склерозу і/або оптичного невриту, пов’язаного з розсіяним склерозом
Формула / Реферат
1. Композиція, яка містить наступні пептиди основного білка мієліну:
МВР 30-44;
МВР 83-99;
МВР 131-145 і
МВР 140-154.
2. Композиція за п. 1, яка складається по суті з наступних пептидів основного білка мієліну: МВР 30-44;
МВР 83-99;
МВР 131-145 і
МВР 140-154.
3. Композиція за пп. 1 або 2 для лікування або профілактики захворювання.
4. Композиція за пп. 1 або 2 для лікування або профілактики розсіяного склерозу.
5. Композиція за пп. 1 або 2 для лікування або профілактики оптичного невриту, пов'язаного з розсіяним склерозом.
6. Застосування композиції за пп. 1 або 2 для виготовлення лікарського засобу для лікування розсіяного склерозу.
7. Застосування композиції за пп. 1 або 2 для виготовлення лікарського засобу для лікування оптичного невриту, пов'язаного з розсіяним склерозом.
8. Спосіб лікування або профілактики розсіяного склерозу у пацієнта, що потребує цього, який включає стадію введення композиції за пп. 1 або 2 пацієнту.
9. Спосіб лікування або профілактики оптичного невриту, пов’язаного з розсіяним склерозом, у пацієнта, що потребує цього, і який включає стадію введення композиції за пп. 1 або 2 пацієнту.
10. Спосіб за пп. 8 або 9, в якому композицію вводять згідно з протоколом із збільшенням дози.
11. Спосіб за будь-яким з пп. 8-10, де композицію вводять HLA-DQ6 або HLA-DR2-позитивним пацієнтам.
12. Набір, який включає наступні пептиди основного білка мієліну:
МВР 30-44;
MBP 83-99;
MBP 131-145 і
MBP 140-154
для спільного, роздільного або послідовного введення.
Текст
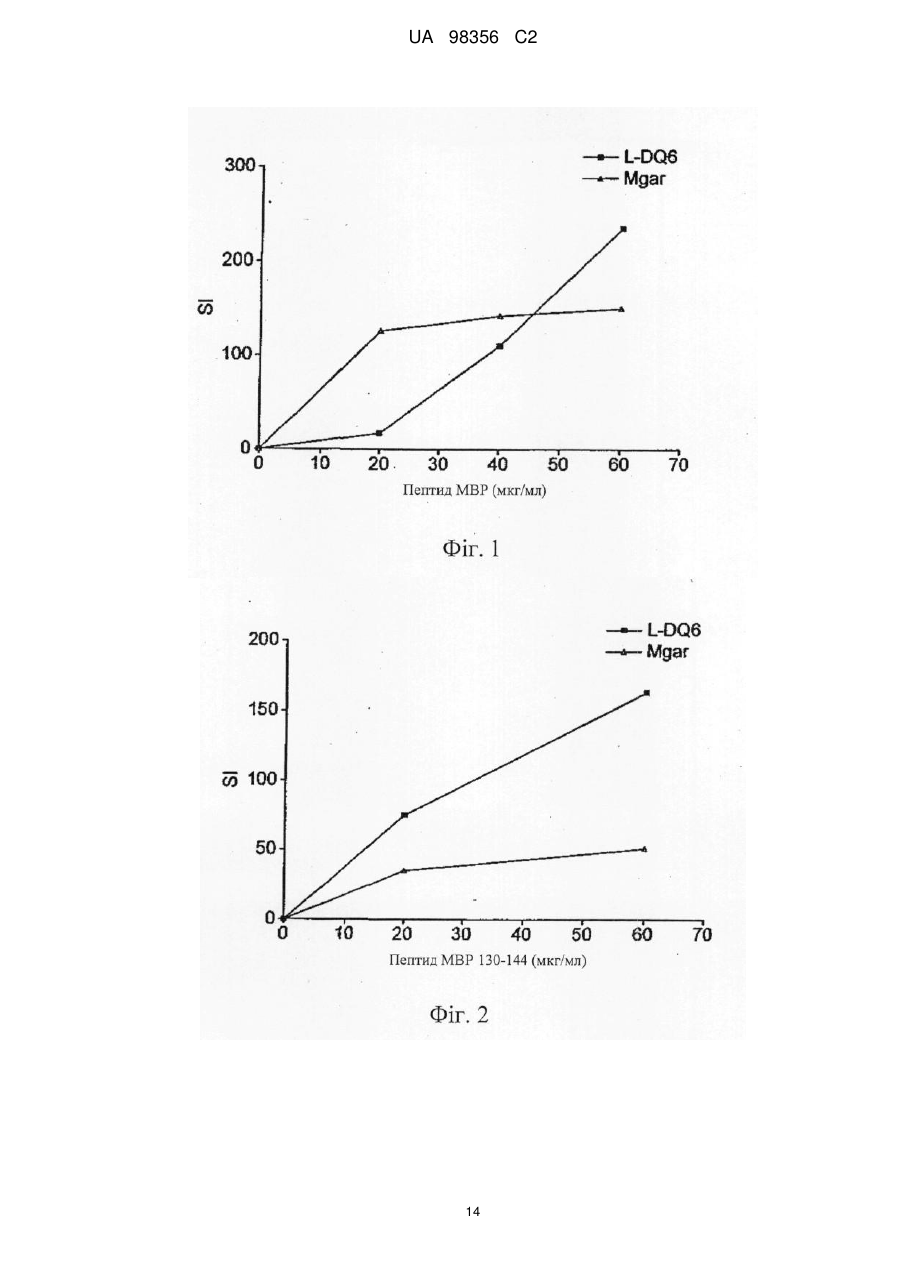
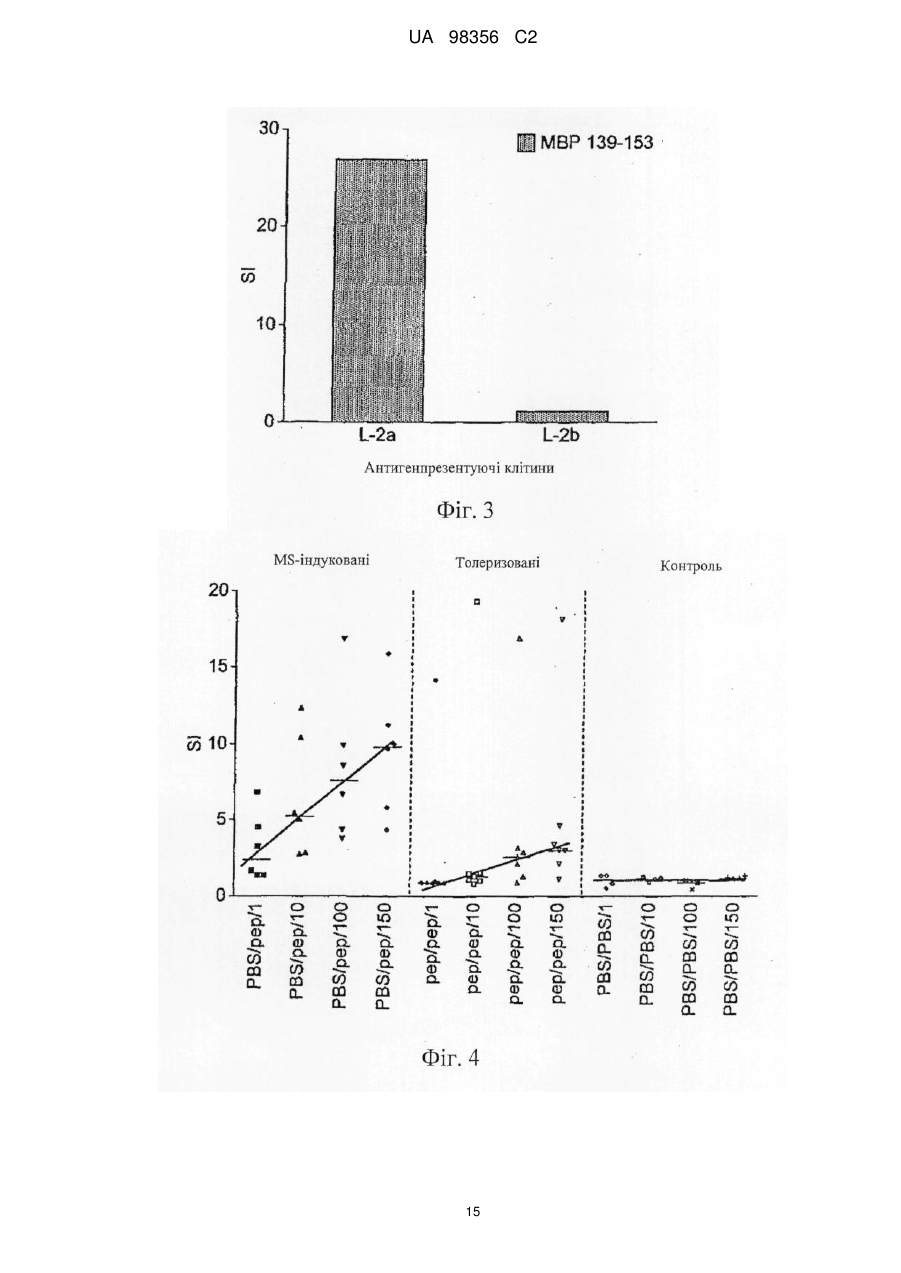
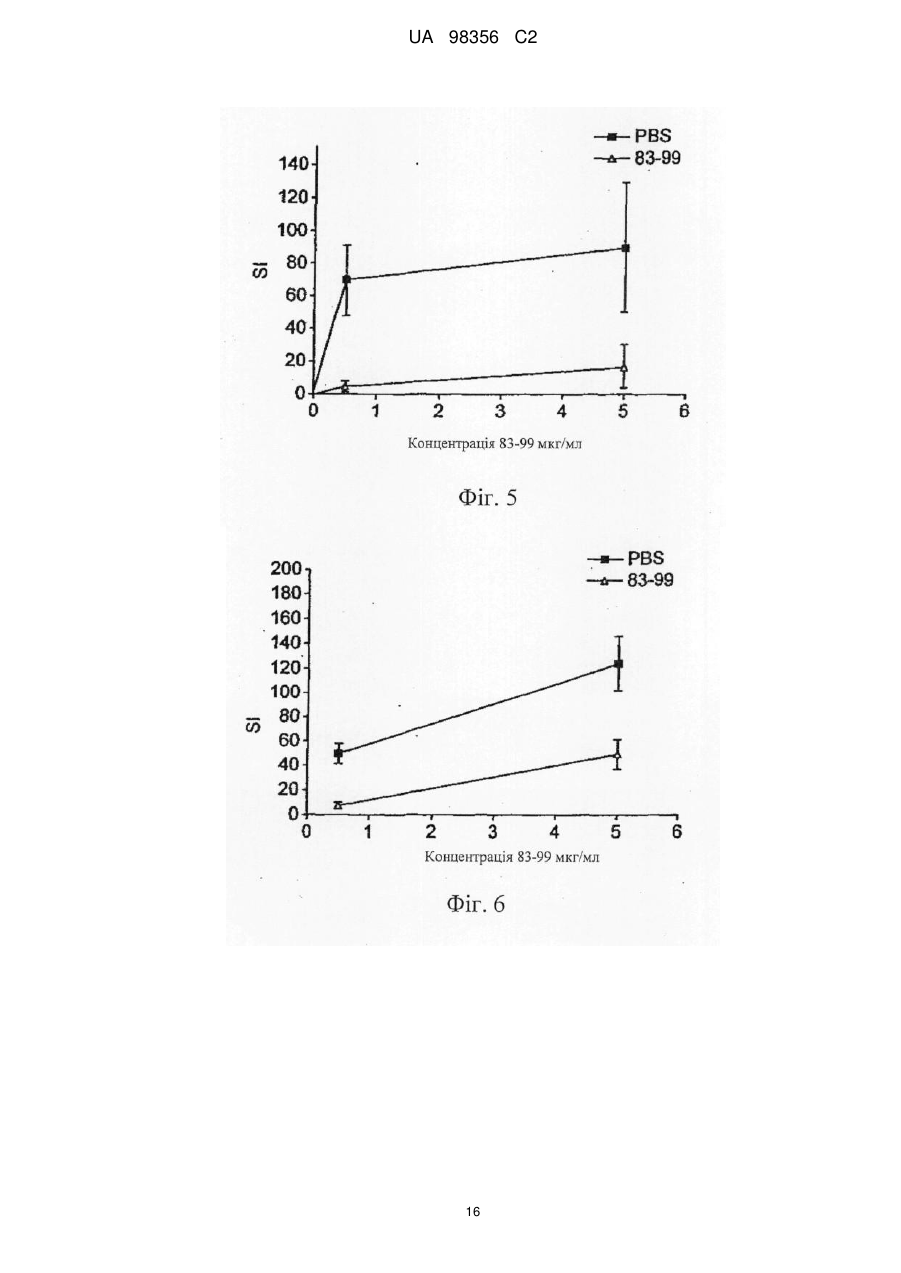
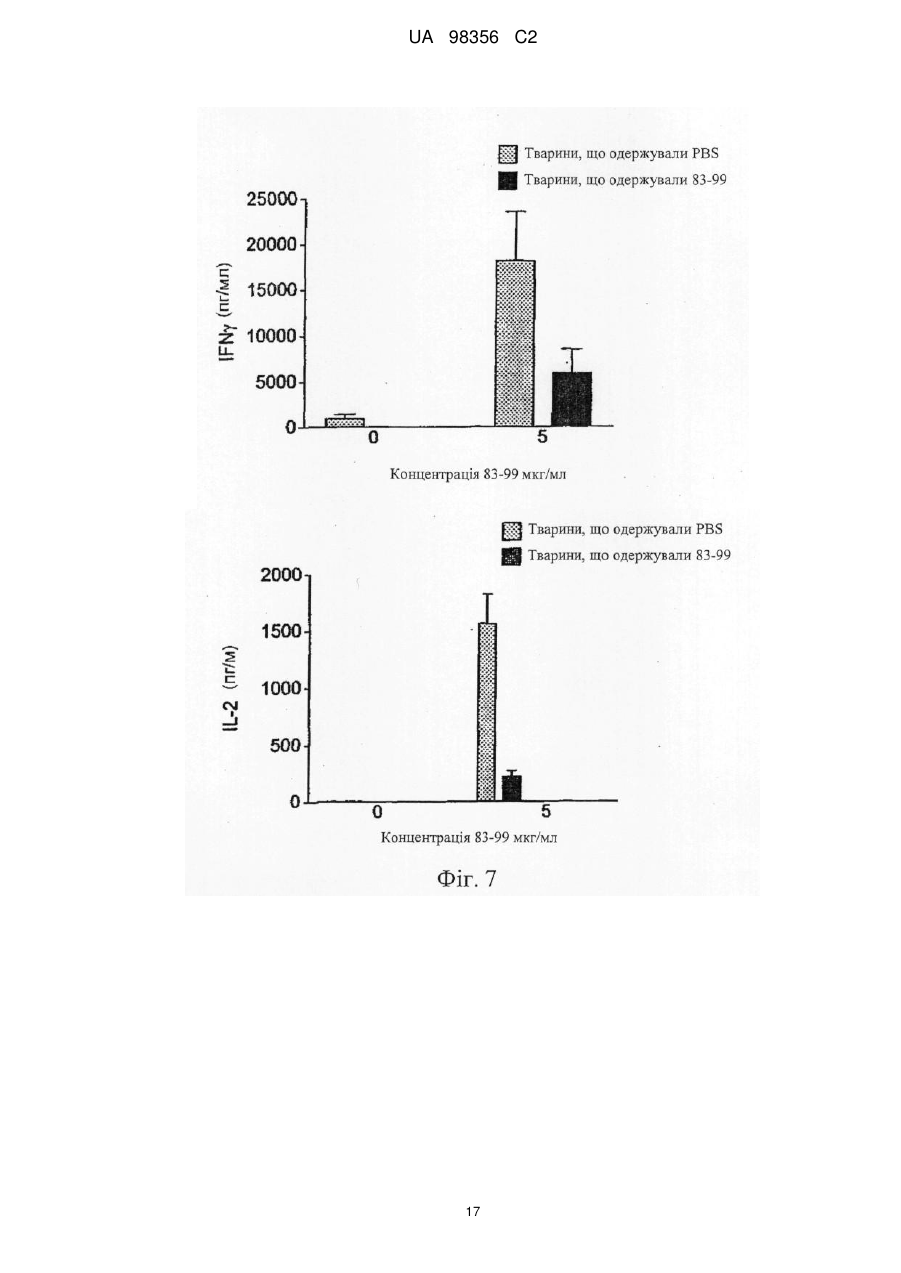
Реферат: Винахід належить до композиції, яка містить наступні пептиди основного білка мієліну: МВР 3044, МВР 83-99, МВР 131-145 і МВР 140-154 та призначена для профілактики або лікування захворювання розсіяного склерозу і/або оптичного невриту, пов’язаного з розсіяним склерозом. UA 98356 C2 (12) UA 98356 C2 UA 98356 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід стосується композиції, яка містить пептиди основного білка мієліну. Композицію можна використовувати для лікування розсіяного склерозу. Розсіяний склероз Розсіяний склероз (MS) є найбільш поширеним інвалідизуючим неврологічним захворюванням, що вражає молодих людей. Близько 85000 чоловік в Великобританії страждають на MS. При розсіяному склерозі (MS), запалення нервової тканини призводить до втрати мієліну, жирової речовини, яка виступає як захисна ізоляція нервових волокон в головному і спинному мозку. Така втрата мієліну, або демієлінізація, залишає множинні області рубцевої тканини, або склерозу, вздовж нервових клітин. У результаті, склероз призводить до множинних неврологічних ознак і симптомів, зазвичай з рецидивами і ремісіями. Звичайні симптоми MS включають зниження або втрату зору, спотикання і нерівну ходу, невиразну мову, а також часте сечовипускання і нетримання сечі. Крім цього, MS може призводити до змін настрою і депресії, м'язових спазмів і важкого паралічу. У даний час вважається, що MS є аутоімунним захворюванням, опосередкованим аутореактивними Т-клітинами. Існуюче лікування MS, як правило, направлене на пригнічення імунної системи. Наприклад, один зі способів лікування включає трансплантацію кісткового мозку і введення цитостатиків і імуносупресивних лікарських засобів. Таке лікування ефективне для частини пацієнтів, але є таким, що дорого коштує і має досить високі ризики ускладнень. Крім того, застосування цитостатиків при лікуванні MS вважається спірним, тому що їх ефекти неясні, а можливі побічні ефекти є важкими. Лікування інтерфероном-бета (IFN) послаблює симптоми MS у частини пацієнтів і, внаслідок цього, широко використовується. Однак, механізм дії інтерферону-бета неясний, а лікування IFN ефективно не для всіх пацієнтів. Більш того лікування IFN ускладняється формуванням анти-IFN антитіл у більшості пацієнтів (Giovannoni, G., Munschauer, F. E., 3rd, і Deisenhammer, F. (2002). Neutralising antibodies to interferon beta during the treatment of multiple sclerosis. J Neurol Neurosurg Psychiatry 73, 465-469). У даний час не існує ефективного способу лікування MS. Лікування спрямоване лише на зменшення симптомів захворювання, зазвичай за рахунок загального пригнічення імунної системи. Таким чином, існує гостра необхідність в терапії, яка специфічно націлена на місцеву імунну відповідь, пов'язану з початком захворювання і його прогресуванням. Синтетичні пептиди Metzler і Wraith (Int. Immunol. 5:1159-1165 (1993)) були першими дослідниками, які описали використання синтетичних пептидів для пригнічення аутоімунної відповіді на мишачій моделі з експериментальним аутоімунним енцефаломієлітом (EAE), загальновідомої моделі MS in vivo. У цьому дослідженні пептиди, одержані з MBP, вводили інтраназально, і було виявлено, що рівень супресії захворювання напряму пов'язаний з антигенною дією використаних пептидів. Пізніше, в 1995, Liu і Wraith (Int. Immunol. 7:1255-1263) показали, що також можна викликати супресію EAE у мишей шляхом внутрішньочеревинного введення розчинних пептидів, одержаних з MBP. У цьому дослідженні була досягнута супресія як Th1, так і Th2-відповіді, і було показано, що введення пептидів після початку імунної відповіді може призводити до пригнічення виникаючих імунних реакцій. Однак було виявлено, що не всі пептиди, здатні діяти як Т-клітині епітопи, здатні викликати толерантність. Пептид 89-101 основного білка мієліну (MBP) після імунізації являє собою імунодомінантний антиген і також є надто ефективним імуногеном як з точки зору праймування Т-клітинної реактивності, так і індукції EAE. Однак була показана неефективність цього пептиду для індукції толерантності при введенні в розчині (Anderton і Wraith (1998) Eur. J. Immunol. 28:1251-1261). Автори даного винаходу раніше показали, що існує зв'язок між здатністю пептиду зв'язуватися з молекулою MHC І або II класу і бути презентованим T-клітині без додаткового процесинга антигену і його здатністю індукувати толерантність in vivo. Можна очікувати, що пептиди, які не залежать від процесинга антигену (тобто не потребують додаткового процесинга антигену для того, щоб зв'язатися з MHC), будуть викликати толерантність in vivo. Ці пептиди називають "апітопи", від Antigen Processing Independent epiTOPES. У WO 02/16410 описані наступні апітопи основного білка мієліну (MBP): 30-44, 80-94, 83-99, 81-95, 82-96, 83-97, 84-98, 110-124, 130-144, 131-145, 132-146 і 133-147. У WO 03/064464 як апітопи визначені наступні пептиди MBP: 134-148; 135-149; 136-150; 137151; 138-152 і 140-154. 1 UA 98356 C2 5 10 15 20 25 30 35 40 45 50 55 60 Автори даного винаходу виявили, що "коктейль" з чотирьох пептидів MBP, кожний з яких є апітопом, особливо ефективний для лікування MS. Вважають що, комбінація чотирьох пептидів може надавати синергічну дію. У першому аспекті, таким чином, даний винахід належить до композиції, яка містить наступні пептиди основного білка мієліну: MBP 30-44; MBP 83-99; MBP 131-145 і MBP 140-154. Композиція може складатися переважно з MBP 30-44, 83-99, 131-145 і 140-154. Композицію можна використовувати для лікування або профілактики захворювання, зокрема, розсіяного склерозу. Композицію можна використовувати для лікування або профілактики оптичного невриту, зокрема, оптичного невриту, зумовленого розсіяним склерозом. У другому аспекті, даний винахід належить до способу лікування або профілактики розсіяного склерозу і/або оптичного невриту шляхом введення пацієнту композиції за першим аспектом винаходу. У способі другого аспекту за винаходом композицію можна вводити, слідуючи протоколу із збільшенням дози. Виявлено, що два пептиду в коктейлі зв'язуються з HLA-DQ6 (MBP 30-44 і 131-145), а два - з HLA-DR2 (MBP 140-154 і 83-99). Комбіноване використання цих апітопів забезпечує більш широке охоплення різних гаплотипів головного комплексу гістосумісності (MHC), що спостерігаються у пацієнтів з MS, ніж при терапії одним пептидом. Спосіб другого аспекту за винаходом може включати введення композиції HLA-DQ6 або НLА-DR2-позитивним пацієнтам. У третьому аспекті, даний винахід належить до набору, який включає наступні пептиди основного білка мієліну: MBP 30-44; MBP 83-99; MBP 131-145 і MBP 140-154 для спільного, роздільного або послідовного введення. Фігура 1: Презентація MBP 30-44 за допомогою HLA-DQ6 Т-клітинному клону MS 49:D3 Фігура 2: Презентація MBP 130-144 за допомогою HLA-DQ6 Т-клітинному клону MS 17:А2 Фігура 3: Презентація MBP 139-153 за допомогою L-клітин, трансфекованих HLA-DR2a і HLA-DR2b, Т-клітинному клону N5:19 Фігура 4: Проліферативна відповідь клітин лімфовузла після толеризації апітопом MS6 Фігура 5: Проліферація спленоцитів у відповідь на апітоп MS7. Спленоцити одержані від мишей, яких лікували за допомогою інтраназального введення або PBS, або апітопу MS7 (8399) Фігура 6: Проліферація спленоцитів у відповідь на апітоп MS7. Спленоцити одержані від мишей, яких лікували за допомогою підшкірного/черезшкірного введення або PBS, або апітопу MS7 (83-99) Фігура 7: Вироблення IFN і IL-2 спленоцитами, одержаними від мишей, яких лікували за допомогою підшкірного/черезшкірного введення або PBS, або апітопу MS7 (83-99) Фігура 8: Приклад таблиці Шеллена Фігура 9: Відповіді PBMC пацієнтів на основний білок мієліну людини (MBP) Фігура 10: Відповіді PBMC пацієнтів на ATX-MS-1467 Фігура 11: Порівняння проліферативної відповіді Т-клітин на MBP до (візит 1) і після (візит 8) лікування з допомогою ATX-MS-1467 Перший аспект винаходу належить до композиції, яка містить декілька пептидів основного білка мієліну. Основний білок мієліну Основний білок мієліну (MBP) являє собою білок масою 18,5 кДа, який може бути виділений з білої речовини головного мозку людини. Зрілий білок містить 170 амінокислот, і його послідовність широко доступна в літературі (дивись наприклад: Chou et al. (1986) J. Neurochem. 46:47-53, фігура 1; Kamholz et al. (1986), PNAS 83:4962-4966, фігура 2; патент США № 5817629, SEQ ID NO: 1; Roth et al. (1987), J. Neurosci. Res. 17:321-328, фігура 4; Medeveczky et al. (2006), FEBS Letters 580:545-552, фігура 3В). Пептиди MBP 2 UA 98356 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "пептид" використовується в звичайному значенні і означає серію залишків, як правило, L-амінокислот, з'єднаних один з іншим зазвичай за допомогою пептидних зв'язків між -аміно і карбоксильною групами сусідніх амінокислот. Термін включає модифіковану пептиди і синтетичні аналоги пептидів. Пептиди, використані в композиції і наборі за даним винаходом, можуть бути одержані з використанням хімічних способів (Peptide Chemistry, A practical Textbook. Mikos Bodansky, Springer- Verlag, Berlin.). Наприклад, пептиди можуть бути синтезовані твердофазними методами (Roberge JY et al (1995) Science 269: 202-204), гідролізовані на іонообмінній смолі і очищені за допомогою препаративної високоефективної рідинної хроматографії (наприклад, Creighton (1983) Proteins Structures And Molecular Principles, WH Freeman і Co, New York NY). Автоматичний синтез може бути здійснений, наприклад, з використанням ABI 43 1 A Peptide Synthesizer (Perkin Elmer) відповідно до інструкцій виробника. Пептид може альтернативно бути одержаний рекомбінантними методами або за допомогою вищеплення з більш довгого поліпептиду. Наприклад, пептид може бути одержаний вищепленням з повнорозмірного MBP. Склад пептиду може бути підтверджений амінокислотним аналізом або секвенуванням (наприклад, методом деградації за Едманом). Пептиди, використані в композиціях і наборах за даним винаходом, представлені нижче: MBP 30-44: H-Pro-Arg-His-Arg-Asp-Thr-Gly-Ile-Leu-Asp-Ser-Ile-Gly-Arg-Phe-NH2 MBP 83-99: H-Glu-Asn-Pro-Val-Val-His-Phe-Phe-Lys-Asn-Ile-Val-Thr-Pro-Arg-Thr-Pro-NH2 MBP 131-145: H-Ala-Ser-Asp-Tyr-Lys-Ser-Ala-His-Lys-Gly-Phe-Lys-Gly-Val-Asp-NH2 MBP 140-154: H-Gly-Phe-Lys-Gly-Val-Asp-Ala-Gln-Gly-Thr-Leu-Ser-Lys-Ile-Phe-NH2 Терміни "MBP 30-44", "МБР 83-99", "MBP 131-145" і "MBP 140-154" включають модифіковані пептиди. Наприклад, пептиди можуть бути мутовані за допомогою амінокислотної вставки, делеції або заміни, за умови, що зберігається МНС-зв'язуюча специфічність немодифікованого пептиду разом з його здатністю бути презентованим Т-клітині. Пептид може мати, наприклад, 5, 4, З, 2, 1 або 0 мутацій в порівнянні з немодифікованою послідовністю. Альтернативно (або крім того) модифікації можуть бути проведені без зміни амінокислотної послідовності пептиду. Наприклад, можуть бути введені D-амінокислоти або інші неприродні амінокислоти, звичайний амідний зв'язок може бути заміщений зв'язками складноефірного або алкільного кістяка, можуть бути включені N- або С-алкільні замісники, модифікації бічного ланцюга і обмежувальні зв'язки, такі як дисульфідні місточки і зв'язки аміду бічного ланцюга або складноефірні. Такі зміни можуть давати кращу стабільність пептиду in vivo і збільшувати біологічний час життя. Модифікації епітопів можуть бути зроблені, основуючись на прогнозуванні для більш ефективної Т-клітинної індукції, одержаних з використанням програми "Peptide Binding Predictions", розробленої K. Parker (NIH), яку можна знайти за адресою http://wwwbimas.dcrt.nih.gov/cgi-bin/molbio/ken_parker_comboform (див. також Parker, K. C et al. 1994. J.Immunol. 152:163). Пептиди MBP можуть бути введені в композицію в нейтральній формі і в формі солі. Фармацевтично прийнятні солі включають кислі солі приєднання (утворені за допомогою вільних аміногруп пептиду) і ті, які утворені за допомогою неорганічних кислот, таких як, наприклад, хлористоводнева або фосфорна кислоти, або органічних кислот, такої як оцтова, щавлева, винна і малеїнова. Солі, утворені за допомогою вільних карбоксильних груп, можуть також бути похідними неорганічних основ, таких як, наприклад, гідроксиди натрію, калію, амонію, кальцію або заліза, і таких органічних основ, як ізопропіламін, триметиламін, 2етиламіноетанол, гістидин і прокаїн. Композиція Композиція за даним винаходом може використовуватися для профілактичного або терапевтичного застосування. Композиція може бути одержана у придатній для ін'єкції формі, у вигляді розчину рідини або суспензії; може також бути одержана у вигляді твердої форми, придатної для розчинення або суспендування в рідині перед ін'єкцією. Препарат може також бути у вигляді емульсії, або пептиди інкапсульовані в ліпосоми. Активні інгредієнти можуть бути змішані з ексципієнтами, які є фармацевтично прийнятними і сумісними з активним інгредієнтом. Зручними ексципієнтами є, наприклад, вода, фізіологічний розчин (наприклад, фосфатно-сольовий буфер), декстроза, гліцерин, етанол, або подібні ним, і їх поєднання. 3 UA 98356 C2 5 10 15 20 25 30 35 40 45 50 55 60 Крім того, при бажанні, композиція може містити незначні кількості допоміжних речовин, таких як змочувальні або емульгувальні реагенти і/або рН-буферні речовини. Буферні солі включають фосфат, цитрат, ацетат. Хлористоводневу кислоту і/або гідроксид натрію можна використовувати для коректування рН. Для стабілізації можна використовувати дисахариди, такі як сахароза або трегалоза. У композиції відносне співвідношення пептидів (MBP 30-44:МВР 83-99:МВР 131-145:МВР 140-154) може бути приблизно 1:1:1:1. Альтернативно, відносне співвідношення кожного пептиду може бути змінене, наприклад, для того, щоб сфокусуватися на толерогенній відповіді певної субпопуляції аутореактивних Т-клітин або, якщо виявлено, що один пептид працює краще, ніж інші у певних типів HLA. Після одержання, композиція може бути поміщена в стерильний контейнер, який потім запаюється і зберігається при низькій температурі, наприклад 4C, або композиція може бути висушена сублімацією. Зручно, якщо композицію одержують у вигляді ліофілізованої (висушеної сублімацією) пудри. Ліофілізація забезпечує можливість довгострокового зберігання в стабілізованій формі. Методи ліофілізації добре відомі в даній галузі, дивись наприклад http://www.devicelink.com/ivdt/archive/97/01/006.html. Наповнювачі, такі як маніт, декстран або гліцин, широко використовуються перед ліофілізацією. Композицію можна вводити зручним способом, таким як пероральний, внутрішньовенний (у випадку водорозчинної), внутрішньом'язовий, підшкірний, сублінгвальний, інтраназальний, черезшкірний або у вигляді супозиторіїв або імплантів (наприклад, з використанням молекул повільного вивільнення). Композиція може переважно вводитися інтраназальним, підшкірним або черезшкірним шляхом. Спосіб і фармацевтичну композицію за винаходом можна використовувати для лікування людини. Зазвичай, лікуючий лікар визначає фактичну дозу, яка найбільш підходить для окремого пацієнта, і яка може варіювати залежно від віку, ваги і відповіді конкретного пацієнта. У переважному варіанті здійснення можна слідувати протоколу «збільшення дози», коли сукупність доз дається пацієнту в зростаючій концентрації. Такий підхід був використаний, наприклад, для пептидів фосфоліпази А2 в імунотерапії алергії до бджолиної отрути (Muller et al (1998) J. Allergy Clin Immunol. 101:747-754 і Akdis et al (1998) J. CIin. Invest. 102:98-106). Набори Зручно, коли чотири пептиди MBP можна вводити разом в формі змішаної композиції або коктейлю. Однак в деяких випадках, при яких переважніше надавати пептиди роздільно у вигляді набору для спільного, роздільного, послідовного або комбінованого введення. Наприклад, набір може включати чотири пептиди в роздільних контейнерах, або два контейнери, що містять по два пептиди кожний. Вміст контейнерів можна комбінувати або не комбінувати перед введенням. Набір може також включати пристрої для змішування і/або для введення (наприклад, розпилювач для інтраназального введення; або шприц і голку для підшкірної/черезшкірної дози). Набір може також включати інструкції з використання. Фармацевтичну композицію або набір за винаходом можна використовувати для лікування і/або профілактики захворювання. Зокрема, композицію/набори можна використовувати для лікування і/або профілактики розсіяного склерозу і/або оптичного невриту. Розсіяний склероз Розсіяний склероз (MS) є найбільш поширеним неврологічним порушенням серед молодих людей (у віці від 20 до 40 років), вражаючи близько 385000 чоловік в Європі і 300000 в США. Це хронічне дегенеративне захворювання центральної нервової системи, при якому відбувається поступове осередкове руйнування мієліну у всіх областях головного і/або спинного мозку, що перешкоджає нервовому зв'язку і викликає м'язову слабкість, втрату координації, мовні і зорові порушення. Через 10 років, приблизно половина пацієнтів, яким спочатку був поставлений діагноз оборотно-ремітуючий MS (RRMS), відмічає зниження частоти загострень, але посилення порушення функцій. Цей стан відомий як повторний прогресуючий MS (SPMS). За деякими оцінками, протягом 25 років приблизно у 90% хворих RRMS переходить у вторинний прогресуючий тип. Як і RRMS, тяжкість вторинного прогресуючого MS може змінюватися. Для деяких пацієнтів, зростання і прогресування порушення функцій відбувається поступово, у інших це трапляється більш швидко. В основному, однак, відновлення після загострень стає все менш і менш повним, симптоми мають тенденцію до посилення, і порушення функцій росте. 4 UA 98356 C2 5 10 15 20 25 30 35 Клінічно атаки стають менш вираженими, і є тенденція до зникнення ремісій, але велика частина тканини ЦНС в даний момент не зруйнована, і накопичення пошкоджень більш виражене на ЯМР. Композицію за винаходом можна використовувати для лікування пацієнтів з MS, що недавно почався, RRMS або SPMS. Композиція за даним винаходом може послаблювати або поліпшувати один або декілька симптомів MS, які включають зниження або втрату зору, спотикання і нерівну ходу, невиразну мову, часте сечовипускання і нетримання сечі, зміни настрою і депресію. SPMS може супроводжуватися м'язовими спазмами і важким паралічем. Зокрема, композиція може поліпшувати оптичний неврит. Оптичний неврит Оптичний неврит (OH) являє собою запалення з супутньою демієлінізацією оптичного нерва, обслуговуючого сітчатку ока. Це змінний стан, і може виявлятися будь-яким з наступних симптомів: нечіткість зору, втрата гостроти зору, часткова або повна втрата колірного зору, повна або часткова сліпота і біль за оком. Оптичний неврит є одним з симптомів розсіяного склерозу, що найчастіше виявляються в даний час, і одним з найбільш поширених симптомів на початку розвитку MS. OH може, однак, бути проявом іншого захворювання, а не MS, такого як ішемічна оптична невропатія. У 70% випадків OH присутній унілатерально (тільки на одному оці). Частіше за все, оптичний неврит спочатку вражає людей у віці від 15 до 50 років. Дослідження показують, що в цій віковій групі, більше ніж у 50% пацієнтів розвивається розсіяний склероз протягом 15 років. Як і у випадку MS, у жінок імовірність появи OH приблизно в два рази вище, ніж у чоловіків, і поширеність OH у європеоїдів вище, ніж в інших расових групах. Основними симптомами оптичного невриту є: • Втрата гостроти зору (нечіткість зору). • Очний біль. • Дисхроматопсія (зниження колірного зору). • Рухові і звукові фосфени (зорові відчуття спалахів, викликані рухом очей з боку в бік або звуком). • Симптом Утхофа, погіршення симптомів з підвищенням температури або занепадом сил. Лікування ОН за допомогою композиції за даним винаходом може запобігати, послаблювати або поліпшувати будь-який з цих симптомів. Для спостереження за прогресуванням OH гострота зору може бути зручно виміряна з використанням таблиці Шеллена. Приклади Наступні приклади служать для ілюстрації даного винаходу, але не є обмежувальними. Винахід належить, зокрема, до специфічних варіантів здійснення, описаних в даних прикладах. З метою прикладів, наступні назви можна використовувати для пептидів MBP: Пептид MBP 30-44 83-99 131-145 140-154 Назви в прикладах (взаємозамінні) ATX-MS-01 Апітоп MS1 ATX-MS-07 Апітоп MS7 ATX-MS-04 Апітоп MS4 ATX-MS-06 Апітоп MS6 40 45 50 Композиція чотирьох пептидів називається ATX-MS-1467 Приклад 1 Ідентифікація обмежених за HLA-DQ6 Т-клітинних епітопів основного білку мієліну Гени MHC класу II передають сприйнятливість до розсіяного склерозу (Nepom і Ehrlich (1991) Ann. Rev. Immunol. 9: 493-525). Серед європеоїдів середньої і центральної Європи, Австралії і Північної Америки асоціація пов'язана з молекулою MHC HLA-DR2 (DR2a [DRB5*0101] і DR2b [DRB1*1501], Haines et al (1998) Human Mol. Genet. 7: 1229-1234). Хоча DR2 і DQ6 алелі MHC знаходяться в різних локусах, існує значна нерівновага за зчепленням між цими двома алелями. Конкордантність між цими двома алелями складає 99%, набагато вище очікуваного, у випадку якби алелі були асоційовані випадковим чином. Таким чином, збільшується можливість того, що певні Т-клітинні епітопи, пов'язані з MS, можуть бути швидше обмежені за HLA-DQ6, ніж за HLA-DR2. Метою даного дослідження було встановити, чи презентуються Т-клітинні епітопи MBP людини за допомогою молекули HLA-DQ6 Т-клітинним клонам, виділеним від HLA-DR2 5 UA 98356 C2 5 10 15 20 25 30 35 40 45 50 55 позитивних пацієнтів з MS. Т-клітинну активацію вимірювали за допомогою Т-клітинної 3 проліферації з використанням інкорпорації [ Н]-тимідину. Пептидні антигени Пептиди MBP 30-44, 130-144 і 139-153 були синтезовані з використанням L-амінокислот і стандартної F-moc хімії на синтезаторі пептидів Abimed AMS 422. Антигенпрезентуючі клітини Як антигенпрезентуючі клітини були використані L-клітини, трансфековані HLA-DQ6, HLADR2a або HLA-DR2b, або клітини Mgar (EACC, Porton Down, UK), які експресують HLA-DQ, DP і DR. Т-клітинні клони Т-клітинні клони MS 49:D3 і MS 17:А2 були одержані від пацієнтів з MS, і клон N5:19 був одержаний від здорової людини. Всі три клони були виділені у DR2-позитивних індивідуумів. Аналіз презентації антигену Антигенпрезентуючі клітини інкубували з різними концентраціями пептиду і відповідними Тклітинами. Проліферацію, і, таким чином, активацію Т-клітин вимірювали за допомогою 3 інкорпорації [ Н]-тимідину, і виражали у вигляді індексу стимуляції (SI = коректована кількість імпульсів на хвилину (ccpm) від культури, що містить пептиди/ccpm від культури без пептидів). Результати Коли пептид MBP 30-44 презентувався L-клітинами, трансфекованими HLA-DQ6, Тклітинний клон MS 49:D3 давав дуже сильну проліферативну відповідь (в 1,5 рази більше в порівнянні з контрольними клітинами Mgar) при найвищій концентрації пептиду (фігура 1). Коли MBP 130-144 презентувався L-клітинами, трансфекованими HLA-DQ6, ще більш сильна відповідь була індукована у MS 17:А2 Т-клітин (збільшення проліферації в 3,24 рази в порівнянні з контрольними клітинами Mgar - фігура 2). Третій Т-клітинний клон N5:19, виділений від індивідуума з DR2, відповів на основний епітоп MBP 140-154 і на серію 15-мірних пептидів, що перекриваються, які покривають цей регіон (138156). Пептид 139-153 стимулював проліферацію Т-клітинного клону N5:19, коли він був презентований L-клітинами, трансфекованими HLA-DR2a, але не у випадку L-клітин, трансфекованих HLA-DR2b (фігура 3). Висновок Т-клітинні клони, виділені від HLA-DR2-позитивних індивідуумів, відповідають на обмежені за HLA-DQ6 MBP Т-клітинні епітопи. Це означає, що асоціація HLA-DR2 з розсіяним склерозом не обмежується DR2 MBP T-клітинними епітопами, але може бути також обмежена за DQ6. У композиції MBP за даним винаходом, два пептиди зв'язуються з HLA-DQ6 (MBP 30-44 і 131-145) і два зв'язуються з HLA-DR2 (MBP 140-154 і 83-99). Таким чином, терапія пептидами з допомогою цих апітопів може бути направлена на HLA-DR2 або HLA-DQ6 індивідуумів. Приклад 2 - Індукція толерантності з допомогою апітопу MS6 у HLA:DR2 трансгенної миші Це дослідження було сплановане для того, щоб показати, що апітоп (апітоп MS6), коли він презентується молекулою MHC класу II, може викликати імунологічну толерантність на гуманізованій мишачій моделі розсіяного склерозу. Апітоп MS6 є апітопом, вибраним з Тклітинних епітопів MBP, являє собою MBP 140-154, презентується за допомогою MHC класу II на антигенпрезентуючих клітинах, і може стимулювати Т-клітини без процесинга (див. WO 03/064464). Була використана мишача модель, трансгенна за молекулою MHC людини HLA:DR2 (DRB 1*1501) (Madsen et al. (1999) Nature Genetics 23:343-347). Індукцію толерантності або зміни в популяції CD4+ Т-клітин у миші після введення апітопу можна проконтролювати за зниженням Т-клітинної проліферації після стимуляції антигеном in vivo. Пептидний синтез Апітоп MS6 (пептид MBP 140-154) був синтезований з використанням L-амінокислот і стандартної F-moc хімії на синтезаторі пептидів Abimed AMS 422. Миші і індукція толерантності У дослідженні були використані HLA:DR2 трансгенні миші у віці 8-12 тижнів. У мишей викликали толерантність за допомогою попереднього введення 100 мкг апітопу MS6 в 25 мкл фосфатно-сольового буфера (PBS) або 25 мкл PBS в чистому вигляді, шляхом інтраназального введення на -8, -6 і -4 дні перед імунізацією на день 0. Слідом за толеризацією, миші були імунізовані підшкірно 100 мкл емульсії, що містить рівні об'єми повного ад'юванту Фрейнда (CFA), PBS, що містить 200 мкг апітопу MS6 і 400 мкг Mycobacterium tuberculosis, вбитої нагріванням. Контрольна група мишей, попередньо толеризована за допомогою PBS інтраназально, була імунізована без пептиду. 6 UA 98356 C2 5 10 15 20 25 30 35 40 45 50 55 60 Через 10 днів після підшкірної імунізації підколінні і пахові лімфовузли видаляли і оцінювали Т-клітинну активацію, аналізуючи проліферацію Т-клітин у відповідь на різні концентрації апітопу 3 MS6. Проліферацію вимірювали за допомогою інкорпорації [ Н]-тимідину, і виражали у вигляді індексу стимуляції (SI = коректована кількість імпульсів на хвилину (ccpm) від культури, що містить пептиди/ccpm від культури без пептидів). Результати Миші групи А, які були толеризовані PBS і потім імунізовані апітопом MS6, відповіли на антигенну стимуляцію, коли вона була проведена повторно з апітопом MS6 дозозалежним способом (фігура 4). Зі збільшенням концентрації пептиду SI збільшився за медіаною від 2,5 до 10. Всі миші в цій групі продемонстрували, що введення PBS інтраназально не може викликати толерантність до апітопу MS6. Навпаки, інтраназальне попереднє введення апітопу MS6 надає серйозний вплив на проліферативну відповідь лімфоцитів, стимульованих цим пептидом. Лімфоцити мишей з групи В були нездатні до відповіді значною будь-якою мірою, навіть при високій концентрації пептиду 150 мкг/мл (медіана SI - 3, фігура 4). Ці дані підтверджують, що апітоп MS6 викликає толерантність у лімфоцитів від HLA-DR2 мишей. Лімфоцити, виділені у мишей, яким заздалегідь вводили PBS і імунізували PBS (Група C), не показали ніякої відповіді на апітоп MS6 (фігура 4). Відсутність відповіді на пептид у Групи C підтверджує, що проліферативна відповідь, що спостерігається в групі А, дійсно була відповіддю на імунізацію апітопом MS6. Висновок Ці дані підтверджують гіпотезу, що пептид MBP (апітоп MS6), який не потребує процесинга і зв'язується з молекулою MHC класу II HLA:DR2, може викликати толерантність при введенні інтраназально. Приклад 3 - Індукція толерантності за допомогою апітопу MS 7 (MBP 83-99) у мишей, трансгенних за двома генами (HLA :DR2 і Т-клітинний рецептор (MBP) 82-100) Дане дослідження вивчає здатність апітопу MS7 (пептиду MBP 83-99) викликати толерантність у мишей, трансгенних за двома генами і експресуючих HLA:DR2 разом з Тклітинним рецептором для зв'язаного з HLA:DR2 пептиду основного білка мієліну (MBP) 82-100. Спленоцити від даних тварин, трансгенних за двома генами, проліферують in vitro у відповідь на апітоп MS7. Зниження або зникнення in vitro відповіді спленоцитів на апітоп, вслід за його повторним введенням in vivo, вказує на те, що стан толерантності досягнутий. Викликати толерантність пробували з використанням як інтраназального, так і підшкірного/черезшкірного шляхів введення апітопу. Індукція толерантності Були використані групи з 6 або 7 порівнянних за віком (8-12 тижнів) і статтю мишей, трансгенних за двома генами. У першому експерименті одній групі вводили 10 разів інтраназально 100 мкг апітопу MS7 в 25 мкл PBS через однакові інтервали протягом трьох тижнів. Контрольна група одержувала чистий PBS. У другому експерименті таку ж кількість пептиду давали за допомогою підшкірного/черезшкірного введення в 100 мкл PBS. Контрольна група одержала такий же об'єм PBS. Аналіз проліферації Через три дні після останнього введення пептиду або PBS, видаляли селезінки і готували клітинні суспензії. Спленоцити інкубували з 0,5 або 5 мкг/мл апітопу MS7, і оцінювали 3 проліферацію за допомогою інкорпорації [ H]-тимідину після 48, 72 і 96 годин культивування. Результати виражені у вигляді індексу стимуляції (SI = кількість імпульсів на хвилину (cpm) від культури, що містить антиген/кількість імпульсів в хвилину без антигену). Вимірювання цитокінів У другому експерименті, де толерантність була індукована через підшкірний/черезшкірний шлях введення, збирали супернатанти клітинної культури спленоцитів через 48 і 72 години культивування і аналізували на наявність IFN і інтерлейкіну-2 (IL-2) з використанням імуноферментного аналізу (ELISA). Результати У всіх трьох досліджених часових точках спленоцити мишей, яким вводився PBS, як при інтраназальному, так і при підшкірному/черезшкірному шляхах введення, показали сильну проліферацію у відповідь на апітоп MS7; сила відповіді підвищувалася із збільшенням концентрації пептиду. Разюче зниження проліферації спостерігали в культурі спленоцитів мишей, що одержували апітоп MS7 за допомогою обох шляхів введення. Як показано на фігурі 5, після 72 годин середній SI, що спостерігається в культурах, які містять 5 мкг/мл апітопу MS7, був 17 у мишей, що одержували інтраназально апітоп MS7. У відповідних культурах від 7 UA 98356 C2 5 10 15 20 25 30 35 40 45 50 контрольних мишей, що одержували PBS, середній SI, що спостерігається, був 89. Аналогічно, як показано на фігурі 6, введення апітопу MS7 за допомогою підшкірного/черезшкірного шляху призвело до зниження SI в середньому від 124 у тварин, що одержували PBS, до 49 у тварин, що одержували апітоп MS7. Рівні IFN і IL-2, визначені в супернатантах культур після 48 часів культивування, показані на фігурі 7. Видно, що повторне лікування пептидом in vivo спричиняє вражаюче зниження секреції обох цитокінів, паралельно зі зниженням проліферативної відповіді. Висновок Дані результати показують, що толерантність до апітопу MS7 може бути успішно викликана на мишачій моделі, створеній для імітації людської системи, і підтримують можливість його використання в терапії розсіяного склерозу. Крім того, його ефективність зберігається при введенні за допомогою підшкірного/черезшкірного шляху, тобто переважного шляху введення для людей. Незважаючи на те, що ефективність апітопів MS6 і MS7 була показана in vivo, в даний час не представляється можливим продемонструвати ефективність апітопів MS1 і MS4. Це пов'язано з невдачею відносно трансгенних мишей, що експресують молекулу HLA-DQ6. Миші, що експресують молекулу, були створені, але було виявлено, що вони не здатні виробляти CD4 Т-клітини в тимусі, і не можуть, таким чином, підвищувати імунну відповідь на антиген в контексті HLA-DQ6. Приклад 4 - Дослідження із збільшенням дози з композицією з чотирьох пептидів MBP Комбінація з чотирьох пептидів (MBP 30-44, 131-145,140-154 і 83-99) була використана у відкритому дослідженні із збільшенням дози ATX-MS-1467 у пацієнтів з повторним прогресуючим розсіяним склерозом. У пацієнтів контролювали гостроту зору (тобто зниження оптичного невриту), імунологічний параметри і запалення в ЦНС через чотири тижні і через три місяці після прийому фінальної дози. Приклад 4А - Контроль гостроти зору Оптичний неврит (OH) являє собою запалення з супутньою демієлінізацією оптичного нерва, обслуговуючого сітчатку ока. Оптичний неврит є одним з симптомів розсіяного склерозу, що найчастіше виявляються в даний час, і одним з найбільш поширених симптомів на початку MS. Звичайні симптоми OH включають: нечіткість зору, втрату гостроти зору, часткову або повну втрату колірного зору, повну або часткову сліпоту і біль за оком. Був досліджений ефект лікування за допомогою ATX-MS-1467 оптичного невриту, який розвинувся внаслідок нейрозапального процесу при MS. ATX-MS-1467 давали згідно з протоколом збільшення дози, відміченим вище, потім через місяць після лікування перевіряли гостроту зору пацієнта з використанням стандартної таблиці Шеллена (фігура 8). Результати показали клінічно значуще поліпшення гостроти зору через один місяць після лікування. Це було продемонстровано в аналізі дослідження гостроти зору при початковому скринінгу в порівнянні з подальшим тестом через один місяць. Початкові показники зору при скринінгу - 6/24 і 6/9 (на правом і лівому оку, відповідно) поліпшилися після лікування до 6/9 (праве око) і 616 (ліве око). Зір пацієнтів раніше залишався незмінним протягом останніх двох років. Приклад 4В - Контроль імунологічний параметрів Як пояснювалося вище, дія пептидної терапії з коктейлем, що містить апітоп™ пептиди з основного білка мієліну (ATX-MS-1467), досліджували на пацієнтах з MS. Кожногопацієнта відбирали перед початком дослідження аж до 14 днів перед першою дозою (візит 1). Першу дозу в кількості 25 мкг ATX-MS-1467 давали на візиті 2, 50 мкг на візиті 3, 100 мкг на візиті 4, 400 мкг на візиті 5 і 800 мкг на візитах 6 і 7. Подальше обстеження проводили через один місяць і через три місяці подальшого спостереження (візити 8 і 9). Наступна таблиця узагальнює протокол і показує кількість візитів в клініку, зроблені кожним пацієнтом, разом з дозою пептиду і зразком крові. 8 UA 98356 C2 Таблиця 1 НОМЕР ВІЗИТУ 1 2 3 4 5 6 7 8 5 10 15 20 25 30 35 40 45 ДОЗА АТХ-MS-1467 (мкг) 25 50 100 400 800 800 КОМЕНТАР Попередній візит. Зразок крові для імунологія (50 мл) Зразки для імунології не збирали Зразок крові для імунології (50 мл) Зразок крові для імунології (50 мл) Зразок крові для імунології (50 мл) Зразок крові для імунології (50 мл) Зразок крові для імунології (50 мл) Зразок крові для імунології (50 мл) взятий через 4 тижні після візиту 7 Зразки крові забирали на візиті 1, і візитах з 3 до 9, і тестували на імунну відповідь до різних антигенів, включаючи очищене білкове похідне (PPD) Mycobacterium tuberculosis, як позитивний контроль, очищений основний білок мієліну (MBP) людини і ATX-MS-1467. Імунну відповідь оцінювали, враховуючи Т-клітинну проліферацію in vitro, секрецію цитокінів в супернатантах тканинної культури і вироблення PHK цитокінів. Результати Спостерігали значну відповідь на MBP, з піком проліферації до візиту 3 (фігура 9). Це корелювало з піком секреції інтерферону гамма. Важливо, однак, що рівень секреції інтерферону гамма знижувався після третього візиту і був на фоновому рівні до візиту 8. Рівні IL-10 не змінювалися суттєво до візиту 7, після якого відбувалося значне збільшення секреції даного цитокіну. Рівні IL-4, IL-5 і TNF альфа були близькі до фонових у відповідь на MBP у всіх часових точках. Ніякої проліферативної відповіді або збільшеної цитокінової відповіді не спостерігали для ATX-MS-1467 (фігура 10). Висновок Відповідь на MBP, що спостерігається до візиту 3, демонструє підвищену секрецію IL-2 і інтерферону гамма, яка корелює з піком проліферації в даній часовій точці. Передбачається, що таке посилення відповіді зумовлено введенням пептидів. Важливо, однак, що за тимчасовим збільшенням цитокінової секреції слідує повернення інтерферону гамма до початкових рівнів. Було також значне збільшення секреції IL-10 після другого введення ATX-MS-1467 в найвищій дозі. Раніше було показано на тваринних моделях, що специфічна імунотерапія синтетичними пептидами ефективна і призводить до індукції регуляторних T-клітин, що секретують IL-10. Під індукцією регуляторних Т-клітин, що секретують IL-10, у мишей, розуміється тимчасова відповідь на пептиди з секрецією інтерферону гамма на низькому рівні (Burkhart et al., 1999 Int Immunol 11: 1625-1634; Sundstedt et al., 2003 J Immunol 170:1240-1248). За цим іде зниження інтерферону гамма і супутнє збільшення IL-10. Кінетика секреції цитокінів, виявлена після лікування за допомогою ATX-MS-1467 фактично відтворює паттерн, що раніше спостерігався у експериментальних мишей, підтверджуючи, що ATX-MS1467 може індукувати регуляторні Т-клітини, що секретують IL-10. Приклад 4С - Відповідь на MBP значно знижується внаслідок лікування за допомогою ATXMS-1467 Шість пацієнтів з повторним прогресуючим розсіяним склерозом (SPMS) були внесені в список і завершили фазу клінічного випробування І/IIа, виконану за протоколом збільшення дози, викладеним в Прикладі 4В. HLA-генотипування показало, що шість пацієнтів демонструють широкий спектр гаплотипів HLA, включаючи 5 гаплотипів HLA-DR15, асоційованих з MS. Широкий розподіл HLA-DRB1 у пацієнтів, залучених до даного дослідження, означає, що ATX-MS-1467 буде безпечний і такий, що добре переноситься пацієнтами з MS, незалежно від їх HLA-DR генотипу. Лікування пацієнтів з допомогою ATX-MS-1467 не викликає вироблення антипептидних антитіл. Це вказує на те, що використання ATX-MS-1467 безпечне і корелює з відсутністю ускладнень в місці ін'єкції або виявами алергії, пов'язаної з дослідженням. Ретельний аналіз Т-клітинної відповіді показав, що: a) Лікування ATX-MS-1467 не має неспецифічної імуносупресівної дії. Це ясно продемонстровано фактом збереження імунної відповіді на очищене білкове похідне, антиген з мікобактерії туберкульозу (дані не показані). 9 UA 98356 C2 5 10 15 20 25 30 35 40 45 50 55 60 b) Лікування ATX-MS-1467, з використанням даного протоколу, не призводить до агресивної імунної відповіді на ATX-MS-1467 або основний білок мієліну (дані не показані). c) порівняння Т-клітинної проліферативної відповіді до (візит 1) і після (візит 8) лікування ATX-MS-1467 виявило значне зниження відповіді на основний білок мієліну (фігура 11). Всі три індивідууми, які відповідали наMBP при візиті 1, показали зниження відповіді на білок на візиті 8. Якщо брати всіх пацієнтів разом, то є вказівки на значне зниження відповіді на MBP від візиту 1 довізиту 8 (Р=0,0313). Матеріали і Методи Склади і дози Кожний з чотирьох пептидів виробляють незалежно за контрактом з використанням твердофазного пептидного синтезу і очищений з використанням ВЕРХ. Пептиди зберігають в ліофілізованому вигляді. ATX-MS-1467 являє собою 1:1:1:1 суміш апітопів MS1, MS4, MS6 і MS7 в фосфатносольовому буфері для черезшкірного введення. Дві концентрації ATX-MS-1467, позначені ATX-MS-1467А і ATX-MS-1467B і утримуючі 4 мг/мл і 0,5 мг/мл пептиду, відповідно, були приготовані для того, щоб зробити можливим збільшення дози. Режим використовує п'ять ін'єкцій із збільшенням дози (загальна доза - 25, 50, 100, 400 і 800 мкг), які даються від 7 до 14 днів роздільно. Пацієнти потім одержують другу дозу 800 мкг в період від з 7 до 14 дня після першої дози в 800 мкг. Після одержання всіх шести доз препарату, що досліджується, пацієнта оцінювали через чотири тижні і через 3 місяці після фінальної дози. Перевірка гостроти зору Використовували таблицю Шеллена стандартного розміру для перевірки на відстані 6 метрів з підсвічуванням позаду, пацієнт сидить на відстані 6 метрів (фігура 8). Кожне око досліджували роздільно для найнижчої строчки в таблиці, яку пацієнт може прочитати. Результати потім позначали як Гострота зору = 6/(рядок, який пацієнт прочитав). Імуноаналіз і) Т-клітинна проліферація: 6 Кріоконсервовані PBMC висаджують в 1 мл культур, що містять 1,5x10 клітин в -MEM в 48ямкові планшети для культивування тканин (Nunc International, Costar, Corning Inc. New York USA). Відповідь на MBP і пептидні антигени в різних концентраціях контролюють протягом періоду в 10 днів. Контрольна ямка не містить антиген. Після 20 годин або 2, 4, 6, 8 і 10 днів культивування, дві аліквоти клітинних суспензії по 100 мкл відбирають з кожної культури в 1 мл 3 для вимірювання проліферації у відповідь на антиген за захопленням [ H] тимідину. іі) Вимірювання секретованих цитокінів (IL-2 і IL-4, IL-5, IL-10, TNF- і IFN): Cytometric Bead Array аналіз: Рівні цитокінів в супернатанті культури визначають з використанням Cytometric Bead Assay (Becton Dickenson Biosciences, Cowley, Oxford, UK) згідно з інструкціями виробника. Після збору даних за зразками, з використанням FACS Calibur (BD Biosciences), результати генеруються у вигляді графіків і таблиць за допомогою програмного забезпечення BD CBA. Мінімальні рівні цитокінів, що піддаються кількісному визначенню, наступні: IL-2 і IL-4 - 2,6 пг/мл, IL-5 - 2,4 пг/мл, IL-10 і TNF- - 2,8 пг/мл, IFN - 7,1 пг/мл. Кількісна ПЛР в реальному часі для вимірювання PHK цитокінів (IL-2, IL-10. IFN і TNF-) Для аналізу IL-2, IL-10, IFN і TNF-, проводили ПЛР в кінцевому обсязі 20 мкл, що містить кДНК, ПЛР буфер, 6,25 мМ MgCl2, 0,4 мМ суміш dNTP, прямий і зворотний праймери (концентрації прямого праймеру: IL-2 - 300 нМ, IL-10 - 600 нМ, IFN - 600 нМ, TNF- - 600 нМ, концентрації зворотного праймера: IL-2 - 600 нМ, IL-10 - 900 нМ IFN- - 900 нМ, TNF- - 600 нМ), 200 нМ зонду FAM-TAMRA і 0,05 U/мкл Platinum Taq-полімерази (Invitrogen). Умови циклів представлені нижче: початкова денатурація при 94°C протягом 30 с, потім 35 циклів по 15 з при 94°C і 1 хв при 60°C. Для -2 мікроглобуліну, суміш для ПЛР, описану вище, доповнювали 0,1 мкМ прямого і зворотного праймерів, 3 мМ MgCl2 і проводили кількісний аналіз з використанням SYBR Green I (Molecular Probes Inc., Х30000 розведення початкового розчину). Після денатурації протягом 1 хв при 95°C, ампліфікація продовжувалася 35 циклів - 15 з при 94°C, 1 хв при 61°С і 1 хв при 72°С. ПЛР реакції і флуоресцентну детекцію одержаних ампліконів проводили на Opticon 2 (MJ Research, USA). Початковий рівень флюоресценції встановлювали з використанням вимірювань від циклу 1 до циклу 10. Величини Ct розраховували, визначаючи точку, в якій флюоресценція в 8-10 разів перевищує стандартне відхилення від базового рівня. Зразки були продубльовані, і кількість піків розраховували за стандартною кривою для кожної ДНК-мішені. Відмінності в кількості внесених піків PHK і синтезі кДНК коректувалися за допомогою нормалізації експресії цитокіну до експресії -2 мікроглобуліну. 10 UA 98356 C2 5 10 15 20 25 HLA типування Аналіз експресії гена HLA виконували за допомогою стандартної техніки конформаційного поліморфізму однониткової ДНК з використанням полімеразної ланцюгової реакції на ДНК, виділеної з лейкоцитів периферичної крові. HLA-тип кожного пацієнта використовували для інтерпретації результатів імунологічних аналізів. Аналіз сироваткових анти-пептидних антитіл 96-ямкові плашки покривають 1-10 мкг/мл кожного апітопу MS1, MS4, MS6 або MS7 при рН 9,6 протягом ночі при 4°C. Плашки промивають чотири рази фосфатно-сольовим буфером, рН 7,2, 0,05% Tween (PBS-Tween), і ямку блокують за допомогою 5% FCS в PBS протягом 1 год при кімнатній температурі. Сироватку розводять 1:100 в PBS-Tween і інкубують в продубльованих ямках протягом однієї години при кімнатній температурі. Після 4 промивань козячі антитіла проти IgG людини, кон'юговані з пероксидазою хрону (Sigma) і розведених 1:12000 в PBS, додавали в кожну ямка і інкубували плашки протягом однієї години при кімнатній температурі. Після 4 промивань 0,4 мг/мл о-фенілендіамін дигідрохлоридом (Sigma) додавали 30% пероксид водню і інкубували при кімнатній температурі протягом 15-20 хв. Фарбування зупиняли за допомогою 2,0 M H2SO4 (50 мкл) і вимірювали величину оптичної густини (OD) при 490 нм з допомогою спектрофотометра для зчитування планшетів з ELISA. Результати представлені у вигляді OD для сироватки, розведеної 1:100. ЯМР-сканування Запалення в ЦНС досліджували ЯМР-скануванням з використанням контрастування з гадолінієм. Досліджували об'єм і кількість бляшок, що збільшилися і порівнювали з початковим скануванням. Різні модифікації і варіації описаних способів і методів за винаходом будуть ясні фахівцям в даній галузі в межах обсяг і суті винаходу. Хоча даний винахід описаний в зв'язку з конкретними переважними варіантами здійснення, потрібно розуміти, що заявлений винахід не обмежений даними конкретними варіантами здійснення. Дійсно, різні модифікації описаних способів здійснення винаходу, які загальновідомі фахівцям в галузі хімії або біології або в суміжних галузях, охоплюються даним винаходом. Всі публікації, згадані у вищевикладеному описі, включені в даний документ як посилання. 30 11 UA 98356 C2 12 UA 98356 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 1. Композиція, яка містить наступні пептиди основного білка мієліну: МВР 30-44; МВР 83-99; МВР 131-145 і МВР 140-154. 2. Композиція за п. 1, яка складається по суті з наступних пептидів основного білка мієліну: МВР 30-44; МВР 83-99; МВР 131-145 і МВР 140-154. 3. Композиція за пп. 1 або 2 для лікування або профілактики захворювання. 4. Композиція за пп. 1 або 2 для лікування або профілактики розсіяного склерозу. 5. Композиція за пп. 1 або 2 для лікування або профілактики оптичного невриту, пов'язаного з розсіяним склерозом. 6. Застосування композиції за пп. 1 або 2 для виготовлення лікарського засобу для лікування розсіяного склерозу. 7. Застосування композиції за пп. 1 або 2 для виготовлення лікарського засобу для лікування оптичного невриту, пов'язаного з розсіяним склерозом. 8. Спосіб лікування або профілактики розсіяного склерозу у пацієнта, що потребує цього, який включає стадію введення композиції за пп. 1 або 2 пацієнту. 9. Спосіб лікування або профілактики оптичного невриту, пов’язаного з розсіяним склерозом, у пацієнта, що потребує цього, і який включає стадію введення композиції за пп. 1 або 2 пацієнту. 10. Спосіб за пп. 8 або 9, в якому композицію вводять згідно з протоколом із збільшенням дози. 11. Спосіб за будь-яким з пп. 8-10, де композицію вводять HLA-DQ6 або HLA-DR2-позитивним пацієнтам. 12. Набір, який включає наступні пептиди основного білка мієліну: МВР 30-44; MBP 83-99; MBP 131-145 і MBP 140-154 для спільного, роздільного або послідовного введення. 13 UA 98356 C2 14 UA 98356 C2 15 UA 98356 C2 16 UA 98356 C2 17 UA 98356 C2 18 UA 98356 C2 19 UA 98356 C2 Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 20
ДивитисяДодаткова інформація
Назва патенту англійськоюComposition for the treatment and prevention of multiple sclerosis and optical neuritis associated with multiple sclerosis
Автори англійськоюWraith, David, Streeter, Heather
Назва патенту російськоюКомпозиция для лечения и профилактики рассеянного склероза и/или оптического неврита, связанного с рассеянным склерозом
Автори російськоюРейт Девид, Стритер Хитер
МПК / Мітки
МПК: A61P 25/00, A61K 38/17, A61P 37/00
Мітки: склерозу, склерозом, композиція, невриту, лікування, пов'язаного, розсіяного, профілактики, розсіяним, оптичного
Код посилання
<a href="https://ua.patents.su/22-98356-kompoziciya-dlya-likuvannya-ta-profilaktiki-rozsiyanogo-sklerozu-i-abo-optichnogo-nevritu-povyazanogo-z-rozsiyanim-sklerozom.html" target="_blank" rel="follow" title="База патентів України">Композиція для лікування та профілактики розсіяного склерозу і/або оптичного невриту, пов’язаного з розсіяним склерозом</a>
Попередній патент: Розміщення і спосіб передачі керуючої інформації в системах бездротового зв’язку
Наступний патент: Спосіб генерації електронного пучка в магнетронній гарматі та пристрій для його здійснення
Випадковий патент: Установка для плазмового наплавлення