Мембрана для регенерації тканин
Номер патенту: 103650
Опубліковано: 11.11.2013
Автори: Рашмілєвітц Якоб, Фрідман Майкл, Грін Ада, Мошейвв Рамі, Сассон Йоель
Формула / Реферат
1. Мембрана для регенерації тканин, що включає щонайменше один позитивно заряджений, синтетичний, гідрофобний полімер, щонайменше один гідрофільний полімер і щонайменше один пластифікатор, яка відрізняється тим, що згаданим щонайменше одним гідрофільним полімером та щонайменше одним пластифікатором є поліетиленгліколь у діапазоні від 300 до 20 000, причому згаданий поліетиленгліколь присутній у концентрації від 1 мас. % до 30 мас. %, при цьому згадана мембрана гнучка і здатна підтримувати щонайменше одне з адгезії клітин, проліферації клітин або диференціації клітин.
2. Мембрана за п. 1, яка відрізняється тим, що згаданим позитивно зарядженим, синтетичним, гідрофобним полімером є співполімер амоній-метакрилату типу А NF (АМСА), згаданим пластифікатором є поліетиленгліколь у діапазоні від 300 до 20 000, при цьому згадана мембрана гнучка і здатна підтримувати щонайменше одне з адгезії клітин, проліферації клітин або диференціації клітин.
3. Мембрана за п. 2, яка відрізняється тим, що і згаданий гідрофільний полімер і згаданий пластифікатор є поліетиленгліколем 400.
4. Мембрана за п. 3, яка відрізняється тим, що згаданий поліетиленгліколь 400 присутній у концентрації 10, 15 або 25 мас. %.
5. Мембрана за будь-яким одним з пунктів 1-4, яка відрізняється тим, що згадана мембрана, крім того, містить щонайменше один тип клітин.
6. Мембрана за п. 5, яка відрізняється тим, що згадані клітини вибирають з групи, що складається зі стовбурових клітин дорослої людини, плюрипотентних стовбурових клітин, мезенхімальних стовбурових клітин, клітин крові пуповини, остеобластів, хондробластів і клітин CD 105+.
7. Мембрана за п. 6, яка відрізняється тим, що згадані стовбурові клітини є аутогенними стовбуровими клітинами дорослої людини.
8. Мембрана за будь-яким одним з пунктів 1-7, яка відрізняється тим, що крім того вміщує принаймні одну активну речовину, причому згадану щонайменше одну активну речовину вибирають з групи, що складається з цитокіну, гормону, бісфосфанату, канабіноїдів, бета-блокатора, агента, що індукує кістку, фактору росту, інгібітору редуктази HMG-СоА, ліків і антибіотика.
9. Мембрана за п. 8, яка відрізняється тим, що згадану активну речовину вибирають з групи, що складається з статину, естрогену, андрогену, пропранололу, трансформуючого фактора росту (TGF), морфогенетичного білка кістки (BMP), інсуліноподібного гормону росту, фібробластного фактору росту (FGF), алендронату, ризендронату і паратиреоїдного гормону.
10. Мембрана за п. 9, яка відрізняється тим, що згадана активна речовина є симвастатином або ловастатином.
11. Мембрана за будь-яким одним з пунктів 1-10, яка відрізняється тим, що згадана мембрана здатна бути пористою після гідратації, і яка відрізняється тим, що розмір пор складає від 0,1 до 5 мкм.
12. Використання мембрани за будь-яким одним з пунктів 1-11, яке відрізняється тим, що згадана мембрана гнучка і здатна підтримувати щонайменше одне з адгезії клітин, проліферації клітин або диференціації клітин, для виготовлення тривимірного порожнистого імплантату для регенерації тканини в області дефектної тканини, причому згадану тканину вибирають зі зв'язки, сухожилля, хряща, міжхребцевого диска, зубів і кістки.
13. Використання мембрани за п. 12, яка відрізняється тим, що згаданий тривимірний порожнистий імплантат вибирають з групи, що складається із трубчастого імплантату, циліндричного імплантату, конічного імплантату або плоского імплантату.
Текст
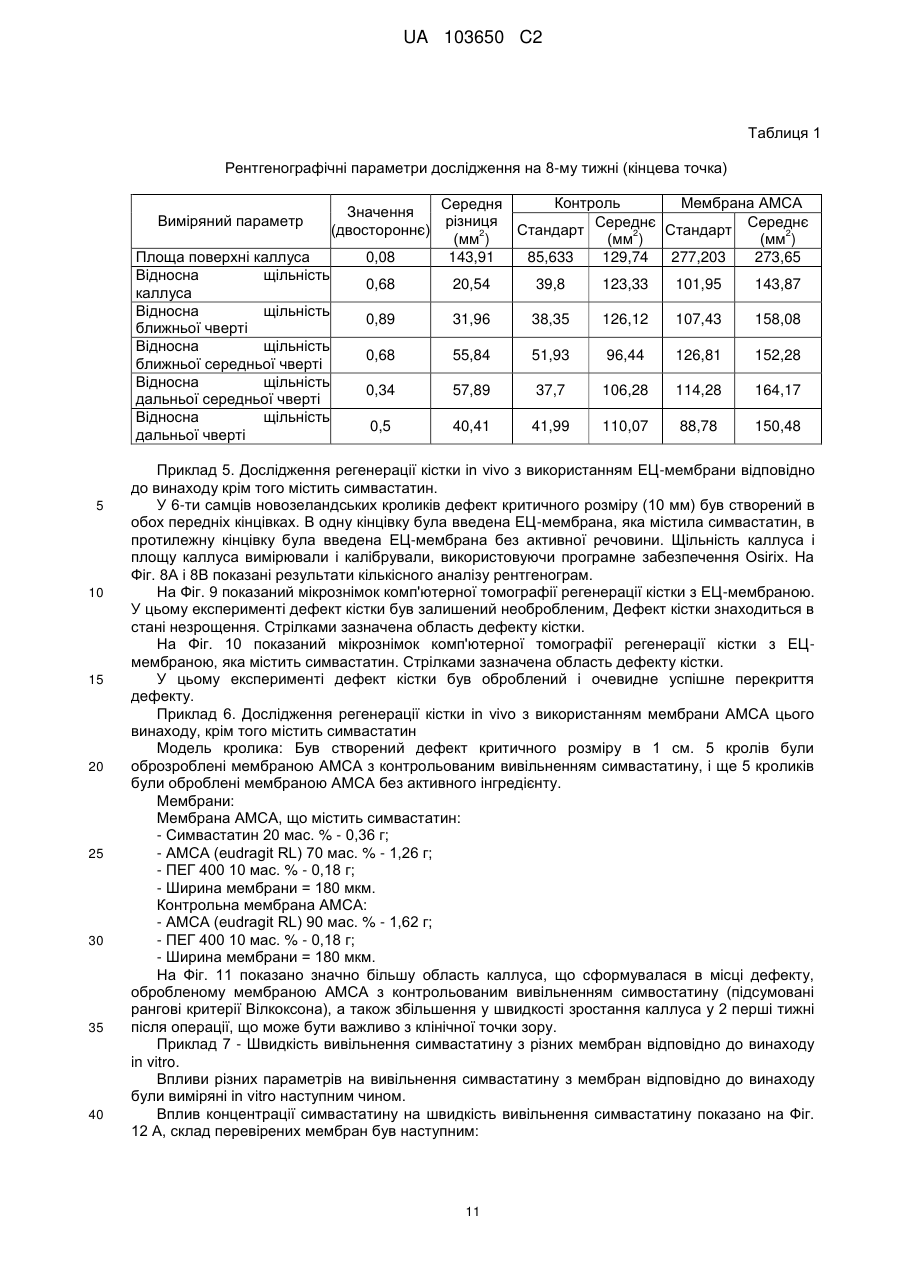
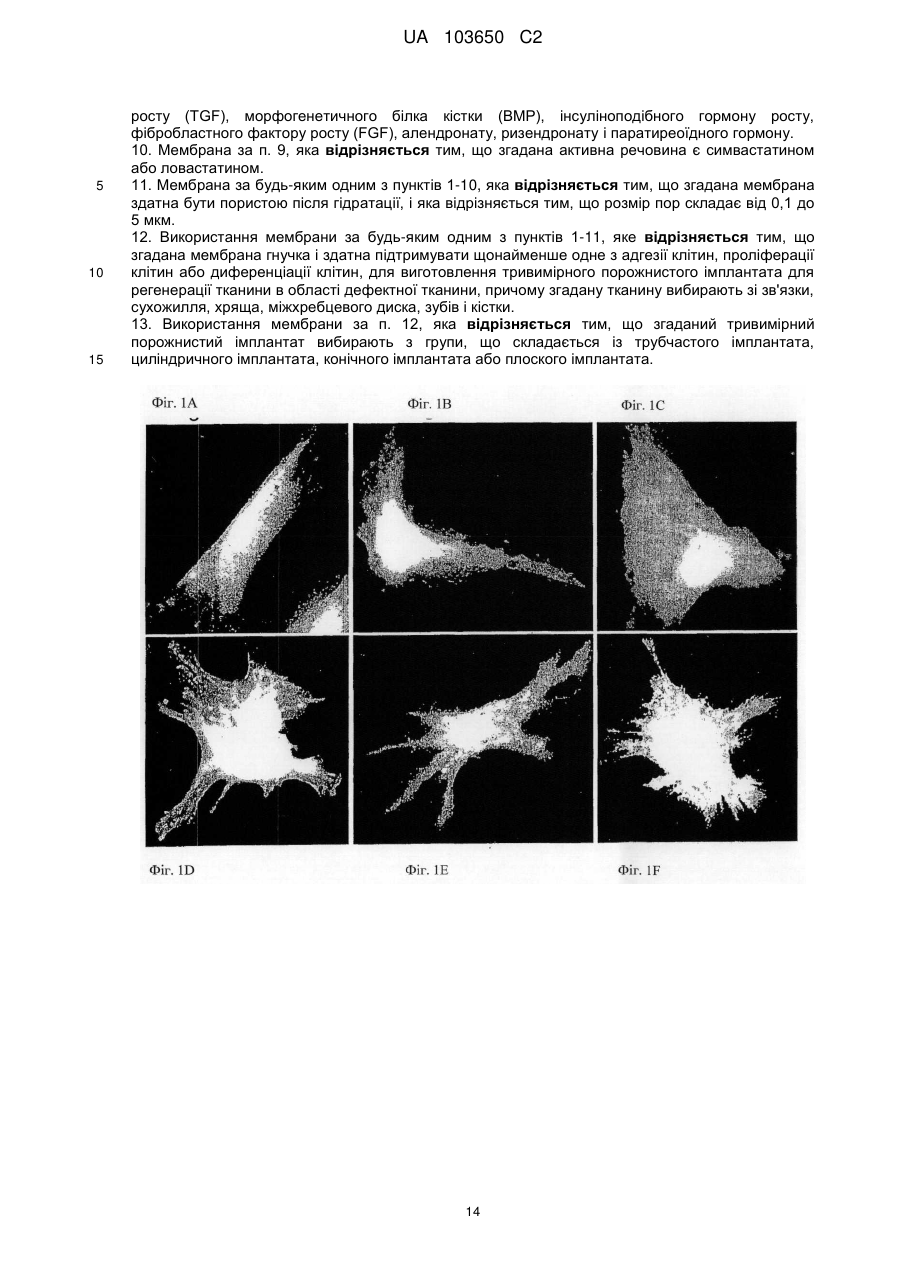
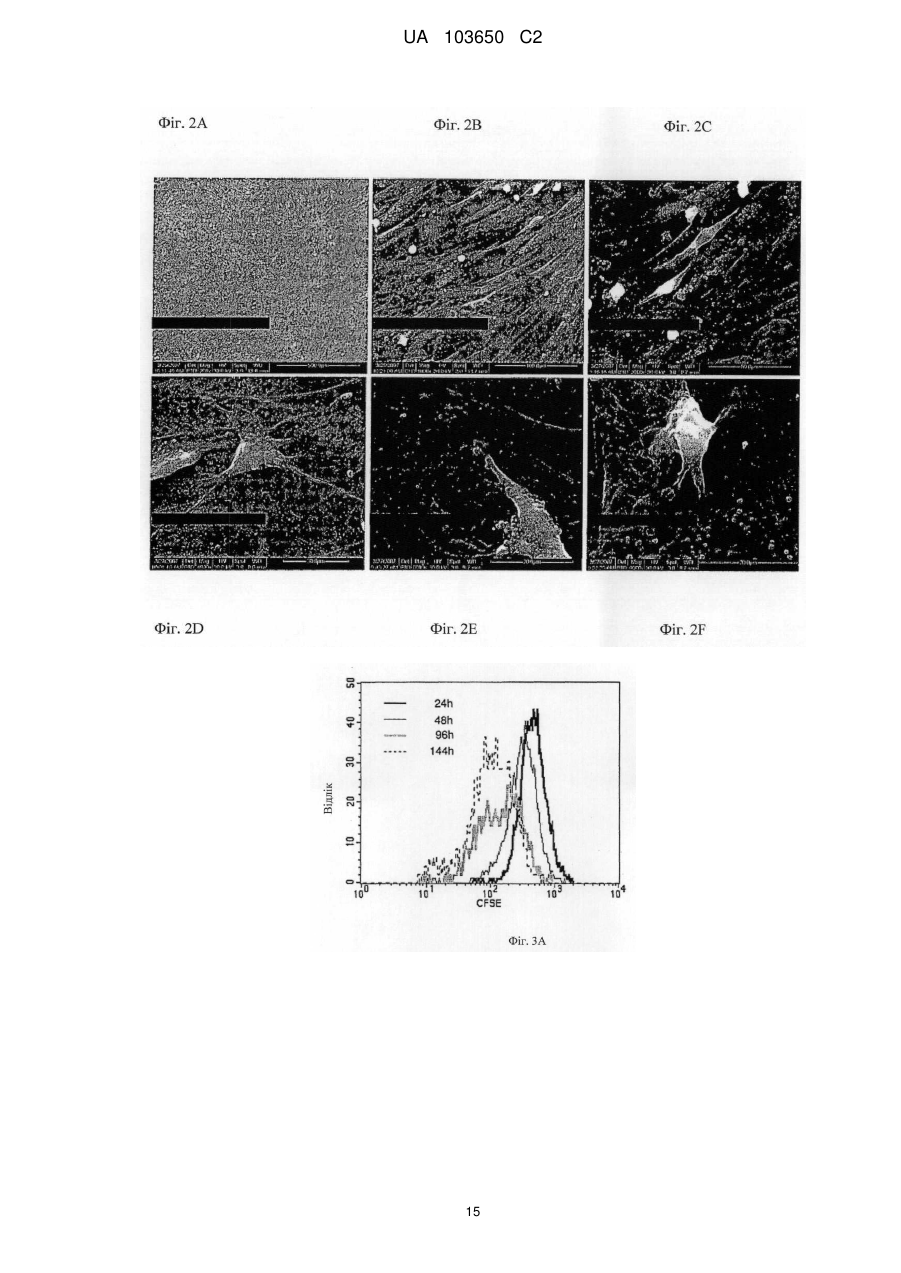
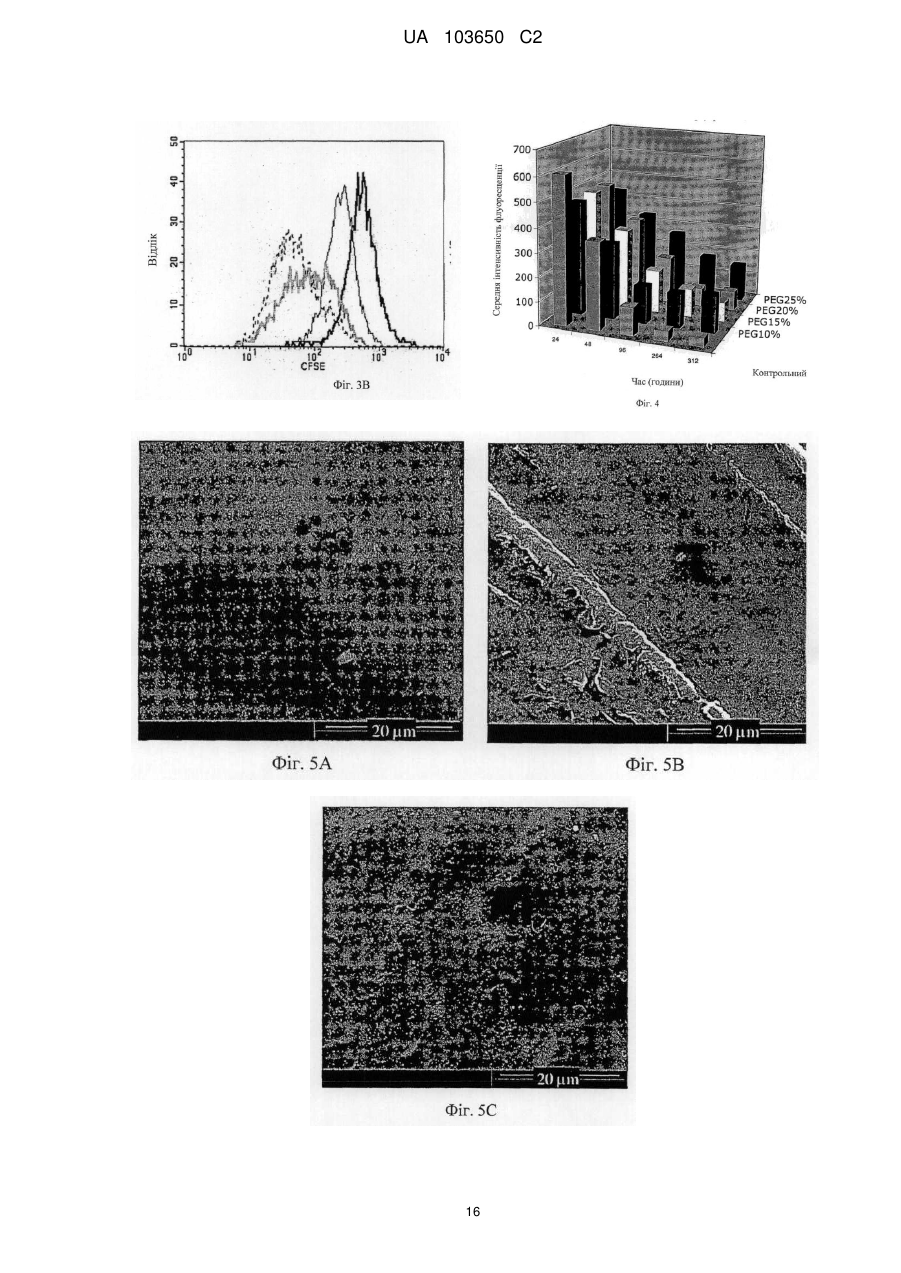
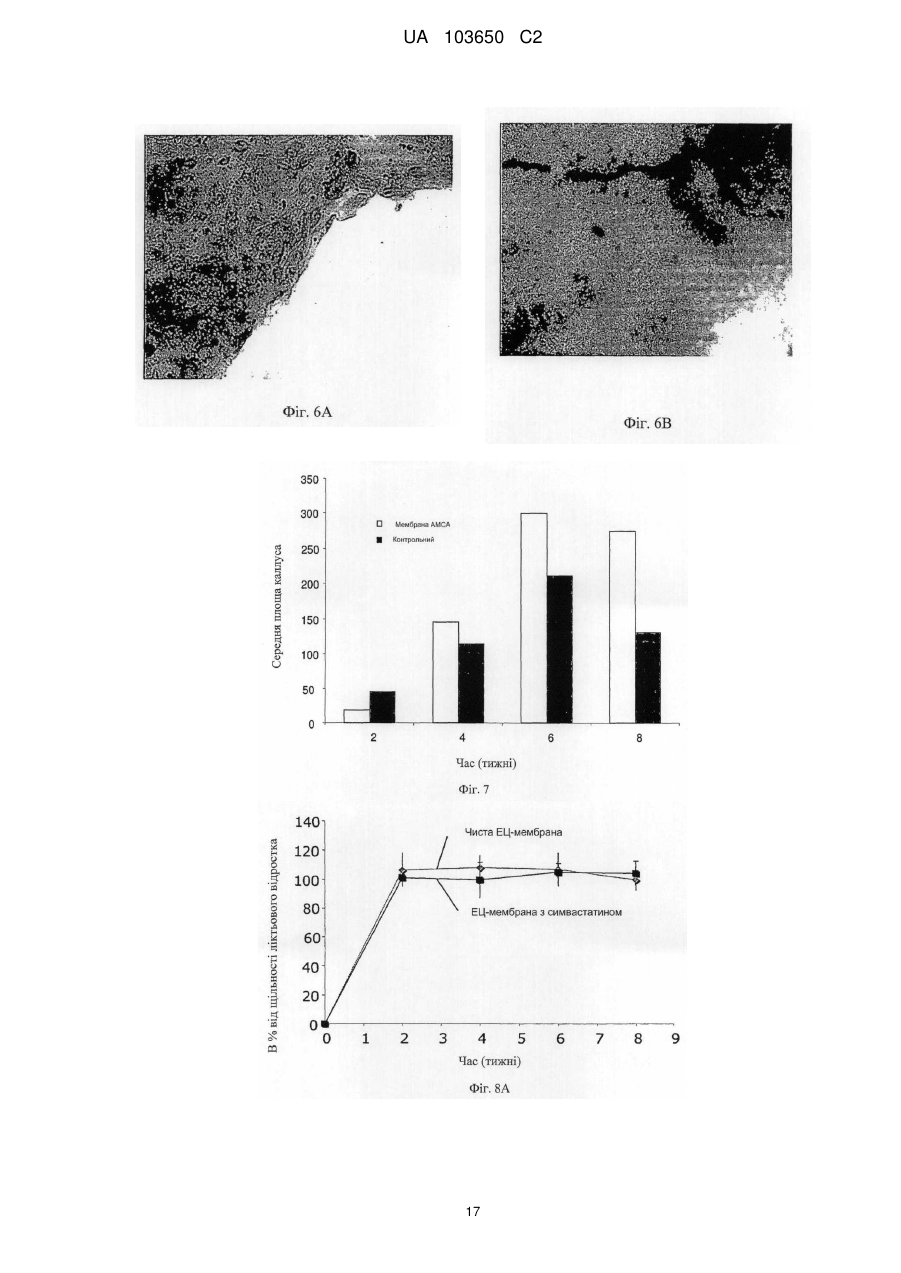
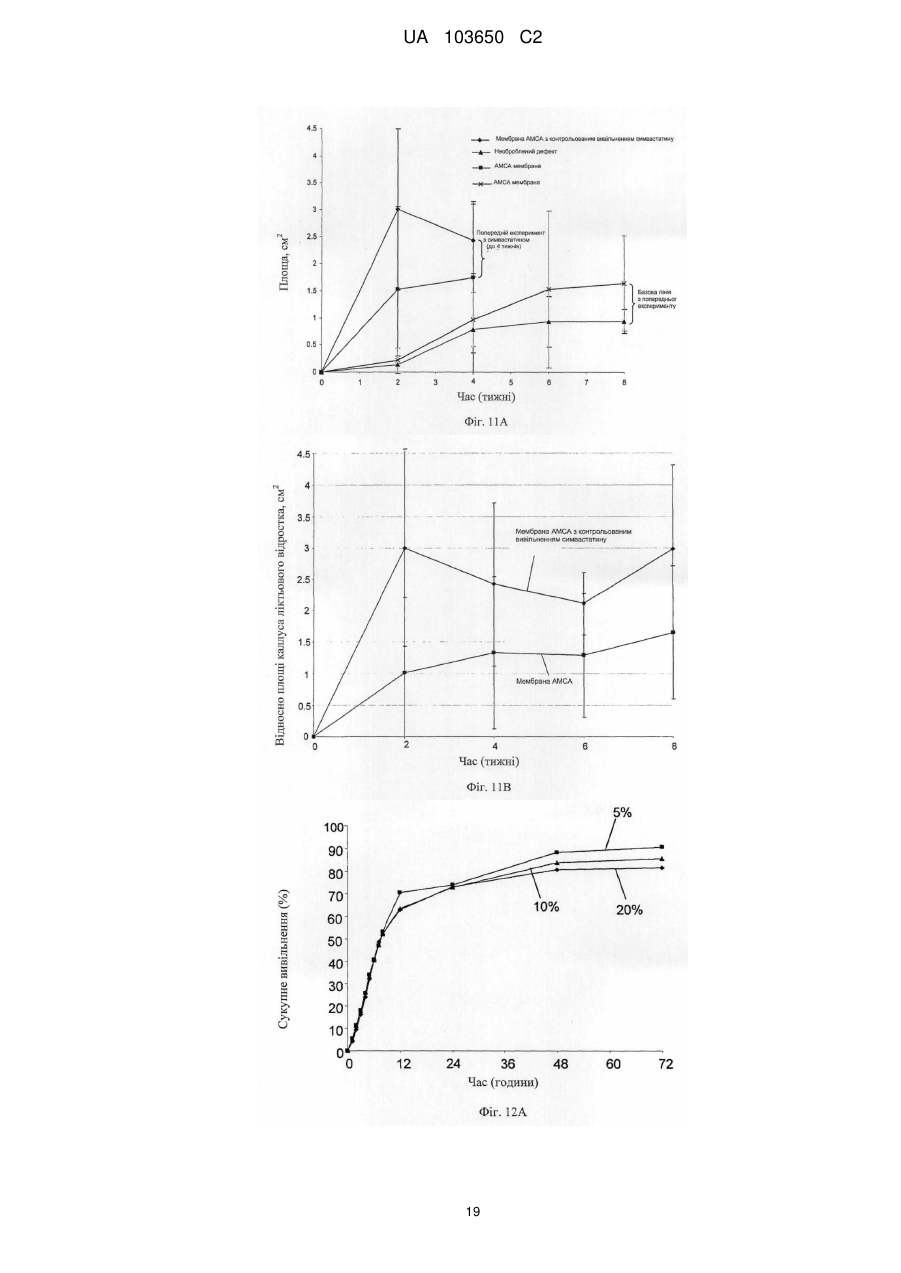
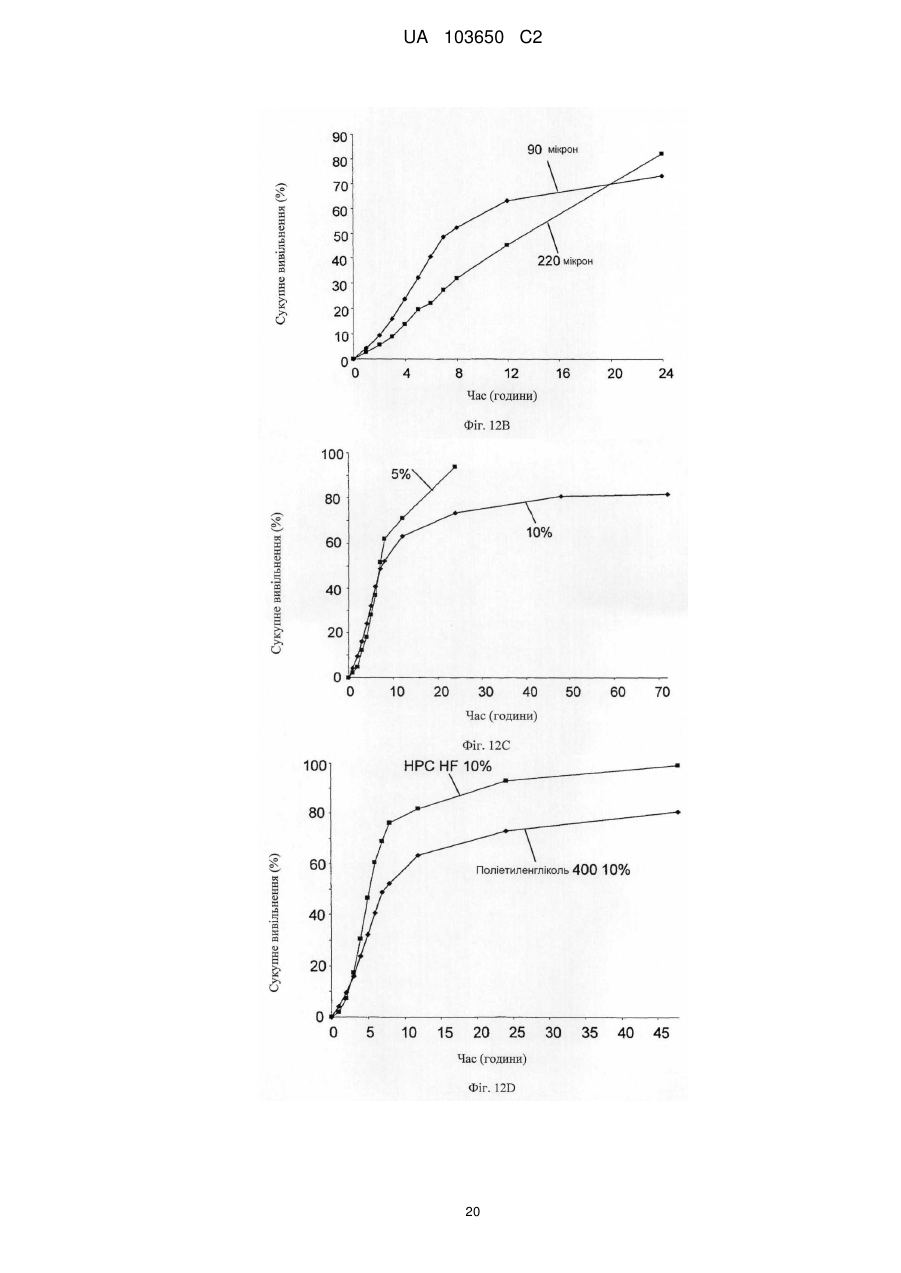
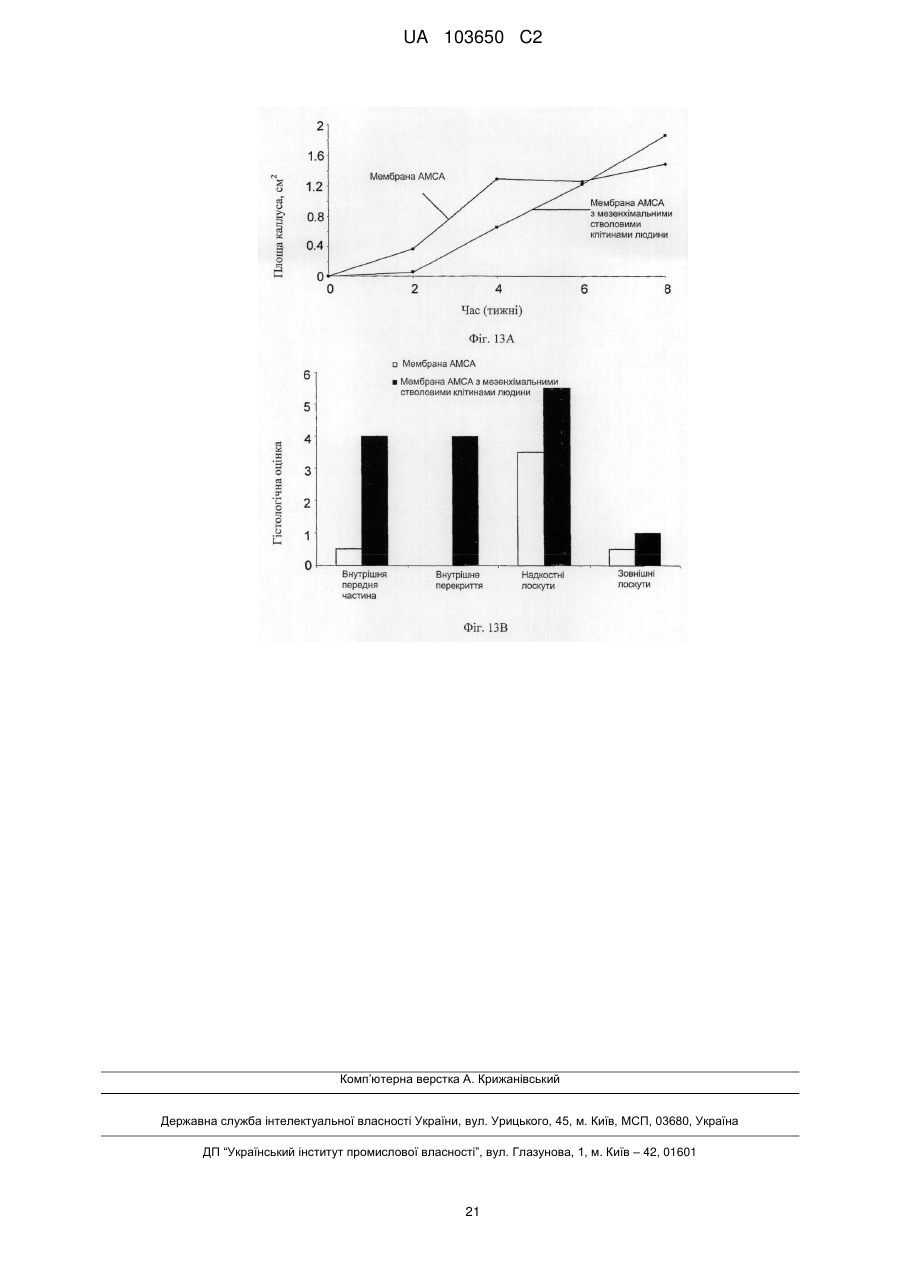
Реферат: Винахід стосується мембрани для регенерації тканин та її використання. Мембрана включає щонайменше один позитивно заряджений, синтетичний, гідрофобний полімер, щонайменше один гідрофільний полімер і щонайменше один пластифікатор, у якій щонайменше одним гідрофільним полімером та щонайменше одним пластифікатором є поліетиленгліколь у діапазоні від 300 до 20 000, що присутній у концентрації від 1 мас. % до 30 мас. %. Згадана UA 103650 C2 (12) UA 103650 C2 мембрана гнучка і здатна підтримувати щонайменше одне з адгезії клітин, проліферації клітин або диференціації клітин. UA 103650 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь техніки Заявлений винахід відноситься до області регенерації тканини, конкретно, регенерації кістки з використанням мембрани на основі полімеру або конструкції, здатної підтримувати адгезію, проліферацію і диференціацію клітин. Рівень техніки Незрощення перелому є станом припинення всіх відновних процесів лікування перелому без зрощення кістки [1-3]. Незрощення також можна визначити як відсутність прогресуючого відновлення, яке не спостерігається за допомогою рентгенографії в період між 3-м і 6-м місяцями з дати отримання перелому [2, 4]. Незрощення може відбуватися або у результаті поганого механічного або біологічного середовища в області перелому або внаслідок їх поєднання [2]. Ця та інші ситуації вимагають маніпулювання або посилення природних механізмів лікування для регенерації великих кількостей нової кістки для досягнення хірургічних цілей [5-7]. Тому нова кістка для відновлення функції травмованої, пошкодженої або втраченої кістки є великою клінічної потребою, і інженерія кісної тканини була проголошена альтернативної стратегією для регенерації кістки [8]. Інженерія тканини у застосуванні до кістки фокусується на відновленні великих сегментів скелета, включаючи опорні кістки. Кістку можна регенерувати за допомогою наступних стратегій: остеогенез - перенесення клітин; остеоіндукція - спонукання клітин до того, щоб стати кісткою; остеокондукція - надання каркаса для клітин, що формують кістку; або остеостімуляція стимуляція лікування і регенерації кістки шляхом розвитку біологічного або механічної середовища для вилікуваних або тканин, що регенеруються. Було доведено, що полімерна полі (L-лактідная) трубчаста мембрана, що охоплює механічно стабільний дефект великого сегмента кістки, сприяє формуванню жіночої кістки і реконструкції дефекту кістки [9]. Мошейф та інші (Mosheiff et al.) розробили модель дефекту критичного розміру для кролика для перевірки лікування втрати кістки. У цій моделі дефект критичного розміру повинен бути створений у передпліччі кролика. Дефект критичного розміру визначений як найменша внутрішньо-кісткова рана, яка не перекривається скелетом за нормальних обставин [10, 11]. Використовуючи цю модель, наша група успішно застосувала мембрани для направлень регенерації кістки (НРК) шляхом остеокондуції [10, 12]. Гуга та інші (Gugala et al.) продемонстрували гомогенне зростання мезенхімальних стовбурових клітин (МСК) на пористих мембранах з формуванням тривимірної фібрилярної мережі [19]. У заявці WO 2005/107826 розкриті кісткові імплантати, що формуються, які містять біосумісні гранули (наприклад, біокераміка), біосумісний полімер і пластифікатор. Імплантат може формувати відкритий пористий каркас або композитну матрицю або може бути введений як рідкий або пластично деформується імплантат. У заявці WO 2004/084968 розкрита пориста матриця, що підходить для використання у якості тканинного каркаса або препарату, який вводиться, переважно виготовленого з зшитого полімеру, який розкладається. Розкриття винаходу Заявлений винахід заснований на даних, що нова мембрана на основі полімеру, що включає гідрофобний і гідрофільний полімери і, крім того, пластифікатор, здатна підтримувати адгезію, проліферацію і диференціацію клітин, і таким чином може бути використана для посилення регенерації тканини, наприклад, при лікуванні великих сегментарних дефектів кістки. Мембрани згідно винаходу працюють як система доставки для клітин і як пристрій для направленої регенерації кістки, на вибір разом з активними речовинами, які сприяють зростанню, адгезії, диференціації та/або проліферації клітин. Більш конкретно, винахід ґрунтується на наявних даних, що мембрана на основі полімеру, яка крім того включає поліетиленгліколь (ПЕГ), підтримує адгезію, диференціацію і проліферацію мезенхімальних стовбурових клітин (МСК). Відповідно, в одному з його аспектів винахід пропонує мембрану, що містить щонайменше один позитивно заряджений, синтетичний, гідрофобний полімер, щонайменше один гідрофільний полімер і щонайменше один пластифікатор; причому згадана мембрана гнучка і здатна підтримувати щонайменше принаймні одне з наступного: адгезія клітин, проліферація клітин або диференціація клітин. Застосований тут термін "мембрана" відноситься до тонкої (грубо двовимірної) безперервної гомогенної конструкції, що має товщину від 30 до 200 мкм, що зазвичай отримується шляхом лиття щонайменше одного позитивно зарядженого, синтетичного, гідрофобного полімеру, щонайменше одного гідрофільного полімеру і щонайменше одного пластифікатора у форми. 1 UA 103650 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "позитивно заряджений, синтетичний, гідрофобний полімер" відноситься до синтетично отриманого полімеру, який не розчиняється у воді, має загальний середній позитивний (поверхневий) заряд, створений позитивно зарядженими або частково позитивно зарядженими мономірними групами (або групами-замісниками на таких мономерах) полімеру. У деяких варіантах здійснення згаданий щонайменше один гідрофобний полімер є поліакрілатом. У інших варіантах здійснення згаданий щонайменше один гідрофобний полімер є сополімером метакрилату із заміщенням щонайменше однієї аміногрупи. Термін "аміногрупа" означає включення будь-якої аміногрупи, такої як, наприклад, NH3, вторинний амін, третинний амін і амонієвої групи. В одному конкретному варіанті здійснення згаданим полімером є амніотичний сополімер метакрилату і більш переважно амніотичний сополімер метакрилату типу A (наприклад, AMCA Eudragit RLTM Degussa, Німеччина). Слід розуміти, що гідрофобний полімер відповідно до винаходу, також охоплює сополімери або суміш гідрофобних, позитивно заряджених полімерів з гідрофобними, не позитивно зарядженими полімерами, наприклад, в яких щонайменше 30 % гідрофобного полімеру має позитивний заряд. У таких варіантах здійснення суміш гідрофобних полімерів може крім того включати поліетилен, поліметакрилат, поліамід-нейлон, поліетіленвінілацетат, нітрат целюлози, силікони, етилцелюлозу і будь-яке їх поєднання. Використовуваний тут термін "полімер, який має аміногрупу і метакрилову групу", відноситься до полімерів, а також співполімерів, які мають метакрилові групи, заміщені аміногрупами, як мономери. Приклад таких полімерів можна знайти, наприклад, у Аггелікі І. та інших (Aggeliki I. et al) [20]. Термін "гідрофільний полімер" відноситься до полімерів (включаючи сополімери і суміші полімерів), які розчиняються у водних середовищах, таких як рідини тіла (наприклад, позаклітинна рідина, тканинна рідина, плазма, кров або слина). Зауважимо, що такі полімери створюють пори у мембрані при дії водних середовищ. У деяких варіантах здійснення згаданий щонайменше один гідрофільний полімер вибирають з групи, що складається з гидроксилпропилметилцеллюлози, гідроксілпропілцеллюлози, карбоксиметилцелюлози, гідроксиетилцелюлози, полівінілового спирту, полісахаридів, альгінату натрію, полівінілпіролідону, модифікованого крохмалю, поліетиленгліколю, оксиду поліетилену і желатину. Термін "пластифікатор" відноситься до сполучення, здатного надавати мембрані гнучкість. Пластифікатор, який використовується відповідно до цього винаходу, не повинен бути токсичним до клітин. У деяких конкретних варіантах здійснення згаданий пластифікатор не токсичний до стовбурових клітин. У деяких варіантах здійснення згаданий щонайменше один пластифікатор вибирають з групи, що складається з поліетиленгліколю, оксиду поліетилену, триетилцитрату, ацетілтріетілцітрату, трібутілцітрату, ацетілтрібутілцітрату, триацетину, дібутілсебацінату, діетилфталату, пропіленгліколю, метоксіетіленгліколя і желатину. В деяких варіантах здійснення мембрана згідно винаходу включає щонайменше один пластифікатор, який розчинний у воді. Перелік водорозчинних пластифікаторів, що не обмежується цим, включає: ПЕГ, триетилцитрат, ацетилтриетилцитрат, трібутілцітрат, ацетілтрібутілцітрат, триацетин, дібутілсебацінат, діетилфталат, пропіленгліколь, метоксіетіленгліколь і желатин. У деяких варіантах здійснення згаданий щонайменше один пластифікатор і щонайменше один гідрофільний полімер сумісні зі стовбуровими клітинами. Як буде продемонстровано у прикладах нижче, доведено нетоксичність ПЕГ відносно стволових клітин. Тому в одному конкретному варіанті здійснення, в якому мембрана включає стовбурові клітини, кращим пластифікатором та / або гідрофільним полімером є ПЕГ. Термін "поліетиленгліколь(ПЕГ)» відноситься до полімерів поліетиленгліколю, котрі розчиняються у водних середовищах. В деяких варіантах здійснення мембрани цього винаходу використовується ПЕГ у діапазоні 300-20 000. В інших варіантах здійснення мембрани цього винаходу використовується ПЕГ 400. У деяких варіантах здійснення згаданим гідрофільним полімером є поліетиленгліколь у діапазоні від 300 до 20 000. У інших варіантах здійснення згаданим пластифікатором є поліетиленгліколь у діапазоні від 300 до 20 000. У інших варіантах здійснення згаданим гідрофільним полімером і згаданим пластифікатором є поліетиленгліколь у діапазоні від 300 до 20 000. Без прив'язки до теорії, в таких випадках виявлено, що ПЕГ виконує у мембрані подвійну функцію: він сприяє гнучкості мембрани і призводить до створення пір при розчиненні. Як продемонстровано у прикладі нижче, пористість (кількість пір в мембрани) збільшується згідно 2 UA 103650 C2 5 10 15 20 25 30 35 40 45 50 55 концентрацій ПЕГ в мембрані. Крім того, підвищена пористість коригується з підвищеною адгезією клітин. В інших варіантах здійснення винаходу згаданий щонайменше один гідрофільний полімер присутній у концентрації приблизно від 0,5 мас. % до 30 мас. % від маси мембрани. У інших варіантах здійснення згаданий щонайменше один гідрофільний полімер присутній у концентрації приблизно від 10 мас. % до 25 мас. % від маси мембрани. В одному конкретному варіанті здійснення згаданий щонайменше один гідрофільний полімер вибирають з групи, що складається з гідроксілпропілметілцеллюлози, гідроксілпропілцеллюлози, карбоксиметилцелюлози, гідроксіетілцеллюлози у концентрації приблизно від 0,5 мас. % до 20 мас. % від маси мембрани. У ще одному конкретному варіанті здійснення згаданим щонайменше одним гідрофільним полімером є ПЕГ у концентрації приблизно від 1 мас. % до 30 мас. %, або приблизно від 10 мас. % до 25 мас. %, або приблизно 15 % від маси мембрани. У ще одному варіанті здійснення мембрана цього винаходу крім того включає щонайменше один тип клітин. В деяких варіантах здійснення згадані клітини вибирають з групи, що складається зі стовбурових клітин дорослої людини, стовбурових клітин ембріона, плюрипотентних стовбурових клітин, мезенхімінімальних стовбурових клітин, клітин крові пуповини, остеобластів, хондробластів і клітин CD 105 +. В інших варіантах здійснення згадані стовбурові клітини є автогенними стовбуровими клітинами дорослої людини. Плюрипотентні мезенхімальні стовбурові клітини мають здатність зазнавати коммітування у кілька послідовностей клітинних поколінь, включаючи остеобласти, адипоцити, хондроцити і міоцити. У одному варіанті здійснення мембрана цього винаходу включає AMCA (амніотичний сополімер метакрилату типу A), поліетиленгліколь у діапазоні від 300 до 20 000 (у кількості, достатній для того, щоб бути і пластифікатором, і гідрофільним полімером, здатним утворювати пори при контакті з водними рідинами in situ) і стовбурові клітини дорослої людини. Використовуваний тут термін "адгезія клітин" або "злипання клітин" відноситься до зв'язування/прикріпленню клітини до поверхні при збереженні життєздатності. Застосований тут термін "проліферація клітин" або "ріст клітин" відноситься до репродукції і збільшення кількості клітин, тобто, до поділу клітин. Застосований тут термін "диференціація клітин" відноситься до процесу, у якому менш спеціалізована клітина стає клітиною більш спеціалізованого типу. Наприклад, стовбурові клітини дорослої людини діляться і створюють повністю диференційовані дочірні клітини під час відновлення тканини і під час нормального обороту клітин, наприклад, мезенхімальні стовбурові клітини можуть диференціюватися у остеобласти. Мембрани за цим винаходом здатні підтримувати злипання клітин, проліферацію клітин та/або диференціацію клітин. Мембрани згідно з цим винаходом проявляють такі якості, як властивість (i) розвивати пряму адгезію і зв'язок з існуючою тканиною; (ii) сприяти клітинній функції; (iii) створювати каркас або шаблон для формування нової тканини і (iv) сприяти регенерації тканини і діяти як носій для біологічних активних матеріалів. У деяких варіантах здійснення мембрана відповідно до винаходу крім того включає щонайменше одну активну речовину та здатна сприяти репродукції тканини і/або забезпечувати фармацевтичні переваги, необхідні в місці імплантації згаданої мембрани. У інших варіантах здійснення мембрана відповідно до винаходу крім того включає щонайменше одну активну речовину, причому згадана принаймні одна активна речовина вибирається з групи, що складається з цитокіну, гормону, бісфосфонатів, каннабіноїдів, бетаблокатора, речовини, яка індукує кістку, фактору росту, інгібітору редуктази HMG-CoA (такого як статини), ліків і антибіотиків і будь-якого їх поєднання. У деяких варіантах здійснення згадану активну речовину вибирають з групи, що складається зі статину, естрогену, андрогену, пропранололу, трансформуючого фактора росту (TGF), морфогенетичного білка кістки (BMP, такого як, наприклад, BMP-2 і BMP-7), інсуліноподібного гормону росту, фібробластного гормону росту (FGF), алендронату, різендронату і паратиреоїдного гормону. У ще одному варіанті здійснення згаданою активною речовиною є симвастатин або ловастатин. Симвастатин належить до статінового сімейства інгібіторів редуктази А кофермента 3гідрокси-3-метил-глютарілу, які широко використовуються як ліки, що знижують холестерин. Статини можуть збільшувати масу тіла через анаболічні і антикатаболичні (антірезорбтивні) механізми. 3 UA 103650 C2 5 10 15 20 25 30 35 40 45 50 55 У деяких варіантах здійснення згадана речовина знаходиться у препараті з контрольованим вивільненням. У ще одному конкретному варіанті здійснення мембрана включає AMCA, ПЕГ і щонайменше одне активну речовину (наприклад, симвастатин). У деяких варіантах здійснення мембрана за цим винаходом здатна бути пористою після гідратації (наприклад, гідратації, досягнутої при контакті з рідинами тіла у місці імплантації), причому розмір пір становить приблизно від 0,1 до 5 мкм. У деяких варіантах здійснення мембрана цього винаходу може мати щонайменше одну пору розміром менше 5 мкм через гідратацію згаданого водорозчинного пластифікатора. У інших варіантах здійснення згаданий розмір пори менше 2 мкм. У інших варіантах здійснення згаданий розмір пір складає приблизно від 0,1 до 5 мкм. Використаний тут термін "гідратація" відноситься до впливу на мембрану заявленого винаходу водного розчину чи рідини тіла, наприклад, тканинної рідини, крові, плазми, слини, що приводить до розчинення водорозчинного пластифікатора. У іншому аспекті винахід пропонує використання мембрани заявленого винаходу для виготовлення тривимірного полого імплантату для регенерації тканини в області пошкодженої тканини. Через гнучкість мембрани відповідно до цього винаходу можна виконати тривимірний імплантат, використовуючи згадану мембрану, без необхідності попереднього лиття або формування мембрани або впливу на неї теплотою. Тривимірна структура, виконана із згаданої мембрани може бути будь-якого типу, що підходить для місця імплантації, і може бути крім того відрегульована на місці імплантації відповідно до галузі, в якій повинен використовуватися згаданий імплантат. У деяких варіантах здійснення згаданий тривимірний порожнистий імплантат обирають з групи, що складається із трубчастого імплантату, циліндричного імплантату, конічного імплантату або плоского імплантату. У ще одному варіанті здійснення згадану тканину, регенеровану з використанням мембрани відповідно до винаходу, або виготовлений з неї тривимірний порожнистий імплантат вибирають із зв'язки, сухожилля, хряща, міжхребцевого диска, зубної тканини (включаючи зуби, емаль, дентин, цемент, пульпу, періодонтальні зв'язки, альвеолярний відросток, тканина ясен) і кістки. У ще одному аспекті винахід пропонує тривимірний порожнистий імплантат, включаючий щонайменше одну мембрану відповідно до винаходу. У одному варіанті виконання мембрана, що міститься всередині тривимірного порожнього імплантату відповідно винаходу, визначає поверхню імплантату. У ще одному аспекті винахід пропонує систему доставки клітин, що включає мембрану цього винаходу. В іншому аспекті винахід пропонує поверхню для вирощування клітин, яка включає мембрану відповідно до винаходу. У ще одному з його аспектів винахід пропонує каркас, по суті покритий мембраною відповідно до винаходу. Винахід також пропонує гранульований матеріал, по суті покритий мембраною цього винаходу. У деяких варіантах здійснення гранульований матеріал складається з сумісної з кісткою кераміки, наприклад, з мінералів на основі кальцію. Винахід крім того пропонує спосіб сприяння регенерації тканини у пошкодженій області тканини, що включає етапи: надання мембрани відповідно до винаходу та імплантації згаданої мембрани поруч зі згаданою областю пошкодженої тканини. У деяких варіантах здійснення згадана дефектна тканина є результатом стану, обраного з незрощеного перелому, остеопорозу, захворювання або стану періодонта, остеолітичного захворювання кістки, стану після пластичної хірургії, після ортопедичної імплантації, після нейрохірургії, після процедур нарощування альвеолярного відростка, після артродеза хребців, після перелому хребта. Короткий опис креслень Для розуміння винаходу і того, як він може бути здійснений на практиці, далі будуть описані варіанти здійснення на певному прикладі, який не обмежує винахід, і з посиланнями на креслення, на яких наведене наступне: Фіг. 1A-1F - мікрознімки адгезії МСК (мезенхімних стовбурових клітин людини) на полістирольній чашці для культивування тканини і на мембрані AMCA. МСК, помічені CFSE, були посіяні на полістирольній чашці для культивування тканини (AC) або на мембрані (DF). Через 24 години клітини, помічені CFSE, розглядали за допомогою конфокальної мікроскопії. Показані три представницькі зображення для кожного стану культивування. 4 UA 103650 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 2A-2F - знімки з скануючого електронного мікроскопа, що показують адгезію МСК на мембранах з AMCA / ПЕГ. МСК були посіяні на мембрану AMCA з ПЕГ 400. Через 24 години культивування клітини зафіксували, як описано у розділі "Матеріали і способи", і виконали аналіз, використовуючи скануючий електронний мікроскоп (СЕМ). Збільшення зображень зліва направо: верхня панель - x200 (фіг. 2A), x1000 (фіг. 2B), x2000 (фіг. 2C); x4000 (фіг. 2D), x5000 (фіг. 2E), x6000 (фіг. 2F). Фіг. 3A-3B - показаний проточний цитометричний аналіз МСК, помічених CFSE. 1 × 105 МСК, помічені CFSE, культивували або на мембрані AMCA з 15 % ПЕГ 400 (фіг. 3 A) або на полістирольній чашці для культивування тканини (фіг. 3B) протягом 24, 48, 96 і 144 годин. У зазначений час клітини зібрали і виконали проточний цитометричний аналіз. Втрата CFSE відображає поділ клітин. Фіг. 4 - графік, що показує проліферацію МСК на мембранах AMCA, виготовлених з різними концентраціями ПЕГ 400. МСК, помічених CFSE, культивували і аналізували, як показано на Фіг. 3. Дані представлені як середня інтенсивність флуоресценції (СІФ) CFSE за часом для мембран AMCA, що містять різні концентрації ПЕГ 400, проти полістирольної чашки для культивування тканини (контрольна). Зменшення у СІФ представляє швидкість проліферації МСК за часом. Фіг. 5A-5C - знімки мембран AMCA зі скануючого електронного мікроскопа: мембрани були виготовлені способом лиття в розчиннику. Мембрани потім аналізували з використанням СЕМ або занурювали у фосфатний буферний фізрозчин (ФБФ) на 24 години і потім аналізували під СЕМ. (Фіг. 5A): мембрана з 15 % ПЕГ 400 перед зануренням у ФБФ - пористості не видно; (фіг. 5B): мембрана з 5 % ПЕГ після занурення у ФБФ - трохи пориста; (фіг. 5C): мембрана з 15 % ПЕГ після занурення в ФБФ - пориста. Збільшення: x5000. Фіг. 6A-6B - диференціація МСК на мембранах AMCA. 1 × 105 МСК культивували або на мембрані, або на полістирольній чашці для культивування тканини. Через 3 доби, коли клітини досягли середовища суцільної диференціації, яка містить питоме середовище з аскорбіновою 8 кислотою (50 мкг / мл), додали дексаметазон (10 ~ M) і P-гліцерофосфат (10 мМ), і клітини отримували свіже середовище для диференціації два рази на тиждень. На 17-ту добу культивування клітини зафіксували 70 % етанолом і виконали фарбування алізариновим червоним. (Фіг. 6A): контрольна полістирольна чашка; (фіг. 6B): мембрана AMCA з 15 % ПЕГ 400. Фіг. 7 - графік, що показує регенерацію кістки по середній області каллуса. Збільшену середню область каллуса вимірювали в кістках з імплантованими мембранами AMCA для порівняння з необробленими контрольними екземплярами. Фіг. 8A-8B - графік, що показує кількісний аналіз відносних змін щільності каллуса за часом (фіг. 8A) і змін області каллуса за часом (фіг. 8B), що спостерігалися для етілцеллюлозної мембрани і етілцеллюлозної мембрани, контрольовано вивільняючої симвастатин, у 6 самців новозеландських кро-ликів, для яких був створений дефект критичного розміру (10 мм) у обох передпліччях. У передпліччя ввели етілцеллюлозну (ЕЦ) мембрану, яка містила симвастатин; у протилежну кінцівку ввели ЕЦ-мембрану. Калібрування здійснювали з використанням програмного забезпечення Osirix. Фіг. 9 - мікрознімок комп'ютерної томографії регенерації кістки з ЕЦ-мембраною. У цьому експерименті дефект кістки був залишений необробленим. Дефект кістки був у стані незрощення. Стрілками відзначена область дефекту кістки. Фіг. 10 - мікрознімок комп'ютерної томографії регенерації кістки з ЕЦ-мембраною, яка містить симвастатин. У цьому експерименті дефект кістки було оброблено, і показано успішне перекривання дефекту. Стрілками відзначена область дефекту кістки. Фіг. 11A-11B - графік, що показує зростання середньої області каллуса для мембрани AMCA цього винаходу з додаванням і без симвастатину з контрольованим вивільненням. A результати через 4 тижні після імплантації мембрани AMCA + симвастатин. B - результати, отримані через 8 тижнів після імплантації мембрани AMCA + симвастатин. Фіг. 12A-12D - графік, що показує впливу різних параметрів на вивільнення симвастатину з мембрани цього винаходу (виміряно in vitro): вплив концентрації симвастатину на швидкість вивільнення симвастатину (фіг. 12A); вплив ширини мембрани на швидкість вивільнення симвастатину (фіг. 12B); вплив пластифікатора на швидкість вивільнення симвастатину (фіг. 12C); вплив типу пластифікатора на швидкість вивільнення симвастатину (фіг. 12D). Фіг. 13A-13B - графік, що показує параметри регенерації кістки, досягнуті з мембраною AMCA як носієм МСК на моделі дефекту критичного розміру у кролика. На Фіг. 13A показано зростання області каллуса. На Фіг. 13B показана гістологічну оцінку дефектів через 8 тижнів після імплантації мембрани. Детальний опис варіантів застосування 5 UA 103650 C2 5 10 15 20 25 30 35 40 45 50 55 За заявленим винаходом пропонується мембрана, що складається щонайменше з трьох елементів, по-перше, синтетичного гідрофобного полімеру з позитивним поверхневим зарядом, який не розкладається біологічно у фізіологічних умовах, щонайменше одного гідрофільного полімеру, який розкладається біологічно у фізіологічних умовах, і щонайменше одного пластифікатора. Без прив'язки до теорії, поєднання цих елементів створює мембрану, яка досить гнучка, щоб створювати тривимірні структури, які підходять для різних терапевтичних застосувань, наприклад, у формі порожнистої трубки. Більш того, після впливу рідини (in vivo або ex vivo), гідрофільний полімер щонайменше частково розкладається, і мембрана стає пористою, цим дозволяючи адгезію клітин. Клітини можуть бути посіяні на мембрану цього винаходу, як буде докладно описано нижче. У інших варіантах здійснення мембрана цього винаходу може крім того включати активну речовину, як буде пояснено нижче. Мембрана цього винаходу може служити як інфраструктура для направлення відновлення тканини, а також як системи доставки клітин. Мембрана цього винаходу також може служити як бар'єрна мембрана для запобігання інфільтрації небажаних клітин, кровоносних судин і м'яких / рубцевих тканин в оброблювану область, а також для ізоляції клітин, доставленій у згадану мембрану з навколишньої тканини, і запобігання витоку клітин і факторів з простору всередині мембрани у навколишню тканину. Мембрану цього винаходу можна використовувати як таку, наприклад, шляхом закриття області, в яку доставлено клітини, однак у деяких варіантах шляхи виконання її можна використовувати для формування тривимірного пристрою (наприклад, полого трубчастого пристрою), який утримує клітини, що доставляються, або щоб покрити каркас для створення тканини, що містить клітини, що доставляються. У деяких варіантах здійснення мембрана цього винаходу складена у бажану тривимірну структуру, наприклад, трубчастий пристрій. Такий трубчастий пристрій можна використовувати як інфраструктури для спрямованого відновлення тканини, а також для доставки клітин в трубчасту область дефекту, такого як дефект кістки, і мембрану можна використовувати для утримання доставлених клітин і компонентів у пристрої і для запобігання інфільтрації клітин, позаклітинного матриксу і кровоносних судин з навколишньої тканини у простір, оточений пристроєм. В інших варіантах здійснення мембрану за винаходом використовують для покриття каркаса для створення тканини. Такий каркас з покритої мембрани може утримувати клітини, що доставляють у якесь місце тіла. Покриття мембрани ізолює клітини, доставлені у каркас з навколишнього тканини, і перешкоджає витоку клітин і розчинних факторів з простору всередині каркаса в навколишню тканину. Покриття каркасу мембраною цього винаходу може дозволити отримати послаблену адгезію клітин і підвищені дози клітин, що доставляються у цільове місце. В інших варіантах здійснення область дефектної кістки може бути загорнута після імплантації каркасу мембраною відповідно до винаходу, щоб запобігти витоку клітин і розчинних факторів і запобігти зростанню м'якої тканини в каркасі. Термін "доставка клітин" відноситься до введення клітин в бажане місце тіла пацієнта в терапевтичних цілях. Мембрана відповідно до винаходу підходить для посіву клітин будь-яких типів, наприклад, стовбурових клітин (як стовбурових клітин дорослої людини, так і стовбурових кліток ембріона). У інших варіантах здійснення тип клітин може бути вибраний з наступного переліку, який не обмежений: мезенхімальні (стромальні) стовбурові клітини, клітини крові пуповини, остеобласти, хондробласти або клітини CD 105 +. Винахід також охоплює посів плюрипотентних стовбурових клітин ембріонального походження, а також клітин дорослої людини, які були перепрограмовані, щоб стати плюрипотентними. Клітини можуть бути аутогенними, алогенними або ксеногенними. У деяких варіантах здійснення клітинами є аутогенні стовбурові клітини дорослої людини, отримані, наприклад, з кісткового мозку або жирової тканини. Посів клітин виконують в деяких варіантах здійснення ex vivo. Клітини можуть бути поміщені на мембрану (наприклад, виконану у формі порожнистого трубчастого пристрою) або поміщені в матрицю для створення тканини (також звану тут як "каркас"), покриту мембраною відповідно до винаходу. Прикладами матриці для створення тканини є матриці, виготовлені із біологічних матеріалів або синтетичних полімерів. У деяких варіантах здійснення винаходу мембрану відповідно до винаходу, трубчастий імплантат згідно з винаходом або покритий каркас згідно з винаходом, з клітинами, посіяними ex vivo, або без них, поміщають у бажане місце тіла. Таке місце зазвичай є місцем, де бажано 6 UA 103650 C2 5 10 15 20 25 30 35 40 45 50 55 60 створити нову тканину замість пошкодженої в результаті травми, хірургічного втручання, генетичних або хворобливих процесів. В деяких варіантах здійснення бажаним місцем є місце, де необхідно створити тканину зі стовбурних клітин дорослої людини; у деяких варіантах здійснення таким місцем є зв'язка, сухожилля, хрящ, міжхребцевий диск, дентин або кісткова тканина, найвпевненіше кісткова тканина. Створення кісткової тканини необхідно в таких умовах як незрощення переломів, остеопороз, захворювання періодонта або імплантація зубів, остеолітичні захворювання кістки, період після пластичної хірургії, після ортопедичної імплантації, після нейрохірургії з видаленням зводу черепа, після процедур нарощування альвеолярного відростка, після артродеза хребців, після перелому хребта. Створення тканини сухожилля/зв'язки потрібно, наприклад, після розриву тканини після травми або запальних станів. Створення тканини хряща потрібно в таких умовах, як ревматоїдний артрит, остеоартрит, травма, хірургія при раку або косметична хірургія. Створення тканин міжхребцевого диска, включаючи nucleous pulposus і annulus fibrosus, потрібно в таких умовах, як дегенерація nucleous pulposus, розриви annulus fibrosus або після нуклеотомії або дискектомії. Зазвичай мембрану, наприклад, у формі порожнистої трубки, поміщають у бажане місце шляхом імплантації. У деяких варіантах здійснення мембрана цього винаходу містить синтетичний, гідрофобний, позитивно заряджений полімер, гідрофільний полімер, пластифікатор і активну речовину, а також засіяна клітинами. В одному конкретному варіанті здійснення мембрана згідно з винаходом містить синтетичний, гідрофобний, гідрофобний позитивно заряджений полімер і ПЕГ і крім того засіяна стовбуровими клітинами. Застосований тут термін "поверхня для росту клітин" відноситься до будь-якої штучної поверхні, що підходить для росту клітин, наприклад, предметне скло, посудина або чашка для культивування клітин / тканини. Поверхня для росту клітин, покрита мембраною відповідно до винаходу, цим набуває властивостей, які підходять для адгезії, проліферації та / або диференціації клітин. Заявлений винахід пропонує гнучку мембрану, здатну підтримувати адгезію, проліферацію і диференціацію МСК. Таку мембрану можна використовувати як засіб лікування в застосуванні для регенерації кістки. Лікування зміщених переломів і регенерація дефектів кістки не відбувається тільки через проліферацію локально присутніх остеобластів, але включає поповнення, проліферацію та диференціацію преостеобластичних клітин. Диференціація мультіпотентних остеобластичних прекурсорів є головною початковою дією при лікуванні кістки і формуванні каллуса, хоча вже існуючі остеобласти також можуть бути задіяні. Будь-яка невдача у поповненні, створенні, проліферації і диференціації цих клітин-попередників може призвести до затримки у зрощенні або незростанні. Існує багато труднощів, пов'язаних з лікуванням дефектів кістки критичного розміру. Загалом, ці труднощі є результатом того, що існує недостатня кількість і / або активність остеобластів організму господаря, щоб дозволити вилікування. Мембрана відповідно до винаходу може направляти регенерацію кістки, а також запобігти небажаній васкуляризації у новоствореній кістці. Мембрана також може захищати область дефекту кістки від інфільтрації сполучних і рубцевих тканин, направляти остеобласти і дозволяти зберігати остеогенні компоненти у просторі, оточеному мембраною, яка може бути потенційно вивільненою з кінців кістки та кісткового мозку [10, 12]. Крім того, приміщення МСК, прикріплених до мембрани у місці моделі дефекту критичного розміру, дасть вихідний матеріал для нової тканини кістки. Тому імплантація мембрани НРК з розширеноними ex vivo МСК може значно поліпшити результат відновлення кістки. Як продемонстровано у прикладах нижче, були перевірені кілька полімерів в поєднанні з різними пластифікаторами. В одному варіанті здійснення мембрана, що складається з AMCA і 15 % ПЕГ 400 була у змозі підтримувати хорошу адгезію, проліферацію і диференціацію МСК: (I) МСК, зрощені з мембраною AMCA з 15 % ПЕГ 400, що визначено світловою мікроскопією, флуоресцентної мікроскопією і СЕМ. (II) МСК підтримують їх активність у проліферації, що визначено фарбуванням CFSE і проточним цитометричним аналізом; (III) МСК підтримують їх здатність до диференціації, що визначено фарбуванням алізариновим червоним. Мембрана AMCA, що містить 15 % ПЕГ 400, підтримувала диференціацію МСК у остеобласти. 7 UA 103650 C2 5 10 15 20 25 30 35 40 45 50 55 60 Матеріали та способи Полімери: сополімер амонію-метакрилату типу A NF (AMCA, Eudragit ® RL, De-gussa, Німеччина) і етилцелюлоза (EC, Ethocel ® N 100, Hercules Inc, Вілмінгтон, штат Делавер, США). Пластифікатори: поліетиленгліколь 400 (ПЕГ 400, Merck, Німеччина), гліцерілтрі-ацетат (триацетин, Fluka, Rehovot, Ізраїль), гліцерин (Frutarom, Ізраїль), тріетіл-цитрат (Fluka, Rehovot, Ізраїль), дібутілсебацінат (Fluka, Rehovot, Ізраїль), дібутілфталат (Fluka, Rehovot, Ізраїль). Виготовлення і стерилізація полімерних мембран. Мембрани виготовили із використанням способу лиття у розчиннику, як сказано у Фрідмана М. і Голомба Г. (Friedman M. and Golomb G. J) [13]. Полімерні мембрани були відлиті з розчину, що складається з полімеру, пластифікатору і етанолу (Frutarom, Ізраїль), у тефлонові форми (круглі пластини, внутрішній діаметр 9,6 см) і розчиннику дали випаровуватися протягом ночі. Ширина мембран становила: 100±5 мкм. Перед використанням у культивуванні тканини мембрани розмістили у розчині ФБФ (Biological Industries, Beit Haemek, Ізраїль) на 24 години, щоб вимити можливі залишки етанолу, і потім стерилізували УФ-випромінюванням протягом 2 годин. Визначення характеристик мембран - мікрофотографії, отримані скануючою електронною мікроскопією (СЕМ) - Мембрани AMCA, що містять 15 % ПЕГ 400, фіксували 2 % глутаральдегідом у кокоділатному буфері (0,1 M; pH=7,2) протягом 2 годин. Потім зразки обробляли способом повітряної сушки, пропускаючі послідовність дегідрування етанолом (етанол розчиняє AMCA, тому він повинен бути виключений з підготовки зразків). Процес завершили через 100 % фреон 113. Зразки енергійно струшували, що дозволило швидко випарувати фреонову фазу. Мембрани встановили в мідні штирі, покрили золотом і потім досліджували у приладі "FEI quanta 200" при пришвидшуючій напрузі 30 кВ. Збір і культивування клітин. МСК отримали з утилізованих кісткових тканин пацієнтів, які перенесли хірургічні операції по повній заміні стегна, зі схвалення Гельсінського комітету з етики Медичного центру Хадасса (Hadassah Medical Center Helsinki Ethics Committee) після інформованої згоди. Зразки МСК були відокремлені від інших клітин, присутніх в кістковому мозку, шляхом зчеплення з пластиком і потім вирощувалися в умовах культивування тканин, які описані у роботах Крампери М. та інших (Krampera M. et al.) [14] і Джоуада Ф. та інших (Djouad F et al) [15]. Клітини витримували у модифікованому середовищі з низьким вмістом глюкози Dulbecco's Modified Eagle Medium (DMEM), доповненою 10 % фетальною телячої сироваткою, інактивованою нагріванням, 2 мМ глутаміну і пеніциліном / стрептоміцином (Biological Industries, Beit-Haemek, Ізраїль). Первісні культури зазвичай витримували протягом 12-16 діб і потім відділяли трипсинізацією і пересівали (Баррі Ф.П. та інші (Barry FP. Et al.) [16]). Середовище міняли кожні 3-4 доби. Адгезія МСК до мембрани. Для мічення МСК повторно суспендованих в ФБФ (107 клітин/мл), що містить 5-карбоксифлуоресцеиндиацетоксиметилэфир (BCECF / AM або CFSE; 5 мкг / мл; Calbiochem), інкубували при 37 °C протягом 10 хвилин і потім клітини промивали тричі. Клітини культивували на стерилізованій мембрані, змоченій ФБФ, 15 × 104 клітин у 150 мкл середовища, і інкубували протягом 6-ти годин при 37 °C. Після цього додали 3 мл середовища. Клітини вивчали через 24 години після посіву під флуоресцентним мікроскопом. Полістирольні чашки для культивування тканин використовували як позитивний контроль для мембрани у перевірці адгезії клітин. Аналіз проліферації на основі CFSE. Для досліджень поділу клітин МСК повторних суспендованих в ФБФ (107 клітин / мл), що містить 3'-0-ацетил-2 ', 7'-біс (карбоксіетіл) -4 або 5карбоксіфлуоресцеін діацетоксіметілефір (BCECF / AM або CFSE; 5 мкг / мл; Calbiochem), інкубували при 37 °C протягом 10 хвилин і промили три рази. Клітини, помічені CFSE, потім посіяли на мембрані або на чашках для культивування тканин, зазначених вище. У зазначений час клітини збирали і проліферацію клітин візуально досліджували по наростаючій втраті флуоресценції CFSE на проточній цитометрії FACSCalibure (Becton Dickinson) з використанням програмного забезпечення Cell Quest. Диференціація МСК на мембрані. МСК посіяли на мембрани або на чашки для культивування з центральним колодязем (Falcon) для контролю, як сказано вище. Як тільки МСК злилися, живильне середовище доповнили аскорбіновою кислотою (50 мкг / мл), 8 дексаметазоном (10- M) і P-гліцерофосфат (10 мМ). Середу міняли двічі на тиждень протягом 17 діб, після чого мембрани і чашки пофарбували алізариновим червоним, як сказано вище. Фарбування алізариновим червоним. Основний розчин 2 % алізаринового червоного у дистильованій воді корегували до pH 4,2 за допомогою NaOH і пропустили через фільтр 0,22 мкм. Культури у чашках з центральним колодязем три рази промили 150 мм NaCl, зафіксували у крижаному 70 % етанолі, промили дистильованою водою і фарбували при кімнатній температурі 8 UA 103650 C2 5 10 15 20 25 30 35 40 45 50 55 60 протягом 10 хвилин, використовуючи 500 мкл основного розчину алізаринового червоного на один колодязь. Окремі колодязі промивали п'ять разів дистильованою водою; шосту і останню промивку виконували протягом 15 хвилин (Халворсен Й.Д. та інші (Halvorsen Y.D. Et al.) [17]). Мембрани через їх позитивний заряд мали більш високу спорідненість до алізаринового червоного ніж негативно заряджені чашки для культивування з центральним колодязем, тому промивка дистильованою водою не видалила барвник з мембран досить добре. Для зменшення фону ми застосували для мембран одинарну промивку з використанням 0,02 M HCl. Потім отримали мікрофотографії. Приклад 1. Адгезія клітин з використанням мембрани відповідно до винаходу Були перевірені різні мембрани на їх здатність підтримувати прикріплення і ріст клітин. Перевірені мембрани відрізнялися за їх полімеру і типу пластифікатора. Були перевірені кілька пластифікаторів, тобто, гліцерин, поліетиленгліколь, триетилцитрат, дібутілсебацінат, дибутилфталат, триацетин. Перевірені пластифікатори були гідрофобними або гідрофільними і були додані для підвищення гнучкості мембрани. МСК були посіяні на стерилізованих мембранах, як сказано вище. ЕЦ-мембрани: клітини МСК показали невелику адгезію до всіх складів ЕЦ-мембран, і агрегація клітин була слабкою. Різні пластифікатори не вплинули на адгезію клітин або форму клітин. В якості контрольних використовували мембрани, вкриті полі-l-лізином. Полі-l-лізин, амінокислотний ланцюг з високим позитивним зарядом, зазвичай використовується як речовина покриття для сприяння адгезії клітин у культурі. Клітини прилиплі у формі одношарового веретена до ЕЦ-мембран, покритих полі-l-лізином, звідси був зроблений висновок, що етилцелюлоза не підтримує адгезію клітин, як така. Однак, було виявлено, що етілцеллюлоза не токсична у присутності полі-l-лізину. Мембрани AMCA: Перевірку на адгезію клітин виконали з сополімером амоній-метакрилату типу A (AMCA, Eudragit RL ™, Degussa, Німеччина) [85 %], змішаним з різними пластифікаторами, зазначеними вище [15 %]. МСК добре злипалися з мембранами AMCA, виготовленими з різними пластифікаторами (фіг. 1, DF) у формі одношарового веретена. Поширення клітин по мембранам AMCA було схоже з розподілом на полістирольних чашках, які використовували в якості позитивного контролю для адгезії клітин (фіг. 1, AC). Вид розподілу вказує на хороший стан клітин. Адгезію клітин далі аналізували, використовуючи СЕМ. Як показано на Фіг. 2, клітини на мембранах AMCA були плоскими і мали форму одношарового веретена. Крім того, при більш високому збільшенні було видно взаємодію між клітинами і мембраною, причому ніжки клітин були прикріплені до мембрани (фіг. 2, DF). Більше того, спостерігалося вивільнення численних вакуолей з поверхні клітин, що продемонструвало функціональність клітин. Подібні результати були отримані при використанні людських і кролячих МСК. Приклад 2. Проліферація клітин з використанням мембрани відповідно до цього винаходу. Здатність МСК до проліферації перевірили, використовуючи флуоресцентний маркер поділу клітин, CFSE і проточний цитометричний аналіз. Цей спосіб заснований на барвнику CFSE, що відноситься до флуоресцеїну, який розділяється з відмінною надійністю між дочірніми клітинами, дозволяючи ідентифікувати від 8 до 10 дискретних генерацій як in vitro, так і in vivo. Цей спосіб дозволяє отримувати комплексну інформацію щодо кінетики проліферації та диференціації. Згідно цього способу окремі клітини позначають флуоресцентним барвником CFSE, який не зворотно зв'язується з цитоплазмою клітини. Коли клітини діляться, їх флуоресценція послідовно ділиться наполовину з кожним поколінням, дозволяючи контролювати за часом історію проліферації будь однієї клітини (див. Лайонс А.Б. та інші (Lyons AB. Et al) [18]). Клітини МСК проліферіровалися на мембрані AMCA з ПЕГ 400 (фіг. 3B) (але протокуфераціі не було відзначено з іншими пластифікаторами; дані не показані), хоча і в чомусь зі зниженою швидкістю в порівнянні з їх здатністю до проліферації на чашках для культивування тканини, які використовуються як контрольні (фіг. 3A). Потім швидкість проліферації МСК за часом перевірили на мембранах, що містять різні концентрації ПЕГ 400 (10, 15, 20 і 25 мас. %). Швидкість проліферації МСК зворотно корегували із середнім значенням інтенсивності флуоресценції (СІФ) (фіг. 4). Цей аналіз показав, що мембрани, що містять 15 % ПЕГ 400 і 20 % ПЕГ 400, були цілком близькі до контрольних полістирольних чашок, але інші концентрації ПЕГ показали вищі або нижчі швидкості проліферації. Крім того, характеристики мембран AMCA з 15 % і з 5 % ПЕГ 400 отримували за допомогою скануючої електронної мікроскопії (СЕМ). Мембрани спостерігали до і після занурення в ФБФ (фіг. 5). Зазначимо, що мембрани занурювали в ФБФ на 24 години перед кожним посівом МСК, 9 UA 103650 C2 5 10 15 20 25 30 35 40 45 50 щоб вимити залишковий етанол. Оскільки ПЕГ 400 розчинний у воді і, таким чином, є порогенним, тільки після занурення у ФБФ на поверхні мембран спостерігали пори (фіг. 5B-C). В обох концентраціях ПЕГ 400 знімків СЕМ демонстрували пористу поверхню при середньому розмірі пір 0,18 мкм. Розподіл пір прямо корелювали з різними концентраціями ПЕГ 400. Приклад 3. Диференціація клітин з використанням мембрани відповідно до винаходу. Середовище для диференціації додали так, як сказано вище. Мембрани і чашки потім пофарбували алізариновим червоним (фіг. 6A і 6B). Алізариновий червоний незворотньо зв'язується з двовалентними позитивними іонами і має особливо високу спорідненість з кальцієм. Кальцій секретується остеобластами і відкладається на мембрані як частина створення позаклітинного матриксу. Тому присутність кальцію відзначає диференціацію з МСК, які не секретують кальцій в остеобласти. На Фіг. 6 показано, що МСК, культивовані на мембрані AMCA і контрольних полістирольних чашках, диференціювалися в остеобласти і створили позаклітинний матрикс. Ці дані підтверджують, що мембрана AMCA з 15 % ПЕГ 400 підтримує дифференціацію МСК, і що МСК після зчеплення з мембраною зберігають свої особливості стовбурових клітин. Приклад 4. Дослідження регенерації кістки in vivo з використанням мембрани цього винаходу. Група для досліджень: п'яти самцям новозеландських кроликів вагою 3,8…4,4 кг була зроблена двостороння резекція в середній частині радіального сегмента кістки (довжиною 1 см) у передніх кінцівках. Трубчасті мембрани AMCA були імплантовані в ліву передню кінцівку (лікування остеотомії) і права кінцівка служила в якості контрольної (остеотомія не лікувалася). Оцінка процесу лікування: рентгенографічна оцінка - бічні рентгенівські знімки передніх кінцівок були зроблені через 2, 4, 6 і 8 тижнів після операції. Для отримання стандартизованих вимірювань дефектів кістки під час відновлювального лікування справжні бічні рентгенівські знімки обох передніх кінцівок були зроблені у стандартних умовах (42 кВ, 2 мА*с). Рентгенівські знімки досліджувалися з використанням програмного забезпечення OsiriX для обробки медичних зображень, щоб оцінити площу і щільність нової кістки. Вимірювані параметри Загальна площа регенерованої кісткової тканини (з'являється навколо дефекту кістки і в ньому). Для усунення можливого зміщення через мінливість розмірів кістки калібровку даних виконали з використанням діаметра процесу ліктьового відростка в його самій вузькій зоні як стандартного контрольного значення. Цей діаметр був визначений як 10 мм у кожному зразку. Відносна щільність нової регенерованої кістки в дефекті. Була окреслена сегментована область і була виміряна щільність. Щільність кістки в центрі процесу ліктьового відростка була виміряна у кожній передній кінцівки для калібровки в якості контрольного значення. Щільність процесу ліктьового відростка була визначена як 100 % для кожного зразка (див. Мошейф Р. та інші (Mosheiff R. et al.) [10]). Результати: на Фіг. 7 показано регенерацію кістки, виражену середньою площею каллуса 2 (мм ) протягом дослідження (2…8-й тижні). На 2-му тижні дослідження середня площа каллуса у контрольній кінцівці була більше ніж у кінцівки, обробленій мембраною AMCA, можливо через утворення гематоми або згустку крові на місці операції. Коли це місце було оточене мембраною, вона ізолювала цю область і, таким чином, сповільнила руйнування гематоми. Однак після 4-х тижнів дослідження середня площа каллуса, створеного в кінцівці, обробленої мембраною 2 2 AMCA, була трохи більше ніж така у контрольній кінцівці (144,8 мм проти 114,5 мм ). Ця тенденція продовжилася на 6-му і 8-му тижнях, одночасно зі збільшенням різниці між середньою площею каллуса в кінцівці з мембраною AMCA і у контрольній кінцівці. На 8-му тижні різниця між середньою площею каллуса в двох кінцівках (з мембраною AMCA та контрольною) 2 досягла свого максимуму і склала 143,91 мм (див. таблицю 1 нижче). Однак ця різниця є статистично незначущою через малого розміру проби (n=5) у цьому попередньому дослідженні і високою мінливістю результатів, як часто буває в дослідженнях in vivo. 10 UA 103650 C2 Таблиця 1 Рентгенографічні параметри дослідження на 8-му тижні (кінцева точка) Виміряний параметр Площа поверхні каллуса Відносна щільність каллуса Відносна щільність ближньої чверті Відносна щільність ближньої середньої чверті Відносна щільність дальньої середньої чверті Відносна щільність дальньої чверті 5 10 15 20 25 30 35 40 Значення (двостороннє) 0,08 Контроль Мембрана АМСА Середня різниця Середнє Середнє Стандарт Стандарт 2 2 2 (мм ) (мм ) (мм ) 143,91 85,633 129,74 277,203 273,65 0,68 20,54 39,8 123,33 101,95 143,87 0,89 31,96 38,35 126,12 107,43 158,08 0,68 55,84 51,93 96,44 126,81 152,28 0,34 57,89 37,7 106,28 114,28 164,17 0,5 40,41 41,99 110,07 88,78 150,48 Приклад 5. Дослідження регенерації кістки in vivo з використанням ЕЦ-мембрани відповідно до винаходу крім того містить симвастатин. У 6-ти самців новозеландських кроликів дефект критичного розміру (10 мм) був створений в обох передніх кінцівках. В одну кінцівку була введена ЕЦ-мембрана, яка містила симвастатин, в протилежну кінцівку була введена ЕЦ-мембрана без активної речовини. Щільність каллуса і площу каллуса вимірювали і калібрували, використовуючи програмне забезпечення Osirix. На Фіг. 8A і 8B показані результати кількісного аналізу рентгенограм. На Фіг. 9 показаний мікрознімок комп'ютерної томографії регенерації кістки з ЕЦ-мембраною. У цьому експерименті дефект кістки був залишений необробленим, Дефект кістки знаходиться в стані незрощення. Стрілками зазначена область дефекту кістки. На Фіг. 10 показаний мікрознімок комп'ютерної томографії регенерації кістки з ЕЦмембраною, яка містить симвастатин. Стрілками зазначена область дефекту кістки. У цьому експерименті дефект кістки був оброблений і очевидне успішне перекриття дефекту. Приклад 6. Дослідження регенерації кістки in vivo з використанням мембрани AMCA цього винаходу, крім того містить симвастатин Модель кролика: Був створений дефект критичного розміру в 1 см. 5 кролів були оброзроблені мембраною AMCA з контрольованим вивільненням симвастатину, і ще 5 кроликів були оброблені мембраною AMCA без активного інгредієнту. Мембрани: Мембрана AMCA, що містить симвастатин: - Симвастатин 20 мас. % - 0,36 г; - AMCA (eudragit RL) 70 мас. % - 1,26 г; - ПЕГ 400 10 мас. % - 0,18 г; - Ширина мембрани = 180 мкм. Контрольна мембрана AMCA: - AMCA (eudragit RL) 90 мас. % - 1,62 г; - ПЕГ 400 10 мас. % - 0,18 г; - Ширина мембрани = 180 мкм. На Фіг. 11 показано значно більшу область каллуса, що сформувалася в місці дефекту, обробленому мембраною AMCA з контрольованим вивільненням симвостатину (підсумовані рангові критерії Вілкоксона), а також збільшення у швидкості зростання каллуса у 2 перші тижні після операції, що може бути важливо з клінічної точки зору. Приклад 7 - Швидкість вивільнення симвастатину з різних мембран відповідно до винаходу in vitro. Впливи різних параметрів на вивільнення симвастатину з мембран відповідно до винаходу були виміряні in vitro наступним чином. Вплив концентрації симвастатину на швидкість вивільнення симвастатину показано на Фіг. 12 A, склад перевірених мембран був наступним: 11 UA 103650 C2 Компоненти мембрани Симвастатин ПЕГ 400 Eudragit RL Ширина (мкм) Мембрана 1 20 % 10 % 70 % 90 Мембрана 2 5% 10 % 85 % 75 Мембрана 3 10 % 10 % 80 % 87 Вплив ширини мембрани на швидкість вивільнення симвастатину показано на Фіг. 12B, склад перевірених мембран був наступним: Компоненти мембрани Мембрана 4 20 % 10 % 70 % 90 Симвастатин ПЕГ 400 Eudragit RL Ширина (мкм) Мембрана 5 20 % 10 % 70 % 220 5 Вплив пластифікатора на швидкість вивільнення симвастатину показано на Фіг. 12C, склад перевірених мембран був наступним: Компоненти мембрани Симвастатин ПЭГ 400 Eudragit RL Ширина (мкм) 10 15 20 25 30 35 40 Мембрана 6 20 % 10 % 70 % 90 Мембрана 7 20 % 5% 75 % 104 Мембрана 8 20 % 10 %-Klucel HF 70 % 87 Вплив типу пластифікатора на швидкість вивільнення симвастатину показано на Фіг. 12D. Приклад 8. Регенерація кістки з мембраною AMCA, яка містить МСК. Модель кролика: був створений дефект кістки критичного розміру 1 см. Два кролика були оброблені мембраною AMCA з МСК в одному передпліччі і мембраною AMCA без МСК в іншому передпліччі. Властивості мембрани: - AMCA (eudragit RL) 85 мас. % - 1,512 г; - ПЕГ 400 15 мас. % - 0,266 г; - Ширина мембрани = 180 мкм. На Фіг. 13A продемонстровано розвиток області каллуса в ураженій кістці. Як показано на Фіг. 13B, гістологічна оцінка різних частин дефектної кістки через 8-м тижнів після операції зазначеної вище для кісток з імплантованою мембраною AMCA, що містить МСК. Джерела інформації:. 1. Gerstenfeld LC, Cullinane DM, Barnes GL, Graves DT, Einhorn TA. Fracture healing as a postnatal developmental process: molecular, spatial, and temporal aspects of its regula-tion. J Cell Biochem 2003; 88 (5):873-84. 2. Megas P. Classification of non-union. Injury 2005; 3 6 Suppl 4: S3 0-7. 3. Crenshaw H. Delayed union and non-union of fractures. St.Louis: CV Mosby; 1987. 2053-118 p. 4. Hernigou P, Poignard A, Beaujean F, Rouard H. Percutaneous autologous bone-marrow grafting for nonunions. Influence of the number and concentration of progenitor cells. J Bone Joint Surg Am 2005; 87 (7):1430-7. 5. Kraus KH, Kirker-Head C. Mesenchymal stem cells and bone regeneration. Vet Surg 2006; 35 (3):232-42. 6. Cancedda R, Mastrogiacomo M, Bianchi G, Derubeis A, Muraglia A, Quarto R. Bone marrow stromal cells and their use in regenerating bone. Novartis Found Symp 2003; 249:133-43; discussion 143-7, 170-4, 239-41. 7. Cancedda R, Dozin B, Giannoni P, Quarto R. Tissue engineering and cell therapy of cartilage and bone. Matrix Biol 2003; 22 (1):81-91. 8. Tsuchiya K, Mori T, Chen G, Ushida T, Tateishi T, Matsuno T, Sakamoto M, Umezawa A. Custom-shaping system for bone regeneration by seeding marrow stromal cells onto a web-like biodegradable hybrid sheet. Cell Tissue Res 2004; 316 (2):141-53. 9. Meinig RP, Rahn B, Perren SM, Gogolewski S. Bone regeneration with resorbable polymeric membranas: treatment of diaphyseal bone defects in the rabbit radius with poly (L-lactide) membrana. A pilot study. J Orthop Trauma 1996; 10 (3): 178-90. 12 UA 103650 C2 5 10 15 20 25 10. Mosheiff R, Friedman A, Friedman M, Liebergall M. Quantification of guided regen-eration of weight-bearing bones. Orthopedics 2003; 26 (8):789-94. 11. Ito K, Nanba K, Murai S. Effects of bioabsorbable and non-resorbable barrier mem-branas on bone augmentation in rabbit calvaria. J Periodontal 1998; 69 (ll):1229-37. 12. Nasser NJ, Friedman A, Friedman M, Moor E, Mosheiff R. Guided bone regeneration in the treatment of segmental diaphyseal defects: a comparison between resorbable and non-resorbable membranas. Injury 2005; 36 (12):1460-6. 13. Friedman M, Golomb G. New sustained release dosage form of chlorhexidine for den-tal use. I. Development and kinetics of release. J Periodontal Res 1982; 17 (3):323-8. 14. Krampera M, Glennie S, Dyson J, Scott D, Laylor R, Simpson E, Dazzi F. Bone mar-row mesenchymal stem cells inhibit the response of naive and memory antigen-specific T cells to their cognate peptide. Blood 2003; 101 (9):3722-9. 15. Djouad F, Plence P, Bony C, Tropel P, Apparailly F, Sany J, Noel D, Jorgensen C. Immunosuppressive effect of mesenchymal stem cells favors tumor growth in allogeneic animals. Blood 2003; 102 (10):3837-44. 16. Barry FP, Murphy JM. Mesenchymal stem cells: clinical applications and biological characterization. Int J Biochem Cell Biol 2004; 36 (4):568-84. 17. characterization. Int J Biochem Cell Biol 2004; 36 (4):568-84. 18. Halvorsen YD, Franklin D, Bond AL, Hitt DC, Auchter C, Boskey AL, Paschalis EP, Wilkison WO, Gimble JM. Extracellular matrix mineralization and osteoblast gene expres-sion by human adipose tissue-derived stromal cells. Tissue Eng 2001; 7 (6):729-41. 19. Lyons AB. Analysing cell division in vivo and in vitro using flow cytometric meas-urement of CFSE dye dilution. J Immunol Methods 2000; 243 (l-2): 147-54. 20. Gugala Z, Gogolewski S. Differentiation, growth and activity of rat bone marrow stromal cells on resorbable poly (L / DL-lactide) membranas. Biomaterials 2004; 25 (12):2299-307. 21. Aggeliki I. et al Macromolecules, 35 (7), 2506-2513, 2002. ФОРМУЛА ВИНАХОДУ 30 35 40 45 50 55 60 1. Мембрана для регенерації тканин, що включає щонайменше один позитивно заряджений, синтетичний, гідрофобний полімер, щонайменше один гідрофільний полімер і щонайменше один пластифікатор, яка відрізняється тим, що згаданим щонайменше одним гідрофільним полімером та щонайменше одним пластифікатором є поліетиленгліколь у діапазоні від 300 до 20 000, причому згаданий поліетиленгліколь присутній у концентрації від 1 мас. % до 30 мас. %, при цьому згадана мембрана гнучка і здатна підтримувати щонайменше одне з адгезії клітин, проліферації клітин або диференціації клітин. 2. Мембрана за п. 1, яка відрізняється тим, що згаданим позитивно зарядженим, синтетичним, гідрофобним полімером є співполімер амоній-метакрилату типу А NF (АМСА), згаданим пластифікатором є поліетиленгліколь у діапазоні від 300 до 20 000, при цьому згадана мембрана гнучка і здатна підтримувати щонайменше одне з адгезії клітин, проліферації клітин або диференціації клітин. 3. Мембрана за п. 2, яка відрізняється тим, що і згаданий гідрофільний полімер, і згаданий пластифікатор є поліетиленгліколем 400. 4. Мембрана за п. 3, яка відрізняється тим, що згаданий поліетиленгліколь 400 присутній у концентрації 10, 15 або 25 мас. %. 5. Мембрана за будь-яким одним з пунктів 1-4, яка відрізняється тим, що згадана мембрана, крім того, містить щонайменше один тип клітин. 6. Мембрана за п. 5, яка відрізняється тим, що згадані клітини вибирають з групи, що складається зі стовбурових клітин дорослої людини, плюрипотентних стовбурових клітин, мезенхімальних стовбурових клітин, клітин крові пуповини, остеобластів, хондробластів і клітин CD 105+. 7. Мембрана за п. 6, яка відрізняється тим, що згадані стовбурові клітини є аутогенними стовбуровими клітинами дорослої людини. 8. Мембрана за будь-яким одним з пунктів 1-7, яка відрізняється тим, що крім того вміщує принаймні одну активну речовину, причому згадану щонайменше одну активну речовину вибирають з групи, що складається з цитокіну, гормону, бісфосфанату, канабіноїдів, бетаблокатора, агента, що індукує кістку, фактору росту, інгібітору редуктази HMG-СоА, ліків і антибіотика. 9. Мембрана за п. 8, яка відрізняється тим, що згадану активну речовину вибирають з групи, що складається з статину, естрогену, андрогену, пропранололу, трансформуючого фактора 13 UA 103650 C2 5 10 15 росту (TGF), морфогенетичного білка кістки (BMP), інсуліноподібного гормону росту, фібробластного фактору росту (FGF), алендронату, ризендронату і паратиреоїдного гормону. 10. Мембрана за п. 9, яка відрізняється тим, що згадана активна речовина є симвастатином або ловастатином. 11. Мембрана за будь-яким одним з пунктів 1-10, яка відрізняється тим, що згадана мембрана здатна бути пористою після гідратації, і яка відрізняється тим, що розмір пор складає від 0,1 до 5 мкм. 12. Використання мембрани за будь-яким одним з пунктів 1-11, яке відрізняється тим, що згадана мембрана гнучка і здатна підтримувати щонайменше одне з адгезії клітин, проліферації клітин або диференціації клітин, для виготовлення тривимірного порожнистого імплантата для регенерації тканини в області дефектної тканини, причому згадану тканину вибирають зі зв'язки, сухожилля, хряща, міжхребцевого диска, зубів і кістки. 13. Використання мембрани за п. 12, яка відрізняється тим, що згаданий тривимірний порожнистий імплантат вибирають з групи, що складається із трубчастого імплантата, циліндричного імплантата, конічного імплантата або плоского імплантата. 14 UA 103650 C2 15 UA 103650 C2 16 UA 103650 C2 17 UA 103650 C2 18 UA 103650 C2 19 UA 103650 C2 20 UA 103650 C2 Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 21
ДивитисяДодаткова інформація
Назва патенту англійськоюTissue regeneration membrane
Автори російськоюFriedman, Michael, Sasson, Yoel, Grin, Ada, Mosheiff, Rami, Rachmilewitz, Jacob
МПК / Мітки
МПК: A61L 27/50, A61L 27/56, A61L 27/26, A61L 27/58
Мітки: регенерації, тканин, мембрана
Код посилання
<a href="https://ua.patents.su/23-103650-membrana-dlya-regeneraci-tkanin.html" target="_blank" rel="follow" title="База патентів України">Мембрана для регенерації тканин</a>