Виділене химерне або гуманізоване антитіло, яке специфічно зв’язується з поліпептидом тат10772 (са125)
Формула / Реферат
1. Виділене химерне або гуманізоване антитіло, яке специфічно зв'язується з поліпептидом TAT10772 (CA125), що містить послідовність, представлену в SEQ ID NO:2, де антитіло містить три гіперваріабельні ділянки легкого ланцюга (HVR-L1, HVR-L2 і HVR-L3) і три гіперваріабельні ділянки важкого ланцюга (HVR-H1, HVR-H2 і HVR-H3), де:
(a) HVR-L1 містить амінокислотну послідовність, представлену в SEQ ID NO:119;
(b) HVR-L2 містить амінокислотну послідовність, представлену в будь-якій з SEQ ID NOs:120-121;
(c) HVR-L3 містить амінокислотну послідовність, представлену в SEQ ID NO:122;
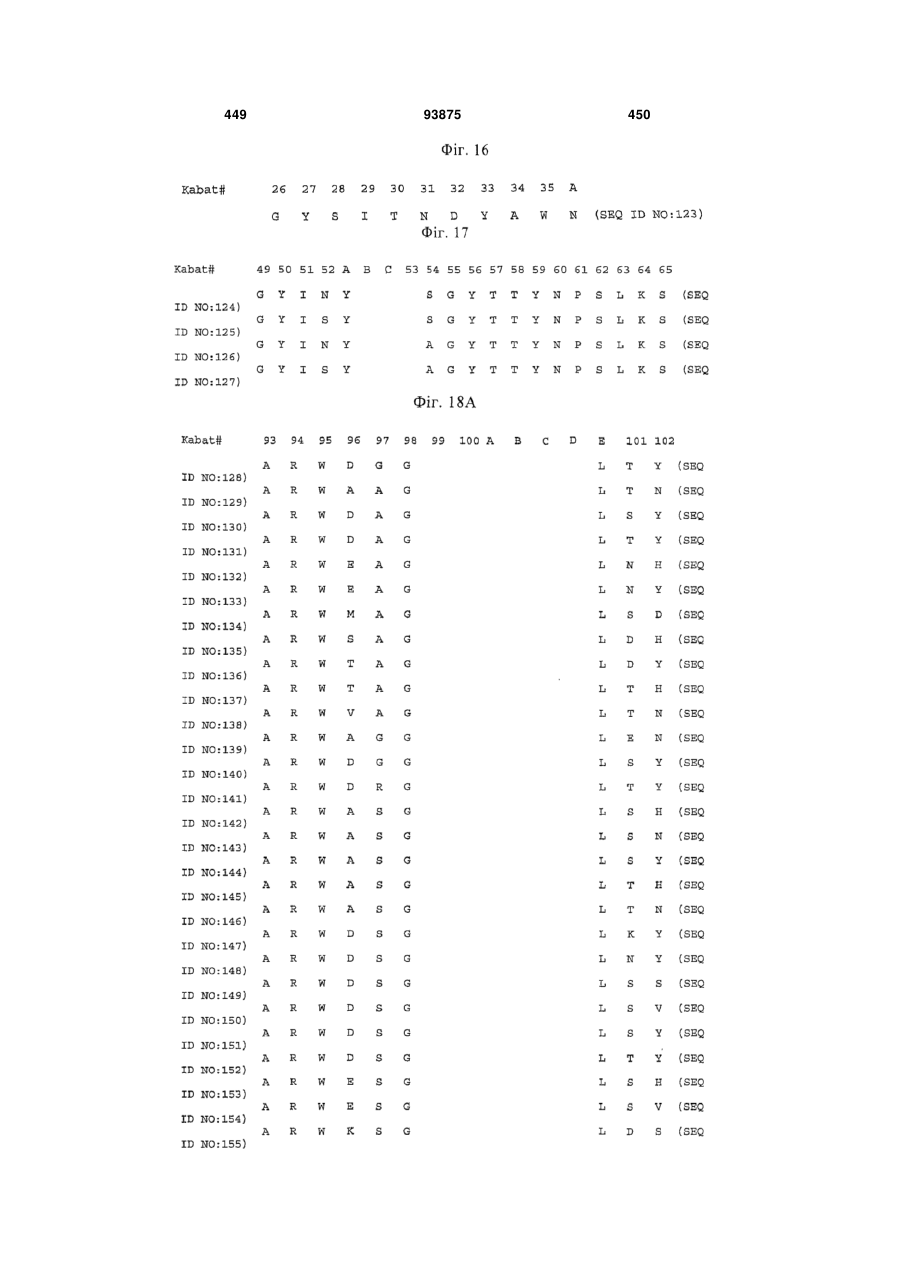
(d) HVR-H1 містить амінокислотну послідовність, представлену в SEQ ID NO:123;
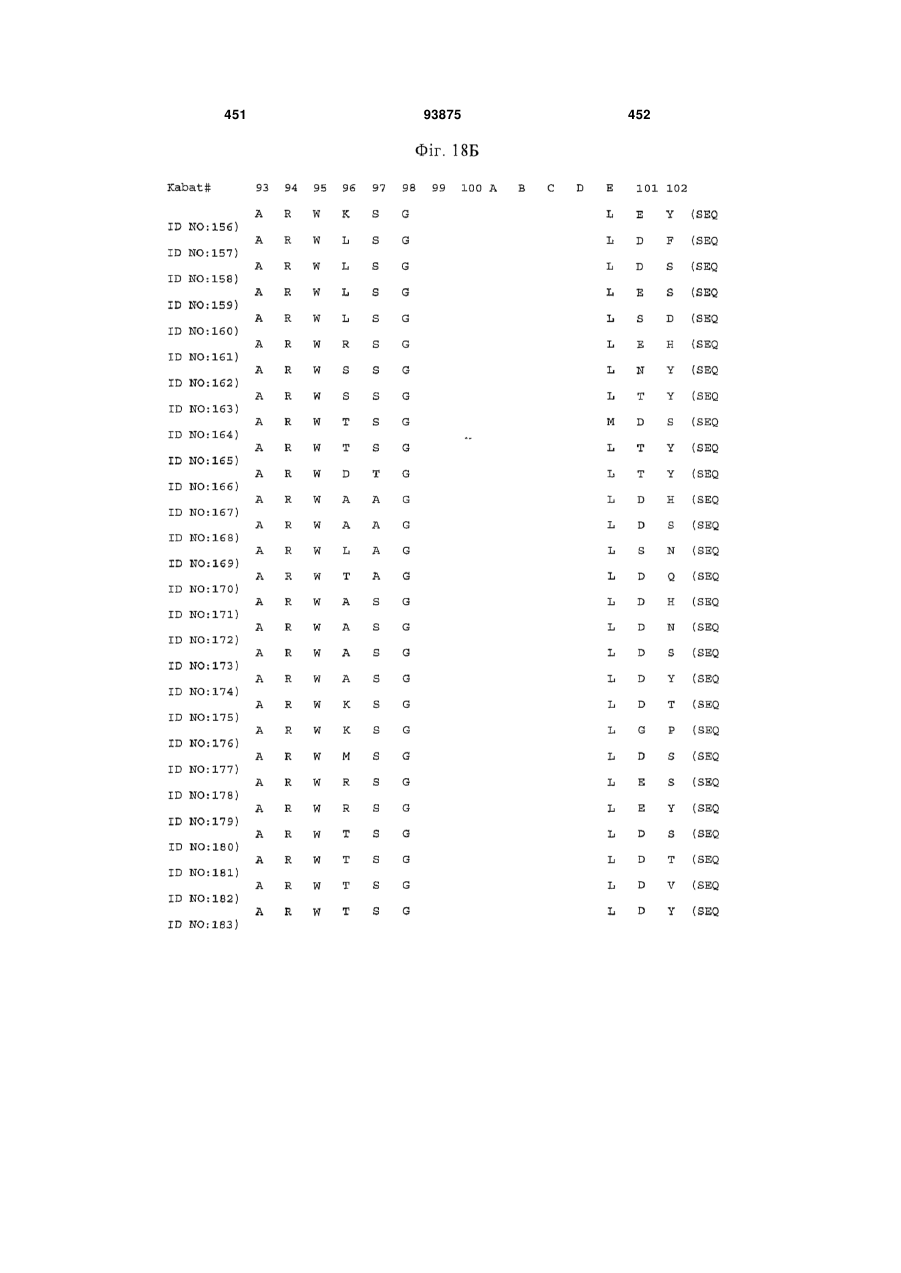
(e) HVR-H2 містить амінокислотну послідовність, представлену в будь-якій з SEQ ID NOs:124-127; і
(f) HVR-H3 містить амінокислотну послідовність, представлену в будь-якій з SEQ ID NOs:128-183.
2. Виділене антитіло за п. 1, яке додатково містить послідовність акцепторної людської консенсусної каркасної ділянки VH, представлену в будь-якій з SEQ ID NOs:184-193.
3. Виділене антитіло за п. 1, яке додатково містить послідовність акцепторної людської консенсусної каркасної ділянки VL, представлену в будь-якій з SEQ ID NOs:194-197.
4. Виділене антитіло за п. 1, яке додатково містить послідовність акцепторної людської консенсусної каркасної ділянки VH, представлену в будь-якій з SEQ ID NOs:184-193, і послідовність акцепторної людської консенсусної каркасної ділянки VL, представлену в будь-якій з SEQ ID NOs:194-197.
5. Антитіло за п. 1, яке являє собою фрагмент антитіла.
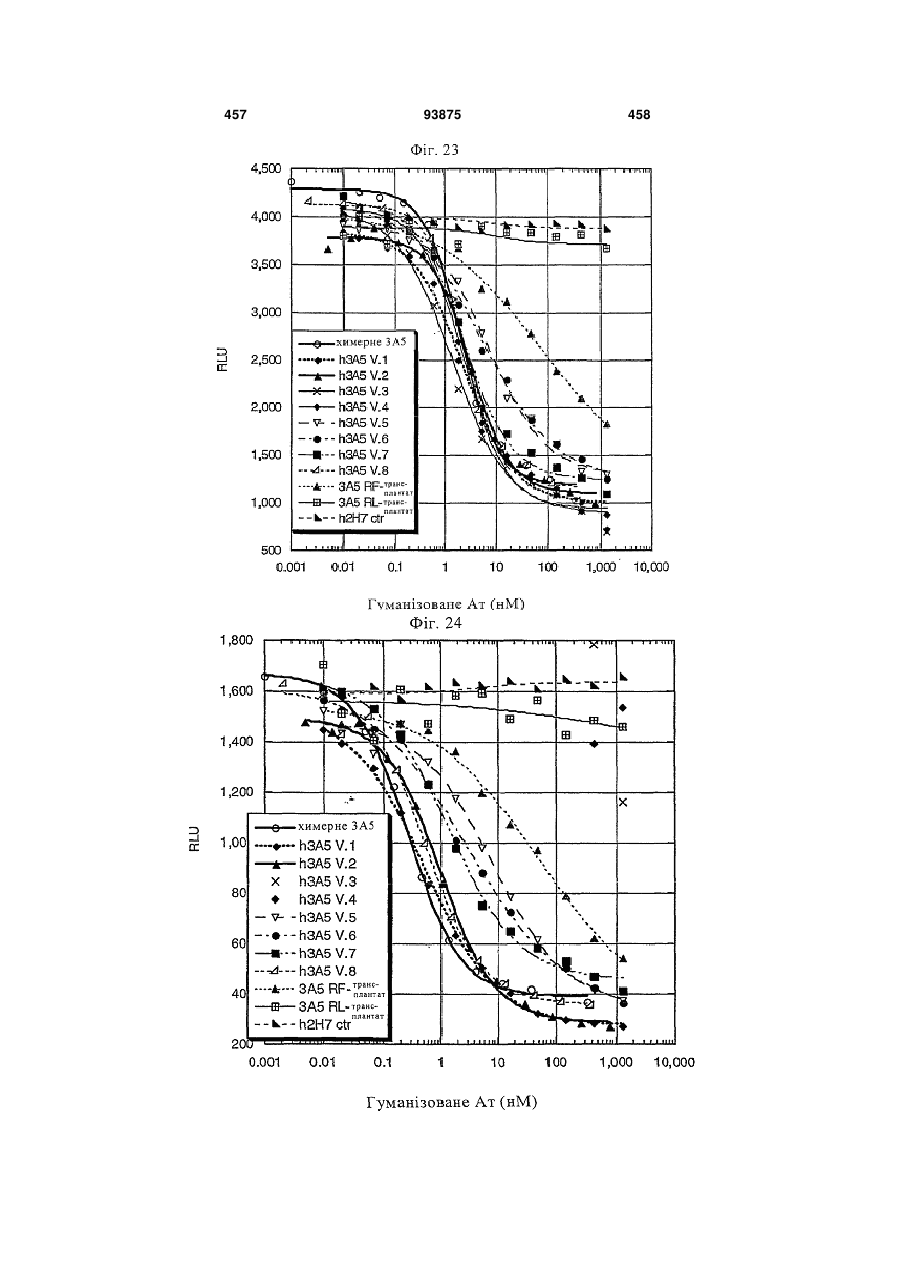
6. Антитіло за п. 1, яке являє собою химерне або гуманізоване антитіло.
7. Антитіло за п. 1, кон'юговане із інгібуючим ріст агентом.
8. Антитіло за п. 1, кон'юговане із цитотоксичним агентом.
9. Антитіло за п. 8, де цитотоксичний агент вибраний із групи, яка включає токсини, антибіотики, радіоактивні ізотопи і нуклеолітичні ферменти.
10. Антитіло за п. 8, у якому цитотоксичний агент являє собою токсин.
11. Антитіло за п. 10, у якому токсин вибраний із групи, яка включає майтансиноїд і каліхеаміцин.
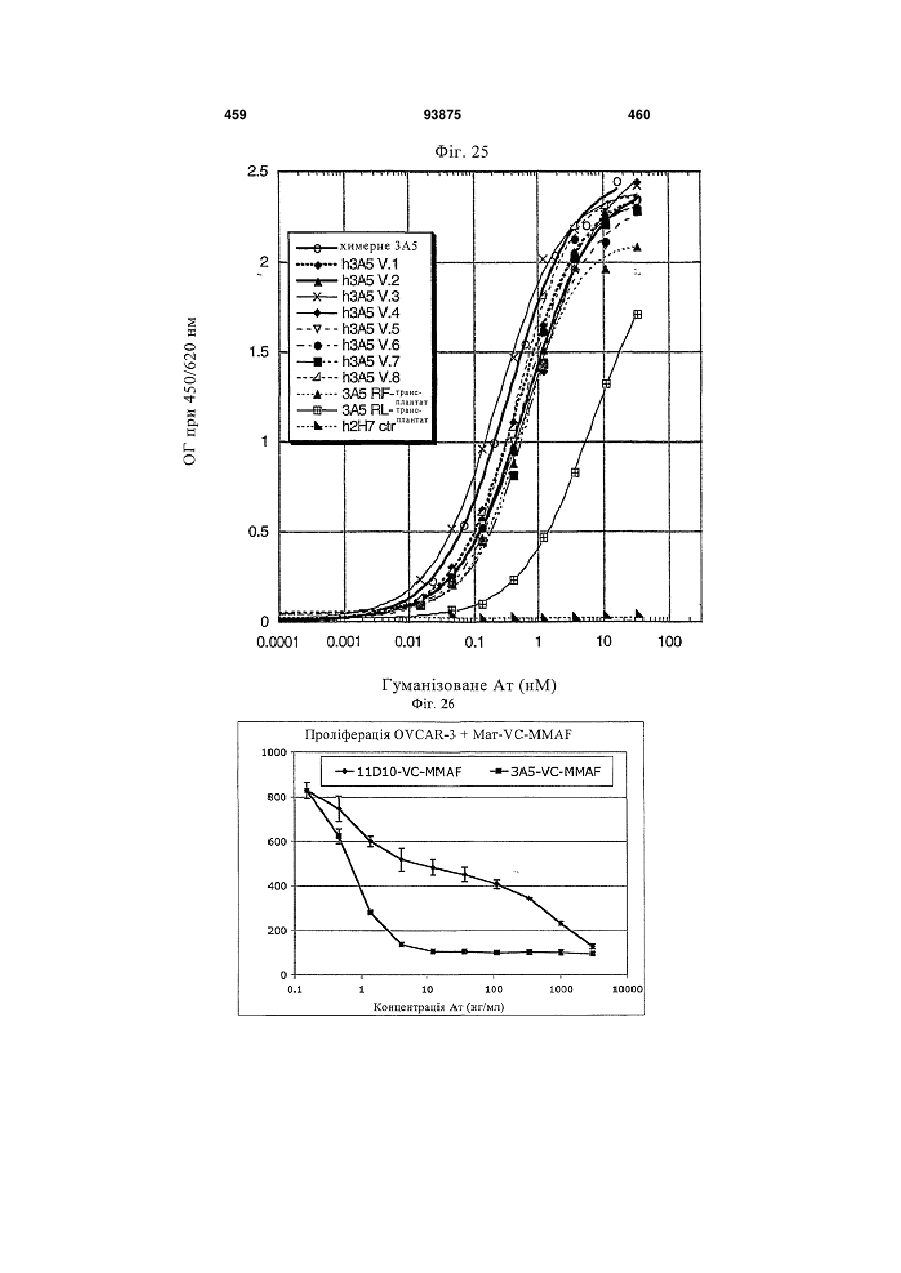
12. Антитіло за п. 10, у якому токсин являє собою майтансиноїд.
13. Антитіло за п. 1, яке продукується в бактеріях.
14. Антитіло за п. 1, яке продукується в CHO-клітинах.
15. Антитіло за п. 1, яке індукує загибель клітини, з якою воно зв'язується.
16. Антитіло за п. 15, де зазначена клітина являє собою клітину раку яєчника.
17. Антитіло за п. 1, яке несе мітку, що виявляється.
18. Антитіло за п. 1, яке містить VH послідовність, представлену в SEQ ID NO:208.
19. Антитіло за п. 1, яке містить VL послідовність, представлену в SEQ ID NO:211.
20. Антитіло за п. 1, яке містить VH послідовність, представлену в SEQ ID NO:208 і VL послідовність, представлену в SEQ ID NO:211.
21. Кон'югат антитіло-лікарський засіб, який містить антитіло, ковалентно приєднане за допомогою лінкера до одного або декількох фрагментів токсичних лікарських засобів, де кон’югат має формулу:
Ab-(L-D)p,
або його фармацевтично прийнятна сіль або сольват, де:
Ab являє собою антитіло за п. 1;
L являє собою лінкер;
D являє собою цитотоксичний агент, вибраний із токсинів, антибіотиків, радіоактивних ізотопів або нуклеолітичних ферментів; і
p дорівнює від 1 до приблизно 20.
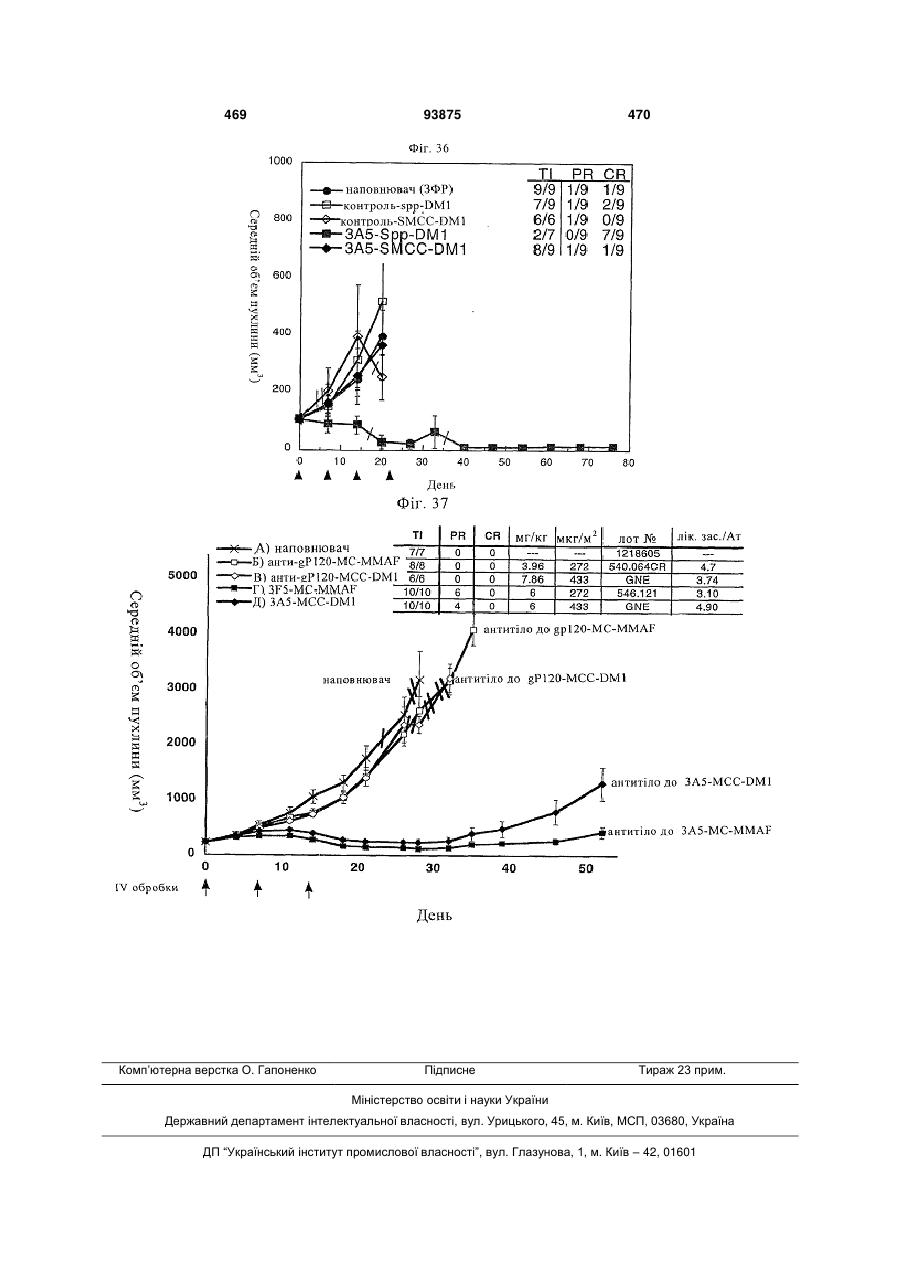
22. Кон'югат антитіло-лікарський засіб за п. 21, де Ab являє собою 3A5.
23. Кон'югат антитіло-лікарський засіб за п. 21, де D являє собою майтансиноїд.
24. Кон'югат антитіло-лікарський засіб за п. 23, де майтансиноїд являє собою DM1.
25. Кон'югат антитіло-лікарський засіб за п. 21, де D являє собою ауристатин.
26. Кон'югат антитіло-лікарський засіб за п. 25, де ауристатин являє собою MMAE або MMAF.
27. Кон'югат антитіло-лікарський засіб за п. 21, де L являє собою MC-val-cit-PAB або MC.
28. Кон'югат антитіло-лікарський засіб за п. 21, де L являє собою SMCC, SPP, або BMPEO.
29. Кон'югат антитіло-лікарський засіб за п. 21, вибраний із формули: Ab-MC-val-cit-PAB-MMAE, Ab-MC-val-cit-PAB-MMAF, Ab-MC-MMAE, Ab-MC-MMAF, Ab-SPP-DM1, і Ab-SMCC-DM1.
30. Кон'югат антитіло-лікарський засіб за п. 29, де Ab являє собою 3A5.
31. Кон'югат антитіло-лікарський засіб за п. 21, де антитіло приєднане до лінкера за допомогою тіолу цистеїну антитіла.
32. Фармацевтична композиція, яка містить кон'югат антитіло-лікарський засіб за п. 21 і фармацевтично прийнятний розчинник, носій або наповнювач.
33. Фармацевтична композиція за п. 32, яка додатково містить терапевтично ефективну кількість хіміотерапевтичного агента, вибраного із летрозолу, оксаліплатину, доксетакселу, 5-FU, лейковорину, лапатинібу і гемцитабіну.
34. Спосіб інгібування клітинної проліферації, який включає обробку пухлинних клітин ссавця в середовищі для культивування клітин кон'югатом антитіло-лікарський засіб за п. 21, в результаті чого інгібується проліферація пухлинних клітин.
35. Спосіб за п. 21, де пухлинними клітинами ссавця є пухлинні клітини яєчника.
36. Спосіб лікування злоякісного новоутворення, який включає введення пацієнту композиції фармацевтичної композиції за п. 32.
37. Спосіб за п. 36, де злоякісне новоутворення вибране із групи, яка включає рак передміхурової залози, рак сечових шляхів, рак підшлункової залози, рак легень, рак молочної залози, рак ободової кишки і рак яєчника.
38. Спосіб за п. 36, де пацієнту вводять хіміотерапевтичний агент в комбінації з кон'югатом антитіло-лікарський засіб, де хіміотерапевтичний агент вибирають із летрозолу, оксаліплатину, доксетакселу, 5-FU, лейковорину, лапатинібу і гемцитабіну.
39. Спосіб виявлення ракових клітин, який включає:
(a) піддавання клітин впливу кон'югату антитіло-лікарський засіб за п. 21; і
(б) визначення ступеня зв'язування сполуки кон'югату антитіло-лікарський засіб із клітинами.
40. Спосіб за п. 39, де клітини являють собою клітини пухлин передміхурової залози, підшлункової залози, легень, молочної залози, ободової кишки або яєчника.
41. Виріб, який включає
кон'югат антитіло-лікарський засіб за п. 21;
контейнер; і
листівку-вкладиш або етикетку, де вказано, що кон'югат можна застосовувати для лікування злоякісного новоутворення, яке характеризується понадекспресією зв’язаного із пухлиною поліпептиду, що містить амінокислотну послідовність, яка принаймні на 80 % ідентична до амінокислотної послідовності, представленої в SEQ ID NO:2.
42. Виріб за п. 41, де злоякісне новоутворення являє собою рак передміхурової залози, рак сечових шляхів, рак підшлункової залози, рак легень, рак молочної залози, рак ободової кишки або рак яєчника.
Текст
1. Виділене химерне або гуманізоване антитіло, яке специфічно зв'язується з поліпептидом TAT10772 (CA125), що містить послідовність, представлену в SEQ ID NO:2, де антитіло містить три гіперваріабельні ділянки легкого ланцюга (HVR-L1, HVR-L2 і HVR-L3) і три гіперваріабельні ділянки важкого ланцюга (HVR-H1, HVR-H2 і HVRH3), де: (a) HVR-L1 містить амінокислотну послідовність, представлену в SEQ ID NO:119; (b) HVR-L2 містить амінокислотну послідовність, представлену в будь-якій з SEQ ID NOs:120-121; (c) HVR-L3 містить амінокислотну послідовність, представлену в SEQ ID NO:122; 2 (19) 1 3 93875 4 16. Антитіло за п. 15, де зазначена клітина являє собою клітину раку яєчника. 17. Антитіло за п. 1, яке несе мітку, що виявляється. 18. Антитіло за п. 1, яке містить VH послідовність, представлену в SEQ ID NO:208. 19. Антитіло за п. 1, яке містить VL послідовність, представлену в SEQ ID NO:211. 20. Антитіло за п. 1, яке містить VH послідовність, представлену в SEQ ID NO:208 і VL послідовність, представлену в SEQ ID NO:211. 21. Кон'югат антитіло-лікарський засіб, який містить антитіло, ковалентно приєднане за допомогою лінкера до одного або декількох фрагментів токсичних лікарських засобів, де кон’югат має формулу: Ab-(L-D)p, або його фармацевтично прийнятна сіль або сольват, де: Ab являє собою антитіло за п. 1; L являє собою лінкер; D являє собою цитотоксичний агент, вибраний із токсинів, антибіотиків, радіоактивних ізотопів або нуклеолітичних ферментів; і p дорівнює від 1 до приблизно 20. 22. Кон'югат антитіло-лікарський засіб за п. 21, де Ab являє собою 3A5. 23. Кон'югат антитіло-лікарський засіб за п. 21, де D являє собою майтансиноїд. 24. Кон'югат антитіло-лікарський засіб за п. 23, де майтансиноїд являє собою DM1. 25. Кон'югат антитіло-лікарський засіб за п. 21, де D являє собою ауристатин. 26. Кон'югат антитіло-лікарський засіб за п. 25, де ауристатин являє собою MMAE або MMAF. 27. Кон'югат антитіло-лікарський засіб за п. 21, де L являє собою MC-val-cit-PAB або MC. 28. Кон'югат антитіло-лікарський засіб за п. 21, де L являє собою SMCC, SPP, або BMPEO. 29. Кон'югат антитіло-лікарський засіб за п. 21, вибраний із формули: Ab-MC-val-cit-PAB-MMAE, Ab-MC-val-cit-PAB-MMAF, Ab-MC-MMAE, Ab-MCMMAF, Ab-SPP-DM1, і Ab-SMCC-DM1. 30. Кон'югат антитіло-лікарський засіб за п. 29, де Ab являє собою 3A5. 31. Кон'югат антитіло-лікарський засіб за п. 21, де антитіло приєднане до лінкера за допомогою тіолу цистеїну антитіла. 32. Фармацевтична композиція, яка містить кон'югат антитіло-лікарський засіб за п. 21 і фармацевтично прийнятний розчинник, носій або наповнювач. 33. Фармацевтична композиція за п. 32, яка додатково містить терапевтично ефективну кількість хіміотерапевтичного агента, вибраного із летрозолу, оксаліплатину, доксетакселу, 5-FU, лейковорину, лапатинібу і гемцитабіну. 34. Спосіб інгібування клітинної проліферації, який включає обробку пухлинних клітин ссавця в середовищі для культивування клітин кон'югатом антитіло-лікарський засіб за п. 21, в результаті чого інгібується проліферація пухлинних клітин. 35. Спосіб за п. 21, де пухлинними клітинами ссавця є пухлинні клітини яєчника. 36. Спосіб лікування злоякісного новоутворення, який включає введення пацієнту композиції фармацевтичної композиції за п. 32. 37. Спосіб за п. 36, де злоякісне новоутворення вибране із групи, яка включає рак передміхурової залози, рак сечових шляхів, рак підшлункової залози, рак легень, рак молочної залози, рак ободової кишки і рак яєчника. 38. Спосіб за п. 36, де пацієнту вводять хіміотерапевтичний агент в комбінації з кон'югатом антитіло-лікарський засіб, де хіміотерапевтичний агент вибирають із летрозолу, оксаліплатину, доксетакселу, 5-FU, лейковорину, лапатинібу і гемцитабіну. 39. Спосіб виявлення ракових клітин, який включає: (a)піддавання клітин впливу кон'югату антитілолікарський засіб за п. 21; і (б)визначення ступеня зв'язування сполуки кон'югату антитіло-лікарський засіб із клітинами. 40. Спосіб за п. 39, де клітини являють собою клітини пухлин передміхурової залози, підшлункової залози, легень, молочної залози, ободової кишки або яєчника. 41. Виріб, який включає кон'югат антитіло-лікарський засіб за п. 21; контейнер; і листівку-вкладиш або етикетку, де вказано, що кон'югат можна застосовувати для лікування злоякісного новоутворення, яке характеризується понадекспресією зв’язаного із пухлиною поліпептиду, що містить амінокислотну послідовність, яка принаймні на 80 % ідентична до амінокислотної послідовності, представленої в SEQ ID NO:2. 42. Виріб за п. 41, де злоякісне новоутворення являє собою рак передміхурової залози, рак сечових шляхів, рак підшлункової залози, рак легень, рак молочної залози, рак ободової кишки або рак яєчника. Посилання на споріднені заявки Дана заявка являє собою непопередню заявку, подану відповідно до 37 C.F.R. § 1.53(b)(1), яка претендує на пріоритет відповідно до 35 U.S.С § 119(е) попередніх заявок сер. № 60/692092, що подана 20 червня 2005 p., і сер. № 60/793951, що подана 21 квітня 2006 p., повний зміст яких включений в даний опис як посилання. Галузь техніки, якої стосується винахід Даний винахід стосується композицій, пропонованих у винаході, які можна застосовувати для діагностики та лікування пухлини у ссавців, і способів застосування для цієї мети композицій, пропонованих у винаході. Передумови створення винаходу Смертність від злоякісних пухлин (різних типів раку) знаходиться на другому місці в Сполучених Штатах після серцево-судинних захворювань 5 (Boring та ін., СА Cancel J. Clin. 43, 1993, с. 7). Рак характеризується збільшенням кількості аномальних або неопластичних клітин, які утворюються зі здорових тканин, які проліферують, формуючи пухлинну масу, інвазією зазначених неопластичних пухлинних клітин у сусідні тканини й утворенням злоякісних клітин, які зрештою поширюються через кровотік або лімфатичну систему в регіональні лімфатичні вузли та у віддалені ділянки за допомогою процесу, який називають метастазуванням. При злоякісному стані відбувається проліферація клітин в умовах, у яких здорові клітини не можуть рости. Рак проявляється в широкій розмаїтості форм, які відрізняються різним ступенем інвазивності та агресивності. При створенні даного винаходу з метою виявлення ефективних клітинних мішеней для діагностики та терапії раку розпочаті спроби ідентифікації трансмембранних або інших асоційованих з мембранами поліпептидів, які специфічно експресуються на поверхні одного або декількох типів ракових клітин, у порівнянні з одним або декількома типами здорових неракових клітин. У багатьох випадках рівень експресії таких поліпептидів, асоційованих з мембраною клітин, вищий на поверхні ракових клітин у порівнянні з їх експресією на поверхні неракових клітин. Ідентифікація зазначених асоційованих з пухлиною поліпептидів, які являють собою антигени клітинної поверхні, дає можливість специфічно руйнувати ракові клітини за допомогою терапії, заснованої на застосуванні антитіл. У цьому зв'язку слід зазначити, що терапія, заснована на застосуванні антитіл, є дуже ефективною при лікуванні певних типів раку. Наприклад, HERCEPTIN і RITUXAN (обидва препарати фірми Genentech Inc., Південний Сан-Франциско, шт. Каліфорнія) являють собою антитіла, які успішно застосовують для лікування раку молочної залози та не-ходжкінської лімфоми відповідно. Більш конкретно, HERCEPTIN являє собою одержане з рекомбінантної ДНК моноклональне антитіло, які селективно зв'язується з позаклітинним доменом рецептора 2 людського епідермального фактора росту (HER2), який являє собою проонкоген. Надекспресія білка HER2 виявлена в 25-30% випадків первинного раку молочної залози. RITUXAN являє собою створене за допомогою генної інженерії химерне мишаче/людське моноклональне антитіло до антигену CD20, що присутній на поверхні здорових і злоякісних В-лімфоцитів. Обидва ці антитіла одержують рекомбінантним шляхом в СНО-клітинах. Незважаючи на досягнуті успіхи в галузі терапії раку в ссавців, існує велика потреба в додаткових діагностичних і терапевтичних агентах, які мають здатність виявляти присутність пухлини в ссавця й ефективно інгібувати ріст неопластичних клітин відповідно. Таким чином, об'єктом даного винаходу є ідентифікація асоційованих з мембраною поліпептидів, рівень експресії яких вищий на поверхні одного або декількох типів ракових клітин у порівнянні зі здоровими клітинами або іншими типами ракових клітин, і застосування зазначених поліпептидів і кодуючих їх нуклеїнових кислот для одержання композицій, пропонованих у винаході, 93875 6 які можна застосовувати для терапевтичного лікування та діагностичного виявлення раку в ссавців. Стислий виклад суті винаходу А. Варіанти здійснення винаходу При створенні даного винаходу вперше були ідентифіковані клітинні поліпептиди (і кодуючі їх нуклеїнові кислоти, або їх фрагменти), рівень експресії яких на поверхні одного або декількох типів ракових клітин вищий в порівнянні з рівнем експресії на поверхні одного або декількох типів здорових неракових клітин. Ці поліпептиди позначені в контексті даного опису як асоційовані з пухлиною антигенні поліпептиди-мішені (Tumor-associated Antigenic Target polypeptides) («ТАТ»-поліпептиди), і передбачається, що вони є ефективними мішенями при здійсненні терапії та діагностики раку в ссавців. Таким чином, одним з варіантів здійснення даного винаходу є виділена молекула нуклеїнової кислоти, яка має нуклеотидну послідовність, яка кодує асоційований з пухлиною антигенний поліпептид-мішень або його фрагмент («ТАТ»поліпептид). Конкретним об'єктом даного винаходу є виділена молекула нуклеїнової кислоти, яка містить нуклеотидну послідовність, яка, принаймні, приблизно на 80% або в іншому варіанті принаймні приблизно на 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 або 100% ідентична нуклеотидній послідовності (а) молекули ДНК, яка кодує повнорозмірний ТАТ-поліпептид, який має амінокислотну послідовність, що представлена в даному описі, ТАТ-поліпептид, в амінокислотній послідовності якого відсутній сигнальний пептид, представлений у даному описі, позаклітинний домен трансмембранного ТАТ-поліпептиду, який містить або не містить сигнальний пептид, представлений у даному описі, або будь-який інший конкретний фрагмент повнорозмірної амінокислотної послідовності ТАТ-поліпептиду, представлений у даному описі, або (б) комплементу молекули ДНК, зазначеної в (а). Іншим об'єктом даного винаходу є виділена молекула нуклеїнової кислоти, яка містить нуклеотидну послідовність, яка, принаймні приблизно на 80% або в іншому варіанті принаймні приблизно на 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 або 100% ідентична нуклеотидній послідовності (а) молекули ДНК, яка містить кодуючу послідовність кДНК повнорозмірного ТАТполіпептиду, наведену в даному описі, кодуючу послідовність ТАТ-поліпептиду, у якій відсутній сигнальний пептид, представлену в даному описі, кодуючу послідовність позаклітинного домену трансмембранного ТАТ-поліпептиду, яка містить або не містить сигнальний пептид, представлену в даному описі, або кодуючу послідовність будьякого іншого конкретного фрагмента повнорозмірної амінокислотної послідовності ТАТ-поліпептиду, представлену в даному описі, або (б) комплементу молекули ДНК, зазначеної в (а). Наступними об'єктами даного винаходу є виділена молекула нуклеїнової кислоти, яка містить нуклеотидну послідовність, яка, принаймні, приблизно на 80% або в іншому варіанті принаймні 7 приблизно на 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 або 100% ідентична нуклеотидній послідовності (а) молекули ДНК, яка кодує такий же зрілий поліпептид, який кодується повнорозмірною кодуючою ділянкою будьяких кДНК людського білка, депонованих в АТСС, які представлені в даному описі, або (б) комплементу молекули ДНК, зазначеної в (а). Наступним об'єктом даного винаходу є виділена молекула нуклеїнової кислоти, яка містить нуклеотидну послідовність, яка кодує ТАТ-пептид, у якого або трансмембранний домен вилучений у результаті делеції, або трансмембранний домен інактивований, або послідовність, комплементарну зазначеній кодуючій нуклеотидній послідовності, де трансмембранний(і) домен(и) зазначеного(их) пептиду(ів) представлений(і) у даному описі. Таким чином, під обсяг винаходу підпадають розчинні позаклітинні домени представлених у даному описі ТАТ-поліпептидів. Іншими об'єктами даного винаходу є виділені молекули нуклеїнової кислоти, які гібридизуються з (а) нуклеотидною послідовністю, яка кодує ТАТполіпептид, який має повнорозмірну амінокислотну послідовність, що представлена в даному описі, ТАТ-поліпептид, в амінокислотній послідовності якого відсутній сигнальний пептид, представлений у даному описі, позаклітинний домен трансмембранного ТАТ-поліпептиду, який містить або не містить сигнальний пептид, представлений у даному описі, або будь-який інший конкретний фрагмент повнорозмірної амінокислотної послідовності ТАТполіпептиду, представлений у даному описі, або з (б) комплементом нуклеотидної послідовності, зазначеної в (а). У цьому зв'язку одним з варіантів здійснення даного винаходу є фрагменти кодуючої послідовності повнорозмірного ТАТ-поліпептиду або її комплементу, представлені в даному описі, яким можна знайти застосування, наприклад, як зонди, що гібридизуються, які придатні, наприклад, як діагностичні зонди, ПЛР-праймери, антисмислові олігонуклеотидні зонди або кодуючі фрагменти повнорозмірного ТАТ-поліпептиду, які необов'язково можуть кодувати поліпептид, який містить сайт зв'язування антитіла до ТАТ-поліпептиду, ТАТ-зв'язуючий олігопептид або іншу невелику органічну молекулу, яка зв'язується з ТАТполіпептидом. Такі фрагменти нуклеїнової кислоти, як правило, складаються принаймні приблизно з 5 нуклеотидів, в іншому варіанті принаймні приблизно з 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990 або 1000 нуклеотидів, при цьому в контексті даного опису поняття «приблизно» означає, що довжина зазна 93875 8 ченої нуклеотидної послідовності може знаходитися в межах плюс або мінус 10% від зазначеної довжини. Крім того, зазначені фрагменти нуклеїнової кислоти, як правило, містять послідовно розташовані нуклеотиди з повнорозмірної кодуючої послідовності ТАТ-поліпептиду або її комплементу. Слід зазначити, що нові фрагменти кодуючої послідовності ТАТ-поліпептиду або її комплементу можна виявляти загальноприйнятим методом шляхом порівняльного аналізу первинної структури кодуючої послідовності ТАТ-поліпептиду та інших відомих нуклеотидних послідовностей з використанням будь-якої із численних добре відомих програм для порівняльного аналізу первинної структури, визначаючи в такий спосіб які(ий) фрагмент(и) кодуючої послідовності ТАТ-поліпептиду або її комплементу являється(ються) новими. Під обсяг винаходу підпадають всі такі нові фрагменти кодуючої послідовності ТАТ-поліпептиду або її комплементу. Під обсяг винаходу підпадають також фрагменти ТАТ-поліпептиду, які кодуються цими фрагментами нуклеотидної молекули, переважно такі фрагменти ТАТ-поліпептиду, які містять сайт зв'язування антитіла до ТАТ, ТАТ-зв'язуючий олігопептид або іншу невелику органічну молекулу, яка зв'язується з ТАТ-поліпептидом. Наступним варіантом здійснення винаходу є виділені ТАТ-поліпептиди, які кодуються будьякими виділеними нуклеотидними послідовностями, зазначеними вище. Одним з об'єктів винаходу є виділений ТАТполіпептид, який містить амінокислотну послідовність, яка ідентична принаймні приблизно на 80%, в іншому варіанті принаймні приблизно на 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 або 100% амінокислотній послідовності ТАТ-поліпептиду, який має повнорозмірну амінокислотну послідовність, представлену у даному описі, амінокислотній послідовності ТАТполіпептиду, у якій відсутній сигнальний пептид, представленої в даному описі, позаклітинного домену трансмембранного білка ТАТ-поліпептиду, який містить або не містить сигнальний пептид, представленої в даному описі, або будь-якого іншого конкретного фрагмента повнорозмірної амінокислотної послідовності ТАТ-поліпептиду, представленої в даному описі. Іншим об'єктом винаходу є виділений ТАТполіпептид, який містить амінокислотну послідовність, яка, принаймні, приблизно на 80% ідентична, в іншому варіанті принаймні приблизно на 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 або 99% ідентична амінокислотній послідовності, яка кодується будь-якими кДНК людського білка, депонованими в АТСС, які представлені в даному описі. І ще одним об'єктом винаходу є виділений ТАТ-поліпептид, який містить амінокислотну послідовність, яка кодується нуклеотидною послідовністю, яка гібридизується з комплементом молекули ДНК, яка кодує (а) ТАТ-поліпептид, який має повнорозмірну амінокислотну послідовність, що представлена в даному описі, (б) амінокислотну послідовність ТАТ-поліпептиду, у якій відсутній сигнальний пептид, представлену в даному описі, 9 (в) позаклітинний домен трансмембранного білка ТАТ-поліпептиду, який містить або не містить сигнальний пептид, представлений у даному описі, (г) амінокислотну послідовність, яка кодується будьякими представленими в даному описі нуклеотидними послідовностями, або (д) будь-який інший конкретний фрагмент повнорозмірної амінокислотної послідовності ТАТ-поліпептиду, представлений у даному описі. Конкретним об'єктом даного винаходу є виділений ТАТ-поліпептид без N-кінцевої сигнальної послідовності і/або без ініціюючого метіоніну та який кодується нуклеотидною послідовністю, яка кодує наведену в даному описі амінокислотну послідовність. Описані також способи їх одержання, які полягають у тому, що культивують клітинухазяїна, яка містить вектор, який несе відповідну молекулу нуклеїнової кислоти, в умовах, придатних для експресії ТАТ-поліпептиду, і виділяють ТАТ-поліпептид із клітинної культури. Іншим об'єктом винаходу є виділений ТАТполіпептид, у якого або трансмембранний домен видалений у результаті делеції, або трансмембранний домен інактивований. Описані також способи їх одержання, які полягають у тому, що культивують клітину-хазяїна, яка містить вектор, який несе відповідну молекулу нуклеїнової кислоти, в умовах, придатних для експресії ТАТ-поліпептиду, і виділяють ТАТ-поліпептид із клітинної культури. Іншими варіантами здійснення винаходу є вектори, які містять ДНК, яка кодує будь-який із представлених у даному описі поліпептидів. Описані також клітини-хазяї, які містять будь-який зазначений вектор. Клітини-хазяїни можуть являти собою, наприклад, СНО-клітини, клітини Е. coli або дріжджові клітини. Запропонований також спосіб одержання будь-якого із представлених у даному описі поліпептидів, який полягає у тому, що культивують клітини-хазяїни в умовах, придатних для експресії необхідного поліпептиду, і виділяють необхідний поліпептид із клітинної культури. Іншими варіантами здійснення винаходу є виділені химерні поліпептиди, які містять будь-які із представлених у даному описі ТАТ-поліпептидів, злиті з гетерологічним (не-ТАТ) поліпептидом. Наведені як приклад зазначені химерні молекули містять будь-який із представлених у даному описі ТАТ-поліпептидів, злитий з гетерологічним поліпептидом, таким, наприклад, як послідовність епітопу-мітки або Fc-ділянка імуноглобуліну. Іншим об'єктом винаходу є антитіло, яке зв'язується, переважно специфічно, з будь-яким з описаних вище або нижче поліпептидів. Антитіло необов'язково являє собою моноклональне антитіло, фрагмент антитіла, химерне антитіло, гуманізоване антитіло, одноланцюгове антитіло або антитіло, яке конкурентно інгібує зв'язування антитіла до ТАТ-поліпептиду з відповідним антигенним епітопом. Антитіла, пропоновані в даному винаході, необов'язково можна кон'югувати із інгібуючим ріст агентом або цитотоксичним агентом, таким як токсин, включаючи, наприклад, майтансиноїд або каліхеаміцин, антибіотиком, радіоактивним ізотопом, нуклеолітичним ферментом або т.п. Антитіла, пропоновані в даному винаході, не 93875 10 обов'язково можна одержувати в СНО-клітинах або бактеріальних клітинах, і переважно вони інгібують ріст або проліферацію або індукують загибель клітини, з якою вони зв'язані. Для діагностичних цілей антитіла, пропоновані в даному винаході, можуть являти собою антитіла, що несуть мітку, яка виявляється прикріплені до твердої підкладки або т.п. Іншими варіантами здійснення даного винаходу є вектори, які містять ДНК, яка кодує будь-яке із представлених у даному описі антитіл. Запропоновані також клітини-хазяї, які містять будь-який зазначений вектор. Наприклад, клітини-хазяїни можуть являти собою СНО-клітини, клітини Е. coli або дріжджові клітини. Запропонований також спосіб одержання будь-якого з їх представлених у даному описі антитіл, який полягає у тому, що культивують клітини-хазяїни в умовах, придатних для експресії необхідного антитіла, і виділяють необхідне антитіло із клітинної культури. Іншим варіантом здійснення винаходу є олігопептиди («ТАТ-зв'язуючі олігопептиди»), які зв'язуються, переважно специфічно, з будь-яким із зазначених вище або нижче необхідним ТАТполіпептидом. Необов'язково ТАТ-зв'язуючі поліпептиди, пропоновані в даному винаході, можна кон'югувати із інгібуючим ріст агентом або цитотоксичним агентом, таким як токсин, включаючи, наприклад, майтансиноїд або каліхеаміцин, антибіотиком, радіоактивним ізотопом, нуклеолітичним ферментом або т.п. ТАТ-зв'язуючі олігопептиди, пропоновані в даному винаході, необов'язково можна одержувати в СНО-клітинах або бактеріальних клітинах, і переважно вони інгібують ріст або проліферацію або індукують загибель клітини, з якою вони зв'язані. Для діагностичних цілей ТАТзв'язуючі олігопептиди, пропоновані в даному винаході, можуть являти собою олігопептиди, що несуть мітку, яка виявляється, прикріплені до твердої підкладки або т.п. Іншими варіантами здійснення даного винаходу є вектори, які містять ДНК, яка кодує будь-який із представлених у даному описі ТАТ-зв'язуючий олігопептид. Запропоновані також клітини-хазяї, які містять будь-який зазначений вектор. Наприклад, клітини-хазяїни можуть являти собою СНОклітини, клітини Е. coli або дріжджові клітини. Запропонований також спосіб одержання будь-якого з їх представлених у даному описі ТАТ-зв'язуючих олігопептидів, і він полягає у тому, що культивують клітини-хазяїни в умовах, придатних для експресії необхідного олігопептиду, і виділяють необхідний олігопептид із клітинної культури. Іншим варіантом здійснення винаходу є невеликі органічні молекули («ТАТ-зв'язуючі органічні молекули»), які зв'язуються, переважно специфічно, з будь-яким із зазначених вище або нижче необхідним ТАТ-поліпептидом. Необов'язково ТАТзв'язуючі органічні молекули, пропоновані в даному винаході, можна кон'югувати із інгібуючим ріст агентом або цитотоксичним агентом, таким як токсин, включаючи, наприклад, майтансиноїд або каліхеаміцин, антибіотиком, радіоактивним ізотопом, нуклеолітичним ферментом або т.п. ТАТзв'язуючі органічні молекули, пропоновані в дано 11 му винаході, переважно інгібують ріст або проліферацію або індукують загибель клітини, з якою вони зв'язані. Для діагностичних цілей ТАТзв'язуючі органічні молекули, пропоновані в даному винаході, можуть являти собою молекули, що несуть мітку, яка виявляється, прикріплені до твердої підкладки, або т.п. І ще одним варіантом здійснення винаходу є композиція, пропонована у винаході, яка містить ТАТ-поліпептид, представлений у даному описі, химерний ТАТ-поліпептид, представлений у даному описі, антитіло до ТАТ, представлене в даному описі, ТАТ-зв'язуючий олігопептид, представлений у даному описі, або ТАТ-зв'язуючу органічну молекулу, представлену в даному описі, у сполученні з носієм. Необов'язково носій являє собою фармацевтично прийнятний носій. І ще одним варіантом здійснення винаходу є виріб у вигляді контейнера й композиції, пропонованої у винаході, яка знаходиться в контейнері, де композиція, пропонована у винаході, може містити ТАТ-поліпептид, представлений у даному описі, химерний ТАТ-поліпептид, представлений у даному описі, антитіло до ТАТ, представлене в даному описі, ТАТ-зв'язуючий олігопептид, представлений у даному описі, або ТАТ-зв'язуючу органічну молекулу, представлену в даному описі. Виріб додатково може містити прикріплену до контейнера етикету або листівку-вкладиш у контейнері, на якій наведений спосіб застосування композиції, пропонованої у винаході, для терапевтичного лікування або діагностичного виявлення пухлини. Наступним варіантом здійснення даного винаходу є застосування ТАТ-поліпептиду, представленого в даному описі, химерного ТАТполіпептиду, представленого в даному описі, антитіла до ТАТ, представленого в даному описі, ТАТ-зв'язуючого олігопептиду, представленого в даному описі, або ТАТ-зв'язуючої органічної молекули, представленої в даному описі, для приготування лікарського засобу, призначеного для лікування стану, який сприйнятливий до ТАТполіпептиду, химерного ТАТ-поліпептиду, антитіла до ТАТ-поліпептиду, ТАТ-зв'язуючого олігопептиду або ТАТ-зв'язуючої органічної молекули. Іншими варіантами здійснення винаходу є будь-які виділені антитіла, які містять одну або декілька послідовностей HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 або HVR-H3, представлених у даному описі, або будь-яке антитіло, яке зв'язується з тим же епітопом, що й будь-яке зазначене антитіло. Б. Додаткові варіанти здійснення винаходу Іншим варіантом здійснення даного винаходу є спосіб інгібування росту клітини, що експресує ТАТ-поліпептид, який полягає у тому, що приводять у контакт клітину з антитілом, олігопептидом або невеликою органічною молекулою, які зв'язуються з ТАТ-поліпептидом, і при цьому зв'язування антитіла, олігопептиду або органічної молекули з ТАТ-поліпептидом викликає інгібування росту клітини, що експресує ТАТ-поліпептид. У кращих варіантах здійснення винаходу клітина являє собою ракову клітину, і зв'язування антитіла, олігопептиду або органічної молекули з ТАТ-поліпептидом 93875 12 викликає загибель клітини, що експресує ТАТполіпептид. Необов'язково антитіло являє собою моноклональне антитіло, фрагмент антитіла, химерне антитіло, гуманізоване антитіло або одноланцюгове антитіло. Антитіла, ТАТ-зв'язуючі олігопептиди та ТАТ-зв'язуючі органічні молекули, які застосовують у способах, пропонованих у даному винаході, необов'язково можна кон'югувати із інгібуючим ріст агентом або цитотоксичним агентом, таким як токсин, включаючи, наприклад, майтансиноїд або каліхеаміцин, антибіотиком, радіоактивним ізотопом, нуклеолітичним ферментом або т.п. Антитіла й ТАТ-зв'язуючі олігопептиди, які застосовують у способах, пропонованих у даному винаході, необов'язково можна одержувати в СНО-клітинах або бактеріальних клітинах. Ще одним варіантом здійснення даного винаходу є спосіб терапевтичного лікування ссавця, в організмі якого є присутнім злоякісна пухлина, яка містить клітини, які експресують ТАТ-поліпептид, який полягає у тому, що ссавцю вводять у терапевтично ефективній кількості антитіло, олігопептид або невелику органічну молекулу, які зв'язуються з ТАТ-поліпептидом, що приводить до ефективного терапевтичного лікування пухлини. Необов'язкове антитіло являє собою моноклональне антитіло, фрагмент антитіла, химерне антитіло, гуманізоване антитіло або одноланцюгове антитіло. Антитіла, ТАТ-зв'язуючі олігопептиди та ТАТ-зв'язуючі органічні молекули, які застосовують у способах, пропонованих у даному винаході, необов'язково можна кон'югувати із інгібуючим ріст агентом або цитотоксичним агентом, таким як токсин, включаючи, наприклад, майтансиноїд або каліхеаміцин, антибіотиком, радіоактивним ізотопом, нуклеолітичним ферментом або т.п. Антитіла й олігопептиди, застосовувані в способах, пропонованих у даному винаході, необов'язково можна одержувати в СНО-клітинах або бактеріальних клітинах. І ще одним варіантом здійснення даного винаходу є спосіб виявлення присутності ТАТполіпептиду в зразку, який, як передбачається, містить ТАТ-поліпептид, який полягає у тому, що піддають зразок впливу антитіла, олігопептиду або невеликої органічної молекули, які зв'язуються з ТАТ-поліпептидом, і визначають зв'язування антитіла, олігопептиду або органічної молекули з ТАТполіпептидом у зразку, де наявність зв'язування свідчить про присутність у зразку ТАТ-поліпептиду. Необов'язково зразок може містити клітини (які можуть являти собою ракові клітини), які, як передбачається, експресують ТАТ-поліпептид. Антитіло, ТАТ-зв'язуючий олігопептид або ТАТзв'язуюча органічна молекула, які застосовують у способі, необов'язково можуть нести мітку, що виявляється, бути прикріпленими до твердої підкладки або т.п. Наступним варіантом здійснення даного винаходу є спосіб діагностики наявності пухлини в ссавця, який полягає у тому, що визначають рівень експресії гена, який кодує ТАТ-поліпептид, (а) у тест-зразку тканинних клітин, одержаних з організму ссавця, і (б) у контрольному зразку клітин, взятих із цієї ж тканини або тканини такого ж типу, для яких відомо, що вони являють собою здорові не 13 ракові клітини, де більш високий рівень експресії ТАТ-поліпептиду в тест-зразку у порівнянні з контрольним зразком свідчить про наявність пухлини в ссавця, із організму якого одержаний тест-зразок. Наступним варіантом здійснення даного винаходу є спосіб діагностики наявності пухлини в ссавця, який полягає у тому, що (а) приводять у контакт тест-зразок, який містить тканинні клітини, які одержані з організму ссавця, з антитілом, олігопептидом або невеликою органічною молекулою, які зв'язуються з ТАТ-поліпептидом, і (б) виявляють утворення комплексу між антитілом, олігопептидом або невеликою органічною молекулою й ТАТполіпептидом у тест-зразку, де утворення комплексу свідчить про наявність пухлини в ссавця. Необов'язково застосовуване антитіло, ТАТзв'язуючий олігопептид або ТАТ-зв'язуючу органічну молекулу мітять із метою виявлення, прикріплюють до твердої підкладки або т.п., і/або тестзразок тканинних клітин одержують із організму індивідуума, у якого, як передбачається, присутня злоякісна пухлина. Наступним варіантом здійснення даного винаходу є спосіб лікування або попередження пов'язаного із проліферацією клітин захворювання, причиною якого є змінений, переважно підвищений, рівень експресії або активності ТАТполіпептиду, який полягає у тому, що індивідуумові, який потребує такого лікування, вводять в ефективній кількості антагоніст ТАТ-поліпептиду. Переважно пов'язане із проліферацією клітин захворювання являє собою рак, а антагоніст ТАТполіпептиду являє собою антитіло до поліпептиду ТАТ, ТАТ-зв'язуючий олігопептид, ТАТ-зв'язуючу органічну молекулу або антисмисловий олігонуклеотид. Ефективне лікування або попередження пов'язаного із проліферацією клітин захворювання, може бути результатом безпосереднього знищення клітин або інгібування росту клітин, які експресують ТАТ-поліпептид, або результатом протидії активності ТАТ-поліпептиду, яка потенціює клітинний ріст. І ще одним варіантом здійснення даного винаходу є спосіб зв'язування антитіла, олігопептиду або невеликої органічної молекули із клітиною, яка експресує ТАТ-поліпептид, який полягає у тому, що приводять у контакт клітину, яка експресує ТАТ-поліпептид, з антитілом, олігопептидом або невеликою органічною молекулою в умовах, які придатні для зв'язування антитіла, олігопептиду або невеликої органічної молекули з ТАТполіпептидом і які дають можливість здійснюватися їх зв'язуванню. У кращих варіантах здійснення винаходу антитіло мітять за допомогою молекули або сполуки, яку можна використовувати для якісного і/або кількісного визначення локалізації і/або кількості антитіла, олігопептиду або невеликої органічної молекули, що зв'язується із клітиною. Іншими варіантами здійснення даного винаходу є застосування (а) ТАТ-поліпептиду, (б) нуклеїнової кислоти, яка кодує ТАТ-поліпептид, або вектора або клітини-хазяїна, яка містить зазначену нуклеїнову кислоту, (в) антитіла до ТАТполіпептиду, (г) ТАТ-зв'язуючого олігопептиду або (д) ТАТ-зв'язуючої невеликої органічної молекули, 93875 14 для приготування лікарського засобу, який можна застосовувати для (І) терапевтичного лікування або діагностичного визначення раку або пухлини або (II) терапевтичного лікування або попередження пов'язаного із проліферацією клітин захворювання. Наступним варіантом здійснення даного винаходу є спосіб інгібування росту ракової клітини, де ріст ракової клітини принаймні частково залежить від потенціюючої(их) ріст дії(дій) ТАТ-поліпептиду (де ТАТ-поліпептид може експресуватися або самою раковою клітиною, або клітиною, яка продукує поліпептид(и), який має(мають) потенціюючу ріст дію на ракові клітини), який полягає у тому, що приводять у контакт ТАТ-поліпептид з антитілом, олігопептидом або невеликою органічної молекулою, які зв'язуються ТАТ-поліпептидом, протидіючи тим самим потенціюючій ріст активності ТАТполіпептиду, і, у свою чергу, інгібуючи ріст ракової клітини. Переважно ріст ракової клітини інгібується повністю. Ще більш краще зв'язування антитіла, олігопептиду або невеликої органічної молекули з ТАТ-поліпептидом індукує загибель ракової клітини. Необов'язкове антитіло являє собою моноклональне антитіло, фрагмент антитіла, химерне антитіло, гуманізоване антитіло, одноланцюгове антитіло. Антитіла, ТАТ-зв'язуючі олігопептиди й ТАТ-зв'язуючі органічні молекули, які застосовують у способах, пропонованих у даному винаході, необов'язково можна кон'югувати із інгібуючим ріст агентом або цитотоксичним агентом, таким як токсин, включаючи, наприклад, майтансиноїд або каліхеаміцин, антибіотиком, радіоактивним ізотопом, нуклеолітичним ферментом або т.п. Антитіла й ТАТ-зв'язуючі олігопептиди, які застосовують у способах, пропонованих у даному винаході, необов'язково можна одержувати в СНО-клітинах або бактеріальних клітинах. І ще одним варіантом здійснення даного винаходу є спосіб терапевтичного лікування пухлини в ссавця, де ріст пухлини принаймні частково залежить від потенціюючої(их) ріст дії(дій) ТАТполіпептиду, який полягає у тому, що ссавцю, який має потребу в цьому, вводять у терапевтично ефективній кількості антитіло, олігопептид або невелику органічну молекулу, які зв'язуються з ТАТ-поліпептидом, протидіючи потенціюючій клітинний ріст активності ТАТ-поліпептиду й приводячи до ефективного терапевтичного лікування пухлини. Необов'язкове антитіло являє собою моноклональне антитіло, фрагмент антитіла, химерне антитіло, гуманізоване антитіло, одноланцюгове антитіло. Антитіла, ТАТ-зв'язуючі олігопептиди й ТАТ-зв'язуючі органічні молекули, які застосовують у способах, пропонованих у даному винаході, необов'язково можна кон'югувати із інгібуючим ріст агентом або цитотоксичним агентом, таким як токсин, включаючи, наприклад, майтансиноїд або каліхеаміцин, антибіотиком, радіоактивним ізотопом, нуклеолітичним ферментом або т.п. Антитіла й ТАТ-зв'язуючі олігопептиди, які застосовують у способах, пропонованих у даному винаході, необов'язково можна одержувати в СНО-клітинах або бактеріальних клітинах. 15 В. Інші додаткові варіанти здійснення винаходу Іншими варіантами здійснення винаходу є наступна група потенційних пунктів формули винаходу, запропонованих у даному описі: 1. Виділена нуклеїнова кислота, нуклеотидна послідовність якої принаймні на 80% ідентична нуклеотидній послідовності: (а) молекули ДНК, яка кодує амінокислотну послідовність, що представлена в SEQ ID NO:2; (б) молекули ДНК, яка кодує амінокислотну послідовність, що представлена в SEQ ID NO:2, у якій відсутній асоційований з нею сигнальний пептид; (в) молекули ДНК, яка кодує позаклітинний домен поліпептиду, представленого в SEQ ID NO:2, включаючи асоційований з ним сигнальний пептид; (г) молекули ДНК, яка кодує позаклітинний домен поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (д) нуклеотидній послідовності, представленій в SEQ ID NO:1; (e) повнорозмірній кодуючій послідовності, нуклеотидній послідовності, представленій в SEQ ID NO:1; або (є) комплементу послідовностей, зазначених в (а), (б), (в), (г), (д) або (e). 2. Виділена нуклеїнова кислота, яка має: (а) нуклеотидну послідовність, яка кодує амінокислотну послідовність, що представлена в SEQ ID NO:2; (б) нуклеотидну послідовність, яка кодує амінокислотну послідовність, що представлена в SEQ ID NO:2, у якій відсутній асоційований з нею сигнальний пептид; (в) нуклеотидну послідовність, яка кодує позаклітинний домен поліпептиду, представленого в SEQ ID NO:2, включаючи асоційований з ним сигнальний пептид; (г) нуклеотидну послідовність, яка кодує позаклітинний домен поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (д) нуклеотидну послідовність, що представлена в SEQ ID NO:1; (e) повнорозмірну кодуючу ділянку нуклеотидної послідовності, представлену в SEQ ID NO:1; або (є) комплемент послідовностей, зазначених в (а), (б), (в), (г), (д) або (e). 3. Виділена нуклеїнова кислота, яка гібридизується з: (а) нуклеотидною послідовністю, яка кодує амінокислотну послідовність, що представлена в SEQ ID NO:2; (б) нуклеотидною послідовністю, яка кодує амінокислотну послідовність, що представлена в SEQ ID NO:2, у якій відсутній асоційований з нею сигнальний пептид; (в) нуклеотидною послідовністю, яка кодує позаклітинний домен поліпептиду, представленого в SEQ ID NO:2, включаючи асоційований з ним сигнальний пептид; 93875 16 (г) нуклеотидною послідовністю, яка кодує позаклітинний домен поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (д) нуклеотидною послідовністю, представленою в SEQ ID NO:1; (e) повнорозмірною кодуючою ділянкою нуклеотидної послідовності, представленої в SEQ ID NO:1; або (ж) комплементом послідовностей, зазначених в (а), (б), (в), (г), (д) або (e). 4. Нуклеїнова кислота за п. 3, гібридизація якої відбувається в строгих умовах. 5. Нуклеїнова кислота за п. 3, яка складається принаймні приблизно з 5 нуклеотидів. 6. Експресійний вектор, який містить нуклеїнову кислоту за п. 1, 2 або 3. 7. Експресійний вектор за п. 6, у якому нуклеїнова кислота функціонально зв'язана з контролюючими послідовностями, розпізнаваними клітиноюхазяїном, яка трансформована вектором. 8. Клітина-хазяїн, яка містить експресійний вектор за п. 7. 9. Клітина-хазяїн за п. 8. яка являє собою СНО-клітину, клітину Е. coli або дріжджову клітину. 10. Спосіб одержання поліпептиду, який полягає у тому, що культивують клітини-хазяїни за п. 8 в умовах, придатних для експресії поліпептиду, і виділяють поліпептид із клітинної культури. 11. Виділений поліпептид, амінокислотна послідовність якого принаймні на 80% ідентична амінокислотній послідовності: (а) поліпептиду, представленого в SEQ ID NO:2; (б) поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (в) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, включаючи асоційований з ним сигнальний пептид; (г) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (д) поліпептиду, який кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO: 1; або (e) поліпептиду, який кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1. 12. Виділений поліпептид, який має: (а) амінокислотну послідовність, що представлена в SEQ ID NO:2; (б) амінокислотну послідовність, що представлена в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; (в) амінокислотну послідовність позаклітинного домену, представлену в SEQ ID NO:2, включаючи асоційовану з нею послідовність сигнального пептиду; (г) амінокислотну послідовність позаклітинного домену, представлену в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; 17 (д) амінокислотну послідовність, яка кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO:1, або (e) амінокислотну послідовність, яка кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1. 13. Химерний поліпептид, який містить поліпептид за п. 11 або 12, злитий з гетерологічним поліпептидом. 14. Химерний поліпептид за п. 13, у якому гетерологічний поліпептид являє собою послідовність епітопу-мітки або Fc-ділянки імуноглобуліну. 15. Виділене антитіло, яке зв'язується з поліпептидом, амінокислотна послідовність якого принаймні на 80% ідентична амінокислотній послідовності: (а) поліпептиду, представленого в SEQ ID NO:2; (б) поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (в) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, включаючи асоційований з ним сигнальний пептид; (г) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (д) поліпептиду, який кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO:1; або (e) поліпептиду, який кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1. 16. Виділене антитіло, яке зв'язується з поліпептидом, який має: (а) амінокислотну послідовність, що представлена в SEQ ID NO:2; (б) амінокислотну послідовність, що представлена в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; (в) амінокислотну послідовність позаклітинного домену, представлену в SEQ ID NO:2, включаючи асоційовану з нею послідовність сигнального пептиду; (г) амінокислотну послідовність позаклітинного домену, представлену в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; (д) амінокислотну послідовність, яка кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO:1, або (e) амінокислотну послідовність, яка кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1. 17. Антитіло за п. 15 або 16, яке являє собою моноклональне антитіло. 18. Антитіло за п. 15 або 16, яке являє собою фрагмент антитіла. 19. Антитіло за п. 15 або 16, яке являє собою химерне антитіло або гуманізоване антитіло. 20. Антитіло за п. 15 або 16, яке кон'юговане з інгібуючим ріст агентом. 21. Антитіло за п. 15 або 16, яке кон'юговане із цитотоксичним агентом. 93875 18 22. Антитіло за п. 21, де цитотоксичний агент вибраний із групи, яка включає токсини, антибіотики, радіоактивні ізотопи та нуклеолітичні ферменти. 23. Антитіло за п. 21, де цитотоксичний агент являє собою токсин. 24. Антитіло за п. 23, де токсин вибраний із групи, яка включає майтансиноїд і каліхеаміцин. 25. Антитіло за п. 23, де токсин являє собою майтансиноїд. 26. Антитіло за п. 15 або 16, одержане в бактеріях. 27. Антитіло за п. 15 або 16, одержане в СНОклітинах. 28. Антитіло за п. 15 або 16, яке індукує загибель клітини, з якою воно зв'язується. 29. Антитіло за п. 15, що несе мітку, яка виявляється. 30. Виділена нуклеїнова кислота, яка має нуклеотидну послідовність, яка кодує антитіло за п. 15 або 16. 31. Експресійний вектор, який містить нуклеїнову кислоту за п. 30, функціонально зв'язану з контролюючими послідовностями, які розпізнаються клітиною-хазяїном, трансформованою вектором. 32. Клітина-хазяїн, яка містить експресійний вектор за п. 31. 33. Клітина-хазяїн за п. 32, яка являє собою СНО-клітину, клітину Е. coli або дріжджову клітину. 34. Спосіб одержання антитіла, який полягає у тому, що культивують клітину-хазяїна за п. 32 в умовах, придатних для експресії антитіла, і виділяють антитіло із клітинної культури. 35. Виділений олігопептид, який зв'язується з поліпептидом, амінокислотна послідовність якого принаймні на 80% ідентична амінокислотній послідовності: (а) поліпептиду, представленого в SEQ ID NO:2; (б) поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (в) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, включаючи асоційований з ним сигнальний пептид; (г) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (д) поліпептиду, який кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO:1; або (e) поліпептиду, який кодується повнорозмірною кодуючою ділянкою, нуклеотидної послідовності, яка представлена в SEQ ID NO:1. 36. Виділений олігопептид, який зв'язується з поліпептидом, який має: (а) амінокислотну послідовність, що представлена в SEQ ID NO:2; (б) амінокислотну послідовність, що представлена в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; (в) амінокислотну послідовність позаклітинного домену, представлену в SEQ ID NO:2, включаючи 19 асоційовану з нею послідовність сигнального пептиду; (г) амінокислотну послідовність позаклітинного домену, представлену в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; (д) амінокислотну послідовність, яка кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO: 1, або (e) амінокислотну послідовність, яка кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1. 37. Олігопептид за п. 35 або 36, який кон'югований з інгібуючим ріст агентом. 38. Олігопептид за п. 35 або 36, який кон'югований із цитотоксичним агентом. 39. Олігопептид за п. 38, де цитотоксичний агент вибраний із групи, яка включає токсини, антибіотики, радіоактивні ізотопи та нуклеолітичні ферменти. 40. Олігопептид за п. 38, де цитотоксичний агент являє собою токсин. 41. Олігопептид за п. 40, де токсин вибраний із групи, яка включає майтансиноїд і каліхеаміцин. 42. Олігопептид за п. 40, де токсин являє собою майтансиноїд. 43. Олігопептид за п. 35 або 36, який індукує загибель клітини, з якою він зв'язується. 44. Олігопептид за п. 35 або 36, що несе мітку, яка виявляється. 45. Органічна молекула, що зв'язується з ТАТ, яка зв'язується з поліпептидом, амінокислотна послідовність якого принаймні на 80% ідентична амінокислотній послідовності: (а) поліпептиду, представленого в SEQ ID NO:2; (б) поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (в) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, включаючи асоційований з ним сигнальний пептид; (г) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (д) поліпептиду, який кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO: 1; або (e) поліпептиду, який кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1. 46. Органічна молекула за п. 45, яка зв'язується з поліпептидом, який має: (а) амінокислотну послідовність, що представлена в SEQ ID NO:2; (б) амінокислотну послідовність, що представлена в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; (в) амінокислотну послідовність позаклітинного домену, представлену в SEQ ID NO:2, включаючи асоційовану з нею послідовність сигнального пептиду; (г) амінокислотну послідовність позаклітинного домену, представлену в SEQ ID NO:2, у якій відсу 93875 20 тня асоційована з нею послідовність сигнального пептиду; (д) амінокислотну послідовність, яка кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO:1, або (e) амінокислотну послідовність, яка кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1. 47. Органічна молекула за п. 45 або 46, яка кон'югована з інгібуючим ріст агентом. 48. Органічна молекула за п. 45 або 46, яка кон'югована із цитотоксичним агентом. 49. Органічна молекула за п. 48, де цитотоксичний агент вибраний із групи, яка включає токсини, антибіотики, радіоактивні ізотопи та нуклеолітичні ферменти. 50. Органічна молекула за п. 48, де цитотоксичний агент являє собою токсин. 51. Органічна молекула за п. 50, де токсин вибраний із групи, яка включає майтансиноїд і каліхеаміцин. 52. Органічна молекула за п. 50, де токсин являє собою майтансиноїд. 53. Органічна молекула за п. 45 або 46, яка індукує загибель клітини, з якою вона зв'язується. 54. Органічна молекула за п. 45 або 46, що несе мітку, яка виявляється. 55. Композиція, пропонована у винаході, яка містить: (а) поліпептид зап. 11; (б) поліпептид за п. 12; (в) химерний поліпептид за п. 13; (г) антитіло за п. 15; (д) антитіло за п. 16; (e) олігопептид за п. 35; (є) олігопептид за п. 36; (ж) органічну молекулу, яка зв'язується з ТАТ за п. 45; або (з) органічну молекулу, яка зв'язується ТАТ за п. 46; у сполученні з носієм. 56. Композиція, пропонована у винаході, за п. 55, у якій носій являє собою фармацевтично прийнятний носій. 57. Виріб, який являє собою: (а) контейнер; і (б) композицію, пропоновану у винаході, за п. 55, яка знаходиться в контейнері. 58. Виріб за п. 57, який додатково містить прикріплену до контейнера етикету або листівкувкладиш у контейнері, на якій наведений спосіб застосування композиції, пропонованої у винаході, для терапевтичного лікування або діагностичного виявлення раку. 59. Спосіб інгібування росту клітини, яка експресу є білок, амінокислотна послідовність якого принаймні на 80% ідентична амінокислотній послідовності: (а) поліпептиду, представленого в SEQ ID NO:2; (б) поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (в) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, включаючи асоційований з ним сигнальний пептид; 21 (г) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (д) поліпептиду, який кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO:1; або (e) поліпептиду, який кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1, який полягає у тому, що приводять у контакт клітину з антитілом, олігопептидом або органічною молекулою, які зв'язуються з білком, при цьому зв'язування антитіла, олігопептиду або органічної молекули з білком викликає інгібування росту клітини. 60. Спосіб за п. 59, у якому антитіло являє собою моноклональне антитіло. 61. Спосіб за п. 59, у якому антитіло являє собою фрагмент антитіла. 62. Спосіб за п. 59, у якому антитіло являє собою химерне або гуманізоване антитіло. 63. Спосіб за п. 59, у якому антитіло, олігопептид або органічну молекулу кон'югують з інгібуючим ріст агентом. 64. Спосіб за п. 59, у якому антитіло, олігопептид або органічну молекулу кон'югують із цитотоксичним агентом. 65. Спосіб за п. 64, у якому цитотоксичний агент вибирають із групи, яка включає токсини, антибіотики, радіоактивні ізотопи та нуклеолітичні ферменти. 66. Спосіб за п. 64, у якому цитотоксичний агент являє собою токсин. 67. Спосіб за п. 66, у якому токсин вибирають із групи, яка включає майтансиноїд і каліхеаміцин. 68. Спосіб за п. 66, у якому токсин являє собою майтансиноїд. 69. Спосіб за п. 59, у якому антитіло одержують у бактеріях. 70. Спосіб за п. 59, у якому антитіло одержують в СНО-клітинах. 71. Спосіб за п. 59, у якому клітина являє собою ракову клітину. 72. Спосіб за п. 71, у якому ракову клітину додатково піддають променевій терапії або обробці хіміотерапевтичним агентом. 73. Спосіб за п. 71, у якому ракову клітину вибирають із групи, яка включає клітину раку молочної залози, клітину колорактального раку, клітину раку легені, клітину раку яєчника, клітину раку центральної нервової системи, клітину раку печінки, клітину раку сечового міхура, клітину раку підшлункової залози, клітину раку шийки матки, клітину меланоми та лейкозну клітину. 74. Спосіб за п. 71, у якому рівень експресії білка в раковій клітині вищий в порівнянні зі здоровою клітиною, одержаною з такої ж тканини. 75. Спосіб за п. 59, який приводить до загибелі клітини. 76. Спосіб за п. 59, у якому білок має: (а) амінокислотну послідовність, що представлена в SEQ ID NO:2; (б) амінокислотну послідовність, що представлена в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; 93875 22 (в) амінокислотну послідовність позаклітинного домену, представлену в SEQ ID NO:2, включаючи асоційовану з нею послідовність сигнального пептиду; (г) амінокислотну послідовність позаклітинного домену, представлену в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; (д) амінокислотну послідовність, яка кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO:1, або (e) амінокислотну послідовність, яка кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO: 1. 77. Спосіб терапевтичного лікування ссавця, який страждає злоякісною пухлиною, яка містить клітини, що експресують білок, амінокислотна послідовність якого принаймні на 80% ідентична амінокислотній послідовності: (а) поліпептиду, представленого в SEQ ID NO:2; (б) поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (в) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, включаючи асоційований з ним сигнальний пептид; (г) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (д) поліпептиду, який кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO:1; або (e) поліпептиду, який кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1, який полягає у тому, що ссавцю вводять у терапевтично ефективній кількості антитіло, олігопептид або органічну молекулу, які зв'язуються з білком, що приводить до ефективного лікування ссавця. 78. Спосіб за п. 77, у якому антитіло являє собою моноклональне антитіло. 79. Спосіб за п. 77, у якому антитіло являє собою фрагмент антитіла. 80. Спосіб за п. 77, у якому антитіло являє собою химерне або гуманізоване антитіло. 81. Спосіб за п. 77, у якому антитіло, олігопептид або органічну молекулу кон'югують з інгібуючим ріст агентом. 82. Спосіб за п. 77, у якому антитіло, олігопептид або органічну молекулу кон'югують із цитотоксичним агентом. 83. Спосіб за п. 82, у якому цитотоксичний агент вибирають із групи, яка включає токсини, антибіотики, радіоактивні ізотопи та нуклеолітичні ферменти. 84. Спосіб за п. 82, у якому цитотоксичний агент являє собою токсин. 85. Спосіб за п. 84, у якому токсин вибирають із групи, яка включає майтансиноїд і каліхеаміцин. 86. Спосіб за п. 84, у якому токсин являє собою майтансиноїд. 87. Спосіб за п. 77, у якому антитіло одержують у бактеріях. 23 88. Спосіб за п. 77, у якому антитіло одержують в СНО-клітинах. 89. Спосіб за п. 77, у якому пухлину додатково піддають променевій терапії або обробці хіміотерапевтичним агентом. 90. Спосіб за п. 77, у якому пухлина являє собою пухлину молочної залози, колоректальну пухлину, пухлину легені, пухлину яєчника, пухлину центральної нервової системи, пухлину печінки, пухлину сечового міхура, пухлину підшлункової залози або пухлину шийки матки. 91. Спосіб за п. 77, у якому рівень експресії білка в ракових клітинах зазначеної пухлини вищий в порівнянні зі здоровою клітиною, одержаною з такої ж тканини. 92. Спосіб за п. 77, у якому білок має: (а) амінокислотну послідовність, що представлена в SEQ ID NO:2; (б) амінокислотну послідовність, що представлена в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; (в) амінокислотну послідовність позаклітинного домену, представлену в SEQ ID NO:2, включаючи асоційовану з нею послідовність сигнального пептиду; (г) амінокислотну послідовність позаклітинного домену, представлену в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; (д) амінокислотну послідовність, яка кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO:1, або (e) амінокислотну послідовність, яка кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1. 93. Спосіб виявлення присутності білка в зразку, який, як передбачається, містить зазначений білок, у якому амінокислотна послідовність білка принаймні на 80% ідентична амінокислотній послідовності: (а) поліпептиду, представленого в SEQ ID NO:2; (б) поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (в) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, включаючи асоційований з ним сигнальний пептид; (г) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (д) поліпептиду, який кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO:1; або (e) поліпептиду, який кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1, який полягає у тому, що приводять у контакт зразок з антитілом, олігопептидом або органічною молекулою, які зв'язуються з білком, і визначають зв'язування антитіла, олігопептиду або органічної молекули з білком у зразку, де зв'язування антитіла, олігопептиду або органічної молекули з білком свідчить про присутність білка в зразку. 93875 24 94. Спосіб за п. 93, у якому зразок містить клітину, яка, як передбачається, експресує зазначений білок. 95. Спосіб за п. 94, у якому клітина являє собою ракову клітину. 96. Спосіб за п. 93, у якому антитіло, олігопептид або органічна молекула несуть мітку, яка виявляється. 97. Спосіб за п. 93, у якому білок містить: (а) амінокислотну послідовність, що представлена в SEQ ID NO:2; (б) амінокислотну послідовність, що представлена в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; (в) амінокислотну послідовність позаклітинного домену поліпептиду, представлену в SEQ ID NO:2, включаючи асоційовану з нею послідовність сигнального пептиду; (г) амінокислотну послідовність позаклітинного домену поліпептиду, представлену в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; (д) амінокислотну послідовність, яка кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO:1, або (e) амінокислотну послідовність, яка кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1. 98. Спосіб діагностики наявності пухлини в ссавця, який полягає у тому, що визначають рівень експресії гена, який кодує білок, амінокислотна послідовність якого ідентична принаймні на 80% амінокислотній послідовності: (а) поліпептиду, представленого в SEQ ID NO:2; (б) поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (в) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, включаючи асоційований з ним сигнальний пептид; (г) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (д) поліпептиду, який кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO:1; або (e) поліпептиду, який кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1, у тест-зразку клітин тканини, одержаних з організму зазначеного ссавця, і в контрольному зразку клітин, взятих з такого ж типу тканини, для яких відомо, що вони являють собою здорові клітини, де більш високий рівень експресії зазначеного білка в тест-зразку в порівнянні з контрольним зразком свідчить про наявність пухлини в ссавця, з організму якого одержаний тест-зразок. 99. Спосіб за п. 98, у якому стадія визначення рівня експресії гена, що кодує зазначений білок, включає застосування олігонуклеотиду при здійсненні гібридизації in situ або ОТ-ПЛР-аналізу. 100. Спосіб за п. 98, у якому стадія визначення рівня експресії гена, який кодує зазначений білок, включає застосування антитіла в імуногістохіміч 25 ному аналізі або аналізі методом Вестернблоттингу. 101. Спосіб за п. 98, у якому білок містить: (а) амінокислотну послідовність, що представлена в SEQ ID NO:2; (б) амінокислотну послідовність, що представлена в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; (в) амінокислотну послідовність позаклітинного домену поліпептиду, представлену в SEQ ID NO:2, включаючи асоційовану з нею послідовність сигнального пептиду; (г) амінокислотну послідовність позаклітинного домену поліпептиду, представлену в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; (д) амінокислотну послідовність, яка кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO: 1, або (е) амінокислотну послідовність, яка кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1. 102. Спосіб діагностики наявності пухлини в ссавця, який полягає у тому, що приводять у контакт тест-зразок клітин тканини, одержаної з організму зазначеного ссавця, з антитілом, олігопептидом або органічною молекулою, яка зв'язується з білком, амінокислотна послідовність якого ідентична принаймні на 80% амінокислотній послідовності: (а) поліпептиду, представленого в SEQ ID NO:2; (б) поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (в) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, включаючи асоційований з ним сигнальний пептид; (г) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (д) поліпептиду, який кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO:1; або (e) поліпептиду, який кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1, і виявляють утворення комплексу між антитілом, олігопептидом або органічною молекулою та зазначеним білком у тест-зразку, де утворення комплексу свідчить про наявність пухлини в організмі ссавця. 103. Спосіб за п. 102, у якому антитіло, олігопептид або органічна молекула несуть мітку, яка виявляється. 104. Спосіб за п. 102, у якому тест-зразок клітин тканини одержують із організму індивідуума, у якого передбачається наявність злоякісної пухлини. 105. Спосіб за п. 102, у якому білок містить: (а) амінокислотну послідовність, що представлена в SEQ ID NO:2; (б) амінокислотну послідовність, що представлена в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; 93875 26 (в) амінокислотну послідовність позаклітинного домену поліпептиду, представлену в SEQ ID NO:2, включаючи асоційовану з нею послідовність сигнального пептиду; (г) амінокислотну послідовність позаклітинного домену поліпептиду, представлену в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; (д) амінокислотну послідовність, яка кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO:1, або (e) амінокислотну послідовність, яка кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1. 106. Спосіб лікування або попередження пов'язаного із проліферацією клітин захворювання, причиною якого є підвищений рівень експресії або активності білка, амінокислотна послідовність якого ідентична принаймні на 80% амінокислотній послідовності: (а) поліпептиду, представленого в SEQ ID NO:2; (б) поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (в) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, включаючи асоційований з ним сигнальний пептид; (г) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (д) поліпептиду, який кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO:1; або (e) поліпептиду, який кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1, який полягає у тому, що індивідууму, який потребує такого лікування, вводять в ефективній кількості антагоніст зазначеного білка, що приводить до ефективного лікування або попередження пов'язаного із проліферацією клітин захворювання. 107. Спосіб за п. 106, у якому пов'язане із проліферацією клітин захворювання являє собою рак. 108. Спосіб за п. 106, у якому антагоніст являє собою антитіло до поліпептиду ТАТ, ТАТзв'язуючий олігопептид, ТАТ-зв'язуючу органічну молекулу або антисмисловий олігопептид. 109. Спосіб зв'язування антитіла, олігопептиду або органічної молекули із клітиною, яка експресує білок, амінокислотна послідовність якого ідентична принаймні на 80% амінокислотній послідовності: (а) поліпептиду, представленого в SEQ ID NO:2; (б) поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (в) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, включаючи асоційований з ним сигнальний пептид; (г) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; 27 (д) поліпептиду, який кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO:1; або (e) поліпептиду, який кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1, який полягає у тому, що приводять у контакт клітину з антитілом, олігопептидом або органічною молекулою, які зв'язуються із зазначеним білком, і дають здійснитися зв'язуванню антитіла, олігопептиду або органічної молекули із зазначеним білком, що приводить до зв'язування антитіла, олігопептиду або органічної молекули із клітиною. 110. Спосіб за п. 109, у якому антитіло являє собою моноклональне антитіло. 111. Спосіб за п. 109, у якому антитіло являє собою фрагмент антитіла. 112. Спосіб за п. 109, у якому антитіло являє собою химерне або гуманізоване антитіло. 113. Спосіб за п. 109, у якому антитіло, олігопептид або органічну молекулу кон'югують з інгібуючим ріст агентом. 114. Спосіб за п. 109, у якому антитіло, олігопептид або органічну молекулу кон'югують із цитотоксичним агентом. 115. Спосіб за п. 114, у якому цитотоксичний агент вибирають із групи, яка включає токсини, антибіотики, радіоактивні ізотопи та нуклеолітичні ферменти. 116. Спосіб за п. 114, у якому цитотоксичний агент являє собою токсин. 117. Спосіб за п. 116, у якому токсин вибраний із групи, яка включає майтансиноїд і каліхеаміцин. 118. Спосіб за п. 116, у якому токсин являє собою майтансиноїд. 119. Спосіб за п. 109, у якому антитіло одержують у бактеріях. 120. Спосіб за п. 109, у якому антитіло одержують у СНО-клітинах. 121. Спосіб за п. 109, у якому клітина являє собою ракову клітину. 122. Спосіб за п. 121, у якому ракову клітину додатково піддають променевій терапії або обробці хіміотерапевтичним агентом. 123. Спосіб за п. 121, у якому ракову клітину вибирають із групи, яка включає клітину раку молочної залози, клітину колорактального раку, клітину раку легені, клітину раку яєчника, клітину раку центральної нервової системи, клітину раку печінки, клітину раку сечового міхура, клітину раку підшлункової залози, клітину раку шийки матки, клітину меланоми та лейкозну клітину. 124. Спосіб за п. 123, у якому рівень експресії білка вищий в раковій клітині в порівнянні зі здоровою клітиною, одержаною з такої ж тканини. 125. Спосіб за п. 109, який приводить до загибелі клітини. 126. Застосування нуклеїнової кислоти за будь-яким з пп. 1-5 або 30 для приготування лікарського засобу, призначеного для терапевтичного лікування або діагностичного виявлення раку. 127. Застосування нуклеїнової кислоти за будь-яким з пп. 1-5 або 30 для приготування лікарського засобу, призначеного для лікування пухлини. 93875 28 128. Застосування нуклеїнової кислоти за будь-яким з пп. 1-5 або 30 для приготування лікарського засобу, призначеного для лікування або попередження пов'язаного із проліферацією клітин захворювання. 129. Застосування експресійного вектора за будь-яким з пп. 6, 7 або 31 для приготування лікарського засобу, призначеного для терапевтичного лікування або діагностичного виявлення раку. 130. Застосування експресійного вектора за будь-яким з пп. 6, 7 або 31 для приготування лікарського засобу, призначеного для пухлини. 131. Застосування експресійного вектора за будь-яким з пп. 6, 7 або 31 для приготування лікарського засобу, призначеного для лікування або попередження пов'язаного із проліферацією клітин захворювання. 132. Застосування клітини-хазяїна за будьяким з пп. 8, 9, 32 або 33 для приготування лікарського засобу, призначеного для терапевтичного лікування або діагностичного виявлення раку. 133. Застосування клітини-хазяїна за будьяким з пп. 8, 9, 32 або 33 для приготування лікарського засобу, призначеного для лікування пухлини. 134. Застосування клітини-хазяїна за будьяким з пп. 8, 9, 32 або 33 для приготування лікарського засобу, призначеного для лікування або попередження пов'язаного із проліферацією клітин захворювання. 135. Застосування поліпептиду за будь-яким з пп. 11-14 для приготування лікарського засобу, призначеного для терапевтичного лікування або діагностичного виявлення раку. 136. Застосування поліпептиду за будь-яким з пп. 11-14 для приготування лікарського засобу, призначеного для пухлини. 137. Застосування поліпептиду за будь-яким з пп. 11-14 для приготування лікарського засобу, призначеного для лікування або попередження пов'язаного із проліферацією клітин захворювання. 138. Застосування антитіла за будь-яким з пп. 15-29 для приготування лікарського засобу, призначеного для терапевтичного лікування або діагностичного виявлення раку. 139. Застосування антитіла за будь-яким з пп. 15-29 для приготування лікарського засобу, призначеного для пухлини. 140. Застосування антитіла за будь-яким з пп. 15-29 для приготування лікарського засобу, призначеного для лікування або попередження пов'язаного із проліферацією клітин захворювання. 141. Застосування олігопептиду за будь-яким з пп. 35-44 для приготування лікарського засобу, призначеного для терапевтичного лікування або діагностичного виявлення раку. 142. Застосування олігопептиду за будь-яким з пп. 35-44 для приготування лікарського засобу, призначеного для лікування пухлини. 143. Застосування олігопептиду за будь-яким з пп. 35-44 для приготування лікарського засобу, призначеного для лікування або попередження пов'язаного із проліферацією клітин захворювання. 29 144. Застосування ТАТ-зв'язуючої органічної молекули за будь-яким з пп. 45-54 для приготування лікарського засобу, призначеного для терапевтичного лікування або діагностичного виявлення раку. 145. Застосування ТАТ-зв'язуючої органічної молекули за будь-яким з пп. 45-54 для приготування лікарського засобу, призначеного для лікування пухлини. 146. Застосування ТАТ-зв'язуючої органічної молекули за будь-яким з пп. 45-54 для приготування лікарського засобу, призначеного для лікування або попередження пов'язаного із проліферацією клітин захворювання. 147. Застосування композиції, пропонованої у винаході, за будь-яким з пп. 55 або 56 для приготування лікарського засобу, призначеного для терапевтичного лікування або діагностичного виявлення раку. 148. Застосування композиції, пропонованої у винаході, за будь-яким з пп. 55 або 56 для приготування лікарського засобу, призначеного для лікування пухлини. 149. Застосування композиції, пропонованої у винаході, за будь-яким з пп. 55 або 56 для приготування лікарського засобу, призначеного для лікування або попередження пов'язаного із проліферацією клітин захворювання. 150. Застосування виробу за будь-яким з пп. 57 або 58 для приготування лікарського засобу, призначеного для терапевтичного лікування або діагностичного виявлення раку. 151. Застосування виробу за будь-яким з пп. 57 або 58 для приготування лікарського засобу, призначеного для лікування пухлини. 152. Застосування виробу за будь-яким з пп. 57 або 58 для приготування лікарського засобу, призначеного для лікування або попередження пов'язаного із проліферацією клітин захворювання. 153. Спосіб інгібування росту клітини, у якому ріст зазначеної клітини принаймні частково залежить від потенціюючої ріст дії білка, амінокислотна послідовність якого ідентична принаймні на 80% амінокислотній послідовності: (а) поліпептиду, представленого в SEQ ID NO:2; (б) поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (в) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, включаючи асоційований з ним сигнальний пептид; (г) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (д) поліпептиду, який кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO: 1; або (e) поліпептиду, який кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1, який полягає у тому, що приводять у контакт зазначений білок з антитілом, олігопептидом або органічною молеку 93875 30 лою, які зв'язуються із зазначеним білком, що приводить до інгібування росту зазначеної клітини. 154. Спосіб за п. 153, у якому клітина являє собою ракову клітину. 155. Спосіб за п. 153, у якому зазначений білок експресується зазначеною клітиною. 156. Спосіб за п. 153, у якому зв'язування антитіла, олігопептиду або органічної молекули з білком здійснює антагоністичну дію на потенціюючу ріст клітини активність зазначеного білка. 157. Спосіб за п. 153, у якому зв'язування антитіла, олігопептиду або органічної молекули з білком індукує загибель зазначеної клітини. 158. Спосіб за п. 153, у якому антитіло являє собою моноклональне антитіло. 159. Спосіб за п. 153, у якому антитіло являє собою фрагмент антитіла. 160. Спосіб за п. 153, у якому антитіло являє собою химерне або гуманізоване антитіло. 161. Спосіб за п. 153, у якому антитіло, олігопептид або органічну молекулу кон'югують з інгібуючим ріст агентом. 162. Спосіб за п. 153, у якому антитіло, олігопептид або органічну молекулу кон'югують із цитотоксичним агентом. 163. Спосіб за п. 162, у якому цитотоксичний агент вибирають із групи, яка включає токсини, антибіотики, радіоактивні ізотопи та нуклеолітичні ферменти. 164. Спосіб за п. 162, у якому цитотоксичний агент являє собою токсин. 165. Спосіб за п. 164, у якому токсин вибирають із групи, яка включає майтансиноїд і каліхеаміцин. 166. Спосіб за п. 164, у якому токсин являє собою майтансиноїд. 167. Спосіб за п. 153, у якому антитіло одержують у бактеріях. 168. Спосіб за п. 153, у якому антитіло одержують у СНО-клітинах. 169. Спосіб за п. 153, у якому білок містить: (а) амінокислотну послідовність, що представлена в SEQ ID NO:2; (б) амінокислотну послідовність, що представлена в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; (в) амінокислотну послідовність позаклітинного домену поліпептиду, представлену в SEQ ID NO:2, включаючи асоційовану з нею послідовність сигнального пептиду; (г) амінокислотну послідовність позаклітинного домену поліпептиду, представлену в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; (д) амінокислотну послідовність, яка кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO:1, або (e) амінокислотну послідовність, яка кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1. 170. Спосіб терапевтичного лікування пухлини в ссавця, у якому ріст пухлини принаймні частково залежить від потенціюючої ріст дії білка, амінокислотна послідовність якого принаймні на 80% ідентична амінокислотній послідовності: 31 (а) поліпептиду, представленого в SEQ ID NO:2; (б) поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (в) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, включаючи асоційований з ним сигнальний пептид; (г) позаклітинного домену поліпептиду, представленого в SEQ ID NO:2, у якому відсутній асоційований з ним сигнальний пептид; (д) поліпептиду, який кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO: 1; або (e) поліпептиду, який кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1, який полягає у тому, що приводять у контакт зазначений білок з антитілом, олігопептидом або органічною молекулою, які зв'язуються із зазначеним білком, що приводить до ефективного лікування пухлини. 171. Спосіб за п. 170, у якому білок експресується клітинами пухлини. 172. Спосіб за п. 170, у якому зв'язування антитіла, олігопептиду або органічної молекули з білком здійснює антагоністичну дію на потенціюючу ріст клітини активність зазначеного білка. 173. Спосіб за п. 170, у якому антитіло являє собою моноклональне антитіло. 174. Спосіб за п. 170, у якому антитіло являє собою фрагмент антитіла. 175. Спосіб за п. 170, у якому антитіло являє собою химерне або гуманізоване антитіло. 176. Спосіб за п. 170, у якому антитіло, олігопептид або органічну молекулу кон'югують з інгібуючим ріст агентом. 177. Спосіб за п. 170, у якому антитіло, олігопептид або органічну молекулу кон'югують із цитотоксичним агентом. 178. Спосіб за п. 177, у якому цитотоксичний агент вибирають із групи, яка включає токсини, антибіотики, радіоактивні ізотопи та нуклеолітичні ферменти. 179. Спосіб за п. 177, у якому цитотоксичний агент являє собою токсин. 180. Спосіб за п. 179, у якому токсин вибирають із групи, яка включає майтансиноїд і каліхеаміцин. 181. Спосіб за п. 179, у якому токсин являє собою майтансиноїд. 182. Спосіб за п. 170, у якому антитіло одержують у бактеріях. 183. Спосіб за п. 170, у якому антитіло одержують у СНО-клітинах. 184. Спосіб за п. 170, у якому білок містить: (а) амінокислотну послідовність, що представлена в SEQ ID NO:2; (б) амінокислотну послідовність, що представлена в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; (в) амінокислотну послідовність позаклітинного домену поліпептиду, представлену в SEQ ID NO:2, включаючи асоційовану з нею послідовність сигнального пептиду; 93875 32 (г) амінокислотну послідовність позаклітинного домену поліпептиду, представлену в SEQ ID NO:2, у якій відсутня асоційована з нею послідовність сигнального пептиду; (д) амінокислотну послідовність, яка кодується нуклеотидною послідовністю, яка представлена в SEQ ID NO:1, або (e) амінокислотну послідовність, яка кодується повнорозмірною кодуючою ділянкою нуклеотидної послідовності, яка представлена в SEQ ID NO:1. 186. Виділене антитіло, яке зв'язується з тим же епітопом, з яким зв'язується антитіло, яке продукується будь-якою із клітинних ліній гібридом, представлених у таблиці 11. 187. Антитіло за п. 186, яке являє собою моноклональне антитіло. 188. Антитіло за п. 186, яке являє собою фрагмент антитіла. 189. Антитіло за п. 186, яке являє собою химерне або гуманізоване антитіло. 190. Антитіло за п. 186, кон'юговане з інгібуючим ріст агентом. 191. Антитіло за п. 186, кон'юговане із цитотоксичним агентом. 192. Антитіло за п. 191, у якому цитотоксичний агент вибраний із групи, яка включає токсини, антибіотики, радіоактивні ізотопи та нуклеолітичні ферменти. 193. Антитіло за п. 191, у якому цитотоксичний агент являє собою токсин. 194. Антитіло за п. 193, у якому токсин вибраний із групи, яка включає майтансиноїд і каліхеаміцин. 195. Спосіб за п. 193, у якому токсин являє собою майтансиноїд. 196. Антитіло за п. 186, яке одержують у бактеріях. 197. Антитіло за п. 186, яке одержують у СНОклітинах. 198. Антитіло за п. 186, яке індукує загибель клітини, з якою воно зв'язується. 199. Антитіло за п. 186, що несе мітку, яка виявляється. 200. Антитіло за п. 186, яке містить принаймні одну гіперваріабельну ділянку будь-якого антитіла, яке продукується будь-якою із клітинних ліній гібридом, представлених у таблиці 11. 201. Моноклональне антитіло, яке продукується будь-якою із клітинних ліній гібридом, представлених у таблиці 11. 202. Клітина гібридоми, яка продукує моноклональне антитіло, яке зв'язується з ТАТполіпептидом. 203. Спосіб ідентифікації антитіла, яке зв'язується з епітопом, який зв'язується з антитілом, яке продукується будь-якою із клітинних ліній гібридом, представлених у таблиці 11, який полягає у тому, що визначають здатність першого антитіла блокувати зв'язування другого антитіла, яке продукується будь-якою із клітинних ліній гібридом, представлених у таблиці 11, з ТАТ-поліпептидом, де здатність першого антитіла блокувати зв'язування другого антитіла з ТАТ-поліпептидом принаймні на 40% і при використанні однакових концентрацій антитіл свідчить про те, що перше 33 антитіло має здатність зв'язуватися з епітопом, з яким зв'язується друге антитіло. Інші варіанти здійснення даного винаходу стануть очевидні спеціалісту в даній галузі після ознайомлення з даним описом. Стислий опис креслень На кресленнях показано: на Фіг. 1А-Д - нуклеотидна послідовність (SEQ ID NO:1) кДНК ТАТ10772, де SEQ ID NO:1 являє собою клон, позначений у даному описі як «DNA772»; на Фіг. 2А-Б - амінокислотна послідовність (SEQ ID NO:2), виведена на основі кодуючої послідовності, SEQ ID NO:1, представленої на Фіг. 1; на Фіг. 3 - порівняльний аналіз первинної структури амінокислотних послідовностей наступних варіабельних ділянок легких ланцюгів: консенсусної послідовності людського легкого ланцюга підгрупи І (huKI; SEQ ID NO:3), мишачого антитіла 11D10 до ТАТ10772 (mu11D10-L; SEQ ID NO:4) і антитіла 11D10 до ТАТ10772, яке має трансплантовані (трансплантат) «гуманізовані» ділянки (11D10-трансплантат; SEQ ID NO:5); на Фіг. 4 - порівняльний аналіз первинної структури амінокислотних послідовностей наступних варіабельних ділянок важких ланцюгів: консенсусної послідовності людського важкого ланцюга підгрупи III (hum III; SEQ ID NO:6), мишачого антитіла 11D10 до ТАТ10772 (mu11D10-H; SEQ ID NO:7) і антитіла 11D10 до ТАТ10772, яке має трансплантовані «гуманізовані» ділянки (11D10трансплантат; SEQ ID NO:8); на Фіг. 5 - порівняльний аналіз первинної структури амінокислотних послідовностей наступних варіабельних ділянок легких ланцюгів: консенсусної послідовності людського легкого ланцюга підгрупи І (huKI; SEQ ID NO:3), мишачого антитіла 3А5 до ТАТ10772 (mu3A5-L; SEQ ID NO:9), і антитіла 3А5 до ТАТ10772, яке має трансплантовані «гуманізовані» ділянки (3А5-трансплантат; SEQ ID NO:10); на Фіг. 6А-Б - порівняльний аналіз первинної структури амінокислотних послідовностей наступних варіабельних ділянок важких ланцюгів: консенсусної послідовності людського важкого ланцюга підгрупи III (hum III; SEQ ID NO:6), мишачого антитіла 3А5 до ТАТ10772 (mu3A5-H; SEQ ID NO:11), антитіла 3A5 до ТАТ10772, яке має трансплантовані «гуманізовані» ділянки, «L-варіант» (3A5.Lтрансплантат; SEQ ID NO:12) і антитіла 3A5 до TAT10772, яке має трансплантовані «гуманізовані» ділянки, «F-варіант» (3A5.F-трансплантат; SEQ ID NO:13); на Фіг. 7 - різні послідовності HVR-L1 (SEQ ID NO:14-34) відібраних виведених з 11D10 антитіл з дозрілою афінність; на Фіг. 8 - різні послідовності HVR-L2 (SEQ ID NO: 35-58) відібраних виведених з 11D10 антитіл з дозрілою афінність; на Фіг. 9 - різні послідовності HVR-L3 (SEQ ID NO: 59-73) відібраних виведених з 11D10 антитіл з дозрілою афінність; на Фіг. 10 - різні послідовності HVR-H1 (SEQ ID NO: 74-93) відібраних виведених з 11D10 антитіл з дозрілою афінність; 93875 34 на Фіг. 11 - різні послідовності HVR-H2 (SEQ ID NO: 94-112) відібраних виведених з 11D10 антитіл з дозрілою афінність; на Фіг. 12 - різні послідовності HVR-H3 (SEQ ID NO: 113-118) відібраних виведених з 11D10 антитіл з дозрілою афінність; на Фіг. 13 - послідовність HVR-L1 (SEQ ID NO:119) відібраного виведеного з 3A5 антитіла з дозрілою афінність; на Фіг. 14 - різні послідовності HVR-L2 (SEQ ID NO:120-121) відібраних виведених з 3A5 антитіл з дозрілою афінність; на Фіг. 15 - послідовність HVR-L3 (SEQ ID NO:122) відібраного виведеного з 3A5 антитіла з дозрілою афінність; на Фіг. 16 - послідовність HVR-H1 (SEQ ID NO:123) відібраного виведеного з 3A5 антитіла з дозрілою афінність; на Фіг. 17 - різні послідовності HVR-H2 (SEQ ID NO: 124-127) відібраних виведених з 3А5 антитіл з дозрілою афінність; на Фіг. 18А-Б - різні послідовності (SEQ ID NO:128-183) відібраних виведених з 3A5 антитіл з дозрілою афінність; на Фіг. 19 - приклади послідовностей акцепторних людських консенсусних каркасних ділянок, які можна використовувати для втілення на практиці даного винаходу, з наступними послідовностямиідентифікаторами: консенсусна каркасна ділянка людської VH підгрупи І мінус CDR за Кеботом (SEQ ID NO:184), консенсусна каркасна ділянка людської VH підгрупи І мінус подовжені гіперваріабельні ділянки (SEQ ID NO: 185-187), консенсусна каркасна ділянка VH підгрупи II мінус CDR за Кеботом (SEQ ID NO:188), консенсусна каркасна ділянка людської VH підгрупи II мінус подовжені гіперваріабельні ділянки (SEQ ID NO: 189-191), консенсусна каркасна ділянка людської VH підгрупи III мінус CDR за Кеботом, «L-варіант» (SEQ ID NO:192) і консенсусна каркасна ділянка людської VH підгрупи III мінус CDR за Кеботом, «F-варіант» (SEQ ID NO:193); на Фіг. 20 - приклади послідовностей акцепторних людських консенсусних каркасних ділянок, які можна використовувати для втілення на практиці даного винаходу, з наступними послідовностямиідентифікаторами: консенсусна каркасна ділянка людської VL-капа підгрупи І мінус CDR за Кеботом (SEQ ID NO:194), консенсусна каркасна ділянка людської VL-капа підгрупи II мінус CDR за Кеботом (SEQ ID NO:195), консенсусна каркасна ділянка людської VL-капа підгрупи III мінус CDR за Кеботом (SEQ ID NO:196) консенсусна каркасна ділянка людської VL-капа підгрупи IV мінус CDR за Кеботом (SEQ ID NO: 197); на Фіг. 21А-Б - повні послідовності варіабельних ділянок важких ланцюгів наступних антитіл: 3A5vl (SEQ ID NO:198), 3A5v2 (SEQ ID NO:199), 3A5v3 (SEQ ID NO:200), 3A5v4 (SEQ ID NO:201), 3A5v5 (SEQ ID NO:202), 3A5v6 (SEQ ID NO:203), 3A5v7 (SEQ ID NO:204), 3A5v8 (SEQ ID NO:205), 3A5v1b.52 (SEQ ID NO:206), 3A5v1b.54 (SEQ ID NO:207), 3A5v4b.52 (SEQ ID NO:208) і 3A5v4b.54 (SEQ ID NO:209). Всі ці антитіла містять амінокис 35 лотну послідовність, що представлена в SEQ ID NO:3, варіабельної ділянки легкого ланцюга huKI; на Фіг. 22 - повні послідовності варіабельних ділянок легких ланцюгів (SEQ ID NO: 210-211), застосовувані для створення конкретних антитіл до ТАТ10772, представлених у даному описі; на Фіг. 23 - дані про здатності різних гуманізованих антитіл 3A5 інгібувати зв'язування міченого за допомогою рутенію химерного 3A5 з біотинілованим 5'-доменом поліпептиду-мішені ТАТ10772. «h2H7 ctr» означає антитіло, застосовуване як негативний контроль, яке не має здатність специфічно зв'язуватися з TAT10772; на Фіг. 24 - дані про здатності різних гуманізованих антитіл 3A5 інгібувати зв'язування міченого за допомогою рутенію химерного 3A5 з біотинілованим поліпептидом СА125. «h2H7 ctr» означає антитіло, застосовуване як негативний контроль, яке не має здатність специфічно зв'язуватися з TAT10772; на Фіг. 25 - результати, одержані за допомогою ELISA з використанням різних гуманізованих антитіл 3A5, для оцінки зв'язування із OVCAR-3клітинами. «h2H7 ctr» означає антитіло, застосовуване як негативний контроль, яке не має здатність специфічно зв'язуватися з TAT10772; на Фіг. 26 - дані про проліферації in vitro ОVCAR-3-клітин (які ендогенно експресують поліпептид TAT10772) після обробки химерними антитілами 11D10-vc-MMAF або 3A5-VC-MMAF; на Фіг. 27 - дані про проліферації in vitro ОVCAR-3-клітин (які ендогенно експресують поліпептид TAT10772) після обробки химерними антитілами 11D10-vc-MMAE або 3A5-VC-MMAE; на Фіг. 28 - дані про проліферації in vitro ОVCAR-3-клітин (які ендогенно експресують поліпептид TAT10772) після обробки химерними антитілами 11D10-MC-MMAF або 3A5-MC-MMAF; на Фіг. 29 - дані про проліферації in vitro PC3клітин, трансфектованих вектором, який надає здатність цим клітинам експресувати поліпептид ТАТ10772 (PC3/А5.3В2), або РС3-клітин, які не експресують полі пептид ТАТ10772 (PC3/neo), після обробки химерними антитілами 11D10-vcMMAF або 3A5-VC-MMAF; на Фіг. 30 - дані про проліферації in vitro РС3клітин, трансфектованих вектором, який надає здатність цим клітинам експресувати поліпептид TAT10772 (PC3/А5.3В2), або РС3-клітин, які не експресують поліпептид TAT10772 (PC3/neo), після обробки химерними антитілами 11D10-vc-PABММАЕ або 3A5-VC-PAB-MMAE; на Фіг. 31 - дані про проліферації in vitro РС3клітин, трансфектованих вектором, який надає здатність цим клітинам експресувати поліпептид ТАТ10772 (PC3/А5.3В2), або РС3-клітин, які не експресують поліпептид TAT10772 (PC3/nео), після обробки химерними антитілами 11D10-MCMMAF або 3A5-MC-MMAf; на Фіг. 32 - одержані in vivo дані про середній об'єм пухлин, одержаних з PC3/А5.3В2 пухлин (модель, заснована на застосуванні підшкірної ін'єкції) після обробки різними кон'югованими з токсинами химерними антитілами 3A5, контрольними антитілами або тільки наповнювачем; 93875 36 на Фіг. 33 - одержані in vivo дані про середній об'єм пухлин, одержаних з ОVCAR-3-пухлин (модель, створена на мишах лінії SCID з вродженою відсутністю природних клітин-кілерів після трансплантації в жирове тіло молочної залози), після обробки різними кон'югованими з токсинами химерними антитілами 3A5, контрольними антитілами або тільки наповнювачем; на Фіг. 34 - одержані in vivo дані про середній об'єм пухлин, одержаних з ОVCAR-3-пухлин (модель, створена на мишах лінії SCID з вродженою відсутністю природних клітин-кілерів після трансплантації в жирове тіло молочної залози), після обробки різними кон'югованими з токсинами химерними антитілами 3A5, контрольними антитілами або тільки наповнювачем; на Фіг. 35 - одержані in vivo дані про середній об'єм пухлин, одержаних з ОVCAR-3-пухлин (модель, створена на мишах лінії SCID з вродженою відсутністю природних клітин-кілерів після трансплантації в жирове тіло молочної залози), після обробки різними кон'югованими з токсинами химерними антитілами 3A5, контрольними антитілами або тільки наповнювачем; на Фіг. 36 - одержані in vivo дані про середній об'єм пухлин, одержаних з PC3/А5.3В2 пухлин (пухлини, одержані в результаті введення ксенотрансплантату безтимусним мишам, 10 мільйонів клітин на мишу), після обробки різними кон'югованими з токсинами химерними антитілами 3A5, контрольними антитілами або тільки наповнювачем; на Фіг. 37 - одержані in vivo дані про середній об'єм пухлин, одержаних з OVCAR-3 пухлин (модель, створена на мишах лінії SCID з вродженою відсутністю природних клітин-кілерів після трансплантації в жирове тіло молочної залози), після обробки різними кон'югованими з токсинами химерними антитілами 3A5, контрольними антитілами або тільки наповнювачем. Докладний опис кращих варіантів здійснення винаходу І. Визначення Поняття «ТАТ-поліпептид, поліпептид ТАТ» і «ТАТ», як їх використовують у контексті даного опису, і у випадку, коли за ними випливає чисельне значення, належать до різних поліпептидів, при цьому повне позначення (тобто ТАТ/номер) стосується конкретних поліпептидних послідовностей, як вони позначені в контексті даного опису. Поняття «ТАТ/номер поліпептиду» і «ТАТ/номер», де «номер» являє собою фактичне чисельне позначення, застосовуване в даному описі, стосуються поліпептидів з нативною послідовністю, варіантів поліпептидів і фрагментів нативної послідовності поліпептидів і варіантів поліпептидів (які визначені далі в даному описі). ТАТ-поліпептиди, пропоновані в даному винаході, можна виділяти з різних джерел, таких як людські тканини різних типів або інші джерела, або одержувати за допомогою рекомбінації або методів синтезу. Поняття «ТАТполіпептид» стосується кожного індивідуального поліпептиду ТАТ/номер, пропонованого в даному винаході. У даному описі будь-яке згадування «ТАТ-поліпептиду» стосується кожного з поліпептидів індивідуально або в сполученні один з од 37 ним. Наприклад, опис одержання, очищення, дериватизації, одержання антитіл до нього, одержання ТАТ-зв'язуючих олігопептидів, одержання ТАТ-зв'язуючих молекул, введення, композицій, що містять його, лікування хвороби й т.д., стосується кожного поліпептиду, пропонованого у винаході, індивідуально. Поняття «ТАТ-поліпептид» включає також варіанти поліпептидів ТАТ/номер, пропонованих у даному винаході. Поняття «нативна послідовність ТАТполіпептиду» означає поліпептид, який має однакову амінокислотну послідовність із відповідним ТАТ-поліпептидом, який має природне походження. Такі нативні послідовності ТАТ-поліпептидів можуть мати природне походження або їх можна одержувати рекомбінантно або шляхом синтезу. Поняття «нативна послідовність ТАТ-поліпептиду» стосується конкретно укорочених або секретуючих форм, які зустрічаються в природних умовах, специфічного ТАТ-поліпептиду (наприклад, послідовність позаклітинного домену), варіантних форм, які зустрічаються в природних умовах (наприклад, форм, одержаних у результаті альтернативного сплайсингу) і алельних варіантів поліпептиду, які зустрічаються в природних умовах. У деяких варіантах здійснення винаходу нативна послідовність ТАТ-поліпептидів, пропонованих у винаході, являє собою зрілу або повнорозмірну послідовність нативних поліпептидів, які містять повнорозмірні амінокислотні послідовності, представленінижче на кресленнях. Стартовий і стоп-кодони (якщо вони позначені) на кресленнях виділені жирним шрифтом і підкреслені. Залишки нуклеїнових кислот, позначені «N» або «X» на представлених нижче кресленнях, означають залишок будь-якої нуклеїнової кислоти. Однак, хоча на прикладених кресленнях показано, що ТАТ-поліпептид починається із залишків метіоніну, які позначені на кресленнях, як амінокислота в положенні 1, представляється можливим застосовувати інші залишки метіоніну, локалізовані на кресленнях проти або за ходом транскрипції відносно амінокислоти в положенні 1, як стартовий амінокислотний залишок ТАТполіпептидів. Поняття «позаклітинний домен» ТАТполіпептиду або «ECD» стосується форми ТАТполіпептиду, практично вільної від трансмембранних і цитоплазматичних доменів. Як правило, в ECD ТАТ-поліпептиду вміст трансмембранних і/або цитоплазматичних доменів повинен становити менш ніж 1% і переважно вміст зазначених доменів повинен становити менш ніж 0,5%. Повинно бути очевидно, що будь-які трансмембранні домени, ідентифіковані в ТАТ-поліпептидах, пропонованих у даному винаході, виявлені відповідно до критеріїв, які звичайно застосовують у даній галузі для ідентифікації такого типу гідрофобного домену. Точні межі трансмембранного домену можуть варіювати, але найбільш прийнятно не більш ніж приблизно на 5 амінокислот на будь-якому кінці домену, спочатку ідентифікованого в даному описі. Таким чином, необов'язково позаклітинний домен ТАТ-поліпептиду може містити приблизно 5 або меншу кількість амінокислот на будь-якому боці межі трансмембранного домену/позаклітинного 93875 38 домену, як описано в прикладах або специфікації, і такі поліпептиди, які містять або не містять сигнальний пептид, і нуклеїнові кислоти, які їх кодують підпадають під обсяг даного винаходу. Приблизна локалізація «сигнальних пептидів» різних ТАТ-поліпептидів, пропонованих у винаході, може бути позначена в даній специфікації і/або в прикладених кресленнях. Однак слід зазначити, що С-кінцева межа сигнального пептиду може варіювати, але найбільш краще не більш ніж приблизно на 5 амінокислот на будь-якому боці С-кінцевої межі сигнального пептиду, спочатку ідентифікованого в даному описі, при цьому С-кінцеву границю сигнально пептиду можна ідентифікувати відповідно до критеріїв, які звичайно застосовують у даній галузі для ідентифікації елемента такого типу амінокислотної послідовності (наприклад, Nielsen та ін., Prot. Eng. 10, 1997, сс. 1-6 von Heinje та ін., Nucl. Acids. Res. 14, 1986, cc. 4683-4690). Однак відомо також, що в деяких випадках відщеплення сигнальної послідовності від секретуючого поліпептиду не є повністю однаковим, що приводить до утворення більш одного виду, який секретується. Ці зрілі поліпептиди, від яких сигнальний пептид відщеплений у межах не більш ніж приблизно 5 амінокислот на будь-якому боці С-кінцевої межі сигнального пептиду, ідентифікованого в даному описі, і полінуклеотиди, що їх кодують, підпадають під обсяг даного винаходу. Поняття «варіант ТАТ-поліпептид» означає ТАТ-поліпептид, переважно активний ТАТполіпептид, як він визначений у контексті даного опису, амінокислотна послідовність якого ідентична принаймні приблизно на 80% повнорозмірній нативній послідовності ТАТ-поліпептиду, що представлена в даному описі, послідовності ТАТполіпептиду, позбавленої сигнального пептиду, представленої в даному описі, послідовності позаклітинного домену ТАТ-поліпептиду із сигнальним пептидом або без нього, як вони представлені в даному описі, або будь-якого іншого фрагмента повнорозмірної послідовності ТАТ-поліпептиду, представленого у даному описі (такі як послідовності, які кодуються нуклеїновою кислотою, яка являє собою тільки частину повної кодуючої послідовності повнорозмірного ТАТ-поліпептиду). Такі варіанти ТАТ-поліпептиду включають, наприклад, ТАТ-поліпептиди, у яких один або декілька амінокислотних залишків додані або вилучені в результаті делеції на N- або С-кінці повнорозмірної нативної амінокислотної послідовності. Як правило, амінокислотна послідовність варіанта ТАТполіпептиду повинна бути ідентична принаймні приблизно на 80%, в іншому варіанті амінокислотна послідовність принаймні приблизно на 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 або 99% ідентична повнорозмірній нативній послідовності ТАТ-поліпептиду, представленій в даному описі, послідовності ТАТ-поліпептиду, у якій відсутній сигнальний пептид, представленій в даному описі, позаклітинного домену ТАТполіпептиду із сигнальним пептидом або без нього, представленого в даному описі, або будь-якого іншого конкретного фрагменту повнорозмірної послідовності ТАТ-поліпептиду, представленого в 39 даному описі. Як правило, варіанти ТАТполіпептидів складаються принаймні приблизно з 10 амінокислот, в іншому варіанті принаймні приблизно з 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600 амінокислот або більше. Необов'язково варіанти ТАТполіпептидів повинні мати не більше однієї консервативної амінокислотної заміни в порівнянні з нативною послідовністю ТАТ-поліпептиду, в іншому варіанті не більше 2, 3, 4, 5, 6, 7, 8, 9 або 10 консервативних амінокислотних замін у порівнянні з нативню послідовністю ТАТ-поліпептиду. Поняття «відсоток (%) ідентичності амінокислотних послідовностей» відносно послідовностей ТАТ-поліпептидів, представлених у даному описі, означає відсоток амінокислотних залишків у розглянутій послідовності (послідовності-кандидаті), ідентичних амінокислотним залишкам у конкретній послідовності ТАТ-поліпептиду, після лінеаризації послідовностей і інтродукції при необхідності проломів для досягнення максимального відсотка ідентичності послідовностей, і при цьому будь-які консервативні заміни не розглядаються при оцінці ідентичності послідовностей. Порівняльний аналіз первинної структури з метою визначення відсотка ідентичності амінокислотних послідовностей можна здійснювати різними шляхами, які відомі спеціалістам у даній ділянки, наприклад, з використанням доступних наукової громадськості комп'ютерних програм, таких як BLAST, BLAST-2, ALIGN або Megalign (DNASTAR). Спеціалісти в даній галузі можуть визначати відповідні параметри для здійснення порівняльного аналізу первинної структури, використовуючи будь-які алгоритми, які необхідні для найбільш повного порівняльного аналізу первинної структури відносно повнорозмірних послідовностей, з якими проводять порівняння. Однак для цілей даного опису відсоток (%) ідентичності амінокислотних послідовностей одержують, використовуючи призначену для порівняння послідовностей комп'ютерну програму ALIGN-2, повний вихідний код для програми ALIGN-2 представлений нижче в таблиці 1. Призначена для порівняння послідовностей комп'ютерна програма ALIGN-2 розроблена на фірмі Genentech, Inc., і вихідний код, представлений нижче в таблиці 1, зданий на зберігання разом з документацією для користувачів в U.S. Copyright Office, Washington D.C., 20559, де він зареєстрований під номером U.S. Copyright Registration No. TXU510087. Наукова громадськість може одержати програму ALIGN-2 від фірми Genentech, Inc., Південний Сан-Франциско, шт. Каліфорнія або може компілювати її на основі вихідного коду, представленого нижче в таблиці 1. Програму ALIGN-2 слід компілювати для застосування в оперативній системі UNIX, бажано цифровій UNIX V4.0D. Всі параметри для порівняння послідовностей закладені в програму ALIGN-2 і не повинні змінюватися. 93875 40 У ситуаціях, коли для порівняння амінокислотних послідовностей застосовують ALIGN-2, відсоток ідентичності амінокислотних послідовностей для даної амінокислотної послідовності А відносно, у порівнянні з або до даної амінокислотної послідовності Б (в іншому варіанті це можна сформулювати як те, що дана амінокислотна послідовність А має певний відсоток ідентичності амінокислотної послідовності відносно, у порівнянні з або до даної амінокислотної послідовності Б) розраховують у такий спосіб: 100X/Y де X означає кількість амінокислотних залишків, визнаних ідентичними при порівнянні первинної структури послідовностей А і Б з використанням програми порівняльного аналізу первинної структури послідовностей ALIGN-2, і де Υ означає кількість амінокислотних залишків у Б. Повинно бути очевидно, що якщо довжина амінокислотної послідовності А не дорівнює довжині амінокислотної послідовності Б, то відсоток ідентичності амінокислотної послідовності А відносно Б не повинен дорівнювати відсотку ідентичності амінокислотної послідовності Б відносно А. Як приклади розрахунків відсотка ідентичності амінокислотних послідовностей за допомогою зазначеного методу в таблицях 2 і 3 продемонстровано як розраховувати відсоток ідентичності амінокислотних послідовностей амінокислотної послідовності, позначеної як «білок, з яким проводять порівняння», відносно амінокислотної послідовності, позначеної як «ТАТ», де «ТАТ» означає амінокислотну послідовність гіпотетичного ТАТ-поліпептиду, який являє інтерес, «білок, з яким проводять порівняння» означає амінокислотну послідовність поліпептиду, з яким слід порівнювати «ТАТ»поліпептид, що являє інтерес, а «Φ», «Υ» і «Z» кожний означає різні гіпотетичні амінокислотні залишки. Якщо спеціально не зазначено інше, всі величини відсотка ідентичності амінокислотних послідовностей, зазначені в даному описі, одержують відповідно до методу, описаного в попередньому параграфі, за допомогою комп'ютерної програми ALIGN-2. Поняття «варіант полінуклеотиду ТАТ» або «варіант нуклеотидної послідовності ТАТ» означає молекулу нуклеїнової кислоти, яка кодує ТАТполіпептид, переважно активний ТАТ-поліпептид, як він визначений у контексті даного опису, нуклеотидна послідовність якого ідентична принаймні приблизно на 80% нуклеотидній послідовності, яка кодує повнорозмірну нативну послідовність ТАТполіпептиду, представлену в даному описі, повнорозмірну нативну послідовність ТАТ-поліпептиду, позбавлену сигнального пептиду, представлену в даному описі, послідовність позаклітинного домену ТАТ-поліпептиду із сигнальним пептидом або без нього, як вони представлені в даному описі, або будь-який інший фрагмент повнорозмірної послідовності ТАТ-поліпептиду, представлений у даному описі (такі як послідовності, що кодуються нуклеїновою кислотою, яка являє собою тільки частину повної кодуючої послідовності повнороз 41 мірного ТАТ-поліпептиду). Як правило, нуклеотидна послідовність варіанта полінуклеотиду ТАТ повинна бути принаймні приблизно на 80% ідентична, в іншому варіанті ідентична принаймні приблизно на 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 або 99% нуклеотидній послідовності, яка кодує повнорозмірну нативну послідовність ТАТ-поліпептиду, представлену в даному описі, повнорозмірну нативну послідовність ТАТ-поліпептиду, позбавлену сигнального пептиду, представлену в даному описі, послідовність позаклітинного домену ТАТ-поліпептиду із сигнальним пептидом або без нього, як вони представлені в даному описі, або будь-який інший фрагмент повнорозмірної послідовності ТАТполіпептиду, представлений у даному описі. Варіанти не містять нативну нуклеотидну послідовність. Як правило, варіанти полінуклеотидів ТАТ складаються принаймні приблизно з 5 нуклеотидів, в іншому варіанті складаються принаймні приблизно з 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990 або 1000 нуклеотидів, причому, у цьому контексті поняття «приблизно» означає, що довжина зазначеної нуклеотидної послідовності знаходиться у межах ±10% від зазначеної довжини. Поняття «відсоток (%) ідентичності нуклеотидних послідовностей» відносно кодуючих ТАТ нуклеотидних послідовностей, представлених у даному описі, означає відсоток нуклеотидів у розглянутій послідовності (послідовностікандидаті), ідентичних нуклеотидам у нуклеотидній послідовності ТАТ, яка являє інтерес, після лінеаризації послідовностей і інтродукції при необхідності дефектів, для досягнення максимального відсотка ідентичності послідовностей. Порівняльний аналіз первинної структури з метою визначення відсотка ідентичності нуклеотидних послідовностей можна здійснювати різними шляхами, які відомі спеціалістам у даній галузі, наприклад, з використанням доступних науковій громадськості комп'ютерних програм, таких як BLAST, BLAST-2, ALIGN або Megalign (DNASTAR). Однак для цілей даного опису величину відсотка ідентичності нуклеотидних послідовностей одержують, використовуючи призначену для порівняння послідовностей комп'ютерну програму ALIGN-2, повний вихідний код програми ALIGN-2 представлений нижче в таблиці 1. Призначена для порівняння послідовностей комп'ютерна програма ALIGN-2 розроблена на фірмі Genentech, Inc., і вихідний код, представлений нижче в таблиці 1, зданий на зберігання разом з документацією для користувачів в U.S. 93875 42 Copyright Office, Washington D.C., 20559, де він зареєстрований під номером U.S. Copyright Registration No. TXU510087. Наукова громадськість може одержати програму ALIGN-2 через фірму Genentech, Inc., Південний Сан-Франциско, шт. Каліфорнія або може компілювати її на основі вихідного коду, представленого нижче в таблиці 1. Програму ALIGN-2 слід компілювати для застосування в оперативній системі UNIX, переважно цифровій UNIX V4.0D. Всі параметри для порівняння послідовностей закладені в програму ALIGN-2 і не повинні змінюватися. У ситуаціях, коли ALIGN-2 застосовують для порівняння нуклеотидних послідовностей, відсоток (%) ідентичності нуклеотидних послідовностей для даної нуклеотидної послідовності В відносно, у порівнянні з або до даної нуклеотидної послідовності Г (в іншому варіанті можна позначати так, що дана нуклеотидна послідовність В має певний відсоток ідентичності нуклеотидної послідовності відносно, у порівнянні з або до даної нуклеотидної послідовності Г) розраховують у такий спосіб: 100W/Z де W означає кількість нуклеотидів, визнаних ідентичними при порівнянні первинної структури послідовностей В та Г за допомогою програми для порівняльного аналізу первинної структури послідовностей ALIGN-2, і де Ζ означає кількість нуклеотидів у Г. Повинно бути очевидно, що, якщо довжина нуклеотидної послідовності В не дорівнює довжині нуклеотидної послідовності Г, то відсоток ідентичності нуклеотидної послідовності В відносно Г не повинен дорівнювати відсотку ідентичності нуклеотидної послідовності Г відносно В. Як приклади розрахунків відсотка ідентичності нуклеотидних послідовностей у таблицях 4 і 5 продемонстровано як розраховувати відсоток ідентичності нуклеотидних послідовностей нуклеотидної послідовності, позначеної як «ДНК, з якою проводять порівняння», і нуклеотидної послідовності, позначеної як «ДНК ТАТ», де «ДНК ТАТ» означає гіпотетичну нуклеотидну послідовність, яка являє інтерес, яка кодує ТАТ, «ДНК, з якою проводять порівняння» означає нуклеотидну послідовність молекули нуклеїнової кислоти, з якою слід порівнювати молекулу нуклеїнової кислоти «ДНК ТАТ», яка являє інтерес, а «N», «L» та «V» кожний означає різні гіпотетичні нуклеотиди. Якщо спеціально не зазначено інше, всі величини відсотка ідентичності нуклеотидних послідовностей, зазначені в даному описі, одержують відповідно до методу, що описаний в попередньому параграфі, за допомогою комп'ютерної програми ALIGN-2. В інших варіантах здійснення винаходу варіанти полінуклеотидів ТАТ являють собою молекули нуклеїнових кислот, які кодують ТАТ-поліпептид і які мають здатність гібридизуватися, переважно в строгих умовах гібридизації та відмивання, з нуклеотидними послідовностями, які кодують повнорозмірний ТАТ-поліпептид, представлений у даному описі. Варіанти ТАТ-поліпептидів можуть являти собою поліпептиди, які кодуються варіантами полінуклеотидів ТАТ. 43 Поняття «повнорозмірна кодуюча ділянка» відносно нуклеїнової кислоти, яка кодує ТАТполіпептид, стосується нуклеотидної послідовності, яка кодує повнорозмірний ТАТ-поліпептид, пропонований у винаході (який на прикладених кресленнях, як правило, позначений між стартовим і стоп-кодонами, включаючи їх). Поняття «повнорозмірна кодуюча ділянка» відносно нуклеїнової кислоти, депонованої в АТСС, стосується фрагменту кДНК, що кодує ТАТ-поліпептид, який вбудований у вектор, депонований в АТСС (який на прикладених кресленнях, як правило, позначений між стартовим і стоп-кодонами, включаючи їх). Поняття «виділений» відносно різних ТАТполіпептидів, представлених у даному описі, означає поліпептид, який був ідентифікований і відділений і/або вилучений з компонента його природного оточення. Забруднювачами в його природному оточенні є продукти, які, як правило, здійснюють вплив при діагностичному або терапевтичному застосуванні поліпептиду, і вони можуть включати ферменти, гормони й інші білкові або небілкові розчинені речовини. У кращих варіантах здійснення винаходу поліпептид повинен бути очищений до (1) ступеня, достатнього для одержання принаймні 15 залишків N-кінцевої або внутрішньої амінокислотної послідовності за допомогою секвенатора з обертовою чашкою або до (2) гомогенного стану за даними ДСН-ПААГ у відновних або невідновних умовах, при забарвленні кумаси брильянтовим блакитним або переважно при забарвленні сріблом. До виділеного поліпептиду належить поліпептид, який знаходиться in situ у рекомбінантних клітинах, якщо в них не є присутнім жоден компонент природного оточення ТАТполіпептиду. Однак, як правило, виділений поліпептид слід одержувати з використанням принаймні однієї стадії очищення. Поняття «виділена» нуклеїнова кислота, яка кодує ТАТ-поліпептид або нуклеїнова кислота, яка кодує інший поліпептид стосується молекули нуклеїнової кислоти, яка ідентифікована й відділена принаймні від однієї молекули нуклеїнової кислоти-забруднювача, з якою вона звичайно асоційована в джерелі нуклеїнової кислоти, яка кодує поліпептид, яке зустрічається в природних умовах. Виділена молекула нуклеїнової кислоти, яка кодує поліпептид, має іншу форму або набір відносно того, у якому вона зустрічається в природі. Таким чином, виділені молекули нуклеїнових кислот, які кодують поліпептид, відрізняються від специфічної молекули нуклеїнової кислоти, яка кодує поліпептид, що присутня у клітинах у природних умовах. Однак виділена молекула нуклеїнової кислоти, яка кодує поліпептид, включає молекули нуклеїнових кислот, які кодують поліпептид, які містяться в клітинах, які в нормі експресують поліпептид, де, наприклад, хромосомна локалізація молекули нуклеїнової кислоти відмінна від локалізації, властивій клітинам у природних умовах. Поняття «контролюючі послідовності» стосується послідовностей ДНК, необхідним для експресії функціонально зв'язаної кодуючої послідовності, у конкретному організмі-хазяїні. Контролюючі послідовності, придатні для прокарі 93875 44 от, включають, наприклад, промотор, необов'язково послідовність оператора й сайт зв'язування рибосом. Відомо, що еукаріотичні клітини використовують промотори, сигнали поліаденілування й енхансери. Нуклеїнова кислота «функціонально зв'язана», коли вона знаходиться у функціональній взаємодії з іншою нуклеотидною послідовністю. Наприклад, ДНК передпослідовності або секреторного лідера функціонально зв'язана із ДНК, яка кодує поліпептид, якщо вона експресується у вигляді передбілка, який бере участь у секреції поліпептиду; промотор або енхансер функціонально в'язаний з кодуючою послідовністю, якщо він впливає на транскрипцію послідовності; або сайт зв'язування рибосом функціонально зв'язаний з кодуючою послідовністю, якщо він розташований так, що полегшує трансляцію. Як правило, «функціонально зв'язана» означає, що послідовності ДНК, будучи зв'язані, є суміжними й, у випадку лідера секреції, суміжними у рамці зчитування. Однак для енхансерів не є необхідним, щоб вони були суміжними. Зв'язування здійснюють за допомогою вбудовування шляхом лігування у відповідні сайти рестрикції. Якщо такі сайти не існують, то відповідно до загальноприйнятої практики застосовують синтетичні олігонуклеотидні адаптори або лінкери. «Строгість» реакцій гібридизації легко може визначати звичайний спеціаліст у даній галузі, і, як правило, вона розраховується емпірично залежно від довжини зонда, температури відмивання й концентрації солей. Як правило, при використанні більш довгих зондів для правильної ренатурації (відпалювання) потрібні більш високі температури, а при використанні більш коротких зондів потрібні більш низькі температури. Гібридизація, як правило, залежить від здатності денатурованої ДНК до повторної ренатурації при температурі нижче її температури плавлення, коли в навколишньому середовищі присутні комплементарні ланцюги. Для досягнення більш високого ступеня необхідної гомології між зондом і здатною до гібридизації послідовністю можна застосовувати більш високі відносні температури. У результаті більш високі відносні температури мають тенденцію робити реакційні умови більш строгими, у той час як більш низькі температури знижують строгість. Додаткові подробиці та пояснення строгості гібридизації див., наприклад, в Ausubel та ін., Current Protocols in Molecular Biology, вид-во Wiley Interscience Publishers, 1995. Поняття «строгі умови» або «умови високої строгості» у контексті даного опису можна охарактеризувати як: (1) застосування низької іонної сили та високої температури для відмивання, наприклад, 0,015М хлориду натрію/0,0015М цитрату натрію/0,1% додецилсульфату натрію (ДСН) при 50°С; (2) застосування в процесі гібридизації денатуруючого агента, такого як формамід, наприклад, 50 об.% формаміду, доповненого 0,1% бичачого сироваткового альбуміну/0,1% Фіколу/0,1% полівінілпіроліону/50мМ натрійфосфатним буфером при рН 6,5, який містить 750мМ хлорид натрію, 75мМ цитрат натрію при 42°С; або (3) гібридизація протягом ночі в розчині, який містить 50% формаміду, 45 5SSC (0,75M NaCl, 0,075M цитрат натрію), 50мМ фосфат натрію (рН 6,8), 0,1% пірофосфатату натрію, 5розчин Денхардта, опромінена ультразвуком ДНК сперми лосося (50мкг/мл), 0,1% ДСН і 10% сульфату декстрану при 42°С, з 10хвилинним відмиванням при 42°С в 0,2SSC (хлорид натрію/цитрат натрію) з наступним 10хвилинним відмиванням у строгих умовах з використанням 0,1SSC, який містить ЕДТК, при 55°С. «Умови середньої строгості» визначені, зокрема, в Sambrook та ін., Molecular Cloning: A Laboratory Manual, вид-во Cold Spring Harbor Press, New York, 1989, і передбачають застосування розчину для відмивання й умов для гібридизації (наприклад, температуру, іонну силу й % ДСН) менш строгі в порівнянні з описаними вище. Прикладом умов середньої строгості є інкубація протягом ночі при 37°С у розчині, який містить: 20% формаміду, 5SSC (150мМ NaCl, 15мМ тринатрійцитрат), 50мМ фосфат натрію (рН 7,6), 5розчин Денхардта, 10% сульфату декстрану та 20мг/мл недатурованої фрагментованої ДНК сперми лосося, з наступним відмиванням фільтрів в 1SSC при температурі приблизно 37-50°С. Спеціалісту в даній галузі повинно бути очевидно, як регулювати температуру, іонну силу й т.д., які необхідно погоджувати з такими факторами, як довжина зонду й т.п. Поняття «мічений епітоп» у контексті даного опису означає химерний поліпептид, який містить ТАТ-поліпептид або антитіло до ТАТ, злите з «поліпептидом-міткою». Поліпептид-мітка має достатню кількість залишків для одержання епітопу, до якого можна створити антитіло, але є в достатньому ступені коротким, щоб не впливати на активність поліпептиду, з яким він злитий. Поліпептидмітка переважно також фактично є унікальним, у результаті чого антитіло не має помітну перехресну реактивність із іншими епітопами. Прийнятні поліпептиди-мітки, як правило, мають принаймні 6 амінокислотних залишків і звичайно приблизно від 8 до 50 амінокислотних залишків (переважно приблизно від 10 до 20 амінокислотних залишків). Поняття «активний» або «активність» у контексті даного опису стосується форми(м) ТАТполіпептиду, яка(і) зберігає(ють) біологічну і/або імунологічну активність нативного або такого, що зустрічається в природних умовах ТАТ, де поняття «біологічна» активність стосується біологічної функції (або інгібуючої, або стимулюючої), обумовленої нативним або таким, що зустрічається в природних умовах ТАТ, відмінної від здатності продукувати утворення антитіла до антигенного епітопу, яка властива нативному або такому, що зустрічається в природних умовах ТАТ, а поняття «імунологічна активність» стосується здатності продукувати антитіло до антигенного епітопу, властивій нативному або такому, що зустрічається в природних умовах, ТАТ. Поняття «антагоніст» застосовують у його найбільш широкому смислі, і воно стосується будь-якої молекули, яка частково або повністю блокує, інгібує або нейтралізує біологічну активність нативного ТАТ-поліпептиду, пропонованого в даному винаході. Аналогічно цьому поняття «аго 93875 46 ніст» застосовують у його найбільш широкому смислі, і воно стосується будь-якої молекули, яка імітує біологічну активність нативного ТАТполіпептиду, пропонованого в даному винаході. Прийнятні молекули агоністів або антагоністів включають, насамперед, агоністичні або антагоністичні антитіла або фрагменти антитіл, фрагменти або варіанти амінокислотних послідовностей нативних ТАТ-поліпептидів, пептиди, антисмислові олігонуклеотиди, невеликі органічні молекули й т.д. Методи ідентифікації агоністів або антагоністів ТАТ-поліпептиду можуть передбачати приведення в контакт ТАТ-поліпептиду з молекулою, яка може бути агоністом або антагоністом (молекулакандидат), оцінку помітної зміни одного або декількох видів біологічної активності, пов'язаної в нормі з ТАТ-поліпептидом. Поняття «лікувати» або «лікування» або «полегшення» стосується як терапевтичного лікування, так і профілактичних або превентивних мір, де задача полягає в попередженні або вповільненні (послабленні) цільового патологічного стану або порушення. Пацієнти, які потребують лікування, включають пацієнтів, які вже мають порушення, схильні до виникнення порушення або тих пацієнтів, у яких слід попереджати появу порушення. «Лікування» людини або ссавця, який страждає раком, при якому відбувається експресія ТАТполіпептиду, є успішним, якщо після введення в терапевтичній кількості антитіла до ТАТ, ТАТзв'язуючого олігопептиду або ТАТ-зв'язуючої органічної молекули відповідно до способів, пропонованих у даному винаході, у пацієнта виявлені помітне і/або вимірюване зниження або відсутність одного або декількох наступних параметрів: зменшення кількості ракових клітин або відсутність ракових клітин; зменшення розміру пухлини; інгібування (тобто зниження до деякої міри або краще припинення) інфільтрації ракових клітин у периферичні органи, включаючи поширення раку в м'яку та кісткову тканину; інгібування (тобто зниження до певного ступеня або краще припинення) метастазування пухлини; інгібування до деякого ступеня росту пухлини; і/або полегшення до деякого ступеня одного або декількох симптомів, пов'язаних з конкретним типом раку; зниження поширеності захворювання й смертності та поліпшення в результаті якості життя. Залежно від ступеня, у якому антитіло до ТАТ або ТАТ-зв'язуючий олігопептид можуть попереджати ріст і/або знищувати існуючі ракові клітини, вони можуть бути цитостатичними і/або цитотоксичними. Пацієнт може почувати зменшення цих ознак або симптомів. Зазначені вище параметри, за якими оцінюють успішність лікування та поліпшення стану хвороби, легко може визначати лікар за допомогою загальноприйнятих процедур. Ефективність терапії раку можна оцінювати, наприклад, визначаючи тривалість розвитку хвороби (ТТР) і/або визначаючи інтенсивність відповіді (RR). Метастази можна визначати шляхом визначення стадії захворювання та сканування кісткової тканини та визначення рівня кальцію й інших ферментів для оцінки поширення в кісткову тканину. Можна здійснювати також сканування за допомогою комп'ютерної томо 47 графії (КТ) для визначення поширення в ділянку таза та лімфатичні вузли в цій ділянки. Рентген грудної клітини й визначення рівня ферментів печінки відомими методами використовують для виявлення метастазів у легені та печінку відповідно. Інші загальноприйняті методи моніторингу захворювання включають трансректальну ультразвукову ехографію (TRUS) і трансректальну пункціонну біопсію (TRNB). Поняття «хронічне» введення стосується тривалого введення агента(ів), на противагу гострому введенню, так, щоб підтримувати початкову терапевтичну дію (активність) протягом пролонгованого періоду часу. «Дробове (переривчасте)» введення стосується лікування, яке здійснюють не безперервно, а з перервами, але яке за своєю природою скоріше є циклічним. Поняття «ссавець», що підлягає лікуванню, полегшенню симптомів або в якого здійснюють діагностику раку, включає будь-яку тварину, що належить до класу ссавців, включаючи людей, домашніх і сільськогосподарських тварин, а також живучих у зоопарку, призначених для спорту або кімнатних тварин, таких як собаки, кішки, корови, коні, вівці, свині, кози, кролики й т.д. Переважно, ссавець являє собою людину. Введення «у сполученні з» одним або декількома додатковими терапевтичними агентами включає одночасне (конкурентне) і послідовне введення в будь-якому порядку. Поняття «носії» у контексті даного опису стосується фармацевтично прийнятних носіїв, ексципієнтів або стабілізаторів, які є нетоксичними для клітин або ссавця при застосуванні їх у прийнятих дозах і концентраціях. Часто фізіологічно прийнятний носій являє собою водний рНзабуферювальний розчин. Прикладами фізіологічно прийнятних носіїв є буфери, такі як фосфатний, цитратний і буфер на основі інших органічних кислот; антиоксиданти, включаючи аскорбінову кислоту; низькомолекулярні (менше приблизно 10 залишків) поліпептиди; білки, такі як сироватковий альбумін, желатин або імуноглобуліни; гідрофільні полімери, такі як полівінілпіролідон; амінокислоти, такі як гліцин, глутамін, аспарагін, аргінін або лізин; моносахариди, дисахариди й інші вуглеводи, включаючи глюкозу, манозу або декстрини; хелатувальні агенти, такі як ЕДТК; цукрові спирти, такі як маніт або сорбіт; солеутворюючі протиіони, такі як іони натрію; і/або неіоногенні поверхневоактивні речовини, такі як TWEEN, поліетиленгліколь (ПЕГ) і PLURONICS. Поняття «тверда фаза» або «тверда підкладка» означає неводну матрицю, до якої антитіло, ТАТ-зв'язуючий олігопептид або ТАТ-зв'язуючу органічну молекулу можна прикріплювати або приєднувати. Прикладами твердих фаз у контексті даного опису є фази, які складаються повністю або частково зі скла (наприклад, скла з контрольованими порами), полісахаридів (наприклад, агарози), поліакриламідів, полістиролу, полівінілового спирту та силіконів. У конкретних варіантах здійснення винаходу, залежно від контексту, тверда фаза може являти собою лунку планшета, у якому здійснюють аналіз; в інших вона являє собою ко 93875 48 лонку для очищення (наприклад, колонку для афінної хроматографії). Під це поняття підпадає також переривчаста тверда фаза, яка складається з окремих частинок, наприклад, фази, які описані в U.S. 4275149. «Ліпосома» являє собою невелику бульбашку, яка складається з різних типів ліпідів, фосфоліпідів і/або поверхнево-активних речовин, яку можна застосовувати для введення лікарського засобу (такого як ТАТ-поліпептид, антитіло до нього або ТАТ-зв'язуючий олігопептид) ссавцю. Компоненти ліпосоми, як правило, мають двошарову будову, що нагадує організацію ліпідів у біологічних мембранах. Поняття «невелика» молекула або «невелика» органічна молекула в контексті даного опису стосується молекули з молекулярною масою менше приблизно 500 Да. «Ефективна кількість» поліпептиду, антитіла, ТАТ-зв'язуючого олігопептиду, ТАТ-зв'язуючої органічної молекули або їх агоніста або антагоніста, представлених у даному описі, являє собою кількість, достатню для вирішення конкретної поставленої задачі. «Ефективну кількість» можна визначати емпірично й загальноприйнятим чином залежно від поставленої задачі. Поняття «терапевтично ефективна кількість» стосується кількості антитіла, поліпептиду, ТАТзв'язуючого олігопептиду, ТАТ-зв'язуючої органічної молекули або іншого лікарського засобу, що ефективно «лікує» захворювання або порушення в людини або ссавця. У випадку раку терапевтично ефективна кількість лікарського засобу може зменшувати кількість ракових клітин; зменшувати розмір пухлини; інгібувати (тобто знижувати певною мірою або переважно припиняти) інфільтрацію ракових клітин у периферичні органи; інгібувати (тобто знижувати певною мірою або переважно припиняти) метастазування пухлини; інгібувати певною мірою ріст пухлини; і/або полегшувати певною мірою один або декілька симптомів, пов'язаних з раком (див. визначення поняття «лікувати»). Залежно від ступеня, у якому лікарський засіб може попереджати ріст і/або знищувати існуючі ракові клітини, воно може бути цитостатичним і/або цитотоксичним. «Кількість, що інгібує ріст» антитіла до ТАТ, ТАТ-поліпептиду, ТАТ-зв'язуючого олігопептиду або ТАТ-зв'язуючої органічної молекули являє собою кількість, яка може інгібувати ріст клітини, насамперед пухлинної, наприклад, ракової клітини, або in vitro, або in vivo. «Кількість, що інгібує ріст» антитіла до ТАТ, ТАТ-поліпептиду, ТАТзв'язуючого олігопептиду або ТАТ-зв'язуючої органічної молекули для інгібування росту неопластичних клітин можна визначати емпірично та загальноприйнятим чином. «Цитотоксична кількість» антитіла до ТАТ, ТАТ-поліпептиду, ТАТ-зв'язуючого олігопептиду або ТАТ-зв'язуючої органічної молекули являє собою кількість, яка може викликати деструкцію клітини, насамперед пухлинної, наприклад, ракової клітини, або in vitro, або in vivo. «Цитотоксичну кількість» антитіла до ТАТ, ТАТ-поліпептиду, ТАТзв'язуючого олігопептиду або ТАТ-зв'язуючої орга 49 нічної молекули для інгібування росту неопластичних клітин можна визначати емпірично та загальноприйнятим чином. Поняття «антитіло» у контексті даного опису застосовують у його найбільш широкому смислі, і воно стосується, наприклад, індивідуальних моноклональних антитіл до ТАТ (включаючи агоністичні, антагоністичні та нейтралізуючі антитіла), композицій антитіл до ТАТ з поліепітопною специфічністю, поліклональних антитіл, одноланцюгових антитіл до ТАТ і фрагментів антитіл до ТАТ (див. нижче), які зберігають свою необхідну біологічну або імунологічну активність. Поняття «імуноглобулін» (Ig) і поняття «антитіло» у контексті даного опису використовують взаємозамінно. «Виділене антитіло» являє собою антитіло, яке ідентифіковане та відділене від і/або одержане з компонента його природного оточення. Забруднювачами в його природному оточенні є продукти, які можуть здійснювати вплив при діагностичному або терапевтичному застосуванні антитіла, і вони можуть включати ферменти, гормони й інші білкові або небілкові розчинені речовини. У кращих варіантах здійснення винаходу антитіло повинне бути очищене до (1) більше 95% у перерахунку на масу антитіла, що визначають методом Лоурі, і найкраще більше 99 мас.%, до (2) ступеня, достатнього для одержання принаймні 15 залишків N-кінцевої або внутрішньої амінокислотної послідовності за допомогою секвінатора з обертовою чашкою або до (3) гомогенного стану за даними ДСН-ПААГ у відновних або невідновних умовах при забарвленні кумаси брильянтовим блакитним або переважно при забарвленні сріблом. До виділеного антитіла належить антитіло, яке знаходиться in situ у рекомбінантній клітині, якщо в ній не присутній будьякий компонент природного оточення антитіла. Однак, як правило, виділене антитіло повинно бути одержане з використанням принаймні однієї стадії очищення. Основна чотириланцюгова одиниця антитіла являє собою гетеротетрамірний глікопротеїн, який складається із двох ідентичних легких (L) ланцюгів і двох ідентичних важких (Н) ланцюгів (антитіло ізотипу IgM складається з 5 основних гетеродимерних одиниць поряд з додатковим поліпептидом, який позначений як J-ланцюг, і в результаті містить 10 антигензв'язуючих центрів, а антитіла ізотипу IgA, що секретуються, можуть полімеризуватися з утворенням полівалентних груп, які містять 2-5 з основних чотирьох ланцюгових одиниць, поряд з J-ланцюгом). У випадку IgG чотириланцюгова одиниця, як правило, має молекулярну масу приблизно 150000 Да. Кожний L-ланцюг зв'язаний з Η-ланцюгом за допомогою одного ковалентного дисульфідного зв'язку, у той час як два Η-ланцюги зв'язані один з одним за допомогою одного або декількох дисульфідних містків залежно від ізотипу Η-ланцюга. Кожний Н- і L-ланцюг включає також правильно розташовані в просторі дисульфідні містки всередині ланцюгів. Кожний Н-ланцюг має N-кінцеву варіабельну ділянку (VH), за якою ідуть три константні ділянки (СН) у кожному - і ланцюгах і 4 СН-ділянки у - і -ізотипах. Кожний L 93875 50 ланцюг має на N-кінці варіабельну ділянку (VL), за якою розташована константна ділянка (CL) на іншому його кінці. VL вистроєна в лінію з VH, a CL вистроєна в лінію з першою константною ділянкою важкого ланцюга (СН1). Імовірно, визначені амінокислотні залишки утворюють поверхню розділу між варіабельними ділянками легкого ланцюга та важкого ланцюга. При спарюванні VH і VL утворюють один антигензв'язуючий центр. Структура та властивості різних класів антитіл описані, наприклад, в Basic and Clinical Immunology, 8-ме вид., під ред. Daniel P. Stites, Abba I. Terr і Tristram G. Parslow, вид-во Appleton & Lange, Norwalk, CT, 1994, с. 71 і розділ 6. L-ланцюг будь-яких видів хребетних тварин можна віднести до одного із двох різних чітко виражених типів, позначених як капа- і лябда-тип, на основі амінокислот амінокислотних послідовностей їх константних ділянок. Залежно від амінокислотної послідовності константної ділянки їх важких ланцюгів (СН) імуноглобуліни можна віднести до різних класів або ізотипів. Відомо п'ять класів імуноглобулінів: IgA, IgD, IgE, IgG та IgM, важкі ланцюги яких позначають як , , , і відповідно, - і -класи додатково розділяють на підкласи на основі відносно невеликих розходжень в СНпослідовності та функції, наприклад, в організмі людини експресуються наступні підкласи: lgG1, IgG2, IgG3, IgG4, IgA1 та IgA2. Поняття «варіабельний» стосується ситуації, коли визначені сегменти варіабельних ділянок різних антитіл у значній мірі відрізняються по послідовності. V-ділянка опосередковує зв'язування антигену та визначає специфічність конкретного антитіла щодо конкретного антигена. Однак варіабельність не рівномірно розподіляється у фрагменті варіабельних ділянок, що складається з 110 амінокислот. Навпроти, V-ділянки складаються з відносно незмінних ділянок, позначених як каркасні ділянки (FR), які складаються з 15-30 амінокислот, розділених більш короткими дуже варіабельними ділянками, які називають «гіперваріабельні ділянки», кожна довжиною 9-12 амінокислот. Кожна з варіабельних ділянок нативних важких і легких ланцюгів містить чотири FR, добре адаптованих до -складчастої конформації, які зв'язані трьома гіперваріабельними ділянками, які утворюють петлі, що з'єднують і в деяких випадках формують частину -складчастої структури. Гіперваріабельні ділянки в кожному ланцюзі підтримуються в тісному зв'язку один з одним за допомогою FR і разом з гіперваріабельними ділянками іншого ланцюга приймають участь в утворенні антигензв'язуючого центра антитіл (див. Kabat та ін., Sequences of Proteins of Immunological Interest, 5-е вид., вид-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991). Константні ділянки не приймають участі безпосередньо у зв'язуванні антитіла з антигеном, але вони мають різні ефекторні функції, такі як участь антитіла в антитілообумовленої клітинозалежної цитотоксичності (ADCC). Поняття «моноклональне антитіло» у контексті даного опису означає антитіло, одержане з популяції практично гомогенних антитіл, тобто індиві 51 дуальні антитіла, що входять до популяції, ідентичні за винятком можливих мутацій, що зустрічаються в природних умовах, які можуть бути присутніми у невеликих кількостях. Моноклональні антитіла є високо специфічними і являють собою антитіла до одного антигенного сайту. Крім того, на відміну від препаратів поліклональних антитіл, які включають різні антитіла до різних детермінантів (епітопам), кожне моноклональне антитіло напрямлене до одного детермінанту на антигені. Крім їх специфічності перевагою моноклональних антитіл є те, що їх можна синтезувати без забруднення іншими антитілами. Прикметник «моноклональне» не має на увазі одержання антитіла за допомогою якого-небудь конкретного методу. Наприклад, моноклональні антитіла, які можна застосовувати відповідно до даного винаходу, можна одержувати за допомогою методу на основі гібридом, уперше описаного Kohler та ін., Nature, 256, 1975, с. 495, або їх можна створювати за допомогою методів рекомбінантної ДНК у бактеріях, клітинах еукаріотичних тваринних або рослинних клітинах (див., наприклад, U.S. 4816567). «Моноклональні антитіла» можна виділяти також з фагових бібліотек антитіл за допомогою методик, описаних, наприклад, в Clackson та ін., Nature, 352, 1991, сс. 624-628 та в Marks та ін., J. Mol. Biol., 222, 1991, сс. 581-597. Моноклональні антитіла в контексті даного опису, зокрема, включають «химерні» антитіла, у яких частина важкого і/або легкого ланцюга ідентична або гомологічна відповідним послідовностям антитіл, одержаним з конкретних видів або належить конкретному класу або підкласу антитіл, а інша ділянка ланцюга(ів) ідентична або гомологічна відповідним послідовностям антитіл, одержаним з інших видів або належить іншому класу або підкласу антитіл, включаючи фрагменти таких антитіл, у випадку, якщо вони мають необхідну біологічну активність (U.S. 4816567; та Morrison та ін., Proc. Natl. Acad. Sci. USA, 81, 1984, сс. 6851-6855). Химерні антитіла, що являють інтерес, включають «приматизовані» антитіла, які містять варіабельну ділянку антигензв'язуючих послідовностей, виведену із примата крім людини (наприклад, нижчих вузьконосих мавп, мавп і т.д.), і послідовності людських константних ділянок. «Інтактне антитіло» являє собою антитіло, яке містить антигензв'язуючу ділянку, а також CL і принаймні константні ділянки важкого ланцюга СН1, СН2 та СН3. Константні ділянки можуть являти собою константні ділянки, які мають нативні послідовності (наприклад, людські константні ділянки, які мають нативні послідовності), або варіанти їх амінокислотних послідовностей. Переважно інтактне антитіло має одну або декілька ефекторних функцій. «Фрагменти антитіла» являють собою частину інтактного антитіла, переважно антигензв'язуючий центр або варіабельну ділянку інтактного антитіла. Приклади фрагментів антитіла включають Fab-, Fab'-, F(ab')2- та Fv-фрагменти; подвійні антитіла, лінійні антитіла (див. U.S. 5641870, приклад 2; Zapata та ін., Protein Eng. 8(10), 1995, сс. 10571062); молекули одноланцюгових антитіл; і мульті 93875 52 специфічні антитіла, одержані із фрагментів антитіл. При розщепленні антитіл папаїном утворюються два ідентичних антигензв'язуючих фрагменти, які називають «Fаb»-фрагментами, і залишається «Fc»-фрагмент, назва якого відбиває його здатність легко кристалізуватися. Fab-фрагмент складається з повного L-ланцюга поряд з варіабельною ділянкою Н-ланцюга (VH) і першою константною ділянкою одного важкого ланцюга (СН1). Кожний Fab-фрагмент є моновалентним відносно антигензв'язуючого центра, тобто він має один антигензв'язуючий центр. Після обробки антитіла пепсином утворюється один великий F(аb')2фрагмент, який грубо відповідає двом зв'язаним дисульфідним містком Fab-фрагментам, має дивалентну антигензв'язуючу активність та ще зберігає здатність до перехресного зв'язування з антигеном. Fab'-фрагменти відрізняються від Fabфрагментів наявністю додаткових декількох залишків на С-кінці СН1-ділянки, включаючи один або декілька залишків цистеїну із шарнірної ділянки антитіла. Fab'-SH у контексті даного опису стосується Fab'-фрагменту, у якому залишок(ки) цистеїну константних ділянок несуть три тіольні групи. F(аb')2-фрагменти антитіла спочатку одержували у вигляді пар Fab'-фрагментів, між якими знаходяться цистеїни шарнірної ділянки. Відомі також інші хімічні сполучення фрагментів антитіл. Fc-фрагмент містить С-кінцеві ділянки обох Ηланцюгів, які утримуються разом дисульфідними мостиками. Ефекторні функції антитіл визначаються послідовностями Fc-фрагмента, ця ділянка є також частиною, що розпізнається Fcрецепторами, які присутні на певних типах клітин. «Fv» являє собою мінімальний фрагмент антитіла, що містить повний антигенрозпізнавальний і антигензв'язуючий центр. Цей фрагмент складається з димеру, що включає одну варіабельну ділянку важкого ланцюга та одну варіабельну ділянку легкого ланцюга в тісному нековалентному зв'язку. У результаті складчастості цих двох доменів утворюється шість гіперваріабельних петель (по 3 петлі з кожного Н- і L-ланцюга), які включають амінокислотні залишки для зв'язування антигену та надають антитілу здатності до зв'язування з антигеном. Однак навіть одна варіабельна ділянка (або половина Fv, що включає тільки три CDR, специфічних для антигену) має здатність розпізнавати та зв'язувати антиген, хоча з більш низькою афінність, у порівнянні з повним зв'язуючим центром. «Одноланцюгові Fv», позначені скорочено також як «sFv» або «scFv», являють собою фрагменти антитіла, які містять VH- і VL-ділянки антитіла, з'єднані у вигляді одноланцюгового поліпептидного ланцюга. Переважно sFv-поліпептид додатково містить поліпептидний лінкер між VL- і VHділянками, що надає scFv-фрагменту будову, необхідну для зв'язування з антигеном. Огляд даних, що відповідають scFv, див. у Pluckthin в: The Pharmacology of Monoclonal Antibodies, том 113, під ред. Rosenbrug і Moore, вид-во Springer-Verlag, New York, cc. 269-315, 1994. 53 Поняття «подвійні антитіла» стосується невеликих фрагментів антитіл, одержаним шляхом створення sFv-фрагментів (див. попередній параграф) з коротким лінкером (приблизно 5-10 залишків) між VH- і VL-ділянками, що дозволяє здійснювати спарювання V-ділянок між ланцюгами, але не усередині ланцюгів, це приводить до утворення бівалентного фрагмента, тобто фрагмента із двома антигензв'язуючими сайтами. Біспецифічні подвійні антитіла являють собою гетеродимери двох sFv-фрагментів-«кросоверів», у яких VH- та VLділянки двох антитіл присутні в різних поліпептидних ланцюгах. Подвійні антитіла більш докладно описані, наприклад, в ЕР 404097; WO 93/11161; та у Hollinger та ін., Proc. Natl. Acad. Sci. USA, 90, 1993, cc. 6444-6448. «Гуманізовані» форми антитіл тварин крім людини (наприклад, гризунів) являють собою химерні антитіла, які включають мінімальну послідовність, одержану з антитіла тварини крім людини. Основна частина гуманізованих антитіл представлена людськими імуноглобулінами (антитіло-реципієнт), у яких залишки з гіперваріабельної ділянки реципієнта замінені залишками з гіперваріабельної ділянки інших видів крім людини (антитіло-донор), таких як миша, щур, кролик або примати крім людини, які мають необхідну специфічність, афінність та потенціал щодо антитіла. У деяких випадках залишки каркасної ділянки (FR) людського імуноглобуліну заміняють відповідними залишками імуноглобуліну виду крім людини. Крім того, гуманізовані антитіла можуть містити залишки, які не присутні в антитілі-реципієнті або в антитілідонорі. Ці модифікації здійснюють із метою додаткового вдосконалення характеристик антитіла. У цілому, гуманізоване антитіло повинне містити практично повністю принаймні одну, а, як правило, дві варіабельні ділянки, у яких всі або практично всі гіперваріабельні петлі відповідають петлям зазначених імуноглобулінів тварин крім людини, а всі або практично всі FR відповідають послідовності імуноглобуліну людини. Гуманізоване антитіло необов'язково може містити також принаймні частину константної ділянки імуноглобуліну (Fc), як правило, людського імуноглобуліну. Додаткові більш докладні дані див. в Jones та ін., Nature, 321, 1986, сс. 522-525; Reichmann та ін., Nature, 332, 1988, сс. 323-329 і Presta, Curr. Op. Struct. Biol., 2, 1992, сс. 593-59. «Залежне від виду антитіло», наприклад, антитіло ссавця до людського IgE, являє собою антитіло, яке має більш виражену афінність до зв'язування з антигеном з перших видів ссавців, ніж з гомологом антигену з інших видів ссавців. Як правило, залежне від виду антитіло «зв'язується специфічно» з людським антигеном (тобто характеризується афінністю до зв'язування (значення Kd), не вище, ніж приблизно 110-7М, переважно не вище, -8 ніж приблизно 110 і більш переважно не більш ніж приблизно 110-9М), але характеризується афінністю до зв'язування з гомологом антигену з інших видів ссавців крім людини принаймні приблизно в 50 разів або принаймні приблизно в 500 разів або принаймні приблизно в 1000 разів більш слабкою в порівнянні з афінністю до зв'язування з 93875 54 людським антигеном. Залежне від виду антитіло може належати до кожного із зазначених вище типів антитіл, але переважно являє собою гуманізоване або людське антитіло. Поняття «нумерація залишків варіабельних ділянок за Кеботом» або «нумерація положення амінокислот за Кеботом» і його варіанти стосується системи нумерації, застосовуваної для варіабельних ділянок важкого ланцюга або варіабельних ділянок легкого ланцюга різних антитіл, описаних у Kabat та ін., Sequences of Proteins of Immunological Interest, 5-вид., вид-во Public Health Service, National Institutes of Health, Bethesda, MD., 1991. На основі цієї системи нумерації фактична лінійна амінокислотна послідовність може містити меншу кількість амінокислот або додаткові амінокислоти, на які вкорочені FR або CDR варіабельні ділянки або які вбудовані в них. Наприклад, варіабельна ділянка важкого ланцюга може включати одну амінокислотну вставку (залишок 52а за Кеботом, розташований за залишком 52 Н2 і вбудовані залишки (наприклад, залишки 82а, 82b та 82с і т.д. за Кеботом) після залишку 82 FR важкого ланцюга. Нумерацію залишків за Кеботом для даного антитіла можна визначати шляхом порівняльного аналізу первинної структури ділянок гомології послідовності антитіла та «стандартної» пронумерованої за Кеботом послідовності. Фраза «практично аналогічний» або «практично такий же» у контексті даного опису означає досить високий ступінь подібності між двома чисельними значеннями (як правило, одне з яких стосується антитіла, пропонованого у винаході, а інше стосується «референс»антитіла/застосовуваного для порівняння антитілу), так, що спеціаліст у даній галузі може вважати, що розходження між двома значеннями є занадто незначним або не має біологічної і/або статистичної значимості в контексті біологічних характеристик, які описуються цим значенням (наприклад, величини Kd). Розходження між цими двома значеннями переважно становить менш ніж приблизно 50%, переважно менш ніж приблизно 40%, переважно менш ніж приблизно 30%, переважно менш ніж приблизно 20%, переважно менш ніж приблизно 10% відносно значення «референс»-антитіла/застосовуваного для порівняння антитіла. Поняття «афінність до зв'язування», як правило, стосується сили загальної суми нековалентних взаємодій між одним зв'язуючим центром молекули (наприклад, антитіла) і партнером, що зв'язується з ним (наприклад, антигеном). Якщо не зазначене інше, то в контексті даного опису «афінність до зв'язування» стосується властивої компонентам пари, що зв'язується, (наприклад, антитілу та антигену) афінності до зв'язування при їх співвідношенні 1:1. Афінність молекули X до її партнера Y, як правило, можна характеризувати константою дисоціації (Kd). Афінність можна оцінювати за допомогою звичайних методів, відомих у даній галузі, у тому числі представлених у даному описі. Антитіла, що мають низьку афінність, як правило, повільно зв'язують антиген і мають тенденцію до швидкої дисоціації, а антитіла, що ма 55 ють високу афінність, як правило, зв'язують антиген швидше та знаходяться у зв'язаному стані протягом більш тривалого періоду часу. Різні методи оцінки афінності до зв'язування відомі в даній галузі, для цілей даного винаходу можна використовувати будь-які з них. Нижче описані їх конкретні наведені як ілюстрація варіанти. В одному з варіантів здійснення винаходу «Kd» або «значення Kd» оцінюють за допомогою аналізу зв'язування радіоактивноміченого антигену (РІА), для здійснення якого використовують версію Fab-фрагмента антитіла, що являє інтерес, і його антиген, як описано в наведеному нижче аналізі, при здійсненні якого вимірюють афінність до зв'язування Fab-фрагментів з антигеном у розчині шляхом урівноважування Fab-фрагмента мінімальною концентрацією міченого за допомогою 125І антигену в присутності титраційних серій неміченого антигену з наступним захопленням зв'язаного антигену, нанесеним на планшет антитілом до Fab (Chen, та ін., J. Mol. Biol. 293, 1999, сс. 865-881). Для визначення умов аналізу титраційні планшети (фірми Dynex) сенсибілізують протягом ночі 5мкг/мл захоплюючого антитіла до Fab (фірми Cappel Labs) в 50мМ карбонату натрію (рН 9,6) і потім блокують за допомогою 2% (мас./об.) бичачого сироваткового альбуміну у ЗФР протягом 2-5 год. при кімнатній температурі (приблизно 23°С). При застосуванні планшетів без адсорбенту (Nunc № 269620), 100пМ або 26пМ [125І]-антиген змішують із серійними розведеннями Fab, що являє інтерес (наприклад, при використанні антитіла до VEGF Fab-12, описаного в Presta та ін., Cancer Res. 57, 1997, сс. 4593-4599). Потім Fab, що являє інтерес, інкубують протягом ночі; однак інкубацію можна продовжувати протягом більше тривалого періоду (наприклад, 65 год.) для гарантії того, що рівновагу досягнуто. Потім суміші переносять на планшет для захоплення та витримують при кімнатній температурі (наприклад, протягом 1 год.). Потім розчин видаляють, і планшет промивають 8 разів 0,1% Твін-20 у ЗФР. Після висушування планшета додають 150мкл/лунку сцинтиляційного розчину (MicroScint-20; фірма Packard) і визначають радіоактивність планшета за допомогою лічильника гамма-квантів (фірма Packard) протягом 10 хв. Для застосування в конкурентних аналізах зв'язування вибирають концентрації кожного Fab, при яких рівень зв'язування менше або дорівнює 20% від максимального. Відповідно до іншого варіанта здійснення винаходу Kd або значення Kd визначають за допомогою резонансу поверхневого плазмону з використанням пристрою ВІАcore2000 або ВІАcore-3000 (фірма ВІАcore, Inc., Піскатавей, шт. Нью-Джерсі) при 25°С з використанням чипів з імобілізованим антигеном типу СМ5 при ~10 одиницях відповіді (RU). У цілому метод полягає у наступному: біосенсорні чипи (СМ5, фірма BIAcore Inc.) з карбоксим етилованого декстрану активують гідрохлоридом N-етил-N'-(3диметиламінопропіл)карбодііміду (ЕДК) і Nгідроксисукцинімідом (NHS) відповідно до інструкцій постачальника. Антиген розводять в 10мМ ацетату натрію, рН 4,8 до концентрації 5мкг/мл (~0,2мк) перед ін'єкцією при швидкості потоку 93875 56 5мкл/хв. для досягнення приблизно 10 одиниць відповіді (RU) зшитого білка. Після ін'єкції антигену ін'єкують 1M етаноламін для того, щоб блокувати групи, які непрореагували. Для кінетичних вимірювань дворазові серійні розведення Fab (від 0,78 до 500нМ) ін'єкують у ЗФР, доповненому 0,05% Твін20 (ЗФР) при 25°С при швидкості потоку приблизно 25мкл/хв. Швидкість асоціації (kon) і швидкість дисоціації (koff) розраховують за допомогою простої (1:1) моделі зв'язування Ленгмюра (програма BIAcore Evaluation, версія 3.2) шляхом одночасної апроксимації сенсограм асоціації та дисоціації. Константу швидкості дисоціації (Kd) розраховують зі співвідношення koff/kon (див., наприклад, Chen, Υ., та ін., J. Mol. Biol. 293, 1999, сс. 865-881). Якщо швидкість асоціації («on-rate») перевищує 10бМ-1с-1 при аналізі за допомогою описаного вище резонансу поверхневого плазмону, то цю швидкість можна визначати з використанням методу гасіння флуоресценції, який дозволяє оцінювати підвищення або зниження інтенсивності флуоресценції, що випромінюється (довжина хвилі збудження 295нм; випромінювання 340нм, смуга пропускання 16нм) при 25°С при концентрації антитіла до антигену 20нМ (Fab-форма) у ЗФР, рН 7,2 у присутності зростаючих концентрацій антигену, здійснюючи оцінку за допомогою спектрометра, такого як спектрофотометр, обладнаний діафрагмою (фірма Aviv Instruments) або спектрофотометра 8000серій типу SLM-Aminco (фірма ThermoSpectronic) із кюветою, що перемішується. «On-rate» або «швидкість асоціації» або «kon» відповідно до даного винаходу можна визначати також за допомогою такого ж методу резонансу поверхневого плазмону, що описаний вище, з використанням ВІАcore-2000 або ВІАcore-3000 (фірма BIAcore, Inc., Піскатавей, шт. Нью-Джерсі) при 25°С з використанням чипів з імобілізованим антигеном типу СМ5 при ~10 одиницях відповіді (RU). У цілому метод полягає у наступному: біосенсорні чипи (СМ5, фірма BIAcore Inc.) з карбоксиметилованого декстрану активують гідрохлоридом N-етил-N'-(3-диметиламінопропіл)карбодііміду (ЕДК) і N-гідроксисукцинімідом (NHS) відповідно до інструкцій постачальника. Антиген розводять в 10мМ ацетату натрію, рН 4,8 до концентрації 5мкг/мл (~0,2мкМ) перед ін'єкцією при швидкості потоку 5мкл/хв. для досягнення приблизно 10 одиниць відповіді (RU) зшитого білка. Після ін'єкції антигену ін'єкують 1M етаноламін для того, щоб блокувати групи, які непрореагували. Для кінетичних вимірювань дворазові серійні розведення Fab (від 0,78 до 500нМ) ін'єкують у ЗФР, доповненому 0,05% Твін-20 (ЗФР) при 25°С при швидкості потоку приблизно 25мкл/хв. Швидкість асоціації (kon) і швидкість дисоціації (koff) розраховують за допомогою простої (1:1) моделі зв'язування Ленгмюра (програма BIAcore Evaluation, версія 3.2) шляхом одночасної апроксимації сенсограм асоціації та дисоціації. Константу швидкості дисоціації (Kd) розраховують зі співвідношення koff/kon (див., наприклад, Chen Y., та ін., J. Mol. Biol. 293, 1999, сс. 865-881). Якщо швидкість асоціації («on-rate») перевищує 10бМ-1с-1 при аналізі за допомогою описаного вище резонансу поверхневого плазмону, то 57 цю швидкість можна визначати з використанням методу гасіння флуоресценції, який дозволяє оцінювати підвищення або зниження інтенсивності флуоресценції, що випромінюється (довжина хвилі збудження 295нм; випромінювання 340нм, смуга пропускання 16нм) при 25°С при концентрації антитіла до антигену 20нМ (Fab-форма) у ЗФР при 7,2 у присутності зростаючих концентрацій антигену, здійснюючи оцінку за допомогою спектрометра, такого як спектрофотометр, обладнаний діафрагмою (фірма Aviv Instruments) або спектрофотометра 8000-серій типу SLM-Aminco (фірма ThermoSpectronic) із кюветою, що перемішується. В одному з варіантів здійснення винаходу «Kd» або «значення Kd» оцінюють за допомогою аналізу зв'язування радіоактивноміченого антигену (РІА), для здійснення якого використовують версію Fab-фрагмента антитіла, яке являє інтерес, і його антиген, як описано в наведеному нижче аналізі, при здійсненні якого вимірюють афінність до зв'язування Fab-фрагментів з антигеном у розчині шляхом урівноважування Fab-фрагмента мінімальною концентрацією міченого за допомогою 125I антигену в присутності титращиних серій неміченого антигену з наступним захопленням зв'язаного антигену нанесеним на планшет антитілом до Fab (Chen, та ін., J. Mol. Biol. 293, 1999, сс. 865-881). Для визначення умов аналізу титраційні планшети (фірми Dynex) сенсибілізують протягом ночі 5мкг/мл захоплюючого антитіла до Fab (фірми Cappel Labs) в 50мМ карбонату натрію (рН 9,6) і потім блокують за допомогою 2% (мас./об.) бичачого сироваткового альбуміну у ЗФР протягом 2-5 год. при кімнатній температурі (приблизно 23°С). При застосуванні планшетів без адсорбенту (Nunc № 269620), 100пМ або 26пМ [125І]-антиген змішують із серійними розведеннями Fab, що являє інтерес, (наприклад, при використанні антитіла до VEGF Fab-12, описаного Presta та ін., Cancer Res. 57, 1997, сс. 4593-4599). Потім Fab, що являє інтерес, інкубують протягом ночі; однак інкубацію можна продовжувати протягом більш тривалого періоду (наприклад, протягом 65 год.) для гарантії того, що рівновагу досягнуто. Потім суміші переносять на планшет для захоплення та витримують при кімнатній температурі (наприклад, протягом 1 год.). Потім розчин видаляють, і планшет промивають 8 разів 0,1% Твін-20 у ЗФР. Після висушування планшета додають 150мкл/лунку сцинтиляційного розчину (MicroScint-20; фірма Packard) і визначають радіоактивність планшета за допомогою лічильника випромінювання гамма-квантів (фірма Packard) протягом 10 хв. Для застосування в конкурентних аналізах зв'язування вибирають концентрації кожного Fab, при яких рівень зв'язування є меншим або дорівнює 20% від максимального. Відповідно до іншого варіанта здійснення винаходу Kd або значення Kd визначають за допомогою резонансу поверхневого плазмону з використанням пристрою ВІАcore-2000 або ВІАcore-3000 (фірма BIAcore, Inc., Піскатавей, шт. Нью-Джерсі) при 25°С з використанням чипів з імобілізованим антигеном типу СМ5 при ~10 одиницях відповіді (RU). У цілому метод полягає у наступному: біосенсорні чипи (СМ5, фірма BIAcore 93875 58 Inc.) з карбоксиметилованого декстрану активують гідрохлоридом Ν-етил-Ν'-(3диметиламінопропіл)карбодііміду (ЕДК) і Nгідроксисукцинімідом (NHS) відповідно до інструкцій постачальника. Антиген розводять в 10мМ ацетаті натрію, рН 4,8 до концентрації 5мкг/мл (~0,2мк) перед ін'єкцією при швидкості потоку 5мкл/хв. для досягнення приблизно 10 одиниць відповіді (RU) зшитого білка. Після ін'єкції антигену ін'єкують 1M етаноламін для того, щоб блокувати групи, які непрореагували. Для кінетичних вимірювань дворазові серійні розведення Fab (від 0,78 до 500нМ) ін'єкують у ЗФР, доповненому 0,05% Твін20 (ЗФР) при 25°С при швидкості потоку приблизно 25мкл/хв. Швидкість асоціації (kon) і швидкість дисоціації (koff) розраховують за допомогою простої (1:1) моделі зв'язування Ленгмюра (програма BIAcore Evaluation, версія 3.2) шляхом одночасної апроксимації сенсограм асоціації та дисоціації. Константу швидкості дисоціації (Kd) розраховують зі співвідношення koff/kon (див., наприклад, Chen, Υ., та ін., J. Mol. Biol. 293, 1999, сс. 865-881). Якщо швидкість асоціації («on-rate») перевищує 106М-1с-1 при аналізі за допомогою описаного вище резонансу поверхневого плазмону, то цю швидкість можна визначати з використанням методу гасіння флуоресценції, який дозволяє оцінювати підвищення або зниження інтенсивності флуоресценції, що випромінюється (довжина хвилі збудження 295нм; випромінювання 340нм, смуга пропускання 16нм) при 25°С при концентрації антитіла до антигену 20нМ (Fab-форма) у ЗФР, 7,2 у присутності зростаючих концентрацій антигену, здійснюючи оцінку за допомогою спектрометра, такого як спектрофотометр, обладнаний діафрагмою (фірма Aviv Instruments) або спектрофотометра 8000серій типу SLM-Aminco (фірма ThermoSpectronic) із кюветою, що перемішується. «On-rate» або «швидкість асоціації» або «kon» відповідно до даного винаходу можна визначати також за допомогою такого ж методу резонансу поверхневого плазмону, що описаний вище, з використанням ВІАcore-2000 або ВІАcore-3000 (фірма BIAcore, Inc., Піскатавей, шт. Нью-Джерсі) при 25°С з використанням чипів з імобілізованим антигеном типу СМ5 при ~10 одиницях відповіді (RU). У цілому метод полягає у наступному: біосенсорні чипи (СМ5, фірма BIAcore Inc.) з карбоксиметилованого декстрану активують гідрохлоридом N-етил-N'-(3-диметиламінопропіл)карбодііміду (ЕДК) і N-гідроксисукцинімідом (NHS) відповідно до інструкцій постачальника. Антиген розводять в 10мМ ацетаті натрію, рН 4,8 до концентрації 5мкг/мл (~0,2мк) перед ін'єкцією при швидкості потоку 5мкл/хв. для досягнення приблизно 10 одиниць відповіді (RU) зшитого білка. Після ін'єкції антигену ін'єкують 1M етаноламін для того, щоб блокувати групи, які непрореагували. Для кінетичних вимірювань дворазові серійні розведення Fab (від 0,78 до 500нМ) ін'єкують у ЗФР, доповненому 0,05% Tween-20 (ЗФР) при 25°С при швидкості потоку приблизно 25мкл/хв. Швидкість асоціації (kon) і швидкість дисоціації (koff) розраховують за допомогою простої (1:1) моделі зв'язування Ленгмюра (програма BIAcore Evaluation, версія 3.2) 59 шляхом одночасної апроксимації сенсограм асоціації та дисоціації. Константу швидкості дисоціації (Kd) розраховують зі співвідношення koff/kon (див., наприклад, Chen Y., та ін., J. Mol. Biol. 293, 1999, сс. 865-881). Якщо швидкість асоціації («on-rate») перевищує 106М-1с-1 при аналізі за допомогою описаного вище резонансу поверхневого плазмону, то цю швидкість можна визначати з використанням методу гасіння флуоресценції, який дозволяє оцінювати підвищення або зниження інтенсивності флуоресценції, що випромінюється (довжина хвилі збудження 295нм; випромінювання 340нм, смуга пропускання 16нм) при 25°С при концентрації антитіла до антигену 20нМ (Fab-форма) у ЗФР при 7,2 у присутності зростаючих концентрацій антигену, здійснюючи оцінку за допомогою спектрометра, такого як спектрофотометр, обладнаний діафрагмою (фірма Aviv Instruments) або спектрофотометра 8000-серій типу SLM-Aminco (фірма ThermoSpectronic) із кюветою, що перемішується. Фраза «істотно знижений» або «істотно відмінний» у контексті даного опису означає досить високий рівень розходження між двома чисельними значеннями (як правило, між одним, яке відповідає антитілу, пропонованому у винаході, і іншим, яке відповідає «референс»антитілу/застосовуваному для порівняння антитілу), так що спеціаліст у даній галузі може розглядати розходження між двома величинами як статистично значиме в контексті біологічної характеристики, що описується цими значеннями (наприклад, значення Kd, НАМА-відповідь). Розходження між двома зазначеними значеннями переважно перевищує приблизно на 10%, переважно перевищує приблизно на 20%, переважно перевищує приблизно на 30%, переважно перевищує приблизно на 40%, переважно перевищує приблизно на 50% відповідне значення для «референс»антитіла/застосовуваного для порівняння антитіла. Поняття «антиген» стосується, насамперед, до антигену, з яким антитіло може вибірково зв'язуватися. Антиген-мішень може являти собою поліпептид, вуглевод, нуклеїнову кислоту, ліпід, гаптен або іншу сполуку, що зустрічається у природних умовах або синтетичну сполуку. Переважно антиген-мішень являє собою поліпептид. Поняття «акцепторна людська каркасна ділянка» у контексті даного опису означає каркасну ділянку, яка містить амінокислотну послідовність каркасної ділянки VL або VH, виведену з каркасної ділянки людського імуноглобуліну або людської консенсусної каркасної ділянки. Акцепторна людська каркасна ділянка, «виведена» з каркасної ділянки людського імуноглобуліну або людської консенсусної каркасної ділянки, може мати таку ж амінокислотну послідовність або може нести раніше існуючі заміни в амінокислотній послідовності. Якщо раніше існуючі амінокислотні заміни присутні, то вони переважно присутні в кількості не більш ніж 5 і переважно в кількості 4 або менше, або 3 або менше. Якщо раніше існуючі амінокислотні заміни присутні в VH, то переважно ці заміни зачіпають тільки 3, 2 або 1 з положень 71Н, 73Н і 78Н; наприклад, амінокислотні залишки в цих положеннях можуть являти собою 71А, 73Т і/або 78А. В одному з варіантів 93875 60 здійснення винаходу акцепторна людська каркасна ділянка VL ідентична послідовності каркасної ділянки VL людського імуноглобуліну або послідовності людської консенсусної каркасної ділянки. Антитіла, пропоновані в даному винаході, можуть мати здатність конкурувати за зв'язування із цим же епітопом, з яким зв'язується друге антитіло. Моноклональні антитіла розглядаються як такі, що мають «один і той же епітоп», якщо кожне з них блокує зв'язування іншого на 40% або більше при використанні однакової концентрації антитіла за даними стандартного аналізу конкурентного зв'язування антитіла in vitro. «Людська консенсусна каркасна ділянка» являє собою каркасну ділянку, що складається з амінокислотних залишків, що найбільш часто зустрічаються у відібраних послідовностях каркасної ділянки VL або VH людського імуноглобуліну. Як правило, VL- або VH-послідовності людського імуноглобуліну вибирають із підгрупи послідовностей варіабельної ділянки. Як правило, підгрупа послідовностей являє собою підгрупу за Кеботом зі співавторами. В одному з варіантів здійснення винаходу для VL підгрупа являє собою підгрупу капа І за Кеботом зі співавторами. В іншому варіанті здійснення винаходу для VH підгрупа являє собою підгрупу III за Кеботом зі співавторами. «Консенсусна каркасна ділянка підгрупи III VH» містить консенсусну послідовність, одержану з амінокислотних послідовностей підгрупи III варіабельної ділянки важкого ланцюга за Кеботом зі співавторами. «Консенсусна каркасна ділянка підгрупи І VL» містить консенсусну послідовність, одержану з амінокислотний послідовностей підгрупи І варіабельного легкого капа-ланцюга за Кеботом зі співавторами. «Немодифікована людська каркасна ділянка» являє собою людську каркасну ділянку, що має таку ж амінокислотну послідовність, як й акцепторна людська каркасна ділянка, наприклад, при цьому в акцепторній людській каркасній ділянці відсутня(і) заміна(и) людських амінокислот на амінокислоти, що не належать людині. «Змінена гіперваріабельна ділянка» у контексті даного опису являє собою гіперваріабельну ділянку, що містить одну або декілька (наприклад, від 1 до приблизно 16) амінокислотних замін. «Немодифікована гіперваріабельна ділянка» у контексті даного опису являє собою гіперваріабельну ділянку, яка має таку ж амінокислотну послідовність, як й антитіло з організму крім людини, з якого воно виведено, тобто в ньому відсутня одна або декілька амінокислотних замін. Поняття «гіперваріабельна ділянка», «HVR» або «HV» у контексті даного опису стосується ділянок варіабельної ділянки антитіла, послідовність яких є гіперваріабельною і/або утворює структурно визначені петлі. Як правило, антитіла містять 6 гіперваріабельних ділянок; три в VH (Н1, Н2, Н3) і три в VL (L1, L2, L3). Застосовують декілька визначень гіперваріабельних ділянок і всі вони підпадають під обсяг даного винаходу. Основою ділянок, що визначають комплементарність, (CDR) за Кеботом є варіабельність послідовностей, і така
ДивитисяДодаткова інформація
Назва патенту англійськоюIsolated chimeric or humanized antibody that binds to a tat10772 (ca125) polypeptide
Автори англійськоюDennis Mark, Mallet William, Polakis, Paul
Назва патенту російськоюВыделенное химерическое или гуманизированное антитело, kotopoe специфически связывается c полипептидом tat10772 (ca125)
Автори російськоюДеннис Марк, Маллет Вилльям, Полакис Пол
МПК / Мітки
МПК: C12N 5/24, G01N 33/574, A61K 39/395, C07K 16/30, A61P 35/00
Мітки: химерне, специфічно, поліпептидом, гуманізоване, виділене, яке, са125, антитіло, зв'язується, тат10772
Код посилання
<a href="https://ua.patents.su/235-93875-vidilene-khimerne-abo-gumanizovane-antitilo-yake-specifichno-zvyazuehtsya-z-polipeptidom-tat10772-sa125.html" target="_blank" rel="follow" title="База патентів України">Виділене химерне або гуманізоване антитіло, яке специфічно зв’язується з поліпептидом тат10772 (са125)</a>
Попередній патент: Ссп-спарена система подачі зондів
Наступний патент: Спосіб приготування гіпсового розчину з модифікаторами та пластифікаторами
Випадковий патент: Спосіб визначення параметрів дифузійного шару при хіміко-термічній обробці