Композиції телмісартану у формі наночастинок та спосіб їх одержання
Номер патенту: 107463
Опубліковано: 12.01.2015
Автори: Філіпчеі Геновева, Етвьош Жольт, Дарваш Ференц, Понграц Каталін
Формула / Реферат
1. Стабільна композиція наноструктурованого телмісартану, яка містить:
(a) наноструктурований телмісартан, що має середній розмір частинок менш ніж приблизно 600 нм; і
(b) щонайменше один стабілізатор, вибраний з групи полівінілпіролідону ідодецилсульфату натрію,
де композиція отримана в протоковому реакторі безперервної дії, краще в протоковому реакторі безперервної дії на основі мікроструминної техніки, та одержана композиція є частково кристалічною або аморфною.
2. Композиція за п. 1, де середній розмір частинок телмісартану становить від 600 нм до 50 нм, краще від 200 нм до 50 нм.
3. Спосіб одержання композиції наноструктурованого телмісартану за будь-яким з пп. 1-2, що включає осадження наноструктурованого телмісартану з розчину телмісартану та щонаймешпе одного стабілізатора, вибраного з групи полівінілпіролідону і додецилсульфату натрію, якщо бажано, в присутності фармацевтично прийнятної кислоти, у протоковому реакторі безперервної дії, краще в протоковому реакторі безперервної дії на основі мікроструминної техніки.
4. Спосіб за п. 3, який включає (1) розчинення телмісартану та одного або більш ніж одного стабілізатора в розчині гідроксиду лужного металу; (2) додавання до розчину зі стадії (1) розчину фармацевтично прийнятної кислоти, який можливо містить один або більш ніж один стабілізатор, і (3) осадження композиції зі стадії (2).
5. Спосіб за п. 4, де розчин гідроксиду лужного металу є розчином гідроксиду натрію, і фармацевтично прийнятна кислота є оцтовою кислотою, лимонною кислотою, малеїновою кислотою, щавлевою кислотою, мурашиною кислотою або бензойною кислотою, краще оцтовою кислотою.
6. Спосіб за п. 4 або 5, який включає використання двох різних розчинників, що змішуються один з одним, де телмісартан є розчинним тільки в одному з них.
Текст
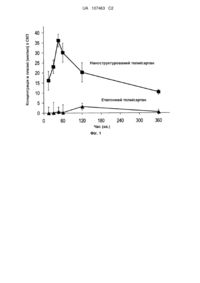
Реферат: Винахід стосується композицій наноструктурованого телмісартану із розміром частинок менш ніж приблизно 600 нм та способу їх одержання. UA 107463 C2 (12) UA 107463 C2 UA 107463 C2 5 10 15 20 25 30 35 40 45 ОБЛАСТЬ ВИНАХОДУ Даний винахід спрямований на композиції наноструктурованого (у формі наночастинок) телмісартану, на спосіб їх одержання та фармацевтичні композиції, що їх містять. Наночастинки телмісартану відповідно до винаходу мають середній розмір частинок менш ніж приблизно 600 нм. Телмісартан є антагоністом рецептора ангіотензину II (ARB), застосовуваним при лікуванні гіпертензії. ПОПЕРЕДНІЙ РІВЕНЬ ТЕХНІКИ А. Попередній рівень техніки, що стосується утворення/одержання наночастинок Розробка наночастинок для фармацевтичних застосувань має справу з виникненням нових технологій для розвитку виробничих рішень під замовлення для систем доставки ліків. Системи доставки ліків повинні позитивно впливати на швидкість всмоктування, розподіл, метаболізм і виведення ліків або інших споріднених хімічних речовин в організмі. Крім того, система доставки ліків повинна давати можливість лікам зв'язуватися з їх рецептором-мішенню та впливати на передачу сигналу та активність цього рецептора. Матеріали для доставки ліків повинні бути сумісними з ними, легко зв'язуватися з конкретними ліками та мати здатність розкладатися на фрагменти після застосування, які або зазнають метаболізму, або виводяться через нормальні екскреторні шляхи. Інший підхід полягає в одержанні активного інгредієнта (активний фармацевтичний інгредієнт, АФІ) у формі наночастинок. Композиція телмісартану описана в заявках на патент US 20020094997, US2009/0030057 A1, US 20090012140 і EP 1797872 A1. Наночастинки АФІ можуть бути отримані, використовуючи, наприклад, методи здрібнювання, гомогенізації, осадження або методи надкритичних середовищ, які відомі в даній області техніки. Способи одержання композицій у формі наночастинок також описані в US 5718388, US 5862999, US 5665331, US 5543133, US 5534270. Б. Попередній рівень техніки, що стосується телмісартану Телмісартан хімічно описаний як 4'-[(1,4'-диметил-2'-пропіл[2,6'-бі-1H-бензімідазол]-1’іл)метил]-[1,1’-дифеніл]-2-карбонова кислота. Його емпіричною формулою є C33H30N4O2, його молекулярна маса дорівнює 514,63, і його структурною формулою є: Телмісартан є твердою речовиною від білого до трохи жовтуватого кольору. Він практично нерозчинний у воді та в діапазоні pH від 3 до 9, слаборозчинний у сильній кислоті (за винятком нерозчинності в соляній кислоті) і розчинний у сильній основі. Телмісартан є в продажу у вигляді таблеток для перорального введення, що містять 20 мг, 40 мг або 80 мг телмісартану. Таблетки містять нижченаведені неактивні інгредієнти: гідроксид натрію, меглумін, повідон, сорбіт і стеарат магнію. Таблетки гігроскопічні та потребують захисту від вологи. Фармакологічні властивості Після перорального введення пікові концентрації (Cmax) телмісартану досягаються за 0,5-1 годину після дозування. Їжа трохи зменшує біодоступність телмісартану при зниженні площі під кривою концентрації плазми за часом (AUC) приблизно 6 % для таблетки 40 мг і приблизно 20 % після дози 160 мг. Абсолютна біодоступність телмісартану є дозазалежною. При дозі 40 і 160 мг біодоступність становила 42 % і 58 %, відповідно. Фармакокінетика введеного перорально телмісартану є нелінійною в межах діапазону доз 20-160 мг із більш ніж пропорційними зростаннями концентрацій у плазмі (Cmax і AUC) при зростаючих дозах. Телмісартан демонструє кінетику біекспоненціального розпаду з кінцевим періодом напіввиведення приблизно 24 години. Концентрації в плазмі телмісартану при однократному 1 UA 107463 C2 5 10 15 20 25 30 35 40 45 50 55 дозуванні за добу становлять 10-25 % пікових концентрацій у плазмі. Телмісартан має індекс накопичення в плазмі від 1,5 до 2,0 при повторному дозуванні один раз на добу. Метаболізм та елімінація Після внутрішньовенного або перорального введення 14C-міченого телмісартану більша частина введеної дози (> 97 %) була елімінована незміненою у фекаліях шляхом біліарної екскреції; лише незначні кількості були виявлені в сечі (0,91 % і 0,49 % сумарної радіоактивності, відповідно). Телмісартан зазнає метаболізму шляхом кон'югації з утворенням фармакологічно неактивного ацилглюкуроніду; глюкуронід батьківської сполуки є єдиним метаболітом, який ідентифікований у плазмі та сечі людини. Після однократної дози глюкуронід представляє приблизно 11 % вимірюваної радіоактивності в плазмі. Ізоферменти цитохрому P450 не залучені в метаболізм телмісартану. Загальний кліренс телмісартану становить більше 800 мл/хв. Кінцевий період напіввиведення та загальний кліренс виявилися незалежними від дози. Розподіл Телмісартан у високому ступені зв'язується з білками плазми (> 99,5 %), в основному, з альбуміном і α1-кислим глікопротеїном. Зв'язування білків плазми є постійним в межах діапазону концентрації, що досягається при рекомендованих дозах. Об'єм розподілу для телмісартану становить приблизно 500 літрів, що вказує на додаткове тканинне зв'язування. Побічні ефекти Найчастіше спонтанно повідомлюваними побічними ефектами є: головний біль, запаморочення, астенія, кашель, нудота, стомлюваність, слабість, набряклість, набряклість обличчя, набряклість нижніх кінцівок, ангіоневротичний набряк, кропивниця, гіперчутливість, підвищене потовиділення, еритема, біль у грудній клітині, миготлива аритмія, застійна серцева недостатність, інфаркт міокарда, підвищений кров'яний тиск, загострення гіпертензії, гіпотензія (включаючи постуральну артеріальну гіпотензію), гіперкалемія, синкопе, диспепсія, діарея, біль, інфекція сечових шляхів, еректильна дисфункція, біль у спині, біль у животі, м'язові судороги (включаючи судороги ніг), міалгія, брадикардія, еозинофілія, тромбоцитопенія, підвищена сечова кислота, аномальна функція печінки/розлад печінки, порушення функції нирок, включаючи гостру ниркову недостатність, анемія та підвищена креатинфосфокіназа (КФК). У зв'язку з нерозчинністю телмісартану у воді в даній області техніки існує потреба в посиленні ліпофільності/біодоступності/підвищенні всмоктування/зниженні побічних ефектів/зменшенні дозування/зниженні харчового ефекту з метою подолання проблем, пов'язаних із застосуванням загальноприйнятих препаратів телмісартану попереднього рівня техніки. Крім того, ці проблеми можуть бути вирішені шляхом поверхневої модифікації, щоб зменшити пресистемний метаболізм або модифікувати метаболізм телмісартану. Крім традиційного препарату телмісартану, черезшкірне застосування могло б зменшити час, потрібний для досягнення бажаного ефекту телмісартану. Даний винахід задовольняє цю потребу. ОПИС ВИНАХОДУ У даному винаході описана наноструктурована композиція телмісартану (у формі наночастинок) з посиленою ліпофільністю/біодоступністю/підвищеним всмоктуванням і швидкістю розчинення/зниженими побічними ефектами/зниженим дозуванням. Як описано в прикладах далі, не кожна комбінація стабілізаторів приведе в результаті до стабільного утворення наночастинок. Було виявлено, що стабільні наночастинки телмісартану можуть бути отримані безперервним протоковим способом, краще, безперервним протоковим способом на основі мікроструминної техніки, використовуючи вибрані стабілізатори. Винахід включає наноструктурований телмісартан, що має середній розмір частинок менш ніж приблизно 600 нм. Наноструктурований телмісартан відповідно до винаходу має середній розмір частинок від 600 нм до 50 нм, краще, від 200 нм до 50 нм. Наступним аспектом винаходу є композиція наноструктурованого телмісартану, яка містить: (a) наноструктурований телмісартан, що має середній розмір частинок менш ніж приблизно 600 нм; і (b) щонайменше один стабілізатор. Композицію за винаходом одержують у протоковому реакторі безперервної дії, краще, в протоковому реакторі безперервної дії на основі мікроструминної техніки. У композиції за винаходом середній розмір частинок телмісартану, краще, становить від 600 нм до 50 нм, краще, від 200 нм до 50 нм. 2 UA 107463 C2 5 10 15 20 25 30 35 40 45 50 55 60 У композиції за винаходом: (a) телмісартан є присутнім в кількості, вибраній з групи, що складається з: від приблизно 99,5 % до приблизно 0,001 %, від приблизно 95 % до приблизно 0,1 %, і від приблизно 90 % до приблизно 0,5 % мас/мас, на основі сумарної об'єднаної маси телмісартану та щонайменше одного стабілізатора, не включаючи інші ексципієнти; (b) стабілізатор присутній в кількості, вибраній з групи, що складається з: від приблизно 0,5 % до приблизно 99,999 % мас/мас, від приблизно 5,0 % до приблизно 99,9 % мас/мас, і від приблизно 10 % до приблизно 99,5 % мас/мас, на основі сумарної об'єднаної сухої маси телмісартану та щонайменше одного стабілізатора, не включаючи інші ексципієнти; або (c) комбінація (a) і (b). У композиції за винаходом телмісартан можна використовувати в кристалічній фазі, аморфній фазі, напівкристалічній фазі, напіваморфній фазі та фазі співкристала, а також в їх сумішах у будь-якій поліморфній формі. Для одержання композиції за винаходом можна використовувати стабілізатори, що включають неіонні, аніонні, катіонні, іонні полімери/сурфактанти та цвітеріонні сурфактанти. Комбінації більш ніж одного стабілізатора також можна використовувати у винаході. Корисні стабілізатори, які можна використовувати у винаході, включають, але без обмеження ними, будь-які органічні та неорганічні фармацевтичні ексципієнти. Такі ексципієнти включають різні полімери, низькомолекулярні олігомери, натуральні продукти та сурфактанти. Репрезентативні приклади стабілізаторів включають гідроксипропілметилцелюлозу, гідроксипропілцелюлозу, полівінілпіролідон, лаурилсульфат натрію, желатин, декстран, стеаринову кислоту, гліцеринмоностеарат, цетостеариловий спирт, складні ефіри сорбіту, поліоксіетиленові похідні касторової олії, поліоксіетиленові ефіри сорбіту та жирної кислоти (наприклад, наявні в продажу продукти Твін®, такі як, наприклад, Твін® 20 і Твін® 80 (ICI Speciality Chemicals)); поліетиленгліколі (наприклад, Карбовакс® 3550 і 934 (Union Carbide), полімери та співполімери на основі полі(мет)акрилату (Eudargit®), співполімер етенілового ефіру оцтової кислоти та 2-піролідинону (співполімери PVP/VA), додецилбензолсульфонат натрію, сукцинати токоферилполіетиленгліколю, поліетоксиловані касторові олії та їх похідні, поліоксіетиленстеарати, метилцелюлозу, гідроксіетилцелюлозу, ацетофталат целюлози, полівініловий спирт (PVA), співполімер 4-(1,1,3,3-тетраметилбутил)-фенолу з етиленоксидом і формальдегідом (також відомий як тилоксапол, суперіон і тритон), полоксамери (наприклад, плюроніки, які є блок-співполімерами етиленоксиду та пропіленоксиду); полоксаміни (наприклад, тетронік, також відомий як полоксамін, який є тетрафункціональним блокспівполімером, утвореним в результаті послідовного приєднання пропіленоксиду та етиленоксиду до етилендіаміну (BASF Wyandotte Corporation, Parsippany, N.J.); ПЕГ-фосфоліпід, ПЕГ-холестерин, похідне ПЕГ-холестерину, ПЕГ-вітамін A, ПЕГ-вітамін E, лізоцим, полі(2оксазолін), полі(метилвініловий ефір), статистичні співполімери вінілпіролідону та вінілацетату, такі як Plasdone S630, і таке інше. Приклади корисних іонних стабілізаторів включають, але без обмеження ними, полімери, біополімери, полісахариди, целюлозні полімери, альгінати, фосфоліпіди та неполімерні сполуки, такі як цвітеріонні стабілізатори, полі-н-метилпіридиній, антрилпіридинію хлорид, катіонні фосфоліпіди, хітозан, полілізин, полівінілімідазол, полібрен, співполімер поліметилметакрилату та триметиламонію броміду (PMMTMABr), бензалконію хлорид, гексадецилтриметиламонію бромід, гексилдезилтриметиламонію бромід (HDMAB) і полі(вінілпіролідон)-2диметиламіноетилметакрилату диметилсульфат. Переваги композиції за винаходом включають, але без обмеження ними: (1) менший розмір таблетки або іншої твердої лікарської форми та сприятливе черезшкірне/місцеве застосування; (2) більш низькі дози ліків, потрібні для одержання такого ж фармакологічного ефекту в порівнянні із загальноприйнятими формами телмісартану; (3) підвищену біодоступність у порівнянні із загальноприйнятими формами телмісартану; (4) поліпшені фармакокінетичні профілі; (5) підвищену швидкість розчинення для наночастинок телмісартану у порівнянні із загальноприйнятими формами тієї ж активної сполуки; (6) модифікований метаболізм наночастинок телмісартану. Для одержання композиції за винаходом можна використовувати способи, що включають безперервне осадження розчинником-осаджувачем, використовуючи один або більш ніж один стабілізатор, або безперервне хімічне осадження з використанням одного або більш ніж одного стабілізатора з утворенням наночастинок без перетворення форми телмісартану або утворення аморфних ліків і без попередньої стерилізації. Інший аспект винаходу є способом одержання наноструктурованого телмісартану, який включає осадження наноструктурованого телмісартану з відповідного розчину телмісартану, що містить один або більш ніж один стабілізатор, якщо бажано, в присутності фармацевтично прийнятної кислоти, у протоковому реакторі безперервної дії. 3 UA 107463 C2 5 10 15 20 25 30 35 40 45 50 55 60 Як протоковий реактор безперервної дії можна використовувати протоковий реактор безперервної дії на основі мікроструминної техніки. Використовуваний протоковий реактор безперервної дії на основі мікроструминної техніки описаний у публікації Microfluid Nanofluid DOI 10.1007/s10404-008-0257-9 авторами I. Hornyak, B. Borcsek і F. Darvas. Краще, цей спосіб можна здійснювати шляхом (1) розчинення телмісартану та, можливо, одного або більш ніж одного стабілізатора в придатному розчиннику; (2) додавання композиції зі стадії (1) до розчину, що можливо містить стабілізатор(и), якщо бажано, в присутності фармацевтично прийнятної кислоти; і (3) осадження композиції зі стадії (2). Іншою кращою формою здійснення цього способу є така, де спосіб здійснюють шляхом (1) розчинення телмісартану та, можливо, одного або більш ніж одного стабілізатора в придатному розчиннику; (2) додавання композиції зі стадії (1) до розчину, що містить один або більш ніж один стабілізатор, якщо бажано, в присутності фармацевтично прийнятної кислоти; і (3) осадження композиції зі стадії (2). Найкраще, спосіб за винаходом здійснюють шляхом (1) розчинення телмісартану та одного або більш ніж одного стабілізатора в розчині гідроксиду лужного металу; (2) додавання композиції зі стадії (1) до розчину фармацевтично прийнятної кислоти, що можливо містить один або більш ніж один стабілізатор; і (3) осадження композиції зі стадії (2). Як розчинники (a) можна використовувати два різні розчинники, що змішуються один з одним, де телмісартан є розчинним тільки в одному з них, або (b) можна використовувати той самий розчинник на двох стадіях, де поліелектролітний комплекс телмісартану утворює наноструктуровані частинки, практично, з тим обмеженням, що застосовуваний стабілізатор є розчинним у використовуваних розчинниках. Такі розчинники можуть, краще, бути розчинами гідроксидів лужних металів, краще, розчином гідроксиду натрію, диметилсульфоксидом, етанолом, ізопропанолом, тетрагідрофураном, ацетоном, метилетилкетоном, диметилформамідом, етиловим ефіром діетиленгліколю. Як фармацевтично прийнятні кислоти можна використовувати оцтову кислоту, лимонну кислоту, малеїнову кислоту, щавлеву кислоту, мурашину кислоту, бензойну кислоту і таке інше. На розмір частинок телмісартану у формі наночастинок можуть впливати використовувані розчинники, швидкість течії та відношення телмісартану до стабілізатора. Інший аспект винаходу спрямований на гарну/миттєву повторну диспергованість твердої наномерної форми телмісартану в біологічно релевантних середовищах, наприклад, у фізіологічному розчині, розчині HCl з pH=2,5. Іншим аспектом винаходу є стабільна фармацевтична композиція, що містить телмісартан у формі наночастинок або його композицію відповідно до винаходу та, можливо, фармацевтично прийнятні допоміжні речовини. Фармацевтичну композицію за винаходом можна готовити: (a) для введення, вибраного з групи, що складається з перорального, легеневого, ректального, товстокишкового, парентерального, інтрацистернального, інтравагінального, внутрішньоочеревинного, очного, вушного, локального, трансбукального, назального та місцевого введення; (b) у лікарській формі, вибраній з групи, що складається з рідких дисперсій, гелів, аерозолів, мазей, кремів, ліофілізованих препаратів, таблеток, капсул; (c) у лікарській формі, вибраній з групи, що складається з препаратів регульованого вивільнення, препаратів, що швидко плавляться, препаратів уповільненого вивільнення, препаратів пролонгованого вивільнення, препаратів імпульсного вивільнення і змішаних препаратів швидкого вивільнення та регульованого вивільнення; або (d) будь-якої комбінації (a), (b) і (c). Композиції можна готовити шляхом додавання різних типів ексципієнтів для перорального введення у твердих, рідких, вагінальних, ректальних, локальних (порошки, мазі або краплі) або місцевих формах введення тощо. Кращою лікарською формою за винаходом є тверда або рідка (крем/мазь) лікарська форма, хоча можна використовувати будь-яку фармацевтично прийнятну лікарську форму. Для пероральної доставки в організм людини наночастинки можна також вводити у вигляді їх водної дисперсії як готової лікарської форми. Цей шлях є шляхом доставки без додаткової обробки після утворення наночастинок. Однак слабка розчинність ліків або полімеру у водному середовищі або поганий смак ліків може вимагати включення колоїдних частинок у тверді лікарські форми, тобто в капсули та таблетки. Альтернативно, водну дисперсію колоїдних частинок можна включати у тверду лікарську форму у вигляді рідини, наприклад, шляхом грануляції придатних наповнювачів з колоїдною дисперсією з утворенням гранулята. Такі гранули можна згодом заповнювати в капсули або 4 UA 107463 C2 5 10 15 20 25 30 35 40 45 50 55 60 пресувати в таблетки. Альтернативно, шляхом нашаровування дисперсії, наприклад, на цукрові пігулки як носії у псевдозрідженому шарі можна одержати тверду форму наночастинок. За цими шляхами виготовлення серцевин таблеток, або гранул, або пігулок може потенційно йти стадія покриття з одержанням таблетки із плівковим покриттям або гранул із плівковим покриттям у капсулі як готової лікарської форми. Композиції, придатні для парентеральної ін'єкції, можуть містити фізіологічно прийнятні стерильні водні чи неводні розчини, дисперсії, суспензії або емульсії, а також стерильні порошки для відновлення в стерильних ін'єкційних розчинах або дисперсіях. Приклади придатних водних і неводних носіїв, розріджувачів, розчинників або наповнювачів включають воду, етанол, поліоли (пропіленгліколь, поліетиленгліколь, гліцерин і таке інше), їх придатні суміші, рослинні олії (такі як маслинова олія) та ін'єкційні органічні ефіри, такі як етилолеат. Відповідну плинність можна підтримувати, наприклад, шляхом використання покриття, такого як лецитин, шляхом підтримання необхідного розміру частинок у випадку дисперсій і шляхом використання сурфактантів. Тверді лікарські форми для перорального введення включають, але без обмеження ними, капсули, таблетки, пігулки, порошки та гранули. У таких твердих лікарських формах активний агент змішаний щонайменше з одним із вказаного нижче: (a) один або більш ніж один інертний ексципієнт (або носій), такий як цитрат натрію або двозаміщений фосфат кальцію; (b) наповнювачі або розріджувачі, такі як крохмалі, лактоза, сахароза, глюкоза, маніт і кремнієва кислота; (c) зв'язувальні речовини, такі як карбоксиметилцелюлоза, альгінати, желатин, полівінілпіролідон, сахароза і аравійська камедь; (d) зволожувачі, такі як гліцерин; (e) розпушувачі, такі як агар-агар, карбонат кальцію, картопляний або тапіоковий крохмаль, альгінова кислота, деякі комплексні силікати та карбонат натрію; (f) сповільнювачі розчинення, такі як парафін; (g) прискорювачі всмоктування, такі як сполуки четвертинного амонію; (h) змочувальні агенти, такі як цетиловий спирт і гліцерилмоностеарат; (i) адсорбенти, такі як каолін і бентоніт; і (j) змащувальні речовини, такі як тальк, стеарат кальцію, стеарат магнію, тверді поліетиленгліколі, лаурилсульфат натрію або їх суміші. Для капсул, таблеток і пігулок лікарські форми можуть також містити буферні агенти. Рідкі лікарські форми для перорального введення включають фармацевтично прийнятні емульсії, розчини, суспензії, сиропи та еліксири. На додаток до телмісартану рідкі лікарські форми можуть містити інертні розріджувачі, звичайно використовувані в даній області техніки, такі як вода або інші розчинники, солюбілізувальні агенти та емульгатори. Зразковими емульгаторами є етиловий спирт, ізопропіловий спирт, етилкарбонат, етилацетат, бензиловий спирт, бензилбензоат, пропіленгліколь, 1,3-бутиленгліколь, диметилформамід, масла, такі як бавовняна олія, олія земляного горіха, олія паростків пшениці, маслинова олія, касторова олія та кунжутна олія, гліцерин, тетрагідрофурфуриловий спирт, поліетиленгліколі, ефіри сорбіту та жирних кислот, або суміші цих речовин і таке інше. Крім таких інертних розріджувачів, композиція може також включати ад'юванти, такі як змочувальні агенти, емульгувальні та суспендувальні агенти, підсолоджувальні, коригувальні та ароматизуючі агенти. Фармацевтичні композиції за винаходом виявляють посилену ліпофільность/біодоступність/підвищену швидкість всмоктування та розчинення/знижені побічні ефекти/більш швидкий початок дії, тому їх можна застосовувати в зниженому дозуванні у порівнянні з телмісартаном загальноприйнятої форми при лікуванні гіпертензії. Даний винахід також спрямований на способи лікування гіпертензії наночастинками телмісартану, розкритими в даній заявці. A. Кращі характеристики наночастинок телмісартану за винаходом 1. Підвищена біодоступність Композиції телмісартану у формі наночастинок за винаходом гадано виявляють підвищену біодоступність, більш швидкий початок дії, знижений харчовий ефект і вимагають менших доз у порівнянні з раніше відомими, загальноприйнятими препаратами телмісартану. Приклад 1: Фармакокінетичні тести in vivo самців пацюків Спраг-Доулі натще: Порівняння еталонного активного фармацевтичного інгредієнта, наявних у продажу таблеток Прайтор, і наноструктурованого телмісартану Експериментальні протоколи Порівняльні фармакокінетичні тести in vivo самців пацюків Спраг-Доулі натще Однократна пероральна доза еталонного телмісартану становила 30 мг/кг, а відповідна доза препарату наноструктурованого телмісартану прикладу 8 становила 223,8 мг/кг, що відповідає 30 мг/кг активного агента. Обидві тестовані речовини вводили через шлунковий зонд в об'ємі 5 UA 107463 C2 5 10 15 20 25 30 35 40 45 50 55 дозування 5 мл/кг. Носієм тестованих речовин був стерильний 0,9 % розчин NaCl, і гомогенність суспензії підтримували шляхом безперервного перемішування під час обробки з метою мінімізації помилки в результаті седиментації. Порівняльні фармакокінетичні тести in vivo самців пацюків Спраг-Доулі в умовах харчування при введенні суспензії наноструктурованої форми pH=5 і Прайтора Однократна пероральна доза еталонного телмісартану становила 30 мг/кг, а відповідна доза препарату наноструктурованого телмісартану прикладу 8 становила 223,8 мг/кг, що відповідає 30 мг/кг активного агента. Обидві тестовані речовини вводили через шлунковий зонд в об'ємі дозування 5 мл/кг. Носієм тестованих речовин був стерильний 0,9 % розчин NaCl, і його pH доводили до pH=5 1н. розчином HCl. Гомогенність суспензії підтримували шляхом безперервного перемішування під час обробки з метою мінімізації помилки в результаті седиментації. Тварини Самців пацюків Вістар (куплених в Laboratory Animal Center, University of Szeged) підтримували на стандартному гранульованому раціоні для гризунів (Bioplan Ltd, Isaszeg, Hungary) у контрольованих умовах температури та освітлення при вільному доступі до водопровідної води. Період акліматизації становив щонайменше 4 доби. Пацюків рандомізували на групи по 6, і кожну групу використовували для взяття зразків крові через різні періоди часу після обробки телмісартаном. Усі тварини голодували протягом 16 годин перед пероральною обробкою. Тварин анестезували галотаном, і кров відбирали шляхом пункції серця через 15, 30, 45, 60, 120 і 360 хвилин після обробки телмісартаном. Вода була доступна відразу після обробки всіх тварин. Пацюки в останній групі (умертвляли через 360 хв.) мали доступ до стандартного корму для гризунів протягом 120 хвилин після обробки. Зразки сироватки готовили шляхом центрифугування (7000 об/хв., 10 хв., 4 °C) зсілої крові в межах 60 хвилин і зберігали при -20 °C до аналізу. Приготування зразка Аліквоту 200 сироватки поєднували з 20 мкл робочого розчину внутрішнього стандарту та 1,2 мл ацетонітрилу для осадження білка. Суміш перемішували на вортексі протягом 1 хв. і центрифугували при 12000 об/хв. протягом 10 хв. при 4 °C. Супернатанти випарювали до сухості в потоці азоту при 40 °C і відновлювали 200 мкл води - метанолу (50:50 об/об), і 20 мкл впорскували в систему ВЕРХ. Статистичний аналіз Непарний t-критерій використовували для статистичного порівняння сироваткових концентрацій, що належать до тих самих моментів часу. Статистичний аналіз і побудову графіка здійснювали за допомогою програми Graphpad Prism 4.0 (програмне забезпечення Graphpad Software, San Diego, USA). Результати a) Порівняння еталонного та наноструктурованого телмісартану Обробка як еталонним активним фармацевтичним агентом, так і наноструктурованим телмісартаном привела в результаті до виявлюваної концентрації в сироватці, що демонструє двофазовий профіль в інтервалі 15-360 хв. після перорального введення 30 мг/кг тестованої речовини. Всмоктування телмісартану з наноструктурованого препарату явно було більш швидким і більш повним, ніж після введення еталонної речовини. Після обробки наноструктурованим телмісартаном максимальна концентрація в сироватці (Cmax) була визначена через 45 хв., тоді як еталонний препарат приводив в результаті до C max через 120 хв. (фіг. 1). Площа під кривою концентрації в сироватці між 15 і 360 хв. (AUC15-360 хв.) обчислена для характеристики ступеня всмоктування тестованих речовин. Наноструктурований телмісартан приводив в результаті до значення AUC15-360 хв. 6412 мкг*хв/мл, тоді як відповідне значення після еталонної обробки становило 940,1 мкг*хв/мл. Відношення двох значень AUC (AUC 15-360 хв. (наномерний)/AUC15-360 хв. (еталонний)) становило 6,82. Фіг. 1: Концентрації в сироватці телмісартану після перорального введення 30 мг/кг наноструктурованої та еталонної тестованої речовини. б) Порівняння наявних у продажу таблеток Прайтор і наноструктурованого телмісартану Обробка як еталонним активним фармацевтичним агентом, так і наноструктурованим телмісартаном привела в результаті до виявлюваної концентрації в сироватці, що демонструє двофазовий профіль в інтервалі 15-360 хв. після перорального введення 30 мг/кг тестованої речовини. Статистично відмінні концентрації в сироватці, що відповідають тому самому часу, не були виявлені між двома обробками (непарний t-критерій). Після обробки наноструктурованим 6 UA 107463 C2 5 10 15 20 25 30 35 40 45 50 55 60 телмісартаном максимальна концентрація в сироватці (Cmax) була визначена через 45 хв., тоді як таблетка Прайтор 40 мг привела в результаті до Cmax через 60 хв. Площа під кривою концентрації в сироватці між 15 і 360 хв. (AUC15-360 хв.) обчислена для характеристики ступеня всмоктування тестованих речовин. Наноструктурований телмісартан приводив в результаті до значення AUC15-360 хв. 6412 мкг*хв/мл, тоді як дане значення після таблетки Прайтор 40 мг становило 8069 мкг*хв/мл. Відношення двох значень AUC (AUC 15-360 хв. (наномерний)/ AUC15-360 хв. (таблетка Прайтор 40 мг)) становило 0,795. Концентрація в сироватці телмісартану через 30 хв. після введення демонструє мінімум. Однак порівняння концентрацій через 15, 30 і 45 хв. (ANOVA з наступним критерієм НьюманаКеулса за отриманими результатами) не виявило статистичної відмінності. В цілому представлені результати чітко вказують на те, що всмоктування наноструктурованого телмісартану статистично ідентично всмоктуванню, отриманому після введення наявного в продажу лікарського препарату (таблетки Прайтор 40 мг) (фіг. 2). Фіг. 2: Концентрації в сироватці телмісартану після перорального введення 30 мг/кг наноструктурованої тестованої речовини та Прайтор. в) Елімінація ефектів присутності NaOH Для оцінки ефекту гідроксиду натрію на розчинність проводили фармакокінетичний (PK) тест після введення таблетки Прайтор і наноструктурованого телмісартану прикладу 8 у фізіологічному розчині, який доводили до pH=5. Всмоктування телмісартану простежували в умовах харчування. Обробка як еталонним активним фармацевтичним агентом, так і наноструктурованим телмісартаном привела в результаті до виявлюваної концентрації в сироватці, що демонструє двофазовий профіль в інтервалі 15-360 хв. після перорального введення 30 мг/кг тестованої речовини в умовах харчування. Всмоктування телмісартану з наноструктурованого препарату є явно більш швидким і більш повним, ніж після введення еталонної речовини. Після обробки наноструктурованим телмісартаном максимальна концентрація в сироватці (C max) була визначена через 30 хв., тоді як еталонний препарат приводив в результаті до Cmax через 120 хв. Площа під кривою концентрації в сироватці між 15 і 360 хв. (AUC15-360 хв.) обчислена для характеристики ступеня всмоктування тестованих речовин. Наноструктурований телмісартан приводив в результаті до значення AUC15-360 хв. 2744 мкг*хв/мл, тоді як дане значення після еталонної обробки становило 1242 мкг*хв/мл. Відношення двох значень AUC (AUC 15-360 хв. (наномерний)/ AUC15-360 хв. (еталонний)) становило 2,21 (фіг. 3). Фіг. 3: Концентрації в сироватці телмісартану після перорального введення 30 мг/кг наноструктурованої тестованої речовини та Прайтор при pH=5 в умовах харчування. Таблиця 1: Результати фармакокінетичних тестів у пацюків. Приклад 2: Порівняльний фармакокінетичний тест in vivo на самках собак породи бігль в умовах харчування/натще Дане дослідження було розроблене для порівняння фармакокінетичних параметрів, отриманих після перорального введення різних препаратів телмісартану у тварин в умовах харчування та натще. Були використані наведені нижче препарати: - Тестований препарат: наноструктурований препарат телмісартану прикладу 8 - Тестований препарат: наноструктурований препарат телмісартану прикладу 8 і NaOH, виміряний в облатці для введення - Еталонний препарат: наявна в продажу таблетка Прайтор 40 мг (введена в облатці), виготовлена фірмою Pfizer AG. Експериментальні протоколи Порівняльний фармакокінетичний тест in vivo був перехресним двоперіодним дослідженням однократної дози. Три самки собак бігль одержували однократну пероральну дозу тестованих і еталонного препаратів, що містять однакову кількість телмісартану. Доза активного інгредієнта становила 40 мг/тварину. Концентрації в плазмі телмісартану кількісно визначали, використовуючи надійний біоаналітичний спосіб. Для характеристики системного впливу телмісартану основні фармакокінетичні параметри (Cmax, Tmax і AUC) визначали для індивідуальних кривих рівня в плазмі проти часу. Параметри, отримані після введення тестованого препарату, порівнювали з параметрами, отриманими для еталонної таблетки. Тварини Собака породи бігль є видом, що не належить до гризунів, придатним для фармакокінетичних досліджень, і є прийнятною для регуляторних органів. Ці собаки легко доступні, з ними легко поводитися, утримувати їх і дозувати, і вони придатні для дослідження 7 UA 107463 C2 5 10 15 20 25 30 35 40 45 50 55 кривої усього рівня в плазмі у кожної індивідуальної тварини. Системний вплив був досліджений у шести собак. Дослідження проводили відповідно до Посібника з утримування та використання лабораторних тварин, NRC, 1996 і в узгодженні із принципами угорського Акта 1998:XXVIII, що регулює захист тварин. Корм і годування Тварини одержували корм для собак Ssniff Hd-H, що виготовляється фірмою Ssniff, Spezialdiaten Gmbh. Корм був запропонований щодоби по300 г/собаку приблизно в один й той самий час. Наступного ранку корм, що залишився, забирали. Перед введеннями тварини голодували протягом ночі (щонайменше 12 год.). На добу обробки тварин рандомізували в групу натще, що одержує корм приблизно через 4 години після введення. Тварин рандомізували в групи харчування, що одержують приблизно 150 г стандартного раціону. Решта 150 г корму були запропоновані приблизно через 4 години після введення. Збирання крові та відокремлення плазми Для визначення рівнів у плазмі телмісартану приблизно 3 мл крові збирали в пластмасові флакони з літієвою сіллю гепарину як антикоагулянтом. Моменти часу взяття крові наведені нижче для обох періодів: перед дозуванням (0 хв.), 15 хв., 30 хв., 45 хв., 1 год., 2 год., 4 год., 6 год., 8 год., 24 год., 48 год. і 72 год. після дозування. Кров брали з v. cephalica antebrachii або v. saphena стерильними одноразовими голками. Після узяття зразків кров тримали охолодженою на колотому льоді до центрифугування. Зразки плазми одержували шляхом центрифугування крові при 2000×g протягом 10 хвилин при 4 °C у межах 60 хвилин після узяття зразків крові. Відокремлену плазму (приблизно 1 мл) переносили в пробірки Еппендорфа. Зразки плазми відразу заморожували та зберігали в морозильному апарату для низькотемпературного заморожування (-20±5 °C) до аналізу. Концентрації телмісартану визначали, використовуючи надійний хроматографічний біоаналітичний спосіб. Фармакокінетична оцінка Фармакокінетичну оцінку проводили шляхом використання програмного забезпечення Winnonlin Professional Version 4.0.1 (Pharsight Corporation, USA). Індивідуальні криві рівнів плазми проти часу оцінювали, використовуючи некомпартментний метод. Результати Пероральне введення наявних в продажу ліків привело в результаті до швидкого зростання концентрацій телмісартану в сироватці як натще, так і в умовах харчування. Швидкість цього зростання концентрації виявляла дуже високу міжіндивідуальну варіабельність. Введення наномерного препарату телмісартану привело в результаті до більш повільного зростання концентрацій у плазмі, особливо в умовах харчування, при значно більш низьких міжіндивідуальних відмінностях (на фіг. 4.a-b показані концентрації в плазмі, визначені в перші 8 годин після перорального введення тваринам натще (а) і в умовах харчування (б)). Площа під кривою для всього періоду дослідження (0-72 год.) (AUClast), Cmax і tmax визначали на основі кривих і обчислювали відносну біодоступність (F rel) наномерного препарату у порівнянні з наявними у продажу ліками (таблиця 2). На фігурах показане пролонговане t max і знижена Cmax для наномерного препарату, тоді як значення AUClast були практично ідентичні показникам відносної біодоступності 102 % і 108 % натще та в умовах харчування, відповідно. Параметри швидкого розчинення та всмоктування наявних в продажу ліків викликані унікальною композицією: таблетки Прайтор містять твердий NaOH. Ця композиція дає можливість розчинення сполуки, але вона також приводить в результаті до дуже швидкого всмоктування, яке може не мати фармакологічної переваги. У клінічній фармакології високе пікове значення, що швидко виникає, є небажаним, оскільки тимчасова висока пікова концентрація може привести в результаті до побічного ефекту. У цьому випадку дуже швидке падіння кров'яного тиску може викликати важку тимчасову гіпотензію. Сильно лужне середовище може також модифікувати всмоктування інших ліків, прийнятих одночасно. Високі міжіндивідуумні відмінності можуть також бути обумовлені різним ступенем алкалінізації та подальшими відмінностями в кількості розчиненого телмісартану. Препарат прикладу 8 не містить NaOH, тому з метою перевірки цих гіпотез дослідження на тваринах були проведені з наноструктурованим телмісартаном і облатками, що містять NaOH. Високі міжіндивідуальні варіації спостерігали в порівнянні із введенням одного лише наноструктурованого телмісартану. Швидке зростання концентрацій у плазмі також спостерігали як натще, так і в умовах харчування (на фіг. 8c показані концентрації в плазмі, визначені у перші 8 годин після перорального введення). Показники відносної біодоступності були подібними у 8 UA 107463 C2 5 10 15 20 25 30 35 40 45 50 55 60 порівнянні з наявними в продажу ліками (97,3 % і 133 % для умов натще та умов харчування, відповідно). Загалом, АФІ у формі наночастинок без додавання NaOH демонструє біоеквівалентність із наявними в продажу ліками у вигляді таблетки без NaOH при більш сприятливому фармакокінетичному (PK) профілі. Фіг. 4: Концентрації в сироватці телмісартану після перорального введення 40 мг наноструктурованоготелмісартану та еталонної тестованої речовини натще (a) і в умовах харчування (b). Концентрації в сироватці телмісартану після перорального введення наноструктурованого телмісартану разом з NaOH натще та в умовах харчування (c). Таблиця 2: Основні фармакокінетичні параметри телмісартану у самок собак, обчислені на основі результатів, представлених на фіг. 4a і 4b. 2. Профілі розчинення композицій телмісартану у формі наночастинок за винаходом Композиції телмісартану у формі наночастинок за винаходом мають підвищену розчинність і профіль розчинення внаслідок зменшеного розміру частинок і унікального утворення наноструктурованих частинок. Швидке розчинення введеного активного агента є кращим, оскільки більш швидке розчинення звичайно приводить до швидшого початку дії та більш високої біодоступності. Приклад 3: Експериментальні протоколи Визначення розчинності (Cmax) Розчинність наноструктурованого телмісартану прикладу 8 у порівнянні з еталонним АФІ визначали в дистильованій воді за допомогою вимірів в ультрафіолетовій і видимій області спектра UV-VIS (спектрофотометр Helios Alfa UV) при довжині хвилі 296 нм і кімнатній температурі. Повторно диспергований зразок фільтрували через 0,20 мкм одноразовий шприцевий фільтр. З метою перевірки присутності наночастинок у розчині його опромінювали червоним лазерним датчиком, який працює при довжині хвилі 670 нм. Якщо розсіювання не спостерігали, фільтрування було успішним, і розчин не містив наночастинок. Визначення розчинності (Cmax) в присутності гідроксиду натрію Таблетка Прайтор містить гідроксид натрію, функцією якого є нейтралізація кислого стану та розчинення телмісартану під час всмоктування. Щоб оцінити ефект гідроксиду натрію на розчинність, наноструктурований телмісартан розчиняли в присутності кількості гідроксиду натрію, рівної тій, що міститься у таблетці Прайтор. Розчиняли 270,1 мг наноструктурованої активної речовини (40 мг телмісартану) прикладу 8, суміш 270,1 мг тієї ж наноструктурованої активної речовини (40 мг телмісартану) і 1,87 мг NaOH, і 1 таблетку Прайтор в 100 мл розчину HCl pH=2,5. Суспензію фільтрували через 0,20 мкм одноразовий шприцевий фільтр. З метою перевірки присутності наночастинок у розчині його опромінювали червоним лазерним датчиком, що працює при довжині хвилі 670 нм. Якщо розсіювання не спостерігали, фільтрування було успішним, і розчин не містив наночастинок. Концентрацію телмісартану визначали за допомогою вимірів в ультрафіолетовій і видимій області спектра (Agilent 8453). Тести на розчинення Тести на розчинення проводили шляхом повторного диспергування 5 мг еталонного телмісартану та 34,7 мг порошку наноструктурованого телмісартану, що містить 5 мг телмісартану, в 10 мл дистильованої води. Суспензію перемішували протягом 1, 5, 10, 20 і 60 хвилин, а потім фільтрували через 0,2 мкм одноразовий шприцевий фільтр. Концентрацію телмісартану визначали за допомогою спектрофотометра UV-VIS (Agilent 8453). Результати Визначення Cmax Тест повторної диспергованості проводили з метою визначення розчинності наноструктурованого телмісартану. Розмір частинок повторно диспергованого наноструктурованого телмісартану становив 104 нм за середнім значенням інтенсивності та 26 нм за числовим середнім. Значення d(90) становили 185 і 40 нм за середнім значенням інтенсивності та числовим середнім, відповідно. Розчинність наноструктурованого телмісартану становила 0,4 мг/мл, що в 124,5 раз вище, ніж розчинність телмісартану в дистильованій воді (фіг. 5). Фіг. 5: Посилення розчинності телмісартану Тест на розчинність в присутності гідроксиду натрію Таблетка Прайтор містить гідроксид натрію, функцією якого є нейтралізація кислого стану та розчинення телмісартану під час всмоктування. Щоб оцінити ефект гідроксиду натрію на розчинність, наноструктурований телмісартан прикладу 8 розчиняли в присутності кількості 9 UA 107463 C2 5 10 15 20 25 30 35 40 45 50 55 60 гідроксиду натрію (46,8 мкмоль), рівної тій, яку містить таблетка Прайтор. В присутності гідроксиду натрію розчинність наноструктурованого телмісартану в розчині HCl pH=2,5 була в 2,9 раз вище, ніж розчинність телмісартану у таблетці Прайтор (фіг. 6). Фіг. 6: Посилення розчинності телмісартану Порівняльний тест на розчинення Внаслідок миттєвої повторної диспергованості наноструктурованого телмісартану прикладу 8 більше 24 % вмісту телмісартану композиції розчиняється відразу при повторному диспергуванні. У межах 10 хвилин розчин, що містить повторно дисперговані наноструктуровані частинки, досягає його насиченого стану, вміст розчиненого телмісартану становить 0,4 мг/мл, що добре корелює з розчинністю наноструктурованого телмісартану (фіг. 7). Вміст еталонного телмісартану в дистильованій воді неможливо виявити способом UV-VIS. Фіг. 7: Порівняльний тест на розчинення еталонного телмісартану та наноструктурованого телмісартану 3. Кристалографічна структура композицій телмісартану у формі наночастинок за винаходом На хімічну стабільність твердих ліків впливає кристалічний стан ліків. Багато лікарських речовин виявляють поліморфізм. Кожний кристалічний стан має відмінну хімічну реакційність. Стабільність ліків в їх аморфній формі звичайно нижче, ніж стабільність ліків в їх кристалічній формі у зв'язку з більш високим рівнем вільної енергії аморфного стану. Знижена хімічна стабільність твердих ліків, викликана механічними навантаженнями, такими як перемелювання, пов'язана зі зміною у кристалічному стані. На хімічну стабільність твердих ліків також впливають відмінності в площі поверхні. Для реакції, яка протікає на твердій поверхні ліків, збільшення площі поверхні може збільшити кількість ліків, що бере участь у реакції. Приклад 4: Визначення кристалографічної структури Стабільні частково кристалічні, кристалічні, поліморфні або аморфні композиції наноструктурованого телмісартану за винаходом виявляють значно посилену розчинність внаслідок збільшеної площі поверхні у порівнянні з кристалічним еталоном. Структура наночастинок телмісартану, отриманих способом безперервного протокового наноосадження прикладу 8, була досліджена шляхом аналізу дифракції рентгенівських променів (порошковий дифрактометр Philips PW1050/1870 RTG). Виміри показали, що композиції наноструктурованого телмісартану є частково кристалічними або аморфними (див. на фіг. 8). Характеристичні кути відбиття кристалічного телмісартану можна знайти на дифрактограмі ПРД наномерного телмісартану, але при більш низькій інтенсивності (фіг. 8a). Фіг. 8: Рентгенівські дифрактограми еталонного телмісартану, композицій наноструктурованого телмісартану за винаходом та стабілізатора. 4. Профілі повторної диспергованості композицій телмісартану у формі наночастинок за винаходом Додатковою ознакою композицій телмісартану у формі наночастинок за даним винаходом є те, що висушені наночастинки, стабілізовані сурфактантом(ами)/полімером(ами), можна повторно диспергувати миттєво або з використанням традиційних повторно диспергуючих агентів, таких як маніт, сахароза. Приклад 5: Повторне диспергуванн порошку наноструктурованого телмісартану прикладу 8 здійснювали шляхом диспергування 10 мг порошку наномерного телмісартану в 5 мл дистильованої води. Після додавання дистильованої води флакон м'яко перемішували вручну, що приводило в результаті до утворення колоїдної дисперсії наноструктурованих частинок телмісартану, як продемонстровано на фіг. 9. Розмір частинки та розподіл за розмірами повторно диспергованих частинок видні на фіг. 10. Фіг. 9: Миттєва повторна диспергованість наноструктурованого телмісартану в дистильованій воді. Фіг. 10: Розмір і розподіл за розмірами наночастинок телмісартану до та після повторного диспергування 5. Посилена ліпофільність для підвищення профілів всмоктування та проникності композицій телмісартану у формі наночастинок за винаходом Внаслідок фосфоліпідної природи клітинних мембран певний ступінь ліпофільності часто є вимогою до лікарської сполуки, не лише для того, щоб вона всмоктувалася через стінку кишечнику після перорального введення, але також, можливо, для того, щоб вона виявляла свою фармакологічну дію на тканину-мішень (F. Kesisoglou et al. /Advanced Drug Delivery Reviews 59 (2007) 631-644). 10 UA 107463 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ліпофільність телмісартану можна підвищити шляхом використання ліпофільного стабілізатора та/або стабілізаторів, що мають ліпофільні бічні групи на полімерному каркасі та/або амфіфільних стабілізаторів під час наноосадження. Внаслідок ліпофільної природи або ліпофільних бічних груп застосовуваного стабілізатора не тільки ліпофільність, але й всмоктування та проникність наночастинок телмісартану за даним винаходом можна підвищити. Наприклад, використовуючи хітозан, можна підвищити параклітинну проникність епітелію тонкого кишечнику, що властиво посиленню всмоктування через слизову оболонку. Більшість амфіфільних співполімерів, застосовуваних з метою доставки ліків, містить або поліефірне, або поліамінокислотне похідне як гідрофобний сегмент. Більшість поліефірів, що представляють інтерес для фармацевтики, належать до сімейства полоксамерів, тобто блокспівполімерів поліпропіленгліколю та поліетиленгліколю. 6. Більш швидкі профілі змочування поверхні композицій телмісартану у формі наночастинок за винаходом Щоб розчинити телмісартан, його поверхню необхідно спочатку змочити навколишньою рідиною. Наномерні аморфні/частково кристалічні форми мають хімічно рандомизовану поверхню, яка демонструє гідрофобні та гідрофільні взаємодії внаслідок природи стабілізатора(ів) і активного фармацевтичного інгредієнта, що може привести до поліпшеної змочуваності. Якщо поверхня наночастинок телмісартану за винаходом функціонализована гідрофільними групами/стабілізатором(ами), більш високий ступінь гідрофільності викликає більш швидке змочування поверхні та більш швидке розчинення у порівнянні з вихідною кристалічною формою. Ця вдосконалена властивість наночастинок телмісартану за даним винаходом підтверджена результатами тесту повторної диспергованості. За рахунок більшої площі поверхні наноструктурованих частинок телмісартану та гідрофільних груп стабілізатора(ів) (наприклад: полоксамерів, полівінілпіролідонів) змочування поверхні відбувається швидше, ніж змочування еталонної кристалічної форми. Приклад 6: Візуальне спостереження змочуваності телмісартану у формі наночастинок Змочуваність наноструктурованих частинок телмісартану прикладу 8 досліджували в дистильованій воді та візуалізували за допомогою стереомікроскопа, обладнаного ПЗЗкамерою. 0,1 мг порошку еталонного та наноструктурованого телмісартану поміщали на скло, а потім до порошку додавали одну краплю дистильованої води. Порошок наноструктурованого телмісартану починав набухати відразу, його змочування було повним, тоді як частинки еталонного телмісартану залишалися в їх агрегованому стані, як продемонстровано на фіг. 11. Фіг. 11: Змочуваність еталонного телмісартану (a) і наноструктурованого телмісартану (b), спостережувана за допомогою стереомікроскопа при 100× збільшенні. Б. Композиції В даному винаході запропоновані композиції наномерного телмісартану у формі наноструктурованих частинок, які містять щонайменше один стабілізатор, щоб стабілізувати його стеричним та/або електростатичним шляхом. Стабілізатори краще зв'язуються або взаємодіють із телмісартаном, але хімічно не взаємодіють із телмісартаном або один з одним. Наночастинки телмісартану за винаходом можна утворювати способами осадження розчинником - осаджувачем, використовуючи стабілізатор(и). Стабільність отриманого колоїдного розчину наномерного телмісартану можна підвищити шляхом комбінування додаткового стабілізатора(ів), що може діяти як другий стеричний або електростатичний стабілізатор. Крім того, використовуючи додатковий стабілізатор, розмір частинок телмісартану за винаходом можна зменшувати та регулювати. Розмір частинок наночастинок телмісартану Винахід містить наночастинки телмісартану, які мають середній розмір частинок менш ніж приблизно 600 нм, як виміряно методом динамічного світлорозсіювання. Під "середнім розміром частинок менш ніж приблизно 600 нм" мають на увазі, що щонайменше 90 % наночастинок телмісартану має розмір частинок менше середнього за числом/інтенсивністю, тобто менш ніж приблизно 600 нм і т.д., при вимірюванні методом, визначеним вище. Приклад 7: Одержання наноструктурованого телмісартану Під час експериментів наночастинки телмісартану одержували в протоковому реакторі безперервної дії на основі мікроструминної техніки. Як вихідний розчин використовували 100 мг телмісартану, 20 мг додецилсульфату натрію та 200 мг полівінілпіролідону PVP K-25, розчинені в 100 мл ДМСО. Отриманий розчин пропускали через реакторний пристрій зі швидкістю течії 0,5 11 UA 107463 C2 5 10 15 20 25 30 35 40 45 50 55 мл/хв, використовуючи подавальний пристрій. В цей час, використовуючи другий подавальний пристрій, дистильовану воду пропускали в змішувальний пристрій зі швидкістю течії 2 мл/хв, де вона змішувалася з розчином, що містить телмісартан, який надходить з першого реакторного пристрою. Наночастинки безперервно одержують при атмосферному тиску внаслідок хімічного осадження водою, що пропускається в змішувальний пристрій. Отриманий колоїдний розчин, що направляється через другий реакторний пристрій, іде у пристрій динамічного світлорозсіювання (Nanotrac), інтегрований із приладом, який може безперервно визначати розмір отриманих наночастинок. Розмір наночастинок можна регулювати в широкому діапазоні шляхом зміни швидкостей течії; тиску та типів стабілізаторів (див. фіг. 12).Розмір частинок і розподіл за розмірами частинок телмісартану можна регулювати кількістю стабілізатора (PVP K25), як показано на фіг. 13. Розмір частинок телмісартану в найкращому разі становив 205 нм. Фіг. 12: Розмір частинок та розподіл за розмірами наночастинок телмісартану при використанні різних стабілізаторів. Фіг. 13: Ефект концентрації стабілізатора на розмір частинок та розподіл за розмірами наночастинок телмісартану. Приклад 8: Одержання наноструктурованого телмісартану Під час експериментів наночастинки телмісартану одержували в протоковому реакторі безперервної дії на основі мікроструминної техніки. Як вихідний розчин використовували 160 мг телмісартану та 320 мг полівінілпіролідону, PVP40, розчинених в 80 мл 0,1M розчину NaOH. Отриманий розчин пропускали через реакторний пристрій зі швидкістю течії 4 мл/хв., використовуючи подавальний пристрій. В цей час, використовуючи другий подавальний пристрій, 0,1M розчин оцтової кислоти пропускали в змішувальний пристрій зі швидкістю течії 3,7 мл/хв., де він змішувався з розчином, що містить телмісартан, який надходить з першого реакторного пристрою. Наночастинки безперервно одержують при атмосферному тиску внаслідок хімічного осадження оцтовою кислотою, що пропускається в змішувальний пристрій. Отриманий колоїдний розчин, що направляється через другий реакторний пристрій, іде у пристрій динамічного світлорозсіювання (Nanotrac), інтегрований із приладом, який може безперервно визначати розмір отриманих наночастинок. Розмір наночастинок можна регулювати в широкому діапазоні шляхом зміни швидкостей течії. Розмір частинок телмісартану в найкращому разі становив 165 нм, як показано на фіг. 14 та в таблиці 3. Фіг. 14: Розмір частинок і розподіл за розмірами наночастинок телмісартану Таблиця 3: Ефект швидкостей течії на розмір частинок телмісартану. Приклад 9: Препарат у вигляді крему, що містить наночастинки телмісартану Одержали 100 мл гелю, що містить наночастинки телмісартану. Розчиняли 1,3 г Карбополу 971 при енергійному перемішуванні при кімнатній температурі в 100 мл колоїдного розчину телмісартану, який синтезований способом, описаним у прикладі 8. ФОРМУЛА ВИНАХОДУ 1. Стабільна композиція наноструктурованого телмісартану, яка містить: (a) наноструктурований телмісартан, що має середній розмір частинок менш ніж приблизно 600 нм; і (b) щонайменше один стабілізатор, вибраний з групи полівінілпіролідону і додецилсульфату натрію, де композиція отримана в протоковому реакторі безперервної дії, краще в протоковому реакторі безперервної дії на основі мікроструминної техніки, та одержана композиція є частково кристалічною або аморфною. 2. Композиція за п. 1, де середній розмір частинок телмісартану становить від 600 нм до 50 нм, краще від 200 нм до 50 нм. 3. Спосіб одержання композиції наноструктурованого телмісартану за будь-яким з пп. 1-2, що включає осадження наноструктурованого телмісартану з розчину телмісартану та щонайменше одного стабілізатора, вибраного з групи полівінілпіролідону і додецилсульфату натрію, якщо бажано, в присутності фармацевтично прийнятної кислоти, у протоковому реакторі безперервної дії, краще в протоковому реакторі безперервної дії на основі мікроструминної техніки. 4. Спосіб за п. 3, який включає (1) розчинення телмісартану та одного або більш ніж одного стабілізатора в розчині гідроксиду лужного металу; (2) додавання до розчину зі стадії (1) 12 UA 107463 C2 5 розчину фармацевтично прийнятної кислоти, який можливо містить один або більш ніж один стабілізатор, і (3) осадження композиції зі стадії (2). 5. Спосіб за п. 4, де розчин гідроксиду лужного металу є розчином гідроксиду натрію, і фармацевтично прийнятна кислота є оцтовою кислотою, лимонною кислотою, малеїновою кислотою, щавлевою кислотою, мурашиною кислотою або бензойною кислотою, краще оцтовою кислотою. 6. Спосіб за п. 4 або 5, який включає використання двох різних розчинників, що змішуються один з одним, де телмісартан є розчинним тільки в одному з них. 13 UA 107463 C2 14 UA 107463 C2 15 UA 107463 C2 16 UA 107463 C2 17 UA 107463 C2 18 UA 107463 C2 19 UA 107463 C2 20 UA 107463 C2 21 UA 107463 C2 Комп’ютерна верстка Л. Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 22
ДивитисяДодаткова інформація
Назва патенту англійськоюNanoparticulate telmisartan compositions and process for the preparation thereof
Автори англійськоюFilipcsei, Genoveva, Otvos, Zsolt, Pongracz, Katalin, Darvas, Ferenc
Автори російськоюФилипчеи Геновева, Этвёш Жольт, Понграц Каталин, Дарваш Ференц
МПК / Мітки
МПК: A61K 31/4184, A61K 9/14
Мітки: композиції, наночастинок, форми, спосіб, одержання, телмісартану
Код посилання
<a href="https://ua.patents.su/24-107463-kompozici-telmisartanu-u-formi-nanochastinok-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Композиції телмісартану у формі наночастинок та спосіб їх одержання</a>
Попередній патент: Спосіб виготовлення електроплавленого порошку стабілізованого діоксиду цирконію для плазмового напилення
Наступний патент: Вмонтована полюсна деталь з ізоляційним корпусом, виготовленим з термопластичного матеріалу
Випадковий патент: Інсектицидний препарат