Наноемульсії
Формула / Реферат
1. Наноемульсія, яка містить а) щонайменше один водний компонент та b) носій, який містить і) щонайменше один ліпофільний компонент, вміст якого становить від 0,1 % (мас.) до 15 % (мас.), іі) щонайменше одну поверхнево-активну речовину та ііі) щонайменше один спирт,
яка відрізняється тим, що щонайменше один спирт має 3-5 атомів вуглецю, та тим, що середній діаметр емульгованих частинок є меншим ніж 100 нм.
2. Наноемульсія за п. 1, яка відрізняється тим, що носій входить до складу водного компонента.
3. Наноемульсія за п. 1 або п. 2, яка відрізняється тим, що вміст поверхнево-активної речовини становить від 1 % (мас.) до 30 % (мас.), і вміст спирту становить від 0,1 % (мас.) до 10 % (мас.), виходячи із загальної маси наноемульсії.
4. Наноемульсія за будь-яким із попередніх пунктів, яка відрізняється тим, що вміст водного компонента становить від 50 % (мас.) до 98 % (мас.), виходячи із загальної маси наноемульсії.
5. Наноемульсія за будь-яким із попередніх пунктів, яка відрізняється тим, що згаданий щонайменше один спирт є ізопропіловим спиртом та/або 1-пропіловим спиртом.
6. Наноемульсія за будь-яким із попередніх пунктів, яка відрізняється тим, що згаданий щонайменше один ліпофільний компонент є тригліцеридами та/або їх сумішшю.
7. Наноемульсія за будь-яким із попередніх пунктів, яка відрізняється тим, що згаданий щонайменше одна поверхнево-активна речовина є лецитином та/або поверхнево-активною речовиною типу поліоксіетилену.
8. Наноемульсія за п. 7, яка відрізняється тим, що лецитином є соєвий лецитин та поверхнево-активною речовиною типу поліоксіетилену є полісорбат 80.
9. Наноемульсія за п. 8, яка відрізняється тим, що вміст фосфатидилхоліну у соєвому лецитині становить щонайменше 80 % (мас.).
10. Наноемульсія за будь-яким із попередніх пунктів, яка відрізняється тим, що середній діаметр емульгованих частинок становить від 10 нм до 50 нм.
11. Спосіб одержання наноемульсії за будь-яким із попередніх пунктів, який включає такі стадії:
a) приготування водного компонента,
b) приготування носія, який містить щонайменше один ліпофільний компонент, щонайменше одну поверхнево-активну речовину і щонайменше один спирт, що має 3-5 атомів вуглецю, та
c) змішування водного компонента стадії а) з носієм стадії b) при температурі від 50 до 60 °С.
12. Фармацевтична композиція, яка містить наноемульсію за будь-яким із пп. 1-10.
13. Косметична композиція, яка містить наноемульсію за будь-яким із пп. 1-10.
14. Композиція, яка містить наноемульсію за будь-яким із пп. 1-10 та активний агент.
15. Композиція за п. 14, яка відрізняється тим, що активний агент вибраний з групи, яку складають 5-амінолевулінова кислота, її похідна, попередник та/або метаболіт.
16. Композиція за п. 15, яка відрізняється тим, що 5-амінолевулінова кислота, її похідна, попередник та/або метаболіт приєднаний на зовнішньому моношарі частинок наноемульсії.
17. Композиція за будь-яким із пп. 14-16, яка відрізняється тим, що композиція представлена у вигляді гелю і містить від 0,01 % (мас.) до 50 % (мас.) активного агента, від 1 % (мас.) до 60 % (мас.) наноемульсії, від 0,01 % (мас.) до 4 % (мас.) згаданого щонайменше одного наповнювача, від 1 % (мас.) до 3 % (мас.) згаданого щонайменше одного консерванту, виходячи із загальної маси композиції, і щонайменше один розчинник як решту композиції.
18. Фармацевтична композиція, яка містить композицію за будь-яким з пп. 14-16.
19. Композиція за п. 18, яка відрізняється тим, що композиція представлена у вигляді гелю і містить від 0,01 % (мас.) до 50 % (мас.) активного агента, від 1 % (мас.) до 60 % (мас.) наноемульсії, від 0,01 % (мас.) до 4 % (мас.) щонайменше одного наповнювача, від 1 % (мас.) до 3 % (мас.) щонайменше одного консерванту, виходячи із загальної маси композиції, і щонайменше один розчинник як решту композиції.
20. Косметична композиція, яка містить композицію за будь-яким з пп. 14-16.
21. Композиція за п. 20, яка відрізняється тим, що композиція представлена у вигляді гелю і містить від 0,01 % (мас.) до 50 % (мас.) активного агента, від 1 % (мас.) до 60 % (мас.) наноемульсії, від 0,01 % (мас.) до 4 % (мас.) згаданого щонайменше одного наповнювача, від 1 % (мас.) до 3 % (мас.) згаданого щонайменше одного консерванту, виходячи із загальної маси композиції, і щонайменше один розчинник як решту композиції.
22. Діагностична композиція, яка містить композицію за будь-яким з пп. 14-16.
23. Композиція за п. 22, яка відрізняється тим, що композиція представлена у вигляді гелю і містить від 0,01 % (мас.) до 50 % (мас.) активного агента, від 1 % (мас.) до 60 % (мас.) наноемульсії, від 0,01 % (мас.) до 4 % (мас.) згаданого щонайменше одного наповнювача, від 1 % (мас.) до 3 % (мас.) згаданого щонайменше одного консерванту, виходячи із загальної маси композиції, і щонайменше один розчинник як решту композиції.
24. Спосіб одержання композиції за будь-яким з пп. 14-23, який включає такі стадії:
a) приготування водного компонента,
b) приготування носія, який містить щонайменше один ліпофільний компонент, щонайменше одну поверхнево-активну речовину і щонайменше один спирт, який має 3-5 атомів вуглецю,
c) змішування водного компонента стадії а) з носієм стадії b) для одержання наноемульсії,
d) додання активного агента перед та/або після одержання згаданої наноемульсії стадії с), та
є) факультативне додання інших домішок та/або наповнювачів до стадії d).
25. Спосіб за п. 24, який відрізняється тим, що активний агент на стадії d) додають після одержання згаданої наноемульсії стадії с).
26. Косметичне застосування наноемульсії за будь-яким із пп. 1-10 як засобу, що уповільнює старіння.
27. Застосування наноемульсії за будь-яким із пп. 1-10 для одержання лікарського засобу для лікування вірусного захворювання.
28. Застосування за п. 27, причому вірусне захворювання спричинюється вірусом папіломи (бородавки) людини (HPV).
29. Застосування за п. 28, причому вірусним захворюванням є гострокінцева кондилома.
30. Застосування наноемульсії за будь-яким із пп. 1-10 для одержання лікарського засобу для лікування шкірних захворювань.
31. Застосування за п. 30, причому захворювання вибране з групи, яку складають нейродерматити.
32. Застосування за п. 31, причому шкірним захворюванням є вугрі та/або захворювання, пов'язане з кератозом.
33. Застосування за п. 32, де кератозом є старечий кератоз.
34. Застосування наноемульсії за будь-яким із пп. 1-10 для одержання лікарського засобу для лікування захворювання, пов'язаного з проліферацією клітин.
35. Застосування за п. 34, причому захворюванням, пов'язаним із проліферацією клітин, є онкологічне захворювання.
36. Застосування за п. 35, причому онкологічне захворювання вибране з групи, яку складають базально-клітинний рак, плоскоклітинний рак, хвороба Боуена, інтраепітеліальна неоплазія вульви (VIN) та/або вузликова та/або підшкірна форми раку.
37. Застосування за п. 30 або 34, причому захворюванням є псоріаз.
38. Застосування композиції за будь-яким із пп. 15-23 для одержання лікарського засобу для фотодинамічної терапії.
39. Застосування за п. 38, причому згадану композицію вводять хворому у ефективній кількості та інкубують впродовж періоду часу, прийнятного для одержання достатньої кількості активного агента у тканині, яка підлягає обробці, і згадану тканину піддають опроміненню світлом.
40. Застосування композиції за будь-яким із пп. 15-23 для виявлення проліферуючих клітин.
41. Застосування композиції за будь-яким із пп. 15-23 для діагностування шкірних та/або онкологічних захворювань.
42. Набір, який включає в себе композицію за будь-яким із пп. 15-23 і щонайменше один компонент, вибраний з групи, яку складають
a) фоторезистне покриття,
b) засіб для прикріплення згаданого покриття до ділянки нанесення, та
c) засіб для нанесення згаданої композиції на ділянку нанесення.
Текст
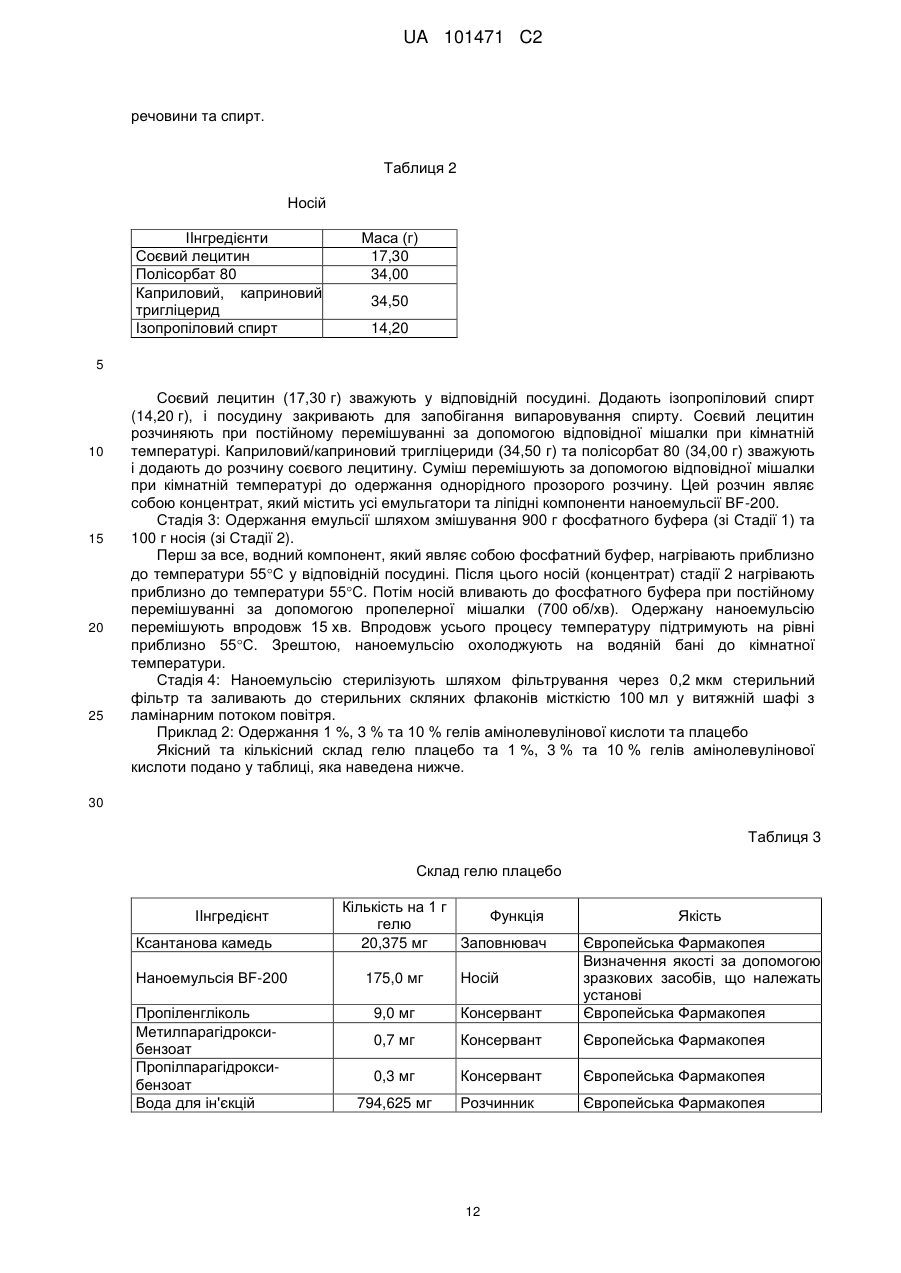
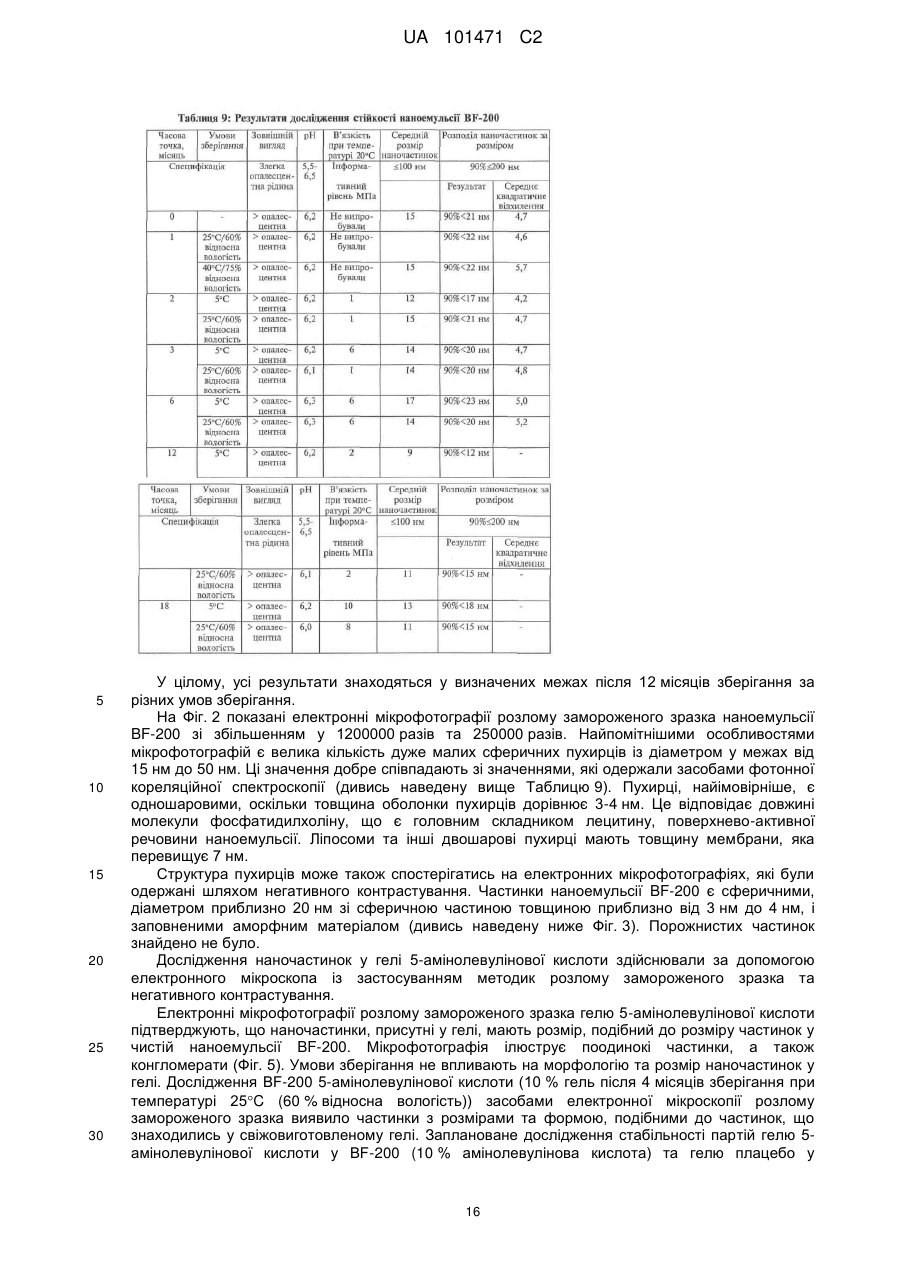
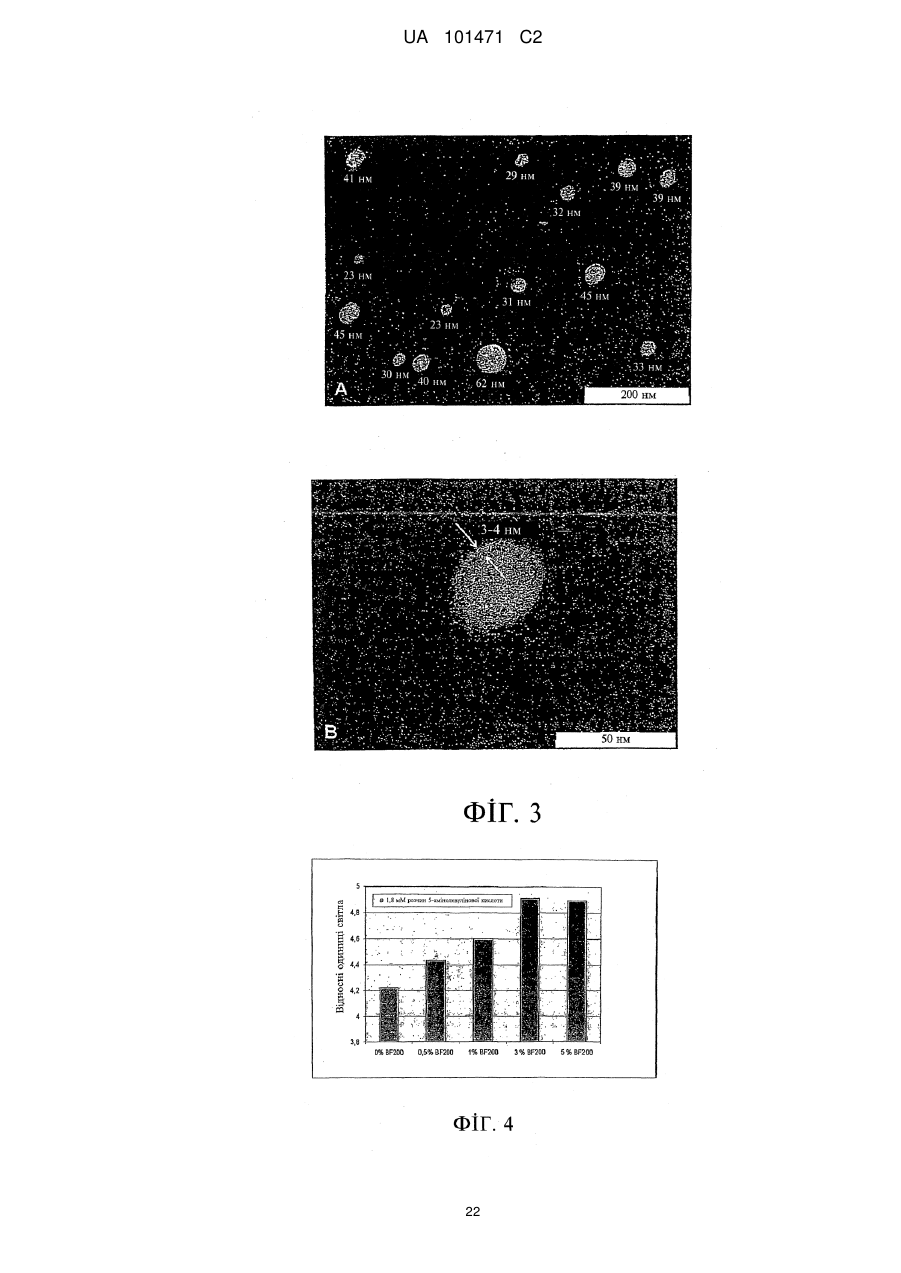
Реферат: Цей винахід належить до наноемульсії, яка містить щонайменше один водний компонент та носій, де згаданий носій містить щонайменше один ліпофільний компонент, щонайменше одну поверхнево-активну речовину і щонайменше один спирт, яка відрізняється тим, що щонайменше один спирт має щонайменше три атоми вуглецю. UA 101471 C2 (12) UA 101471 C2 UA 101471 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей винахід має відношення до наноемульсії, яка містить щонайменше один водний компонент та носій, де згаданий носій містить щонайменше один ліпофільний компонент, щонайменше одну поверхнево-активну речовину і щонайменше один спирт. Цей винахід додатково має відношення до композиції, яка містить згадану наноемульсію та активний агент. Зокрема, композиція надається у вигляді гелю, і активним агентом є 5-амінолевулінова кислота (ALA), її похідна, попередник та/або метаболіт. Цей винахід також має відношення до одержання згаданої наноемульсії та/або композиції та до їх застосування для лікування шкірних захворювань, вірусних захворювань, а також захворювань, пов'язаних із проліферацією клітин, зокрема, онкологічних захворювань та/або псоріазу. Цей винахід також спрямований на застосування згаданої наноемульсії у косметичних виробах. Наноемульсії являють собою колоїдну систему. Колоїдні системи включають міцели, ліпосоми, віросоми, наносуспензії, мікроемульсії та розчини полімерів. Наноемульсії, виходячи з їх фізичних та хімічних характеристик, належать до групи мікроемульсій. Мікроемульсії являють собою водні дисперсії однорідних мікрочастинок, які складаються з ліпідної серцевини, яку оточують моношари поверхнево-активної речовини та вторинної поверхнево-активної речовини. Наноемульсії характеризуються середнім розміром частинок (середнім діаметром) меншим за 200 нм, часто меншим за 100 нм, та вузьким діапазоном гранулометричного складу монодисперсних частинок. Окрім того, наноемульсії є прозорими та злегка опалесцентними. Наноемульсії, як правило, одержують шляхом механічного подрібнення масляної фази у водній фазі у присутності поверхнево-активної речовини. Масляні кульки дуже малого розміру часто одержують шляхом щонайменше одного проходження через гомогенізатор високого тиску або ультразвуковий дезінтегратор. Одержання наноемульсій, опис яких наведено, не потребує застосування таких пристроїв із високим зсувним зусиллям. Невеликий розмір кульок та їх висока однорідність надає наноемульсіям корисних для застосування у косметичних засобах властивостей, завдяки яким наноемульсії відрізняються від традиційних емульсій: вони є прозорими та демонструють нову консистенцію. Окрім того, вони можуть переносити активні агенти з більшою ефективністю і, таким чином, набувають більшого значення у галузі медицини і фармації. Мікроемульсії, відомі у цій галузі, які називають нанодисперсіями, містять а) мембранотвірну молекулу, наприклад, соєвий лецитин, b) допоміжний емульгатор, c) ліпофільний компонент, наприклад, каприловий та/або каприновий тригліцерид (мігліол 812 (Miglyol 812) або міритол 318 (Myritol 318)) та факультативно d) спирт, зокрема, етиловий спирт (EP 0 956 853). Ці нанодисперсії застосовують у фармацевтичних композиціях як транспортні засоби для фармацевтично активних агентів. Однак застосування етилового спирту у наноемульсіях має декілька недоліків. По-перше, наслідком застосування етилового спирту як вторинної поверхнево-активної речовини, є одержання більших наночастинок, аніж у разі застосування спиртів із більшими вуглецевими ланцюгами. Більші частинки спричинюють зменшення контактної поверхні між шкірою та наноемульсією, наслідком чого є зниження швидкості проникнення. По-друге, 3 етиловий спирт має відносно низьку в'язкість (1,10 сПз (1,1010- Пас)), що не є оптимальним для стабільності мікроемульсій. Окрім того, унаслідок відносно низької гідрофобності етилового спирту, проникнення наноемульсій через ліпофільні фізіологічні мембрани шкіри може порушуватись. Як наслідок, зменшується стабільність наноемульсії, а також її біодоступність, тобто проникнення до тканин. На додаток до цього, етиловий спирт є дуже дорогим спиртом, порівняно зі спиртом інших видів, наприклад, ізопропіловим спиртом. Окрім того, етиловий спирт у декількох країнах за певних умов оподатковується спеціальним податком на спиртні напої. Таким чином, мета цього винаходу полягала у наданні наноемульсії, яка позбавлена недоліків наноемульсій, відомих у цій галузі, і яка, зокрема, демонструє оптимальні фізичні властивості, які можуть поліпшити стабільність, а також проникнення до клітин та тканин, і яка, водночас, є дешевшою за наноемульсії, відомі у цій галузі. Ця мета досягається, за цим винаходом, шляхом надання наноемульсії, яка містить a) щонайменше один водний компонент та b) носій, який містить i) щонайменше один ліпофільний компонент, ii) щонайменше одну поверхнево-активну речовину та iii) щонайменше один спирт, де щонайменше один спирт має щонайменше три атоми вуглецю. Винахідники встановили, що наноемульсія за цим винаходом має оптимально менший середній розмір частинок із гранулометричним складом вузького діапазону. Зменшення розміру частинок сприяє поліпшенню стабільності та кращому проникненню наноемульсії до клітин та тканин. Вміст компонента і) носія, тобто ліпофільного компонента, за варіантом, якому віддається 1 UA 101471 C2 5 10 15 20 25 30 35 40 45 50 55 60 перевага, становить від 0,1 % (мас.) до 15 % (мас.), за варіантом, якому віддається більша перевага, від 1 % (мас.) до 8 % (мас.) і за варіантом, якому віддається найбільша перевага, від 3 % (мас.) до 4 % (мас.), виходячи із загальної маси наноемульсії. Вміст компонента іі) носія, тобто поверхнево-активної речовини або поверхнево-активних речовин, за варіантом, якому віддається перевага, становить від 1 % (мас.) до 30 % (мас.), за варіантом, якому віддається більша перевага, від 2 % (мас.) до 15 % (мас.) і за варіантом, якому віддається найбільша перевага, від 4 % (мас.) до 6 % (мас.), виходячи із загальної маси наноемульсії. Вміст компонента ііі) носія, тобто спирту, за варіантом, якому віддається перевага, становить від 0,1 % (мас.) до 10 % (мас.), за варіантом, якому віддається більша перевага, від 0,5 % (мас.) до 5 % (мас.) і за варіантом, якому віддається найбільша перевага, від 1 % (мас.) до 2 % (мас.), виходячи із загальної маси наноемульсії. Вміст водного компонента, за варіантом, якому віддається перевага, у наноемульсії становить від 50 % (мас.) до 98 % (мас.), за варіантом, якому віддається більша перевага, від 70 % (мас.) до 95 % (мас.) і за варіантом, якому віддається найбільша перевага, від 88 % (мас.) до 92 % (мас.), виходячи із загальної маси наноемульсії. За варіантом, якому віддається перевага, завдяки цьому специфічному складу наноемульсії, одержують наноемульсію, яка добре переноситься шкірою і під час нанесення на шкіру не викликає відчуття її липкості, що, окрім усього іншого, обумовлюється відносно низьким вмістом поверхнево-активних речовин та ліпофільних компонентів. За варіантом здійснення цього винаходу, якому віддається перевага, наноемульсія як поверхнево-активна речовина містить мембранотвірну поверхнево-активну речовину та вторинну поверхнево-активну речовину, що утворює емульсію масла у воді. Масове співвідношення кількості мембранотвірної поверхнево-активної речовини до кількості вторинної поверхнево-активної речовини, яка утворює емульсію масла у воді, коливається у межах від 0,1:1 до 10:1, за варіантом, якому віддається перевага, від 0,2:1 до 0,8:1, за варіантом, якому віддається більша перевага, від 0,4:1 до 0,6:1. Спиртом, який має щонайменше 3 атоми вуглецю, якому віддається перевага у межах обсягу цього винаходу, є спирт, який має 3-10 атомів вуглецю, за варіантом, якому віддається перевага, 3-7 атомів вуглецю, за варіантом, якому віддається більша перевага, 3-5 атомів вуглецю і за варіантом, якому віддається найбільша перевага, 3 атоми вуглецю. Особливо придатними спиртами, які мають 5 атомів вуглецю, є 1-пентанол та/або 4-метил-2-пентанол. Придатними спиртами, які мають 4 атоми вуглецю, є 1-бутиловий спирт, трет-бутиловий спирт (2-метил-2-пропанол) та/або втор-бутиловий спирт (2-бутанол). Найбільшу перевагу віддають спиртам, які мають 3 атоми вуглецю, а саме 1-пропіловому спирту та ізопропіловому спирту, з яких перевагу віддають ізопропіловому спирту. У разі застосування С 3-спирту, зокрема, ізопропілового спирту, у наноемульсії за цим винаходом, винахідники встановили, що наноемульсія має частинки зменшеного розміру та гранулометричний склад вужчого діапазону, а також поліпшену стабільність та підвищене проникнення до тканин, порівняно з наноемульсіями відомого рівня техніки із застосуванням як спирту етилового спирту. Це було несподіваним, оскільки ізопропанол та етиловий спирт є дуже подібними за своїми фізіологічними та хімічними характеристиками. У разі застосування ізопропанолу як спирту у наноемульсії за цим винаходом, розмір емульгованих частинок є меншим, порівняно із застосуванням етилового спирту. Завдяки одержаній в результаті підвищеній контактній поверхні наноемульсії зі шкірою, поліпшуються властивості проникнення. Зменшення розміру частинок є також вирішальним для поліпшення стабільності наноемульсії, оскільки відомо, що швидкість аглютинації частинок, яка зрештою призводить до розділення фаз, підвищується з розміром частинок. Корисна дія ізопропанолу може бути обумовлена його дещо більшою гідрофобністю, результатом чого може бути краща здатність до проникнення через ліпофільні фізіологічні мембрани. На додаток до цього, 3 ізопропанол має більшу в'язкість (2,32 сПз (2,3210- Пас) при температурі 25C) порівняно з 3 етиловим спиртом (в'язкість 1,10 сПз (1,1010- Пас) при температурі 25C). Згадана підвищена в'язкість ізопропанолу може бути кращим стабілізаційним механізмом у наноемульсіях, оскільки в'язкість зменшує рухливість молекул. Додаткова перевага ізопропанолу, порівняно з етиловим спиртом, полягає у тому, що він є доступним за відносно низькою ціною, яка становить приблизно 1/3 ціни етилового спирту, і вільним від додаткового податку на спиртні напої. За варіантом, якому віддається перевага, щонайменше одним ліпофільним компонентом носія наноемульсії за цим винаходом є ліпід, рослинна олія та/або тваринний жир. Придатними ліпідами, за цим винаходом, є фізіологічно прийнятні ліпіди, наприклад, церамід, моно-, ді- та триацилгліцерин (тригліцериди), зокрема, каприловий та/або каприновий тригліцерид та/або їх суміш, при цьому особлива перевага віддається мігліолу (Miglyol) (наприклад, мігліолу 812 2 UA 101471 C2 5 10 15 20 25 30 35 40 45 50 55 60 (Miglyol 812) або міритолу 318 (Myritol 318), що є доступними, наприклад, від компанії Henkel). Придатними рослинними оліями та тваринними жирами є, наприклад, соняшникова олія, соєва олія, арахісова олія, ріпакова олія, риб'ячий жир та/або спермацет. Придатною мембранотвірною поверхнево-активною речовиною є фосфоліпід, лізофосфоліпід, церамід та/або їх суміш. За варіантом, якому віддається перевага, фосфоліпідом є лецитин або цефалін з сої або курячих яєць, за варіантом, якому віддається більша перевага, лецитином є соєвий лецитин. За варіантом, якому віддається перевага, вміст фосфатидилхоліну у лецитині становить щонайменше 80 % (мас.), за варіантом, якому віддається більша перевага, щонайменше 90 % (мас.), за варіантом, якому віддається найбільша перевага, щонайменше 94 % (мас.). Винахідники встановили, що якість лецитину, а саме вміст у ньому фосфатидилхоліну, відіграє вирішальну роль для розміру частинок наноемульсії. Чим вищим є вміст фосфатидилхоліну у лецитині, тим меншим є розмір частинок наноемульсії. Придатними як вторинні поверхнево-активні речовини, що утворюють емульсію масла у воді, є аніонні, неіоногенні, катіонні та/або амфотерні поверхнево-активні речовини, а також блок-співполімери. Придатними аніонними поверхнево-активними речовинами є мила, алкілбензолсульфонати, алкансульфонати, алкілсульфати та/або сульфати алкілового ефіру. Придатними катіонними поверхнево-активними речовинами є сполуки четвертинного амонію, які, за варіантом, якому віддається перевага, мають одну або дві гідрофобні групи (наприклад, цетилтриметиламонійбромід та цетилтриметиламонійхлорид) та/або солі довголанцюгових первинних амінів. Придатною амфотерною поверхнево-активною речовиною є N(ациламідоалкіл)бетаїн, N-алкіл--амінопропіонат та/або амін-N-оксид. Придатним блокспівполімером, наприклад, є пропіленоксид. За обсягом цього винаходу, особлива перевага віддається неіоногенній поверхнево-активній речовині як вторинній поверхнево-активній речовині, що утворює емульсію масла у воді. Придатну неіоногенну поверхнево-активну речовину вибирають з групи, яку складають полігліколевий ефір жирного спирту, полігліколевий ефір алкілфенолу, алкілполіглюкозид, глюкамід жирної кислоти, полігліколевий ефір жирної кислоти, блокспівполімер етиленоксиду та пропіленоксиду, складний ефір полігліцерину та жирної кислоти, алканоламід жирної кислоти та складний ефір (етоксилованого) сорбіту та жирної кислоти (сорбітан). Складним ефіром етоксилованого сорбіту та жирної кислоти, якому віддають особливу перевагу, є поліоксіетиленсорбітанмоноолеат, за варіантом, якому віддається найбільша перевага, полісорбат 80 (Polysorbate 80). Водний компонент наноемульсії за цим винаходом, за варіантом, якому віддається перевага, являє собою слабку буферну систему з низьким вмістом солі, за варіантом, якому віддається більша перевага, 5-30 мМ фосфатний буфер і за варіантом, якому віддається найбільша перевага, 10 мМ фосфатний буфер. Значення рН фосфатного буфера, за варіантом, якому віддається перевага, коливається у межах від рН 4 до рН 8, за варіантом, якому віддається більша перевага, від рН 5 до рН 7 і за варіантом, якому віддається найбільша перевага, від рН 5,5 до рН 6,5. Вода, яку застосовують для одержання фосфатного буфера, за варіантом, якому віддається перевага, являє собою стерильну деіонізовану воду та/або воду для ін'єкцій, за варіантом, якому віддається більша перевага, воду для ін'єкцій. Середній діаметр емульгованих частинок (наносом) у наноемульсії становить від 5 нм до 500 нм, за варіантом, якому віддається перевага, від 10 нм до 200 нм, за варіантом, якому віддається більша перевага, він є меншим за 100 нм, зокрема, до 90 нм, за варіантом, якому віддається перевага, до 70 нм, за варіантом, якому віддається ще більша перевага, від 10 нм до 50 нм, і за варіантом, якому віддається найбільша перевага, від 15 нм до 35 нм. Гранулометричний склад наночастинок за варіантом, якому віддається перевага, є монодисперсним і підпорядковується нормальному розподілу. Діаметр емульгованих частинок за цим винаходом визначають за допомогою гранулометричного складу, який визначають за методом динамічного розсіяння світла (DLS) (який називають також фотонною кореляційною спектроскопією (PCS)). Статистичний аналіз розподілу частинок за цим винаходом здійснюють за методом, який називають зваженим розподілом кількості частинок. Ще одним об'єктом цього винаходу є спосіб одержання наноемульсії за цим винаходом, який включає такі стадії: a) приготування водного компонента, b) приготування носія, який містить щонайменше один ліпофільний компонент, щонайменше одну поверхнево-активну речовину і щонайменше один спирт, де щонайменше один спирт має щонайменше три атоми вуглецю, та c) змішування водного компонента стадії a) з носієм стадії b). У процесі одержання наноемульсії компоненти носія вводять у водний компонент, і суміш перетворюють на наноемульсію шляхом інтенсивної або обережної гомогенізації. Гомогенізація може здійснюватись, наприклад, за допомогою комерційно доступних гомогенізаторів. Після 3 UA 101471 C2 5 10 15 20 25 30 35 40 45 50 55 60 одержання наноемульсії можуть додаватись інші домішки та наповнювачі, присутність яких є небажаною під час гомогенізації. Спосіб одержання наноемульсії за варіантом, якому віддається перевага, здійснюють за асептичних умов, наприклад, із застосуванням витяжної шафи з ламінарним потоком повітря. Винахідники встановили, що, окрім композиції, деякі стадії способу одержання є вирішальними для кінцевого розміру та гранулометричного складу емульгованих частинок у наноемульсії. Зокрема, на стадії с) головну роль відіграють температура та умови гомогенізації. Стадію с) здійснюють при температурі у межах від 50C до 60C. Усі інгредієнти попередньо нагрівають до цієї температури. Контейнер та мішалка також повинні бути оптимізованими для дуже швидкого одержання гомогенної суміші компонентів (впродовж секунд) із виключенням утворення піни. Дивись Приклад 1 для ілюстрації цього процесу. За альтернативним варіантом гомогенізація не потребує пристроїв із високим зсувним зусиллям, наприклад, ультразвукових дезінтеграторів або гомогенізаторів високого тиску. Ще одним аспектом цього винаходу є фармацевтична та/або косметична композиція, яка містить наноемульсію за цим винаходом. Наноемульсія за цим винаходом є придатною для використання у галузі косметичних виробів, наприклад, як компонент, який уповільнює старіння, оскільки вона відіграє роль чудового, прозорого носія, який може застосовуватись для цілого ряду виробів різного типу. Наноемульсія являє собою систему з дуже тонкою рівновагою, яка містить відносно низькі рівні емульгаторів, які вважаються подразливим компонентом. Наноемульсія за цим винаходом зберігає бажану прозорість або напівпрозорість, вона є здатною вмістити прийнятну кількість домішок, наприклад, ароматизаторів або зволожувачів, разом із тим залишаючись стабільною, м'якою і ніжною на шкірі споживача унаслідок низького рівня вмісту емульгатора. Для передбачуваного застосування кінцевого продукту у разі косметичних виробів можна додавати нетерапевтичні або неактивні агенти, наприклад, пом'якшувальні речовини, ароматизатори, барвники, коригенти, желеутворювальні компоненти, загущувачі, сонцезахисні компоненти тощо, які покращують кінцеве застосування продукту, зокрема, для місцевого косметичного застосування, за умови прийняття заходів для запобігання вибору компонентів, які погіршать прозорість продукту. Кінцевий продукт може набувати форму молочка, крему, лосьону, гелю, сироватки, рідкого спрею тощо. У разі сонцезахисних засобів, наноемульсії за цим винаходом можуть включати один або декілька сонцезахисних компонентів, наприклад, бензофенонів, авобензонів, цинаматів, саліцилатів тощо. Наноемульсії можуть також застосовуватись у фармацевтичних композиціях, зокрема, вони можуть застосовуватись для виготовлення місцевих лікарських засобів для лікування шкірних захворювань, наприклад, нейродерматитів, псоріазу, кератозу, зокрема, старечого кератозу, та хвороб, пов'язаних із проліферацією клітин, наприклад, онкологічних захворювань. За варіантом, якому віддається перевага, онкологічні захворювання вибрані з групи, яку складають базально-клітинний рак, плоскоклітинний рак, хвороба Боуена, інтраепітеліальна неоплазія вульви (VIN), вузликова або підшкірна форми раку. Окрім того, наноемульсія є придатною для лікування вірусних захворювань, що викликаються вірусом папіломи (бородавки) людини, наприклад, гострокінцевої кондиломи (Condylomata acuminata). Включення до складу наноемульсії ліпофільного компонента може корисно впливати на втрату води через шкіру, тобто може посилюватись бар'єрна функція шкіри і, таким чином, може справлятись корисний вплив на шкірні захворювання, наприклад, нейродерматит. Ще один аспект цього винаходу має відношення до композиції, яка містить наноемульсію за цим винаходом і активний агент. У цьому відношенні композиція є особливо придатною як фармацевтична та/або косметична композиція, наприклад, для нанесення на шкіру або волосся. Наноемульсії за цим винаходом, які входять до складу згаданих композицій, відіграють роль дуже ефективних систем доставки для найрізноманітніших активних агентів. До прикладів активних агентів, які можуть бути корисними, належать агенти для видалення старечих плям (на шкірі), кератозів та зморшок, болезаспокійливі засоби, анестетики, засоби від вугрів, бактерицидні засоби, протидріжджові препарати, протигрибкові препарати, противірусні засоби, засоби проти лупи, засоби проти дерматиту, засоби проти сверблячки, протиблювотні засоби, засоби проти захитування, протизапальні засоби, антигіперкератолітичні засоби, засоби проти сухої шкіри, антиперспіранти, засоби проти псоріазу, засоби проти себореї, кондиціонери для волосся і засоби для догляду за волоссям, компоненти, що уповільнюють старіння, засоби проти зморшок, протиастматичні засоби та бронхолітичні засоби, сонцезахисні засоби, протигістамінні засоби, компоненти, які вибілюють шкіру, депігментувальні засоби, вітаміни, кортикостероїди, гормони, ретиноїди, наприклад, ретиноєва кислота та ретинол, місцеві серцево-судинні засоби, клотримазол (clotrimazole), кетоконазол (ketokonazole), міконазол (miconazole), грізеофульвін (griseofulvin), гідроксизин (hydroxyzine), дифенгідрамін 4 UA 101471 C2 5 10 15 20 25 30 35 40 45 50 55 60 (diphenhydramine), прамоксин (pramoxine), лідокаїн (lidocaine), прокаїн (procaine), мепівакаїн (mepivacaine), монобензон (monobenzone), еритроміцин, тетрациклін, кліндаміцин, канаміцин, меклоцилін, гідрохінон, міноциклін, напроксен, ібупрофен, теофілін, кромолін, альбутерол, місцеві стероїди, наприклад, гідрокортизон, гідрокортизону 21-ацетат, гідрокортизону 17валерат та гідрокортизону 17-бутират, бетаметазону валерат, бетаметазону дипропріонат, триамцинолону ацетонід, флуоцинонід (fluocinonide), клобетазолу пропіонат, бензоїлпероксид, кротамітон, пропранолол, прометазин, пальмітат вітаміну А, ацетат вітаміну Е та їх суміші. За варіантом здійснення цього винаходу, якому віддається перевага, активний агент вибраний з групи, яку складають 5-амінолевулінова кислота, її похідна, попередник та/або метаболіт. Термін "похідна" слід розуміти як, зокрема, сполуку з алкілованою аміногрупою 5амінолевулінової кислоти, яка заміщена однією або двома алкільними групами, за варіантом, якому віддається особлива перевага, однією метильною групою. Похідною, якій віддається найбільша перевага, є метиламінолевулінова кислота. Дериватизація може розумітись також як сольові комплекси та продукти приєднання, а також алкіловані сполуки. "Попередник" та "метаболіт" повинні розумітись як речовини, що перетворюються у клітині на протопорфірин IX. Особлива перевага віддається активному агенту, яким є 5-амінолевулінова кислота або її похідні. 5-амінолевулінову кислоту застосовують як проліки у галузі фотодинамічної терапії. Фотодинамічна терапія є перспективним методом лікування різних передракових та ракових захворювань, які пов'язуються з проліферацією клітин (Тейлор Е.Л. (Taylor E.L.), Браун С.Б. (Brown S.B.), 2002, Journal of Dermatological treatment, 13, Suppl. 1, S3-11; Пенг К. (Peng Q.) та інші, 1997, Cancer, 79, S2282-2308). Принцип фотодинамічної терапії полягає у веденні так званого фотосенсибілізувального агента до ураженої тканини і подальшому опроміненні світлом відповідної довжини хвилі з метою перетворення агента на цитотоксично активний агент, який, у свою чергу, здійснить руйнування клітини. Селективна дія цього способу обумовлюється підвищеною концентрацією сенсибілізувального агента у швидко проліферуючих або пошкоджених клітинах, порівняно з нормальною тканиною. Окрім того, опромінення фотосенсибілізатора обумовлює виникнення характеристичного флуоресцентного випромінення, яке може застосовуватись для діагностичних цілей, наприклад, для виявлення проліферуючих клітин. 5-амінолевулінова кислота є ендогенною речовиною, яка синтезується з гліцину та сукцинілСоА у межах клітини. У межах обсягу біосинтезу гему, протопорфірин IX, який має високий ступінь фотоактивності, утворюється з 5-амінолевулінової кислоти (5-ALA), після чого перетворюється на гем. Цей контрольний механізм оминається шляхом екзогенного введення 5-амінолевулінової кислоти, яка була одержана синтетичним шляхом, що спричинює підвищене продукування протопорфірину IX. Оскільки розклад протопорфірину IX додатково інгібується природним контрольним механізмом, ця сполука концентрується у клітинах. У разі опромінення світлом, протопорфірин IX піддається фотохімічному окисненню, після чого відіграє роль фотосенсибілізатора для фотодинамічної терапії. Системне застосування 5-амінолевулінової кислоти пов'язується з рядом побічних ефектів, яких можна запобігти шляхом місцевого застосування лікарського засобу. У цій галузі є відомим цілий ряд досліджень стосовно місцевого застосування композицій 5-амінолевулінової кислоти. Разом із тим, що ці дослідження мають спільну особливість, яка полягає у тому, що 5амінолевулінова кислота застосовується у формі емульсії масла у воді, існують різниці стосовно інших параметрів, а саме періоду проникнення, періоду лікування, типу світла, що застосовується, та дози світла, що застосовується. Б. Тіль (B. Thiele) та інші (H+G, том 69, № 3, стор. 161-164 (1994)) описують дослідження, які включають застосування 20 % -амінолевулінової кислоти у формі емульсії масла у воді із періодом проникнення від 5 год. до 6 год. та подальшим опроміненням аргоновим лазером з іонним накачуванням (максимум випромінення 630 нм), що забезпечує сумарну енергетичну 2 3 2 2 2 2 експозицію від 50 Дж/см (510- Дж/м ) до 100 Дж/см (10- Дж/м ). Вольф (Wolf) та інші (Journal of the American Academy of Dermatology, том 28, стор. 17-21, 1993) описують дослідження, які включають застосування 20 % 5-амінолевулінової кислоти у формі емульсії масла у воді із періодом проникнення 4 год., 6 год. або 8 год. та опромінення нефільтрованим світлом або червоним світлом, що забезпечує енергетичну експозицію від 2 3 2 2 2 2 30 Дж/см (310- Дж/м ) до 100 Дж/см (10- Дж/м ). Незважаючи на те, що дослідження, розкриті у цій галузі, безперечно демонструють перспективний потенціал фотодинамічної терапії із застосуванням 5-амінолевулінової кислоти, відомі на цей час емульсії масла у воді мають цілий ряд недоліків. Наприклад, М. Ново Родрігес (M. Novo Rodriguez) та інші (SPIE, том 2371, стор. 204-209) 5 UA 101471 C2 5 10 15 20 25 30 35 40 45 50 55 60 показали, що 5-амінолевулінова кислота з високими концентраціями, необхідними для клінічного застосування, є нестійкою у водних розчинах у діапазоні значень рН від нейтральних до основних. Впродовж періоду дослідження, тривалість якого становила 25 год., задовільні результати були одержані лише при 3 % концентрації та при рН 5; ці умови визначаються як оптимальні для водних розчинів 5-амінолевулінової кислоти. Для клінічного застосування, однак, необхідним буде, взагалі, надання також композицій з концентраціями у ширшому діапазоні; окрім того, для комерційного застосування розчини 5-амінолевулінової кислоти повинні зберігати стабільність впродовж періоду часу, тривалість якого вимірюється тижнями або місяцями. В. фон Аркс (V. von Arx) та інші (J. Pharm. Pharmacol., 49: 652-656, 1997) описують дослідження, які мають відношення до місцевого застосування 5-амінолевулінової кислоти у різноманітних гелях. Ця публікація вказує, що найкращою композицією для збереження стабільності 5-амінолевулінової кислоти є комбінація з Novion AA-1, поліакриловою кислотою, при рН94 % фосфатидилхоліну, для фармацевтичного застосування, Фармакопея США 1,73 Поверхнево-активна речовина 3,40 Вторинна поверхневоЄвропейська Фармакопея активна речовина 3,45 Ліпідна серцевина Європейська Фармакопея 1,42 Розчинник Європейська Фармакопея Вода для ін'єкцій: Європейська Фармакопея Двонатрійфосфат та гідрофосфат натрію: Європейська Фармакопея 10 мМ фосфатний буфер, Додати до 100,00 Розчинник рН 6 30 Якість Процес виготовлення емульсії BF-200 включає наведені нижче стадії: Стадія 1: Одержання 10 мМ фосфатного буфера, рН 6 (водний компонент). Стадія 2: Одержання носія, який містить ліпофільний компонент, поверхнево-активні речовини та спирт. Стадія 3: Одержання наноемульсії шляхом змішування водного компонента Стадії 1 та носія Стадії 2. Стадія 4: Стерилізація фільтруванням через мікропористу мембрану та заповнення стерильних скляних флаконів наноемульсією BF-200 у витяжній шафі з ламінарним потоком повітря. Опис процесу виготовлення партії типового розміру: Стадія 1: Одержують 10 мМ фосфатний буфер (1000 г, рН 6), і стерилізують його шляхом фільтрації через 0,2 мкм стерильний фільтр. Стадія 2: Одержання носія, який містить ліпофільний компонент, поверхнево-активні 11 UA 101471 C2 речовини та спирт. Таблиця 2 Носій ІIнгредієнти Соєвий лецитин Полісорбат 80 Каприловий, каприновий тригліцерид Ізопропіловий спирт Маса (г) 17,30 34,00 34,50 14,20 5 10 15 20 25 Соєвий лецитин (17,30 г) зважують у відповідній посудині. Додають ізопропіловий спирт (14,20 г), і посудину закривають для запобігання випаровування спирту. Соєвий лецитин розчиняють при постійному перемішуванні за допомогою відповідної мішалки при кімнатній температурі. Каприловий/каприновий тригліцериди (34,50 г) та полісорбат 80 (34,00 г) зважують і додають до розчину соєвого лецитину. Суміш перемішують за допомогою відповідної мішалки при кімнатній температурі до одержання однорідного прозорого розчину. Цей розчин являє собою концентрат, який містить усі емульгатори та ліпідні компоненти наноемульсії BF-200. Стадія 3: Одержання емульсії шляхом змішування 900 г фосфатного буфера (зі Стадії 1) та 100 г носія (зі Стадії 2). Перш за все, водний компонент, який являє собою фосфатний буфер, нагрівають приблизно до температури 55C у відповідній посудині. Після цього носій (концентрат) стадії 2 нагрівають приблизно до температури 55C. Потім носій вливають до фосфатного буфера при постійному перемішуванні за допомогою пропелерної мішалки (700 об/хв). Одержану наноемульсію перемішують впродовж 15 хв. Впродовж усього процесу температуру підтримують на рівні приблизно 55C. Зрештою, наноемульсію охолоджують на водяній бані до кімнатної температури. Стадія 4: Наноемульсію стерилізують шляхом фільтрування через 0,2 мкм стерильний фільтр та заливають до стерильних скляних флаконів місткістю 100 мл у витяжній шафі з ламінарним потоком повітря. Приклад 2: Одержання 1 %, 3 % та 10 % гелів амінолевулінової кислоти та плацебо Якісний та кількісний склад гелю плацебо та 1 %, 3 % та 10 % гелів амінолевулінової кислоти подано у таблиці, яка наведена нижче. 30 Таблиця 3 Склад гелю плацебо ІIнгредієнт Ксантанова камедь Кількість на 1 г Функція гелю 20,375 мг Заповнювач Якість Наноемульсія BF-200 175,0 мг Пропіленгліколь Метилпарагідроксибензоат Пропілпарагідроксибензоат Вода для ін'єкцій 9,0 мг Консервант Європейська Фармакопея Визначення якості за допомогою зразкових засобів, що належать установі Європейська Фармакопея 0,7 мг Консервант Європейська Фармакопея 0,3 мг Консервант Європейська Фармакопея 794,625 мг Розчинник Європейська Фармакопея Носій 12 UA 101471 C2 Таблиця 4 Склад 1 % гелю амінолевулінової кислоти Склад Ксантанова камедь 20,125 мг Наноемульсія BF-200 175,0 мг Пропіленгліколь Метилпарагідроксибензоат Пропілпарагідроксибензоат Вода для ін'єкцій 9,0 мг Якість Визначення якості за допомогою Лікарський засіб зразкових засобів, що належать установі Заповнювач Європейська Фармакопея Визначення якості за допомогою Носій зразкових засобів, що належать установі Консервант Європейська Фармакопея 0,7 мг Консервант Європейська Фармакопея 0,3 мг Консервант Європейська Фармакопея 784,875 мг Розчинник Європейська Фармакопея Гідрохлорид амінолевулінової кислоти Кількість/г гелю 10,0 мг Функція Таблиця 5 Склад 3 % гелю амінолевулінової кислоти ІIнгредієнт Гідрохлорид амінолевулінової кислоти Кількість/г гелю 9,0 мг 0,7 мг Якість Визначення якості за допомогою Лікарський засіб зразкових засобів, що належать установі Заповнювач Європейська Фармакопея Визначення якості за допомогою Носій зразкових засобів, що належать установі Консервант Європейська Фармакопея Консервант Європейська Фармакопея 0,3 мг Консервант Європейська Фармакопея 765,375 мг Розчинник Європейська Фармакопея 30,0 мг Ксантанова камедь 19,625 мг Наноемульсія BF-200 175,0 мг Пропіленгліколь Метилпарагідрокси-бензоат Пропілпарагідроксибензоат Вода для ін'єкцій Функція 5 Таблиця 6 Склад 10 % гелю амінолевулінової кислоти ІIнгредієнт Кількість/г гелю 9,0 мг 0,7 мг Якість Визначення якості за допомогою Лікарський засіб зразкових засобів, що належать установі Заповнювач Європейська Фармакопея Визначення якості за допомогою Носій зразкових засобів, що належать установі Консервант Європейська Фармакопея Консервант Європейська Фармакопея 0,3 мг Консервант Європейська Фармакопея 697,125 мг Розчинник Європейська Фармакопея Гідрохлорид амінолевулінової кислоти 100,0 мг Ксантанова смола 17,875 мг Наноемульсія BF-200 175,0 мг Пропіленгліколь Метилпарагідрокси-бензоат Пропілпарагідроксибензоат Вода для ін'єкцій Функція Процес виготовлення гелю плацебо або амінолевулінової кислоти включає такі стадії: 13 UA 101471 C2 5 10 15 20 25 - Стадія 1: Одержання гелевої основи шляхом додання ксантанової камеді до води для ін'єкцій, перемішування та стерилізації парою. - Стадія 2: Одержання концентрованого розчину консервантів (метилпарагідроксибензоат та пропілпарагідроксибензоат) у пропіленгліколі. - Стадія 3, для плацебо: Одержання кінцевої гелевої композиції шляхом додання концентрованого розчину консервантів до гелевої основи, додання наноемульсії BF-200 до гелевої основи та гомогенізації гелю. - Стадія 3, для гелів амінолевулінової кислоти: Одержання кінцевої гелевої композиції шляхом додання концентрованого розчину консервантів до гелевої основи. Одержання розчину гідрохлориду амінолевулінової кислоти у наноемульсії BF-200. Додання розчину гідрохлориду амінолевулінової кислоти у наноемульсії BF-200 до гелевої основи та гомогенізація гелю. Опис процесу виготовлення: Стадія 1: Одержання гелевої основи з ксантановою камеддю Чашу Стефана дезінфікують 70 % ізопропанолом. До чаші вливають воду для ін'єкцій (у кількості 97,50 частини), після чого на неї насипають ксантан (у кількості 2,5 частини). Суміш 4 диспергують у вакуумі при швидкості відкачування приблизно 100 мбар/хв (10 Па/хв) при 600 обертах впродовж 90 хв. Одержану гелеву основу заливають до колб Шотта місткістю 200 мл, які були заздалегідь прополоскані водою для ін'єкцій (максимальне заповнення на 1/3 об'єму). Після цього гелеву основу у колбах стерилізують парою у автоклаві впродовж 20 хв при температурі 121C. Стадія 2: Одержання концентрованих складних ефірів пара-оксибензойної кислоти Метилпарагідроксибензойну кислоту (7,0 частин) та пропілпарагідроксибензойну кислоту (3,0 частини) зважують у відповідній посудині. До них примішують пропіленгліколь (90 частин), і утворені парагідроксибензоати розчиняють у пропіленгліколі. Суміш нагрівають на гарячій плиті при перемішуванні за допомогою магнітної мішалки до розчинення суміші (70C), і одержують прозорий розчин. Стадія 3, частина 1: Одержання гелю плацебо Таблиця 7 Одержання гелю плацебо з гелевої основи та концентрованих складних ефірів параоксибензойної кислоти A B D 30 35 Компоненти Гелева основа Наноемульсія BF-200 Концентровані складні ефіри пара-оксибензойної кислоти, FH Разом Кількість частин 81,50 17,50 1,0 100,0 Усі подальші стадії здійснювали у витяжній шафі з ламінарним потоком повітря у асептичних умовах. Концентровані складні ефіри пара-оксибензойної кислоти (D) у кількості 1 частини та гелеву основу (А) у кількості 81,5 частин вносять до відповідної посудини. Наноемульсію (В) у кількості 17,5 частин фільтрують через 0,2 мкм стерильний фільтр і додають до гелевої основи. Суміш перемішують впродовж 10 хв. Після цього гель вливають (по 2 частини) до ламінованих алюмінієвих туб. 14 UA 101471 C2 Стадія 3, частина 2: Одержання 1 % гелю амінолевулінової кислоти Таблиця 8 Одержання 1 % гелю амінолевулінової кислоти A B С D 5 10 15 20 25 30 35 Компоненти Гелева основа Наноемульсія BF-200 5-амінолевулінова кислота (гідрохлорид амінолевулінової кислоти) Концентровані складні ефіри пара-оксибензойної кислоти, FH Разом Кількість частин 80,50 17,50 1,00 1,0 100,0 Усі подальші стадії здійснювали у витяжній шафі з ламінарним потоком повітря за асептичних умов. Концентровані складні ефіри пара-оксибензойної кислоти (D) у кількості 1 частини та гелеву основу (А) у кількості 80,5 частин вносять до відповідної посудини. 5амінолевулінову кислоту (С) у кількості 1 частини розчиняють у 17,5 частинах наноемульсії (В) шляхом обережного перемішування з одержанням розчину. Згаданий розчин фільтрують через 0,2 мкм стерильний фільтр і додають до гелевої основи. Суміш перемішують впродовж 10 хв із метою одержання однорідного гелю. Після цього гель вливають (по 2 г) до ламінованих алюмінієвих туб. Ñòàä³ÿ 3, ÷àñòèìà 3: Îäåðæàììÿ 3 % òà 10 % ãåëþ àí³ìîëåâóë³ìîâî¿ êèñëîòè 3 % та 10 % гель одержали таким самим чином, як описано для 1 % гелю із застосуванням, однак, 78,50 частин гелевої основи та 3 частин 5-амінолевулінової кислоти або 71,50 частин гелевої основи та 10 частин 5-амінолевулінової кислоти, відповідно. Приклад 3: Гранулометричний склад наноемульсії BF-200 Середній розмір частинок наноемульсії, яку одержали, за визначенням за допомогою фотонної кореляційної спектроскопії, PCS (яку називають також динамічним розсіянням світла, DLS), є меншим за 100 нм. На додаток до цього, наноемульсія відрізняється дуже вузьким діапазоном гранулометричного складу (дивись Фіг. 1). Наноемульсія є стабільною у широкому діапазоні температур, але може руйнуватись у разі заморожування та автоклавування. Наноемульсії є відносно нечутливими до змін рН та іонної сили і, завдяки невеликому розміру, вони можуть стерилізуватись шляхом фільтрації через 0,2 мкм фільтр. Наноемульсії поліпшують доставку активних речовин до шкіри і, таким чином, посилюють ефективність місцево застосовуваних лікарських засобів. Наноемульсію BF-200 виготовляють із застосуванням низькоенергетичної технології; тобто одержання наноемульсії не потребує застосування пристроїв із високим зсувним зусиллям, наприклад, ультразвукових дезінтеграторів або гомогенізаторів високого тиску. Дослідження наночастинок наноемульсії BF-200 здійснювали засобами фотонної кореляційної спектроскопії за двома електронномікроскопічними методиками: електронна мікроскопія розлому замороженого зразка та негативне контрастування. Дані фотонної кореляційної спектроскопії підтвердили, що BF-200 являє собою наноемульсію з дуже стійким та достовірним розміром частинок та вузьким діапазоном гранулометричного складу. Ці характеристики залишаються стабільними впродовж тривалого періоду часу та при різних температурах (дивись наведену нижче Таблицю 9). 15 UA 101471 C2 5 10 15 20 25 30 У цілому, усі результати знаходяться у визначених межах після 12 місяців зберігання за різних умов зберігання. На Фіг. 2 показані електронні мікрофотографії розлому замороженого зразка наноемульсії BF-200 зі збільшенням у 1200000 разів та 250000 разів. Найпомітнішими особливостями мікрофотографій є велика кількість дуже малих сферичних пухирців із діаметром у межах від 15 нм до 50 нм. Ці значення добре співпадають зі значеннями, які одержали засобами фотонної кореляційної спектроскопії (дивись наведену вище Таблицю 9). Пухирці, найімовірніше, є одношаровими, оскільки товщина оболонки пухирців дорівнює 3-4 нм. Це відповідає довжині молекули фосфатидилхоліну, що є головним складником лецитину, поверхнево-активної речовини наноемульсії. Ліпосоми та інші двошарові пухирці мають товщину мембрани, яка перевищує 7 нм. Структура пухирців може також спостерігатись на електронних мікрофотографіях, які були одержані шляхом негативного контрастування. Частинки наноемульсії BF-200 є сферичними, діаметром приблизно 20 нм зі сферичною частиною товщиною приблизно від 3 нм до 4 нм, і заповненими аморфним матеріалом (дивись наведену ниже Фіг. 3). Порожнистих частинок знайдено не було. Дослідження наночастинок у гелі 5-амінолевулінової кислоти здійснювали за допомогою електронного мікроскопа із застосуванням методик розлому замороженого зразка та негативного контрастування. Електронні мікрофотографії розлому замороженого зразка гелю 5-амінолевулінової кислоти підтверджують, що наночастинки, присутні у гелі, мають розмір, подібний до розміру частинок у чистій наноемульсії BF-200. Мікрофотографія ілюструє поодинокі частинки, а також конгломерати (Фіг. 5). Умови зберігання не впливають на морфологію та розмір наночастинок у гелі. Дослідження BF-200 5-амінолевулінової кислоти (10 % гель після 4 місяців зберігання при температурі 25C (60 % відносна вологість)) засобами електронної мікроскопії розлому замороженого зразка виявило частинки з розмірами та формою, подібними до частинок, що знаходились у свіжовиготовленому гелі. Заплановане дослідження стабільності партій гелю 5амінолевулінової кислоти у BF-200 (10 % амінолевулінова кислота) та гелю плацебо у 16 UA 101471 C2 5 10 15 20 25 30 35 40 45 50 55 60 порівнянні з гелем 5-амінолевулінової кислоти у BF-200, призначених для застосування під час клінічного дослідження фази III водночас із клінічним дослідженням, буде включати визначення розміру частинок засобами електронної мікроскопії у пізніші часові точки. На Фіг. 6 показані електронні мікрофотографії розлому замороженого зразка гелю з більшим збільшенням. Поверхня розлому показує, головним чином, оболонку вкритих частинок. Розлом через саму частинку спостерігається дуже рідко. Пухирці видаються оточеними шаром матеріалу, який, як гадають, являє собою 5-амінолевулінову кислоту. Це утворює картину, яка нагадує яєчню (позначено стрілками на частині В Фіг. 6). На електронних мікрофотографіях, які одержали шляхом негативного контрастування 10 % гелю 5-амінолевулінової кислоти, зображені наночастинки з туманною дифузною структурою поверхні, що може підтверджувати стратифікацію матеріалу на наночастинках, яка спостерігалась на електронних мікрофотографіях розлому замороженого зразка. Приклад 4: Поглинання клітинами ссавців: in vitro дослідження культур клітин щодо включення 5-амінолевулінової кислоти: Дослідження на культурах клітин Процес поглинання 5-амінолевулінової кислоти культивованими клітинами і її перетворення на протопорфірин IX (PpIX) може контролюватись шляхом визначення УФ-індукованої флуоресценцї PpIX. Експерименти на культурі клітин проводили з декількома лініями пухлинних клітин: HeLa, HepG2 та СCD 106 KERTr (лінія клітин епітеліальних кератиноцитів людини). Клітини інкубували у рідких живильних середовищах із метиламінолевуліновою кислотою (MAL), 5-амінолевуліновою кислотою (ALA) або BF-200 з 5-амінолевуліновою кислотою впродовж 3 год. максимум. У разі застосування вибраних концентрацій лікарського засобу усі три інкубаційні середовища мали однакове значення рН. Після завершення інкубування клітини обережно промивали, і додавали свіже живильне середовище. Продукування PpIX визначали через різні періоди часу шляхом кількісного визначення рівня флуоресценції. На Фіг. 5 показані результати, які одержали для клітин HeLa. Вплив підвищення концентрацій наноемульсії BF-200 (при постійній концентрації 5амінолевулінової кислоти) на синтез протопорфірину IX показано на Фіг. 5. Флуоресценція протопорфірину IX у клітинах була інтенсивнішою у разі підвищення концентрації BF-200 і досягала максимального рівня при 3 % BF-200. Приклад 5 Ефективність наноемульсійної композиції 5-амінолевулінової кислоти для фотодинамічної терапії (PDT) старечого кератозу була продемонстрована при проведенні II фази клінічих досліджень із визначення дози, які були розпочаті восени 2006 року і спонсорувались компанією Biofrontera Bioscience GmbH. Плацебо-контрольоване, рандомізоване, подвійне сліпе дослідження проводили у 13 клінічних центрах Германії під медичним керівництвом професора доктора Рольфа-Маркуса Шімеса (Rolf-Markus Szeimies), університетська клініка Регенсбурга. Застосовували три активні дози (1 %, 3 % та 10 % 5-амінолевулінова кислота) та плацебо. Для перевірки ефективності сполуки 105 хворих піддали одноразовому лікувальному сеансу з однією з трьох різних концентрацій 5-амінолевулінової кислоти або плацебо. Були включені хворі з 3-10 спричиненими старечим кератозом ураженнями на обличчі або на волосистій частині шкіри голови. Кожного хворого піддавали одному лікувальному сеансу (1 %, 3 % або 10 % 5-амінолевулінова кислота (ALA) або плацебо) з усіма його/її ураженнями. Червоне світло застосовували після 3 год. інкубування. Після лікувального сеансу суб'єкти повертались до клініки через 3 тижні, 8 тижнів та 12 тижнів для перевірки клінічних наслідків та процесу загоєння. Кожного разу дослідник перевіряв ділянку ураження, яке було спричинене старечим кератозом (АК) і піддавалось лікуванню, для виявлення залишкових ділянок з ознаками АК та клінічними сиптомами. Головною змінною ефективності була швидкість повного очищення усіх уражень, спричинених АК, під час візиту через 12 тижнів, яка визначалась як кількість уражень, що демонстрували повну ремісію (ураження повністю очистились і більше не мають прилиплих кератозних бляшок, що злущуються). Контролювали також появу болю під час опромінювання після застосування наноемульсії BF-200 5-амінолевулінової кислоти. Результати: Встановили, що попередня обробка 10 % ALA, що передувала фотодинамічній терапії, була найфективнішою з трьох перевірених концентрацій щодо очищення уражень, спричинених старечим кератозом (статистична значущість перевищувала відповідний показник для плацебо). Коли хворих оглядали через 12 тижнів після одноразової обробки BF-200 ALA, щонайменше 60-70 % оброблених уражень були повністю загоєними, у залежності від зважування клінічними центрами та площини голови. Швидкість очищення у групі, яка одержувала плацебо, становила приблизно 5-15 % оброблених уражень, у залежності від зважування клінічними центрами. Швидкість очищення добре співпадала з опублікованими результатами ALA-PDT досліджень із подібним плануванням дослідження, але з більшими 17 UA 101471 C2 5 10 концентраціями активних речовин, 5-ALA або метиламінолевулінової кислоти. Косметичні результати були надзвичайно добрими. Лише 6 % хворих скаржились на сильний біль. Відповідні побічні ефекти під час проведення дослідження не спостерігались, косметичні результати були надзвичайно добрими. Під час проведення фотодинамічної терапії та впродовж 12-тижневого періоду після фотодинамічної терапії не було зареєстровано жодних застережень щодо безпечності у жодній із чотирьох груп. Як додатковий захід із забезпечення безпечності, ця частина із визначенням дози включала здійснення фармакокінетичних визначень. Визначали системні рівні 5-амінолевулінової кислоти та її метаболіту, протопорфірину IX, у плазмі та сечі. Концентрації цих сполук у плазмі та сечі хворих, які одержували 5-амінолевулінову кислоту, не були підвищеними порівнянно з природними фізіологічними значеннями у тих самих індивідів. ФОРМУЛА ВИНАХОДУ 15 20 25 30 35 40 45 50 55 60 1. Наноемульсія, яка містить а) щонайменше один водний компонент та b) носій, який містить і) щонайменше один ліпофільний компонент, вміст якого становить від 0,1 % (мас.) до 15 % (мас.), іі) щонайменше одну поверхнево-активну речовину та ііі) щонайменше один спирт, яка відрізняється тим, що щонайменше один спирт має 3-5 атомів вуглецю, та тим, що середній діаметр емульгованих частинок є меншим ніж 100 нм. 2. Наноемульсія за п. 1, яка відрізняється тим, що носій входить до складу водного компонента. 3. Наноемульсія за п. 1 або п. 2, яка відрізняється тим, що вміст поверхнево-активної речовини становить від 1 % (мас.) до 30 % (мас.), і вміст спирту становить від 0,1 % (мас.) до 10 % (мас.), виходячи із загальної маси наноемульсії. 4. Наноемульсія за будь-яким із попередніх пунктів, яка відрізняється тим, що вміст водного компонента становить від 50 % (мас.) до 98 % (мас.), виходячи із загальної маси наноемульсії. 5. Наноемульсія за будь-яким із попередніх пунктів, яка відрізняється тим, що згаданий щонайменше один спирт є ізопропіловим спиртом та/або 1-пропіловим спиртом. 6. Наноемульсія за будь-яким із попередніх пунктів, яка відрізняється тим, що згаданий щонайменше один ліпофільний компонент є тригліцеридами та/або їх сумішшю. 7. Наноемульсія за будь-яким із попередніх пунктів, яка відрізняється тим, що згаданий щонайменше одна поверхнево-активна речовина є лецитином та/або поверхнево-активною речовиною типу поліоксіетилену. 8. Наноемульсія за п. 7, яка відрізняється тим, що лецитином є соєвий лецитин та поверхневоактивною речовиною типу поліоксіетилену є полісорбат 80. 9. Наноемульсія за п. 8, яка відрізняється тим, що вміст фосфатидилхоліну у соєвому лецитині становить щонайменше 80 % (мас.). 10. Наноемульсія за будь-яким із попередніх пунктів, яка відрізняється тим, що середній діаметр емульгованих частинок становить від 10 нм до 50 нм. 11. Спосіб одержання наноемульсії за будь-яким із попередніх пунктів, який включає такі стадії: a) приготування водного компонента, b) приготування носія, який містить щонайменше один ліпофільний компонент, щонайменше одну поверхнево-активну речовину і щонайменше один спирт, що має 3-5 атомів вуглецю, та c) змішування водного компонента стадії а) з носієм стадії b) при температурі від 50 до 60 °С. 12. Фармацевтична композиція, яка містить наноемульсію за будь-яким із пп. 1-10. 13. Косметична композиція, яка містить наноемульсію за будь-яким із пп. 1-10. 14. Композиція, яка містить наноемульсію за будь-яким із пп. 1-10 та активний агент. 15. Композиція за п. 14, яка відрізняється тим, що активний агент вибраний з групи, яку складають 5-амінолевулінова кислота, її похідна, попередник та/або метаболіт. 16. Композиція за п. 15, яка відрізняється тим, що 5-амінолевулінова кислота, її похідна, попередник та/або метаболіт приєднаний на зовнішньому моношарі частинок наноемульсії. 17. Композиція за будь-яким із пп. 14-16, яка відрізняється тим, що композиція представлена у вигляді гелю і містить від 0,01 % (мас.) до 50 % (мас.) активного агента, від 1 % (мас.) до 60 % (мас.) наноемульсії, від 0,01 % (мас.) до 4 % (мас.) згаданого щонайменше одного наповнювача, від 1 % (мас.) до 3 % (мас.) згаданого щонайменше одного консерванту, виходячи із загальної маси композиції, і щонайменше один розчинник як решту композиції. 18. Фармацевтична композиція, яка містить композицію за будь-яким з пп. 14-16. 19. Композиція за п. 18, яка відрізняється тим, що композиція представлена у вигляді гелю і містить від 0,01 % (мас.) до 50 % (мас.) активного агента, від 1 % (мас.) до 60 % (мас.) наноемульсії, від 0,01 % (мас.) до 4 % (мас.) щонайменше одного наповнювача, від 1 % (мас.) 18 UA 101471 C2 5 10 15 20 25 30 35 40 45 50 55 до 3 % (мас.) щонайменше одного консерванту, виходячи із загальної маси композиції, і щонайменше один розчинник як решту композиції. 20. Косметична композиція, яка містить композицію за будь-яким з пп. 14-16. 21. Композиція за п. 20, яка відрізняється тим, що композиція представлена у вигляді гелю і містить від 0,01 % (мас.) до 50 % (мас.) активного агента, від 1 % (мас.) до 60 % (мас.) наноемульсії, від 0,01 % (мас.) до 4 % (мас.) згаданого щонайменше одного наповнювача, від 1 % (мас.) до 3 % (мас.) згаданого щонайменше одного консерванту, виходячи із загальної маси композиції, і щонайменше один розчинник як решту композиції. 22. Діагностична композиція, яка містить композицію за будь-яким з пп. 14-16. 23. Композиція за п. 22, яка відрізняється тим, що композиція представлена у вигляді гелю і містить від 0,01 % (мас.) до 50 % (мас.) активного агента, від 1 % (мас.) до 60 % (мас.) наноемульсії, від 0,01 % (мас.) до 4 % (мас.) згаданого щонайменше одного наповнювача, від 1 % (мас.) до 3 % (мас.) згаданого щонайменше одного консерванту, виходячи із загальної маси композиції, і щонайменше один розчинник як решту композиції. 24. Спосіб одержання композиції за будь-яким з пп. 14-23, який включає такі стадії: a) приготування водного компонента, b) приготування носія, який містить щонайменше один ліпофільний компонент, щонайменше одну поверхнево-активну речовину і щонайменше один спирт, який має 3-5 атомів вуглецю, c) змішування водного компонента стадії а) з носієм стадії b) для одержання наноемульсії, d) додання активного агента перед та/або після одержання згаданої наноемульсії стадії с), та є) факультативне додання інших домішок та/або наповнювачів до стадії d). 25. Спосіб за п. 24, який відрізняється тим, що активний агент на стадії d) додають після одержання згаданої наноемульсії стадії с). 26. Косметичне застосування наноемульсії за будь-яким із пп. 1-10 як засобу, що уповільнює старіння. 27. Застосування наноемульсії за будь-яким із пп. 1-10 для одержання лікарського засобу для лікування вірусного захворювання. 28. Застосування за п. 27, причому вірусне захворювання спричинюється вірусом папіломи (бородавки) людини (HPV). 29. Застосування за п. 28, причому вірусним захворюванням є гострокінцева кондилома. 30. Застосування наноемульсії за будь-яким із пп. 1-10 для одержання лікарського засобу для лікування шкірних захворювань. 31. Застосування за п. 30, причому захворювання вибране з групи, яку складають нейродерматити. 32. Застосування за п. 31, причому шкірним захворюванням є вугрі та/або захворювання, пов'язане з кератозом. 33. Застосування за п. 32, де кератозом є старечий кератоз. 34. Застосування наноемульсії за будь-яким із пп. 1-10 для одержання лікарського засобу для лікування захворювання, пов'язаного з проліферацією клітин. 35. Застосування за п. 34, причому захворюванням, пов'язаним із проліферацією клітин, є онкологічне захворювання. 36. Застосування за п. 35, причому онкологічне захворювання вибране з групи, яку складають базально-клітинний рак, плоскоклітинний рак, хвороба Боуена, інтраепітеліальна неоплазія вульви (VIN) та/або вузликова та/або підшкірна форми раку. 37. Застосування за п. 30 або 34, причому захворюванням є псоріаз. 38. Застосування композиції за будь-яким із пп. 15-23 для одержання лікарського засобу для фотодинамічної терапії. 39. Застосування за п. 38, причому згадану композицію вводять хворому у ефективній кількості та інкубують впродовж періоду часу, прийнятного для одержання достатньої кількості активного агента у тканині, яка підлягає обробці, і згадану тканину піддають опроміненню світлом. 40. Застосування композиції за будь-яким із пп. 15-23 для виявлення проліферуючих клітин. 41. Застосування композиції за будь-яким із пп. 15-23 для діагностування шкірних та/або онкологічних захворювань. 42. Набір, який включає в себе композицію за будь-яким із пп. 15-23 і щонайменше один компонент, вибраний з групи, яку складають a) фоторезистне покриття, b) засіб для прикріплення згаданого покриття до ділянки нанесення, та c) засіб для нанесення згаданої композиції на ділянку нанесення. 19 UA 101471 C2 20 UA 101471 C2 21 UA 101471 C2 22 UA 101471 C2 Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 23
ДивитисяДодаткова інформація
Назва патенту англійськоюNanoemulsions
Автори англійськоюFoguet Roca, Montserrat
Назва патенту російськоюНаноэмульсии
Автори російськоюФогет Рока Монтсеррат
МПК / Мітки
МПК: A61K 9/12, A61K 47/10, A61K 9/107, A61K 47/44, A61K 31/195
Мітки: наноемульсії
Код посилання
<a href="https://ua.patents.su/25-101471-nanoemulsi.html" target="_blank" rel="follow" title="База патентів України">Наноемульсії</a>