Застосування твердої мінеральної композиції як засобу для підвищення родючості оброблюваних ґрунтів або пасовищних ґрунтів
Номер патенту: 103629
Опубліковано: 11.11.2013
Автори: Дарідон Брюно, Руа Віржіні, Мора Філіп, Блен Дід'є, Джусті Стефані, Вейр'є Тібо, М'ямбі Едуард
Формула / Реферат
1. Застосування твердої мінеральної композиції, що має наступний склад:
карбонат кальцію
від 4,58 % до 77,8 %
доломіт
від 3,85 % до 69,29 %
хлорид натрію
від 5,7 % до 12,4 %
лігносульфат
від 4,25 % до 8,49 %
сульфат калію
від 0,37 % до 2,44 %
оксид магнію
від 0,01 % до 0,07 %
елементарна сірка
від 0,009 % до 0,066 %,
де приведеним вище процентним вмістом є масовий відсоток кожної із сполук від загальної маси сухої речовини мінеральної композиції як засобу для підвищення родючості ґрунту за рахунок збільшення принаймні одного виду ферментативної активності, наявної в ґрунті, вибраної з числа активності (і) фосфатази, (іі) b-ксилозидази, (ііі) a-глюкозидази та (iv) b-глюкозидази.
2. Застосування за п. 1, яке відрізняється тим, що тверда мінеральна композиція викликає збільшення принаймні в 1,5 рази, і переважно принаймні в 2 рази ферментативної активності, вибраної з активності (і) лужної фосфатази, (іі) b-ксилозидази, (ііі) a-тлюкозидази і b-глюкозидази.
3. Застосування за п. 1, яке відрізняється тим, що тверда мінеральна композиція викликає збільшення принаймні в 2 рази активності фосфатази.
4. Застосування за п. 1, яке відрізняється тим, що тверда мінеральна композиція викликає збільшення принаймні в 2 рази активності b-ксилозидази.
5. Застосування за п. 1, яке відрізняється тим, що тверда мінеральна композиція викликає збільшення принаймні в 2 рази активності a-глюкозидази.
6. Застосування за п. 1, яке відрізняється тим, що тверда мінеральна композиція викликає збільшення принаймні в 2 рази активності b-глюкозидази.
7. Застосування за п. 1, яке відрізняється тим, що мінеральна композиція викликає зміни, що можуть бути виявлені, співвідношень переважання відповідних бактерійних таксонів, присутніх в ґрунті, відносно один до одного.
8. Застосування за п. 1, яке відрізняється тим, що тверда мінеральна композиція викликає збільшення принаймні в 1,5 разу утворення рослинної біомаси ґрунтом.
9. Застосування за будь-яким з попередніх пунктів, яке відрізняється тим, що мінеральну композицію формули (І) вносять до удобрюваного ґрунту в кількості принаймні від 0,01 кг/м2 до 0,10 кг/м2, переважно в кількості від 0,02 до 0,04 кг/м2.
Текст
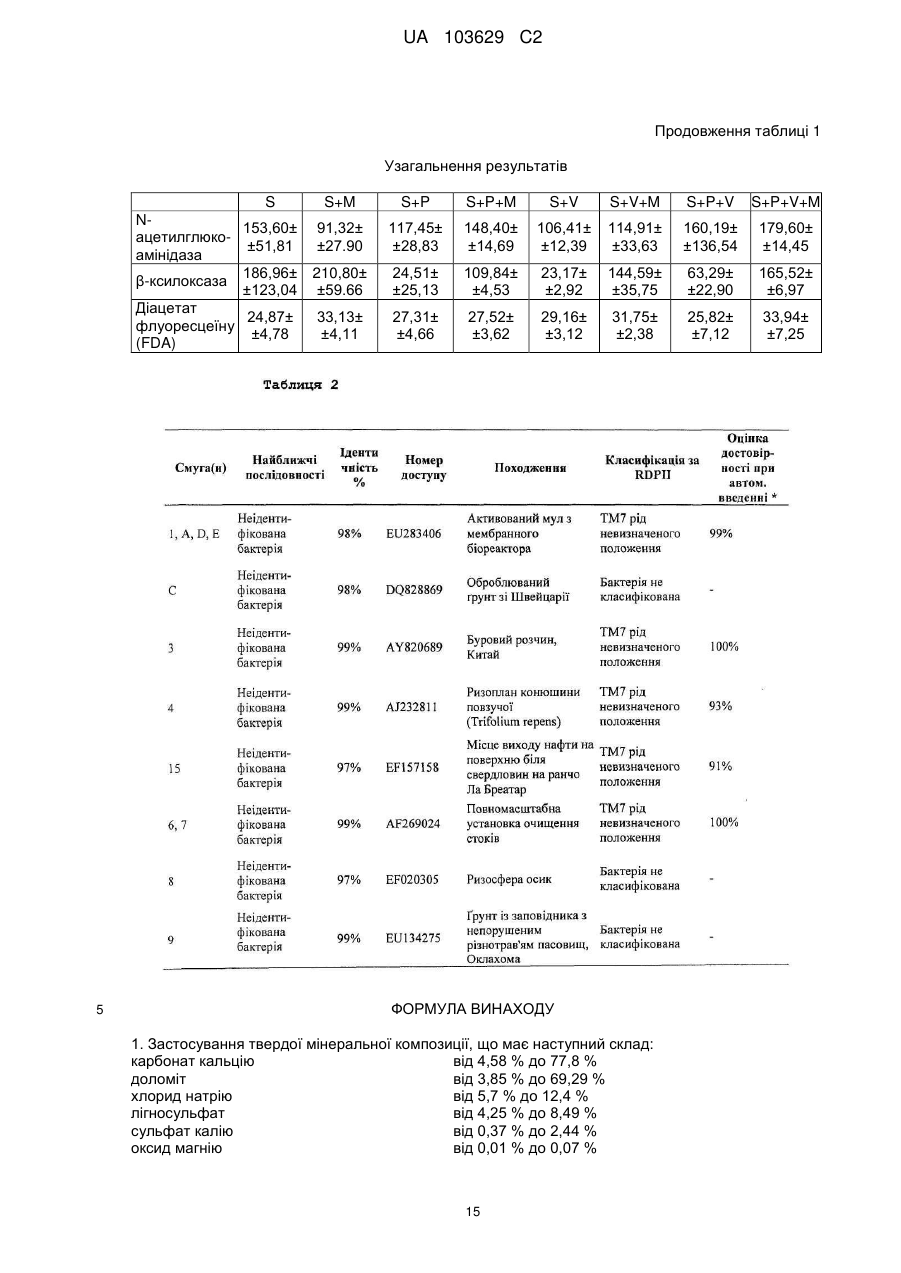
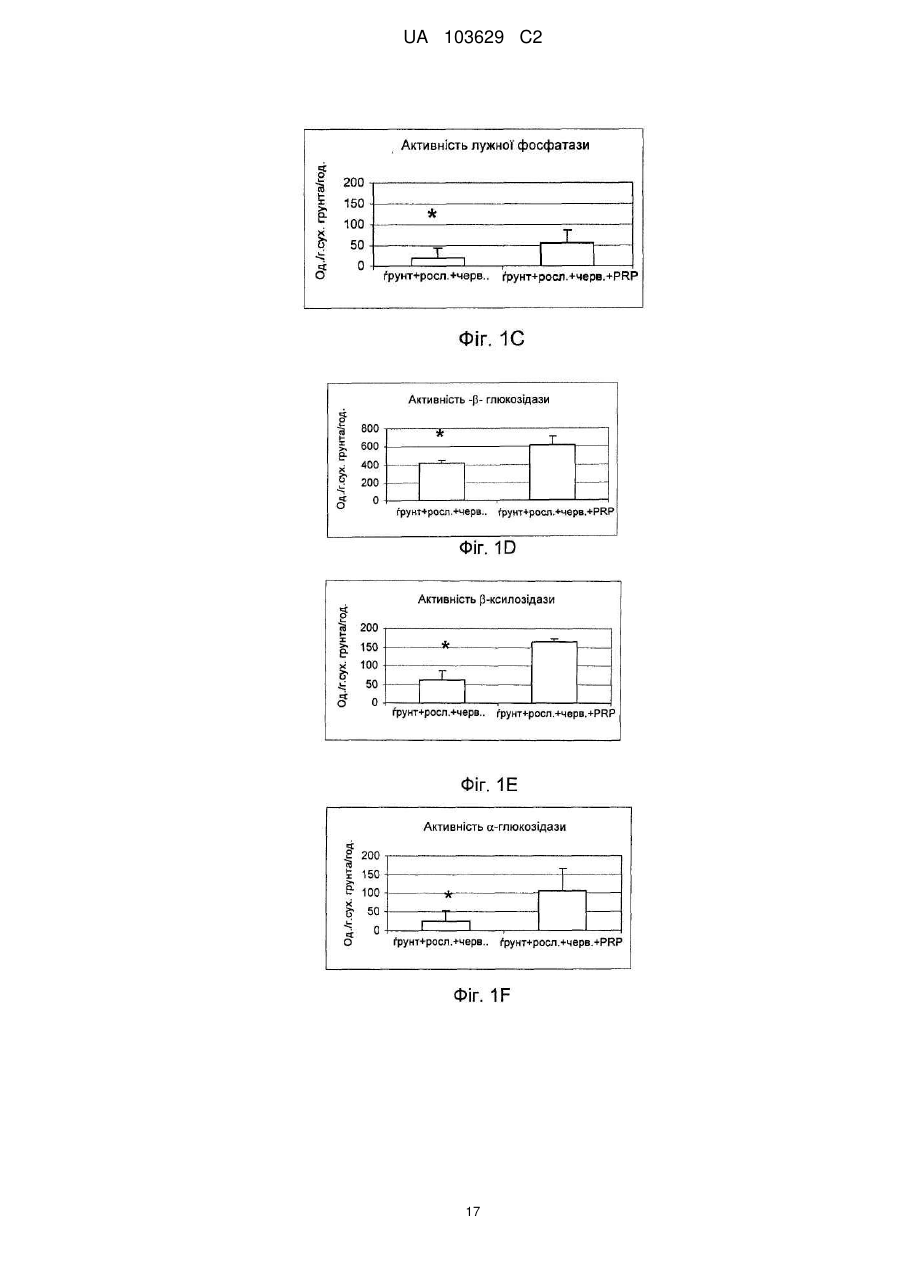
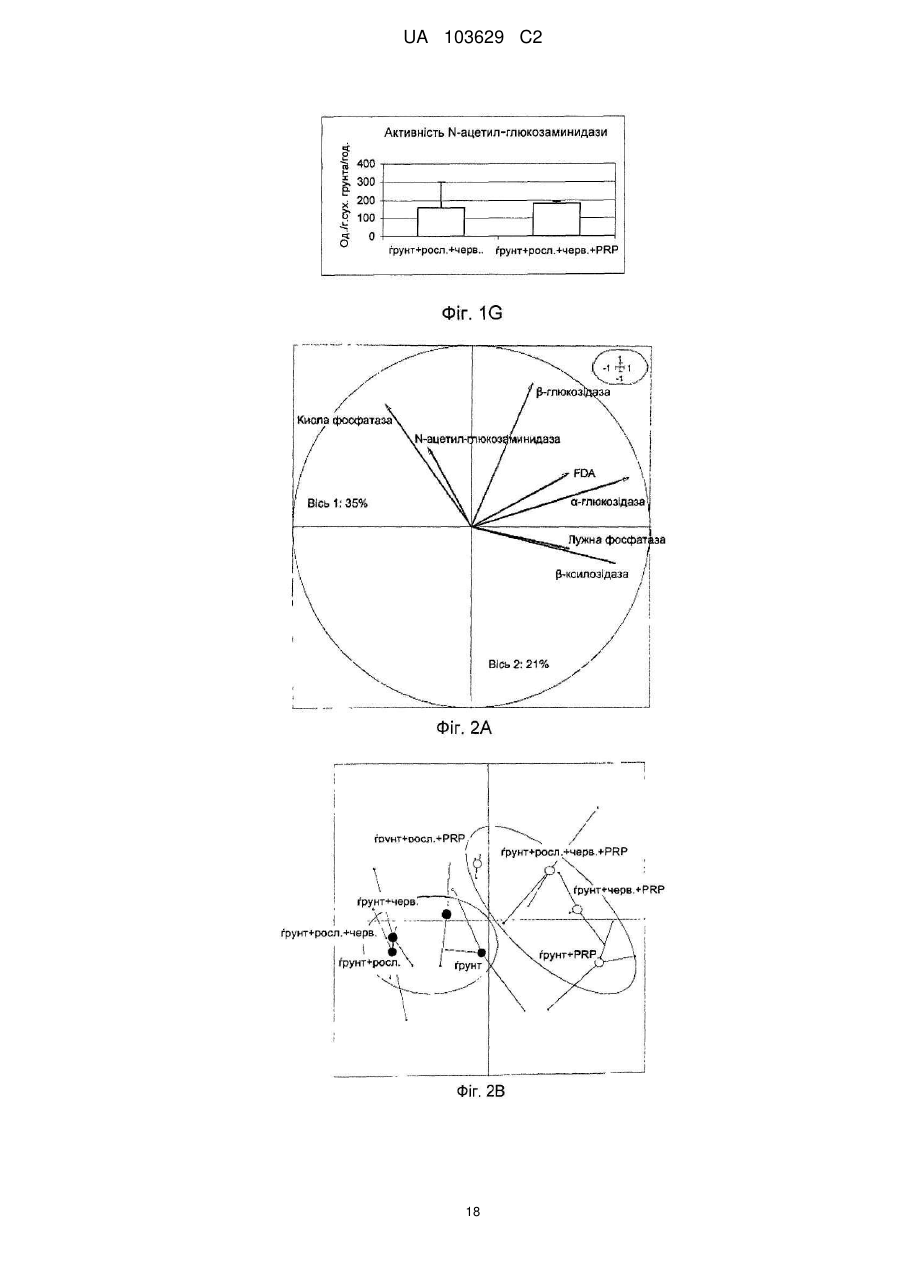
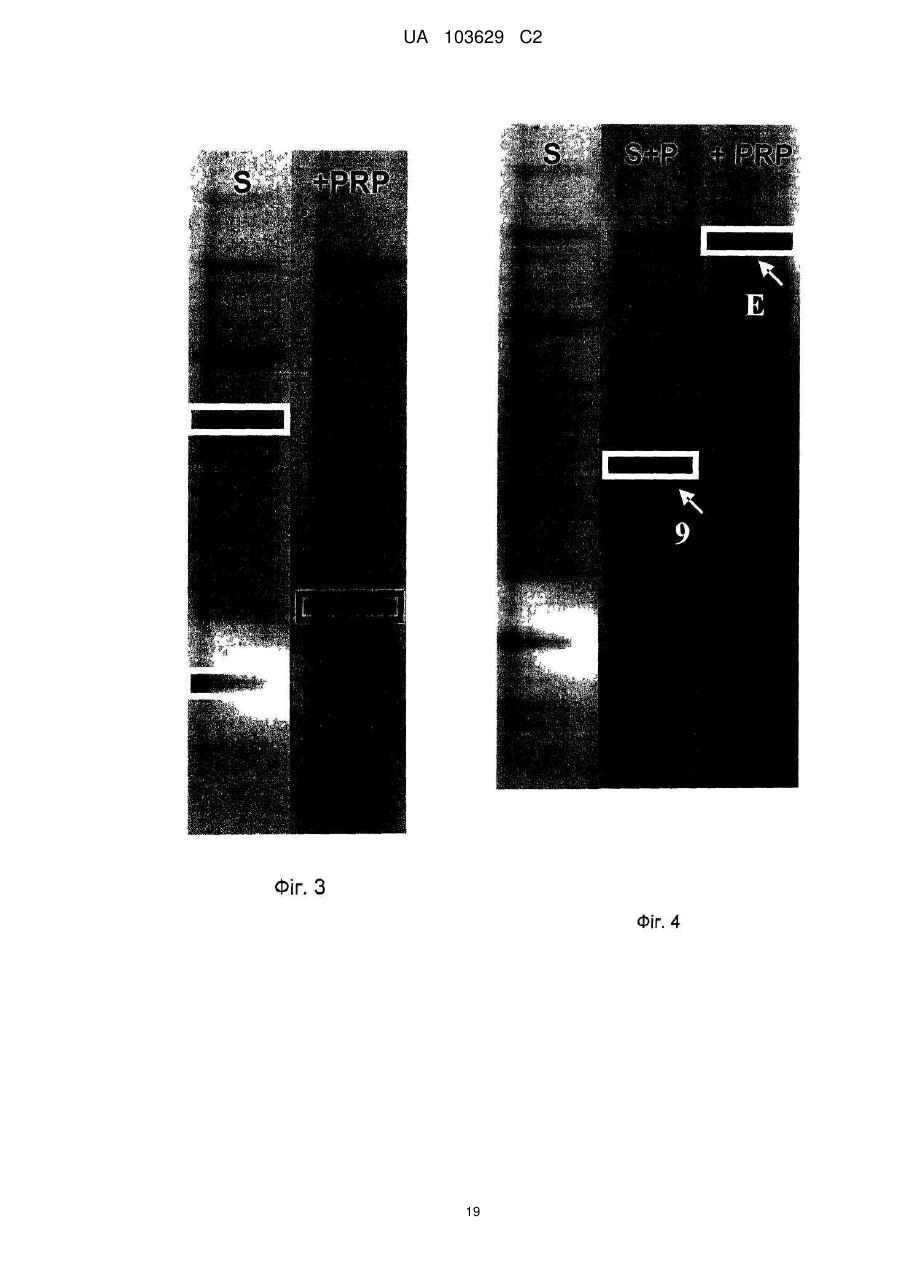
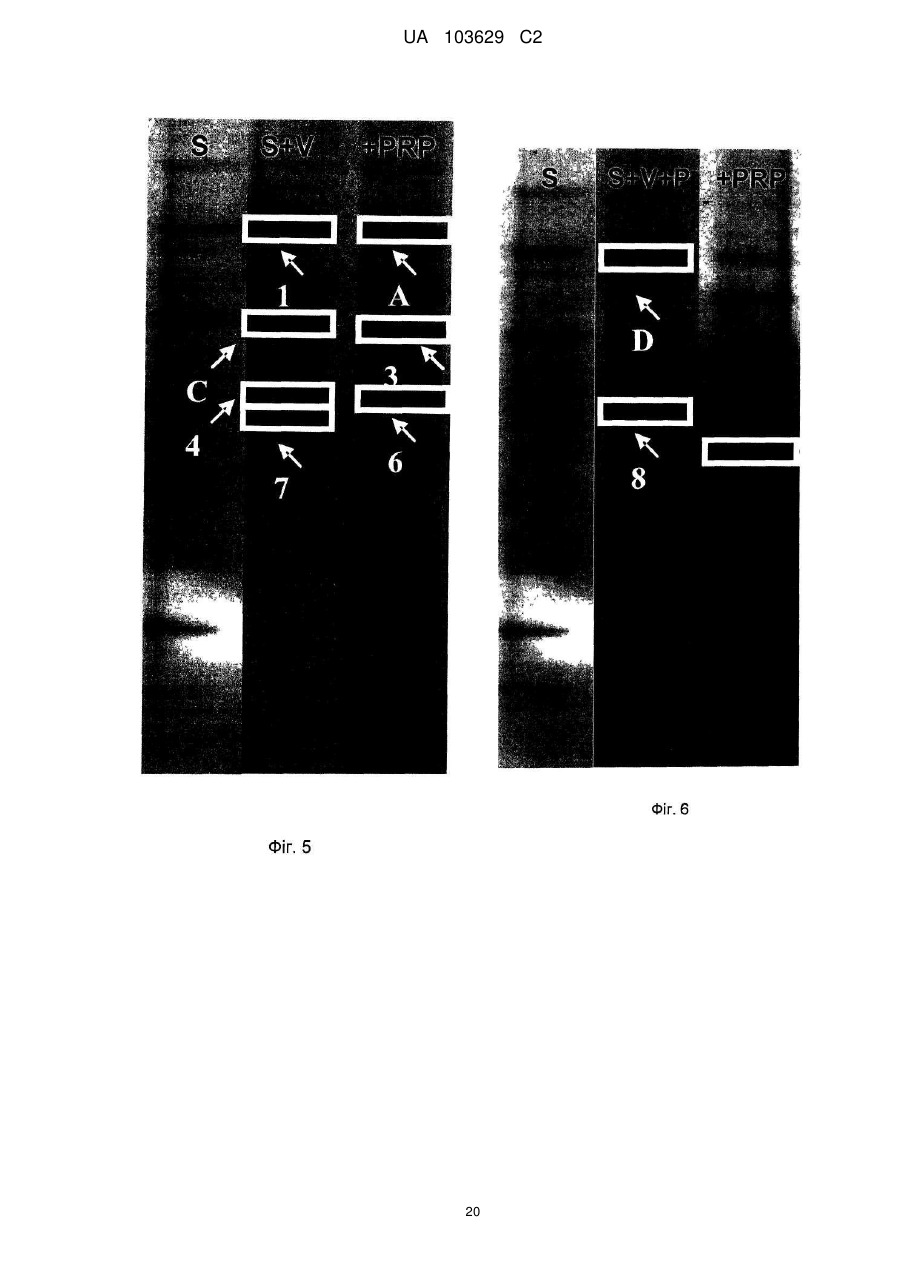
Реферат: Винахід належить до сільського господарства, зокрема до застосування добрив, що використовуються в землеробстві, садівництві і лісовому господарстві. Заявлено застосування твердої мінеральної композиції, що має наступні компоненти: карбонат кальцію, доломіт, хлорид натрію, лігносульфат, сульфат калію, оксид магнію та елементарну сірку, причому композиція призначена для підвищення родючості ґрунту за рахунок збільшення принаймні одного виду ферментативної активності, наявного в ґрунті, вибраного з числа активності (і) фосфатази, (іі) -ксилозидази, (ііі) -глюкозидази і (iv) -глюкозидази. UA 103629 C2 (12) UA 103629 C2 UA 103629 C2 5 10 15 20 25 30 35 40 45 50 55 60 Область техніки, до якої відноситься винахід Даний винахід відноситься до сільського господарства і, конкретніше, до добрив, що використовуються, зокрема, в землеробстві, садівництві і лісоводстві. Попередній рівень техніки У цій галузі добре відоме застосування органічних або мінеральних композицій, які вносять на поверхню оброблюваних ґрунтів з метою підвищення їх родючості. Так, велика частина композицій з органічних або мінеральних добрив відома і застосовується протягом тривалого часу в землеробстві, садівництві і лісоводстві. Щоб бути родючим, ґрунт повинен володіти оптимальною рівновагою між органічними і мінеральними компонентами. В даний час не існує показників, що дозволяють однозначно оцінити родючість ґрунту. Проте вимірювання біологічної активності тваринних організмів, рослинних організмів і мікроорганізмів, що містяться в ґрунті, все ширше враховується для визначення здатності ґрунту до відновлення, який взаємозв'язаний з родючістю ґрунту. Наприклад, можна згадати визначення родючості ґрунту на підставі вимірювання вироблення вуглекислого газу репрезентативним зразком. Згідно іншим дослідженням якість ґрунту, а, отже, його родючість пов'язана принаймні частково з ферментативною активністю ґрунту, який, зокрема, відображає її мікробну діяльність. Вивчення впливу способів внесення добрив на мікрофлору і на ферментативну активність ґрунту є класичним підходом стосовно органічних добрив (компост, гній, гнойова рідина, солома, зелені добрива …), оскільки такі матеріали є прямим джерелом живильних елементів, тобто вуглецю і азоту для мікроорганізмів, що мешкають в ґрунті. Деякі дослідження показують, що мікрофлора в орних ґрунтах кількісно і якісно бідніше, ніж у відповідних початкових лісових ґрунтах. Вивчення мікрофлори ґрунту можна проводити різними способами, включаючи повну екстракцію за допомогою фумігації-екстракції, вимірювання повної респіраторної або мінералізуючої активності ґрунту, проточну цитометрію, екстракцію і культуру всієї відновлюваної мікрофлори, аналіз маркерів, специфічних для деяких популяцій, таких як жирні кислоти, стероли, такі як ергостабіл, аналіз метаболічних профілів на мікропланшетах, аналіз ферментативної активності ґрунтових екстрактів або новіші методики, такі як екстракція всіх нуклеїнових кислот з ґрунту (метагеном), потім специфічна ампліфікація генів, кодуючих рибосомні РНК (16S для бактерій або 18S для грибів), методом ПЦР (полімеразній ланцюговій реакції), з подальшим аналізом ампліфікованих фрагментів за допомогою ДГГЕ (денатуруючого градієнтного гель-електрофорезу). У попередньому рівні техніки зазвичай вважалося, що ферментативна активність може бути важливим показником біологічної активності ґрунту у зв'язку з тим, що ферментативні реакції беруть участь в динаміці кругообігу живильних елементів і в перенесенні енергії до багатоклітинних рослинних організмів. Загальновідомо, що ферментативні реакції тісно пов'язані з родючістю ґрунту, оскільки ферментативні реакції реалізують перетворення форм деяких живильних речовин, що не трансформуються в ході обміну речовин, у форми, які можуть безпосередньо засвоюватися рослинами і мікробною біомасою. Конкретніше, ферменти ґрунту беруть участь в деградації і в синтезі органічних матеріалів, важливих для зростання рослин, які не синтезуються самими рослинами. Іншими словами, ферментативна активність відображає інтенсивність і природу біохімічних процесів, що проходять в ґрунті. З цієї причини ферментативна активність є індикатором біологічної здатності ґрунту до проведення біохімічних процесів, які важливі для підтримки її родючості. При удобренні ґрунтів додавання екзогенного органічного матеріалу (гнойової рідини, компосту, гною, мулу) сприяє коротко- і середньостроковій біорізноманітності, але склад мікрофлори, мабуть, прагне до повернення до первинного рівноважного складу після періоду тривалістю декілька тижнів або місяців після внесення органічних добрив. Існує багато робіт, присвячених вивченню мікрофлори і динаміки деградації внесених до ґрунту органічних речовин або пов'язаних з мулом, отриманим з багатих важкими металами органічних міських відходів. Значно менше робіт присвячено вивченню впливу мінеральних добрив на мікрофлору і на ферментативну активність ґрунту. Існуючі дослідження головним чином направлені на азотні добрива, на вплив важких металів, на наслідки накопичення доз мікроелементів в орних ґрунтах із-за інтенсивного і частого внесення добрив, як у разі міді, яку активно застосовували і продовжують застосовувати у фітосанітарних препаратах, зокрема, для виноградників. Можна також згадати деякі роботи, що стосуються внесення мінеральних сполук, таких як гіпс і 1 UA 103629 C2 5 10 15 20 25 30 35 40 45 феригідрит, вплив якого оцінювали на популяціях метаноутворюючих бактерій в ґрунті рисових полів. Так, в сучасному рівні техніки існує постійна потреба в композиціях, призначених для підтримки або підвищення родючості ґрунтів, які володіють сприятливим впливом на ферментативну активність ґрунтів. Суть винаходу Метою даного винаходу є застосування твердої мінеральної композиції, що має наступну формулу (I): від 4,58 % до - Карбонат кальцію 77,8 % від 3,85 % до - Доломіт 69,29 % - Хлорид натрію від 5,7 % до 12,4 % від 4,25 % до - Лігносульфат 8,49 % від 0,37 % до - Сульфат калію 2,44 % від 0,01 % до - Окис магнію 0,07 % від 0,009 % до - Елементарна сірка 0,066 % причому приведеним вище процентним вмістом є масовий відсоток кожної зі сполук від загальної маси сухої речовини мінеральної композиції для підвищення родючості ґрунту за рахунок збільшення принаймні одного виду ферментативної активності, наявного в ґрунті, вибраного з числа активності (i) фосфатази, (ii) β-ксилозидази, (iii) α-глюкозидази і (iv) βглюкозидази. Опис фігур Фіг. 1 ілюструє результати вимірювання ферментативної активності в різних ґрунтах. На Фіг. 1A-1G показані дані вимірювання різної ферментативної активності ґрунту з рослинним покривом і земляними черв'яками, відповідно, у відсутність мінеральної композиції формули (I) (лівий стовпчик) і з обробкою мінеральною композицією формули (I) (правий стовпчик). На осі ординат відкладена ферментативна активність в одиницях активності на грам сухого ґрунту на годину. На Фіг. 1A показані результати вимірювання загальної ферментативної активності. На Фіг. 1В показані результати вимірювання ферментативної активності кислої фосфатази. На Фіг. 1С показані результати вимірювання ферментативної активності лужної фосфатази. На Фіг. 1D показані результати вимірювання ферментативної активності β-глюкозидази. На Фіг. 1Е показані результати вимірювання ферментативної активності β-ксилозидази. На Фіг. 1F показані результати вимірювання ферментативної активності α-глюкозидази. На Фіг. 1G показані результати вимірювання ферментативної активності N-ацетил-глюкозамінідази. На Фіг. 2A показаний круг кореляції виміряної ферментативної активності. На Фіг. 2B показана проекція об'єктів (різних зразків) на осі 1 і осі 2 Фіг. 2A. На Фіг. 3 показано зображення гелю денатуруючого градієнтного гель-електрофореза (ДГГЕ). Ліва доріжка: ґрунт без рослинного покриву і без земляних черв'яків. Права доріжка: той же ґрунт, оброблений мінеральною композицією формули (I). На Фіг. 4 показано зображення гелю денатуруючого градієнтного гель-електрофореза (ДГГЕ). Ліва доріжка: ґрунт без рослинного покриву і без земляних черв'яків. Середня доріжка: ґрунт з рослинним покривом і без земляних черв'яків. Права доріжка: той же ґрунт з рослинним покривом і без земляних черв'яків, оброблена мінеральною композицією формули (I). На Фіг. 5 показано зображення гелю денатуруючого градієнтного гель-електрофореза (ДГГЕ). Ліва доріжка: ґрунт без рослинного покриву і без земляних черв'яків. Середня доріжка: ґрунт без рослинного покриву і із земляними черв'яками. Права доріжка: той же ґрунт без рослинного покриву і із земляними черв'яками, оброблена мінеральною композицією формули (I). На Фіг. 6 показано зображення гелю денатуруючого градієнтного гель-електрофореза (ДГГЕ). Ліва доріжка: ґрунт без рослинного покриву і без земляних черв'яків. Середня доріжка: ґрунт з рослинним покривом і із земляними черв'яками. Права доріжка: той же ґрунт з рослинним покривом і із земляними черв'яками, оброблена мінеральною композицією формули (I). 2 UA 103629 C2 5 10 15 20 25 30 35 40 45 На Фіг. 7 показана дендрограма, що ілюструє схожість профілів популяцій бактерій, виявлених в різних досліджених ґрунтах, на підставі профілів смуг міграції при ДГГЕ, показаних на Фіг. 3-6. На Фіг. 8 показано зображення гелю денатуруючого градієнтного гель-електрофореза (ДГГЕ). Доріжка "S": ґрунт без рослинного покриву і без земляних черв'яків. Доріжка "S+V": ґрунт "S" без рослинного покриву і із земляними черв'яками. Доріжка "S+M": ґрунт "S", оброблений мінеральною композицією формули (I). Доріжка "S+P": ґрунт "S" з рослинним покривом і без земляних черв'яків. Доріжка "S+V+M": ґрунт "S+V", оброблений мінеральною композицією формули (I). Доріжка "S+V+P": ґрунт "S" з рослинним покривом і із земляними черв'яками. Доріжка "S+P+M": ґрунт "S+P", оброблений мінеральною композицією формули (I). Доріжка "S+V+P+M": ґрунт "S+V+P", оброблений мінеральною композицією формули (I). На Фіг. 9 показана реконструкція філогенезу розділу TM7 на підставі Р-ДНК 16S по методу найближчого скріплення, що включає групи бактерій, секвеновані на базі деяких смуг міграції в гелі ДГГЕ, зображеному на Фіг. 8, і споріднені послідовності, які були отримані з банку даних. На Фіг. 10 зображений вплив мінеральної композиції формули (I), на утворення рослинної біомаси. По осі ординат: результати вимірювання утворення рослинної біомаси в грамах сухої ваги. На Фіг. 10A показано порівняння утворення рослинної біомаси (i) в ґрунті з рослинним покривом і без земляних черв'яків (лівий стовпчик) і (ii) в тому ж ґрунті, обробленою мінеральною композицією формули (I). На Фіг. 10В показано порівняння утворення рослинної біомаси (i) в ґрунті з рослинним покривом і із земляними черв'яками (лівий стовпчик) і (ii) в тому ж ґрунті, обробленою мінеральною композицією формули (I). Детальний опис винаходу Було показано, що додавання специфічної для ґрунту мінеральної композиції за винаходом призводить до значної зміни в профілі ферментативної активності ґрунту і підвищує її родючість. Конкретніше, було показано, що додавання специфічної для ґрунту мінеральній композиції за винаходом призводить до збільшення активності деяких ферментів, таких як фосфатаза, βксилозидаза, α-глюкозидаза і β-глюкозидаза, які відомі як критично важливі для родючості. Таким чином, даний винахід відноситься до застосування твердої мінеральної композиції, що має наступну формулу (I): від 4,58 % до - Карбонат кальцію 77,8 % від 3,85 % до - Доломіт 69,29 % - Хлорид натрію від 5,7 % до 12,4 % від 4,25 % до - Лігносульфат 8,49 % від 0,37 % до - Сульфат калію 2,44 % від 0,01 % до - Окис магнію 0,07 % від 0,009 % до - Елементарна сірка 0,066 % причому приведеним вище процентним вмістом є масовий відсоток кожної зі сполук від загальної маси сухої речовини мінеральної композиції для підвищення родючості ґрунту за рахунок збільшення принаймні одного виду ферментативної активності, наявного в ґрунті, вибраного з числа активності (i) лужної фосфатази, (ii) β-ксилозидази, (iii) α-глюкозидази і (iv) глюкозидази. Переважно вище тверда мінеральна композиція також включає комбінацію однієї або декількох додаткових сполук, вибраних з числа бікарбонату натрію, сульфату заліза, сульфату магнію, окису цинку, йодиду калію, сульфату міді і борної кислоти. Переважніше, вище одна або декілька додаткових сполук присутня в мінеральній композиції в наступних кількостях: - від 0,007 % до 0,158 % бікарбонату натрію - від 0,0009 % до 0,0434 % сульфату заліза - від 0,004 % до 0,040 % сульфату магнію - від 0,0006 % до 0,0040 % окису цинку - від 0,0004 % до 0,0032 % йодиду калію - від 0,0002 % до 0,0040 % сульфату міді, і - від 0,0006 % до 0,0040 % борної кислоти 3 UA 103629 C2 5 10 15 20 25 30 35 40 45 50 55 причому приведеним вище процентним вмістом є масовий відсоток кожної із сполук від загальної маси сухої речовини мінеральної композиції. Переважна мінеральна композиція для застосування по винаходу має наступний склад: - 45,78 % карбонату кальцію - 38,49 % доломіту - 9,52 % хлориду натрію - 5,66 % лігносульфату - 0,49 % сульфату калію - 0,014 окисів магнію - 0,015 % елементарної сірки і - відповідні кількості сполуки або поєднання принаймні двох сполук, вибраних з числа бікарбонату натрію, сульфату заліза, сульфату магнію, окису цинку, йодиду калію, сульфату міді і борної кислоти так, щоб мінеральна композиція містила 100 % компонентів за масою причому приведеним вище процентним вмістом є масовий відсоток кожної із сполук від загальної маси сухої речовини мінеральної композиції. Переважно для удобрення ґрунту мінеральну композицію формули (I) вносять в кількості 2 2 принаймні від 0,01 кг/м до 0,10 кг/м . Згідно ще одному аспекту даний винахід також відноситься до способу удобрення ґрунту, що включає принаймні один етап, під час якого мінеральну композицію формули (I) додають до 2 ґрунту в кількості принаймні від 0,02 до 0,04 кг/м . Як правило, мінеральну композицію формули (I), яка є твердою композицією, яка переважно має форму гранул, вносять до удобрюваного ґрунту простим розкиданням над оброблюваним ґрунтом. Фосфатаза, яка каталізує гідроліз фосфорно-ефірних зв'язків, викликає вивільнення неорганічного фосфату, який потім може бути використаний рослинами як метаболіт. Зазвичай вважається, що цей фермент грає важливу роль в метаболічних циклах фосфату і чинить вплив на зростання рослин. Таким чином, чим вище активність фосфатази ґрунту, зокрема, активність лужної фосфатази ґрунту, тим сильніше здатність такого ґрунту стимулювати зростання рослин, навіть якщо вміст неорганічного фосфату в ґрунті понижений. β-ксилозидаза, що бере участь в гідролізі ксилану (геміцелюлози), дозволяє забезпечити ґрунтову мікрофлору живильними речовинами, які, будучи мінералізованими, асимілюються рослиною. Дія β-ксилозидази відбувається на останніх етапах деградації ксилану, який є одним з основних компонентів стінки рослинних кліток і який виявляється в рослинних залишках, наявних в ґрунтах. Активність β-глюкозидази вважається індикатором якості ґрунтів. Активність β-глюкозидази, целюлози, що бере участь в гідролізі, важлива для родючості ґрунту, оскільки целюлоза є кількісно найбільш поширеною сполукою, присутньою в ґрунтах. β-глюкозидаза грає важливу роль в ґрунтах, оскільки цей фермент відповідає за гідроліз різних β-глюкозидів, присутніх в рослинних відходах, що розкладаються, які знаходяться в ґрунтах. Деградація целюлози вважається одним з основних процесів циклу вуглецю в ґрунті. Мікробна деградації целюлози в ґрунті є комплексним процесом, в якому беруть участь принаймні три типи ферментів, відповідно ендо-β-1,4-глюканази, екзо-β-1,4-глюканази і β-1,4-глюкозидази. Під дією β-1,4глюкозидази відбувається гідроліз продуктів деградації целюлози, таких як дисахарид (целобіоза) на молекули глюкози, які можуть безпосередньо асимілюватися мікроорганізмами ґрунту. Таким чином, деградація целюлози, що міститься в ґрунтах, може бути повною тільки у присутності активності β-глюкозидази. Активність β-глюкозидази вважається індикатором оновлення (обороту) рослинної біомаси. Діяльність α-глюкозидази гідролізує олігосахариди, що утворились в результаті деградації крохмалю, присутнього в рослинних залишках, що розкладаються, в ґрунті, при цьому утворюється D-глюкоза як кінцевий продукт, яка може безпосередньо асимілюватися мікроорганізмами ґрунту. Для цілей даного винаходу під "ґрунтом" конкретніше мають на увазі оброблюваний ґрунт або ґрунт пасовищ (лугів). Оброблювані ґрунти включають орні ґрунти, які використовуються у всіх галузях рослинництва, включаючи садівництво, лісоводство і виноградарство. Ґрунти пасовищ включають необроблювані ґрунти, які, зокрема, використовуються для забезпечення свіжого або висушеного рослинного матеріалу для годування тварин, конкретніше, для годування худоби. 4 UA 103629 C2 5 10 15 20 25 30 35 40 45 50 55 60 В цілому, ґрунти зазвичай включають поєднання мінеральних елементів і органічних елементів, що містять різні співвідношення піску, глин(и), мулу(ів), вапняку будь-якого розміру, гумусу, органічних залишків, мікроорганізмів, повітря і води. Для цілей даного винаходу під "ферментативною активністю" мають на увазі каталітичну активність перетворення даної сполуки субстрату в кінцевий продукт каталітичної реакції. Вимірювання ферментативної активності видів ферментів (i) фосфатаза, (ii) β-ксилозидаза, (iii) α-глюкозидаза і β-глюкозидаза може проводитися будь-яким відповідним способом, добре відомим фахівцеві в цій галузі. Переважно невеликий зразок ґрунту переводять в зважений стан у відповідному об'ємі дистильованої води для отримання первинного екстракту, який потім використовують для спеціальних ферментних аналізів. Ферментні аналізи можуть проводитися традиційним способом, інкубацією аліквоти первинного екстракту землі, що підлягає тестуванню, разом з субстратом ферментативної активності протягом певного періоду часу, потім, після зупинки ферментативної реакції, кількісним визначенням продукту каталітичної реакції, зазвичай за допомогою спектрофотометра. Для прикладу, можна застосовувати наступні субстрати: - для активності фосфатази: сіль 4-нітрофенил ди- або три-фосфат - для активності β-глюкозидази: 4- нітрофенілу β-D-глюкопіранозид - для активності β-ксилозидази: 4- нітрофенілу β-ксилозид, і - для активності α-глюкозидази: 4- нітрофенілу α-глюкозид. Для тестування активності N-ацетил-глюкозамінідази можна використовувати 4-нітрофенил N-ацетил-β-D-глюкозамінид. При застосуванні вищезазначених субстратів кількісний аналіз кінцевого продукту каталітичної реакції виконується спектрофотометрією з визначенням оптичної щільності (O.D.) при довжині хвилі 405 нанометрів. Було показано, що додавання мінеральної композиції формули (I) до ґрунту (i), що має рослинний покрив у відсутність земляних черв'яків, або до ґрунту (ii), що має рослинний покрив і земляних черв'яків, викликає значне підвищення активності лужної фосфатази. Так, було показано, що при додаванні мінеральної композиції формули (I) до описаного вище типу ґрунту (i) активність лужної фосфатази стає вдесятеро вищою в порівнянні з активністю лужної фосфатази, визначеної у типу ґрунту (i), позбавленого композиції формули (I). Стосовно описаного вище типу ґрунту (ii) активність лужної фосфатази зазвичай збільшується принаймні удвічі в порівнянні з активністю фосфатази, визначеної у типу ґрунту (ii), що має той же склад, але позбавленого мінеральної композиції формули (I). Було також показано, що додавання мінеральної композиції формули (I) до ґрунту (i), що має рослинний покрив у відсутність земляних черв'яків, до ґрунту (ii), що має рослинний покрив і земляних черв'яків, або до ґрунту (iii), що не має рослинного покриву, але що має земляних черв'яків, викликає значне підвищення активності β-ксилозидази. Так, було показано, що при додаванні мінеральної композиції формули (I) до типу ґрунту (i) активність β-ксилозидази стає принаймні в три рази вище в порівнянні з активністю β-ксилозидази, визначеної у типу ґрунту (i), позбавленого мінеральної композиції формули (I). Також було показано, що активність βксилозидази, визначена у типу ґрунту (ii) після додавання мінеральної композиції формули (I), принаймні удвічі вище за активність β-ксилозидази, визначеної у типу ґрунту (ii), позбавленого мінеральної композиції формули (I). У описаного вище типу ґрунту (iii) активність β-ксилозидази зазвичай збільшується принаймні в п'ять разів в порівнянні з активністю β-ксилозидази, визначеної у типу ґрунту (iii), позбавленого мінеральної композиції формули (I). Було також показано, що додавання мінеральної композиції формули (I) до ґрунту (i), що має рослинний покрив і що не має земляних черв'яків, до ґрунту (ii), що має рослинний покрив і земляних черв'яків, або до ґрунту (iii), що не має рослинного покриву, але що має земляних черв'яків, викликає значне підвищення активності α-глюкозидази, яка в чотири рази вища за активність α-глюкозидази, визначену у типі ґрунту (i), (ii), (iii), позбавленого мінеральної композиції формули (I). Було також показано, що додавання мінеральної композиції формули (I) до ґрунту (ii), що має рослинний покрив і земляних черв'яків, викликає значне підвищення активності βглюкозидази, яка принаймні в півтора рази вища за активність β-глюкозидази, визначену у типі ґрунту (ii), позбавленого мінеральної композиції формули (I). Стосовно Фіг. 2B, було показано, що композиція формули (I) робить статистично значущий вплив на підвищення визначеної вище ферментативної активності (i) - (iv) незалежно від типу оброблюваного ґрунту. 5 UA 103629 C2 5 10 15 20 25 30 35 40 45 50 55 60 Без прив'язки до якої б то не було теорії заявник вважає, що збільшення ферментативного потенціалу ґрунту в результаті додавання композиції формули (I) дозволяє поліпшити телурові процеси мінералізації органічних речовин. Як описано вище, мінеральна композиція формули (I) з позиції ферментативної активності головним чином викликає підвищення видів ферментативної активності, названих "малими", зважаючи на їх кількісне відношення до загальної ферментативної активності ґрунту, таких як активність β-ксилозидази, α-глюкозидази або лужної фосфатази. При цьому слід пам'ятати, що мінеральна композиція формули (I) також викликає підвищення видів ферментативної активності, названих "великими", зважаючи на їх кількісне відношення до загальної ферментативної активності ґрунту, таких як активність β-глюкозидази. Без прив'язки до будь-якої теорії заявник вважає, що мінеральна композиція формули (I) викликає "відновлення балансу" ферментативного профілю ґрунту підвищенням деяких видів ферментативної активності, не призводячи до одночасного значного зниження інших видів ферментативної активності. Крім того, результати, отримані за винаходом, показують, що вплив композиції формули (I) на ферментативну активність варіює залежно від типів ґрунту, до якого додавали склад, що доводить, що вплив цього складу на ферментативну активність залежить від якісного і/або кількісного складу живих організмів, зокрема організмів флори і фауни в оброблюваному ґрунті, включаючи мікроорганізми, конкретніше бактерійні і грибні мікроорганізми. Ці результати показують, що мінеральна композиція формули (I) надає стимулюючий ефект на біологічну активність ґрунтів. Як показано на прикладах, підвищення, що спостерігається для кожного з видів ферментативної активності (i) лужної фосфатази, (ii) β-ксилозидази, (iii) α-глюкозидази і (iv) βглюкозидази в типах ґрунту (i), (ii) і (iii) у присутності мінеральної композиції формули (I), не означає, що додавання композиції формули (I) викликає загальне підвищення ферментативної активності оброблених ґрунтів. Таким чином, показано, що загальна ферментативна активність ґрунту, обробленого мінеральною композицією формули (I), по суті ідентична загальній ферментативній активності того ж ґрунту, який не був оброблений мінеральною композицією формули (I). Загальну ферментативну активність ґрунту можна визначити кількісним аналізом неспецифічного деградації субстрату діацетату флуоресцеїну (FDA). Навпаки, підвищення родючості ґрунту, обробленого композицією формули (I), в результаті специфічного підвищення ферментативної активності (i) - (iv) ілюструється тим фактом, що додавання композиції формули (I) викликає збільшення утворення надземної і підземної рослинної біомаси принаймні в 1,5 рази в порівнянні з такою ідентичного ґрунту, який не був оброблений композицією формули (I). Таким чином, було показано, що додавання композиції формули (I) до ґрунту (i), що має рослинне покриття у відсутності земляних черв'яків, викликає збільшення утворення надземної і підземної рослинної біомаси принаймні в 1,5 разу в перерахунку на суху вагу рослинної біомаси після збору урожаю. Також було показано, що додавання композиції формули (I) до ґрунту (ii), що має рослинне покриття і що має земляних черв'яків, викликає збільшення утворення надземної і підземної рослинної біомаси принаймні удвічі в перерахунку на суху вагу біомаси після збору урожаю. В цілому, заявник спостерігав, що поліпшення якості ґрунтів, яке досягається додаванням мінеральній композиції формули (I), ілюструється збільшенням надземної і підземної рослинної біомаси при вирощуванні більшості рослин, так званих культур "для крупного сільськогосподарського виробництва" і овочевих культур, а також при лісоводстві та у виноградарстві. Крім того, на прикладах показано, що мінеральна композиція формули (I) також призводить до зміни профілю бактерійних популяцій, присутніх в ґрунті. Вивчення профілів бактерійних популяцій шляхом аналізу рибосомальної ДНК 16S методом ДГГЕ (денатуруючий градієнтний гель-електрофорез) виявило, що додавання композиції формули (I) незалежно від типу ґрунту, що вивчається, призводило (i) до збільшення відносної чисельності деяких бактерійних таксонів, яке виявлялася на електрофоретичному гелі збільшенням відносної щільності забарвлення однієї або декількох смуг міграції і (ii) до зменшення відносної чисельності інших бактерійних таксонів, яка виявлялася зниженням відносної щільності забарвлення однієї або декількох інших смуг міграції. Так, результати, приведені в прикладах, показують, що мінеральна композиція формули (I) викликає значні зміни, що виявляються, в співвідношеннях чисельності різних бактерійних таксонів в порівнянні з ґрунтами, які не були оброблені мінеральною композицією формули (I). Як показано на прикладах, при порівнянні профілів смуг міграції, відповідних фрагментам 16S рДНК, отриманих методом ДГГЕ, було показано, що мінеральна композиція формули (I) 6 UA 103629 C2 5 10 15 20 25 30 35 40 45 50 55 60 викликає найбільш помітні зміни в профілях бактерійних популяцій в ґрунтах, в яких є комплексні умови флори і фауни, конкретніше, в ґрунтах, що мають рослинний покрив і/або земляних черв'яків, при цьому вплив композиції формули (I) збільшується у міру посилення комплексності умов оброблюваного ґрунту. Було також проведено секвенування фрагментів 16S рДНК, відповідних деяким смугам, що переважали в ДГГЕ, які були виявлені, відповідно, в кожному з різних ґрунтів, що розрізняються по біологічній комплексності, не оброблених або оброблених мінеральною композицією формули (I). Потім на підставі даних про послідовність було визначено спорідненість філогенезу відповідних основних бактерій. Оскільки багато з телурових бактерій неможливо культивувати і, отже, неможливо ідентифікувати, порівняння наших послідовностей і опублікованих даних не завжди призводило до таксономічної ідентифікації. Проте результати показують, що в ґрунті (i), що має рослинний покрив без земляних черв'яків і в ґрунті (iii), що не має рослинного покриву, але що має земляних черв'яків, мінеральна композиція формули (I) сприяє переважанню бактерійних популяцій, споріднених бактеріям розділу TM7, які були виявлені в різосфері і в торф'яниках. Зазвичай з аналізу після секвенування 16S рДНК витікає, що додавання мінеральної композиції формули (I) викликає великі зміни у відносній чисельності бактерійних таксонів, сприяючи розвитку деяких з них і уповільнюючи розвиток інших, включаючи розвиток бактерійних таксонів, переважаючих в ідентичному ґрунті, але не обробленому композицією формули (I). У будь-якому випадку, мінеральна композиція формули (I) викликає зміни профілю бактерійних популяцій, масштаб яких зростає по мірі збільшення біологічної комплексності ґрунту. Для прикладу, можна спостерігати все більш масштабні зміни профілю бактерійних популяцій, викликаних композицією формули (I), при порівнянні ґрунту, що не має ніякого рослинного покриву і що не має земляних черв'яків з брунькою, що має рослинний покрив і земляних черв'яків. Так, результати прикладів показують, що дія мінеральної композиції формули (I) варіюється як кількісно, так і якісно залежно від типу пов'язаних з телуром умов, конкретніше, залежно від присутності або відсутності рослинного покриву, і/або залежно від присутності або відсутності земляних черв'яків. Зазвичай зміни профілю ферментативної активності і профілю бактерійних популяцій в результаті додавання мінеральної композиції формули (I) є індикаторами підвищення родючості ґрунту, яка виявляється збільшенням, спостережуваним в утворенні надземної і підземної рослинної біомаси. Крім того, даний винахід буде проілюстрований наступними прикладами. Відомості, підтверджуючі можливість здійснення винаходу A. Матеріали і методи A.1. Матеріали Ґрунт – це ґрунт сільськогосподарського використання, узятий в околицях Тарденуа (регіон Пікардія, Франція) порохняно-глинистого типу. Зразки ґрунту відбирали довільно. Після цього ґрунт висушували при температурі навколишнього середовища, а потім просівали через сито з розміром чарунок 2 мм. Рослиною, використаною для створення рослинного покриву ґрунту, є райграс, що відноситься до широко представлених у продажу видів. Можна використовувати райграс, що випускається в продаж компанією Jardiland (Лонь, Франція). Земляними черв'яками, використаними в цих експериментах, були глибоко проникаючі в землю черв'яки, що відносяться до виду Nicodrilus giardi (також званому Allolobophora terrestris або Aporrectodea terrestris). Мінеральну композицію формули (I) додавали в кількості, відповідній 200 кг/га в кожен експериментальний зразок землі за винятком контрольних зразків. A.2. Приготування контрольних зразків землі і експериментальних зразків Зразками були пластикові контейнери, кожен з яких містив 1 кг сухої землі. Землю зволожували до її польової вологоємкості. У певні контейнери додавали черв'яків з розрахунку 6 г біомаси/ кг сухої землі. Для посіву в певних контейнерах використовували один грам насіння райграсу. Черв'яків поміщали в контейнери, коли паростки райграсу досягали висоти близько 5 см. Дослід був закладений в трьох повторностях (або серіях), кожна з яких відповідала 8 варіантам, тобто загальна кількість зразків складала 24. Зразки знаходилися при температурі навколишнього середовища (від 20 до 23 °C) протягом 1,5 місяців. Після цього періоду райграс (надземну і підземну кореневу частині) збирали і потім поміщали в сушильну шафу для визначення його сухої ваги. З кожного контейнера відбирали дві партії зразків для проведення біохімічного і молекулярного аналізу. 7 UA 103629 C2 5 10 15 20 25 30 35 40 45 50 55 60 A.3. Ферментні аналізи Один грам ґрунту суспендували в 5 мл дистильованої води при 4 °C. Ця суспензія була первинним екстрактом для ферментних кількісних аналізів. 1. Кількісний аналіз гетерозидаз (PNP) Приготування реактивів: - Na2CO3: 2 г розчиняли в 100 мл дистильованої води. - Ферментний субстрат: 80 міліграм субстрату розчиняли в 10 мл дистильованої води. - Сіль 4-нітрофеніл ди(три) фосфат (PNP-фосфат). Цей субстрат дозволяє визначати активність ферментів фосфатаз, що беруть участь в мінералізації органічного фосфату. - 4-нітрофеніл – β -D-глюкопіранозид (PNP- β -глюкозид). Гідроліз цього субстрату дозволяє кількісно визначити активність β -глюкозидази, що бере участь в останніх етапах деградації целюлози. - 4-нитрофенил N-ацетил- β -D-глюкозамінид (PNP-N-ацетил- β -D-глюкозамінид). Хітин є субстратом, широко поширеним в ґрунтах, він походить з кутикул членистоногих і входить до складу мембран більшості грибів. Деградація цього субстрату хітиназами і N-ацетилглюкозамінидазою є етапом, що передує вивільненню аміноцукрів, що одночасно беруть участь в циклах вуглецю і азоту. - 4-нітрофеніл β -ксилозид (PNP- β -D-ксилозид) був гідролізований β -ксилозидазою, що бере участь в останніх етапах деградації ксилану, одного з основних компонентів рослинної клітинної стінки. - 4-нитрофенил α-глюкозид (PNP-α-D-глюкозид). α-глюкозидаза, яка гідролізує цей субстрат, є одним з ферментів, що беруть участь в деградації крохмалю. Розчини зберігали при 4 °C в пляшечках з темного скла. - Фосфатний буфер pH 5: 24,3 мл лимонної кислоти 0,1M додавали до 25,7 мл Na2HPO4, 12H2O (0,2 M). - Боратний буфер pH 9: 10 мл HCl 0,1 M додавали до 90 мл борату натрію 0,1 M Буферні розчини зберігали при 4 °C Аналіз на мікропланшетах: Аналізи проводили в мікропланшетах. Для кожного ферменту (кисла фосфатаза, лужна фосфатаза, β -глюкозидаза α -глюкозидаза та β -ксилозидаза) готували одну холосту пробу, три контрольні субстрати, три контрольні ферменти і три проби для аналізу. - Холоста проба: - 100 мкл дистильованої води - 25 мкл буфера Мак-Ільвена pH 5 або 9 залежно від аналізованого ферменту. - Контрольний субстрат: - 50 мкл дистильованої води - 25 мкл фосфатного буфера pH 5 або боратного буфера pH 9 для лужної фосфатази - 50 мкл субстрату PNP - Контрольний фермент: - 50 мкл дистильованої води - 25 мкл буфера Мак-Ільвена pH 5 або 9 - 50 мкл розчину ферменту (земля) - Проба для аналізу - 50 мкл субстрату PNP - 25 мкл буфера Мак-Ільвена pH 5 або 9 - 50 мкл розчину ферменту (земля) Аналіз проводили в мікропланшеті з конічним дном. Планшет інкубували протягом 2 годин в шафі при 37 °C при перемішуванні. Після інкубації в кожну лунку додавали 75 мкл 2 % Na2CO3. Потім мікропланшет центрифугували при 2500 об/хв. протягом 10 хв. З кожної лунки 50 мкл надосадової рідини переносили в лунки іншого планшета, в які заздалегідь додавали 250 мкл 2 % Na2CO3. Після перемішування проводили аналіз спектрофотометрії при 405 нм в порівнянні з холостою пробою. На базі стандартного ряду, який був складений заздалегідь, відношення між оптичною щільністю (OD) і кількістю фенолу задавалося наступною формулою: X (мкг фенолу) = розр. OD x 1,14 Де розр. OD=OD проби для аналізу – (OD контр. субстрату + OD контр. ферменту). Ферментативну активність визначали по кількості фенолу, що вивільнявся /г ґрунту/год. 2. Аналіз мікробної активності за допомогою FDA (діацетату флуоресцеїну) Приготування реактивів - FDA: з 0,3 г FDA, розчиненого в 10 мл ацетону, готували аліквоти в скляних пляшечках по 1 мл в пляшечці. Цей розчин, який зберігали при -20 °C, був початковим розчином. Перед використанням початковий розчин розводили в співвідношенні 1:10. - Фосфатний буфер pH 7: 6,5 мл лимонної кислоти 0,1 M+43,6 мл Na2HPO4, 12H2O (0,2 M). 8 UA 103629 C2 5 10 15 20 25 30 35 40 45 50 55 Аналіз на мікропланшетах: Аналізи проводили в мікропланшетах. Для кожного аналізу готували одну холосту пробу, три контрольні субстрати, три контрольні ферменти і три проби для аналізу. - Холоста проба: - 150 мкл H2O - 50 мкл фосфатного буфера pH 7 - Контрольний фермент: - 50 мкл H2O - 50 мкл буфера Мак-Ільвена pH 7 - 50 мкл розчину ґрунту - Контрольний субстрат: - 100 мкл H2O - 50 мкл фосфатного буфера pH 7 - 50 мкл FDA (розведений розчин) - Проба для аналізу - 100 мкл розчину ґрунту - 50 мкл буфера Мак-Ільвена pH 7 - 50 мкл FDA Мікропланшет інкубували при 37 °C на 2 години, після чого центрифугували протягом 10 хвилин при 2500 об/хв. З кожної лунки 100 мкл надосадкової рідини переносили в лунки другого планшета з круглим дном, в яких заздалегідь додавали 100 мкл крижаного буфера Мак-Ільвена pH 7 (4 °C) і проводили аналіз спектрофотометрії при 490 нм в порівнянні з холостою пробою. Для FDA ферментативну активність виражали в кількості флуоресцеїну /г ґрунту /час. Визначення стандартного ряду дало можливість встановити співвідношення між оптичною щільністю (OD) і кількістю флуоресцеїну (мкг) у вигляді наступної формули: X (мкг флуоресцеїну) = розр. OD * 0,086 3. Молекулярні аналізи Для секвенування генів 16S рибосомальної ДНК, специфічної для переважаючих і/або представляючих інтерес бактерійних популяцій в різних зразках ґрунту, ДНК екстрагували із зразків ґрунту і зберігали в спирті. 3.1. Екстрагування ДНК з ґрунту Спосіб, вибраний для екстрагування ДНК з ґрунту, заснований на застосуванні буфера ЦТАБ (CTAB) (Цетил-триметил-амоній бромід). У пробірки, що містять керамічні, кварцеві і скляні кульки (Lysing Matrix E, MP Biomedicals) і 1000 мкл екстрагуючого буфера ЦТАБ (CTAB) додавали 500 міліграм кожного з 24 зразків ґрунту (8 варіантів: S, S+P, S+M, S+V, S+V+P, S+P+M, S+V+M, S+V+M+P x 3 повторність). Лізис кліток проводили за допомогою гомогенізатора типу FastPrep-24 (MP Biomedicals) протягом 45 сек. при 6,5 м/с. Потім зразки інкубували на водяній лазні при 65 °C протягом 1 години. Екстрагування і очищення нуклеїнових кислот проводили сумішшю фенол/хлороформ/ізоаміловий спирт (24:24:1) і хлороформ/ізоаміловий спирт (24:1) у поєднанні з трубками для висновку фази гелю (VWR). Потім ДНК облягали за допомогою ПЕГ, осад промивали 70 % етанолом і додавали 50 млк буфера EB (трис HCl). ДНК, екстраговану в 3 повторностях, об'єднували для кожного з 8 зразків з метою отримання ДНК в кількості, достатній для подальших реакцій. Потім проводили кількісний аналіз ДНК і оцінювали її чистоту (відсутність гумінової кислоти, протеїнів) за допомогою спектрофотометра (Nanodrop). 3.2. ПЦР ампліфікація фрагментів бактерійної 16S рДНК Полімеразні ланцюгові реакції проводили з використанням термоциклера типу TC-3000 (Techne) з універсальними бактерійними праймерами. Для кожної реакції використовували 0,25 мікромоль кожного праймера, 10 мкл ПЦР буфера 10X, 1,5 мілімоля MgCl 2, 0,2 мілімоля дНТФ (дезоксинуклеотидтрифосфатів), 6Од ДНК полімерази Taq (Invitrogen), 15-80 нг матриці ДНК, і воду до об'єму 100 мкл. Праймерами, використаними для ПЦР, були 518r (5’-ATT ACC GCG GCT GCT GG-3" - послідовність № 1) і GC-338f (5’-CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG GAC TCC TAC GGG AGG CAG CAG-3" – послідовність № 2); вони точно ампліфікували варіабельну область V3 16S рибосомальної ДНК, що збереглася у бактерій (близько 200 pb). Послідовність, багата GC (GC-шпилька), приєднана до 5" кінця праймера GC-338f, перешкоджала повній денатурації подвійного ланцюжка ДНК під час розділення фрагментів ПЦР за допомогою ДГГЕ. ПЦР-ампліфікацію проводили з первинної денатурації при 94 °C протягом 5 хвилин, після чого виконували 32 цикли: 1) денатурація при 94 °C протягом 30 с., 2) гібридизація при 54 °C протягом 45 с. і 3) подовження при 72 °C протягом 1 хв.30. Ампліфікацію закінчували завершуючим подовженням при 72 °C протягом 20 хв. 3.3. Візуалізація і кількісний аналіз продуктів ПЦР 9 UA 103629 C2 5 10 15 20 25 30 35 40 45 50 55 Продукти ПЦР розділяли в 2 % агарозному гелі і забарвлювали SYBR Safe (Invitrogen) в концентрації 1X. Візуалізацію фрагментів ПЦР проводили з допомогою УФ, а кількісний аналіз за допомогою кількісного маркера розміру типу SmartLadder (Eurogentec). 3.4. ДГГЕ Аналіз методом ДГГЕ (денатуруючим градієнтним гель-електрофорезом) був проведений на Універсальній системі виявлення мутацій DCode (Bio-Rad). Зразки продуктів ПЦР (100 мкл, тобто близько 500 нг) розділяли в 8 % поліакриламідному гелі в TAE 0,5X (Тріс-оцтова кислота– ЕДТА). Для отримання поліакриламідного гелю з лінійним денатуруючим градієнтом 30-70 % змішували 11,2 мл розчину 0 % (акриламід 20 мл, TAE 50 × 2 мл і H2O до 100 мл) і 4,8 мл розчину 100 % (акриламід 20 мл, TAE 50 × 2 мл, формамід 40 мл, сечовина 42 г і H 2O до 100 мл) для отримання розчину низької концентрації (30 %). Аналогічно змішували 4,8 мл розчину 0 % і 11,2 мл розчину 100 % для отримання розчину високої концентрації (70 %). Електрофорез проводили при 60 °C протягом 16 години при 75 В. По закінченні електрофорезу гель поміщали в етидіум броміду і фотографували в УФ. Смуги, що представляють інтерес, вирізали. 3.5. Секвенування смуг, що представляють інтерес ДНК, що міститься в смугах, елююювали індивідуально, в 50 мкл надчистої води протягом ночі при 4 °C. Для ре-ампліфікації смуг в індивідуальному порядку за допомогою ПЦР відповідно до описаної вище процедури використовували 2 мкл елюату. Для перевірки присутності єдиної смуги в кожному з продуктів ПЦР, продукти ПЦР розділяли в гелі для ДГГЕ (градієнт 30-50 %) поряд з початковим зразком. Процедуру повторювали до отримання однієї смуги у кожного продукту ПЦР. Чисті продукти ПЦР секвенували (Gexbyweb, Genome Express). A.4. Статистичний аналіз профілів міграції смуг при ДГГЕ 1. Графічний і статистичний аналіз профілів Отримували фотографію гелю і аналізували за допомогою програмного забезпечення Quantity One software v4.6.5 (Biorad), яке дозволяло автоматично виявляти смуги на профілі ДГГЕ. Бінарну матрицю, що представляє смуги профілю, складали таким чином: присутність смуги кодувалася "1", її відсутність кодувалася "0", стосовно смуг, які можна було виявити у всіх зразках того ж гелю. На підставі цієї бінарної матриці була складена матриця відстаней із застосуванням коефіцієнта схожості. При цьому був використаний коефіцієнт Дайса (SDice=2NAB / (NA+NB), де NA и NB відповідно, представляли число смуг в зразках A і B, а NAB - число загальних смуг). Потім був проведений аналіз матриці відстаней методом угрупування UPGMA (незважене попарне угрупування з математичним усереднюванням) і методом найближчого скріплення, що дозволило побудувати на цій підставі дендрограмму, що графічно описує відстані між всіма різними зразками. 2. Молекулярний і філогенез аналіз послідовностей Хроматограми послідовностей були отримані і візуалізовані за допомогою програмного забезпечення Chromas LITE, версія 2.01, що також дозволяє проводити коректування послідовностей вручну. Послідовності порівнювали зі всіма послідовностями, наявними в банках даних Національного центру біотехнологічної інформації, за допомогою аналізу BLAST (програма для виявлення схожості послідовностей білків шляхом їх локального вирівнювання), який встановлював спорідненість послідовностей з найбільшим показником ідентичності з досліджуваними послідовностями. Додатковий аналіз таксономічного віднесення був проведений за допомогою Ribosomal Database Project II Classifier (класифікатора II проекту баз даних рибосомальних ДНК). Потім отримані послідовності були вирівняні з 47 репрезентативними послідовностями бактерій розділу TM7, 2 послідовностями TM6, 2 послідовностями групи I Termite і 2 послідовностями зелених несірчистих бактерій, доступними з баз даних Національного центру біотехнологічної інформації, з використанням програмного забезпечення CLUSTALW. Вирівнювання (140 pb) коректували уручну за допомогою програми SEAVIEW. У результаті було побудовано дерево по методу найближчого скріплення за допомогою програмного забезпечення MEGA4 з 1000 повторностями автоматичного введення. B. Результати Приклад 1: Вплив композиції формули (I) на ферментативну активність ґрунту Сукупність результатів вимірювань ферментативної активності приведена на Фіг. 1, відповідно по: загальній ферментативній активності (Фіг. 1A), активності кислої фосфатази (Фіг. 1B), активності лужної фосфатази (Фіг. 1C), активності β-глюкозидази (Фіг. 1D), активності βксилозидази (Фіг. 1E), активності α-глюкозидази (Фіг. 1F) і активності N-ацетил-глюкозамінідази (Фіг. 1G). 1. A/ У присутності ґрунту 10 UA 103629 C2 5 10 15 20 25 30 35 40 45 50 55 60 Незалежно від досліджуваного ферменту не було виявлено істотного збільшення в ґрунтах без рослинного покриву і без земляних черв'яків, оброблених і не оброблених мінеральною композицією формули (I). Аналогічно, не було виявлено негативного впливу. 1. B/ У присутності ґрунту і райграсу На деградацію FDA (діацетату флуоресцеїну) не зробила впливу присутність мінеральної композиції формули (I). Активність кислої фосфатази, β-глюкозидази і N-ацетил-глюкозамінідази у присутності мінеральної композиції формули (I) була вище за активність, зміряну в контролі. Проте унаслідок варіабельності спостережувані відмінності були неістотними з ризиком α 5 %. Навпаки, активність лужної фосфатази, β-ксилозидази і α-глюкозидази істотно зросла, при цьому коефіцієнт збільшення склав 10, 4 і 4, відповідно. Ці результати показують, що у присутності рослинного покриву: 1) має місце вплив мінеральної композиції формули (I) на ферментативну активність ґрунту 2) цей вплив наголошується стосовно ферментів, активність яких менше по інтенсивності. 1. C/ У присутності ґрунту і земляних черв'яків При додаванні мінеральної композиції формули (I) до ґрунту у присутності земляних черв'яків (lumbricus) було відмічено значне підвищення активності двох ферментів. Цими ферментами є β-ксилозидаза, активність якої зросла в 6 разів, і α-глюкозидаза, яка з рівня -1 1 активності в 25 в контролі переходить до 112 Од.на г сухого ґрунту сек год.- . Активність інших досліджених ферментів не змінилася. 1. D/ У присутності земляних черв'яків і райграсу У присутності земляних черв'яків і райграсу мінеральна композиція формули (I) дозволяє збільшити активність лужної фосфатази в 3 рази, активність β-глюкозидази – в 1,5 разу, активність β-ксилозидази – в 2,5 разу і активність α-глюкозидази в 4 рази. 1. E/ Аналіз основних компонентів Мета цього аналізу полягає в статистичному підтвердженні присутності впливу мінеральної композиції формули (I) на ферментативну активність ґрунту залежно від різних досліджених варіантів (присутність рослин і/або земляних черв'яків …). Круг кореляції, представлений на Фіг. 2A, показує, що вісь 1 представляє 35 % всіх відхилень, виявлених стосовно активності лужної фосфатази, α-глюкозидази β-ксилозидази і стосовно деградації FDA. Вісь 2, відповідна 21 % відхилення, у свою чергу, визначається активністю кислої фосфатази, N- ацетил-глюкозамінідази і β-глюкозидази. Як зображено на Фіг. 2B, проекція об'єктів на обох осях показує явне протистояння між обробками мінеральною композицією формули (I) і різними варіантами контролю. Отже, дійсно має місце вплив композиції формули (I) на ферментний профіль дослідженого ґрунту. Результати вимірювань ферментативної активності, представлені на Фіг. 1A, -1G, детальніше описані в таблиці 1 в кінці даного опису. У таблиці 1: - "S" позначає ґрунт без рослинного покриву і без земляних черв'яків, - "S+M" позначає ґрунт "S", оброблений мінеральною композицією формули (I), - "S+V" позначає ґрунт без рослинного покриву, але із земляними черв'яками, - "S+V+M" позначає ґрунт "S+V", оброблений мінеральною композицією формули (I), - "S+P" позначає ґрунт з рослинним покривом, але без земляних черв'яків, - "S+P+M" позначає ґрунт "S+P", оброблений мінеральною композицією формули (I), - "S+V+P" позначає ґрунт з рослинним покривом і із земляними черв'яками, і - "S+V+P+M" позначає ґрунт "S+V+P", оброблений мінеральною композицією формули (I). Це дослідження дозволило експериментально показати, що додавання мінеральної композиції формули (I) дає можливість значно збільшити утворення рослинної біомаси. Було також показано, що додавання мінеральної композиції формули (I), ґрунту, що дозволяє підвищити ферментний потенціал, для оптимізації процесу мінералізації органічної речовини, також отримало підтвердження, про що свідчить аналіз основних компонентів. При цьому отримані результати показують, що позитивний ефект мінеральної композиції формули (I) залежить від 1) даного ферменту. Так, два основні види активності, тобто активність кислої фосфатази і β-глюкозидази, які характерні для цього ґрунту, не відносяться до ферментів, на які більшою мірою впливає мінеральна композиція формули (I). Дійсно, такий сприятливий ефект наголошується стосовно "другорядних" ферментів (другорядні не у зв'язку з їх роллю в продуктивності ґрунту, а у зв'язку з рівнем їх активності), таким як β-ксилозидаза, α-глюкозидаза або лужна фосфатаза. Це означає, що мінеральна композиція формули (I) дозволяє "відновити баланс" ферментного профілю ґрунтів, не викликаючи якого-небудь зниження інших видів активності 11 UA 103629 C2 5 10 15 20 25 30 35 40 45 50 55 60 2) наявних варіантів. Дійсно, залежно від досліджуваного варіанту (присутність або відсутність райграсу /земляних черв'яків) отримані результати розрізняються. Отже, вплив мінеральної композиції формули (I) залежить від живих організмів (рослин /тварин). Цей результат переконливо указує на те, що мінеральна композиція формули (I) діє як каталізатор, стимулюючий деякі види біологічної активності ґрунту. Виявлення змін у ферментних профілях ґрунту, конкретніше, в циклах деградації сахаридів агрополімерів у зв'язку з мінеральною композицією формули (I) піднімає питання про те, чи обумовлена така зміна зміною мікробних співтовариств. Це є метою описаного нижче прикладу 2. Приклад 2: Вплив мінеральної композиції формули (I) на бактерійні популяції ґрунту Провели порівняння результатів ДГГЕ аналізу ампліфікованих за допомогою ПЦР фрагментів гена 16S рРНК, отриманих для 8 зразків, з метою візуалізації змін генетичної різноманітності бактерійних співтовариств після різних обробок. Візуальний огляд профілів ДГГЕ виявив, що ряд бактерійних популяцій не були істотно змінені в результаті обробок ґрунту. Навпаки, переважаючі мікробні популяції, мабуть, не завжди однакові залежно від обробки ґрунту. A/ Вплив мінерального розчину PRP у присутності одного ґрунту Результати представлені на Фіг. 3. Додавання мінеральної композиції формули (I) викликає зміни в структурі бактерійних співтовариств в порівнянні з варіантом одного ґрунту (профіль S). Популяції, переважаючі у варіанті одного ґрунту (відмічено червоним), більше не є переважаючими в ґрунті з додаванням композиції (I) (смуги зникають або стають світлішими). Проте зникнення /зниження інтенсивності смуг не завжди слід тлумачити як зникнення відповідних таксонів. Дійсно, це може тільки відображати зміну відносній щільності серед популяцій, при якій збільшення деяких популяцій може привести до того, що інші виявляться нижчими за поріг виявлення методом ДГГЕ. У ґрунті, до якого була додана композиція (I), переважаючою представлялася якась бактерійна популяція (помічено зеленим), хоча вона вже була присутня у варіанті з одним ґрунтом. Це може свідчити або про розвиток цієї популяції у присутності композиції (I), або про регуляцію популяцій, які переважали у варіанті з одним ґрунтом. Ця остання гіпотеза, можливо, отримає підтвердження тим фактом, що профіль є одноріднішим в плані інтенсивності смуг у зразка ґрунту, обробленого композицією (I), яка, мабуть, діє як модулятор. B/ Вплив мінерального складу PRP у присутності райграсу Результати представлені на Фіг.4. У присутності райграсу (профіль S+P) структура бактерійних співтовариств значно змінюється в порівнянні з варіантом з одним ґрунтом. У числі переважаючих популяцій можна спостерігати одну популяцію, значно переважаючу (смуга 9), яка не визначалася у варіанті з одним ґрунтом. При додаванні композиції (I) у присутності райграсу ці переважаючі популяції більше не спостерігаються. Смуга E, яка є найінтенсивнішою в цьому профілі, відповідає популяції, яка могла виявитися активізованою у присутності композиції (I), або яка стала переважаючою в результаті регуляції тих популяцій, які переважали в присутності тільки райграсу. В цьому випадку також очевидне те, що композиція (I) виступає в ролі модулятора для бактерійних співтовариств, присутніх в ґрунті. C/ Вплив мінерального складу PRP у присутності земляних черв'яків Результати представлені на Фіг. 5. У присутності земляних черв'яків (профіль S+V) мабуть також відбувається зміна структури бактерійних співтовариств ґрунту. Не дивлячись на те, що значна кількість смуг є загальними, відносна частка популяцій значно змінюється. Конкретніше, слід зазначити присутність трьох переважаючих популяцій у присутності земляних черв'яків (смуги 1, 4 і 7). Додавання композиції (I) у присутності черв'яків приводить до абсолютно іншій структурі співтовариств. Якщо виявляються популяції, загальні з популяціями профілю S+V, їх відносна частка представляється зміненою. Так, популяції, відповідні смугам A і 6, переважають у меншій мірі і, навпаки, популяція, відповідна смузі 3, починає переважати у присутності композиції (I). Ця смуга 3 не відповідає смузі C, виявленій на профілі S+V (див. послідовності). Хоча існують інтенсивні смуги і, отже, переважаючі групи, у всій сукупності профілю у присутності композиції (I) можна констатувати, що вплив PRP виявляється в більш вираженій різноманітності мікробних популяцій при щодо рівномірної щільності. В цьому випадку також можна спостерігати модулюючий вплив композиції (I), навіть у присутності земляних черв'яків. D/ Вплив мінерального складу PRP у присутності райграсу і земляних черв'яків Результати представлені на Фіг. 6. 12 UA 103629 C2 5 10 15 20 25 30 35 40 45 50 55 60 Поєднання райграсу і черв'яків (профіль S+V+P) надає значний вплив на бактерійні спільноти в порівнянні з варіантом з одним ґрунтом (профіль S). Популяції, відповідні смугам D і 8, стають переважаючими. Інша переважаюча популяція в поєднанні черв'яки/райграс відповідає смузі 8. Додавання композиції (I) у присутності райграсу і черв'яків сильно змінює бактерійні спільноти. Популяції, відповідні смугам D і 8, більше не є переважаючими, а інша популяція (відмічено зеленим, послідовність не отримували), мабуть, виявляється безпосередньо активованою композицією (I) або отримує переваги в результаті регуляції, що надається на інші популяції. В цьому випадку модулюючий вплив композиції (I), що спостерігається для інших варіантів досвіду, менш виражений. Приклад 3: Специфіка впливу мінеральної композиції формули (I) на переважаючі бактерійні популяції Аналіз схожості в різних варіантах обробки проводили з урахуванням одночасної присутності смуг (отже, присутність бактерійних співтовариств) і їх інтенсивності (Фіг. 7). Цей аналіз міг включати два варіанти обстановки: 1) вплив композиції (I) слабо виражений. В цьому випадку бактерійний профіль ґрунту без композиції (I) повинен мати значну схожість з бактерійним профілем того ж ґрунту, обробленою композицією (I). В цьому випадку на дендрограмі схожість, зображеній на Фіг. 7, ці два варіанти виявляються об'єднаними або розташованими недалеко один від одного. 2) вплив композиції (I) дуже значний, тоді в цьому випадку бактерійні профілі ґрунтів, оброблених композицією (I), повинні мати низький коефіцієнт схожості з бактерійними профілями тих же ґрунтів, що не пройшли обробку. В цьому випадку на дендрограмі схожість їх відповідні позиції знаходяться на відносному видаленні один від одного. Аналіз, графічно представлений на Фіг. 7, показує, що ґрунт (S) і варіант з одним ґрунтом, обробленим композицією (I) (S+M), присутні на рівні одного кластера. Це означає, що внесення композиції (I) до ґрунту без черв'яків і без рослин робить відносно помірний вплив в порівнянні з іншими дослідженими варіантами обробки. Навпаки, вплив композиції (I) явно виражений стосовно ґрунту у присутності земляних черв'яків і райграсу (S+V+P+M), оскільки цей варіант обробки сильно відрізняється від сукупності інших варіантів обробки, особливо від варіанту, що включає черв'яків /рослини без композиції (I) (S+V+P). Це також спостерігалося у ґрунту з райграсом (S+P), оскільки цей варіант відносно віддалений від ґрунту з райграсом і композицією (I) (S+P+M). Стосовно ґрунту із земляними черв'яками (S+V) порівняно з ґрунтом із земляними черв'яками і композицією (I) (S+V+M) вплив також поза сумнівом, хоча і менш виражено. Приклад 4: Ідентифікуючий аналіз секвенуванням фрагментів 16S рДНК, відповідних переважаючим популяціям бактерій A/ Для секвенування використовували гель ДГГЕ Гель ДГГЕ, представлений на Фіг. 8, має різні смуги, які були зібрані, очищені і потім секвеновані. Ці смуги були вибрані унаслідок їх щодо високої інтенсивності в профілі. Слід зазначити, що деякі переважаючі смуги стало неможливо секвенувати у зв'язку з дуже великими труднощами з їх очищенням. B / Порівняння послідовностей з лунок у ґрунту (S) / ґрунт + PRP (S+M) У ґрунті, до якого була додана композиція (I) (S+M), одна бактерійна популяція є помітно переважаючою (смуга 15). Аналіз BLAST прирівнює послідовність цієї групи до послідовності бактеріального таксона, який неможливо культивувати, а значить, він морфологічно не ідентифікується (номер доступу в Genbank: EF 157158, ідентичність: 97 %). Згідно класифікаторові RDPII (який доступний в інтернеті за наступною адресою: "http://rdp.cme.msu.edu/classifier/classifier") така популяція може бути спорідненою розділу бактерій TM7 з відсотком віднесення 91 %. Цей розділ, який був нещодавно описаний, включає членів, широко поширених в навколишньому середовищі. Так, в ґрунті бактерії розділу TM7 були виявлені в різосфері і в торф'яниках. C/ Порівняння послідовностей з лунок у ґрунті + райграс (S+P)/ ґрунт + райграс + PRP (S+P+M) Секвенування 16S рДНК смуги 9 не дозволило ідентифікувати цю популяцію, значно переважаючу в ґрунті з райграсом. Дійсно, найближча послідовність згідно аналізу BLAST (номер доступу в Genbank EU134275, ідентичність 99 %) відповідає неідентифікованому бактерійному клону, що походить з ґрунту пасовищ (див. таблицю 2 нижче). При додаванні композиції (I) у присутності райграсу смуга E здається найбільш інтенсивною. Секвенування 16S рДНК указує на те, що найближча послідовність відповідає номеру доступу EU283406 (ідентичність 98 %, популяція походить з активованого мула) (див. таблицю 2 в кінці 13 UA 103629 C2 5 10 15 20 25 30 35 40 даного опису). Згідно класифікаторові RDPII така популяція може бути спорідненою розділу бактерій TM7 з відсотком віднесення 97 %. D/ Порівняння послідовностей з лунок у ґрунті + черв'яки (S+V)/ ґрунт + черв'яки + PRP (S+V+M) Стосовно ґрунту з черв'яками (S+V) молекулярний аналіз і таксономічне віднесення показують, що три популяції (смуги 1, 4, 7) споріднено розділу бактерій TM7 (відповідні найбільш близькі послідовності: AN EU283406, ідентичність 98 %; AN AJ232811, ідентичність 99 % і AN AF269024, ідентичність 99 %) (таблиця 2). Аналіз (Фіг. 2) філогенезу підтверджує таку класифікацію. Не дивлячись на спорідненість з послідовністю DQ 828869 (ідентичність 98 %), що походить з оброблюваного ґрунту, популяцію C до теперішнього часу не вдалося пов'язати з якою б то не було ідентифікованою групою бактерій. У присутності черв'яків + композиція (I) (S+V+M) були виявлені популяції, загальні з профілем S+V, але їх співвідношення міняється. Дійсно, наприклад, популяція, відповідна смузі A (та ж 1, розділ TM7), переважає у меншій мірі у присутності мінеральної композиції PRP. З іншого боку, тоді як популяції, відповідні смугам 1, 4 і 7, значно переважали в профілі S+E, переважаючими популяціями в профілі (S+E+M) є ті, які відповідають смугам 6 (найближча послідовність: AN AF269024, 99 %, розділ TM7) і 3 (найближча послідовність: AN AY820689, ідентичність 99 %, розділ TM7). E/ Порівняння послідовностей з лунок у ґрунті + черв'яки + райграс (S+V+P)/ ґрунт + черв'яки + райграс +PRP (S+V+P+M) Цікаво відзначити, що в зразку S+V+P популяція, відповідна смузі D (переважаючою в профілі S+V+P), є тією ж (або дуже близькою), що і популяції в смугах E (переважаючою в профілі S+P+M), 1 (переважаючою в профілі S+V) і A (переважаючою в профілі S+V+M), тобто бактерії споріднені розділу TM7. Іншу переважаючу популяцію в поєднанні черв'яки/райграс (S+V+P), відповідну смузі 8, не вдалося молекулярно ідентифікувати. Найближчою послідовністю, виявленою аналізом BLAST, дійсно є неідентифікований бактерійний клон, що походить з ґрунтів, пов'язаних з осиками (AN EF020305. ідентичність 97 %), і таксономічне віднесення RDPII не дозволяє пов'язати цю послідовність ні з яким розділом. У зразку з мінеральним складом PRP (S+V+P+M) популяції, відповідні смугам D і 8, більше не є переважаючими, і інша популяція (найінтенсивніша смуга), ДНК якої не вдалося очистити, мабуть, виявляється безпосередньо активованою мінеральним розчином PRP або отримує переваги в результаті регуляції, що надається на інші популяції. Результати аналізів методами молекулярної біології, приведені в прикладах, безперечно показують, що ці зміни ферментативній активності пов'язані із змінами, що відбуваються в мікробних спільнотах. Таким чином, це підтверджує, що мінеральна композиція формули (I) володіє біологічною дією. Проте це біологічна дія залежить від організмів, таких як рослини і черв'яки, які відомі впливом телурової мікрофлори через сфери активності, які вони створюють (ризосфера і дрилосфера). Отже, зміни в мікробних спільнотах є результатом подвійного процесу, (i) дії мінеральної композиції формули (I), з одного боку, і (ii) процесу деяких організмів, з іншого боку. Приклад 5: Вплив мінеральної композиції формули (I) на утворення рослинної біомаси. Результати представлені на Фіг. 10A і 10B. Продукція райграсу у присутності мінеральної композиції формули (I) дозволяє збільшити більш ніж удвічі суху вагу біомаси. У присутності земляних черв'яків відмічається та ж тенденція. 45 Таблиця 1 Узагальнення результатів S 0 542,49± ±185,17 102,48± ±23,87 42,61± a-глюкозидаза ±39,62 β454,21± глюкозидаза ±106,98 Біомаса Кисла фосфатаза Лужна фосфатаза S+M 0 407,78± ±98.88 110,47± ±15.89 103,75± ±35.52 512,81± ±35.09 S+P S+P+M S+V 0.89±0,03 1,49±0,08 0 501,39± 594,36± 538,93± ±50,63 ±95,25 ±80,19 7,22± 68,36± 89,92± ±6,49 ±31,22 ±14,66 16,23± 68,61± 28,41± ±8,13 ±9,32 ±16,23 445,96± 624,93± 554,41± ±180,41 ±84,91 ±86,25 14 S+V+M S+P+V S+P+V+M 0 0,42±0,01 0,85±0,05 426,56± 557,07± 472,34± ±63,56 ±54,37 ±71,13 99,56± 20,54± 55,04± ±61,99 ±24,76 ±31,79 113,52± 25,49± 105,27± ±18,64 ±26,99 ±61,00 620,37± 415,14± 613,14± ±77,86 ±38,06 ±97,36 UA 103629 C2 Продовження таблиці 1 Узагальнення результатів S N153,60± ацетилглюко±51,81 амінідаза 186,96± β-ксилоксаза ±123,04 Діацетат 24,87± флуоресцеїну ±4,78 (FDA) 5 S+M S+P S+P+M S+V S+V+M S+P+V S+P+V+M 91,32± ±27.90 117,45± ±28,83 148,40± ±14,69 106,41± ±12,39 114,91± ±33,63 160,19± ±136,54 179,60± ±14,45 210,80± ±59.66 24,51± ±25,13 109,84± ±4,53 23,17± ±2,92 144,59± ±35,75 63,29± ±22,90 165,52± ±6,97 33,13± ±4,11 27,31± ±4,66 27,52± ±3,62 29,16± ±3,12 31,75± ±2,38 25,82± ±7,12 33,94± ±7,25 ФОРМУЛА ВИНАХОДУ 1. Застосування твердої мінеральної композиції, що має наступний склад: карбонат кальцію від 4,58 % до 77,8 % доломіт від 3,85 % до 69,29 % хлорид натрію від 5,7 % до 12,4 % лігносульфат від 4,25 % до 8,49 % сульфат калію від 0,37 % до 2,44 % оксид магнію від 0,01 % до 0,07 % 15 UA 103629 C2 5 10 15 20 25 елементарна сірка від 0,009 % до 0,066 %, де приведеним вище процентним вмістом є масовий відсоток кожної із сполук від загальної маси сухої речовини мінеральної композиції як засобу для підвищення родючості ґрунту за рахунок збільшення принаймні одного виду ферментативної активності, наявної в ґрунті, вибраної з числа активності (і) фосфатази, (іі) -ксилозидази, (ііі) -глюкозидази та (iv) глюкозидази. 2. Застосування за п. 1, яке відрізняється тим, що тверда мінеральна композиція викликає збільшення принаймні в 1,5 рази, і переважно принаймні в 2 рази ферментативної активності, вибраної з активності (і) лужної фосфатази, (іі) -ксилозидази, (ііі) -тлюкозидази і глюкозидази. 3. Застосування за п. 1, яке відрізняється тим, що тверда мінеральна композиція викликає збільшення принаймні в 2 рази активності фосфатази. 4. Застосування за п. 1, яке відрізняється тим, що тверда мінеральна композиція викликає збільшення принаймні в 2 рази активності -ксилозидази. 5. Застосування за п. 1, яке відрізняється тим, що тверда мінеральна композиція викликає збільшення принаймні в 2 рази активності -глюкозидази. 6. Застосування за п. 1, яке відрізняється тим, що тверда мінеральна композиція викликає збільшення принаймні в 2 рази активності -глюкозидази. 7. Застосування за п. 1, яке відрізняється тим, що мінеральна композиція викликає зміни, що можуть бути виявлені, співвідношень переважання відповідних бактерійних таксонів, присутніх в ґрунті, відносно один до одного. 8. Застосування за п. 1, яке відрізняється тим, що тверда мінеральна композиція викликає збільшення принаймні в 1,5 разу утворення рослинної біомаси ґрунтом. 9. Застосування за будь-яким з попередніх пунктів, яке відрізняється тим, що мінеральну 2 композицію формули (І) вносять до удобрюваного ґрунту в кількості принаймні від 0,01 кг/м до 2 2 0,10 кг/м , переважно в кількості від 0,02 до 0,04 кг/м . 16 UA 103629 C2 17 UA 103629 C2 18 UA 103629 C2 19 UA 103629 C2 20 UA 103629 C2 21 UA 103629 C2 22 UA 103629 C2 Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 23
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of a solid mineral composition for increasing the fertility of a crop soil or of a prairie soil
Автори російськоюMora, Philippe, Miambi, Edouard, Roy, Virginie, Giusti, Stephanie, Blin, Didier, Veyrier, Thibaut, Daridon, Bruno
МПК / Мітки
МПК: C05D 9/02, C05D 3/00, C05D 5/00
Мітки: родючості, підвищення, засобу, ґрунтів, пасовищних, оброблюваних, композиції, мінеральної, застосування, твердої
Код посилання
<a href="https://ua.patents.su/25-103629-zastosuvannya-tverdo-mineralno-kompozici-yak-zasobu-dlya-pidvishhennya-rodyuchosti-obroblyuvanikh-runtiv-abo-pasovishhnikh-runtiv.html" target="_blank" rel="follow" title="База патентів України">Застосування твердої мінеральної композиції як засобу для підвищення родючості оброблюваних ґрунтів або пасовищних ґрунтів</a>
Попередній патент: Піролопіримідини та їх застосування
Наступний патент: Гель на основі гіалуронової кислоти, який містить лідокаїн
Випадковий патент: Установка для одержання харчового порошку з термолабільної сировини