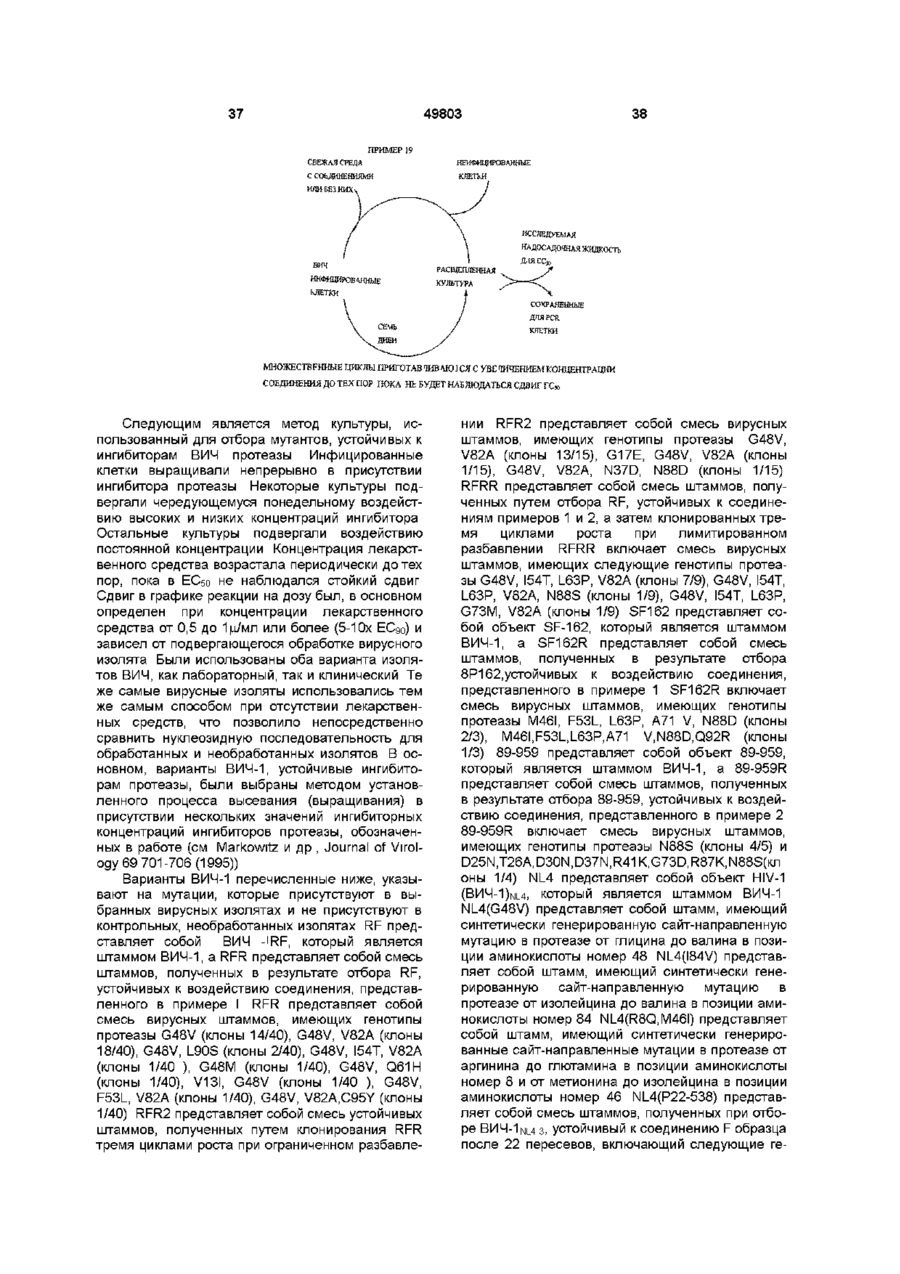
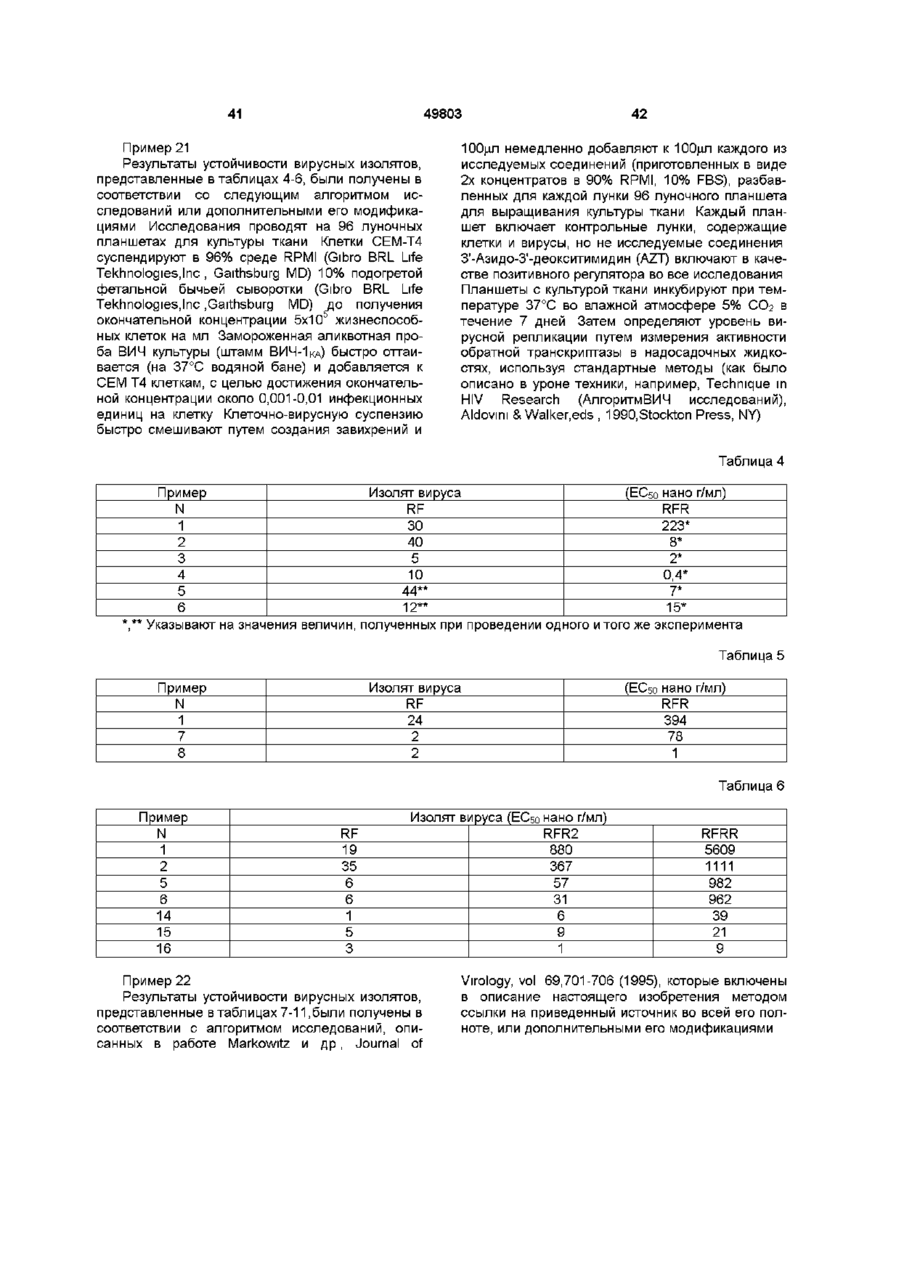
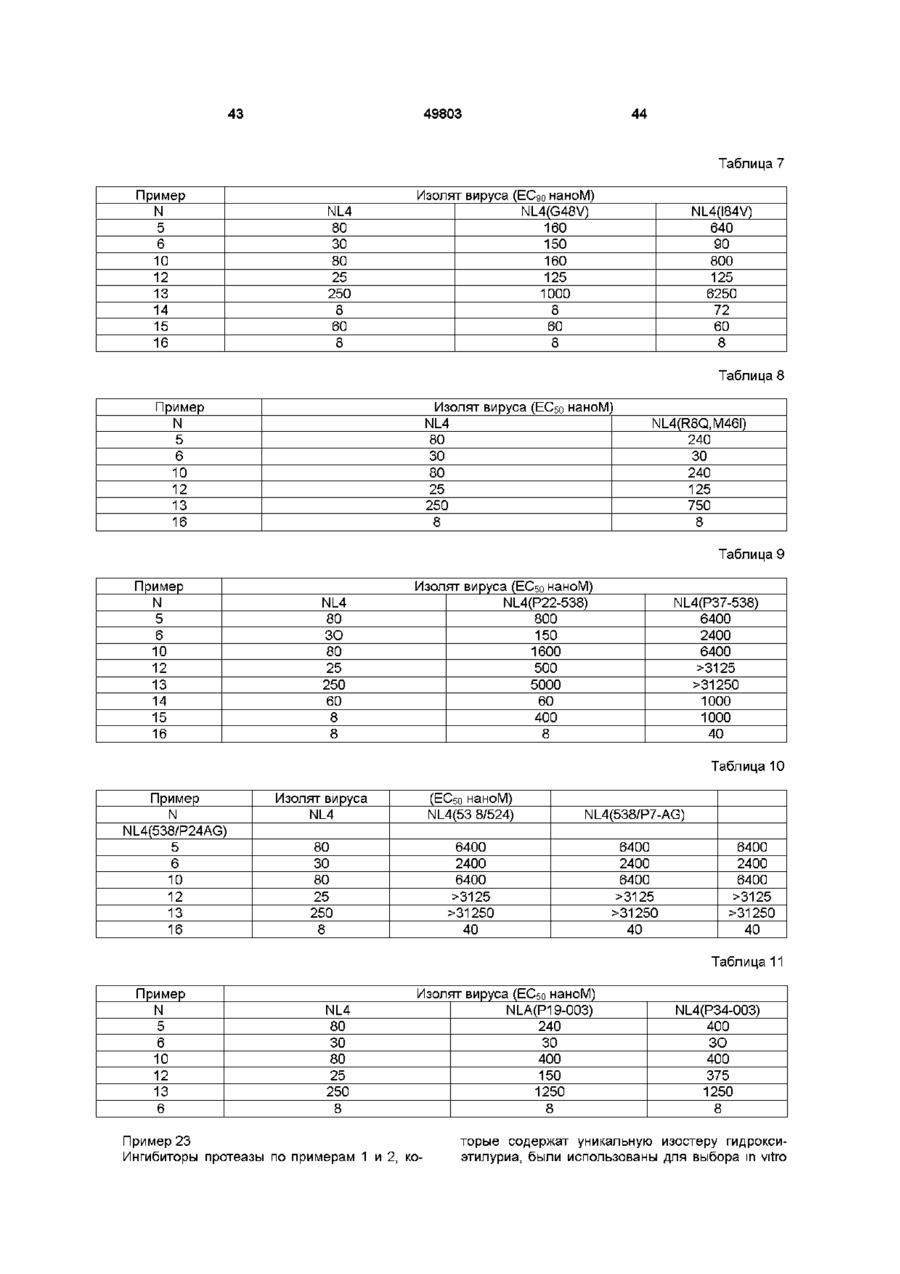
Спосіб лікування ретровірусних інфекцій
Номер патенту: 49803
Опубліковано: 15.10.2002
Автори: Поттс Керен Е., Брайент Мартін Л., Таккер Саймен П., Смідт Мері
Формула / Реферат
1. Способ лечения ретровирусных инфекций у млекопитающих, содержащий введение этому млекопитающему а) эффективного количества первого ингибитора ретровирусной протеазы; и b) эффективного количества второго ингибитора ретровирусной протеазы, где этот второй ингибитор ретровирусной протеазы эффективен против по меньшей мере одного ретровирусного штамма, устойчивого к этому первому ингибитору ретровирусной протеазы.
2. Способ по п. 1, отличающийся тем, что первый и второй ингибиторы вводят так, чтобы эффективное количество обоих ингибиторов присутствовало в этом млекопитающем.
3. Способ по п. 1, отличающийся тем, что введение первого и второго ингибиторов чередуют так, чтобы в этом млекопитающем в период времени присутствовало эффективное количество одного ингибитора.
4. Способ по п. 1, отличающийся тем, что первый ингибитор ретровирусной протеазы является:
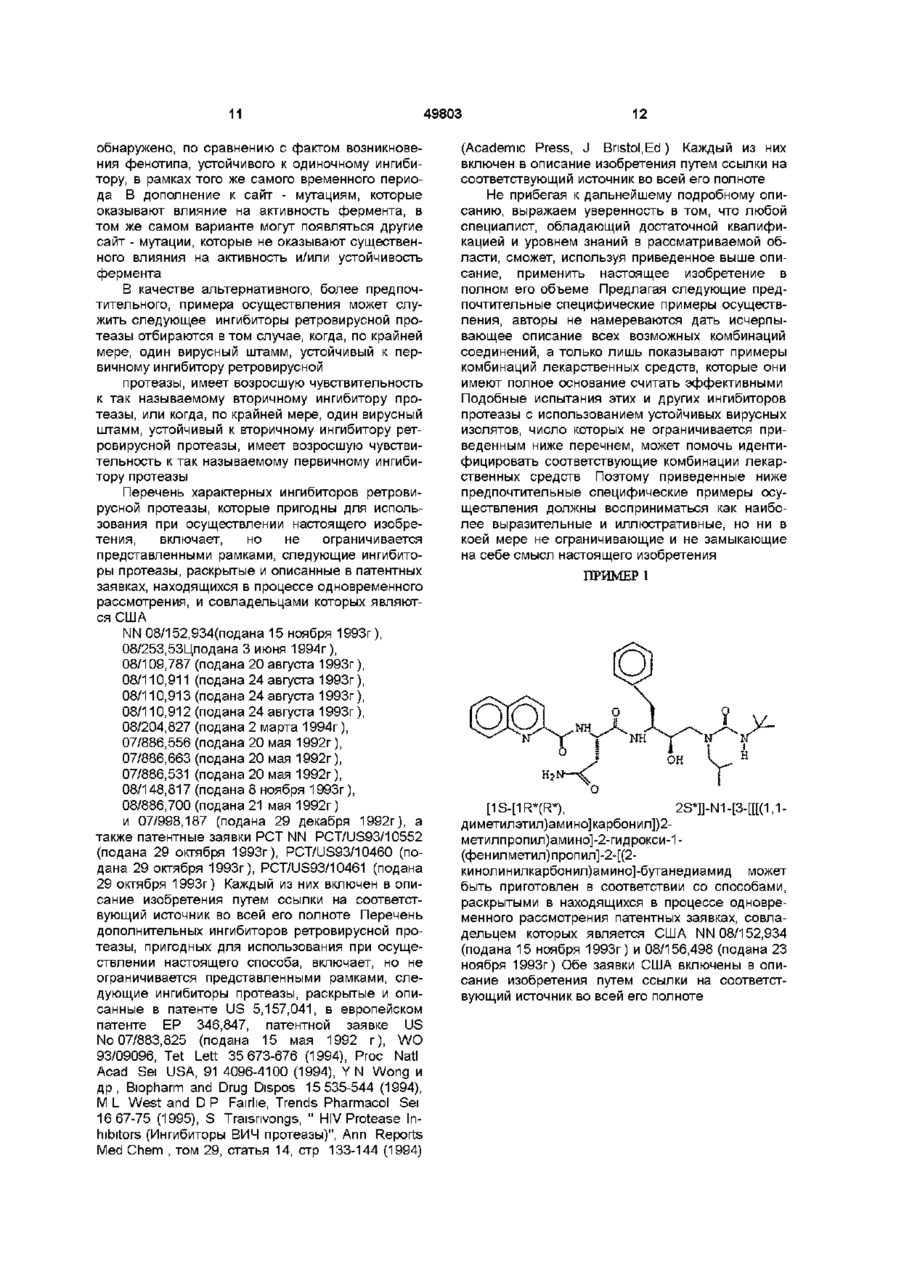
N-(2(R)-Гидрокси-1(S)-инданил)-2(R)-фенилметил-4(S)-гидрокси-5-(1-(4- (3-пиридилметил)-2(S)-N'-(1-бутилкарбоксамидо)-пиперазинил))-пентанамидом;
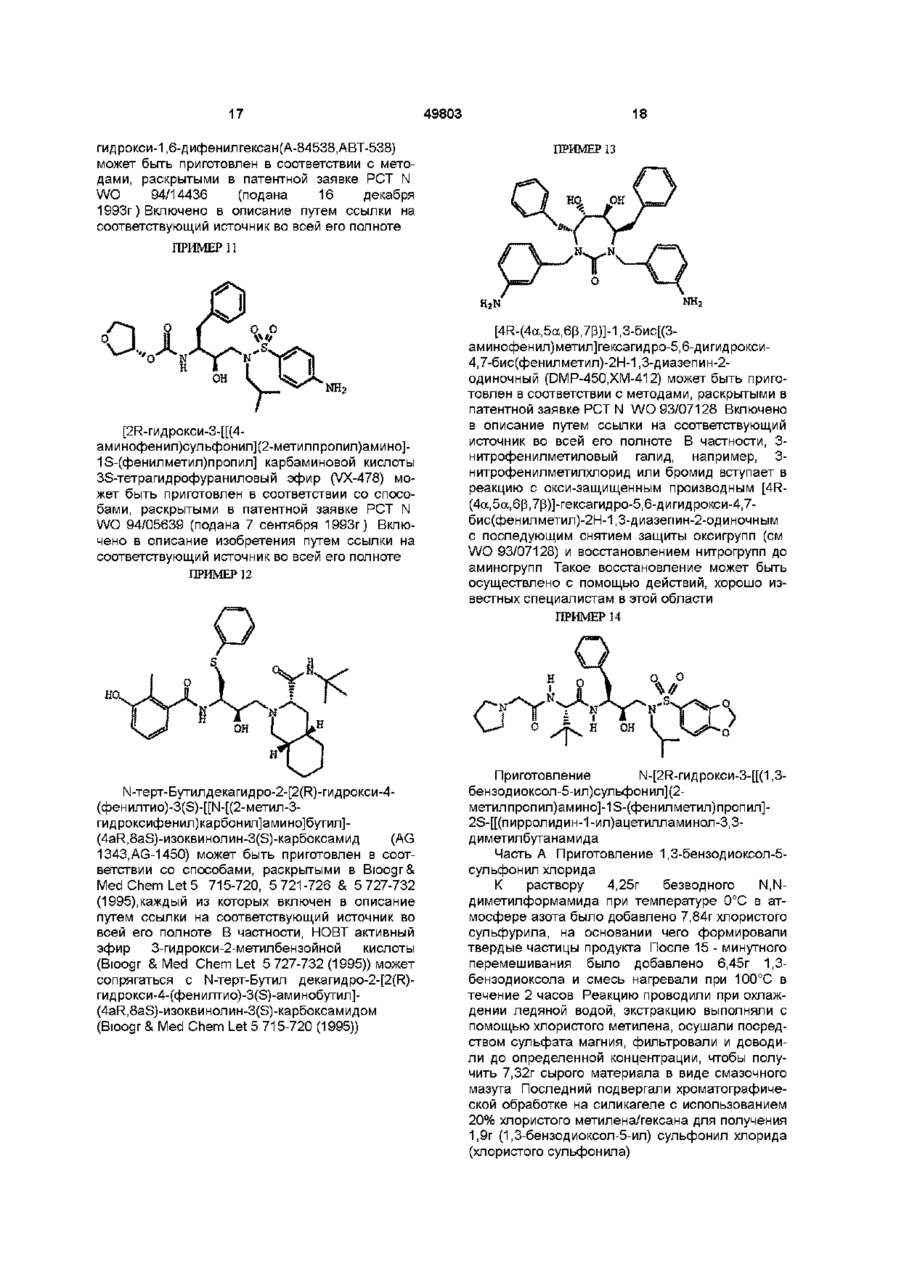
N-трет-бутилдекагидро-2-[2(R)-гидрокси-4-фенил-3(S)-[[N-(2-хинолилкарбонил)-L-аспарагинил]амино]бутил]-(4аR,8аS)-изохинолин-3(S)-карбоксамидом;
(2S,3R,4S,5S)-2,5-бис-[N-[N-[N-метил-N-(2-пиридинилметил)амино]карбонил]валинил]амино]-3,4-дигидрокси-1,6-дифенилгексаном;
(2S,3S,5S)-5-[N-[N-[N-метил-[(2-изопропил-4-тиазолил)метил]амино]карбонил]валинил]амино]-2-[N-[(5-тиазолил)метоксикарбонил]амино]-3-гидрокси-1,6-дифенилгексаном;
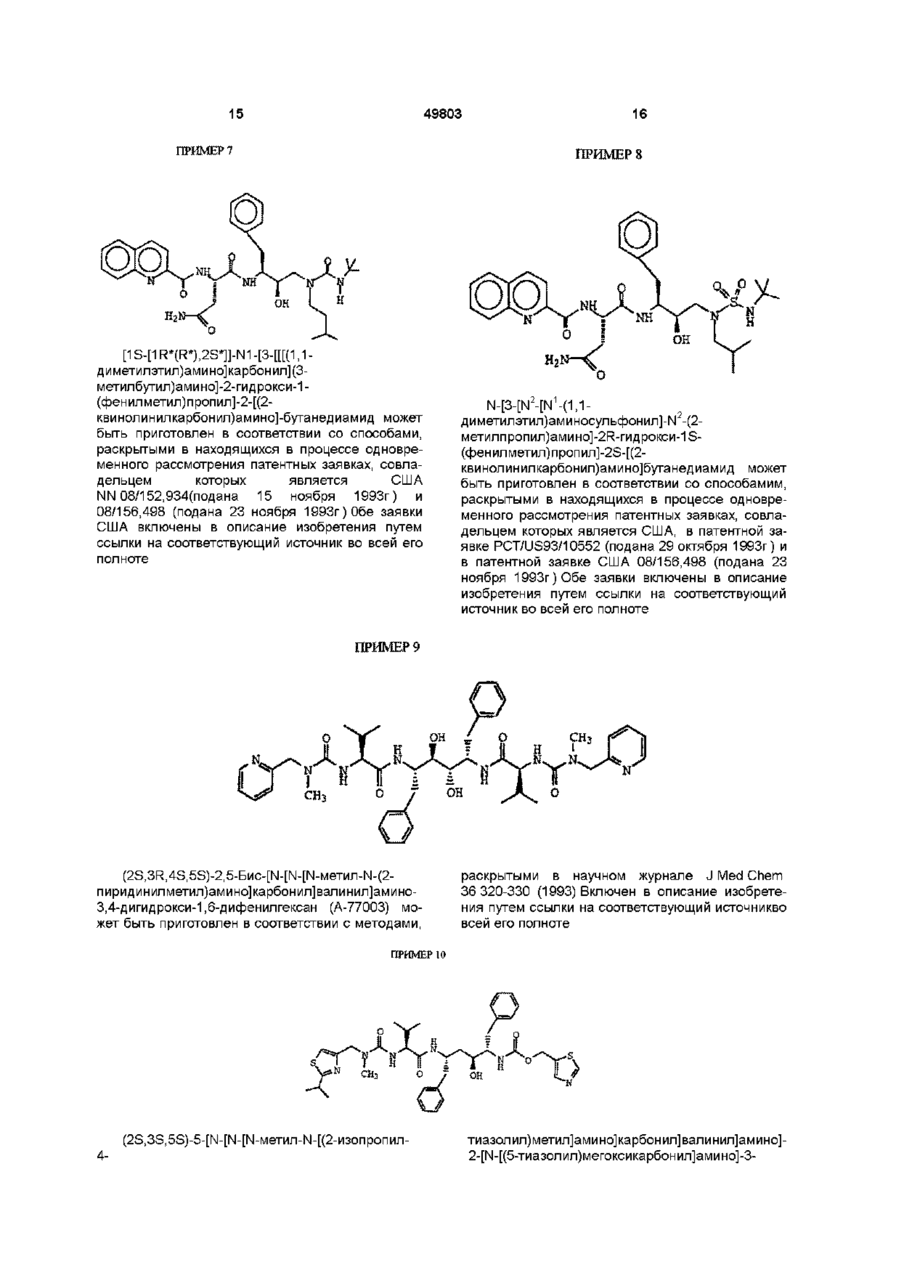
3S-тетрагидрофураниловым эфиром [2R-гидрокси-3-[[(4-аминофенил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропил] карбаминовой кислоты;
N-трет-бутилдекагидро-2-[2(R)-гидрокси-4-(фенилтио)-3(S)-[[N-[(2-метил-3-гидроксифенил)карбонил]амино]бутил]-(4аR,8аS)-изохинолин-3(S)-карбоксамидом;
[4R-(4![]() ,5
,5![]() ,6
,6![]() ,7
,7![]() )]-1,3-бис[(3-аминофенил)метил]гексагидро-5,6-дигидрокси-4,7-бис(фенилметил)-2Н-1,3-диазепин-2-оном;
)]-1,3-бис[(3-аминофенил)метил]гексагидро-5,6-дигидрокси-4,7-бис(фенилметил)-2Н-1,3-диазепин-2-оном;
N-[2R-гидрокси-3-[[(1,3-бензодиоксол-5-ил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропил]-2S-[[(пирролидин-1-ил)ацетил]амино]-3,3-диметилбутанамидом;
N-[2R-гидрокси-3-[(2-метилпропил)[(1,3-бензодиоксол-5-ил)сульфонил]амино]-1S-(фенилметил)пропил]-2S-метил-3-(метилсульфонил)пропанамидом;
[1S-[1R*(R*),2S*]]-N-[2-гидрокси-3-[N'-(2-метилпропил)-N'-(4-метоксифенилсульфонил)амино]-1-(фенилметил)пропил]-2-метил-3-(метилсульфонил)пропанамидом;
2S-[[(N-метиламино)ацетил]амино]-N-[2R-гидрокси-3-[[(1,3-бензодиоксол-5-ил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропил]-3,3-диметилбутанамидом;
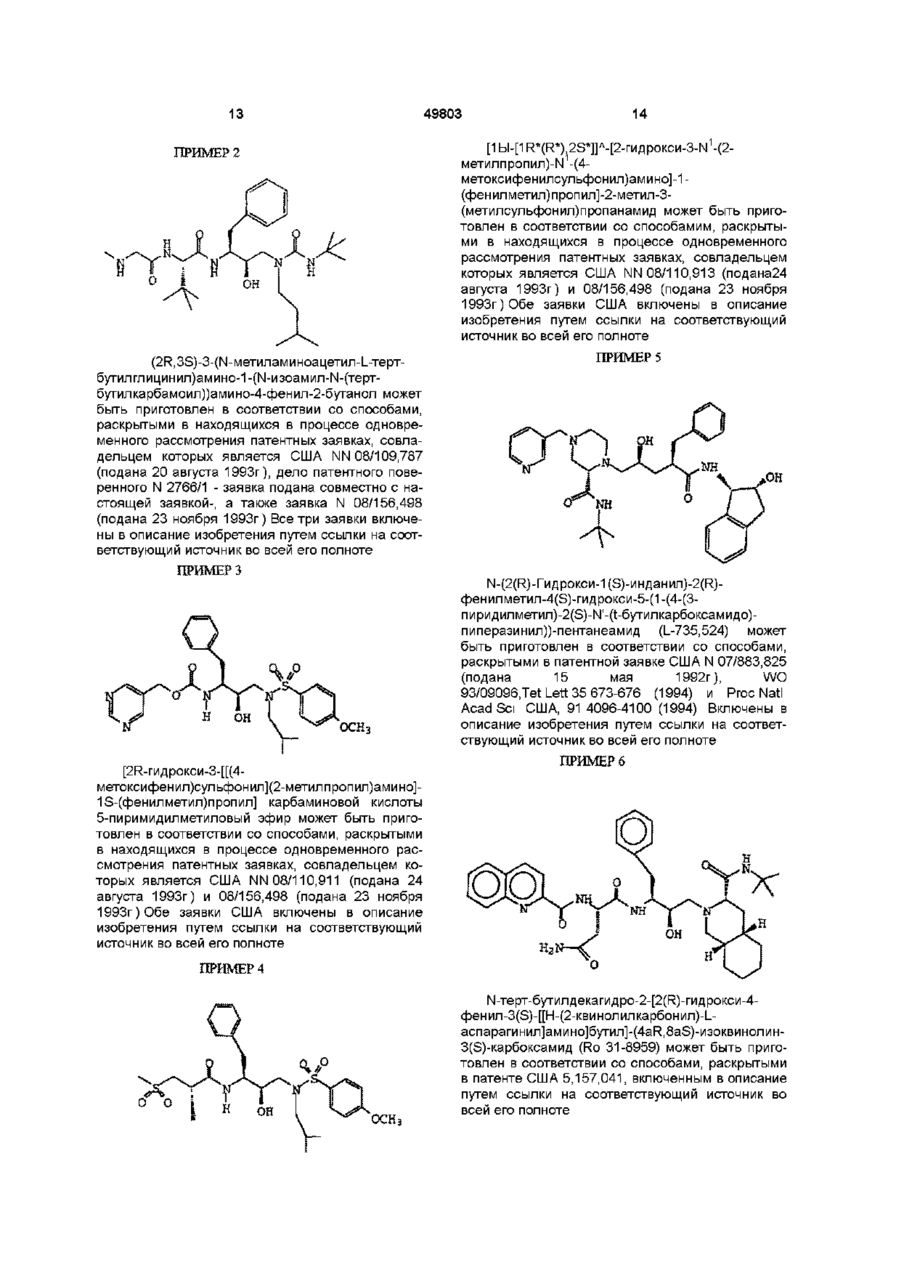
или (2R,3S)-3-(N-метиламиноацетил-L-трет-бутилглицинил)амино-1-(N-изоамил-N-(трет-бутилкарбамоил))амино-4-фенил-2-бутанолом;
5. Способ по п. 1, отличающийся тем, что второй ингибитор ретровирусной протеазы является:
N-(2(R)-гидрокси-1(S)-инданил)-2(R)-фенилметил-4(S)-гидрокси-5-(1-(4-(3-пиридилметил)-2(S)-N'-(трет-бутилкарбоксамидо)-пиперазинил))-пентанамидом;
N-трет-бутилдекагидро-2-[2(R)-гидрокси-4-фенил-3(S)-[[N-(2-хинолилкарбонил)-L-аспарагинил]амино]бутил]-(4аR,8аS)-изохинолин-3(S)-карбоксамидом;
(2S,3R,4S,5S)-2,5-бис-[N-[N-[[N-метил-N-(2-пиридинилметил)амино]карбонил]валинил]амино]-3,4-дигидрокси-1,6-дифенилгексаном;
(2S,3S,5S)-5-[N-[N-[N-метил-N-[(2-изопропил-4-тиазолил)метил]амино]карбонил]валинил]амино]-2-[N-[(5-тиазолил)метоксикарбонил]амино]-3-гидрокси-1,6-дифенилгексаном;
3S-тетрагидрофураниловым эфиром [2R-гидрокси-3-[[(4-аминофенил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропил] карбаминовой кислоты;
N-трет-бутилдекагидро-2-[2(R)-гидрокси-4-(фенилтио)-3(S)-[[N-[(2-метил-3-гидроксифенил)карбонил]амино]бутил]-(4аR,8аS)-изохинолин-3(S)-карбоксамидом;
[4R-(4![]() ,5
,5![]() ,6
,6![]() ,7
,7![]() )]-1,3-бис[(3-аминофенил)метил]гексагидро-5,6-дигидрокси-4,7-бис(фенилметил)-2Н-1,3-диазепин-2-оном;
)]-1,3-бис[(3-аминофенил)метил]гексагидро-5,6-дигидрокси-4,7-бис(фенилметил)-2Н-1,3-диазепин-2-оном;
N-[2R-гидрокси-3-[[(1,3-бензодиоксол-5-ил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропил]-2S-[[(пирролидин-1-ил)ацетил] амино]-3,3-диметилбутанамидом;
N-[2R-гидрокси-3-[(2-метилпропил)[(1,3-бензодиоксол-5-ил)сульфонил]амино]-1S-(фенилметил)пропил]-2S-метил-3-(метилсульфонил)пропанамидом;
[1S-[1R*(R*),2S*]]-N-[2-гидрокси-3-[N'-(2-метилпропил)-N'-(4-метоксифенилсульфонил)амино]-1-(фенилметил)пропил]-2-метил-3-(метилсульфонил)пропанамидом;
2S-[[(N-метиламино)ацетил]амино]-N-[2R-гидрокси-3-[[(1,3-бензодиоксол-5-ил)cульфонил](2-метилпропил)амино]-1S-(фенилметил)пропил]-3,3-диметилбутанамидом
или (2R,3S)-3-(N-метиламиноацетил-L-трет-бутилглицинил)амино-1-(N-изоамил-N-(трет-бутилкарбамоил))амино-4-фенил-2-бутанолом.
6. Способ по п. 1, отличающийся тем, что первый ингибитор ретровирусной протеазы является:
N-(2(R)-гидрокси-1(S)-инданил)-2(R)-фенилметил-4(S)-гидрокси-5-(1-(4-(3-пиридилметил)-2(S)-N'-(трет-бутилкарбоксамидо)-пиперазинил))-пентанамидом;
N-тpeт-бyтилдeкaгидpo-2-[2(R)-гидpoкcи-4-фeнил-3(S)-[[N-(2-хинoлилкapбoнил)-L-acпapaгинил]амино]бутил]-(4аR,8аS)-изохинолин-3(S)-карбоксамидом;
(2S,3R,4S,5S)-2,5-бис-[N-[N-[N-метил-N-(2-пиридинилметил)амино]карбонил]валинил]амино]-3,4-дигидрокси-1,6-дифенилгексаном;
(2S,3S,5S)-5-[N-[N-[N-метил-N-[(2-изопропил-4-тиазолил)метил]амино]карбонил]валинил]амино]-2-[N-[(5-тиазолил)метоксикарбонил]амино]-3-гидрокси-1,6-дифенилгексаном;
3S-тетрагидрофураниловым эфиром [2R-гидрокси-3-[[(4-аминофенил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропил] карбаминовой кислоты;
N-трет-бутилдекагидро-2-[2(R)-гидрокси-4-(фенилтио)-3(S)-[N-[(2-метил-3-гидроксифенил)карбонил]амино]бутил]-(4аR,8аS)-изохинолин-3(S)-карбоксамидом;
[4R-(4![]() ,5
,5![]() ,6
,6![]() ,7
,7![]() )]-1,3-бис[(3-аминофенил)метил]гексагидро-5,6-дигидрокси-4,7-бис(фенилметил)-2Н-1,3-диазепин-2-оном;
)]-1,3-бис[(3-аминофенил)метил]гексагидро-5,6-дигидрокси-4,7-бис(фенилметил)-2Н-1,3-диазепин-2-оном;
N-[2R-гидрокси-3-[[(1,3-бензодиоксол-5-ил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропил]-2S-[[(пирролидин-1-ил)ацетил]амино]-3,3-диметилбутанамидом;
N-[2R-гидрокси-3-[(2-метилпропил) [(1,3 -бензодиоксол-5 -ил)сульфонил] амино]-1S-(фенилметил)пропил]-2S-метил-3-(метилсульфонил)пропанамидом;
[1S-[1R*(R*),2S*]]-N-[2-гидрокси-3-[N'-(2-мeтилпpoпил)-N'-(4-мeтoкcифeнилcyльфoнил)aминo]-1-(фенилметил)пропил]-2-метил-3-(метилсульфонил)пропанамидом или
(2R,3S)-3-(N-метиламиноацетил-L-трет-бутилглицинил)амино-1-(N-изоамил-N-(трет-бутилкарбамоил))амино-4-фенил-2-бутанолом,
и второй ингибитор ретровирусной протеазы является
2S-[[(N-метиламино)ацетил]амино]-N-[2R-гидрокси-3-[[(1,3-бензодиоксол-5-ил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропил]-3,3-диметилбутанамидом.
7. Способ по п. 1, отличающийся тем, что первый ингибитор ретровирусной протеазы является:
N-(2(R)-гидрокси-1(S)-инданил)-2(R)-фенилметил-4(S)-гидрокси-5-(1-(4-(3-пиридилметил)-2(S)-N'-(трет-бутилкарбоксамидо)-пиперазинил))-пентанеамидом,
а второй ингибитор ретровирусной протеиназы является
(2R,3S)-3-(N-метиламиноацетил-L-трет-бутилглицинил)амино-1-(N-изоамил-N-(трет-бутилкарбамоил))амино-4-фенил-2-бутанолом;
N-[2R-гидpoкcи-3-[(2-мeтилпpoпил)[(l,3-бeнзoдиoкcoл-5-ил)cyльфoнил]aминo]-lS-(фeнилмeтил)пропил]-2S-метил-3-(метилсульфонил)пропанамидом;
[1S-[1R*(R*),2S*]]-N-[2-гидрокси-3-[N'-(2-метилпропил)-N'-(4-метоксифенилсульфонил)амино]-1-(фенилметил)пропил]-2-метил-3-(метилсульфонил)пропанамидом или
2S-[[(N-метиламино)ацетил]амино]-N-[2R-гидрокси-3-[[(1,3-бензодиоксол-5-ил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропил]-3,3-диметилбутанамидом.
8. Способ по п. 1, отличающийся тем, что первый ингибитор ретровирусной протеазы является:
(2S,3S,5S)-5-[N-[N-[N-метил-N-[(2-изопропил-4-тиазолил)метил]амино]карбонил]валинил]амино]-2-[N-[(5-тиазолил)метоксикарбонил]амино]-3-гидрокси-1,6-дифенилгексаном,
а второй ингибитор ретровирусной протеиназы является
(2R,3S)-3-(N-метиламиноацетил-L-трет-бутилглицинил)амино-1-(N-изоамил-N-(трет-бутилкарбамоил))амино-4-фенил-2-бутанолом;
N-(2R-гидрокси-3-[[(1,3-бензодиоксол-5-ил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропил]-2S-[[(пирролидин-1-ил)ацетил]амино]-3,3-диметилбутанамидом
или 2S-[[(N-метиламино)ацетил]амино]-N-[2R-гидрокси-3-[[(1,3-бензодиоксол-5-ил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропил]-3,3-диметилбутанамидом.
9. Способ по п. 1, отличающийся тем, что пациенту вводят третий ингибитор ретровирусной протеазы, который эффективен против по меньшей мере одного вирусного штамма, который устойчив как к первому так и ко второму ингибиторам ретровирусной протеазы.
10. Способ по п. 9, отличающийся тем, что третий ингибитор ретровирусной протеазы является:
N-(2(R)-гидрокси-1(S)-инданил)-2(R)-фенилметил-4(S)-гидрокси-5-(1-(4-(3-пиридилметил)-2(S)-N'-(трет-бутилкарбоксамидо)-пиперазинил))-пентанамидом;
N-трет-бутилдекагидро-2-[2(R)-гидрокси-4-фенил-3(S)-[N-(2-хинолилкарбонил)-L-аспарагинил]амино]бутил]-(4аR,8аS)-изохинолин-3(S)-карбоксамидом;
(2S,3R,4S,5S)-2,5-бис-[N-[N-[[N-метил-N-(2-пиридинилметил)амино]карбонил]валинил]амино]-3,4-дигидрокси-1,6-дифенилгексаном;
(2S,3S,5S)-5-[N-[N-[N-метил-N-[(2-изопропил-4-тиазолил)метил]амино]карбонил]валинил]амино]-2-[N-[(5-тиазолил)метоксикарбонил]амино]-3-гидрокси-1,6-дифенилгексаном;
3S-тетрагидрофураниловым эфиром [2R-гидрокси-3-[[(4-аминофенил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропил] карбаминовой кислоты;
N-трет-бутилдекагидро-2-[2(R)-гидрокси-4-(фенилтио)-3(S)-[[N-[(2-метил-3-гидроксифенил)карбонил]амино]бутил]-(4aR,8аS)-изохинолин-3 (S)-карбоксамидом;
[4R-(4![]() ,5
,5![]() ,6
,6![]() ,7
,7![]() )]-1,3-бис[(3-аминофенил)метил]гексагидро-5,6-дигидрокси-4,7-бис(фенилметил)-2Н-1,3-диазепин-2-оном;
)]-1,3-бис[(3-аминофенил)метил]гексагидро-5,6-дигидрокси-4,7-бис(фенилметил)-2Н-1,3-диазепин-2-оном;
N-[2R-гидрокси-3-[[(1,3-бензодиоксол-5-ил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропил]-2S-[[(пирролидин-1-ил)ацетил]амино]-3,3-диметилбутанамидом;
N-[2R-гидрокси-3-[(2-метилпропил)[(1,3-бензодиоксол-5-ил)сульфонил]амино]-1S-(фенилметил)пропил]-2S-метил-3-(метилсульфонил)пропанамидом;
[1S-[1R*(R*),2S*]]-N-[2-гидрокси-3-[N'-(2-метилпропил)-N'-(4-метоксифенилсульфонил)амино]-1-(фенилметил)пропил]-2-метил-3-(метилсульфонил)пропанамидом;
2S-[[(N-метиламино)ацетил]амино]-N-[2R-гидрокси-3-[[(1,3-бензодиоксол-5-ил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропил]-3,3-диметилбутанамидом
или (2R,3S)-3-(N-метиламиноацетил-L-трет-бутилглицинил)амино-1-(N-изоамил-N-(трет-бутилкарбамоил))амино-4-фенил-2-бутанолом.
11. Способ по п. 1, отличающийся тем, что по крайней мере один вирусный штамм устойчив к этому первому ингибитору ретровирусной протеазы, и по меньшей мере один вирусный штамм устойчив к этому второму ингибитору ретровирусной протеазы, каждый из которых продуцирует ретровирусные протеазы, имеющие по меньшей мере одно аминокислотное замещение в пептидной последовательности протеазы, где это замещение влияет на ту же самую область сайта связывания субстрата протеазы и содействует наблюдаемой устойчивости к ингибитору.
12. Способ по п. 1, отличающийся тем, что включает также введение по меньшей мере одного противовирусного средства, отличного от ингибитора протеазы.
13. Способ по п. 12, отличающийся тем, что противовирусное средство является аналогом нуклеозида, ненуклеозидным ингибитором обратной транскриптазы, антагонистом tat (тирозинаминотрансферазы) или ингибитором гликозидазы.
14. Способ по п. 13, отличающийся тем, что аналог нуклеозида выбирают AZY, DDI, DDC, 3ТС, D4T или РМЕА и этот ингибитор гликозидазы является кастаноспермином или N-бутил-1-деоксиножирмицином.
15. Способ по п. 1, отличающийся тем, что млекопитающее является человеком, обезьяной или кошкой.
16. Способ по п. 1, отличающийся тем, что ретровирус является ВИЧ или HTLV.
17. Способ по п. 16, отличающийся тем, что ретровирус является ВИЧ-1 или ВИЧ-2.
18. Способ лечения ретровирусных инфекций у млекопитающего, содержащий
a) выбор двух ингибиторов ретровирусной протеазы, где второй выбранный ингибитор ретровирусной протеазы эффективен против по меньшей мере одного ретровирусного штамма, устойчивого к первому ингибитору ретровирусной протеазы и
b) введение этому пациенту эффективного количества первого и второго выбранных ингибиторов.
19. Способ по п. 18, отличающийся тем, что первый и второй ингибиторы вводят так, чтобы в этом пациенте присутствовало эффективное количество обоих ингибиторов.
20. Способ по п. 1, отличающийся тем, что введение первого и второго ингибиторов чередуют так, чтобы в организме пациента в период времени присутствовало эффективное количество одного ингибитора.
Текст
1 Способ лечения ретровирусных инфекций у млекопитающих, содержащий введение этому млекопитающему а) эффективного количества первого ингибитора ретровирусной протеазы, и Ь) эффективного количества второго ингибитора ретровирусной протеазы, где этот второй ингибитор ретровирусной протеазы эффективен против по меньшей мере одного ретровирусного штамма, устойчивого к этому первому ингибитору ретровирусной протеазы 2 Способ по п 1, отличающийся тем, что первый и второй ингибиторы вводят так, чтобы эффективное количество обоих ингибиторов присутствовало в этом млекопитающем 3 Способ по п 1, отличающийся тем, что введение первого и второго ингибиторов чередуют так, чтобы в этом млекопитающем в период времени присутствовало эффективное количество одного ингибитора 4 Способ по п 1, отличающийся тем, что первый ингибитор ретровирусной протеазы является |\|-(2(Р)-Гидрокси-1(3)-инданил)-2(Р)-фенилметил4(Э)-гидрокси-5-(1 -(4- (3-пиридилметил)-2(3)-1\Г-(1 бутил карбоксамидо)-пиперазинил))пентанамидом, г\|-трет-бутилдекагидро-2-[2(Р)-гидрокси-4-фенил3(3)-[[І\І-(2-хинолилкарбонил)-І_аспарагинил]амино]бутил]-(4аР,8аЗ)-изохинолин3(Э)-карбоксамидом, (2S,3R,4S,5S)-2,5-6nc-[N-[N-[N-MeTHn-N-(2пиридинилметил)амино]карбонил]валинил]амино]3,4-дигидрокси-1,6-дифенил гексаном, (2S,3S,5S)-5-[N-[N-[N-Me™-|-[(2-H3onponmi-4тиазолил)метил]амино]карбонил]валинил]амино]2-[І\І-[(5-тиазолил)метоксикарбонил]амино]-3гидрокси-1,6-дифенил гексаном, ЗЭ-тетрагидрофураниловым эфиром [2Rгидрокси-3-[[(4-аминофенил)сульфонил](2метилпропил)амино]-1Э-(фенилметил)пропил] карбаминовой кислоты, г\|-трет-бутилдекагидро-2-[2(Р)-гидрокси-4(фенилтио)-3(Э)-[[М-[(2-метил-3гидроксифенил)карбонил]амино]бутил]-(4аР,8аЗ)изохинолин-3(3)-карбоксамидом, [4R-(4 а ,5 а ,6 р ,7 р )]-1,3-бис[(3аминофенил)метил]гексагидро-5,6-дигидрокси-4,7бис(фенилметил)-2Н-1,3-диазепин-2-оном, |\|-[2Р-гидрокси-3-[[(1,3-бензодиоксол-5ил)сульфонил](2-метилпропил)амино]-13(фенилметил)пропил]-23-[[(пирролидин-1ил)ацетил]амино]-3,3-диметилбутанамидом, |\|-[2Р-гидрокси-3-[(2-метилпропил)[(1,3бензодиоксол-5-ил)сульфонил]амино]-13(фенилметил)пропил]-23-метил-3(метилсульфонил)пропанамидом, [1 S-[1 R*(R*),2S*]]-N-[2-rHflpoKCH-3-[N'-(2метилпропил)-І\Г-(4метоксифенилсульфонил)амино]-1(фенилметил)пропил]-2-метил-3(метилсульфонил)пропанамидом, 23-[[(М-метиламино)ацетил]амино]-М-[2Ргидрокси-3-[[(1,3-бензодиоксол-5-ил)сульфонил](2метилпропил)амино]-13-(фенилметил)пропил]-3,3диметилбутанамидом, или (2Р,33)-3-(г\І-метиламиноацетил-І_-третбутилглицинил)амино-1-(М-изоамил-М-(третбутилкарбамоил))амино-4-фенил-2-бутанолом, 5 Способ по п 1, отличающийся тем, что второй ингибитор ретровирусной протеазы является 1\1-(2(Р)-гидрокси-1(3)-инданил)-2(Р)-фенилметил4(3)-гидрокси-5-(1-(4-(3-пиридилметил)-2(3)-1\Г(трет-бутилкарбоксамидо)-пиперазинил))пентанамидом, М-трет-бутилдекагидро-2-[2(Р)-гидрокси-4-фенил3(3)-[[г\І-(2-хинолилкарбонил)-І_аспарагинил]амино]бутил]-(4аР,8аЗ)-изохинолин3(3)-карбоксамидом, (2S,3R,4S,5S)-2,5-6HC-[N-[N-[[N-MeTHn-N-(2пиридинилметил)амино]карбонил]валинил]амино]3,4-дигидрокси-1,6-дифенил гексаном, (2S,3S,5S)-5-[N-[N-[N-Me™>N-[(2-H3onponmi-4тиазолил)метил]амино]карбонил]валинил]амино] О го о 00 49803 2-[І\І-[(5-тиазолил)метоксикарбонил]амино]-3гидрокси-1,6-дифенил гексаном, ЗЗ-тетрагидрофураниловым эфиром [2Rгидрокси-3-[[(4-аминофенил)сульфонил](2метилпропил)амино]-13-(фенилметил)пропил] карбаминовой кислоты, |\|-трет-бутилдекагидро-2-[2(Р)-гидрокси-4(фенилтио)-3(3)-[[І\І-[(2-метил-3гидроксифенил)карбонил]амино]бутил]-(4аР,8аЗ)изохинолин-3(3)-карбоксамидом, [4R-(4 а ,5 а ,6 [3 ,7 р )]-1,3-бис[(3аминофенил)метил]гексагидро-5,6-дигидрокси-4,7бис(фенилметил)-2Н-1,3-диазепин-2-оном, М-[2Р-гидрокси-3-[[(1,3-бензодиоксол-5ил)сульфонил](2-метилпропил)амино]-13(фенилметил)пропил]-23-[[(пирролидин-1ил)ацетил] амино]-3,3-диметилбутанамидом, М-[2Р-гидрокси-3-[(2-метилпропил)[(1,3бензодиоксол-5-ил)сульфонил]амино]-13(фенилметил)пропил]-23-метил-3(метилсульфонил)пропанамидом, [1 S-[1 R*(R*),2S*]]-N-[2-rHflpoKCH-3-[N'-(2метилпропил)-І\Г-(4метоксифенилсульфонил)амино]-1(фенилметил)пропил]-2-метил-3(метилсульфонил)пропанамидом, 2S-[[(N-MeTHnaMHHo)aL(eTHn]aMHHo]-N-[2Rгидрокси-3-[[(1,3-бензодиоксол-5-ил)сульфонил](2метилпропил)амино]-13-(фенилметил)пропил]-3,3диметилбутанамидом или (2R,3S)-3-(N-MeTnnaMHHoaL(eTHn-L-TpeTбутилглицинил)амино-1-(М-изоамил-М-(третбутилкарбамоил))амино-4-фенил-2-бутанолом 6 Способ по п 1, отличающийся тем, что первый ингибитор ретровирусной протеазы является 4(3)-гидрокси-5-(1-(4-(3-пиридилметил)-2(3)-М'(трет-бутилкарбоксамидо)-пиперазинил))пентанамидом, М-трет-бутилдекагидро-2-[2(Р)-гидрокси-4-фенил3(S)-[[N-(2-XHHonHnKap6oHHn)-LacnaparHHHn]aMHHo]6yTHn]-(4aR,8aS)-H3OXHHonHH3(S)-Kap6oKcaMHflOM, (2S,3R,4S,5S)-2,5-6HC-[N-[N-[N-MeTHn-N-(2пиридинилметил)амино]карбонил]валинил]амино]3,4-дигидрокси-1,6-дифенил гексаном, (2S,3S,5S)-5-[N-[N-[N-MeTHn-N-[(2-H3onponHn-4тиазолил)метил]амино]карбонил]валинил]амино]2-[М-[(5-тиазолил)метоксикарбонил]амино]-3гидрокси-1,6-дифенил гексаном, ЗЗ-тетрагидрофураниловым эфиром [2Rгидрокси-3-[[(4-аминофенил)сульфонил](2метилпропил)амино]-13-(фенилметил)пропил] карбаминовой кислоты, г\І-трет-бутилдекагидро-2-[2^)-гидрокси-4(фенилтио)-3(3)-[М-[(2-метил-3гидpoкcифeнил)кapбoнил]aминo]бyтил]-(4aR,8aS)изохинолин-3(3)-карбоксамидом, [4R-(4 а ,5 а ,6 р ,7 р )]-1,3-бис[(3аминофенил)метил]гексагидро-5,6-дигидрокси-4,7бис(фенилметил)-2Н-1,3-диазепин-2-оном, М-[2^-гидрокси-3-[[(1,3-бензодиоксол-5ил)сульфонил](2-метилпропил)амино]-13 (фенилметил)пропил]-23-[[(пирролидин-1ил)ацетил]амино]-3,3-диметилбутанамидом, N-[2R-rHflpoKCH-3-[(2-MeTHnnponnn) [(1,3 бензодиоксол-5 -ил)сульфонил] амино]-13(фенилметил)пропил]-23-метил-3(метилсульфонил)пропанамидом, [1 S-[1 R*(R*),2S*]]-N-[2-rHflpoKCH-3-[N'-(2метилпропил)-М'-(4метоксифенилсульфонил)амино]-1(фенилметил)пропил]-2-метил-3(метилсульфонил)пропанамидом или (2R,3S)-3-(N-MeTnnaMHHoaL(eTHn-L-TpeTбутилглицинил)амино-1-(М-изоамил-М-(третбутилкарбамоил))амино-4-фенил-2-бутанолом, и второй ингибитор ретровирусной протеазы является 2S-[[(N-MeTnnaMHHo)aL(eTHn]aMHHo]-N-[2Rгидрокси-3-[[(1,3-бензодиоксол-5-ил)сульфонил](2метилпропил)амино]-13-(фенилметил)пропил]-3,3диметилбутанамидом 7 Способ по п 1, отличающийся тем, что первый ингибитор ретровирусной протеазы является г\1-(2^)-гидрокси-1(3)-инданил)-2^)-фенилметил4(3)-гидрокси-5-(1-(4-(3-пиридилметил)-2(3)-г\Г(трет-бутилкарбоксамидо)-пиперазинил))пентанеамидом, а второй ингибитор ретровирусной протеиназы является (2R,3S)-3-(N-MeTnnaMHHoaL(eTHn-L-TpeTбутилглицинил)амино-1-(М-изоамил-М-(третбутилкарбамоил))амино-4-фенил-2-бутанолом, N-[2R-rHflpoKCH-3-[(2-MeTHnnponnn)[(l,3бензодиоксол-5-ил)сульфонил]амино]-ІЗ(фенилметил)пропил]-23-метил-3(метилсульфонил)пропанамидом, [1 S-[1 R*(R*),2S*]]-N-[2-rHflpoKCH-3-[N'-(2метилпропил)-М'-(4метоксифенилсульфонил)амино]-1(фенилметил)пропил]-2-метил-3(метилсульфонил)пропанамидом или 2S-[[(N-MeTnnaMHHo)aL(eTHn]aMHHo]-N-[2Rгидрокси-3-[[(1,3-бензодиоксол-5-ил)сульфонил](2метилпропил)амино]-13-(фенилметил)пропил]-3,3диметилбутанамидом 8 Способ по п 1, отличающийся тем, что первый ингибитор ретровирусной протеазы является (2S,3S,5S)-5-[N-[N-[N-Me™>N-[(2-H3onponmi-4тиазолил)метил]амино]карбонил]валинил]амино]2-[І\І-[(5-тиазолил)метоксикарбонил]амино]-3гидрокси-1,6-дифенил гексаном, а второй ингибитор ретровирусной протеиназы является (2R,3S)-3-(N-MeTnnaMHHoaL(eTHn-L-TpeTбутилглицинил)амино-1-(г\1-изоамил-г\1-(третбутилкарбамоил))амино-4-фенил-2-бутанолом, N-(2R-rHflpoKCH-3-[[(1,3-6eH3OflHOKCon-5ил)сульфонил](2-метилпропил)амино]-13(фенилметил)пропил]-23-[[(пирролидин-1ил)ацетил]амино]-3,3-диметилбутанамидом или 2S-[[(N-MeTnnaMHHo)aL(eTHn]aMHHo]-N-[2Rгидрокси-3-[[(1,3-бензодиоксол-5-ил)сульфонил](2метилпропил)амино]-13-(фенилметил)пропил]-3,3диметилбутанамидом 9 Способ по п 1, отличающийся тем, что пациенту вводят третий ингибитор ретровирусной про 49803 теазы, который эффективен против по меньшей мере одного вирусного штамма, который устойчив как к первому так и ко второму ингибиторам ретровируснои протеазы 10 Способ по п 9, отличающийся тем, что третий ингибитор ретровируснои протеазы является 1\1-(2(Р)-гидрокси-1(3)-инданил)-2(Р)-фенилметил4(3)-гидрокси-5-(1-(4-(3-пиридилметил)-2(3)-г\Г(трет-бутилкарбоксамидо)-пиперазинил))пентанамидом, г\|-трет-бутилдекагидро-2-[2(Р)-гидрокси-4-фенил3(3)-[І\І-(2-хинолилкарбонил)-І_аспарагинил]амино]бутил]-(4аР,8аЗ)-изохинолин3(3)-карбоксамидом, (2S,3R,4S,5S)-2,5-6HC-[N-[N-[[N-MeTHn-N-(2пиридинилметил)амино]карбонил]валинил]амино]3,4-дигидрокси-1,6-дифенил гексаном, (2S,3S,5S)-5-[N-[N-[N-MeTHn-N-[(2-H3onponnn-4тиазолил)метил]амино]карбонил]валинил]амино]2-[І\І-[(5-тиазолил)метоксикарбонил]амино]-3гидрокси-1,6-дифенил гексаном, ЗЗ-тетрагидрофураниловым эфиром [2Rгидрокси-3-[[(4-аминофенил)сульфонил](2метилпропил)амино]-13-(фенилметил)пропил] карбаминовой кислоты, г\|-трет-бутилдекагидро-2-[2(Р)-гидрокси-4(фенилтио)-3(3)-[[1\1-[(2-метил-3гидроксифенил)карбонил]амино]бутил]-(4аР,8аЗ)изохинолин-3 (З)-карбоксамидом, [4R-(4 а ,5 а ,6 р ,7 р )]-1,3-бис[(3аминофенил)метил]гексагидро-5,6-дигидрокси-4,7бис(фенилметил)-2Н-1,3-диазепин-2-оном, М-[2Р-гидрокси-3-[[(1,3-бензодиоксол-5ил)сульфонил](2-метилпропил)амино]-13(фенилметил)пропил]-23-[[(пирролидин-1ил)ацетил]амино]-3,3-диметилбутанамидом, М-[2Р-гидрокси-3-[(2-метилпропил)[(1,3бензодиоксол-5-ил)сульфонил]амино]-13(фенилметил)пропил]-23-метил-3(метилсульфонил)пропанамидом, [1 S-[1 R*(R*),2S*]]-N-[2-rHflpoKCH-3-[N'-(2метилпропил)-І\Г-(4метоксифенилсульфонил)амино]-1(фенилметил)пропил]-2-метил-3(метилсульфонил)пропанамидом, 23-[[(М-метиламино)ацетил]амино]-М-[2Ргидрокси-3-[[(1,3-бензодиоксол-5-ил)сульфонил](2метилпропил)амино]-13-(фенилметил)пропил]-3,3диметилбутанамидом или (2R,3S)-3-(N-MeTnnaMHHoaL(eTHn-L-TpeTбутилглицинил)амино-1-(г\1-изоамил-г\1-(третбутилкарбамоил))амино-4-фенил-2-бутанолом Настоящее изобретение относится к способам лечения заболеваний млекопитающих, вызванных ретровирусными инфекциями, например, вирусного иммунодефицита человека (ВИЧ), характеризующихся использованием комбинаций ингибиторов ретровируснои протеазы, которые обладают эффективной способностью предотвращать реп 11 Способ по п 1, отличающийся тем, что по крайней мере один вирусный штамм устойчив к этому первому ингибитору ретровируснои протеазы, и по меньшей мере один вирусный штамм устойчив к этому второму ингибитору ретровируснои протеазы, каждый из которых продуцирует ретровирусные протеазы, имеющие по меньшей мере одно аминокислотное замещение в пептидной последовательности протеазы, где это замещение влияет на ту же самую область сайта связывания субстрата протеазы и содействует наблюдаемой устойчивости к ингибитору 12 Способ по п 1, отличающийся тем, что включает также введение по меньшей мере одного противовирусного средства, отличного от ингибитора протеазы 13 Способ по п 12, отличающийся тем, что противовирусное средство является аналогом нуклеозида, ненуклеозидным ингибитором обратной транскриптазы, антагонистом tat (тирозинаминотрансферазы) или ингибитором гликозидазы 14 Способ по п 13, отличающийся тем, что аналог нуклеозида выбирают AZY, DDI, DDC, ЗТС, D4T или РМЕА и этот ингибитор гликозидазы является кастаноспермином или N-бутил-ідеоксиножирмицином 15 Способ по п 1, отличающийся тем, что млекопитающее является человеком, обезьяной или кошкой 16 Способ по п 1, отличающийся тем, что ретровирус является ВИЧ или HTLV 17 Способ по п 16, отличающийся тем, что ретровирус является ВИЧ-1 или ВИЧ-2 18 Способ лечения ретровирусных инфекций у млекопитающего, содержащий a) выбор двух ингибиторов ретровируснои протеазы, где второй выбранный ингибитор ретровируснои протеазы эффективен против по меньшей мере одного ретровирусного штамма, устойчивого к первому ингибитору ретровируснои протеазы и b) введение этому пациенту эффективного количества первого и второго выбранных ингибиторов 19 Способ по п 18, отличающийся тем, что первый и второй ингибиторы вводят так, чтобы в этом пациенте присутствовало эффективное количество обоих ингибиторов 20 Способ по п 1, отличающийся тем, что введение первого и второго ингибиторов чередуют так, чтобы в организме пациента в период времени присутствовало эффективное количество одного ингибитора ликации ретровирусов млекопитающего, подобных ВИЧ, in vivo и in vitro В частности, настоящее изобретение относится к соединениям ингибиторов протеазы, применяемым в комбинированной терапии вместе с другими соединениями ингибиторов протеазы В течение репликационного цикла ретровиру 49803 сов продукты транскрипции гена глюкозаминглюкана и глюкозаминглюкана - полимера (gag and gag - polgene transcription products) реализуются в виде протеинов Протеины последовательно обрабатываются протеазой (или протеиназой), кодированной посредством вируса, с целью получения вирусных ферментов и структурных протеинов сердцевины вируса В большинстве случаев, протеины предшественников глюкозаминглюкана преобразуются в протеины сердцевины (белок сердцевины), а протеины предшественника полимера преобразуются в вирусные ферменты, например в обратную транскриптазу и ретровирусную протеазу Было показано, что корректная обработка протеинов предшественника с помощью ретровирусной протеиназы необходима для получения упорядоченной структуры (сборки) инфекционных вирусов Так, было показано, что мутации со сдвигом рамки в зоне протеазы полимерного гена вируса иммунодефицита человека (ВИЧ) предотвращают образование протеина предшественника глюкозаминоглюкана Посредством сай направленного мутагенеза остатка аспаргиновой кислоты в активном сайте ВИЧ протеазы был также продемонстрировано предотвращение процессинга предшественника глюкозаминоглюкаи Таким образом, были сделаны попытки ингибировать вирусную репликацию путем снижения активности ретровирусных протеаз Обычно ингибирование ретровирусной протеазы вовлекает в паталогический процесс транзицию - состояние, при котором иммитируется процесс, характеризующийся открытостью ретровирусной протеазы воздействию миметического соединения, которое связывает ее (обычно обратимым способом ) до состояния фермента, в конкуренции с протеинами глюкозаминоклюкана и глюкозаминоглюкана - полимера, с целью подавления специфического процессинга структурных протеинов и выделения ретровирусной протеазы как таковой Используя описанный механизм, можно успешно ингибировать репликационные ретровирусные протеазы Было предложено несколько классов миметических соединений, в частности, для ингибирования протеаз, например, для ингибирования ВИЧ протеазы Такие миметические соединения включают изостеры оксиэтиламина, восстановленные изостеры амида и непептидные изостеры Примерами могут служить ЕР 0 346 847, ЕР 0 342 541, Roberts и др " Rational Design of Peptide - Based Protemase Inhibitors (Усовершенствованные схемы ингибиторов протеиназы на основе пептидов )", Science (Наука), 248, 358 (1990), Encson и др "Design Activity, and 2 8 A Crystal Structure of a C2 Symmetric Inhibitor Complexed to HIV -1 Protease (Схематическая активность и 2 8 А кристаллическая структура Сг преобразованная с помощью симметрического ингибитора в ВИЧ - 1 протеазу)", Science (Наука), 249, 527, (1990), и S Thaisnvongs, "Structure - Based Design of Non - Peptide HIV Protease Inhibitors (Структурная схема ингибитора непептидной ВИЧ протеазы)", 35th Annual Buffalo Medicinal Chemistry Meeting, State University of New - York at Buffalo, NY, May 22-25, 1994 (35 - e Годо 8 вое совещание по химико -медицинским проблемам, Государственный Университет, Буффало, штат Нью - Йорк, 22-25 мая 1994г) Проблемой для ингибиторов ретровирусной протеиназы, например ингибиторов ВИЧ протеиназы, является образование штаммов вируса, устойчивых к воздействию ингибитора Например, в соответствии с Merck and Co's, ингибитор L 735,524 ВИЧ протеазы оказывает эффективное воздействие на ВИЧ инфекции в организме человека, в то время как ВИЧ устойчивые штаммы L 735, 524 продолжают прогрессировать в организме больных (Waldholz, The Wall Street Journal, 25 февраля 1994г, стр ВЗ, Condra и др, Nature, 374 569-571 (1995)) Другие примеры могут быть обнаружены в работах Vacca и др , Proc Natl AcadSci USA 91 4096-4100 (1994), Но и др , J Virol 68 2016-2020 (1994),и Sardana и др, Biochem 33 2004-2010(1994) Настоящее изобретение направлено на создание способа лечения заболеваний, вызываемых ретровирусными инфекциями млекопитающих, например вирусом иммунодифицита человека (ВИЧ), путем использования комбинаций ингибиторов ретровирусной протеазы, которые характеризуются способностью предотвращать репликацию in vivo или in vitro Данное изобретение, в частности, относится к соединениям ингибиторов протеазы, применяемым в комбинированной терапии вместе с другими соединениями ингибиторов протеазы Кроме того, данная комбинация может быть также использована в сочетании с другими антивирусными агентами Ретровирусная протеаза представляет собой фермент, имеющий решающее значение для ретровирусного репликационного процесса Размножение ретровирусов, подобных ВИЧ, может блокироваться, благодаря появлению возможности воздействия на вирус со стороны ингибитора ретровирусной протеазы Однако, при длительной открытости ретровирусов воздействию ингибитора протеазы процесс отбора вариантных ретровирусов может получить такое развитие, которое приведет к появлению нового доминирующего штамма ретровируса, устойчивого к ингибитору протеазы Новый доминирующий штамм ретровируса может создать такую протеазу, которая больше не сможет быть ингибирована, или, что встречается чаще, в недостаточной степени сможет выть ингибирована ингибитором протеазы Она получит возможность свободного размножения даже в присутствии ингибитора протеазы до тех пор, пока концентрация ингибитора в значительной степени не возрастет Настоящее изобретение предлагает способ предотвращения возникновения ретровирусных штаммов, обладающих устойчивостью к воздействию ингибитора ретровирусной протеазы Данный способ предназначен для лечения млекопитающих, например человека, обезьяны, кошачьих и т п путем назначения эффективного количества, по меньшей мере, двух ингибиторов ретровирусной протеазы Лечение может быть осуществлено совместным воздействием, по крайней мере, двух ингибиторов ретровирусной 49803 протеазы, то есть таким назначением двух или более ингибиторов ретровирусной протеазы, при котором эффективное количество, по крайней мере, двух ингибиторов поступает в организм млекопитающего за один прием В качестве альтернативного варианта, лечение может быть совершено непрерывным или попеременным воздействием, по крайней мере, двух ингибиторов ретровирусной протеазы, то есть, таким назначением двух или более ингибиторов ретровирусной протеазы, при котором эффективное количество только одного ингибитора поступает в организм млекопитающего за один прием При надлежащем отборе ингибиторов ретровирусной протеазы данный способ может обеспечить эффективный контроль размножения ретровирусов даже в присутствии штаммов, устойчивых к воздействию любого из данных ингибиторов Ингибиторы ретровирусной протеазы отбираются, в зависимости от профиля (характеристик) устойчивых штаммов ретровирусов, который проявляется in vivo или in vitro под воздействием ингибитора на размножающуюся культуру ретровирусов Ингибиторы ретровирусной протеазы отбираются на отсутствие перекрестной устойчивости, по меньшей мере, одним ретровирусным устойчивым штаммом Ретровирусный штамм считается перекрестно-устойчивым воздействию двух ингибиторов протеиназы в том случае, если ретровирусный штамм устойчив воздействию обоих ингибиторов В том случае, когда перекрестная устойчивость может допускаться лишь с оговорками, есть основания для утверждения, что никакой перекрестной устойчивости не существует между отобранными ингибиторами ретровирусной протеазы, если они рассматриваются как одна группа Таким образом, вариант (или штамм-мутант) ретровируса, который возникает в результате воздействия первичного ингибитора ретровирусной протеазы, может все еще ингибироваться (подавляться) вторичным ингибитором ретровирусноц протеазы, а также вариант, который возникает в результате воздействия как первичного, так и вторичного ингибиторов ретровирусной протеазы, может все еще ингибироваться третичным ингибитором ретровирусной протеазы или четвертичным ингибитором ретровирусной протеазы и так далее Проводится сравнение профилей (характеристик) перекрестной устойчивости различных ингибиторов протеаз и отбираются соединения для комбинированной терапии, которые, предпочтительно, характеризуются незначительной перекрестной устойчивостью или лишены ее вообще Фенотип устойчивости к воздействию лекарственного средства может быть подразделен на следующие уровни отсутствие какой бы-то ни было устойчивости, низкий уровень устойчивости (менее 10 сдвигов складок в ECso или ЕСдо), средний уровень устойчивости (примерно от 10 до 100 сдвигов складок в ECso или ЕСдо) или высокий уровень устойчивости (более 100 сдвигов складок в ЕС50 или ЕСдо) Существует предположение, что устойчивость к лекарственным средствам должна быть связана со снижением степени воздействия на вирусный груз пациента, когда достигаемая in 10 vivo концентрация ингибитора имеет пониженную способность подавления протеазы, то есть когда речь идет об устойчивом вирусе Таким образом, наиболее предпочтительными комбинациями ингибиторов протеазы могут считаться такие, которые проявляют минимум профилей (характеристик) перекрестной устойчивости (то есть, предпочтительно, не более, чем для среднего уровня устойчивости, более предпочтительно - не более, чем для низкого уровня устойчивости, и наиболее предпочтительным вариантом является полное отсутствие устойчивости), и максимум присущей им способности воздействовать на вирусы "дикого типа" и/или вирусы, отобранные в качестве устойчивых к другим ингибиторам Например, предпочтительные соединения, выбранные для использования в сочетании с первичным соединением должны быть предпочтительными с точки зрения их эффективного воздействия на штаммы вируса, которые занимают промежуточный уровень, более предпочтительными - высокий уровень устойчивости к первичному соединению Фармакологические и токсикологические характеристики каждого ингибитора и каждой комбинации также являются факторами, принимаемыми во внимание при отборе ингибиторов для комбинированной терапии Более предпочтительным вариантом выбора ингибиторов ретровирусной протеазы является ситуация, когда, по крайней мере, один вирусный штамм, устойчивый к первичному ингибитору ретровирусной протеазы, и, по крайней мере, один вирусный штамм, устойчивый ко вторичному ингибитору ретровирусной протеазы, имеют различные аминокислотные замещения в пептидной последовательности протеазы, которые воздействуют на одну и ту же зону сайта связывания субстрата протеазы и способствуют устойчивости к ингибитору Таким образом, число возможных замещений аминокислот, которые могут произойти в одном и том же сайте в протеазе, ограничено В этой связи следует подчеркнуть, что сайт имеет решающее значение для определения активности, эффективности и/или стабильности фермента Этот момент был исследован в отношении ингибиторов ВИЧ протеазы примеров 1 и 2 Ретровирусная устойчивость комбинации по примеру 1 является результатом сайт - мутации в аминокислоте 88 ВИЧ протеазы (замещение аспаргина 88 с помощью аспаргиновой кислоты 88) Ретровирусная устойчивость к соединению по примеру 2 также является результатом сайт - мутации аминокислоты 88 ВИЧ протеазы (замещение аспаргина 88 с помощью серина 88) Как известно, некоторые замещения в аминокислоте 88 вызывают потерю активности фермента (Loeb и др Каидге(Природа)340 387-400 (1989)) Таким образом, назначение обоих ингибиторов ВИЧ протеазы по примерам 1 и 2 значительно снижает правдоподобие продолжающегося возникновения устойчивых штаммов вирусов с перекрестной устойчивостью к воздействию обоих ингибиторов Через 6 недель после начала лечения устойчивости к обоим ингибиторам, использованным в комбинации, не было 11 49803 обнаружено, по сравнению с фактом возникновения фенотипа, устойчивого к одиночному ингибитору, в рамках того же самого временного периода В дополнение к сайт - мутациям, которые оказывают влияние на активность фермента, в том же самом варианте могут появляться другие сайт - мутации, которые не оказывают существенного влияния на активность и/или устойчивость фермента В качестве альтернативного, более предпочтительного, примера осуществления может служить следующее ингибиторы ретровирусной протеазы отбираются втом случае, когда, по крайней мере, один вирусный штамм, устойчивый к первичному ингибитору ретровирусной протеазы, имеет возросшую чувствительность к так называемому вторичному ингибитору протеазы, или когда, по крайней мере, один вирусный штамм, устойчивый к вторичному ингибитору ретровирусной протеазы, имеет возросшую чувствительность к так называемому первичному ингибитору протеазы Перечень характерных ингибиторов ретровирусной протеазы, которые пригодны для использования при осуществлении настоящего изобретения, включает, но не ограничивается представленными рамками, следующие ингибиторы протеазы, раскрытые и описанные в патентных заявках, находящихся в процессе одновременного рассмотрения, и совладельцами которых являются США NN 08/152,934(подана 15 ноября 1993г), 08/253,53Цподана 3 июня 1994г), 08/109,787 (подана 20 августа 1993г), 08/110,911 (подана 24 августа 1993г), 08/110,913 (подана 24 августа 1993г), 08/110,912 (подана 24 августа 1993г), 08/204,827 (подана 2 марта 1994г), 07/886,556 (подана 20 мая 1992г), 07/886,663 (подана 20 мая 1992г), 07/886,531 (подана 20 мая 1992г), 08/148,817 (подана 8 ноября 1993г), 08/886,700 (подана 21 мая 1992г) и 07/998,187 (подана 29 декабря 1992г), а также патентные заявки РСТ NN PCT/US93/10552 (подана 29 октября 1993г), PCT/US93/10460 (подана 29 октября 1993г), PCT/US93/10461 (подана 29 октября 1993г) Каждый из них включен в описание изобретения путем ссылки на соответствующий источник во всей его полноте Перечень дополнительных ингибиторов ретровирусной протеазы, пригодных для использования при осуществлении настоящего способа, включает, но не ограничивается представленными рамками, следующие ингибиторы протеазы, раскрытые и описанные в патенте US 5,157,041, в европейском патенте ЕР 346,847, патентной заявке US No 07/883,825 (подана 15 мая 1992 г), WO 93/09096, Tet Lett 35 673-676 (1994), Proc Natl Acad Sei USA, 91 4096-4100 (1994), YN Wong и др , Biopharm and Drug Dispos 15 535-544 (1994), M L West and D P Fairhe, Trends Pharmacol Sei 16 67-75 (1995), S Traisnvongs, " HIV Protease Inhibitors (Ингибиторы ВИЧ протеазы)", Ann Reports Med Chem , том 29, статья 14, стр 133-144 (1994) 12 (Academic Press, J Bristol,Ed) Каждый из них включен в описание изобретения путем ссылки на соответствующий источник во всей его полноте Не прибегая к дальнейшему подробному описанию, выражаем уверенность в том, что любой специалист, обладающий достаточной квалификацией и уровнем знаний в рассматриваемой области, сможет, используя приведенное выше описание, применить настоящее изобретение в полном его объеме Предлагая следующие предпочтительные специфические примеры осуществления, авторы не намереваются дать исчерпывающее описание всех возможных комбинаций соединений, а только лишь показывают примеры комбинаций лекарственных средств, которые они имеют полное основание считать эффективными Подобные испытания этих и других ингибиторов протеазы с использованием устойчивых вирусных изолятов, число которых не ограничивается приведенным ниже перечнем, может помочь идентифицировать соответствующие комбинации лекарственных средств Поэтому приведенные ниже предпочтительные специфические примеры осуществления должны восприниматься как наиболее выразительные и иллюстративные, но ни в коей мере не ограничивающие и не замыкающие на себе смысл настоящего изобретения ПРИМЕР 1 [1 S-[1 R*(R*), 2S*]]-N1 -[3-[[[(1,1 диметилэтил)амино]карбонил])2метилпропил)амино]-2-гидрокси-1(фенилметил)пропил]-2-[(2кинолинилкарбонил)амино]-бутанедиамид может быть приготовлен в соответствии со способами, раскрытыми в находящихся в процессе одновременного рассмотрения патентных заявках, совладельцем которых является США NN08/152,934 (подана 15 ноября 1993г) и 08/156,498 (подана 23 ноября 1993г) Обе заявки США включены в описание изобретения путем ссылки на соответствующий источник во всей его полноте 49803 13 14 A 1 [1 Ы-[1 R*(R*),2S*]] -[2-rnflpoKCH-3-N -(2метилпропил)-^-(4метоксифенилсульфонил)амино]-1(фенилметил)пропил]-2-метил-3(метилсульфонил)пропанамид может быть приготовлен в соответствии со способамим, раскрытыми в находящихся в процессе одновременного рассмотрения патентных заявках, совладельцем которых является США NN08/110,913 (подана24 августа 1993г) и 08/156,498 (подана 23 ноября 1993г) Обе заявки США включены в описание изобретения путем ссылки на соответствующий источник во всей его полноте ПРИМЕР 2 (2Р,33)-3-(ІЧ-метиламиноацетил-І_-тертбутилглицинил)амино-1-(М-изоамил-1\1-(тертбутилкарбамоил))амино-4-фенил-2-бутанол может быть приготовлен в соответствии со способами, раскрытыми в находящихся в процессе одновременного рассмотрения патентных заявках, совладельцем которых является США NN08/109,787 (подана 20 августа 1993г), дело патентного поверенного N 2766/1 - заявка подана совместно с настоящей заявкой-, а также заявка N 08/156,498 (подана 23 ноября 1993г) Все три заявки включены в описание изобретения путем ссылки на соответствующий источник во всей его полноте ПРИМЕРЗ ПРИМЕР 5 N-(2(R)-l~HflpoKCH-1(S)-HHflaHHn)-2(R)фенилметил-4(3)-гидрокси-5-(1-(4-(3пиридилметил)-2(3)-^-(1:-бутилкарбоксамидо)пиперазинил))-пентанеамид (L-735,524) может быть приготовлен в соответствии со способами, раскрытыми в патентной заявке США N 07/883,825 (подана 15 мая 1992г), WO 93/09096,Tet Lett 35 673-676 (1994) и Proc Natl Acad Sci США, 91 4096-4100 (1994) Включены в описание изобретения путем ссылки на соответствующий источник во всей его полноте ОСНз [2Р-гидрокси-3-[[(4метоксифенил)сульфонил](2-метилпропил)амино]13-(фенилметил)пропил] карбаминовой кислоты 5-пиримидилметиловый эфир может быть приготовлен в соответствии со способами, раскрытыми в находящихся в процессе одновременного рассмотрения патентных заявках, совладельцем которых является США NN08/110,911 (подана 24 августа 1993г) и 08/156,498 (подана 23 ноября 1993г) Обе заявки США включены в описание изобретения путем ссылки на соответствующий источник во всей его полноте ПРИМЕР 6 ПРИМЕР 4 ОСНз ^терт-бутилдекагидро-2-[2^)-гидрокси-4фенил-3(3)-[[Н-(2-квинолилкарбонил)-І_acnaparHHHn]aMHHo]6yrHn]-(4aR,8aS)-H3OKBHHonHH3(3)-карбоксамид (Ro 31-8959) может быть приготовлен в соответствии со способами, раскрытыми в патенте США 5,157,041, включенным в описание путем ссылки на соответствующий источник во всей его полноте 15 49803 ПРИМЕР? 16 ПРИМЕР 8 V X [1 S-[1 R*(R*),2S*]]-N1 -[3-[[[(1,1 диметилэтил)амино]карбонил](3метилбутил)амино]-2-гидрокси-1 (фенил метил)проп ил]-2-[(2квинолинилкарбонил)амино]-бутанедиамид может быть приготовлен в соответствии со способами, раскрытыми в находящихся в процессе одновременного рассмотрения патентных заявках, совладельцем которых является США NN 08/152,934(подана 15 ноября 1993г) и 08/156,498 (подана 23 ноября 1993г)0бе заявки США включены в описание изобретения путем ссылки на соответствующий источник во всей его полноте диметилэтил)аминосульфонил]-^-(2метилпропил)амино]-2Р-гидрокси-13(фенилметил)пропил]-23-[(2квинолинилкарбонил)амино]бутанедиамид может быть приготовлен в соответствии со способамим, раскрытыми в находящихся в процессе одновременного рассмотрения патентных заявках, совладельцем которых является США, в патентной заявке PCT/US93/10552 (подана 29 октября 1993г) и в патентной заявке США 08/156,498 (подана 23 ноября 1993г)Обе заявки включены в описание изобретения путем ссылки на соответствующий источник во всей его полноте ПРИМЕР 9 (2S,3R,4S,5S)-2,5-Bnc-[N-[N-[N-MeTHn-N-(2 пиридинилметил)амино]карбонил]валинил]амино3,4-дигидрокси-1,6-дифенилгексан (А-77003) может быть приготовлен в соответствии с методами, раскрытыми в научном журнале J Med Chem 36 320-330 (1993) Включен в описание изобретения путем ссылки на соответствующий источникво всей его полноте ПРИМЕРЮ (2S,3S,5S)-5-[N-[N-[N-Me™>N-[(2-H3onponmi4 тиазолил)метил]амино]карбонил]валинил]амино] 2-[М-[(5-тиазолил)мегоксикарбонил]амино]-3 17 гидрокси-1,6-дифенилгексан(А-84538,АВТ-538) может быть приготовлен в соответствии с методами, раскрытыми в патентной заявке РСТ N WO 94/14436 (подана 16 декабря 1993г) Включено в описание путем ссылки на соответствующий источник во всей его полноте 49803 18 ПРИМЕР 13 ПРИМЕР И O J L [2Р-гидрокси-3-[[(4аминофенил)сульфонил](2-метилпропил)амино]13-(фенилметил)пропил] карбаминовой кислоты ЗЗ-тетрагидрофураниловый эфир (VX-478) может быть приготовлен в соответствии со способами, раскрытыми в патентной заявке РСТ N WO 94/05639 (подана 7 сентября 1993г) Включено в описание изобретения путем ссылки на соответствующий источник во всей его полноте ПРИМЕР 12 г\|-терт-Бутилдекагидро-2-[2(Р)-гидрокси-4(фенилтио)-3(3)-[[1\1-[(2-метил-3гидроксифенил)карбонил]амино]бутил](4аР,8аЗ)-изоквинолин-3(3)-карбоксамид (AG 1343.AG-1450) может быть приготовлен в соответствии со способами, раскрытыми в Bioogr & Med Chem Let 5 715-720, 5 721-726 & 5 727-732 (1995),каждый из которых включен в описание путем ссылки на соответствующий источник во всей его полноте В частности, НОВТ активный эфир З-гидрокси-2-метилбензойной кислоты (Bioogr & Med Chem Let 5 727-732 (1995)) может сопрягаться с N-терт-Бутил декагидро-2-[2(Р)гидрокси-4-(фенилтио)-3(3)-аминобутил](4аР,8аЗ)-изоквинолин-3(3)-карбоксамидом (Bioogr & Med Chem Let 5 715-720 (1995)) [4R-(4a,5a,6p,7p)]-1,3-бис[(3аминофенил)метил]гексагидро-5,6-дигидрокси4,7-бис(фенилметил)-2Н-1,3-диазепин-2одиночный (DMP-450.XM-412) может быть приготовлен в соответствии с методами, раскрытыми в патентной заявке РСТ N WO 93/07128 Включено в описание путем ссылки на соответствующий источник во всей его полноте В частности, 3нитрофенил метиловый гал ид, например, 3нитрофенилметилхлорид или бромид вступает в реакцию с окси-защищенным производным [4R(4а,5а,бр,7р)]-гексагидро-5,6-дигидрокси-4,7бис(фенилметил)-2Н-1,3-диазепин-2-одиночным с последующим снятием защиты оксигрупп (см WO 93/07128) и восстановлением нитрогрупп до аминогрупп Такое восстановление может быть осуществлено с помощью действий, хорошо известных специалистам в этой области ПРИМЕР 14 Приготовление N-[2R-rnflpoKCH-3-[[(1,3бензодиоксол-5-ил)сульфонил](2метилпропил)амино]-13-(фенилметил)пропил]23-[[(пирролидин-1-ил)ацетилламинол-3,3диметилбутанамида Часть А Приготовление 1,3-бензодиоксол-5сульфонил хлорида К раствору 4,25г безводного N,Nдиметилформамида при температуре 0°С в атмосфере азота было добавлено 7,84г хлористого сульфурила, на основании чего формировали твердые частицы продукта После 15 - минутного перемешивания было добавлено 6,45г 1,3бензодиоксола и смесь нагревали при 100°С в течение 2 часов Реакцию проводили при охлаждении ледяной водой, экстракцию выполняли с помощью хлористого метилена, осушали посредством сульфата магния, фильтровали и доводили до определенной концентрации, чтобы получить 7,32г сырого материала в виде смазочного мазута Последний подвергали хроматографической обработке на силикагеле с использованием 20% хлористого метилена/гексана для получения 1,9г (1,3-бензодиоксол-5-ил) сульфонил хлорида (хлористого сульфонила) 19 Существует альтернативный способ, при котором в бутыль с круглым дном объемом 22л, снабженную механической мешалкой, охлаждающим конденсатором, нагревательным устройством и выравнивающей давление капельной воронкой, вливали сложную смесь (DMF) триокисида серы (серного ангидрида) (2778г, 18,1 молей) Затем добавляли дихлорэтан (4л) и начинали перемешивание 1,3 - Бензодиоксол (1905г, 15,6 молей) вводили в течение пяти минут через капельную воронку Температуру поднимали до 75°С и поддерживали на таком уровне в течение 22 часов (Измерительное устройство (NMR ядерный магнитный резонанс) показало, что реакция завершилась через 9 часов) Продукты реакции охлаждали до 26°С, и был добавлен оксалилхлорид (2290г, 18,1 моля) с такой интенсивностью, чтобы поддержать температуру ниже 40°С (в течение 1,5 часа) Смесь подогревали до 67°С в течение 5 часов с последующим охлаждение до 16°С на ледяной бане Реакция была приостановлена с помощью воды (5л) с интенсивностью, обеспечивающей поддержание температуры ниже 20°С После того, как добавление воды было прекращено, смесь перемешивали в течение 10 минут Слои были разделены, и органический слой снова дважды промыли водой (5л) Органический слой высушивали с помощью сульфата магния (500г) и отфильтровывали, с целью отделения осушающего агента Растворитель был удален под вакуумом при 50°С Полученной теплой жидкости дали возможность остыть, и в этот период началось формирование твердых частиц По истечении часа, твердые частицы были промыты гексаном (400мл), отфильтрованы и высушены, с целью получения требуемого хлористого сульфонила (2823г) Промывочную гексановую жидкость концентрировали, и полученные твердые частицы промыли гексаном (400мл) для получения дополнительного количества хлористого сульфонила (464г) Общее количество полученного продукта составило 3287г (95,5% - на основе 1,3бензодиоксола) Часть Б Приготовление 23-[Бис(фенилметил)амино]-3-фенилпропанола Метод 1 23-[Бис(фенилметил)амино]-3фенилпропанол из DIBAL восстановления N,Nбис(фениметил)-І_-Фенилаланин фенил метилового эфира Этап 1 Раствор L-фенилаламина (50,Ог, 0,302мол ), гидроокись натрия (24,2г, 0,605мол ) и карбонат калия (83,6г, 0,605мол) в воде (500мл) нагревали до 97°С Затем медленно добавляли бромистый бензил (108,5мл, 0,605мол), (период времени,в течение которого добавлялся бромистый бензил - 25мин ) Смесь перемешивали при 97°С в атмосфере азота в течение 30 минут Раствор охлаждали до комнатной температуры и экстрагировали с помощью толуола (2х250мл) Комбинированные органические слои промывали водой или рассолом, высушивали посредством сульфата магния, фильтровали и концентрировали до состояния нефти (мазута) г\І,г\І-бис(фениметил)-І_-Фенилаланин фенил ме 49803 20 тиловый эфир может очищаться методом колоночной хроматографии (силикагель, 15% этилацетат/гексан) Обычно продукт получается достаточно чистым,чтобы быть использованным на следующем этапе без дополнительной очистки EIMS m/z434(M-1) Этап 2 Бензилированный фенилаланин фенилметиловый эфир (0,302мол), полученный в результате реакции первого этапа, был растворен в толуоле (750мл) и охлажден до -55°С 1,5 М-раствор DIBALa в толуоле (443,9 мл,0,666 мол) добавляли с такой интенсивностью, чтобы поддержать диапазон температуры в пределах от -55° до -50°С (период времени, израсходованный на процесс добавления - 1 час) Смесь перемешивали в течение 20 минут в атмосфере азота, а затем гасили реакцию при -55°С путем медленного добавления метанола (37мл) Холодный раствор затем был влит в холодный (5°С) раствор 1,5 N HCL (1,8л) Выпавшие в осадок твердые частицы (приблизительно 138г) были отфильтрованы и промыты толуолом Твердый продукт был взвешен в смеси толуола (400мл) и воды (100мл) Смесь охлаждали до 5°С и обрабатывали 2,5 N NaOH (186мл), а затем перемешивали при комнатной температуре до растворения твердых частиц Слой толуола был отделен от водной фазы и промыт водой или расолом, высушен посредством сульфата магния, отфильтрован и концентрирован до объема 75мл (89г) Этилацетат (25мл) и гексан (25мл) были добавлены к остатку, после чего начал кристаллизоваться требуемый спиртопродукт По истечении 30 минут были добавлены дополнительные 50мл гексана, с целью активизации пооиесса дальнейшей кристализации Полученные твердые частицы были отфильтрованы и промыты 50мл гексана для получения 34,9г первой порции продукта Вторая порция продукта (5,6г) была выделена путем повторной фильтрации маточного раствора Обе порции были объединены и рекристаллизованы из этилацетата (20мл) и гексана (30мл), чтобы получить 40г 23-[Бис(фенил-метил)амино]-3фенилпропанола, 40% получено из Lфенилаланина Аналогичный расчет выполнен для C23H25ON С, 83,34, Н, 7,60, N, 4,23 Получено С, 83,43, Н, 7,59, N, 4,22 Метод 2 Приготовление рЗ-2-[Бис(фенилметил)амино]бензин-пропанола из N.N-Дибензиляции L-Фенилаланинола L-фенилаланинол (176,6г, 1,168мол) добавляли к перемешиваемому раствору карбоната калия (484,6г, 3,506мол) в 710мл воды Смесь нагревали до 65°С в атмосфере азота Раствор бромистого бензила (400г, 2,339мол) в ЗА этаноле (305мл) добавляли с интенсивностью, которая обеспечивала поддержание температуры в пределах 6068°С Двухфазный раствор перемешивали при 65°С в течение 55мин , а затем давали ему возможность остыть до 10°С при интенсивном перемешивании Маслянистый продукт отверждался в виде мелких гранул Продукт разбавляли 2,0л водопроводной воды и перемешивали в течение 5 минут для растворения неорганики с помощью 21 продукта Продукт выделяли путем фильтрации при пониженном давлении и промывали водой до тех пор, пока рН не достигал 7 Полученный сырой продукт подвергали рекристаллизации из 1,1л этилацетатаУ/гептана (1 10) Продукт выделяли путем фильтрации ( при -8°С), промывали 1,6л охлажденного (-10°С) этилацетата/гептана (1 10) и высушивали воздухом, с целью получения 339г (88% выхода) 2S[Бис(фенилметил)амино]-3-фенилпропанола, точка плавления Мр=71,5-73,0°С Часть С Приготовление 23-[Бис(фенилметил)амино]-3-фенилпропанальдегида Метод 1 23-[Бис(фенилметил)амино]-3фенилпропанол (200г, 0,604мол )растворяли в триэтиламине (300мл, 2,15мол) Смесь охлаждали до 12°С и добавляли трехокись серы/пиридиновая смесь (380г, 2,39мол) в диметилсульфоксиде (DMSO) (1,6л) с интенсивностью, обеспечивающей поддержание температуры в пределах 8-17°С Раствор перемешивали при температуре окружающей среды в атмосфере азота в течение 1,5 часа Реактивную смесь охлаждали ледяной водой и гасили реакцию 1,6л холодной воды (10-15°С) более 45 минут Полученный раствор экстрагировали с помощью этилацетата (2,0л), промывали 5% лимонной кислотой (2,0л) и рассолом (2,2л), высушивали посредством MgSO4 (280г) и отфильтровывали Растворитель удаляли in vacuo и высушивали в вакууме с получением 198,8г 2S[Бис(фенилметил)амино]-3фенилпропанальдегида в виде бледно-желтой маслянистой жидкости (99,9%) Полученный сырой продукт был достаточно чистым для использования в следующем этапе без дополнительной очистки Метод 2 Раствор оксалилхлорида (8,4мл, 0,096мол) в дихлорометане (240мл) охлаждали до -74°С Затем медленно добавляли раствор диметилсульфоксида (12,0мл, 0,155мол) в дихлорометане (50мл) Интенсивность процесса добавления выбирали таким образом, чтобы поддержать температуру - 74°С (время добавления ~ 1,25 часа) Смесь перемешивали в течение 5 минут с последующим добавлением раствора 23-[Бис(фенилметил)амино]-3-фенилпропанола (0,74мол) в 100мл дихлорометана (время добавления - 20 минут, температура - от -75°С до 68°С) Раствор перемешивали при -78°С в течение 35 минут в атмосфере азота Затем в течение более 10 минут добавляли триэтиламин (41,2мл, 0,295мол ) (при температуре от -78°С до -68°С), при этом выпадала в осадок соль аммония Холодную смесь перемешивали в течение 30 минут, а затем добавляли воду (255мл ) Слой дихлорометана выделяли из водной фазы и промывали водой, рассолом, высушивали в сульфате магния, фильтровали и концентрировали Осадок разбавляли этилацетатом и гексаном, а затем фильтровали, с целью дальнейшего извлечения соли аммония Фильтрат концентрировали для получения 23-[Бис(фенилметил)амино]-3-фенилпропанальдегида Альдегид передавали на следующий этап обработки без 49803 22 дополнительной очистки Метод 3 К смеси из 1,0г (З.Оммол) 2S[Бис(фенилметил)амино]-3-фенилпропанол, 0,531г (4,53ммол ) N-метилморфолина, 2,27г молекулярных сит (4А) и 9,1мл ацетонитрила добавляли 53мг (0,15ммол) перутената тетрапропиламмония (TRAP) Смесь перемешивали в течение 40 минут при комнатной температуре и концентрировали при пониженном давлении Осадок взвешивали в 15мл этилацетата, фильтровали через фильтровальный элемент силикагеля Фильтрат концентрировали при пониженном давлении, с целью получения продукта, содержащего, приблизительно, 50% 2S[Бис(фенилметил)амино]-3-фенилпропанальдегида в виде бледно-желтого маслянистого вещества Метод 4 К раствору 1,0г (3,02ммол) 2S[Бис(фенилметил)амино]-3-фенилпропанола в 9,0мл толуола добавили 4,69мг (О.ОЗммол) 2,2,6,6-тетраметил-1-пиперидинилокси, свободного радикала (TEMPO), 0,32г (3,11 мол) бромистого натрия, 9,0мл этилацетата и 1,5мл воды Смесь охлаждали до 0°С и в течение 25 минут с лишним медленно добавляли 2,87мл водного раствора 5% хозяйственной хлорной извести, содержащей 0,735г (8,75ммол) бикарбоната натрия и 8,53мл воды Смесь перемешивали при 0°С в течение 60 минут Выполняли еще два дополнительных добавления хлорной извести (каждое по 1,44мл) с последующим перемешиванием в течение Юмин Водный слой был дважды экстрагирован 20мл этилацетата Комбинированный органический слой был промыт 4,0мл раствора, содержащего 25мг йодистого калия и воды (4,0мл), 20мл 10% водного раствора тиосульфата натрия, а затем раствором рассола Органический раствор был высушен посредством сульфата магния, отфильтрован и концентрирован при пониженном давлении, с целью получения 1,34г сырого маслянистого продукта, содержащего небольшое количество требуемого альдегида продукта 23-[Бис(фенилметил)амино]-3- фенилпропанальдегида Часть D Приготовление І\І,г\І-дибензил-3(3)амино-1,2-(3)-эпокси-4-фенилбутана Метод 1 Раствор 23-[Бис(фенилметил)амиино]-3-фенилпропанальдегида (191,7г, 0,58мол) и хлороиодометана (56,4мл, 0,77мол) в тетрагидрофуране (1,8л) был охлажден до температуры от -30°С до - 35°С в реакторе из нержавеющей стали в атмосфере азота Затем был добавлен раствор п-бутиллития в гексане (1,6М, 365мл, 0,58мол) с интенсивностью, обеспечивающей поддержание температуры ниже -25°С После этой процедуры смесь перемешивали при температуре от -35°С до -35°С в течение 10 минут Дальнейшие добавления реагентов осуществляли следующим образом (1) Осуществляли дополнительную добавку хлороиодометана (17мл) с последующей добавкой п-бутиллитиума (110мл) при температуре ниже -25°С После добавок раствор перемешивали при температуре от -30°С до -35°С в течение 10 минут Это повторяли еще раз 23 (2) Осуществляли дополнительную добавку хлороиодометана (8,5мл,0,11 мол ) с последующей добавкой п-бутиллитиума (55мл, 0,088мол) при температуре ниже -25°С После добавок раствор перемешивали при температуре от -30°С до -35°С в течение 10 минут Это повторяли 5 раз (3) Осуществляли дополнительную добавку хлороиодометана (8,5мл, 0,11 мол) с последующей добавкой п-бутиллитиума (37мл, 0,059мол) при температуре ниже -25°С После добавок раствор перемешивали при температуре от -30°С до -35С в течение 10 минут Это повторяли еще раз Наружное охлаждение приостанавливали и смесь нагревали до комнатной температуры в течение промежутка времени от 4 до 16 часов, до тех пор, пока TLC (результаты токослойной хроматографии) (силикагель, 20% этилацетата/гексана) не показывали завершение реакции Реактивная смесь была охлаждена до 10°С и погашена 1452г 16% раствора хлористого аммония при поддержании температуры ниже 23°С Смесь перемешивали в течение 10 минут и органический слой отделяли от водного Водная фаза была экстрагирована етилацетатом (2х500мл) Слой этилацетата был объединен со слоем тетрагидрофурана Комбинированный раствор был высушен с помощью сульфата магния (220г), отфильтрован и концентрирован in vacuo Коричневый маслянистый осадок был высушен при 70°С in vacuo ( 0,8бар) в течение 1 часа, в результате чего было получено 222,8г сырого продукта Этот сырой продукт использовали непосредственно для проведения следующего этапа процесса без дополнительной очистки Метод 2 Раствор сырого альдегида (0,074мол) и хлороиодометана (7,0мл, 0,096мол) в тетрагидрофуране (285мл) охлаждали до -78°С ватмосфере азота 1,6М раствор п-бутиллитиума в гексане (25мл, 0,040мол) был добавлен с интенсивностью, обеспечивающей поддержание температуры в районе 75°С После осуществления первой добавки снова было добавлено дополнительное количество хлороиодометана (1,6мл, 0,022мол) с последующим добавлением п-бутиллитиума (23мл, 0,037мол ) при поддержании температуры -75°С Смесь перемешивали в течение 15 минут Каждый из реагентов, хлороиодометан (0,70мл, 0,01 Омол) и пбутиллитиум (5мл, 0,008мол) добавляли еще 4 раза в течение 45мин при-75°С Холодную баню затем удаляли, а раствор подогревали до 22°С в течение 1,5 часа Раствор вливали в 300мл насыщенного водного раствора хлористого аммония Слой тетрагидрофурана отделяли Водную фазу экстрагировали этилацетатом (1х300мл) Комбинированные органические слои промывали рассолом, высушивали в присутствии сульфата магния, отфильтровывали и концентрировали, в результате чего был получен коричневый маслянистый продукт (27,4г) Полученный продукт мог быть использован в следующем этапе без дополнительной очистки Метод 3 Раствор 23-[Бис(фенилметил)амиино]-3-фенилпропанальдегида (178,84г, 0,54мол) и бромохлорометана (46мл, 0,71 мол) в тетра 49803 24 гидрофуране (1,8л) бал охлажден до температуры от -30°С до - 35°С в реакторе из нержавеющей стали в атмосфере азота Затем был добавлен раствор п-бутиллития в гексане (1,6М, 340мл, 0,54мол) с интенсивностью, обеспечивающей поддержание температуры ниже -25°С После этой процедуры смесь перемешивали при температуре от -30°С до - 35°С в течение 10 минут Дальнейшие добавления реагентов осуществляли следующим образом (1) Осуществляли дополнительную добавку бромохлорометана (14мл) с последующей добавкой п-бутиллитиума (102мл) при температуре ниже -25°С После добавок раствор перемешивали при температуре от -30°С до -35°С в течение 10 минут Это повторяли еще раз (2) Осуществляли дополнительную добавку бромхлорометана (7мл, 0,11мол) с последующей добавкой п-бутиллитиума (51мл, 0,082мол) при температуре ниже -25°С После добавок раствор перемешивали при температуре от -30°С до -35°С в течение 10 минут Это повторяли 5 раз (3) Осуществляли дополнительную добавку бромохлорометана (7мл, 0,11мол) с последующей добавкой п-бутиллитиума (51мл, 0,082мол) при температуре ниже -25°С После добавок раствор перемешивали при температуре от -30°С до -35°С в течение 10 минут Это повторяли еще раз Наружное охлаждение приостанавливали и смесь нагревали до температуры окружающей среды в течение промежутка времени от 4 до 16 часов, до тех пор, пока TLC (результаты токослойной хроматографии) (силикагель, 20% этилацетата//гексан а) не показывали завершение реакции Реактивная смесь была охлаждена до 10°С и погашена 145г 16% раствора хлористого аммония при поддержании температуры ниже 23°С Смесь перемешивали в течение 10 минут и органический слой был отделен от водного Водная фаза была экстрагирована этилацетатом (2х500мл) Слой этилацетата был объединен со слоем тетрагидрофурана Комбинированный раствор был высушен с помощью сульфата магния (220г), отфильтрован и концентрирован на ротационном выпарном устройстве при температуре 65°С Коричневый маслянистый осадок был высушен при 70°С in vacuo (0,8бар) в течение 1 часа, в результате чего было получено 222,8г сырого продукта Часть Е Приготовление N-[3(S)-[N,Nбис(фенилметил)амино]-2(Р)-гидрокси-4фенилбутил]-г\І-изобутиламина соли щавелевой кислоты Этап 1 К раствору сырого N.N-дибензил3(3)-амино-1,2(3)-эпокси-4-фенилбутана (388,5г, 1,13мол) в изопропаноле (2,7л) (или этилацетате) добавляли изобутиламин (1,7кгм, 23,1 мол) в течение 2 минут Температура поднималась от 25°С до 30°С Раствор подогревали до 82°С и перемешивали при этой температуре в течение 1,5 часа Теплый раствор концентрировали in vacuo Коричневый маслянистый осадок высушивали in vacuo (0,8мм Hg) в течение 10 часов, в результате чего был получен сырой маслянистый продукт в количестве 450 г 25 Этап 2 К раствору щавелевой кислоты (8,08г, 89,72ммол ) в метаноле (76мл) добавляли раствор сырого [3(3)-[г\1,г\1-бис(фенилметил)амиино]-1-(2-метилпропил)амино-4-фенилбутан-2(Р)ола в етилацетате (90мл) в течение 15 минут Смесь перемешивали при комнатной температуре в течение около 2 часов Твердый продукт был выделен путем фильтрации, промыт этилацетатом (2х20мл) и высушен in vacuo в течение около часа, в результате чего было получено 21,86г 97 % диастереометрически чистой соли Точка плавления Мр=174,99°С, Микроанализы Подсчитано С 71,05%, Н 7,50%, N 5,53%, Получено С 71,71%, Н 7,75%, N 5,39% При альтернативном варианте сырой 3(S)[|\|,г\1-бис(фенилметил)амино]-1-(2этилпропил)амино-4-фенилбутан-2(Р)-ол (5г) растворяли в метил-терт-бутилетеое (эфире) (МТВЕ) (10мл) и добавляли щавелевую кислоту (1г) в метаноле (4мл) Смесь перемешивали в течение 2 часов Полученный твердый продукт отфильтровывали,промывали холодным МТВЕ и высушивали, в результате чего получали около 98,9% диастереометрически чистого продукта (основываясь на пиковых зонах жидкостной хроматографии высокого разрешения (HPLC)) Часть F Приготовление 1-[N-[(1,3бензодиоксол-5-ил)сульфонил]-І\І-(2метилпропил)амино]-3(3)-[г\І,г\Ібис(фенилметшІ)амино]-4-фенил-2(Р)- бутанола К М-[3(3)-[М,М-бис(фенилметил)амино]-2(Р)гидрокси-4-фенилбутил]-г\І-изобутиламин соли щавелевой кислоты (354,7г, 0,7мол) в 1,4диоксина (2000мл) добавляли раствор карбоната калия (241,9г, 1,75мол) в воде (250мл) Смесь перемешивали в течение 2 часов при комнатной температуре с последующим добавлением в течение более 15 минут 1,3-бензодиоксол-5сульфонил хлорида (162,2г, 0,735мол) в 1,4диоксоле (250мл) Реактивную смесь перемешивали при комнатной температуре в течение 18 часов Затем добавляли этилацетат (1000мл) и воду (500мл) с непрерывным перемешиванием в течение еще одного часа Водный слой отделяли, а затем экстрагировали с помощью этилацетата (200мл) Объединенные слои этилацетата промывали 25% раствором рассола (500мл) и высушивали с помощью безводного сульфата магния После фильтрации и промывки сульфата магния этилацетатом (200мл) растворитель удаляли in vacuo, в результате чего получали требуемый сульфонамид в виде желтого пенистого маслянистого продукта (440,2г, 105% выход) Жидкостная хроматография высокого разрешения /МС PLC/MS) (электроразбрызгивание) m/z 601 [М+Н]+) Существует альтернативный способ, при котором М-[3(3)-[г\І,г\І-бис(фенилметил)амино]-2(Р)гидрокси-4-фенилбутил]-г\І-изобутиламин соль щавелевой кислоты (2800г, 5,53мол) и THF (4л) вливали в 22-литровую бутыль с круглым дном, оснащенную механической мешалкой Карбонат калия (1921г, 13,9мол) растворяли в воде (2,8л) и добавляли к суспензии THF Затем смесь перемешивали в течение часа 1,3-бензодиоксол-5 49803 26 сульфонилхлорид (1281г, 5,8мол) растворяли в THF (1,4л) и добавляли к реактивной смеси в течение более 25 минут Дополнительные 200мл THF были использованы для прополаскивания воронки через которую призволились добавки Реактивной смеси дали возможность находиться в состоянии перемешивания в течение 14 часов, а затем добавили воду (4л) Смесь перемешивали в течение 30 минут и затем обеспечивали возможность расслоения Слои отделили, а водный слой дважды промыли с помощью THF (500мл) Комбинированные слои THF высушивали сульфатом магния (500г) в течение одного часа Затем раствор был отфильтрован, с целью удаления осушающего агента и использования его для проведения последующих реакций Часть G Приготовление 1-[1\1-[(1,3-бензодиоксол-5-ил)сульфонил]-І\І-(2метилпропил)амино]-3(3)-амино-4-фенил-2(Р)бутанол Соли метансульфокислоты Сырой 1 -[N-[(1,3-бензодиоксол-5-ил)сульфонил]-І\І-(2-метилпропил)амино]-3(3)бис(фенилметил)амино]-4-фенил-2(Р)-бутанол (6,2г, О.ОЮмол) растворяли в метаноле (40мл) Метан сульфокислоту (0,969г, О.ОЮмол) и воду (5мл) добавляли к этому раствору Смесь была помещали в емкость на 500мл для Parr гидрирования, содержащую 20% Pd(OH)2 на углероде (255мг, 50% содержание воды) Емкость помещали в гидрогенератор и продували 5 раз азотом и 5 раз водородом Реакцию проводили при температуре 35°С, водород подавали под давлением 63 PSI (абсолютное давление в фунтах на квадратный дюйм) в течение 18 часов Затем добавляли дополнительный катализатор (125мг), продували и процесс гидрирования продолжался с учетом дополнительных 20 часов Смесь фильтровали через целит, который промывали метанолом (2х10мл) Приблизительно одну треть метанола удаляли при пониженным давлении Оставшийся метанол отделяли посредством азиотропной дистилляции в присутствии толуола при 80 torr Толуол добавляли порциями 15,10,10 и 10мл Продукт выкристаллизовывался из смеси, отфильтровывался и дважды промывался 10мл -порциями толуола Твердый продукт высушивали при комнатной температуре при 1 torr в течение 6 часов для того, чтобы получить аминовую соль (4,5г, 84%) m/z 421 [М+Н]+ Существует альтернативный способ, при котором к THF раствору сырого 1-[N-[(1,3бензодиоксол-5-ил)сульфонил]-І\І-(2метилпропил)амино]-3(3)бис(фенилметил)амино]-4-фенил-2(Р)-бутанола добавляли воду (500мл), а затем метансульфокислоту (531 г, 5,5мол) Раствор перемешивали дотех пор, пока не убеждались в том, что произошло полное смешение Смесь была помещена в автоклав на 5 галлонов Катализатор Pearlman (200г 20% Pd(OH)2 на С/50% воды) добавляли в автоклав посредством THF (500мл) Реактор продували 4 раза азотом и 4 раза водородом Реактор заполняли водородом под давлением 60 psig (избыточное давление в фунтах на квадратный дюйм) и осуществляли переме 27 шивание со стартовой скоростью 450об/мин По истечении 16 часов, анализ HPLC указал на присутствие небольшого количества промежуточного монобензила Затем добавляли дополнительный катализатор (50г) и обеспечивали (быстрое, в течение ночи) протекание реакции Смесь фильтровали через целит (500г), чтобы отделить катализатор, и затем концентрировали в вакууме в виде пяти порций К каждой порции добавляли толуол (500 мл) и удаляли под вакуумом в азеотропным способом выделенную остаточную воду Полученный твердый продукт подразделяли натри порции и каждую из них промывали метил t-бутиловым эфиром (2л), а затем отфильтровывали Оставшийся растворитель выделяли при комнатной температуре в вакуумной печи при мене,чем 1 torr, с целью получения 2714г требуемой соли Часть Н Приготовление ІЧ-[2Р-гидрокси-3[[(1,3-бензодиоксол-5-ил)сульфонил](2метилпропил)амино]-13-(фенилметил)пропил]23-[(фенилметоксикарбонил) амино]-3,3диметилбутанамида К раствору 118,8г (0,776мол) Nгидроксибензотриазола и 137,1 г (0,52мол) Nкарбобензилоксикарбонил-І_-терт-лейцина в 750мл безводного DMF при температуре 0°С в атмосфере азота было добавлено 109,1 г (0,57мол) EDC После перемешивания при 0°С в течение 2 часов добавляли раствор 273г (0,53мол) 2Р-гидрокси-3-[[(1,3-бензодиоксол-5ил)сульфонил](2-метилпропил)амино]-13(фенилметил)пропиламинметанесульфоната в 250мл безводного DMF, предварительно нейтрализованный 228мл (21 Ог, 2,08мол) 4метилморфолина После перемешивания при 0°С в течение 30 минут смесь перемешивали при комнатной температуре в течение 18 часов Растворители удаляли при пониженном давлении и при температуре 45°С, добавляли 1,5л этилацетата, выполняли промывку 5% лимонной кислотой, насыщенным бикарбонатом натрия, рассолом, высушивали посредством безводного сульфата магния, отфильтровывали и концентрировали до получения 400г сырого материала Полученный продукт подвергли хроматографическому анализу, разделив на 3 группы, приготовив 2000 хроматограмм на силикагеле с использованием 20%-50% этилацетата/ /гексана в качестве элюента для выделения 320г очищенного продукта, m/e=674(M+l_i), 98% посредством HPLC Часть I Приготовление ІЧ-[2Р-гидрокси-3[[(1,3-бензодиоксол-5-ил)сульфонил](2метилпропил)амино]-13-(фенилметил)пропил]23-амино-3,3-диметилбутанамида Раствор 312г N-[2R-mflpoKCH-3-[[(1,3бензодиоксол-5-ил)сульфонил](2метилпропил)амино]-13-(фенилметил)пропил]23-[(фенилметоксикарбонил)амино]-3,3диметилбутанамида в 1л тетрагидрофурана подвергался гидрированию водородом при избыточным давлением 60 psig в течение 6 часов при комнатной температуре в присутствии ЮОг катализатора, в качестве которого выбран 4% палла 49803 28 дий - на- углероде Катализатор удаляли путем фильтрации, а растворители отделяли при пониженном давлении, с целью получения 240г требуемого соединения Часть J Приготовление ІЧ-[2Р-гидрокси-3[[(1,3-бензодиоксол-5-ил)сульфонил](2метилпропил)амино]-13-(фенилметил)пропил]23-[(хлороацетил)амино]-3,3диметилбутанамида К раствору 234,3г (0,439мол ) N-^R-гидрокси3-[[(1,3-бензодиоксол-5-ил)сульфонил](2метилпропил)амино]-13-(фенилметил)пропил]23-амино-3,3-диметилбутанамида в 1л метиленхлорида было добавлено 80мл (59,5г, 0,46мол) дизопропилетиламина с последующим медленным добавлением при комнатной температуре 78,8г (0,46мол ) ангидрида хлороуксусной кислоты при поддержании температуры ниже 36°С После перемешивания в течение дополнительного часа хроматографические анализы HPLC указали на присутствие небольшого количества исходного материала и после этого еще добавляли 1,5г ангидрида хлороуксусной кислоты По истечение 10 минут, растворители были удалены при пониженном давлении, добавлен 1л этилацетата, выполнена промывка 5% лимонной кислотой, насыщенным бикарбонатом натрия, рассолом, высушены посредством безводного сульфата магния, отфильтрованы и концентрированы до получения 314г сырого материала Полученный продукт подвергали хроматографическому анализу, разделив на 3 группы, приготовив 2000 хроматограмм на силикагеле с использованием 20%-50% этилацетата/гексана для получения 165г требуемого продукта, m/e=616(M+l_i), 98% посредством HPLC Часть К Приготовление ІЧ-[2Р-гидрокси-3[[(1,3-бензодиоксол-5-ил)сульфонил](2метилпропил)амино]-13-(фенилметил)пропил]23-[(пирролидин-1-ил)ацетил]амино]-3,3диметилбутанамида К 164,2г (0,27мол) Ы-[2Р-гидрокси-3-[[(1,3бензодиоксол-5-ил)сульфонил](2метилпропил)амино]-13-(фенилметил)пропил]23-[([хлорацетил)амино]-3,3-диметилбутанамида было добавлено 500мл тетрагидрофурана Растворитель удаляли при пониженном давлении, с целью полного извлечения этилацетата,а затем было добавлено 350мл тетрагидрофурана К этому раствору при температуре 10°С было добавлено 130мл (1,56мол) пирролидина По истечении 1 часа, растворители были удалены при пониженном давлении, добавлен 1л этилацетата, выполнена промывка насыщенным бикарбонатом натрия, рассолом, осушка посредством безводного сульфата магния, фильтрация и концентрация до получения 185 г сырого продукта, который подвергали хроматографическому анализу HPLC, с целью получения 98,8% чистоты Полученный продукт был разделен на 3 группы и подвергнут хроматографическому анализу, с приготовлением 2000 хроматограмм,с использованием первой порции 50% этилацетата/гексана и последующей обработкой 5% метанол/эти л ацетатом для получения 160г чистого 29 продуїсга (99% методом HPLC) Затем этот продую" подвергли рекристаллизации из 460мл диэтилового эфира и 70мл гексана, с целью получения 121 г требуемого родукта (более 99% методом HPLC), m/e=651(M+Li), mp=112-114°C ПРИМЕР 15 СНЭ S /Д 0 0 V = СН3 Н Приготовление N-[2R-rnflpoKCH-3-[(2метилпропил)[1,3-бензодиоксол-5ил)сульфонил]амино]-13-(фенилметил)пропил]23-метил-3-(метилсульфанол)пропанамида Часть А Приготовление 2(3)-метил-3(метилсульфонил) пропионовой кислоты Этап 1 К раствору 200г (1,23мол) D-(-)-3ацетил-Ь-меркаптоизомасляной кислоты в 1,0л метанола добавляли 161,Ог (2,47мол) гидроокиси калия, растворенные в 500мл метанола при поддержании температуры ниже 10°С , благодаря охлаждению на ледяной бане После перемешивания, в течение дополнительных 20 минут, добавляли 117мл (156г, 1,23мол) диметилсульфата при поддержании температуры ниже 20°С Ледяную баню удаляли, а смесь перемешивали в течение дополнительных 60 минут Соли удаляли путем фильтрации, растворители выделяли при пониженном давлении и добавляли этилацетат После отделения водного слоя он был подкислен концентрированной хлористоводородной кислотой, экстрагирован этилацетатом, высушен безводным сульфатом магния, отфильтрован и концентрирован до получения 164г (99%) требуемого продукта 2(3)-метил-3(метилтио)пропионовой кислоты, т/е=133(М-Н) Этап 2 К раствору 10,0г (74,6ммол) 2(S)метил-З-(метилтио) пропионовой кислоты в 150мл ацетона и 30мл воды, охлажденному до 18°С на ледяной бане, было добавлено 161,8г (263ммол ) оксона После того, как была добавлена почти половина материала, температура поднималась до 24°С В этот момент процесс добавления прекращали, температуру снижали до 18°С, а затем процесс добавления снова возобновляли После перемешивания в течение 15 минут при температуре 15-20°С баню удаляли и перемешивание реактивной смеси продолжали при комнатной температуре в течение часа Твердый продукт отфильтровывали и промывали ацетоном, фильтрат концентрировали, приблизительно, до объема 40мл, а осадок растворяли в 200мл этилацетата Слой этилацетата высушивали безводным сульфатом магния, отфильтровывали и концентрировали, с целью получения 11,4г маслянистого продукта Он был растворен в минимальном количестве этилацетата, был добавлен гексан, чтобы вызвать формирование 49803 ЗО осадка Последний был собран, с целью получения 6,95г требуемого продукта, т/е=167(М+Н) Часть В Приготовление І\І-[2Р-гидрокси-3-[(2метилпропил)[(1,3-бензодиоксол-5ил)сульфонил]амино]-13-(фенилметил)пропил]23-метил-3-(метилсульфонил)пропанамида К раствору 5,0г (ЗОммол) 2(3)-метил-3(метилсульфонил)пропионовой кислоты и 6,90г (45ммол) N-гидроксибензотриазола в 30мл безводного DMF при 0°С в атмосфере азота было добавлено 6, 34г (ЗЗммол) EDC По истечении приблизительно 10 минут, EDC весь расворялся По истечении 60 минут, при 0°С был добавлен раствор 15,5г (ЗОммол) 2Р-гидрокси-3-[[(1,3бензодиоксол-5-ил)сульфонил](2метилпропил)амино]-13(фенилметил)пропиламинметанесульфоната в 30мл безводного DMF после предварительной нейтрализации 3,4мл (31,6ммол) 4метилморфолина По истечении 3 часов при 0°С, смесь интенсивно перемешивали в течение 17 часов DMF удаляли при пониженном давлении, добавляли этилацетат, промывали 5% лимонной кислотой, насыщенным бикарбонатом натрия, водой, рассолом, высушивали безводным сульфатом магния, отфильтровывали и концентрировали для получения 16г сырого продукта, который методом хроматографии (HPLC) очищали до достижения 88% степени чистоты Затем продукт подвергали хроматографии на силикагеле с использованием 20%-80% этилацетата/гексана для получения чистого продукта, который получали методом рекристаллизации из этилацетата/гексана, сцелью получения 8,84г чистого продукта, мр 131,8-133,8°С (точка плавления) Существует альтернативный способ, при котором к раствору 35,Ог (211 ммол) 2(3)-метил-3(метилсульфонил) пропионовой кислоты и 48,Зг (315ммол ) N-гидроксибензотриазола в 210мл безводного DMF при 0°С в атмосфере азота было добавлено 44,4г (231 ммол) EDC По истечении приблизительно 30 минут, EDC весь расворялся По истечении дополнительных 60 минут, при 0°С был добавлен раствор 108,8г (211 ммол ) 2Р-гидрокси-3-[[(1,3-бензодиоксол-5ил)сульфонил](2-метилпропил)амино]-13(фенилметил)пропиламинметанесульфоната в 350мл безводного DMF, после предварительной нейтрализации 24мл (22,Зг) 4-метилморфолина По истечении 2 часов при 0°С интенсивно перемешивали в течение 18 часов DMF удаляли при пониженном давлении, добавляли 1л этилацетата, промывали 5% лимонной кислотой, насыщенным бикарбонатом натрия, водой, рассолом, высушивали безводным сульфатом магния, отфильтровывали и концентрировали, с целью получения 120,4г сырого продукта, который методом хроматографии (HPLC) очищали до достижения 90% степени чистоты Полученный продукт дважды подвергали кристаллизации из 7501000мл абсолютного этанола для получения 82,6г требуемого продукта 31 ПРИМЕР 16 CHi Приготовление 23-[[(г\І-метиламино)ацетил]амино]-М-[2Р-гидрокси-3-[[(1,3-бензодиоксол5-ил)сульфонил](2-метилпропил)амино]-1Э(фенилметил)пропил]-3,3- диметилбутанамида К 6,55г (10,7ммол) N-[2R-rHflpoKCH-3-[[(1,3бензодиоксол-5-ил)сульфонил](2метилпропил)амино]-1Э-(фенилметил)пропил]23-[(хлороацетил)амино]-3,3-диметилбутанамида добавляли 25мл тетрагидрофурана Растворитель удаляли при пониженном давлении,с целью полного извлечения этилацетата, затем добавляли 25мл тетрагидрофурана, К этому раствору было добавлено 19мл (214ммол) 40% водного раствора метиламина при температуре 10°С По истечении 2 часов, растворители удаляли при пониженном давлении, добавляли 1л этилацетата, производили промывку насыщенным бикарбонатом натрия, рассолом, сушку безводным сульфатом магния, фильтрацию и концентрацию, для получения 6,0г продукта (с 98% чистотой) Пример 17 Соединения ингибиторов ретровирусной протеазы по настоящему изобретению являются эффективными ингибиторами ВИЧ протеазы Ферментные испытания, описанные ниже, могут быть применены с целью отбора ингибиторов ретровирусной протеазы для использования в комбинированной терапии С использованием данного способа для таких соединений может быть рассчитана величина значения IC50 (концентрации, при которой соединение ингибитора снижает активность на 50%) Ферментный способ представляет собой следующее В качестве субстрата выбирают 2aMHHo6eH3OHn-lle-Nle-Phe(p-NO2)-Gln-ArgNH2 Позитивный контроль осуществляется с помощью операционной системы MVT-101 (системы мультипрограммирования с переменным числом задач) (Miller и др , Science (Наука), 246,1149 (1989)) В качестве буфера при испытаниях используют 20мМ сульфата натрия, рН 6,4, 20% глицерола, 1мМ EDTA (этилендиаминтатра уксусная кислота (ЭДТК)), 1мМ DTT (дитиотреитол) и 0,1% CHAPS Затем субстрат растворяют в DMSO (диметилсульфоксиде), разбавляют 10 складок в буфере, использованном в испытаниях Окончательную концентрацию субстрата, участвующего в исследованиях, доводят, приблизительно, до 80цМ ВИЧ протеазу растворяют буфере, использованном при проведении исследований, с целью получения окончательной кон 49803 32 центрации ферментов, равной, приблизительно, 12,3 наномоляра (nanomolar) на основании молекулярного веса 10,870 Окончательная концентрация DMSO составляет около 14%, а окончательная концентрация глицерола составляет около 18% Участвующее в исследовании соединение растворяют в DMSO и разбавляют в DMSO до десятикратной (10х) тестовой концентрации, Юшп субстрата Усиление флуоресценции отмечают в 4 временных точках (0,8,16,24мин) при температуре окружающей среды Каждое исследование проводят в удвоенных (сдвоенных) лунках Пример 18 Эффективность выбранных соединений ингибиторов ВИЧ протеазы по настоящему изобретению может быть определена путем использования описанного выше ферментного исследования с последующим тестированием CD4+ клеточной линии Антивирусные активные состояния ингибиторов протеазы проявляются при значениях эффективной концентрации 50 (ЕС50) и/или эффективной концентрации 90 (ЕСдо) Названные выше концентрации представляют собой такие концентрации ингибиторов, которые были необходимы для ингибирования вирусной репликации до 50% или 90%, соответственно Способ исследования процесса ВИЧ ингибирования, проведенных на реально инициированных клетках, представляет собой автоматизированный тетразолиум (tetrazohum) на основе только колорометрического анализа, представленного в работе Pauwels и др , J Virol Methods 20,309-321 (1988) Испытания проводились на 96 - луночных планшетах для культуры ткани Клеточная линия CD4+,например СЕМ, МТ-2, МТ-4 или другая подобная клеточная линия, выращивается в RPMI -1640 среде (Gibco), к которой добавлена 10% фетальная телячья сыворотка, а затем обрабатывается полибреном (polybrene) (2цг/мл) 80цшп объема среды, содержащей 1 х 104 клеток, распределяли в каждую из лунок планшета для культуры ткани В каждую лунку добавляли ЮОшп объема исследуемого соединения, растворенного в среде культуры ткани (или среде без исследуемого соединения, взятой в качестве контрольной), чтобы получить окончательную концентрацию и создать условия для инкубации клеток при 37°С в течение 1 часа Замороженную ВИЧ культуру разбавляют средой культуры до концентрации 5x104 TCIDso на мл (TCID50 - дозе вируса, которая инфицирует 50% клеток в культуре ткани) и 20шп объема вирусной пробы (содержащей 1000 TCIDso вируса) добавляют в лунки, содержащие исследуемое соединение, и в лунки, содержащие только среду (инфицированные контрольные клетки) Некоторые лунки содержат культурную среду без вируса (неинфицированные контрольные клетки) Подобным образом, с помощью добавления среды, не содержащей вирус, в несколько лунок с исследуемым соединением, определяется присущая этому соединению токсичность В общем, планшеты культурой ткани содержат следующие 33 49803 экспериментальные данные Клетки 1 2 3 4 + + + + Лекарственные средства + + Вирусы + + В результате экспериментов 2 и 4 получали следующие значения окончательной концентрации исследуемых соединений 1,10,100, и 500цг/мл Азидотимидин (AZT) и дидеоксиинозин (ddl) включают в качестве позитивного контрольного элемента для управления воздействием лекарственного средства Исследуемые соединения растворяют в DMSO и разбавляют в среде культуры ткани таким образом,чтобы окончательная концентрация DMSO не превышала в каждом из случаев 1,5% Во все контрольные лунки добавляют DMSO в соответствующей концентрации После добавления вируса клетки выращивают в инкубационных условиях при 37°С в увлажненной атмосфере 5% СОг в течение 7 дней Исследуемые соединения могут добавляться в 0,2 или 5-й день, если потребуется На 7-й день после инфицирования клетки в каждой из лунок ресуспендируют и ЮОшп пробы каждой клеточной суспензии извлекают для проведения исследований 20шп объема раствора 5мг/мл 3-(4,5диметилтиазол-2-ил)-2,5-дифенилтетразолиум бромида (МТТ) добавляют к каждому шп клеточной суспензии и клетки помещают на 4 часа в инкубационную 5% СОг среду с температурой 37°С В процессе выращивания в инкубационных условиях состав МТТ метаболически снижается за счет живых клеток, в результате чего в клетке образуется окрашенный formazan продукт К каждой пробе добавляют ЮОцІ 10% додицилсульфата натрия в 0,01 N HCL, с целью лизирования (растворения), а сами пробы сразу же помещают в инкубационные условия Использование считывающего устройства для анализа микропланшетов при молекулярных исследованиях позволяет обнаружить поглощение на 590 нанометрах (nm) для каждой пробы Цитотоксичность и антивирусная эффективность исследуемого соединения определяется при сравнении значений степени поглощения, полученных для лунок, содержащих инфицированные или неинфицированные клетки, выращенные в инкубационных условиях вместе с соединениями, и для неинфицированных, необработанных контрольных лунок Методика выращивания культуры ВИЧ Стимулирование лимфоцитов доноров Светлые слои кровяного сгустка были получены от Американского Красного Креста или из Банка крови медицинского отделения Вашингтонгского университета Эти препараты пыли предварительно отобраны для антител вируса иммунодефицита человека (HIV)(BH4) и вируса мозаики цветной капусты (CMV), а также антиге 34 на поверхности вируса гепатита B(HBV) (HBsAg) и ALT (активности аланиновой трансферазы) в качестве маркера для негепатита - А и негепатита В Обогащенную лейкоцитами кровь (30мл) удаляют из пластмассового контейнера и 15мл распределяют по двум 50мл центробежным пробиркам с завичивающейся крышкой Каждый образец разводят в равном объеме стерильного физиологического раствора с фосфатным буфером (PBS) и смешивают методом пипетирования Ficoll-Paque (набор фикола) или LSM (вещество, стимулирующее размножение лимфоцитов ) размещают под разведенными образцами крови, используя пипетку Пастера и дают возможность раствору стечь на дно пробирки Затем каждую пробирку подвергают центрифугированию со скоростью 1300об/мин (400хд) в течение 45 минут при температуре 20°С После центрифугирования зону лимфоцитов поверхности раздела выделяют и переносят в 50мл пробирку Добавляют стерильный PBS для разбавления выделенных лимфоцитов, а затем центрифугируют со скоростью 1300об/мин, в течение 8 минут Клеточный осадок в пробирке после центрифугирования дважды промывают путем ресуспендирования в PBS и повторного центрифугирования Окончательный клеточный осадок ресуспендируют в 20мл PBS путем пипетирования и общее количество жизнеспособных клеток определяют путем исключения Trypan Blue (трипановой голубизны) Исследования острой инфекционной способности путем использования клинических изолятов Приблизительно Зч 107 клеток в течение 48 часов подвергают воздействию, примерно, 35цг/мл фитогемоагглютилина (РНА) в KPMI, содержащем 10% фетальную бычью сыворотку и IL-2 (10U/ml) Определенное количество маточного раствора вируса добавляют к суспензии лимфоцитов при множественности инфицирования около 0,001-0,01 Клеточно-вирусную суспензию инкубируют в течение 2 часов при температуре 37°С, с целью обеспечения вирусной абсорбции Осадочный вирусный инокулят удаляют методом центрифугирования, а клетки ресуспендируют в RPMI, содержащем 10% FBC и 10U/ml IL-2 Эти инфицированные клетки добавляют к исследуемому объекту, разбавленному завершенной (готовой) средой культуры ткани из запаса маточного раствора (10мг/мл) в DMSO на 96 луночном тетрационном микропланшете, с целью получения около 5x105 клеток на лунку, содержащую 200шп Инфицированные необработанные клетки и клетки, обработанные только DMSO(0,1%), AZT или DDI, были использованы в качестве контрольных Культуры были исследованы на образование синцития на 7 и 11 день после инфицирования или надосадочных жидкостей, которые были тестированы на активность обратной транскриптазы или антигена р24 Исследования хронической инфекционной способности Клетки СЕМ, хронически инфицированные НХВ2 (лабораторный штамм HIV-1 (ВИЧ-1)) до 35 бавляют в шесть лунок 12 луночного тетрационного микропланшета, с целью распределения 5x104 клеток на каждую лунку Половина лунок обрабатывается исследуемым соединением в различных концентрациях, а такое же количество неинфицированных клеток СЕМ остается без добавления исследуемого соединения Свежая среда, содержащая или не содержащая исследуемое соединение, добавляется каждый день в течение последующих трех дней После этого культуры инкубируют в течение 48 часов без изменения среды Клетки собирают методом центрифугирования, промывают (дважды) 2х в PBS и ресуспендируют в 50шп (дважды) 2х в буфере Laemmh, содержащем 0.125М Триз (Tns) pH6,8, 4% д од еци л сульфита натрия (SDS), 20% глицерола, 10% бета меркаптоэтанола и 0,02% бромофенола голубого Надосадочные культуры пропускают через 0,22цм фильтр для удаления остатков органических веществ (дебриса) и центрифугируют со скоростью 50000об/мин в течение 90 минут для концентрации вирусных частиц Вирусный осадок ресуспендируют в 50шп 2х буфера Laemmh Клетки вирусной суспензии кипятятся в течение 5 минут, а затем подвергаются электрофоретической сепарации в 10-20% SDS геля градиента полиакриламида Компоненты, входящие в состав геля, затем переносятся в нитроцеллюлозу методом электроблоттинга Материалы Триз (Tns) (pH7,8) KCI DTT (Дитиотреитол) (хранение при -20С ) MgCI 2 poly(rA)p(dT012-18) Pharmacia (фармация) 27-7878 NP-40 'H-TTR (NET 221 A, 80 Ci/mmol) H2O Способ 1 Добавить по 50ц, 1 RT - смеси на лунку в 96 луночный тетрационный микропланшет с Uобразным дном 2 Добавить по 10-20ц1 на лунку раствора надосадочной жидкости, свободной от присутствия клеток 3 Перемешать содержимое лунки механическим перемешивающим устройством 4 Инкубировать при 37°С в течение 2 часов 5 Отсосать на фильтровальную бумагу DE81 49803 36 ВИЧ специфифические протеины обнаруживают, используя моноклональные антитела, присоединенные к р4 и р17, после чего следует goat-antimouse IgG, присоединенный к биотину, и авидин, присоединенный к пироксидазе хрена (HRP) Ферментная конверсия 4-хлоро-1-нафтола была использована для обеспечения визуального наблюдения над специфическими протеинами, распознанными моноклональными антителами В дополнение, была проанализирована инфицирующая способность вируса, приобретенная благодаря хроническому инфицированию клеток СЕМ в присутствии или в отсутствии исследуемых соединений Отфильтрованные надосадочные жидкости разбавляются и используют для инфицирования неинфицированных клеток СЕМ (около 1х104/лунка) Культуры были исследованы на формирование синцития на 7 или 11 день после инфицирования или надосадочных жидкостей, тестированных на активность обратной транскриптазы, или антигена р24 Микротесты обратной транскриптазы (RT) Микротест RT представляет собой адаптацию нескольких стандартных тестов RT Была разработана методика, позволяющая проводить, с помощью количественных измерений малых объемов, исследования активности RT ВИЧ и облегчить обработку многочисленных образцов (проб) Маточный рабочий раствор 1,0M 3,0М 0,1М 0.15М 25U/2,5ml 2% 2,5Ci/ml (на 1 мл) 50JJ.I 25цІ 20JJ.I ЗЗцІ 25цІ (0.5U) 25цІ 10ц1 777ц! или эквивалентный материал, используя ТОМТЕС 6 Прополоскать четыре раза, используя 2Х SSC (раствор хлорида и цитрата натрия) 7 Прополоскать один раз, используя 95% этанол 8 Осушить фильтр 9 Приготовить для под счета, используя бетапланшетный счетчик (Фармация) 37 49803 38 ПРИМЕР 19 СВЕЖАЯ СРЕДА с сседикЕниями НЕИФЩИГОВ АННЫЕ КЛЕТКИ ЙЯИБЕЗНИХч ИССЛЕДУЕМАЯ НАДОСАДОЧНАЯ ЖИДКОСТЬ АШЕС» РАСЩЕПЛЕННАЯ КУЛЬТУРА СОХРАНЕННЫЕ ДДЯРСИ КЛЕТКИ МНОЖЕСТВЕННЫЕ ЦИКЛЫПРИГ0ТАВЧИВЩПСЛ С УВЕЛИЧЕНИЕМШЩЕНТРАЦИИ СОЕДИНЕНИЯ ДО ТЕХ ПОР ПОКА НЬ БУДЕТ НАБЛЮДАТЬСЯ СДВИГ ГС» Следующим является метод культуры, использованный для отбора мутантов, устойчивых к ингибиторам ВИЧ протеазы Инфицированные клетки выращивали непрерывно в присутствии ингибитора протеазы Некоторые культуры подвергали чередующемуся понедельному воздействию высоких и низких концентраций ингибитора Остальные культуры подвергали воздействию постоянной концентрации Концентрация лекарственного средства возрастала периодически до тех пор, пока в ЕС50 не наблюдался стойкий сдвиг Сдвиг в графике реакции на дозу был, в основном определен при концентрации лекарственного средства от 0,5 до 1ц/мл или более (5-1 Ox ECgo) и зависел от подвергающегося обработке вирусного изолята Были использованы оба варианта изолятов ВИЧ, как лабораторный, так и клинический Те же самые вирусные изоляты использовались тем же самым способом при отсутствии лекарственных средств, что позволило непосредственно сравнить нуклеозидную последовательность для обработанных и необработанных изолятов В основном, варианты ВИЧ-1, устойчивые ингибиторам протеазы, были выбраны методом установленного процесса высевания (выращивания) в присутствии нескольких значений ингибиторных концентраций ингибиторов протеазы, обозначенных в работе (см Markowitz и др , Journal of Virology 69 701-706 (1995)) Варианты ВИЧ-1 перечисленные ниже, указывают на мутации, которые присутствуют в выбранных вирусных изолятах и не присутствуют в контрольных, необработанных изолятах RF представляет собой ВИЧ -IRF, который является штаммом ВИЧ-1, a RFR представляет собой смесь штаммов, полученных в результате отбора RF, устойчивых к воздействию соединения, представленного в примере I RFR представляет собой смесь вирусных штаммов, имеющих генотипы протеазы G48V (клоны 14/40), G48V, V82A (клоны 18/40), G48V, L90S (клоны 2/40), G48V, I54T, V82A (клоны 1/40 ), G48M (клоны 1/40), G48V, Q61H (клоны 1/40), V13I, G48V (клоны 1/40 ), G48V, F53L, V82A (клоны 1/40), G48V, V82A.C95Y (клоны 1/40) RFR2 представляет собой смесь устойчивых штаммов, полученных путем клонирования RFR тремя циклами роста при ограниченном разбавле нии RFR2 представляет собой смесь вирусных штаммов, имеющих генотипы протеазы G48V, V82A (клоны 13/15), G17E, G48V, V82A (клоны 1/15), G48V, V82A, N37D, N88D (клоны 1/15) RFRR представляет собой смесь штаммов, полученных путем отбора RF, устойчивых к соединениям примеров 1 и 2, а затем клонированных тремя циклами роста при лимитированном разбавлении RFRR включает смесь вирусных штаммов, имеющих следующие генотипы протеазы G48V, I54T, L63P, V82A (клоны 7/9), G48V, I54T, L63P, V82A, N88S (клоны 1/9), G48V, I54T, L63P, G73M, V82A (клоны 1/9) SF162 представляет собой объект SF-162, который является штаммом ВИЧ-1, a SF162R представляет собой смесь штаммов, полученных в результате отбора 8Р162,устойчивых к воздействию соединения, представленного в примере 1 SF162R включает смесь вирусных штаммов, имеющих генотипы протеазы M46I, F53L, L63P, А71 V, N88D (клоны 2/3), M46I,F53L,L63P,A71 V,N88D,Q92R (клоны 1/3) 89-959 представляет собой объект 89-959, который является штаммом ВИЧ-1, a 89-959R представляет собой смесь штаммов, полученных в результате отбора 89-959, устойчивых к воздействию соединения, представленного в примере 2 89-959R включает смесь вирусных штаммов, имеющих генотипы протеазы N88S (клоны 4/5) и D25N,T26A,D30N,D37N,R41K,G73D,R87K,N88S(m оны 1/4) NL4 представляет собой объект HIV-1 (ВИЧ-1 )NL4, который является штаммом ВИЧ-1 NL4(G48V) представляет собой штамм, имеющий синтетически генерированную сайт-направленную мутацию в протеазе от глицина до валина в позиции аминокислоты номер 48 NL4(I84V) представляет собой штамм, имеющий синтетически генерированную сайт-направленную мутацию в протеазе от изолейцина до валина в позиции аминокислоты номер 84 NL4(R8Q,M46I) представляет собой штамм, имеющий синтетически генерированные сайт-направленные мутации в протеазе от аргинина до глютамина в позиции аминокислоты номер 8 и от метионина до изолейцина в позиции аминокислоты номер 46 NL4(P22-538) представляет собой смесь штаммов, полученных при отборе ВИЧ-1 NL4 з, устойчивый к соединению F образца после 22 пересевов, включающий следующие ге 39 49803 нотипы протеазы M46I, L63P, A71V, V82F, I84V (4/10 ), M46I,L63P,V82F,I84V (3/10), М46ІД71 V.V82FJ84V (3/10) NL4(P37-538) представляет собой штаммы, полученные при отборе ВИЧ-1 NL4-3, устойчивые к соединению примера 10 после 37 пересевов, включающие следующий генотип протеазы 46I.L63P, А71 VJ84A NL4 (538/524) представляет собой штаммы, полученные при отборе NL4 (Р22-538), устойчивые к соединению примера 5 после 24 пересевов, включающие следующий генотип протеазы M46I, L63P, A71VJ84A NL4(538/P7-AG) представляет собой смесь штаммов, полученных при отборе NL4 (Р22538),устойчивую к соединению примера 12 после 7 пересевов, включающую следующие генотипы протеазы M46I, L63P, А71 V, I84A, V32I.V82I NL4 (538/P24-AG) представляет собой штаммы, полученные при отборе NL4 (Р22-538),устойчивые к соединению примера 12 после 24 пересевов, включающие следующий генотип протеазы 46I,L63P,A71V,I84A NL4(P 19-003) представляет собой штаммы, полученные при отборе ВИЧ-1 NI_4 з, устойчивые к соединению примера 9 после 19 пересевов, включающие следующий генотип прОТеаЗЬі R8K, М46І NL4(P34-003) представляет собой штаммы, полученные при отборе ВИЧ-1 NI_4 з, устойчивые к соединению примера 9 после 34 пересевов, включающие следующий генотип протеазы R8K,M46I,L63P, A71V.L90M Результаты устойчивости вирусных изолятов представлены в таблицах 1-11 Пример 20 40 Результаты устойчивости вирусных изолятов, представленные в таблицах 1-3, были получены в соответствии со следующим алгоритмом исследований или дополнительными его модификациями Приблизительно 3x107 клеток в течение 48 часов активизируют 3-5цг/мл РНА в RPMI, содержащем 10% фетальной бычьей сыворотки и IL-2 (10U/ml) Определенные количества маточных растворов добавляют к активизированной суспензии лимфоцитов при множественности инфицирования около 0,001-0,01 Суспензию клеточного вируса инкубируют при температуре 37°С в течение 2 часов для обеспечения процесса вирусной абсорбции Осадочный вирусный инокулят удаляют центрифугированием, а клетки ресуспендируют в RPMI, содержащем 10% FBS и 10U/ml IL2 Эти инфицированные клетки добавляют к исследуемому объекту, разбавленному готовой средой культуры ткани из запаса маточного раствора (10мг/мл) в DMSO на 96 луночном тетрационном микропланшете, с целью получения около 5x105 клеток на лунку, содержащую 200шп Инфицированные необработанные клетки и клетки, обработанные только DMSO (0,1%) или AZT , или DDI, были использованы в качестве контрольных Культуры были исследованы на образование синцития на 7 и 11 день после инфицирования или надосадочных жидкостей, которые были тестированы на активность обратной транскриптазы, или антигена р24 Таблица 1 Пример N 1 2 5 6 Изолят вируса SF162 31 2 4 2 (ЕС 50 нано г/мл) SF162R 443 6 4 11 Таблица 2 Пример N 1 7 8 Изолят вируса SF162 2 1 1 (ЕС 50 нано г/мл) SF162R 111 108 98 Таблица 3 Пример Изолят вируса (ЕС 50 нано г/мл) N 89-959 89-959R 89-959R 1 96* 5* 37** 2 100* 395* 872** 5 36* 5* 38** 6 4 6** 7 13Э 12s 8 12Э 11 Э Указывают на значения величин, полученных при проведении одного и того же эксперимента 49803 41 Пример 21 Результаты устойчивости вирусных изолятов, представленные в таблицах 4-6, были получены в соответствии со следующим алгоритмом исследований или дополнительными его модификациями Исследования проводят на 96 луночных планшетах для культуры ткани Клетки СЕМ-Т4 суспендируют в 96% среде RPMI (Gibro BRL Life Tekhnologies.lnc , Gaithsburg MD) 10% подогретой фетальной бычьей сыворотки (Gibro BRL Life Tekhnologies.lnc .Gaithsburg MD) до получения окончательной концентрации 5x10 жизнеспособных клеток на мл Замороженная аликвотная проба ВИЧ культуры (штамм ВИЧ-1КА) быстро оттаивается (на 37°С водяной бане) и добавляется к СЕМ Т4 клеткам, с целью достижения окончательной концентрации около 0,001-0,01 инфекционных единиц на клетку Клеточно-вирусную суспензию быстро смешивают путем создания завихрений и 42 ЮОшп немедленно добавляют к ЮОшп каждого из исследуемых соединений (приготовленных в виде 2х концентратов в 90% RPMI, 10% FBS), разбавленных для каждой лунки 96 луночного планшета для выращивания культуры ткани Каждый планшет включает контрольные лунки, содержащие клетки и вирусы, но не исследуемые соединения З'-Азидо-З'-деокситимидин (AZT) включают в качестве позитивного регулятора во все исследования Планшеты с культурой ткани инкубируют при температуре 37°С во влажной атмосфере 5% ССЬ в течение 7 дней Затем определяют уровень вирусной репликации путем измерения активности обратной транскриптазы в надосадочных жидкостях, используя стандартные методы (как было описано в уроне техники, например, Technique in HIV Research (АлгоритмВИЧ исследований), Aldovim SWalker.eds , 1990,Stockton Press, NY) Таблица 4 Пример Изолят вируса (ЕС50 нано г/мл) N RF RFR 1 ЗО 223* 2 40 8* 3 5 2* 4 10 0,4* 5 44** 7* 6 12** 15* Указывают на значения величин, полученных при проведений одного и того же эксперимента Таблица 5 Пример N 1 7 8 Изолят вируса RF 24 2 2 (EC50 нано г/мл) RFR 394 78 1 Таблица 6 Пример N 1 2 5 6 14 15 16 RF 19 35 6 6 1 5 3 Изолят вируса (ECso нано г/мл) RFR2 880 367 57 31 6 9 1 Пример 22 Результаты устойчивости вирусных изолятов, представленные в таблицах 7-11,были получены в соответствии с алгоритмом исследований, описанных в работе Markowitz и др, Journal of RFRR 5609 1111 982 962 39 21 9 Virology, vol 69,701-706 (1995), которые включены в описание настоящего изобретения методом ссылки на приведенный источник во всей его полноте, или дополнительными его модификациями 43 49803 44 Таблица 7 Пример N 5 6 10 12 13 14 15 16 NL4 80 30 80 25 250 8 60 8 Изолят вируса (ЕСдо наноМ) NL4(G48V) 160 150 160 125 1000 8 60 8 NL4(I84V) 640 90 800 125 6250 72 60 8 Таблица 8 Пример N 5 6 10 12 13 16 Изолят вируса (ECso наноМ) NL4 80 30 80 25 250 8 NL4(R8Q,M46I) 240 30 240 125 750 8 Таблица 9 Пример N 5 6 10 12 13 14 15 16 NL4 80 30 80 25 250 60 8 8 Изолят вируса (ECso наноМ) NL4(P22-538) 800 150 1600 500 5000 60 400 8 NL4(P37-538) 6400 2400 6400 >3125 >31250 1000 1000 40 Таблица 10 Пример N NL4(538/P24AG) 5 6 10 12 13 16 Изолят вируса NL4 (ЕС5о наноМ) NL4(53 8/524) NL4(538/P7-AG) 80 30 80 25 250 8 6400 2400 6400 >3125 >31250 40 6400 2400 6400 >3125 >31250 40 6400 2400 6400 >3125 >31250 40 Таблица 11 Пример N 5 6 10 12 13 6 NL4 80 30 80 25 250 8 Изолят вируса (ECso наноМ) NLA(P19-003) 240 30 400 150 1250 8 Пример 23 Ингибиторы протеазы по примерам 1 и 2, ко NL4(P34-003) 400 ЗО 400 375 1250 8 торые содержат уникальную изостеру гидроксиэтилуриа, были использованы для выбора in vitro 45 вариантов ВИЧ-1, устойчивых к воздействию лекарственных средств Клинические и лабораторные штаммы ВИЧ-1 были засеяны в Т-клеточные линии или в мононуклеарные клетки периферийной кровеносной системы (PBMCS)B присутствии увеличивающихся концентраций лекарственных средств Устойчивые варианты стабильно демонстрировали значения ЕС50, по меньшей мере, десятью фолдами выше, чем контрольные вирусы, высеянные на идентичный период времени, но без ингибитора Вирусная ДНК была усилена с помощью PCR (камеры для обслуживания и замены полезной нагрузки), а нуклеотидная последовательностью гена, кодирующего протеазу, была определена с использованием стандартных методов Для вирусов, устойчивых к воздействию ингибиторов протеазы по примерам 2 и соответственно, во многих отобранных вариантах наблюдалась характерная замена аминокислоты в позиции 88 Аспаргиновыи остаток в позиции 88 располагается внутри законсервированной улиткообразной зоны, присутствующей как в мономерной, так и в бимерной аспаргиновой протеиназе Последовательность соответствующих конечных карбоксильных групп Gly-Frg-Asp/Asn (остатки 86-88) является уникальной для ретровирусных аспаргиновых протеиназ В то время, как любые объяснения подобных результатов могут восприниматься как простые рассуждения, создание моделей на основе изучения матриц, полученных из высокорастворимых радиоактивных структур прототипных ингибиторов гидроксиэтилугеа, присоединенных к рекомбинанту ВИЧ-1 протеазы, дает все основания предположить, что мутации аспаргина (Ans88) могут явиться подтверждением сдвига протеазы Соединения ингибитора ретровирусной протеазы по настоящему изобретению представляют собой эффективные антивирусные соединения, в частности, являются эффективными ингибиторами ретровирусов, например лентивирусов, как было показано выше Таким образом, рассматриваемые соединения являются эффективными ингибиторами ВИЧ Можно предположить, что рассматриваемые соединения смогут оказывать угнетающее воздействие также и на другие штаммы ВИЧ, например на ВИЧ-2, а также на другие вирусы, например на вирус VISNA, вирус иммунодефицита обезьяны, (SIV), HTLV-1, HTLV-2 Настоящее изобретение также относится к растворам или гидратам соединений ингибиторов ретровирусной протеазы, которые в заданных условиях приготовляют или выделяют способами, известными из уровня техники Соединения ингибиторов ретровирусной протеазы могут быть использованы в виде солей, полученных из органических или неорганических кислот Перечень этих солей включает, но не ограничивается следующим ацетат, адипат, альгинат, цитрат, соль аспаргиновой кислоты, соль бензойной кислоты, бензолсульфонат, бисульфат, соль масляной кислоты, соль камфорной кислоты, камфорсульфонат, диглюконат, циклопентанепропионат, додециклсульфат, этанесульфонат, глюкогептаноат, глицерофосфат, гемисульфат, гептпноат, гексаноат, фумарат, 49803 46 гидрохлорид, гидробромид, гидроиодид, 2гидрокси-этанесульфонат, лактат, малеат, метанесульфонат, никотинат, 2-нафталенесульфонат, оксалат, палмоат, ректинат, персульфат, 3фенилпропионат, соль пикриновой кислоты, пивалат (соль триметилуксусной кислоты), пропионат (соль пропионовой кислоты), соль янтарной кислоты, тартрат, тиоцианат, тозилат, мезилат и соль ундекановой кислоты Примерами кислот, которые могут быть использованы для формирования фармацевтически допустимых кислых добавочных солей, могут служить такие неорганические кислоты хлористоводородная кислота, серная кислота и фосфорная кислота, а также органические кислоты щавелевая кислота, малеиновая кислота, янтарная кислота и лимонная кислота Предпочтительным вариантом может служить хлористоводородная соль Другие примеры включают соли со щелочными или щелочно-земельными металлами, например натрием, калием, кальцием или магнием или с органическим основанием Общая дневная доза, назначаемая хозяину одноразово или в виде нескольких доз, может составить, например, от 0,01 до 50мг/кг веса тела, а чаще от 0,1 до 30мг Композиция единицы дозировки может содержать такие количества их подмножеств, которые могут формировать дневную зону Количество активных ингредиентов, которые могут быть объединены с материаламиносителями для создания единой формы дозировки, должны меняться в зависимости от обрабатываемого хозяина и особенностей метода лечения Схема приема лекарственного средства для лечения болезни с помощью соединений или композиций ингибитора ретровирусной протеазы выбирается в соответствии с целым набором факторов, включающим тип, возраст, вес, пол, режим питания и медицинские показания пациента, а именно, тяжесть заболевания, способ применения лекарственного вещества, фармакологические признаки, например активность, эффективность, фармакокинетические и токсикологические особенности используемого соединения, то есть, принимается во внимание информация о том, используется ли отдельная система прохождения лекарственного вещества и назначается ли соединение как часть комбинации лекарственных средств Итак, режим дозировки действительно применяемого способа лечения может широко видоизменяться и поэтому может отличаться от предпочтительного варианта режима дозировки, установленного выше Соединения по настоящему изобретению могут приниматься орально, парентерально, в виде ингаляций, через прямую кишку, локально, в виде дозированных, приготовленных по специальной технологии единиц, содержащих традиционные нетоксичные фармацевтически допустимые носители, адьюванты и наполнители,по выбору В качестве типичных назначений могут быть также использованы трансдермальные назначения в виде трансдермальных бляшек или лекарственного электрофореза Термин парентеральный в кон 47 тексте настоящего описания включает подкожные инъекции, внутривенные, внутримышечные, инъекции в крудную клетку и различные методы вливаний В качестве составов, пригодных для инъекций, например стерильные водные растворы или маслянистые суспензии могут приготавливаться в соответствии с известными из уровня техники методиками, использующими соответствующие дисперсные или влажные субсидированные агенты Стерильные, пригодные для инъекций препараты могут быть также представлены в виде стерильных растворов или суспензий в нетоксичных, пригодных для парентеральных назначений растворителях, например в виде раствора в 1,3бутанедиола Среди допустимых наполнителей и растворов, которые могут применяться в этих случаях - вода, раствор Рингера, и изотонический раствор хлорида натрия Кроме того, стерильные фиксированные масла могут быть использованы в качестве растворителя или суспендирующей среды Для этой цели могут применяться легкие фиксированные масла, включая синтетические моноили диглицериды Кроме того, в приготовлении препаратов для инъекций находят применение жирные кислоты, например олеиновая кислота Суппозитории для ректального назначения лекарственного вещества могут быть приготовлены путем смешения лекарственного вещества с подходящим не раздражающим инертным наполнителем, например, маслом какао и полиэтиленгликолями, которые имеют твердую консистенцию при обычной температуре, но превращаются в жидкость при ректальной температуре и поэтому растворяются в прямой кишке и высвобождают лекарственное средство Виды твердых дозировок для орального назначения могут включать капсулы, таблетки, пилюли, порошки, гранулы В таких видах твердых дозировок активный компонент может быть добавлен в качестве примеси, по крайней мере, к одному из таких инертных разбавителей, как сахароза, лактоза или крахмал Такие виды дозировки могут также включать, в практическом применении, дополнительные вещества, отличные от инертных разбавителей, например, смазывающие агенты, а именно магниевая соль стеариновой кислоты В случаях с капсулами, таблетками и пилюлями дозировки могут также содержать буфферные элементы Таблетки и пилюли могут быть приготовлены в энтеросолюбильных покрытиях Виды жидких дозировок для орального назначения могут включать фармацевтически допустимые эмульсии, растворы, суспензии, сиропы и эликсиры, содержащие инертные разбавители, обчно встречающиеся в уровне техники, например воду Такие композиции могут также содержать адьюванты, например, увлажняющие вещества, эмульгирующие и суспендирующие элементы, подслащивающие, коррегирующие и отдушивающие агенты В том случае, когда соединения ингибиторов ретровирусной протеазы, по настоящему изобретению, назначаются в качестве единственных активно действующих фармацевтических средств, 49803 48 они могут применяться в сочетании с другими антивирусными агентами, которые способны активно противодействовать таким ретровирусам как ВИЧ1 Такие соединения включают, но не ограничиваются ими, другие ингибиторы ВИЧ-1 протеазы, различные нуклеозидные аналоги, ингибиторы ненуклеозидной обратной транскриптазы, татантагонисты и ингибиторы глюкозидазы Примеры ингибиторов ВИЧ-1 протеазы включают, но не ограничиваются следующим Ко 31859 (Roberts, N А и др Science 1990, 248, 258-261 and Drugs of the Future (Наука 1990, 248, 258-261 и лекарственные средства будущего)1991, 16(3), 210-212 KNI-272, (Kagayama.S , и др Antimicrobial Agents and Chemotherapy (Противомикробные агенты и гемотерапия) 1993, 810-817), цикличные серии мочевины (Lam, P ,и др "De Novo Design and Discovery of Potent, Nonpeptidal HIV-1 Protease Inhibitors," paper 96 at the 205th Amencal Chemical Society National Meetmg, Medical Chemistry Division, Denver.Co, March 28-Apnl 2,1993) ("Новые методы конструирования и открытие сильнодействующих ингибиторов непептидной ВИЧ-1 протеазы ", документ 96 205 национального заседания Американского химического общества, Отделение химической медицины, 28 марта-2 апреля 1993г), L-735,524 (Dorsey, B D и др, "L735,524 The Rational Design of a Potent and Orally Bioavailable HIV Protease Inhibiror," paper 6 at the 206th Amencal Chemical Society National Meeting, Medical Chemistry Division, Chicago,IL, August 2227,1993) ("L-735,524 Рациональная структура сильнодействующего орально назначаемого ингибитора ВИЧ протеазы", документ 6 206 национального заседания Американского химического общества, Отделение химической медицины, Чикаго, IL, 22-27 августа 1993 г ), и аналогичные Перечень примеров нуклеозидных аналогов включают, но не ограничивается, азидотимидин (AZT), дидеоксиинозин (DDI), DDC, ЗТС , D4T, РМЕА Перечень примеров ингибиторов ненуклеозидной обратной транскриптазы включает, но не ограничивается, класс пиридинов (WeiJ S и др J Med Chem 1993,36,249-255, Hoffman, J М и др J Med Chem 1992,35,3784-3791, Saan и др J Med Chem 1992,35,3792-3802, Drugs of the Future (Лекарственные средства будущего 1992, 17 (4), 283285 и их аналоги),бис-(гетероарил)класса пиперазинов (Romero D L и др J Med Chem 1993,36,1505-1508, Romero D L и др Proc Natl Acad Sei USA 1991,34,746-751 и 3187-3198, и их аналогов) и трициклик пиридобензо - и депиридодиазепинов (Hargrave, К D , J Med Chem 1991,34, 2231-2241, Merluzzi, M J Science (Наука) 1990, 250,1411-1413, и их аналоги) и 5-хлоро-З(фенилсульфонил)индоле-2-карбоксамид и его аналоги (Williams.T M и др J Med Chem 1993, 36, 1291-1294) Примеры тат антагонистов включают, но не ограничиваются, Ro 5-3335 и Ro 24-7429 (Hsu MС и др Proc Natl Acad Sci USA 1993,909,6395-6399, Tam.S и др "Tat Inhibitors a New Class of Anti-HIV Agents" paper 372, at the 204th Amencal Chemical Society National Meeting, Organic Chemistry Division, Washington, DC, August 23-28,1992) ("Тат ингибиторы новый класс анти 49 49803 50 ВИЧ агентов ", документ 372 204 национального заседания Американского химического общества, Отделение органической химии, Вашингтон, DC, 23-28 августа 1992г), и их аналоги Примеры ингибиторов гликозидазы включают, но не ограничивают их круг, кастаноспермин, кастаноспермин 6 бутриловый эфир, N-бутил-і-деоксиножиримицин, N-бутил-і-деоксиножиримицин пер-бутриловый эфир и их аналоги, а также их пролекарственные средства Терапевтические средства могут быть представлены как отдельные композиции,которые назначаются, фактически в одно и то же время, или терапевтические средства, которые назначаются в виде одного единственного соединения, в результате чего все эффективно действующие агенты оказываются в организме носителя инфекции в терапевтически достаточном количество Кроме того, терапевтические агенты могут назначаться в различное время, но таким образом, чтобы только один или два активных агента за один раз оказывались в организме в терапевтически эффективном количестве Рассматриваемые соединения и способы также являются эффективными при предупреждении роста ретровиросной инфекции в растворе Клеточная культура как человека, так и животного, например, культуры Т-лимфоцитов, используются для различных целей, например, для исследования и диагностики , включая отладку и контроль Перед и в течение выращивания и хранения клеточной культуры рассматриваемые соединения могут добавляться к среде клеточной культуры в концентрации, эффективной для предотвращения неожиданной или нежелательной репликации ретровируса, который может скрыто присутствовать в клеточной культуре Вирус может изначально присутствовать в клеточной культуре, например известно, что ВИЧ должен присутствовать в Тлимфоцитах человека задолго до того, как его обнаружат в крови или через воздействие на него вирусом Использование рассматриваемых соединений и методов обеспечивает выявление исследователями и врачами-клиницистами скрытой предрасположенности к потенциально летальным ретровирусам Соединения и способы по настоящему изобретению являются эффективными антивирусными соединениями и, в частности, эффективными ретровирусными ингибиторами, как было показано выше Таким образом, рассматриваемые соединения являются эффективными ингибиторами ВИЧ протеазы Было сделано предположение, что рассматриваемые соединения должны угнетающе действовать на другие ретровирусы, например на лентивирусы, вчастности на другие штаммы ВИЧ, например ВИЧ-2, на вирус Т-клеточной лейкемии, саркомы Рауса, вирус иммунодефицита обезьяны, лейкемии кошек, иммунодефицита кошек и т п Таким образом, рассматриваемые соединения являются эффективными при лечении и / или профилактике ретровирусных заболеваний В формуле изобретения представлены существенные его признаки, однако объем защиты не ограничивается представленными в примерах осуществления соединениями Тем не менее, варианты и изменения, которые могут стать очевидными для специалистов в данном уровне техники, должны находиться в пределах объема защиты, представленного в приложенной формуле изобретения Специалист в данной области может легко обнаружить основные характерные особенности настоящего изобретения и в пределах формулы изобретения успешно произвести их эквивалентную замену, чтобы приспособить изобретение к использованию в заданных условиях ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна ( 0 4 4 ) 4 5 6 - 2 0 - 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for treatment of retrovirus infections
Назва патенту російськоюСпособ лечения ретровирусных инфекций
МПК / Мітки
МПК: A61K 31/425, A61K 31/395, A61K 31/495, A61K 31/18, A61K 31/16, A61K 31/44
Мітки: спосіб, лікування, ретровірусних, інфекцій
Код посилання
<a href="https://ua.patents.su/25-49803-sposib-likuvannya-retrovirusnikh-infekcijj.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування ретровірусних інфекцій</a>
Попередній патент: Пристрій закриття гнучкої завіси
Наступний патент: Змішувальний клапан крана (варіанти), шаровий елемент для змішувального клапана і гільза для шарового елемента
Випадковий патент: Кормовий білковий продукт