Сукцинат біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(r)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил]}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру та його застосування д
Номер патенту: 100364
Опубліковано: 25.12.2012
Автори: Чудасама Решма, Кеннеді Ендрю, Кіндон Лінда Джейн, Мале Франк Патрік
Формула / Реферат
1. Сукцинат біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру або його сольват, який є у кристалічній формі 1, що характеризується рентгенодифрактограмою порошку, що має піки дифракції при значеннях 2θ 5,0±0,3 та 10,0±0,3.
2. Сіль за п. 1, де сіль характеризується:
а) даними диференційної сканувальної калориметрії, котрі показують точку плавлення у межах 170 °С - 180 °С;
б) інфрачервоним спектром поглинання із показовими смугами поглинання приблизно при 3265, 2832, 1735, 1718, 1679, 1669, 1591, 1540, 1518, 1493, 1439, 1405, 1339, 1302, 1283, 1239, 1202, 1163, 1144, 1107, 1095, 1039, 1009, 973, 921, 885, 868, 838, 773, 751 та 707 см-1.
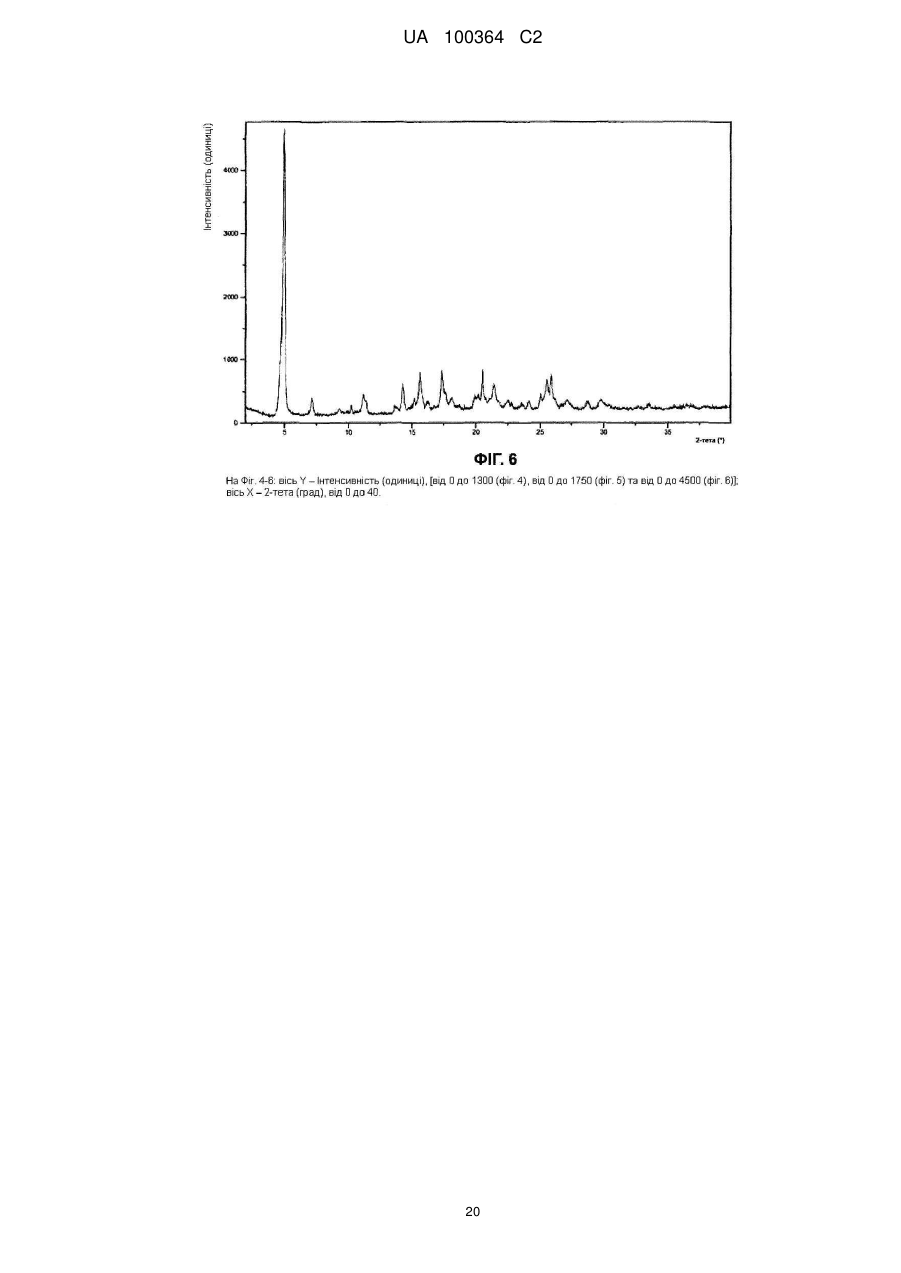
3. Сіль за п. 1, яка характеризується рентгенодифрактограмою порошку, у котрій позиції піків по суті відповідають позиціям піків рентгенодифрактограми, показаної у Фіг. 4.
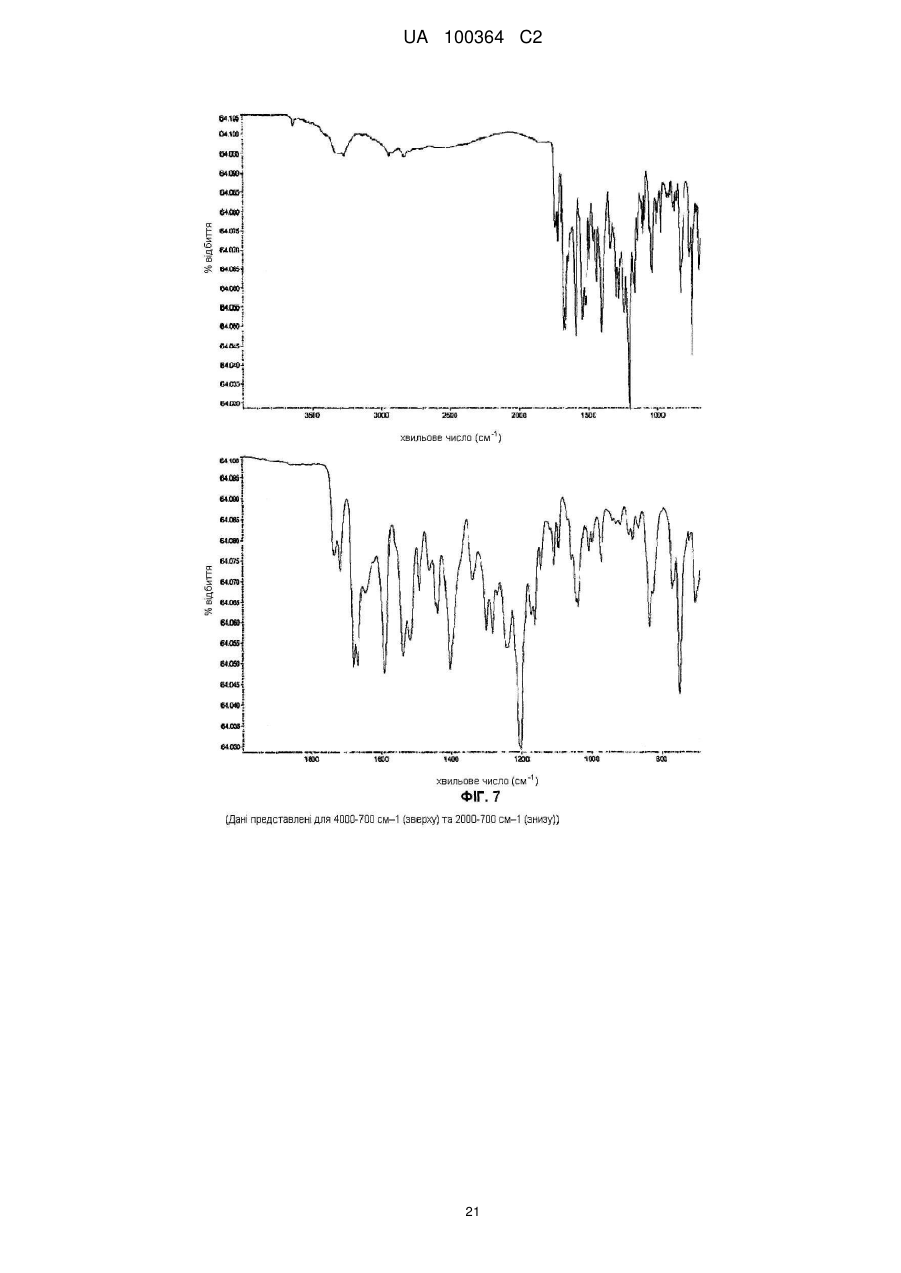
4. Сіль за п. 1, яка характеризується інфрачервоним спектром поглинання, який по суті відповідає спектру, що показано у Фіг. 7.
5. Сіль за будь-яким з пп. 1-4, яка є у мікронізованій формі.
6. Фармацевтична композиція, яка містить фармацевтично прийнятний носій та сіль за будь-яким з пп. 1-4.
7. Фармацевтична композиція за п. 6, яка додатково містить стероїдний антизапальний агент.
8. Фармацевтична композиція за п. 7, де стероїдним антизапальним агентом є 6α,9α-дифлуор-17α-[(2-фуранілкарбоніл)окси]-11β-гідрокси-16α-метил-3-оксо-андроста-1,4-дієн-17β-карботіонової кислоти S-флуорметиловий естер або його сольват.
9. Фармацевтична композиція за п. 7, де стероїдним антизапальним агентом є флютиказону пропіонат.
10. Фармацевтична композиція за п. 6, яку формують для застосування інгаляцією.
11. Фармацевтична композиція за п. 6 у мікронізованій формі.
12. Фармацевтична композиція за п. 10, де носієм є лактоза, крохмаль, манітол, декстроза, полімолочна кислота, полілактид-когліколід або їх комбінація.
13. Комбінація, що містить:
(а) сіль за будь-яким з пп. 1-4; та
(b) стероїдний антизапальний агент.
14. Комбінація за п. 13, де стероїдним антизапальним агентом є 6α,9α-дифлуор-17α-[(2-фуранілкарбоніл)окси]-11β-гідрокси-16α-метил-3-оксо-андроста-1,4-дієн-17β-карботіонової кислоти S-флуорметиловий естер або його сольват.
15. Комбінація за п. 13, де стероїдним антизапальним агентом є флютиказону пропіонат.
16. Сукцинат біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру або його сольват, згідно з п. 1, для застосування у терапії або як медикаменту.
17. Застосування сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру або його сольвату, згідно з п. 1, для виробництва медикаменту, призначеного для лікування розладу легень.
18. Застосування за п. 17, де розладом легень є хронічна обструктивна хвороба легень або астма.
19. Застосування за п. 17 або 18, де медикамент містить стероїдний антизапальний агент.
20. Застосування за п. 19, де стероїдним антизапальним агентом є 6α,9α-дифлуор-17α-[(2-фуранілкарбоніл)окси]-11β-гідрокси-16α-метил-3-оксо-андроста-1,4-дієн-17β-карботіонової кислоти S-флуорметиловий естер або його сольват.
21. Застосування за п. 19, де стероїдним антизапальним агентом є флютиказону пропіонат.
22. Спосіб отримання форми 1 сукцинату за п. 1, при якому здійснюють такі етапи:
розчинення сукцинату у водному ТГФ (10-18 %) при температурі 18-23 °С;
додавання першого об'єму нижчого спирту, який є або етанолом або ізопропанолом, та нагрівання до 32-40 °С;
необов'язково внесення затравки форми 1;
додавання другого об'єму нижчого спирту;
охолодження до температури 18-23 °С; та
збирання кристалічного продукту.
Текст
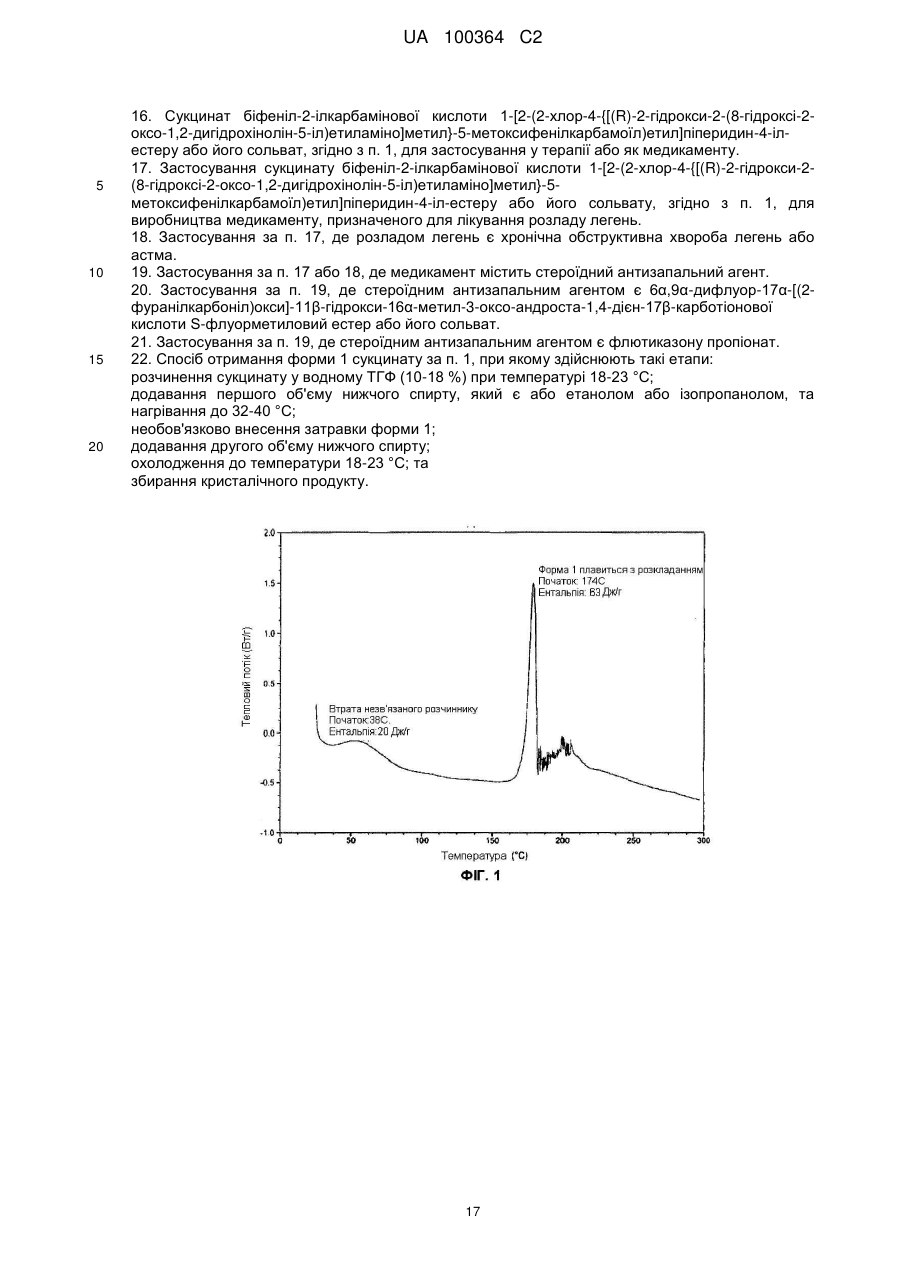
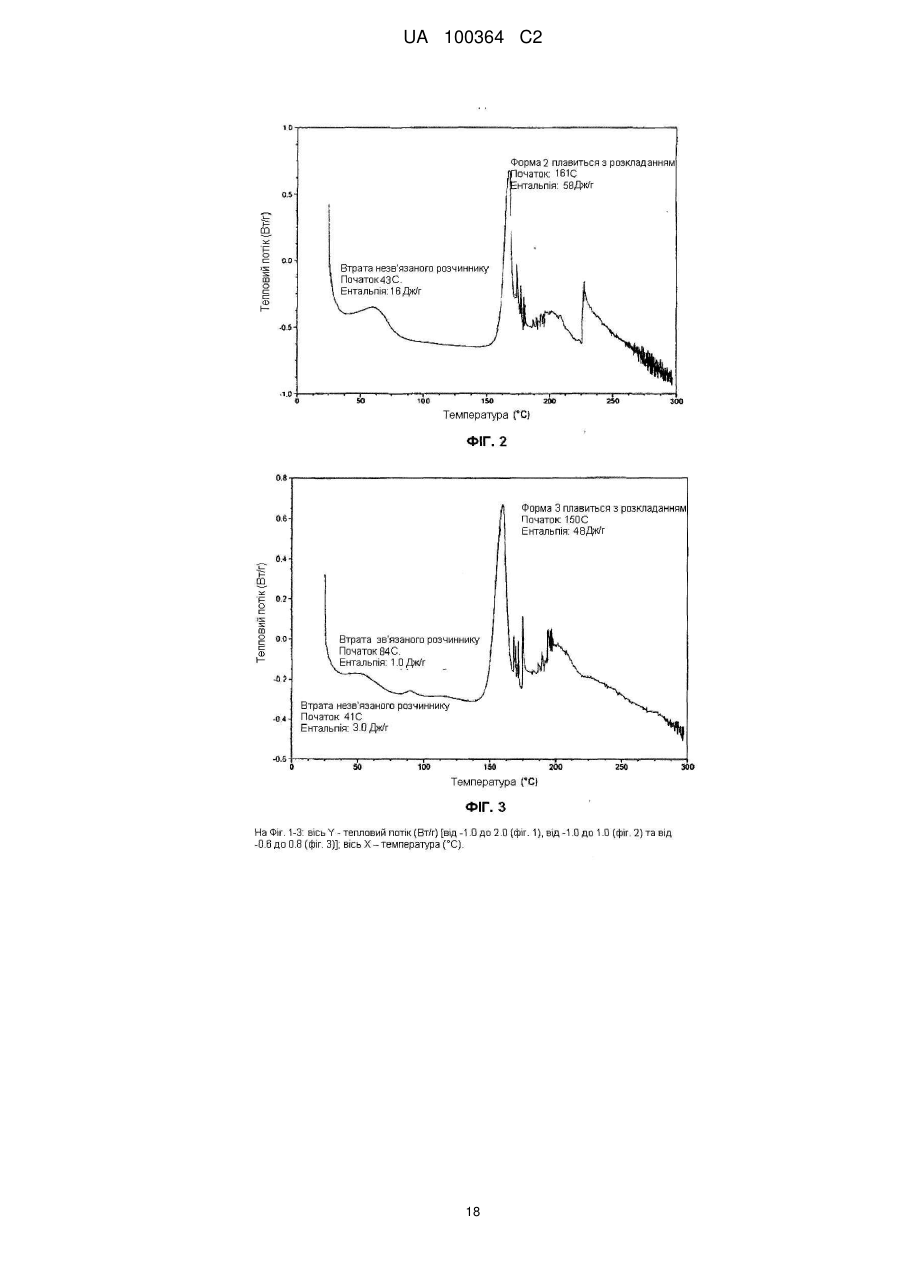
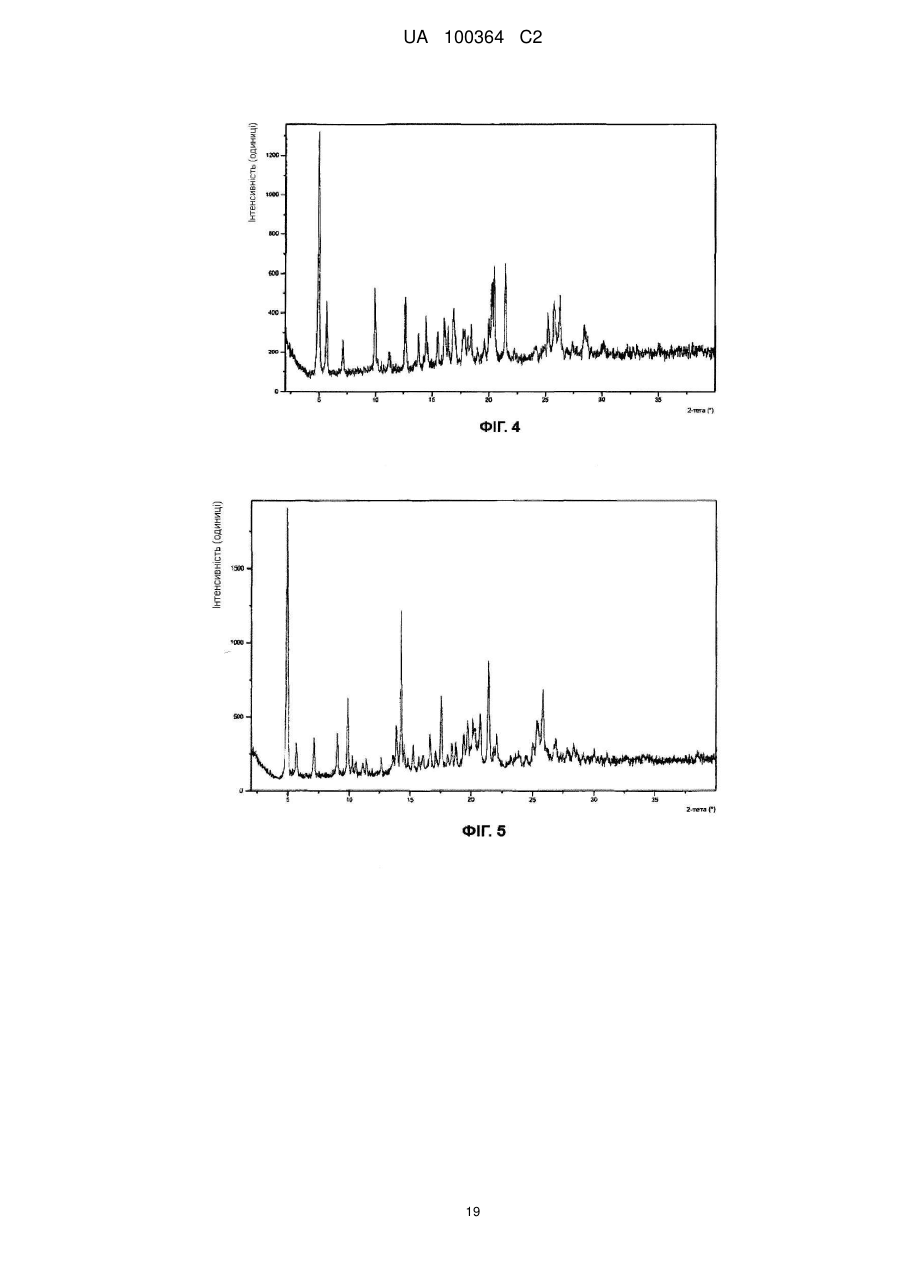
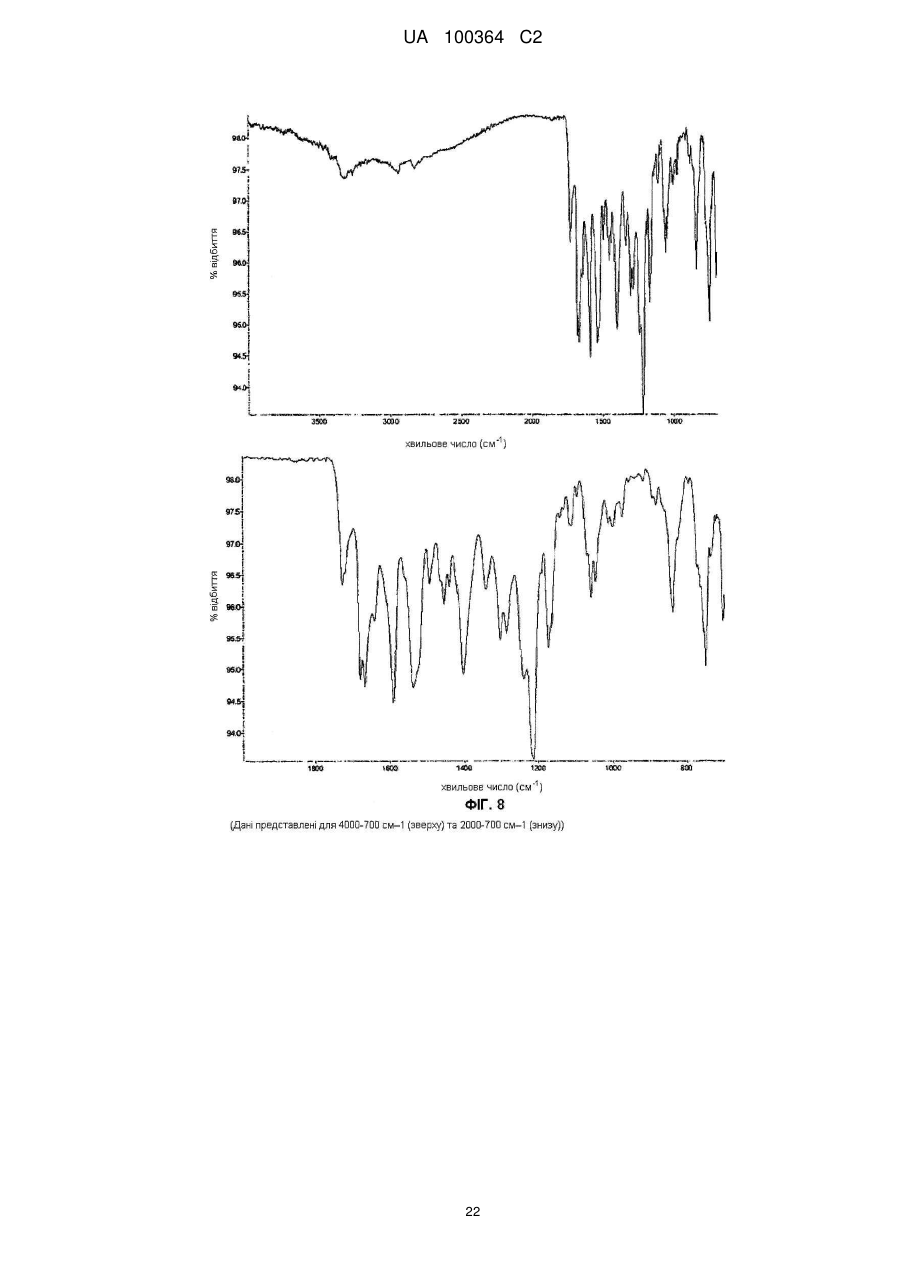
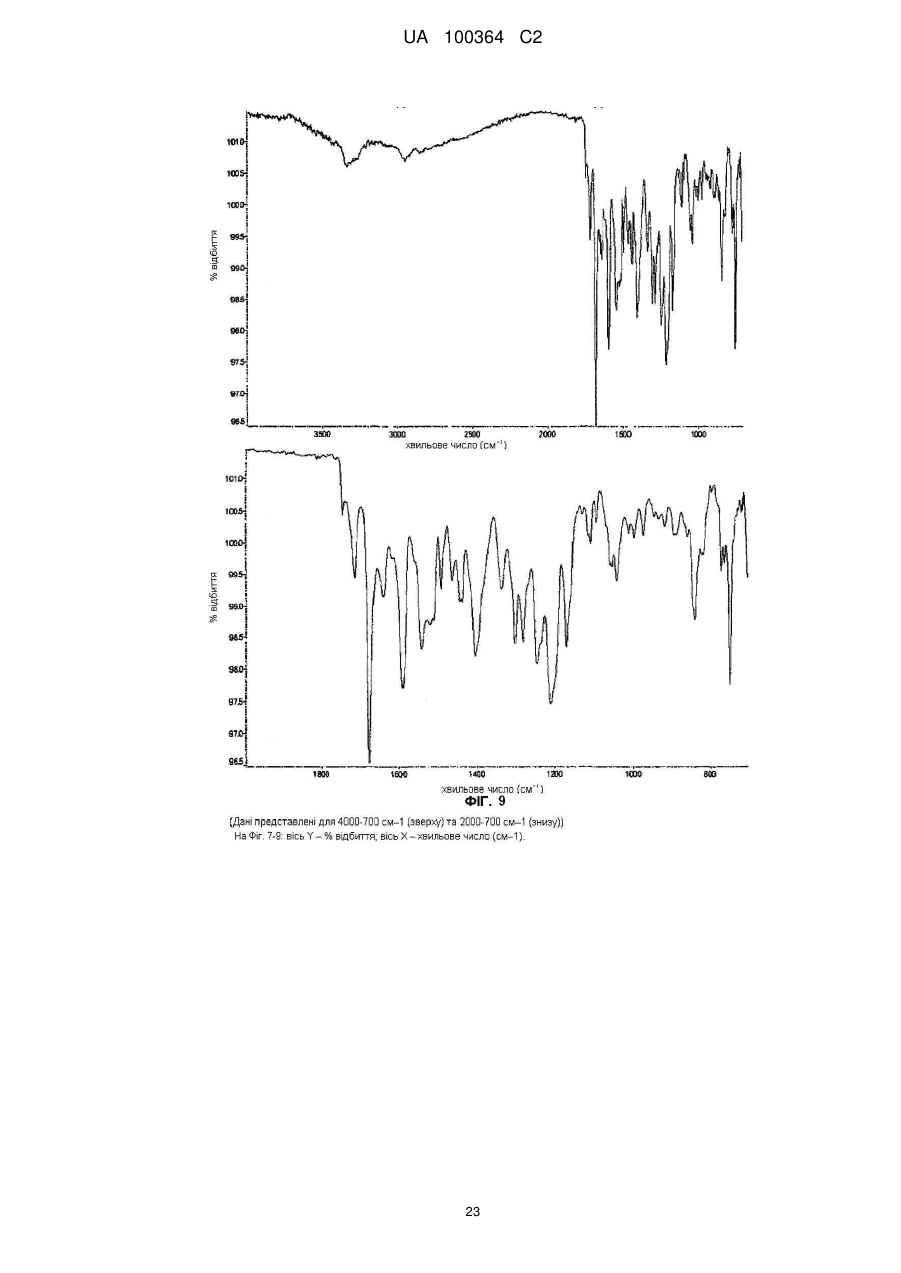
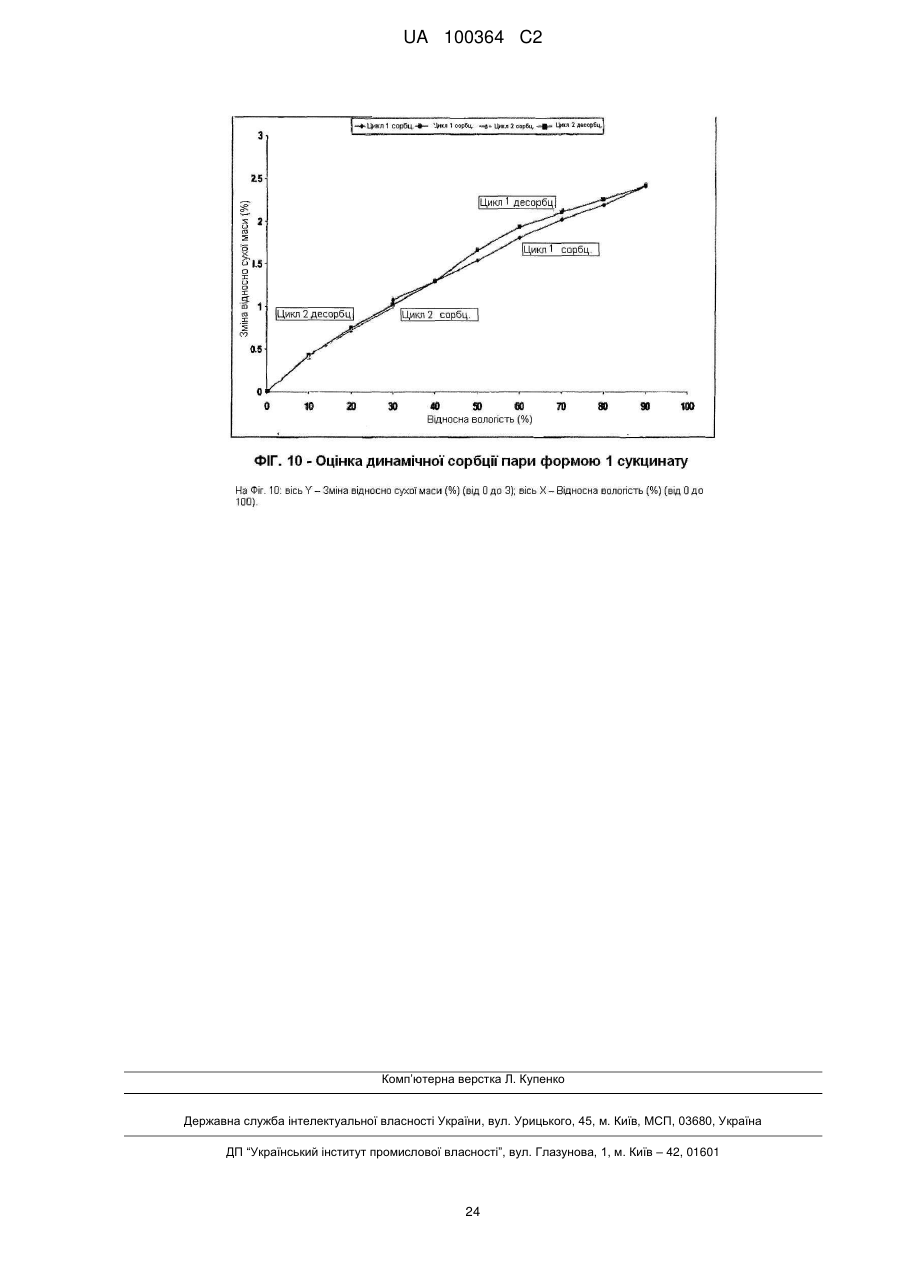
Реферат: Сукцинат біфеніл-2-ілкарбамінової кислоти 1-[2-(2-xлop-4-{[(R)-2-гiдpoкcи-2-(8-гідрокси-2-оксо1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру для застосування при лікуванні легеневих розладів. UA 100364 C2 (12) UA 100364 C2 UA 100364 C2 5 10 15 20 25 30 35 40 45 50 Заявлений винахід стосується нового сукцинату біфенільної сполуки, зокрема кристалічних твердих форм сукцинату. Біфенільна сполука, як очікують, буде корисною як терапевтичний агент для лікування легеневих розладів. Цей винахід також стосується фармацевтичної композиції, що містить сіль або отримана з цієї солі, способів та інтермедіатів для отримання солі та способів застосування солі для лікування легеневого розладу. Міжнародна патентна заявка РСТ/US2004/004449, WО 2004/074246 А2 (Тhеrаvаnсе Іnс, Sоuth Sаn Frаnсіsсо, Саlіfоrnіа, US) розкриває нові біфенільні сполуки, що є корисними як терапевтичні агенти для лікування легеневих розладів, як-то хронічна обструктивна хвороба легень (СОРD) та астма. Зокрема, біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5метоксифенілкарбамоїл)етил]піперидин-4-іл-естер є конкретно розкритим у цих заявках як такий, що має активність мускаринового антагоністу та агоністу β2-адренергічного рецептору. Хімічна структура біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-ілестеру є представленою формулою І: Терапевтичні агенти, корисні для лікування легеневих розладів, переважно застосовують безпосередньо у респіраторний тракт інгаляцією. Для цього розроблені кілька типів фармацевтичних пристроїв для інгаляції для застосування терапевтичних агентів інгаляцією, охоплюючи інгалятори сухого порошку (DРІ), інгалятори з вимірюваною дозою (МDІ) та розпилювальні інгалятори. При отриманні фармацевтичних композицій та композицій для застосування у таких пристроях, дуже бажано мати кристалічну форму терапевтичного агенту, що не є ані гігроскопічною, ані такою, що розпливається на повітрі, та, котра має відносно високу точку плавлення (тобто більше, ніж приблизно 150 °C), таким чином даючи матеріал, що можна мікронізувати без значного розкладання або втрати кристалічності. Міжнародна патентна заявка РСТ/US2004/004449, WО 2004/074246 А2 (Тhеrаvаnсе Іnс, Sоuth Sаn Frаnсіsсо, Саlіfоrnіа, US), раgе 135, як приклад 35, описує отримання сполуки формули І як ді-трифлуорацетату у ліофілізованій формі. Міжнародна патентна заявка РСТ/US2005/029013, WО 2006/023454, fіlеd 15 Аug 2005, (Тhеrаvаnсе Іnс, Sоuth Sаn Frаnсіsсо, Саlіfоrnіа, US) описує кристалічні 1,2-етандисульфонати сполуки формули І. Залишається необхідність подальшої ідентифікації стабільної, такої, що не розпливається на повітрі, кристалічної солі сполуки формули І, котра має прийнятний рівень гігроскопічності та відносно високу точку плавлення. Заявлений винахід стосується сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру, особливо його кристалічної форми або сольвату. В одному втіленні кристалічна форма солі заявленого винаходу, далі названа як форма 1, має точку плавлення більше, ніж приблизно 170 °C та виявлена як така, що не розпливається на повітрі, навіть при дії атмосферної вологи. Інші форми кристалічної солі, далі названі як форма 2 та 3, ідентифіковані також. Серед інших застосувань сукцинат сполуки формули І є корисним для отримання фармацевтичних композицій, котрі, як очікують, будуть корисними для лікування легеневих розладів. Відповідно, у наступному втіленні, заявлений винахід стосується фармацевтичної композиції, що містить фармацевтично прийнятний носій та сукцинат біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру, особливо його кристалічну форму або сольват. В особливому втіленні фармацевтична композиція цього винаходу крім того містить стероїдний антизапальний агент, як-то кортикостероїд; мускариновий антагоніст або інгібітор фосфодіестерази-4; або їх комбінацію. 1 UA 100364 C2 5 10 15 20 25 30 35 40 45 50 55 60 У ще одному втіленні цей винахід стосується фармацевтичної композиції, що містить водний ізотонічний фізіологічний розчин, що містить сукцинат біфеніл-2-ілкарбамінової кислоти 1-[2-(2хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру, де розчин має рН у межах приблизно 4-6. У ще одному втіленні цей винахід стосується комбінації, що містить: (a) сукцинат біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-ілестеру, особливо його кристалічну форму або сольват; та (b) стероїдний антизапальний агент. Сполука формули І має активність мускаринового антагоністу та агоністу β2-адренергічного рецептору. Відповідно, сукцинат цього винаходу, як очікують, буде корисним як терапевтичний агент для лікування легеневих розладів, як-то астма та хронічна обструктивна хвороба легень. Відповідно, в одному з аспектів цей винахід стосується способу лікування легеневого розладу, який полягає у застосуванні до пацієнта при необхідності лікування терапевтично ефективної кількості сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(S)-2-гідрокси2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру або його сольвату. На додаток, у ще одному з аспектів цей винахід стосується способу створення бронходилатації у пацієнта, який полягає у застосуванні до пацієнта інгаляцією кількості, що створює бронходилатацію, сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2гідрокси-2-(8-гідрокси-2-оксо-1,2-дедигідрохінолін-5-іл)етиламіно]метил}-5метоксифенілкарбамоїл)етил]-піперидин-4-іл-естеру або його сольвату. Цей винахід також стосується способу лікування хронічної обструктивної хвороби легень або астми, який полягає у застосуванні до пацієнта при необхідності лікування терапевтично ефективної кількості сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру або його сольвату, Цей винахід також стосується способів отримання сукцинату формули І, особливо його кристалічної форми. Відповідно, цей винахід стосується способу отримання сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру або його сольвату; спосіб полягає у контактуванні біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру з бурштиновою кислотою. Це утворення солі етап можна зручно проводити, застосовуючи відповідну вільну основу, отриману з відповідного триалкілсилілокси-захищеного попереднику, без необхідності повного виділення проміжної вільної основи. Цей винахід також стосується сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру, або його кристалічної форми чи сольвату для застосування у терапії або як медикаменту. На додаток, цей винахід стосується застосування сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру або його кристалічної форми чи сольвату для виробництва медикаменту; особливо для виробництва медикаменту для лікування легеневого розладу. Цей винахід також стосується застосування (a) сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-ілестеру, або його кристалічної форми чи сольвату; та (b) стероїдного антизапального агенту; у виробництві медикаменту для лікування легеневого розладу. Цей винахід також стосується сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру, або його кристалічної форми чи сольвату у мікронізованій формі; та фармацевтичних композицій, що містять фармацевтично прийнятний носій та сукцинат біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]-піперидин-4-ілестеру або його кристалічну форму чи сольват у мікронізованій формі. 2 UA 100364 C2 5 10 15 20 25 30 35 40 45 50 55 Різні аспекти заявленого винаходу ілюстровані з посиланням на нижченаведені графіки. Фіг. 1 показує запис диференційної сканувальної калориметрії (ДСК) для зразку першої кристалічної форми сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру цього винаходу, далі названої як форма 1. Фіг. 2 показує запис диференційної сканувальної калориметрії (ДСК) для зразку другої кристалічної форми сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру цього винаходу, далі названої як форма 2. Фіг. 3 показує запис диференційної сканувальної калориметрії (ДСК) для зразку третьої кристалічної форми сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру цього винаходу, далі названої як форма 3. Фіг. 4 показує рентгенодифрактограму від порошку (РДП) зразку кристалічного 1,2-сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру (форма 1). Фіг. 5 показує рентгенодифрактограму від порошку (РДП) зразку кристалічного 1,2-сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру (форма 2). Фіг. 6 показує рентгенодифрактограму від порошку (РДП) зразку кристалічного 1,2-сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру (форма 3). Фіг. 7 показує інфрачервоні спектри поглинання (ІЧ) зразку кристалічного 1,2-сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(S)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру (форма 1). Фіг. 8 показує інфрачервоні спектри поглинання (ІЧ) зразку кристалічного 1,2-сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру (форма 2). Фіг. 9 показує інфрачервоні спектри поглинання (ІЧ) зразку кристалічного 1,2-сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру (форма 3). Фіг. 10 показує профіль динамічної сорбції пари зразку кристалічного сукцинату (форма 1). Цей винахід стосується сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру, особливо його кристалічних форм (поліморфів), охоплюючи їх сольвати. Кристалічний сукцинат заявленого винаходу може бути присутнім як одна або більше різних відмінних кристалічних форм. Заявлений винахід охоплює усі такі тверді форми. В одному втіленні заявлений винахід стосується першої кристалічної форми сукцинату сполуки формули І: його форми 1. У наступному втіленні, заявлений винахід стосується другої кристалічної форми сукцинату сполуки формули І: його форми 2. У наступному втіленні, заявлений винахід стосується третьої кристалічної форми сукцинату сполуки формули І: його форми 3. Активний терапевтичний агент у цих солях (тобто, сполуки формули І) містить один хіральний центр, що має (R) конфігурацію. Однак, фахівцю зрозуміло, що несуттєві кількості (S) стереоізомеру можуть бути присутніми у композиції цього винаходу, якщо не вказане інше, за умови, що будь-як корисність композицій у цілому не є усуненою присутністю такого ізомеру. Сполуку формули І названо, застосовуючи комерційно-доступну програму АutоNоm (МDL, Sаn Lеаndrо, Саlіfоrnіа). Визначення При описі сполук, композицій та способів цього винаходу, наступні терміни мають нижченаведені значення, якщо не вказане інше. 3 UA 100364 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "точка плавлення", як застосовано тут, означає температуру початку плавлення як спостережено диференційною сканувальною калориметрією. Термін "мікронізована форма" означає форму частинок, у котрий принаймні 90 % частинок мають діаметр менше, ніж приблизно 10 мкм. Термін "сольват" означає комплекс або агрегат, утворений одною або більше молекулами розчиненої речовини, тобто сукцинату сполуки формули І та одної або більше молекул розчиннику. Такі сольвати звичайно мають по суті фіксоване молярне співвідношення розчиненої речовини та розчиннику. Цей термін також охоплює клатрати, охоплюючи клатрати з водою. Репрезентативні розчинники охоплюють, наприклад, воду, метанол, етанол, ізопропанол, оцтову кислоту тощо. Коли розчинником є вода, утворений сольват є гідратом. Термін "терапевтично ефективна кількість" означає кількість, достатню для лікування, при застосуванні до пацієнта при необхідності лікування. Термін "лікування", як застосовано тут, означає лікування хвороби або медичного стану (якто СОРD) у пацієнта, як-то ссавця (особливо людини), що охоплює: (a) попередження появи хвороби або медичного стану, тобто, профілактичне лікування пацієнта; (b) полегшення хвороби або медичного стану, тобто, усунення або спричинення регресії хвороби або медичного стану у пацієнта; (c) пригнічення хвороби або медичного стану, тобто, уповільнення або затримування розвитку хвороби або медичного стану у пацієнта; або (d) полегшення симптомів хвороби або медичного стану у пацієнта. Термін "форма окремої дози" стосується фізично дискретної одиниці, придатної для дозування пацієнта, тобто, кожної одиниці з вмістом попередньо визначеної кількості солі винаходу, розрахованої для продукування бажаного терапевтичного впливу, поодинці або у комбінації із одною або більше додатковими одиницями. Наприклад, такими формами окремих доз можуть бути капсули інгалятору сухого порошку або блістерні стрічки, виміряні дози з інгалятору з вимірюваною дозою, капсули, таблетки, пілюлі, тощо. Сукцинати винаходу Сукцинат біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-ілестеру цього винаходу можна отримувати з біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру та бурштинової кислоти. Сукцинат цього винаходу звичайно містить приблизно 0,90-1,10 молярних еквівалентів бурштинової кислоти на молярний еквівалент сполуки формули І; охоплюючи приблизно 0,951,05 молярних еквівалентів бурштинової кислоти на молярний еквівалент сполуки формули І. В особливому втіленні сукцинат цього винаходу містить приблизно 1 молярний еквівалент бурштинової кислоти на молярний еквівалент сполуки формули І. Молярне співвідношення бурштинової кислоти до біфеніл-2-ілкарбамінової кислоти 1-[2-(2хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру можна легко визначати різними способами, доступними фахівцям. Наприклад, такі молярні співвідношення можна легко визначати за 1 допомогою Н ЯМР. Альтернативно, для визначення молярного співвідношення можна застосовувати аналіз на елементи. Біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]-піперидин-4-іл-естер можна зручно отримати з відповідного 2-трет-бутилдиметилсиланілокси)-захищеного попереднику. Цей попередник можна позбавити захисту, застосовуючи джерело флуорид-іону, як-то цезій флуорид, з оцтовою кислотою, у розчиннику, як-то метанол. Отримання т(Бутилдиметилсиланілокси)-захищеного попереднику є описаним у міжнародній патентній заявці РСТ/US2004/004449, WО 2004/074246 А2, 135, Отримання 98. Бурштинова кислота є комерційно доступною, наприклад, від Sіgmа-Аldrсh Со. Ltd., Gіllіnghаm, UК. В одному втіленні бурштинова кислота має чистоту не менше 99 % (як визначено за допомогою ВЕРХ). Кристалічну сіль цього винаходу можна отримувати контактуванням біфеніл-2ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру з приблизно 0,75-1,3 молярними еквівалентами бурштинової кислоти. Загалом, цю реакцію проводять в інертному розріджувачі при температурі у межах приблизно 0 °C - 60 °C; охоплюючи приблизно 20 °C 55 °C, як-то приблизно 25 °C - 55 °C. Придатні інертні розріджувачі для цієї реакції охоплюють, 4 UA 100364 C2 5 10 15 20 25 30 35 40 45 50 55 60 але без обмеження, метанол, етанол, ізопропанол, ізобутанол, етилацетат, тетрагідрофуран, дихлорметан тощо, або їх суміш, необов'язково з вмістом води. В одному втіленні бурштинову кислоту можна додавати як розчин, у розчиннику, як-то етанол або ізопропанол, до розчину біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру. Розчину таким чином утвореної солі тоді дають охолонути протягом часу, необов'язково із затравкою при проміжній температурі, та необов'язково з перемішуванням, для утворення кристалічного продукту. У наступному втіленні розчин бурштинової кислоти в етанолі додають до розчину біфеніл-2-ілкарбамінової кислоти 1[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру у подібному об'ємі тетрагідрофурану, при температурі приблизно 55 °C, цей розчин тоді охолоджують до 45 °C, засівають, тоді далі охолоджують до 20 °C та перемішують протягом подовженого періоду, наприклад, приблизно 48 годин, при цьому утворюється кристалічний продукт. У наступному втіленні розчин бурштинової кислоти в ізопропанолі можна додавати до розчину біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру у приблизно трикратному об'ємі тетрагідрофурану, при температурі приблизно 37 °C, цей розчин тоді засівають та тоді тримають при цій температурі протягом приблизно 4 годин, тоді охолоджують до 15 °C протягом періоду кількох годин, наприклад, приблизно 4 годин, а тоді залишають при цій температурі, при цьому утворюється кристалічний продукт. Цей спосіб, як було виявлено, дає переважно форму 3. У наступному втіленні, кристалічний сукцинат можна отримувати зі сполуки формули І додаванням розчину бурштинової кислоти в етанолі порціями до розчину біфеніл-2ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру в етанолі, при температурі приблизно 50 °C, протягом періоду приблизно 4 годин, а потім додаванням води (приблизно 10-15 об. %, та тоді циклізацією температури, наприклад, у межах 0-40 °C, протягом періоду кількох діб, наприклад, 2-5 діб, звичайно приблизно 3 діб. Цей спосіб, як було виявлено, дає переважно форму 1. У наступному втіленні, кристалічний сукцинат можна отримувати зі сполуки формули І додаванням розчину бурштинової кислоти порціями протягом годин, наприклад, 3-7 годин, звичайно приблизно 5 годин, до суспензії сполуки формули 1 в інертній рідині, як-то метанол fі або тетрагідрофуран, при підвищеній температурі, наприклад, у межах 40-60 С, звичайно приблизно 50 °C, та тоді піддаванням утвореної суспензії циклізації температури, наприклад, у межах 0-40 °C, протягом періоду кількох діб, наприклад, 3-7 доби, звичайно приблизно 5 доби. Цей спосіб, як було виявлено, дає переважно форму 2 (розчинник = метанол) або переважно форму 3 (розчинник = ТГФ), залежно від застосовуваного розчиннику. У вищенаведених способах, продукт від зняття захисту силіл-захищеного похідного сполуки формули І може контактувати з бурштиновою кислотою без необхідності повного виділення або очистки інтермедіату. Слід розуміти, що чистота спочатку отриманої кристалічної солі може бути поліпшена перекристалізацією. Більш того, можуть бути вибраними умови перекристалізації, котрі визначають, яку форму солі отримують. Таким чином, виявлено, що форму 1 можна зручно отримати перекристалізацією спочатку отриманої кристалічної солі з антирозчинником з водного ТГФ, застосовуючи нижчий спирт, якто етанол або ізопропанол як антирозчинник. Як виявлено, % води є важливим, оскільки призводить до неповного розчинення чи неповної перекристалізації та розкладання. Також виявлене корисним обмеження вищої застосовуваної температури для запобігання небажаного розкладання продукту. Виявлено бажаність повільної перекристалізації, протягом годин, для поліпшення якості таким чином утворених кристалів. На відміну, характеристики розчинності та відмінність у розчинності між вищими та нижчими температурами у межах одиничних розчинників, як виявлено, заважає перекристалізації з розчиннику. Відповідно, у наступному втіленні, заявлений винахід стосується способу отримання форми 1 сукцинату, котрий має етапи: розчинення сукцинату у водному ТГФ (10-18 %, наприклад, 10-16 %), при температурі у межах 18-23 °C, наприклад, приблизно 20 °C; додавання першого об'єму нижчого спирту як антирозчиннику, наприклад, етанолу або ізопропанолу, особливо ізопропанолу, та нагрівання до 32-40 °C, звичайно 36±3 °C; необов'язково із затравкою формою 1; 5 UA 100364 C2 5 10 15 20 25 30 додавання другого об'єму нижчого спирту, наприклад, протягом кількох годин, переважно приблизно 12 годин охолодження до температури у межах 18-23 °C, наприклад, приблизно 20 °C; та збирання кристалічного продукту. В особливому втіленні кристалічний сукцинат, наприклад, форму 3 солі, розчиняють у тетрагідрофурані з вмістом 14 % води, при температурі приблизно 20 °C, до чого можна тоді додавати подібний об'єм ізопропанолу. Розчин нагрівають до 36 °C, та тоді додають затравочні кристали. Звичайно, співвідношення маси затравочних кристалів до маси кристалічної солі у розчині є приблизно 1:400. Розчин тоді перемішують при цій температурі протягом короткого часу, наприклад, приблизно 1 годину, після чого ще додають ізопропанол протягом годин, наприклад, приблизно 12 годин, протягом чого відбувається кристалізація. Після наступного короткого періоду, наприклад, приблизно 1 години, таким чином утворену суспензію Q охолоджують до температури приблизно 20 С та залишають протягом наступного короткого періоду, наприклад, 1 години, перед тим, як кристалічний продукт, наприклад, форму 1 солі, збирають фільтруванням. Виявлено корисним для отримання кристалічного сукцинату з рівнем чистоти, придатним для застосування як активного фармацевтичного інгредієнту (АРІ) двоетапним способом, охоплюючи початкове отримання інтермедіату типу солі, а потім перекристалізацією цього типу інтермедіату контрольованим чином та із затравкою, для отримання бажаної форми, що має бажану якість кристалів. В одному втіленні тип інтермедіату виділяють по суті як форму 3, як наслідок застосовуваних умов, та це тоді перетворюють у бажану форму 1 перекристалізацією з антирозчинником. Високопродуктивні способи скринінгу поліморфів, варіаціями умов кристалізації, наприклад, розчиннику, температури, зараз розвиваються та стають доступними фахівцю, або продаються комерційними постачальниками, як-то Аvаntіum Тесhnоlоgіеs. Наступні кристалічні форми можна ідентифікувати, застосовуючи такі високопродуктивні способи. У наступному аспекті заявленого винаходу виявлено, що тип біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру, придатний для застосування у наступній реакції утворення сукцинату (початковий продукт етапу 3) можна зручно отримати з 1-(3-{[2-хлор-4-(гідроксиметил)-5-метоксифеніл]аміно}-3--оксопропіл)піперидин-4-іл біфеніл-2-ілкарбамату (у міжнародній патентній заявці РСТ/US2004/004449, WО 2004/074246 А2, раgе 134, Отримання 96) три-етапним способом, без необхідності повного виділення або очистки інтермедіатів, з етапів 1 та 2, згідно зі схемою 1: 6 UA 100364 C2 5 10 15 20 25 Схема1 Тверді форми У наступному втіленні, заявлений винахід стосується трьох відмінних кристалічних форм сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру, форм 1, 2 та 3, що ідентифіковані диференційною сканувальною калориметрією (ДСК). Кращу тверду форму, позначену як форма 1, характеризують високою точкою плавлення, як доказано диференційною сканувальною калориметрією (ДСК), при приблизно 174 °C. Залишкові тверді форми, форми 2 та 3, характеризують точками плавлення, як доказано диференційною сканувальною калориметрією (ДСК), при приблизно 161 °C та 150 °C відповідно. Більш того, форму 1 характеризують рентгенодифрактограмою від порошку (РДП), що має значущі дифракційні піки при значеннях 2θ 5,0±0,3, та 10,0±0,3. Більш того, форму 2 характеризують рентгенодифрактограмою від порошку (РДП), що має значущі дифракційні піки при значеннях 2θ 5,0±0,3, та 9,9±0,3. Більш того, форму 3 характеризують рентгенодифрактограмою від порошку (РДП), що має значущі дифракційні піки при значеннях 2θ 5,0±0,3. На додаток, форму 1 характеризують її інфрачервоним спектром поглинання (ІЧ), котрий показує значущі смуги поглинання при приблизно: 3265, 2832, 1735, 1718, 1679, 1669, 1591, 1540, 1518, 1493, 1439, 1405, 1339, 1302, 1283, 1239, 1202, 1163, 1144, 1107, 1095, 1039, 1009, -1 973, 921, 885, 868, 838, 773, 751, та 707 см . На додаток, форму 2 характеризують її інфрачервоним спектром поглинання (ІЧ), котрий показує значущі смуги поглинання при приблизно: 3317,2947, 1728, 1678, 1667, 1591, 1537, 1494, 1453, 1439, 1403, 1339,1302, 1284, 1213, 1172, 1111, 1058, 1046,999, 975, 885, 839, та 750 -1 см . На додаток, форму 3 характеризують її інфрачервоним спектром поглинання (ІЧ), котрий показує значущі смуги поглинання при приблизно: 3335, 2949, 1745, 1715, 1678, 1641, 1592, 7 UA 100364 C2 5 10 15 20 25 30 35 40 45 50 55 60 1542, 1493, 1464, 1439, 1405, 1338, 1303, 1283, 1247, 1211, 1170, 1109, 1093, 1053, 1041, 997, -1 974, 919, 889, 842, 774, 766, 751 та 721 см . Форма 1, як продемонстровано, має оборотний профіль сорбції/десорбції із гарним рівнем гігроскопічності (тобто менше, ніж приблизно 2,0 % приросту маси у межах вологості від 30 % відносної вологості до 90 % відносної вологості), як показано за її профілем динамічної сорбції пари. Ці властивості солей цього винаходу далі ілюстровані у прикладах нижче. Фармацевтичні композиції Сукцинат сполуки формули І можна звичайно застосовувати до пацієнта у формі фармацевтичної композиції. Такі фармацевтичні композиції можна застосовувати до пацієнта будь-яким прийнятним шляхом застосування, охоплюючи, без обмеження, інгаляцію, пероральні, назальні, місцеві (охоплюючи трансдермальні) та парентеральні способи застосування, зокрема застосування інгаляцією. Однак, фахівцю зрозуміло що, як тільки кристалічну сіль цього винаходу створено, вона може далі не бути у кристалічній формі, тобто, сіль може бути розчиненою у придатному носії, або бути вихідною кристалічною формою. Відповідно, в одному з аспектів цей винахід стосується фармацевтичної композиції, що містить фармацевтично прийнятний носій або наповнювач та сукцинат біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру або його сольвату. Необов'язково, такі фармацевтичні композиції можуть містити інші терапевтичні та/або формувальні агенти, якщо бажано. Фармацевтичні композиції цього винаходу звичайно містять терапевтично ефективну кількість сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-ілестеру або його сольвату. Звичайно, такі фармацевтичні композиції повинні містити приблизно 0,01 - приблизно 95 % за масою активного агенту, у тому числі приблизно 0,01 - приблизно 30 % за масою, як-то приблизно 0,01 - приблизно 10 % за масою активного агенту. Будь-який звичайний носій або наповнювач можна застосовувати у фармацевтичних композиціях цього винаходу. Вибір конкретного носія або наповнювачу, або комбінації носіїв або наповнювачів, залежить від режиму застосування, що є застосовуваним для лікування конкретного пацієнту або типу медичного стану або стану хвороби. Стосовно цього, отримання придатної фармацевтичної композиції для конкретного режиму застосування є добре відомим фахівцям. На додаток, інгредієнти для таких композицій є комерційно доступними від, наприклад, Sіgmа, Р.О. Вох 14508, St. Lоuіs, МО 63178. Для ілюстрації звичайні способи th композиції є описаними у Rеmіngtоn: Тhе Sсіеnсе аnd Рrасtісе оf Рhаrmасу, 20 Еdіtіоn, Lірріnсоtt Wіllіаms & Whіtе, Ваltіmоrе, Маrуlаnd де(2000); та Н.С. Аnsеl еt аl., Рhаrmасеutісаl Dоsаgе Fоrms th аnd Drug Dеlіvеrу Sуstеms, 7 Еdіtіоn, Lірріnсоtt Wіllіаms & Whіtе, Ваltіmоrе, Маrуlаnd (1999). Репрезентативні приклади матеріалів, котрі можуть бути фармацевтично прийнятними носіями, охоплюють, але без обмеження: (1) цукри, як-то лактоза, глюкоза та сахароза; (2) крохмалі, як-то кукурудзяний крохмаль та картопляний крохмаль; (3) целюлоза, та її похідні, якто натрій-карбоксиметилцелюлоза, етилцелюлоза та ацетат целюлози; (4) розпорошений трагакант; (5) солод; (6) желатин; (7) тальк; (8) наповнювачі, як-то масло какао та воски для супозиторію; (9) олії, як-то арахісова олія, бавовняна олія, сафлорова олія, кунжутна олія, оливкова олія, кукурудзяна олія та соєва олія; (10) гліколі, як-то пропіленгліколь; (11) поліоли, як-то гліцерин, сорбітол, манітол та поліетиленгліколь; (12) естери, як-то етилолеат та етиллаурат; (13) агар; (14) буферувальні агенти, як-то магній гідроксид та алюміній гідроксид; (15) альгінова кислота; (16) вода без пірогену; (17) ізотонічний фізіологічний розчин; (18) розчин Рингера; (19) етиловий спирт; (20) фосфатний буфер; (21) стиснуті газуваті пропеленти, як-то хлорфлуоркарбони та гідрофлуоркарбони; та (22) інші нетоксичні сумісні речовини, застосовувані у фармацевтичних композиціях. Фармацевтичні композиції цього винаходу звичайно отримують повним та тісним змішуванням солі винаходу з фармацевтично прийнятним носієм та одним або більше довільними інгредієнтами. Якщо необхідно або бажано, утворену однорідно змішану суміш можна тоді формувати або завантажувати у таблетки, капсули, пілюлі, каністри, картриджі, дозатори тощо, застосовуючи звичайні процедури та обладнання. В одному втіленні фармацевтичні композиції цього винаходу є придатними для інгаляції. Придатні фармацевтичні композиції для інгаляції повинні звичайно бути у формі аерозолю або порошку. Такі композиції загалом застосовують, застосовуючи добре відомі пристрої постачання, як-то розпилювальний інгалятор, інгалятор з вимірюваною дозою (МDІ), інгалятор сухого порошку (DРІ) або подібний пристрій постачання. 8 UA 100364 C2 5 10 15 20 25 30 35 40 45 50 55 У певному втіленні цього винаходу, фармацевтичну композицію, що містить активний агент, застосовують інгаляцією, застосовуючи розпилювальний інгалятор. Такі розпилювальні пристрої звичайно дають потік повітря високої швидкості, що дає фармацевтичну композицію, що містить активний агент, для розпилення, як туман, що поступає у респіраторний тракт пацієнта. Відповідно, при формуванні для застосування у розпилювальному інгаляторі активний агент звичайно розчиняють у придатному носії для утворення розчину. Придатні розпилювальні пристрої запропоновані комерційно, наприклад, РАRІ GmbН (Stаmbеrg, Gеrmаn). Інші розпилювальні пристрої охоплюють Rеsріmаt (Воеhrіngеr Іngеlhеіm) та розкриті, наприклад, у патентах США №№ 6,123,068 та WО 97/12687. Репрезентативна фармацевтична композиція для застосування у розпилювальному інгаляторі містить водний розчин, що містить приблизно 0,05 мкг/мл - 10 мг/мл сукцинату сполуки формули І або його сольвату. В одному втіленні водна розпилювальна композиція є ізотонічною. В одному втіленні водна розпилювальна композиція має рН у межах приблизно 4-6. В особливому втіленні водна розпилювальна композиція є буферованою цитратним буфером до рН приблизно 5. У ще одному конкретному втіленні водна розпилювальна композиція містить приблизно 0,1 мг/мл - 1,0 мг/мл еквівалентів вільної основи біфеніл-2-ілкарбамінової кислоти 1[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру. У ще одному певному втіленні цього винаходу, фармацевтичну композицію, що містить активний агент, застосовують інгаляцією, застосовуючи інгалятор сухого порошку. Такі інгалятори сухого порошку звичайно застосовують активний агент як вільно сипучий порошок, що диспергують у потоці повітря при вдиханні. Для отримання вільно сипучого порошку, активний агент звичайно формують з придатним наповнювачем, як-то лактоза, крохмаль, манітол, декстроза, полімолочна кислота, (РLА), полілактид-когліколід (РLGА) або їх комбінації. Звичайно, активний агент є мікронізованим та комбінованим з придатним носієм для утворення суміші мікронізованих частинок придатного для респірації розміру, де "мікронізовані частинки" або "мікронізована форма" означає, що принаймні 90 % частинок мають діаметр менше, ніж приблизно 10 мкм. Композиція сухого порошку може крім того містити третій агент, як-то магній стеарат, у кількості 0,1-2 мас. %, для стабілізації композиції. Репрезентативна фармацевтична композиція для застосування в інгаляторі сухого порошку містить лактозу, що має розмір частинок приблизно 1 мкм - 100 мкм та мікронізовані частинки сукцинату сполуки формули І, або його сольвату. Таку композицію сухого порошку можна зробити, наприклад, комбінуванням лактози з активним агентом та тоді змішуванням сухих компонентів. Альтернативно, якщо бажано, активний агент можна формувати без наповнювачу. Фармацевтичну композицію тоді звичайно завантажують у дозатор сухого порошку, або в інгаляційні блістерні стрічки, картриджі або капсули для застосування пристроєм постачання сухого порошку. Приклади пристроїв постачання інгалятору сухого порошку охоплюють Dіskhаlеr (GlахоSmіthКlіnе, Rеsеаrсh Тrіаnglе Раrk, NС) (дивись, наприклад, патент США № 5,035,237); Dіskus (GlахоSmіthКlіnе) (дивись, наприклад, патент США № 6,378,519; Тurbuhаlеr (АstrаZеnеса, Wіlmіngtоn, DЕ) (дивись, наприклад, патент США № 4,524,769); Rоtаhаlеr (GlахоSmіthКlіnе) (дивись, наприклад, патент США № 4,353,365) та Наndіhаlеr (Воеhrіngеr Іngеlhеіm). Наступні приклади придатних пристроїв DРІ є описаними у патентах США №№ 5,415,162, 5,239,993, та 5,715,810, WО-А-2006/018261, та WО-А-03/061743, та посиланнях, цитованих там. У ще одному певному втіленні цього винаходу, фармацевтичну композицію, що містить активний агент, застосовують інгаляцією, застосовуючи інгалятор з вимірюваною дозою. Такі інгалятори з вимірюваною дозою звичайно видають виміряну кількість активного агенту або фармацевтично прийнятної солі застосуванням стиснутого газуватого пропеленту. Відповідно, фармацевтичні композиції, де застосовують інгалятор з вимірюваною дозою, звичайно містять розчин або суспензію активного агенту у зрідженому пропеленті. Будь-який придатний зріджений пропелент можна застосовувати, у тому числі хлорфлуоркарбони, як-то ССІ3F, та гідрофлуоралкани (НFА), як-то 1,1,1,2-тетрафлуоретан (НFА 134а) та 1,1,1,2,3,3,3-гептафлуорн-пропан, (НFА 227). Внаслідок впливу хлорфлуоркарбонів на озоновий шар, композиції з вмістом НFА є загалом кращими. Додаткові довільні компоненти композиції НFА охоплюють співрозчинники, як-то етанол або пентан, та ПАР, як-то сорбітан триолеат, олеїнова кислота, лецитин та гліцерин. Дивись, наприклад, патент США № 5,225,183, ЕР 0717987 А2, та WО 92/22286. Репрезентативна фармацевтична композиція для застосування в інгаляторі з вимірюваною дозою містить приблизно 0,01 % - 5 % за масою сукцинату сполуки формули І, або його 9 UA 100364 C2 5 10 15 20 25 30 35 40 45 50 55 60 сольвату; приблизно 0 % - 20 % за масою етанолу; та приблизно 0 % - 5 % за масою ПАР; із залишком, що є НFА-пропелентом. Такі композиції звичайно отримують додаванням охолодженого або стиснутого гідрофлуоралкану у придатну ємність з вмістом активного агенту, етанолу (якщо є) та ПАР (якщо є). Для отримання суспензії активний агент мікронізують та тоді комбінують із пропелентом. Композицію тоді завантажують у аерозольний балон інгалятору, котрий створює порцію виміряної дози. Приклади інгалятору з виміряною дозою, розроблені конкретно для застосування з НFА-пропелентами, запропоновані у патентах США №№ 6,006,745 та 6,143,277. Альтернативно, композицію суспензії можна отримувати розпилювальною сушкою покриття ПАР на мікронізовані частинки активного агенту. Дивись, наприклад, WО 99/53901 та WО 00/61108. Для додаткових прикладів способів отримання придатних для розпилення частинок та композицій та пристроїв, придатних для інгаляції дивись патенти США №№ 6,268,533, 5,983,956, 5,874,063, та 6,221,398, та WО 99/55319 та WО 00/30614. Фармацевтичні композиції цього винаходу можуть також містити інші терапевтичні агенти, що співзастосовують із сукцинатом сполуки формули І або його сольватом. Наприклад, фармацевтичні композиції цього винаходу можуть крім того містити один або більше терапевтичних агентів, вибраних з антизапальних агентів (наприклад, стероїдних антизапальних агентів, як-то кортикостероїди; та нестероїдних антизапальних агентів (NSАІD), інгібіторів фосфодіестерази-4, антиінфекційних агентів (наприклад, антибіотики або антивірусні засоби), антигістамінів, агоністів β2-адренергічного рецептору, антагоністів мускаринового рецептору (тобто, антихолінергічні агенти) тощо, зокрема стероїдних антизапальних агентів або антагоністів мускаринового рецептору. Інші терапевтичні агенти можна застосовувати у формі фармацевтично прийнятних солей або сольватів. На додаток, якщо прийнятно, інші терапевтичні агенти можна застосовувати як оптично чисті стереоізомери. Якщо бажано, солі цього винаходу можна також застосовувати у комбінації із ще одним терапевтичним агентом або агентами, описаними тут. У цьому втіленні компоненти не змішують фізично разом, але застосовують одночасно або послідовно як окремі композиції. Наприклад, сіль цього винаходу можна застосовувати інгаляцією одночасно або послідовно зі стероїдним антизапальним агентом, як-то кортикостероїд, застосовуючи пристрій для постачання інгаляцією, що застосовує окремі відділення (наприклад, блістерні упаковки) для кожного терапевтичного агенту. Альтернативно, комбінацію можна застосовувати з пристрою для багатократного постачання, тобто, одного пристрою постачання для кожного терапевтичного агенту. Репрезентативні стероїдні антизапальні агенти, що можна застосовувати зі сполуками цього винаходу, охоплюють, але без обмеження, метилпреднізолон, преднізолон, дексаметазон, флутиказон пропіонат, 6,9-дифлуор-17 -[(2-фуранілкарбоніл)окси]-11-гідрокси-16-метил-3--оксоандроста-1,4-дієн-17-карботіонової кислоти S-флуорметиловий естер, 6,9-дифлуор-11-гідрокси16 -метил-3-оксо-17 -пропіонілокси-андроста-1,4-дієн-17-карботіонової кислоти S-(2--оксотетрагідрофуран-3S-іл)-естер, естери беклометазону (наприклад, 17-пропіонат-естер або 17,21дипропіонат-естер), будезонід, флунізолід, естери мометазону (наприклад, фуроат-естер), триамцинолон ацетонід, рофлепонід, циклезонід, бутиксокорт пропіонат, RРR-106541, SТ-126 тощо, або їх фармацевтично прийнятні солі. В особливому втіленні стероїдним антизапальним агентом є 6α,9α-дифлуор-17а -[(2-фуранілкарбоніл)окси]-11β-гідрокси-16α-метил-3--оксоандроста-1,4-дієн--17β-карботіонової кислоти S-флуорметиловий естер або його фармацевтично прийнятна сіль або сольват. При застосуванні, стероїдні антизапальні агенти повинні бути присутніми у фармацевтичній композиції у терапевтично ефективній кількості. Звичайно, стероїдний антизапальний агент повинен бути у кількості, достатній для забезпечення приблизно 0,05 мкг - 500 мкг на дозу. Репрезентативні мускаринові антагоністи (тобто, антихолінергічні агенти), що можна застосовувати зі сполуками цього винаходу охоплюють, але без обмеження, атропін, атропін сульфат, атропін оксид, метилатропін нітрат, гоматропін гідробромід, гіосціамін (d, І) гідробромід, скополамін гідробромід, іпратропіум бромід, окситропіум бромід, тіотропіум бромід, метантелін, пропантелін бромід, анізотропін метилбромід, клідиній бромід, копіролат (Rоbіnul), ізопропамід йодид, мепензолят бромід, тридигексетилхлорид (Раthіlоnе), гексоцикліум метилсульфат, циклопентолат гідрохлорид, тропікамід, тригексилфенідил гідрохлорид, пірензепін, телензепін, АF-DХ 116 та метоктрамін тощо, або їх фармацевтично прийнятна сіль; або, для сполук, що є сіллю, інша її фармацевтично прийнятна сіль. Репрезентативні антигістаміни, інгібітори фосфодіестерази-4 (РDЕ4) або змішані інгібітори РDЕ3/РDЕ4 та агоністи β2-адренергічного рецептору, що можна застосовувати зі сполуками 10 UA 100364 C2 5 10 15 20 25 30 35 40 45 50 55 цього винаходу, є описаними у міжнародній патентній заявці РСТ/US2004/004449, WО 2004/074246 А2. Інші терапевтичні агенти, котрі можна застосовувати зі сполуками заявленого винаходу, охоплюють, наприклад, інші антизапальні агенти, наприклад, NSАІD (як-то натрій хромоглікат; недохроміл натрій; антагоністи лейкотриєну (наприклад, монтелукаст); інгібітори синтезу лейкотриєну; інгібітори іNОS; інгібітори протеаз, як-то інгібітори триптази та еластази; антагоністи бета-2 інтегрину та агоністи або антагоністи рецептору адензину (наприклад, агоністи адензину 2а); антагоністи цитокінів (наприклад, антагоністи хемокіну як-то, антитіло інтерлейкіну (антитіло ІL), особливо, терапія ІL-4, терапія ІL-13 або їх комбінація); або інгібітори синтезу цитокінів. Придатні дози для інших терапевтичних агентів, застосовуваних зі сполукою винаходу, є у межах приблизно 0,05 мг/добу - 100 мг/добу. Наступні композиції ілюструють репрезентативні фармацевтичні композиції заявленого винаходу: Приклад композиції А Сухий порошок для застосування інгаляцією отримують таким чином: Інгредієнти Кількість Сіль винаходу 0,2 мг Лактоза 25 мг Репрезентативний спосіб: Сполуку винаходу мікронізують та тоді змішують з лактозою. Цю змішану суміш тоді завантажують у желатиновий картридж для інгаляції. Вмісти картриджу застосовують за допомогою інгалятору порошку. Приклад композиції В Композицію сухого порошку для застосування в інгаляторі сухого порошку отримують таким чином: Репрезентативний спосіб: Отримують фармацевтичну композицію, що має співвідношення мікронізованої солі винаходу з лактозою 1:200. Композицію упаковують в інгалятор сухого порошку, здатний постачати між приблизно 10 мкг - 100 мкг сполуки винаходу на дозу. Приклад композиції С Сухий порошок для застосування інгаляцією в інгаляторі з вимірюваною дозою отримують таким чином: Репрезентативний спосіб: Суспензію з вмістом 5 мас. % солі винаходу та 0,1 мас. % лецитину отримують диспергуванням 10 г сполуки винаходу як мікронізованих частинок з середнім розміром менше, ніж 10 мкм у розчині, утвореному з 0,2 г лецетину, розчиненого у 200 мл демінералізованої води. Суспензію сушать розпиленням та утворений матеріал мікронізують до частинок, що мають середній діаметр менше, ніж 1,5 мкм. Частинки завантажують у картридж зі стиснутим 1,1,1,2-тетрафлуоретаном. Приклад композиції D Фармацевтичну композицію для застосування в інгаляторі з вимірюваною дозою отримують таким чином: Репрезентативний спосіб: Суспензію з вмістом 5 % солі винаходу, 0,5 % лецитину та 0,5 % трегалози отримують диспергуванням 5 г активного інгредієнту як мікронізованих частинок з середнім розміром менше, ніж 10 м у колоїдному розчині, утвореному з 0,5 г трегалози та 0,5 г лецетину, розчинених у 100 мл демінералізованої води. Суспензію сушать розпиленням та утворений матеріал мікронізують до частинок, що мають середній діаметр менше, ніж 1,5 мкм. Частинки завантажують у каністри зі стиснутим 1,1,1,2-тетрафлуоретаном. Приклад композиції Е Фармацевтичну композицію для застосування у розпилювальному інгаляторі отримують таким чином: Репрезентативний спосіб: Водну аерозольну композицію для застосування розпиленням отримують розчиненням 0,5 мг солі винаходу у 1 мл 0,9 % розчин натрій хлориду з лимонною кислотою. Суміш перемішують та обробляють ультразвуком до розчинення активного інгредієнту. рН розчину доводять до значення приблизно 5 повільною добавкою NаОН. Приклад композиції F Основну масу композиції отримували з вмістом 0,8 %, 1,6 % та 4 мас. % сукцинату (форма 1, мікронізували, отримуючи середній розмір приблизно 2 мікрон) у моногідраті лактози (що має середній розмір 70-90 мікрони), для забезпечення 100, 200 та 500 мкг вільної основи (Біфеніл-2-ілкарбамінової кислоти 1-[2-(2-Хлор-4-{[(R)-2-гідрокси-2-(8гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру) на блістер, для застосування у інгаляторі сухого порошку D1SКUS™. Вищенаведені композиції були також отриманими, але також з вмістом магній стеарату як стабілізатору, на рівні 0,2-1 мас. %. 11 UA 100364 C2 5 10 15 20 25 30 35 40 45 50 55 Застосування Сполука формули І виявляє активність агоністу β2-адренергічного рецептору та антагоністу мускаринового рецептору, а тому сукцинат сполуки формули І заявленого винаходу, як очікують, буде корисним як терапевтичний агент для лікування медичних станів, опосередкованих β2-адренергічними рецепторами або мускариновими рецепторами, тобто, медичних станів, що полегшують лікуванням агоністом β2-адренергічного рецептору або антагоністом мускаринового рецептору. Такі медичні стани охоплюють, наприклад, розлади або хвороби легень, охоплюючи пов'язані із оборотною обструкцією дихальних шляхів, як-то хронічна обструктивна хвороба легень (наприклад, хронічний та хрипкий бронхіт та емфізема), астма, фіброз легень, алергічний риніт, ринорея, тощо. Інші стани, котрі можна лікувати, охоплюють передчасні пологи, депресію, застійну серцеву недостатність, хвороби шкіри (наприклад, запальні, алергічні, псоріазні та проліферативні хвороби шкіри, умови, де зниження травної кислотності є бажаним (наприклад, утворення кишкових та шлункових виразок) та хворобу виснажених м'язів. Відповідно, в одному втіленні цей винахід стосується способу лікування розладу легень, який полягає у застосуванні до пацієнта при необхідності лікування терапевтично ефективної кількості сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-ілестеру або його сольвату. При застосуванні для лікування розладу легень, сіль цього винаходу звичайно застосовують інгаляцією багаторазовими дозами на добу, одиничними дозами на добу або одиничними дозами на тиждень. Загалом, доза для лікування розладу легень повинна бути приблизно 10 мкг/добу - 200 мкг/добу. При застосуванні інгаляцією, сполуки цього винаходу звичайно мають вплив оf бронходилатацію. Відповідно, у ще одному з аспектів цей винахід стосується способу забезпечення бронходилатації у пацієнта при необхідності бронходилатації, який полягає у застосуванні до пацієнта кількості, що створює бронходилатацію, сукцинату біфеніл-2ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру або його сольвату. Загалом, доза для забезпечення бронходилатації повинна бути приблизно 10 мкг/добу - 200 мкг/добу. В одному втіленні цей винахід стосується способу лікування хронічної обструктивної хвороби легень або астми, який полягає у застосуванні до пацієнта при необхідності лікування терапевтично ефективної кількості сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5метоксифенілкарбамоїл)етил]-піперидин-4-іл-естеру або його сольвату. При застосуванні для лікування СОРD або астми сіль цього винаходу звичайно застосовують інгаляцією багаторазовими дозами на добу або одиничною дозою на добу. Загалом, доза для лікування СОРD або астма повинна бути приблизно 10 мкг/добу - 200 мкг/добу. Як це застосовано тут, СОРD охоплює хронічний обструктивний бронхіт та емфізему (дивись, наприклад, Ваrnеs, Сhrоnіс Оbstruсtіvе Рulmоnаrу Dіsеаsе, N Еngl J Меd 2000: 343;269-78). При застосуванні для лікування розладу легень, сіль цього винаходу необов'язково застосовують у комбінації з іншими терапевтичними агентами. Відповідно, в особливому втіленні фармацевтичні композиції та способи цього винаходу крім того містять терапевтично ефективну кількість стероїдного антизапального агенту. Властивості та застосування сукцинатів цього винаходу можна продемонструвати, застосовуючи різні іn vіtrо та іn vіvо аналізи, добре відомі фахівцям. Наприклад, репрезентативні аналізи є описаними у міжнародній патентній заявці РСТ/US2004/004449, WО 2004/074246 А2 (Тhеrаvаnсе Іnс, Sоuth Sаn Frаnсіsсо, Саlіfоrnіа, US). ПРИКЛАДИ Нижченаведені Отримання та Приклади запропоновані для ілюстрації певних втілень цього винаходу. Ці певні втілення, однак, не обмежують цей винахід будь-яким шляхом, якщо не вказане інше. Якщо не вказане інше, реагенти, вихідні матеріали та розчинники отримували від комерційних постачальників (як-то Sіgmа-Аldrісh, Flukа тощо) та застосовували без подальшої очистки. 1-(3-{[2-хлор-4-(гідроксиметил)-5-метоксифеніл]аміно}-3--оксо-пропіл)піперидин-4-іл біфеніл2-ілкарбамат можна отримувати згідно з описом, запропонованим у міжнародній патентній заявці РСТ/US2004/004449, WО 2004/074246 А2, раgе 134, Отримання 96. Біфеніл-2-ілкарбамінової кислоти 1-[2-(4-{[(R)-2-(трет-Бутилдиметилсиланілокси)-2-(8гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-2-хлор-5-метоксифенілкарбамоїл) 12 UA 100364 C2 5 10 15 20 25 30 35 40 45 50 55 етил]піперидин-4-іл-естеру можна отримувати згідно з описом, запропонованим у міжнародній патентній заявці РСТ/US2004/004449, WО 2004/074246 А2, раgе 135, Отримання 98. Приклад 1: Біфеніл-2-ілкарбамінової кислоти 1-[2-(2-Хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)-етил]піперидин-4-ілестеру сукцинат 1-(3-{[2-хлор-4-(гідроксиметил)-5-метоксифеніл]аміно}-3-оксо-пропіл)піперидин-4-іл біфеніл2-ілкарбамат (69 г) суспендували у толуолі (480 мл) при ~65 °C. Манган діоксид (48 г) додавали та утворену суміш перемішували приблизно при 65 °C протягом приблизно 6 годин. Суміш тоді розбавляли толуолом (300 мл), та додавали броунмілерит (24 г). Утворену суміш фільтрували та промивали толуолом (180 мл) для видалення залишків мангану. Утворений розчин концентрували приблизно до половини вихідного об'єму (540 мл), охолоджували до -20 °C, та розбавляли метанолом (240 мл). 5-((1Н)-2-аміно-1-{[трет-бутил(диметил)силіл]окси}етил)-8гідроксихінолін-2(1Н)-он ацетат (48,4 г) додавали та суміш перемішували приблизно при 65 °C до повного розчинення. Розчин охолоджували до приблизно 2 °C та натрій борогідрид (2,12 г) додавали у 4 порції протягом 1 годин. Після повної добавки реакційну суміш гасили добавкою води (300 мл). Суміш перемішували повністю та тоді шари розділяли приблизно при 20 °C. Метанол (540 мл) додавали до органічного шару та це тоді концентрували приблизно до третини вихідного об'єму. Додатковий метанол (600 мл) додавали до залишку, котрий тоді концентрували приблизно до половини вихідного об'єму. Розчин охолоджували до -17 °C та додавали цезій флуорид (54,1 г) та оцтову кислоту (9,2 г). Утворену суміш перемішували приблизно при 17 °C протягом приблизно 13 годин. Після закінчення реакції додавали 2метилтетрагідрофуран (605 мл) та воду (275 мл). Суміш перемішували повністю та шари тоді розділяли. Органічний шар промивали водним насиченим розчином натрій гідрокарбонату (275 мл) та тоді водою (220 мл). Органічний шар тоді концентрували приблизно до половини вихідного об'єму вакуумною дистиляцією перед розбавленням ТГФ (500 мл)*. Розчин нагрівали до -37 °C та додавали розчин бурштинової кислоти (1 l, 0 г) в ізопропанолі (250 мл). Розчин тоді засівали (формою 1), тримали приблизно при 37 °C протягом приблизно 4 годин, охолоджували до -15 °C протягом приблизно 4 годин перед витримкою приблизно при 15 °C протягом 84 годин. Утворений твердий матеріал виділяли фільтруванням, промивали сумішшю ТГФ:ізопропанол:вода (50:50:3, 300 мл) та ТВМЕ (300 мл) перед сушкою у вакуумі приблизно при 45 °C, отримуючи заголовну сполуку як білий порошок, котрий був майже виключно (~ 98 %) формою 3 (55,0 г). -1 1Н ЯМР (500 МГц, ДМСО-D6: δ(млн ): 10,27 (s, 1Н), 8,67 (s, 1Н), 8,11 (d, 1Н, J=9,5), 7,79 (s, 1Н), 7,33 (m, 10Н), 7,07 (d, 1Н, J-8,0), 6,93 (d, 1Н, J=8,5), 6,49 (d, 1Н, J=10,0), 5,10 (m, 1Н), 4,50 (m, 1Н), 3,80 (s, 2Н), 3,73 (s, 3Н), 2,74 (m, 4Н), 2,62 (m, 2Н), 2,55 (m, 2Н), 2,38 (s, 4Н), 2,24 (m, 2Н), 1,77 (m, 2Н), 1,51 (m, 2Н); m/z: [М+Н+] розраховано для С40Н42СlN5О7, 740,29; виявлено 740,24 * органічний шар можна випарювати до сухого стану для забезпечення біфеніл-2ілкарбамінової кислоти 1-[2-(2-Хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етиламіно]метил}-5-метоксифенілкарбамоїл)-етил]піперидин-4-іл-естеру для наступного перетворення у сукцинат. Отримання 1: Біфеніл-2-ілкарбамінової кислоти 1-[2-(2-Хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)-етил]піперидин-4-ілестер 1-(3-{[2-хлор-4-(гідроксиметил)-5-метоксифеніл]аміно}-3-оксо-пропіл)піперидин-4-іл біфеніл-2-ілкарбамат (12,5 г) та манган діоксид (8 г) нагрівали разом у толуолі (94 мл) при приблизно 60 °C протягом 5 годин. Манган діоксид (8 г) тоді видаляли фільтруванням через броунмілерит (2 г), з промивкою толуолом (2 × 3 мл). Утворений розчин концентрували (до 100 мл) та тоді нагрівали до приблизно 60 °С. 5-((1R)-2-аміно-1-{[третбутил(диметил)силіл]окси}етил)-8-гідроксихінолін-2(1R)-он ацетат (8 г) та додавали метанол (19 мл) і суміш перемішували до повного розчинення. Розчин охолоджували до приблизно 5 °C, додавали натрій борогідрид (0,28 г) та суміш тоді перемішували протягом 2 годин. Воду (50 мл) тоді додавали для гасіння реакції та суміш перемішували енергійно при 20 °C протягом 30 хвилин. Шари розділяли та водний відкидали. Органічний шар тоді розчиняли у метанолі (75 мл).Цезій флуорид (11,4 г) та оцтову кислоту (1,7 г) додавали та утворену суміш перемішували при 20 °C протягом приблизно 22 годин. Суміш було зменшено в об'ємі (до приблизно 60 мл) та додавали метилтетрагідрофуран (100 мл) та воду (50 мл) для можливості розділення фаз. Водний шар відкидали та органічний шар випарювали до сухого стану, отримуючи заголовну сполуку як твердий матеріал (12,0 г. 70 %). 13 UA 100364 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 2: Біфеніл-2-ілкарбамінової кислоти 1-[2-(2-Хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2оксо-1,2-дигідрохінолін-5-іл)етил аміно]метил}-5-метоксифенілкарбамоїл)-етил]піперидин-4-ілестеру Сукцинат (форма 1) Етанол (14 мл) додавали до Біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру (1,5 г) та нагрівали при приблизно 70 °C протягом 1 годин. Температуру тоді знижували до 50 °C та бурштинову кислоту (251,25 мг, 1,05 еквів) в етанолі (2 мл) додавали порціями протягом приблизно 4 годин. Після додавання усієї кислоти додавали воду (2,25 мл), а потім тримали 30 хвилин при 50 °C. Реакційну суміш тоді піддавали циклуванню температури між 0 °C та 40 °C протягом 3 діб. Утворений білий твердий матеріал виділяли фільтруванням, промивали етанолом та сушили у вакуумній шафі при температур довкілля, отримуючи заголовну сполуку як кристалічний твердий матеріал (727 мг). Приклад 3: Біфеніл-2-ілкарбамінової кислоти 1-[2-(2-Хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)-етил]піперидин-4-ілестеру Сукцинат (форма 2) Біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8гідрокси-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естер (отриманий як в отриманні 1) (200 мг) суспендували у метанолі (1,5 мл) приблизно при 70 °C. Першу порцію (100 мкл) бурштинової кислоти у метанолі додавали від загальної бурштинової кислоти (67 мг, 2,1 еквів) у метанолі (0,5 мл), та температуру зменшували до 50 °C. Залишкову бурштинову кислоту у метанолі додавали у чотири порції (100 мкл) протягом приблизно 5 годин, і ще додавали метанол (1 мл) через 3 години для заміни втраченого розчиннику. Через ще 30 хвилин утворену суспензію піддавали циклуванню температури між 0 °C та 40 °C протягом 5 діб. Утворений твердий матеріал виділяли фільтруванням, промивали ТГФ, сушили на фільтр-папері та тоді у вакуумній шафі, отримуючи заголовну сполуку як кристалічний твердий матеріал (148 мг). Приклад 4: Біфеніл-2-ілкарбамінової кислоти 1-[2-(2-Хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2оксо-1,2-дигідрохінолін-5-іл)етиламіно)метил}-5-метоксифенілкарбамоїл)-етил]піперидин-4-ілестеру Сукцинат (форма 2) Біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)-етил]піперидин-4-іл-естер (2 г) розчиняли у метанолі (16 мл) приблизно при 70 °C, протягом 1 години. Через ще 1 годину додавали бурштинову кислоту (335 мг) у метанолі (4 мл) та це піддавали циклуванню температури між 0 °C та 40 °C протягом 2 діб. Утворений твердий матеріал виділяли фільтруванням, промивали метанолом, сушили на фільтр-папері та тоді сушили при 40 °C у вакуумній шафі протягом ночі, отримуючи заголовну сполуку як кристалічний твердий матеріал (979 мг). Було підтверджено за допомогою ДСК форму 2. Приклад 5: Біфеніл-2-ілкарбамінової кислоти 1-[2-(2-Хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)-етил]піперидин-4-ілестеру Сукцинат (форма 3) Біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)-етил]піперидин-4-іл-естер (200 мг) суспендували у тетрагідрофурані (1,5 мл) приблизно при 70 °C. Першу порцію (100 мкл) бурштинової кислоти у метанолі додавали, від загальної бурштинової кислоти (33,5 мг, 1,05 еквів) у ТГФ (0,5 мл) та температур зменшували до 50 °C. Залишкову бурштинову кислоту у метанолі додавали у чотири порції протягом приблизно 5 годин, і ще додавали ТГФ (1 мл) через 1 годину для заміни втраченого розчиннику. Через ще 30 хвилин утворену суспензію піддавали циклуванню температури між 0 °C та 40 °C протягом 5 діб. Утворений твердий матеріал виділяли фільтруванням, промивали метанолом, сушили на фільтр-папері протягом ночі та тоді у вакуумній шафі, отримуючи заголовну сполуку як кристалічний твердий матеріал (140 мг). Приклад 6: Біфеніл-2-ілкарбамінової кислоти 1-[2-(2-Хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)-етил]піперидин-4-ілестеру Сукцинат (форма 1) Біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(S)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)-етил]піперидин-4-іл-естеру сукцинат, отриманий як у прикладі 1 (363,6 г) розчиняли у 14 % води у тетрагідрофурані (2906 мл) приблизно при 20 °C та перемішували протягом 1,5 годин до утворення розчину. Ізопропанол (635 мл) додавали до утворення прозорого розчину, який тоді нагрівали до 36±3 °C. Затравку (0,91 г) додавали та розчин перемішували приблизно при 36±3 °C протягом приблизно 1 години. Ізопропанол (6080 мл) тоді додавали до суміші протягом приблизно 12 годин. Суспензію тоді тримали при 36±3 °C протягом приблизно 1 години перед охолодженням 14 UA 100364 C2 5 10 15 20 приблизно до 20 °C та тримали при цій температурі протягом принаймні ще години. Утворений осад виділяли фільтруванням, промивали сумішшю ТГФ:ізопропанол:вода (70:25:5, 3636 мл) та тоді ТВМЕ (3636 мл) та сушили у вакуумі приблизно при 60 °C, отримуючи заголовну сполуку як кристалічний твердий матеріал. Приклад 7 - Термічний Аналіз ДСК-термограми твердих форм 1, 2 та 3 отримували, застосовуючи Прилад ТА Іnstrumеnts Q1000 саlоrіmеtеr №: 970001,901, та серійний №: 1000-0126. Зразок зважували в алюмінієвій чашці, кришку чашки поміщали зверху та слабко закручували без герметизування чашки. -1 Експерименти проводили, застосовуючи швидкість нагрівання 10 °C хвилин . Репрезентативну ДСК-термограму для зразку кожної з форм 1, 2 та 3 сукцинату біфеніл-2ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідрокси-2-оксо-1,2-дигідрохінолін-5іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру, який отримано способом, описаним у прикладах 2, 3 та 5, показано у Фіг. 1-3. Приклад 8 - Рентгенодифракція від порошку Дані рентгенодифракції від порошку (РДП) твердих форм 1, 2 та 3 були отриманими на дифрактометрі порошку РАNаlуtісаl Х.Реrt Рrо, модель РW3040/60, застосовуючи детектор ХСеlеrаtоr. Умовами були: випромінювання: Сu Кα, генератор напруги: 40 кВ, генератор струму: 45 мА, початковий кут 2θ: 2,0°, кінцевий кут 2θ: 40,0°, етап розміром: 0,0167° 2θ, час на етап: 31,75 с. Зразок отримували монтуванням кількох міліграм зразку на силіцієвій підкладці (нульовий фон), утвореного тонким шаром порошку. Характеристичні РДП-кути та d-проміжки показані у таблиці 1 для зразку кожної з форм 1, 2 та 3, які отримані способом, описаним у прикладах 2, 3, та 5. Таблиця 1 Характеристичні позиції піків РДП для форм 1-3. 2θ 5,0 5,7 7,1 10,0 12,6 13,8 14,4 15,5 16,1 16,4 16,9 17,8 18,5 20,2 20,5 21,4 25,3 25,8 26,3* 25 30 Форма 1 d-проміжок / А 17,7 15,6 12,4 8,9 7,0 6,4 6,1 5,7 5,5 5,4 5,3 5,0 4,8 4,4 4,3 4,1 3,5 3,5 3,4* 2θ 5,0 5,7 7,1 9,0* 9,9 13,8 14,2 16,6 17,5 19,7 20,7 21,4 25,8 Форма 2 d-проміжок / А 17,8 15,5 12,4 9,8* 9,0 6,4 6,2 5,3 5,1 4,5 43 4,2 3,4 2θ 5,0 7,2 11,2 14,3 15,6 17,4* 20,5 21,5 25,6 25,9 Форма 3 d-проміжок / А 17,6 12,3 7,9 6,2 5,7 5,1* 4,3 4,1 3,5 3,4 Характеристичні позиції піків та розраховані d-проміжки наведені у таблиці 1. Вони були розрахованими, застосовуючи програму Ніghsсоrе. Піки, помічені * відрізняють цю форму від інших. Інші піки (не підкреслені та жирні) також відрізняють форми, однак, вони є слабшими або мають низьку інтенсивність піків ще одної форми близько схожих, що робить ці піки менш певним, ніж із заштрихованим фоном. РДП-дані ілюстровані у Фіг.фіг. 4-6, відповідно. Приклад 9 - ІЧ ІЧ-спектр твердих форми 1, 2 та 3 реєстрували, застосовуючи ІЧ спектрометр Nісоlеt Аvаtаr -1 -1 360, з додатковим Dіаmоnd/ZnSе АТR, з розділенням 4 см , у межах частот 4000-700 см . 15 UA 100364 C2 5 10 15 20 Смуги форми 1 були спостереженими при: 3265, 2832, 1735, 1718, 1679, 1669, 1591, 1540, 1518, 1493, 1439, 1405, 1339, 1302, 1283, 1239, 1202, 1163, 1144, 1107, 1095, 1039, 1009, 973, -1 921, 885, 868, 838, 773, 751, та 707 см . Смуги форми 2 були спостереженими при: 3317,2947, 1728, 1678, 1667, 1591, 1537, 1494, -1 1453, 1439, 1403, 1339, 1302, 1284, 1213, 1172, 1111, 1058, 1046, 999, 975, 885, 839, та 750 см . Смуги форми 3 були спостереженими при: 3335, 2949, 1745, 1715, 1678, 1641, 1592, 1542, 1493, 1464, 1439, 1405, 1338, 1303, 1283, 1247, 1211, 1170, 1109, 1093, 1053, 1041, 997, 974, -1 919, 889, 842, 774, 766, 751 та 721 см . Дані для репрезентативного зразку кожної з форм 1,2 та 3 показано у Фіг. 7-9, відповідно. Приклад 10 - Оцінка динамічної сорбції пари Профіль динамічної сорбції пари (ДСП) форми 1 отримували, застосовуючи прилад SМS DVS-1, з водою як реагентом при 25 °C. 20-30 мг зразку поміщали у скляну колбу та урівноважували при відносній вологості 30 %RН. Відносну вологість було збільшено до 90 % у 10 % етапів. Відносну вологість було тоді знижено до 0 % у 10 % етапів, та зрештою збільшено до 30 %, знов у 10 % етапів. Результати двох циклів сорбції/десорбції показані у Фіг. 10 Профіль ДСП показує, що форма сукцинату 1, має оборотний профіль сорбції/десорбції із гарним рівнем гігроскопічності (менше, ніж приблизно 2,0 % приросту маси у межах вологості від 30 % відносної вологості до 90 % відносної вологості). Оборотний профіль сорбції/десорбції вологи демонструє, що форма 1 сукцинату заявленого винаходу виявляє прийнятну гігроскопічність та не розпливається на повітрі, таким чином це робить її придатною для фармацевтичних розробок. ФОРМУЛА ВИНАХОДУ 25 30 35 40 45 50 55 1. Сукцинат біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідроксі-2-оксо1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру або його сольват, який є у кристалічній формі 1, що характеризується рентгенодифрактограмою порошку, що має піки дифракції при значеннях 2θ 5,0±0,3 та 10,0±0,3. 2. Сіль за п. 1, де сіль характеризується: а) даними диференційної сканувальної калориметрії, котрі показують точку плавлення у межах 170-180 °С; б) інфрачервоним спектром поглинання із показовими смугами поглинання приблизно при 3265, 2832, 1735, 1718, 1679, 1669, 1591, 1540, 1518, 1493, 1439, 1405, 1339, 1302, 1283, 1239, 1202, -1 1163, 1144, 1107, 1095, 1039, 1009, 973, 921, 885, 868, 838, 773, 751 та 707 см . 3. Сіль за п. 1, яка характеризується рентгенодифрактограмою порошку, у котрій позиції піків по суті відповідають позиціям піків рентгенодифрактограми, показаної у Фіг. 4. 4. Сіль за п. 1, яка характеризується інфрачервоним спектром поглинання, який по суті відповідає спектру, що показано у Фіг. 7. 5. Сіль за будь-яким з пп. 1-4, яка є у мікронізованій формі. 6. Фармацевтична композиція, яка містить фармацевтично прийнятний носій та сіль за будьяким з пп. 1-4. 7. Фармацевтична композиція за п. 6, яка додатково містить стероїдний антизапальний агент. 8. Фармацевтична композиція за п. 7, де стероїдним антизапальним агентом є 6α,9α-дифлуор17α-[(2-фуранілкарбоніл)окси]-11β-гідрокси-16α-метил-3-оксо-андроста-1,4-дієн-17βкарботіонової кислоти S-флуорметиловий естер або його сольват. 9. Фармацевтична композиція за п. 7, де стероїдним антизапальним агентом є флютиказону пропіонат. 10. Фармацевтична композиція за п. 6, яку формують для застосування інгаляцією. 11. Фармацевтична композиція за п. 6 у мікронізованій формі. 12. Фармацевтична композиція за п. 10, де носієм є лактоза, крохмаль, манітол, декстроза, полімолочна кислота, полілактид-когліколід або їх комбінація. 13. Комбінація, що містить: (а) сіль за будь-яким з пп. 1-4; та (b) стероїдний антизапальний агент. 14. Комбінація за п. 13, де стероїдним антизапальним агентом є 6α,9α-дифлуор-17α-[(2фуранілкарбоніл)окси]-11β-гідрокси-16α-метил-3-оксо-андроста-1,4-дієн-17β-карботіонової кислоти S-флуорметиловий естер або його сольват. 15. Комбінація за п. 13, де стероїдним антизапальним агентом є флютиказону пропіонат. 16 UA 100364 C2 5 10 15 20 16. Сукцинат біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2-(8-гідроксі-2оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5-метоксифенілкарбамоїл)етил]піперидин-4-ілестеру або його сольват, згідно з п. 1, для застосування у терапії або як медикаменту. 17. Застосування сукцинату біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(R)-2-гідрокси-2(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил}-5метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру або його сольвату, згідно з п. 1, для виробництва медикаменту, призначеного для лікування розладу легень. 18. Застосування за п. 17, де розладом легень є хронічна обструктивна хвороба легень або астма. 19. Застосування за п. 17 або 18, де медикамент містить стероїдний антизапальний агент. 20. Застосування за п. 19, де стероїдним антизапальним агентом є 6α,9α-дифлуор-17α-[(2фуранілкарбоніл)окси]-11β-гідрокси-16α-метил-3-оксо-андроста-1,4-дієн-17β-карботіонової кислоти S-флуорметиловий естер або його сольват. 21. Застосування за п. 19, де стероїдним антизапальним агентом є флютиказону пропіонат. 22. Спосіб отримання форми 1 сукцинату за п. 1, при якому здійснюють такі етапи: розчинення сукцинату у водному ТГФ (10-18 %) при температурі 18-23 °С; додавання першого об'єму нижчого спирту, який є або етанолом або ізопропанолом, та нагрівання до 32-40 °С; необов'язково внесення затравки форми 1; додавання другого об'єму нижчого спирту; охолодження до температури 18-23 °С; та збирання кристалічного продукту. 17 UA 100364 C2 18 UA 100364 C2 19 UA 100364 C2 20 UA 100364 C2 21 UA 100364 C2 22 UA 100364 C2 23 UA 100364 C2 Комп’ютерна верстка Л. Купенко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 24
ДивитисяДодаткова інформація
Назва патенту англійськоюSuccinic acid salt of biphenyl-2-ylcarbamic acid 1-[2-(2-chloro-4-{[ (r)-2-hydroxy-2- (8-hydroxy-2-oxo-1, 2-dihydroquinolin-5-yl) eth ylaminoimethyl] }-5-methoxyphenylcarbamoyl) ethyl]piperidin-4-yl ester and its use for the treatment of pulmonary disorders
Автори англійськоюChudasama Reshma, Kennedy Andrew, Kindon, Leanda Jane, Mallett Franck Patrick
Назва патенту російськоюСукцинат бифенил-2-илкарбаминовой кислоты 1-[2-(2-хлор-4-{[(r)-2-гидрокси-2-(8-гидрокси-2-оксо-1,2-дигидрохинолин-5-ил)этиламино]метил]}-5-метоксифенилкарбамоил)этил]пиперидин-4-ил-эстера и его применение для лечения легочных расстройств
Автори російськоюЧудасама Решма, Кеннеди Эндрю, Киндон Линда Джейн, Мале Франк Патрик
МПК / Мітки
МПК: A61K 31/4709, C07D 401/12
Мітки: сукцинат, кислоти, 1-[2-(2-хлор-4-{[(r)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил]}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру, застосування, біфеніл-2-ілкарбамінової
Код посилання
<a href="https://ua.patents.su/26-100364-sukcinat-bifenil-2-ilkarbaminovo-kisloti-1-2-2-khlor-4-r-2-gidroksi-2-8-gidroksi-2-okso-12-digidrokhinolin-5-iletilaminometil-5-metoksifenilkarbamoletilpiperidin-4-il-esteru-ta-jjo.html" target="_blank" rel="follow" title="База патентів України">Сукцинат біфеніл-2-ілкарбамінової кислоти 1-[2-(2-хлор-4-{[(r)-2-гідрокси-2-(8-гідроксі-2-оксо-1,2-дигідрохінолін-5-іл)етиламіно]метил]}-5-метоксифенілкарбамоїл)етил]піперидин-4-іл-естеру та його застосування д</a>
Попередній патент: Пристрій для відсаджування текучої аерованої кондитерської маси та спосіб отримання кондитерського виробу з його використанням
Наступний патент: Сільськогосподарський комбайн
Випадковий патент: Водорозчинна тверда фотополімеризаційноздатна композиція