Спосіб лікування судинних захворювань
Номер патенту: 86344
Опубліковано: 27.04.2009
Автори: Оттербайн Лео Е., Бах Фрітц Х., Цуккербраун Брайан, Чоі Огастін М.К.
Формула / Реферат
1. Спосіб виконання ангіопластики у пацієнта, де спосіб включає:
(a) виконання ангіопластики у пацієнта і
(b) перед, під час або після (а) введення пацієнту фармацевтичної композиції, що включає кількість монооксиду вуглецю, ефективну для лікування гіперплазії інтими у пацієнта.
2. Спосіб за п. 1, де ангіопластика включає балонну ангіопластику.
3. Спосіб за п. 1, де ангіопластика включає лазерну ангіопластику.
4. Спосіб за п. 1, де ангіопластика включає направлену атеректомію.
5. Спосіб за п. 1, де ангіопластика включає ротаційну атеректомію.
6. Спосіб за п. 1, де ангіопластика включає екстракційну атеректомію.
7. Спосіб за п. 1, де ангіопластика включає процедуру стентування.
8. Спосіб за п. 1, де ангіопластика включає балонну ангіопластику і процедуру стентування.
9. Спосіб лікування або запобігання рестенозу у пацієнта, причому спосіб включає:
(a) надання посудини, що містить стиснутий газ, який включає газоподібний монооксид вуглецю;
(b) виявлення пацієнта, страждаючого рестенозом або з ризиком його розвитку;
(c) вивільнення стиснутого газу з посудини для утворення атмосфери, що включає газоподібний монооксид вуглецю, і
(d) контакт пацієнта з атмосферою, причому кількість монооксиду вуглецю в атмосфері достатня для лікування або запобігання рестенозу у пацієнта.
10. Спосіб лікування або запобігання рестенозу у пацієнта, що включає:
(a) виявлення пацієнта, страждаючого рестенозом або з ризиком його розвитку, і
(b) введення пацієнту фармацевтичної композиції, що включає кількість монооксиду вуглецю, ефективну для лікування або запобігання рестенозу у пацієнта.
11. Спосіб за п. 10, де рестеноз виникає в результаті балонної ангіопластики.
12. Спосіб за п.10, де рестеноз виникає в результаті лазерної ангіопластики.
13. Спосіб за п.10, де рестеноз виникає в результаті направленої атеректомії.
14. Спосіб за п.10, де рестеноз виникає в результаті ротаційної атеректомії.
15. Спосіб за п.10, де рестеноз виникає в результаті екстракційної атеректомії.
16. Спосіб за п.10, де рестеноз виникає внаслідок процедури стентування.
17. Спосіб лікування або запобігання гіперплазії інтими у пацієнта, що включає:
(a) виявлення пацієнта, страждаючого гіперплазією інтими або з ризиком її розвитку не внаслідок процедури трансплантації, і
(b) введення пацієнту фармацевтичної композиції, що включає кількість монооксиду вуглецю, ефективну для лікування або запобігання гіперплазії інтими у пацієнта.
18. Спосіб за п. 17, де гіперплазія інтими виникає в результаті балонної ангіопластики.
19. Спосіб за п. 17, де гіперплазія інтими виникає в результаті лазерної ангіопластики.
20. Спосіб за п. 17, де гіперплазія інтими виникає в результаті направленої атеректомії.
21. Спосіб за п. 17, де гіперплазія інтими виникає в результаті ротаційної атеректомії.
22. Спосіб за п. 17, де гіперплазія інтими виникає в результаті екстракційної атеректомії.
23. Спосіб за п. 17, де гіперплазія інтими виникає внаслідок процедури стентування.
24. Спосіб виконання ангіопластики у пацієнта, що включає:
(а) надання пристрою для ангіопластики, здатного ввести монооксид вуглецю пацієнту;
(b) розміщення пристрою в кровоносній судині, що має потребу в ангіопластиці;
(c) виконання ангіопластики з використанням пристрою і
(d) використання до, під час і/або після (с) пристрою для введення монооксиду вуглецю в кровоносну судину в кількості, достатній для лікування або запобігання гіперплазії інтими.
25. Застосування монооксиду вуглецю для одержання фармацевтичної композиції для лікування або запобігання рестенозу у пацієнта.
26. Застосування монооксиду вуглецю для одержання фармацевтичної композиції для лікування або запобігання гіперплазії інтими у пацієнта.
27. Застосування за п. 25, де рестеноз виникає в результаті балонної ангіопластики.
28. Застосування за п. 26, де гіперплазія інтими виникає в результаті балонної ангіопластики.
29. Застосування за п. 25 або 26, де рестеноз або гіперплазія інтими виникає в результаті лазерної ангіопластики.
30. Застосування за п. 25 або 26, де рестеноз або гіперплазія інтими виникає в результаті спрямованої атеректомії.
31. Застосування за п. 25 або 26, де рестеноз або гіперплазія інтими виникає в результаті ротаційної атеректомії.
32. Застосування за п. 25 або 26, де рестеноз або гіперплазія інтими виникає в результаті екстракційної атеректомії.
33. Застосування за п. 25 або 26, де рестеноз або гіперплазія інтими виникає в результаті процедури стентування.
Текст
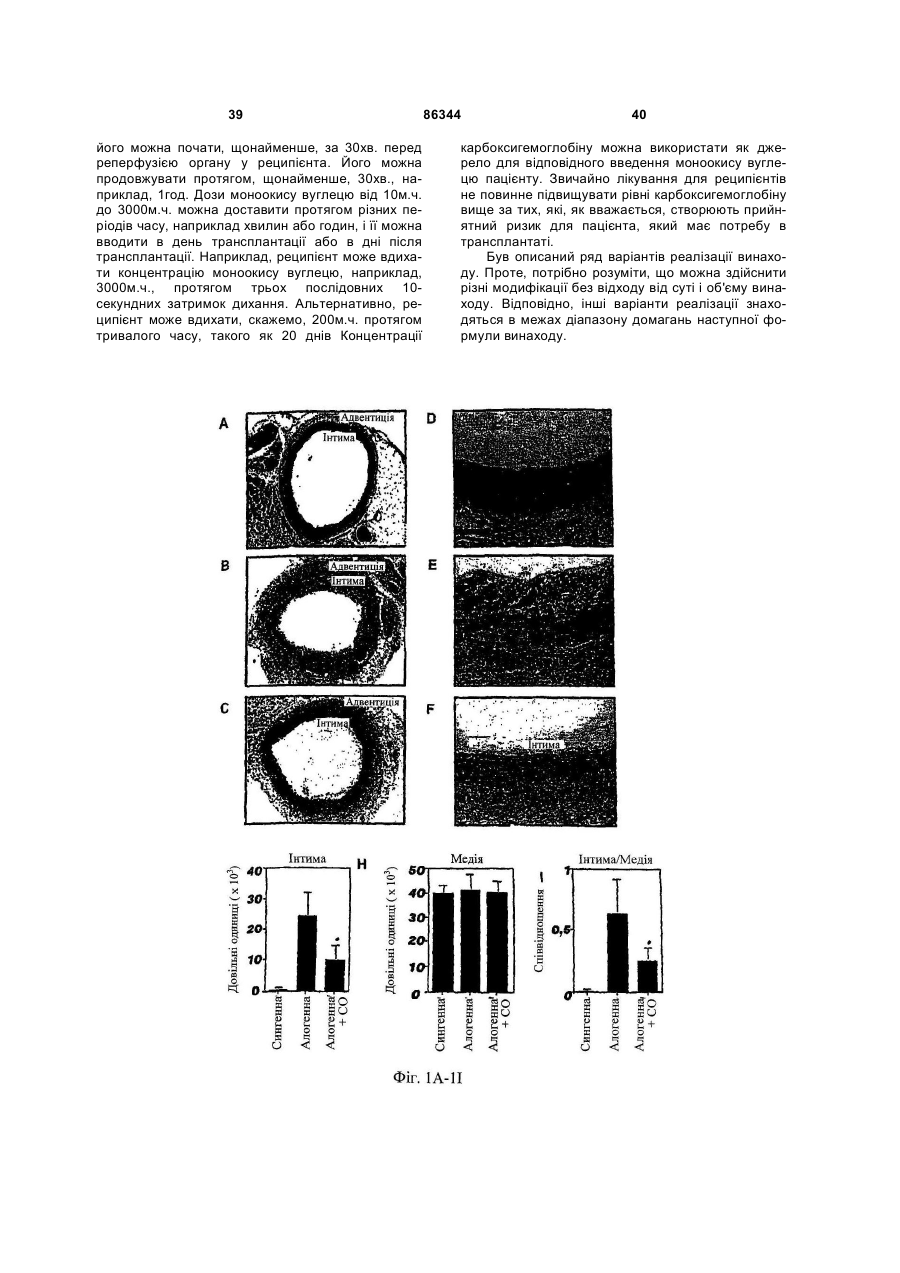
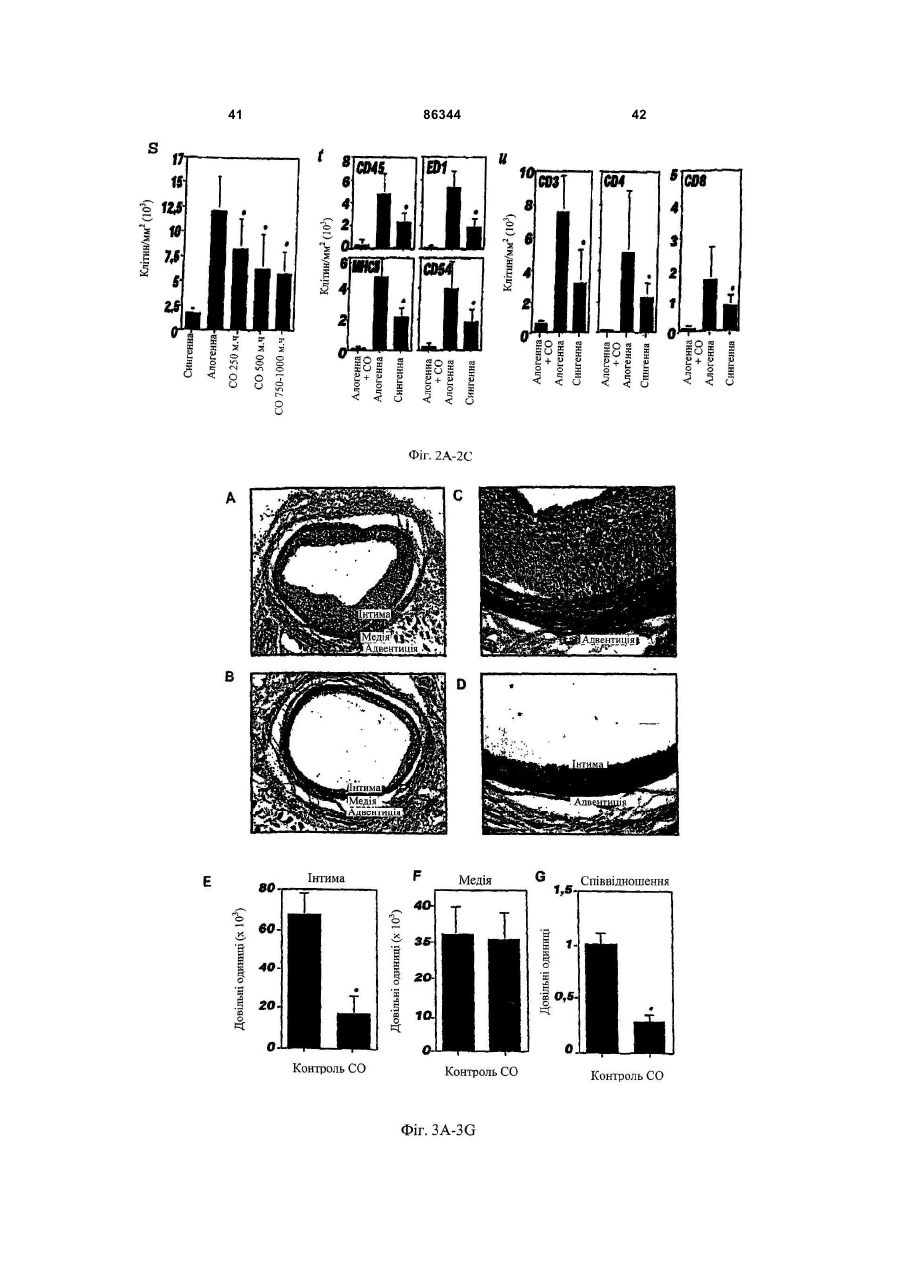
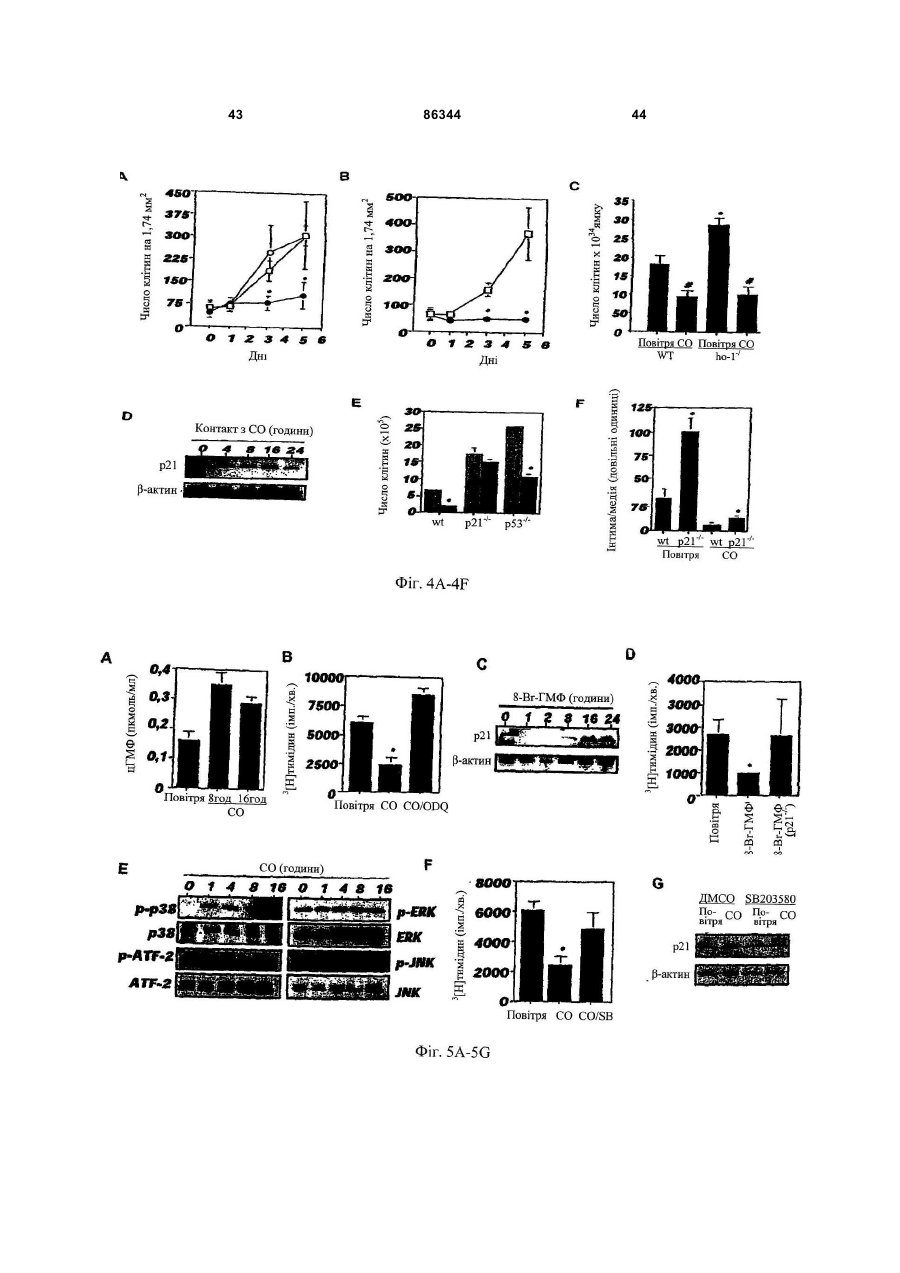
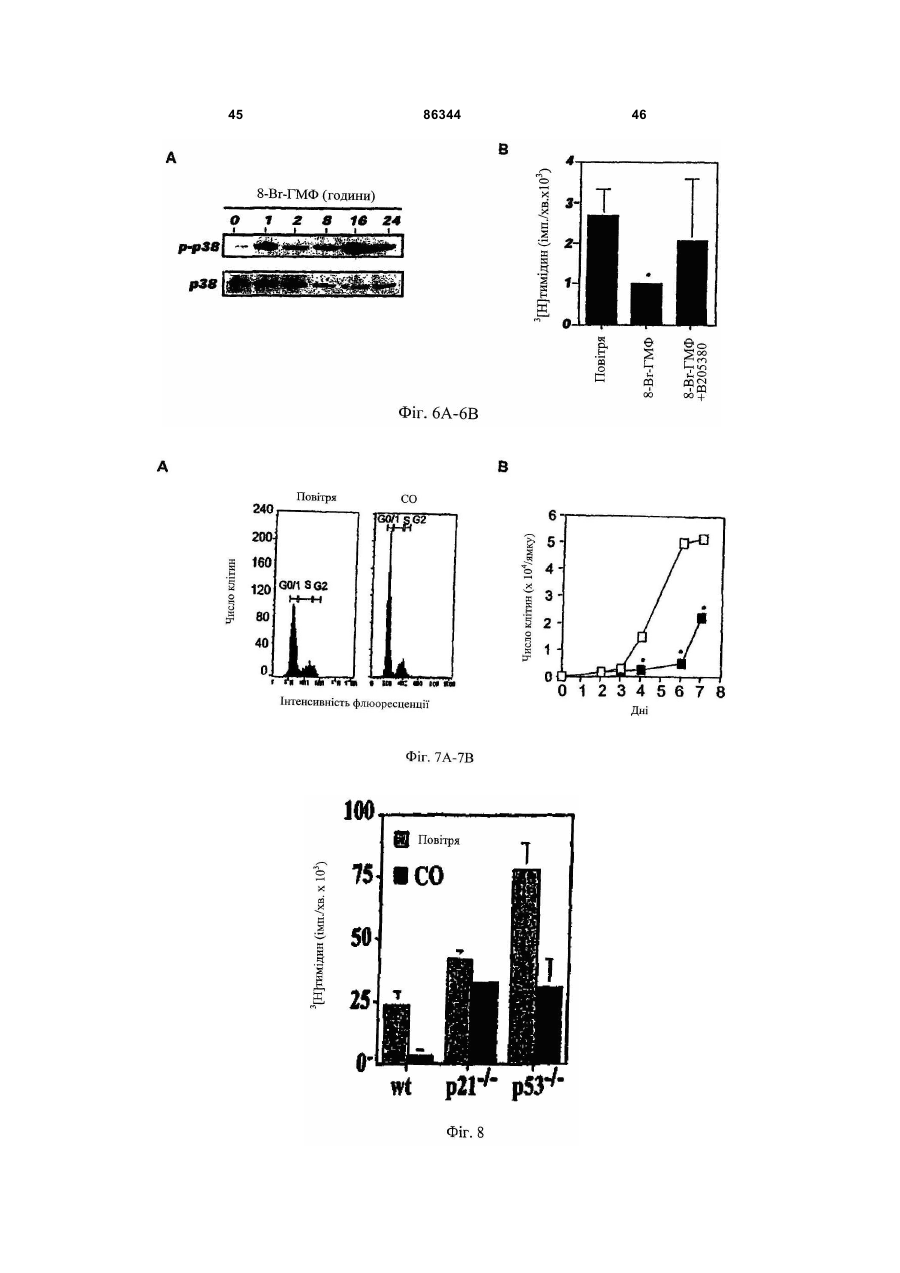
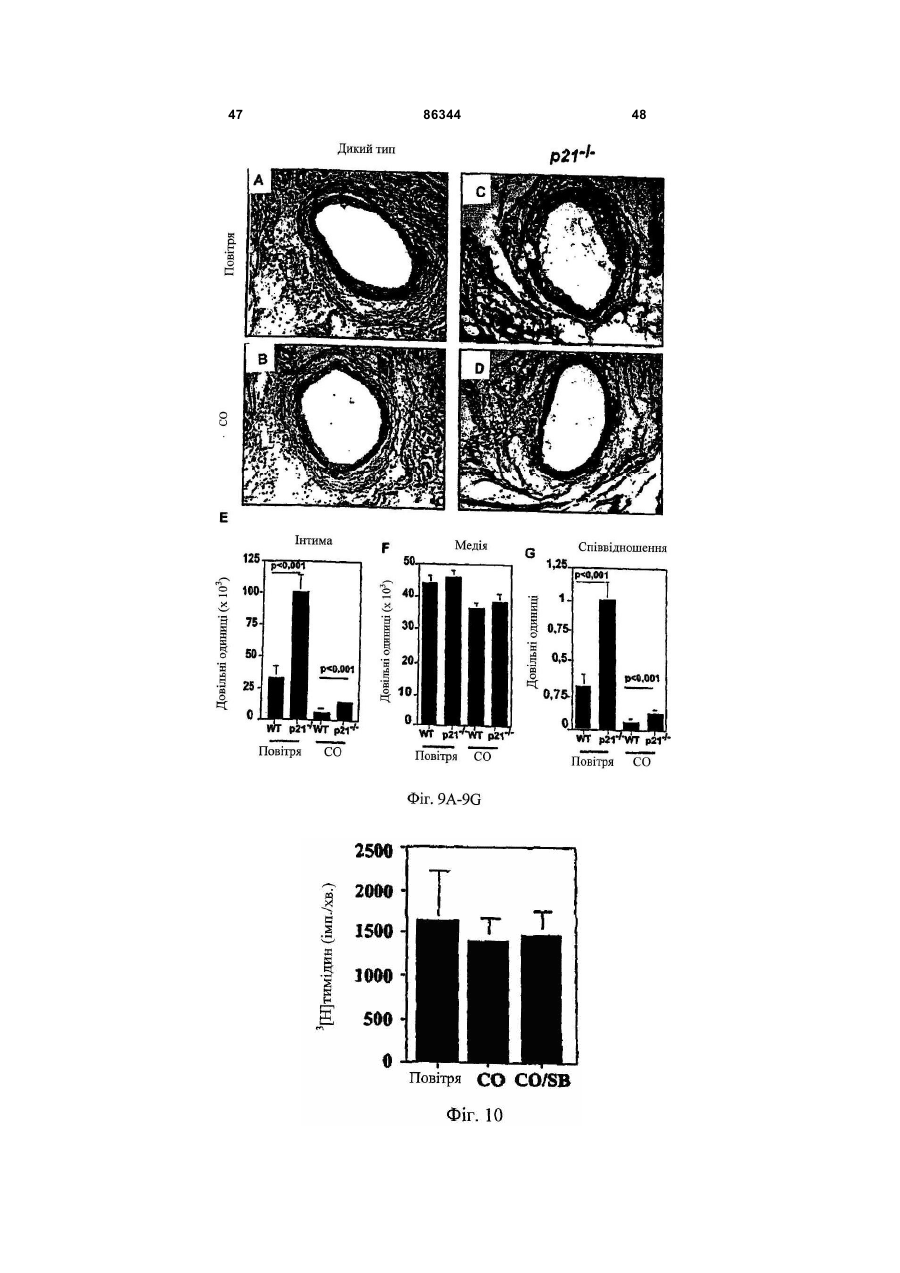
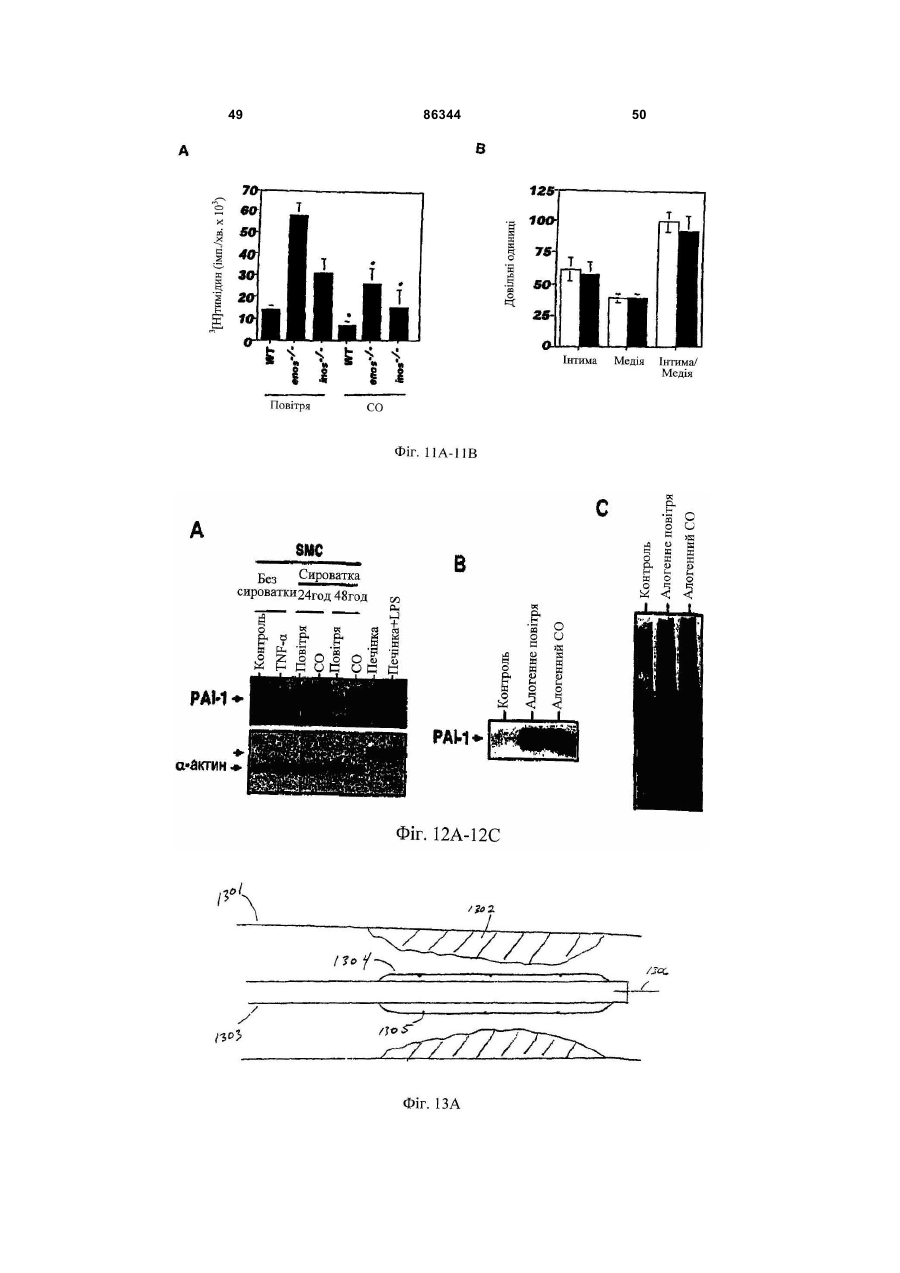
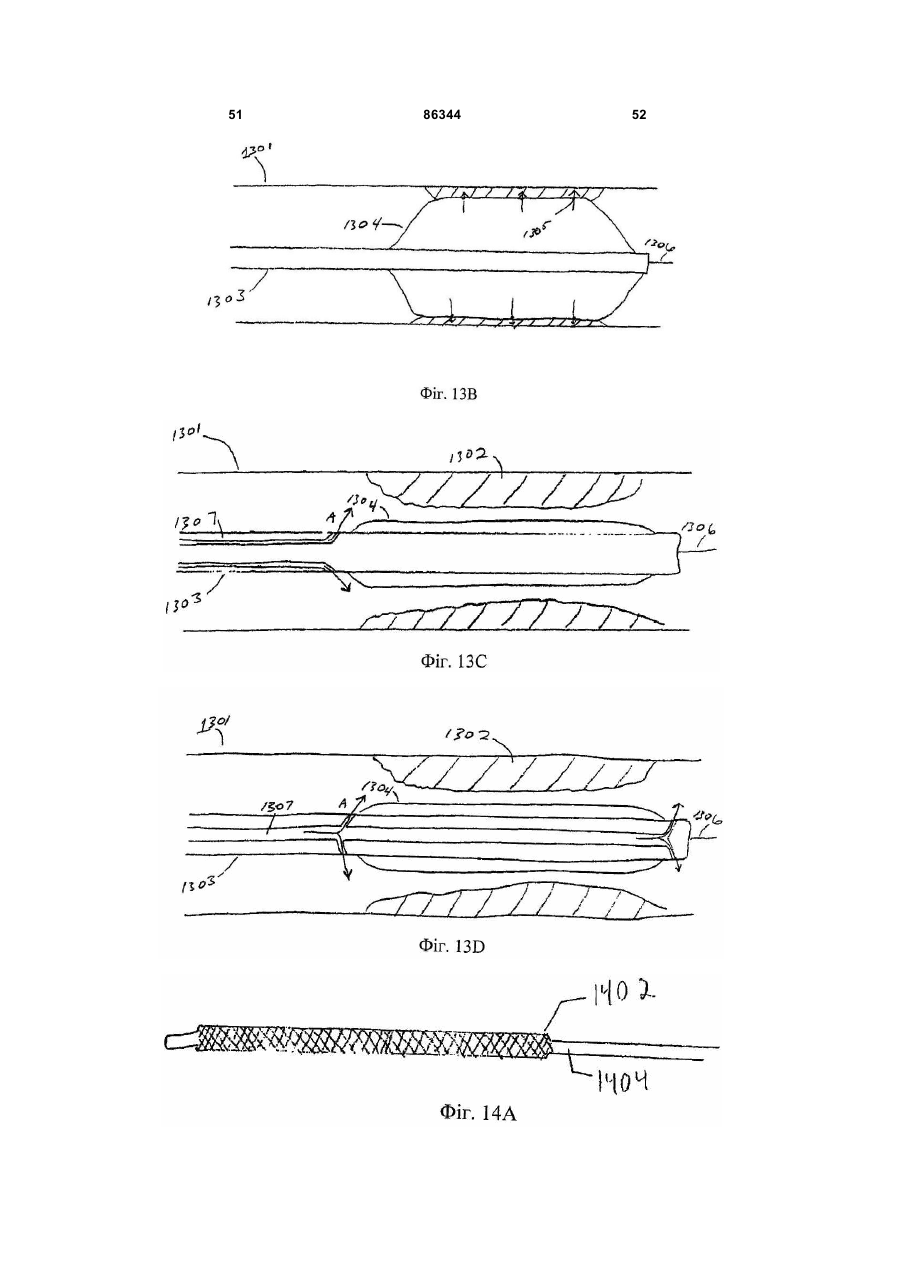
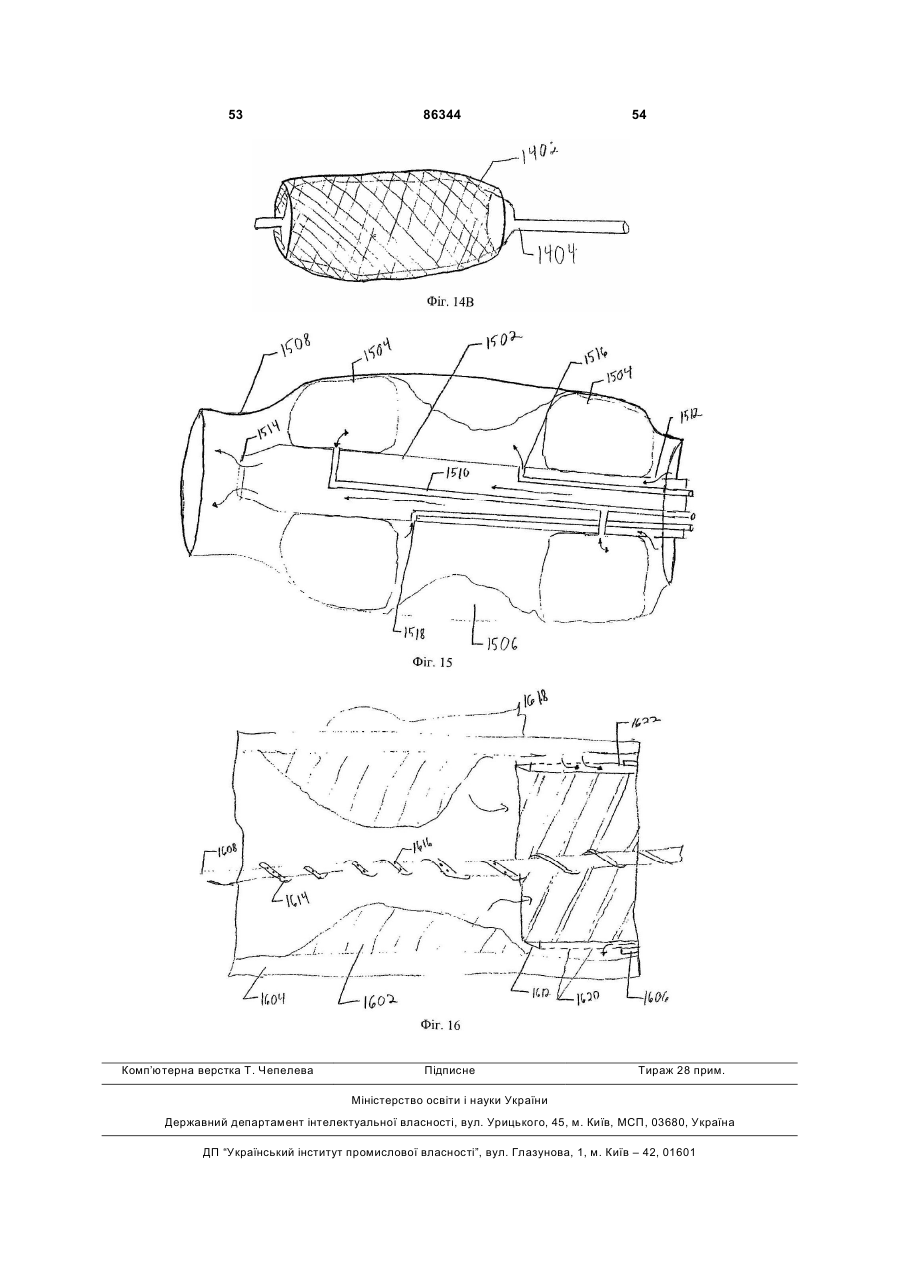
1. Спосіб виконання ангіопластики у пацієнта, де спосіб включає: (a) виконання ангіопластики у пацієнта і (b) перед, під час або після (а) введення пацієнту фармацевтичної композиції, що включає кількість монооксиду вуглецю, ефективну для лікування гіперплазії інтими у пацієнта. 2. Спосіб за п.1, де ангіопластика включає балонну ангіопластику. 3. Спосіб за п.1, де ангіопластика включає лазерну ангіопластику. 4. Спосіб за п.1, де ангіопластика включає направлену атеректомію. 5. Спосіб за п.1, де ангіопластика включає ротаційну атеректомію. 6. Спосіб за п.1, де ангіопластика включає екстракційну атеректомію. 7. Спосіб за п.1, де ангіопластика включає процедуру стентування. 8. Спосіб за п.1, де ангіопластика включає балонну ангіопластику і процедуру стентування. 9. Спосіб лікування або запобігання рестенозу у пацієнта, причому спосіб включає: (a) надання посудини, що містить стиснутий газ, який включає газоподібний монооксид вуглецю; (b) виявлення пацієнта, страждаючого рестенозом або з ризиком його розвитку; (c) вивільнення стиснутого газу з посудини для утворення атмосфери, що включає газоподібний монооксид вуглецю, і 2 (19) 1 3 86344 4 24. Спосіб виконання ангіопластики у пацієнта, що включає: (а) надання пристрою для ангіопластики, здатного ввести монооксид вуглецю пацієнту; (b) розміщення пристрою в кровоносній судині, що має потребу в ангіопластиці; (c) виконання ангіопластики з використанням пристрою і (d) використання до, під час і/або після (с) пристрою для введення монооксиду вуглецю в кровоносну судину в кількості, достатній для лікування або запобігання гіперплазії інтими. 25. Застосування монооксиду вуглецю для одержання фармацевтичної композиції для лікування або запобігання рестенозу у пацієнта. 26. Застосування монооксиду вуглецю для одержання фармацевтичної композиції для лікування або запобігання гіперплазії інтими у пацієнта. 27. Застосування за п.25, де рестеноз виникає в результаті балонної ангіопластики. 28. Застосування за п.26, де гіперплазія інтими виникає в результаті балонної ангіопластики. 29. Застосування за п.25 або 26, де рестеноз або гіперплазія інтими виникає в результаті лазерної ангіопластики. 30. Застосування за п.25 або 26, де рестеноз або гіперплазія інтими виникає в результаті спрямованої атеректомії. 31. Застосування за п.25 або 26, де рестеноз або гіперплазія інтими виникає в результаті ротаційної атеректомії. 32. Застосування за п.25 або 26, де рестеноз або гіперплазія інтими виникає в результаті екстракційної атеректомії. 33. Застосування за п.25 або 26, де рестеноз або гіперплазія інтими виникає в результаті процедури стентування. Даний винахід відноситься переважно до лікування судинних захворювань. Оксигеназа-1 гема (НО-1) каталізує перший етап в розпаді гема. НО-1 розщеплює αмезовуглецевий мостиковий зв'язок молекул гема типу b окисленням з отриманням еквимолярних кількостей білівердину ІХа, моноокису вуглецю (CO) і вільного заліза. У подальшому білівердин перетворюється в білірубін за допомогою редуктази білівердину, а вільне залізо зв'язується в феритин (продукція якого індукується вільним залізом). CO визнана як важлива сигнальна молекула [Verma et al., Science 259: 381-384, 1993]. Передбачали, що моноокис вуглецю діє як нейронна молекула-посередник в мозку (див. там же) і як нейроендокринний модулятор в гіпоталамусі [Pozzoli et al., Endocrinology 735: 2314-2317, 1994]. CO, як і окисел азоту, являє собою агент, що розслабляє гладку мускулатуру [Utz et al., Biochem Pharmacol. 47: 195-201, 1991; Christodoulides et al., Circulation 97: 2306-9, 1995] і інгібує агрегацію тромбоцитів [Mansouri et al., Thromb Haemost. 48: 286-8, 1982]. Було показано, що вдихання низьких рівнів CO володіє протизапальними ефектами на деяких моделях. Гіперплазія інтими, потовщення внутрішнього шару кровоносної судини, являє собою патологічний процес, який виникає внаслідок пошкодження судини внаслідок таких процедур, як ангіопластика, обхідне шунтування або трансплантація органу. Гіперплазія інтими продовжує обмежувати успіх вказаних лікувальних втручань. Даний винахід частково оснований на відкриттях того, що СО запобігає артеріосклеротичним ураженням і гіперплазії інтими після аортальної трансплантації і балонного пошкодження сонних артерій у тварин. Відповідно, в одному аспекті винахід надає спосіб лікування гіперплазії інтими у пацієнта. Спосіб включає виявлення пацієнта, страждаючого гіперплазією інтими або з ризиком її розвитку (наприклад, гіперплазії інтими внаслідок процедури ангіопластики або процедури трансплантації, або внаслідок процедури або стану, відмінного від процедури трансплантації) і введення пацієнту фармацевтичної композиції, що включає кількість моноокису вуглецю, ефективну для лікування гіперплазії інтими у пацієнта. Винахід також надає спосіб виконання ангіопластики у пацієнта. Спосіб включає виконання ангіопластики у пацієнта і до, під час і/або після виконання ангіопластики введення пацієнту фармацевтичної композиції, що включає кількість СО, ефективну для лікування гіперплазії інтими у пацієнта. Ангіопластика може являти собою будьяку процедуру ангіопластики, наприклад, балонну ангіопластику, лазерну ангіопластику, артеректомію, наприклад, направлену артеректомію, ротаційну артеректомію або екстракційну артеректомію і/або будь-яку процедуру ангіопластики з використанням стенту, або будь-яку комбінацію таких процедур. Винахід також надає спосіб лікування (наприклад, запобігання або зменшення) рестенозу у пацієнта. Спосіб включає надання судини, що містить стиснутий газ, який включає моноокис вуглецю, виявлення пацієнта, страждаючого рестенозом або з ризиком його розвитку, вивільнення стиснутого газу з судини для утворення атмосфери, що включає газоподібну моноокис вуглецю, і контактування пацієнта з атмосферою, причому кількість моноокису вуглецю в атмосфері достатня для лікування рестенозу у пацієнта. В іншому аспекті винахід надає спосіб лікування рестенозу у пацієнта. Спосіб включає виявлення пацієнта, страждаючого рестенозом або з ризиком його розвитку, і введення пацієнту фармацевтичної композиції, що включає кількість 5 моноокису вуглецю, ефективну для лікування рестенозу у пацієнта. Рестеноз може розвиватися внаслідок будь-якої процедури ангіопластики, наприклад, балонної ангіопластики, лазерної ангіопластики, артеректомії, наприклад, направленої артеректомії, ротаційної артеректомії або екстракційної артеректомії і/або будь-якої процедури ангіопластики з використанням стенту, або будь-якої комбінації таких процедур. Винахід також надає спосіб виконання судинної хірургічної операції, наприклад, процедури трансплантації, у пацієнта. Спосіб включає: (а) виконання судинної хірургічної операції (наприклад, процедури трансплантації) у пацієнта і (b) перед, під час і/або після (а) введення пацієнту фармацевтичної композиції, що включає кількість CO, ефективну для лікування артеріосклерозу (наприклад, гіперплазії інтими) у пацієнта. В Іншому аспекті винахід надає спосіб інгібування проліферації гладком'язової клітини(клітин). Спосіб включає надання гладком'язової клітини(клітин) і введення в гладком'язову клітину(клітини) кількості СО, ефективної для інгібування проліферації гладком'язової клітини(клітин). Це можна проводити in vivo або in vitro. Наданий також спосіб виконання ангіопластики у пацієнта, який включає надання пристрою для ангіопластики (наприклад, пристрою, описаного тут), здатного вводити моноокис вуглецю пацієнту, розміщення пристрою в кровоносній судині, потребуючій ангіопластики, виконання ангіопластики з використанням пристрою і до, під час і/або після виконання ангіопластики введення СО в кровоносну судину з використанням пристрою в кількості, достатній для лікування гіперплазії інтими, для виконання за допомогою цього ангіопластики у пацієнта. Пристрій може являти собою будь-який пристрій, який можна використати при процедурі ангіопластики, наприклад, описаний тут пристрій. Альтернативно або на доповнення пристрій може бути покритий агентом, що вивільняє CO, наприклад, гідрогелем, олією або маззю, яка вивільняє CO, або сполукою, що вивільняє CO. В іншому аспекті винахід надає посудину, що містить стиснутий газоподібний CO медичної чистоти. Посудина може містити етикетку, яка вказує, що газ можна у використати для зменшення рестенозу, атеросклерозу і/або гіперплазії інтими у пацієнта (наприклад, людини) і/або його можна використати при процедурі ангіопластики. Газоподібний CO може знаходитися в суміші з газоподібним азотом, окисом азоту і газоподібним азотом або з газом, що містить кисень. Газоподібний СО може бути присутнім в суміші в концентрації, щонайменше близько 0,025%, наприклад, щонайменше близько 0,05%, 0,10%, 0,50%, 1,0%, 2,0%, 10%, 50% або 90%. Винахід також надає набір, який включає пристрій для ангіопластики (наприклад, пристрій для балонної ангіопластики, пристрій для лазерної ангіопластики, пристрій для атеректомії і/або стент) і посудину, що містить СО (наприклад, композицію рідкого і/або газоподібного СО). Пристрій для ангіопластики здатний вводити моноокис вуглецю пацієнту. Набір може, крім того, включати 86344 6 інструкції з використання композиції моноокису вуглецю в способі виконання ангіопластики у пацієнта. В іншому аспекті винахід надає пристрої для ангіопластики (наприклад, пристрої для балонної ангіопластики, пристрої для лазерної ангіопластики, пристрої для атеректомії і стенти, наприклад, пристрої, описані тут), здатні вводити СО пацієнту, і/або в кровоносну судину безпосередньо перед, під час і/або після процедури ангіопластики. В одному варіанті реалізації пристрій для ангіопластики містить композицію СО. В іншому варіанті реалізації пристрій являє собою пристрій для балонної ангіопластики, який включає наповнюваний елемент (наприклад, балон), який має множину отворів, і резервуар, що містить CO (наприклад, композицію рідкого і/або газоподібного CO), сполучений з наповнюваним елементом, так що CO можна доставити з резервуара через наповнюваний елемент і в кровоносну судину. Також в рамках винаходу знаходиться застосування СО для виготовлення лікарського засобу для лікування або запобігання описаному тут стану, наприклад, гіперплазії інтими, рестенозу і/або артеріосклерозу. Лікарський засіб можна також використати в способі виконання процедури ангіопластики і/або процедури трансплантації. Лікарський засіб може бути в будь-якій формі, як описано тут, наприклад, у вигляді композиції рідкого і/або газоподібного CO. При відсутності інших визначень, всі технічні і наукові терміни, що використовуються тут, мають таке ж значення, яке звичайно мається на увазі, і зрозумілі середньому фахівцеві в даній галузі, для якого призначений даний винахід. Відповідні способи і матеріали описані нижче, хоча на практиці або при застосуванні даного винаходу можна використати способи і матеріали, аналогічні або еквівалентні тим, які описані тут. Всі публікації, патентні заявки, патенти і інші посилання, згадані тут, повністю включені як посилання. У випадку суперечності контролем буде служити даний опис, який включає визначення. Матеріали, способи і приклади є лише ілюстративними і не призначені бути обмежувальними. Інші ознаки і переваги винаходу будуть очевидні з наступного докладного опису і з формули винаходу. Фіг.1А являє собою мікрофотографію (із збільшенням в 50 разів) сингенно трансплантованого аортального трансплантату, що ілюструє ефект сингенної трансплантації на трансплантат. Фіг.1В являє собою мікрофотографію (із збільшенням в 50 разів) алогенно трансплантованого аортального трансплантату, що ілюструє ефект алогенної трансплантації на трансплантат. Фіг.1С являє собою мікрофотографію (із збільшенням в 50 разів) алогенно трансплантованого аортального трансплантату, що ілюструє ефект алогенної трансплантації на трансплантат, коли реципієнт контактує з CO. Фіг.1D являє собою мікрофотографію (із збільшенням в 200 разів) сингенно трансплантованого аортального трансплантату, що ілюструє ефект сингенної трансплантації на трансплантат. 7 Фіг.1E являє собою мікрофотографію (із збільшенням в 200 разів) алогенно трансплантованого аортального трансплантату, що ілюструє ефект алогенної трансплантації на трансплантат. Фіг.1F являє собою мікрофотографію (із збільшенням в 200 разів) алогенно трансплантованого аортального трансплантату, що ілюструє ефект алогенної трансплантації на трансплантат, коли реципієнт контактує з CO. Фіг.1G являє собою гістограму, що демонструє середні відносні площі (в довільних одиницях) інтими аортальних трансплантатів, трансплантованих сингенно реципієнтам, що контактують з повітрям (Syng.), алогенно трансплантованих реципієнтам, що контактують з повітрям (Аllо.), і алогенно трансплантованих реципієнтам, що контактують з CO (Allo.+CO). Фіг.1H являє собою гістограму, що демонструє середні відносні площі (в довільних одиницях) медії аортальних трансплантатів, трансплантованих сингенно реципієнтам, що контактують з повітрям (Syng.), алогенно трансплантованих реципієнтам, що контактують з повітрям (Аllо.), і алогенно трансплантованих реципієнтам, що контактують з CO (Аllо.+CO). Фіг.1I являє собою гістограму, що демонструє співвідношення між площею інтими і медії аортальних трансплантатів, трансплантованих сингенно реципієнтам, що контактують з повітрям (Syng.), алогенно трансплантованих реципієнтам, що контактують з повітрям (АIIо.), і алогенно трансплантованих реципієнтам, що контактують з CO (АIIо.+CO). Фіг.2А являє собою гістограму, що демонструє накопичення активованих лейкоцитів (виміряне підрахунком загальної кількості ядер) в адвентиції аортальних трансплантатів, трансплантованих сингенно реципієнтам, що контактують з повітрям (Syngeneic), алогенно реципієнтам, що контактують з повітрям (Allogeneic), і алогенно реципієнтам, що контактують з різними концентраціями CO (CO 250мл; СО 500мл і СО 750-1000м.ч.). Фіг.2В являє собою серію гістограм, що демонструють накопичення клітин, що містять CD45, EDI, МНСll і CD54, в адвентиції аортальних трансплантатів, трансплантованих сингенно реципієнтам, що контактують з повітрям (Syng.), алогенно трансплантованих реципієнтам, що контактують з повітрям (АIIо.), і алогенно трансплантованих реципієнтам, що контактують з CO (АIIо.+CO). Фіг.2С являє собою серію гістограм, що демонструють накопичення клітин, що містять CD3, CD4 і CD8, в адвентиції аортальних трансплантатів, трансплантованих сингенно реципієнтам, що контактують з повітрям (Syng.), алогенно трансплантованих реципієнтам, що контактують з повітрям (АIIо.), і алогенно трансплантованих реципієнтам, що контактують з СО (АIIо.+СО). Фіг.3А являє собою мікрофотографію (із збільшенням в 10 разів) зразка сонної артерії, що ілюструє вплив балонної ангіопластики на артерію. Фіг.3В являє собою мікрофотографію (із збільшенням в 10 разів) зразка сонної артерії, що ілюструє вплив балонної ангіопластики на артерію, коли індивідуум заздалегідь контактував з CO. 86344 8 Фіг.3С являє собою мікрофотографію зразка сонної артерії, що ілюструє вплив балонної ангіопластики на артерію. Фіг.3D являє собою мікрофотографію зразка сонної артерії, що ілюструє вплив балонної ангіопластики на артерію, коли індивідуум заздалегідь контактував з CO. Фіг.3Е являє собою гістограму, що демонструє середні відносні площі (в довільних одиницях) інтими сонних артерій, підданих балонній ангіопластиці, коли тварина, що є об'єктом дослідження, заздалегідь контактує або з повітрям (контроль), або з 250мл СО (СО). Фіг.3F являє собою гістограму, що демонструє середні відносні площі (в довільних одиницях) медії сонних артерій, підданих балонній ангіопластиці, коли тварина, що є об'єктом дослідження, заздалегідь контактує або з повітрям (контроль), або з 250м.ч. CO (CO). Фіг.3С являє собою гістограму, що демонструє співвідношення між площею інтими і медії сонних артерій, підданих балонній ангіопластиці, коли тварина, що є об'єктом дослідження, заздалегідь контактує або з повітрям, або з 250м.ч. CO (CO). Фіг.4А являє собою лінійний графік, що ілюструє проліферацію щурячих гладком'язових клітин (SMC), які не були трансдуковані (о; середня), трансдукованих рекомбінантним вірусом Lac.Z (□; LacZ Rec.Ad.) або трансдукованих рекомбінантним аденовірусом (×; НО-1 rec.Ad.). Фіг.4В являє собою лінійний графік, що ілюструє проліферацію щурячих SMC в присутності (×; 1000м.ч.) або відсутність (□) CO. Фіг.4С являє собою гістограму, що демонструє проліферацію SMC, виділених у мишей дикого типу (wt) або мишей з дефіцитом НО-1 (ho-1-I-) в присутності (CO) і за відсутності (повітря) CO. Фіг.4D відображає вестерн-блотинг, що ілюструє вплив контакту з CO (протягом 0, 4, 5, 16 і 24год.) на експресію білка р21 і β-актину в мишачих SMC. Фіг.4Е являє собою гістограму, що демонструє вплив СО на проліферацію мишачих SMC, виділених у мишей дикого типу (wt) і мишей з дефіцитом р21Сір1 (р2-l-) і р53 (р53-l-). Сірі стовпці показують клітини, що контактували з кімнатним повітрям, а чорні стовпці - клітини, що контактували з CO (250м.ч.). Фіг.4F являє собою гістограму, що демонструє співвідношення між площею інтими і медії пошкоджених балоном сонних артерій від мишей дикого типу (C57/B16/S129; wt) і р21-l-, що контактували з повітрям (Air) або моно окисом вуглецю (CO). Фіг.5А являє собою гістограму, що демонструє ефект від контакту з повітрям (Air) і CO (250м.ч. протягом 8год. або 16год.) на середній вміст циклічного гуанозин монофосфату (цГМФ) в мишачих клітинах SMC. Фіг.5В являє собою гістограму, що демонструє захоплення [3Н]тимідину мишачими SMC, що контактували з повітрям (Air), CO (250м.ч.) і СО плюс інгібітором гуанілатциклази 1Н(1,2,4)оксадіазол(4,3-а)хіноксаліном-1 (CO/ODQ). 9 Фіг.5С являє собою складову картину вестернблотинга, що ілюструє ефект від натрієвої солі 8бромгуанозин 3'-5'-циклічного монофосфату (8-ВrцГМФ) на експресію р21Сip1. Фіг.5D являє собою гістограму, що демонструє захоплення [3Н]тимідину SMC, виділених у мишей дикого типу (wt) і мишей з дефіцитом р21Сip1 (р21-l-) в присутності 8-Вr-цГМФ; 8-Вr-цГМФ (р21-l-) і відсутності (повітря) аналога цГМФ 8-Вr-цГМФ. Фіг.5Е являє собою складову картину вестернблотинга, що ілюструє вплив CO (250м.ч.) на експресію фосфорильованого р38 МАРК (р-р38), ATF2 (p-ATF-2), JNK (p-JNK) і ERK (p-ERK), в порівнянні із загальним вмістом р38 МАРК, ATF-2, JNK і ERK в SMC. Фіг.5F являє собою гістограму, що демонструє захоплення [3Н]тимідину мишачими SMC, що контактували з повітрям (Air), 250м.ч. CO (CO) і СО плюс інгібітор р38 МАРК SB203580 (CO/SB). Фіг.5G являє собою складову картину вестернблотинга, що ілюструє вплив повітря (Air), CO (250м.ч.; CO), SB203580 і ДМСО на експресію р21Сір1 в мишачих SMC. Фіг.6А являє собою складову картину вестернблотинга, що ілюструє ефект від 8-Вr-цГМФ на експресію р38 МАРК в мишачих SMC. Фіг.6В являє собою гістограму, що демонструє захоплення [3Н]тимідину мишачими SMC, що контактували з повітрям (Air), CO плюс 8-Вr-цГМФ (8Br-цГМФ) і CO плюс 8-Вr-цГМФ плюс SB203580 (8Вr-цГМФ+SB203580). Фіг.7А являє собою графік результатів проточної цитометрії, що ілюструє ефект від контакту з повітрям (Air) і CO (250м.ч.) на клітинний цикл SMC аорти щурів. Фіг.7В являє собою лінійний графік, що ілюструє ефект впливу повітря (а) і CO (×) на проліферацію SMC. Фіг.8 являє собою гістограму, що демонструє захоплення [3Н]тимідину SMC мишей дикого типу (wt), p21-l- і р53-l-, що контактували або з повітрям (сірі стовпці) або з CO (250м.ч., чорні стовпці) протягом 24год. Фіг.9А являє собою мікрофотографію (збільшення в 20 разів) зрізу сонної артерії у миші дикого типу через 14 днів після пошкодження дротом. Тварина, що досліджується, контактувала з кімнатним повітрям протягом 1год. перед пошкодженням дротом. Фіг.9В являє собою мікрофотографію (збільшення в 20 разів) зрізу сонної артерії у миші дикого типу через 14 днів після пошкодження дротом. Тварина, що досліджується, контактувала з СО (250м.ч.) протягом 1год. перед пошкодженням дротом. Фіг.9С являє собою мікрофотографію (збільшення в 20 разів) зрізу сонної артерії у миші р21-lчерез 14 днів після пошкодження дротом. Тварина, що досліджується, контактувала з кімнатним повітрям протягом 1год. перед пошкодженням дротом. Фіг.9D являє собою мікрофотографію (збільшення в 20 разів) зрізу сонної артерії у миші р21-lчерез 14 днів після пошкодження дротом. Тварина, що досліджується, контактувала з СО (250м.ч.) протягом 1год. перед пошкодженням дротом. 86344 10 Фіг.9Е являє собою гістограму, що демонструє середні відносні площі (в довільних одиницях) інтими пошкоджених дротом сонних артерій від мишей дикого типу (wt) і р21-l-, що контактували або з повітрям (контроль), або з 250м.ч. CO (CO). Фіг.9F являє собою гістограму, що демонструє середні відносні площі (в довільних одиницях) медії пошкоджених дротом сонних артерій від мишей дикого типу (wt) і p21-l-, що контактували або з повітрям (контроль), або з 250м.ч. CO (CO). Фіг.9G являє собою гістограму, що демонструє співвідношення між площами інтими і медії пошкоджених дротом сонних артерій від мишей дикого типу (wt) і р21-l-, що контактували або з повітрям (контроль), або з 250м.ч. CO (CO). Фіг.10 являє собою гістограму, що демонструє захоплення [3Н]тимідину SMC, отриманих у мишей p21-l- оброблених повітрям (Air), CO (250м.ч., CO) і СО плюс SB203580 (CO/SB). Фіг.11А являє собою гістограму, що демонструє захоплення [3Н]тимідину SMC, отриманих у мишей дикого типу (wt) і мишей з дефіцитом enos-lі inos-l-, оброблених повітрям (Air) або CO (250м.ч., CO). Фіг.11В являє собою гістограму, що демонструє середні площі інтими і медії і співвідношення між площами інтими і медії сонних артерій щурів Sprague-Dawley, що контактували з кімнатним повітрям (білі стовпці), або NO (чорні стовпці; 1год., 250м.ч.) перед балонним пошкодженням сонної артерії. Фіг.12А являє собою складову картину вестерн-блотинга, що ілюструє експресію РАІ-1 в SMC, оброблених сироваткою або без сироватки (відповідно Serum і No Serum) і CO і без CO (відповідно Air і CO) протягом 24 і 48год. Liver= лізати цільних клітин з гомогенатів печінки щурів, оброблені без ендотоксину (LPS). Liver+LPS= лізати цільних клітин з гомогенатів печінки щурів, оброблені ендотоксином (LPS). Фактор пухлинного некрозу-α (TNF-α)= контроль, де TNF-α додавали до клітинної культури для стимуляції експресії РАІ-1. Фіг.12В являє собою картину вестернблотинга, що ілюструє експресію РАІ-1 в не трансплантованих (контроль), трансплантованих (Аllо.+Air) і оброблених CO трансплантованих (Allo.+CO) аортах через 56 днів після трансплантації. Фіг.12С являє собою картину поліакриламідного гелю, забарвленого кумасі синім, використаного для вестерн-блотинга, показаного на Фіг.12В, яка ілюструє експресію РАІ-1 в не трансплантованих (контроль), трансплантованих (Allo.+Air) і оброблених CO трансплантованих (Allo.+CO) аортах через 56 днів після трансплантації. Фіг.13А-13В ілюструють приклад пристрою для балонної ангіопластики, здатного вводити CO пацієнту, під час процедури ангіопластики на різних стадіях операції. Фіг.13С-13D ілюструють альтернативні варіанти реалізації пристрою для балонної ангіопластики. 11 Фіг.14А-14В ілюструють приклад стенту, здатного вводити CO пацієнту, під час процедури ангіопластики на різних стадіях операції. Фіг.15 ілюструє приклад пристрою для балонної ангіопластики з множинним балонами, призначеного для введення CO пацієнту, під час процедури ангіопластики. Фіг.16 ілюструє приклад пристрою для атеректомії, здатного вводити CO пацієнту під час процедури ангіопластики. Термін «моноокис вуглецю» (або «CO»), що використовується тут, описує молекулярний моноокис вуглецю в його газоподібному стані, стиснутий до рідкої форми, або розчинений у водному розчині. Термін «композиція моноокису вуглецю» або «фармацевтична композиція, що включає моноокис вуглецю» використовується у всьому описі для опису газоподібної або рідкої композиції, що включає моноокис вуглецю, який можна вводити пацієнту і/або в кровоносну судину, наприклад, пацієнту (або в кровоносну судину), що піддається ангіопластиці, операції обхідного шунтування, трансплантації або будь-якій іншій процедурі, яка може привести або приведе до гіперплазії інтими і/або артеріосклерозу. Досвідченому фахівцеві буде зрозуміло, яка форма фармацевтичної композиції, наприклад, газоподібна, рідка або як газоподібна, так і рідка, переважна для даного застосування. Термін «гіперплазія інтими» являє собою термін, визнаний в даній галузі, і використовується тут для опису проліферації клітин, наприклад, гладком'язових клітин, всередині інтими кровоносної судини. Досвідченому фахівцеві буде зрозуміло, що гіперплазія інтими може бути викликана рядом чинників, наприклад, механічним, хімічним і/або імунологічним пошкодженням інтими. Гіперплазію інтими можна часто спостерігати у пацієнтів, наприклад, після балонної ангіопластики або операцій на судинах, наприклад, операцій на судинах, що включають венозні трансплантати (наприклад, операції трансплантації). «Артеріосклероз», «артеріосклеротичне ураження», «артеріосклеротична бляшка» і «артеріосклеротичне захворювання» також являють собою терміни, визнані в даній галузі, і використовуються тут для опису потовщення і отвердіння артеріальної стінки. Термін «судинна мережа», що використовується тут, відноситься до судинної системи (або будь-якої її частини) організму, людського або не людського, і включає кровоносні судини, наприклад, артерії, артеріоли, вени, венули і капіляри. Термін «рестеноз» відноситься до повторного звуження артерії після ангіопластики. Термін «ангіопластика» являє собою термін, визнаний в даній галузі, і відноситься до будь-якої процедури, окремо або в комбінації, що включає реконструкцію кровоносної судини, наприклад, розширення ділянки стенозу в судинній системі пацієнта для відновлення адекватного кровотоку позаду стенозу. Такі процедури включають чрезшкірну транслюмінальну ангіопластику (ЧТА), при якій використовується катетер, який має дистальний кінець, що розширюється, тобто наповнюваний балон (відому як «балонна ангіопластика»); 86344 12 лазерну ангіопластику, екстракційну атеректомію, направлену атеректомію, ротаційну атеректомію, стентування і будь-яку іншу процедуру для реконструкції кровоносної судини, наприклад, артерії. Терміни «ефективна кількість» і «ефективна для лікування», що використовуються тут, відносяться до кількості або концентрації моноокису вуглецю, яка використовується протягом періоду часу (включаючи однократне і тривале введення і періодичне або безперервне введення), яке ефективне в рамках контексту його введення для того, щоб викликати передбачуваний ефект або фізіологічний вихід. Ефективні кількості моноокису вуглецю для застосування в даному винаході включають, наприклад, кількості, які запобігають або зменшують гіперплазію інтими після процедури, наприклад, ангіопластики. Ефективні кількості моноокису вуглецю також включають кількості, які запобігають або зменшують артеріосклероз у пацієнта, наприклад, у пацієнта після трансплантації. Термін «лікувати (лікування)» використовується тут для опису затримки початку, інгібування або полегшення ушкоджуючих впливів стану, такого як гіперплазія інтими і/або артеріосклероз. Для газів ефективні кількості CO загалом укладаються в межі діапазону від близько 0,0000001% до близько 0,3% мас, наприклад, від близько 0,0001% до близько 0,25% мас, переважно, щонайменше близько 0,001% мас, наприклад, щонайменше близько 0,005%, 0,010%, 0,02%, 0,025%, 0,03%, 0,04%, 0,05%, 0,06%, 0,08%, 0,10%, 0,15%, 0,20%, 0,22% або 0,24% мас. CO. Переважні діапазони CO включають від 0,002% до близько 0,24%, від близько 0,005% до близько 0,22%, від близько 0,01% до близько 0,20% і від близько 0,02% до близько 0,1% мас. Для рідких розчинів CO ефективні кількості загалом укладаються в діапазон від близько 0,0001 до близько 0,0044г СО/100г рідини, наприклад, щонайменше, приблизно 0,0001, 0,0002, 0,0004, 0,0006, 0,0008, 0,0010, 0,0013, 0,0014, 0,0015, 0,0016, 0,0018, 0,0020, 0,0021, 0,0022, 0,0024, 0,0026, 0,0028, 0,0030, 0,0032, 0,0035, 0,0037, 0,0040 або 0,0042г СО/100г водного розчину. Переважні діапазони включають, наприклад, від близько 0,0010 до близько 0,0030г СО/100г водного розчину, від близько 0,0015 до близько 0,0026г СО/100г водного розчину або від близько 0,0018 до близько 0,0024г СО/100г водного розчину. Досвідченому фахівцеві в даній галузі буде зрозуміло, що в залежності від виду застосування, можна застосовувати кількості, що виходять за межі вказаних діапазонів. Термін «пацієнт» використовується у всьому описі для опису тварини, людини або не людини, якій надається лікування відповідно до способів даного винаходу. Даний винахід передбачає ветеринарні і не ветеринарні види застосування. Термін включає, але не обмежується, ссавців, наприклад, людей, інших приматів, свиней, гризунів, таких як миші і щури, кролики, морські свинки, хом'яки, корови, коні, кішки, собаки, вівці і кози. Термін «трансплантація» використовується по всьому опису як загальний термін для опису способу перенесення органу або тканини пацієнту. Термін «трансплантація» визначається в даній 13 галузі як перенесення живих тканин або клітин від донору реципієнту з наміром підтримки функціональної єдності трансплантованої тканини або клітин у реципієнта [див., наприклад, The Merck Manual, Berkow, Fletcher, and Beers, Eds., Merck Research Laboratories, Rahway, N.J., 1992]. Термін включає всі категорії трансплантатів, відомі в даній галузі. Трансплантати діляться на категорії по ділянці і генетичному зв'язку між донором і реципієнтом. Термін включає, наприклад, аутотрансплантацію (видалення і перенесення клітин або тканини з одного положення у пацієнта в ту ж або іншу ділянку у того ж пацієнта), алотрансплантацію (трансплантацію між членами одного і того ж виду) і ксенотрансплантацію (трансплантацію між членами різних видів). Термін «донор» або «пацієнт-донор», що використовується тут, відноситься до тварини (людини або не людини), від якої можна отримати орган або тканину з метою трансплантації пацієнту-реципієнту. Термін «реципієнт» або «пацієнтреципієнт» відноситься до тварини (людини або не людини), якій можна перенести орган або тканину. Терміни «відторгнення органу», «відторгнення трансплантату» і «відторгнення» є визнаними в даній галузі і використовуються у всьому описі як загальні терміни для опису процесу відторгнення органу, тканин або клітин у реципієнта. У визначення включені, наприклад, три основних типи відторгнення, які звичайно виявляються в клінічній практиці: надгостре відторгнення, гостре відторгнення і хронічне відторгнення [див., наприклад, Oxford Textbook of Surgery, Morris and Malt, Eds., Oxford University Press, 1994]. Термін «орган(и)» використовується по всьому опису як загальний термін для опису будь-якої анатомічної частини або елемента, що має специфічну функцію у тварини. Далі в значення даного терміну включені істотні частини органів, наприклад, пов'язані тканини, отримані з органу. Такі органи включають, нирку, печінку, серце, кишечник, наприклад, товсту або тонку кишку, підшлункову залозу і легені, але не обмежуються ними. У дане визначення включена також судинна система, наприклад, вени і артерії, і кістки. Особливо сприятливий вплив винахід може надати на індивідуумів, у яких, як вважають, є ризик розвитку гіперплазії інтими або артеріосклерозу, насамперед тому, що профілактичне лікування CO можна проводити перед тим як у пацієнта буде проведена процедура, або перед будь-якими виявами гіперплазії інтими або артеріосклеротичної бляшки. Індивідууми «з ризиком» включають, наприклад, пацієнтів, які мають або будуть мати будь-який тип механічного, хімічного і/або імунологічного пошкодження інтими, наприклад, пацієнтів, які були піддані або будуть піддані операції трансплантації і/або ангіопластиці. Кваліфікованому фахівцеві буде зрозуміло, що ризик гіперплазії інтими або артеріосклерозу у пацієнта можна визначити будь-яким способом, відомим в даній галузі, наприклад, медичною діагностикою. Отримання газоподібних композицій 86344 14 Композиція CO може являти собою газоподібну композицію. Стиснутий або такий газ, що знаходиться під підвищеним тиском, який можна використати в способах винаходу, можна отримати з будь-якого комерційного джерела і в будь-якому типі посудини, відповідної для зберігання стиснутого газу. Наприклад, стиснуті або такі гази, що знаходяться під підвищеним тиском, можна отримати з будь-якого джерела, яке постачає стиснуті гази, такі як кисень, для медичного використання. Термін газ «медичної чистоти», що використовується тут, відноситься до газу, відповідного для введення визначеному тут пацієнту. Стиснутий газ, включаючи CO, що використовується в способах даного винаходу, може бути наданий таким чином, щоб всі гази бажаної кінцевої композиції (наприклад, CO, Не, NO, СO2, O2, N2) знаходилися в одній і тій же посудині, за винятком того, що NO і O2 не можна зберігати разом. Способи даного винаходу можна необов'язково виконувати з використанням множини посудин, що містять окремі гази. Наприклад, може бути надана одна посудина, яка містить моноокис вуглецю з іншими газами або без них, вміст яких може бути необов'язково змішаний з вмістом інших посудин, наприклад, посудин, що містять кисень, азот, двоокис вуглецю, стиснуте повітря або будь-який інший відповідний газ або їх суміші. Газоподібні композиції, що вводяться пацієнту відповідно до даного винаходу, звичайно містять від 0% до близько 79% мас. азоту, від близько 21% до близько 100% мас. кисню і від близько 0,0000001% до близько 0,3% мас. (відповідні приблизно 1 частці на мільярд або від 0,001м.ч. до близько 3000м.ч.) CO. Переважно, кількість азоту в газоподібній композиції становить приблизно 79% мас, кількість кисню становить приблизно 21% мас, а кількість CO складає приблизно від близько 0,0001% до близько 0,25% мас. Кількість CO становить переважно, щонайменше приблизно 0,001%, наприклад, щонайменше приблизно 0,005%, 0,01%, 0,02%, 0,025%, 0,03%, 0,04%, 0,05%, 0,06%, 0,08%, 0,10%, 0,15%, 0,20%, 0,22% або 0,24% мас Переважні діапазони CO включають від 0,005% до близько 0,24%, близько 0,01% до близько 0,22%, від близько 0,015% до близько 0,20% і від близько 0,025% до близько 0,1% мас. Зазначено, що газоподібні композиції CO, що мають концентрацію CO більше 0,3% (таку як 1% або більше) можна використати протягом коротких періодів (наприклад, для одного або декількох вдихів), в залежності від застосування. Газоподібну композицію CO можна застосовувати для створення атмосфери, яка включає газ CO. Атмосферу, яка включає відповідні рівні газоподібного CO, можна створити, наприклад, наданням посудини, що містить газ, який знаходиться під підвищеним тиском, що включає газоподібний CO, і вивільненням газу, який знаходиться під підвищеним тиском, в камеру або простір для формування атмосфери, яка включає газоподібний CO всередині камери або простору. Альтернативно, гази можна вивільняти в пристрій, який закінчується дихальною маскою або дихальною трубкою, створюючи за допомогою цього атмосферу, що 15 містить газоподібний СО в дихальній масці або дихальній трубці, гарантуючи те, що пацієнт являє собою єдину особу в приміщенні, що контактує зі значними рівнями CO. Рівні СО в атмосфері можна виміряти або контролювати з використанням будь-якого способу, відомого в даній галузі. Такі способи включають електрохімічне виявлення, газову хроматографію, радіоізотопний підрахунок, поглинання інфрачервоного випромінювання, колориметрію і електрохімічні способи, основані на селективних мембранах [див., наприклад, Sunderman et al., Clin. Chem. 28: 2026-2032, 1982; Ingi et al., Neuron 16: 835-842, 1996]. Рівні CO, що складають менше за частини на мільйон можна виявити, наприклад, газовою хроматографією і радіоізотопним підрахунком. Далі, в даній галузі відомо, що рівні СО в діапазоні нижче за м.ч. можна виміряти в біологічній тканині середньо-інфрачервоним газовим датчиком [Morimoto et al., Am. J. Physiol. Heart. Circ. Physiol 280: H482-H488, 2001]. Датчики CO і пристрої виявлення газів широко доступні з багатьох комерційних джерел. Отримання рідких композицій Фармацевтична композиція, що включає CO, може також являти собою рідку композицію. Рідину можна перетворити в фармацевтичну композицію, що включає CO, будь-яким способом, відомим в даній галузі для того, щоб спричинити розчинення газів в рідинах. Наприклад, рідину можна вмістити в так званий «СО2-інкубатор» і забезпечити її контакт з постійним потоком CO, переважно, збалансованим двоокисом вуглецю доти, поки в рідині не буде досягнута бажана концентрація CO. Як інший приклад, газоподібний CO можна «барботувати» безпосередньо через рідину доти, поки в рідині не буде досягнута бажана концентрація CO. Кількість CO, яку можна розчинити в даному водному розчині, зростає із зменшенням температури. Як ще один приклад, відповідну рідину можна пропустити через трубку, яка забезпечує можливість дифузії газу, причому трубка проходить через атмосферу, що включає CO (наприклад, з використанням такого пристрою як екстракорпоральний мембранний оксигенатор). СО дифундує в рідину для створення рідкої композиції CO. Ймовірно, що така рідка композиція, призначена для введення живій тварині, повинна мати температуру, що дорівнює або близька до 37°С в той час, коли її вводять тварині. Рідина може являти собою будь-яку рідину, відому фахівцям в даній галузі, як відповідну для введення пацієнтам [див., наприклад, Oxford Textbook of Surgery, Morris and Malt, Eds., Oxford University Press, 1994]. Загалом, рідина повинна являти собою водний розчин. Приклади розчинів включають фосфатний буферований сольовий розчин (PBS), Celsior™, Perfadex™, розчин Колінза, розчин цитрату і розчин Вісконсинського університету (UW) [Oxford Textbook of Surgery, Morris and Malt, Eds., Oxford University Press, 1994]. В одному варіанті реалізації даного винаходу рідина являє собою розчин Рінгера, наприклад, розчин Рінгера з лактатом, або будь-яку іншу рідину, яку 86344 16 можна вливати пацієнту. В іншому варіанті реалізації рідина включає кров, наприклад цільну кров. Будь-яку відповідну рідину можна насичувати до встановленої концентрації СО за допомогою газових дифузорів. Альтернативно, можна використати заздалегідь виготовлені розчини, які пройшли контроль якості, за вмістом встановлених рівнів CO. Точного контролю дози можна досягти за допомогою вимірювань за допомогою проникної для газу, непроникної для рідини мембрани, сполученої з аналізатором CO. Розчини можна насичувати до бажаних ефективних концентрацій і підтримувати на вказаних рівнях. Лікування пацієнтів і судинної системи композиціями CO Даний винахід передбачає введення композицій CO пацієнтам і/або в частини їх судинної системи до, під час і/або після того як пацієнт зазнає ангіопластики, операції трансплантації, операції на судинах або будь-якої іншої процедури, яка викликає/збільшує ризик гіперплазії інтими, рестенозу і/або артеріосклерозу у пацієнта. Пацієнта можна лікувати системно газоподібними і/або рідкими композиціями CO будь-яким способом, відомим в галузі введення газів і/або рідин пацієнтам, наприклад, інгаляцією газу і внутрішньовенним або внутрішньоартеріальним введенням рідини. При системному лікуванні по суті всю судинну систему пацієнта можна обробити CO. Частину судинної системи пацієнта, наприклад, певну вену або артерію можна обробити введенням газоподібної або рідкої композиції CO безпосередньо у вену або артерію. Хоча даний винахід не обмежений якимнебудь конкретним способом введення композицій CO пацієнтам і/або в частини їх судинної системи, різні види лікування детально обговорені нижче. Системна доставка газоподібного СО Газоподібні композиції СО можна системно доставляти пацієнту, наприклад, страждаючому гіперплазією інтими або з ризиком її розвитку (наприклад, рестенозом і/або артеріосклерозом). Газоподібні композиції СО звичайно вводять інгаляцією через ротову порожнину або носові ходи в легені, де СО легко всмоктується в потік крові пацієнта. Концентрація активної сполуки (СО), що використовується в терапевтичній газоподібній композиції, буде залежати від швидкостей всмоктування, розподілу, інактивації і виділення (загалом, через дихання) СО, а також від інших чинників, відомих фахівцям в даній галузі. Крім того, потрібно розуміти, що для будь-якого конкретного індивідуума, слід протягом часу підбирати певні схеми дозування відповідно до індивідуальної потреби і професійної оцінки особи, що вводить або, що спостерігає за введенням композицій, і що викладені тут діапазони концентрації є лише ілюстративними і не призначені для обмеження об'єму або практики застосування композиції, що заявляється. Даний винахід передбачає однократне, короткочасне і тривале введення CO. CO може бути доставлений пацієнту протягом часу (включаючи невизначений), достатнього для лікування стану і надання передбачуваного фармакологічного або біологічного ефекту. 17 Далі йдуть приклади деяких способів і пристроїв, які можна використати для введення газоподібних композицій CO пацієнтам. Апарати штучної вентиляції CO медичної чистоти (концентрації можуть варіювати) можна закупити у вигляді суміші з повітрям або іншим газом, що містить кисень, в стандартному резервуарі для стиснутого газу (наприклад, 21% О2, 79% N2). Він є не реактивним, і концентрації, які потрібні для способів даного винаходу, значно нижче діапазону запалення (10% в повітрі). У лікарняній установі газ можливо буде доставлятися до постелі пацієнта, де він буде змішуватися з киснем або повітрям приміщення в змішувачі до бажаної концентрації в м.ч. (частках на мільйон). Пацієнт буде вдихати газову суміш через апарат штучної вентиляції, швидкість потоку в якому буде встановлена виходячи з комфорту і потреб пацієнта. Це визначається легеневими графіками (тобто частотою дихання, дихальними об'ємами і т.д.). У пристрій подачі може бути вмонтований механізм(и) збереження робочого режиму при відмові окремих елементів для запобігання небажаному отриманню пацієнтом кількостей моноокису вуглецю, більших, ніж бажані. Рівень СО у пацієнта можна контролювати оцінкою (1) карбоксигемоглобіну (СОНb), який можна вимірювати у венозній крові, і (2) СО в повітрі, що видихається, зібраному з бічного отвору апарату штучної вентиляції. Рівень впливу CO можна регулювати на основі стану здоров'я пацієнта і на основі маркерів. За необхідності, CO можна вимити з організму пацієнта перемиканням на інгаляцію 100% О2. СО не метаболізується; таким чином, все, що вдихується, зрештою буде видихатися, за винятком дуже маленької процентної частки, яка перетворюється в СО2. СО можна також змішувати з будь-яким рівнем О2 для забезпечення терапевтичної доставки СО без подальших гіпоксичних станів. Лицьова маска і тент Газову суміш, що містить СО, готують, як вказано вище, для забезпечення можливості пасивного вдихання пацієнтом з використанням лицьової маски або тенту. Концентрацію вдихуваного СО можна змінювати, і його можна вимити перемиканням на 100% О2. Моніторинг рівнів СО повинен проводитися в масці або тенті або близько від них з використанням механізму збереження робочого режиму при відмові окремих елементів, який повинен запобігти вдиханню дуже високої концентрації CO. Портативний інгалятор Стиснутий CO може бути упакований в портативний інгаляційний пристрій і вдихатися у відміряній дозі, наприклад, для забезпечення можливості переривистого лікування реципієнта, який не знаходиться в стаціонарних умовах. У контейнери можна упаковувати різні концентрації CO. Пристрій може бути дуже простим і являти собою маленький резервуар (наприклад, до 5кг) відповідним чином розчиненого CO з двопозиційним клапаном і трубкою, з якої пацієнт отримує струмінь CO відповідно до стандартної схеми або за необхідності. Внутрішньовенна штучна легеня 86344 18 Для доставки СО можна використати штучний легень (катетерний пристрій для обміну газів в крові), призначений для доставки О2 і видалення СО2. Катетер при імплантації знаходиться в одній з великих вен і повинен бути здатний доставити СО в бажаних концентраціях або для системної доставки, або в локальну ділянку. Доставка може являти собою локальну доставку високої концентрації СО протягом короткого періоду часу в ділянку ангіопластичної процедури (дана висока концентрація швидко розбавиться в потоку крові), або відносно більш тривалий контакт з більш низькою концентрацією CO. Приклади штучних легенів описані, наприклад, в [Hattler et al., Artif, Organs 18(11): 806-812, 1994; Golob et al., ASAIO J., 47(5): 432-437, 2001]. Термін «пристрій внутрішньосудинної доставки моноокису вуглецю», що використовується тут, відноситься до катетерного пристрою, наприклад, штучного легеня (або його модифікованого варіанту), здатного знаходитися в кровоносній судині протягом тривалих періодів часу (включаючи невизначено тривалий) і доставляти CO пацієнту системно і/або місцево. Камера з нормальним атмосферним тиском У певних випадках було б бажано піддати впливу СО весь організм пацієнта. Пацієнт повинен бути всередині повітронепроникної камери, яка буде заповнена СО на рівні, який не є небезпечним для пацієнта, або на рівні, який являє собою прийнятний ризик без ризику впливу на людей, що знаходяться поряд. Після завершення впливу камеру можна провітрити повітрям (наприклад, 21% О2, 79% N2) і проби можна аналізувати аналізаторами СО для того, щоб забезпечити відсутність CO, що залишився, перед дозволом пацієнту вийти з пристрою для впливу. Системна доставка рідких композицій CO Даний винахід, крім того, передбачає, що можуть бути створені рідкі композиції СО для системної доставки пацієнту, наприклад, внутрішньовенним або внутрішньоартеріальним вливанням пацієнту. Наприклад, рідку композицію CO, таку як насичений CO розчин Рінгера, можна вливати пацієнту перед, під час і/або після процедури ангіопластики або трансплантації. Альтернативно, або в доповнення, пацієнту можна вливати цільну (або часткову) кров, частково або повністю насичену CO. Даний винахід також передбачає можливість використання агентів, здатних доставляти дози газу або рідин CO (наприклад смоли, креми, мазі або накладки, що вивільняють CO). Доставка СО в частини судинної системи Обробка in situ Альтернативно або на доповнення до системного лікування, композиції моноокису вуглецю можна наносити безпосередньо на будь-яку частину судинної системи пацієнта, в якого є гіперплазія інтими і/або артеріосклероз або ризик їх розвитку. Газоподібну композицію можна нанести безпосередньо на частину судинної системи пацієнта, наприклад, на уражену артерію, будь-яким способом для введення газів в судинну систему пацієнта, відомим в даній галузі. Наприклад, CO можна доставити в артерію до, під час і/або після ангіопластичної (наприклад, балонної ангіопластики) або 19 хірургічної (наприклад, трансплантаційної) процедури, через пристрій, подібний до описаного вище внутрішньовенного штучного легеня. Як інший приклад, будь-який пристрій, що використовується для виконання ангіопластичної процедури, можна модифікувати для введення СО в судинну систему пацієнта через інструмент під час виконання ангіопластики. Такі пристрої далі детально обговорені нижче. Рідкі композиції CO можна також наносити безпосередньо на частину судинної системи пацієнта. Рідкі композиції CO можна вводити будьяким способом, відомим в галузі введення рідин в судинну систему пацієнта. Наприклад, рідку композицію CO можна вводити в певну вену (наприклад, внутрішньовенною ін'єкцією), або артерію (наприклад, внутрішньоартеріальною ін'єкцією) перед, під час і/або після процедури. Як інший приклад, як описано вище, будь-який інструмент, що використовується при ангіопластичних процедурах, можна модифікувати для введення у вену або артерію рідкої композиції СО в той час, коли виконується ангіопластична процедура. Лікування ex vivo Даний винахід, крім того, передбачає застосування композицій СО для запобігання або зменшення гіперплазії інтими і/або артеріосклерозу в трансплантованих судинах, наприклад, окремих кровоносних судинах (наприклад, трансплантатах вен або аорти) або кровоносних судинах, які залишаються пов'язаними з органом, що трансплантується (наприклад, ниркою, печінкою, серцем або леґенем). Альтернативно або в доповнення до описаних вище впливів in situ, контакт судин з композиціями CO може відбуватися ex vivo. Наприклад, перед трансплантацією окремих кровоносних судин або органу з пов'язаними з ним судинами пацієнту-реципієнту судини можуть контактувати з атмосферою, що включає газоподібний моноокис вуглецю, з рідкою композицією моноокису вуглецю, наприклад, рідким перфузатом, консерваційним розчином або промивним розчином, що має розчинений в ньому моноокис вуглецю, або з ними обома. Контакт судин з газоподібною композицією CO ex vivo можна здійснити в будь-якій камері або зоні, відповідній для створення атмосфери, яка включає відповідні рівні газу CO. Такі камери включають, наприклад, інкубатори і камери, виготовлені з метою розміщення органу в консервувальному розчині. Як інший приклад, відповідна камера може являти собою камеру, в якій тільки гази, що подаються в камеру, присутні у внутрішній атмосфері, так, що концентрацію моноокису вуглецю можна встановити і підтримувати на рівні даної концентрації і чистоти, наприклад, коли камера є повітронепроникною. Наприклад, можна використати СО2-інкубатор для контакту судин з композицією моноокису вуглецю, причому газ моноокису вуглецю подається постійним потоком з посудини, яка містить газ. Контакт судин з газоподібною композицією CO ex vivo можна здійснити в будь-якій камері або просторі, що має достатній об'єм для повного або часткового занурення судин в рідку композицію 86344 20 CO. Контакт судин з такими композиціями можна також здійснити вміщенням судин в будь-який відповідний контейнер і викликаючи «відмивання» або промивання судин рідкою композицією СО так, щоб судини контактували з безперервним потоком композиції CO. Як інший приклад, судини можна навантажити в середовище або розчин, який не включає CO, і вміщені в камеру так, що середовище або розчин могли бути введені в композицію CO за допомогою контакту з атмосферою, що містить CO, як описано тут. Як ще один приклад, судини можна навантажити в рідину, яка не включає CO, і CO можна «барботувати» через рідину. Пристрої Даний винахід передбачає введення СО в судинну систему пацієнта з використанням пристрою, який може використовуватися і для виконання процедури ангіопластики, і для введення CO в судинну систему. CO можна вводити через і/або за допомогою інструмента, або з покриттям на ньому, що подає СО, в той час як виконується ангіопластика (наприклад, виконується безпосередньо перед, під час і/або безпосередньо після ангіопластики). Такі пристрої включають пристрої, що використовуються для балонної ангіопластики («пристрої для балонної ангіопластики»), лазерної ангіопластики («пристрої лазерної ангіопластики») і пристрої, що використовуються для атеректомії («пристрої для атеректомії»), наприклад, екстракційної атеректомії, направленої атеректомії, ротаційної атеректомії і стенти. Термін «пристрій для ангіопластики», що використовується тут, являє собою будь-який пристрій, який можна використати для виконання ангіопластики у пацієнта. Приклади катетерного пристрою з елементом (наприклад, балоном), що наповнюється, призначеного для введення CO (наприклад, рідкої або газоподібної композиції CO) пацієнту під час ангіопластики показані з посиланням на Фіг.13А і 13D. На Фіг.13А показаний катетер 1303 в положенні всередині стенозованої ділянки 1302 кровоносної судини 1301. Наповнюваний балон 1304 показаний в стані, що спався. Наповнюваний елемент, включає, щонайменше один отвір 1305, через який CO можна ввести в судину під час процедури. CO можна ввести в елемент (наприклад, для наповнення наповнюваного елемента), що наповнюється з резервуара (не показаного), який містить CO, наприклад фармацевтичну композицію, що включає моноокис вуглецю. Пристрій можна необов'язково направляти в передбачувану ділянку гнучким провідником 1306. На Фіг.13В показаний катетер 1303 з наповнюваним елементом 1304 в наповненому стані. CO можна ввести через отвір(отвори) 1305 в судину 1301. В одному варіанті реалізації наповнюваний елемент наповнений CO або сумішшю газів, включаючи CO, так, що кількість CO, достатня для лікування гіперплазії інтими, вийде з отвору(отворів) і подається в кровоносну судину 1301 під час і/або після наповнення елемента, що наповнюється, 1304. Фіг.13С ілюструє інший варіант реалізації катетерного пристрою, в якому катетер 1303 включає, щонайменше, один просвіт 1307 для доставки 21 СО в кровоносну судину 1301 під час процедури ангіопластики. Ще один варіант реалізації показаний на Фіг.13D, де центральний просвіт 1307 доставляє СО до множини ділянок в кровоносній судині 1301. Резервуар, що містить СО (не показаний), може бути сполучений з просвітом 1307 так, що доза CO вводиться з резервуара через просвіт 1307 в кровоносну судину. Альтернативно або в доповнення наповнюваний елемент 1304 може бути покритий покриттям, що вивільняє CO, наприклад, гідрогелем, який містить композицію СО так, що СО подається до стенотичної ділянки 1302, наприклад, при контакті з наповнюваним елементом 1304. На Фіг.14А і 14В показаний приклад стенту, призначеного для введення СО пацієнту. Термін «стент» являє собою визнаний в даній галузі термін і відноситься до сітчастої трубки, звичайно виготовленої з дроту, що використовується для підтримки кровоносної судини у відкритому положенні, наприклад кровоносна судина, яка недавно була піддана реконструкції під час ангіопластики. На Фіг.14А стент 1402 показаний в стані, що спався. Стент покриває балонний катетер 1404, показаний на Фіг.14А в стані, що спався. На Фіг.14В стент 1402 і балонний катетер 1404 показані в розпрямленому/наповненому стані. Після наповнення балонного катетера 1404 стент 1402 розширяється, фіксується на місці і утворює каркас, як показано на Фіг.14В, втримуючи за допомогою цього кровоносну судину у відкритому положенні. В одному варіанті реалізації даного винаходу стент 1402 має покриття, що вивільняє СО, наприклад, гідрогель, який вивільняє СО, так що кількість СО, достатня для лікування гіперплазії інтими, подається в кровоносну судину протягом відповідної кількості часу, наприклад, протягом всього періоду часу, поки стент залишається на місці. На Фіг.15 показаний катетер 1502 з двома наповнюваними елементами 1504. Наповнювані елементи 1504 можна використати для ізоляції стенотичної ділянки 1506, так що СО можна ввести в стенотичну ділянку 1506 між наповнюваними елементами 1504. Катетер 1502 вводять в кровоносну судину 1508 перед заповненням наповнюваних елементів 1504. Наповнювані елементи 1504 потім наповнюють з використанням трубки наповнення/випорожнення 1520, вміщеної всередину катетера 1502. Наповнювані елементи 1504 в їх наповненому стані закупорюють потік крові до ділянки кровоносної судини, яка піддається лікуванню. Впускні протоки 1512 на проксимальному кінці катетера забезпечують можливість крові текти в катетер 1502 і через нього до випускних протоків 1514, розташованих на дистальному кінці катетера. Це забезпечує можливість крові продовжувати текти в іншу артерію 1508, в той час як локальна ділянка артерії 1506 піддається обробці. CO можна ввести в ізольовану ділянку за допомогою введення через трубку подачі 1516. Наповнені елементи, що наповнюються, 1504 забезпечують ізольовану ділянку обробки, в межах якої можна ввести в судину відповідні рівні CO. Крім того, волоконні датчики (не показані) можна фіксувати на 86344 22 корпусі катетера 1502, і ділянку можна піддати впливу електромагнітного випромінювання через волоконні датчики. CO можна вводити в ділянку перед, під час і/або після обробки ділянки електромагнітним випромінюванням. Нас Фіг.16 показаний приклад пристрою, здатного вводити CO пацієнту, в той же самий час, виконуючи атеректомію. Атеректомія включає відсікання і видалення бляшки 1602 від стінок кровоносної судини 1604. Катетер 1606 розташовують всередині артерії 1604. Гнучкий провідник 1608 використовують для просування пристрою через ділянку обробки 1610. Обертові різальні леза 1612 потім висуваються за межі катетера 1606. Обертові різальні леза 1612 йдуть за гнучким провідником 1608 і перетинають бляшку 1602. Обертові різальні леза 1612 тягнуть видалені частки бляшки в проксимальний кінець катетера 1606 і в його напрямі. CO можна ввести в ділянку, що обробляється, за допомогою трубки для введення 1614 всередині катетера 1606. Трубку для введення 1614 можна фіксувати з провідником 1608. CO можна ввести через катетер 1606 через один отвір 1616 на дистальному кінці трубки для введення 1614. Альтернативно або в доповнення до подачі CO через трубку для введення 1614, протоки 1620 і 1622 можна розташувати всередині стінок різальних лез 1612. Моноокис вуглецю можна подавати через випускний протік 1620. На закінчення лікування впускний протік 1622 може видалити CO. CO можна вводити перед, під час і/або після видалення бляшок. У доповнення до викладеного вище, досвідченому фахівцеві буде ясно, що будь-який пристрій, відомий в галузі, для виконання процедур ангіопластики, можна модифікувати для введення СО в судинну систему пацієнта під час використання. Приклади таких пристроїв можна знайти, наприклад, в [патентах США №№6409716, 5985307, 6508787, 5709875 і 6450989]. Крім того, досвідченому фахівцеві буде зрозуміло, що будь-які такі пристрої можуть бути покриті засобом, що доставляє СО, наприклад, олією, маззю або гідрогелем, здатним вивільняти ефективні дози СО, так що СО доставляється в кровоносну судину після контакту з пристроєм/покриттям. Застосування гемоксигенази-1 і інших сполук Даний винахід також передбачає індукцію або експресію гемокисгенази-1 (НО-1) в поєднанні з введенням моноокису вуглецю. НО-1 можна надати пацієнту індукцією або експресією НО-1 у пацієнта або введенням екзогенної НО-1 безпосередньо пацієнту. Термін «індукувати(індукована)», що використовується тут, означає викликати збільшену продукцію білка, такого як НО-1, в ізольованих клітинах або клітинах тканини, органу або тварини з використанням власного ендогенного (наприклад, не рекомбінантного) гена клітин, який кодує білок. НО-1 можна індукувати у пацієнта будь-яким способом, відомим в даній галузі. Наприклад, продукцію НО-1 можна викликати геміном, протопорфірином заліза або протопорфірином кобальту. Різноманітні не пов'язані з гемом агенти, включаючи важкі метали, цитокіни, гормони, окис азоту, 23 СОСl2, ендотоксин і тепловий шок також являють собою сильні індуктори експресії НО-1 [Otterbein et al., Am. J. Physiol. Lung Cell Моl. Physiol. 279: L1029-L1037, 2000; Choi Tenhunen et al., J. Lab. Clin. Med. 75: 410-421, 1970]. НО-1 також високо індукується різноманітними агентами і станами, які створюють окислювальний стрес, включаючи перекис водню, агенти, що зменшують запаси глутатіону, УФ опромінення і гіпероксію [Choi et al., Am. J. Respir, Cell Моl. Biol. 15: 9-19, 1996; Maines, Annu. Rev. Pharmacol. Toxicol. 37: 517-554, 1997; і Keyse et al., Proc. Natl. Acad. Sci. USA 86: 99-103, 1989]. «Фармацевтична композиція, що включає індуктор НО-1» означає фармацевтичну композицію, яка містить будь-який агент, здатний індукувати НО-1 у пацієнта, наприклад, будь-який з агентів, описаних вище, наприклад, гемін, протопорфірин заліза і/або протопорфірин кобальту. Експресію НО-1 в клітині можна збільшити за допомогою перенесення гена. Термін «експресувати (експресований)», що використовується тут, означає викликати збільшену продукцію білка, наприклад, НО-1 або феритину, в ізольованих клітинах або клітинах тканини, органу або тварини з використанням екзогенно введеного гена (наприклад, рекомбінантного гена). НО-1 або феритин переважно отримані від того ж виду (наприклад, людини, миші, щура і т.д.), що і реципієнт, для мінімізації будь-якої імунної реакції. Експресію можна запустити конститутивним промотором (наприклад, цитомегаловірусним промотором) або промотором, специфічним для тканини (наприклад, промотор молочної сироватки для клітин молочної залози або альбуміновий промотор для печінкових клітин). Відповідний вектор генної терапії (наприклад, ретровірус, аденовірус, аденоасоційований вірус (AAV), поксвірус (наприклад, вірус коров'ячої віспи), вірус імунодефіциту людини (ВІЛ), «мінут-вірус» мишей, вірус гепатиту В, вірус грипу, вірус простого герпесу-1 і лентивірус), що кодує НО-1 або феритин, потрібно вводити пацієнту перорально, інгаляцією або ін'єкцією в ділянку, відповідну для лікування гіперплазії інтими. Аналогічним чином, можна ввести вектори, що кодують НО-1 або апо-феритин, наприклад, такі як депротеїнізована ДНК, в ліпосомах або в мікрочастках. Далі, екзогенний білок НО-1 можна безпосередньо водити пацієнту будь-яким способом, відомим в даній галузі. Екзогенну НО-1 можна безпосередньо водити в доповнення або як альтернативу індукції або експресії НО-1 у пацієнта, як описано вище. Білок НО-1 можна доставити пацієнту, наприклад, в ліпосомах і/або у вигляді злитого білка, наприклад у вигляді ТАТ-злитого білка [див., наприклад, Hapak et al., Methods 24: 247-256, 2001]. Альтернативно або в доповнення, будь-який з продуктів метаболізму НО-1, наприклад, білірубін, білівердин, залізо і/або феритин, можна ввести пацієнту в поєднанні з моноокисом вуглецю або замість нього, для запобігання або лікування гіперплазії інтими. Далі, даний винахід передбачає те, що пацієнту можна ввести зв'язуючі залізо молекули, відмінні від феритину, наприклад, десфе 86344 24 роксамін (DFO), декстран заліза і/або апоферитин. Крім того, даний винахід передбачає, що для створення/посилення бажаного ефекту можна інгібувати ферменти (наприклад, білівердинредуктазу), які каталізують розпад будь-якого з вказаних продуктів. Даний винахід передбачає, що сполуки, які вивільняють СО в організмі після введення сполуки (наприклад, сполук, що вивільняють CO), наприклад, декакарбонілу димарганцю, димеру трикрабонілдихлоррутенію(ll) і метиленхлориду (наприклад, в дозі від 400 до 600мг/кг, наприклад, близько 500 мг/кг) також можна використати в способах даного винаходу, як і карбоксигемоглобін і СО-вмісні замісники гемоглобіну. Будь-яку з вказаних вище сполук можна вводити пацієнту будь-яким шляхом, наприклад, пероральним, внутрішньовенним або внутрішньоартеріальним введенням. Будь-яку з вказаних вище сполук можна вводити пацієнту місцево і/або системно і в будь-якій комбінації. Винахід частково ілюструється наступними прикладами, які не треба сприймати як такі, що обмежують винахід яким-небудь чином. Приклад 1. CO придушує артеріосклероз, розвиток гіперплазії інтими і проліферацію SMC Тварини. Самців (250-350г) коричневих норвезьких щурів (RTIn) використали як донорів аортальних трансплантатів, а самців (250-350г) щурів Lewis (RTI1) як реципієнтів. Щурів Dawley (400450г) використали в моделі балонного пошкодження. Дорослих самців мишей C57BL/6, C57/S129, р21-l- і р53-l- нуль придбавали в Jackson Laboratory (Bar Harbor, ME), мишей mkk3(-l-) нуль генерували, як описано Lu et al. [EMBO. 18: 18451857, 1999]. Мишей inos-/- і enos-/- розводили в Пітeбурзькому університеті. Модель аортальної трансплантації. Трансплантацію аорти виконували, як описано в Shimizu et al. [Nat Med. 7: 738-741, 2001]. Коротко, від 3 до 4см низхідної аорти брали у донора і трансплантували між нирковими артеріями і біфуркацією аорти реципієнта. Обидва краї нативної черевинної аорти перев'язували. Модель балонного пошкодження. Балонну ангііюпластику проводили, як описано в Murakami et al. [Atherosclerosis 157: 361-368, 2001]. Коротко, катетер для емболектомії 2 калібру (Baxter, Chicago, IL) вводили в загальну сонну артерію, і пошкодження створювали роздуванням балона тиском до 5 атмосфер протягом 5хв. Артерії промивали, і зовнішню сонну артерію перев'язували, забезпечуючи повернення кровотоку через загальну і внутрішню сонну артерії. Пошкодження судинної стінки і подальший патоморфологічний аналіз проводили сліпим методом відносно групи лікування. Контакт з CO. CO доставляли тваринам, як описано в Otterbein et al. [Nat Med. 6: 422-428, 2000]. Донорів і реципієнтів піддавали впливу CO (250м.ч.) протягом 2 днів перед трансплантацією і протягом 56 днів безпосередньо після трансплантації. У моделі балонного пошкодження щури отримували або попереднє лікування, або зазнавали впливу CO (250м.ч.) протягом 1год. перед 25 пошкодженням. Після операції щурів витримували в кімнатному повітрі протягом 2 тижнів. Клітини. Первинні гладком'язові клітини (SMC) мишей і щурів виділяли і культивували, як описано в Laubach et al. [Proc. Natl. Acad. Sci. USA 92: 10688-9, 1995]. Мишачі SMC, виділені у мишей НО-1-/-, отримували, як описано в Duckers et al. [Nat Med. 7: 693-698, 2001]. Обробка клітин і реагенти. Інгібітор гуанілатциклази 1Н(1,2,4)оксадіазол(4,3-а)хіноксалін-1 (ODQ; Calbiochem-Novabiochem, San Diego, CA; 10100мкМ) і інгібітор р38 МАРК піридинілімідазол SB203580 (Calbiochem; 5-20мкМ) розчиняли в ДМСО. Аналог цГМФ натрієва сіль 8-бром цГМФ (8-Вr-цГМФ; Sigma-Aldrich, St.Louis, МО; 10100мкМ) і інгібітор ФКГ (10-100мкМ; Alexis Buichamicaks) розчиняли у воді. Кількість клітин і включення [3Н]тимідину. SMC мишей і щурів виділяли і культивували, як описано в Peyton et al. [Blood 99: 4443-4448, 2002]. Аналізи проліферації проводили, як описано в Petkova et al. [J. Biol. Chem. 276: 7932-7936, 2001]. Для досліджень включення [3Н]тимідину клітини позбавляли сироватки протягом ночі, а потім стимулювали 10% сироваткою, що містить 5мкКі/мл [3Н]тимідину (New England Nuclear, Boston, MA). Включення [3Н]тимідину вимірювали сцинтиляційною спектроскопією і представляли у вигляді середнього значення імпульсів/хв./лунку. Гістоморфометричний аналіз. Аортальні трансплантати і сонні артерії брали відповідно на 56 і 14 дні. Судини фіксували, заливали, і робили серійні зрізи (5мкм) in toto. Кожне третє покривне скло забарвлювали гематоксиліном і еозином (Н&Е) для гістоморфлогічних аналізів. В обох моделях вибирали одне або два зображення на покривне скло при розрізненні 1520´1080 пікселів при збільшенні в 25 разів мікроскопом Zeiss (Axioskop, Iowa City, Iowa), робили кольорові фотографії апаратом RT SPOT (Diagnostic Instruments, Inc., Saint Joseph, MI) і обробляли на комп'ютері Compaq (Windows NT) з використанням програмного забезпечення Adobe Photoshop версії 5.5. Ділянки від 8 до 10 вибраних зображень підраховували з використанням програмного забезпечення цифрової візуалізації у вигляді числа пікселів, відповідного вказаним ділянкам. Від 24 до 48 зрізів з кожної групи статистично аналізували програмним забезпеченням SPSS версії 10. Імунозабарвлення і гістоморфометричний аналіз клітинної проліферації. Трансплантати брали через 56 днів після трансплантації. Популяції щурячих лейкоцитів виявляли з використанням антитіла проти спільного антигена щурячих лейкоцитів (LCA, CD45; ОХ-1) (Serotec, Harlan Bioproducts, Indianapolis, IN); CDS (G4.18), CD4 (OX-35), CDS (OX-8), макрофага (CD68, ED-1), ICAM-1 (CD54; 1A29) і головного комплексу тканинної сумісності класу II (ОХ-6), які всі були отримані від компанії Becton Dickinson Biosciences (San Diego, CA). Антитіло проти РАІ-1mAb було отримане від компанії America Diagnostica (Greenwich, CT). Вибирали від 8 до 10 зображень кожної трансплантованої аорти і аналізували, як детально описано вище. 86344 26 Клітинні екстракти і аналіз вестерн-блотингом. Клітинні білкові екстракти піддавали електрофорезу (10-12,5% поліакриламідні гелі) і переносили на нітроцелюлозу (BioRad, Hercules, CA). Спільні і фосфорильовані форми ERK, JNK і р38 МАРК, а також ATF-2 виявляли з використанням кролячих поліклональних антитіл (Cell Signalling Technologies, Beverly, MA). Антитіло проти αактину (Sigma; St.Louis, МО) р21 Сірі виявляли з використанням кролячого поліклонального антитіла (Santa Cruz Biotech, Santas Cruz, CA). Первинні антитіла виявляли, як описано в додаткових методах. Статистичний аналіз. Значущість відмінностей визначали з використанням дисперсійного аналізу (ANOVA). Контакт з окислом азоту (NO). Щурів піддавали впливу 250м.ч. або 500м.ч. NO протягом 1год. Газоподібний NO (1% в N2) змішували з повітрям в тому ж пристрої, що забезпечує вплив, який використали в експериментах з CO. Концентрації в камері контролювали аналізатором NO (InterScan). Після впливу балонну ангіопластику проводили, як описано вище. Контрольні тварини зазнавали впливу повітря. Хірург, що проводив балонне пошкодження, маніпулював на щурах сліпим методом. Аналізи сонних артерій проводили через 2 тижні після процедури, як описано вище. Пошкодження артерій мишей. Розтин був аналогічним описаному Lindner et al. [Circ Res. 73: 792-796, 1993] і виконувався з використанням гнучкого провідника товщиною 0,018 дюйма (0,045мм) (Cook, Bloomington, IN), введеною через артеріотомію зовнішньої сонної артерії в загальну сонну артерію, обертали на 360 градусів 3 рази і видаляли усього три послідовних рази. Імуноаналіз цГМФ. Рівні цГМФ в клітинах кількісно визначали з використанням імуноферментного аналізу (ЕІА) (Biomol, Plymouth Meeting, PA). SMC інкубували в присутності або за відсутності CO (250м.ч.) і клітинні лізати аналізували на вміст цГМФ, як запропоновано продавцем. Кількість клітин. Клітини висівали в концентрації 5´103клітин/лунку і культивували протягом ночі в середовищі DMEM з високим вмістом глюкози, що включає 10% фетальної телячої сироватки (FCS), пеніцилін і гентаміцин (Life Technologies). Клітини позбавляли сироватки протягом додаткових 48год. (0% сироватки) і, при наявності показань, піддавали впливу СО (250м.ч. для щурячих і мишачих SMC) перед індукцією клітинної проліферації (10% FCS, Life Technologies). Клітини підраховували щодня з використанням гемоцитометра Neubauer. Життєздатність оцінювали за допомогою трипанового синього. Рекомбінантний аденовірус. Рекомбінантний β-галактозидазний аденовірус отримували в медичному центрі University of Texas Southwest Medical Center, Dallas, TX. Рекомбінантний аденовірус НО1, що експресує цДНК щурячого НО-1, був описаний в публікації Brouard et al. [J. Exp. Med. 192: 1015-1026, 2000]. Щурячі SMC інфікували із множинністю зараження (МОЇ) 400 бляшкоутворювальних одиниць на клітину (PFU/клітина), як описано у [Brouard et al.] (там же). 27 Проточна цитометрія. SMC щурячої аорти збирали переварюванням трипсином (0,025% трипсину/0,01% ЕДТА) (Life Technology), промивали фосфатним буферованим сольовим розчином (PBS, рН7,2) з 0,5% бичачого сироваткового альбуміну (BSA; Sigma-Aldrich Co) і інкубували з йодидом пропідію (1мкг/мл, 1год., кімнатна температура). Мітку флюоресцеїном оцінювали з використанням пристрою FACsort, обладнаного програмним забезпеченням Cell Quest (Becton Dickinson, Palo Alto, CA). Експерименти проводили в трьох повтореннях. Гістоморфометричні аналізи. На моделі трансплантації трансплантати брали через 56 днів після трансплантації. Аорти фіксували в 10% формаліні, заливали в парафін і робили серійні зрізи (5мкм) in toto. 10 зразків з кожних трьох зрізів вміщували на покривне скло при загальній кількості приблизно від 24 до 30 покривних стекол. Кожне третє покривне скло забарвлювали гематоксиліном і еозином (Н&Е) для гістоморфометричного аналізу. На моделі балонного пошкодження тварин піддавали евтаназії через 14 днів після пошкодження, і артерії брали для морфометричного аналізу. Сонні артерії щурів перфузували і фіксували in situ PBS і формальдегідом (2%). Судини фіксували протягом 2год. в 2% формальдегіді при 4°С і піддавали кріопротекції в 30% сахарозі протягом ночі при 4°С. Судини швидко заморожували в 2-метилбутані і робили кріозрізи товщиною 7 мкм. Виявлення первинних антитіл для імуноблотинга. Первинні антитіла виявляли з використанням вторинних антитіл проти кролячого IgG, кон'югованих з пероксидазою хрону (Pierce, Rockford, IL, USA). Пероксидазу візуалізували з використанням аналізу посиленої хемолюмінесценції (Amersham Life Science Inc., Arlington Heights, IL, USA) відповідно до інструкцій виробника і зберігали у вигляді фоторентгенограм (Biomax TMMS, Eastman Kodak, Rochester, NY). При наявності показань, мембрани видаляли (62,5мМ Tris×HCl pH6,8, 2% додецилсульфат натрію (SDS) і 100мМ р-меркаптоетанолу, 30хв., 50°С). Фосфорильовані р38 нормалізували до загальної кількості р38, виявленої в тій же мембрані. Інші реагенти. Мишачі iNOS і eNOS виявляли з використанням кролячих антитіл проти мишачих поліклональних антитіл проти iNOS і eNOS (Becton Dickinson Biosciences, San Diego, CA). CO придушує розвиток пов'язаного з трансплантатом артеріосклерозу. Фіг.1А-1I ілюструють, що обробка CO придушує гіперплазію інтими, звичайно пов'язану з хронічним відторгненням трансплантату. Фіг.1A-1F являють собою мікрофотографії зразків різних аортальних трансплантатів через 56 днів після трансплантації. Для отримання вказаних даних аорти коричневих норвезьких щурів трансплантували коричневим норвезьким щурам (Фіг.1А і 1D), щурам Lewis, що контактували з повітрям (Фіг.1В і 1E), і щурам Lewis, що контактували з CO (250м.д; Фіг.1С і 1F). Зразки брали через 56 днів після трансплантації і забарвлювали модифікованим трихромом, специфічним для еластичної тканини 86344 28 (еластична; Фіг.1А-1С) або гематоксиліном і еозином (Н&Е; Фіг.1D-1Е). Фарбування еластичної тканини збільшені в 50 разів (Фіг.1А-1С), а фарбування Н&Е збільшені в 200 разів (Фіг.1D-1E). Показані зразки є репрезентативними від 3-6 тварин, проаналізованих на групу. Фіг.1С-1I являють собою гістограми, що показують середні (± стандартне відхилення) відносні площі, відповідні ділянкам інтими і медії, розрахованим за зразками, взятими з аорт коричневих норвезьких щурів, трансплантованих коричневим норвезьким щурам (Syng.; n=6), щурам Lewis, що контактували з повітрям (Аllо.; n=6) або CO (250м.ч.) (Allo.+CO; n=3). *Р
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;method of treating vascular disease
Автори англійськоюOtterbein Leo E., Choi Augustine M.K., Bach Fritz H., Zuckerbraun Brian
Назва патенту російськоюСпособ лечения сосудистых заболеваний
Автори російськоюОттербайн Лео Е., Чои Огастин М.К., Бах Фритц Х., Цуккербраун Брайан
МПК / Мітки
МПК: A61K 33/00, A61M 16/00, A61P 41/00
Мітки: спосіб, судинних, захворювань, лікування
Код посилання
<a href="https://ua.patents.su/27-86344-sposib-likuvannya-sudinnikh-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування судинних захворювань</a>
Попередній патент: Різенарізний патрон
Наступний патент: Застосування остеопротегерину для лікування та/або запобігання фіброзу
Випадковий патент: Пристрій для затримання спливаючих речовин