Fc-фрагмент імуноглобуліну igg4, який має модифіковану шарнірну ділянку
Номер патенту: 115906
Опубліковано: 10.01.2018
Автори: Чун Сун Юб, Лі Чон-Су, Хух Йон Хо, Парк Сон Хі, Чхой Ін Йон
Формула / Реферат
1. Модифікований фрагмент Fc-ділянки імуноглобуліну IgG4, що містить модифіковану шарнірну ділянку, в якому частину цієї шарнірної ділянки, представленої наступною амінокислотною послідовністю, видалено делецією з утворенням лише одного цистеїнового залишку:
Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys-Pro-Ser-Cys-Pro.
2. Модифікований фрагмент Fc-ділянки імуноглобуліну IgG4 за п. 1, в якому не відбувається реакція обміну ланцюгів та утворення мономерів in vivo.
3. Модифікований фрагмент Fc-ділянки імуноглобуліну IgG4 за п. 1, в якому шарнірну ділянку змінено мутацією, яка полягає у делеції 1-8 безперервно або переривчасто розташованих амінокислот з цистеїновим залишком у 8 положенні.
4. Модифікований фрагмент Fc-ділянки імуноглобуліну IgG4 за п. 1, в якому шарнірну ділянку змінено мутацією, яка полягає у делеції 1-8 безперервно або переривчасто розташованих амінокислот з цистеїновим залишком у 11 положенні.
5. Модифікований фрагмент Fc-ділянки імуноглобуліну IgG4 за п. 1, в якому шарнірну ділянку змінено мутацією, яка полягає у делеції 1-5 безперервно або переривчасто розташованих амінокислот з цистеїновим залишком у 8 положенні.
6. Модифікований фрагмент Fc-ділянки імуноглобуліну IgG4 за п. 1, в якому шарнірну ділянку змінено мутацією, яка полягає у делеції 1-5 безперервно або переривчасто розташованих амінокислот з цистеїновим залишком у 11 положенні.
7. Модифікований фрагмент Fc-ділянки імуноглобуліну IgG4 за п. 1, в якому шарнірну ділянку змінено мутацією, яка полягає у делеції 1-3 безперервно або переривчасто розташованихамінокислот з цистеїновим залишком у 8 положенні.
8. Модифікований фрагмент Fc-ділянки імуноглобуліну IgG4 за п. 1, в якому шарнірну ділянку змінено мутацією, яка полягає у делеції 1-3 безперервно або переривчасто розташованих амінокислот з цистеїновим залишком у 11 положенні.
9. Модифікований фрагмент Fc-ділянки імуноглобуліну IgG4 за п. 1, який є аглікозилованим.
10. Модифікований фрагмент Fc-ділянки імуноглобуліну IgG4 за п. 1, який модифіковано непептидильним полімером.
11. Нуклеїнова кислота, яка кодує фрагмент Fc-ділянки IgG4 за п. 1.
12. Вектор, який містить нуклеїнову кислоту за п. 11.
13. Мікроорганізм, який вводять з вектором за п. 12.
14. Спосіб отримання фрагмента Fc-ділянки імуноглобуліну IgG4 за будь-яким з пп. 1-10, який полягає у культивуванні мікроорганізму за п. 13.
15. Кон'югат з лікарським засобом, в якому фрагмент Fc-ділянки IgG4 за будь-яким з пп. 1-10 кон'юговано до нього за допомогою лінкеру.
16. Кон'югат з лікарським засобом за п. 15, в якому лікарський засіб вибрано з групи, яка складається з гормону росту людини, гормону, який вивільнює гормон росту людини, пептиду, який вивільнює гормон росту людини, інтерферонів та рецепторів інтерферону, колонієстимулюючих факторів, інтерлейкінів та рецепторів інтерлейкінів, інтерлейкін- та цитокінзв'язуючих білків, фактора активації макрофагів, макрофагального пептиду, В-клітинних та Т-клітинних факторів, протеїну А, факторів пригнічення алергії, некротичного глікопротеїну, імунотоксину, лімфотоксину, фактора некрозу пухлини, пухлинного супресору, трансформуючого фактора росту, a-1 антитрипсину, альбуміну, a-лактальбуміну, аполіпопротеїну-Е, еритропоетину, високоглікозилованого еритропоетину, ангіопоетину, гемоглобіну, тромбіну, пептид-агоністу рецептора тромбіну, тромбомодуліну, фактора згортання крові VII, фактора згортання крові VIIa, фактора згортання крові VIII, фактора згортання крові IX, фактора згортання крові XIII, активатора плазміногену, фібринзв'язуючого пептиду, урокінази, стрептокінази, гірудину, С-білка, С-реактивного білка, пригнічувачу реніну, пригнічувача колагенази, супероксиддисмутазу, лептину, фактора росту тромбоцитів, фактора росту епітелію судин, епідермального фактора росту, ангіостатину, ангіотензину, кісткового морфогенетичного фактора росту, кісткового морфогенетичного білка, кальцитоніну, інсуліну та його похідної, атріопептину, хрящового індукуючого фактора імпульсної відповіді, елкатоніну, фактора активування сполучної тканини, пригнічувача тканинного фактора, фолікулостимулюючого гормону, лютеїнізуючого гормону, люліберину, факторів росту нервової тканини (включаючи нейроростовий фактор, циліарний нейротрофічний фактор, фактор аксогенезу-1, натрійуретичний пептид головного мозку, нейротрофічний фактор гліальної клітинної лінії, пригнічувач міграції нейтрофілів, нейротрофічний фактор та нейтрин), паратиреоїдного гормону, релаксину, секретину, соматомедину, інсуліноподібного фактора росту, гормону кори надниркових залоз, глюкагону, інсулінотропних пептидів, включаючи глюкагоноподібний пептид-1 та ексендин-4, інкретини, які виділяються в кишечнику, адипоцитів, включаючи лептони та ефективні для метаболічного синдрому нейроцитокіни, холецистокініну, панкреатичних поліпептидів, пептидів, які вивільнюють гастрин, фактора вивільнення кортикотропіну, тиреотропного гормону, автотаксину, лактоферину, міостатину, рецептора, рецепторного антагоністу, антигену клітинної поверхні, моноклональних антитіл, поліклональних антитіл, фрагментів антитіл та вакцинного антигену вірусного походження.
17. Кон'югат з лікарським засобом за п. 15, в якому лікарський засіб є колонієстимулюючим фактором гранулоцитів.
18. Кон'югат з лікарським засобом за п. 15, в якому лінкер є непептидильним полімером.
19. Кон'югат з лікарським засобом за п. 18, в якому непептидильний полімер має 2 або 3 хімічно активні кінці.
20. Фармацевтична композиція, яка містить кон'югат за п. 15.
21. Носій лікарського засобу, який містить модифікований фрагмент Fc-ділянки IgG4, що містить модифіковану шарнірну ділянку, в якому частину такої шарнірної ділянки, представленої наступною амінокислотною послідовністю, видалено делецією з утворенням лише одного цистеїнового залишку:
Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys-Pro-Ser-Cys-Pro, та
в якому не відбувається реакція обміну ланцюгів та утворення мономерів in vivo.
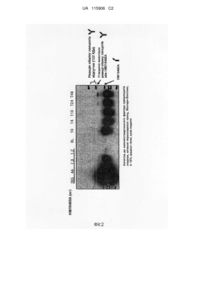
Текст
Реферат: Винахід стосується модифікованого фрагмента Fc-ділянки імуноглобуліну IgG4, нуклеїнової кислоти, вектора, мікроорганізму, способу одержання модифікованого фрагмента Fc-ділянки імуноглобуліну IgG4, кон’югата, фармацевтичної композиції та носія лікарського засобу, що містить модифікований фрагмент Fc-ділянки імуноглобуліну IgG4. UA 115906 C2 (12) UA 115906 C2 UA 115906 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід стосується Fc - фрагменту імуноглобуліну IgG4, корисного, як носій для доставки ліків та, більш докладно, він стосується Fc - фрагменту імуноглобуліну IgG4, який може звести до мінімуму викликані ним ефекторні функції, але не викликає реакції обміну ланцюгами IgG in vivo та може покращити час напівжиття кон'югованого лікарського засобу in vivo. Розвиток генної інженерії призвів до виробництва та застосування різних видів білкових препаратів. Тим не менш, білкові препарати мають серйозні проблеми через те, що вони легко піддаються денатурації або легко розкладаються протеазами in vivo та таким чином не можуть підтримувати свої концентрації або титри in vivo протягом тривалого періоду часу. Таким чином, дуже важливою стає підтримка концентрацій білкових препаратів в крові та in vivo на відповідному рівні збільшенням стійкості білка для забезпечення ефективного лікування пацієнтів разом із одночасним зменшенням труднощів, пов'язаних з частим отриманням ними цих білкових препаратів ін'єкціями, тощо, та пов'язаних з цим витрат. Відповідно, протягом тривалого часу було здійснено ряд різних спроб покращення стійкості білкових препаратів in vivo, які полягали у зміненні їх типового хімічного складу, у злитті їх з іншими білками або у прикріпленні до поверхонь цих білків відповідних полімерів із застосуванням хімічних або біологічних способів. Одним з підходів покращення стійкості білка його злиттям з іншими білками є отримання злиття між цим білком та Fc – ділянкою імуноглобуліну. Fc – ділянка відповідає за ефекторні функції, як-то за залежну від комплементу цитотоксичність (CDC) та залежну від антитіл клітинну цитотоксичність (ADCC), яка, на додачу до антиген - зв'язувальної здатності, є головною функцією імуноглобулінів. Крім того, присутня у Fc – ділянці послідовність FcRn відіграє роль у регулюванні сироваткового рівня імуноглобуліну IgG збільшенням їх часу напівжиття in vivo внаслідок їх кон'югації in vivo з рецептором FcRn. У зв'язку з цим були проведені активні дослідження з метою покращення властивостей лікарських білків їх злиттям з Fc - ділянкою. Однак, отримані генетичною рекомбінацією Fc-злиті білки мають певні недоліки через те, що білкове злиття є можливим лише у певному місці Fc - ділянки, тобто на її N- та C-кінцях та воно може відбуватися лише між глікозилованими або aглікозилованими білками та не відбувається між глікозилованим та aглікозилованим білками. Крім того, отримані генетичною рекомбінацією Fc-злиті білки мають проблеми, які полягають в тому, що отримана злиттям амінокислотна послідовність може викликати імунну відповідь, а також у можливому збільшенні чутливості протеїнази до лінкерної ділянки. Крім того, злиті білки з Fc – ділянкою мають збільшений сироватковий час напівжиття цільового білка, але інколи вони також мають проблему, яка полягає у виникненні ефекторних функцій, викликаних Fc - ділянкою (U.S. Pat. No. 5349053). Завдяки ефекторним функціям Fc – ділянки ці злиті білки можуть затримувати комплементи або зв'язуватися з клітинами, в яких відбувається експресія Fc-ділянок з руйнуванням окремих клітин та викликати утворення та секрецію різних цитокінів, які викликають запалення, тим самим викликаючи це запалення. Крім того, білкові послідовності у злитих ділянках являють собою нові білкові послідовності, які не існують в організмі людини, отже вони мають різні недоліки, в тому числі можливий виклик імунних відповідей у разі довготривалого застосування. Відповідним чином, дослідження було зосереджено на застосуванні імуноглобулінів або фрагментів імуноглобулінів з видаленими ефекторними функціями з одночасним збереженням показників часу напівжиття у сироватці. Спочатку Cole et al. повідомили про пригнічення ADCC – активності внаслідок заміщення аланіном залишків у 234, 235 та 237 положеннях домену CH2, який, як відомо, відіграє важливу роль у зв'язуванні з Fc-рецепторами. Метою такого заміщення було отримання Fc – похідних зі зменшеною спорідненістю до Fc-рецепторів (Cole et al., J. Immunol. 159: 3613-3621, 1997). Однак всі ці ділянки мали неприйнятні амінокислоти, які відрізнялися від подібних амінокислот у складі природної Fc – ділянки людини, отже вони могли мати підвищену імунність та антигенність з можливою втратою бажаних функцій Fc – ділянки. Як спосіб усунення або зменшення небажаних ефекторних функцій з одночасним збереженням високих концентрацій імуноглобулінів в крові було досліджено спосіб усунення сахаридів з імуноглобулінів. У U.S. Pat. No. 5585097, aглікозиловані похідні антитіл було отримано заміщенням аспарагінового залишку у 297 положенні домену CH2, який був глікозилованим залишком антитіл CD3 іншою амінокислотою під час отримання антитіл CD3, та, зокрема, отримані похідні виявили зменшені ефекторні функції з одночасним збереженням сили зв'язування до рецептора FcRn без змінення власних показників сироваткового часу напівжиття. Однак, цей спосіб також мав проблему, яка полягала в тому, що отримані похідні могли бути впізнані, як чужорідні матеріали та відторгнуті імунною системою у зв'язку з отриманням нової рекомбінантної конструкції. 1 UA 115906 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для отримання злитих білків із застосуванням послідовностей нативних Fc-ділянок імуноглобулінів типу IgG з метою мінімізувати їх ефекторні функції можуть бути вибрані Fcділянки IgG4. Як відомо, імуноглобуліни IgG4 мають час напівжиття in vivo, який є подібним до часу напівжиття імуноглобулінів IgG1, але завдяки різниці у амінокислотній послідовності, їм притаманні відносно низькі ефекторні функції. Однак, незважаючи на переваги імуноглобулінів IgG4, які мають зменшені ефекторні функції, через наявність характерної шарнірної послідовності між ними може виникати обмін ланцюгів in vivo, отже було повідомлено, що це спричинює багато труднощів у разі застосування цих злитих білків з лікувальною метою (van der Neut Kolfschoten, et al., Science, 317:1554-1557, 2007). Тобто, існує проблема в тому, що у разі застосування Fc-ділянки IgG4, як носія для злиття білка, між ними трапляється обмін ланцюгів з присутніми in vivo імуноглобулінами IgG4, в результаті чого виникає гібрид з нативними IgG4 або він може існувати у вигляді мономерів, тим самим змінюючи початкову структуру з отриманням структури з низькою лікувальною активністю. Це є звичайною проблемою без різниці, чи буде отримано продукт злиття між Fc - фрагментом імуноглобуліну IgG4 та фізіологічно активним матеріалом in vitro або генно-інженерним способом. В таких умовах, в результаті досліджень по розробці фрагмента Fc-ділянки IgG4, здатного діяти, як носій лікарського засобу з низьким ризиком появи ефекторних функцій та викликання реакції обміну Fab - ділянками з імуноглобулінами IgG in vivo, здатного подолати недоліки способу злиття на основі генетичної рекомбінації, винахідники відкрили, що можна створити кон'югaт ліків з покращеним строком життя, але без ризику викликання ефекторних функцій та реакції обміну Fab - ділянками з імуноглобулінами IgG in vivo у разі отримання в E. coli та кон'югації з лікарським засобом зміненої мутацією шарнірної послідовності фрагменту Fcділянки IgG4, в результаті якої залишається лише один цистеїновий залишок. Це отримання є завершенням заявленого винаходу. Метою цього винаходу є отримання фрагменту Fc-ділянки IgG4 з низьким ризиком виникнення ефекторних функцій або реакції обміну ланцюгів з IgG in vivo та який може діяти, як носій лікарського засобу. Більш докладно, метою цього винаходу є отримання модифікованого фрагменту Fc-ділянки IgG4, включаючи модифіковану шарнірну ділянку, в якій видалена частина шарнірної послідовності містить лише один цистеїновий залишок. Іншою метою винаходу є отримання нуклеїнової кислоти, яка кодує модифікований фрагмент Fc-ділянки IgG4, включаючи модифіковану шарнірну ділянку, в якій видалена частина шарнірної послідовності містить лише один цистеїновий залишок. Іншою метою винаходу є отримання вектора, який містить нуклеїнову кислоту, що кодує модифікований фрагмент Fc-ділянки IgG4, включаючи модифіковану шарнірну ділянку, в якій видалена частина шарнірної послідовності містить лише один цистеїновий залишок. Іншою метою винаходу є отримання мікроорганізму, якого вводять з вектором, який містить нуклеїнову кислоту, що кодує модифікований фрагмент Fc-ділянки IgG4, включаючи модифіковану шарнірну ділянку, в якій видалена частина шарнірної послідовності містить лише один цистеїновий залишок. Іншою метою винаходу є надання способу отримання модифікованого фрагменту Fc-ділянки IgG4, який полягає у культивуванні мікроорганізму, якого вводять з вектором, який містить нуклеїнову кислоту, що кодує модифікований фрагмент Fc-ділянки IgG4. Іншою метою винаходу є отримання кон'югaту з лікарським засобом, в якому лікарський засіб та модифікований фрагмент Fc-ділянки IgG4 кон'юговано з допомогою лінкера. Іншою метою винаходу є отримання фармацевтичної композиції, яка містить кон'югaт з лікарським засобом, в якому цей лікарський засіб та модифікований фрагмент Fc-ділянки IgG4 кон'юговано з допомогою лінкера. Винаходом також може бути передбачено модифікований фрагмент Fc-ділянки IgG4, який має мінімізовану ефекторну функцію без заміщення або додавання амінокислот або додавання глюкану та який не вступає в реакцію обміну ланцюгів з імуноглобуліном IgG4 in vivo. Модифікований фрагмент Fc-ділянки IgG4 за винаходом, незалежно від способу кон'югaції його з лікарським засобом, будь-то генно-інженерний спосіб чи спосіб ковалентного зв'язку in vitro, може пригнічувати in vivo реакцію обміну ланцюгів кон'югованого лікарського засобу у разі, коли цей фрагмент кон'юговано з лікарським засобом та, отже, може надати йому значної терапевтичної переваги у порівнянні з нативним фрагментом Fc-ділянки IgG4. Стислий опис фігур. На Фіг.1 зображено присутність / відсутність реакції обміну ланцюгів людського імуноглобуліну IgG4, яка виникає між біотінільованим людським імуноглобуліном IgG4 (hIgG4) та кон'югaтом типу "гранулоцитарний колонієстимулюючий фактор людини -ПЕГ- фрагмент Fcділянки IgG4" у крові щурів. 2 UA 115906 C2 5 10 15 20 25 30 35 40 45 50 55 60 На Фіг.2 зображено присутність / відсутність реакції обміну ланцюгів людського імуноглобуліну IgG4, яка виникає між біотінільованим людським імуноглобуліном IgG4 (hIgG4) та кон'югaтом типу "гранулоцитарний колонієстимулюючий фактор людини -ПЕГ- фрагмент Fcділянки IgG4" у крові людини. Більш детальніше бажані втілення винаходу буде описано нижче з посиланням на супроводжуючі креслення. Проте цей винахід може бути втілено в різних формах та він не повинен тлумачитися, як обмежений наведеними тут втіленнями. Скоріше, ці втілення тут надано таким чином, щоб розкриття суті цього винаходу було повним та завершеним та повністю передавало її фахівцям у цій галузі. В одному аспекті для досягнення вищезазначених цілей, винаходом передбачено модифікований фрагмент Fc-ділянки IgG4, корисний як носій лікарського засобу. Більш докладно, винаходом передбачено модифікований фрагмент Fc-ділянки IgG4, який містить модифіковану шарнірну ділянку, в якій видалено частину шарнірної послідовності, включаючи лише один цистеїновий залишок. Модифікований фрагмент Fc-ділянки IgG4 винаходу містить модифіковану шарнірну ділянку, в якій видалено її частину, що являє собою наступну амінокислотну послідовність, включаючи лише один цистеїновий залишок: Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys-Pro-Ser-Cys-Pro (SEQ ID NO: 1). Прагнучи вирішити проблему з фрагментом Fc-ділянки IgG4, корисність якого була низькою через реакцію обміну ланцюгів з IgG4 in vivo, незважаючи на його ефективність в якості носія, призначеного для збільшення показників часу напівжиття лікарських засобів in vivo, винахідники відкрили, що через реакція обміну ланцюгів in vivo та утворення мономеру не відбувається у разі модифікації фрагменту Fc-ділянки IgG4, яка полягає у вилученні делецією одного з двох цистеїнових залишків, присутніх у шарнірній ділянці фрагменту Fc-ділянки IgG4, а також частини цієї шарнірної ділянки, тим самим підтверджуючи, що цей модифікований фрагмент Fc-ділянки IgG4 може бути ефективно застосовано, як носій лікарського засобу. У одному втіленні, фрагмент Fc-ділянки IgG4 винаходу може містити шарнірну ділянку, яка була модифікована делецією 1-8 амінокислот, включаючи цистеїновий залишок у 8 положенні амінокислотної послідовності SEQ ID NO: 1. Додатково, у одному втіленні, фрагмент Fc-ділянки IgG4 винаходу може містити шарнірну ділянку, яка була модифікована делецією 1-8 амінокислот, включаючи цистеїновий залишок у 11 положенні амінокислотної послідовності SEQ ID NO: 1. Альтернативним чином, у одному втіленні, фрагмент Fc-ділянки IgG4 винаходу може містити шарнірну ділянку, яка була модифікована делецією 1-5 амінокислот, включаючи цистеїновий залишок у 8 положенні або 1-5 амінокислот, включаючи цистеїновий залишок у 11 положенні амінокислотної послідовності SEQ ID NO: 1. Альтернативним чином, у одному втіленні, фрагмент Fc-ділянки IgG4 винаходу може містити шарнірну ділянку, яка була модифікована делецією 1-3 амінокислот, включаючи цистеїновий залишок у 8 положенні або 1-3 амінокислот, включаючи цистеїновий залишок у 11 положенні амінокислотної послідовності SEQ ID NO: 1. Зазначені вище видалені амінокислотні залишки можуть бути суцільно або переривчасто розташованими. Шарнірна ділянка фрагменту Fc-ділянки IgG4 винаходу відрізняється тим, що вона є модифікованою таким чином, щоб вона містила лише один цистеїновий залишок з двох цистеїнових залишків у 8 та 11 положеннях амінокислотної послідовності SEQ ID NO: 1 без усунення обох двох цистеїнових залишків. Шарнірна ділянка, модифікована таким чином, щоб містити лише один з двох цистеїнових залишків у складі шарнірної ділянки діє на модифікований фрагмент Fc-ділянки IgG4 без виникнення реакції обміну ланцюгів in vivo та утворення мономерів тощо. Як тут застосовано, термін "носій" означає матеріал, який є кон'югованим з лікарським засобом та у цьому кон'югованому стані він звичайно підвищує або усуває активні фізіологічні властивості лікарського засобу. В той же час носій винаходу підвищує стійкість лікарського засобу in vivo з одночасною мінімізацією втрат його активних фізіологічних властивостей. Носій за винаходом відрізняється тим, що він не викликає жодних фармакологічних дій, попереджуючих лікувальні активні властивості кон'югованого з носієм лікарського засобу, як-то апоптоз або активація комплементу, та зв'язуванням з певним білком. Як тут застосовано, термін "фрагмент Fc-ділянки IgG4" означає сталу ділянку важкого ланцюга 2 (CH2) та сталу ділянку важкого ланцюга 3 (CH3) за виключенням змінних ділянок важкого та легкого ланцюгів, сталої ділянки важкого ланцюга 1 (CH1) та сталої ділянки легкого ланцюга 1 (CL1) імуноглобуліну IgG4, але зі включенням модифікованої шарнірної ділянки у 3 UA 115906 C2 5 10 15 20 25 30 35 40 45 50 55 60 сталій ділянці важкого ланцюга. Додатково, фрагмент Fc-ділянки IgG4 за винаходом може бути подовженою Fc - ділянкою, включаючи частину або повну сталу ділянку важкого ланцюга 1 (CH1) та / або сталу ділянку легкого ланцюга 1 (CL1) за виключенням змінних ділянок важкого та легкого ланцюгів імуноглобуліну до такої міри, доки фрагмент Fc-ділянки IgG4 буде мати суттєво ту ж саме або покращену дію у порівнянні з подібним фрагментом нативного типу. Додатково, фрагмент Fc-ділянки IgG4 за винаходом містить не тільки свої нативні амінокислотні послідовності, але й також і похідні цих послідовностей (мутеїни). Як тут застосовано, термін "мутеїн фрагменту Fc-ділянки IgG4" означає Fc - фрагмент імуноглобуліну IgG4, який має амінокислотну послідовність, що відрізняється від свого нативного типу та є отриманою делецією, вставки, консервативного та неконсервативного заміщення або їх комбінації принаймні одного амінокислотного залишку нативної амінокислотної послідовності у ділянці, яка не належить до шарнірної ділянки. Крім того, також може бути можливим застосування різних типів похідних з видаленням ділянки, здатної утворювати дисульфідний зв'язок, з видаленням кількох амінокислот з N-кінця нативної Fc-ділянки або з додаванням метіонінового залишку до N-кінця нативної Fc-ділянки. Додатково, для усунення ефекторної функції може бути видалено ділянку зв'язування з комплементом, наприклад, ділянку зв'язування з C1q або ADCC - ділянку. Способи отримання мутеїнів Fc – ділянки наведено у International Patent Publications WO 97/34631, WO 96/32478 тощо. Також було попередньо описано явище амінокислотного обміну у білках або пептидах без повного змінення активності молекул (H. Neurath, R. L. Hill, The Proteins, Academic Press, New York, 1979). Цей обмін, який звичайно трапляється охоплює обмін між амінокислотними залишками Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Thy/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu та Asp/Gly. За певних обставин, модифікацію можна здійснити фосфорилюванням, сульфатуванням, акрилуванням, гликозилюванням, метилюванням, фарнезилуванням, ацетилюванням, амідуванням, тощо. Слід зазначити, що фрагмент Fc-ділянки IgG4 за винаходом може походити від людини, великої рогатої худоби, кіз, свиней, мишей, кролів, хом'яків, щурів, морських свинок тощо та переважним чином він може мати людське походження. Фрагмент Fc-ділянки IgG4 за винаходом може бути фрагментом рекомбінантного типу, в якому Fc - ділянку, яка походить від людини, великої рогатої худоби, кіз, свиней, мишей, кролів, хом'яків, щурів, морських свинок тощо було отримано від мікроорганізмів. Крім того, фрагмент Fc-ділянки IgG4 може існувати у вигляді нативних глюканів, глюканів зі збільшеною, порівняно до нативних глюканів, кількістю або не містити глюканів. Збільшення, зменшення або усунення Fc – глюканів у складі імуноглобулінів може бути здійснено із застосуванням загальноприйнятного способу, як-то хімічного, ферментативного способу, генноінженерного способу із застосуванням мікроорганізмів тощо. Зокрема, оскільки Fc - ділянка імуноглобуліну у разі відокремлення від неї глюканів виявляє значне погіршення зв'язувальної здатності комплементу (c1q) та зменшення або усунення залежної від антитіл або залежної від комплементу цитотоксичності, вона не викликає непотрібних імунних відповідей in vivo. У цьому зв'язку, більш прийнятним типом фрагменту Fc-ділянки IgG4, який краще буде відповідати початковій меті, як носій лікарського засобу, може бути aглікозилований фрагмент Fc-ділянки IgG4. Як тут застосовано, термін "деглікозилування" означає Fc – ділянку, в якій сахариди усунено ферментативно, та "аглікозилування" означає aглікозилований Fc – фрагмент, отриманий у прокаріотичній клітині, переважним чином у E. coli. Додатковим чином, фрагмент Fc-ділянки IgG4 винаходу може бути модифіковано із застосуванням непептидного полімеру. Переважним чином, фрагмент Fc-ділянки IgG4 за винаходом винаходу може бути модифіковано із застосуванням поліетиленгліколю. Фрагмент Fc-ділянки IgG4, модифікований із застосуванням поліетиленгліколю може бути отримано реакцією з поліетиленгліколем з pH 7 або вище, переважним чином з pH 7,5-9, та більш переважніше з pH 8,0. Як тут застосовано, термін "модифікована шарнірна ділянка" означає шарнірну ділянку, в якій видалено будь-який один цистеїновий залишок з цистеїнових залишків у 8 та 11 положеннях амінокислотної послідовності SEQ ID NO: 1, яка є послідовністю шарнірної ділянки нативного фрагменту Fc-ділянки IgG4 та додатково видалено частину амінокислот. У цьому винаході, кількість видалених у шарнірній ділянці амінокислотних залишків може знаходитися в межах 1-8, та, зокрема, ці амінокислотні залишки (залишок) можуть безперервно або переривчасто розташованими. Точніше, наприклад, модифікована шарнірна ділянка винаходу може містити делецію лише одного цистеїнового залишку у 8 положенні або у 11 положенні; або делецію 2-8 суміжних або несуміжних амінокислот, включаючи цистеїновий 4 UA 115906 C2 5 10 15 20 25 30 35 40 45 50 55 60 залишок у 8 положенні; або делецію 2-8 суміжних або несуміжних амінокислот, включаючи цистеїновий залишок у 11 положенні. Модифікована шарнірна ділянка за винаходом може мати, наприклад, принаймні одну амінокислотну послідовність з наведених нижче амінокислотних послідовностей: Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Pro-Ser-Cys-Pro, Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys-Pro-Ser-Pro, Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys-Pro-Ser, Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys-Pro-Pro, Lys-Tyr-GlyPro-Pro-Cys-Pro-Ser, Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys, Glu-Lys-Tyr-Gly-Pro-Pro-Cys, Glu-Ser-ProSer-Cys-Pro, Glu-Pro-Ser-Cys-Pro, Pro-Ser-Cys-Pro, Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Ser-Cys-Pro, LysTyr-Gly-Pro-Pro-Pro-Ser-Cys-Pro, Glu-Ser-Lys-Tyr-Gly-Pro-Ser-Cys-Pro, Glu-Ser-Lys-Tyr-Gly-ProPro-Cys, Lys-Tyr-Gly-Pro-Pro-Cys-Pro, Glu-Ser-Lys-Pro-Ser-Cys-Pro, Glu-Ser-Pro-Ser-Cys-Pro, GluPro-Ser-Cys. У зразковому втіленні винаходу, з метою дослідження механізму реакції обміну ланцюгів між присутнім у крові щурів та людини імуноглобуліном IgG4 та кон'югaтом на основі модифікованого фрагменту Fc-ділянки IgG4 та фізіологічно активного білка за винаходом, кров щурів та людини відповідно перемішали з кон'югaтом на основі модифікованого фрагменту Fcділянки IgG4 та фізіологічно активного білка та зразки зібрали відповідно до кожної зони часу та піддали Вестерн-блот аналізу із застосуванням антитіл до фізіологічно активного білка. В результаті було підтверджено відсутність продукування молекул, яких можна отримати реакцією обміну ланцюгів між IgG4 щурів або людини. Отже, у разі застосування модифікованого фрагменту Fc-ділянки IgG4 за винаходом, як носія для лікарських засобів, його також можна ефективно застосувати для збільшення показників часу напівжиття лікарських засобів у сироватці та покращення їх фізіологічних активних властивостей без обміну з нативними імуноглобулінами in vivo. Відповідно до іншого аспекту, винаходом передбачено нуклеїнову кислоту, що кодує модифікований фрагмент Fc-ділянки IgG4, який має шарнірну ділянку, змінену делецією частини амінокислот таким чином, що вона має лише один цистеїновий залишок; та вектор, який її містить. Нуклеїнова кислота, яка кодує модифікований фрагмент Fc-ділянки IgG4 за винаходом охоплює нуклеїнові кислоти, які кодують модифікований фрагмент Fc-ділянки IgG4, що містить амінокислотну послідовність SEQ ID NO: 2 (Pro-Ser-Cys-Pro-Ala-Pro-Glu-Phe-Leu-Gly-Gly-ProSer-Val-Phe-Leu-Phe-Pro-Pro-Lys-Pro-Lys-Asp-Thr-Leu-Met-Ile-Ser-Arg-Thr-Pro-Glu-Val-Thr-CysVal-Val-Val-Asp-Val-Ser-Gln-Glu-Asp-Pro-Glu-ValGln-Phe-Asn-Trp-Tyr-Val-Asp-Gly-Val-Glu-Val-His-Asn-Ala-Lys-Thr-Lys-Pro-Arg-Glu-GluGln-Phe-Asn-Ser-Thr-Tyr-Arg-Val-Val-Ser-Val-Leu-Thr-Val-Leu-His-Gln-Asp-Trp-Leu-Asn-GlyLys-Glu-Tyr-Lys-Cys-Lys-Val-Ser-Asn-Lys-Gly-Leu-Pro-Ser-Ser-Ile-Glu-Lys-Thr-IleSer-Lys-Ala-Lys-Gly-Gln-Pro-Arg-Glu-Pro-Gln-Val-Tyr-Thr-Leu-Pro-Pro-Ser-Gln-Glu-GluMet-Thr-Lys-Asn-Gln-Val-Ser-Leu-Thr-Cys-Leu-Val-Lys-Gly-Phe-Tyr-Pro-Ser-Asp-Ile-AlaVal-Glu-Trp-Glu-Ser-Asn-Gly-Gln-Pro-Glu-Asn-Asn-Tyr-Lys-Thr-Thr-Pro-Pro-Val-Leu-Asp-SerAsp-Gly-Ser-Phe-Phe-Leu-Tyr-Ser-Arg-Leu-Thr-Val-Asp-Lys-Ser-Arg-Trp-Gln-Glu-Gly-Asn-Val-PheSer-Cys-Ser-Val-Met-His-Glu-Ala-Leu-His-Asn-His-Tyr-Thr-Gln-Lys-Ser-Leu-Ser-Leu-Ser-Leu-GlyLys). Наприклад, нуклеїнова кислота за винаходом може містити нуклеотидну послідовність SEQ ID NO: 3 (CCATCATGCCCAGCACCTGAGTTCCTGGG GGGACCATCAGTCTTCCTGTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCT GAGGTCACATGCGTGGTGGTGGACGTGAGCCAGGAAGACCCTGAGGTCCAGTTCAACTGGTAC GTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTTCAACAGCACG TACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGT GCAAGGTCTCCAACAAAGGCCTCCCATCCTCCATCGA GAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCA TCCCAGGAGGAGATGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCA GCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACT ACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAGGCT AACCGTGGACAAGAGCAGGTGGCAGGAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAG GCTCTGCACAACCACTACACACAGAAGAGCCTCTCCCTGTCTCTGGGTAAA). Як тут застосовано, термін "вектор" означає рекомбінантний вектор, здатний до експресії цільового білка у відповідній клітині – хазяїні та який є генетичною конструкцією, що містить регуляторні фактори, функціонально з'єднані для забезпечення експресії вставленого гена. Як тут застосовано, термін "функціонально з'єднані" означає, що регуляторна послідовність нуклеїнової кислоти є функціонально з'єднаною з послідовністю нуклеїнової кислоти, що кодує потрібний білок таким чином, щоб могло бути забезпечено здійснення головних функцій. Функціональне з'єднання з вектором може бути отримано із застосуванням добре відомих у цій 5 UA 115906 C2 5 10 15 20 25 30 35 40 45 50 55 60 галузі технологій генетичної рекомбінації та сайт-специфічну рестрикцію та лігування ДНК можна легко здійснити із застосуванням добре відомих у цій галузі ферментів тощо. Відповідні вектори експресії можуть містити послідовності регуляторних елементів для експресії, як-то промотор, підсилювач, старт- та стоп- кодони та сигнал поліаденілування. Старт- та стопкодони повинні суттєво виконувати свої функції у об'єкті у разі вставки в ньому генетичної конструкції та повинні знаходитися в одній рамці зчитування з кодуючою послідовністю. Головний промотор може бути конститутивним або індукованим. Вектор експресії також може містити селективний маркер для відбору клітини-хазяїна, що містить вектор та для здатного до реплікації вектора експресії він може містити точку початку реплікації. У іншому аспекті, винаходом передбачено мікроорганізм, який вводять з зазначеним вище вектором, здатним виробляти модифіковані фрагменти Fc-ділянки IgG4. Для досягнення мети винаходу, цей мікроорганізм переважним чином є еукаріотичною клітиною, яка може бути Escherichia coli, Bacillus subtilis, Streptomyces, Pseudomonas, Proteus mirabilis, Staphylococcus тощо та переважним чином Escherichia coli, яка може належати до штамів E. coli XL-1 blue, E. coli BL21 (DE3), E. coli JM109, E. Coli серії DH, E. coli TOP10 та E. coli HB101 та більш переважніше це може бути (але без обмеження) E. coli BL21 (DE3). У разі застосування E. coli, як клітини-хазяїна, Fc - ділянку імуноглобулінів може бути отримано у формі, в якій наявні у домені CH2 нативних імуноглобулінів сахариди з самого початку є видаленими через те, що E. coli не має системи для кон'югaції глюканів з білками. Хоча сахариди імуноглобулінового домену CH2 не впливають на структурну стійкість імуноглобулінів, все ж є відомо, що імуноглобуліни можуть зв'язуватися з клітинами, в яких відбувається експресія рецептора Fc та викликати залежну від антитіл клітинну цитотоксичність, викликати появу імунних клітин до цитокінів, що виділяються, тим самим викликаючи запальні відповіді, а також зв'язуватися з елементом комплементів C1q та викликати комплемент- фіксуючі реакції. Відповідно, у разі утворення Fc - ділянок aглікозилованих імуноглобулінів та кон'югації їх з лікувальними білками, сироваткову концентрацію таких лікувальних білків можна підтримувати протягом тривалого періоду часу без викликання ефекторних функцій імуноглобулінів. Спосіб трансформації вищезазначеного вектора у прокаріотичну клітину може полягати у будь-якому способі, з допомогою якого можна ввести нуклеїнові кислоти у клітину та таку трансформацію можна здійснити вибором стандартної та прийнятної для вибраної відомої у цій галузі клітини-хазяїна технології. Прикладами такого способу є, без обмеження, електропорація, злиття протопластів, осадження фосфатом кальцію (CaPO 4) чи осадження хлоридом кальцію (CaCl2), перемішування із застосуванням карбідкремнієвих волокон, ПЕГ, декстрансульфату, ліпофектаміну тощо. Введений з рекомбінантним вектором експресії мікроорганізм може бути культивовано загальноприйнятним способом. Процес культивування може бути застосовано після легкого пристосування до вибраного мікроорганізму. Звичайно застосоване для культивування середовище повинно містити всі поживні речовини, потрібні для росту та виживання клітин. Це середовище може містити різні джерела вуглецю, азоту та компоненти, багаті на мікроелементи. Приклади джерел вуглецю можуть охоплювати вуглеводи, як-то глюкозу, цукрозу, лактозу, фруктозу, мальтозу, крохмаль, целюлозу та жири, як-то соєве масло, соняшникову олію, рицинову олію, кокосове масло; жирні кислоти, як-то пальмітинову, стеаринову та лінолеву кислоту; спирти, як-то гліцерин та етанол; та органічні кислоти, як-то оцтову кислоту з можливістю їх застосування окремо або в комбінації. Приклади джерел азоту можуть охоплювати органічні джерела азоту, як-то пептон, дріжджовий екстракт, м'ясний сік, солодовий екстракт, кукурудзяний екстракт (CSL) та соєвий шрот; та неорганічні джерела азоту, як-то сечовину, сульфат амонію, хлорид амонію, фосфат амонію, карбонат амонію та нітрат амонію з можливістю їх застосування окремо або в комбінації. Вищезазначене середовище також може містити різні джерела фосфору, як-то дигідрофосфат, гідроортофосфат калію та відповідні натрієві солі. Крім того, до складу такого середовища можуть бути включені солі металів, як-то сульфат магнію або сульфат заліза, а також амінокислоти, вітаміни та відповідні попередники. Протягом періоду культивування, pH культури може бути налаштовано додаванням до неї відповідним чином потрібної сполуки, якто гідроксиду амонію, гідроксиду калію, аміаку, фосфорної та сірчаної кислоти. Додатково, протягом періоду культивування, до культури може бути додано агент для запобігання утворення піни, як-то полігліколевий естер жирної кислоти. Крім того, для збереження аеробного стану культури, через неї може бути пропущено кисень або газ, що містить кисень (наприклад, повітря). Температура культури звичайно може знаходитися в межах 20 °C-45 °C та переважним чином в межах 25 °C-40 °C. Також додатково може бути застосовано ферментер. У разі виробництва білків із застосуванням ферментера потрібно розглянути різні фактори, 6 UA 115906 C2 5 10 15 20 25 30 35 40 45 50 55 включаючи швидкість росту та рівень експресії продуктів клітини-хазяїна. Експресію білка також можна викликати додаванням ІПТГ або подібних сполук до культури у відповідному стані. Також може бути досягнута надлишкова експресія у клітині – хазяїні модифікованого фрагменту Fcділянки IgG4 винаходу у вигляді агрегату або може бути досягнута його експресія у водній формі. Незважаючи на тип експресії, білки може бути очищено із застосуванням загальноприйнятного способу очищення. Відповідно у іншому аспекті, винаходом передбачено спосіб отримання модифікованого фрагменту Fc-ділянки IgG4, який полягає у культивуванні мікроорганізму, введеного з нуклеїновою кислотою, що кодує модифікований фрагмент Fc-ділянки IgG4. Відповідно до вищезазначеного способу, промислове застосування цього фрагменту Fcділянки IgG4, отриманого у прокаріотичній клітині, як-то E. coli, не має особливих обмежень. Зразковим застосуванням може бути застосування його, як носія для отримання кон'югaту з незалежно вибраним лікарським засобом. Відповідно у іншому аспекті, винаходом передбачено лікарський засіб та кон'югaт з лікарським засобом, в якому модифікований фрагмент Fc-ділянки IgG4 кон'юговано до нього з допомогою лінкера. Як тут застосовано, "кон'югaт" або "кон'югaт з лікарським засобом" означає, що принаймні один лікарський засіб є взаємопов'язаним з принаймні одним з модифікованих фрагментів Fcділянки IgG4. Як тут застосовано, "лікарський засіб" означає матеріал, який може виявляти лікувальні активні властивості у разі його введення людині або тваринам та який може містити, але без обмеження, поліпептид, сполуку, екстракт, нуклеїнову кислоту тощо, Переважним чином, лікарський засіб є поліпептидним лікарським засобом. Як тут застосовано, слід розуміти, що терміни "фізіологічно активний поліпептидний лікарський засіб", "поліпептидний лікарський засіб" та "білковий лікарський засіб" мають однакове значення та відрізняються тим, що вони є фізіологічно активними типами, які виявляють антагонізм до різного фізіологічного явища in vivo. Тип кон'югату, в якому фрагмент Fc-ділянки IgG4 є кон'юговано з лікарським засобом не має особливих обмежень та фрагмент Fc-ділянки IgG4 та лікарський засіб може бути кон'юговано з різними співвідношеннями. У цьому винаході, "лінкер" може означати як пептидний, так і непептидний лінкер, переважним чином непептидний лінкер та, більш переважніше, непептидний полімер. "Непептидний полімер" означає біосумісний полімер, з яким кон'юговано принаймні дві одиниці, які повторюються та ці одиниці, які повторюються є взаємопов'язаними з допомогою випадкового ковалентного зв'язку, який відрізняється від пептидних зв'язків. Непептидний полімер може бути вибрано з групи, яка охоплює поліетиленгліколь, пропіленгліколь, поліоксиетильований поліол, полівініловий спирт, полісахарид, декстран, полівініловий етиловий етер, біорозкладаний полімер, як-то полімолочну кислоту (PLA) та полімолочногліколеву кислоту (PLGA), ліпідний полімер, хітин, гіалуронову кислоту, а також їх комбінації, та, переважним чином, поліетиленгліколь. Також винахід стосується відомих у цій галузі похідних та похідних, які можна легко отримати із застосуванням відомих у цій галузі способів. Непептидний полімер за винаходом може мати два або три хімічно активних кінці та кінцева хімічно активна група непептидного полімеру є переважним чином вибраною з групи, яка охоплює хімічно активну альдегідну групу, пропіональдегідну групу, бутилальдегідну групу, малеїмідну групу та сукцинімідну похідну. Приклади сукцинімідних похідних можуть охоплювати сукцинімідил-пропіонат, гідрокси-сукцінімідил, сукцинімідил-карбоксиметил та сукцинімідилкарбонат. Зокрема, коли реакційною групою на кінці непептидного полімеру є хімічно активна альдегідна група, то цей непептидний полімер може звести до мінімуму неспецифічні реакції та ефективно діє у відповідному зв'язуванні з фізіологічним поліпептидом та Fc-фрагментом імуноглобуліну. Кінцевий продукт, отриманий з допомогою відновного алкілування альдегідним зв'язуванням є більш стабільним, ніж продукт, з'єднаний з допомогою амідного зв'язку. Хімічно активна альдегідна група є здатною до селективної реакції на N-кінці при низькому рН. В умовах високого рН, наприклад, рН 9,0, вона може утворювати ковалентний зв'язок із залишком лізину. Кінцеві хімічно активні групи непептидного полімеру можуть бути однаковими або відрізнятися між собою. Наприклад, непептидний полімер може мати малеїмідну групу на одному кінці та мати альдегідну групу, пропіональдегідну групу або бутилальдегідну групу на іншому кінці. У разі, якщо поліетиленгліколь або непептидний полімер мають гідроксильну хімічно активну групу на обох кінцях, то кон'югaт винаходу може бути отримано активуванням гідроксильної групи з різними хімічно активними групами відповідно за відомою хімічною 7 UA 115906 C2 5 10 15 20 25 30 35 40 45 50 55 реакцією або із застосуванням наявного у продажу поліетиленгліколю, що має модифіковану хімічно активну групу. Що стосується фізіологічно активних поліпептидів, які може бути застосовано зв'язуванням з модифікованим фрагментом Fc-ділянки IgG4 за винаходом, то будь-які з них, які потребують збільшення сироваткового часу напівжиття можуть бути застосовані без обмеження. Наприклад, можуть бути застосовані різні фізіологічно активні поліпептиди, як-то цитокіни, інтерлейкіни, інтерлейкін-зв'язуючі білки, ферменти, антитіла, фактори росту, регуляторні фактори транскрипції, фактори згортання крові, вакцини, структурні білки, білки лігандів або рецепторів, антигени клітинної поверхні, антагоністи рецепторів, їх похідні та аналоги. Зокрема, фізіологічно активні поліпептиди можуть охоплювати, але без обмеження, гормон росту людини, гормон, який вивільнює гормон росту людини, пептид, який вивільнює гормон росту людини інтерферони та рецептори інтерферону (наприклад, інтерферон-α, -β, та -γ, рецептор інтерферону розчинного типу I тощо), колонієстимулюючі фактори, інтерлейкіни (наприклад, інтерлейкін-1, -2, -3, -4, -5, -6, -7, -8, -9, -10, -11, -12, -13, -14, -15, -16, -17, -18, -19, 20, -21, -22, -23, -24, -25, -26, -27, -28, -29, -30 тощо) та рецептори інтерлейкінів (наприклад, рецептор IL-1, рецептор IL-4 тощо), ферменти (наприклад, глюкоцереброзидазу, ідуронат-2сульфатазу, альфа-галактозидазу-А, α-, β-агалзидазу, α-L-ідуронідазу, бутирилхолінестеразу, хітиназу, глутаматдекарбоксилазу, іміглюцеразу, ліпазу, уриказу, ацетилгідролазу фактора активації тромбоцитів, нейтральну ендопептідазу, мієлопероксидазу тощо), інтерлейкін та цитокін-зв'язуючі білки (наприклад, IL-18bp, TNF-зв'язуючий білок тощо), фактор активації макрофагів, макрофагальний пептид, B – клітинні та T – клітинні фактори, протеїн A, фактори пригнічення алергії, некротичні глікопротеїни, іммунотоксини, лимфотоксини, фактори некрозу пухлини, пухлинні супресори, трансформуючі фактори росту, α-1 антитрипсин, альбумін, αлактальбумин, аполіпопротеїн-Е, еритропоетин, високоглікозилований еритропоетин, ангіопоетін, гемоглобини, тромбін, пептид-агоніст рецептора тромбіну, тромбомодулін, фактор згортання крові, фактор згортання крові α, фактор згортання крові, фактор згортання крові, фактор згортання крові XIII, активатор плазміногену, фібрин-зв'язуючий пептид, урокіназу, стрептокіназу, гірудин, C-білок, C-реактивний білок, пригнічувач реніну, пригнічувач колагенази, супероксиддисмутазу, фактор росту тромбоцитів, фактор росту епітелію судин, епідермальний фактор росту, ангіостатин, ангіотензин, кістковий морфогенетичний фактор росту, кістковий морфогенетичний білок, кальцитонін, інсулін та його похідна, атріопептин, хрящовий індукуючий фактор імпульсної відповіді, елкатонін, фактор активування сполучної тканини, пригнічувач тканевого фактора, фолікулостимулюючий гормон, лютеїнізуючий гормон, люліберин, фактори росту нервової тканини (наприклад, нейроростовий фактор, циліарний нейротрофічний фактор, фактор аксогенезу-1, натрійуретичний пептид головного мозку, нейротрофічний фактор гліальної клітинної лінії, пригнічувач міграції нейтрофілів, нейротрофічні фактори, нейтрин тощо), паратиреоїдний гормон, релаксин, секретин, соматомедин, інсуліноподібний фактор росту, гормон кори надниркових залоз, глюкагон, інсулінотропні пептиди, включаючи глюкагоноподібний пептид-1 та ексендин-4, інкретини, які виділяються в кишечнику, адипоцити, включаючи лептони та ефективні для метаболічного синдрому нейроцитокіни, холецистокінін, панкреатичні поліпептиди, пептиди, які вивільнюють гастрин, фактор вивільнення кортикотропіну, тиреотропний гормон, автотаксин, лактоферин, міостатин, рецептори (наприклад, TNFR (P75), TNFR (P55), рецептор IL-1, рецептор VEGF, рецептор фактора активування B - клітин тощо), антагоністи рецепторів (наприклад, IL1-Ra тощо), антигени клітинної поверхні (наприклад, CD 2, 3, 4, 5, 7, 11a, 11b, 18, 19, 20, 23, 25, 33, 38, 40, 45, 69, тощо), моноклональні антитіла, поліклональні антитіла, фрагменти антитіл (наприклад, scFv, Fab, Fab', F(ab')2 та Fd) та вакцинний антиген вірусного походження, тощо. Прийнятний для застосування у цьому винаході фізіологічно активний поліпептид може бути природним поліпептидом; поліпептидом, отримані генетичною рекомбінацією у прокаріотичній клітині, як-то E. coli, або у еукаріотичній клітині, як-то у клітині дріжджів, комах або тварин; або він може бути похідною, яка має активність, еквівалентну активності природного типу та мутацію у принаймні одному амінокислотному положенні. Модифікований фрагмент Fc-ділянки IgG4 винаходу може бути отримано в клітині після приєднання його до фізіологічно активного поліпептиду у вигляді моногенної послідовності із застосуванням способу безпосередньої генетичної рекомбінації; або цей фрагмент Fc-ділянки IgG4 може бути отримано незалежним чином та кон'юговано in vitro з лікарським засобом, як-то з фізіологічно активним поліпептидом. У іншому аспекті, винаходом передбачено фармацевтичну композицію, що містить вищезазначений кон'югaт лікарського засобу за винаходом, як активний інгредієнт. 8 UA 115906 C2 5 10 15 20 25 30 35 40 45 50 55 Фармацевтична композиція, яка містить кон'югaт винаходу також може містити фармацевтично прийнятний носій. Приклади фармацевтично прийнятного носія можуть охоплювати в'яжучу речовину, мастило, розпушувач, наповнювач, солюбілізатор, диспергатор, стабілізатор, суспендуючу речовину, барвник, ароматизатор тощо. Для препаратів, призначених для введення ін'єкціями може бути застосовано буферизуючий агент, консервант, знеболювальний засіб, ізотонічний агент, стабілізатор тощо, які можуть бути змішані для застосування; та для препаратів, призначених для місцевого введення може бути застосовано основу, наповнювач, мастило, консервант тощо. Може бути отримано різний тип препарату на основі фармацевтичної композиції за винаходом поєднанням її з фармацевтично прийнятним носієм. Наприклад, фармацевтичну композицію для перорального введення можна отримати у вигляді таблеток, драже, капсул, еліксирів, суспензій, сиропів, брикетів тощо; фармацевтичну композицію для введення ін'єкцією можна отримати у вигляді однодозових ампул або багатодозових контейнерів. Фармацевтичну композицію також можна отримати у розчинах, суспензіях, таблетках, капсулах та у препаратах з уповільненим вивільненням. При цьому, приклади прийнятних носіїв, допоміжних речовин та розріджувачів можуть охоплювати лактозу, декстрозу, цукрозу, сорбіт, маніт, ксиліт, еритрит, мальтит, крохмаль, гуміарабік, альгинат, желатин, фосфат кальцію, силікат кальцію, целюлозу, метилцелюлозу, мікрокристалічну целюлозу, полівінілпіролідон, воду, метил-гідроксибензоат, пропілгідроксибензоат, тальк, стеарат магнію, мінеральні оливи тощо. Крім того, композиція винаходу може додатково містити наповнювач, антикоагулянт, мастило, змочувальну речовину, ароматизатор, емульгатор, консервант тощо. Ефективну дозу лікарських засобів за винаходом, в яких фрагмент Fc-ділянки IgG4 застосовано в якості носія будуть визначати на основі типів лікарських засобів, застосованих, як активні інгредієнти, а також в залежності від різних інших факторів, як-то хвороби, що підлягає лікуванню, шляху введення, віку, статі та маси тіла пацієнта, тяжкості захворювання тощо. Оскільки фармацевтична композиція винаходу має відмінну тривалість in vivo, кількість та частоту введення фармацевтичного препарату за винаходом може бути суттєво зменшено. Фармацевтичний препарат за винаходом може бути введено різними варіантами. Як тут застосовано, термін "введення" означає введення відповідним чином певного матеріалу пацієнту та кон'югований лікарський засіб за винаходом може бути введено будьяким загальноприйнятно за умови його потрапляння до потрібної тканини. Введення може бути здійснено, наприклад, але без обмеження, внутрішньочеревним, внутрішньовенним, внутрішньом'язовим, внутрішньолегеневим, підшкірним, черезшкірним, пероральним, місцевим, інтраназальним, та ректальним шляхом, однак, оскільки пептиди розщеплюються під час перорального введення, активні інгредієнти композиції для такого введення повинні бути покритими оболонкою або знаходитися у складі препарату, захищеного від їх деградації у шлунку. Переважним чином, композицію за винаходом може бути введено у формі, яка є прийнятною для ін'єкції. Крім того, цю фармацевтичну композицію може бути введено із застосуванням певного пристрою, здатного до перенесення активних інгредієнтів до клітинимішені. Далі винахід буде більш детально описано з посиланням на наведені нижче приклади, як надано лише в ілюстративних цілях. Винахід не призначено бути обмеженим наведеними нижче прикладами. Приклад 1. Отримання кон'югaту "колонієстимулюючий фактор гранулоцитів людини- ПЕГімуноглобулін". Конструюювання вектора експресії Fc - домену IgG4. Для клонування Fc – ділянки важкого ланцюга, що містить шарнірну ділянку IgG4, було здійснено ПЛР- реакцію зі зворотною транскрипцією із застосуванням клітин, зібраних з крові людини в якості матриці, як описано нижче. Спочатку з крові (з pH приблизно 6) виділили загальну РНК та здійснили ампліфікацію гена на основі РНК-матриці із застосуванням набору Qiamp RNA blood kit (Qiagen) та пари послідовностей SEQ ID NO: 4 (gggcatatgc catcatgccc agcacctgag ttcctgggg) та SEQ ID NO: 5 (gggggatccc tatttaccca gagacagggaga) в якості праймерів. Для забезпечення наступного процесу у праймери було вставлено домен, здатний впізнавати сайти рестрикції NdeI та необхідний для експресії білка старт-кодон ATG та у 3-праймер послідовності SEQ ID NO: 5б було вставлено домен, здатний впізнавати сайти рестрикції BamHI. Потім ампліфіковану Fc - ділянку продукту розрізали, відповідно, рестриктазами NdeI та BamHI та субклонували у вектор pET22b (Novagen Co., Ltd.) з отриманням плазміди. Цю плазміду було створено таким чином, щоб фрагмент Fc-ділянки IgG4 містив власну шарнірну 9 UA 115906 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовність з делецією амінокислотних залишків у 1-8 положеннях повної амінокислотної послідовності Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys-Pro-Ser-Cys-Pro. Ця плазміда отримала назву "pmHMC001" та в результаті аналізу її послідовності було виявлено, що нуклеїнова кислота, яка кодує фрагмент Fc-ділянки IgG4 мала нуклеотидну послідовність SEQ ID NO: 3 та фрагмент Fc-ділянки IgG4 під час експресії мав амінокислотну послідовність SEQ ID NO: 2. Отриманим вектором експресії трансформували E. coli штаму BL21 (DE3) та отримали трансформант E. coli BL21/pmHMC001 (HMC001). Експресія та очищення Fc - ділянки IgG4. Отриманим у Прикладі трансформантом мікроорганізму інокулювали призначене для ферментації середовище у ферментері (Marubishi Co., Ltd.) та дослідили експресію фрагменту Fc-ділянки IgG4. Спочатку наведені вище трансформанти у 100 мл середовища LB культивували на водяній бані зі струшуванням протягом ночі, після чого інокуляцію з культурою було продовжено у ферментері з підтриманням температури у 35 °C або 28 °C та початком культивування з перемішуванням зі швидкістю у 500 об/хв. з одночасним постачанням повітря (20 об'єм/об'єм/хв.) для запобігання виникнення анаеробного стану. З розвитком ферментації, джерела енергії, яких було недостатньо для росту мікроорганізмів поповнювали із застосуванням глюкози та дріжджового екстракту у відповідності зі станом ферментації мікроорганізму та з досягненням оптичної густини 80 (довжина хвилі 600 нм) експресію було викликано додаванням індуктора (ІПТГ). Для отримання культури з високою концентрацією, процес культивування тривав 40-45 год. до досягнення оптичної густини 100-120 (довжина хвилі 600 нм). Експресію трансформанту Fc-фрагменту IgG4 у E. coli також було підтверджено описаним нижче експериментом. З метою підтвердження закінчення експресії Fc-фрагменту IgG4 у цитоплазмі, частину ферментаційної рідини перемішали з такою ж кількістю 2x білкового буферу крапельно та піддали електрофорезу у 15 % ПААГ-гелі з додецилсульфатом натрію по Лемлі (SDS-PAGE) (Criterion Gel, Bio-Rad). В результаті було підтверджено наявність надлишкової експресії Fcфрагменту IgG4 у отриманому трансформанті. Було виявлено, що білок, який виник внаслідок цієї надлишкової експресії, утворював коагулянти і його очищали наступним рефолдингом коагулянтів та хроматографією на колонці. Спочатку 10 г клітин розчинили у 100 мл лізуючого буферу (10 мМ Tris, pH 9,0, 1 мМ EDTA, 0,5 % Triton X-100, та 0,2 M NaCl) та піддали руйнуванню ультразвуком. Отриманий розчин центрифугували зі швидкістю 10000 об/хв протягом 20 хв. Для розділення розчинної та нерозчинної фракцій 2 г нерозчинного коагулянту розчинили у 20 мл солюбілізаційного буферу (6 M гуанідин та 50 мМ Tris) та залишили для здійснення реакції протягом 30 хв. при 4 та з обережним перемішуванням. Після завершення реакції отриману суміш розвели додаванням 10 об'ємів буферу для рефолдингу (2 M сечовина, 50 мМ Tris, 0,25 M аргінін та 3 мМ цистеїн, pH 9,0) та потім залишили для здійснення реакції на ніч з обережним перемішуванням. Після завершення реакції з допомогою гель-фільтрації (Sephadex G25) було отримано зразок у свіжому буфері 10 мМ Tris-HCl (pH 8,0), який потім елюювали із заміненим буфером у градієнті концентрації Tris-HCl (pH 8,0) та NaCl із застосуванням сефарози DEAE-FF (GE healthcare), та у градієнті концентрації сульфату амонію та 10 мМ Tris-HCl (pH 7,5) із застосуванням фенил-сефарози phenyl-FF (GE healthcare) з метою усунення великої кількості мультимерів та мономерів. Для наступного очищення на колонці отриману речовину знесолили 10 мМ Tris (pH 7,5) з допомогою гель-фільтрації (Sephadex G25 від GE healthcare), та потім, з метою отримання високої чистоти Fc-фрагментів IgG4, їх елюювали із застосуванням хроматографічного середовища 15Q (GE healthcare) у градієнті концентрації 10 мМ Tris-HCl (pH 7,5) та NaCl з отриманням кінцевого продукту IgG4 Fc. Отримання кон'югaту 1 з лікарським засобом. 1) Отримання кон'югaту колонієстимулюючих факторів гранулоцитів та ПЕГ. Біфункціональний пропіональдегід ALD-PEG-ALD (Shearwater Inc., USA), який являв собою поліетиленгліколь з молекулярною масою у 3,4 кДа з альдегідними хімічно активними групами на обох кінцях додали до 100 мМ фосфатного буферу, в якому було розчинено колонієстимулюючі фактори гранулоцитів з концентрацією у 5 мг/мл таким чином, щоб молярне співвідношення колонієстимулюючих факторів гранулоцитів та ПЕГ складало 1:5. Потім до розчину додали відновник - ціаноборгідрид натрію (NaCNBH3) до кінцевої концентрації у 20 мМ та реакція тривала 3 год. з температурою 4 °C та обережним перемішуванням. З метою отримання кон'югaту, в якому ПЕГ буде вибірковим чином приєднано до N-кінців колонієстимулюючих факторів гранулоцитів та кон'югaцію ПЕГ та колонієстимулюючих факторів 10 UA 115906 C2 5 10 15 20 25 30 35 40 45 50 55 гранулоцитів буде здійснено у співвідношенні 1:1, реакційну суміш піддали ексклюзійній хроматографії з середовищем Superdex (Superdex R, Pharmacia, USA). Колонієстимулюючі фактори гранулоцитів очистили із застосуванням 10 мМ калій-фосфатного буферу (pH 6,0), як буферу для елюювання з усуненням некон'югованих з ПЕГ колонієстимулюючих факторів гранулоцитів, некон'югованого ПЕГ та химерних побічних продуктів, які виникли в разі кон'югації з ПЕГ двох колонієстимулюючих факторів гранулоцитів. Очищений кон'югaт колонієстимулюючих факторів гранулоцитів та ПЕГ концентрували до 5 мг/мл. 2) Утворення кон'югaту між кон'югaтом колонієстимулюючого фактора гранулоцитів та PEG та фрагментом Fc-ділянки IgG4. Фрагмент Fc-ділянки IgG4 винаходу розчинили у 100 мМ фосфатному буфері. Для кон'югaції фрагменту Fc-ділянки IgG4 з хімічно активними альдегідними групами очищеного вище кон'югaту колонієстимулюючого фактора гранулоцитів з ПЕГ, цей кон'югaт додали до буферу, який містив фрагмент Fc-ділянки IgG4 таким чином, щоб молярне співвідношення кон'югaту колонієстимулюючого фактора гранулоцитів з ПЕГ та фрагменту Fc-ділянки IgG4 становило 1:5. Потім до розчину додали відновник, ціаноборгідрид натрію (NaCNBH 3) до кінцевої концентрації у 20 мM та реакція тривала 20 год. з температурою 4 °C та обережним перемішуванням. Після закінчення реакції кон'югaції було здійснено усунення побічних продуктів та матеріалів, як не приймали участі в реакції та отриманий кон'югaт колонієстимулюючого фактора гранулоцитів ПЕГ-білка імуноглобуліну очистили із застосуванням аніонообмінної хроматографії. Очищення кон'югaту колонієстимулюючого фактора гранулоцитів - ПЕГ- фрагменту Fc-ділянки IgG4 було здійснено нанесенням вищезазначеної реакційної суміші на ДЕАЕ-колонку (Pharmacia, USA), врівноважену 20 мМ буфером Tris (pH 7,5) з наступним пропусканням крізь колонку такого ж саме буферу, який містив 1 M NaCl із застосуванням способу лінійного градієнту концентрації (концентрація NaCl: 0 M → 0,5 M). Для усунення невеликої кількості імуноглобулінів, які не приймали участі в реакції та гормону росту людини, який знаходився у вигляді домішки в цій отриманій фракції кон'югaту колонієстимулюючого фактора гранулоцитів -ПЕГ- фрагменту Fcділянки IgG4 було здійснено додаткове очищення катіонообмінною хроматографією. Для цього фракцію кон'югaту колонієстимулюючого фактора гранулоцитів -ПЕГ- фрагменту Fc-ділянки IgG4 нанесли на колонку polyCAT (PolyLC, USA), врівноважену 10 мМ ацетатом натрію (pH 4,5) та додатково її очистили пропусканням через колонку 10 мМ буферу ацетату натрію (pH 4,5), який містив 1 M NaCl із застосуванням способу лінійного градієнту концентрації (концентрація NaCl: 0 M → 0,5 M), в результаті чого було отримано чистий кон'югaт колонієстимулюючого фактора гранулоцитів -ПЕГ- фрагменту Fc-ділянки IgG4 (HM10460A). Приклад 2. Підтвердження наявності реакції обміну ланцюгів між кон'югaтом колонієстимулюючого фактора гранулоцитів людини-ПЕГ-імуноглобуліну та імуноглобуліном IgG4 людини в крові щурів. 2 мг людського імуноглобуліну IgG4 помітили біотиновою міткою змішуванням з 20 мг/мл розчину біотин-7-NHL з молекулярним співвідношенням 1:10 та очищеним з набором Biotin Protein Labeling Kit (Roche). Зібрану зі здорових щурів кров обробили гепарином для запобігання її згортання та додали до неї суміш пеніциліну та стрептоміцину (1 % у об'ємному співвідношенні). Потім до 3 мл крові додали 1,5 мг міченого біотином IgG4 та 1,32 мг HM10460A, суміш перемішали та аліквоти її розподілили по 6 пробіркам (0,5 мл / пробірку) та піддали інкубуванню при 37 °C. По одній пробірці було вилучено через, відповідно, 0 год., 4 год., 10 год., 24 год., та 48 год. інкубування з відокремленням плазми крові із кожного зразка, яку потім зберігали при -20 °C. Кожен з цих зразків плазми крові та стандартні матеріали (мічений біотином IgG4 та HM10460A) перемішали з буфером для білкових проб для застосування у невідновних умовах та отриману суміш піддали електрофорезу у поліакриламідному гелі в присутності додецилсульфату натрію із застосуванням 4 % - 15 % градієнта концентрації поліакриламідного гелю. Після закінчення електрофорезу гель піддали блотингу на ПВДФмембрані (Immobilon-P, Millipore) та аналізу із застосуванням антитіл до колонієстимулюючого фактора гранулоцитів людини та стрептавідинової мітки з пероксидазою хрону. Щодо умов зв'язування антитіл, то антитіла до Fc-фрагменту людського імуноглобуліну IgG (Sigma) було застосовано в умовах із блокуванням 5 % знежиреним молоком після розведення зі співвідношенням 1:150000, антитіла до колонієстимулюючого фактора гранулоцитів людини (Human G-CSF Assay Kit. IBL) було застосовано в умовах із блокуванням 1 % знежиреним молоком після розведення зі співвідношенням 1:2000 та стрептавідинову мітку з пероксидазою хрону було застосовано в умовах із блокуванням 5 % знежиреним молоком після розведення, відповідно, зі співвідношенням 1:5000. Було підтверджено утворення димерів HM10460A (94 кДа), які складалися з двох колонієстимулюючих факторів гранулоцитів людини на кожен 11 UA 115906 C2 5 10 15 20 25 30 фрагмент Fc-ділянки IgG4 та фрагментів Fc-ділянки IgG4 (50 кДа), яке виникало внаслідок реакції обміну ланцюгів HM10460A. На відміну від цього, у разі викликання кон'югaтом HM10460A реакції взаємного обміну ланцюгів між HM10460A та IgG4 людини очікувалося утворення молекул розміром 100 кДа та 122 кДа, однак в результаті досліджень із застосуванням Вестерн-блот аналізу цих молекул виявлено не було. Навпаки, у разі застосування аналізу зі стрептавідиновою міткою з пероксидазою хрону було виявлено смугу у 75 кДа, яка з'явилася на доріжці IgG4 людини, що підтверджує утворення мономерів з IgG4 людини, який природно є димером (Фіг. 1). Приклад 3. Підтвердження наявності реакції обміну ланцюгів між кон'югaтом колонієстимулюючого фактора гранулоцитів людини-ПЕГ-імуноглобуліну та імуноглобуліном IgG4 людини в крові людини. До отриманої від донора крові людини додали пеніцилін-стрептоміцин (1 % у об'ємному співвідношенні). 1,32 мг отриманого у Прикладі 1 кон'югaту HM10460A змішали з 3 мл цієї крові та аліквоти отриманої суміші налили у 6 пробірок (0,5 мл / пробірку) та піддали інкубуванню при 37 °C. По одній пробірці було вилучено через, відповідно, 0 год., 4 год., 10 год., 24 год., та 48 год. інкубування з відокремленням плазми крові із кожного зразка, яку перед аналізом зберігали при -20 °C. Кожен зразок плазми, HM10460A та Fc - фрагмент імуноглобуліну IgG4 зі змінними концентраціями (контрольні матеріали) перемішали з буфером для білкових проб для застосування у невідновних умовах та отриману суміш піддали електрофорезу у поліакриламідному гелі в присутності додецилсульфату натрію із застосуванням 4 % - 15 % градієнта концентрації поліакриламідного гелю. Після закінчення електрофорезу гель піддали блотингу на ПВДФ-мембрані (Immobilon-P, Millipore) та аналізу із застосуванням антитіл до колонієстимулюючого фактора гранулоцитів людини. Антитіла до колонієстимулюючого фактора гранулоцитів людини (Human G-CSF Assay Kit. IBL) було застосовано в умовах із блокуванням 1 % знежиреним молоком після розведення зі співвідношенням 1:2000. Як і в крові щурів, не було виявлено утворення молекул розміром 100 кДа та 122 кДа, які могли бути отримані внаслідок реакції обміну ланцюгів з людським імуноглобуліном IgG4 (Фіг. 2). Пересічному фахівцеві у цій галузі буде зрозуміло, що цей винахід може бути втілено в інших специфічних формах без відходу від його суті або важливих характеристик. Описані втілення повинні бути розглянуті в усіх відношеннях тільки ілюстративним чином та вони не мають обмежувального характеру. Таким чином, обсяг винаходу більш визначено у доданій Формулі Винаходу, ніж у наведеному вище описі. Всі змінення, які може бути здійснено в межах сенсу та діапазону еквівалентності Формули Винаходу повинні охоплюватися обсягом цього винаходу. 35 12 UA 115906 C2 13 UA 115906 C2 14 UA 115906 C2 15 UA 115906 C2 16 UA 115906 C2 17 UA 115906 C2 18 UA 115906 C2 19 UA 115906 C2 20 UA 115906 C2 21 UA 115906 C2 22 UA 115906 C2 23 UA 115906 C2 24 UA 115906 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 1. Модифікований фрагмент Fc-ділянки імуноглобуліну IgG4, що містить модифіковану шарнірну ділянку, в якому частину цієї шарнірної ділянки, представленої наступною амінокислотною послідовністю, видалено делецією з утворенням лише одного цистеїнового залишку: Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys-Pro-Ser-Cys-Pro. 2. Модифікований фрагмент Fc-ділянки імуноглобуліну IgG4 за п. 1, в якому не відбувається реакція обміну ланцюгів та утворення мономерів in vivo. 3. Модифікований фрагмент Fc-ділянки імуноглобуліну IgG4 за п. 1, в якому шарнірну ділянку змінено мутацією, яка полягає у делеції 1-8 безперервно або переривчасто розташованих амінокислот з цистеїновим залишком у 8 положенні. 4. Модифікований фрагмент Fc-ділянки імуноглобуліну IgG4 за п. 1, в якому шарнірну ділянку змінено мутацією, яка полягає у делеції 1-8 безперервно або переривчасто розташованих амінокислот з цистеїновим залишком у 11 положенні. 5. Модифікований фрагмент Fc-ділянки імуноглобуліну IgG4 за п. 1, в якому шарнірну ділянку змінено мутацією, яка полягає у делеції 1-5 безперервно або переривчасто розташованих амінокислот з цистеїновим залишком у 8 положенні. 6. Модифікований фрагмент Fc-ділянки імуноглобуліну IgG4 за п. 1, в якому шарнірну ділянку змінено мутацією, яка полягає у делеції 1-5 безперервно або переривчасто розташованих амінокислот з цистеїновим залишком у 11 положенні. 7. Модифікований фрагмент Fc-ділянки імуноглобуліну IgG4 за п. 1, в якому шарнірну ділянку змінено мутацією, яка полягає у делеції 1-3 безперервно або переривчасто розташованих амінокислот з цистеїновим залишком у 8 положенні. 8. Модифікований фрагмент Fc-ділянки імуноглобуліну IgG4 за п. 1, в якому шарнірну ділянку змінено мутацією, яка полягає у делеції 1-3 безперервно або переривчасто розташованих амінокислот з цистеїновим залишком у 11 положенні. 9. Модифікований фрагмент Fc-ділянки імуноглобуліну IgG4 за п. 1, який є аглікозилованим. 10. Модифікований фрагмент Fc-ділянки імуноглобуліну IgG4 за п. 1, який модифіковано непептидильним полімером. 11. Нуклеїнова кислота, яка кодує фрагмент Fc-ділянки IgG4 за п. 1. 12. Вектор, який містить нуклеїнову кислоту за п. 11. 13. Мікроорганізм, який вводять з вектором за п. 12. 14. Спосіб отримання фрагмента Fc-ділянки імуноглобуліну IgG4 за будь-яким з пп. 1-10, який полягає у культивуванні мікроорганізму за п. 13. 25 UA 115906 C2 5 10 15 20 25 30 35 40 15. Кон'югат з лікарським засобом, в якому фрагмент Fc-ділянки IgG4 за будь-яким з пп. 1-10 кон'юговано до нього за допомогою лінкеру. 16. Кон'югат з лікарським засобом за п. 15, в якому лікарський засіб вибрано з групи, яка складається з гормону росту людини, гормону, який вивільнює гормон росту людини, пептиду, який вивільнює гормон росту людини, інтерферонів та рецепторів інтерферону, колонієстимулюючих факторів, інтерлейкінів та рецепторів інтерлейкінів, інтерлейкін- та цитокінзв'язуючих білків, фактора активації макрофагів, макрофагального пептиду, В-клітинних та Т-клітинних факторів, протеїну А, факторів пригнічення алергії, некротичного глікопротеїну, імунотоксину, лімфотоксину, фактора некрозу пухлини, пухлинного супресору, трансформуючого фактора росту, -1 антитрипсину, альбуміну, -лактальбуміну, аполіпопротеїну-Е, еритропоетину, високоглікозилованого еритропоетину, ангіопоетину, гемоглобіну, тромбіну, пептид-агоністу рецептора тромбіну, тромбомодуліну, фактора згортання крові VII, фактора згортання крові VII, фактора згортання крові VIII, фактора згортання крові IX, фактора згортання крові XIII, активатора плазміногену, фібринзв'язуючого пептиду, урокінази, стрептокінази, гірудину, С-білка, С-реактивного білка, пригнічувачу реніну, пригнічувача колагенази, супероксиддисмутазу, лептину, фактора росту тромбоцитів, фактора росту епітелію судин, епідермального фактора росту, ангіостатину, ангіотензину, кісткового морфогенетичного фактора росту, кісткового морфогенетичного білка, кальцитоніну, інсуліну та його похідної, атріопептину, хрящового індукуючого фактора імпульсної відповіді, елкатоніну, фактора активування сполучної тканини, пригнічувача тканинного фактора, фолікулостимулюючого гормону, лютеїнізуючого гормону, люліберину, факторів росту нервової тканини (включаючи нейроростовий фактор, циліарний нейротрофічний фактор, фактор аксогенезу-1, натрійуретичний пептид головного мозку, нейротрофічний фактор гліальної клітинної лінії, пригнічувач міграції нейтрофілів, нейротрофічний фактор та нейтрин), паратиреоїдного гормону, релаксину, секретину, соматомедину, інсуліноподібного фактора росту, гормону кори надниркових залоз, глюкагону, інсулінотропних пептидів, включаючи глюкагоноподібний пептид1 та ексендин-4, інкретини, які виділяються в кишечнику, адипоцитів, включаючи лептони та ефективні для метаболічного синдрому нейроцитокіни, холецистокініну, панкреатичних поліпептидів, пептидів, які вивільнюють гастрин, фактора вивільнення кортикотропіну, тиреотропного гормону, автотаксину, лактоферину, міостатину, рецептора, рецепторного антагоністу, антигену клітинної поверхні, моноклональних антитіл, поліклональних антитіл, фрагментів антитіл та вакцинного антигену вірусного походження. 17. Кон'югат з лікарським засобом за п. 15, в якому лікарський засіб є колонієстимулюючим фактором гранулоцитів. 18. Кон'югат з лікарським засобом за п. 15, в якому лінкер є непептидильним полімером. 19. Кон'югат з лікарським засобом за п. 18, в якому непептидильний полімер має 2 або 3 хімічно активні кінці. 20. Фармацевтична композиція, яка містить кон'югат за п. 15. 21. Носій лікарського засобу, який містить модифікований фрагмент Fc-ділянки IgG4, що містить модифіковану шарнірну ділянку, в якому частину такої шарнірної ділянки, представленої наступною амінокислотною послідовністю, видалено делецією з утворенням лише одного цистеїнового залишку: Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys-Pro-Ser-Cys-Pro, та в якому не відбувається реакція обміну ланцюгів та утворення мономерів in vivo. 26 UA 115906 C2 27 UA 115906 C2 Комп’ютерна верстка Л. Бурлак Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 28
ДивитисяДодаткова інформація
Назва патенту англійськоюIgg4 fc fragment comprising modified hinge region
Автори англійськоюJung, Sung Youb, Huh, Yong Ho, Park, Sung Hee, Lee, Jong Soo, Choi, In Young
Автори російськоюЧун Сун Юб, Хух Йон Хо, Парк Сон Хи, Ли Чон Су, Чхой Ин Йон
МПК / Мітки
МПК: A61K 47/42, C12N 15/13, C12N 15/63, C07K 7/08
Мітки: fc-фрагмент, ділянку, імуноглобуліну, igg4, модифіковану, шарнірну, має
Код посилання
<a href="https://ua.patents.su/30-115906-fc-fragment-imunoglobulinu-igg4-yakijj-maeh-modifikovanu-sharnirnu-dilyanku.html" target="_blank" rel="follow" title="База патентів України">Fc-фрагмент імуноглобуліну igg4, який має модифіковану шарнірну ділянку</a>
Попередній патент: Оптопара
Наступний патент: Установка для гарячого покриття зануренням металевої смуги, яка містить регульований ізолюючий відсік
Випадковий патент: Спосіб одержання фармацевтичної композиції на основі ципрофлоксацину гідрохлориду і дексаметазону для застосування в офтальмологічній та отологічній практиці