Спосіб активації гена, що в нормі транскрипційно мовчить, з геному еукаріотичної клітинної лінії, спосіб модифікації характеристик експресії гена з геному еукаріотичної клітинної лінії, диференційована еукаріот
Формула / Реферат
1. Способ активации транскрипционно молчащего в норме гена из генома эукариотической клеточной линии и экспрессии продукта указанного гена, предусматривающий:
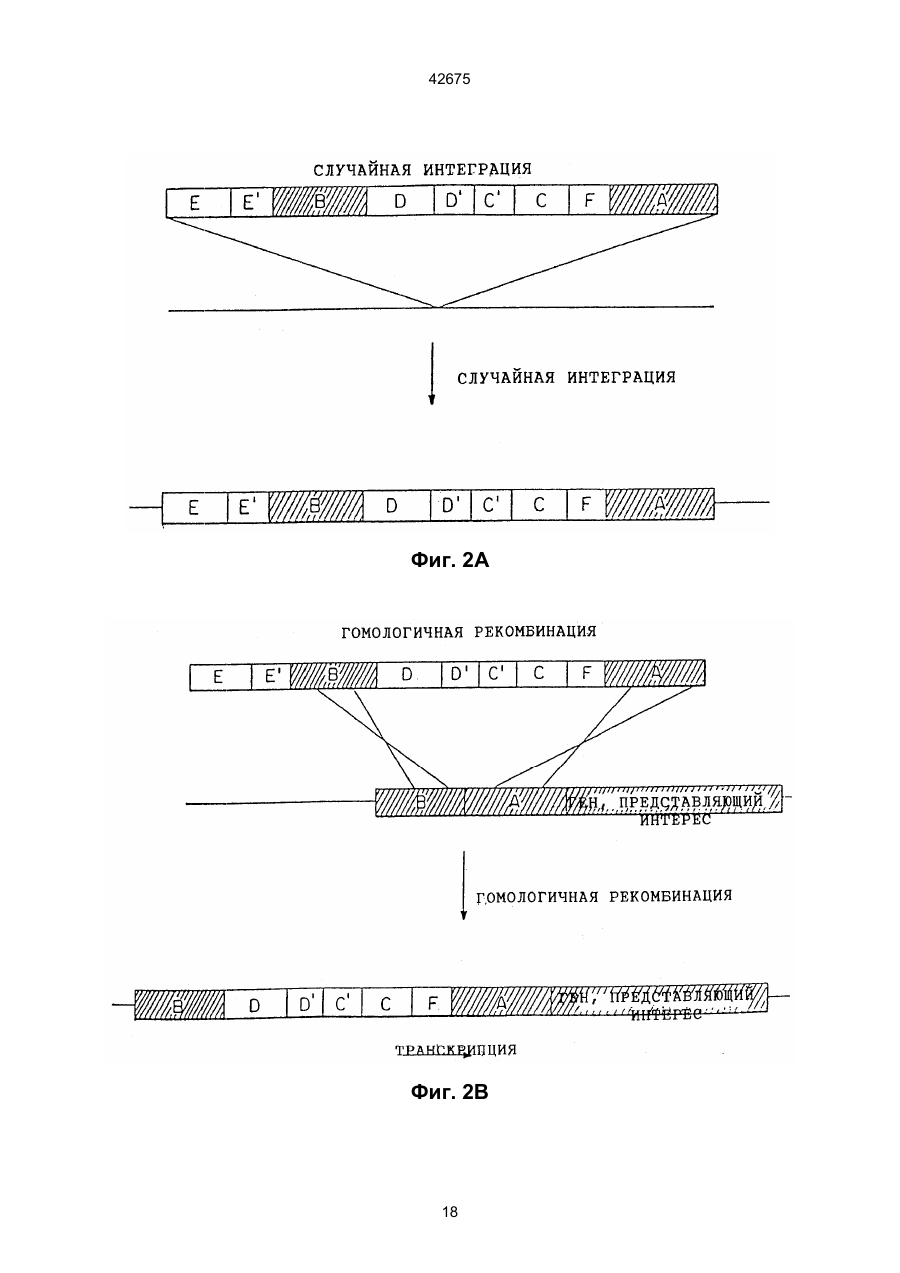
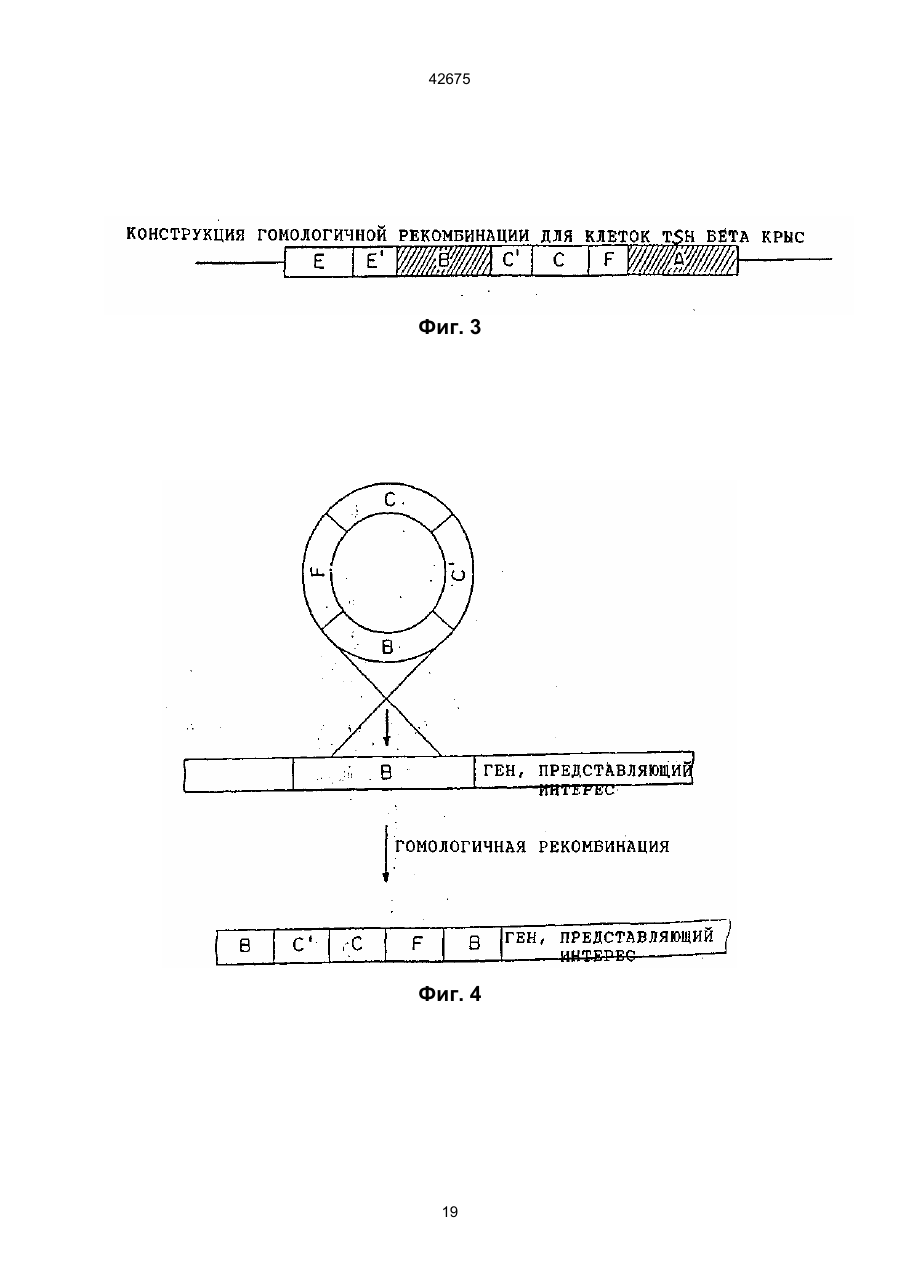
(а) встраивание ДНК-конструкта в указанный геном путем гомологичной рекомбинации, отличающийся тем, что указанный ДНК-конструкт включает регуляторний сегмент ДНК, способный стимулировать экспрессию указанного гена, будучи оперативно связан с ним, и направляющий сегмент ДНК, гомологичный области указанного генома, находящейся в пределах или поблизости от указанного гена, где указанный конструкт встраивают таким образом, что указанный регуляторний сегмент оперативно связан с указанным интересующим геном;
(б) культивирование клеточной линии в условиях, обеспечивающих экспрессию указанного генного продукта; и
(с) сбор указанного генного продукта.
2. Способ по п. 1, отличающийся тем, что указанный ДНК-конструкт содержит экспрессируемый амплифицируемый ген, способный амплифицировать указанный интересующий ген, будучи встроен достаточно близко к нему, где указанный конструкт встраивают таким образом, что указанный амплифицируемый ген находится достаточно близко к указанному интересующему гену, чтобы вызвать его амплификацию при амплификации указанного амплифицируемого гена.
3. Способ по п. 2, отличающийся тем, что указанный ДНК-конструкт дополнительно содержит, по крайней мере, один экспрессируемый селективный маркерный ген, расположенный таким образом, чтобы встраиваться с указанным экспрессируемым амплифицируемым геном.
4. Способ по любому из пп. 1, 2, 3, отличающийся тем, что указанный ДНК-конструкт содержит два направляющих сегмента ДНК, каждый из которых гомологичен области указанного генома, находящейся в пределах или поблизости от указанного гена, причем один из указанных направляющих сегментов располагается выше указанного регуляторного сегмента, а другой указанный направляющий сегмент располагается выше указанного регуляторного сегмента.
5. Способ по любому из пп. 1, 2, отличающийся тем, что указанный ДНК-конструкт дополнительно содержит, по крайней мере, один экспрессируемый селективный маркерный ген, расположенный таким образом, чтобы встраиваться с указанным регуляторним сегментом.
6. Способ по любому из пп. 1, 2, 3, 4, 5, отличающийся тем, что указанный ДНК-конструкт дополнительно содержит отрицательно селективный маркерный ген, расположенный по отношению к указанному направляющему сегменту таким образом, чтобы не встраиваться, когда указанный конструкт надлежащим образом встраивается путем гомологичной рекомбинации, в результате чего указанный отрицательно селективный маркер не экспрессируется в клетках, в которые надлежащим образом встроен указанный ДНК-конструкт.
7. Способ по любому из пп. 1, 2, 3, 4, 5, 6, отличающийся тем, что указанная клеточная линия представляет собой клеточную линию животного.
8. Способ по любому из пп. 1, 2, 3, 4, 5, 6, отличающийся тем, что указанная клеточная линия представляет собой клеточную линию млекопитающего.
9. Способ по любому из пп. 1, 2, 3, 4, 5, 6, отличающийся тем, что указанная клеточная линия представляет собой клеточную линию растения.
10. Способ по п. 5, дополнительно предусматривающий для индукции экспрессии указанного генного продукта стадию отбора клонов указанной клеточной линии, которые экспрессируют продукт указанного селективного маркерного гена, следующую за указанной стадией встраивания.
11. Способ по п. 10, отличающийся тем, что указанный селективный маркерный ген представляет собой ген устойчивости к неомицину, а указанная стадия отбора включает отбор таких клонов, обладающих устойчивостью к неомицину.
12. Способ по п. 10 или 11, отличающийся тем, что указанный ДНК-конструкт дополнительно содержит отрицательно селективный маркерный ген, расположенный по отношению к указанному направляющему сегменту таким образом, чтобы не встраиваться, когда указанный конструкт надлежащим образом встраивается путем гомологичной рекомбинации, в результате чего указанный отрицательно селективный маркер не экспрессируется в клетках, в которые надлежащим образом встроен указанный ДНК-конструкт, а указанная стадия отбора включает отбор таких клонов, которые не экспрессируют указанный отрицательно селективный маркерный ген.
13. Способ по п. 12, отличающийся тем, что указанный отрицательно селективный маркерный ген представляет собой ген тимидинкиназы вируса простого герпеса, а указанная стадия отбора включает отбор таких клонов, которые выжили в среде, которую не переносят клетки, которые экспрессируют указанный ген.
14. Способ модификации характеристик экспрессии гена из генома эукариотической клеточной линии и экспрессии продукта указанного гена, предусматривающий:
(а) встраивание ДНК-конструкта в указанный геном путем гомологичной рекомбинации, отличающийся тем, что указанный ДНК-конструкт включает регуляторный сегмент ДНК, способный модифицировать характеристики экспрессии указанного гена, будучи оперативно связан с ним, по сравнению с его существующим регуляторным сегментом ДНК, и направляющий сегмент ДНК, гомологичный области указанного генома, находящейся в пределах или поблизости от указанного гена, где указанный конструкт встраивают таким образом, что указанный регуляторный сегмент оперативно связан с указанным интересующим геном;
(б) культивирование клеточной линии в условиях, обеспечивающих экспрессию указанного генного продукта; и
(с) сбор указанного генного продукта.
15. Способ по п. 14, отличающийся тем, что указанный ДНК-конструкт содержит экспрессируемый амплифицируемый ген, способный амплифицировать указанный интересующий ген, будучи встроен достаточно близко к нему, где указанный конструкт встраивают таким образом, что указанный амплифицируемый ген находится достаточно близко к указанному интересующему гену, чтобы вызвать его амплификацию при амплификации указанного амплифицируемого гена.
16. Способ по п. 15, отличающийся тем, что указанный ДНК-конструкт дополнительно содержит, по крайней мере, один экспрессируемый селективный маркерный ген, расположенный таким образом, чтобы встраиваться с указанным экспрессируемым амплифицируемым геном.
17. Способ по любому из пп. 14, 15, 16, отличающийся тем, что указанный ДНК-конструкт содержит два направляющих сегмента ДНК, каждый из которых гомологичен области указанного генома, находящейся в пределах или поблизости от указанного гена, причем один из указанных направляющих сегментов располагается выше указанного регуляторного сегмента, а другой указанный направляющий сегмент располагается выше указанного регуляторного сегмента.
18. Способ по любому из пп. 14, 15, отличающийся тем, что указанный ДНК-конструкт дополнительно содержит, по крайней мере, один экспрессируемый селективный маркерный ген, расположенный таким образом, чтобы встраиваться с указанным регуляторным сегментом.
19. Способ по любому из пп. 14, 15, 16, 17, 18, отличающийся тем, что указанный ДНК-конструкт дополнительно содержит отрицательно селективный маркерный ген, расположенный по отношению к указанному направляющему сегменту таким образом, чтобы не встраиваться, когда указанный конструкт надлежащим образом встраивается путем гомологичной рекомбинации, в результате чего указанный отрицательно селективный маркер не экспрессируется в клетках, в которые надлежащим образом встроен указанный ДНК-конструкт.
20. Способ по любому из пп. 14, 15, 16, 17, 18, 19, отличающийся тем, что указанная клеточная линия представляет собой клеточную линию животного.
21. Способ по любому из пп. 14, 15, 16, 17, 18, 19, отличающийся тем, что указанная клеточная линия представляет собой клеточную линию млекопитающего.
22. Способ по любому из пп. 14, 15, 16, 17, 18, 19, отличающийся тем, что указанная клеточная линия представляет собой клеточную линию растения.
23. Способ по п. 18, дополнительно предусматривающий для индукции экспрессии указанного генного продукта стадию отбора клонов указанной клеточной линии, которые экспрессируют продукт указанного селективного маркерного гена, следующую за указанной стадией встраивания.
24. Способ по п. 23, отличающийся тем, что указанный селективный маркерный ген представляет собой ген устойчивости к неомицину, а указанная стадия отбора включает отбор таких клонов, обладающих устойчивостью к неомицину.
25. Способ по п. 23 или 24, отличающийся тем, что указанный ДНК-конструкт дополнительно содержит отрицательно селективный маркерный ген, расположенный по отношению к указанному направляющему сегменту таким образом, чтобы не встраиваться, когда указанный конструкт надлежащим образом встраивается путем гомологичной рекомбинации, в результате чего указанный отрицательно селективный маркер не экспрессируется в клетках, в которые надлежащим образом встроен указанный ДНК-конструкт, а указанная стадия отбора включает отбор таких клонов, которые не экспрессируют указанный отрицательно селективный маркерный ген.
26. Способ по п. 25, отличающийся тем, что указанный отрицательно селективный маркерный ген представляет собой ген тимидинкиназы вируса простого герпеса, а указанная стадия отбора включает отбор таких клонов, которые выжили в среде, которую не переносят клетки, которые экспрессируют указанный ген.
27. Дифференцированная эукариотическая клеточная линия, способная экспрессировать продукт транскрипционно молчащего в норме гена в геноме указанной клеточной линии, отличающаяся тем, что указанный геном содержит встроенный экзогенный регуляторный сегмент ДНК, оперативно связанный с указанным транскрипционно молчащим в норме геном, причем указанный регуляторный сегмент ДНК способен стимулировать экспрессию генного продукта указанной клеточной линией.
28. Клеточная линия по п. 27, отличающаяся тем, что указанный регуляторный сегмент ДНК представляет собой сегмент, способный стимулировать экспрессию генного продукта, в норме экспрессируемого указанной клеточной линией.
29. Клеточная линия по п. 28, отличающаяся тем, что встроенный регуляторный сегмент ДНК является частью ДНК-конструкта, содержащего указанный регуляторный сегмент ДНК и, по крайней мере, один селективный маркерный ген.
30. Клеточная линия по п. 29, отличающаяся тем, что указанный ДНК-конструкт дополнительно содержит амплифицируемый ген.
31. Дифференцированная эукариотическая клеточная линия, способная модифицированно экспрессировать генный продукт по сравнению с клеточной линией, из которой она происходит, отличающаяся тем, что указанный генный продукт представляет собой продукт экспрессии эндогенного гена из генома указанной клетки, причем указанный геном содержит встроенный оперативным образом в непосредственной близости указанного эндогенного гена или рядом с ним экзогенный регуляторный сегмент ДНК и необязательно амплифицируемый ген, способные модифицировать экспрессию указанного генного продукта указанной клеточной линией.
32. Клеточная линия по п. 31, отличающаяся тем, что указанный регуляторный сегмент ДНК представляет собой сегмент, способный стимулировать экспрессию генного продукта, в норме экспрессируемого указанной клеточной линией.
33. Клеточная линия по п. 32, отличающаяся тем, что встроенный регуляторный сегмент ДНК является частью ДНК-конструкта, содержащего указанный регуляторный сегмент ДНК и, по крайней мере, один селективный маркерный ген.
34. Клеточная линия по п. 33, отличающаяся тем, что указанный ДНК-конструкт дополнительно содержит амплифицируемый ген.
35. ДНК-конструкт для встраивания в предварительно определенную клеточную линию, содержащий регуляторный сегмент ДНК, способный модифицировать характеристики экспрессии предварительно определенного гена в линии клеток-хозяев, будучи оперативно связан с ним, и направляющий сегмент ДНК, гомологичный области указанного генома, находящейся в пределах или поблизости от указанного предварительно определенного гена линии клеток-хозяев, причем регуляторный сегмент ДНК отличен от такового, связанного с предварительно определенным геном в природе, и указанный регуляторный сегмент ДНК способен стимулировать экспрессию генного продукта, в норме экспрессируемого указанной клеточной линией.
Текст
1. Способ активации транскрипционно молчащего в норме гена из генома эукариотической клеточной линии и экспрессии продукта указанного гена, предусматривающий: (а) встраивание ДНК-конструкта в указанный геном путем гомологичной рекомбинации, отличающийся тем, что указанный ДНК-конструкт включает регуляторный сегмент ДНК, способный стимулировать экспрессию указанного гена, будучи оперативно связан с ним, и направляющий сегмент ДНК, гомологичный области указанного генома, находящейся в пределах или поблизости от указанного гена, где указанный конструкт встраивают таким образом, что указанный регуляторный сегмент оперативно связан с указанным интересующим геном; (б) культивирование клеточной линии в условиях, обеспечивающих экспрессию указанного генного продукта; и (с) сбор указанного генного продукта. 2. Способ по п. 1, отличающийся тем, что указанный ДНК-конструкт содержит экспрессируемый амплифицируемый ген, способный амплифицировать указанный интересующий ген, будучи встроен достаточно близко к нему, где указанный конструкт встраивают таким образом, что указанный амплифицируемый ген находится достаточно близко к указанному интересующему гену, чтобы вызвать его амплификацию при амплификации указанного амплифицируемого гена. 3. Способ по п. 2, отличающийся тем, что указанный ДНК-конструкт дополнительно содержит, по C2 (54) СПОСІБ АКТИВАЦІЇ ГЕНА, ЩО В НОРМІ ТРАНСКРИПЦІЙНО МОВЧИТЬ, З ГЕНОМУ ЕУКАРІОТИЧНОЇ КЛІТИННОЇ ЛІНІЇ, СПОСІБ МОДИФІКАЦІЇ ХАРАКТЕРИСТИК ЕКСПРЕСІЇ ГЕНА З ГЕНОМУ ЕУКАРІОТИЧНОЇ КЛІТИННОЇ ЛІНІЇ, ДИФЕРЕНЦІЙОВАНА ЕУКАРІОТИЧНА КЛІТИННА ЛІНІЯ (ВАРІАНТИ), ДНККОНСТРУКТ 42675 11. Способ по п. 10, отличающийся тем, что указанный селективный маркерный ген представляет собой ген устойчивости к неомицину, а указанная стадия отбора включает отбор таких клонов, обладающих устойчивостью к неомицину. 12. Способ по п. 10 или 11, отличающийся тем, что указанный ДНК-конструкт дополнительно содержит отрицательно селективный маркерный ген, расположенный по отношению к указанному направляющему сегменту таким образом, чтобы не встраиваться, когда указанный конструкт надлежащим образом встраивается путем гомологичной рекомбинации, в результате чего указанный отрицательно селективный маркер не экспрессируется в клетках, в которые надлежащим образом встроен указанный ДНК-конструкт, а указанная стадия отбора включает отбор таких клонов, которые не экспрессируют указанный отрицательно селективный маркерный ген. 13. Способ по п. 12, отличающийся тем, что указанный отрицательно селективный маркерный ген представляет собой ген тимидинкиназы вируса простого герпеса, а указанная стадия отбора включает отбор таких клонов, которые выжили в среде, которую не переносят клетки, которые экспрессируют указанный ген. 14. Способ модификации характеристик экспрессии гена из генома эукариотической клеточной линии и экспрессии продукта указанного гена, предусматривающий: (а) встраивание ДНК-конструкта в указанный геном путем гомологичной рекомбинации, отличающийся тем, что указанный ДНК-конструкт включает регуляторный сегмент ДНК, способный модифицировать характеристики экспрессии указанного гена, будучи оперативно связан с ним, по сравнению с его существующим регуляторным сегментом ДНК, и направляющий сегмент ДНК, гомологичный области указанного генома, находящейся в пределах или поблизости от указанного гена, где указанный конструкт встраивают таким образом, что указанный регуляторный сегмент оперативно связан с указанным интересующим геном; (б) культивирование клеточной линии в условиях, обеспечивающих экспрессию указанного генного продукта; и (с) сбор указанного генного продукта. 15. Способ по п. 14, отличающийся тем, что указанный ДНК-конструкт содержит экспрессируемый амплифицируемый ген, способный амплифицировать указанный интересующий ген, будучи встроен достаточно близко к нему, где указанный конструкт встраивают таким образом, что указанный амплифицируемый ген находится достаточно близко к указанному интересующему гену, чтобы вызвать его амплификацию при амплификации указанного амплифицируемого гена. 16. Способ по п. 15, отличающийся тем, что указанный ДНК-конструкт дополнительно содержит, по крайней мере, один экспрессируемый селективный маркерный ген, расположенный таким образом, чтобы встраиваться с указанным экспрессируемым амплифицируемым геном. 17. Способ по любому из пп. 14, 15, 16, отличающийся тем, что указанный ДНК-конструкт содержит два направляющих сегмента ДНК, каждый из которых гомологичен области указанного генома, находящейся в пределах или поблизости от указанного гена, причем один из указанных направляющих сегментов располагается выше указанного регуляторного сегмента, а другой указанный направляющий сегмент располагается выше указанного регуляторного сегмента. 18. Способ по любому из пп. 14, 15, отличающийся тем, что указанный ДНК-конструкт дополнительно содержит, по крайней мере, один экспрессируемый селективный маркерный ген, расположенный таким образом, чтобы встраиваться с указанным регуляторным сегментом. 19. Способ по любому из пп. 14, 15, 16, 17, 18, отличающийся тем, что указанный ДНК-конструкт дополнительно содержит отрицательно селективный маркерный ген, расположенный по отношению к указанному направляющему сегменту таким образом, чтобы не встраиваться, когда указанный конструкт надлежащим образом встраивается путем гомологичной рекомбинации, в результате чего указанный отрицательно селективный маркер не экспрессируется в клетках, в которые надлежащим образом встроен указанный ДНК-конструкт. 20. Способ по любому из пп. 14, 15, 16, 17, 18, 19, отличающийся тем, что указанная клеточная линия представляет собой клеточную линию животного. 21. Способ по любому из пп. 14, 15, 16, 17, 18, 19, отличающийся тем, что указанная клеточная линия представляет собой клеточную линию млекопитающего. 22. Способ по любому из пп. 14, 15, 16, 17, 18, 19, отличающийся тем, что указанная клеточная линия представляет собой клеточную линию растения. 23. Способ по п. 18, дополнительно предусматривающий для индукции экспрессии указанного генного продукта стадию отбора клонов указанной клеточной линии, которые экспрессируют продукт указанного селективного маркерного гена, следующую за указанной стадией встраивания. 24. Способ по п. 23, отличающийся тем, что указанный селективный маркерный ген представляет собой ген устойчивости к неомицину, а указанная стадия отбора включает отбор таких клонов, обладающих устойчивостью к неомицину. 25. Способ по п. 23 или 24, отличающийся тем, что указанный ДНК-конструкт дополнительно содержит отрицательно селективный маркерный ген, расположенный по отношению к указанному направляющему сегменту таким образом, чтобы не встраиваться, когда указанный конструкт надлежащим образом встраивается путем гомологичной рекомбинации, в результате чего указанный отрицательно селективный маркер не экспрессируется в клетках, в которые надлежащим образом встроен указанный ДНК-конструкт, а указанная стадия отбора включает отбор таких клонов, которые не экспрессируют указанный отрицательно селективный маркерный ген. 26. Способ по п. 25, отличающийся тем, что указанный отрицательно селективный маркерный ген представляет собой ген тимидинкиназы вируса простого герпеса, а указанная стадия отбора включает отбор таких клонов, которые выжили в 2 42675 среде, которую не переносят клетки, которые экспрессируют указанный ген. 27. Дифференцированная эукариотическая клеточная линия, способная экспрессировать продукт транскрипционно молчащего в норме гена в геноме указанной клеточной линии, отличающаяся тем, что указанный геном содержит встроенный экзогенный регуляторный сегмент ДНК, оперативно связанный с указанным транскрипционно молчащим в норме геном, причем указанный регуляторный сегмент ДНК способен стимулировать экспрессию генного продукта указанной клеточной линией. 28. Клеточная линия по п. 27, отличающаяся тем, что указанный регуляторный сегмент ДНК представляет собой сегмент, способный стимулировать экспрессию генного продукта, в норме экспрессируемого указанной клеточной линией. 29. Клеточная линия по п. 28, отличающаяся тем, что встроенный регуляторный сегмент ДНК является частью ДНК-конструкта, содержащего указанный регуляторный сегмент ДНК и, по крайней мере, один селективный маркерный ген. 30. Клеточная линия по п. 29, отличающаяся тем, что указанный ДНК-конструкт дополнительно содержит амплифицируемый ген. 31. Дифференцированная эукариотическая клеточная линия, способная модифицированно экспрессировать генный продукт по сравнению с клеточной линией, из которой она происходит, отличающаяся тем, что указанный генный продукт представляет собой продукт экспрессии эндогенного гена из генома указанной клетки, причем указанный геном содержит встроенный оперативным образом в непосредственной близости указанного эндогенного гена или рядом с ним экзогенный регуляторный сегмент ДНК и необязательно амплифицируемый ген, способные модифицировать экспрессию указанного генного продукта указанной клеточной линией. 32. Клеточная линия по п. 31, отличающаяся тем, что указанный регуляторный сегмент ДНК представляет собой сегмент, способный стимулировать экспрессию генного продукта, в норме экспрессируемого указанной клеточной линией. 33. Клеточная линия по п. 32, отличающаяся тем, что встроенный регуляторный сегмент ДНК является частью ДНК-конструкта, содержащего указанный регуляторный сегмент ДНК и, по крайней мере, один селективный маркерный ген. 34. Клеточная линия по п. 33, отличающаяся тем, что указанный ДНК-конструкт дополнительно содержит амплифицируемый ген. 35. ДНК-конструкт для встраивания в предварительно определенную клеточную линию, содержащий регуляторный сегмент ДНК, способный модифицировать характеристики экспрессии предварительно определенного гена в линии клеток-хозяев, будучи оперативно связан с ним, и направляющий сегмент ДНК, гомологичный области указанного генома, находящейся в пределах или поблизости от указанного предварительно определенного гена линии клеток-хозяев, причем регуляторный сегмент ДНК отличен от такового, связанного с предварительно определенным геном в природе, и указанный регуляторный сегмент ДНК способен стимулировать экспрессию генного продукта, в норме экспрессируемого указанной клеточной линией. Изобретение касается процесса модификации характеристик экспрессии гена, который в естественном состоянии присутствует в геноме стабильной клеточной линии или клонируемого микроорганизма. Еще лучше сказать, что изобретение касается процесса активации и экспрессии гена, который представлен в стабильной клеточной линии и в норме является транскрипционно молчащим или инертным. В результате, белковый продукт такого гена экспрессируется. Этот феномен осуществляется без трансфекции клетки ДНК, которая кодирует продукт. Скорее, постоянный ген, кодирующий желаемый продукт, идентифицируется в клетке и активируется путем встраивания соответствующего регуляторного сегмента в результате применения метода гомологичной рекомбинации. Позитивные и/или негативные селективные маркеры также могут быть встроены для более эффективного отбора клеток, в которых осуществилась соответствующая гомологичная рекомбинация. Кроме того, специфический ген можно усилить с целью увеличения скорости экспрессии, независимо от того, является ли этот ген в норме транскрипционно "молчащим" и активирован с помощью метода данного изобретения, или же экспрессия продукта выполняется эндогенно. Хорошо известно, что каждая клетка организма содержит генетическую информацию, кодирующую все белки, свойственные данному организму. Однако, только очень небольшой процент генов, представленных в соответствующем типе клеток, транскрибируется в данный момент. В настоящее время выяснены внутриклеточные механизмы, регулирующие порядок генов при транскрипции. Специфические белки клеток, присутствующие в ядрах, вступают во взаимодействие с регуляторними сегментами ДНК, которые сцеплены с определенными генами. Взаимодействие ядерных белков с последовательностями ДНК, несущими регуляторную функцию, необходимо для генной транскрипции, которая приводит к биосинтезу мРНК, и в качестве конечного результата, и экспрессии кодируемого белка (Mitchell и Tjian, Science, 245:371, 1989). Эти регуляторные сегменты или элементы ДНК для каждого гена лежат "против течения" или, в некоторых случаях, "по течению" или в пределах кодирующих областей. Благодаря взаимодействию со специфическими ядерными белками клетки регуляторные сегменты ДНК оказывают влияние на способность РНК-полимеразы, фермента, определяющего скорость экспрессии белков, получать доступ к гену и инициировать синтез мРНК транскрипта. Таким образом, указанные сегменты ДНК и соответствующие ядерные белки играют важную роль в регуляции экспрессии специфических генов (Johnson и MсKnight, Ann. Rev. Biochem., 68:799, 1989). ДНК регуляторные сегменты представляют собой сайты ДНК, к которым присоединяются ядер 3 42675 ные белки. При этом они, очевидно, таким образом изменяют структуру ДНК, что нужный в данном случае ген становится доступным для узнавания РНК-полимеразой, которая участвует в генной транскрипции. Экспрессия этих, специфических для клеток, регуляторних белков определяет, какие именно гены будут транскрибироваться в клетке и с какой скоростью будет осуществляться экспрессия. В качестве примера специфичности такой системы можно привести клетки гипофиза, в которых, в отличие от клеток печени, осуществляется экспрессия гипофизарных белков, хотя гены этих белков представлены также во всех печеночных клетках. Однако, ядра последних не содержат специфических, связывающихся с ДНК белков, которые бы вступали во взаимодействие с сегментами гипофизарных генов, присутствующими в клетках печени. Современные методы, применяемые для экспрессии белков, с использованием рекомбинантной ДНК. Основываясь на данных, что для активации генной транскрипции в определенных типах клеток требуется участие специфических регуляторных последовательностей ДНК, ученые выполняли экспрессию чужеродных генов путем методов генной инженерии. Обычно, регуляторные сегменты ДНК, которые узнаются ядерными белками клетки, располагаются "против течения" от кодирующей области чужеродного гена, экспрессия которого должна быть осуществлена. И, таким образом, после встраивания в клетку чужеродной ДНК может быть осуществлена ее экспрессия, поскольку ядерные регуляторные белки клетки теперь способны узнавать соответствующие регуляторные последовательности ДНК. Эта технология была применена для получения белков, выделение и очистка которых из природных источников при использовании традиционных методов очистки связана с определенными трудностями. В добавление к узнаваемым последовательностям ДНК и нужному гену к ДНК конструкции еще присоединяют выбранный маркер. Таким образом, только клетки, в геном которых включилась ДНК, выживают после культивирования в избирательной среде. Например, в вектор экспрессии может быть включен ген устойчивости к неомицину. После трансфекции клетки культивируют в G418 с антибиотиком неомицином, который летален по отношению к клеткам млекопитающих. Однако, если клетки получили ген резистентности к неомицину, то они способны противостоять токсическим эффектам препарата. Таким образом, в культуре переживают только те клетки, которые приобрели трансфекционную ДНК. Понятно, что любой селективный маркер можно использовать до тех пор, пока он обеспечивает отбор клеток, которые получили трансфекционную ДНК. Кроме того, естественно, не имеется каких-либо ограничений относительно спефицической локализации встраимого генетического материала в клетке. Только важно, чтобы этот материал был включен в пределах ядер, так как и регуляторный сегмент, и чужеродный ген (как и селективный маркер) встраиваются вместе. Хотя выше указанные методы в своей основе включают достижения генной инженерии, они не всегда достаточно эффективны для экспрессии ге нов. Это обусловлено тем фактом, что встраивание ДНК в ядра клеточной линии выполняется обычно путем, так называемой трансфекции. ДНК, предназначенная для генно-инженерной обработки с целью экспрессии в необходимой клеточной линии, осаждается, и клеточная мембрана растворяется, чтобы ДНК могла проникнуть в клетку. Как сказано выше, никогда нельзя предугадать точное место включения ДНК; действительно, она может остаться в эписомальной области (без интеграции в геном). Это приводит к непредсказуемости как уровня экспрессии продуцируемого белка, так и стабильности клеточной линии. Второй недостаток указанной выше техники связан с крайней трудностью конструирования вектора экспрессии в том случае, когда нужный ген имеет относительно крупные размеры (больше 510 килобаз/кб). Многие из белков, экспрессия которых осуществляется путем технологии рекомбинантной ДНК, кодировались скорее кДНК, чем более крупными геномными клонами, что обеспечивает снижение общего размера вставок. Поскольку использование кДНК делает применение генной инженерии более удобным, то, в результате, могут пострадать скорость генной транскрипции и продукции белка. В последнее время показано, что иногда уровни экспрессии в значительной степени повышены благодаря использованию скорее геномных, чем кДНК вставок (Вrinster с соавт., Proc. Nath. Acad. Sсі., 05:836-840, 1988; Сhung, Реrrу, Mol. Cell. Biol, 9:2075-2082, 1989). Хотя механизмы, ответственные за выше указанный феномен, еще не совсем понятны, однако известно, что в определенных условиях усиливающие элементы, представленные в интронах, могут повышать эффективность генной транскрипции. Имеется целый ряд данных, согласно которым интроны или связанные с ними события могут оказывать влияние на процессинг РНК после инициации транскрипции (Buchman, Bеrg, Mol. Cell. Biol., 8:4395-4405, 1985). Это может привести к стабилизации транскрипта и, таким образом, к повышению скорости накопления мРНК. В выше указанном сообщении также предполагается, что положение интронов внутри гена может иметь значение для "фазирования" нуклеосом относительно промотора. Влияние различных регуляторных элементов на транскрипцию генов эукариот обсуждается у Кhоury c cоавт., Cell. 33:313-314 (1983), Maniatis с соавт., Scienсе, 236:1237-45 (1987) и Мuller с соавт., Eur. J. Biochem., 176:485-95 (1988). В-третьих, трансфекционная ДНК, включающая полную кодирующую область чужеродного гена, чтобы проникнуть в ядро, должна пересечь цитоплазму после прохождения через проницаемую плазменную мембрану клетки. В течение этого времени возможен контакт ДНК с лизосомальными ферментами, которые могут изменять или полностью разрушать ее целостность. Поэтому, кодирующая область ДНК не может быть идентичной всей ДНК, подвергаемой трансфекции. Новый метод активации генов и/пли модификации экспрессии, который мы описываем ниже, не может приводить к получению мутантных форм нужного белка, так как кодирующая область гена этого белка не подвергается модификациям со стороны ферментов. 4 42675 В качестве резюме, при использовании традиционных методов не может с точностью транскрибироваться большое количество трансфектируемой в клетку ДНК, и особенно ее кодирующей части. Перед проникновением в ядро, она может быть подвергнута разрушающему действию ферментов и, в связи с этим, потеряет способность кодировать нужный белок, или же она может не содержать какой-либо из необходимых для транскрипции регуляторных сегментов. Она может встраиваться в часть генома, которая препятствует транскрипции. Если транскрибируется кДНК, то производство нужного белка не всегда может быть эффективно, что обусловлено пропуском интронов, содержащих усилители или способных обеспечивать эффективный процессинг мРНК. И, наконец, она может оставаться на уровне эписом, обеспечивать синтез белка, но быть нестабильной в процессе роста клеточной популяции посредством деления клеток. Было бы целесообразно разработать такой метод индукции генной экспрессии, с помощью которого можно было бы получить клеточную линию и который бы заключал в себе все положительные характеристики существующих методов, но был лишен всех нежелательных, присущих им черт. Далее, было бы желательно выполнить экспрессию или модификацию эндогенной экспрессии специфических генов выбранного клеточного типа. Кроме того, было бы целесообразно использовать те выгодные возможности, которые потенциально присущи полной геномной последовательности, включающей скрытые усилители транскрипции, расположенные внутри интронов, путем соответствующего помещения интронов для надлежащего нуклеосомного фазирования или путем более эффективного процессинга мРНК. Эти преимущества обычно не используются в методах экспрессии с применением рекомбинантной ДНК, что обусловлено размерами гена. В том случае, если найти способ выполнить экспрессию гена, который уже имеется в геноме, то есть эндогенного гена, то стабильность клеточной линии и скорость экспрессии стали бы более постоянными и предсказуемыми. Основная цель изобретения заключается в оптимизации существующих методов, в частности, уменьшении количества выше указанных недостатков. Другой целью изобретения является обеспечение метода регуляции и/или усиления генной экспрессии, при этом метод включает положительные характеристики технологии рекомбинантных генов, однако, лишен ее нежелательных черт. Далее, цель изобретения заключается в обеспечении метода экспрессии специфических генов, которые представлены в геноме выбранной клеточной линии, однако, в норме являются транскрипционно "молчащими" генами. Цель изобретения также состоит в разработке метода экспрессии белков, в основу которого легли бы все преимущества полной геномной последовательности, ответственной за накопление мРНК и/или транскрипцию. Далее, целью изобретения является разработка метода модификации характеристик экспрессии нужного гена путем встраивания ДНК регуля торных сегментов и/или амплификаторных (усиливающих) сегментов в положения "против течения", в пределах или же проксимально по отношению к нативному, представляющему интерес, гену в клетках стабильной клеточной линии или клонируемого микроорганизма. Кроме того, цель изобретения состоит в том, чтобы обеспечить метод для модификации характеристик экспрессии гена, который естественно присутствует в геноме устойчивой клеточной линии или клонируемого микроорганизма, и в то же время, метод позволяет включить характеристики, которые помогут отбору определенным образом модифицированных клеток. Другой целью изобретения является получить, в данном случае, геном, который обладает проксимально к кодирующей области или экзонам нужного гена регуляторным или амплификаторным сегментом, отсутствующим в данных местах природного генома. Цель изобретения также состоит в получении конструкций ДНК, которые можно использовать в методах гомологичной рекомбинации данного изобретения. Далее, цель изобретения заключается в получении клеточных линий и микроорганизмов, содержащих геномы в соответствии с настоящим изобретением. Реализация этих и других целей изобретения осуществляется при помощи методов гомологичной рекомбинации, используя эти, общепринятые в данной области методы, можно добиться экспрессии или, предпочтительно, амплификации постоянных, хотя и транскрипционно "молчащих" генов. Применяя эту же технику, можно также модифицировать характеристики экспрессии гена, который в природе является, правда не всегда, "молчащим" или инертным и присутствует в геноме устойчивой клеточной линии. Модификация может выражаться, например, в изменении условий экспрессии, ее подавлении или, наоборот, индукции, или увеличении ее скорости. Изобретение обеспечивает метод модификации характеристик экспрессии гена в геноме клеточной линии или микроорганизма. Определенная конструкция ДНК включается в геном путем использования техники гомологичной рекомбинации. Конструкция ДНК включает регуляторный сегмент ДНК, способный к модификации характеристик экспрессии любого гена, с которым сегмент сцеплен оперативно, в клетках хозяина, представленного клеточной линией или микроорганизмом, а также улавливающий сегмент, гомологичный области генома, в которую желательно встроить ДНК регуляторный сегмент. Техника конструирования и встраивания предназначается для обеспечения оперативного сцепления нового ДНК регуляторного сегмента с нужным геном. Таким образом, осуществляется модификация характеристик экспрессии соответствующего гена без необходимости встраивания каких-либо новых кодирующих экзонов. В предпочитаемом варианте, ген является транскрипционно "молчащим" или инертным в норме в клетках хозяина: клеточной линии или микроорганизме. Посредством ДНК регуляторной области, которая встраивается путем использования техники гомологичной рекомбинации в соответст 5 42675 вующее положение по отношению к указанному гену, последний, таким образом, активируется для экспрессии своего продукта. ДНК конструкция в предпочитаемом варианте включает два улавливающих сегмента, которые располагаются близко друг к другу в нативном гене, и в то же время разделены друг от друга в конструкции ДНК теми элементами, которые встраиваются в геном. Далее, конструкция, предпочтительно, включает, по крайней мере, один экспрессируемый, селективный, маркерный ген, например, ген, обусловливающий резистентность к неомицину. Этот маркерный ген, включая его промотор, также расположен между двумя улавливающими областями конструкции. В другом случае, конструкция включает экспрессируемый ген амплификатор для усиления экспрессии нужного гена. Данный ген, включая его промотор, также располагается между двумя улавливающими областями конструкции. В некоторых случаях функции селективного маркера и гена-амплификатора может выполнять один и тот же ген. Еще один вариант изобретения состоит в том, что ДНК конструкция включает негативний, селективный, маркерный ген, не подвергающийся экспрессии в клетках, в которые надлежащим образом встроена ДНК конструкция. Этот негативный, селективный маркер расположен за пределами двух улавливающих областей, поэтому может быть удален, если конструкция правильно встраивается в геном путем гомологичной рекомбинации. Примером такого негативного, селективного маркерного гена может быть ген тимидин киназы Herpes Simplex Virus. В следующем варианте, изобретение может обеспечивать модификацию характеристик экспрессии специфического гена, продукт которого в данный момент уже экспрессируется в клеточной линии или микроорганизме, представляющих интерес для специалиста. Модификация может быть выполнена путем гомологичной рекомбинации в результате встраивания ДНК конструкции, в состав которой входят (1) экспрессируемый ген-амплификатор, обусловливающий увеличение количества копий нужного гена, в случае, если клеточная линия или микроорганизм подвержены влиянию условий усиления, и/или (2) промотор/усилитель-элемент (или другой регуляторный элемент), с помощью которого осуществляется модификация экспрессии нужного гена, например, путем повышения скорости транскрипции, повышения эффективности трансляции, увеличения накопления мРНК, обеспечения индуцибельной экспрессии и т.д. Экспрессия гена, которая модифицируется таким образом, может быть естественной или вызванной предварительными генетическими манипуляциями с клеточной линией или микроорганизмом. Такого рода манипуляция может осуществляться обычными методами или путем гомологичной рекомбинации в соответствии с изобретением. В последнем случае встраивание ДНК, приводящее к модификации характеристик экспрессии, может быть выполнено, как часть той же самой генетической манипуляции, в результате которой происходит экспрессия гена, или как последующая ступень. Изобретение также включает конструкции, приготовленные в соответствии с выше приведенным обсуждением, так же как геномы, которые должным образом подвергались гомологичной рекомбинации с использованием этих конструкций, а также клеточных линий и микроорганизмов, включающих эти геномы. Более того, изобретение также касается процесса получения нужного продукта путем культивирования трансформированных клеток в соответствии с настоящим изобретением. Фиг. 1 дает общую схему ДНК конструкции в соответствии с изобретением. Фиг. 2А представляет способ интеграции ДНК конструкции в геном в случае негомологичной или случайной рекомбинации. Фиг. 2В представляет способ интеграции ДНК конструкции в случае гомологичной рекомбинации. Фиг. 3 представляет конструкцию предпочитаемого вектора гомологичной рекомбинации в соответствии с изобретением. Фиг. 4 представляет способ интеграции кольцевого куска ДНК путем гомологичной рекомбинации в случае использования только одного улавливающего сегмента ДНК. Фиг. 5 представляет pRSVCAT плазмиду, включая ее сайты рестрикции. Фиг. 6 представляет конструкцию pRSV плазмиды, включая ее сайты рестрикции. Фиг. 7 представляет pSV2NEO плазмиду, включая ее сайты рестрикции. Фиг. 8 представляет конструкцию pSVNEOBAM плазмиды, включая ее сайты рестрикции. Фиг. 9 представляет конструкцию рSVNEO плазмиды, включая ее сайты рестрикции. Фиг. 10 представляет конструкцию pRSVCATNEO плазмиды, включая ее сайты рестрикции. Фиг. 11 представляет фрагмент 15,3 кб гена крыс ТSНb и различные сегменты рестрикции. Фиг. 12 представляет конструкцию рRSVСAТNEОTSHB3 плазмиды, включая ее сайты рестрикции. Фиг. 13 представляет конструкцию рRSVСAТNEОTSHB3-5XbaI плазмиды, включая ее сайты рестрикции. Фиг. 14 представляет часть нуклеотидной последовательности ТSНb вместе с ее участками, которым соответствуют праймары для РПЦ амплификации. Экзоны 2 и 3 указаны заглавными буквами. 247 усиливаемый фрагмент подчеркнут звездочками. Фиг. 15 представляет результаты электрофореза в полиакриламидном геле кДНК, синтезированной с помощью РНК, которая экстрагирована из различных клеточных популяций и TSHb кДНК которой, если представлена, амплифицирована путем РПЦ. Природа клеток, представляющих различные линии, указывается на фиг. 15 ниже геля. Гомологичная рекомбинация, как метод, была разработана в течение последних нескольких лет для "улавливающих" генов с целью индукции или коррекции мутаций в транскрипционно активных 6 42675 генах (Kucherlapati, Prog. in Nucl. Heid. Res. and Моl. Biol., 36:301 (1989). Данная техника гомологичной рекомбинации разработана в качестве метода для введения специфических мутаций в определенные области генома млекопитающих (Thomas et al., Сеll, 44:419-428, 1986; Thomas and Capecchi, Cell. 51:503-532, 1987; Doetschman et al., Proc. Natl. Acad, Sci., 85:8583-8587, 1988) или для коррекции специфических мутаций в пораженных генах (Doetschman et al., Nature, 330:576-578, 1987). Посредством этой техники кусок ДНК, который желательно встроить в геном, может быть помещен в специфическую область гена, интересующего исследователя, путем присоединения его к так называемой "улавливающей ДНК". Эта улавливающая ДНК комплементарна (гомологична) соответствующей области геномной ДНК. Если два гомологичных куска одноцепочечной ДНК (т.е. улавливающая и геномная ДНК) находятся в тесной близости, то они подвергаются гибридизации с образованием двухцепочечной спирали. ДНК последовательность, присоединенную к улавливающей ДНК желательно встроить в геном. Гомологичная рекомбинация может осуществляться с помощью целого ряда методов. Одним из примеров является рекомбинация, происходящая в ходе процесса репликации ДНК во время митоза в клетке. Посредством механизма, который еще не совсем понятен, родительская двухцепочечная ДНК раскручивается непосредственно перед клеточным делением на определенном участке, называемым пузырем репликации. Теперь две отдельных цепи ДНК могут служить в качестве матриц для синтеза новых цепей ДНК. Одно из плеч репликативной вилки характеризуется направленностью кода ДНК от 5' к 3' концу, которая служит соответствующей ориентацией для считывания ДНКполимеразой. Этот фермент присоединяется к 5' концу одноцепочечной ДНК и, используя цепочку в качестве матрицы, инициирует синтез цепочки комплементарной ДНК. Направленность кодирования другой родительской цепочки ДНК от 3' к 5'. Для ДНК-полимеразы считывание информации невозможно в этом направлении, и, очевидно, репликация указанной цепочки ДНК должна осуществляться посредством особого механизма. Специфический фермент РНК-праймаза присоединяется к 3'®5' цепи ДНК, обеспечивая синтез короткой затравки РНК с интервалами вдоль цепочки. Используя эти фрагменты РНК в качестве затравок, ДНК-полимераза теперь присоединяется к ДНК с затравочной РНК и обусловливает синтез комплементарного куска ДНК в направлении от 5' к 3' концу. Эти куски вновь синтезированной ДНК получили название фрагментов Оказаки. РНК затравки, которые ответственны за инициацию полной реакции, удаляются в результате экзонуклеазной активности ДНК полимеразы и замещаются ДНК. Этот процесс продолжается, пока полимераза не достигнет участка ДНК, лишенного затравочной РНК, где прекращается локальный синтез. Таким образом, хотя комплементарная родительская цепь в общем синтезируется в направлении 3'®5', фактически она формируется путем "прострочивания" от конца 5' к 3'. Какие-либо по вреждения, имеющие место в ДНК в ходе процесса "прострочивания", устраняются ферментом ДНК-лигазой. Для сохранения абсолютно точного кода ДНК ДНК-полимераза наделена функцией надежного считывания. Для синтеза новых ДНК цепей ДНКполимеразе необходимы затравочные куски ДНК. Как уже упоминалось выше, это может быть одиночная цепочка ДНК с затравочной РНК, или комплементарная цепь ДНК. Если ДНК-полимераза находит комплементарно несоответствующие куски ДНК, она может выполнять функцию экзонуклеазы и удалять ДНКоснования в направлении 3'®5', пока снова не достигнет полного соответствия. Принимая во внимание все выше сказанное, становится понятной основа описываемой здесь техники. Небольшие куски улавливающей ДНК, которые комплементарны специфической области генома, вступают в контакт с родительской цепью в ходе процесса ДНК репликации. Это основное свойство ДНК, которая встраивается в клетку для гибридизации и последующей рекомбинации с другими кусками ДНК посредством раздельных гомологичных областей. В том случае, если комплементарная цепь присоединяется к олигонуклеотиду, содержащему мутацию или другую последовательность ДНК, то он также включается во вновь синтезированную цепочку в результате рекомбинации. Вследствие функции точного считывания новая последовательность ДНК может служить в качестве матрицы. Таким образом, трансфекционная ДНК включается в геном. Если известна последовательность специфического гена, кусок ДНК, комплементарный выбранному участку гена, может быть синтезирован или получен иным путем, например, путем соответствующей рестрикции нативной ДНК в специфических сайтах узнавания, связывающих нужную область. Этот кусок будет выполнять роль улавливающего приспособления при встраивании в клетку и гибридизации со своим гомологичным участком внутри генома. Если гибридизация происходит в ходе ДНК репликации, то этот кусок и любая дополнительная, присоединенная к нему последовательность, будет функционировать в качестве фрагмента Оказаки и участвовать в процессе "прострочивания" для вновь синтезированной дочерней цепи ДНК. В методе изобретения к этим кускам улавливающей ДНК присоединяются области ДНК, которые известны как взаимодействующие с ядерными регуляторными белками, содержащимися в клетке, и, правда, необязательно, с амплификаторными и селективными маркерамн ДНК. Таким образом, экспрессия специфических белков может быть достигнута не только путем трансфекции ДНК, с кодом самого гена и маркерного гена, что обычно, но также и путем использования улавливающей ДНК (участки гомологии с нужным, эндогенным геном), связанной с ДНК регуляторными сегментами, которые обеспечивают ген сигналами узнавания для транскрипции. С помощью представленного метода возможно добиться экспрессии и амплификации любого родственного гена, представленного в клеточном типе без фактической трансфекции соответствующего гена. Кроме 7 42675 того, экспрессия этого гена контролируется скорее полной геномной ДНК, чем его частями или кДНК, тем самым обусловливая повышение скорости транскрипции и эффективности процессинга мРНК. Более того, характеристики экспрессии любого родственного гена, представленного в клеточном типе можно изменить путем соответствующего встраивания ДНК регуляторных сегментов и без встраивания целых кодирующих областей нужного гена. В соответствии с указанными аспектами изобретение непосредственно обеспечивает новые методы экспрессии генов, в норме транскрипционно молчащих, но представляющих интерес, или для модификации экспрессии эндогенно экспрессирующихся нужных генов в дифференцированной клеточной линии. Родственные геномные последовательности, экспрессию которых желательно осуществить или достичь ее модификации, обеспечиваются необходимыми последовательностями специфической клеточной ДНК (регуляторными и/или амплификаторными сегментами) для управления или модификации экспрессии гена внутри клетки. Полученная ДНК включает ДНК последовательность, кодирующую нужный белок, сцепленную оперативным путем с гетерологичными (для родственной ДНК последовательности) регуляторними и/или амплификаторными сегментами. Для повышения качества скрининга полученных клеток в конструкцию, правда необязательно, включается положительный селективный маркер. Предпочитается использование резистентного к неомицину гена, хотя может быть применен любой выбранный маркер. Могут быть также использованы, тоже необязательно, негативные селективные маркеры. Например, ген тимидин киназы Неrреs Simplex Virus (HSVtk) можно применять как маркер для выбраковки случайно интегрированных векторных ДНК. Соединенные ДНК или ДНК, экспрессия которых уже осуществляется, можно подвергнуть амплификации, если улавливающая ДНК связывается с амплификаторным маркером. Следовательно, в соответствии с методом изобретения любой ген, который в норме экспрессируется в своей линии клеток эукариот, особенно, в дифференцированной клеточной линии, можно подвергнуть экспрессии в неспецифической для него клеточной линии, где этот ген находится в "молчащем" состоянии. Это осуществляется без встраивания полной последовательности ДНК этого гена. Кроме того, указанный ген или в норме экспрессирущийся ген, можно подвергнуть амплификации с целью повышения скорости экспрессии. Делее, можно изменить характеристики экспрессии генов, которые в целом не являются транскрипционно молчащими, как, например, характеристики экспрессии генов микроорганизмов. В одном из вариантов изобретения клетки эукариот, содержащие специфический нужный ген, транскрипция которого, однако нарушена, подвергают индукции, используя описанную ниже технику. Вектор гомологичной рекомбинации, описание которого будет представлено в дальнейшем, встраивается в клональную клеточную линию и после химического отбора проверяется на продукцию специфического генного продукта путем соот ветствующих методов, таких, например, как обнаружение мРНК, транскрибируемой с вновь активированного гена, иммунологическое определение специфического генного продукта, или функциональная проба на специфический генный продукт. Общая схема конструкции ДНК, которая используется дли активирования транскрипции эндогенных генов посредством гомологичной рекомбинации, представлена на фиг. 1. Обычно, конструкция ДНК включает, по крайней мере, от двух до шести или более отдельных ДНК сегментов. Сегменты состоят из одного, предпочтительно, двух улавливающих ДНК фрагментов (А и В), гомологичных области клеточного генома, располагающейся в пределах или проксимально от нужного гена, который должен быть экспрессирован, позитивный селективный ген (С), амплификаторный ген (D), негативный селективный ген (Е) и ДНК регуляторный сегмент (F), который транскрипционно активен в клетке для трансфекции. В основном варианте изобретения должны быть представлены только единственный улавливающий сегмент (В) и регуляторний сегмент (F). Каждый из других указанных участков необязателен и обеспечивает предпочитаемые конструкции. Области А и В представлены последовательностями ДНК, гомологичными участкам эндогенного нужного гена, который должен быть активирован для транскрипции. Специфические области А и В эндогенного гена выбираются таким образом, чтобы расположение их было "против течения" или "вниз по течению" соответственно, от специфического положения, в которое желательно встроить регуляторний сегмент. И хотя в конструкции эти области разделены, в эндогенном гене они, в основном, близко расположены друг к другу. Возможны случаи, где в качестве улавливающих сегментов используются несоприкасающиеся части генома, например, где желательно устранить часть генома, такие, например, как негативный регуляторный элемент. В то время как две улавливающие области предпочтительны для целей увеличения общей области гомологии и, тем самым, повышения эффективности рекомбинации, процесс изобретения также включает применение только одной улавливающей области. В самой простой форме (когда встраиваются только регуляторный сегмент F и селективный маркерный ген С с промотором С'), применяется кольцевой кусок ДНК, который содержит эти элементы вместе с улавливающей ДНК (см. фиг. 4). Таким образом, осуществляется гибридизация гомологичной области (В) с ее геномным двойником. Сегменты С', С и F встраиваются в пределы В части родственного гена после крос-синговера. Если желательно, чтобы регуляторная ДНК последовательность была встроена против течения нужного гена, как, например, если требуется осуществить активацию и экспрессию в норме транскрипционно молчащего гена, предпочтительной является область гомологии, которая гомологична некодирующей части генома против течения от кодирующих частей нужного гена. Если присутствуют два улавливающих участка, то область по течению (А) может включать часть кодирующего участка, хотя предпочтительнее, чтобы 8 42675 он тоже был в основном против течения от кодирующей области. Наиболее предпочтительно выбирать гомологичные области таким образом, чтобы ДНК регуляторная последовательность встраивалась по течению от нативного промотора нужного гена, особенно если нативный промотор является скорее негативным промотором, чем выключенным положительным промотором. Размер областей улавливания, то есть областей гомологии, не является строго определенным, хотя чем короче эти области, тем с меньшей вероятностью они находят соответствующие гомологичные участки и включаются в рекомбинацию в желаемом месте. Таким образом, чем короче области гомологии, тем менее эффективна гомологичная рекомбинация, то есть тем ниже процент успешно рекомбинированных клонов. Предполагается, что минимум для последовательности гомологии составляет 25 пар оснований (Ayares с соавт., РNAS, США, 83:5199-5203, 1986). Более, того, если в геноме клеток хозяина также попадаются какие-либо другие элементы конструкции, то возникает возможность рекомбинации в ошибочном месте. Однако, принимая во внимание высокую степень позитивной и негативной избирательности, обеспечиваемую изобретением, можно с успехом использовать метод, даже с низкой эффективностью. Оптимальные результаты получают, если целая область гомологии, включая улавливающие области, имеет крупные размеры. До тех пор, пока регуляторный сегмент F можно оперативно связывать с нужным геном, нет предела размеру улавливающей области, и особенно области улавливания В "против течения". Можно легко определить эмпирическим путем, являются ли улавливающие области слишком крупными и расположен ли регуляторный сегмент F слишком далеко от кодирующей области гена, к которому он должен быть присоединен. В таком случае, можно получать области А и В, гомологичные различным участкам нужного гена, причем повторять процедуру до тех пор, пока регуляторный сегмент F не будет встроен должным образом, чтобы возникла действенная связь между им и нужным геном. Например, можно изменять сайт рестрикции комбинированной области А-В эндогенного гена и повторять процесс. Однажды познакомившись с концепцией изобретения и методами, описанными здесь, любой из специалистов данной области будет способен использовать настоящее изобретение в отношении нужного гена какой-либо клеточной линии или микроорганизма без выполнения несвоевременных экспериментов. Область С представляет собой позитивный селективный маркерный ген, который способен переводить трансфектируемую клеточную линию в состояние резистентности к токсическим условиям. Примерами таких генов являются гены аденозин деаминазы (ADA), аминогликозид фосфотрансферазы (heo), дигидрофолат редуктазы (DHFR), гидромицин-В-фосфотрансферазы (НРН), тимидин киназы (tk), ксантин-гуанин фосфорибозилтрансферазы (qpt), ген множественной устойчивости к лекарствам (MDR), ген резистентности к орнитин декарбоксилазе (ОDC) и N-(фосфонацетил)L-аспартату (CAD). В дополнение к позитивному селективному маркерному гену в конструкцию может быть включен, правда необязательно, амплификаторный ген в области D. К амплификаторным относятся гены, обусловливающие увеличение количества копий при соответствующем отборе. Количество копий гена, расположенного по соседству с геном-амплификатором, также будет возрастать. Амплификаторниые гены, которые можно использовать, включают: DHFR, MDR, ОDС, ADA и САD. Члены группы позитивных, селективных, маркерных генов и члены группы генов-амплификаторов перекрываются, и, теоретически, вместо двух генов, для позитивного отбора и для амплификации, можно использовать всего один ген для обеих целей. Однако, поскольку большинство клеточных линий содержат эндогенные копии выше указанных амплификаторных генов, клетки обладают уже некоторой резистентностью к условиям отбора, и, в связи с этим, могут возникнуть трудности при выявлении различий между клетками с трансфекционной ДНК и клетками, которые ее не получили. Таким образом, в примерах, где желательно использование амплификаторного гена, в конструкцию должен быть также включен ген положительной селекции, являющийся доминантным, как, например, НРН, qpt, nео и tк (tк-клетках). В некоторых случаях амплификаторный маркер возможно или предпочтительно опустить. Например, когда интересующий нас ген не нуждается в амплификации. Так, достаточно высокая транскрипционная активность, не требующая амплификации, отмечается под влиянием гетерологичной ДНК регуляторной последовательности. Также, в случае очень низкой эффективности гомологичной рекомбинации может появиться необходимость исключить амплификаторный ген, поскольку отношение негомологичной ДНК к гомологичной ДНК непосредственно связано с эффективностью гомологичной рекомбинации (Letsou, Genetics, 117:759-770, 1987). Кроме того, возможно исключить ген положительной селекции и отобрать клетки только путем скринирования на продукцию желаемого белка или мРНК. Однако, в большинстве случаев, предпочтительно включать, по крайней мере, один ген положительной селекции. Область Е конструкции представлена негативным селективным маркерным геном. Экспрессия такого гена не наблюдается в клетках, в которые путем гомологичной рекомбинации правильно встроена конструкция ДНК, однако в клетках, где конструкция ДНК встроена неправильно, выше указанный ген экспрессируется, что, например, отмечается при случайной интеграции. Одним из таких генов является ген тимидин киназы Herpes Simplex Virus (HSVtk). Гeн HSVtk обладает более низкой строгостью к нуклеотидам и способен к фосфорилированию нуклеотидных аналогов, что не свойственно для нормальных клеток млекопитающих. Если HSVtk присутствует в клетках, нуклеотидные аналоги, такие как ацикловир и ганцикловир фосфорилируются и включаются в ДНК клеток хозяина, тем самым убивая клетку. Наличие негативного селективного маркерного гена дает возможность использовать позитивно-негативный отбор для гомологичной ре 9 42675 комбинации, как описано Mansour с соавт. (Nature, 336:348-352, 1988). Сареcсhі применяет методику, в основе которой лежат преимущества определенных способов интеграции, что, например, отмечается при встраивании линейного вектора ДНК путем гомологичной рекомбинации по сравнению с его встраиванием путем случайной интеграции. Для последнего случая характерно встраивание большинства вставок через концы (Folger et al., Mol. Cell. Biol., 2:1372-1387, 1982; Roth et al. Moll. Сеll. Biol., 5:2599-2607, 1985; Thomas et al., Cell. 44:419-428, 1986). С другой стороны, если вектор встраивается путем гомологичной рекомбинации, то рекомбинация будет осуществляться посредством областей гомологии, что обуславливает потерю последовательностей за пределами указанных областей. На фиг. 2А и 2В иллюстрируется способ интеграции при гомологичной рекомбинации по сравнению со случайной интеграцией, причем в качестве примера используется конструкция, указанная на фиг. 1. В случае негомологичной рекомбинации вектор встраивается через концы конструкции (фиг. 2А). Это позволяет области Е, в данном случае ген HSVtk встраиваться в геном. Однако, при гомологичной рекомбинации (фиг. 2В) ген HSVtk теряется. Первый этап отбора использует соответствующий препарат или условия для позитивного отбора, представляемые самой конструкцией. Клетки, содержащие ДНК, интегрированную путем гомологичной рекомбинации или случайной интеграции, выживают после первого этапа отбора. Выжившие клетки затем выдерживаются с препаратом, таким как ганцикловир, который убивает все клетки, содержащие ген HSVtk. В данном случае, большинство клеток, в которых вектор интегрирован путем случайного встраивания, содержат HSVtk ген и погибают от препарата. В то же время, клетки, где вектор интегрирован путем гомологической интеграции, теряют ген HSVtk выживают. Это позволяет устранить большинство клеток, которые содержат случайно интегрированную ДНК, и сохранить большинство выживших клеток, содержащих ДНК, интегрированную в результате гомологичной рекомбинации, что в значительной степени способствует идентификации правильного процесса рекомбинации. При необходимости, может быть устранена также ступень негативного отбора, что потребует более интенсивной работы на этапе скрининга, включая необходимость применения таких методов, как реакция полимеризации цепи (РПЦ) или иммунологический скрининг. Шестая область (F) содержит ДНК регуляторный сегмент, который используется для активации транскрипции нужного гена. Соответствующий ДНК регуляторный сегмент выбирается в зависимости от используемого типа клеток. Предпочитается регуляторний сегмент, который известен, как способствующий экспрессии данного гена в дифференцированной клеточной линии хозяина. Например, если клеточная линия хозяина представлена гипофизарными клетками, в которых в естественном состоянии осуществляется экспрессия таких белков, как гормон роста и пролактин, промотор любого из генов этих белков может быть использован в качестве регуляторного элемента ДНК (F). При встраивании в соответствии с методом изобретения регуляторный сегмент оперативно связывается с транскрипционно молчащим в норме геном, нужным исследователям, и стимулирует транскрипцию и/или экспрессию указанного гена в клеточной линии хозяина. Кроме того, пригодны случайные регуляторные сегменты ДНК, которые работают в клеточных типах, такие как промотор, rous Sarcoma virus (RSV). С того момента, как регуляторный сегмент стимулирует транскрипцию и/или экспрессию, или может быть индуцирован к стимуляции транскрипции и/или экспрессии нужного гена после его встраивания в геном клеточной линии хозяина с помощью методов изобретения таким образом, что оказывается оперативно, сцепленным с нужным геном, данный регуляторный сегмент можно использовать в настоящем изобретении. При присоединении регуляторного сегмента F к улавливающему сегменту А очень важно, чтобы в последовательность не был введен случайным образом пусковой кодон, поскольку это может изменить схему считывания гена, экспрессии которого желательно добиться. И, конечно, конструкцию необходимо получить и встроить таким образом, чтобы регуляторный сегмент F оперативно соединялся с нужным геном. Присутствия ДНК регуляторного сегмента, области F, нe требуется в тех случаях, когда ген нужной клеточной линии уже находится в состоянии экспрессии и желательны только усиление или амплификация его транскрипции, поскольку указанный ген естественно экспрессируется в данной клеточной линии или же ДНК клеток этой линии уже была предварительно подвергнута манипуляциям с целью еe экспрессии. В этих примерах было бы достаточным для увеличения количества копий нужного гена и, таким образом, для увеличения общего числа транскриптов, встраивание амплифицированного гена, область D, предпочтительно с позитивным, селективным, маркерным геном, область С, и, также, но необязательно, с негативным, селективным, маркерным геном, область Е. В качестве альтернативы для дальнейшего усиления транскрипции нужного, находящегося в состоянии экспрессии гена в конструкцию может быть включен новый регуляторный сегмент, область F, врожденно способствующий повышенной (или по-другому модифицированной) скорости транскрипции по сравнению с уже существующей регуляторной областью для нужного гена. Такой новый регуляторный сегмент мог бы включать промоторы и усилители, повышающие эффективность транскрипции. Области С', D' и Е' представлены областями промоторов, используемых для инициации активности генов в областях С, D, Е, соответственно. Указанные промоторы активны в отношении транскрипции в выбранной клеточной линиии могут быть те же самые или отличаться от промотора области F, предназначенного для активации нужного эндогенного гена. Специфическое направление транскрипции, указанное на фиг. 1, не являет 10 42675 данным Thomas c соавт. (Сеll, 51:503-512, 1987). Во второй конструкции ДНК возможна замена промотора полиомы описанным выше промотором RSV. ДНК регуляторная последовательность, используемая для активации TSHb гена, может быть представлена или промотором RSV, или промотором крысиного гормона роста. Промотор крысиного гормона роста включает фрагмент Sасl-ЕсоRl, полученный из плазмиды pRGH 237 CAT (Larson c соавт., PNAS, 83:8283-8287, 1986). Промотор RSV имеет то преимущество, что может работать в клеточных линиях, кроме GН клеток, в то время как GH промотор активен в GН клетках и специфически индуцируется (Brent с соавт., J. Biol., Chem., 264:178-182, 1969). Промотор крысиного гормона роста и промотор RSV могут быть встроены в положение F в отдельных конструкциях. После трансфекции выше указанной конструкции в GН клеточную линию, клетки могут расти в среде, содержащей G418. Возможность роста приобретают те клетки, в геном которых интегрирована ДНК плазмиды путем гомологичной рекомбинации или случайной интеграции. Выживающие клетки могут расти в среде, содержащей ганцикловир. Большинство клеток, которые переживают этот этап селекции, представлено клетками, в которые интегрирована векторная плазмидная ДНК путем гомологичной рекомбинации. Эти клетки можно подвергнуть скринированию с целью показать, что они синтезируют мРНК, соответствующую TSHb гену, и что они продуцируют TSHb белок. Кроме того, с целью гарантии, что соответствующая рекомбинация осуществилась, геномная ДНК вблизи области встраивания может быть подвергнута анализу последовательностей оснований. Пример - Активация TSHb гена в гипофизарных клетках крыс В соответствии с ниже приведенным протоколом, путем гомологичной рекомбинации с введением активирующего элемента ("против течения" кодирующей области TSHb активировали транскрипцию гена бета субъединицы тиреотропина (TSHb), в норме отсутствующую в гипофизарных клетках линии GH3 крыс. В качестве активирующего елемента был выбран промотор вируса Rous саркомы (RSV), который активен в клетках GH3 (Christian Nelson с соавт., Nature, 322:557-562 (1986); Zheng - Sheng Yе с соавт., The JournaL of Biological Chemistry, 263:7821-7829, (1988)). Сконструированный плазмидный вектор содержал RSV активирующий элемент, части 5' концевой области локуcа гена TSHb и селективный лекарственный маркер, ген аминогликозид фосфотрансферазы (NЕО), для изолирования популяций трансфектированных клеток. Рибонуклеиновую кислоту экстрагировали из общего пула клеточных популяций GH3, резистнтных к лекарству, и использовали для получения комплементарной ДНК (кДНК), которую подвергали скринированию с помощью реакции полимеризации цепи (РПЦ) на наличие TSHb кДНК. Ниже дано описание конструкций векторов гомологичной рекомбинации и контрольных векторов, а также методов и результатов. Плазмидная конструкция Гомологичная рекомбинация (ГР) Backbone вектора (pRSVCATNEO) ся строго определенным. Специалисты в данной области могут определить любое подходящее расположение генов С, D и Е и их промоторов, таким образом, чтобы промоторы стимулировали экспрессию связанных с ними генов без одновременного нарушения каким-либо образом экспрессии нужного гена или любого из других генов конструкции. Изобретение можно проиллюстрировать ссылкой на активацию бета-субъединиц тиреотропина крыс (ТSНb) в GH1 (ATCC ССL 82), GН3 (AТСС CCL 82.1) или GН4Сl клеточных линиях (GН). GН клеточные линии являются производными опухоли гипофиза, индуцированной облучением у крыс MtT (W5 /Takemoto, Cancer Res., 22:917, 1962) и адаптированных к росту в культуре Tashji an. с соавт. (Еndосrinоlоgу, 82:342-352, 1968). Эти клеточные линии можно подвергать субклонированию и скринированию на их способность продуцировать гормон роста и TSHb. Такое скринирование предпочтительно выполнять методом блот анализа Норсерна, чтобы определить, присутствует ли мРНК для гена крысиного гормона роста и установить, что не производится мРНК для гена TSHb. Используя анализ Соусерна, можно также скринировать клеточные линии с целью определения, что хотя бы одна копия гена TSHb присутствует в геноме. Используются только линии GН, которые продуцируют гормон роcта, и не производят гормон TSHb, однако, содержат копию гена TSHb. Схема вектора специфической гомологичной рекомбинации для использования в GН клетках представлена на фиг. 3. Область А может включать 5' "против течения" нетранслируемую область гена TSHb, определяемую Hindlll фрагментом, который простирается от -74 до -2785, а область В может содержать фрагмент ДНК, простирающийся от -2785 Hindlll сайта до Ncol сайта примерно на 2,1 кб далее "против течения" согласно описания Саrr с соавт. (J. Biol. Chem., 262:981-987, 1987) и Сrоуlе с соавт. (ДНК, 5:299304, 1986). Ген положительной селекции (область С) может быть представлен Вglll-Smal фрагментом (1067 пар оснований), полученным из плазмиды pSV2neo (ATCC № 37.149) (Southern с соавт. J. Mol. Appl. Gen., 1:327-341, 1982), neo ген может быть инициирован промотором (облаcть С') вируса Rous саркомы (RSV), который получен из Ndel-Нindlll фрагмента из плазмиды pRSVcat (ATCC № 37.152) (Gorman с соавт., PNAS, 79:67776781, 1982). В данном примере не используется амплификаторный маркер и, следовательно, не требуется область D для повышения эффективности гомологичной рекомбинации. Эффективность находится в обратной зависимости от отношения негомологических последовательностей к гомологическим, присутствующим в конструкции (Letsou c соавт., Genetics, 117:759-770, 1987). Область Е или ген негативной cелекции, может быть представлена геном HSVtk, определяемым 2 кб Xho фрагментом, полученным из плазмиды рМСІТК (Сарессhi с соавт., Nature, 336:348-352, 1988). Ген HSVtk в данной конструкции может инициироваться промотором вируса полиомы и модифицироваться под влиянием усилителя (область Е') согласно 11 42675 Вектор вируса Rous саркомы (RSV ) получали из плазмиды pRSVCAT (Corneliа М. Gorman с соавт., Proceeding of the National Асаdеmу of Sсіеncе, 79:6777-6781 (1982)) (фиг. 5) путем изолирования Ndel-Hindlll фрагмента с 580 парами оснований (нп), содержащего функциональную единицу промотора. Концы этого фрагмента затупляли с помощью Кленова фрагмента ДНК-полимеразы l и Хbаl линкеров, лигированных с тупыми концами. После переваривания с Хbаl рестрикционной эндонуклеазой и очистки в гелеполученный фрагмент лигировали с Хbаl сайтом рUC18. Бактериальная колония, несущая плазмиду с RSV вставкой в ориентации, показанной на фиг. 6, обозначена как рRSV. Ген аминогликозид фосфотрансферазы (NЕО) клонировали от рSV2NЕО (P.J. Sоutеrn с соавт., Jоurnаl of Моlесulаr аnd АррІiеd Genetics, 1:327-341 (1982)) путем изолирования Bglll и BanHl фрагмента (фиг. 7) и лигирования этого фрагмента с BamHl сайтом плазмиды pRSV (фиг. 6). Плазмиду, содержащую NEO ген в ориентации, показанной на фиг. 8, выделяли из культуры и обозначали как рRSVNЕОВАМ. рRSVNЕОВАМ переваривали с Smal и 4228 нп фрагмент, содержащий область RSV промотора, большую часть NЕО гена и рUС18 изолировали путем электрофореза в геле. Smal концы этого фрагмента обрабатывали Хhоl линкерами, разрезали Xhol рестрикционным ферментом, после чего сшивали плазмиду путем лигирования. Полученная плазмида представлена на фиг. 9 и обозначена как pRSVNEO. Эта последняя стадия клонирования приводит к делеции 786 нп фрагмента от 3' конца NEO фрагмента, который не является обязательным для его функциональной экспрессии. Эта конструкция обеспечивает плазмиду, в которой транскрипция NEO гена управляется RSV промотором. Следующий Ndel сайт, расположенный на 5' конце RSV промотора в pRSVCAT (фиг. 5) превращается в Sаll сайт. Это осуществляется путем переваривания pRSVCAT c Ndel, заполнения концов при помощи Кленов фрагмента ДНК полимеразы и лигирования Sаll линкеров к полученным тупым концам. Линкеры подвергали полному перевариванию с Sаll и вновь получали плазмиду путем лигирования. В новый сконструированный сайт Sall клонировали Sаll-Xhоl фрагмент из рRSVNEO (фиг. 9), содержащий RSV промотор и NEO ген. Плазмиду с RSV промотором и NEO фрагментом, ориентированную как указано на фиг. 10, изолировали и обозначали pRSVCATNEO. Эта плазмида при трансфекции в GН3 клетки способна обусловливать у этих клеток G418 резистентность, что говорит о способности RSV прпротора управлять транскрипцией NEO гена, а также способности РНК этого гена осуществлять трансляцию функционального белка (данные не представлены). Общая РНК из выше указанных стабильных трансфектантов подвергалась анализу с применением реакции полимеризации цепи (РПЦ) для выяснения, происходит ли транскрипция CAT гена. По данным РПЦ, CAT ген действительно транскрибируется во всех исследуемых, G418 резистентных колониях (данные не представлены), что свидетельствует о способности RSV промотора 5' CAT гена управлять транскрипцией гена, расположенного на конце 3' по отношению к нему. Важность этого момента обусловлена тем, что RSV промотор ответственен за управление транскрипцией гена TSHb, когда TSHb вектор, описанный ниже, интегрирует путем гомологичной рекомбинации в GН3 геном. TSHb HR Вектор Вектор, способный к интеграции в GН3 геном посредством гомологичной рекомбинации, получен в результате встраивания двух тяжей 5' концевых областей гена бета субъединицы тиротропина (TSHb) в уникальные сайты SalІ и HindІІІ, содержащиеся в плазмиде pRSVCATHEO (фиг. 10). От Stratagene, San Diego, CH, была получена библиотека генов селезенки крыс, которая содержала вставки из 15 кб и более, клонируемыe в lambda DASH. Согласно протоколам, (Current Protocols in Molecular Biology, с. 1.9.1.-1.13.6, 6.1.1-6.4.10) был изолирован 15,3 кб клон TSHb гена крыс, включающий 9 кб последовательность 5' первого экзона. 15,3 кб фрагмент состоял из двух ХlаІ фрагментов, 10,6 кб фрагмента, соответственно 5' концу 15,3 кб фрагмента, и 4,7 кб кусок, соответcтвующий 3' области 15,3 кб фрагмента (фиг. 11). Оба эти ХlaІ фрагмента были подвергнуты субклонированию в pUC18 и плазмиды, содержащие вставки в обеих ориентациях, были изолированы. 2,3 кб XlаІ-HindІІІ фрагмент, содержащийся в 4,7 кб ХlаІ фрагменте (фиг. 11) очищали в ХlаІ сайт этого фрагмента превращали в HindІІІ сайт путем наполнения концов с участием Кленов фрагмента и лигирования c HindІІІ линкерами. Фрагмент лигировали в уникальный HindІІІ сайт, содержащийся в pRSVCATNEO (фиг. 10). Изолят, соответствующий плазмиде с 2,3 кб вставкой в правильной ориентации, как показано на фиг. 12, был обозначен pRSVCATNEOTSHB3. Субклонируемый 10,6 кб ХbаI фрагмент из TSHb клона крыс (фиг. 11) изолировали и Хbаl концы превращали в Sall сайты путем затупления фрагмента посредством Кленов фрагмента ДНК полимеразы и прикрепления Sall линкеров. Затем 10,6 кб фрагмент клонировали в Sall cайт pRSVCATNEOTSHB3 (фиг. 12). Плазмида, содержащая вставку в правильной ориентации была идентифицирована и обозначена как pRSVCATNEOTSHB3-5Xbal (фиг. 13). Эта плазмида была сдана на хранение в Коллекцию Американских культур, Rockville, MD, получив номер депозита АТСС 40933. Исходя из целей хранения, плазмида была переименована в pHRTSH. Данный депозит был подготовлен в соответствии с требованиями Будапештского Договора. Линия клеток Клетки GH3 представляют собой субклональную популяцию MtT/W5, которая происходит от опухоли гипофиза, индуцированной облучением у крыс (В.K. Takemoto, Cancer Research, 22:917, (1962)) и адаптирована к росту в культуре Tashjian с соавт., Endосrinоlоgy, 82:342-352 (1968). Клетки GH3 были получены из банка клеток Американской Коллекции Стандартных культур и поддерживаются в культуре с использованием среды следующего состава: Дульбекко-модифицированная среда Игла (DMEM) + 15% лошадиной сыворотки (HS) + 2,5% плодной бычьей сыворотки (FBS) + 1% Lглютамина (GН3 cреда) при 37°С в 5% СО2. 12 42675 фекции. Клетки оставляли стоять при комнатной температуре в течение 20 минут, после чего к ним добавляли 5 мл GН3 среды, и чашки инкубировали при 37°С в течение 6 часов. Затем клетки разбивали путем отсасывания среды и добавлении 5 мл свежего трансфекционного буфера, содержащего 15% глицерина, на 3,5 минут. Клетки дважды промывали фосфатным буфером и добавляли 10 мл GН3 среды. Через 48 часов после трансфекции среду удаляли и добавляли 10 мл GН3 среды, содержащей 400 мкг/мл G418. Электропорация Электропорацию выполняли с помощью ВТХ 300 Трансфектора с 3,5 мм щелевыми электродами. 1´107 GН3 клеток в состоянии лог фазы собирали из чашек путем трипсинизации, осаждали центрифугированием и промывали один раз фосфатным буфером. Клетки ресуспензировали, в 1,0 мл фосфатного буфера и переносили в 2,9 мл Ультра-УВ одноразовые кюветы (Американские продукты для научных исследований) на льду. К клеткам добавляли 10 мкг ДНК, смешивали и помещали снова на лед на 5 минут, после чего в камеру помещали электроды и клетки подвергали электропорации в режиме 750 микрофарад с импульсом 200 вольт. Затем кювету возвращали на лед на 10 минут. Из кюветы клетки переносили в 9 мл GН3 среды, содержащей 1% пенициллина и 1% стрептомицина, при комнатной температуре в 15 мл коническую пробирку и оставляли стоять на 10 минут. В результате полной электропорации 1´107 клеток получены три 10 мл чашки, каждая из которых, содержала примерно 3´106 клеток. Через 48 часов к ним добавляли GH3 среду, содержащую 400 мкг/мл G418. Трансфекция GH3 клеток с pRSVCATNEOTSHB3-5Xbal (Aatll cut), pRSVCATNEOTSHB3-5Xbal (Apalcut) и pRSVCATNEO (Apal cut) pRSVCATNEOTSHB3-5Xbal (Aatllcut). pRSVCATNEOTSHB3-5Xbal (Apall cut), и pRSVCATNEO (Apal cut) плазмиды подвергали трансфекции в GН3 клетки с контролем без ДНК в соответствии c протоколом фосфата кальция и протоколом электропорации. Через 48 часов после трансфекции клетки подвергались G418 отбору. Примерно, через 14-21 день колонии можно было различить на 10 см чашках, после чего их подсчитывали. В каждом контроле без ДНК не отмечено видимых колоний, и это свидетельствует о том, что G418 отбор работает и что присутствие плазмиды, содержащей RSV - NEO область, необходимо для подтверждения G418 резистeнтности. В это же время колонии собираются и объединяются путем изолирования областей на 10 см чашках с использованием клонирующих колец шириной 17 мм. Эти крупные клонирующие кольца окружают около 10-70 колоний, в зависимости от плотности колоний на чашку, что позволяет собрать клетки в эти изолированные области и объединить их в одно и то же время путем трипсинизации. Трипсинизированные колонии каждого кольца переносят в 6-луночные чашки и оставляют расти в GН3 среде, содержащей G418. По достижении 70-80% слияния 80000 клеток переносят в 24 луночные пластинки и оставляют на хранениe в криостате для дальнейших исследований. Рост Приготовление ДНК Крупно-масштабное получение плазмидной ДНК Всe плазмиды, используемые для стабильных трансфекций, подвергались очистке путем применения метода щелочного лизиса для крупно-масштабной очистки ДНК плазмид, как описано в Current protocols in Molecular Biology, т. 1, c. 1.7.11.7.2. ДНК, изолированную методом щелочного лизиса, очищали путем двойного связывания в градиенте хлорида цезия, согласно Current Protocols in Molecular Biology, т. 1, с. 1.7.5-1.7.7. Перед трансфекцией HP вектора подвергали перевариванию с AatІІ или АраІ. ApaІ использовали для получения линейной формы контрольных плазмид pRSVCATNEO и АаtІІ для линеаризации плазмиды pRSVCATNEOTSHB3-5XbaІ. Положение сайтов разрезания АраІ и AatІІ можно видеть на фиг. 10 и 13 соответственно. После переваривания соответствующим рестрикционным ферментом выполняли экстракцию фенолом/хлороформом, экстракцию хлороформом, осаждение этанолом и однократное промывание 70% спиртом. Затем плазмиды ресуспензировали в стерильной деионизированной воде (dH2O) до концентрации 1 микрограмм/микролитр (мкг/мкл), что определяется путем абсорбции при 0D260. С целью повысить эффективность трансфекции и/или отношение результатов гомологической рекомбинации к таковым случайной интеграции, pRSVCATNEOTSHB3-5XbaІ перепаривали с АраІ. В результате переваривания с AраІ pRSVCATNEOTSHB3-5XbаІ разрезается в трех отдельных местах, после чего удаляются все области вектора за исключением тех, которые необходимы для гомологичной рекомбинации (фиг. 13). После переваривания с АраІ выполняли электрофорез в 0,8% агарозном геле, и затем материал верхней полосы, соответствующий 10,992 нп фрагменту, который содержит две 5' концевых области TSHb гена, RSV промотор - NEO область и RSV промотор, активизирующий TSHb ген, изолировали из геля путем электроилюции в трубке для диализа. Электроэлюированная ДНК затем подвергалась очистке в миниколонке для элюции (Schleicher и Schuell) с стандартной прописью использования, рекомендованной изготовителем. После элюирования с колонки, ДНК осаждали спиртом, промывали 70% спиртом и ресуспензировали до концентрации 1 мкг/мкл. Стабильные трансфекции Фосфат кальциевая трансфекция За 48 часов до трансфекции 3´106 GH3 клеток помещали в чашки диаметром 10 см. В каждую чашку добавляли 10 мкг вектора ДНК вместе с 30 мкг спермы лосося, разбитой ультразвуком, и 0,5 мл трансфекционного буфера. Буфер трансфекции готовили путем смешивания в dH2О: 4 г NаСl, 0,185 г Kcl, 0,05 г Na2HPO4, 0,5 г декстрозы, 2,5 г HEPES и доведения dН2О до конечного oбъeмa 500 мл и рН 7,5. 31 мкл 2М раствора СаСl2 добавляли к 0,5 мл смеси ДНК + буфер трансфекции и перемешивали. Раствор оставляли стоять при комнатной температуре в течение 45 минут. Когда ДНК – СаСl2 - буфер трансфекции был готов, GН3 среду удаляли от клеток GН3 и наслаивали на них приготовленную смесь ДНК-CaCl2 - буфер транс 13 42675 клеток в 24 луночных пластинках продолжается до тех пор, пока не будет достигнуто 50-80% слияния. Затем из этих GН3 клеток собирается общая ДНК с помощью следующей процедуры. Изолирование РНК из трансфектированных GН3 клеток, росших в 24 луночных пластинках Ниже приводится модификация протокола, описанного Chomezynski, Sacchi, Anal. Biochem., 162:156-159 (1987). Среду, покрывающую GН3 клетки в 24 луночных пластинках, удаляли и клетки промывали 1 мл фосфатного буфера. 1 мл раствора ГТЦ добавляли к клеткам и инкубацию проводили при комнатной температуре в течение 5 минут. Раствор ГТЦ готовили путем растворения 250 г гуанидин тиоцианата (Флука) в 293 мл dH2O и последующего добавления 17,6 мл 0,75 М цитрата натрия, рН 7,0 и 24,6 мл 10% саркозила (LЛаурил саркозин). Непосредственно перед использованием добавляли 360 мкл b-меркаптоэтанола на 50 мл ГТЦ раствора. Через 5 минут выдерживания при комнатной температуре 1 мл ГТЦклеточного лизата переносили в Сарстедт 55.518 пробирку с защелкивающейся крышкой, содержащую 2 мл ГТЦ раствора. В каждую пробирку добавляли 300 мкл 2 М ацетата натрия, рН 4,0, после чего пробирку встряхивали. Затем в пробирки добавляли 3 мл насыщенного dН2О фенола и вновь подвергали встряхиванию. На следующем этапе в каждую пробирку добавляли 600 мкл смеси: хлороформа и изоамилового спирта в пропорции 49:1, после чего пробирки встряхивали вручную в течение 10 сек. и помещали на лед на 15 минут. Затем пробирки центрифугировали в Сорвал РЦ-5Б, используя СМ24 ротор, при 8000 оборотов в минуту в течение 20 минут при 4°С. Водную фазу переносили в свежую Сарстедт пробирку, содержащую 13 мл изопропанола, которую помещали на 1 час в холодильник с температурой -20°С. Через час пробирки центрифугировали в Сорвал РЦ-5Б, используя СМ24 ротор, при 8000 оборотах в минуту в течение 20 минут при 4°С, после удаления супернатантов осадки ресуспензировали в 500 мкл ГТЦ раствора. Ресуспензированную РНК переносили в 1,5 мл пробирку Эппендорфа, в которую добавляли 500 мкл изопропанола. Пробирки снова помещали на 1 час в условия -20°С. Содержимое в пробирках Эппендорфа центрифугировали в течение 5 минут в микроцентрифуге и супернатант отбрасывали. Осадок промывали 2 раза 70% этанолом и высушивали до полного испарения спирта. Осадок ресуспензировали в20 мкл диэтилпирокарбоната (deps), обработанного водой и нагревали до 65°С в течение 5 минут. Эту РНК затем использовали для получения кДНК в одном из двух, описанных ниже методов. кДНК реакции Метод 1 Первую цепь кДНК синтезировали из 2,56,0 микролитров целой РНК (примерно 0,5-6 мкг) в реакционном объеме 10-20 микролитров. Общую РНК получали с помощью метода экстракции, описанного ниже, и денатурировали в течение 510 минут при 70°С, после чего быстро охлаждали на льду перед добавлением компонентов реакции. По условиям реакции, 50 мМ Трис-НСl (pH 8,3) 10 мМ MgМоСІ2, 10 мМ ДТТ, 0,5 мМ каждого из dСTP, dATP, dGTP, dTTР (Фармация), 40 мМ КСІ, 500 единиц/мл РНазин (Промера Биотехнол.), 85 мкг/мл олиго (dT)12-18 (Collaborative Research, Inс.), 15000-20000 единиц/мл обратной транcкриптазы вируса лейкемии Молони мышей (исследовательская лаборатория Бесесды) инкубировали при 37°С в течение 60 минут. Реакцию оканчивали путем добавления ЭДТА до 40 мМ, после чего осаждали нуклеиновую кислоту путем добавления ацетата натрия до концентрации 0,3 М и двух объемов этанола. Для образования преципитата материал выдерживали при 0°С в течение 30 минут и осаждали путем центрифугирования в микроцентрифуге при 14000 оборотов в минуту в течение 30 минут. Осадок промывали 70% этанолом, высушивали и ресуспензировали в deps обработанной воде до объема 15-25 микролитров. Метод 2 Условия синтеза первой цепи кДНК из РНК соответствуют методу, описанному Carol A. Brenner с соавт., BioТеchniques, т 7, № 10, с.1096-1103 (1989). 1 мкл общей РНК из РHK, приготовленной выше описанным методом, добавляли к 9 мкм реакционного буфера в 0,5 мл пробирке Эппендорфа. Реакционный буфер включает 200 единиц обратной транскриптазы вируса лейкемии Молони мышей (MMLVRT, Бесесда, исследовательские лаборатории) и конечные концентрации следующих реактивов: 70 мМ Трис-НСІ рН 8,8; 40 мМ КСІ; 0,1% Тритон Х-100; 1 мM каждого из dNTP, 4 мМ МgСІ2 и 0,45 OD260 единиц случайных гексамеров (Фармакопея). После перемешивания пробирки инкубируют при комнатной температуре в течение 10 минут, после чего помещают на 1 час в условия 42°С. Через 1 час пробирки нагревают до 90°С в течение 1 минуты с целью инактивирования MMLVRT и затем охлаждают до комнатной температуры. Реакция полимеризации цепи (РПЦ) и амплификация РНК от GH3 клеток Использовали следующие затравки для амплификации, путем РПЦ, TSHb кДНК, синтезированной с РНК транскриптов, продуцируемых GH3 клетками в результате активирования HR плазмидами эндогенного TSHb гена путем гомологичной рекомбинации Затравка 5' 3' TSHb5 AGTATATGATGTAСGTGGACAGG TSHb3 CACTTGCCACACТТGCAGCTCAGG На фиг. 14 показаны области TSHb гена, которым соответствует каждая затравка. Условия реакции РПЦ Все реакции РПЦ выполняли в Еriсоmр двухблочном термоциклорегуляторе. Если РПЦ амплификация должна протекать на кДНК, полученной методом 2, то 40 мкл дополнительной реакционной смеси непосредственно добавляют к 10 мкл материала реакции кДНК, тем самым доведя объем до 50 мкл. Конечные концентрации реактивов в 50 мкл составляют: 70 мМ Трис.НСІ рН 8,8, 40 мМ КСІ, 0,1% Тритон X-100, 2,25 единиц Tag полимеразы (Фармакопея), 0,2 микромолей (мкМ) каждой затравки, 200 мкМ каждого dNTR, и 0,8 мМ MgCI2. В том случае, если РПЦ необходимо выполнять на кДНК, полученной с помощью выше описанного метода 1, то от 5 до 10 мкл суспензированной кДНК добавляют к 40-45 мкл смеси, со 14 42675 держащей конечные концентрации следующих реактивов: 70 мМ Трис.НСІ рН 0,8, 40 мМ КСІ, 0,1% Тритон Х-100, 2,25 единиц Таg полимеразы, 0,2 мкМ каждой затравки, 200 мкМ каждого dNTR, и 0,8 мМ MgCl2. Затем реакции проходили следующие РПЦ циклы: 1 минута при 94°С. 30 секунд при 55°С. 2 минуты при 72°С. Выше указанные циклы повторяют от 30 до 40 раз. 10 мкл каждой реакционной смеси обрабатывают в 6% полиакриламидном геле, после чего просматривают на наличие 247 нп РПЦ фрагмента, показывающего присутствие надлежащим образом сплетенной мРНК для TSHb. РПЦ результаты для амплификации TSHb РНК от GH3 клеток и общей РНК гипофиза крыс Для того, чтобы определить, синтезируют ли GН3 клетки TSHb РНК в норме, кДНК из нетрансфектированных GH3 клеток, так же как кДНК из клеток гипофиза крыс, подвергли обработке в условиях выше описанной РПЦ реакции. Полоса, включающая точно 247 нп, как показатель наличия TSHb mPНK, обнаруживается в положительном контроле пробы гипофизарных клеток крыс, однако подобной полосы не наблюдается в пробе общей РНК из GН3 клеток даже после 60 циклов (данные не приводятся). Результаты трансфекции Число резистентных к G418 колоний, полученных на 10 см чашках в период между 14 и 21 днями после добавления к среде G418, подсчитано и представлено в таблице. плазмида G418 рези- TSHb РНК постентные ко- ложительные лонии pRSVCATNEO 60 0 pRSVCATNEOTSHB34942 3 5XBAІ (Aat 2 переваренная) pRSVCATNEOTSHB38580 6 5XBAІ (ApaІ переваренная) Эти результаты показывают успешное активирование в норме трапскрипционно "молчащего" TSHb гена в результате использования метода изобретения. Поскольку количество колоний, положительных в отношении TSHb транскрипции, мало сравнимо с числом колоний, резистентных к G418 (примерно, одна из каждых 103 G418 резистентных колоний), то этот результат в основном согласуется с сообщениями о других экспериментах по гомологической рекомбинации (Michael Kriegler, Перенос генов и экспрессия, Лабораторное руководство, Stockton Press, Нью-Йорк, NY (1990), с. 56-60). Исследования обычно показывают, что скорость гомологической рекомбинации, по всей вероятности, пропорциональна скорости транскрипции гена-мишени (М. Frohman и G. Martin, Сell, 56-145 (1989); S. L. Mansour с соавт., Nature, 336-348 (1988)). Необходимо отметить, что показанная скорость на три порядка выше величины, ожидаемой от случайной мутации, включающей TSHb ген. С целью гарантии повторяемости результатов для каждого пула колоний и стабильности активирования транскрипции РHK предварительно замороженные пулы колоний, которые при первом скринировании оценивались как положительные, подвергались оттаиванию и последующему культивированию. Свеже оттаянные GН3 положительные пулы высевались в Т 25 флаконы для тканевых культур и культивировали до тех пор, пока клетки не достигали 70-80% слияния. Затем 80000 клеток из каждого флакона помещали в 24 луночную пластину, после чего клетки росли вплоть до достижения 50-70% слияния. РНК экстрагировали из клеток, превращали в кДНК и снова подвергали скринированию на присутствие TSHb РHK путем наслаивания 10 мкл РПЦ реакционной смеси на 6% полиакриламидный гель. Фиг. 15 показывает результаты типичных РПЦ реакций от второго скринирования, заключавшегося в просмотре материалов полиакриламидного геля с использованием окрашивания этидим бромида и флюоресценции. Полосы 1, 2 и 3 содержат материал РПЦ реакций с кДНК от GН3 клеток, которые были трансфектированы плазмидой pRSVCATNEO. pRSVCATNEO не содержит областей, гомологичных TSHb, и, таким образом, не способна к активированию TSHb гена путем гомологической рекомбинации. Как можно видеть по картине геля на фиг. 15, полосы, соответствующие 247 нп, отсутствуют в этих препаратах, тем самым свидетельствуя, что ген TSHb не активен. Полоса 6 также представляет отрицательный контроль. Материал этой полосы содержит комбинацию трех пулов из проб GН3 клеток, подвергавшихся трансфекции с Метод трансфекКолонии на 10 см чашку ции pRSVCAT PRSVCATNEO NEO TSHB3-5XbaІ Apa1 cut AAt2 cut Фосфат кальция 1 48 13 29 Фосфат кальция 2 21 58 Электропорация 1 1295 415 Электропорация 2 1051 723 Общая РНК собрана из пула колоний, содержавшихся в 24 луночных чашках, согласно выше приведенному описанию. Из этих препаратов РНК получена кДНК и подвергнута РПЦ амплификации. Число положительных колоний, продуцирующих TSHb мРНК определяли по наличию 247 нп фрагмента при исследовании в полиакриламидном геле. Каждый из просмотренных пулов содержал от 10 до 70 колоний. Установленное число колоний на пул и на трансфекцию использовали для приблизительного определения числа клонов GН3 клеток, резистентних к G418, и в которых произошла активация транскрипции TSHb гена. В случае положително тестируемого пула, принято считать, что в данном пуле присутствует одна положительная колония. 15 42675 pRSVCATNEOTSHB3-5XbaІ (AраІ cut) и оказавшимся отрицательными в отношении транскрипции TSHb гена при первом скринировании. Отсутствие 247 нп фрагмента в полосе G показывает, что случайное интегрирование трансфектируемой плазмиды pRSVCATNEOTSHB3-5XbaІ (AраІ cut) в геном не способно обеспечивать продукцию 247 нп TSHb PПЦ фрагмента. Линии 7, 8, 9 и 10 включают материал PПЦ реакций с кДНК, полученной из общей РНК, синтезированной в гипофизарных клетках крыс, в количествах на реакцию соответственно 25 нг, 100 нг, 200 нг и 400 нг. Присутствие в этих препаратах ожидаемой 247 нп полосы, производной кДНК, приготовленной из ткани крыс, в которой в норме экспрессируется ген TSHb, показало, что условия РПЦ реакции соответствующим образом оптимизированы и что РПЦ полоса, обнаруженная в препаратах 4 и 5, содержащих положительный в отношении гомологической рекомбинации TSHb материал, имеет соответственно точный размер. Два пула, трансфекция которых осуществлялась плазмидой pRSVCATNEOTSHB35ХbaІ (АраІ сut), положительных при первом скринировании: АраІ-107 в полосе 4 и АраІ-130 в полосе 5, вновь оказались положительными при тестировании в отношении активации TSHb гена, показателем чего является наличие соответствующей TSHb РПЦ полосы, амплифицированной из кДНК, полученной из экстрактов общей РНК, указанных пулов, что свидетельствует в пользу стабильной активации транскрипции TSHb гена. Присутствие полос на уровне 247 нп в пробах 4 и 5, содержащих РНК из предварительно определенных, как положительные, пулов АраІ-136 и АраІ-107, и отсутствие полос в отрицательных контролях трансфектированных с помощью pRSVCATNEO клеток GН3 в пробах 1-3 и отрицательные показатели с pRSVCATNEOTSHB3-5ХваІ (ApaІ сut) в пробе 6, говорят о том, что продукция РНК TSHb в клеточной линии, которая в норме ее не синтезирует, стабильно осуществляется в результате гомологичной рекомбинации. Изобретение не ограничено только клеточной линией, которая здесь описана. Клетки всех линий содержат генетическую информацию, которая в норме является "молчащей" или инертной. Большинство из них экспрессирует только определенные гены. Однако, в норме транскрипционно молчащий или инертный ген какой-либо из этих клеточных линий может быть активирован к экспрессии генного продукта в соответствии с настоящим изобретением, так как, согласно данному изобретению, могут быть модифицированы характеристики экспрессии любого из генов генома. Могут быть использованы даже ранее трансформированные клеточные линии, причем до тех пор, пока предварительная трансформация не разрушит нужного гена. Источник клеточной линии не столь важен. Клеточная линия может быть животного или растительного происхождения, первичной, перевиваемой или постоянно поддерживаемой. Конечно, желательно, чтобы любая из этих линий обладала определенной устойчивостью и выживали после обработки методами, предлагаемыми изобретением, что обеспечит возможность поставить процесс экспрессии на промышленную основу. Кло нируемые микроорганизмы, независимо от прокариот или от эукариот, также можно обрабатывать методами, представленными изобретением. Помимо того, что изобретение описано предпочтительно в отношении экспрессии транскрипции в норме молчащих или инертных генов, методы изобретения также применимы для модификаций характеристик экспрессии генов, которые в естественном состоянии экспрессируются в клеточной линии хозяина. Например, если желательно получить экспрессию гена в зависимости от условий культивирования, или обеспечить возможность включения или выключения экспрессии, можно встроить соответствующий ДНК регуляторный сегмент, такой как регулирующий промотор, который обусловливает такие характеристики, как репрессия или индукция. Например, если известно, что клеточный тип содержит рецепторы ядерных стероидов, таких как экстроген, тестостерон или глюкокортикоид, или рецепторы тироксина, то элементы стероидного или тироксинового ответов используют как область F. Таким элементом ответа является любая ДНК, связывающая упомянутый рецептор, с целью получения позитивного ответа в отношении транскрипции. Даже еспи клетка в естественном состоянии не отвечает на глюкокортикоиды, то в конструкцию можно добавить кусок ДНК, кодирующую рецептор глюкокортикоида или встроить его в геном где-то в другом месте, и, таким образом, обеспечить способность клеток отвечать на глюкокортикоиды. Использование регуляторного промотора желательно, независимо от того, является или нет "молчащим" нужный ген в нормальном состоянии. Используя методы изобретения, может быть достигнута другого рoдa pегуляция путем точного улавливания нужного места для встраивания соответствующего ДНК регуляторного сегмента. Таким образом, хотя стимуляция экспрессии транскрипционно "молчащих" в норме генов является предпочитаемым аспектом применения настоящего изобретения, оно также может быть использовано в более широком смысле, например, для модификации характеристик экспрессии любого гена, эндогенного для данной клеточной линии. Специфическая техника гомологической рекомбинации не является сама по себе открытием данного изобретения. Эта технология хорошо известна, и любой из специалистов в данной области поймет возможность использования такого рода методов в данном изобретении, поскольку с их помощью возможно улавливание точного положения ДНК регуляторной последовательности по отношению к гену, представляющему интерес. Хотя в качестве предпочтительного, изобретение предлагает метод, использующий кольцевую конструкцию с двумя гомологичными областями на любом конце встраиваемых последовательностей, необходимо отметить, что в задачи изобретения входит также охватить методы, которые бы обеспечили решение тех же целей; например, использование кольцевых конструкций ДНК. Главной чертой настоящего изобретения является применение техники гомологичной рекомбинации для встраивания ДНК регуляторной последовательно 16 42675 сти, которая обусловливает модификацию характеристик экспрессии в используемых клеточных линиях или микроорганизмах, оперативно соединяясь с нужным геном в геноме клеточной линии, предпочтительно с тем, который в норме является транскрипционно "молчащим", а также для встраивания амплификаторной последовательности в отсутствии регуляторного сегмента в достаточной близости к гeну в геноме клеточной линии, который уже транскрибируется, с целью обеспечения амплификации этого гена с помощью амплификаторного сегмента. Совсем не обязательно включение селективного маркера. Иногда отбор может быть основан на обнаружении продукта нужного гена или мРНК в среде или клетках после встраивания ДНК конструкции. Более того, в том случае, когда встраивается регуляторная последовательность, амплификация, если желательна, не является определяющей в успешном выполнении метода. То же самое относится и к негативному селективному гену, который облегчает процесс скрининга, но опять же, не является решающим для успеха реализации изобретения. Таким образом, в основном варианте требуется только встраивание ДНК регуляторного сегмента или амплификаторного сегмента в специфически желаемое положение. Однако, с целью оптимизации отбора, предпочтительно, использовать дополнительные позитивные и/или негативные селективные мaркepные гены, как и введение генаамплификатора в тех случаях, когда добавляется регуляторный сегмент. Термин "модификация экспрессии" при использовании его в разделе спецификации, как и формуле изобретения, подразумевает исключительно ограничение экспрессии в результате встраивания путем гомологичной рекомбинации мутации, делеции, стоп-кодона или какой-либо другой нуклеотидной последовательности, включая целый ген, в нужный ген с целью предупреждения экспрессии соответствующего продукта. Прежние специалисты обучались использованию гомологической рекомбинации для встраивания специфических мутаций, и экспрессия клеточного продукта может, в своей основе, заканчиваться посредст вом ее же (см., например, Schwartzberg с соавт., PNAS (CШA), 87:3210-3214 (1990)). Настоящее изобретение не ставило своей целью заниматься такого рода процедурой. В изобретении "модификация экспроссии" выполняется посредством встраиваиия регуляторной и/или амплификаторной областей в специфический, желательный для исследователя, участок генома путем гомологичной рекомбинации. К наиболее предпочитаемым модификациям относятся те, в результате которых происходит активация и/или усиление экспрессии нужного продукта. Всякий paз, когда в данной спецификации встречается выражение, что ДНК регуляторный сегмент "оперативно сцеплен с геном", это означает такое расположение регуляторного сегмента по отношению к нужному гену, которое обеспечивает возможность регуляции указанным сегментом транскрипции этого гена. Наиболее предпочтительное расположение регуляторного сегмента "против течения" гена, однако допускается также его локализация "по течению" и в пределах гена, при условии, что он сможет осуществлять регуляцию экспрессии нужного гена определенным образом. ДНК регуляторный сегмент может быть промотором, терминатором, оператором, усилителем, атенуатер (ослабитель) или же включать их комбинации. Всякий раз, когда в данной модификации используется термин "против течения" или "по течению", это означает в направлении 5' конца или 3' конца относительно кодирующей части нужного гена. Предшествующее описание специфических аспектов настолько полно дает общую природу изобретения, что имеется возможность очень быстрой адаптации этих специфических вариантов для различных условий использования изобретения без отклонения от общей концепции. Любые такие модификации и адаптации представляют собой эквиваленты вариантов изобретения в пределах их значимости и возможностей. Понятно, что используемые здесь фразеология и терминология важны исключительно для описания изобретения, а вовсе не для каких-либо ограни-чений. Фиг. 1 17 42675 Фиг. 2А Фиг. 2В 18 42675 Фиг. 3 Фиг. 4 19 42675 Фиг. 5 20 42675 Фиг. 6 21 42675 Фиг. 7 22 42675 Фиг. 8 23 42675 Фиг. 9 24 42675 Фиг. 10 25 42675 Фиг. 11 26 42675 Фиг. 12 27 42675 Фиг. 13 28 42675 Фиг. 14 29 42675 Фиг. 15 __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2002 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк.Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 30
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for gene activation of eucariotic cell line genom, which is transcriptionally latent in normal conditions, method for modification of gene expression characteristics for eucariotic cell line gene, differentiated eucariotic cell line (variants), dna-constract
Автори англійськоюCHAPPEL SCOTT C.
Назва патенту російськоюСпособ активации гена, транскрипционно молчащего в норме, из генома эукариотической клеточной линии, способ модификации характеристик экспрессии гена из генома эукариотической клеточной линии, диференцированная эукариотическая клеточная линия (варианты), днк-конструкт
Автори російськоюЧеппель Скотт С.
МПК / Мітки
МПК: C12N 15/09, C12N 1/19, C12N 15/67, C12N 1/15, C12N 15/90, C12N 15/85, C12P 21/02, C12N 5/10, C12Q 1/68, C12N 1/21
Мітки: гена, еукаріот, спосіб, активації, диференційована, модифікації, клітинної, еукаріотичної, геному, характеристик, транскрипційно, мовчить, норми, експресії, лінії
Код посилання
<a href="https://ua.patents.su/30-42675-sposib-aktivaci-gena-shho-v-normi-transkripcijjno-movchit-z-genomu-eukariotichno-klitinno-lini-sposib-modifikaci-kharakteristik-ekspresi-gena-z-genomu-eukariotichno-klitinno-lini-d.html" target="_blank" rel="follow" title="База патентів України">Спосіб активації гена, що в нормі транскрипційно мовчить, з геному еукаріотичної клітинної лінії, спосіб модифікації характеристик експресії гена з геному еукаріотичної клітинної лінії, диференційована еукаріот</a>
Попередній патент: Спосіб одержання похідних 3-кето-4-азастероїду та проміжні сполуки для його здійснення
Наступний патент: Спосіб перетворення контрольного каналу для використання його як звукового каналу/каналу даних в радіокомунікаційній системі
Випадковий патент: Спосіб дослідження слухової системи людини