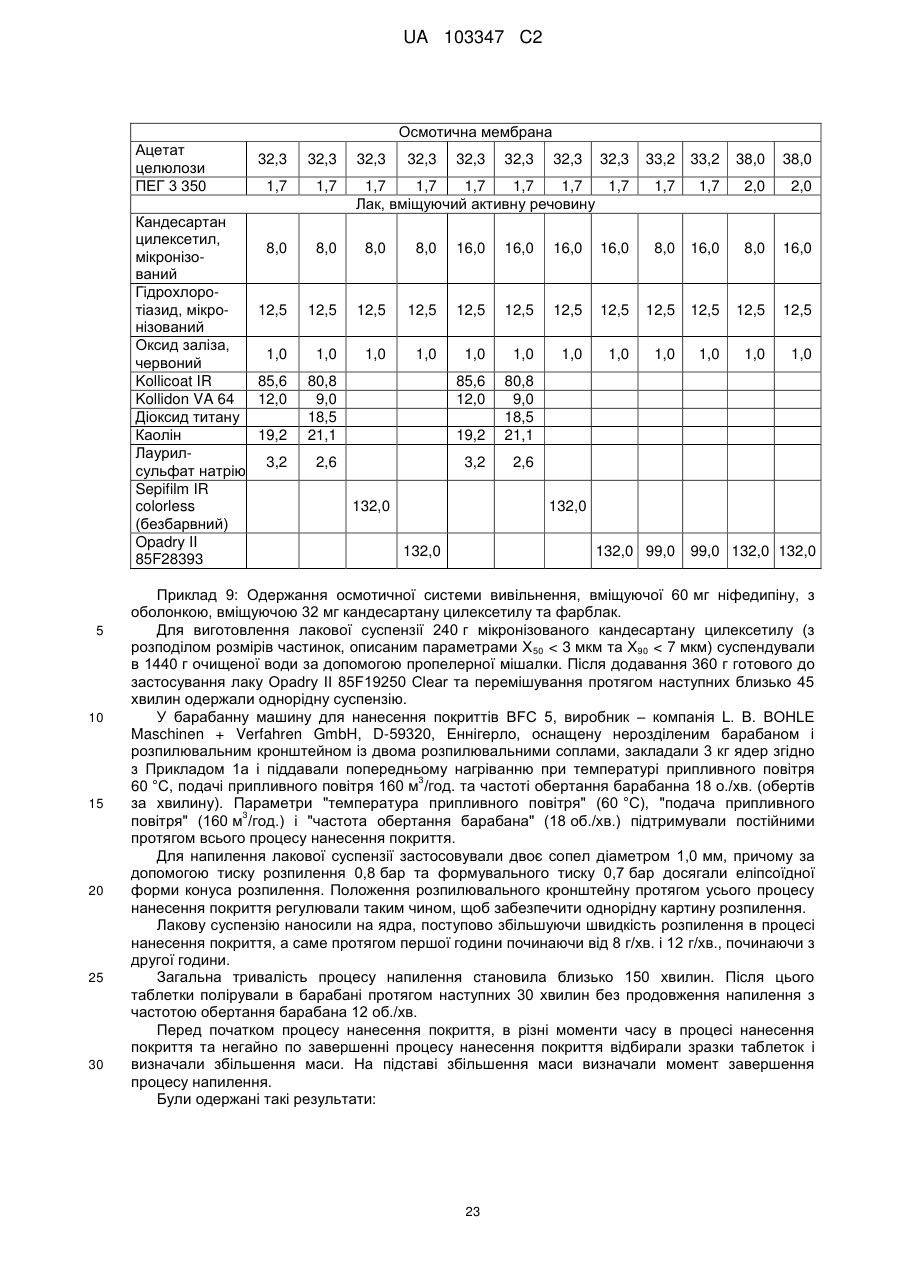
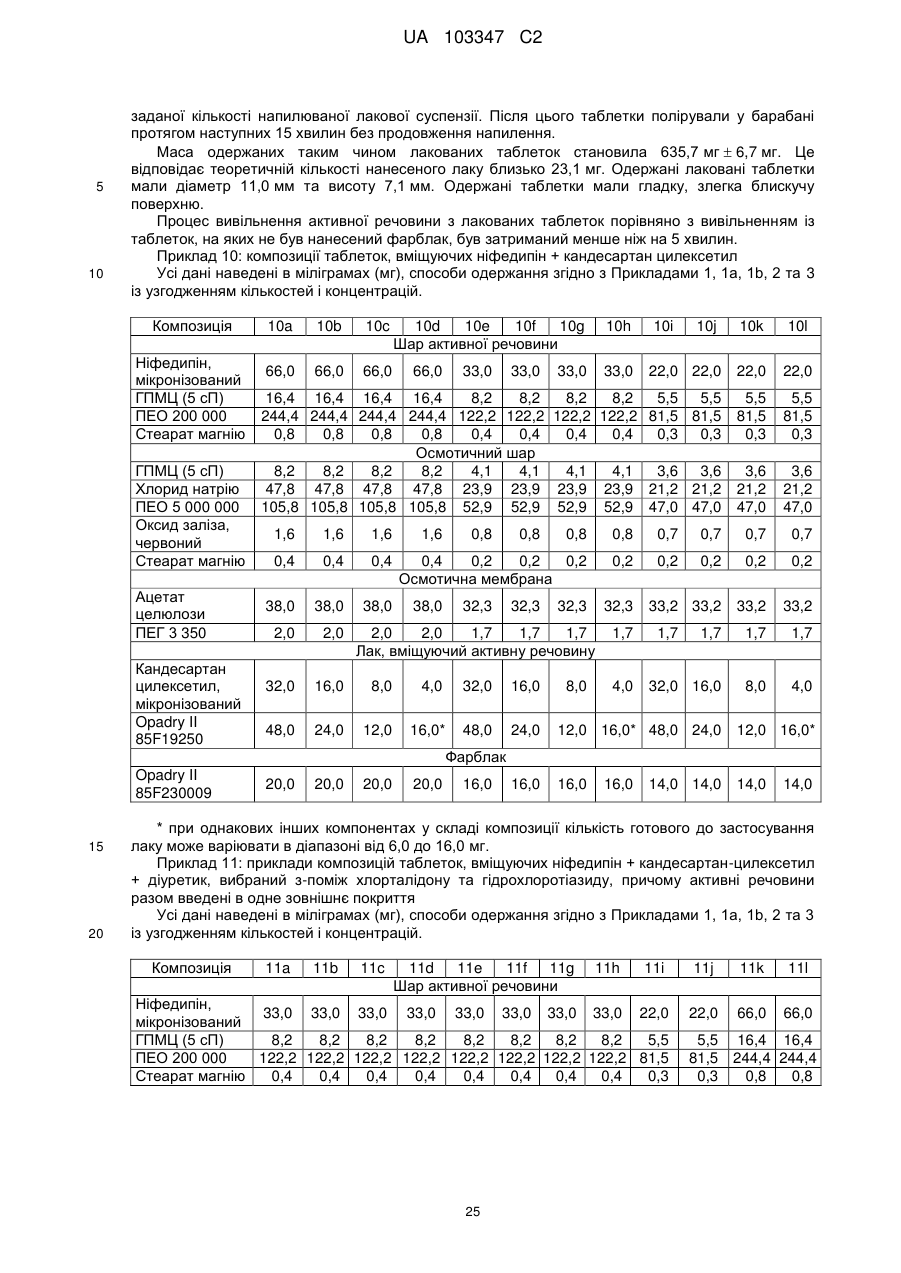
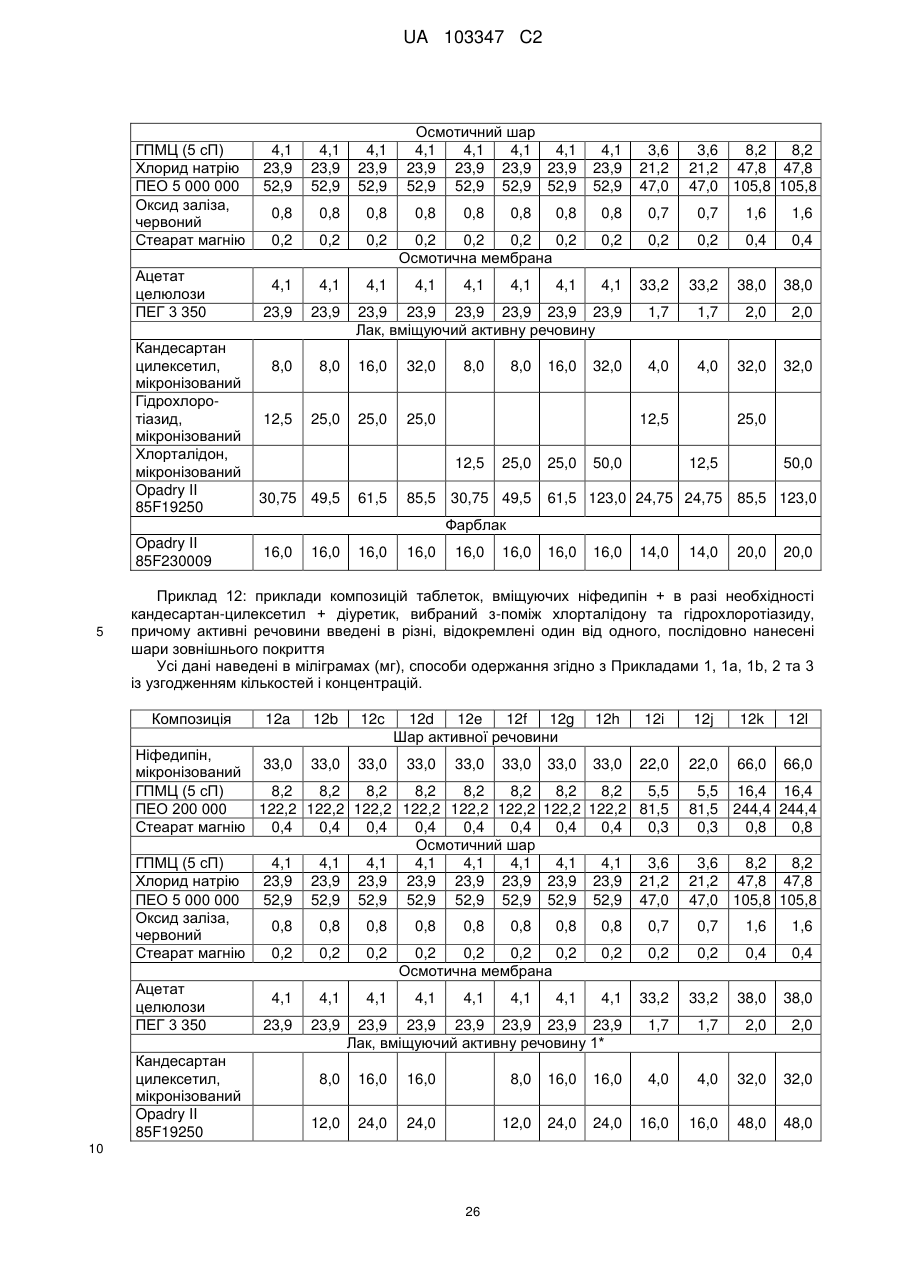
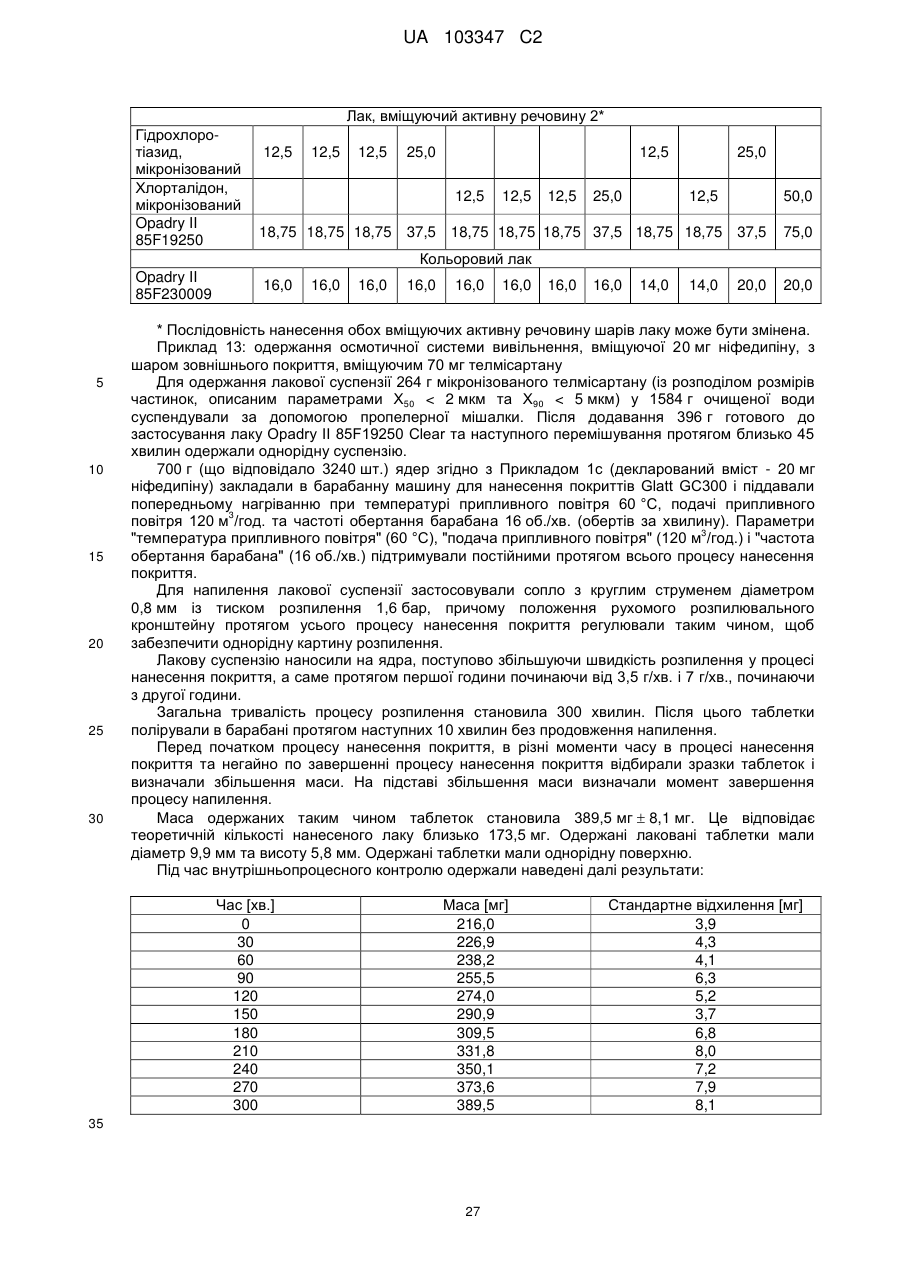
Фармацевтична препаративна форма, що містить ніфедипін або нізолдипін і антагоніст ангіотензину-ii та/або діуретик
Номер патенту: 103347
Опубліковано: 10.10.2013
Автори: Функе Адріан, Куль Александер, Ом Андреас, БРЬОККЕР ФРАНК, КВЕСІЧ ДЕННІС, Фолькмер Томас, Брендель Еріх
Формула / Реферат
1. Фармацевтична препаративна форма, що містить комбінацію активної речовини ніфедипіну або нізолдипіну із принаймні одним антагоністом ангіотензину-ІІ та/або принаймні одним діуретиком, яка відрізняється тим, що ядро є осмотичною системою вивільнення та що ніфедипін або нізолдипін вміщені в ядро, а антагоніст ангіотензину-ІІ та/або діуретик - в зовнішнє покриття навколо ядра, а також, що вивільнення принаймні 85 % ніфедипіну або нізолдипіну (відносно декларованої загальної кількості відповідної активної речовини) відбувається протягом періоду часу принаймні 4 та максимум 24 години, а вивільнення принаймні 60 % антагоніста ангіотензину-ІІ та/або діуретика (відносно декларованої загальної кількості відповідної активної речовини) відбувається протягом 30 хвилин згідно з методикою вивільнення Фармакопеї США (USP) із застосуванням апаратури 2 (лопатева мішалка), причому зовнішнє покриття містить принаймні один плівкоутворюючий полімер, придатний для швидкого вивільнення активної речовини.
2. Фармацевтична препаративна форма за п. 1, в якій антагоніст ангіотензину-ІІ вибраний із групи, що включає азилсартан, кандесартан, лосартан, телмісартан, ірбесартан, ембурсартан, епросартан, валсартан або олмесартан, або кандесартан у формі його проліків кандесартану цилексетилу або олмесартан у формі його проліків олмесартану медоксомілу.
3. Фармацевтична препаративна форма за будь-яким з пп. 1 або 2, в якій діуретик вибраний із групи, що включає ацетазоламід, дихлорфенамід, метазоламід, фуросемід, торасемід, буметанід, етакринову кислоту, піретанід, амілорид, триамтерен, спіронолактон, канреонат калію, еплеренон, гідрохлоротіазид, хлорталідон, ксипамід, метолазон, мефрузид або індапамід.
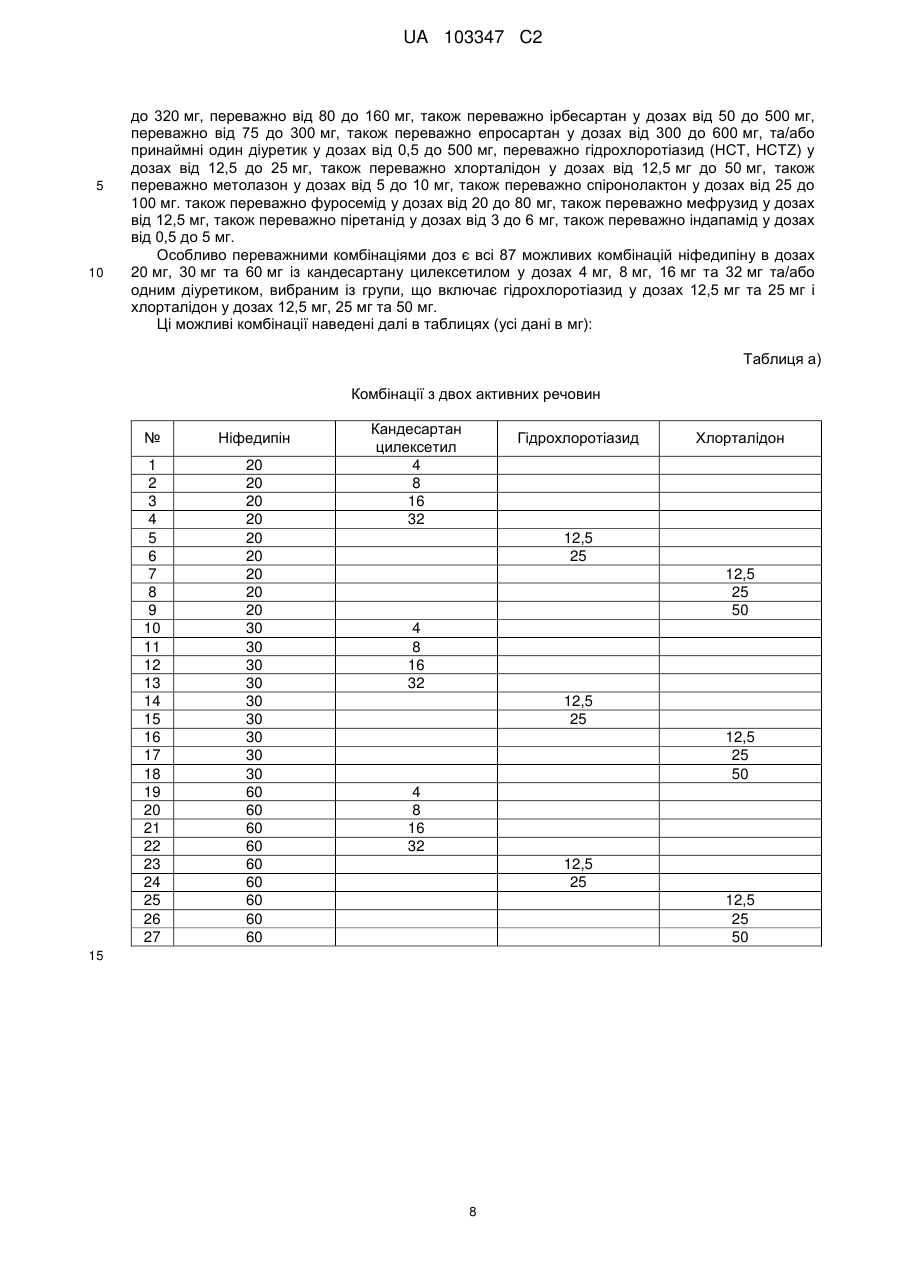
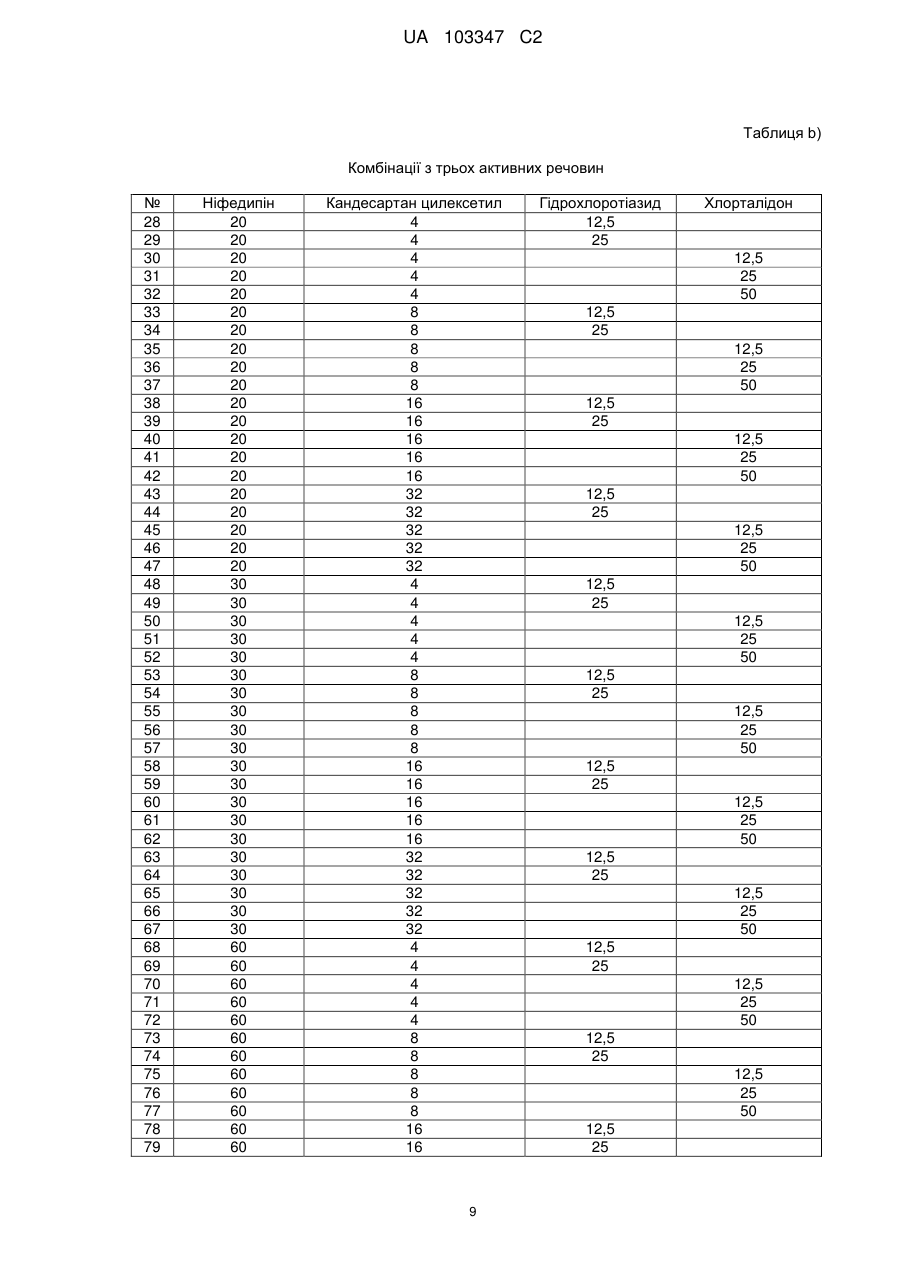
4. Фармацевтична препаративна форма за будь-яким з пп. 1-3, яка відрізняється тим, що мінімальна доза, в якій застосовано ніфедипін або нізолдипін, становить 5 мг, а максимальна доза - 90 мг, і мінімальна доза, в якій застосовано антагоніст ангіотензину-ІІ, становить 2 мг, а максимальна доза - 500 мг, та/або мінімальна доза, в якій застосовано діуретик, становить 0,5 мг, а максимальна доза - 500 мг.
5. Фармацевтична препаративна форма за будь-яким з пп. 1-4, яка відрізняється тим, що оболонка осмотичної системи вивільнення виконана з ацетилцелюлози або суміші ацетилцелюлози та поліетиленгліколю.
6. Фармацевтична препаративна форма за будь-яким з пп. 1-5, яка відрізняється тим, що плівкоутворюючий полімер вибраний із групи, що включає похідні целюлози, такі як метилцелюлоза (МЦ, МС), гідроксиметилпропілцелюлоза (ГПМЦ, НРМС), гідроксипропілцелюлоза (ГПЦ, НРС), карбоксиметилцелюлоза натрію (Na-CMC), гідроксіетилцелюлоза (ГЕЦ, НЕС) та їх суміші, або із групи, що включає синтетичні полімери, такі як полівінілпіролідон (повідон, PVP) співполімер вінілпіролідону та вінілацетату (коповідон), полівініловий спирт (PVA), полівінілацетат (PVAc), частково гідролізований полівініловий спирт, співполімери полівінілового спирту та поліетиленгліколю (PVA-CO-PEG) та їх суміші.
7. Фармацевтична препаративна форма будь-яким з пп. 1-6, яка відрізняється тим, що плівкоутворюючий полімер вибраний із групи, що включає полівініловий спирт (PVA), полівінілацетат (PVAc), частково гідролізований полівініловий спирт, співполімери полівінілового спирту та поліетиленгліколю (PVA-PEG Co-Polymer) та їх суміші.
8. Фармацевтична препаративна форма будь-яким з пп. 1-7, яка відрізняється тим, що плівкоутворюючим полімером є полівініловий спирт (PVA).
9. Фармацевтична препаративна форма за будь-яким з пп. 1-8, яка відрізняється тим, що вміст антагоніста ангіотензину-ІІ та/або діуретика в зовнішньому покритті становить від 10 до 50 % відносно маси сухої речовини зовнішнього покриття.
10. Фармацевтична препаративна форма за будь-яким з пп. 1-9, яка відрізняється тим, що маса зовнішнього покриття у відповідній винаходові препаративній формі становить від 20 до 300 мг.
11. Фармацевтична препаративна форма за будь-яким з пп. 1-10, яка відрізняється тим, що товщина зовнішнього покриття становить від 50 до 1500 мкм.
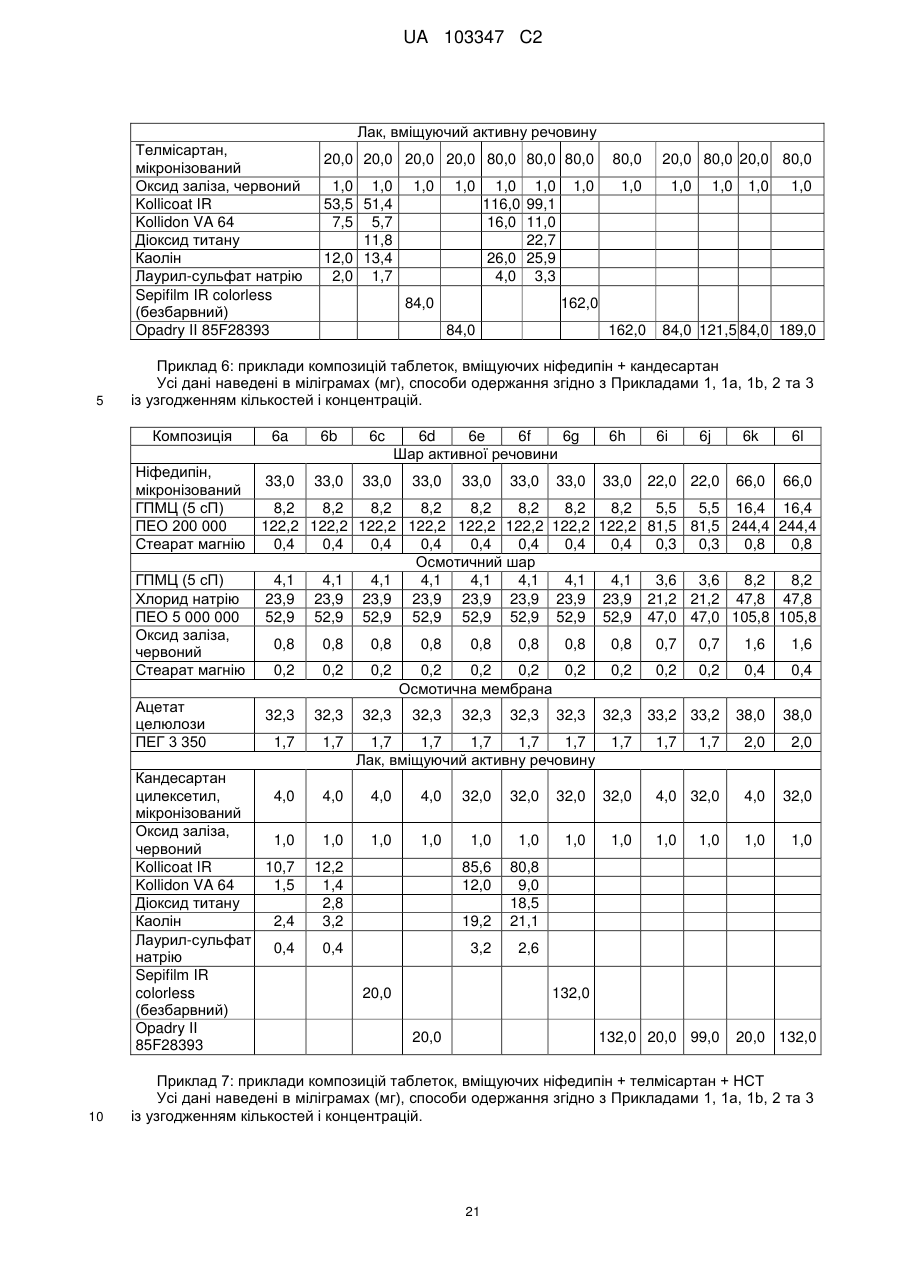
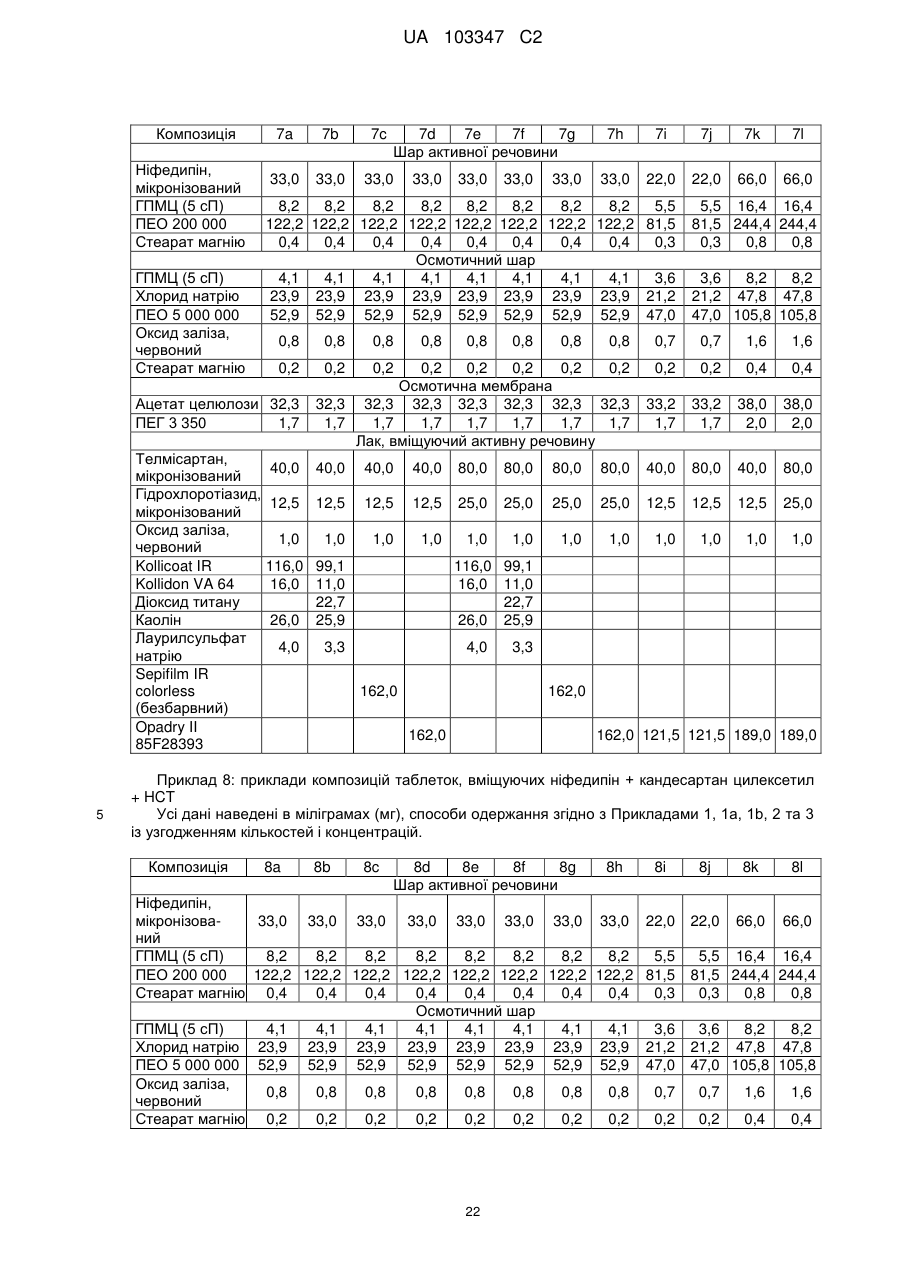
12. Спосіб одержання фармацевтичної препаративної форми за одним або кількома пунктами 1-11, який відрізняється тим, що водну лакову суспензію, яка містить принаймні один антагоніст ангіотензину-ІІ та/або принаймні один діуретик, принаймні один плівкоутворюючий полімер і, в разі необхідності, інші допоміжні речовини, шляхом напилення наносять на ядра при температурі припливного повітря від 40 до 70 °С.
Текст
Реферат: Винахід стосується фармацевтичної препаративної форми, що містить комбінацію активної речовини ніфедипін або нізолдипін із принаймні одним антагоністом ангіотензину-ІІ та/або принаймні одним діуретиком, яка відрізняється тим, що в організмі вивільнення ніфедипіну або нізолдипіну відбувається контрольовано (модифіковано), а вивільнення антагоніста ангіотензину-ІІ та/або діуретика відбувається швидко (immediate release (IR)), а також способу її одержання, її застосування як лікарського засобу, а також її застосування для профілактики, вторинної профілактики або лікування захворювань. UA 103347 C2 (12) UA 103347 C2 UA 103347 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід стосується фармацевтичної препаративної форми, що містить комбінацію активної речовини ніфедипін або нізолдипін із принаймні одним антагоністом ангіотензину-IІ та/або принаймні одним діуретиком, яка відрізняється контрольованим (модифікованим) вивільненням в організмі ніфедипіну або нізолдипіну та швидким вивільненням (негайним вивільненням, immediate release (IR)) антагоніста ангіотензину-IІ та/або діуретика, способу її одержання, її застосування як лікарського засобу, а також її застосування для профілактики, вторинної профілактики або лікування захворювань. Головною метою фармакологічної терапії гіпертонії є контроль кров'яного тиску для запобігання захворюванням, які є наслідком попередніх хвороб, таким як серцево-судинні захворювання, цереброваскулярні захворювання і пошкодження кінцевих органів. Первинну терапію пацієнтів із підвищеним кров'яним тиском у загальному випадку починають з призначення монотерапії одним гіпотензивним препаратом (рекомендації з діагностики та лікування European Society of Hypertension Leitlinien 2007, Joint National Committee VII (JNC VII) Leitlinien, Japanese Society of Hypertension (JSH) Leitlinien). Слід очікувати, що в разі застосування монотерапії препаратами для лікування гіпертонії для частини пацієнтів не буде досягнутий необхідний цільовий кров'яний тиск, як описано в міжнародних рекомендаціях із діагностики та лікування. У Сполучених Штатах Америки близько 33 % хворих на гіпертонію пацієнтів, яким було призначено монотерапію, протягом першого року були переведені на терапію другої лінії. Антагоністи кальцію, такі як, наприклад, ніфедипін і нізолдипін, успішно застосовують у терапії високого кров'яного тиску як перевірені на практиці активні речовини. Наведені приклади добре відомі фахівцям і описані у відповідній спеціальній літературі. Завдяки безпосередній дії на артеріальні кровоносні судини вони надійно знижують кров'яний тиск у багатьох пацієнтів. Проте, внаслідок переважної ділятації приносних судин (Vasa afferentia) вони спричиняють підйом фільтраційного тиску в нирках. При попередньому ураженні нирок це може призвести до збільшеного навантаження фільтраційного апарату і спричинити протеїнурію у пацієнтів. Запобігти цьому ефекту можна шляхом додавання терапевтично ефективної дози антагоністу ангіотензину-IІ. Придатними до застосування як антагоністи ангіотензину-IІ є всі відомі антагоністи ангіотензину-IІ, такі як, наприклад, азилсартан, кандесартан, ембурсартан, епросартан, ірбесартан, лосартан, телмісартан, валсартан або олмесартан. Наведені приклади добре відомі фахівцям і описані у відповідній спеціальній літературі. Оскільки антагоністи ангіотензину-IІ проявляють дилятаторну активність також в області виносних судин (Vas efferens), додаткове введення цих речовин дозволяє запобігти небажаному зростанню фільтраційного тиску. Як відомо з публікації Hayashi K; Nagahama T, Oka K, Epstein M, Sarute T: Disparate effects of calcium antagonists on renal microcirculation. Hypertens Res 1996: 19: 31-36, комбінація ніфедипіну або нізолдипіну з антагоністом ангіотензину-IІ дозволяє дуже ефективно знизити кров'яний тиск із невеликим навантаженням нирок. Це є значним терапевтичним прогресом. Окрім цього, при застосуванні цієї комбінації можуть бути зменшені також інші побічні ефекти, такі як периферійні набряки, спричинені антагоністами кальцію, та зумовлене рефлекторним вивільненням норадреналіну стимулювання симпатичної нервової системи. Результати останніх досліджень (ACCOMPLISH; American Cardiolygy Congress Jamerson KA, і інші, березень, 31, 2008; Чікаго, Ілінойс) підтверджують перевагу твердих комбінацій не лише щодо ефективності контролю кров'яного тиску, але й при застосуванні антагоністу кальцію щодо зменшення рівня захворюваності та смертності від серцево-судинних захворювань. При хворобах, які потребують довготривалого лікування, або для довготермінової профілактики захворювань бажано, щоб частота прийому медикаментів була якомога меншою. Це не лише зручніше для пацієнтів, але й дозволяє підвищити надійність лікування, оскільки зменшує недоліки нерегулярного прийому. Бажаного зменшення частоти прийому препаратів, наприклад від уведення препаратів двічі на добу до одноразового введення добової дози, можна досягти шляхом подовження періоду наявності терапевтично ефективного рівня активної речовини у плазмі завдяки модифікованому процесу вивільнення активної речовини із препаративних форм. Завдяки застосуванню препаративних форм із модифікованим вивільненням активної речовини можна також зменшити небажані побічні ефекти, які корельовані з піками концентрації, шляхом згладжування коливань зміни рівня активної речовини в плазмі (мінімізації так званого коефіцієнта рівноваги (peak-trough), тобто співвідношення між залишковою дією препарату і піковою дією), отже шляхом уникнення високих концентрацій активної речовини в плазмі, які часто можна спостерігати після введення лікарських форм зі швидким вивільненням активної речовини. 1 UA 103347 C2 5 10 15 20 25 30 35 40 45 50 55 60 Насамперед для довготривалої терапії або профілактики і вторинної профілактики серцевосудинних захворювань зручно мати в розпорядженні активні речовини в такій формі, яка завдяки модифікованому вивільненню активної речовини спричиняє зменшення коефіцієнта рівноваги (peak-trough) і дозволяє вводити препарат лише один раз на добу. При розробці композиції слід враховувати також фізико-хімічні та біологічні характеристики активних речовин, наприклад відносно невелику водорозчинність ніфедипіну (близько 9 мг/л) та період напіввиведення з плазми, який становить близько 2 годин. Отже, для забезпечення можливості бажаного одноразового введення добової дози необхідні спеціальні галенові композиції з модифікованим процесом вивільнення ніфедипіну або нізолдипіну з урахуванням їх фізико-хімічних та біологічних характеристик. Усі комерційно доступні антагоністи ангіотензину-IІ продають у формі композицій швидкого вивільнення (immediate release (IR)), оскільки вони попри короткий домінантний період напіввиведення з плазми зберігають активність протягом 24 годин. Тому бажано розробити фармацевтичну препаративну форму, яка містить принаймні один антагоніст ангіотензину-IІ та ніфедипін або нізолдипін, причому антагоніст ангіотензину-IІ вивільняється швидко, а процес вивільнення ніфедипіну або нізолдипіну є модифікованим. Стосовно біологічних характеристик ніфедипіну або нізолдипіну та антагоністу ангіотензинуIІ вирішальним є те, що резорбція обох активних речовин відбувається з віддалених ділянок кишечнику без суттєвої втрати біодоступності. Це відбувається лише приблизно для 30-50 % усіх активних речовин, і тому відповідний вибір активних речовин комбінацій має вирішальне значення при розробці продукту, що містить комбінацію швидко вивільнюваних активних речовин та активних речовин пролонгованої дії. Діуретики є лікарськими препаратами для виведення води з організму людей чи тварин. Почасти відбувається також посилене виведення солей. Це призводить до зменшення об'єму плазми, а також периферичного опору. Насамперед діуретики застосовують для зниження кров'яного тиску. Розрізняють різні типи діуретиків. Інгібітори карбоангідрази (ацетазоламід): блокада секреції протонів і реабсорбція бікарбонату натрію, переважно у проксимальному канальці. Їх застосовують хіба що лише при лікуванні глаукоми в офтальмології. Петльові діуретики (фуросемід, торасемід, буметанід, етакринова кислота, піретанід): оборотне інгібування транспортної системи Na/2Cl/K у товстому сегменті висхідного відділу петлі Генле. Калійзберігаючі діуретики (амілорид, триамтерен): блокада натрієвих каналів у з'єднувальному канальці та в збиральній трубочці, інгібування реабсорбції натрію, внаслідок чого зменшення секреції калію. Антагоністи альдостерону (спіронолактон, канреонат калію, еплеренон): конкурентне зв'язування з рецептором альдостерону, внаслідок чого інгібування реабсорбції натрію та секреції калію; застосовують при асциті в зв'язку з цирозом печінки та як додатковий терапевтичний засіб при хронічній серцевій недостатності. Тіазидні діуретики та інші сульфонамідні діуретики (гідрохлоротіазид (HCTZ), хлоротіазид, хлорталідон, ксипамід, індапамід, мефрусид): оборотне гальмування котранспорту NaCl у звивистому дистальному канальці (люмінальне), інгібування карбоангідрази, зменшення швидкості гломерулярної фільтрації (GFR; glomerular filtration rate), гідрохлоротіазид дуже часто застосовують у комбінації з гіпотензивними препаратами. Додавання діуретика, такого як, наприклад, HCTZ, при монотерапії посилює гіпотензивну дію комбінації. Комбінації діуретика з антагоністом ангіотензину-IІ відомі фахівцям, наприклад, із публікації EP 1 306 088 B (кандесартан і фуросемід), як і наведені далі препарати з фіксованою ® комбінацією доз (Fix Dosis) для лікування артеріальної гіпертонії, такі як, наприклад, Hyzaar ® (лосартан калію плюс HCTZ) компанії Merck, Co-Diovan (валсатран плюс HCTZ) компанії ® Novartis або Micardis Plus компанії Boehringer (телмісартан плюс HCTZ). Комбінації антагоніста ангіотензину-IІ із блокаторами кальцієвих каналів з однієї сторони або з діуретиками з іншої сторони відомі фахівцям, наприклад, із публікації WO 92/10097. Окремо описані комбінації епросартану з ніфедипіном та епросартану з гідрохлортіазидом. Конкретно описані капсули з твердого желатину і таблетки зі швидким вивільненням активної речовини. Препаративні форми із модифікованим/пролонгованим процесом вивільнення активної речовини ніфедипін або нізолдипін у комбінації з антагоністом ангіотензину-IІ, а також спосіб їх одержання описані, наприклад, у публікації WO 2007/003330. Процес вивільнення як ніфедипіну, так і антагоніста ангіотензину-IІ із цих композицій пролонгований. Діуретики із різними періодами напіввиведення активної речовини з плазми і тривалістю дії комерційно доступні переважно в формі композицій зі швидким вивільненням (immediate release (IR)) активних речовин для одноразового прийому добової дози. Тому бажано розробити фармацевтичну препаративну форму, яка містить принаймні один антагоніст ангіотензину-IІ та/або діуретик і ніфедипін або нізолдипін, причому процес вивільнення антагоніста 2 UA 103347 C2 5 10 15 20 25 30 35 40 45 50 55 60 ангіотензину-IІ та/або діуретика відбувається швидко, а процес вивільнення ніфедипіну або нізолдипіну модифікований. Відомі різні способи одержання фармацевтичної препаративної форми з модифікованим процесом вивільнення активної речовини, див., наприклад, публікації B. Lippold у "Oral Controlled Release Products: Therapeutic and Biopharmaceutic Assessment" видавництво U. Gundert-Remy, та H. Möller, Штутгарт, видавництво Wiss.Verl.-Ges., 1989, 39-57. Препаративні форми, із яких процес вивільнення активних речовин ніфедипін або нізолдипін модифікований/уповільнений, а також їх виготовлення описані, наприклад, у публікаціях EP 0 299 211, EP 0 386 440, EP 0 776 660 та WO 2003/080057. Основою особливо придатних до застосування препаративних форм із модифікованим/пролонгованим вивільненням активних речовин ніфедипін або нізолдипін є осмотичні системи вивільнення. При цьому ядро, наприклад капсули або таблетки, переважно таблетки, оточують напівпроникною мембраною, в якій виконаний принаймні один отвір. Водопроникна мембрана є непроникною для компонентів ядра, але впускає воду ззовні в систему шляхом осмосу. Після цього проникла вода під дією утвореного осмотичного тиску починає розчиняти активну речовину або вільно проникає в мембрану крізь один чи кілька отворів, утворюючи суспензію. Регулювати загальну кількість та швидкість вивільнення активної речовини можна в основному шляхом відповідного вибору товщини і пористості напівпроникної мембрани, складу ядра, а також кількості та розміру отвору/отворів. Переваги, аспекти складення композицій, форми застосування та інформація щодо способів виготовлення описані, зокрема, в наведених далі публікаціях: - Santus, G., Baker, R.W., „Osmotic drug delivery: a review of the patent literature”, Journal of Controlled Release 35 (1995), 1-21 - Verma, R.K., Mishra, B., Garg, S., „Osmotically controlled oral drug delivery“, Drug Development and Industrial Pharmacy 26 (7), 695-708 (2000) - Verma, R.K., Krishna, D.M., Garg, S., „Formulation aspects in the development of osmotically controlled oral drug delivery systems“, Journal of Controlled Release 79 (2002), 7-27 - Verma, R.K., Arora, S., Garg, S., „Osmotic pumps in drug delivery“, Critical Reviews in Therapeutic Drug Carrier Systems 21 (6) (2004), 477-520 - US 4,327,725, US 4,765,989, US 20030161882, EP 1 024 793. Осмотичні системи вивільнення з покриттям також відомі. Зокрема, в публікації EP 0 339 811 описана осмотична система вивільнення, яка складається з ацетил-целюлозної оболонки, що оточує вміщуюче ніфедипін та агент набухання ядро, на яку нанесене зовнішнє покриття з ГПМЦ (гідроксипропілметилцелюлози) завтовшки 0,0025 см. У публікаціях US 4,948,592, WO 93/03711 та WO 93/00071 описані осмотичні системи вивільнення, що містять в ядрі частину активної речовини із пролонгованим профілем вивільнення та частину тієї самої активної речовини у зовнішньому покритті, яка може вивільнятися безпосередньо. При цьому зовнішнє покриття завжди містить лише невелику частину загальної кількості активної речовини, необхідної для забезпечення фармацевтичної дії. Комбінації із різних активних речовин або зовнішніх покриттів, які містять антагоніст ангіотензину-IІ та/або діуретик, не описані. Задачею винаходу було розроблення стабільної фармацевтичної композиції, яка містить ніфедипін або нізолдипін і принаймні один антагоніст ангіотензину-IІ та/або принаймні один діуретик, причому вивільнення антагоніста ангіотензину-IІ та/або діуретика відбувається швидко (IR), а процес вивільнення ніфедипіну або нізолдипіну пролонгований (Retard), і таким чином відповідає динаміці процесу вивільнення відомих однокомпонентних препаратів. Неочікувано було виявлено, що винахід уможливлює одержання стабільної фармацевтичної препаративної форми, яка містить антагоніст ангіотензину-IІ та/або діуретик у достатній для забезпечення його фармацевтичної дії формі та може швидко його вивільняти, а також містить ніфедипін або нізолдипін, які може вивільняти контрольовано (модифіковано). Для забезпечення швидкого вивільнення антагоніста ангіотензину-IІ та/або діуретика необхідно ввести його у шар зовнішнього покриття препаративної форми. Щоб вміщувати необхідну кількість активної речовини, товщина шару зовнішнього покриття має набагато перевищувати товщину досі відомих плівкових зовнішніх покриттів осмотичних систем вивільнення, які не містять активної речовини. Таким чином, параметри зовнішнього покриття значною мірою залежать від властивостей оброблюваної активної речовини. Особливо в осмотичних системах вивільнення активних речовин на основі ацетилцелюлози нанесення товстих шарів внаслідок гладкої та гідрофобної поверхні є критичним. Загальна проблема, яка полягає у слабкому зчепленні товстих шарів, також неочікувано була вирішена згідно з винаходом, що дозволило уникнути відшаровування зовнішнього покриття. Вимога щодо розроблення уніфікованих стосовно вмісту активної речовини в зовнішньому покритті препаративних форм (однорідність 3 UA 103347 C2 5 10 15 20 25 30 35 40 45 50 55 вмісту, content uniformity) також дотримана. Цю вимогу дотримати тим важче, чим товщий шар зовнішнього покриття, оскільки в звичайному випадку зі збільшенням товщини шару невпинно збільшуються флуктуації. Крім цього, виконання товстого шару зовнішнього покриття потребує тривалого технологічного часу при роботі у вологих теплих умовах, які можуть прискорити хімічні реакції розкладу в шарі зовнішнього покриття. Неочікувано було виявлено, що динаміка процесу вивільнення активних речовин із відповідної винаходові препаративної форми приблизно відповідає динаміці процесу вивільнення активної речовини із відомих однокомпонентних препаратів, тобто швидке вивільнення (IR) антагоніста ангіотензину-IІ та/або діуретика і контрольоване (модифіковане, пролонговане) вивільнення ніфедипіну або нізолдипіну. Таким чином, відповідні винаходові препаративні форми можна вважати біоеквівалентними відомим однокомпонентним лікарським препаратам з такою самою дозою активної речовини. Крім цього, в процесі напилення згідно з відповідним винаходові способом одержання покриття неочікувано забезпечується стабільність антагоніста ангіотензину-IІ та/або діуретика. Предметом винаходу є фармакологічна препаративна форма, яка містить комбінацію активної речовини ніфедипін або нізолдипін із принаймні одним антагоністом ангіотензину-IІ та/або принаймні одним діуретиком і принаймні одним плівкоутворюючим полімером, яка відрізняється тим, що ніфедипін або нізолдипін вміщені в ядро, а антагоніст ангіотензину-IІ та/або діуретик – у зовнішнє покриття, яке оточує ядро. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що плівкоутворюючим полімером є частково гідролізований полівініловий спирт. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що як плівкоутворюючий полімер застосовують комерційно доступний препарат, так званий "готовий до застосування лак", який вже містить інші фармацевтичні допоміжні речовини і легко розчиняється у воді. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що як плівкоутворюючий полімер застосовують Opadry II 85F19250 Clear (готовий до застосування лак на основі ПВА марки Colorcon), який має такий склад: частково гідролізований полівініловий спирт, тальк, поліетиленгліколь (ПЕГ 3350), Полісорбат 80 (Твин 80). Іншим предметом винаходу є фармацевтична препаративна форма, яка містить комбінацію активної речовини ніфедипін або нізолдипін із принаймні одним антагоністом ангіотензину-IІ та принаймні одним плівкоутворюючим полімером, яка відрізняється тим, що ніфедипін або нізолдипін вміщені в ядро, а антагоніст ангіотензину-IІ – у зовнішнє покриття, яке оточує ядро. Іншим предметом винаходу є фармацевтична препаративна форма, яка містить комбінацію активної речовини ніфедипін або нізолдипін із принаймні одним діуретиком та принаймні одним плівкоутворюючим полімером, яка відрізняється тим, що ніфедипін або нізолдипін вміщені в ядро, а діуретик – у зовнішнє покриття, яке оточує ядро. Іншим предметом винаходу є фармацевтична препаративна форма, яка містить комбінацію активної речовини ніфедипін або нізолдипін із антагоністом ангіотензину-IІ та принаймні одним діуретиком і принаймні одним плівкоутворюючим полімером, яка відрізняється тим, що ніфедипін або нізолдипін вміщені в ядро, а антагоніст ангіотензину-IІ та діуретик – у зовнішнє покриття, яке оточує ядро. Відповідна винаходові препаративна форма відрізняється тим, що процес вивільнення ніфедипіну або нізолдипіну пролонгований, а вивільнення антагоніста ангіотензину-IІ чи діуретика відбувається швидко. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що фармацевтична препаративна форма має тверду, придатну до перорального введення, побудовану на основі осмотичної системи вивільнення активної речовини структуру. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що активні речовини перебувають у кристалічній чи переважно кристалічній формі. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що активні речовини перебувають у мікронізованій формі. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що активні речовини повністю або частково перебувають в аморфній формі. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що мінімальна доза, в якій застосовують ніфедипін або нізолдипін, становить 5 мг, а максимальна доза – 90 мг. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що мінімальна доза, в якій застосовують ніфедипін, становить 10 мг, а максимальна доза – 60 4 UA 103347 C2 5 10 15 20 25 30 35 40 45 50 55 60 мг, і мінімальна доза, в якій застосовують нізолдипін, становить 5 мг, а максимальна доза – 30 мг. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що доза, в якій застосовують ніфедипін, становить 20 мг, 30 мг або 60 мг, і мінімальна доза, в якій застосовують нізолдипін, становить 5 мг, а максимальна доза – 30 мг. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що мінімальна доза, в якій застосовують ніфедипін або нізолдипін, становить 10 мг, а максимальна доза – 40 мг. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що антагоністом ангіотензину-IІ є азилсартан, кандесартан, лосартан, телмісартан, ірбесартан, ембурсартан, епросартан, валсартан або олмесартан або їх проліки, або їх фармацевтично придатна сіль. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що антагоністом ангіотензину-IІ є кандесартан, олмесартан або телмісартан, або їх проліки, або їх фармацевтично придатна сіль. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що антагоністом ангіотензину-IІ є кандесартан або телмісартан, або їх проліки, або їх фармацевтично придатна сіль. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що антагоністом ангіотензину-IІ є кандесартан цілексетил. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що як антагоніст ангіотензину-IІ застосовують кандесартан або один із його проліків у дозі 416 мг. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що як антагоніст ангіотензину-IІ застосовують кандесартан або один із його проліків у дозі 232 мг. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що як антагоніст ангіотензину-IІ застосовують кандесартан або один із його проліків у дозі 4 мг, 8 мг, 16 мг або 32 мг. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що як антагоніст ангіотензину-IІ застосовують кандесартан або один із його проліків у дозі 416 мг. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що антагоніст ангіотензину-IІ олмесартан або один із його проліків застосовують у дозі 5-40 мг. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що олмесартан або один із його проліків застосовують у дозі від 10 до 40 мг. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що антагоністом ангіотензину-IІ є телмісартан, який застосовують у дозі від 10 до 80 мг. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що телмісартан застосовують у дозі від 10 до 40 мг. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що телмісартан застосовують у дозі 20 мг, 40 мг або 80 мг. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що лосартан застосовують у дозі від 25 до 100 мг. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що лосартан застосовують у дозі від 40 до 60 мг. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що ірбесартан застосовують у дозі від 50 до 500 мг. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що ірбесартан застосовують у дозі від 75 до 300 мг. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що діуретиком є гідрохлоротіазид, хлорталідон, мефрузид, піретанід або індапамід. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що діуретиком є гідрохлоротіазид або хлорталідон. Іншим предметом винаходу є фармацевтична препаративна форма, яка виконана у вигляді осмотичної однокамерної системи. Іншим предметом винаходу є фармацевтична препаративна форма, яка виконана у вигляді осмотичної однокамерної системи, що включає ядро, яке містить - від 5 до 50 % активної речовини ніфедипін або нізолдипін, - від 10 до 50 % ксантану, 5 UA 103347 C2 5 10 15 20 25 30 35 40 45 50 55 60 - від 5 до 40 % співполімеру вінілпіролідону з вінілацетатом, а також оболонку із водопроникного, не проникного для компонентів ядра матеріалу, в якій виконаний принаймні один отвір. Іншим предметом винаходу є фармацевтична препаративна форма, яка в ядрі містить додатково хлорид натрію як осмотично активну добавку. Іншим предметом винаходу є фармацевтична препаративна форма, яка в ядрі містить додатково хлорид натрію як осмотично активну добавку в кількості до 30 % відносно загальної маси компонентів внутрішнього ядра. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що оболонка виконана з ацетилцелюлози або суміші ацетилцелюлози та поліетиленгліколю. Іншим предметом винаходу є спосіб виготовлення осмотичної однокамерної системи, який відрізняється тим, що компоненти ядра змішують між собою, гранулюють і таблетують, утворене таким чином ядро покривають оболонкою, і потім в оболонці виконують один чи кілька отворів. Іншим предметом винаходу є спосіб одержання осмотичної однокамерної системи, яка відрізняється тим, що застосовують мокре гранулювання. Іншим предметом винаходу є фармацевтична препаративна форма, виконана у вигляді осмотичної двокамерної системи. Іншим предметом винаходу є фармацевтична препаративна форма, яка виконана у вигляді осмотичної двокамерної системи, що включає ядро, покрите шаром активної речовини, що містить - від 5 до 50 % активної речовини ніфедипін або нізолдипін, - від 40 до 95 % одного чи кількох осмотично активних полімерів, та осмотичний шар, що містить - від 40 до 90 % одного чи кількох осмотично активних полімерів, - від 5 до 40 % осмотично активної добавки, а також оболонку із водопроникного, не проникного для компонентів ядра матеріалу, в якій виконаний принаймні один отвір. Іншим предметом винаходу є фармацевтична препаративна форма, яка додатково містить у ядрі хлорид натрію як осмотично активну добавку. Іншим предметом винаходу є фармацевтична препаративна форма, яка в шарі активної речовини ядра містить поліетиленоксид в'язкістю від 40 до 100 мПа·с (5 %-ний водний розчин, 25 °C) як осмотично активний полімер, а в осмотичному шарі ядра містить поліетиленоксид в'язкістю від 5000 до 8000 мПа·с (1 %-ний водний розчин, 25 °C) як осмотично активний полімер. Іншим предметом винаходу є фармацевтична препаративна форма, яка відрізняється тим, що оболонка виконана з ацетилцелюлози або суміші ацетилцелюлози та поліетиленгліколю. Іншим предметом винаходу є спосіб виготовлення осмотичної двокамерної системи, яка відрізняється тим, що - компоненти шару активної речовини змішують і гранулюють, та - компоненти осмотичного шару змішують і гранулюють, - потім у таблетувальному пресі для виготовлення двошарових таблеток обидва грануляти спресовують у двошарову таблетку, - утворене таким чином внутрішнє ядро потім покривають оболонкою, та - в оболонці зі сторони активної речовини виконують один чи кілька отворів. Іншим предметом винаходу є спосіб виготовлення осмотичної двокамерної системи, який відрізняється тим, що здійснюють сухе гранулювання компонентів шару активної речовини. Іншим предметом винаходу є лікарський препарат, який містить фармацевтичну препаративну форму. Іншим предметом винаходу є застосування фармацевтичної препаративної форми для профілактики, вторинної профілактики та/або лікування захворювань. Іншим предметом винаходу є застосування фармацевтичної препаративної форми для виготовлення лікарського препарату для профілактики, вторинної профілактики та/або лікування захворювань. Іншим предметом винаходу є застосування для профілактики, вторинної профілактики та/або лікування серцево-судинних захворювань. Іншим предметом винаходу є застосування для профілактики, вторинної профілактики та/або лікування артеріальної гіпертонії. Іншим предметом винаходу є застосування ніфедипіну або нізолдипіну та антагоніста ангіотензину-IІ, та/або діуретика для одержання фармацевтичної препаративної форми. 6 UA 103347 C2 5 10 15 20 25 30 35 40 45 50 55 60 Іншим предметом винаходу є фармацевтична препаративна форма, в яку окрім ніфедипіну або нізолдипіну та антагоніста ангіотензину-IІ вводять іншу гіпотензивну активну речовину. Іншим предметом винаходу є фармацевтична препаративна форма, в яку окрім ніфедипіну або нізолдипіну та антагоніста ангіотензину-IІ вводять діуретик. Іншим предметом винаходу є фармацевтична препаративна форма, в якій застосовують гідрохлоротіазид. Іншим предметом винаходу є спосіб профілактики, вторинної профілактики та/або лікування серцево-судинних захворювань шляхом введення твердої, придатної для перорального застосування, вміщуючої комбінацію ніфедипіну або нізолдипіну/антагоніста ангіотензину-IІ фармацевтичної препаративної форми, що ґрунтується на системах вивільнення активної речовини. Ядром відповідної винаходові фармацевтичної препаративної форми може бути, в свою чергу, таблетка з пролонгованим вивільненням активної речовини, таблетка в оболонці, таблетка в оболонці із зовнішнім покриттям, капсула з прологнованим вивільненням активної речовини або осмотична система вивільнення активної речовини, яка має відповідне винаходові зовнішнє покриття, вміщуюче принаймні один антагоніст ангіотензину-IІ та/або принаймні один діуретик. Переважно ядром є осмотична система вивільнення активної речовини. Таким чином, переважним предметом винаходу є фармацевтична препаративна форма, що містить комбінацію активної речовини ніфедипін або нізолдипін із принаймні одним антагоністом ангіотензину-IІ та/або принаймні одним діуретиком, яка відрізняється тим, що ніфедипін або нізолдипін вміщені в ядро осмотичної системи вивільнення активної речовини, а антагоніст ангіотензину-IІ та/або діуретик вміщені в зовнішнє покриття, нанесене поверх осмотичної системи вивільнення активної речовини. Іншим предметом винаходу є фармацевтична препаративна форма, що містить комбінацію активної речовини ніфедипін або нізолдипін із принаймні одним антагоністом ангіотензину-IІ та/або принаймні одним діуретиком, яка відрізняється тим, що в організмі вивільнення вміщених у ядро ніфедипіну або нізолдипіну відбувається контрольовано (модифіковано), а вивільнення вміщеного в покривний шар антагоністу ангіотензину-IІ та/або діуретику відбувається швидко. Як переважні антагоністи ангіотензину-IІ застосовують азилсартан, кандесартан, лосартан, телмісартан, ірбесартан, ембурсартан, епросартан, валсартан або олмесартан, особливо переважно кандесартан, олмесартан або телмісартан, цілком переважно кандесартан або телмісартан, або їх проліки. Поняття "проліки" охоплює сполуки, які самі можуть бути біологічно активними або неактивними, проте протягом часу їх перебування в організмі перетворюються на застосовувані згідно з винаходом сполуки (наприклад в результаті метаболічних чи гідролітичних процесів). Проліком кандесартану є, наприклад, кандесартан цілексетил. Цей та інші приклади придатних до застосування проліків описані в публікації J. Med. Chem. серпень 1993 6; 36(16):2343-9. Проліком олмесартану є, наприклад, олмесартан медоксоміл. Наведені сартани можуть перебувати також у формі фармацевтично придатних солей, наприклад лосартану калію та епросартану мезилату. В особливо переважній формі виконання винаходу як антагоніст ангіотензину-IІ застосовують кандесартан цілексетил. Як переважні діуретики застосовують інгібітори карбоангідрази, такі як, наприклад, ацетазоламід, дихлорфенамід та метазоламід, або петльові діуретики, такі як, наприклад, фуросемід, торасемід, буметанід, етакринова кислота та піретанід, або калійзберігаючі діуретики, такі як, наприклад, амілорид та триамтерен, або антагоністи альдостерону, такі як, наприклад, спіронолактон, канреонат калію та еплеренон, або тіазидні діуретики, та інші сульфонамідні діуретики, такі як, наприклад, гідрохлоротіазид, хлорталідон, ксипамід, метолазон, мефрузид та індапамід. Особливо переважно застосовують гідрохлоротіазид, хлорталідон, мефрузид, піретанід та індапамід. Цілком переважно застосовують гідрохлоротіазид або хлорталідон. Відповідна винаходові препаративна форма містить переважно ніфедипін або нізолдипін у дозах від 5 до 90 мг, у разі застосування ніфедипіну переважно у дозах від 10 до 60 мг, особливо переважно в дозах 20, 30 або 60 мг, у разі застосування нізолдипіну - переважно у дозах від 5 до 30 мг, та принаймні один антагоніст ангіотензину-IІ у дозах від 2 до 500 мг, переважно кандесартан, особливо переважно кандесартан цилексетил у дозах від 2 до 40 мг, переважно від 4 до 32 мг, особливо переважно у дозах від 4, 8, 16 або 32 мг, також переважно олмесартан, особливо переважно олмесартан медоксоміл у дозах від 5 до 40 мг, переважно від 10 до 40 мг, також переважно телмісартан у дозах від 10 до 80 мг, особливо переважно у дозах 20, 40 або 80 мг, також переважно лосартан у дозах від 25 до 100 мг, переважно від 40 до 60 мг, також переважно азилсартан у дозах від 20 до 80 мг, також переважно валсартан у дозах від 40 7 UA 103347 C2 5 10 до 320 мг, переважно від 80 до 160 мг, також переважно ірбесартан у дозах від 50 до 500 мг, переважно від 75 до 300 мг, також переважно епросартан у дозах від 300 до 600 мг, та/або принаймні один діуретик у дозах від 0,5 до 500 мг, переважно гідрохлоротіазид (HCT, HCTZ) у дозах від 12,5 до 25 мг, також переважно хлорталідон у дозах від 12,5 мг до 50 мг, також переважно метолазон у дозах від 5 до 10 мг, також переважно спіронолактон у дозах від 25 до 100 мг. також переважно фуросемід у дозах від 20 до 80 мг, також переважно мефрузид у дозах від 12,5 мг, також переважно піретанід у дозах від 3 до 6 мг, також переважно індапамід у дозах від 0,5 до 5 мг. Особливо переважними комбінаціями доз є всі 87 можливих комбінацій ніфедипіну в дозах 20 мг, 30 мг та 60 мг із кандесартану цилексетилом у дозах 4 мг, 8 мг, 16 мг та 32 мг та/або одним діуретиком, вибраним із групи, що включає гідрохлоротіазид у дозах 12,5 мг та 25 мг і хлорталідон у дозах 12,5 мг, 25 мг та 50 мг. Ці можливі комбінації наведені далі в таблицях (усі дані в мг): Таблиця a) Комбінації з двох активних речовин № Ніфедипін 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 20 20 20 20 20 20 20 20 20 30 30 30 30 30 30 30 30 30 60 60 60 60 60 60 60 60 60 Кандесартан цилексетил 4 8 16 32 Гідрохлоротіазид Хлорталідон 12,5 25 12,5 25 50 4 8 16 32 12,5 25 12,5 25 50 4 8 16 32 12,5 25 12,5 25 50 15 8 UA 103347 C2 Таблиця b) Комбінації з трьох активних речовин № 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 Ніфедипін 20 20 20 20 20 20 20 20 20 20 20 20 20 20 20 20 20 20 20 20 30 30 30 30 30 30 30 30 30 30 30 30 30 30 30 30 30 30 30 30 60 60 60 60 60 60 60 60 60 60 60 60 Кандесартан цилексетил 4 4 4 4 4 8 8 8 8 8 16 16 16 16 16 32 32 32 32 32 4 4 4 4 4 8 8 8 8 8 16 16 16 16 16 32 32 32 32 32 4 4 4 4 4 8 8 8 8 8 16 16 9 Гідрохлоротіазид 12,5 25 Хлорталідон 12,5 25 50 12,5 25 12,5 25 50 12,5 25 12,5 25 50 12,5 25 12,5 25 50 12,5 25 12,5 25 50 12,5 25 12,5 25 50 12,5 25 12,5 25 50 12,5 25 12,5 25 50 12,5 25 12,5 25 50 12,5 25 12,5 25 50 12,5 25 UA 103347 C2 80 81 82 83 84 85 86 87 5 10 15 20 25 30 35 40 45 50 60 60 60 60 60 60 60 60 16 16 16 32 32 32 32 32 12,5 25 50 12,5 25 12,5 25 50 Особливо переважними комбінаціями доз є всі можливі дво- і трикомпонентні комбінації ніфедипіну в дозах 20 мг, 30 мг та 60 мг із телмісартаном у дозах 20 мг, 40 мг, та 80 мг, та/або одним діуретиком, вибраним з групи, що включає гідрохлоротіазид у дозах 12,5 мг та 25 мг і хлорталідон у дозах 12,5 мг, 25 мг та 50 мг. Переважно вся кількість активної речовини ніфедипіну або нізолдипіну вміщена в ядро, переважно в ядро осмотичної системи вивільнення, а вся кількість активної речовини антагоніста ангіотензину-IІ та/або діуретика вміщена в зовнішнє покриття. У формах виконання винаходу, які містять антагоніст ангіотензину-II та діуретик у зовнішньому покритті, антагоніст ангіотензину-II та діуретик можуть бути вміщені в один і той самий шар зовнішнього покриття або у відокремлені один від одного, послідовно нанесені шари зовнішнього покриття. Залежно від конкретних обставин може виявитися необхідним застосування активної речовини в іншій кількості на відміну від вищенаведених значень, а саме залежно від маси тіла пацієнта чи способу введення, його індивідуальної реакції на медикаменти, виду застосованої композиції та моменту чи інтервалу введення. Наприклад, у деяких випадках може виявитися достатнім застосування меншої кількості, ніж зазначена вище, в той час як в інших випадках доводиться перевищувати вищенаведені верхні граничні значення. Іншим предметом винаходу є вміщуюча тверду, придатну до перорального введення комбінацію активної речовини ніфедипін або нізолдипін із антагоністом ангіотензину-IІ та/або діуретиком фармацевтична препаративна форма для одноразового добового введення, що ґрунтується на осмотичних системах вивільнення, яка відрізняється тим, що принаймні 85 % ніфедипіну або нізолдипіну (відносно наведеної загальної кількості відповідної активної речовини) вивільняється протягом періоду часу від принаймні 4 до максимум 24 годин, переважно від 5 до 17 % ніфедипіну або нізолдипіну вивільняється протягом 4 годин і від 43 до 80 % ніфедипіну або нізолдипіну вивільняється протягом 12 годин згідно з Методикою Фармакопеї США для визначення швидкості вивільнення активних речовин із застосуванням апаратури 2 (лопатева мішалка) при 100 обертах за хвилину в 900 мл фосфатного буфера pH = 6,8 із додаванням 1 % лаурилсульфату натрію при температурі 37 °C, і принаймні 70 % антагоніста ангіотензину-IІ та/або діуретика (відносно наведеної загальної кількості відповідної активної речовини) вивільняється протягом 30 хвилин згідно з Методикою Фармакопеї США для визначення швидкості вивільнення активних речовин із застосуванням апаратури 2 (лопатева мішалка) при 75 обертах за хвилину в 1000 мл придатного до застосування засобу, наприклад фосфатного буфера при температурі 37 °C. Іншим предметом винаходу є вміщуюча тверду, придатну до перорального введення комбінацію активної речовини ніфедипін або нізолдипін із антагоністом ангіотензину-IІ та/або діуретиком фармацевтична препаративна форма для одноразового добового введення, що ґрунтується на осмотичних системах вивільнення, яка відрізняється тим, що принаймні 85 % ніфедипіну або нізолдипіну (відносно наведеної загальної кількості відповідної активної речовини) вивільняється протягом періоду часу від принаймні 4 до максимум 24 годин, переважно від 5 до 17 % ніфедипіну або нізолдипіну вивільняється протягом 4 годин і від 43 до 80 % ніфедипіну або нізолдипіну вивільняється протягом 12 годин, а також принаймні 60 %, переважно принаймні 70 %, особливо переважно принаймні 80 % антагоніста ангіотензину-IІ та/або діуретика (відносно наведеної загальної кількості відповідної активної речовини) вивільняється протягом 30 хвилин згідно з Методикою Фармакопеї США для визначення швидкості вивільнення активних речовин із застосуванням апаратури 2 (лопатева мішалка) при 75 обертах за хвилину в 900 мл придатного до застосування засобу, наприклад 0,1 N соляної кислоти (pH = 1,0) із додаванням 1,0 % лаурилсульфату натрію або фосфатного буфера (pH = 6,8) із додаванням 1,0 % лаурилсульфату натрію при температурі 37 °C). Фахівцям відомо, що умови тесту для визначення швидкості вивільнення активної речовини мають бути узгоджені з розчинністю активної речовини. Для композицій, що містять ніфедипін і кандесартан цилексетил, дослідження дисолюції in-vitro здійснюють, наприклад, переважно для обох активних речовин одночасно згідно з Методикою Фармакопеї США для визначення 10 UA 103347 C2 5 10 15 20 25 30 35 40 45 50 55 60 швидкості вивільнення активних речовин із застосуванням апаратури 2 (лопатева мішалка) при 75 обертах у 900 мл придатного до застосування засобу при температурі 37 °C, причому придатний до застосування засіб вибраний із групи, що включає 0,1 N соляну кислоту (pH = 1,0), 0,01 N соляну кислоту (pH = 2,0), ацетатний буфер (pH = 4,5), фосфатний буфер (pH = 6,5), фосфатний буфер (pH = 6,8) та фосфатний буфер (pH = 8,0), в кожному разі із додаванням 0,6 1,0 % лаурилсульфату натрію або 0,6-1,0 % Полісорбату 20 (Твін 20). В особливо переважному варіанті застосовують 0,1 N соляну кислоту (pH = 1,0) із додаванням 1,0 % лаурилсульфату натрію. Іншим предметом винаходу є вміщуюча тверду, придатну до перорального введення комбінацію активної речовини ніфедипін із кандесартаном цилексетилом та необов'язково діуретиком фармацевтична препаративна форма для одноразового добового прийому, що ґрунтується на осмотичних системах вивільнення, яка відрізняється тим, що принаймні 85 % des ніфедипіну (відносно наведеної загальної кількості ніфедипіну) вивільняється протягом 24 годин, від 5 до 17 % ніфедипіну вивільняється протягом 4 годин і від 45 до 75 % ніфедипіну вивільняється протягом 12 годин, а також принаймні 70 % кандесартану цилексетилу (відносно наведеної загальної кількості кандесартану цилексетилу) вивільняється протягом 30 хвилин згідно з Методикою Фармакопеї США для визначення швидкості вивільнення активних речовин із застосуванням апаратури 2 (лопатева мішалка) при 75 обертах за хвилину в 900 мл 0,1 N соляної кислоти (pH = 1,0) із додаванням 1,0 % лаурилсульфату натрію при температурі 37 °C. Іншим предметом винаходу є вміщуюча тверду, придатну до перорального введення комбінацію активної речовини ніфедипін із телмісартаном і необов'язково діуретиком фармацевтична препаративна форма для одноразового добового прийому, яка відрізняється тим, що принаймні 85 % ніфедипіну (відносно наведеної загальної кількості ніфедипіну) вивільняється протягом 24 годин, від 5 до 17 % ніфедипіну вивільняється протягом 4 годин і від 43 до 80 % ніфедипіну вивільняється протягом 12 годин, а також принаймні 60 % телмісартану (відносно наведеної загальної кількості телмісартану) вивільняється протягом 30 хвилин згідно з Методикою Фармакопеї США для визначення швидкості вивільнення активних речовин із застосуванням апаратури 2 (лопатева мішалка) при 75 обертах за хвилину в 900 мл ацетатного буфера (pH = 4,5) із додаванням 0,6 % лаурилсульфату натрію при температурі 37 °C. Іншим предметом винаходу є вміщуюча тверду, придатну до перорального введення комбінацію активної речовини ніфедипін або нізолдипін із антагоністом ангіотензину-IІ та/або діуретиком фармацевтична препаративна форма для одноразового добового прийому, що ґрунтується на осмотичних системах вивільнення, яка відрізняється тим, що профіль вивільнення ніфедипіну менше ніж на 30 хвилин, переважно менше ніж на 15 хвилин, особливо переважно менше ніж на 5 хвилин відрізняється від профілю вивільнення ніфедипіну в ® композиціях Adalat GITS однакової дози, і що профіль вивільнення антагоніста ангіотензину-IІ та/або діуретика менше ніж на 10 хвилин, переважно менше ніж на 5 хвилин відрізняється від профілю вивільнення антагоніста ангіотензину-IІ у дозі, що відповідає кількості активної речовини в комерційно доступній композиції, як, наприклад, кандесартан цилексетил у ® ® ® ® композиціях Atacand чи Blopress , або телмісартан у Kinzalmono чи Micardis , або ® гідрохлоротіазид у Esidrix . У відповідній винаходові фармацевтичній препаративній формі активні речовини можуть перебувати в кристалічній або в некристалічній, аморфній формі, або в формі сумішей кристалічних та аморфних активних речовин. Деякі активні речовини можуть перебувати у кількох кристалічних модифікаціях. У принципі відповідні винаходові фармацевтичні препаративні форми можуть містити активні речовини в усіх можливих кристалічних формах. Наприклад, відомо, що кандесартан цилексетил перебуває у вигляді Модифікації I або Типу C (див. публікацію EP 0 459 136 B1). Відомо також, що існують інші кристалічні модифікації кандесартану цилексетилу (див., наприклад, публікацію WO 2008/035360 A). Переважно застосовують кандесартан цилексетил кристалічної Модифікації I. Відома також поліморфна кристалічна Модифікація B телмісартану (див. публікацію WO 00/43370 A). Для досягнення якомога рівномірнішого розподілу активної речовини її застосовують у відповідній винаходові препаративній формі у вигляді якомога дрібніших частинок. Фахівцям відомі методи зменшення розміру частинок. Серед цих методів переважним є насамперед особливо тонке подрібнення у струминному млині (мікронізація). За допомогою цього методу перемелювання у типовому випадку може бути досягнутий розподіл розмірів частинок, які відрізняються параметром X50 = 10 мкм або менше та параметром X90 = 30 мкм або менше. Якщо відповідні винаходові препаративні форми містять активну речовину в кристалічній формі, у переважній формі виконання винаходу їх застосовують у мікронізованій формі, переважно з середнім діаметром частинок менше 10 мкм, переважно менше 5 мкм, особливо 11 UA 103347 C2 5 10 15 20 25 30 35 40 45 50 55 переважно менше 3 мкм. При цьому середній розмір X50 частинок ніфедипіну або нізолдипіну становить переважно від 2 до 6 мкм, а середнє значення X90 (частка 90 %) становить менше 12 мкм; середній розмір X50 частинок кандесартану цилексетилу становить переважно від 0,5 до 8 мкм, переважно від 1 до 5 мкм, а значення X90 (частка 90 %) становить менше 20 мкм, переважно менше 10 мкм. Значення X50 та X90 завжди стосуються розподілу розмірів частинок, визначеного шляхом лазерної дифрактометрії, і відповідають об'ємному розподілу. Придатними для застосування як осмотичні системи вивільнення активної речовини є осмотичні однокамерні системи (елементарний осмотичний насос, elementary osmotic pump) та двокамерні системи (двотактні осмотичні насоси, push-pull). Оболонка як однокамерної, так і двокамерної осмотичної системи вивільнення активної речовини виконана з водопроникного, не проникного для компонентів внутрішнього ядра матеріалу. Такі матеріали оболонок в принципі відомі та описані, наприклад, у публікації EP 024 793 B1, стор. 3-4; цим посиланням їх опис залучається до даної заявки. Згідно з винаходом як матеріал для оболонок використовують переважно ацетилцелюлозу або суміші ацетилцелюлози та поліетиленгліколю. В осмотичній однокамерній системі внутрішнє ядро містить переважно від 5 до 50 % ніфедипіну або нізолдипіну, від 10 до 50 % ксантану та від 5 до 40 % співполімеру вінілпіролідону з вінілацетатом, причому в разі необхідності перепад до 100 % забезпечується завдяки застосуванню одного або кількох додаткових компонентів, вибраних із групи, що включає інші гідрофільні, здатні до набухання полімери, осмотично активні добавки та традиційні фармацевтичні допоміжні речовини. Сума компонентів внутрішньої оболонки становить 100 %, причому дані у відсотках наведені відносно загальної маси внутрішнього ядра. Як один із важливих компонентів внутрішнього ядра, осмотична однокамерна система містить гідрофільний, здатний до набухання у воді полімер ксантан. При цьому йдеться про аніонний гетеропролісахарид, комерційно доступний, наприклад, за фірмовим найменуванням Rhodigel (виробник – компанія Rhodia). Його вміст становить від 10 до 50 %, переважно від 20 до 40 % відносно загальної маси компонентів внутрішнього ядра. Іншим важливим компонентом внутрішнього ядра є співполімер вінілпіролідону з вінілацетатом. Цей співполімер відомий і може бути одержаний при будь-якому співвідношенні компонентів суміші мономерів. Переважно застосовуваний, комерційно доступний Kollidon VA64 (виробник – компанія BASF) є, наприклад, співполімеризатом зі співвідношенням між компонентами суміші 60:40. У загальному випадку його середньовагова молекулярна маса Mw, визначена шляхом вимірювань розсіяння світла, становить приблизно від 45 000 до 70 000. Вміст співполімеру вінілпіролідону з вінілацетатом у внутрішньому ядрі становить від 5 до 40 %, переважно від 15 до 25 % відносно загальної маси компонентів внутрішнього ядра. Додатково введеними в разі необхідності у внутрішнє ядро гідрофільними здатними до набухання полімерами є, наприклад, гідроксипропілцелюлоза, гідроксипропілметил-целюлоза, карбоксиметилцелюлоза натрію, карбоксиметилкрохмаль натрію, поліакрилові кислоти та їх солі. Додатково введеними в разі необхідності у внутрішнє ядро осмотично активними добавками є, наприклад, усі водорозчинні речовини, застосування яких у фармацевтиці не викликає побоювань, такі як, наприклад, наведені у фармакопеях або у "Коментарі Гагера" (Hager) і довіднику "Фармацевтичні науки" Ремінгтона (Remington Pharmaceutical Science) водорозчинні допоміжні речовини. Зокрема, можуть бути застосовані водорозчинні солі неорганічних або органічних кислот, або неіонні органічні речовини з високою водорозчинністю, такі як, наприклад, вуглеводні, зокрема цукор, цукрові спирти або амінокислоти. Наприклад, можуть бути застосовані осмотично активні добавки, вибрані з групи, що включає неорганічні солі, такі як хлориди, сульфати, карбонати і бікарбонати лужних та лужноземельних металів, таких як літій, натрій, калій, магній, кальцій, а також фосфати, гідро- або дигідрофосфати, ацетати, сукцинати, бензоати, цитрати або аскорбати. Крім цього, можуть бути застосовані пентози, такі як арабіноза, рибоза або ксилоза, гексози, такі як глюкоза, фруктоза, галактоза або маноза, дисахариди, такі як цукроза, мальтоза або лактоза, або трисахариди, такі як рафіноза. До водорозчинних амінокислот належать гліцин, лейцин, аланін або метіонін. Згідно з винаходом особливо переважно застосовують хлорид натрію. Вміст осмотично активних добавок становить переважно до 30 % відносно загальної маси компонентів внутрішнього ядра. Додатково введеними в разі необхідності у внутрішнє ядро традиційними фармацевтичними допоміжними речовинами є, наприклад, буферні речовини, такі як бікарбонат натрію, зв'язувальні речовини, такі як гідроксипропілцелюлоза, гідроксипропілметилцелюлоза або полівінілпіролідон, змащувальні матеріали, такі як стеарат магнію, змочувальні засоби, такі як 12 UA 103347 C2 5 10 15 20 25 30 35 40 45 50 55 60 лаурилсульфат натрію, або засоби для регулювання реологічних властивостей, такі як високодисперсний діоксид кремнію, та стабілізатори, такі як антиоксиданти. Осмотична однокамерна система може бути одержана, наприклад, шляхом змішування компонентів внутрішнього ядра, що включають ніфедипін або нізолдипін, гранулювання суміші в разі необхідності мокрим чи сухим способом, переважно мокрим способом, наступного таблетування і покриття утвореного в такий спосіб внутрішнього ядра оболонкою, в якій виконано один або кілька отворів. У осмотичних двокамерних систем внутрішнє ядро складається з двох шарів, шару активної речовини та осмотичного шару. Подібна осмотична двокамерна система описана, наприклад, у публікації DE 34 17 113 C2; цим посиланням її опис залучається до даної заявки. Шар активної речовини містить переважно від 5 до 50 % ніфедипіну або нізолдипіну, переважно від 10 до 45 %, також переважно від 10 до 40 %, також переважно від 10 до 30 %, також особливо переважно від 15 до 25 %, насамперед переважно від 18 до 22 %, цілком переважно від 20 % та від 40 до 95 %, переважно від 50 до 85 %, також переважно від 55 до 85 %, також переважно від 60 до 85 %, також цілком переважно від 65 до 85 %, насамперед переважно від 70 до 80 % одного чи кількох осмотично активних полімерів, переважно поліетиленоксиду середньої в'язкості (від 40 до 100 мПа·с; 5 %-ний водний розчин, 25 °C), а осмотичний шар містить переважно від 40 до 90 %, переважно від 50 до 80 %, також переважно від 55 до 75 %, також переважно 55 до 70 %, насамперед від 60 до 67 % одного чи кількох осмотично активних полімерів, переважно поліетиленоксиду високої в'язкості (від 5000 до 8000 мПа·с; 1 %-ний водний розчин, 25 °C), та від 5 до 40 %, переважно від 10 до 40 %, також переважно від 15 до 40 %, також переважно від 20 до 40 %, насамперед переважно від 20 до 35 % осмотично активної добавки, причому перепад до 100 % забезпечується в кожному з окремих шарів незалежно один від одного завдяки одному або кільком додатковим компонентам у формі традиційно застосовуваних у фармацевтиці допоміжних речовин. Дані у відсотках у кожному випадку наведені відносно загальної маси відповідного внутрішнього шару ядра. У внутрішньому ядрі осмотичної двокамерної системи можуть бути застосовані також осмотично активні добавки, аналогічні описаному вище випадку однокамерної системи. Переважним при цьому є хлорид натрію. У внутрішньому ядрі осмотичної двокамерної системи можуть бути застосовані традиційні фармацевтичні допоміжні речовини, аналогічні застосовуваним у описаному вище випадку однокамерної системи. Переважно при цьому застосовують такі зв'язувальні речовини, як гідроксипропілцелюлоза, гідроксипропілметилцелюлоза або полівінілпіро-лідон, змащувальні засоби, такі як стеарат магнію, змочувальні засоби, такі як лаурилсульфат натрію, або засоби для регулювання реологічних властивостей, такі як високодисперсний діоксид кремнію, барвний пігмент, такий як оксид заліза, в одному з обох шарів для утворення перепаду між шаром активної речовини та осмотичним шаром, а також стабілізатори/антиоксиданти в шарі активної речовини. Осмотична двокамерна система може бути одержана, наприклад, шляхом змішування компонентів шару активної речовини, що включає ніфедипін або нізолдипін, і гранулювання цієї суміші мокрим або сухим способом, переважно мокрим способом, змішування та гранулювання компонентів осмотичного шару і наступного спресовування обох гранулятів у таблетковому пресі для одержання двошарових таблеток. Потім на утворене в такий спосіб внутрішнє ядро вкривають оболонкою. В оболонці зі сторони активної речовини виконують одне або кілька отворів. В альтернативній формі винаходу на цій стадії від виконання одного або кількох отворів можна відмовитися. У цьому випадку лише після нанесення одного чи кількох наступних шарів зовнішнього покриття у кожній із двох сторін таблетки виконують по одному отвору, що проходять від зовнішньої поверхні до внутрішнього ядра, тобто пронизують зовнішнє покриття та оболонку. У переважній формі виконання винаходу при виготовленні осмотичної двокамерної системи як компоненти шару активної речовини, так і компоненти осмотичного шару гранулюють, зокрема за допомогою валкового гранулятора. Згідно з винаходом внаслідок фізико-хімічних властивостей комбінації активної речовини переважно застосовують осмотичні двокамерні системи (двотактні, push-pull системи), в яких шар активної речовини та осмотичний шар розділені та наприклад і переважно виконані у вигляді двошарової таблетки. При цьому перевагами порівняно з осмотичними однокамерними системами є рівномірніша протягом тривалого періоду часу швидкість вивільнення, а також можливість зменшити обумовлений специфікою системи необхідний надлишок активної речовини. 13 UA 103347 C2 5 10 15 20 25 30 35 40 45 50 55 60 Зовнішнє покриття відповідної винаходові препаративної форми містить принаймні один антагоніст ангіотензину-IІ та/або принаймні один діуретик і принаймні один плівкоутворюючий полімер. Може бути вибраний плівкоутворюючий полімер, придатний до швидкого вивільнення активної речовини. У формах виконання винаходу, які містять антагоніст ангіотензину-II та діуретик у зовнішньому покритті, антагоніст ангіотензину-II та діуретик можуть бути введені в один шар зовнішнього покриття або у відокремлені один від одного послідовно нанесені шари зовнішнього покриття. Як плівкоутворюючі полімери можуть бути застосовані похідні целюлози, синтетичні полімери та їх суміші. Як похідні целюлози застосовують метилцелюлозу (MC, МЦ), гідроксиметилпропілцелюлозу (HPMC, ГПМЦ), гідроксипропілцелюлозу (HPC, ГПЦ), карбоксиметилцелюлозу натрію (Na-CMC), гідроксіетилцелюлозу (HEC, ГЕЦ) та їх суміші. Як синтетичні полімери застосовують полівінілпіролідон (повідон, PVP), співполімер вінілпіролідону із вінілацетатом (коповідон), полівініловий спирт (PVA), полівінілацетат (PVAc), частково гідролізований полівініловий спирт, співполімери полівінілового спирту і поліетиленгліколю (PVA-co-PEG) та їх суміші. Переважними плівкоутворювачами є полівініловий спирт (PVA), полівінілацетат (PVAc), частково гідролізований полівініловий спирт, співполімер вінілпіролідону із вінілацетатом (співполімер PVA-PEG) та їх суміші. Переважним плівкоувторювачем є зокрема частково гідролізований полівініловий спирт. Переважними є також зокрема наведені далі комерційно доступні препарати, так звані "готові до застосування лаки", які вже містять інші фармацевтичні допоміжні речовини і легко розчиняються у воді. - Kollicoat IR white (готовий до застосування лак виробництва компанії BASF на основі PVAco-PEG з білим пігментом), склад: Kollicoat IR (PVA-co-PEG), Kollidon VA64 (коповідон), каолін, лаурилсульфат натрію, діоксид титану. Sepifilm IR Colorless (готовий до застосування лак виробництва компанії SEPPIC на основі PVA-co-PEG без пігментів), склад: Kollicoat IR (PVA-co-PEG), полідекстроза, каолін, поліетиленгліколь (PEG 400). - Opadry II 85F19250 Clear (готовий до застосування лак виробництва компанії Colorcon на основі PVA), склад: частково гідролізований полівініловий спирт, тальк, поліетиленгліколь (PEG 3350), Полісорбат 80 (Твін 80). Цей готовий до застосування лак застосовують особливо переважно. - Opadry II 85F28393 (готовий до застосування лак виробництва компанії Colorcon на основі PVA), склад: частково гідролізований полівініловий спирт, тальк, поліетиленгліколь (PEG 3350), діоксид титану. Зовнішнє покриття може бути також виготовлене з окремих компонентів, наприклад, із наведених далі комерційно доступних препатарів: BASF Kollicoat IR (PVA-co-PEG), BASF Kollidon VA64 (коповідон), Merck Emprove (PVA). Зовнішнє покриття може містити додаткові допоміжні речовини, такі як, наприклад, змочувальні засоби (наприклад, лаурилсульфат натрію, четвертинні сполуки амонію, лецитин (зокрема соєвий лецитин), полісорбати (зокрема Полісорбат 80, синонім – Твін 80)), пігменти (наприклад діоксид титану, тальк), барвні пігменти (наприклад червоний, жовтий або чорний оксид заліза, або їх суміші), розділювальні/змащувальні засоби (наприклад каолін, тальк, високодисперсний діоксид кремнію, стеарат магнію, гліцеролмоностеарат) та/або пластифікатори (наприклад поліетиленгліколь (зокрема Поліетиленгліколь ПЕГ 400, Поліетиленгліколь ПЕГ 3350), поліпропіленгліколь, пропіленгліколь, гліцерол, триацетин, триетилцитрат). У зовнішньому покритті частка антагоніста ангіотензину-IІ, у разі необхідності разом із часткою діуретика, становить від 10 до 50 %, переважно від 15 до 40 %, переважно від 10 до 40 %, особливо переважно від 20 до 40 %, також переважно від 20 до 45 %, особливо переважно від 25 до 45 %, особливо переважно від 30 до 45 % цілком переважно 20, 30, 33, 40 % або 45 %; частка плівкоутворюючого полімера становить від 20 до 75 %, переважно від 25 до 60 %, особливо переважно приблизно від 30 до 45 %, частка пігменту становить від 0 до 20 %, частка змочувального засобу становить від 0 до 3 %, переважно від 1 до 2 % відносно сухої маси зовнішнього покриття. При використанні готових до застосування лаків частка антагоніста ангіотензину-IІ, в разі необхідності разом із часткою діуретика, становить від 10 до 50 %, переважно від 15 до 40 %, переважно від 10 до 40 %, особливо переважно від 20 до 40 %, також переважно від 20 до 45 %, особливо переважно від 25 до 45 %, особливо переважно 30 до 45 %, цілком переважно 20, 30, 33 40 % або 45 %, особливо переважно 40 %, а частка 14 UA 103347 C2 5 10 15 20 25 30 35 40 45 50 55 60 готового до застосування лаку становить від 50 до 90 %, переважно від 50 до 80 %, переважно від 50 до 75 %, переважно від 55 до 70 %, переважно 60, 67, 70 або 80 %, особливо переважно 60 %. При цьому дані у відсотках стосовно вмісту у зовнішньому покритті наведені відносно частини лаку, вміщуючого активну речовину, без урахування можливо наявного готового до застосування лаку. Частка зовнішнього покриття без урахування можливо наявного готового до застосування лаку у відповідній винаходові препаративній формі становить від 5 до 100 %, переважно від 5 до 80 %, особливо переважно від 10 до 50 %, також особливо переважно, наприклад, приблизно більше 10 %, 15 %, 20 %, 30 %, 40 % або 50 % відносно маси ядра. Відносно загальної маси препаративної форми частка зовнішнього покриття без урахування можливо наявного готового до застосування лаку у відповідній винаходові препаративній формі становить від 4 до 50 %, переважно від 5 до 45 %, особливо переважно від 9 до 33 %, також особливо переважно, наприклад, приблизно більше 10 %, 15 %, 20 %, 25 %, 30 % або 33 %. Маса зовнішнього покриття у відповідній винаходові препаративній формі становить в загальному випадку від 10 до 300 мг, переважно від 20 до 300 мг, переважно від 25 до 250 мг, особливо переважно від 50 до 200 мг, також особливо переважно від 100 мг до 150 мг. Маса зовнішнього покриття у відповідній винаходові препаративній формі в тому випадку, коли шар активної речовини містить лише одну активну речовину, становить від 10 до 300 мг, переважно від 10 до 250 мг, переважно від 10 до 150 мг, особливо переважно від 10 до 100 мг, також особливо переважно від 10 мг до 80 мг. Маса зовнішнього покриття у відповідній винаходові препаративній формі в тому випадку, коли шар активної речовини містить дві активні речовини, становить від 10 до 300 мг, переважно від 20 до 250 мг, переважно від 30 до 200 мг, особливо переважно від 40 до 200 мг, також особливо переважно від 40 мг до 150 мг. При цьому у масі зовнішнього покриття враховують лише один лак, вміщуючий активну речовину, без урахування можливо наявного готового до застосування лаку. Товщина зовнішнього покриття становить від 25 до 1500 мкм, переважно від 50 до 1500 мкм, особливо переважно від 50 до 1200 мкм, також переважно від 75 до 1200 мкм, цілком переважно від 100 до 1000 мкм, також особливо переважно більше ніж 25 мкм, 50 мкм, 75 мкм, 100 мкм, 150 мкм, 200 мкм, 250 мкм. Відповідна винаходові препаративна форма відповідає вимогам фармакопеї щодо однорідності вмісту (Content Uniformity) (наприклад фармакопеї США USP 31, "Однорідність дозованих одиниць", (Uniformity of dosage units). При цьому прийнятне значення становить менше 15 %, а відсоткове стандартне відхилення вмісту антагоніста ангіотензину-IІ та/або діуретика в зовнішньому покритті становить менше 6,25 %, переважно менше 6 %, особливо переважно менше 5 % при n = 10 разових доз, або менше 7,5 %, переважно менше 6 %, особливо переважно менше 5 % при n = 10 разових доз. При цьому середній вміст антагоніста ангіотензину-IІ та/або діуретика в зовнішньому покритті, розрахований на підставі визначених для n = 10 або n = 30 разових доз становить від 95 до 105 %, переважно від 97 до 103 %, особливо переважно від 98,5 до 101,5 % відносно заданого вмісту таблетки. Стираність відповідної винаходові препаративної форми в тесті на стираність (наприклад згідно з USP 31 Tablet Friability) виявилося дуже низькою – менше 0,5 %, переважно менше 0,1 %, особливо переважно менше 0,01 % і до взагалі не вимірюваних значень відносно маси препаративної форми. Міцність на розрив відповідної винаходові препаративної форми у тесті на розрив, визначена за допомогою тестера для таблеток (наприклад марки Schleuniger, тип 6D або тип 8M, виробник – компанія Dr. Schleuniger Pharmatron AG, Золотурн, Швейцарія), була вище ніж 200 Н, переважно вище ніж 300 Н. Під час проведення тесту на міцність на розрив особливо переважної форми виконання винаходу застосування зусилля 449 Н ще не спричиняло викришування шару оболонки, лише максимум легку пластичну деформацію. У тесті для визначення часу розкладення (наприклад згідно з USP 31 Disintegration) зовнішнє покриття відповідної винаходові препаративної форми із застосуванням очищеної води як середовища при 37 °C повністю відокремлювалося від ядра протягом 40 хвилин, переважно протягом 25 хвилин, особливо переважно протягом 10 хвилин. У тесті на розчинення in-vitro із відповідної винаходові препаративної форми відбувалося вивільнення 85 % ніфедипіну або нізолдипіну (відносно наведеної загальної кількості відповідної активної речовини) протягом періоду часу принаймні 4 та максимум 24 години; переважно від 5 до 17 % ніфедипіну або нізолдипіну вивільнялося протягом 4 годин і від 43 до 80 %, особливо переважно від 45 до 75 % ніфедипіну або нізолдипіну вивільнялося протягом 12 годин. Окрім цього, із відповідної винаходові препаративної форми у тесті на розчинення in-vitro відбувалося вивільнення принаймні 60 %, переважно 70 %, особливо переважно принаймні 15 UA 103347 C2 5 10 15 20 25 30 35 40 45 50 55 60 80 % антагоніста ангіотензину-IІ та/або діуретика (відносно наведеної загальної кількості відповідної активної речовини) протягом 30 хвилин. Для проведення тесту на розчинення in-vitro згідно з методикою Фармакопеї США застосовували апаратуру 2 (лопатева мішалка), швидкість обертання становила від 50 до 100, переважно від 75 або 100 обертів, у відповідному засобі кількістю від 900 до 1000 мл при 37 °C. Відповідний засіб залежно від розчинності активної речовини може бути вибраний, наприклад, із групи, що включає 0,1 N соляну кислоту (pH = 1,0), 0,01 N соляну кислоту (pH = 2,0), ацетатний буфер (pH = 4,5), фосфатний буфер (pH = 4,5), фосфатний буфер (pH = 6,8) та фосфатний буфер (pH = 8,0), із додаванням 0-1 % лаурилсульфату натрію або 0-1 % Полісорбату 20 (Твін 20), переважно 0,4-1,0 % лаурилсульфату натрію. Тест на розчинність in-vitro може бути проведений одночасно в одному засобі для всіх активних речовин, які містить композиція, або в різних засобах для окремих активних речовин незалежно одна від одної. Іншим предметом винаходу є спосіб одержання відповідної винаходові препаративної форми, яка включає ядро, переважно осмотичну систему вивільнення активних речовин як ядро, та шар зовнішнього покриття, причому для нанесення зовнішнього покриття ядра, наприклад у кількості 800 г, закладають у барабанну машину для нанесення покриттів номінальною місткістю 1 кг завантажуваного матеріалу і шляхом напилення наносять на них водну лакову суспензію, наприклад у кількості 1600 г, яка містить принаймні один антагоніст ангіотензину-IІ та/або принаймні один діуретик, принаймні один плівкоутворюючий полімер і в разі необхідності додаткові допоміжні речовини. Температура припливного повітря становить від 40 до 70 °C, переважно від 55 до 65 °C, особливо переважно 60 °C, наприклад при подачі 3 припливного повітря близько 120 м /год. та частоті обертання барабана від 10 до 18 обертів за хвилину, переважно від 12 до 15 обертів за хвилину. Як розпилювальне сопло може бути використане, наприклад, сопло з круглим отвором діаметром від 0,8 до 1,2 мм або сопло з плоским отвором iз тиском розпилення від 1,6 до 2,2 бар. Початкова швидкість розпилення, наприклад 4 г/хв., може бути збільшена в процесі напилення безперервно або дискретно, наприклад через кожні 10 - 30 хвилин ступенями, наприклад, по 1 г/хв. або по 10 % поточної швидкості розпилення, до 18 г/хв. По завершенні процесу напилення, наприклад через 180 - 240 хвилин, таблетки без додаткового напилення можуть бути піддані поліруванню в барабані протягом, наприклад, 5 - 60 хвилин, переважно від 10 до 30 хвилин, або до остаточного охолодження до кімнатної температури при періодичному або безперервному обертанні барабана, переважно безперервного, при частоті обертання барабана від 6 до 15 об./хв. У разі застосування більших або менших барабанних машин для нанесення покриттів параметри процесу можуть бути відповідно узгоджені. Відповідні параметри процесу для барабанних машин для нанесення покриттів різних типорозмірів наведені у Прикладах 2, 9 та 13. Переважно розпилювальне сопло фіксують на розпилювальному кронштейні, положення якого можна регулювати в процесі напилення для забезпечення оптимальних результатів напилення активної речовини. Водна лакова суспензія містить переважно від близько 20 до близько 30 %, особливо переважно 25-30 % твердих речовин відносно загальної маси лакової суспензії. Момент завершення процесу напилення може бути визначений різними способами. З однієї сторони, може бути чітко задана кількість напилюваної лакової суспензії; при цьому в типовому випадку має бути врахована втрата матеріалу в процесі напилення, що становить від близько 5 до 20 %, переважно 10 - 15 %. З іншої сторони, момент завершення процесу напилення може бути встановлений також шляхом внутрішньопроцесного контролю таблеток, на які має бути нанесене зовнішнє покриття. З цією метою переважно в рамках внутрішньопроцесного контролю в режимі at-line в процесі напилення в задані моменти часу відбирають таблетки, і потім шляхом зважування та/або за допомогою спектроскопічних методів, таких як, наприклад, ближня інфрачервона спектроскопія (NIR), раманівська спектроскопія (Raman) або спектроскопії в терагерцовому діапазоні, визначають товщину шару лаку або вміст активної речовини в шарі лаку. На підставі значень, одержаних шляхом внутрішньопроцесного контролю, процес напилення завершують точно по досягненні цільової кількості нанесеного матеріалу. Вищенаведені спектроскопічні методи в принципі придатні також для внутрішньопроцесного контролю в режимі in-line. У цьому випадку зонд спектроскопа вбудовують у барабанну машину для нанесення покриття, завдяки чому забезпечується можливість поточного вимірювання параметрів окремих таблеток у процесі напилення, причому немає потреби у їх вийманні з барабанної машини для нанесення покриття. На зовнішнє покриття відповідної винаходові препаративної форми в разі необхідності може бути нанесений додатковий шар лаку, не вміщуючий активну речовину, наприклад світлозахисного лаку або фарблаку. Для цього в принципі можуть бути застосовані такі самі 16 UA 103347 C2 5 10 15 20 25 30 35 40 допоміжні речовини, що й для зовнішнього покриття. Придатними до застосування матеріалами при цьому є, зокрема, полімери, такі як, наприклад, полівініловий спирт, гідроксипропілцелюлоза або гідроксипропілметилцелюлоза, в разі необхідності в комбінації з придатними до застосування пластифікаторами, такими як, наприклад, поліетиленгліколь, і пігментами, такими як, наприклад, оксид титану або оксиди заліза. Переважними є, зокрема, наведені далі комерційно доступні препарати, так звані "готові до застосування лаки", які вже містять додаткові фармацевтичні допоміжні речовини і легко розчиняються у воді, такі як, наприклад. Opadry II 85F230009 Orange (готовий до застосування лак виробництва компанії Colorcon, основою якого є PVA), склад: частково гідролізований полівініловий спирт, тальк, поліетиленгліколь (ПЕГ 3350), оксид титану, червоний оксид заліза, жовтий оксид заліза та Полісорбат 80 (Tвін 80). Іншим предметом винаходу є призначені для перорального одноразового добового прийому лікарські препарати, які містять відповідну винаходові препаративну форму. Іншим предметом винаходу є застосування відповідної винаходові препаративної форми для профілактики, вторинної профілактики або лікування серцево-судинних захворювань, наприклад артеріальної гіпертонії. Іншим предметом винаходу є застосування відповідної винаходові препаративної форми для виготовлення лікарського засобу для профілактики, вторинної профілактики або лікування серцево-судинних захворювань, наприклад артеріальної гіпертонії, інфаркту міокарда, повторного інфаркту, стенокардії (Angina pectoris), ішемічної хвороби серця, хронічної серцевої недостатності, транзиторних ішемічних нападів або інсульту. Іншим предметом винаходу є спосіб профілактики, вторинної профілактики або лікування серцево-судинних захворювань шляхом уведення відповідної винаходові препаративної форми. Комбінація ніфедипіну або нізолдипіну з антагоністом ангіотензину-II та діуретиком є особливо ефективною для лікування пацієнтів, у яких шляхом монотерапії або дуальної комбінаційної терапії не вдається досягти бажаного зменшення кров'яного тиску. Резистентні до терапії пацієнти часто належать до пацієнтів, для яких адекватний контроль кров'яного тиску є особливо важливим. Хоча антагоністи кальцію та діуретики належать до медикаментів, що знижують кров'яний тиск незалежно від системи ренін-ангіотензин, проте, вони відрізняються механізмом дії. Антагоністи кальцію є насамперед вазоділятаторами, що проявляють слабку натрійуретичну дію, в той час як для діуретиків (тіазидів) є чинним протилежне. У разі інгібування системи ренін-ангіотензин дія діуретиків сумується з дією антагоністів кальцію. Неочікувано вдалося довести, що застосування описаної вище потрійної комбінації дозволяє забезпечити адекватний контроль кров'яного тиску також у резистентних до терапії пацієнтів. Далі винахід пояснюється докладніше за допомогою переважних прикладів виконання, які, проте, не мають обмежувального характеру. Якщо не зазначено інше, всі дані щодо кількості наведені у масових відсотках. Експериментальна частина Приклад 1: Oсмотична система вивільнення (двокамерна система) Склад ядра, мг/ядро (декларований вміст – 30 мг ніфедипіну) Шар активної речовини: Ніфедипін, мікронізований 33,0 мг Гідроксипропілметилцелюлоза (ГПМЦ) (5 8,2 мг сП) Поліетиленоксид (ПЕО) (молярна маса 122,2 мг 200 000) Стеарат магнію 0,4 мг Сума 163,8 мг Осмотичний шар: Гідроксипропілметилцелюлоза (5 сП) 4,1 мг Хлорид натрію 23,9 мг Поліетиленоксид (молярна маса 52,9 мг 5 000 000) Оксид заліза, червоний 0,8 мг Стеарат магнію 0,2 мг Сума 81,9 мг Оболонка (осмотична мембрана) Ацетат целюлози 32,3 мг Поліетиленгліколь 3 350 1,7 мг Сума 34,0 мг 17 UA 103347 C2 5 10 15 20 Одержання: Компоненти шару активної речовини змішували і гранулювали сухим способом. Аналогічно змішували і гранулювали сухим способом компоненти осмотичного шару. На таблетувальному пресі для двошарових таблеток обидва грануляти спресовували у двошарові таблетки. На таблетки наносили розчин ацетату целюлози та поліетиленгліколю в ацетоні та висушували. Потім у кожній таблетці зі сторони активної речовини за допомогою лазерного променя виконували отвір діаметром 0,9 мм. Одержані таким чином ядра по завершенні процесу мали діаметр 8,8 мм, висоту 4,6 мм і масу 276,6 мг 4,8 мг. Приклад 1a: Oсмотична система вивільнення (двокамерна система) Склад ядра, мг/ядро (декларований вміст – 60 мг ніфедипіну) Шар активної речовини: Ніфедипін, мікронізований 66,0 мг Гідроксипропілметилцелюлоза (5 сП) 16,4 мг Поліетиленоксид (молярна маса 200 244,4 мг 000) Стеарат магнію 0,8 мг Сума 327,6 мг Осмотичний шар: Гідроксипропілметилцелюлоза (5 cП) 8,2 мг Хлорид натірю 47,8 мг Поліетиленоксид (молярна маса 5 000 105,8 мг 000) Оксид заліза, червоний 1,6 мг Стеарат магнію 0,4 мг Сума 163,8 мг Оболонка (осмотична мембрана) Ацетат целюлози 38,0 мг Поліетиленгліколь 3 350 2,0 мг Сума 40,0 мг Одержання: аналогічно Прикладу 1 Одержані в такий спосіб ядра по завершенні процесу мали діаметр 10,6 мм, висоту 6,4 мм і масу 531,0 мг 3,9 мг. Приклад 1b: Осмотична система вивільнення (двокамерна система) Склад ядра, мг/ядро (декларований вміст – 20 мг ніфедипіну) Шар активної речовини: Ніфедипін, мікронізований 22,0 мг Гідроксипропілметилцелюлоза (5 сП) 5,5 мг Поліетиленоксид (молярна маса 200 000) 81,5 мг Стеарат магнію 0,3 мг Сума 109,3 мг Осмотичний шар: Гідроксипропілметилцелюлоза (5 сП) 3,6 мг Хлорид натрію 21,2 мг Поліетиленоксид (молярна маса 5 000 47,0 мг 000) Оксид заліза, червоний 0,7 мг Стеарат магнію 0,2 мг Сума 72,7 мг Оболонка (осмотична мембрана) Ацетат целюлози 33,2 мг Поліетиленгліколь 3 350 1,7 мг Сума 34,9 мг Одержання: аналогічно Прикладу 1 Одержані в такий спосіб ядра по завершенні процесу мали діаметр 8,3 мм, висоту 4,2 мм і масу 216,0 3,9 мг. Приклад 2: Ядра з нанесеним покриттям Одержання: 18 UA 103347 C2 5 10 15 500 г готового до застосування лаку Colorcon Opadry II 85G25457 у вигляді суміші з великим вмістом частинок пігменту – червоного оксиду заліза відновлювали згідно з інструкцією виробника шляхом замішування пропелерною мішалкою у 2000 мл очищеної води і перемішування протягом наступних 45 хвилин (лакова суспензія). 810,5 г (що відповідало 2930 шт.) ядер згідно з Прикладом 1 (декларована кількість – 30 мг ніфедипіну) закладали у машину для нанесення покриття Coater Glatt GC300 і піддавали попередньому нагріванню при температурі припливного повітря 60 °C, подачі припливного 3 повітря 120 м /год. і частоті обертання барабана 10 об./хв. (обертів за хвилину). Параметри 3 "температура припливного повітря" (60 °C), "подача припливного повітря" (120 м /год.) і "частота обертання барабана" (10 об./хв.) підтримували постійними протягом всього процесу нанесення покриття. Для напилення лакової суспензії застосовували сопло з круглим струменем діаметром 0,8 мм із тиском розпилення 1,6 бар, причому положення рухомого розпилювального кронштейну протягом усього процесу нанесення покриття регулювали таким чином, щоб забезпечити однорідну картину розпилення. Лакову суспензію наносили на ядра, поступово збільшуючи швидкість розпилення у процесі нанесення покриття, а саме починаючи від 6 г/хв. і закінчуючи 16 г/хв. такими ступенями: Час [хв.] 0 – 40 40 – 50 50 – 70 70 – 80 80 – 90 90 – 100 100 – 130 130 – 140 140 – 150 150 – 160 160 – 210 20 25 Загальна тривалість процесу напилення становила 210 хвилин. Після цього таблетки полірували в барабані протягом наступних 10 хвилин без продовження напилення. Перед початком процесу нанесення покриття, в різні моменти часу в процесі нанесення покриття та негайно по завершенні процесу нанесення покриття відбирали зразки таблеток і визначали збільшення маси. Були одержані такі результати: Час [хв.] 0 30 60 90 120 150 180 210 30 35 Швидкість розпилення [г/хв.] 6 7 8 9 10 11 12 13 14 15 16 Маса [мг] 276,6 298,5 311,0 326,3 351,6 380,4 414,4 446,1 Стандартне відхилення [мг] 4,8 4,8 5,3 6,8 9,1 8,4 10,9 12,2 Маса одержаних таким чином таблеток становила 446,1 мг 12,2 мг. Це відповідає кількості нанесеного лаку 170 мг. Одержані таблетки мали діаметр 10,3 мм і висоту 6,0 мм. Виготовляли поперечний переріз таблетки і розглядали під мікроскопом для дослідження у відбитому світлі. Ядро GITS, що складається з двошарової таблетки, покритої шаром ацетатцелюлозного лаку завтовшки приблизно 0,13 мм, було вміщено в оболонку рівномірної товщини близько 0,7 мм однорідного червоного кольору. Одержані таблетки досліджували за допомогою тестера для визначення міцності на розрив (модель Schleuniger, тип 6D, виробник – компанія Dr. Schleuniger Pharmatron AG, Золотурн, 19 UA 103347 C2 5 10 15 20 25 30 Швейцарія). Максимально можливе зусилля 449 Н не спричиняло викришування шару оболонки, лише легку пластичну деформацію плівки лаку. Одержані таблетки піддавали випробуванню на стираність згідно з методикою фармакопеї США USP 31 ( Tablet Friability). Стирання не було виявлене. Одержані таблетки піддавали випробуванню на час розпаду згідно з методикою фармакопеї США USP 31 ( Disintegration) із застосуванням очищеної води як середовища при 37 °C в режимі безперервного спостереження. Не пізніше ніж через 25 хвилин плівка лаку повністю розчинилася. Одержані таблетки піддавали тесту на швидкість вивільнення згідно з методикою фармакопеї США USP 31 ( Dissolution) із застосуванням апаратури 2 (лопатева мішалка) з частотою обертання 50 об./хв. (обертів за хвилину) та 1000 мл очищеної води як середовища при 37 °C в режимі безперервного спостереження. Не пізніше ніж через 25 хвилин плівка лаку повністю розчинилася. Приклад 3: Осмотична система вивільнення із зовнішнім покриттям, вміщуючим телмісартан Із лакової суспензії на основі похідного полівінілового спирту виготовляли однорідну суспензію з вмістом 30 % телмісартану (відносно загального вмісту твердої речовини у лаковій суспензії). У барабанну машину для нанесення покриття закладали таку кількість ядер згідно з Прикладами 1, 1a або 1b, щоб завантаження машини становило близько 75 % завантаження машини в типовому випадку. На ці ядра згідно з Прикладом 2 наносили лакову суспензію, що містила телмісартан, до досягнення загальної маси таблеток близько 125 % завантаження машини в типовому випадку. Приклад 4: Oсмотична система вивільнення з оболонкою, вміщуючою кандесартан Із лакової суспензії на основі похідного полівінілового спирту виготовляли однорідну суспензію з вмістом 20 % кандесартану цилексетилу (відносно загального вмісту твердої речовини у лаковій суспензії). У барабанну машину для нанесення покриття закладали таку кількість ядер згідно з Прикладами 1, 1a або 1b, щоб завантаження машини становило близько 80 % завантаження машини в типовому випадку. На ці ядра згідно з Прикладом 2 наносили лакову суспензію, що містила кандесартан цилексетил до досягнення загальної маси таблеток близько 120 % завантаження машини в типовому випадку. Приклад 5: приклади композицій таблеток, вміщуючих ніфедипін + телмісартан Усі дані наведені в міліграмах (мг), способи одержання згідно з Прикладами 1, 1a, 1b, 2 та 3 із узгодженням кількостей і концентрацій. 35 Композиція Ніфедипін, мікронізований ГПМЦ (5 cП) ПEO 200.000 Стеарат магнію ГПМЦ (5 cП) Хлорид натрію ПЕО 5 000 000 Оксид заліза, червоний Стеарат магнію Ацетат целюлози ПЕГ 3 350 5a 5b 5c 5d 5e 5f 5g Шар активної речовини 5h 5i 33,0 33,0 22,0 22,0 66,0 66,0 8,2 8,2 8,2 8,2 8,2 8,2 8,2 122,2 122,2 122,2 122,2 122,2 122,2 122,2 0,4 0,4 0,4 0,4 0,4 0,4 0,4 Осмотичний шар 4,1 4,1 4,1 4,1 4,1 4,1 4,1 23,9 23,9 23,9 23,9 23,9 23,9 23,9 52,9 52,9 52,9 52,9 52,9 52,9 52,9 8,2 122,2 0,4 5,5 81,5 0,3 5,5 16,4 16,4 81,5 244,4 244,4 0,3 0,8 0,8 4,1 23,9 52,9 3,6 21,2 47,0 3,6 8,2 8,2 21,2 47,8 47,8 47,0 105,8 105,8 0,8 0,7 33,0 33,0 33,0 33,0 33,0 33,0 0,8 0,8 0,8 0,2 0,2 0,8 0,8 0,2 0,8 0,8 5j 0,7 5k 1,6 5l 1,6 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,4 0,4 Осмотична мембрана 32,3 32,3 32,3 32,3 32,3 32,3 32,3 32,3 33,2 33,2 38,0 38,0 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 2,0 2,0 20 UA 103347 C2 Лак, вміщуючий активну речовину Телмісартан, мікронізований Оксид заліза, червоний Kollicoat IR Kollidon VA 64 Діоксид титану Каолін Лаурил-сульфат натрію Sepifilm IR colorless (безбарвний) Opadry II 85F28393 5 1,0 1,0 53,5 51,4 7,5 5,7 11,8 12,0 13,4 2,0 1,7 1,0 1,0 1,0 1,0 116,0 99,1 16,0 11,0 22,7 26,0 25,9 4,0 3,3 84,0 1,0 80,0 20,0 80,0 20,0 80,0 1,0 1,0 1,0 1,0 1,0 162,0 84,0 162,0 84,0 121,5 84,0 189,0 Приклад 6: приклади композицій таблеток, вміщуючих ніфедипін + кандесартан Усі дані наведені в міліграмах (мг), способи одержання згідно з Прикладами 1, 1a, 1b, 2 та 3 із узгодженням кількостей і концентрацій. Композиція Ніфедипін, мікронізований ГПМЦ (5 cП) ПЕО 200 000 Стеарат магнію ГПМЦ (5 cП) Хлорид натрію ПЕО 5 000 000 Оксид заліза, червоний Стеарат магнію Ацетат целюлози ПЕГ 3 350 6a 6b 6c 6k 6l 33,0 33,0 33,0 66,0 66,0 8,2 8,2 8,2 8,2 8,2 8,2 8,2 8,2 5,5 5,5 16,4 122,2 122,2 122,2 122,2 122,2 122,2 122,2 122,2 81,5 81,5 244,4 0,4 0,4 0,4 0,4 0,4 0,4 0,4 0,4 0,3 0,3 0,8 Осмотичний шар 4,1 4,1 4,1 4,1 4,1 4,1 4,1 4,1 3,6 3,6 8,2 23,9 23,9 23,9 23,9 23,9 23,9 23,9 23,9 21,2 21,2 47,8 52,9 52,9 52,9 52,9 52,9 52,9 52,9 52,9 47,0 47,0 105,8 16,4 244,4 0,8 0,8 0,8 0,8 0,2 0,2 0,2 32,3 32,3 32,3 1,7 1,7 Кандесартан цилексетил, 4,0 мікронізований Оксид заліза, 1,0 червоний Kollicoat IR 10,7 Kollidon VA 64 1,5 Діоксид титану Каолін 2,4 Лаурил-сульфат 0,4 натрію Sepifilm IR colorless (безбарвний) Opadry II 85F28393 10 20,0 20,0 20,0 20,0 80,0 80,0 80,0 6d 6e 6f 6g Шар активної речовини 33,0 0,8 33,0 33,0 6j 22,0 22,0 8,2 47,8 105,8 0,8 0,7 0,7 1,6 1,6 0,2 0,2 0,2 0,2 Осмотична мембрана 0,2 0,2 0,2 0,4 0,4 33,2 33,2 38,0 38,0 1,7 2,0 2,0 4,0 32,0 4,0 32,0 1,0 1,0 1,0 32,3 0,8 33,0 6i 0,8 32,3 0,8 33,0 6h 32,3 32,3 1,7 1,7 1,7 1,7 1,7 Лак, вміщуючий активну речовину 32,3 1,7 4,0 4,0 4,0 32,0 32,0 32,0 32,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 12,2 1,4 2,8 3,2 85,6 12,0 19,2 80,8 9,018,5 21,1 0,4 3,2 1,7 2,6 20,0 1,0 132,0 20,0 132,0 20,0 99,0 20,0 132,0 Приклад 7: приклади композицій таблеток, вміщуючих ніфедипін + телмісартан + HCT Усі дані наведені в міліграмах (мг), способи одержання згідно з Прикладами 1, 1a, 1b, 2 та 3 із узгодженням кількостей і концентрацій. 21 UA 103347 C2 Композиція Ніфедипін, мікронізований ГПМЦ (5 cП) ПЕО 200 000 Стеарат магнію ГПМЦ (5 cП) Хлорид натрію ПЕО 5 000 000 Оксид заліза, червоний Стеарат магнію 7a 7b 7c 33,0 33,0 33,0 5 33,0 33,0 33,0 33,0 7h 7i 7j 7k 7l 33,0 22,0 22,0 66,0 66,0 8,2 8,2 8,2 8,2 8,2 8,2 8,2 8,2 5,5 122,2 122,2 122,2 122,2 122,2 122,2 122,2 122,2 81,5 0,4 0,4 0,4 0,4 0,4 0,4 0,4 0,4 0,3 Осмотичний шар 4,1 4,1 4,1 4,1 4,1 4,1 4,1 4,1 3,6 23,9 23,9 23,9 23,9 23,9 23,9 23,9 23,9 21,2 52,9 52,9 52,9 52,9 52,9 52,9 52,9 52,9 47,0 0,8 0,8 0,8 0,2 0,2 0,2 Ацетат целюлози 32,3 ПЕГ 3 350 1,7 Телмісартан, мікронізований Гідрохлоротіазид, мікронізований Оксид заліза, червоний Kollicoat IR Kollidon VA 64 Діоксид титану Каолін Лаурилсульфат натрію Sepifilm IR colorless (безбарвний) Opadry II 85F28393 7d 7e 7f 7g Шар активної речовини 0,8 0,8 0,8 0,8 5,5 16,4 16,4 81,5 244,4 244,4 0,3 0,8 0,8 3,6 8,2 8,2 21,2 47,8 47,8 47,0 105,8 105,8 0,8 0,7 0,7 1,6 1,6 0,2 0,2 0,2 0,2 0,2 Осмотична мембрана 32,3 32,3 32,3 32,3 32,3 32,3 32,3 1,7 1,7 1,7 1,7 1,7 1,7 1,7 Лак, вміщуючий активну речовину 0,2 0,2 0,4 0,4 33,2 1,7 33,2 1,7 38,0 2,0 38,0 2,0 40,0 40,0 40,0 40,0 80,0 80,0 80,0 80,0 40,0 80,0 40,0 80,0 12,5 12,5 12,5 12,5 25,0 25,0 25,0 25,0 12,5 12,5 12,5 25,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 116,0 99,1 16,0 11,0 22,7 26,0 25,9 4,0 116,0 99,1 16,0 11,0 22,7 26,0 25,9 3,3 4,0 162,0 3,3 162,0 162,0 162,0 121,5 121,5 189,0 189,0 Приклад 8: приклади композицій таблеток, вміщуючих ніфедипін + кандесартан цилексетил + HCT Усі дані наведені в міліграмах (мг), способи одержання згідно з Прикладами 1, 1a, 1b, 2 та 3 із узгодженням кількостей і концентрацій. Композиція 8a 8b 8c 8d 8e 8f 8g Шар активної речовини 8h Ніфедипін, мікронізова33,0 33,0 33,0 33,0 33,0 33,0 33,0 33,0 ний ГПМЦ (5 сП) 8,2 8,2 8,2 8,2 8,2 8,2 8,2 8,2 ПЕО 200 000 122,2 122,2 122,2 122,2 122,2 122,2 122,2 122,2 Стеарат магнію 0,4 0,4 0,4 0,4 0,4 0,4 0,4 0,4 Осмотичний шар ГПМЦ (5 сП) 4,1 4,1 4,1 4,1 4,1 4,1 4,1 4,1 Хлорид натрію 23,9 23,9 23,9 23,9 23,9 23,9 23,9 23,9 ПЕО 5 000 000 52,9 52,9 52,9 52,9 52,9 52,9 52,9 52,9 Оксид заліза, 0,8 0,8 0,8 0,8 0,8 0,8 0,8 0,8 червоний Стеарат магнію 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 22 8i 8j 8k 8l 22,0 22,0 66,0 66,0 5,5 81,5 0,3 5,5 16,4 16,4 81,5 244,4 244,4 0,3 0,8 0,8 3,6 21,2 47,0 3,6 8,2 8,2 21,2 47,8 47,8 47,0 105,8 105,8 0,7 0,7 1,6 1,6 0,2 0,2 0,4 0,4 UA 103347 C2 Осмотична мембрана Ацетат целюлози ПЕГ 3 350 Кандесартан цилексетил, мікронізований Гідрохлоротіазид, мікронізований Оксид заліза, червоний Kollicoat IR Kollidon VA 64 Діоксид титану Каолін Лаурилсульфат натрію Sepifilm IR colorless (безбарвний) Opadry II 85F28393 5 10 15 20 25 30 32,3 32,3 32,3 32,3 32,3 32,3 33,2 33,2 38,0 38,0 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 Лак, вміщуючий активну речовину 1,7 1,7 2,0 2,0 8,0 8,0 8,0 8,0 16,0 16,0 16,0 16,0 8,0 16,0 8,0 16,0 12,5 12,5 12,5 12,5 12,5 12,5 12,5 12,5 12,5 12,5 12,5 12,5 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 85,6 12,0 85,6 12,0 19,2 80,8 9,0 18,5 21,1 19,2 80,8 9,0 18,5 21,1 3,2 2,6 3,2 2,6 132,0 32,3 32,3 132,0 132,0 132,0 99,0 99,0 132,0 132,0 Приклад 9: Одержання осмотичної системи вивільнення, вміщуючої 60 мг ніфедипіну, з оболонкою, вміщуючою 32 мг кандесартану цилексетилу та фарблак. Для виготовлення лакової суспензії 240 г мікронізованого кандесартану цилексетилу (з розподілом розмірів частинок, описаним параметрами X 50 < 3 мкм та X90 < 7 мкм) суспендували в 1440 г очищеної води за допомогою пропелерної мішалки. Після додавання 360 г готового до застосування лаку Opadry II 85F19250 Clear та перемішування протягом наступних близько 45 хвилин одержали однорідну суспензію. У барабанну машину для нанесення покриттів BFC 5, виробник – компанія L. B. BOHLE Maschinen + Verfahren GmbH, D-59320, Еннігерло, оснащену нерозділеним барабаном і розпилювальним кронштейном із двома розпилювальними соплами, закладали 3 кг ядер згідно з Прикладом 1a і піддавали попередньому нагріванню при температурі припливного повітря 3 60 °C, подачі припливного повітря 160 м /год. та частоті обертання барабанна 18 о./хв. (обертів за хвилину). Параметри "температура припливного повітря" (60 °C), "подача припливного 3 повітря" (160 м /год.) і "частота обертання барабана" (18 об./хв.) підтримували постійними протягом всього процесу нанесення покриття. Для напилення лакової суспензії застосовували двоє сопел діаметром 1,0 мм, причому за допомогою тиску розпилення 0,8 бар та формувального тиску 0,7 бар досягали еліпсоїдної форми конуса розпилення. Положення розпилювального кронштейну протягом усього процесу нанесення покриття регулювали таким чином, щоб забезпечити однорідну картину розпилення. Лакову суспензію наносили на ядра, поступово збільшуючи швидкість розпилення в процесі нанесення покриття, а саме протягом першої години починаючи від 8 г/хв. і 12 г/хв., починаючи з другої години. Загальна тривалість процесу напилення становила близько 150 хвилин. Після цього таблетки полірували в барабані протягом наступних 30 хвилин без продовження напилення з частотою обертання барабана 12 об./хв. Перед початком процесу нанесення покриття, в різні моменти часу в процесі нанесення покриття та негайно по завершенні процесу нанесення покриття відбирали зразки таблеток і визначали збільшення маси. На підставі збільшення маси визначали момент завершення процесу напилення. Були одержані такі результати: 23 UA 103347 C2 Час [хв.] 0 30 60 90 120 150 5 10 15 20 25 30 35 40 45 50 Маса [мг] 531,0 544,8 558,3 572,9 593,2 612,6 Стандартне відхилення [мг] 3,9 4,1 4,6 3,4 6,4 6,5 Маса одержаних таким чином таблеток становила 612,6 мг 6,5 мг. Це відповідає теоретичній кількості нанесеного лаку близько 81,6 мг. Одержані таблетки мали діаметр 10,9 мм та висоту 7,0 мм. Одержані таблетки мали гладку, злегка блискучу поверхню. Одержані таблетки досліджували за допомогою тестера для визначення міцності на розрив (модель Schleuniger, тип 6D, виробник – компанія Dr. Schleuniger Pharmatron AG, Золотурн, Швейцарія). Лише під дією зусиль понад 400 Н почалося руйнування таблеток. Одержані таблетки піддавали випробуванню на стираність згідно з методикою фармакопеї США USP 31 ( Tablet Friability). Стирання не було виявлене. Одержані таблетки піддавали випробуванню на час розпаду згідно з методикою фармакопеї США USP 31 ( Disintegration) із застосуванням очищеної води як середовища при 37 °C в режимі безперервного спостереження. Не пізніше ніж через 10 хвилин плівка лаку повністю розчинилася. Одержані таблетки піддавали тесту на швидкість вивільнення згідно з методикою фармакопеї США USP 31 ( Dissolution) із застосуванням апаратури 2 (лопатева мішалка) з частотою обертання 75 об./хв. (обертів за хвилину) та 900 мл ацетатного буфера (pH = 4,5) із додаванням 0,6 % лаурилсульфату натрію як середовища при 37 °C. Вміст активної речовини у середовищі для вивільнення визначали шляхом високоефективної рідинної хроматографії (ВЕРХ) із УФ-детектуванням. Протягом 30 хвилин відбулося вивільнення принаймні 80 % кандесартану цилексетилу (найнижче значення із 12 результатів окремих вимірювань). Вивільнення ніфедипіну становило 10 % (середнє значення із 6 одиничних значень; діапазон одиничних значень: 7 – 12 %) протягом 4 годин, 52 % (45 – 56 %) протягом 12 годин та 98 % (91 – 100 %) протягом 24 годин. Одержані таблетки піддавали додатковому тесту на швидкість вивільнення згідно з методикою фармакопеї США USP 31 ( Dissolution) із застосуванням апаратури 2 (лопатева мішалка) з частотою обертання 75 об./хв. (обертів за хвилину) та 900 мл 0,1 N соляної кислоти (pH = 1,0) із додаванням 0,6 % лаурилсульфату натрію як середовища при 37 °C. Вміст активної речовини у середовищі для вивільнення визначали шляхом високоефективної рідинної хроматографії (ВЕРХ) із УФ-детектуванням. Протягом 30 хвилин відбулося вивільнення принаймні 88 % кандесартану цилексетилу (найнижче значення із 6 результатів окремих вимірювань). Для кожної із 10 таблеток, випадково вибраних із загальної кількості одержаних таблеток, визначали вміст окремої речовини кандесартану цилексетилу шляхом високоефективної рідинної хроматографії (ВЕРХ) із УФ-детектуванням. Середнє значення вмісту окремої речовини становило 32,0 мг при стандартному відхиленні 5,0 % відносно середнього значення. Звідси при тестуванні на однорідність вмісту (content uniformity) одержали прийнятне значення 12,1 %. Для нанесення додаткового шару фарблаку 3,065 кг таблеток закладали в барабанну машину для нанесення покриття BFC 5 виробництва компанії L. B. BOHLE Maschinen + Verfahren GmbH, D-59320, Еннігерло, і піддавали попередньому нагріванню при температурі 3 припливного повітря 60 °C, подачі припливного повітря 160 м /год. та частоті обертання барабана 18 об./хв. (обертів за хвилину). Параметри "температура припливного повітря" 3 (60 °C), "подача припливного повітря" (160 м /год.) і "частота обертання барабана" (18 об./хв.) підтримували постійними протягом всього процесу нанесення покриття. Для напилення лакової суспензії застосовували двоє сопел діаметром 1,0 мм, причому за допомогою тиску розпилення 0,8 бар та формувального тиску 0,7 бар досягали еліпсоїдної форми конуса розпилення. Положення розпилювального кронштейну протягом усього процесу нанесення покриття регулювали таким чином, щоб забезпечити однорідну картину розпилення. Лакову суспензію виготовляли шляхом диспергування 165 г готового до застосування лаку Opadry II 85F230009 у 495 г очищеної води. 444 г одержаної таким чином суспензії фарблаку наносили на таблетки зі швидкістю розпилення 8 г/хв. Загальна тривалість процесу напилення становила близько 55 хвилин. Момент завершення процесу напилення визначали на підставі 24 UA 103347 C2 5 10 заданої кількості напилюваної лакової суспензії. Після цього таблетки полірували у барабані протягом наступних 15 хвилин без продовження напилення. Маса одержаних таким чином лакованих таблеток становила635,7 мг 6,7 мг. Це відповідає теоретичній кількості нанесеного лаку близько 23,1 мг. Одержані лаковані таблетки мали діаметр 11,0 мм та висоту 7,1 мм. Одержані таблетки мали гладку, злегка блискучу поверхню. Процес вивільнення активної речовини з лакованих таблеток порівняно з вивільненням із таблеток, на яких не був нанесений фарблак, був затриманий менше ніж на 5 хвилин. Приклад 10: композиції таблеток, вміщуючих ніфедипін + кандесартан цилексетил Усі дані наведені в міліграмах (мг), способи одержання згідно з Прикладами 1, 1a, 1b, 2 та 3 із узгодженням кількостей і концентрацій. Композиція Ніфедипін, мікронізований ГПМЦ (5 cП) ПЕО 200 000 Стеарат магнію ГПМЦ (5 cП) Хлорид натрію ПЕО 5 000 000 Оксид заліза, червоний Стеарат магнію Ацетат целюлози ПЕГ 3 350 Кандесартан цилексетил, мікронізований Opadry II 85F19250 10a 10b 10c 66,0 66,0 66,0 10d 10e 10f 10g Шар активної речовини 10k 10l 22,0 22,0 22,0 22,0 16,4 16,4 16,4 16,4 8,2 8,2 8,2 8,2 5,5 5,5 244,4 244,4 244,4 244,4 122,2 122,2 122,2 122,2 81,5 81,5 0,8 0,8 0,8 0,8 0,4 0,4 0,4 0,4 0,3 0,3 Осмотичний шар 8,2 8,2 8,2 8,2 4,1 4,1 4,1 4,1 3,6 3,6 47,8 47,8 47,8 47,8 23,9 23,9 23,9 23,9 21,2 21,2 105,8 105,8 105,8 105,8 52,9 52,9 52,9 52,9 47,0 47,0 5,5 81,5 0,3 5,5 81,5 0,3 3,6 21,2 47,0 3,6 21,2 47,0 66,0 1,6 33,0 33,0 10j 1,6 1,6 0,8 0,8 0,7 0,7 0,7 0,7 0,4 0,4 0,4 0,4 0,2 0,2 0,2 Осмотична мембрана 0,2 0,2 0,2 0,2 0,2 38,0 38,0 38,0 33,2 33,2 33,2 33,2 2,0 2,0 1,7 1,7 1,7 32,0 16,0 8,0 4,0 32,0 16,0 32,0 16,0 8,0 4,0 48,0 24,0 12,0 16,0* 48,0 24,0 12,0 16,0* 48,0 24,0 12,0 16,0* 16,0 16,0 14,0 32,3 0,8 33,0 10i 1,6 38,0 0,8 33,0 10h 32,3 32,3 32,3 2,0 2,0 1,7 1,7 1,7 Лак, вміщуючий активну речовину 8,0 1,7 4,0 1,7 Фарблак Opadry II 85F230009 15 20 20,0 20,0 20,0 20,0 16,0 16,0 14,0 14,0 14,0 * при однакових інших компонентах у складі композиції кількість готового до застосування лаку може варіювати в діапазоні від 6,0 до 16,0 мг. Приклад 11: приклади композицій таблеток, вміщуючих ніфедипін + кандесартан-цилексетил + діуретик, вибраний з-поміж хлорталідону та гідрохлоротіазиду, причому активні речовини разом введені в одне зовнішнє покриття Усі дані наведені в міліграмах (мг), способи одержання згідно з Прикладами 1, 1a, 1b, 2 та 3 із узгодженням кількостей і концентрацій. Композиція 11a 11b 11c 11d 11e 11f 11g Шар активної речовини 11h 11i Ніфедипін, 33,0 33,0 33,0 33,0 33,0 33,0 33,0 33,0 22,0 мікронізований ГПМЦ (5 cП) 8,2 8,2 8,2 8,2 8,2 8,2 8,2 8,2 5,5 ПЕО 200 000 122,2 122,2 122,2 122,2 122,2 122,2 122,2 122,2 81,5 Стеарат магнію 0,4 0,4 0,4 0,4 0,4 0,4 0,4 0,4 0,3 25 11j 11k 11l 22,0 66,0 66,0 5,5 16,4 16,4 81,5 244,4 244,4 0,3 0,8 0,8 UA 103347 C2 ГПМЦ (5 cП) Хлорид натрію ПЕО 5 000 000 Оксид заліза, червоний Стеарат магнію Ацетат целюлози ПЕГ 3 350 Кандесартан цилексетил, мікронізований Гідрохлоротіазид, мікронізований Хлорталідон, мікронізований Opadry II 85F19250 4,1 23,9 52,9 4,1 23,9 52,9 4,1 23,9 52,9 0,8 0,8 0,8 0,2 0,2 0,2 4,1 4,1 4,1 23,9 23,9 8,0 12,5 Осмотичний шар 4,1 4,1 4,1 4,1 23,9 23,9 23,9 23,9 52,9 52,9 52,9 52,9 4,1 23,9 52,9 3,6 21,2 47,0 0,8 0,8 0,7 0,7 1,6 1,6 0,2 0,2 0,2 0,2 Осмотична мембрана 0,2 0,2 0,2 0,4 0,4 4,1 33,2 33,2 38,0 38,0 23,9 23,9 23,9 23,9 23,9 23,9 Лак, вміщуючий активну речовину 1,7 1,7 2,0 2,0 8,0 16,0 32,0 4,0 4,0 32,0 32,0 25,0 25,0 25,0 0,8 4,1 0,8 4,1 61,5 4,1 8,0 8,0 4,1 16,0 32,0 12,5 12,5 30,75 49,5 0,8 3,6 8,2 8,2 21,2 47,8 47,8 47,0 105,8 105,8 25,0 85,5 30,75 49,5 25,0 50,0 25,0 12,5 50,0 61,5 123,0 24,75 24,75 85,5 123,0 Фарблак Opadry II 85F230009 5 16,0 16,0 16,0 16,0 16,0 16,0 16,0 16,0 14,0 14,0 20,0 20,0 Приклад 12: приклади композицій таблеток, вміщуючих ніфедипін + в разі необхідності кандесартан-цилексетил + діуретик, вибраний з-поміж хлорталідону та гідрохлоротіазиду, причому активні речовини введені в різні, відокремлені один від одного, послідовно нанесені шари зовнішнього покриття Усі дані наведені в міліграмах (мг), способи одержання згідно з Прикладами 1, 1a, 1b, 2 та 3 із узгодженням кількостей і концентрацій. Композиція 12a 12b 12c 12d 12e 12f 12g Шар активної речовини 12h Ніфедипін, 33,0 33,0 33,0 33,0 33,0 33,0 33,0 33,0 мікронізований ГПМЦ (5 cП) 8,2 8,2 8,2 8,2 8,2 8,2 8,2 8,2 ПЕО 200 000 122,2 122,2 122,2 122,2 122,2 122,2 122,2 122,2 Стеарат магнію 0,4 0,4 0,4 0,4 0,4 0,4 0,4 0,4 Осмотичний шар ГПМЦ (5 cП) 4,1 4,1 4,1 4,1 4,1 4,1 4,1 4,1 Хлорид натрію 23,9 23,9 23,9 23,9 23,9 23,9 23,9 23,9 ПЕО 5 000 000 52,9 52,9 52,9 52,9 52,9 52,9 52,9 52,9 Оксид заліза, 0,8 0,8 0,8 0,8 0,8 0,8 0,8 0,8 червоний Стеарат магнію 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 Осмотична мембрана Ацетат 4,1 4,1 4,1 4,1 4,1 4,1 4,1 4,1 целюлози ПЕГ 3 350 23,9 23,9 23,9 23,9 23,9 23,9 23,9 23,9 Лак, вміщуючий активну речовину 1* Кандесартан цилексетил, 8,0 16,0 16,0 8,0 16,0 16,0 мікронізований Opadry II 12,0 24,0 24,0 12,0 24,0 24,0 85F19250 10 26 12i 12j 12k 12l 22,0 22,0 66,0 66,0 5,5 81,5 0,3 5,5 16,4 16,4 81,5 244,4 244,4 0,3 0,8 0,8 3,6 21,2 47,0 3,6 8,2 8,2 21,2 47,8 47,8 47,0 105,8 105,8 0,7 0,7 1,6 1,6 0,2 0,2 0,4 0,4 33,2 33,2 38,0 38,0 1,7 1,7 2,0 2,0 4,0 4,0 32,0 32,0 16,0 16,0 48,0 48,0 UA 103347 C2 Лак, вміщуючий активну речовину 2* Гідрохлоротіазид, мікронізований Хлорталідон, мікронізований Opadry II 85F19250 12,5 12,5 12,5 25,0 12,5 12,5 18,75 18,75 18,75 12,5 12,5 25,0 25,0 12,5 50,0 37,5 18,75 18,75 18,75 37,5 18,75 18,75 37,5 75,0 Кольоровий лак Opadry II 85F230009 5 10 15 20 25 30 16,0 16,0 16,0 16,0 16,0 16,0 16,0 16,0 14,0 14,0 20,0 20,0 * Послідовність нанесення обох вміщуючих активну речовину шарів лаку може бути змінена. Приклад 13: одержання осмотичної системи вивільнення, вміщуючої 20 мг ніфедипіну, з шаром зовнішнього покриття, вміщуючим 70 мг телмісартану Для одержання лакової суспензії 264 г мікронізованого телмісартану (із розподілом розмірів частинок, описаним параметрами X50 < 2 мкм та X90 < 5 мкм) у 1584 г очищеної води суспендували за допомогою пропелерної мішалки. Після додавання 396 г готового до застосування лаку Opadry II 85F19250 Clear та наступного перемішування протягом близько 45 хвилин одержали однорідну суспензію. 700 г (що відповідало 3240 шт.) ядер згідно з Прикладом 1c (декларований вміст - 20 мг ніфедипіну) закладали в барабанну машину для нанесення покриттів Glatt GC300 і піддавали попередньому нагріванню при температурі припливного повітря 60 °C, подачі припливного 3 повітря 120 м /год. та частоті обертання барабана 16 об./хв. (обертів за хвилину). Параметри 3 "температура припливного повітря" (60 °C), "подача припливного повітря" (120 м /год.) і "частота обертання барабана" (16 об./хв.) підтримували постійними протягом всього процесу нанесення покриття. Для напилення лакової суспензії застосовували сопло з круглим струменем діаметром 0,8 мм із тиском розпилення 1,6 бар, причому положення рухомого розпилювального кронштейну протягом усього процесу нанесення покриття регулювали таким чином, щоб забезпечити однорідну картину розпилення. Лакову суспензію наносили на ядра, поступово збільшуючи швидкість розпилення у процесі нанесення покриття, а саме протягом першої години починаючи від 3,5 г/хв. і 7 г/хв., починаючи з другої години. Загальна тривалість процесу розпилення становила 300 хвилин. Після цього таблетки полірували в барабані протягом наступних 10 хвилин без продовження напилення. Перед початком процесу нанесення покриття, в різні моменти часу в процесі нанесення покриття та негайно по завершенні процесу нанесення покриття відбирали зразки таблеток і визначали збільшення маси. На підставі збільшення маси визначали момент завершення процесу напилення. Маса одержаних таким чином таблеток становила 389,5 мг 8,1 мг. Це відповідає теоретичній кількості нанесеного лаку близько 173,5 мг. Одержані лаковані таблетки мали діаметр 9,9 мм та висоту 5,8 мм. Одержані таблетки мали однорідну поверхню. Під час внутрішньопроцесного контролю одержали наведені далі результати: Час [хв.] 0 30 60 90 120 150 180 210 240 270 300 Маса [мг] 216,0 226,9 238,2 255,5 274,0 290,9 309,5 331,8 350,1 373,6 389,5 35 27 Стандартне відхилення [мг] 3,9 4,3 4,1 6,3 5,2 3,7 6,8 8,0 7,2 7,9 8,1 UA 103347 C2 5 10 15 20 Міцність на розрив 10-ти з одержаних таблеток визначали за допомогою тестера для визначення міцності на розрив (модель Schleuniger, тип 6D, виробник – компанія Dr. Schleuniger Pharmatron AG, Золотурн, Швейцарія). Середня міцність на розрив становила 320 Н, виміряні одиничні значення становили від 280 до 390 Н. Одержані таблетки піддавали випробуванню на стираність згідно з методикою фармакопеї США USP 31 ( Tablet Friability). Стирання не було виявлене. Одержані таблетки піддавали випробуванню на час розпаду згідно з методикою фармакопеї США USP 31 ( Disintegration) із застосуванням очищеної води як середовища при 37 °C в режимі безперервного спостереження. Не пізніше ніж через 27 хвилин плівка лаку повністю розчинилася. Одержані таблетки піддавали тесту на швидкість вивільнення згідно з методикою фармакопеї США USP 31 ( Dissolution) із застосуванням апаратури 2 (лопатева мішалка) з частотою обертання 75 об./хв. (обертів за хвилину) та 900 мл ацетатного буфера (pH = 4,5) із додаванням 0,6 % лаурилсульфату натрію як середовища при 37 °C. Досліджували 6 таблеток. Вміст активної речовини у середовищі для вивільнення визначали шляхом високоефективної рідинної хроматографії (ВЕРХ) із УФ-детектуванням. Протягом 30 хвилин відбулося вивільнення в середньому 65 % телмісартану, протягом 60 хвилин відбулося повне вивільнення телмісартану з усіх таблеток. Вивільнення ніфедипіну становило 10 % протягом 4 годин, 55 % протягом 12 годин та 90 % протягом 24 годин. Для кожної із 10 випадково вибраних із загальної кількості одержаних таблеток визначали вміст єдиної речовини телмісартану шляхом високоефективної рідинної хроматографії (ВЕРХ) із УФ-детектуванням. Середнє значення вмісту єдиної речовини становило 70,0 мг при стандартному відхиленні 5,7 % відносно середнього значення. Звідси при тестуванні на однорідність вмісту (content uniformity) одержали прийнятне значення 13,7 %. 25 ФОРМУЛА ВИНАХОДУ 30 35 40 45 50 55 60 1. Фармацевтична препаративна форма, що містить комбінацію активної речовини ніфедипіну або нізолдипіну із принаймні одним антагоністом ангіотензину-ІІ та/або принаймні одним діуретиком, яка відрізняється тим, що ядро є осмотичною системою вивільнення та, що ніфедипін або нізолдипін вміщені в ядро, а антагоніст ангіотензину-ІІ та/або діуретик - в зовнішнє покриття навколо ядра, а також, що вивільнення принаймні 85 % ніфедипіну або нізолдипіну (відносно декларованої загальної кількості відповідної активної речовини) відбувається протягом періоду часу принаймні 4 та максимум 24 години, а вивільнення принаймні 60 % антагоніста ангіотензину-ІІ та/або діуретика (відносно декларованої загальної кількості відповідної активної речовини) відбувається протягом 30 хвилин згідно з методикою вивільнення Фармакопеї США (USP) із застосуванням апаратури 2 (лопатева мішалка), причому зовнішнє покриття містить принаймні один плівкоутворюючий полімер, придатний для швидкого вивільнення активної речовини. 2. Фармацевтична препаративна форма за п. 1, в якій антагоніст ангіотензину-ІІ вибраний із групи, що включає азилсартан, кандесартан, лосартан, телмісартан, ірбесартан, ембурсартан, епросартан, валсартан або олмесартан, або кандесартан у формі його проліків кандесартану цилексетилу або олмесартан у формі його проліків олмесартану медоксомілу. 3. Фармацевтична препаративна форма за будь-яким з пп. 1 або 2, в якій діуретик вибраний із групи, що включає ацетазоламід, дихлорфенамід, метазоламід, фуросемід, торасемід, буметанід, етакринову кислоту, піретанід, амілорид, триамтерен, спіронолактон, канреонат калію, еплеренон, гідрохлоротіазид, хлорталідон, ксипамід, метолазон, мефрузид або індапамід. 4. Фармацевтична препаративна форма за будь-яким з пп. 1-3, яка відрізняється тим, що мінімальна доза, в якій застосовано ніфедипін або нізолдипін, становить 5 мг, а максимальна доза - 90 мг, і мінімальна доза, в якій застосовано антагоніст ангіотензину-ІІ, становить 2 мг, а максимальна доза - 500 мг, та/або мінімальна доза, в якій застосовано діуретик, становить 0,5 мг, а максимальна доза - 500 мг. 5. Фармацевтична препаративна форма за будь-яким з пп. 1-4, яка відрізняється тим, що оболонка осмотичної системи вивільнення виконана з ацетилцелюлози або суміші ацетилцелюлози та поліетиленгліколю. 6. Фармацевтична препаративна форма за будь-яким з пп. 1-5, яка відрізняється тим, що плівкоутворюючий полімер вибраний із групи, що включає похідні целюлози, такі як метилцелюлоза (МЦ, МС), гідроксипропілметилцелюлоза (ГПМЦ, НРМС), гідроксипропілцелюлоза (ГПЦ, НРС), карбоксиметилцелюлоза натрію (Na-CMC), 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical dosage form comprising nifedipine or nisoldipine and an angiotensin-ii antagonist and/or a diuretic
Автори англійськоюKuhl, Alexander, Brendel, Erich, Brocker, Frank, Funke, Adrian, Ohm, Andreas, Kvesic, Dennis, Volkmer, Thomas
Автори російськоюФунке Адриан, Ом Андреас
МПК / Мітки
МПК: A61K 31/4184, A61K 31/4422, A61K 9/28, A61K 31/4178
Мітки: фармацевтична, препаративна, містить, форма, нізолдипін, ангіотензину-ii, ніфедипін, антагоніст, діуретик
Код посилання
<a href="https://ua.patents.su/31-103347-farmacevtichna-preparativna-forma-shho-mistit-nifedipin-abo-nizoldipin-i-antagonist-angiotenzinu-ii-ta-abo-diuretik.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична препаративна форма, що містить ніфедипін або нізолдипін і антагоніст ангіотензину-ii та/або діуретик</a>
Попередній патент: Газова турбіна зовнішнього згоряння, що використовує ротаційний регенеративний теплообмінник
Наступний патент: Склад і спосіб для боротьби зі шкідниками
Випадковий патент: Прутковий конвеєр