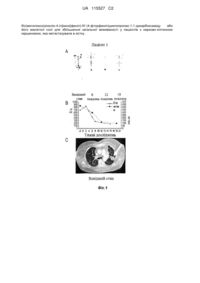
Застосування n-(4-{[6,7-бic(мeтилoкcи)xiнoлiн-4-iл]oкcи}фeнiл)-n’-(4-фтopфeнiл)циклoпpoпaн-1,1-дикapбoкcaмiду для лікування нирково-клітинної карциноми (варіанти)
Формула / Реферат
1. Застосування Сполуки 1:
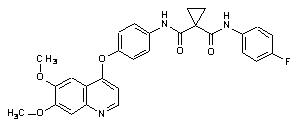
або її малатної солі один раз на день у вигляді таблетки, що містить 60, 40 або 20 мг Сполуки 1, де таблетка має склад, мас. %:
Сполука 1 31,68
мікрокристалічна целюлоза 38,85
безводна лактоза 19,42
гідроксипропілцелюлоза 3,00
кроскармелоза натрію 6,00
діоксид кремнію, колоїдний 0,30
стеарат магнію 0,75,
для лікування метастазів в кістці у пацієнта з нирково-клітинною карциномою.
2. Застосування за п. 1, де Сполука 1 є (L)- або (D)-малатною сіллю.
3. Застосування за п. 1, де Сполука 1 є (L)-малатною сіллю.
4. Застосування Сполуки 1:

або її малатної солі один раз на день у вигляді таблетки, що містить 60, 40 або 20 мг Сполуки 1, де таблетка має склад, мас. %:
Сполука 1 31,68
мікрокристалічна целюлоза 38,85
безводна лактоза 19,42
гідроксипропілцелюлоза 3,00
кроскармелоза натрію 6,00
діоксид кремнію, колоїдний 0,30
стеарат магнію 0,75,
для зменшення або стабілізації метастатичних уражень кістки, пов’язаних з нирково-клітинною карциномою.
5. Застосування за п. 4, де Сполука 1 є (L)- або (D)-малатною сіллю.
6. Застосування за п. 4, де Сполука 1 є (L)-малатною сіллю.
7. Застосування Сполуки 1:

або її малатної солі один раз на день у вигляді таблетки, що містить 60, 40 або 20 мг Сполуки 1, де таблетка має склад, мас. %:
Сполука 1 31,68
мікрокристалічна целюлоза 38,85
безводна лактоза 19,42
гідроксипропілцелюлоза 3,00
кроскармелоза натрію 6,00
діоксид кремнію, колоїдний 0,30
стеарат магнію 0,75,
для ослаблення болю в кістці через метастатичні ураження кістки, пов’язані з нирково-клітинною карциномою.
8. Застосування за п. 7, де Сполука 1 є (L)- або (D)-малатною сіллю.
9. Застосування за п. 7, де Сполука 1 є (L)-малатною сіллю.
10. Застосування Сполуки 1:

або її малатної солі один раз на день у вигляді таблетки, що містить 60, 40 або 20 мг Сполуки 1, де таблетка має склад, мас. %:
Сполука 1 31,68
мікрокристалічна целюлоза 38,85
безводна лактоза 19,42
гідроксипропілцелюлоза 3,00
кроскармелоза натрію 6,00
діоксид кремнію, колоїдний 0,30
стеарат магнію 0,75,
для збільшення загальної виживаності у пацієнтів з нирково-клітинною карциномою, яка метастазувала в кістку.
11. Застосування за п. 10, де Сполука 1 є (L)- або (D)-малатною сіллю.
12. Застосування за п. 10, де Сполука 1 є (L)-малатною сіллю.
13. Застосування за п. 10, де Сполука 1 є (D)-малатною сіллю.
14. Застосування за п. 10, де рак кістки викликаний раком нирки, який метастазував у кістку.
Текст
Реферат: Винахід стосується застосування N-(4-{[6,7-бic(мeтилoкcи)xiнoлiн-4-iл]oкcи}фeнiл)-N'-(4фтopфeнiл)циклoпpoпaн-1,1-дикapбoкcaмiду або його малатної солі один раз на день у вигляді таблетки, що містить 60, 40 або 20 мг N-(4-{[6,7-бic(мeтилoкcи)xiнoлiн-4-iл]oкcи}фeнiл)-N'-(4фтopфeнiл)циклoпpoпaн-1,1-дикapбoкcaмiду, для лікування метастазів в кістці у пацієнта з нирково-клітинною карциномою; застосування N-(4-{[6,7-бic(мeтилoкcи)xiнoлiн-4-iл]oкcи}фeнiл)N'-(4-фтopфeнiл)циклoпpoпaн-1,1-дикapбoкcaмiду або його малатної солі для зменшення або стабілізації метастатичних уражень кістки, пов’язаних з нирково-клітинною карциномою; застосування N-(4-{[6,7-бic(мeтилoкcи)xiнoлiн-4-iл]oкcи}фeнiл)-N'-(4-фтopфeнiл)циклoпpoпaн1,1-дикapбoкcaмiду або його малатної солі для ослаблення болю в кістці через метастатичні ураження кістки, пов’язані з нирково-клітинною карциномою; застосування N-(4-{[6,7 UA 115527 C2 (12) UA 115527 C2 бic(мeтилoкcи)xiнoлiн-4-iл]oкcи}фeнiл)-N'-(4-фтopфeнiл)циклoпpoпaн-1,1-дикapбoкcaмiду або його малатної солі для збільшення загальної виживаності у пацієнтів з нирково-клітинною карциномою, яка метастазувала в кістку. UA 115527 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0001] У цій заявці заявляється пріоритет попередньої заявки на патент США № 61/481682, яку подано 2 травня 2011 року, і попередньої заявки на патент США № 61/ 557366, яку подано 8 листопада 2011 року, які включені в цей документ шляхом посилання. Галузь техніки [0002] Цей винахід відноситься до лікування раку, зокрема, ракових захворювань, в яких поширені кісткові хвороби. Ці ракові захворювання включають рак молочної залози, меланому, нирково-клітинну карциному та рак щитовидної залози, а також інші, з використанням сполук Формули I, описаної в цьому документі. Крім лікування цих форм раку, сполук Формули I може бути використано для лікування болю, пов'язаного з метастазами в кістки. Здатність сполук Формули I лікувати ці та інші форми раку, а також пов'язаний з ними біль у кістках, може бути виміряна за допомогою технологій візуалізації, включаючи серед інших способів, візуалізацію магнітного резонансу. Рівень техніки [0003] Кісткові захворювання поширені у пацієнтів з раком простати, рак легенів, рак молочної залози, меланомою, нирково-клітинною карциномою і раком щитовидної залози. Наприклад, кастрат - резистентний рак передміхурової залози (КРРПЗ) є основною причиною смерті від раку у чоловіків. Незважаючи на досягнення в системному лікуванні КРРПЗ, поліпшення виживаності є помірним, і практично всі пацієнти, які гинуть від цього захворювання, мають середню виживаність близько 2 років. Головною причиною захворюваності та смертності при КРРПЗ є метастаз в кістку, на частку якого припадає близько 90 % випадків. [0004] Метастаз в кістку є комплексним процесом, який включає взаємодію між раковими клітинами та компонентами кістного мікрооточення, включаючи остеобласти, остеокласти та ендотеліальні клітини. Метастази в кістки викликають локальне порушення нормального ремоделювання кістки та враження, як правило, демонструє схильність до остеобластичної кістки (кісткоутворювальної) або остеолітичної (кісткорезорбуючої) активності. Хоча велика кількість пацієнтів з КРРПЗ із метастазами в кістку демонструють характеристики обох типів ураження, метастази в кістки при раку передміхурової залози часто є остеобластичними з патологічним відкладенням безструктурних кісток, яке супроводжується збільшенням скелетних переломів, компресією спинного мозку та сильним болем в кістках. [0005] Рецепторна тирозинкіназа МЕТ відіграє важливі ролі в клітинній рухливості, проліферації та виживанні, та було показано, що вона є ключовим фактором в ангіогенезі, інвазивності та метастазі пухлини. В первинних та метастатичних карциномах передміхурової залози спостерігали значну експресію МЕТ, з даними про більш високі рівні експресії в метастазах в кістках в порівнянні з метастазами в лімфатичні вузли або первинними пухлинами. [0006] Передача сигналів МЕТ може впливати на функцію остеобластів та остеобластів. В остеобластах кістки, яка формується, спостерігали сильне імуногістохімічне фарбування МЕТ, тоді як обидві HGF та MET експресуються остеобластами та остеобластами in vitro та регулюють кліткові відповіді, такі як проліферація, міграція і диференціація. Було зроблено припущення, що секреція HGF остеобластами є ключовим фактором у зв’язуванні остеобластів/остеобластів і, ймовірно прискорює розвиток метастазів у кістки пухлинними клітинами, які експресують MET. [0007] Фактор росту судинного ендотелію (VEGF) та його рецептори на ендотеліальних клітинах є загальноприйнятими ключевими медіаторами в процесі ангіогенезу пухлини. При раку передміхурової залози підвищений вміст VEGF в плазмі або в сечі пов’язують з більш короткою загальною виживаністю. VEGF може також відігравати роль в активації шляху МЕТ в пухлинних клітинах за рахунок зв’язування з нейроліпіном-1, який часто підвищено регулюється при раку передміхурової залози та активує МЕТ в со-рецепторному комплексі. Агенти, які спрямовані на сигнальний шлях VEGF, демонструють деяку активність у пацієнтів з КРРПЗ, а також з раком молочної залози, меланомою, нирково-клітинною карциномою та раком щитовидної залози. [0008] Як і МЕТ, сигнальний шлях VEGF сильно залучений до формування та ремоделювання кісток. Остеобласти та остеокласти експресують VEGF та рецептори VEGF, які приймають участь в аутокринних та/або паракринних оборотних механізмах регуляції клітинної проліферації, міграції, диференціювання та виживання [62-66]. Експерименти з використанням генетично модифікованих мишей показали, що ангіогенез і передача сигналів VEGF в остеобластах важливі при формуванні та відновленні кісток. [0009] Зберігається необхідність в способах лікування раку у пацієнтів, які є людьми з раком молочної залози, меланомою, нирково-клітинною карциномою та раком щитовидної залози, а також метастазів в кістки, пов'язаних з цими формами раку. Також зберігається необхідність у способі лікування раку кісток або болю, пов'язаних із метастазами в кістку, у пацієнтів, які 1 UA 115527 C2 5 10 15 20 25 потребують такого лікування. Короткий опис винаходу [0010] Ці та інші потреби задовольняються цим винаходом, який стосується способу лікування раку кісток, пов'язаного з раком молочної залози, меланомою, нирково-клітинною карциномою, раком легенів і раком щитовидної залози. Цей спосіб включає введення терапевтично ефективної кількості сполуки, яка модулює передачу сигналів MET і VEGF, пацієнту, який потребує такого лікування. У деяких варіантах реалізації, рак кісток є метастазами в кістки, пов'язані з раком молочної залози, меланомою, нирково-клітинною карциномою та раком щитовидної залози. [0011] В одному аспекті, цей винахід відноситься до способу лікування метастазів у кістки, раку легенів, раку молочної залози, меланоми, нирково-клітинної карциноми або раку щитовидної залози, або метастазів у кістки, пов'язаних з раком молочної залози, меланомою, нирково-клітинної карциномою або раком щитовидної залози, включає введення терапевтично ефективної кількості сполуки, яка модулює передачу сигналів MET і VEGF, пацієнту, потребує такого лікування. У деяких варіантах реалізації рак кісток або метастази є остеобластичий рак кісток або метастази в кістки. [0012] В одному варіанті реалізації цього та інших аспектів, інгібітор подвійної дії MET / VEGF є сполуками Формули I : I або його фармацевтично придатну сіль, при цьому: 1 R є галогеном; 2 R є галогеном; 3 R є (C1-C6)алкілом; 4 R є (C1-C6)алкілом; та Q є CH або N. [0013] В іншому варіанті реалізації, сполука Формули І є сполукою 1: H N H N O CH3 O O F O 30 35 40 H3 C O N Сполука 1 або його фармацевтично придатну сіль. Сполука 1 відома як N-(4-{[6,7біс(метилокси)хінолін-4-іл]окси}феніл)-N'-(4-фторфеніл)циклопропан-1,1-дикарбоксамід. [0014] В іншому аспекті, в цьому винаході представлений спосіб лікування метастазів в кістки, пов’язаних з раком легенів, раком молочної залози, меланомою, нирково-клітинною карциномою або раком щитовидної залози, що включає введення терапевтично ефективної кількості фармацевтичної композиції пацієнту, який потребує такого лікування, яка містить Сполуки Формули I або яблучнокислу сіль Сполуки Формули I, або іншу фармацевтично придатну сіль Сполуки Формули I, пацієнту, який потребує такого лікування. [0015] В іншому аспекті, в цьому винаході представлений спосіб зменшення або стабілізації уражень метастазів в кістки, пов’язаних з раком легенів, раком молочної залози, меланомою, нирково-клітинною карциномою або раком щитовидної залози, що включає введення терапевтично ефективної кількості фармацевтичної композиції пацієнту, який потребує такого лікування, яка містить Сполуки Формули I або яблучнокислу сіль Сполуки Формули I, або іншу 2 UA 115527 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтично придатну сіль Сполуки Формули I, пацієнту, який потребує такого лікування. [0016] В іншому аспекті, в цьому винаході представлений спосіб зменшення болю в кістках через метастатичні ураження кісток, пов’язаних з раком легенів, раком молочної залози, меланомою, нирково-клітинною карциномою або раком щитовидної залози, що включає введення терапевтично ефективної кількості фармацевтичної композиції пацієнтові, який потребує такого лікування, яка містить Сполуки Формули I або яблучнокислу сіль Сполуки Формули I, або іншу фармацевтично придатну сіль Сполуки Формули I, пацієнту, який потребує такого лікування. [0017] В іншому аспекті, в цьому винаході представлений спосіб лікування або мінімізації болю в кістках через метастатичних уражень кісток, пов’язаних з раком легенів, раком молочної залози, меланомою, нирково-клітинною карциномою або раком щитовидної залози, що включає введення терапевтично ефективної кількості фармацевтичної композиції пацієнтові, який потребує такого лікування, яка містить Сполуки Формули I або яблучнокислу сіль Сполуки Формули I, або іншу фармацевтично придатну сіль Сполуки Формули I, пацієнту, який потребує такого лікування. [0018] В іншому аспекті, в цьому винаході представлений спосіб попередження метастазів в кістки, пов’язаних з з раком легенів, раком молочної залози, меланомою, нирково-клітинною карциномою або раком щитовидної залози, що включає введення терапевтично ефективної кількості фармацевтичної композиції пацієнтові, який потребує такого лікування, яка містить Сполуки Формули I або яблучнокислу сіль Сполуки Формули I, або іншу фармацевтично придатну сіль Сполуки Формули I, пацієнту, який потребує такого лікування. [0019] В іншому аспекті, в цьому винаході представлений спосіб попередження метастазів в кістки у пацієнтів з раком легенів, раком молочної залози, меланомою, нирково-клітинною карциномою або раком щитовидної залози, що включає введення терапевтично ефективної кількості фармацевтичної композиції пацієнтові, який потребує такого лікування, яка містить Сполуки Формули I або яблучнокислу сіль Сполуки Формули I, або іншу фармацевтично придатну сіль Сполуки Формули I, пацієнту, який потребує такого лікування. [0020] В іншому аспекті, в цьому винаході представлений спосіб збільшення загальної виживаності у пацієнтів з раком легенів, раком молочної залози, меланомою, нирково-клітинною карциномою або раком щитовидної залози, що включає введення терапевтично ефективної кількості фармацевтичної композиції пацієнтові, який потребує такого лікування, яка містить Сполуки Формули I або яблучнокислу сіль Сполуки Формули I, або іншу фармацевтично придатну сіль Сполуки Формули I, пацієнту, який потребує такого лікування. [0021] В іншому аспекті, в цьому винаході представлений спосіб лікування ракового болю в кістках у індивідуума, який включає введення зазначеному індивідууму ефективної кількості Сполуки Формули I або яблучнокислої солі Сполуки Формули I, або іншої фармацевтично придатної солі Сполуки Формули I, пацієнту, який потребує такого лікування. В конкретному варіанті реалізації, Сполука Формули І є Сполукою І. В цьому аспекті раковий біль може виникати через рак кісток, остеосаркоми, а також через рак, який дав метастази в кістку. Так, в цьому аспекті, раковий біль в кістках може бути зі списку, який включає, але не обмежуючись цим, метастази в кістки з раку легенів, раку молочної залози, саркоми та раку нирок. [0022] В цих та інших аспектах, здатність сполуки Формули І лікувати, покращувати або знижувати тяжкість метастазів у кістки може бути визначена якісно і кількісно за допомогою різних фізіологічних маркерів, таких як циркулюючі біомаркери кісткового ремоделювання (тобто bALP, CTx і NTx), циркулюючі кількості пухлинних клітин (CTC) і технології візуалізації. Технології візуалізації включають позитронно-емісійну томографію (ПЕТ) або комп'ютеризовану томографію (КТ) і візуалізацію магнітного резонансу. Використовуючи ці прийоми візуалізації, можна контролювати і кількісно вимірювати зменшення розміру пухлини і зниження кількості та розміру кісткових поразок у відповідь на лікування сполукою Формули I. [0023] У цих та інших аспектах, в результаті введення сполуки Формули I пацієнтам з КРРПЗ, спостерігали скорочення м'якої тканини і вісцеральних пошкоджень. Більш того, введення сполуки Формули I призводить до збільшення концентрації гемоглобіну у пацієнтів з КРРПЗ, які страждають на анемію. Короткий опис графічних матеріалів [0024] На Фігурах 1А-С показана остеосцинтиграфія (Фігура 1А), відповідь остеосцинтиграфії (Фігура 1В) та дані КТ сканування (Фігура 1С) для Пацієнта 1, який страждає на КРРПЗ. [0025] На Фігурах 2А-С показана остеосцинтиграфія (Фігура 2А), відповідь остеосцинтиграфії (Фігура 2В) та дані КТ сканування (Фігура 2С) для Пацієнта 2, який страждає на КРРПЗ. [0026] На Фігурах 3А-В показана остеосцинтиграфія (Фігура 3А), відповідь остеосцинтиграфії (Фігура 3В) для пацієнта 3, який страждає на КРРПЗ. 3 UA 115527 C2 5 10 [0027] Фігури 4А та В демонструють остеосцинтиграфію (Фігура 4А), відповідь остеосцинтиграфії (Фігура 4В) для Пацієнта, який страждає на нирково-клітинну карциному з метастазами в кістки. [0028] Фігури 5А та 5В демонструють остеосцинтиграфію (Фігура 5А), відповідь остеосцинтиграфії (Фігура 5В) для Пацієнта, який страждає на меланому з метастазами в кістки. [0029] На Фігурі 6 представлено КТ сканування метастазу в кістки пацієнта з диференційованим раком щитовидної залози до (Фігура 6А) та після (Фігура 6В) лікування. Докладний опис винаходу Скорочення та визначення [0030] Наступні скорочення та терміни мають в цьому документі вказані значення: Скорочення Значення Ac Ацетил bALP Кістково-специфічна лужна фосфатаза br Широкий °C Градуси Цельсію циклоЦикло CBZ Карбобензокси = бензилоксикарбоніл CTx Поперечно-зшиті С-кінцеві телопептиди колагену типу-1 d Дублет dd Дублет дублетів dt Дублет триплетів ДХМ Дихлорметан ДМЭ 1,2-диметоксіетан ДМФ N,N-Диметилформамід ДМСО диметилсульфоксид Dppf 1,1’біс(дифенілфосфано)фероцен EI Іонизація електронним ударом г грам(и) год година(и) ЖХВД Рідинна хроматографія високого тиску л літр(ів) M Молярний або молярність m Мультиплет мг Міліграм(и) МГц Мегагерц (частота) Хв. Хвилина(и) мл Мілілітр(и) мкл Мікролітр(и) мкМ Мікромоль(і) або мікромолярний мМ Мілімолярний ммоль Мілімоль(і) моль Моль(і) MS Масс-спектральний аналіз н. Нормальний або нормальність нМ Наномолярний ЯМР Спектроскопія ядерного магнітного резонансу NTx Поперечно-зшиті N-кінцеві телопептиди колагена типу-1 q Квартет RT Кімнатна температура s Синглет t или tr Триплет 4 UA 115527 C2 Скорочення Значення ТФК Трифтороцтова кислота ТГФ Тетрагідрофуран ТСХ Тонкошарова хроматографія 5 10 [0031] Символ «-» означає одинарний зв’язок, «=» означає подвійний зв’язок. [0032] При зображенні або описанні хімічних структур, якщо однозначно не указано інше, всі атоми вуглецю вважаються такими, що мають водневі замісники для відповідності валентності, яка дорівнює чотирьом. Наприклад, в структурі в лівій частині схематичного зображення, представленого нижче, мається на увазі дев’ять атомів водню. Ці дев'ять атомів водню зображені в правій структурі. Іноді певний атом у структурі описаний текстовою формулою, як такий, що має заміщення атомом водню або атомами водню (явно певний водень), наприклад, -CH2CH2-. Фахівцям в даній галузі зрозуміло, що викладений вище описовий прийом поширений в галузі хімії для забезпечення стислості та простоти опису структур, які в іншому випадку є H H H H Br Br H H H складними. H H [0033] Якщо група «R» зображена в кільцевій системі як «плаваюча», як, наприклад, у формулі: R 15 20 25 30 35 то, якщо не вказано інше, заступник «R» може займати будь-який атом кільцевої системи, маючи на увазі заміщення зображеного, який мається на увазі або явно певного водню у одного з кільцевих атомів, за умови утворення стійкої структури. [0034] Якщо група «R» зображена в конденсованій кільцевій системі плаваючою, як, наприклад, у формулах: H R N R Z N HN R H або , або то, якщо не вказано інше, заступник «R» може перебувати у будь-якого атома зазначеної конденсованої кільцевої системи, маючи на увазі заміщення зображеного водню (наприклад, NH- в представленій вище формулі), водню, який мається на увазі (наприклад, як у поданій вище формулі, де атоми водню не показані, але розуміється, що вони присутні), або явно певного водню (наприклад, в представленій вище формулі, «Z» дорівнює = CH- ) у одного з кільцевих атомів, за умови утворення стійкої структури. У зображеному прикладі, група «R» може знаходитися в 5-членному або 6-членному кільці конденсованої кільцевої системи. Якщо група «R» зображена як існуюча в кільцевій системі, яка містить насичені атоми вуглецю, як, наприклад, у формулі: (R)y причому в цьому прикладі «Y» може бути більше одного, маючи на увазі, що кожен з них заміщає зображений, який маємо на увазі або явно певний водень в кільці; то, якщо не вказано інше, за умови стійкості структури, яка утворюється, два «R» можуть знаходитися в одного атома вуглецю. Простим прикладом є випадок, коли R є метиловою групою; у вуглецю зображеного кільця («кільцевого» вуглецю) може існувати гемінальний диметил. В іншому прикладі, два «R» у одного атома вуглецю, включаючи цей атом вуглецю, можуть утворювати кільце, утворюючи, таким чином, спіроциклічну кільцеву («спіроциклілову» групу) структуру, з кільцем, зображеним, наприклад, у формулі: HN 40 [0035] «Галоген» або «гало» відноситься до фтору, хлору, брому або йоду. [0036] «Вихід» для кожної реакції, описаної в цьому документі, виражений у відсотках від 5 UA 115527 C2 5 10 15 20 25 30 35 40 45 50 55 60 теоретичного виходу. [0037] Пацієнт», для цілей даного винаходу, включає людей і інших тварин, зокрема, ссавців, і інші організми. Отже, способи цього винаходу можуть бути застосовані як для лікування людей, так і для застосування у ветеринарії. В іншому варіанті реалізації пацієнт є ссавцем, а в іншому варіанті реалізації пацієнт є людиною. [0038] «Фармацевтично придатна сіль» сполуки означає сіль, яка є фармацевтично придатною, і яка має задану фармакологічну активність вихідної сполуки. Слід розуміти, що фармацевтично придатні солі є нетоксичними. Додаткова інформація про відповідні фармацевтично придатні солі представлена в публікації Remington’s Pharmaceutical Sciences, е 17 видавництво, Mack Publishing Company, Істон, штат Пенсільванія, 1985 рік, яка входить в цей документ шляхом посилання або S. M. Berge, et al., “Pharmaceutical Salts,” J. Pharm. Sci., 1977;66:1-19, які входять в цей документ шляхом посилання. [0039] Приклади фармацевтично придатних солей приєднань кислот включають солі, що утворені з неорганічними кислотами, такими як хлороводнева кислота, бромоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота, і тому подобні; а також з органічними кислотами, такими як оцтова кислота, трифтороцтова кислота, пропіонова кислота, гексанова кислота, циклопентанпропіонова кислота, гліколева кислота, піровиноградна кислота, молочна кислота, щавлева кислота, малеїнова кислота, малонова кислота, бурштинова кислота, фумарова кислота, винна кислота, яблучна кислота, лимонна кислота, бензойна кислота, корична кислота, 3-(4-гідроксибензоїл)бензойна кислота, мигдалева кислота, метансульфонова кислота, етансульфонова кислота, 1,2-етандисульфонова кислота, 2-гідроксиетансульфонова кислота, бензолсульфонова кислота, 4-хлорбензолсульфонова кислота, 2-нафталінсульфонова кислота, 4-толуолсульфонова кислота, камфорсульфонова кислота, глюкогептонова кислота, 4,4’-метиленбіс-(3-гідрокси-2-ен-1-карбонова кислота), 3-фенілпропіонова кислота, триметилоцтова кислота, трет-бутилоцтова кислота, лаурилсірчана кислота, глюконова кислота, глутамінова кислота, гідроксинафтойна кислота, саліцилова кислота, стеаринова кислота, муконова кислота, п-толуолсульфонова кислота та саліцилова кислота, і тому подібними. [0040] «Проліки» відносяться до сполук, які перетворюються (звичайно швидко) in vivo з утворенням вихідної сполуки представлених вище формул, наприклад, шляхом гідролізу в крові. Загальні приклади включають, але не обмежуючись цим, складно ефірні та амідні форми сполуки, яка має активну групу карбонової кислоти. Приклади фармацевтично придатних складних ефірів сполук цього винаходу включають, але не обмежуючись цим, алкілові ефіри (наприклад, які містять від приблизно одного до приблизно шести атомів вуглецю), де алкілова група має пряму або розгалужену будову. Придатні складні ефіри включають також циклоалкілові ефіри та арил алкілові ефіри, такі як, але не обмежуючись цим, бензил. Приклад фармацевтично придатних амідів цього винаходу включають, але не обмежуючись цим, первинні аміди та вторинні та третинні аміди (наприклад, які містять від приблизно одного до приблизно шести атомів вуглецю). Аміди та складні ефіри сполук цього винаходу можуть бути отримані звичайними способами. Повний огляд проліків представлений в публікації T. Higuchi and V. Stella, “Pro-drugs as Novel Delivery Systems”, том 14 серії симпозіумів A.C.S., а також у публікації Bioreversible Carriers in Drug Design, під редакцією Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987, які включені в цей документ шляхом посилання для всіх цілей. [0041] «Терапевтично ефективна кількість» є кількістю сполуки цього винаходу, яка при введенні пацієнту покращує симптом захворювання. Мається на увазі, що терапевтична ефективна кількість сполуки окремо або у комбінації з іншими активними інгредієнтами, ефективними для модулювання c-Met та/або VEGFR2, або ефективними для лікування або попередження раку. Кількість сполуки цього винаходу, яке складає «терапевтично ефективну кількість» може варіюватися в залежності від зазначеної сполуки, стадії захворювання та його складності, віку пацієнта, який підлягає лікуванню, і тому подібного. Терапевтично ефективна кількість може бути визначена спеціалістами в даній галузі, з урахуванням їх знань та цього опису. [0042] «Лікувати» або «лікування» захворювання, розладу або синдром, при використанні в цьому документі, включає (i) попередження виникнення захворювання, розладу або синдрома у людини, тобто запобігання розвитку клінічних симптомів захворювання, розладу або синдрому у тварини, яке може підлягати або бути схильним до цього захворювання, розладу або синдрому, але ще не хворіє або не проявляє симптомів захворювання, розладу або синдрому; (ii) інгібування захворювання, розладу або синдрому, тобто зупинення його розвитку; та (iii) полегшення захворювання, розладу або синдрому, тобто спричинення регресії захворювання, 6 UA 115527 C2 5 10 розладу або синдрому. Як відомо в цій галузі, може бути необхідне поправлення на системну доставку проти локалізованої доставку, вік, маса тіла, загальний стан здоров’я, стать, харчування, час введення, взаємодію ліків та тяжкість стану, та вона може бути встановлена звичайним експериментуванням. Варіанти реалізації [0043] В одному із варіантів реалізації, сполука Формули І є сполукою Формули Іа: Формула Ia або її фармацевтично придатною сіллю, при цьому: 1 R є галогеном; 2 R є галогеном; та Q є CH або N. [0044] В іншому варіанті реалізації, сполука Формули І є Сполукою 1: H N H N O CH3 O F O O H3 C 15 20 25 30 35 40 O N Сполука 1 або її фармацевтично придатною сіллю. Як зазначено раніше, сполука 1, яка згадується в цьому документі як N-(4-{[6,7-біс(метилокси)хінолін-4-іл]окси}феніл)-N'-(4фторфеніл)циклопропан-1,1-дикарбоксамід. У публікації WO 2005/030140 описано Сполуку 1 та описано її одержання (Приклад 12, 37, 38 та 48), а також описана терапевтична активність цієї сполуки для інгібування, регуляція та/або модулювання сигнальної трансдукції кіназ (Аналізи, Таблиця 4, рядок 289). Приклад 48 знаходиться в параграфі [0353] публікації WO 2005/030140. [0045] В інших варіантах реалізації, сполука Формули І, Іа або Сполука 1, або їх фармацевтично придатні солі, при цьому зазначена фармацевтична композиція додатково місти фармацевтично придатний носій, формоутворювальний засіб або розріджувач. В конкретному варіанті реалізації Сполука І є Сполукою 1. [0046] Сполука Формули І, Іа та Сполука 1, які описані в цьому документі, включають зазначені сполуки, а також окремі ізомера та суміші ізомерів. В кожному випадку сполука Формули І містить фармацевтично придатні солі, гідрати та/або сольвати згадуваних сполук або будь-яких їх окремих ізомерів або сумішей ізомерів. [0047] В інших варіантах реалізації, сполука Формули І, Іа або Сполука 1 може бути яблучнокислою сіллю. Яблучнокисла сіль Сполуки Формули І та Сполука 1 описана в PCT/US2010/021194 та 61/325095. [0048] В інших варіантах реалізації, сполука Формули І, Іа або Сполука 1 може бути (D)яблучнокислою сіллю. [0049] В інших варіантах реалізації, сполука Формули І, Іа або 1 може бути яблучнокислою сіллю. [0050] В інших варіантах реалізації, сполука Формули І, Іа або 1 може бути (L)яблучнокислою сіллю. [0051] В інших варіантах реалізації, Сполука 1 може бути (D)-яблучнокислою сіллю. [0052] В інших варіантах реалізації, Сполука 1 може бути (L)-яблучнокислою сіллю. [0053] В інших варіантах реалізації, яблучнокисла сіль Сполуки 1 є кристалічною N-1 формою (L)- яблучнокислої солі та/або (D)-яблучнокислої солі Сполуки 1, описаного в заявці на 7 UA 115527 C2 5 10 15 20 25 30 35 40 45 50 55 60 патент США серійного № 61/325095. Дивись також WO 2008/083319, де описані властивості кристалічних енантіомерів, включаючи N-1 та/або N-2 кристалічні форми яблучнокислої солі Сполуки 1. Способи отримання та опис таких форм докладно описані в PCT/US10/21194, що включений в цей документ шляхом посилання у повному обсязі. [0054] В іншому варіанті реалізації, цей винахід відноситься до способу поліпшення симптомів метастазів в кісту, який включає введення пацієнту, який потребує такого лікування, терапевтично ефективної кількості сполуки Формули І в будь-якому із варіантів реалізації, описаних в цьому документі. В конкретному варіанті реалізації, Сполука Формули І є Сполукою 1. [0055] В іншому варіанті реалізації, цей винахід відноситься до способів лікування болю, пов’язаного з метастазами в кісту, який включає введення пацієнту, який потребує такого лікування, терапевтично ефективної кількості сполуки Формули І в будь-якому із варіантів реалізації, описаних в цьому документі. В конкретному варіанті реалізації, Сполука Формули І є Сполукою 1. [0056] В іншому варіанті реалізації, сполуку Формули І вводять після лікування таксотером. В конкретному варіанті реалізації, Сполука Формули І є Сполукою 1. [0057] В іншому варіанті реалізації, сполука Формули І є також ефективним або більш ефективним, ніж мітоксантрон плюс преднізон. В конкретному випадку реалізації, Сполука Формули І є Сполукою 1. [0058] В іншому варіанті реалізації, Сполуку Формули І, Іа або Сполуку 1, або його фармацевтично придатну сіль вводять перорально один раз на день у вигляді таблетки або капсули. [0059] В іншому варіантіреалізації, Сполуку 1 вводять перорально у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці. [0060] В іншому варіанті реалізації, Сполуку 1 вводять перорально один раз на день у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці, яка містить до 100 мг Сполуки 1. [0061] В іншому варіанті реалізації, Сполуку 1 вводять перорально один раз на день у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці, яка містить 100 мг Сполуки 1. [0062] В іншому варіанті реалізації, Сполуку 1 вводять перорально один раз на день у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці, яка містить до 95 мг Сполуки 1. [0063] В іншому варіанті реалізації, Сполуку 1 вводять перорально один раз на день у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці, яка містить до 90 мг Сполуки 1. . [0064] В іншому варіанті реалізації, Сполуку 1 вводять перорально один раз на день у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці, яка містить до 85 мг Сполуки 1. [0065] В іншому варіанті реалізації, Сполуку 1 вводять перорально один раз на день у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці, яка містить до 80 мг Сполуки 1. [0066] В іншому варіанті реалізації, Сполуку 1 вводять перорально один раз на день у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці, яка містить до 75 мг Сполуки 1. [0067] В іншому варіанті реалізації, Сполуку 1 вводять перорально один раз на день у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці, яка містить до 70 мг Сполуки 1. [0068] В іншому варіанті реалізації, Сполуку 1 вводять перорально один раз на день у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці, яка містить до 65 мг Сполуки 1. [0069] В іншому варіанті реалізації, Сполуку 1 вводять перорально один раз на день у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці, яка містить до 60 мг Сполуки 1. [0070] В іншому варіанті реалізації, Сполуку 1 вводять перорально один раз на день у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці, яка містить до 55 мг Сполуки 1. [0071] В іншому варіанті реалізації, Сполуку 1 вводять перорально один раз на день у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці, яка містить до 50 мг Сполуки 1. 8 UA 115527 C2 5 10 15 20 25 30 [0072] В іншому варіанті реалізації, Сполуку 1 вводять перорально один раз на день у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці, яка містить до 45 мг Сполуки 1. [0073] В іншому варіанті реалізації, Сполуку 1 вводять перорально один раз на день у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці, яка містить до 40 мг Сполуки 1. [0074] В іншому варіанті реалізації, Сполуку 1 вводять перорально один раз на день у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці, яка містить до 30 мг Сполуки 1. [0075] В іншому варіанті реалізації, Сполуку 1 вводять перорально один раз на день у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці, яка містить до 25 мг Сполуки 1. [0076] В іншому варіанті реалізації, Сполуку 1 вводять перорально один раз на день у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці, яка містить до 20 мг Сполуки 1. [0077] В іншому варіанті реалізації, Сполуку 1 вводять перорально один раз на день у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці, яка містить до 15 мг Сполуки 1. [0078] В іншому варіанті реалізації, Сполуку 1 вводять перорально один раз на день у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці, яка містить до 10 мг Сполуки 1. [0079] В іншому варіанті реалізації, Сполуку 1 вводять перорально один раз на день у вигляді вільної основи або яблучнокислої солі в капсулі або таблетці, яка містить до 5 мг Сполуки 1. [0080] В іншому варіанті реалізації, Сполуку 1 вводять у вигляді вільної основи або яблучнокислої солі перорально один раз на день у формі таблетки, яка представлена в наступній таблиці. Інгредієнт (% мас./мас.) Сполука 1 31,68 Мікрокристалічна целюлоза 38,85 Безводна лактоза 19,42 Гідроксипропілцелюлоза 3,00 Кроскармелоза натрію 3,00 Разом всередині гранули 95,95 Діоксид кремнію, колоїдний 0,30 Кроскармелоза натрію 3,00 Стеарат магнію 0,75 Разом 100,00 [0081] В іншому варіанті реалізації, Сполуку 1 вводять перорально у вигляді вільної основи або яблучнокислої солі один раз на день у формі таблетки, яка представлена в наступній таблиці. Інгредієнт (% мас./мас.) Сполука 1 25,0-33,3 Мікрокристалічна целюлоза Необхідна целюлоза кількість Гідроксипропілцелюлоза 3 Полоксамер 0-3 Кроскармелоза натрію 6,0 Колоїдний діоксид кремнію 0,5 Стеарат магнію 0,5-1,0 Разом 100 [0082] В іншому варіанті реалізації, Сполуку 1 вводять перорально у вигляді вільної основи або яблучнокислої солі один раз на день у формі таблетки, яка представлена в наступній таблиці. 9 UA 115527 C2 Інгредієнт 5 10 15 20 25 30 35 40 Теоретична кількість (мг/разова доза) 100,0 Сполука 1 Мікрокристалічна целюлоза PH-102 155,4 Безводна лактоза 60М 77,7 Гідроксипропілцелюлоза, EXF 12,0 Кроскармелоза натрію 24 Колоїдна двуокис кремнію 1,2 Стеарат магнію (не з крупної рогатої скотини) 3,0 Опадрай жовтий 16,0 Разом 416 [0083] Будь-які композиції таблеток, які представлені вище, можуть бути скориговані у відповідності з заданою дозою Сполуки 1. Так, кількість кожного інгредієнта композиції може бути пропорційно підібрано для забезпечення таблетки, які містить різні кількості Сполуки 1, як це представлено в попередніх параграфах. В іншому варіанті реалізації композиції можуть містити 20, 40, 60 або 80 мг Сполуки 1. Введення [0084] Введення сполуки Формули І, Формули Іа або Сполуки 1, або їх фармацевтично придатних солей, в чистій формі або у відповідній фармацевтичній композиції, може бути здійснено будь-яким придатним способом введення або засобами, які служать для таких самих цілей. Так, введення може бути, наприклад, пероральним, назальним, парентеральним (внутрішньовенним, внутрішньом’язовим або підшкірним), місцевим, трансдермальним, внутрішньовагінальним, внутрішньосудинним, внутрішньопорожнинним або ректальним, у формі твердої речовини, напівтвердої речовини, ліофілізованого порошку або рідких лікарських форм таких як, наприклад, таблетки, супозиторії, пілюлі, м'які еластичні або жорсткі желатинові дози (які можуть бути в капсулах або таблетках), порошки, розчини, суспензії або аерозолі, і тому подібні, зокрема, в лікарських формах з одноразовим дозуванням, придатним для простого введення точних доз. [0085] Композиції містять стандартний фармацевтичний носій або формоутворювальний засіб та сполуку Формули I як активний агент, крім цього, можуть містити носії та ад'юванти, і так далі. [0086] Ад'ювант включають консерванти, зволожувачі, суспендуючі засоби, підсолоджувачі, ароматизатори, віддушки, емульгатори та засоби дозування. Зараження мікроорганізмами можна запобігти за рахунок додавання різних антибактеріальних і протигрибкових агентів, наприклад, парабенів, хлорбутанолу, фенолу, сорбінової кислоти і тому подібних. Також може бути бажаним включити ізотонічні агенти, наприклад, цукр, хлорид натрію і тому подібні. Пролонговане поглинання фармацевтичної форми, яка ін’єктується, може бути здійснено за рахунок використання засобів сповільненої абсорбції, наприклад, моностеарату алюмінію та желатину. [0087] При необхідності, фармацевтична композиція сполуки Формули I може також містити невеликі кількості допоміжних речовин, таких як зволожуючі і емульгуючі засоби, рН буферні агенти, антиоксиданти і тому подібні, такі як, наприклад, лимонна кислота, сорбітмонолаурат, триетаноламіну олеат, бутильований гідрокситолуол і так далі. [0088] Вибір композиції залежить від різних факторів, таких як, спосіб введення ліків (наприклад, для перорального введення - композиції у формі таблеток, пігулок або капсул) і біодоступність лікарської речовини. Нещодавно були розроблені фармацевтичні композиції спеціально для ліків, що володіють слабкою біодоступністю на підставі того принципу, що біодоступність можна збільшити за рахунок збільшення площі поверхні, тобто, зниження розміру часток. Наприклад, у патенті США № 4107288 описана фармацевтична композиція, що має частинки з діапазоном розмірів від 10 до 1000 нм, в якій активний матеріал нанесений на поперечно - зшиту матрицю макромолекул. У патенті США № 5145684 описано виробництво фармацевтичної композиції, в якій лікарську речовину подрібнено до наночастинок (середній розмір часток 400 нм) у присутності модифікатора поверхні, а потім дисперговані у рідкому 10 UA 115527 C2 5 10 15 20 25 30 35 40 45 50 55 60 середовищі з утворенням фармацевтичної композиції, що має помітно високу біодоступність. [0089] Композиції, придатні для парентерального введення, можуть містити фізіологічно придатні стерильні водні або не водні розчини, диперсії, суспензії або емульсії, а також стерильні порошки для відновлення стерильних розчинах або дисперсіях, якими роблять ін’єкцію. Приклади придатних водних та неводних носіїв, розріджувачів, розчинників або середовищ включають воду, етанол, поліоли (пропіленгліколь, поліетиленгліколь, гліцерин і тому подібні), їх відповідні суміші, олії (такі як оливкова олія) або органічні складні ефіри, якими роблять ін’єкцію, такі як етил олеат. Необхідна текучість може бути забезпечена, наприклад за рахунок використання покриття, такого як лецитин, які зберігають необхідний розмір частинок у випадку дисперсій, а також за допомогою поверхнево-активних речовин. [0090] Одним із конкретних способів введення є пероральний, з використання зручної денної схеми введення, яка може регулюватись у відповідності з важкістю стану хвороби, яка підлягає лікуванню. [0091] Тверді лікувальні форми для перорального введення включають капсули, таблетки, пілюлі, порошки та гранули. В таких твердих лікарських формах активну сполуку вводять щонайменше з одним стандартним інертним формоутворюючим засобом (або носієм), таким як цитрат натрію або фосфат дикальцію або (а) наповнючами або сухими розріджувачами, такими як, наприклад, похідні целюлози, крохмали, лактоза, сахароза, глюкоза, маніт та кремнієва кислота; (b) зв’язуючими, такими як, наприклад, похідні целюлози, крохмали, альгінати, желатин, полівінілпіролідон, сахароза та гуміарабік; (с) зволожувачами, такими як, наприклад, гліцерин; (d) засобами для покращення здатності таблеток розпадатися, такими як, наприклад, агар-агар, карбонат кальцію, картопляний або тапіоковий крохмаль, альгінова кислота, кроскармелоза натрію, складні силікати та карбонат натрію; (e) інгібіторами розчинення, як наприклад, парафін; (f) прискорювачами абсорбції, як наприклад, четвертинні амонієві сполуки; (g) агентами, що змочуються, як наприклад, цетиловий спирт, моностеарат гліцерина, стеарат магнію і тому подібними; (h) адсорбентами, як наприклад, каолін та бентоніт; та (i) змазувальними агентами, як наприклад, тальк, стеарат кальцію, стеарат магнію, тверді поліетиленгліколі, лаурилсульфат натрію, або їх сумішами. У випадку капсул, таблеток та пілюль, лекарські форми можуть також містити буферні агенти. [0092] Тверді лікарські форми, описані вище, можуть бути приготовлені з покриттями та оболонками, такими як ентеросолюбільні покриття та інші відомі в даній галузі. Вони можуть також містити контрастні агенти, і можуть мати такий склад, що активна сполука або сполуки вивільняються в певній частині кишечника уповільненим способом. Прикладами залитих композицій, які можуть бути використані, є полімерні речовини та віск. Активні сполуки можуть також бути в мікроінкапсульовані формі, якщо це доречно, з одним або декількома з вищезазначених формоутворювальних засобів. [0093] Рідкі лікарські форми для перорального введення включають фармацевтично придатні емульсії, суспензії, сиропи та еліксири. Такі лікарські форми готують, наприклад, розчиненням, диспергуванням і так далі, сполуки Формули I або її фармацевтично придатної солі, і необов'язково фармацевтичних ад'ювантів в носії, такому як, наприклад, вода, сольовий розчин, водний розчин глюкози, гліцерин, етанол і тому подібні; солюбілізатор і емульгаторів, таких як, наприклад, етиловий спирт, ізопропіловий спирт, етилкарбонат, етилацетат, бензиловий спирт, бензилбензоат, пропіленгліколь, 1,3-бутиленгліколь, диметилформамід і тому подібні; олій, зокрема, бавовняної олії, арахісової олії, олії із зародків кукурудзи, оливкової олії, касторової олії та кунжутної олії, гліцерину, тетрагідрофурфурілового спирту; поліетиленгліколей та складних ефірів жирних кислот сорбіту; або сумішей цих речовин, і тому подібних, з утворенням розчину або суспензії. [0094] Суспензії, крім активних сполук, можуть містити суспендуючі агенти, як наприклад, етоксильовані ізостеарилові спирти, поліоксіетиленсорбіт і складні ефіри сорбіту, мікрокристалічна целюлоза, метагідроксід алюмінію, бентоніт, агар-агар та трагакант або суміші цих сполук, тощо. [0095] Композиції для ректального введення є, наприклад, супозиторіями, які можуть бути отримані змішуванням сполуки Формули I, наприклад, з відповідними недратівливими формоутворювальними засобами або носіями, такими як масло какао, поліетиленгліколь або віск для супозиторіїв, які є твердими при звичайних температурах, але рідкими при температурі тіла, і тому плавляться у відповідній порожнині тіла і вивільняють активний компонент. [0096] Лікарські форми для місцевого введення сполуки Формули I включають мазі, порошки, спреї та засоби для інгаляції. Активний компонент змішують у стерильних умовах з фізіологічно придатним носієм і будь-якими консервантами, буферами або пропелентами, які можуть бути необхідні. Передбачається, що офтальмологічні композиції, очні мазі, порошки і 11 UA 115527 C2 5 10 15 20 25 30 35 40 розчини також входять в цей опис. [0097] Стиснені гази можуть бути використані для диспергування сполуки Формули I в аерозольній формі. Інертними газами, придатними для цієї мети, є азот, діоксид вуглецю і так далі. [0098] Як правило, в залежності від передбачуваного способу введення, фармацевтично придатні композиції містять приблизно від 1% приблизно до 99 % за масою сполуки (сполук) Формули I або її фармацевтично придатної солі, та від 99 % до 1% за масою відповідного фармацевтичного формоутворювального засобу. В одному варіанті реалізації, композиція містить приблизно від 5% приблизно до 75 % за масою сполуки (сполук) Формули I, Формули Ia або Сполуки 1, або її фармацевтично придатної солі, а решту становлять відповідні фармацевтичні формоутворювальні засоби. [0099] Актуальні способи отримання таких лікарських форм відомі або зрозумілі фахівцям в даній галузі; наприклад, дивись Remington's Pharmaceutical Sciences, 18-е видання, (Mack Publishing Company, Істон, штат Пенсільванія, 1990 рік) Композиція для введення, в будь-якому випадку, містить терапевтично ефективну кількість сполуки Формули I або її фармацевтично придатної солі, для лікування хворобливого стану відповідно з ідеєю цього опису. [00100] Сполуки цього опису або їх фармацевтично придатні солі, або сольвати, вводять в терапевтично ефективній кількості, яке варіюється в залежності від різних факторів, включаючи активність конкретної сполуки, яка використовується, метаболічної стійкості та тривалості дії цієї сполуки, віку, ваги тіла, загального стану здоров'я, статі, харчування, режиму та часу введення швидкості екскреції, комбінації ліків та тяжкість конкретного стану хвороби, і реципієнта, що проходить терапію. Сполука Формули I, Формули Ia або Сполука 1 може бути введена пацієнту при рівнях доз в діапазоні від близько 0,1 до близько 1000 мг на день. Для нормального дорослої людини з масою тіла близько 70 кілограм, доза знаходиться в діапазоні від близько 0,01 до близько 100 мг на кілограм маси тіла на день, наприклад. Однак конкретна доза може варіюватися. Наприклад, доза може залежати від ряду факторів, включаючи вимоги пацієнта, тяжкість стану, що підлягає лікуванню, і фармакологічну активність використовуваної сполуки. Визначення оптимальних доз для конкретного пацієнта добре відомо фахівцям в даній галузі. [00101] В інших варіантах реалізації, сполука Формули I, Формули Ia або Сполука 1 може бути введена пацієнту одночасно з іншими засобами лікування раку. Такі засоби лікування включають інші хіміотерапевтичні засоби для лікування раку, гормональну замісну терапію, променеву терапію або імунотерапію, серед інших . Вибір іншої терапії залежить від ряду факторів, включаючи метаболічну стійкість та тривалість дії зазначеної сполуки, віку, ваги тіла, загального стану здоров'я, статі, харчування, режиму та часу введення, швидкості екскреції, комбінації ліків, тяжкості конкретного хворобливого стану, і реципієнта, що підлягає лікуванню. Отримання Сполуки 1 [00102] Отримання N-(4-{[6,7-біс(метилокси)хінолін-4-іл]окси}феніл)-N’-(4фторфеніл)циклопропан-1,1-дикарбоксаміду та його (L)-яблучнокислої солі. [00103] Синтетичний шлях, який використано для отримання N-(4-{[6,7біс(метилокси)хінолін-4-іл]окси}феніл)-N’-(4-фторфеніл)циклопропан-1,1-дикарбоксаміда або його (L)-яблучнокислої солі, зображений на Схемі 1. 12 UA 115527 C2 Схема 1 5 10 15 20 25 30 35 Одержання 4-хлор-6,7-диметокси-хіноліну [00104] У реактор послідовно завантажили 6,7-диметоксихінолін-4-ол (10,0 кг) і ацетонітрил (64,0 л). Отриману суміш нагріли приблизно до 65 °C і додали оксихлорид фосфору (POCl3, 50,0 кг). Після додавання POCl3 температуру реакційної суміші підвищили приблизно до 80 °C. Реакцію вважали закінченою (приблизно 9,0 годин), коли залишилося менше 2 відсотків вихідного матеріалу (вбудований аналіз високоефективної рідинної хроматографії [ВЕРХ]). Реакційну суміш охолодили приблизно до 10 °C, а потім погасили, виливши в охолоджений розчин дихлорметана (ДХМ, 238,0 кг), 30- процентного NH4OH (135,0 кг) і льоду (440,0 кг). Отриману суміш нагріли приблизно до 14 °C та розділили фази. Органічну фазу промили водою (40,0 кг) та концентрували вакуумної дистиляцією з видаленням розчинника (близько 190,0 кг). У цю партію додали метил - трет-бутиловий ефір (МТБЕ, 50,0 кг) і охолодили суміш приблизно до 10 °C, і протягом цього часу викристалізувався продукт. Тверді речовини виділили центрифугуванням, промили н-гептаном (20,0 кг) і висушили приблизно при 40 °C для отримання зазначеної у назві сполуки (8,0 кг). Отримання 6,7-диметил-4-(4-нітро-фенокси)-хіноліну [00105] В реактор послідовно завантажили 4-хлор-6,7-диметокси-хінолін (8,0 кг), 4нітрофенол (7,0 кг), 4-диметиламінопіридин (0,9 кг) та 2,6-диметилпіридин (40,0 кг). Вміст реактора нагріли приблизно до 147 °C. По завершенню реакції (залишилося менше 5% вихідного матеріалу, за результатами визначення вбудованим аналізом ВЕРХ, приблизно 20 годин), вміст реактора залишили холонути приблизно до 25 °C. Додали метанол (26,0 кг), потім карбонат калію (3,0 кг), розчинений у воді (50,0 кг). Вміст реактора перемішували приблизно протягом 2 годин. Отриманий твердий осад відфільтрували, промили водою (67,0 кг) і висушили при 25 °C приблизно протягом 12 годин для отримання зазначеної в назві сполуки (4,0 кг). Отримання 4-(6,7-диметокси-хінолін-4-ілокси)-феніламіну [00106] Розчин, що містить форміат калію (5,0 кг), мурашину кислоту (3,0 кг) і воду (16,0 кг), додали до суміші 6,7-диметокси-4-(4-нітро-фенокси)-хіноліну (4,0 кг), 10 % паладію на вуглеці (вологість 50 відсотків, 0,4 кг) у тетрагідрофурані (40,0 кг), яка була нагріта приблизно до 60 °C. Це додавання виконали так, щоб температура реакційної суміші залишалася приблизно при 60 °C. Коли було вирішено, що реакцію завершено, за результатами визначення з використанням вбудованого ВЕРХ аналізу (залишилося менше 2 відсотків вихідного матеріалу, зазвичай 1,5-15 годин), вміст реактора відфільтрували. Фільтрат концентрували вакуумною дистиляцією приблизно при 35 °C до половини від початкового об'єму, внаслідок чого продукт випав в осад. Продукт виділили фільтрацією, промили водою (12,0 кг) і висушили під вакуумом приблизно при 50 °C для отримання зазначеної у назві сполуки (3,0 кг; площа під кривою 97 відсотків). 13 UA 115527 C2 5 10 15 20 25 30 35 40 Отримання 1-(4-фтор-фенілкарбамоїл)-циклопропанкарбонової кислоти [00107] Триетиламін (8,0 кг) додали до охолодженого (приблизно 4 °C) розчину наявної у продажу циклопропан-1,1-дикарбонової кислоти (10,0 кг) у ТГФ (63,0 кг) з такою швидкістю, щоб температура партії не перевищувала 10 °C. Розчин перемішували приблизно протягом 30 хвилин, а потім додали тіонілхлорид (9,0 кг), підтримуючи температуру партії нижче 10 °C. По завершенню додавання, додали розчин 4-фторанілін (9,0 кг) у ТГФ (25,0 кг) з такою швидкістю, щоб температура партії не перевищувала 10 °C. Суміш перемішували приблизно протягом 4 годин, а потім розбавили ізопропілацетат (87,0 кг). Цей розчин послідовно промили водним розчином гідроксиду натрію (2,0 кг, розчинені у 50,0 л води), водою (40,0 л) та водним розчином хлориду натрію (10,0 кг, розчинені у 40,0 л води). Органічний розчин концентрували вакуумної дистиляцією, потім додали гептан, в результаті чого в осад випала тверда речовина. Тверду речовина виділили центрифугуванням, а потім висушили приблизно при 35 °C під вакуумом для отримання зазначеної у назві сполуки (10,0 кг). Отримання 1-(4-фтор-фенілкарбамоїл)-циклопропанкарбоніл хлориду [00108] Оксалілхлорид (1,0 кг) додали до розчину 1-(4-фтор-фенілкарбамоїл)циклопропанкарбонової кислоти (2,0 кг) в суміші ТГФ (11 кг ) та N,N-диметилформаміду (ДМФ; 0,02 кг) з такою швидкістю, щоб температура партії не перевищувала 30 °C. Цей розчин використовували на наступній стадії без додаткової обробки. Отримання N-({[6,7-бис(метилокси)хінолін-4-иіл]окси}феніл)-N'-(4-фторфеніл)циклопропан1,1-дикарбоксаміду [00109] Розчин з попередньої стадії, що містить 1-(4-фтор-фенілкарбамоїл)циклопропанкарбоніл хлорид, додали до суміші 4-(6,7-диметокси-хінолін-4-ілокси)-феніламіну (3,0 кг) і карбонату калію (4,0 кг) у ТГФ (27,0 кг) і воді (13,0 кг) з такою швидкістю, щоб температура партії не перевищувала 30 °C. По завершенню реакції (приблизно 10 хвилин), додали воду (74,0 кг). Суміш перемішували при температурі 15-30 °C приблизно протягом 10 годин, в результаті чого продукт випав в осад. Продукт виділили фільтрацією, промили попередньо приготовленим розчином ТГФ (11,0 кг) і води (24,0 кг) і висушили приблизно при 65 °C під вакуумом приблизно протягом 12 годин для отримання зазначеної у назві сполуки (вільна 1 основа, 5,0 кг). H ЯМР (400 МГц, d6-ДМСО): 10,2 (s, 1H), 10,05 (s, 1H), 8,4 (s, 1H), 7,8 (m, 2H), 7,65 (m, 2H), 7,5 (s, 1H), 7,35 (s, 1H), 7,25 (m, 2H), 7,15 (m, 2H), 6,4 (s, 1H), 4,0 (d, 6H), 1,5 (s, 4H). LC/MS: M+H= 502. Отримання N-(4-{[6,7-біс(метилокси)хінолін-4-іл]окси}феніл)-N’-(4-фторфеніл)циклопропан1,1-дикарбоксаміду, (L)-яблучнокислої солі [00110] Розчин L-яблучної кислоти (2,0 кг) у воді (2,0 кг) додали до розчину циклопропан-1,1дикарбонової кислоти [4-(6,7-диметокси-хінолін-4-ілокси)-феніл]амида (4-фтор-фенил)-аміду, вільної основи (1 5, 5,0 кг) в етанолі, підтримуючи температуру партії приблизно при 25 °C. Потім додали вуглець (0,5 кг) і тіол - функціоналізований діоксид кремнію (0,1 кг), і отриману суміш нагріли приблизно до 78 °C, і в цей час додали воду (6,0 кг). Потім реакційну суміш відфільтрували, потім додали ізопропанол (38,0 кг). Реакційну суміш залишили холонути приблизно до 25 ° C. Продукт виділили фільтрацією і промили ізопропанолом (20,0 кг) і висушили приблизно при 65 ° C для отримання вказаного в заголовку сполуки (5,0 кг). [00111] Альтернативний шлях для одержання Сполуки 1 зображений на Схемі 2. 14 UA 115527 C2 Схема 2 5 10 15 20 25 30 35 Отримання 4-хлор-6,7-диметокси-хіноліну [00112] В реактор послідовно завантажили 6,7-диметокси-хінолін-4-ол (47,0 кг) та ацетонітрил (318,8 кг). Отриману суміш нагріли приблизно до 60 °C та додали оксихлорид фосфору (POCl3, 130,6 кг). Після додавання POCl3 температуру реакційної суміші підвищили приблизно до 77 °C. Реакцію вважали завершеною (приблизно 13 годин), коли залишилося менше 3 процентів вихідного матеріалу (вбудований аналіз високоефективної рідинної хроматографії [ВЕРХ]). Реакційну суміш охолодили приблизно до 2-7 °C, а потім погасили, виливши в охолоджений розчин дихлорметану (ДХМ, 482,8 кг), 26-процентного NH4OH (251,3 кг) та води (900 л). Отриману суміш нагріли приблизно до 20-25 °C та розділили фази. Органічну фазу відфільтрували через шар AW Hyflo Super-cel NF (Целіт; 5,4 кг), а осад на фільтрі промили ДХМ (118,9 кг). Об’єднану органічну фазу промили насиченим сольовим розчином (282,9 кг) та змішали з водою (120 л). Фази розділили, а органічну фазу концентрували вакуумною дистиляцією з видаленням розчинника (остаточний об’єм приблизно 95 л). В реактор, який містить органічну фазу, завантажили ДХМ (686,5 кг) та концентрували вакуумною дистиляцією з видаленням розчинника (остаточний об’єм приблизно 90 л). Потім завантажили метил-трет-бутиловий ефір (МТБЕ, 226,0 кг), а температуру суміші довели до значення от -20 до 25 °C та підтримували протягом 2,5 годин. В результаті утворився твердий осадок осад, який потім відфільтрували, промили н-гептаном (92,0 кг) і висушили на фільтрі приблизно при 25 °C під азотом для отримання зазначеної у назві сполуки (35,6 кг). Отримання 4-(6,7-диметокси-хінолін-4-ілокси)-феніламіну [00113] 4-Амінофенол (24,4 кг), розчинений в N,N-диметилацетаміді (ДМА, 184,3 кг), завантажили в реактор, який містить 4-хлор-6,7-диметоксихінолін (35,3 кг), трет-бутоксид натрію (21,4 кг) і ДМА (167,2 кг), при температурі 20-25 °C. Цю суміш потім нагрівали до 100-105 °C приблизно протягом 13 годин. Коли було вирішено, що реакція закінчена, по результатам визначення з використанням вбудованого ВЕРХ аналізу (лишилось менше 2 процентів вихідного матеріалу), вміст реактора охолодили до 15-20 °C, та завантажили воду (попередньо охолоджену, 2-7 °C, 587 л) з такою швидкістю, щоб підтримувати температуру при 15-30 °C. Твердий осад, що утворився відфільтрували, промили сумішшю води (47 л) та ДМА (89,1 кг) і, нарешті, водою (214 л). Потім осад на фільтрі висушили на фільтрі приблизно при 25 °C для отримання неочищеного 4-(6,7-диметокси-хінолін-4-ілокси)-феніламіну (59,4 кг вологого, 41,6 кг сухого, розраховано на підставі втрат при висушуванні). Неочищений 4-(6,7-диметокси-хінолін4-ілокси)-феніламіин нагрівали з дефлегматором (приблизно 75 °C) в суміші тетрагідрофурану (ТГФ, 211,4 кг) і ДМА (108,8 кг) приблизно протягом 1 години, а потім охолодили до 0-5 °C і лишили дозрівати приблизно на 1 годину, після чого тверду речовину відфільтрували, промили 15 UA 115527 C2 5 10 15 20 25 30 35 40 45 50 55 60 ТГФ (147,6 кг) і висушили на фільтрі під вакуумом приблизно при 25 °C для отримання 4-(6,7диметокси-хінолін-4-ілокси)-феніламіну (34,0 кг). Альтернативне отримання 4-(6,7-диметокси-хінолін-4-ілокси)-феніламіну [00114] В реактор завантажили 4-хлор-6,7-диметоксихінолін (34,8 кг) і 4-амінофенол (30,8 кг), і трет-пентоксид натрію (1,8 еквівалентів, 88,7 кг, 35 мас.% в ТГФ), а потім N,Nдиметилацетамід (ДМА, 293,3 кг). Цю суміш потім нагрівали до 105-115 °C приблизно протягом 9 годин. Коли було вирішено, що реакція закінчена, по результатам визначення з використанням вбудованого ВЕРХ аналізу (лишилось менше 2 процентів вихідного матеріалу), вміст реактору охолодили до 15-25 °C, і додали воду (315 кг) за період у дві години, підтримуючи температуру між 20 і 30 °C. Потім реакційну суміш перемішували ще одну годину при 20-25 °C. Неочищений продукт зібрали фільтрацією і промили сумішшю води (88 кг) і ДМА (82,1 кг), потім водою (175 кг). Продукт висушили на фільтрі-осушувачі протягом 53 годин. Втрати при висушуванні склали менше 1 відсотка, вага/вага (мас./мас.). [00115] В альтернативному способі використовували 1,6 еквівалентів трет-пентоксиду натрію, і температуру реакції підвищили з 110 до 120 °C. Крім того, температуру охолодження підвищили до 35-40 °C, а вихідну температуру доданої води довели до 35-40 °C, залишивши її екзотермічно підвищуватися до 45 °C. Отримання 1-(4-фтор-фенілкарбамоїл)-циклопропанкарбонової кислоти [00116] Триетиламін (19,5 кг) додали до охолодженого (приблизно 5 °C) розчину у циклопропан-1,1-дикарбонової кислоти (24,7 кг) в ТГФ (89,6 кг) з такою швидкістю, щоб температура партії не перевищувала 5 °C. Розчин перемішували приблизно протягом 1,3 години, і потім додали тіонілхлорид (23,1 кг), підтримуючи температуру партії нижче 10 °C. Після завершення додавання, розчин перемішували приблизно протягом 4 годин, підтримуючи температуру нижче 10 °C. Потім додали розчин 4-фтораніліну (18,0 кг) в ТГФ (33,1 кг) з такою швидкістю, щоб температура партії не перевищувала 10 °C. Суміш перемішували приблизно протягом 10 годин, після чого реакцію вважали завершеною. Потім реакційну суміш розріджували ізопропілацетатом (218,1 кг). Цей розчин послідовно промили водним розчином гідроксиду натрію (10,4 кг, 50%, розчинені в 119 л води), додатково розрідженого водою (415 л), потім водою (100 л) і, нарешті, водним розчином хлориду натрію (20,0 кг, розчинені в 100 л води). Органічний розчин концентрували вакуумною дистиляцією (остаточний об’єм 100 л) при температурі нижче 40 °C, потім додали н-гептан (171,4 кг), в результаті чого в осад випала тверда речовина. Тверду речовину виділили фільтрацією і промили н-гептаном (102,4 кг), отримав вологу, неочищену 1-(4-фтор-фенілкарбамоїл)-циклопропанкарбонову кислоту (29,0 кг). Неочищену 1-(4-фтор-фенілкарбамоїл)-циклопропанкарбонову кислоту розчинили у метанолі (139,7 кг) приблизно при 25 °C, потім додали воду (320 л), отримав завись, яку виділили фільтрацією, послідовно промили водою (20 мл) і н-гептаном (103,1 кг), а потім висушили на фільтрі приблизно при 25 °C під азотом для отримання зазначеної заголовку назві сполуки (25,4 кг). Отримання 1-(4-фтор-фенілкарбамоїл)-циклопропанкарбоніл хлориду [00117] Оксалілхлорид (12,6 кг) додали до розчину 1-(4-фтор-фенілкарбамоїл)циклопропанкарбонової кислоти (22,8 кг) у суміші ТГФ (96,1 кг) і N,N-диметилформаміду (ДМФ; 0,23 кг) з такою швидкістю, щоб температура партії не перевищувала 25 °C. Цей розчин використовували на наступній стадії без додаткової обробки. Альтернативне отримання 1-(4-фтор-фенілкарбамоїл)-циклопропанкарбоніл хлориду [00118] В реактор завантажили 1-(4-фтор-фенілкарбамоїл)-циклопропанкарбонову кислоту (35 кг), ДМФ (344 г) і ТГФ (175 кг). Реакційну суміш довели до 12-17 °C, а потім в реакційну суміш завантажили 19,9 кг оксалілхлориду за період в 1 годину. Реакційну суміш лишили перемішуватися при 12-17 °C на 3-8 годин. Цей розчин використовували на наступній стадії без додаткової обробки. Отримання циклопропан-1,1-дикарбонової кислоти [4-(6,7-диметокси-хінолін-4-ілокси)феніл]-аміду (4-фтор-феніл)-аміду [00119] Розчин з попередньої стадії, що містить 1-(4-фтор-фенілкарбамоіл)ціклопропанкарбоніл хлорид, додали до суміші сполуки 4-(6,7-диметокси-хінолін-4-ілокси)феніламіна (23,5 кг) і карбонату калію ( 31,9 кг) в ТГФ (245,7 кг) і воді (116 л) з такою швидкістю, щоб температура партії не перевищувала 30 °C. По завершенню реакції (приблизно 20 хвилин), додали воду (653 л). Суміш перемішували при температурі 20-25 °C приблизно протягом 10 годин, в результаті чого продукт випав в осад. Продукт виділили фільтрацією, промили попередньо приготовленим розчином ТГФ (68,6 кг) і води (256 л), і висушили спочатку на фільтрі під азотом приблизно при 25 °C, а потім висушили приблизно при 45 °C під вакуумом для отримання зазначеного в заголовку з'єднання (41,0 кг, 38,1 кг, розрахували на підставі втрат 16 UA 115527 C2 5 10 15 20 25 30 35 40 45 50 55 60 при висушуванні). Альтернативне отримання циклопропан-1,1-дикарбонової кислоти [4-(6,7-диметокси-хінолін4-ілокси)-феніл]-аміду (4-фтор-феніл)-аміду [00120] В реактор завантажили 4-(6,7-диметокси-хінолін-4-ілокси)-феніламін (35,7 кг, 1 еквівалент), потім ТГФ (412,9 кг). В реакційну суміш завантажили розчин K 2CO3 (48,3 г) у воді (169 кг). В реактор, який містить 4-(6,7-диметокси-хінолін-4-ілокси)-феніламін, перенесли розчин хлорангідриду кислоти, який описаний вище в Альтернативному отриманні 1-(4-фторфенілкарбамоїл)-циклопропанкарбоніл хлориду, підтримуючи температуру між 20 та 30 °C, за період не менше двох годин. Реакційну суміш перемішували при 20-25 °C не менше трьох годин. Потім реакційну суміш довели до 30-25 °C і перемішали суміш. Перемішування припинили, і залишили розділятися фази суміші. Нижній водний шар видалили і відкинули. До верхньої органічної фази, що залишилася додали воду (804 кг). Реакційну суміш лишили перемішуватися при 15-25 °C не менше 16 годин. [00121] Продукт випав в осадок осад. Продукт відфільтрували і промили сумішшю води (179 кг) і ТГФ (157,9 кг), двома порціями. Неочищений продукт висушували під вакуумом не менше двох годин. Потім висушений продукт помістили в ТГФ (285,1 кг). Отриману суспензію перенесли в реакційний сосуд і перемішували до тих пір, поки суспензія не стала прозорою рас твором, (що розчинився), для чого було потрібно нагрівання до 30-35 °C приблизно протягом 30 хвилин. Потім до розчину додали воду (456 кг), а також етанол SDAG-1 (20 кг) (етанол, денатурирований метанолом протягом двох годин). Суміш перемішували при 15-25 °C не менше 16 годин. Продукт відфільтрували і промили сумішшю води (143 кг) і ТГФ (126,7 кг), двома порціями. Продукт висушили при температурі, яка встановлена на максимальне значення 40 °C. [00122] В альтернативному способі, температуру реакції при утворенні хлорангідриду кислоти довели до 10-15 °C. Температуру перекристалізації змінили з 15-25 °C на 45-50 °C на 1 годину, а потім охолоджували до 15-25 °C протягом 2 годин. Отримання циклопропан-1,1-дикарбонової кислоти [4-(6,7-диметокси-хінолін-4-ілокси)феніл]-аміду (4-фтор-феніл)-аміду, (L)-яблучнокислої солі [00123] Циклопропан-1,1-дикарбонової кислоти [4-(6,7-диметокси-хінолін-4-ілокси)-феніл]аміду (4-фтор-феніл)-амід (13,3 кг), L-яблучну кислоту (4,96 кг), метил-етил-кетон (МЕК; 188,6 кг) і воду (37,3 кг) завантажили в реактор, і нагрівали суміш з дефлегматором (приблизно 74 °C) приблизно протягом 2 годин. Температуру реактора понизили до 50-55 °C, і відфільтрували вміст реактора. Ці последовні стадії, які описані вище, повторили ще два рази, починаючи з таких же кількостей циклопропан-1,1-дикарбонової кислоти [4-(6,7-диметокси-хінолін-4-ілокси)феніл]-аміду (4-фтор-феніл)-аміду (13,3 кг), L-яблучної кислоти (4,96 кг), МЕК (198,6 кг) і води (37,2 кг). Об’єднаний фільтрат азеотропно висушили при атмосферному тиску з використанням МЕК (1133,2 кг) (приблизний остаточний об’єм 711 л; вміст води за методом Карла Фішера < 0,5% мас./мас.), приблизно при 74 °C. Температуру вмісту реактора понизили до 20-25 °C і підтримували приблизно 4 години, в результаті утворився твердий осад, який відфільтрували, промили МЕК (448 кг) і висушили під вакуумом при 50 °C для отримання зазначеної у назві сполуки (45,5 кг). Альтернативне отримання циклопропан-1,1-дикарбонової кислоти [4-(6,7-диметокси-хінолін4-ілокси)-феніл]-аміду (4-фтор-феніл)-аміду, (L)-яблучнокислої солі [00124] Циклопропан-1,1-дикарбонової кислоти [4-(6,7-диметокси-хінолін-4-ілокси)-феніл]аміду (4-фтор-феніл)-амід (47,9 кг), L-яблучну кислоту (17,2), 658,2 кг метил-етил-кетона і 129,1 кг води (37,3 кг) завантажили в реактор, і нагрівали суміш до 50-55 °C приблизно протягом 1-3 годин, а потім при 55-60 °C ще 4-5 годин. Суміш просвітлили фільтрацією через 1 мкм картридж. Температуру реактора довели до 20-25 °C і перегнали вакуумною дистиляцією з вакуумом 150-200 мм рт.ст. з максимальною температурою оболонки 55 °C до об’єму 558-731 л. [00125] Вакуумну дистиляцію виконали ще два рази з завантаженням 380 кг і 380,2 кг метилетил-кетону, відповідно. Після третьої дистиляції об’єм партії довели до 18 об’єм/вага (об./мас.) циклопропан-1-дикарбонової кислоти [4-(6,7-диметокси-хінолін-4-ілокси)-феніл]-аміду (4-фторфеніл)-аміду завантаженням метил-етил-кетону (159,9 кг) для отримання загального об’єму 880 л. Виконали додаткову вакуумну дистиляцію регулюванням метил-етил-кетону (245,7 кг). Реакційну суміш лишили при помірному перемішуванні при 20-25 °C щонайменше на 24 години. Продукт відфільтрували і промили метил-етил-кетоном (415,1 кг), трьома порціями. Продукт висушили під вакуумом з температурою оболонки, встановленої на 45 °C. [00126] В альтернативному способі змінили порядок додавання, так що розчин L-яблучної кислоти (17,7 кг), розчиненої у воді (129,9 кг), додали до циклопропан-1,1-дикарбонової кислоти [4-(6,7-диметокси-хінолін-4-ілокси)-феніл]-аміду (4-фтор-феніл)-аміду (48,7 кг) в метил-етил 17 UA 115527 C2 5 10 15 20 25 30 35 кетоні (673,3 кг). Застосування сполуки Формули I для лікування раку [00127] Сигнальні шляхи MET і VEGF відіграють важливі ролі у функції остеобластів і остеокластів. При формуванні кістки в обох типах клітин спостерігали сильне імуногістохімічне фарбування MET. HGF і MET експресуються остеобластами і остеокластами in vitro і опосередковують клітинні відповіді, такі як проліферація, міграція і експресія ALP. Було зроблено припущення, що секреція HGF остеобластами є ключовим фактором у зв'язуванні остеобластів/остеокластів і у розвитку метастазів у кістки пухлинними клітинами, які експресують MET. Остеобласти і остеокласти експресують також VEGF і його рецептори, а передача сигналів VEGF в цих клітинах бере участі в потенційних аутокрінной і/або паракрінних зворотних механізмах, що регулюють клітинну міграцію, диференціювання і виживання. [00128] Сполука 1 є перорально біодоступним багатоцільовим інгібітором тирозинкінази з потужною дією проти MET і VEGFR2. Сполука 1 пригнічує передачу сигналів MET і VEGFR2, швидко викликає апоптоз ендотеліальних клітин і клітин пухлини, і викликає регресію пухлини в моделях ксенотрансплантата пухлини. Сполука 1 також істотно знижує інвазивність пухлини і метастаз, і значно покращує загальну виживаність в моделі нейроендокринної пухлини підшлункової залози на мишах. На 1 фазі клінічного випробування, Сполука 1 переносилася, в цілому, добре, і найбільш загальними спостерігаються несприятливими подіями, що спостерігались, були втома, діарея, анорексія, висип і долонно-підошовна еритродизестезія. Конкретне дослідження 1 [00129] Сполука 1 є перорально біодоступним багатоцільовим інгібітором тирозинкінази з потужною дією проти MET і VEGFR2. Сполука 1 пригнічує передачу сигналів MET і VEGFR2, швидко викликає апоптоз ендотеліальних клітин і клітин пухлини, і викликає регресію пухлини в моделях ксенотрансплантата пухлини. Сполука 1 також істотно знижує інвазивність пухлини і метастаз, і значно покращує загальну виживаність в моделі нейроендокринної пухлини підшлункової залози на мишах. На 1 фазі клінічного випробування, Сполука 1 переносилося, в цілому, добре, і найбільш загальними спостерігаються несприятливими подіями були втома, діарея, анорексія, висип і долонно-підошовна еритродизестезія. [00130] На підставі логічного обґрунтування мети і протипухлинної активності у клінічних випробуваннях, зробили адаптивне випробування 2 фази при багатьох свідченнях, включаючи КРРПЗ (http://clinicaltrials.gov/ct2/results?term=NCT00940225 для випробування NCT00940225, останнє відвідування 20 вересня 2011 року)), в якому Сполука 1 вводили пацієнту в дозі 100 мг. Отримані відомості для перших трьох пацієнтів з КРРПЗ з даними про метастази в кістки на остеосцинтиграфії, долучені до цього дослідження, описані в наступних Конкретних дослідженнях. [00131] Характеристики вихідного стану пацієнтів 1-3 представлені в Таблиці 1. Таблиця 1 Зведення характеристик вихідного стану та попередніх найкращих реакцій для пацієнтів з КРРПЗ, яких лікували Сполукою І Характеристики вихідного стану Вік (років) Діагноз Характеристика за шкалою ECOG Місцезнаходження захворювання Попередні терапії раку Бісфосфонати Наркотичні засоби Біль PSA (нг/мл) tALP (Е/л) Гемоглобін (г/дл) Пацієнт 1 Пацієнт 2 77 73 1993 2009 1 0 Легені, ЛУ, кістки Печінка, ЛУ, кістки Радикальна простатектомія, Опромінення ложа лобкової кістки та передміжурової вертлюжної залози, CAB, DES, западини, CAB доцетаксел Ні Ні Так Ні Так Так 430,4 14,7 689 108 13,5 13,3 18 Пацієнт 3 66 2009 1 ЛУ, кістки CAB, доцетаксел Так Ні Так 2,8 869 10,2 UA 115527 C2 Таблиця 1 Зведення характеристик вихідного стану та попередніх найкращих реакцій для пацієнтів з КРРПЗ, яких лікували Сполукою І Характеристики вихідного стану Результати найкращих реакцій у відповідь Реакція у відповідь пухлини Остеосцинтиграфія Біль PSA tALP Гемоглобін (г/дл) Пацієнт 1 Пацієнт 2 Пацієнт 3 - 41% Повна ремісія Покращення - 78% - 77% + 1,4 - 20% Покращення Відсутність болю + 61% - 6% + 1,8 - 51% Близько до ремісії Відсутність болю - 57% - 77% + 2,2 ADT, антиандрогенна терапія; CAB, комплексна андрогенна блокада (лейпролід + бікалутамід); DES, диетилстильбестрол; ЛУ, лімфатичний вузол; PSA, простатоспецифічний антиген; tALP, загальна лужна фосфатаза. 5 10 15 20 25 30 35 40 [00132] Пацієнт 1 був діагностований з локалізованим раком передміхурової залози в 1993 році і пройшов лікування радикальною простатектомією (індекс Глісона відсутній; PSA, 0,99 нг/мл). У 2000 році локальний рецидив захворювання лікували променевою терапією. У 2001 році почали андрогенную блокаду (CAB) з лейпролідом і бікалутамідом для підвищення PSA (3,5 нг/мл). У 2006 році швидко ввели діетилстильбестрол (DES). У 2007 році провели 6 циклів доцетакселу для нових метастазів в легенях. Підвищення PSA було несприйнятливим до виключення антиандрогену. Андроген-абляційну терапію продовжували до клінічного прогресування. У жовтні 2009 року метастази в кістки хребта, пов'язані з проникненням в спинний мозок і болем у спині, лікували променевою терапією (37,5 Гр). У лютому 2010 року виконали остеосцинтиграфію через посилення болю в кістках, яке показало дифузне поглинання радіоактивної мітки в осьовому і додатковому скелеті. КТ сканування виявило нові метастази в легенях і медіастинальної лімфатичних вузлі. PSA склав 430,4 нг/мл. [00133] Пацієнта 2 діагностували у квітні 2009 року після появи патологічного перелому (індекс Глісона, 4+5 = 9; PSA, 45,34 нг/мл). Остеосцинтиграфія показала поглинання радіоактивної мітки в лівому клубовому крилі, лівому крижово-клубовому зчленуванні, голівці стегна і лобковому симфізі. Біопсія лівої лобкової кістки підтвердила метастатичну аденокарциному зі змішаним літичним і бластичним ураженням. CAB з лейпролідом і бікалутамідом, і променева терапія (8 Гр) лівої лобкової кістки і вертлюгової западини призвела до полегшення болю в кістці і нормалізації PSA. Підвищення PSA в листопаді 2009 року (16 нг/мл) було несприйнятливим до виключення антиандрогену. У лютому 2010 року остеосцинтиграфія показала численні осередки в осьовому і додатковому скелеті. КТ сканування виявило збільшення ретроперитонеального лімфатичного вузла і метастази в печінку (PSA, 28,1 нг/мл). Подальше прогресування захворювання було відзначено періодичної болем у кістках, новими метастазами в легені і печінку. [00134] Пацієнта 3 діагностували у квітні 2009 року після появи болю в правому стегні (індекс Гліссона, 4+5=9; PSA, 2,6 нг/мл). Остеосцинтиграфія показала поглинання радіоактивної мітки в багатьох осередках осьового і додаткового скелета. КТ сканування виявило ретроперитонеальну, загальну клубову і надключичну аденопатію. Почали CAB з лейпролідом і бікалутамідом. Пацієнт прийняв 6 циклів доцетакселу протягом грудня 2009 року. Після лікування остеосцинтиграфія не показала жодних змін. КТ сканування виявило майже повну ремісію ретроперітонеальної і загальної клубової аденопатії. У березні 2010 року PSA почав збільшуватися, і біль в кістках посилилася. Повторна остеосцинтиграфія показала нові осередки, і КТ сканування показало збільшення ретроперітонеальної, парааортальної і білатеральної загальної клубової аденопатії. Підвищення PSA в квітні 2010 року (2,8 нг/мл) і посилення болю в кістках були несприйнятливими до виключення антиандрогену. Результати [00135] Перед відбірковим дослідженням всі пацієнти дали інформовану згоду. [00136] Пацієнт 1 почав приймати Сполуку 1 12 лютого 2010 року. Через чотири тижні було відзначено істотне зменшення болю в кістках. На 6 тижні остеосцинтиграфія показала значне зниження поглинання радіоактивної мітки метастазами в кістки (Фігура 1А). КТ сканування показало часткову ремісію (ЧР) з 33% зниженням вимірних цільових осередків (Фігура 1С). На 19 UA 115527 C2 5 10 15 20 25 30 35 40 45 50 55 60 12 тижні спостерігали майже повну ремісію кісткових ушкоджень та 44 % зниження цільових осередків, яке було стійким до 18 тижня. Узгоджуючи з відповіддю остеосцинтиграфії, після первинного підвищення рівня tALP в сироватці знизилося з 689 Е/л в початковому стані до 159 Е/л на 18 тижні (Фігура 1В і Таблиця 1). Крім того, спостерігали підвищення гемоглобіну на 1,4 г/дл на 2 тижні, в порівнянні з вихідним станом (Таблиця 1). PSA знизився з 430 нг/мл у вихідному стані до 93,5 нг/мл на 18 тижні (Фігура 1В і Таблиця 1). Пацієнт проходив відкрите дослідження лікування до 18 тижня, коли воно було припинено після розвитку діареї 3 ступеня. [00137] Пацієнт 2 почав приймати Сполуку 1 31 березня 2010 року. На 4 тижні було відзначено зменшення болю в кістках. На 6 тижні остеосцинтиграфія показала невелике зниження поглинання радіоактивної мітки кістковими ушкодженнями (Постать 2А), а КТ сканування показало 13 % зниження цільових осередків (Фігура 2С). На 12 тижні спостерігали суттєве зниження поглинання радіоактивної мітки (Фігура 2А) і 20 % зменшення вимірного захворювання (Таблиця 1). Після рандомізації на плацебо на 12 тижні, у пацієнта розвинулася сильний біль у кістках і утиск корінця крижового нерва. У хребет ввели іонізуюче випромінювання, і на 15 тижні пацієнта перевели на відкрите дослідження лікування Сполукою 1. Рівні tALP в сироватці були в нормальному діапазоні (101-144 Е/л) (Фігура 2В). На 12 тижні гемоглобін підвищився на 1,8 г/дл, у порівнянні з вихідним значенням (Таблиця 1). На 16 тижні PSA різко піднявся майже в 6 разів від вихідного значення, але потім на 18 тижні знизився до 2кратного рівня від початкового значення після переходу від плацебо до Сполуки 1 (Фігура 2В і Таблиця 1). Станом на вересень 2010 року пацієнт продовжував лікування Сполукою 1. [00138] Пацієнт 3 почав приймати Сполуку 1 26 квітня 2010 року. Через три тижні було відзначено повне зникнення болю. На 6 тижні остеосцинтиграфія показала істотне зниження поглинання радіоактивного маркера (Фігура 3А), а КТ сканування показало часткову ремісію з 43% зниженням вимірних цільових осередків. На 12 тижні на остеосцинтиграфії спостерігали повну ремісію кісткових ушкоджень (Фігура 3А) і 51 % зниження вимірного захворювання (Таблиця 1 і Фігура 3В). Після первинного підвищення, рівні tALP в сироватці поступово зменшувалися, зі значеннями tALP 869 Е/л в початковому стані і 197 Е/л на 18 тижні (Фігура 3В і Таблиця 1). На 2 тижні гемоглобін підвищився на 2,2 г/дл, у порівнянні з вихідним значенням (Таблиця 1). PSA знизився з 2,4 нг/мл при відбірковому дослідженні до 1,2 нг/мл на 18 тижні (Фігура 3В і Таблиця 1). Станом на вересень 2010 року пацієнт продовжував лікування Сполукою 1. Обговорення [00139] При лікуванні Сполукою 1 у всіх трьох пацієнтів спостерігали різке зниження поглинання радіоактивного маркера на остеосцинтиграфії. Ці дані супроводжувалися значним зменшенням болю в кістках і даними про ремісії або стабілізації ушкоджень м'яких тканин при лікуванні Сполукою 1. Поява цього ефекту було дуже швидким у двох з пацієнтів, з істотним поліпшенням або майже повною ремісією на остеосцинтиграфії, і полегшенням болю протягом перших 6 тижнів. У третього пацієнта поява очевидного поліпшення на остеосцинтиграфії спостерігали на 6 тижні, з подальшим поліпшенням до 12 тижня. Наскільки відомо авторам винаходу, таке всебічне і швидкий вплив на захворювання кісткових і м'яких тканин в цій групі пацієнтів ще не спостерігалося. [00140] Поглинання радіоактивного маркера в кістках залежить від локального кровотоку і остеобластичній активності, які можуть бути патологічно змінені пухлинними клітинами, пов'язаними з кістковим поразкою. Тому зменшення поглинання може бути приписано порушення локального кровотоку, прямому модулювання остеобластичній активності, прямому впливу на пухлинні клітини в кістки або комбінації цих процесів. Однак зниження поглинання на остеосцинтиграфії у чоловіків з КРРПЗ лише зрідка зазначалося при цільовій терапії VEGF/VEGFR, незважаючи на численні спроби лікування такими агентами. Аналогічно, спостереження зменшення поглинання на остеосцинтиграфії у пацієнтів з КРРПЗ лише зрідка були відзначені для абіратерон, який спрямований безпосередньо на ракові клітини, і для дазатініба, який спрямований на ракові клітини і остеокласти. Таким чином, таргетинг тільки ангіогенезу або селективний таргетинг пухлинних клітин і/або остеокластів не приводить до таких же результатів, які спостерігалися у пацієнтів, які проходили лікування Сполукою 1. [00141] Ці результати показують потенційно критичну роль сигнальних шляхів MET і VEGF у прогресуванні КРРПЗ і вказують на можливість того, що одночасний таргетинг цих шляхів може знижувати захворюваність і смертність в цій групі пацієнтів. Конкретне дослідження 2 [00142] На 2 фазі адаптивного випробування з рандомізованим скасуванням препарату (РСП), Сполука 1 призводить до ремісії або стабілізації метастатичних кісткових ушкоджень на остеосцинтиграфії у 85 з 108 (76 відсотків) пацієнтів, оцінених за цим способом. Більшість 20 UA 115527 C2 5 10 15 20 25 30 35 40 45 50 55 60 пацієнтів, які проходили лікування Сполукою 1, відзначили зменшення болю в кістках і зниження залежності від прийому наркотичних болезаспокійливих засобів. У цілому, 83 пацієнта мали метастази в кістки і відзначали біль у кістках у початковому стані, і була виконана щонайменше одна оцінка стану болю після вихідного стану. 56 з цих пацієнтів (68%) показали зменшення болю на 6 або 12 тижні. Наркотичні знеболюючі кошти були необхідні в початковому стані для контролювання болю в кістках у 67 пацієнтів, які пройшли оцінку споживання наркотичних засобів після вихідного стану. З цих 67 пацієнтів 47 (70%) змогли зменшити або припинити прийом наркотичних засобів для полегшення болю в кістках. Дані про біль в кістках і застосуванні наркотичних засобів, за оцінкою дослідника, були зібрані ретроспективно. Ці результати дозволяють припустити, що Сполука 1 може бути використана для лікування і поліпшення кісток і/ бо поліпшення метастазів у кістки і болю через інші форми раку. [00143] Пацієнти з частковою або повною ремісією метастатичних кісткових ушкоджень, за остеосцинтиграфією, більш певно не піддаються прогресуванню захворювання на 6 місяць, відчувають полегшення болю, зменшують або виключають прийом наркотичних анальгетиків, досягають регресії пухлини і відчувають помітне зниження маркерів кісткового ре моделювання, порівняно з пацієнтами, у яких не відзначена ремісія на остеосцинтиграфії. [00144] Оновлені дані виживання без прогресування (ВБП ) показують, що Сполука 1 призводить до такої ж середньої ВБП, як у пацієнтів, які не проходили лікування доцетакселом і які пройшли попереднє лікування, і відносно сприятливо для групи, яка відповідає історичним контрольним значенням. У рандомізованій фазі відміни препарату в цьому дослідженні, спостерігали суттєве поліпшення середньої ВБП у пацієнтів, рандомізованих на Сполуку 1. Хоча лише 31 пацієнт був рандомізований на 12 тижні, результати були високо статистично значущими і дозволяли припустити вимірний вплив лікування порівняно з плацебо. Спостерігали також стійке збільшення рівнів гемоглобіну у анемічних пацієнтів. [00145] На фазі рандомізованої відміни препарату, на 12 тижні в цілому 31 пацієнта зі стабілізованим захворюванням рандомізували на плацебо або Сполуку 1. Починаючи з 12 тижня, середня ВБП, за оцінками дослідника, склала 6 тижнів (довірчий інтервал 95 % [ДІ] : 5, 12 тижнів) для групи плацебо (n = 17) і 21 тиждень (ДІ 95 % : 11 тижнів, верхня межа ще не досягнута) для групи Сполуки 1 (n = 14). Коефіцієнт ризику (КР), що склав 0,13 (ДІ 95 %, 0,03, 0,50), дає вагомі підстави на користь Сполуки 1 і відповідає 87 % зниження ризику прогресування для пацієнтів, які проходили лікування Сполукою 1, в порівнянні з плацебо. Ці результати були статистично значущими (р = 0,0007). [00146] Виключаючи пацієнтів, рандомізованих на плацебо, середня ВБП склала 29 тижнів для всієї групи (n = 154). Середня ВБП в підгрупах пацієнтів, які не проходили лікування доцетакселом і пройшли попереднє лікування, склала 24 тижні (ДІ 95%, 24, верхня межа ще не досягнута) і 29 тижнів (ДІ 95%, 18, 33), відповідно. Ці дані показують, що лікування Сполукою 1 призводить до стійкого контролюванню захворювання в групах, які не проходили лікування доцетакселом і пройшли попереднє лікування. [00147] Вплив на остеосцинтиграфію додатково оцінили за допомогою незалежного експерта в більш великій підгрупі (n = 108) пацієнтів з метастазами в кістки. Часткову або повну ремісію на остеосцинтиграфії спостерігали у 82 (76%) суб'єктів. Двадцять три пацієнта (21%) показали стабілізацію захворювання (СЗ) на остеосцинтиграфії, і лише три пацієнта (3%) показали прогресування захворювання в кістці за найкращою оцінкою. [00148] На підставі вторинного аналізу, пацієнти з ремісією на остеосцинтиграфії (повної або часткової) більш певно не піддаються прогресуванню захворювання на 6 місяць (61% проти 35%), відчувають полегшення болю (83% проти 43%), зменшують або виключають прийом наркотичних анальгетиків (68% проти 33%), досягають регресії пухлини (78% проти 58%) і відчувають помітне зниження маркерів кісткового ремоделювання (60% проти 43%), порівняно з пацієнтами, у яких не відзначена ремісія на остеосцинтиграфії (стійка чи прогресуюча остеосцінтіграфія). [00149] З 55 пацієнтів, що страждали на біль у кістках в початковому стані, у 42 спостерігали повну (n = 10) або часткову (n = 32) ремісію, і у 13 спостерігали стабілізацію захворювання, за оцінкою остеосцинтиграфії. З цих пацієнтів 80 %, 84 % і 38 %, відповідно, відзначили поліпшення болю в кістках. Ці відомості першими показують зв'язок між змінами у візуалізації остеосцинтиграфії і поліпшенням клінічних симптомів захворювання. [00150] Сполука 1, інгібітор росту, метастазу і ангіогенезу пухлини, одночасно спрямоване на MET і VEGFR2, основні кінази, що у розвитку і прогресуванні багатьох видів раку. У первинних і метастатичних карциномах передміхурової залози спостерігали помітну експресію MET, з даними про підвищених рівнях експресії в метастазах в кістки. У карциномі передміхурової залози спостерігали також надекспресією фактора росту гепатоцитів (HGF), 21 UA 115527 C2 5 10 15 20 25 30 35 40 45 50 55 ліганда до MET, і підвищені рівні HGF в плазмі, які пов'язані зі зниженою загальною виживанням при КРРПЗ. Дані доклінічних досліджень також дозволяють припустити, що HGF і MET регулюються при раку передміхурової залози андрогенним сигнальним шляхом, причому регуляція передачі сигналів MET, яка підвищується, пов'язана з переходом до андрогеннезалежного зростанню пухлини. Крім того, сигнальні шляхи MET і VEGFR також відіграють важливі ролі у функції остеобластів і остеокластів - клітин у кістковому мікрооточенні, які часто дисрегулюються при виникненні та прогресуванні метастазів у кістки. [00151] Основною причиною захворюваності та смертності пацієнтів з КРРПЗ є метастаз в кістку, на частку якого припадає близько 90 % випадків. Метастази в кістки викликають локальне порушення нормального ремоделювання кістки, з ураженнями, як правило, демонструють схильність до остеобластичного (кісткоутворюючого) фенотипу при візуалізації. Ці ушкодження найчастіше призводять до збільшення скелетних переломів, компресії спинного мозку і сильним болем у кістках. Остеобластичні пошкодження зазвичай візуалізують у пацієнтів з КРРПЗ при остеосцинтиграфії, яка виявляє швидке впровадження радіоактивної мітки 99mTc - міченого метилен - дифосфонати у щойно сформувалася кістку. Крім того, підвищені рівні ALP і CTx в крові, маркерів активності остеобластів і остеокластів, відповідно, найчастіше спостерігають у пацієнтів з КРРПЗ з метастазами в кістки, і вони пов'язані з коротшою загальною здатностю до виживання. Конкретне дослідження 4: Нирково-клітинна карцинома з метастазами в кістку [00152] На I фазі випробувань пацієнтів з нирково-клітинною карциномою з метастазами в кістку, у пацієнта спостерігали скорочення пухлини на підставі аналізу остеосцинтиграфії (Фігура 4). Цей пацієнт, який продемонстрував ремісію кісткових ушкоджень на остеосцинтиграфії, також значно скоротив використання наркотичних засобів на сім тижнів для контролювання болю і продовжив зниження споживання наркотичних засобів до 25 тижня. Другий пацієнт з нирково-клітинною карциномою з метастазами в кістку і болем в початковому стані (больова оцінка 5 за 10-бальною шкалою) відзначив повну ремісію болю за чотири тижні і збереження стану без болю станом на 73 тиждень дослідження. Конкретне дослідження 5: Меланома з метастазами в кістку [00153] У рандомізованому дослідженні відміни препарату серед 65 пацієнтів з меланомою з метастазами в кістку, зменшення пухлини спостерігали у 39 з 65 пацієнтів (60 %), на підставі аналізу остеосцинтиграфії (Фігура 5). Конкретне дослідження 6: Рак молочної залози з метастазами в кістку [00154] У рандомізованому дослідженні відміни препарату серед 44 пацієнтів з раком молочної залози, у 10 була виявлена ремісія остеосцинтиграфії, яка піддатлива оцінці. Зменшення пухлини спостерігали у 4 (40 %) пацієнтів, на підставі аналізу остеосцинтиграфії. Конкретне дослідження 7: Диференційований рак щитовидної залозі з метастазом в кістку. [00155] На Фазі 1 випробування взаємодії ліків було зареєстровано 15 пацієнтів з диференційованим раком щитовидної залози, у одного з яких був метастаз в кістку черепа. Це ураження продемонструвало істотний відгук через 9 тижнів лікування кабозантінібом, за оцінкою відображення магнітного резонансу (Фігура 6). x Випробування 8: Вплив введення Сполуки 1 на концентрацію CT у плазмі [00156] Вплив лікування Сполукою 1 на активність остеокластів досліджували також на підставі вимірювання змін концентрації поперечно-зшитих С-кінцевих телопептидів колагену типу-1 (CTx) у плазмі пацієнтів, які отримували лікування біфосфонатом і які не отримували бісфосфонати, які страждають на рак яєчників, що демонструють метастази в кістки (N = 27). У більшості пацієнтів рівні CTx впали в порівнянні з вихідним станом, на підставі зразків плазми, аналізованих імуноферментним твердофазним аналізом на 6 і 12 тижні дослідження. Результати показують здатність Сполуки 1 інгібувати резорбцію кісток. Інші варіанти реалізації [00157] Викладений вище опис був описаний в деяких деталях як ілюстрація та приклад, для ясності і розуміння. Цей винахід був описаний з посиланням на різні конкретні і переважні варіанти і способи. Однак слід розуміти, що в межах спільної ідеї і меж даного винаходу можуть бути зроблені багато варіації та модифікації. Фахівцям у цій галузі, що в межах прикладеної формули винаходу на практиці можуть бути зроблені зміни та модифікації. Тому слід розуміти, що представлений вище опис є ілюстративним, але не обмежувальним. [00158] Отже, межі цього винаходу визначаються не посиланням на представлений вище опис, а замість цього визначаються посиланням на наступну додану формулу винаходу, разом із повним діапазоном еквівалентів, на які дають право її пункти. 60 22 UA 115527 C2 ФОРМУЛА ВИНАХОДУ 1. Застосування Сполуки 1: 5 10 15 20 25 30 35 або її малатної солі один раз на день у вигляді таблетки, що містить 60, 40 або 20 мг Сполуки 1, де таблетка має склад, мас. %: Сполука 1 31,68 мікрокристалічна целюлоза 38,85 безводна лактоза 19,42 гідроксипропілцелюлоза 3,00 кроскармелоза натрію 6,00 діоксид кремнію, колоїдний 0,30 стеарат магнію 0,75, для лікування метастазів в кістці у пацієнта з нирково-клітинною карциномою. 2. Застосування за п. 1, де Сполука 1 є (L)- або (D)-малатною сіллю. 3. Застосування за п. 1, де Сполука 1 є (L)-малатною сіллю. 4. Застосування Сполуки 1: або її малатної солі один раз на день у вигляді таблетки, що містить 60, 40 або 20 мг Сполуки 1, де таблетка має склад, мас. %: Сполука 1 31,68 мікрокристалічна целюлоза 38,85 безводна лактоза 19,42 гідроксипропілцелюлоза 3,00 кроскармелоза натрію 6,00 діоксид кремнію, колоїдний 0,30 стеарат магнію 0,75, для зменшення або стабілізації метастатичних уражень кістки, пов’язаних з нирково-клітинною карциномою. 5. Застосування за п. 4, де Сполука 1 є (L)- або (D)-малатною сіллю. 6. Застосування за п. 4, де Сполука 1 є (L)-малатною сіллю. 7. Застосування Сполуки 1: або її малатної солі один раз на день у вигляді таблетки, що містить 60, 40 або 20 мг Сполуки 1, де таблетка має склад, мас. %: Сполука 1 31,68 мікрокристалічна целюлоза 38,85 безводна лактоза 19,42 гідроксипропілцелюлоза 3,00 23 UA 115527 C2 5 10 15 20 кроскармелоза натрію 6,00 діоксид кремнію, колоїдний 0,30 стеарат магнію 0,75, для ослаблення болю в кістці через метастатичні ураження кістки, пов’язані з нирковоклітинною карциномою. 8. Застосування за п. 7, де Сполука 1 є (L)- або (D)-малатною сіллю. 9. Застосування за п. 7, де Сполука 1 є (L)-малатною сіллю. 10. Застосування Сполуки 1: або її малатної солі один раз на день у вигляді таблетки, що містить 60, 40 або 20 мг Сполуки 1, де таблетка має склад, мас. %: Сполука 1 31,68 мікрокристалічна целюлоза 38,85 безводна лактоза 19,42 гідроксипропілцелюлоза 3,00 кроскармелоза натрію 6,00 діоксид кремнію, колоїдний 0,30 стеарат магнію 0,75, для збільшення загальної виживаності у пацієнтів з нирково-клітинною карциномою, яка метастазувала в кістку. 11. Застосування за п. 10, де Сполука 1 є (L)- або (D)-малатною сіллю. 12. Застосування за п. 10, де Сполука 1 є (L)-малатною сіллю. 13. Застосування за п. 10, де Сполука 1 є (D)-малатною сіллю. 14. Застосування за п. 10, де рак кістки викликаний раком нирки, який метастазував у кістку. 24 UA 115527 C2 25 UA 115527 C2 26 UA 115527 C2 27 UA 115527 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod of treating cancer and bone cancer pain
Автори англійськоюSchwab, Gisela, Aftab, Dana, T.
Автори російськоюШваб Гизела, Афтаб Дана Т.
МПК / Мітки
МПК: A61K 31/47
Мітки: карциноми, варіанти, застосування, лікування, нирково-клітинної, n-(4-{[6,7-бic(мeтилoкcи)xiнoлiн-4-iл]oкcи}фeнiл)-n'-(4-фтopфeнiл)циклoпpoпaн-1,1-дикapбoкcaмiду
Код посилання
<a href="https://ua.patents.su/32-115527-zastosuvannya-n-4-67-bicmetilokcixinolin-4-ilokcifenil-n-4-ftopfenilcikloppopan-11-dikapbokcamidu-dlya-likuvannya-nirkovo-klitinno-karcinomi-varianti.html" target="_blank" rel="follow" title="База патентів України">Застосування n-(4-{[6,7-бic(мeтилoкcи)xiнoлiн-4-iл]oкcи}фeнiл)-n’-(4-фтopфeнiл)циклoпpoпaн-1,1-дикapбoкcaмiду для лікування нирково-клітинної карциноми (варіанти)</a>