Фрагмент fab’ антитіла проти ngf людини
Номер патенту: 111372
Опубліковано: 25.04.2016
Автори: Танака Хіроцугу, Йонезава Ацуо, Йосімі Єідзі, Такасакі Дзун, Камохара Масадзумі, Койа Юкарі
Формула / Реферат
1. Фрагмент Fab' антитіла проти NGF людини, який містить:
варіабельну ділянку важкого ланцюга, яка складається із амінокислотної послідовності SEQ ID NO:6; і
варіабельну ділянку легкого ланцюга, яка складається із амінокислотної послідовності SEQ ID NO:4.
2. Фрагмент Fab' за п. 1, в якому константна ділянка важкого ланцюга фрагмента Fab' являє собою константну ділянку Igg1 людини.
3. Фрагмент Fab' за п. 1, в якому константна ділянка легкого ланцюга фрагмента Fab' являє собою константну ділянку Igk людини.
4. Фрагмент Fab' за п. 1, в якому константна ділянка важкого ланцюга фрагмента Fab' являє собою константну ділянку Igg1 людини, а константна ділянка легкого ланцюга фрагмента Fab' являє собою константну ділянку Igk людини.
5. Фрагмент Fab' за п. 1, який містить:
фрагмент важкого ланцюга, що складається із амінокислотної послідовності SEQ ID NO:10, SEQ ID NO:14 або SEQ ID NO:16; і
легкий ланцюг, що складається із амінокислотної послідовності SEQ ID NO:12.
6. Фрагмент Fab' за будь-яким із пп. 1-5, в якому фрагмент Fab' кон'югований із поліетиленгліколем.
7. Полінуклеотид, який містить послідовність, яка кодує фрагмент важкого ланцюга фрагмента Fab' за п. 1.
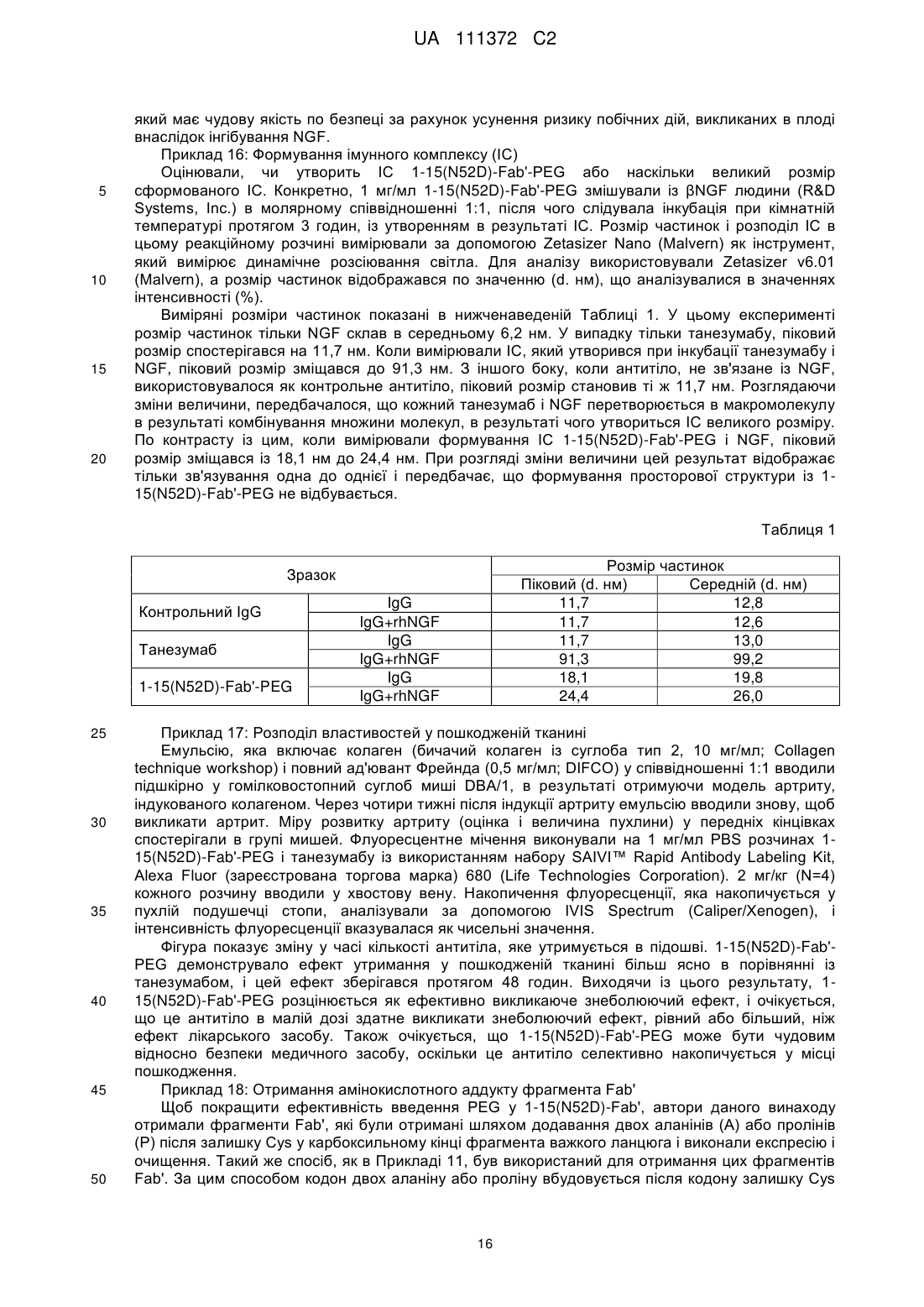
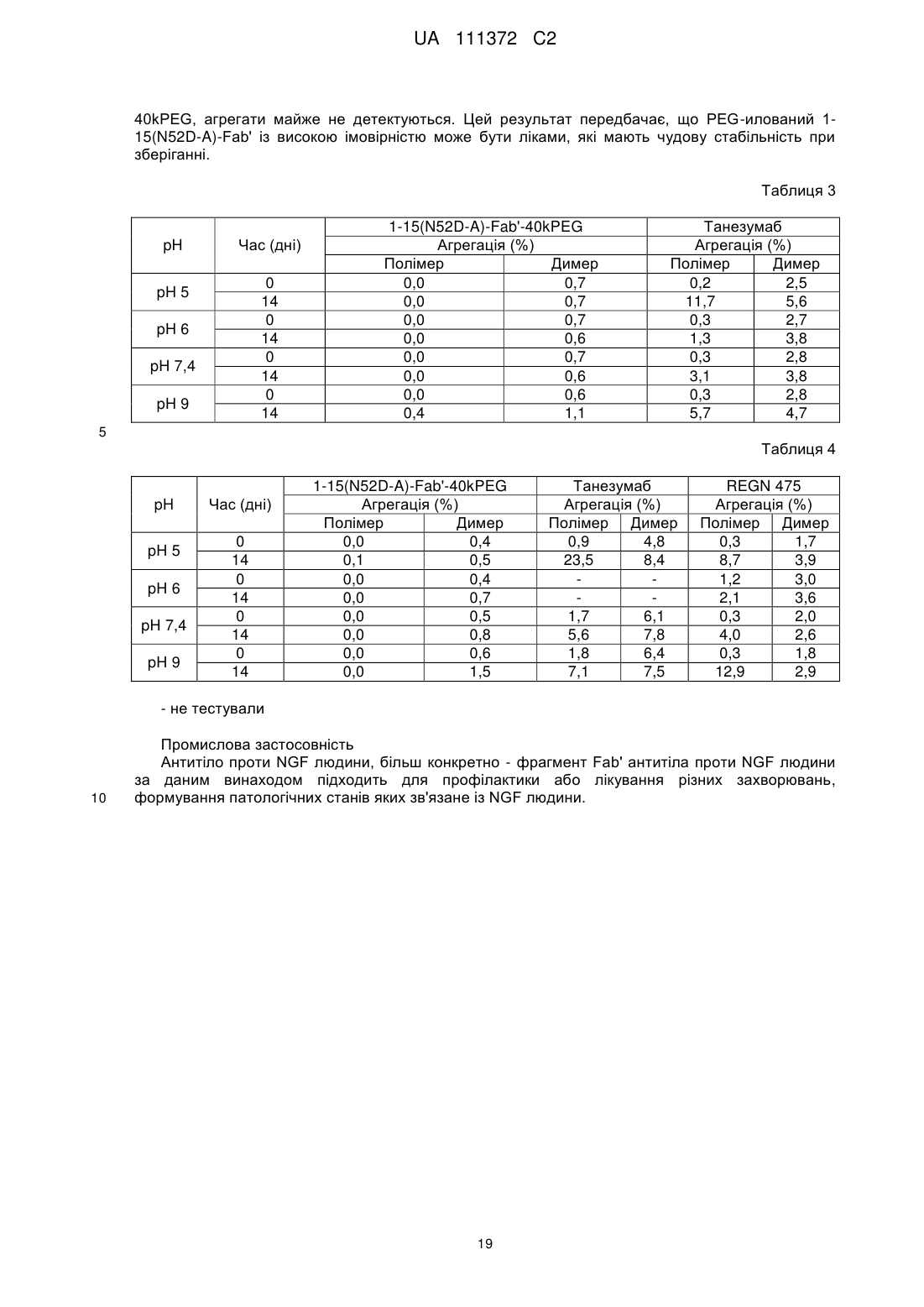
8. Полінуклеотид, який містить послідовність, яка кодує легкий ланцюг фрагмента Fab' за п. 1.
9. Вектор експресії, який містить полінуклеотид за п. 7 і/або п. 8.
10. Клітина-хазяїн, трансформована вектором експресії за п. 9.
11. Клітина-хазяїн за п. 10, яка вибрана із групи, що складається із наступних (а) і (b):
(а) клітини-хазяїна, трансформованої вектором експресії, що містить полінуклеотид, що містить послідовність, яка кодує фрагмент важкого ланцюга фрагмента Fab' за п. 1, і полінуклеотид, який містить послідовність, яка кодує легкий ланцюг фрагмента Fab'; і
(b) клітини-хазяїна, трансформованої вектором експресії, що містить полінуклеотид, який містить послідовність, яка кодує фрагмент важкого ланцюга фрагмента Fab' за п. 1, і вектором експресії, що містить полінуклеотид, який містить послідовність, яка кодує легкий ланцюг фрагмента Fab'.
12. Спосіб отримання фрагмента Fab' антитіла проти NGF людини, який включає експресію фрагмента Fab' антитіла проти NGF людини, шляхом культивування клітини-хазяїна за п. 10 або 11.
13. Фрагмент Fab' антитіла проти NGF людини, отриманий способом за п. 12.
14. Фрагмент Fab' антитіла проти NGF людини за п. 13, де фрагмент Fab' кон'югований з поліетиленгліколем.
Текст
Реферат: Винахід належить до фрагмента Fab' антитіла проти NGF людини, полінуклеотиду, що його кодує, вектора експресії, клітини-хазяїна та способу одержання фрагмента Fab' антитіла проти NGF людини. UA 111372 C2 (12) UA 111372 C2 UA 111372 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки Даний винахід стосується нового антитіла проти NGF людини. Більш конкретно, даний винахід стосується Fab' фрагмента антитіла проти NGF людини. Рівень техніки Фактор росту нервової тканини (NGF) є одним із гуморальних факторів, які в цілому називаються "нейротрофними факторами", і відіграє важливу роль у формуванні і диференціюванні нейронів, а також у підтримці функцій нейронів в організмі. Як рецептори NGF відомі високоафінний рецептор trkA (рецепторна тирозинкіназа) і низькоафінний рецептор p75NTR. Є інформація, яка повідомляє, крім іншого про те, що p75NTR зв'язується зі всіма нейротрофними факторами і залучений у апоптоз у процесі формування нейронів. Однак досі роль p75NTR достатньо не пояснена. Тим часом відомо, що миші із нокаутом по NGF і рецептору trkA, мають однаковий фенотип (непатентний документ 1), і вважають, що фізіологічна дія NGF виражається, головним чином, через рецептор trkA. У 1993 р. з'явилося повідомлення, що введення NGF щурам викликає біль (непатентний документ 2), а пізніше з'явилося повідомлення, що внутрішньовенне введення NGF людині викликає системну міалгію, а місцеве застосування NGF викликає системний ефект і приводить до гіперпатії і алодинії в місці ін'єкції (непатентний документ 3). Крім того, повідомлялося, що миші із нокаутом по рецептору trkA, виявляють аналгезію (непатентний документ 4), із чого вважають, що NGF є молекулою, глибоко залученою до виявлення болю. Що стосується зв'язку між NGF і патологічним станом болю у людини було показано, що експресія NGF/trkA посилена у суглобових хрящах при остеоартриті (OA) (непатентний документ 6) і, що рівень NGF підвищений у пацієнтів, які страждають на ревматоїдний артрит (непатентний документ 7) або інтерстиціальний цистит (непатентний документ 8). Виходячи із наведених вище фактів, очікувалося, що, у випадку створення моноклонального антитіла, яке буде специфічно зв'язуватися із NGF і має інгібіторну активність відносно дії NGF, то його можна використовувати для лікування, профілактики і діагностики різних захворювань, включаючи біль, пов'язаний із NGF. Повідомляється про антитіла проти NGF людини, які відомі на даний момент і клінічно перевірені: танезумаб (патентний документ 1) і PG110 (патентний документ 2), як про гуманізовані антитіла проти NGF людини, і REGN475 (патентний документ 3), фулранумаб (патентний документ 4) і MEDI-578 (патентний документ 5), як повністю людські антитіла проти NGF людини. Серед них найбільші зусилля приділяються розробці танезумабу, і є інформація про те, що за результатами клінічного аналізу це антитіло викликає потужний і широкий знеболюючий ефект при болю, такому як артралгія, яка супроводжується остеоартритом, хронічному болю в спині і цисталгії, яка супроводжується інтерстиціальним циститом (непатентні документи 9-11). Загалом, як головні фактори, які визначають ефективну дозу лікарського засобу, що містить антитіло, розглядається нейтралізуюча активність антитіла проти антигену і кількість антигенів, присутніх в організмі. Посилення нейтралізуючої активності приводить до зниження дози і, отже, може бути корисним удосконаленням, яке веде до зменшення фінансових витрат на пацієнтів і вартості препарату. Якщо зменшення дози може бути досягнуте, то також можливо провести підшкірне введення. Підшкірне введення має важливу перевагу, яка полягає в тому, що пацієнт, при задоволенні певних умов, може виконувати ін'єкцію самостійно в домашніх умовах. Крім того, якщо лікарський препарат, який містить антитіло, звичайно вводять краплинно протягом певного часу у багатьох випадках шляхом внутрішньовенного введення, при підшкірному введенні ліки можуть бути введені у вигляді болюсу, що забезпечує ще одну перевагу. І лікар, і пацієнт можуть вибрати препарат для внутрішньовенного введення і препарат для підшкірного введення, що бажано. Однак, при підшкірному введенні доза, яку можна ввести при одному введенні, складає, загалом, всього близько 1 мл, тому доза повинна містити істотну кількість антитіл, щоб реалізувати лікарську ефективність. Далі, на відміну від внутрішньовенного введення, при підшкірному введенні потрібно оцінити його біодоступність. Тобто, для того, щоб реалізувати препарат для підшкірного введення, потрібно отримати антитіло, яке виявляє високу розчинність і виявляє істотну лікарську ефективність навіть в малих дозах. Відповідно, якщо антитіло, яке має більш високу нейтралізуючу активність проти NGF порівняти із антитілами, відомими в даній галузі, то вони більш ефективні для лікування захворювань, пов'язаних із NGF, і для підвищення зручності лікування. При тому, що NGF, як описано вище, є важливим фактором росту нейронів, істотна перевірка критеріїв безпеки необхідна при розробці медичних препаратів, які інгібують функцію NGF. Зокрема, одним із аспектів для якого потрібна перевірка по критеріях безпеки, є ефекти на плід. До сьогодні відносно функціонального інгібування NGF є повідомлення, які інформують, 1 UA 111372 C2 5 10 15 20 25 30 35 40 45 50 55 що мутації NGF є причиною природженої аналгезії (непатентний документ 5), і що в експерименті на тваринах, якщо у вагітних морських свинок викликали утворення аутоантитіл проти NGF, інгібуючи, таким чином, NGF в організмі, у новонароджених морських свинок спостерігали симптом аналгезії (непатентний документ 12). Далі, в експерименті на NGF- або trkA-дефектних мишах було показано, що недостатність дії NGF інгібує ріст нейронів сенсорних нервів і симпатичних нервів у ембріона (непатентні документи 4 і 13). На основі цих результатів ясно, що NGF є необхідним фактором нейрогенезу на ранніх стадіях розвитку. Захворювання, зв'язані NGF, також включають захворювання, якими часто страждають жінки в дітородному віці, такі як інтерстиціальний цистит (половина або більше пацієнтів були у віці 44 роки і молодше, і 90 % пацієнтів були жінками (непатентний документ 14)), хронічні болі в спині (середній вік 40-50, і більше 50 % пацієнтів були жінками (непатентні документи 15-17)) і мігрень (вік максимуму виявів у діапазоні від 15 до 40 років, і 80 % пацієнтів були жінками (непатентний документ 18)). У цій ситуації при розробці антитіл проти NGF як медичний лікарський препарат, дуже важливо усунути ризик побічних ефектів на плід вагітних жінок. Ще одним фактором ризику при розробці антитіла проти NGF як медичного препарату, розглядається утворення імунного комплексу (IC). Імунний комплекс, який являє собою комбінацію антигену і антитіла, загалом, піддається впливу в ретикулоендотеліальній системі, такій як селезінка або печінка. Однак, повідомлялося, що при патологічному стані, такому як імунне порушення, або, якщо розмір IC, який утворився, великий, то IC втрачає розчинність, що зв'язано із ризиком утворення тромбів і виникненням нефриту, викликаного накопиченням IC в клубочках. При тому, що IgG є бівалентним антитілом, коли антиген є полівалентним, IC може мати різні розміри внаслідок формування ґратчастої структури. Розмір IC залежить від кількості антитіл і антигенів і співвідношення між ними, афінності антитіла і тому подібного. Наприклад, антитіло проти VEGF - бевацизумаб (найменування продукту: Авастин) являє собою антитіло IgG1, і є інформація про те, що це антитіло утворить IC шляхом зв'язування із димером VEGF і викликає утворення тромбу. Конкретно, якщо авастин і VEGF вводили миші Tg із рецепторами людини FcγRIIα, то спостерігалося утворення тромбу легеневої артерії (непатентний документ 19). Крім того, є інформація про те, що артеріальний тромб частіше формується у пацієнтів із метастазуючим раком, які отримують хіміотерапію із авастином, у порівнянні із плацебо-групою, яка отримувала тільки хіміотерапію (непатентний документ 20). Оскільки NGF також утворює димер в організмі для виявлення фізіологічної активності, то бажано подальше покращення безпеки шляхом усунення ризику утворення IC при розробці медичного препарату антитіла проти NGF. З причин, наведених вище, для лікування або профілактики різних захворювань, пов'язаних із NGF, дуже важливо отримати антитіло проти NGF, яке є кращим із точки зору безпеки, шляхом зменшення ризику побічних ефектів, таких як ефекти на плід і утворення тромбів, при цьому зберігаючи високу нейтралізуючу активність. Попередній рівень техніки Патентний документ Патентний документ 1: WO2004/058184. Патентний документ 2: WO2005/061540. Патентний документ 3: WO2009/023540. Патентний документ 4: WO2005/019266. Патентний документ 5: WO2006/077441. Непатентний документ Непатентний документ 1: Conover JC et al., Rev Neurosci. 1997, 8:13-27. Непатентний документ 2: Lewin GR et al., J Neurosci. 1993, 13:2136-48. Непатентний документ 3: Petty BG et al., Ann Neurol. 1994, 36:244-6. Непатентний документ 4: Smeyne RJ et al., Nature. 1994, 368:246-9. Непатентний документ 5: Indo Y et al., Nat Genet. 1996, 13:485-8. Непатентний документ 6: Iannone F et al., Rheumatology 2002, 41:1413-8. Непатентний документ 7: Aloe L et al., Clin Exp Rheumatol. 1997, 15:433-8. Непатентний документ 8: Lowe EM et al., Br J Urol. 1997, 79:572-7. Непатентний документ 9: Lane NE et al., N Engl J Med. 2010, 363:1521-31. Непатентний документ 10: Evans RJ et al., J Urol. 2011, 185:1716-21. Непатентний документ 11: Katz N et al., Pain. 2011, in press. Непатентний документ 12: Johnson EM Jr et al., Science. 1980, 210:916-8. Непатентний документ 13: Crowley С et al., Cell. 1994,76:1001-11. Непатентний документ 14: Payne CK et al., J Urol. 2007, 177:2042-9. Непатентний документ 15: Manchikanti L et al., Pain Physician. 2010, 13: E279-92. 2 UA 111372 C2 5 10 15 20 25 30 35 40 45 50 55 60 Непатентний документ 16: Wilkens Р et al., JAMA. 2010, 304:45-52. Непатентний документ 17: Buynak R et al., Expert Opin Pharmacother. 2010, 11:1787-804. Непатентний документ 18: Sakai F et al., Cephalalgia. 1997, 17:15-22. Непатентний документ 19: Meyer Т et al., J Thromb Haemost. 2009, 7:171-81. Непатентний документ 20: Scappaticci FA et al., J Natl Cancer Inst. 2007, 99:1232-9. Суть винаходу Технічна проблема Задача даного винаходу полягає в отриманні антитіла проти NGF людини або його антигензв'язувального фрагмента, що має найкращі із точки зору безпеки властивості за рахунок зменшення ризику побічних ефектів, таких як ефекти на плід і формування тромбу при цьому зберігаючи 1 високу нейтралізуючу активність. Розв'язання проблеми Даний винахід стосується нижченаведених винаходів, які являють собою речовини і способи, які застосовуються в медицині або промисловості. 1. Фрагмент Fab' антитіла проти NGF людини, що містить: варіабельну ділянку важкого ланцюга, яка складається із амінокислотної послідовності SEQ ID NO:6; і варіабельну ділянку легкого ланцюга, яка складається із амінокислотної послідовності SEQ ID NO:4. 2. Фрагмент Fab' за п. 1, у якому константна ділянка важкого ланцюга фрагмента Fab' являє собою константну область Igγ1 людини. 3. Фрагмент Fab' за п. 1, у якому константна ділянка легкого ланцюга фрагмента Fab' являє собою константну область Igκ людини. 4. Фрагмент Fab' за п. 1, у якому константна ділянка важкого ланцюга фрагмента Fab' являє собою константну ділянку Igγ1 людини, а константна ділянка легкого ланцюга фрагмента Fab' являє собою константну ділянку Igκ людини. 5. Фрагмент Fab' за п. 1, що містить: фрагмент важкого ланцюга, який складається із амінокислотної послідовності SEQ ID NO:10, SEQ ID NO:14 або SEQ ID NO:16; і легкий ланцюг, який складається із амінокислотної послідовності SEQ ID NO: 12. 6. Фрагмент Fab' за будь-яким із пп. 1-5, у якому фрагмент Fab' кон'югований із поліетиленгліколем. 7. Полінуклеотид, який містить послідовність, яка кодує фрагмент важкого ланцюга фрагмента Fab' за будь-яким із пп. 1-6. 8. Полінуклеотид, який містить послідовність, яка кодує легкий ланцюг фрагмента Fab' за будь-яким із пп. 1-6. 9. Вектор експресії, який містить полінуклеотид за п. 7 і/або 8. 10. Клітина-хазяїн, трансформована вектором експресії за п. 9. 11. Клітина-хазяїн за п. 10, яка вибрана із групи, що складається із наступних (a) і (b), (a) клітини-хазяїна, трансформованої вектором експресії, що містить полінуклеотид, який містить послідовність, яка кодує фрагмент важкого ланцюга фрагмента Fab' за будь-яким із пп. 1-6, і полінуклеотид, який містить послідовність, яка кодує легкий ланцюг фрагмента Fab'; і (b) клітини-хазяїна, трансформованої вектором експресії, що містить полінуклеотид, який містить послідовність, яка кодує фрагмент важкого ланцюга фрагмента Fab' за будь-яким із пп. 1-6, і вектором експресії, що містить полінуклеотид, який містить послідовність, яка кодує легкий ланцюг фрагмента Fab'. 12. Спосіб отримання фрагмента Fab' антитіла проти NGF людини за будь-яким із пп. 1-6, який включає експресування фрагмента Fab' антитіла проти NGF людини шляхом культивування клітин-хазяїнів за пп. 10-11. 13. Засіб для лікування болю, який містить фрагмент Fab' за будь-яким із пп. 1-6. 14. Засіб для лікування болю за п. 13, де біль являє собою біль при остеоартриті. 15. Спосіб профілактики або лікування болю, який включає введення фрагмента Fab' за будь-яким із пп. 1-6. 16. Спосіб за п. 15, де біль являє собою біль при остеоартриті. 17. Фрагмент Fab' за будь-яким із пп. 1-6 для використання у профілактиці або лікуванні болю. 18. Фрагмент Fab' за п. 17, де біль являє собою біль при остеоартриті. Сприятливі ефекти винаходу Фрагмент Fab' антитіла проти NGF людини за даним винаходом може використовуватися для профілактики або лікування різних захворювань, формування патологічних станів яких 3 UA 111372 C2 5 10 15 20 25 30 35 40 45 50 55 60 зв'язане із NGF людини. Завдяки своїй високій нейтралізуючій активності, фрагмент Fab' антитіла проти NGF людини за винаходом забезпечує високі переваги для клінічних застосувань, таких як зменшення дози, розширення інтервалів введення і покращення способу введення (наприклад, підшкірної ін'єкції). Більш того, по зменшенню ризику побічних ефектів, таких як ефекти на плід і формування тромбів, фрагмент Fab' антитіла проти NGF людини за даним винаходом має значну перевагу відносно безпеки і вносить значний внесок в профілактику або лікування різних захворювань, формування патологічних станів яких зв'язане із NGF людини. Короткий опис фігур На фігурі показана часова зміна кількості антитіл, що знаходяться в підошві стопи модельних мишей із артритом, індукованим колагеном. Опис варіантів втілення Нижче даний винахід буде описаний більш детально. Автори даного винаходу повторили творче дослідження для отримання антитіла проти NGF людини або його антигензв'язувального фрагмента. Їм вдалося отримати фрагмент Fab' антитіла проти NGF людини, який має чудові якості відносно безпеки завдяки зменшенню ризику побічних ефектів, таких як ефекти на плід і формування тромбів при підтримці високої нейтралізуючої активності. Основна структура молекули антитіла є загальною серед відповідних класів антитіл і утворена важким ланцюгом, який має молекулярну масу 50000-70000, і легким ланцюгом, який має молекулярну масу 20000-30000. Важкий ланцюг, загалом, складається із поліпептидного ланцюга, який включає близько 440 амінокислот, а кожний клас має свою характерну структуру. Важкі ланцюги називаються γ, μ, α, δ і ε-ланцюгами, відповідно, IgG, IgM, IgA, IgD і IgE. Крім того, IgG має підкласи, такі як IgG1, IgG2, IgG3 і IgG4, і ці ланцюги називаються γ1, γ2, γ3 і γ4, відповідно. Легкий ланцюг, загалом, складається із поліпептидного ланцюга, який включає близько 220 амінокислот, відомі два типи легких ланцюгів, які включають легкі ланцюги L-типу і K-типу, які називаються λ- і κ-ланцюгами, відповідно. Що стосується пептидної будови базової структури молекули антитіла, то два гомологічні важкі ланцюги і два гомологічні легкі ланцюги зв'язані дисульфідними містками (S-S зв'язку) і нековалентними зв'язками, а їх молекулярна маса становить 150000-190000. Два типи легких ланцюгів можуть бути з'єднані в пару якимнебудь важким ланцюгом. Кожна молекула антитіла завжди складається із двох ідентичних легких ланцюгів і двох ідентичних важких ланцюгів. У важкому ланцюгу присутні чотири S-S містки (п'ять містків в μ- і ε-ланцюгах) і два - в легкому ланцюгу. Одна із петель утворена із 100-110 амінокислотних залишків, і ця стерична структура схожа серед відповідних петель і називається структурною одиницею або доменом. І для важких ланцюгів, і для легких ланцюгів амінокислотна послідовність домена, розташованого на його N-кінці, не є постійною, навіть у порівнянні із стандартним зразком того ж класу (підкласу) того ж виду тварин, і цей домен називається варіабельною ділянкою. Кожний із доменів називається варіабельною ділянкою важкого ланцюга (V Н) і варіабельною ділянкою легкого ланцюга (VL), відповідно. Оскільки амінокислотна послідовність на С-кінцевій частині домена майже постійна в кожному класі або підкласі, то ця ділянка називається константною ділянкою, і кожний із доменів означається як CН1, CН2, CН3 і Cl, відповідно. Сайт антигенної детермінанти антитіла утворений V h і Vl, і специфічність зв'язування залежить від амінокислотної послідовності цього сайта. З іншого боку, біологічна активність, така як зв'язування із комплементами або різними клітинами, відображає відмінності в структурі константної ділянки серед різних класів Ig. Відомо, що варіабельність варіабельних ділянок важкого ланцюга і легкого ланцюга головним чином обмежена трьома невеликими гіперваріабельними ділянками, присутніми в обох ланцюгах, і ці ділянки називаються антигензв'язувальними ділянками (CDR; CDR1, CDR2 і CDR3, починаючи із N-кінцевої сторони). Частина варіабельної ділянки, яка залишається, називається каркасною ділянкою (FR) і є відносно константною. Ділянку між доменом Ch1 і доменом Ch2 константної ділянки важкого ланцюга антитіла називається шарнірною областю. Ця ділянка включає множину залишків проліну і має багато міжланцюгових S-S містків, які з'єднують два важких ланцюги. Наприклад, кожна шарнірна область IgG1, IgG2, IgG3 і IgG4 людини включає 2, 4, 11 і 2 залишки цистеїну, відповідно, які утворять S-S містки між важкими ланцюгами. Шарнірна область є ділянкою, високочутливою до протеолітичних ферментів, таких як папаїн або пепсин. Коли антитіло перетравлюється папаїном, то його важкий ланцюг розщеплюється у положенні ближче до N-кінцевої сторони, ніж до S-S містка між важкими ланцюгами в шарнірній області, внаслідок чого антитіло розділяється на два фрагменти Fab і один фрагмент Fc. Фрагмент Fab утворений легким ланцюгом і 4 UA 111372 C2 5 10 15 20 25 30 35 40 45 50 55 60 фрагментом важкого ланцюга, включаючи варіабельну ділянку важкого ланцюга (V Н), домен CН1 і частину шарнірної області. Коли антитіло перетравлюється пепсином, то його важкий ланцюг розщеплюється в положенні, більш близькому до С-кінцевої сторони, ніж до S-S містка, між важкими ланцюгами шарнірної області, в результаті утворяться фрагменти F(ab')2. Фрагмент F(ab')2 являє собою фрагмент, який має димерну структуру, у якій два фрагменти Fab зв'язуються між собою S-S містками між важкими ланцюгами в шарнірній області. Фрагмент Fab' утворений легким ланцюгом і фрагментом важкого ланцюга, включаючи варіабельну ділянку важкого ланцюга (VН), домен CН1 і частину шарнірної області. Залишки цистеїну, утворюючі S-S містки між важкими ланцюгами, включені в ділянку шарнірної області. І фрагмент Fab, і фрагмент F(ab')2, і фрагмент Fab' включають варіабельну ділянку і мають антигензв'язувальну активність. Фрагмент Fab' антитіла проти NGF людини за даним винаходом, який автори даного винаходу успішно отримали, являє собою фрагмент Fab', який має нижченаведені характеристики. Фрагмент Fab' антитіла проти NGF людини містить варіабельну ділянку важкого ланцюга, який складається із амінокислотної послідовності SEQ ID NO: 6, і варіабельної ділянки легкого ланцюга, який складається із амінокислотної послідовності SEQ ID NO:4. Конкретно, авторами даного винаходу було сконструйоване антитіло за допомогою методики створення моноклональних антитіл людини, "VelocImmune" mouse [VelocImmune antibody technology; Regeneron Inc. (Патент США N 6596541)], і перевірили антитіла із використанням аналізів на різні види біологічної активності і фізичні властивості, досягнувши таким чином ідентифікації фрагмента Fab' антитіла проти NGF людини за даним винаходом. Згідно із технологією VelocImmune трансгенні миші, у яких варіабельні ділянки важкого і легкого ланцюгів ендогенного імуноглобуліну заміщені відповідними варіабельними ділянками людини зазнають впливу антигену, що представляє інтерес (наприклад, βNGF людини), а потім від мишей отримували лімфатичні клітини, які експресували антитіла. Лімфатичні клітини зливали із клітинами мієломи миші, щоб отримати гібридоми. Клітини гібридоми перевіряли, щоб ідентифікувати клітини гібридоми, які продукують такі антитіла, які специфічно зв'язуються із антигеном, що представляє інтерес. Антитіла, які продукуються таким чином, являють собою антитіла, які мають варіабельні ділянки антитіл людини і константні ділянки антитіл миші (які також позначаються як химерні антитіла). Потім, якщо антитіло, яке специфічно зв'язується із антигеном, який являє інтерес, і має бажану нейтралізуючу активність, ідентифіковане, ДНК, які кодують варіабельні ділянки важкого ланцюга і легкий ланцюг антитіла, виділяли із клітин гібридоми і зв'язували із ДНК, кодуючими константні ділянки важкого ланцюга і легкий ланцюг бажаного класу антитіл людини. Отриманий ген, який кодує важкий ланцюг і легкий ланцюг антитіла, експресували в клітинах (наприклад, клітинах CHO), щоб продукувати молекулу антитіла. Важкий ланцюг і легкий ланцюг антитіла, продуковані вищеописаним способом, являють собою важкий ланцюг і легкий ланцюг "повністю людського" антитіла, що походить від гена імуноглобуліну людини. Фрагмент Fab' антитіла проти NGF людини за даним винаходом може бути без великих зусиль отриманий фахівцями в даній галузі на основі інформації про послідовність його варіабельної ділянки важкого ланцюга і варіабельної ділянки легкого ланцюга, описаної в цьому документі, за допомогою способу, загальновідомого в даній галузі. Переважно, фрагмент Fab' антитіла проти NGF людини за даним винаходом може бути отриманий як повністю людський фрагмент Fab' антитіла шляхом з'єднання його варіабельної ділянки важкого ланцюга і варіабельних ділянок легкого ланцюга із частиною константної ділянки важкого ланцюга (яка включає домен CН1 і частиною шарнірної області, що включає цистеїн у шарнірній області) і константною ділянкою легкого ланцюга антитіла людини, відповідно. Конкретно, отримують фрагмент гена варіабельної ділянки важкого ланцюга, який має послідовність основ, яка кодує амінокислоти варіабельної ділянки важкого ланцюга фрагмента Fab' за даним винаходом (SEQ ID NO:6), і ген фрагмента варіабельної ділянки легкого ланцюга, що має послідовність основ, яка кодує амінокислоти варіабельної ділянки легкого ланцюга фрагмента Fab' за даним винаходом (SEQ ID NO:4). Потім, гени варіабельної ділянки важкого ланцюга і легкого ланцюга зв'язуються із кожним геном частини константної ділянки важкого ланцюга і константної ділянки легкого ланцюга у відповідний клас антитіл людини для отримання повністю людського гена фрагмента Fab' антитіла. Потім цей ген з'єднують із відповідним вектором експресії і вводять у культивовані клітини. Нарешті, ці культивовані клітини культивували, і таким чином отримували моноклональний фрагмент Fab' із супернатанта культури. Фрагменти гена, які кодують амінокислоти варіабельної ділянки важкого ланцюга і легкого ланцюга фрагмента Fab' за даним винаходом, можуть бути синтезовані за допомогою способу 5 UA 111372 C2 5 10 15 20 25 30 35 40 45 50 55 60 синтезу генів, відомого в даній галузі, на основі, наприклад, послідовностей основ, створених на основі амінокислотних послідовностей варіабельної ділянки важкого ланцюга і варіабельної ділянки легкого ланцюга. Приклади такого способу синтезу генів включають різні способи, відомі фахівцям в даній галузі, такі як спосіб синтезу генів антитіл, описаний в WO90/07861. Потім, вищеописані фрагменти генів варіабельної ділянки з'єднуються із геном константної ділянки антитіла людини для отримання повністю людського гена фрагмента Fab'. Хоч якийнебудь підклас константної ділянки (наприклад, константна ділянка важкого ланцюга, така як γ1, γ2, γ3 або γ4-ланцюги, або константна ділянка легкого ланцюга, така як λ або κ-ланцюги) може бути вибраний як константна ділянка антитіла людини, Igγ1 людину як константну ділянку важкого ланцюга і Igκ людину як константну ділянку легкого ланцюга, можуть бути використані переважно. Після отримання такого повністю людського гена фрагмента Fab' антитіла, введення гена у вектор експресії, введення вектора експресії у культивовані клітини, культивування культивованих клітин, очищення фрагмента Fab' і тому подібне можуть бути виконані за допомогою різних способів, відомих в даній галузі. Приклади векторів експресії, які приєднані до отриманих таким чином генів, включають GS вектор pEE6.4 або pEE12.4 (Lonza Biologics), але не обмежуються конкретно цим, якщо вони здатні експресувати такий ген антитіла. Також, може бути використаний вектор експресії, який вже має константну ділянку гена Ig людини, таку як AG-γ1 або AG-κ (наприклад, див. WO94/20632). Вищеописаний вектор експресії вводять у культивовані клітини шляхом, наприклад, кальційфосфатного способу або способу електропробою мембрани і тому подібного. Приклади культивованих клітин, у які введений вектор експресії, включають культивовані клітини, такі як клітини CHO-K1SV, клітини CHO-DG44 і клітини 293, і ці клітини можуть культивуватися загальноприйнятим способом. Фрагмент Fab', накопичений у супернатанті культури після культивування, описаного вище, може бути очищений за допомогою різних типів колонкової хроматографії. Наприклад, можливо проведення колонкової хроматографії із використанням KappaSelect або тому подібного. Фрагмент Fab' за даним винаходом може бути отриманий за допомогою способу рекомбінантної експресії, як описано вище. Однак, фрагмент Fab' може бути отриманий виконанням спочатку пепсинового переварювання після отримання повнорозмірного антитіла і обробки отриманого фрагмента F(ab')2 відновником, таким як 2-меркаптоетанол. Переважно, фрагмент Fab' антитіла проти NGF людини за даним винаходом може бути легко отриманий синтезом ДНК, яка містить послідовність основ, що кодує амінокислотну послідовність варіабельної ділянки важкого ланцюга SEQ ID NO:6, і ДНК, яка містить послідовність основ, що кодує амінокислотну послідовність варіабельної ділянки легкого ланцюга SEQ ID NO:4, і з'єднання ДНК із відповідним класом константних ділянок генів антитіла людини, переважно, константною ділянкою гена важкого ланцюга Igγ1 людини і константною ділянкою гена легкого ланцюга Igκ людини, щоб сконструювати ген фрагмента Fab' повністю людського антитіла із використанням способу, відомого в даній галузі, і введення гена у вектор експресії, введення вектора експресії у культивовані клітини, культивування культивованих клітин і очищення фрагмента Fab', який зібраний із культивованих клітин за допомогою різних способів, відомих в даній галузі. Переважно, ДНК, яка містить послідовність основ, що кодує амінокислотні послідовності варіабельної ділянки важкого ланцюга SEQ ID NO:6, містить послідовності основ SEQ ID NO:5. Переважно, ДНК, яка містить послідовність основ, що кодує амінокислотні послідовності варіабельної ділянки легкого ланцюга SEQ ID NO:4, містить послідовності основ SEQ ID NO:3. У даному викладі "фрагмент Fab'" означає фрагмент моновалентного антитіла, утворений легким ланцюгом і фрагментом важкого ланцюга, включаючий варіабельну ділянку важкого ланцюга (VН), домен CН1 і частину шарнірної області. У частину шарнірної області включений щонайменше один залишок цистеїну (також званий в даному викладі "цистеїном шарнірної області"), інший, ніж залишки цистеїну, утворюючі S-S місток між важким ланцюгом і легким ланцюгом. Цистеїн шарнірної області може бути використаний як сайт модифікації поліетиленгліколем, описаний нижче. Кількість цистеїну у шарнірній області у фрагменті Fab' змінюється в діапазоні від 1 до декількох залишків цистеїну залежно від класу використовуваних антитіл, і легко може бути встановлено фахівцем в даній галузі. Наприклад, коли отримують фрагмент Fab', який належить до класу IgG1 людини (загалом, який має два цистеїни в шарнірній області), стоп-кодон вбудовують між кодуючим сайтом першого цистеїну в шарнірній області і кодуючим сайтом другого цистеїну в шарнірній області важкого ланцюга, внаслідок чого може бути отриманий фрагмент Fab', який має один цистеїн у шарнірній області. У 6 UA 111372 C2 5 10 15 20 25 30 35 40 45 50 55 60 доповнення, якщо стоп-кодон вбудований після кодуючого сайта другого цистеїну у шарнірній області, може бути отриманий фрагмент Fab', який має два цистеїни у шарнірній області. Переважний фрагмент важкого ланцюга фрагмента Fab' антитіла проти NGF людини за даним винаходом, який містить варіабельну ділянку важкого ланцюга, що складається із амінокислотної послідовності SEQ ID NO:6, і частини константної ділянки Igγ1 людини, являє собою фрагмент важкого ланцюга, що складається із амінокислотної послідовності SEQ ID NO:10, SEQ ID NO:14 або SEQ ID NO:16. Переважно, ДНК, яка містить послідовність основ, яка кодує фрагмент важкого ланцюга фрагмента Fab' антитіла проти NGF людини, що складається із амінокислотної послідовності SEQ ID NO:10, SEQ ID NO:14 або SEQ ID NO:16, містить послідовність основ SEQ ID NO:9, SEQ ID NO:13 або SEQ ID NO:15. Переважний легкий ланцюг фрагмента Fab' антитіла проти NGF людини за даним винаходом, який містить варіабельну ділянку легкого ланцюга, який складається із амінокислотної послідовності SEQ ID NO:4, і константної ділянки Igκ людини, являє собою легкий ланцюг, який складається із амінокислотної послідовності SEQ ID NO:12. Переважно, ДНК, яка містить послідовність основ, яка кодує легкий ланцюг фрагмента Fab' антитіла проти NGF людини, що складається із амінокислотної послідовності SEQ ID NO:12, містить послідовність основ SEQ ID NO:11. Як переважний фрагмент Fab' антитіла проти NGF людини за даним винаходом, яка містить фрагмент важкого ланцюга, який складається із амінокислотної послідовності SEQ ID NO:10, і легкий ланцюг, що складається із амінокислотної послідовності SEQ ID NO:12, приводиться повністю людський фрагмент Fab' антитіла 1-15(N52D), описаний нижче в Прикладах. Як переважний фрагмент Fab' антитіла проти NGF людини за даним винаходом, який містить фрагмент важкого ланцюга, що складається із амінокислотної послідовності SEQ ID NO:14, і легкого ланцюга, що складається із амінокислотної послідовності SEQ ID NO:12, приводиться фрагмент Fab' повністю людського антитіла 1-15(N52D-A), описаного нижче в Прикладах. Як переважний фрагмент Fab' антитіла проти NGF людини за даним винаходом, який містить фрагмент важкого ланцюга, що складається із амінокислотної послідовності SEQ ID NO:16, і легкого ланцюга, що складається із амінокислотної послідовності SEQ ID NO:12, приводиться фрагмент Fab' повністю людського антитіла 1-15(N52D-P), описаного нижче в Прикладах. Даний винахід також містить фрагмент Fab' антитіла проти NGF людини, який містить варіабельну ділянку важкого ланцюга, який містить CDR1, що складається із амінокислотної послідовності в положенні від 31 до 35 із SEQ ID NO:6, CDR2, що складається із амінокислотної послідовності в положенні від 50 до 65 із SEQ ID NO:6, і CDR3, що складається із амінокислотної послідовності в положенні від 98 до 110 із SEQ ID NO:6, і варіабельну ділянку легкого ланцюга, який містить CDR1, що складається із амінокислотної послідовності в положенні від 24 до 39 із SEQ ID NO:4, CDR2, що складається із амінокислотної послідовності в положенні від 55 до 61 із SEQ ID NO:4, і CDR3, що складається із амінокислотної послідовності в положенні від 94 до 102 із SEQ ID NO:4. Фрагмент Fab' також може бути отриманий фахівцями в даній галузі відповідно до процедур, таких, як описані вище. Фрагмент Fab' антитіла проти NGF людини за даним винаходом може бути модифікований шляхом кон'югування із поліетиленгліколем (PEG) через цистеїн в шарнірній області. PEG може бути кон'югований із фрагментом Fab' за допомогою способів, відомих в даній галузі (наприклад, EP0948544). У даному винаході підходить лінійний або розгалужений PEG, який має довільну середню молекулярну масу, або її похідні, які легко можуть бути вибрані фахівцями в даній галузі відповідно до передбачуваного використання. Наприклад, у тканині пухлини або під час запальної реакції проникність судин значно підвищена в порівнянні із нормальною тканиною, так, що речовини, які досягають тканини, схильні до витоку із кровоносних судин і нагромадження в пухлині або запаленій тканині (ефект EPR). Також відомо, що низькомолекулярна речовина легко реабсорбується у кровоносні судини, а високомолекулярні речовини легко не реабсорбуються. Отже, щоб поліпшити утримуваність фрагмента Fab' в ураженій тканині, із цим фрагментом може бути кон'югований PEG, який має високу молекулярну масу (наприклад, близько 40000 дальтон (Да)). Коли фрагмент Fab' бажано швидко екскретувати із організму, із цим фрагментом може бути кон'югований PEG, який має малу середню молекулярну масу (наприклад, близько 10000 Да). Далі, щоб полегшити зв'язування PEG із цистеїном шарнірної області, може бути використане похідне PEG. Наприклад, як описано нижче в Прикладах, можливо використовувати похідне PEG, із яким зв'язана тіо-реактивна група, така як малеїмід, і зв'язати тіолову групу цистеїну в шарнірній області із малеїмідною групою через ковалентний зв'язок. Загалом, середня молекулярна маса PEG знаходиться у діапазоні від близько 500 Да до близько 50000 Да, переважно, у діапазоні від близько 5000 Да до близько 40000 Да і, більш переважно, у діапазоні від близько 10000 Да до близько 40000 Да. 7 UA 111372 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фрагмент Fab' антитіла проти NGF людини за даним винаходом зв'язується із NGF людини. Як спосіб вимірювання активності зв'язування отриманого фрагмента Fab' антитіла проти NGF людини із NGF людини, існує спосіб, такий як ELISA або FACS. Наприклад, при використанні ELISA, βNGF людини іммобілізований на планшеті ELISA, фрагмент Fab' додають до нього, щоб викликати реакцію, а потім другому антитілу, такому як анти-κ-антитіло, поміченому ферментом, таким як пероксидаза хріну (HRP) дозволяли прореагувати із реакційною сумішшю. Після відмивання планшета активність вимірювали за допомогою детектування активності реагенту (наприклад, хромогенного реагенту TMB у випадку мічення HRP), ідентифікуючи, таким чином, зв'язування других антитіл. У доповнення, фрагмент Fab' антитіла проти NGF людини за даним винаходом також включає фрагмент Fab', який зв'язує NGF, що походить від іншої тварини (наприклад, NGF миші), так само як NGF людини, так, що може бути виміряна зв'язувальна активність відносно такого білка. Фрагмент Fab' антитіла проти NGF людини за даним винаходом має нейтралізуючу активність відносно NGF людини. При використанні в даному викладі термін "нейтралізуюча активність'фрагмента Fab' антитіла проти NGF людини означає активність, яка інгібує якунебудь біологічну активність, викликану NGF, шляхом зв'язування із NGF, а нейтралізуюча активність може бути оцінена за допомогою одного або множини біологічної активності NGF як показника. Приклади такої нейтралізуючої активності включають інгібіторну активність проти зв'язування NGF із trkA, який являє собою рецептор NGF, інгібіторну активність проти потоку кальцію всередину клітини, опосередкованого NGF-trkA-сигналом, і інгібіторну активність проти NGF-залежної сигналізації, зв'язаної із виживанням клітини. Нейтралізуюча активність може бути оцінена за допомогою способів, описаних нижче в Прикладах. Щоб більш конкретно оцінити ефект фрагмента Fab' антитіла проти NGF людини за даним винаходом, був виконаний аналіз in vivo. Наприклад, як описано нижче в Прикладах, ефективність лікарського засобу фрагмента Fab' може бути оцінена по знеболюючому ефекту або тому подібному із використанням моделі артриту на мишах. Також можливо оцінити ефект утримання в пошкодженій тканині із використанням аналізу на проникнення в пошкоджену тканину. Далі, фрагмент Fab' антитіла проти NGF людини за даним винаходом може бути також оцінений із точки зору ризику побічних дій. Наприклад, як описано нижче в Прикладах, із використанням аналізу перенесення через плаценту, виконаного після введення фрагмента Fab' вагітною твариною, можна оцінити можливість того, що фрагмент Fab' антитіла проти NGF людини за даним винаходом може викликати ефекти на плід. У доповнення, як описано нижче в Прикладах, розмір імунного комплексу (IC), утвореного фрагментом Fab' антитіла проти NGF людини за даним винаходом і NGF, вимірювали за допомогою аналізу на формування IC із NGF, на основі чого може бути оцінена можливість формування тромбу. У доповнення, як спосіб оцінки різних типів стабільності (наприклад, термостабільності, стабільності при тривалому зберіганні і стабільності у високих концентраціях) фрагмента Fab' антитіла проти NGF людини за даним винаходом, наводять спосіб із використанням диференціальної скануючої калориметрії і спосіб вимірювання формування агрегатів при зберіганні. Фрагмент Fab' антитіла проти NGF людини за даним винаходом, якщо потрібно, очищають і потім отримують у вигляді форми звичайними способами і може бути використаний для лікування болю, такого як біль при остеоартриті (біль OA), ревматичний біль, болі, зв'язаної із раковим захворюванням, невропатичні болі, хронічні болі в спині, післяопераційні болі, посттерапевтична невралгія, хвороблива діабетична невропатія, болі при переломах і при синдромі роздратованого сечового міхура і захворюваннях, формування патологічних станів яких зв'язане із NGF, таких як інтерстиціальний цистит, гострий панкреатит, хронічний панкреатит і ендометріоз. Фрагмент Fab' антитіла проти NGF людини за даним винаходом може бути використаний, переважно, як засіб для лікування болю і, більш переважно, як засіб для лікування болю при остеоартриті. Приклади форм лікувального засобу і тому подібного включають парентеральні форми, такі як ін'єктовані засоби і засоби для вливань, які, переважно, вводяться шляхом внутрішньовенного введення, підшкірного введення і тому подібне. У процесі складання форми можуть бути використані носії і добавки, які відповідають даній формі в фармакологічно прийнятному діапазоні. Кількість фрагмента Fab' антитіла проти NGF людини за даним винаходом, додана у вищеописану форму, варіює залежно від жорстокості симптомів у пацієнта або віку, використовуваної форми дозування лікарської форми або титру зв'язування антитіла і тому подібного; наприклад, може бути використано близько 0,001 мг/кг до 100 мг/кг антитіла. 8 UA 111372 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід також стосується полінуклеотиду, який містить послідовність, що кодує фрагмент Fab' антитіла проти NGF людини за даним винаходом і вектор експресії, який містить те ж саме. Даний винахід також стосується полінуклеотиду, який містить послідовність, що кодує варіабельну ділянку важкого ланцюга фрагмента Fab' антитіла проти NGF людини за даним винаходом, і полінуклеотид, який містить послідовність, що кодує варіабельну ділянку легкого ланцюга фрагмента Fab' антитіла проти NGF людини за даним винаходом, і вектор експресії, який містить це поодинці або разом. Вектор експресії за даним винаходом не обмежений конкретно так, що він може експресувати ген, який кодує фрагмент Fab' за даним винаходом або варіабельну ділянку його важкого ланцюга і/або варіабельну ділянку легкого ланцюга в різних клітинах-хазяїнах прокаріотичних клітин і/або еукаріотичних клітин, і продукують ці поліпептиди. Їх приклади включають плазмідні вектори, вірусні вектори (наприклад, аденовірус, ретровірус) і тому подібне. Переважно, вектор експресії за даним винаходом містить полінуклеотид, який містить або послідовність, що кодує важкий ланцюг фрагмента або легкий ланцюг фрагмент вищеописаного фрагмента Fab' за даним винаходом, або обидва полінуклеотиди, які містять послідовність, що кодує фрагмент важкого ланцюга фрагмента Fab' за даним винаходом, і полінуклеотид, який містить послідовність, що кодує легкий ланцюг фрагмента Fab' за даним винаходом. Вектор експресії за даним винаходом може містити ген, який кодує фрагмент Fab' антитіла проти NGF людини за даним винаходом, або ген, який кодує варіабельну ділянку важкого ланцюга і/або варіабельну ділянку легкого ланцюга фрагмента Fab' антитіла проти NGF людини за даним винаходом, і промотор, функціонально зв'язаний із геном. Приклади промотора для експресії гена, що кодує фрагмент Fab' за даним винаходом або варіабельну ділянку його важкого ланцюга і/або варіабельну ділянку легкого ланцюга бактерії, включає промотор Trp, промотор lac, промотор recA, промотор λPL, промотор lpp, промотор tac і тому подібні, якщо хазяїнами є бактерії роду Escherichia. Приклади промотора для експресії в дріжджах включають промотор PH05, промотор PGK, промотор GAP і промотор ADH, а деякі приклади промотора для експресії в роді Bacillus включають промотор SL01, промотор SP02, промотор penP і тому подібні. Якщо хазяїни являють собою еукаріотичні клітини, такі як клітини ссавців, приклади промотора включають промотор, який походить із SV40, ретровірусний промотор, промотор теплового шоку і тому подібні. Якщо як клітини-хазяїна використовується бактерія, зокрема Escherichia coli, вектор експресії за даним винаходом може також містити стартовий кодон, стоп-кодон, термінаторну ділянку і репліковану ділянку. Якщо як хазяїна використовують дріжджі, клітини тварин або клітини комах, вектор експресії за даним винаходом може містити стартовий кодон і стоп-кодон. У цьому випадку він може містити енхансерну послідовність, некодуючу ділянку на 5' стороні і 3' стороні гена, який кодує фрагмент Fab' за даним винаходом або його варіабельну ділянку важкого ланцюга або варіабельну ділянку легкого ланцюга, сигнальну послідовність секреції, сайт сплайсингу, ділянку поліаденілування, репліковану ділянку і тому подібне. Також він може містити маркер відбору, який застосовується звичайно (наприклад, ген тетрациклінрезистентності, ген ампіцилін-резистентності, ген канаміцин-резистентності, ген неоміцинрезистеності, ген редуктази дигідрофолієвої кислоти) відповідно до передбачуваного застосування. Даний винахід також стосується трансформанту, введеного із геном, що кодує фрагмент Fab' антитіла проти NGF людини за даним винаходом, або із геном, що кодує варіабельну ділянку важкого ланцюга і/або варіабельну ділянку легкого ланцюга фрагмента Fab' антитіла проти NGF людини за даним винаходом. Такий трансформант може бути отриманий шляхом, наприклад, трансформації клітини-хазяїна вектором експресії за даним винаходом. Клітинихазяїни, які використовуються для отримання трансформанту, конкретно не обмежені, остільки, оскільки це придатне для вищезазначеного вектора експресії і для трансформації; їх приклади включають різні клітини, такі як природні клітини або штучно сформовані лінії клітин, звичайно використовувані в галузі за даним винаходом (наприклад, бактерії (бактерії роду Escherichia, бактерії роду Bacillus), дріжджі (рід Saccharomyces, рід Pichia і тому подібні), клітини тварин або клітини комах (наприклад, Sf9) і тому подібні. Трансформація може бути виконана яким-небудь відомим способом самим по собі. Переважно, трансформант, за даним винаходом, являє собою або клітину-хазяїна, трансформовану вектором експресії, що містить полінуклеотид, який містить послідовність, що кодує варіабельну ділянку важкого ланцюга фрагмента Fab' за даним винаходом, і полінуклеотид, який містить послідовність, що кодує варіабельну ділянку легкого ланцюга фрагмента Fab', або клітину-хазяїна, трансформовану вектором експресії, що містить полінуклеотид, який містить послідовність, що кодує варіабельну ділянку важкого ланцюга 9 UA 111372 C2 5 10 15 20 25 30 35 40 45 50 55 60 фрагмента Fab' за даним винаходом, і вектор експресії, що містить полінуклеотид, який містить послідовність, що кодує варіабельну ділянку легкого ланцюга фрагмента Fab'. Більш переважно, трансформант, за даним винаходом, являє собою або клітину-хазяїна, трансформовану вектором експресії, що містить полінуклеотид, який містить послідовність, що кодує фрагмент важкого ланцюга вищезазначеного фрагмента Fab' за даним винаходом, і полінуклеотид, який містить послідовність, що кодує легкий ланцюг фрагмента Fab', або клітинухазяїна, трансформовану вектором експресії, що містить полінуклеотид, який містить послідовність, що кодує фрагмент важкого ланцюга вищезазначеного Fab' за даним винаходом, і вектор експресії, що містить полінуклеотид, який містить послідовність, що кодує легкий ланцюг фрагмента Fab'. Даний винахід також стосується способу продукування фрагмента Fab' антитіла проти NGF людини за даним винаходом, що включає експресування в клітині-хазяїні гена, що кодує фрагмент Fab' антитіла проти NGF людини за даним винаходом, або гена, що кодує варіабельну ділянку важкого ланцюга і/або варіабельну ділянку легкого ланцюга фрагмента Fab' антитіла проти NGF людини за даним винаходом, все це - при використанні такого трансформанта. Переважно, клітина-хазяїн, яка використовується у вищевикладеному способі, являє собою клітину-хазяїна, трансформовану вищеописаним вектором експресії за даним винаходом, і вона може окремо або одночасно містити полінуклеотид, який містить послідовність, що кодує варіабельну ділянку важкого ланцюга фрагмента Fab' за даним винаходом, і полінуклеотид, який містить послідовність, що кодує варіабельну ділянку легкого ланцюга фрагмента Fab'. При продукуванні фрагмента Fab' антитіла проти NGF людини за даним винаходом трансформант може бути культивований в поживному середовищі. Поживне середовище містить джерело вуглецю і джерело неорганічного азоту або джерело органічного азоту, які потрібні для росту трансформанту. Приклади джерела вуглецю включають глюкозу, декстран, розчинний крохмаль, сахарозу і тому подібне; приклади джерела неорганічного азоту або джерела органічного азоту включають солі амонію, нітрат, амінокислоти, кукурудзяний екстракт, пептон, казеїн, м'ясний екстракт, соєву макуху, екстракт картоплі і тому подібне. Якщо бажано, можуть міститися інші поживні речовини (наприклад, неорганічні солі (наприклад, хлористий кальцій, однозаміщений фосфат натрію, хлористий магній), вітаміни, антибіотики (наприклад, тетрациклін, неоміцин, ампіцилін, канаміцин і тому подібне). Культивування трансформанту проводиться способом, який відомий сам по собі. Умови культивування, наприклад, температура, pH середовище і час культивування вибираються придатним чином. Наприклад, якщо хазяїн являє собою клітину тварини, як середовище може бути використане середовище MEM, що містить близько 5 % до 20 % фетальної бичачої сироватки (Science, Vol. 122, р. 501, 1952), середовище DMEM (Virology, Vol.8, р. 396, 1959), середовище RPMI 1640 (J. Am. Med. Assoc, Vol. 199, р. 519, 1967), середовище 199 (Proc. Soc. Exp. Biol. Med., Vol. 73, р. l, 1950) і тому подібне. pH середовища, переважно, складає близько 6 до 8, культивування звичайно проводиться при близько 30 °C до 40 °C протягом близько 15 до 72 годин, а аерація або перемішування можуть проводитися, якщо потрібно. Коли хазяїн являє собою клітину комахи, наприклад, може бути згадане середовище Грейса, яке містить фетальну бичачу сироватку (Proc. Natl. Acad. Sci. USA, Vol. 82, р. 8404, 1985) і тому подібне, а її pH складає, переважно, від близько 5 до 8. Культивування звичайно проводиться при близько 20 °C до 40 °C протягом 15-100 годин, а, якщо потрібно, можуть бути виконана аерація або перемішування. Якщо хазяїн являє собою бактерію, актиноміцет, дріжджі або нитчастий гриб, придатне, наприклад, рідке середовище, яке містить вищезазначені джерела поживних речовин. Середовище, яке має pH 5-8 є переважним. Коли хазяїн являє собою Е. coli, переважні приклади середовища включають середовище LB, середовище M9 (Miller et al., Exp. Mol. Genet, Cold Spring Harbor Laboratory, р. 431, 1972) і тому подібне. У цьому випадку культивування звичайно проводять при 14-43 °C протягом близько 3-24 годин, тоді як аерація або перемішування виконується, якщо необхідно. Коли хазяїн являє собою бактерію роду Bacillus, культивування звичайно проводили при 30-40 °C протягом близько 16-96 годин, тоді як аерація або перемішування виконується, якщо необхідно. Коли хазяїн являє собою дріжджі, приклади середовища включають мінімальне середовище Буркхолдера (Bostian, Proc. Natl. Acad. Sci. USA, Vol. 77, р. 4505, 1980), а pH середовища бажано 5-8. Культивування звичайно проводять при близько 20-35 °C протягом близько 14-144 годин, тоді як аерація або перемішування виконується, якщо необхідно. Фрагмент Fab' антитіла проти NGF людини за даним винаходом може бути отриманий, переважно, виділений і очищений, із культури трансформанту, як описано вище. Приклади способу виділення і очищення включають способи, основані на відмінностях розчинності, таких 10 UA 111372 C2 5 10 15 20 25 30 35 40 45 50 55 60 як висолювання і осадження розчинника; способи, основані на відмінностях молекулярної маси, такі як діаліз, ультрафільтрація, гель-фільтрація і електрофорез в додецилсульфатполіакридамідному гелі; способи, основані на відмінностях електричного заряду, такі як іонообмінна хроматографія і хроматографія на гідроксил апатиті; способи, основані на специфічній афінності, такі як афінна хроматографія; способи, основані на відмінностях гідрофобності, такі як зворотнофазова хроматографія високого дозволу; способи, основані на відмінностях ізоелектричної точки, такі як ізоелектричне фокусування і тому подібні. Хоч даний винахід, загалом описано вище, конкретні приклади представлені в даному документі тільки для кращого розуміння даного винаходу. Ці приклади направлені тільки на ілюстративні цілі і не обмежують сферу даного винаходу. Приклади На стадіях, які використовують комерційно доступні набори або реагенти, експерименти виконували відповідно до прикладених протоколів, якщо не позначене інше. Приклад 1: Імунізація мишей VelocImmune Антитіло проти NGF людини було отримане імунізацією мишей VelocImmune. Щоб збільшити різноманітність отримуваних антитіл, автори даного винаходу перевірили множину способів імунізації, шляхів введення, ад'ювантів, періодів імунізації і тому подібного. Використовуючи βNGF людини (R&D Systems, Inc.) як імуноген, автори даного винаходу перевірили спосіб імунізації, в якому βNGF людини був використаний для імунізації шляхом змішування із ад'ювантом після розчинення, і спосіб імунізації, в якому βNGF людини використовували шляхом змішування його із ад'ювантом після термічної денатурації (обробка при 80 °C протягом 10 хвилин в 0,5 % розчині лаурилсульфату натрію (SDS)). Як шляхи введення перевіряли введення в подушечку стопи і інтраперитонеальне введення. Як ад'ювант перевіряли TiterMax Gold (CytRx Corporation), повний ад'ювант Фрейнда (Sigma), неповний ад'ювант Фрейнда (Sigma), і ад'ювант RIBI (Corixa Corporation). Як імуноактиватор, який додається, перевіряли олігонуклеотид CpG і гель фосфату алюмінію (BRENNTAG). Як період імунізації перевіряли 3-14 тижнів. Після того, як тварина була імунізована декілька разів, кров збирали із хвостової вени миші, а титр контролювали. Таким чином відбирали мишей VelocImmune, продукуючих антитіло, яке зв'язує NGF людини. Титр вимірювали із використанням стандартного способу ELISA. βNGF людини додавали в планшет Maxisorp 384 (Nunc) 10 нг/ямку і іммобілізували шляхом інкубування протягом ночі при 4 °C. На наступний день планшет відмивали один раз відмивальним розчином (TBST: трісбуфер (TBS), який містить 0,05 % Tween-20), потім туди додавали блокуючий засіб (TBST, який містить 20 % Blocking One (Nacalai Tesque, Inc.)), і планшет залишали при кімнатній температурі на годину. Після однократного відмивання планшета відмивальним розчином TBST зібрану кров серійно розбавляли і додавали у планшет. Через годину інкубації при кімнатній температурі планшет відмивали три рази відмивальним розчином TBST, і туди додавали HRP-козячі антитіла проти Ig миші (Zymed), які були розбавлені в 2000 разів відмивальним розчином TBST, що містить 5 % Blocking One. Через годину інкубації при кімнатній температурі планшет відмивали три рази відмивальним розчином TBST. У планшет додавали хромогенний реагент TMB (SUMITOMO BAKELITE CO., LTD) і залишали стояти при кімнатній температурі протягом 10 хвилин, потім туди додавали стоп-розчин (2 моль/л сірчаної кислоти), щоб зупинити реакцію, і вимірювали поглинання при 450 нм. Приклад 2: Отримання гібридоми, продукуючої антитіло проти NGF людини Миші, відібрані шляхом підтвердження підвищення титру антитіл, були заключно імунізовані (внутрішньовенне або інтраперитонеальне введення антигену). Селезінку, лімфатичний вузол або тому подібне імунізованих мишей виділяли звичайним способом, щоб зібрати лімфоцити, і лімфоцити зливали із клітинами мієломи миші SP2/0, отримуючи таким чином гібридому. Гібридома зазнавала серійного розведення і моноклонування, а антитіло очищали із супернатанта за допомогою колонок із білком А або білком G (GE Healthcare Japan). Приклад 3: Оцінка інгібування зв'язування NGF-trkA βNGF людини (R&D Systems, Inc.) дозволяли прореагувати із EZ-LINK 5(біотинамідо)пентиламіном (Pierce) при кімнатній температурі протягом 30 хвилин в темному місці, щоб провести мічення біотином, а надлишок біотину видаляли за допомогою знесолювальних колонок, отримуючи, таким чином, βNGF людини, мічений біотином. У нижченаведених Прикладах 6 і 7, підтверджено, що отриманий βNGF людини, мічений біотином, має таку ж біологічну активність, як оригінальний βNGF людини. Інгібіторну активність вимірювали нижченаведеним способом. trkA людини (R&D Systems, Inc.) додавали в білий планшет Maxisorp 384 (Nunc) по 60 нг/ямка і іммобілізували шляхом інкубування протягом ночі при 4 °C. На наступний день планшет відмивали один раз 11 UA 111372 C2 5 10 15 20 25 30 35 40 45 50 55 відмивальним розчином TBST, а потім додавали в нього блокуючий засіб (TBST, який містить 20 % Blocking One (Nacalai Tesque, Inc.)), і планшет залишали стояти при кімнатній температурі протягом години. Потім суміш, отриману змішуванням міченого біотином βNGF людини (0,2 мкг/мл), отриманого, як описано вище, із антитілом, отриманим в Прикладі 2, додавали в планшет із іммобілізованим trkA, який пройшов блокування. Через годину інкубації при кімнатній температурі планшет три рази відмивали відмивальним розчином TBST і туди додавали стрептавідин, мічений лужною фосфатазою (Pierce). Через годину інкубації при кімнатній температурі планшет відмивали три рази відмивальним розчином TBST, а потім додавали APU4 (BioFx), який являє собою реагент для детектування хемілюмінесценції, і вимірювали кількість хемілюмінесценції лічильником EnVision (PerkinElmer Co., Ltd.). Приклад 4: Оцінка міжвидової перехресної реактивності Якщо антитіло має перехресну реактивність із βNGF миші, можливо виконати оцінку ефективності лікарського препарату на моделі патології миші із використанням антитіла. У результаті, міченому біотином βNGF миші готували способом за Прикладом 3 із використанням βNGF миші (R&D Systems, Inc.), за допомогою якого оцінювали перехресну реактивність антитіла проти βNGF миші. Приклад 5: Оцінка специфічності зв'язування Специфічність зв'язування антитіла проти NGF оцінювали за допомогою способу ELISA, описаного в Прикладі 1. Конкретно, використовували NT-3 як сімейство молекул, що демонструють найвищу гомологію із NGF. NT-3 людини (PeproTech) додавали в планшет способом за Прикладом 1 20 нг/ямка і іммобілізували на планшеті, таким чином дозволяючи виконати оцінку. Приклад 6: Оцінка інгібування сигналізації NGF-trkA Оцінювали інгібіторну активність антитіла проти NGF-trkA сигналізації. NGF підвищує 2+ внутрішньоклітинну концентрацію кальцію (Ca ) через trkA як рецептор NGF. Загалом, зміна 2+ концентрації Ca може бути оцінена в присутності кальцієвого індикатора за допомогою 2+ системи вимірювання концентрації внутрішньоклітинного кальцію (Ca ) (FLIPR; Molecular Devices, LLC). Інгібіторну активність вимірювали нижченаведеним способом. Клітини HEK293 (WO2009/054468), в яких викликана стабільна експресія trkA людини, розносили в покриті полі4 D-лізином ямки 96-ямкового планшета (Becton, Dickinson and Company, Japan) 2×10 клітин/ямку за день до експерименту і культивували протягом ночі. На наступний день культуральне середовище замінювали на культуральне середовище DMEM (що містить 3,6 мМ гідрату оксиду натрію (NaOH) і 2,5 мМ пробенециду (Sigma)), що містить кальцієвий індикатор (Fluo4-AM; Dojindo) і залишали стояти при 37 °C протягом 30 хвилин. Потім клітини двічі відмивали відмивальним розчином (збалансованим сольовим розчином Хенкса) (HBSS) (20 мМ 2-[4-(2гідроксіетил)-1-піперазиніл]етан сульфонова кислота (HEPES), 3,6 мМ гідрату оксиду натрію, 2,5 мМ пробенециду (Sigma) і 0,1 % бичачого сироваткового альбуміну), і культуральне середовище замінювали цим відмивальним розчином по 150 мкл/ямку. Планшет із клітинами вміщували в FLIPR. Керуючи FLIPR, змішаний розчин антитіла, отриманий за Прикладом 2, і NGF додавали в планшет по 50 мкл/ямку (кінцева концентрація NGF-100 нг/мл) і вимірювали 2+ зміну внутрішньоклітинної концентрації Ca . Різницю між максимальним і мінімальним 2+ значеннями зміни внутрішньоклітинної концентрації Ca розраховували і зберігали як дані вимірювання. Приклад 7: Оцінка інгібування NGF-залежної сигналізації виживання клітин Коли клітини PC 12, природно експресуючі trkA і p75 рецептори, культивуються в безсироваткових умовах, NGF дає можливість клітинам виживати протягом декількох днів. Нижченаведеним способом оцінювали інгібіторну активність антитіла проти NGF-залежної сигналізації виживання клітин. Клітини PC 12 висівали в 96-ямковий покритий колагеном планшет (ASAHI TECHNO CO., 4 LTD.) по 1×10 клітин/ямку і інкубували протягом ночі в культуральному середовищі F12K (Invitrogen), що містить 2,5 % фетальної бичачої сироватки і 15 % інактивованої кінської сироватки (Invitrogen) при 37 °C під 5 % CO2. На наступний день культуральне середовище замінювали на тільки F12K в безсироваткових умовах. Через годину туди додавали антитіло і βNGF людини (кінцева концентрація 50 нг/мл), після чого культивували протягом 72 годин. Потім культуральний розчин видаляли за допомогою аспіратора і вимірювали життєздатність клітин за допомогою реагенту (CellTiter Glo; аromega Corporation), що кількісно визначає ендогенну АТФ клітин. Приклад 8: Отримання фрагмента Fab 12 UA 111372 C2 5 10 15 20 25 30 35 40 45 50 55 60 Гель, із яким зв'язаний переварюючий фермент папаїн, додавали до 1 мг/мл антитіла із використанням набору препарату Fab (Pierce), після чого оброблявся при 37 °C протягом 3 годин. Розчин, що пройшов реакцію, наносили на колонку із білком G (GE Healthcare Japan), розщеплений Fc і непрореагований IgG видаляли абсорбцією на колонці, а елюйовану фракцію збирали, отримуючи, таким чином, фрагменти Fab. Отримані фрагменти Fab оцінювали за допомогою експериментів, описаних в Прикладах 3, 6 і 7. Внаслідок оцінки Прикладів 3-8, було підтверджено, що антитіло, яке називається 1-15 (химерне антитіло) має високу нейтралізуючу активність, міжвидову перехресну реактивність і специфічність зв'язування і зберігає високу нейтралізуючу активність, навіть коли це антитіло присутнє в формі фрагмента моновалентного антитіла. Приклад 9: Визначення послідовності гена антитіла Для ідентифікованого антитіла 1-15 автори даного винаходу клонували гени, що кодують важкі ланцюги і легкі ланцюги антитіла із гібридом. Конкретно, клон гібридоми отримували в 5 кількості 1×10 або більше і суспендували в буфері RLT, який включений в набір RNeasy Mini Kit (QIAGEN), а потім клітини були дезінтегровані за допомогою QIAshredder (QIAGEN). Потім відповідно до протоколу екстрагували РНК і, використовуючи екстраговану РНК як матриця, синтезували кДНК за допомогою набору для ампліфікації ДНК (SMARTer RACE cDNA Amplification Kit; Clontech). Полімеразну ланцюгову реакцію (ПЛР) виконували за допомогою отриманої кДНК, подовжуючи і ампліфікуючи таким чином варіабельну ділянку важких ланцюгів і легких ланцюгів. Аналіз послідовності виконували безпосередньо на продуктах ПЛР за допомогою сиквенатора (ABI PRISM 3100; Applied Biosystems). У доповнення продукти ПЛР рекомбінували із вектором субклонування продукту ПЛР, таким як pCR3.1-TOPO (Invitrogen), після чого аналізували послідовність гена, в результаті визначаючи послідовність. Певна послідовність основ варіабельної ділянки важкого ланцюга антитіла 1-15 показана в SEQ ID NO:1, а її амінокислотна послідовність показана в SEQ ID NO:2.Далі, послідовність основ варіабельної ділянки легкого ланцюга антитіла показана в SEQ ID NO:3, а її амінокислотна послідовність показана в SEQ ID NO:4. CDR1, CDR2 і CDR3 варіабельної ділянки важкого ланцюга антитіла 1-15 являють собою ділянки в положеннях від 31 до 35, 50-65 і 95-102 варіабельної ділянки важкого ланцюга, засновуючись на нумерації Кебата, відповідно, які складаються із амінокислотних послідовностей в положенні від 31 до 35, 50-65 і 98-110 в SEQ ID NO:2, відповідно. CDR1, CDR2 і CDR3 варіабельної ділянки легкого ланцюга антитіла 1-15 являють собою ділянку в положенні від 24 до 34, 50-56 і 89-97 варіабельної ділянки легкого ланцюга, засновуючись на нумерації Кебата, відповідно, які складаються із амінокислотних послідовностей в положенні від 24 до 39, 55-61 і 94-102 в SEQ ID NO:4, відповідно. Приклад 10: Отримання мутанта сайта глікозилування варіабельної ділянки Амінокислоти (SEQ ID NO:2) варіабельної ділянки важкого ланцюга антитіла 1-15, описаного вище, включають послідовність мотиву глікозилування N-типу, N-X-(Т/S). Конкретно, у варіабельній ділянці важкого ланцюга, показаній в SEQ ID NO:2, Asn (N52) в положенні 52, засновуючись на нумерації Кебата, відповідає сайту глікозилування. Відомо, що глікозилування антитіла відбувається в ході культивування клітини, якщо антитіло має сайт глікозилування, залежно від умов культивування або хазяїна, експресуючого антитіло. Іншими словами, навіть серед однаково отриманих клітин, продукуючих антитіло, міра глікозилування, ймовірно, варіює залежно від умов культивування (таких як культуральне середовище і щільність клітин), що приводить до можливості того, що можливі труднощі із отриманням із антитіла лікарського засобу однакової якості. Тому автори даного винаходу отримали 1-15(N52D), який був отриманий шляхом введення мутації в N52 варіабельної ділянки важкого ланцюга антитіла 1-15. Послідовність основ варіабельної ділянки важкого ланцюга отриманого 1-15(N52D) показана в SEQ ID NO:5, а її амінокислотна послідовність показана в SEQ ID NO:6. CDR1, CDR2 і CDR3 варіабельної ділянки важкого ланцюга антитіла 1-15(N52D) являє собою ділянки в положенні від 31 до 35, 50-65 і 95-102 варіабельної ділянки важкого ланцюга, засновуючись на нумерації Кебата, відповідно, який містить амінокислотні послідовності в положенні від 31 до 35, 50-65 і 98-110 в SEQ ID NO: 6, відповідно. Приклад 11: Отримання повністю людського фрагмента Fab' антитіла Використовуючи варіабельну ділянку важкого ланцюга 1-15 і 1-15(N52D), описаних вище, і варіабельну ділянку легкого ланцюга 1-15, отримували відповідні повністю людські фрагменти Fab' антитіла. Сигнальна послідовність була з'єднана із 5'-стороною відповідної варіабельної ділянки важкого ланцюга генів 1-15 і 1-15(N52D), а константна ділянка гена Igγ1 людини (Man Sung Co. et al., (1992) J Immunol. Vol. 148(4):1149-1154) була з'єднана із її 3'-стороною, відповідно. Цей ген фрагмента важкого ланцюга був вбудований в GS вектор pEE6.4 (Lonza Biologies). У той же 13 UA 111372 C2 5 10 15 20 25 30 35 40 45 50 55 60 час, щоб експресувати гени як фрагмент Fab', стоп-кодон був вбудований після кодону Cys в положенні 226 (відповідному Cys в положенні 230 амінокислотної послідовностей SEQ ID NO:8 і SEQ ID NO:10, описаних нижче), засновуючись на індексі EU, в гені константної ділянки важкого ланцюга. У доповнення, сигнальна послідовність була з'єднана із 5'-стороною варіабельної ділянки легкого ланцюга гена 1-15, а константна ділянка гена κ-ланцюги людини (Man Sung Co. et al., описано вище) була з'єднана із її 3'-стороною, відповідно. Цей ген легкого ланцюга був вбудований в GS вектор pEE12.4 (Lonza Biologics). Фрагмент Fab' експресували двома шляхами, включаючи короткочасну експресію і постійну експресію. При короткочасній експресії, клітини FreeStyle 293 (Invitrogen), які культивувалися в середовищі експресії FreeStyle 293 (Invitrogen) при близько 1000000 клітин/мл, були трансфіковані вищеописаними векторами GS фрагмента важкого ланцюга і легкого ланцюга за допомогою 293fectin (Invitrogen), після чого культивувалися протягом семи днів. При постійній експресії обидва вектори GS, описані вище, розщеплювалися ферментами рестрикції NotI і PvuI, після чого йшло лігування за допомогою набору для лігування ДНК (TAKARA BIO INC), в результаті чого конструювався вектор GS, в який вбудовані гени і фрагмента важкого ланцюга, і легкого ланцюга. Цей вектор експресії кодує фрагмент важкого ланцюга, легкий ланцюг і глютамін синтетазу і експресується після трансфекції в клітини CHO-K1-SV. Після того, як вектори експресувалися відповідними шляхами, супернатант культури очищали за допомогою KappaSelect (GE Healthcare Japan), із отриманням відповідних фрагментів Fab'. Послідовність основ фрагмента важкого ланцюга повністю людського фрагмента Fab' антитіла 1-15 (що також позначається як 1-15-Fab') показана в SEQ ID NO:7, а його амінокислотна послідовність показана в SEQ ID NO:8, відповідно. Послідовність основ фрагмента важкого ланцюга отриманого повністю людського фрагмента Fab' антитіла 1-15(N52D) (який також позначається як 1-15(N52D)-Fab'), показана в SEQ ID NO:9, а його амінокислотна послідовність показана в SEQ ID NO:10, відповідно. Легкий ланцюг відповідних фрагментів Fab' однаковий, а їх послідовність основ показана в SEQ ID NO:11, а їх амінокислотна послідовність показана в SEQ ID NO:12, відповідно. Приклад 12: Оцінка нейтралізуючої активності і рівня експресії повністю людського фрагмента Fab' антитіла 1-15-Fab' і 1-15(N52D)-Fab', отримані в Прикладі 11, були оцінені за допомогою експериментів, описаних в Прикладах 3 і 6. В експерименті за Прикладом 3 IC50 1-15-Fab' і 115(N52D)-Fab' становила 0,17 мкг/мл і 0,18 мкг/мл, відповідно. У експерименті за Прикладом 6 IC50 1-15-Fab' і 1-15(N52D)-Fab' становила 0,021 мкг/мл і 0,018 мкг/мл, відповідно. На основі цих результатів було підтверджено, що нейтралізуюча активність 1-15(N52D)-Fab' підтримувалася на майже такому ж рівні, що у немодифікованого 1-15-Fab', і що нейтралізуюча активність не змінюється, навіть якщо введена мутація. У доповнення, відповідні фрагменти Fab' експресувалися шляхом постійної експресії, і вимірювали кількість антитіла, продукованого в супернатанті культури клітинного пулу стабільної експресії. У результаті, концентрації відповідних супернатантів культури 1-15-Fab' і 115(N52D)-Fab' становили 86 мг/л і 106 мг/л, відповідно, що показує, що 1-15(N52D)-Fab' є антитілом, яке продукується в більшій кількості, ніж немодифікований 1-15-Fab'. Приклад 13: Отримання PEG-илованого фрагмента Fab' і оцінка нейтралізуючої активності Далі, автори даного винаходу ввели PEG в 1-15(N52D)-Fab'. Після очищення за допомогою KappaSelect фрагмент Fab' піддавався реакції відновлення за допомогою гідрохлориду TCEP (Tris(2-карбоксіетил)фосфін HCl), внаслідок чого фрагмент Fab' перетворювався в PEG-иловану структуру. Конкретно, TCEP додавали до розчину фрагмента Fab', чию концентрацію встановлювали на рівні 1,2 мг/мл за допомогою 20 мМ натрій-фосфатного буфера (pH 6,8), так що TCEP становила 1 мМ, після чого проходила реакція при 37 °C протягом 2 годин, а отримане розбавляли 20 мМ натрій-ацетатним буфером (pH 5,0), щоб встановити pH. Цей розчин адсорбувався на катіонообмінній смолі (SP-5PW; TOSOH CORPORATION) і піддавався елюції в градієнті NaCl, і основний пік збирали. Отриманий фрагмент Fab' розбавляли 20 мМ натрійфосфатного буфера (pH 6,8), так що вихід становив 1 мг/мл, pH встановлювали на 6,8, а потім розчин залишали стояти при 4 °C на ніч або більше, так що він окислювався природним чином. 40 кДа PEG (SUNBRIGHT GL2-400MA; NOF CORPORATION) додавали до розчину, щоб отримати кінцеву концентрацію 0,1 мМ, і розчин залишали стояти при кімнатній температурі протягом 2 годин, а потім при 4 °C протягом ночі. Цей PEG, який має малеімідну групу на кінці, швидко реагує із Cys (C226, засновуючись на індексі EU; Cys в положенні 230 в SEQ ID NO:10) карбоксильного кінця фрагмента важкого ланцюга. Розчин розбавляли 20 мМ натрій-ацетатним буфером (pH 4,5), щоб встановити pH, а потім адсорбували знову на катіонообмінній смолі (SP 14 UA 111372 C2 5 10 15 20 25 30 35 40 45 50 55 5PW; TOSOH CORPORATION), отримане піддавали елюції градієнтом NaCl, і головний пік збирали. Отриманий PEG-илований фрагмент Fab' очищали. Цей PEG-илований 1-15(N52D)Fab' також називається 1-15(N52D)-Fab'-PEG. Нейтралізуюча активність не-PEG-илованого і PEG-илованого 1-15(N52D)-Fab' оцінювали способом, показаним в Прикладі 3. У результаті, тоді як IC50 1-15(N52D)-Fab' становить 0,15 мкг/мл, IC50 1-15(N52D)-Fab'-PEG становить 0,12 мкг/мл (по концентрації фрагмента Fab'), в результаті підтвердилося, що нейтралізуюча активність 1-15(N52D)-Fab' не змінюється, навіть якщо доданий PEG. У доповнення, за допомогою способу за Прикладом 6 1-15(N52D)-Fab'-PEG порівняли із антитілом проти NGF людини попереднього рівня техніки - танезумабом, по нейтралізуючій активності по відношенню до NGF людини і миші. У результаті, тоді як IC50 1-15(N52D)-Fab'PEG становила 0,051 мкг/мл для NGF людини і 0,069 мкг/мл для NGF миші, IC50 танезумабу становила 0,17 мкг/мл для NGF людини і 0,23 мкг/мл для NGF миші. Отже, підтверджено, що нейтралізуюча активність 1-15(N52D)-Fab'-PEG в близько 3,3 разу вище, ніж танезумабу, по відношенню до NGF людини і миші. Приклад 14: Аналіз на знеболюючий ефект на моделі артриту, викликаного ад'ювантом, у миші Автори даного винаходу оцінювали знеболюючий ефект вищезазначеного 1-15(N52D)-Fab'PEG на моделі артриту, викликаного ад'ювантом, у миші. 1-15(N52D)- Fab'-PEG вводили мишам внутрішньовенно (0,03 мг/кг, 0,1 мг/кг і 0,3 мг/кг; доза становила 10 мл/кг), і 1 мг/мл повного ад'юванта Фрейнда (Sigma) вводили в кількості 25 мкл в подушечку передньої лапи, щоб викликати біль. Через 24 години після того, як був індукований біль, протягом 20 хвилин вимірювали поведінкову реакцію у вигляді вертикальної стійки (на задніх лапах). Конкретно, за допомогою системи моніторинга спонтанної активності SUPERMEX (Muromachi Kikai Co., Ltd.), кількість часу спонтанного положення миші у вертикальній стійці протягом 20 хвилин вимірювали за допомогою сенсора інфрачервоного випромінювання (Matson et al., JPET 320:194-201, 2007). Як порівняльний контроль використовували антитіло танезумаб, яке стосується попереднього рівня техніки. У результаті, тоді як внутрішньовенне введення танезумабу викликало знеболюючий ефект із ED50=0,27 мг/кг, 1-15(N52D)-Fab'-PEG викликав знеболюючий ефект із ED50=0,11 мг/кг, що показує ефективність, більшу в близько 3 рази. Приклад 15: Аналіз на перенесення через плаценту щура 1-15(N52D)-Fab'-PEG або танезумаб вводили внутрішньовенно (100 мг/кг, доза становила 10 мл/кг) самицям щурів на 17-й день вагітності. Через три дні вимірювали концентрацію антитіла в крові матері і плода. Концентрацію антитіла вимірювали нижченаведеним чином. βNGF людини (R&D Systems, Inc.) додавали в 96-ямковий планшет MULTI-ARRAY plate (Standard) (Meso Scale Discovery) по 25 нг/ямку і іммобілізували, залишаючи стояти при кімнатній температурі протягом години. Планшет відмивали три рази відмивальним розчином TBST і туди додавали блокуючий засіб (1 % казеїн TBS; Thermo Fisher) і залишали стояти при кімнатній температурі протягом години. Потім, зразок крові, отриманий шляхом розбавлення зібраної тим часом крові, додавали у планшет із іммобілізованим βNGF людини, що зазнав блокування. Після того, як суміш реагувала при кімнатній температурі протягом 60 хвилин при струшуванні, планшет відмивали три рази відмивальним розчином TBST, а потім туди додавали мічене біотином κ-антитіло людини (Immuno-Biological Laboratories Co., Ltd.). Після того, як суміш прореагувала протягом 60 хвилин при кімнатній температурі при струшуванні, планшет три рази відмивали відмивальним розчином TBST і туди додавали SULFO-TAG-мічений стрептавідин (Meso Scale Discovery). Після того, як суміш прореагувала протягом 60 хвилин при кімнатній температурі при струшуванні, планшет три рази відмивали відмивальним розчином TBST, туди додавали Read Buffer Т (Meso Scale Discovery) і вимірювали величину електрохімічної люмінесценції за допомогою SECTOR Imager 6000 (Meso Scale Discovery). Цей експеримент виконували на трьох щурах-матерях. Через три дні концентрація антитіл 115(N52D)-Fab'-PEG і танезумабу в крові щурів-матерів склала в середньому 12,1 мкг/мл і 7,1 мкг/мл, відповідно. Тим часом, що стосується концентрації антитіл в крові 3 плодів, отриманих від кожної із щурів-матерів (всього 9 плодів), тоді як концентрація 1-15(N52D)-Fab'-PEG в крові становила 0,01 мкг/мл (межа кількісного визначення) або менше у всіх плодах, концентрація танезумабу в крові склала в середньому 5,39 мкг/мл. Тобто, тоді як танезумаб переносився в плід на рівні 75,9 %, 1-15(N52D)-Fab'-PEG переносився в плід на рівні 0,08 % (межа визначення) або менше. Ці результати передбачають, що 1-15(N52D)-Fab'-PEG являє собою медичний засіб, 15 UA 111372 C2 5 10 15 20 який має чудову якість по безпеці за рахунок усунення ризику побічних дій, викликаних в плоді внаслідок інгібування NGF. Приклад 16: Формування імунного комплексу (IC) Оцінювали, чи утворить IC 1-15(N52D)-Fab'-PEG або наскільки великий розмір сформованого IC. Конкретно, 1 мг/мл 1-15(N52D)-Fab'-PEG змішували із βNGF людини (R&D Systems, Inc.) в молярному співвідношенні 1:1, після чого слідувала інкубація при кімнатній температурі протягом 3 годин, із утворенням в результаті IC. Розмір частинок і розподіл IC в цьому реакційному розчині вимірювали за допомогою Zetasizer Nano (Malvern) як інструмент, який вимірює динамічне розсіювання світла. Для аналізу використовували Zetasizer v6.01 (Malvern), а розмір частинок відображався по значенню (d. нм), що аналізувалися в значеннях інтенсивності (%). Виміряні розміри частинок показані в нижченаведеній Таблиці 1. У цьому експерименті розмір частинок тільки NGF склав в середньому 6,2 нм. У випадку тільки танезумабу, піковий розмір спостерігався на 11,7 нм. Коли вимірювали IC, який утворився при інкубації танезумабу і NGF, піковий розмір зміщався до 91,3 нм. З іншого боку, коли антитіло, не зв'язане із NGF, використовувалося як контрольне антитіло, піковий розмір становив ті ж 11,7 нм. Розглядаючи зміни величини, передбачалося, що кожний танезумаб і NGF перетворюється в макромолекулу в результаті комбінування множини молекул, в результаті чого утвориться IC великого розміру. По контрасту із цим, коли вимірювали формування IC 1-15(N52D)-Fab'-PEG і NGF, піковий розмір зміщався із 18,1 нм до 24,4 нм. При розгляді зміни величини цей результат відображає тільки зв'язування одна до однієї і передбачає, що формування просторової структури із 115(N52D)-Fab'-PEG не відбувається. Таблиця 1 Розмір частинок Піковий (d. нм) Середній (d. нм) 11,7 12,8 11,7 12,6 11,7 13,0 91,3 99,2 18,1 19,8 24,4 26,0 Зразок Контрольний IgG Танезумаб 1-15(N52D)-Fab'-PEG 25 30 35 40 45 50 IgG IgG+rhNGF IgG IgG+rhNGF IgG IgG+rhNGF Приклад 17: Розподіл властивостей у пошкодженій тканині Емульсію, яка включає колаген (бичачий колаген із суглоба тип 2, 10 мг/мл; Collagen technique workshop) і повний ад'ювант Фрейнда (0,5 мг/мл; DIFCO) у співвідношенні 1:1 вводили підшкірно у гомілковостопний суглоб миші DBA/1, в результаті отримуючи модель артриту, індукованого колагеном. Через чотири тижні після індукції артриту емульсію вводили знову, щоб викликати артрит. Міру розвитку артриту (оцінка і величина пухлини) у передніх кінцівках спостерігали в групі мишей. Флуоресцентне мічення виконували на 1 мг/мл PBS розчинах 115(N52D)-Fab'-PEG і танезумабу із використанням набору SAIVI™ Rapid Antibody Labeling Kit, Alexa Fluor (зареєстрована торгова марка) 680 (Life Technologies Corporation). 2 мг/кг (N=4) кожного розчину вводили у хвостову вену. Накопичення флуоресценції, яка накопичується у пухлій подушечці стопи, аналізували за допомогою IVIS Spectrum (Caliper/Xenogen), і інтенсивність флуоресценції вказувалася як чисельні значення. Фігура показує зміну у часі кількості антитіла, яке утримується в підошві. 1-15(N52D)-Fab'PEG демонструвало ефект утримання у пошкодженій тканині більш ясно в порівнянні із танезумабом, і цей ефект зберігався протягом 48 годин. Виходячи із цього результату, 115(N52D)-Fab'-PEG розцінюється як ефективно викликаюче знеболюючий ефект, і очікується, що це антитіло в малій дозі здатне викликати знеболюючий ефект, рівний або більший, ніж ефект лікарського засобу. Також очікується, що 1-15(N52D)-Fab'-PEG може бути чудовим відносно безпеки медичного засобу, оскільки це антитіло селективно накопичується у місці пошкодження. Приклад 18: Отримання амінокислотного аддукту фрагмента Fab' Щоб покращити ефективність введення PEG у 1-15(N52D)-Fab', автори даного винаходу отримали фрагменти Fab', які були отримані шляхом додавання двох аланінів (А) або пролінів (Р) після залишку Cys у карбоксильному кінці фрагмента важкого ланцюга і виконали експресію і очищення. Такий же спосіб, як в Прикладі 11, був використаний для отримання цих фрагментів Fab'. За цим способом кодон двох аланіну або проліну вбудовується після кодону залишку Cys 16 UA 111372 C2 5 10 15 20 25 30 35 40 45 на карбоксильному кінці фрагмента важкого ланцюга 1-15(N52D)-Fab', а стоп-кодон вбудовується після цього кодону. Послідовність основ фрагмента важкого ланцюга 1-15(N52D)-Fab' із доданим аланіном (повністю людський 1-15(N52D-A) фрагмент Fab' антитіла; також позначається як 1-15(N52D-A)Fab'), показана в SEQ ID NO:13, а її амінокислотна послідовність показана в SEQ ID NO:14, відповідно. Послідовність основ фрагмента важкого ланцюга із додаванням проліну 1-15(N52D)Fab' (повністю людський 1-15(N52D-P) фрагменти Fab' антитіла; також позначається як 115(N52D-P)-Fab'), показана в SEQ ID NO:15, а її амінокислотна послідовність показана в SEQ ID NO:16, відповідно. Легкий ланцюг відповідних фрагментів Fab' такий же, як легкий ланцюг 115(N52D)-Fab', а послідовність основ і її амінокислотна послідовність показані в SEQ ID NO:11 і SEQ ID NO:12, відповідно. Приклад 19: Отримання PEG-илованого 1-15(N52D-A)-Fab' і оцінка нейтралізуючої активності і фармакологічна оцінка 40 кДа PEG кон'югували із 1-15(N52D-A)-Fab' таким же чином, як в Прикладі 13, в результаті отримуючи PEG-илований 1-15(N52D-A)-Fab' (тут і далі також позначається як 1-15(N52D-A)Fab'-PEG). Нейтралізуючу активність 1-15(N52D-A)-Fab'-PEG оцінювали за способом, описаним в Прикладі 3. У результаті, тоді як IC50 1-15(N52D)-Fab'-PEG становила 0,081±0,034 мкг/мл, IC50 1-15(N52D-A)-Fab'-PEG становила 0,074±0,021 мкг/мл. У доповнення, IC50 танезумабу в той же час становила 0,410±0,099 мкг/мл. Далі, нейтралізуючу активність порівнювали за допомогою способу, описаного в Прикладі 6. У результаті, тоді як IC50 1-15(N52D)-Fab'-PEG становила 0,061±0,011 мкг/мл для NGF людини, IC50 1-15(N52D-A)-Fab'-PEG становила 0,064±0,028 мкг/мл. Далі, знеболюючий ефект на моделі артриту, викликаного ад'ювантом, оцінювали за допомогою способу, описаного в Прикладі 14. У результаті, 1-15(N52D-A)-Fab'-PEG продемонстрував знеболюючий ефект на моделі артриту. Наведені вище результати підтверджують, що навіть при додаванні двох аланінів після залишку Cys на карбоксильному кінці, нейтралізуюча активність і фармакологічна активність не змінені. Приклад 20: Оцінка афінності зв'язування 1-15(N52D-A)-Fab'-PEG Термодинаміку зв'язування 1-15(N52D-A)-Fab'-PEG і танезумабу із антигеном NGF досліджували за допомогою ізотермічної титраційної калориметрії (ITC) (Scappaticci FA, J Natl Cancer Inst. 2007, 99:1232-9. Velazquez-Compoy А. et al, Curr Protoc Cell Biol. 2004, Chapter 17, Unit 17-18). Все вимірювання цілком виконували за допомогою Auto-iTC 200, зробленого GE healthcare. У ході експеримента виконували аналіз при нижченаведених концентраціях, так щоб оцінити зв'язування моновалентного фрагмента Fab' із однією молекулою антигену, а весь аналіз проводили в розчині PBS. Конкретно, 44 мкМ βNGF людини (R&D Systems, Inc.), які містяться в титрувальному шприці, титрували в калориметричну комірку, заповнений зразком антитіла (3 мкМ 1-15(N52D-A)-Fab'-PEG або 1,5 мкМ танезумабу) по 1,4 мкл 30 разів, і детектувалася кількість тепла, продукована в результаті. Отримані дані аналізували за допомогою моделі моносайтового зв'язування за допомогою програмного забезпечення, яке додається до приладу, таким чином розраховуючи афінність зв'язування (Kd), співвідношення зв'язування (n), вільну енергію зв'язування (ΔG), ентальпію зв'язування (ΔH) і ентропію зв'язування (-TΔS), зв'язані із зв'язуванням антиген-антитіло. Ці результати показані в Таблиці 2. У результаті, значення Kd танезумабу становило 20,41 нМ, значення Kd 1-15(N52D-A)-Fab'PEG становило 1,49 нМ, що показує, що афінність зв'язування 1-15(N52D-A)-Fab'-PEG було більш сильним в 10 разів або більше, ніж такове танезумабу (Таблиця 2). Таблиця 2 Танезумаб 1-15(N52D-A)-Fab'-PEG Kd (нМ) 20,41 1,49 ΔG (кал/моль) -10490 -12041 ΔH (кал/моль) -4759 -20806 -TΔS (кал/моль) -5731 8765 50 55 Приклад 21: Отримання PEG-илованого 1-15(N52D-A)-Fab', що має PEG різного розміру, і оцінка нейтралізуючої активності 1-15(N52D-A)-Fab', отриманий за Прикладом 18, кон'югували із 5 кДа PEG або 10 кДа PEG за допомогою процедури, схожою із такою за Прикладом 13. Конкретно, розчин фрагмента Fab', отриманий за допомогою 20 мМ Tris-HCl буфера (pH 7,4), піддавали відновній обробці за 17 UA 111372 C2 5 10 15 20 25 30 35 40 45 50 55 60 допомогою TCEP. Потім, фрагмент Fab' збирали за допомогою висолюючої колонки. PEG (SUNBRIGHT GL2-50MA або SUNBRIGHT GL2-100MA; NOF CORPORATION) додавали до отриманого фрагмента Fab', і розчин залишали стояти при 4 °C протягом ночі. 1-15(N52D-A)фрагменти Fab', кон'юговані із 5 кДа PEG або із 10 кДа PEG, які були отримані таким чином, називалися 1-15(N52D-A)-Fab'-5kPEG і 1-15(N52D-A)-Fab'-10kPEG, відповідно. Потім, за допомогою способу, показаного в Прикладі 6, відповідні PEG-иловані фрагменти Fab' порівнювали між собою по нейтралізуючій активності. Як порівняльний контроль використовували 1-15(N52D-A)-Fab'-PEG (кон'югований із 40 кДа PEG; тут і далі також позначається як 1-15(N52D-A)-Fab'-40kPEG), отриманий за Прикладом 19. У той же час, виконували аналіз при кінцевій концентрації NGF 50 нг/мл. У результаті, IC50 1-15(N52D-A)-Fab'5kPEG, 1-15(N52D-A)-Fab'-10kPEG і 1-15(N52D-A)-Fab'-40kPEG становили 0,030 мкг/мл, 0,028 мкг/мл і 0,023 мкг/мл, відповідно. Виходячи із цих результатів зрозуміло, що PEG, розміри якого знаходяться в діапазоні від 5 кДа до 40 кДа, не впливає на нейтралізуючу активність фрагментів Fab'. Приклад 22: Оцінка PK миші для PEG-илованого 1-15(N52D-A)-Fab', що має PEG різних розмірів Оцінка PK миші була виконана для різних типів PEG-илованих 1-15(N52D-A)-Fab'. Конкретно, 0,3 мг/кг різних типів PEG-илованих 1-15(N52D-A)-Fab' вводили внутрішньовенно, кров збирали на 1, 4, 8, 12, 24, 48, 72, 96 і 168 години після введення. Кількість антитіла, яке тестується в отриманій крові вимірювали за допомогою сендвіч-ELISA. Конкретно, антитіло, яке тестується, додавали у планшет MSD (Meso Scale Discovery), в якому іммобілізований NGF. Антитіло, зв'язане із планшетом, розпізнавали за допомогою κ-антитіла людини, міченого біотином, яке потім детектувалося за допомогою стрептавідину, міченого SULFO-TAG. Концентрацію антитіла в крові розраховували за допомогою створення калібрувальної кривої із використанням відповідних стандартів. Із розрахованої концентрації антитіла в крові, розраховували час напівжиття антитіла в крові (T1/2: година). У результаті, T1/2 1-15(N52D-A)Fab'-5kPEG, 1-15(N52D-A)-Fab'-10kPEG і 1-15(N52D-A)-Fab'-40kPEG становили 13,8±2,2 години, 17,7±0,4 години і 39,2±3,7 години, відповідно. Приклад 23: Аналіз на знеболюючий ефект із використанням моделі надрізу підошви щура Використовуючи модель болю після надрізу підошви щура (Brennan et al., Current Protocols in Pharmacology 2004; 5.34.1-5.34.8), яка розглядається як відображаюча післяопераційний біль у клінічній практиці, оцінювали знеболюючий ефект 1-15(N52D-A)-Fab'-5kPEG і 1-15(N52D-A)Fab'-10kPEG на післяопераційний біль. Конкретно, у кожній групі було по 8 щурів, і 1-15(N52D-A)-Fab'-5kPEG або -10kPEG вводили щурам внутрішньовенно (0,1 мг/кг, 0,3 мг/кг і 1 мг/кг, доза становила 1 мл/кг). Потім, у підошві правої передньої лапи робився прямий надріз, який мав величину 10 мм в напрямку пальців у положенні, віддаленому на 5 мм від кінця п'ятки, а потім негайно накладався матрацний шов нейлоновою ниткою в двох місцях, викликаючи таким чином біль. Больові пороги в області операції вимірювали через 5 годин і на перший, другий, третій, четвертий і п'ятий дні після індукції болю. Для вимірювання був використаний динамічний підошовний анестезіометр виробництва фірми Ugo Basile, щоб виміряти тиск, при якому щури демонструють реакцію уникнення, коли тиск прикладається до підошви. Як порівняльний контроль використовували антитіло танезумаб, із попереднього рівня техніки. У результаті, внутрішньовенне введення танезумабу приводило до знеболюючого ефекту ED50=0,26 мг/кг в 1-й післяопераційний день, і 1-15(N52D-A)-Fab'-5kPEG, і -10kPEG викликали знеболюючий ефект ED50=0,15 мг/кг, що приблизно в два рази більш ефективно. У доповнення, істотний знеболюючий ефект 1-15(N52D-A)-Fab'-5kPEG і -10kPEG продовжував спостерігатися і в 3-й і 4-й післяопераційні дні, відповідно. Приклад 24: Оцінка стабільності агрегації 1-15(N52D-A)-Fab'-40kPEG розчиняли до 1 мг/мл і 10 мг/мл в умовах pH 5, pH 6, pH 7,4 і pH 9. Кожний із цих розчинів тримали при 50 °C, щоб оцінити стабільність агрегації через 2 тижні. Щоб оцінити властивості агрегації виконували ексклюзійну хроматографію за допомогою Agilent 1100 виробництва фірми Agilent. Як умови вимірювання використовували 0,1 M фосфат натрію, який містить 0,2 M аргініну (pH 6,8) як буфер пересувної фази, а TSK gel Super Sw3000 (TOSOH, 2,0 мм ID × 300 мм) використовували як колонку. Довжина хвилі детектування становила 280 нм. В аналізі при 1 мг/мл, танезумаб використовували як антитіло порівняння, а результати показані в Таблиці 3. В аналізі при 10 мг/мл, танезумаб і REGN 475 використовували як антитіла порівняння, а результати показані в Таблиці 4. У результаті, для танезумабу і REGN 475, помітне збільшення кількості агрегатів, які утворилися, спостерігалися через два тижні. По контрасту із цим, для 1-15(N52D-A)-Fab' 18 UA 111372 C2 40kPEG, агрегати майже не детектуються. Цей результат передбачає, що PEG-илований 115(N52D-A)-Fab' із високою імовірністю може бути ліками, які мають чудову стабільність при зберіганні. Таблиця 3 pH Час (дні) 0 14 0 14 0 14 0 14 pH 5 pH 6 pH 7,4 pH 9 1-15(N52D-A)-Fab'-40kPEG Агрегація (%) Полімер Димер 0,0 0,7 0,0 0,7 0,0 0,7 0,0 0,6 0,0 0,7 0,0 0,6 0,0 0,6 0,4 1,1 Танезумаб Агрегація (%) Полімер Димер 0,2 2,5 11,7 5,6 0,3 2,7 1,3 3,8 0,3 2,8 3,1 3,8 0,3 2,8 5,7 4,7 5 Таблиця 4 pH pH 5 pH 6 pH 7,4 pH 9 Час (дні) 0 14 0 14 0 14 0 14 1-15(N52D-A)-Fab'-40kPEG Агрегація (%) Полімер Димер 0,0 0,4 0,1 0,5 0,0 0,4 0,0 0,7 0,0 0,5 0,0 0,8 0,0 0,6 0,0 1,5 Танезумаб Агрегація (%) Полімер Димер 0,9 4,8 23,5 8,4 1,7 6,1 5,6 7,8 1,8 6,4 7,1 7,5 REGN 475 Агрегація (%) Полімер Димер 0,3 1,7 8,7 3,9 1,2 3,0 2,1 3,6 0,3 2,0 4,0 2,6 0,3 1,8 12,9 2,9 - не тестували 10 Промислова застосовність Антитіло проти NGF людини, більш конкретно - фрагмент Fab' антитіла проти NGF людини за даним винаходом підходить для профілактики або лікування різних захворювань, формування патологічних станів яких зв'язане із NGF людини. 19 UA 111372 C2 20 UA 111372 C2 21 UA 111372 C2 22 UA 111372 C2 23 UA 111372 C2 24 UA 111372 C2 25 UA 111372 C2 26 UA 111372 C2 27 UA 111372 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAnti-human ngf antibody fab? fragment
Автори англійськоюKamohara, Masazumi, Tanaka, Hirotsugu, Koya, Yukari, Takasaki, Jun, Yonezawa, Atsuo, Yoshimi, Eiji
Назва патенту російськоюФрагмент fab' антитела против ngf человека
Автори російськоюКамохара Масадзуми, Танака Хироцугу, Койа Юкари, Такасаки Дзун, Йонезава Ацуо, Йосими Еидзи
МПК / Мітки
МПК: C12N 15/09, C12P 21/08, C12N 1/15, C12N 1/19, C12N 1/21, C12N 5/10, C07K 16/22
Мітки: антитіла, фрагмент, людини
Код посилання
<a href="https://ua.patents.su/34-111372-fragment-fab-antitila-proti-ngf-lyudini.html" target="_blank" rel="follow" title="База патентів України">Фрагмент fab’ антитіла проти ngf людини</a>
Попередній патент: Застосування метилового естеру 5-метил-4-оксо-3,4-дигідротієно[2,3-d]піримідин-6-карбонової кислоти як анальгетичного та протизапального засобу
Наступний патент: Синергетична гербіцидна композиція, яка містить феноксулам і флорасулам
Випадковий патент: Ручний одноразовий імпульсний пристрій для гасіння пожежі