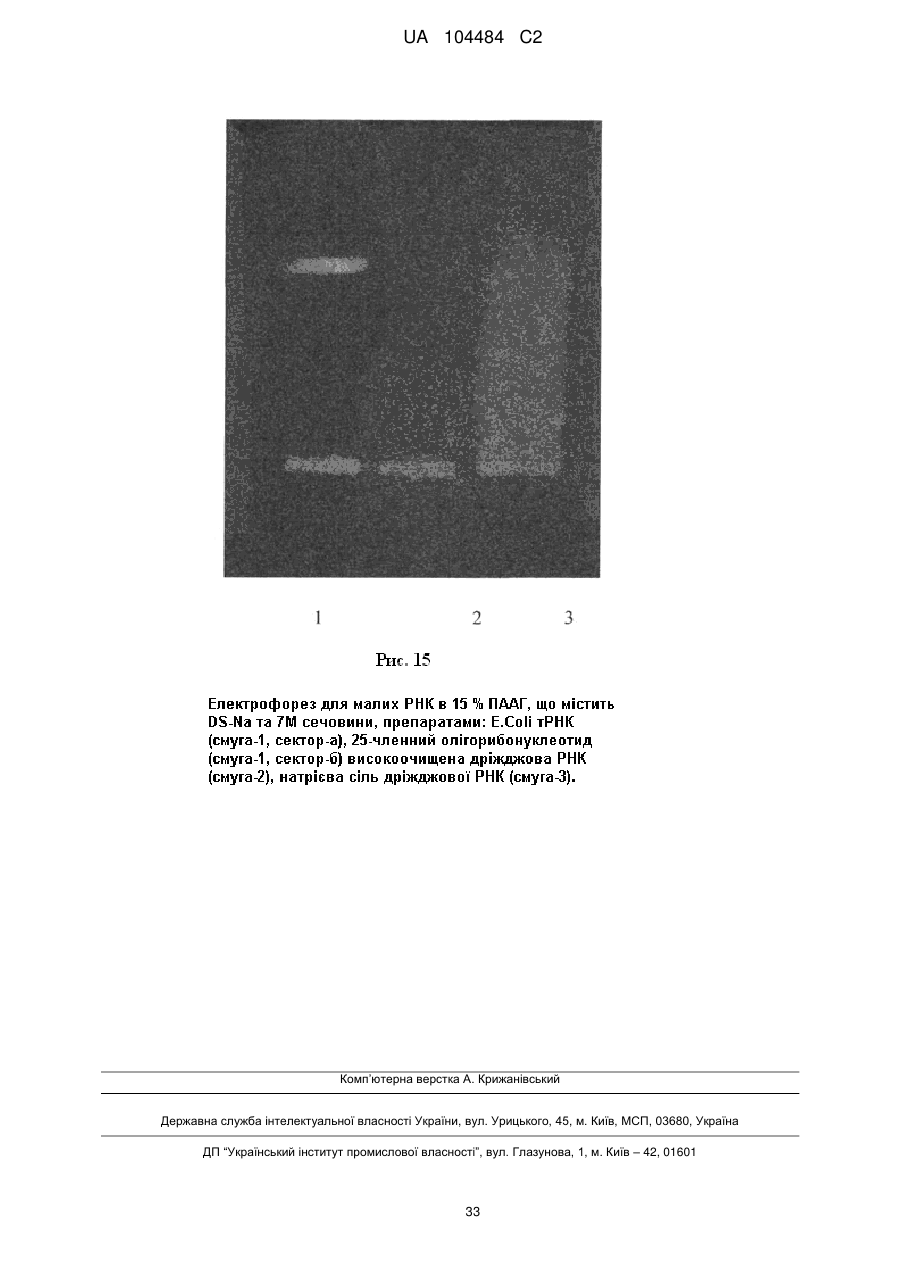
Противірусна сполука множинної дії, її склад та спосіб лікування вірусних захворювань
Формула / Реферат
1. Спосіб профілактики або лікування вірусних інфекцій у пацієнтів, який відрізняється тим, що включає введення пацієнтові в кількості, достатній для профілактики і лікування інфекцій, композиції з очищеного екстракту дріжджової РНК, яка має за масою принаймні 75 % фрагментів з 25±10 нуклеотидів, що за вагою становить не менше 99 %, в поєднанні з манітом в пропорції від 2:1 до 3:1 за вагою, де екстракт дріжджової РНК був нагрітий з манітом, при цьому екстракт РНК становить не менше 50 % від ваги композиції.
2. Спосіб згідно з п. 1, який відрізняється тим, що композиція містить таку кількість очищеної дріжджової РНК, яка здатна інгібувати розмноження вірусу.
3. Спосіб згідно з п. 1, який відрізняється тим, що включає введення такої кількості композиції, що ефективно пригнічує рецептори вірусу, які забезпечують реплікацію вірусів в клітинах.
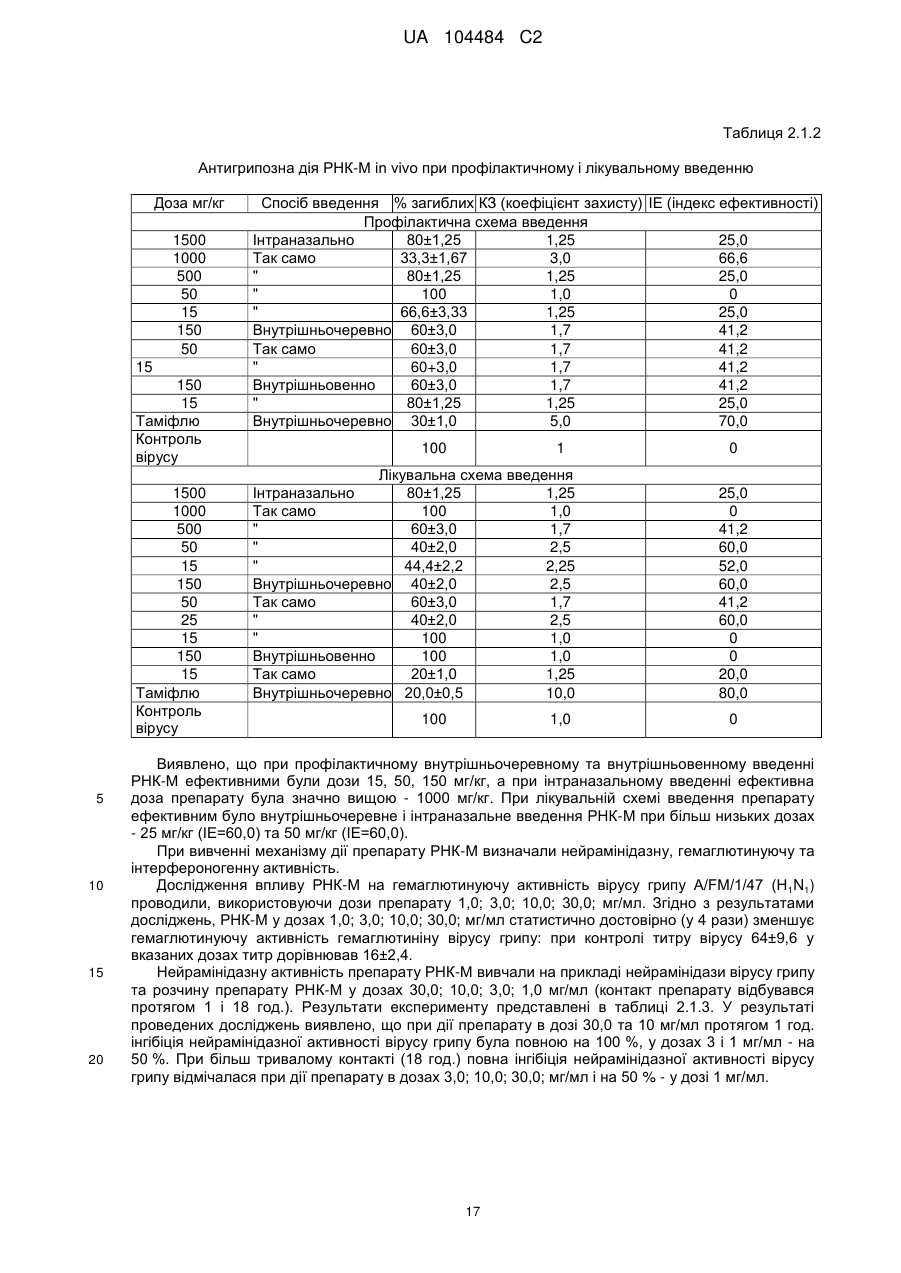
4. Спосіб згідно з п. 1, який відрізняється тим, що є способом профілактики або лікування інфекції, викликаної вірусом з родини Orthomyxoviridae.
5. Спосіб згідно з п. 4, який відрізняється тим, що вірус викликає антропонозну гостру респіраторну інфекцію.
6. Спосіб згідно з п. 1, який відрізняється тим, що є способом профілактики або лікування інфекції вірусом із сімейства параміксовірусів.
7. Спосіб згідно з п. 1, який відрізняється тим, що є способом профілактики або лікування інфекцій, які викликаються вірусами гепатиту.
8. Спосіб згідно з п. 7, який відрізняється тим, що вірусом є вірус гепатиту С.
9. Спосіб згідно з п. 1, який відрізняється тим, що є способом профілактики або лікування інфекції, яка викликається вірусами із сімейства герпесвірусів.
10. Спосіб згідно з п. 9, який відрізняється тим, що вірусом є вірус простого герпесу.
11. Спосіб згідно з п. 9, який відрізняється тим, що вірусом є вірус геніального герпесу.
12. Спосіб згідно з п.1, який відрізняється тим, що є способом профілактики або лікування інфекції вірусу грипу.
13. Спосіб згідно з п. 12, який відрізняється тим, що вірусом інфекції грипу є штам H1N1.
14. Спосіб згідно з п. 12, який відрізняється тим, що вірусом інфекції грипу є штам H5N2.
15. Спосіб згідно з п. 1, який відрізняється тим, що є способом профілактики або лікування інфекції вірусу імунодефіциту людини.
16. Спосіб згідно з п. 1, який відрізняється тим, що є способом профілактики або лікування зараження ентеровірусом.
17. Спосіб згідно з п. 16, який відрізняється тим, що вірусом є Коксакі В вірус.
18. Спосіб згідно з п. 1, який відрізняється тим, що є методом профілактики або лікування зараження аденовірусом.
19. Спосіб згідно з п. 1, який відрізняється тим, що композиція вводиться інтраназально, підшкірно, перорально, внутрішньочеревно, внутрішньом'язово, внутрішньовенно або локально в області вірусної інфекції або осередку інфекції.
20. Спосіб згідно з п. 1, який відрізняється тим, що препарат вводять у вигляді ін'єкцій, капсул, таблеток, супозиторіїв, гелів або спреїв.
21. Композиція для профілактики або лікування інфекції вірусів, що включає високоочищену дріжджову РНК, яка має за масою принаймні 75 % фрагментів з 25±10 нуклеотидів, що за вагою становить не менше 99 %, при цьому, екстракт дріжджової РНК був нагрітий з манітом, і екстракт дріжджової РНК знаходиться з манітом в пропорції від 2:1 до 3:1 за вагою, де екстракт РНК становить не менше 50 % від ваги композиції.
22. Композиція згідно з п. 21, яка відрізняється тим, що РНК є екстрактом з дріжджів.
23. Композиція згідно з п. 22, яка відрізняється тим, що дріжджі є Saccharomyces cerevislae.
24. Композиція згідно з п. 22, яка відрізняється тим, що дріжджі є Candida utilis.
25. Композиція згідно з п. 21, яка відрізняється тим, що екстракт очищеної дріжджової РНК практично не містить білків, ДНК і нуклеотидів.
26. Композиція згідно з п. 21, яка відрізняється тим, що очищена РНК містить більше 14,5 % від маси азоту і більше 8,5 % від маси фосфору.
27. Спосіб приготування композиції за п. 21 для профілактики або лікування інфекції вірусів, у якій дріжджова РНК містить олігонуклеотидні фрагменти з 25±10 нуклеотидів за вагою не менше 99 %, а екстракт дріжджової РНК і маніт знаходяться у пропорції від 2:1 до 3:1 за вагою, при цьому, екстракт РНК становить не менше 50 % від ваги композиції, який включає нагрівання очищеного екстракту дріжджової РНК з манітом при температурі в діапазоні 40-70 °С.
28. Спосіб згідно з п. 27, який відрізняється тим, що включає обробку екстракту РНК лужними амінокислотами.
29. Спосіб згідно з п. 27, який відрізняється тим, що включає обробку екстракту РНК аргініном.
Текст
Реферат: Винахід стосується способу приготування антивірусних препаратів, який включає модифікацію високо очищеної дріжджової РНК, а також спосіб лікування та профілактики вірусних захворювань, що передбачає введення пацієнтові композиції, яка містить ефективну кількість рибонуклеїнової кислоти для зменшення вірусного навантаження та покращення симптомів захворювання. UA 104484 C2 (12) UA 104484 C2 UA 104484 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід описує сполуку та фармацевтичну композицію модифікованої РНК для лікування вірусних захворювань, які зокрема викликаються вірусами з Orthomyxoviridae, Paramyxovirus, Hepatitis, сімейства Herpesviridae, ентеровірусами і аденовірусами. Крім того, модифікована дріжджова РНК здатна інгібувати розмноження вірусів грипу, вірусу гепатиту С, генітального герпесу, вірусу імунодефіциту людини і вірусу Коксакі В. Даний винахід також описує терапевтичні методи для покращення або попередження вірусних захворювань. Швидко зростаюча стійкість вірусів до противірусних препаратів вимагає створення нових ліків з різним механізмом дії, а також нових препаратів, що діють на нещодавно відкриті мішені. Оскільки вірусні захворювання часто пов'язані з декількома видами вірусів, створення нових противірусних препаратів з різними механізмами дії, проти багатьох вірусів, має особливе значення для суттєвого покращення результатів лікування. Молекули РНК можуть приймати широкий спектр різноманітних конформацій і виконувати велику кількість клітинних функцій за рахунок утворення структур, які дозволяють їм мати конкретні РНК-РНК, РНК-ДНК або РНК-білкові взаємодії. Успіхи у вивченні цих різноманітних РНК-взаємодій дозволили розробити ряд технологій, які дали можливість створити нові методи лікування різних захворювань. Зараз відомо ряд нових хімічно-синтезованих терапевтичних РНК, яким зараз приділяється найбільша увага, це в першу чергу, так звані Інгібітори генів, інгібітори білків та імуностимулюючі РНК (Bruce A. Sullenger & Eli Gilboa, Emerging clinical applications of RNA, Nature, 2002, 418, July 11, pp. 252-258). Як приклад, до інгібіторів генів можна віднести комплементарні РНК, які специфічно впізнають цільові транскрипти шляхом формування з ними пар основ відповідно до їх послідовностей. їх ще називають антисенсові РНК. Формування цього дуплексу РНК, призводить до деградації РНК-мішені і в результаті до інгібування її трансляції. Були зроблені відкриття, що деякі РНК можуть бути каталізаторами гідролізу РНК, що призвело до розвитку нового класу терапевтичних РНК, так званих транс-розщеплюючих (trans-cleaving) рибозимів. Така прив'язка рибозимів до субстрату РНК через взаємодію спарених основ, розщеплює пов'язані РНК-мішені, звільняючи продукти розщеплення. (Guerrier-Takada, C, Gardiner, K., Marsh, Т., Расе, N. & Altman, S, The RNA moiety of ribonuclease P is the catalytic subunit of the enzyme, Cell, 1983, 35, pp. 849-857) Були розпочаті декілька клінічних випробувань І та II фази з використанням транс-розщеплюючих рибозимів в невеликої кількості хворих з інфекційними захворюваннями. (Wong-Staal, F., Poeschla, Е. М. & Looney, D. J., A controlled, Phase 1 clinical trial to evaluate the safety and effects in HIV-1 infected humans of autologous lymphocytes transduced with a ribozyme that cleaves HIV-1 RNA, Hum. Gene Ther. 1998, 9, pp. 2407-2425). Нажаль, ці клінічні дослідження показали, що даний метод не дає довготривалого ефекту (Bruce A. Sullenger & Eli Gilboa, Emerging clinical applications of RNA, Nature, 2002, 418, July 11, pp. 252258. Критичні фактори, які визначають успіх ефективності випробувань цих синтетичних рибозимів, є здатність забезпечити ефективну доставку рибозимів у відповідні клітини in vivo, та рівень і тривалість гальмування цільового гена, який повинен уповільнювати розвиток хвороби. Для одужання пацієнтів з хронічними захворюваннями, такими як рак, ВІЛ-інфекція і гепатит С, потрібні стійкі до розщеплення рибозими, з високим рівнем гальмування цільових транскриптів. На практиці це важко досягти, особливо коли мішенню є високо експресована вірусна РНК. До інгібіторів білків належать хімічно-синтезовані РНК, які можуть утворювати складні структури, що вступають в молекулярну взаємодію з білками і підтримують з ними стабільні комплекси. (Daley D. Т. A., Luscombe N. М., Berman H. M. and Thornton J. M., Protein-RNA interactions: a structural analysis. Nucleic Acids Research, 29, 4, pp. 943-954. Для відбору таких біологічно активних РНК, які являють собою олігонуклеотиди довжиною 15-35 нуклеотидів, нещодавно було розроблено ряд технологічних рішень. Такі олігонуклеотиди можуть специфічно зв'язуватися з білковими мішенями (A. D. Keefe, S. Раі, А. Ellington, Aptamers as therapeutics, Nature Review, 2010, 9, pp. 537-550). Перш за все, були розроблені технології хімічного синтезу олігонуклеотидів, які з високою афінністю зв'язуються з білковими мішенями, що включає широке коло білків, в тому числі цитокіни, протеази, кінази, рецептори на поверхні клітин і молекули клітинних адгезій. В даний час розробляються хімічно-синтезовані олігонуклеотиди, які можуть системно вводитися в організм, в першу чергу це мішені крові, такі як тромбін, фактор ІХа і фактора Віллебранда, або мішені на поверхні клітин такі як рецептор епідермального фактору росту (EGFR). Хімічно синтезовані олігонуклеотиди можуть використовуватись для терапевтичних цілей і в даний час проходять клінічні випробовування для захворювання очей, гематологічних захворювань та для лікування раку (Keefe A.D., Schaub R.G., Aptamers as candidate therapeutics for cardiovascular indications, Curr. Opin. Pharmacol. 2008, Apr., 8(2), pp. 147-52, Epub Jan 28, 2008; Barbas A.S., Mi 1 UA 104484 C2 5 10 15 20 25 30 35 40 45 50 55 60 J., Clary B.M., White R.R., Aptamer applications for targeted cancer therapy, Future Oncol., 2010, Jul, 6(7), pp. 1117-26). Більшість хімічно синтезованих олігонуклеотидів в організмі піддаються нуклеазоопосередкованій деградації ферментами сироватки крові, нирковій фільтрації, поглинання печінкою, селезінкою та іншими тканинами. Тому олігонуклеотиди, які незахищені модифікованими нуклеотидами мають період напіврозпаду в крові не більше ніж 2 хвилини. При допомозі досить трудомісткого процесу, можна специфічно модифікувати нуклеотиди, які входять до складу хімічно-синтезованих олігонуклеотидів, провести їх захист на 3'-кінці, що підвищує стійкість до нуклеаз сироватки крові (Floege J. et al., Novel approach to specific growth factor inhibition in vivo antagonism of platelet-derived growth factor in glomerulonephritis by aptamers, American Journal of Pathology, 1999, 154, pp. 169-179; Beigelman, L. et al., Synthesis and biological activities of a phosphorodithioate analog of 2',5'-oligoadenylate, Nucleic Acids Res., 1995, 23, pp. 3989-3994). Така стратегія збільшує напіврозпад таких олігонуклеотидів в сироватці крові в десятки разів). Для зниження ниркової фільтрації їх кон'югують до полімерів типу PEG з високою молекулярною масою, який найчастіше запобігає витоку препарату шляхом ниркової фільтрації. Некон'юговані олігонуклеотиди виводяться з системи кровообігу миші з періодом напіврозпаду 5-10 хвилин, в той час як 40 кДа PEG-кон'югати можуть мати напіврозпад в кровообігу не менше 1 день. (Burmeister, P. Е. et al., Direct in vitro selection of a2'-O-methyl aptamer to VEGF. Chem. Biol., 2005, 12, pp. 25-33). Зараз є декілька хімічно-синтезованих олігорибонуклеотидів, які вже пройшли клінічне випробування та перебувають в процесі розгляду. В грудні 2004 року US FDA схвалив перший хімічно синтезований олігонуклеотид Pegaptanib для терапевтичного використання і в даний час продається Pfizer і Eyetech як Macugen. Це 27 членний олігорибонуклеотид, який вводиться інтравітреальними ін'єкціями в око раз на 6 тижнів, і використовується для поліпшення втраченої гостроти зору при віковій макулярній дегенерації (ВМД) (Chakravarthy, U. et al., Year 2 efficacy results of 2 randomized controlled clinical trials of pegaptanibfor neovascular age-related macular degeneration, Ophthalmology, 2006, 113, e1-e25). Ha II фазі клінічних випробувань перебуває REG1, 34-членний олігонуклеотид, який є специфічним інгібітором фактора згортання ІХа. Він показує швидкий початок антикоагуляції in vivo після внутрішньовенного введення, яке швидко повертається до вихідного рівня після введення антидоту RB007. (Chan M. Y. et al., Phase 1b randomized study of antidote-controlled modulation of Factor IXa activity in patients with stable coronary artery disease circulation, 2008, 117, pp. 2865-2874). На першій фазі клінічних випробувань перебуває ARC 1905, який є 39-членним олігонуклеотидом, і використовується спільно з vEGF-специфічниим фрагментом антитіла Ранібізумаб для AMD захворювання (Biesecker G., et al., Derivation of RNA aptamer inhibitors of human complement C5, Immunopharmacology, 1999, 42, 1-3, pp. 219-230). Оскільки більшість існуючих препаратів даного класу є білковими антагоністами, кінцевий їх успіх як терапевтичних агентів залежить від того, наскільки добре вони будуть конкурувати з іншими класами терапевтичних сполук, зокрема з моноклональними антитілами, які в даний час випробовуються по відношенню до тих же білків, як більшість олігонуклеотидів, які знаходяться в доклінічному вивченні. Крім того, для олігонуклеотидів - інгібіторів білків характерна висока специфічність по відношенню до конкретних білків. Кожному такому олігонуклеотиду властиве інгібування тільки одного білка, що робить їх дуже вразливими при лікуванні вірусних захворювань. Відомо, що віруси дуже швидко виробляють стійкість до окремих інгібіторів, тому використання таких дуже специфічних олігонуклеотидів для лікування вірусних захворювань викликає великі сумніви. Сумарні РНК, особливо виділені з дріжджів, вже тривалий час використовуються як терапевтичні препарати. (Zemskov V.M., Lidak M., Zemskov A.M., Mikstays U.Ya., Small RNA. Preparation, hydrolysis and its application in medicine, Riga, Zanatne, 1985, p. 191). Однак, в даному випадку використовується натрієва сіль дріжджової РНК, яка недостатньо очищена, має високу гетерогенність по молекулярній вазі (в ній присутній весь спектр нуклеотидних сполук від динуклеотидів до малих транспортних РНК) і має тільки імуномодулюючими властивостями (Zemskov A.M., Perederiy V.G., Zemskov V.M., Bychkova N.G., Immunocorrective nucleic acid drugs and their clinical application, Kiev, Healthy, 1994, p. 232). Відомі використання дріжджової рибонуклеїнової кислоти для загоєння ран. (Kulkarni et al., Ribonucleotide preparations and uses thereof-U.S. Patent No. 5,712,256, Jan. 27, 1988). Однак, в даному випадку використовуються продукти гідролізу РНК, а не сама РНК, як певна послідовність, або конфігурація за рахунок її вторинної структури. Для лікування запалення і пов'язаних з запаленням захворювань була запропонована високоочищена, гомогенна по молекулярній вазі дріжджова РНК (Tkachuk Z., Compound, 2 UA 104484 C2 5 10 15 20 25 30 35 40 45 50 55 60 composition and method for the treatment of inflammatory and inflammatory-related disorders, U.S. Patent No. 6,737,271, May 18, 2004). На основі цієї субстанції був створений препарат Нуклеїнат, який успішно пройшов II фазу клінічних випробувань і останні сім років досить успішно просувається на фармринку України. Нуклеїнат зарекомендував себе як імуномодулятор та протизапальний препарат для лікування гострих та хронічних запалень легенів, нирок та інших запальних процесів. Однак, високоочищена дріжджова РНК не має специфічну противірусну активність. Нуклеїнові кислоти і особливо РНК до сих пір не використовувалися як специфічні противірусні препарати з множинною дією проти багатьох вірусних захворювань. Віруси грипу. Вірус грипу належить до родини ортоміксовірусів (лат. Orthomyxoviridae) та включає три серотипи А, В, С Віруси серотипів А і В складають один рід, а серотип С інший. Кожний серотип має свою антигенну характеристику, яка визначається нуклеопротеїнами (NP) та матричними (М) білковими антигенами. Віруси грипу типу А широко розповсюджені в природі й уражають як людей, так і деяких ссавців і птахів. Віруси грипу типу В виділяються тільки в людини, типу С - у людей і свиней. Збудники грипу типу А і В відповідальні за щорічні епідемії. Серотип А включає підтипи, які розрізняються за характеристикою свого гемаглютиніну (Н) та нейрамінідази (N). Для вірусів серотипу А (рідше В) характерна часта зміна антигенної структури при перебуванні їх у природних умовах. Антитіла, що виробляються у відповідь на гемаглютинін, складають основу імунітету проти певного підтипу збудника грипу. На даний час відомо 15 підтипів гемаглютиніну (НА) і 10 підтипів нейрамінідази (NA) вірусів грипу типу А, що циркулюють серед хребетних. За даними вірусологічних, імунологічних і сероархеологічних досліджень, епідемії і пандемії, починаючи з 1889 року, були викликані вірусами, які мають у своєму складі гемаглютинін Н1, Н2 або Н3 та нейрамінідазу N1 або N2. Ці збудники об'єднані в три підтипи вірусу грипу А людини: A(H1N1), A(H2N2) і A(H3N2), у появі яких на епідеміологічній орбіті спостерігається визначена циклічність. Віруси паразитують у епітелії слизових оболонок носоглотки та верхніх дихальних шляхів, мають сильний токсин, що вражає кровоносні судини та капіляри. Під час епідемії, вірус грипу атакує велику кількість людей, що негативно впливає на економіку країни. Отже, пошук і використання хіміотерапевтичних препаратів, здатних блокувати розмноження вірусу, стає дуже важливим. До недавнього часу ефективність хіміопрофілактики грипу, а також інших вірусних захворювань була дуже низькою. Перше повідомлення про противірусну дію 1-аміно-адамантану зробив у 1963 році Джексон і співавтори. (Jackson G.G., Muldon R.L, Akers L.W., Serological evidence for prevention of influenza infection in volunteers by anti-influenzal drug amantadine hydrochloride, in Antimicrobial agents and chemotherapy, S. 1., Acad. Press, New York, 1964, pp. 703-707). У 1964 році Дівайс і співавтори опублікували результати експериментів (Davies W.L, Grunert R.R., De Somer P. et al., Antiviral activity of l-adamantanamine (amantadine), Science, 1964, 144, pp. 862-863), і з того часу ремантадин став першим препаратом, який широко використовується для профілактики і лікування грипу. У 1970 році була відкрита кристалічна структура вірусної нейрамінідази грипу А і В типів і було доведено, що інгібування нейрамінідазної компоненти вірусу грипу затримує розмноження вірусу. (Miller W.E., Mechanisms of action and pharmacology chemical agents, in Antiviral agents and viral diseases of man, Ed. by G. J. Gallasso et al., Raven Press, New York, 1979, pp. 77-149; Hay den F.G., Osterhaus A.D., Treanor J.J. et al., Efficacy and safety of the neur-aminidase inhibitor zanamivir in the treatment of influenza virus infections, in GG 167 Influenza Study Group, N. Engl. J. Med., 1997, 337, 13, pp. 874-880). Це дозволило створити препарати осельтамівір і занамівір, які блокують активність нейрамінідази А і В типів вірусу грипу. Ці препарати захищають від зараження клітини епітелію дихальних шляхів і запобігають поширенню вірусу в організмі. Осельтамівір і занамівір показали високу профілактичну та лікувальну ефективність із зменшенням в середньому на 2-3 дні період лікування і легший перебіг хвороби (Monto A.S., Fleming D.М., Henry D. et al., Efficacy and safety of the neuraminidase inhibitor zanamivir in the treatment of influenza A and В virus infections, J. Infect Diseases, 1999, 180, 2, pp. 254-261; lozzo M., Efficacy and tolerability of the neuraminidase inhibitor Zanamivir, J. Acad. Phys. Assistants, 2001, 2, 2, pp. 186-188; Hoyden F. G., Treanor J. J., Fritz R. S. et al., Use of oral neuraminidase inhibitor Osettamivir in experimental human influenza, J. Amer. Med. Assoc, 1999, 282, 13, pp. 48-50). Епідемії грипу та гострих респіраторних вірусних інфекцій супроводжуються високим рівнем смертності і серйозними ускладненнями в уразливих групах населення. В групу ризику входять люди з хронічними захворюваннями, особливо серцево-судинними захворюваннями (Davis М.М., Taubert К., Benin A.L. et al., Influenza vaccination as secondary prevention for cardiovascular disease: a science advisory from the American Heart Association, Amer. College of Cardiology, 3 UA 104484 C2 5 10 15 20 25 30 35 40 45 50 55 60 Circulation, 2006, 114, pp. 1549-1553). Існує переконливий доказ того, що гострі респіраторні вірусні інфекції та грип спричиняють напади серця і було переконливо доведено, що препарати проти вірусних інфекцій є ефективним методом для зниження ризику серцевих нападів у людей з серцево-судинними захворюваннями. (Warren-Gash С, Smeeth L, Hayviard A.C, Influenza as a trigger for acute myocardial infarction or death from cardiovascular disease: a systematic review, Lancet Infect. Dis., 2009, 9, pp. 601-610). Епідемії грипу та ГРВІ супроводжуються частою смертністю і небезпечними ускладненнями серед уразливих груп людей. До населення, схильного до ризику, належать люди з хронічними патологіями, особливо з такими як серцево-судинні захворювання. (Davis M.M., Taubert К., Benin A.L. et al., Influenza vaccination as secondary prevention for cardiovascular disease, a science advisory from the American Heart Association, American College of Cardiology, Circulation, 2006, 114, pp. 1549-1553). Тим не менше, зв'язок між зараженням ГРВІ та грипом і гострим інфарктом міокарда довго залишався неясним. В той же час різні автори повідомила про сезонність моделей серцево-судинної смертності, що нагадували моделі циркуляції ГРВІ та грипу (Ailing D.W., Blackwelder W.C., Stuart-Harris C.H., А study of excess mortality during influenza epidemics in the United States, 1968-1976, Am. Epidemiol., 1981, 113, pp. 30-33; Collins S.D., Excess mortality from causes other than influenza and pneumonia during influenza epidemics, Public Health Rep., 1932, 47, pp. 2159-2179; Eickhoff Т., Sherman I, Serfling R., Observations on excess mortality associated with epidemic influenza, JAMA, 1961, 176, pp. 776-782; Housworth J., Langmuir A.D., Excess mortality from epidemic influenza, 1957-1966, Am. J. Epidemiol., 1974, 100, pp. 40-48) Клінічні оцінки у пацієнтів з грипом вказують на кінцеві системні наслідки, такі як висока температура, м'язові болі і втома, які також часто супроводжують епізоди ішемії міокарда (Greaves К., Oxford J.S., Price C.P., Clarke G.H., Crake Т., The prevalence of myocarditis and skeletal muscle injury during acute viral infection in adults: measurement of cardiac troponins I and T in 152 patients with acute influenza infection, Arch. Intern. Med. 2003, 163, pp. 165-168; Ison M.G., Campbell V., Rembold C, Dent J., Hayden F.G., Cardiac findings during uncomplicated acute influenza in ambulatory adults, Clin. Infect. Dis., 2005, 40, pp. 415-422; Paul B.K., Clinical observations of influenza, with special reference to its effects and cardiac functional efficiency, Indian Med. J., 1963, 57, pp. 251-283; Verel D., Warrack A.J., Potter C.W., Ward C, Rickards D.F., Observations on the A2 England influenza epidemic: a clinicopathological study, Am. Heart J., 1976, 92, pp. 290-96). Ці результати привели до висновку про те, що грип може відігравати роль гострого запального стимулу, який викликає серцево-судинні розлади. Для того, щоб прогнозувати ризик судинних захворювань у людей, як важливий компонент стали використовувати маркери системного запалення і запальної активації клітин. Відомо, що вірус грипу дуже сильно впливає на запальні, коагуляційні і метаболічні шляхи (Madjid M. t Aboshady I., Awan I., litovsky S., Casscells S.W., Influenza and cardiovascular disease: is there a causal relationship, Tex. Heart Inst. J., 2004, 31, pp. 4-13), які можуть призвести до дестабілізації атеросклеротичних бляшок і, таким чином, до часткової оклюзії або повної обтурації коронарних судин, що є основною причиною гострого інфаркту міокарда (White H.D., Chew D.P., Acute myocardial infarction, Lancet, 2008, 372, pp. 570-584). Крім того, грип може виступати як гострі запальні та про-коагуляторні стимули швидких змін в ендотелії (Housworth J., Langmuir A.D., Excess mortality from epidemic influenza, 1957-1966, Am. J. Epidemiol. 1974, 100, pp. 40-48; Madjid M., Awan I…, Ali M, Frazier L., Casscells W., Influenza and atherosclerosis: vaccination for cardiovascular disease prevention, Expert Opin. Bid. Ther., 2005, 5, pp. 91-96). Добре відомі серцеві ускладнення, такі як міокардит, перикардит як результат захворювання грипом, хоча поки що роль грипу в характері тригерно-спускового механізму гострого інфаркту міокарда чітко не доведена. У той же час в конкретній літературі з'явилося багато фактів того, що грип (у тому числі захворювання грипом та гострі респіраторні інфекції) може прискорити смертність від гострого інфаркту міокарда або судинну смерть. Численні дослідження, проведені в різних умовах з використанням різних методів, показують, що існує тісний зв'язок між грипом та гострим інфарктом міокарда. У той же час існує не так багато клінічних досліджень, які досліджують можливість зниження ризику серцево-судинних ускладнень за допомогою противірусних препаратів і їх кардіопротекторну дію у пацієнтів з грипом і ГРВІ. Тільки в двох невеликих рандомізованих дослідженнях була оцінена позитивна дія вакцинації проти грипу, яка позначується на профілактиці серцевих нападів у пацієнтів із серцево-судинними захворюваннями. Було показано, що вакцинація проти грипу призводить до значного захисту від судинної смерті. Отримані оцінки представлених моделей рандомізованих наслідків показують захисний ефект вакцинації. Автори вважають, що слід заохочувати вакцинацію проти грипу, особливо у людей з серцево-судинними захворюваннями, які часто опозиційно відносяться до вакцинації. (Warren-Gash С, Smeeth L, Hayviard AC. Influenza as a trigger for acute myocardial 4 UA 104484 C2 5 10 15 20 25 30 35 40 45 50 55 60 infarction or death from cardiovascular disease: a systematic review, Lancet Infect. Dis., 2009, 9, pp. 601-610). Таким чином, існують численні докази того, що грип може спровокувати розвиток гострого інфаркту міокарда, підвищення судинної смертності, і використання антивірусних препаратів може бути ефективним способом зниження випадків серцевих нападів у пацієнтів із серцевосудинними захворюваннями. Віруси гепатиту. Згідно визначенню Всесвітньої організації охорони здоров'я /ВООЗ/, гепатит - це запалення печінки, що в більшості випадків викликається вірусною інфекцією. Існує п'ять основних вірусів гепатиту - А, В, С, D і Е. Гепатит А - гостра інфекційна хвороба з переважним ураженням травного тракту, особливо печінки. Гепатит А викликається вірусом гепатиту А, що потрапляє до організму з їжею або водою. Джерелом інфекції є хворий. Хвороба дуже небезпечна, бо призводить до загибелі печінкових клітин і порушення всіх функцій печінки. Гепатит В - хвороба, яка викликається вірусом гепатиту В (HBV) та уражує печінку, що призводить до її запалення. Щороку від ускладнень гепатиту В на Землі помирає близько 600 тисяч людей. HBV передається від інфікованої до здорової людини при контакті або з кров'ю та іншими рідинами організму - сім'ям, вагінальною рідиною та слиною. Шляхи розповсюдження гепатиту В ідентичні до вірусу імунодефіциту людини (ВІЛ), але інфекційність HBV у 50-100 разів вища. На відміну від ВІЛ, HBV може жити поза організмом щонайменше 7 днів. Гепатит D. Викликається вірусом гепатиту D вірусу (або дельта-вірус) і характеризується гострим розвитком з масивними пошкодженнями клітин печінки. Дельта вірус не в змозі відтворитися сам по собі, тому для реплікації та експресії він вимагає наявність вірусу гепатиту В. Шляхи передачі гепатиту D є аналогічними, як у гепатиту В і гепатиту С. Його інкубаційний період складає від 3 до 7 тижнів. Клінічні прояви гепатиту D аналогічні гепатиту В. Вакцинація проти гепатиту В також запобігає появі гепатиту D. Гепатит Е. Провокує симптоми, схожі на гепатит А. Шляхи передачі гепатиту Е також аналогічні гепатиту А. Гепатит Е поширюється через забруднену воду або їжу, а також може передаватися через кров. Найчастіше він зустрічається у Центральній Азії і в африканських країнах. Відомі ще віруси гепатиту F і G, які ідентифіковані недавно і недостатньо вивчені. Гепатит С - вірусне захворювання з парентеральним механізмом зараження, найчастіше протікає у вигляді посттрансфузійного гепатиту. Вірус був відкритий в 1989 році в крові хворих на гепатит, в яких була виявлена вірусна РНК, характерна для флавовірусів. Вірусний гепатит С викликається РНК-вірусоом з розміром віріона 30-60 нм, що належить до сімейства Flaviviridae. На даний момент розрізняють 11 основних генотипів вірусу гепатиту С: 1а, 1b, 1с, 2а, 2b, 2с, 3а, 3b, 4a, 4b, 4c, 4d, 4е, 5а, 6а, 7а, 7b, 8а, 8b, 9а, 10а, 11а. Вірусні частинки HCV мають оболонку, містяться в крові у слідових кількостях і асоційовані з ліпопротеїнами низької щільності. Джерелом інфекції є хворі з активним гепатитом С і латентні хворі - носії вірусу. HCVінфекція є інфекцією з парентеральним механізмом зараження - через інфіковану кров та її компоненти. В даний час стандартом лікування вірусного гепатиту С, прийнятим низкою країн, є комбінована противірусна терапія (ПВТ) препаратами інтерферону альфа і рибавірину. Згідно з цим стандартом ПВТ показана пацієнтам з постійно підвищеними рівнями АЛТ в сироватці крові, при визначенні РНК вірусу гепатиту С і наявності виражених гістологічних змін у печінці хворого. Тривалість терапії може становити від 12 до 72 тижнів, в залежності від генотипу вірусу гепатиту С. Відповіді на лікування, пов'язані багато в чому з індивідуальними особливостями пацієнта, які визначаються його геномом. Критерієм ефективності лікування в даний час є стійка біохімічна ремісія (нормалізація рівня аланінамінотрансферази протягом тривалого часу після ПВТ) і відсутність віремії (невизначений рівень РНК через 6 місяців і більше після завершення лікування). Вірусний гепатит С є глобальною проблемою охорони здоров'я. Збудник гепатиту С є РНКвмісний вірус, що передається парентеральним шляхом і викликає у людини як гострий, так і хронічний гепатит, який в 60-80 % випадків може призвести до цирозу або раку печінки. За даними ВОЗ біля 1 % населення планети інфіковано вірусом гепатиту С (HCV). Джерелом інфекції є людина, і в 100 % випадків він визначається в крові хворого. Вірус гепатиту С називають "тихим (ласкавим) вбивцею". В 70 % випадків захворювання протікає в скритій формі. Незалежно від ступеню важкості в 50-80 % випадків гепатит С приймає хронічну форму з наступним розвитком цирозу, карциноми, вражає нервові клітини, викликаючи тяжкі наслідки. Вірус віднесений до роду Hepatitis С like-viruses родини Flaviviridae (Alter Y.J., To 5 UA 104484 C2 5 10 15 20 25 30 35 40 45 50 55 60 or not to C: these are questions, Blood, 1995, 85, pp. 1681-1695; National Institutes of Health Consensus Development Conference Panel Statement: Management of Hepatitis C, Hepatology, 1997, 26, pp. 2-10 містить РНК позитивної полярності (Lindsay K.L., Therapy of hepatitis С overview, Hepatology, 1997, 26, pp. 715-775), який характеризується високим ступенем неоднорідності. (Yohko K.S., Hiroshi Y., In vitro systems for the detection of hepatitis С virus infection, Viral Hepatitis Rev., 1995, 1, pp. 59-65; National Institutes of Health Consensus Development Conference Panel Statement: Management of Hepatitis C, Hepatology, 1997, 26, pp. 210). Препарати альфа - інтерферону (ІФН) (реаферон, роферон А, інтрон А та ін.) залишаються базовими для лікування ВГС-інфекції (EASL International Consensus Conference on Hepatitis С. Consensus Statement. Paris, J. Hepatol., 1999, 30, pp. 976-995), однак достовірний противірусний ефект (відсутність РНК ВГС в сироватці крові протягом 6 місяців після лікування) спостерігається лише у 8-12 % пацієнтів, яких лікували альфа ІФН (Lindsay K.L., Therapy of ^ hepatitis С overview, Hepatology, 1997, 26, pp. 715-775). Таким чином, в даний час залишається актуальним пошук альтернативних шляхів терапії ВГС-інфекції. Досить перспективною групою препаратів для лікування вірусних інфекцій, в тому числі і ВГС, можуть стати індуктори ІФН, які представляють різноманітну групу високо- і низькомолекулярних природних і синтетичних сполук, що об'єднані здатністю викликати утворення ІНФ. Індуктори ІФН мають характерну для нього антивірусну, антитуморогенну та імунологічну дію (Ershov F.Y., Anti-virus Pharmaceuticals, Moscow., 1998, p. 240). Вакцина проти гепатиту С на даний час не розроблена, немає і препаратів, які б ефективно пригнічували реплікацію вірусу в організмі. Труднощі в розробці профілактичних і лікувальних препаратів по відношенню до гепатиту С полягають в безрезультативності багатьох спроб, які розпочаті у світі, отримати експериментальні моделі інфекції для проведення скринінгових досліджень, для визначення препаратів, здатних ефективно лікувати гепатит С. Віруси герпесу Герпес (лат. герпесвірусів) - велика родина ДНК-вірусів, що викликають різні захворювання не тільки у людини та інших ссавців, але і птахів, рептилій, амфібій, риб. Вірусами герпесу заражено більшість населення нашої планети (Baltimore D. The strategy of RNA viruses, Harvey Lect, 1974, 70 Series, pp. 57-74). Герпетична інфекція є класичним представником латентного інфекційного процесу. Встановлено, що більш ніж 70 % з тих, хто вперше зіткнувся з вірусом простого герпесу (ВПГ), в подальшому переносили рецидиви інфекції, незважаючи на високий рівень протигерпетичних антитіл. Герпетичні інфекції - це група антропонозних інфекційних захворювань, які викликаються вірусами герпесу людини (ВГЛ) та перебіг яких відбувається у вигляді інапарантних, субклінічних і клінічно маніфестних форм (Liesegang Т., Herpes simplex, Cornea, 1999, Vol. 18, No. 6., p. 739). Герпес (від грец. herpes - повзучий) - одна з найбільш поширених і погано контрольованих інфекцій людини. В організмі з нормальною імунною системою герпетичні віруси можуть циркулювати безсимптомно, але у людей з імуносупресією вони викликають тяжкі захворювання з летальним наслідком. У людини виділено 8 типів вірусів герпесу, які представлено ДНКвмісними вірусами з дуже подібною морфологією, що не дає змоги розрізняти їх при електронній мікроскопії (Herpesviruses, in: Baron's Medical Microbiology, Baron S et al., Eds., 4th.; U. of Texas Medical Branch, 1996; Medical Microbiology, 5th Ed., Elsevier Mosby, 2005). Потрапляючи в організм людини, ВПГ довічно приживається в ньому, періодично викликаючи рецидиви різноманітної тяжкості. ВПГ у латентному стані перебуває в паравертебральних сенсорних гангліях у вигляді L-PREP-часток. Найтиповіший представник ВГЛ - вірус простого герпесу 1-го типу ВПГ-1, або ВГЛ-1, що викликає орофаціальний герпес. Близький до нього за морфологічними, антигенними та фізико-хімічними властивостями вірус герпесу людини 2-го типу (ВПГ-2, або ВГЛ-2), що викликає генітальний герпес (ГГ)- ГГ - це один з випадків герпетичної інфекції, що належить до найпоширеніших захворювань, які передаються статевим шляхом і які відрізняються від інших захворювань цієї групи довічним носійством збудника в організмі людини (латенцією). Ця обставина обумовлює високу частоту виникнення хвороби, якій притаманні часті рецидиви. Виникнення ГГ часто пов'язують з ВПГ-2; до такого висновку приводять дані з частоти виявлення антитіл до цього серотипу вірусу при епідеміологічних дослідженнях. Раніше вважали, що ВПГ-1 частіше ідентифікується при ураженні шкіри обличчя, верхніх кінцівок, тулуба. Зараз встановлено, що ГГ може бути викликаний ВПГ-1. При цьому генітальна інфекція, викликана ВПГ-1, рецидивує порівняно рідко, частіше рецидиви виникають у хворих з високими титрами антитіл до ВПГ-2. Методом гібридизації ДНК ВПГ та ДНК з тканин, отриманих при операціях раку шийки матки та злоякісних патологій цервікального каналу, встановлено роль цього вірусу у виникненні раку шийки матки. 6 UA 104484 C2 5 10 15 20 25 30 35 40 45 50 55 Вірус герпесу людини 3-го типу (ВГЛ-3) викликає два самостійних захворювання - вітряну віспу та оперізуючий лишай. Вірус герпесу людини 4-го типу (ВГЛ-4), або вірус Епштейна-Барр, це етіологічний чинник інфекційного мононуклеозу, лімфоми Беркітта, назофарингіальної карциноми, волосистої лейкоплакії язика. Вірус герпесу людини 5-го типу (ВГЛ-5) спричиняє цитомегаловірусну інфекцію і, нарешті, вірус герпесу людини 6-го типу (ВГЛ-6), як вірогідно встановлено останнім часом, викликає раптову екзантему у дітей раннього віку й синдром хронічної втоми у дорослих. У сучасній літературі є дані, що посередньо вказують на можливу участь ВГЛ-6 у розвитку лімфогранульоматозу, злоякісної В-клітинної лімфоми, саркоїдозу, синдрому Шегрена, хвороби Крона, аутоімунного тиреоїдиту, а також інфекційного мононуклеозу, не пов'язаного з вірусом Епштейна-Барр. Виявлено причетність цього вірусу до розвитку гострих гепатитів у дорослих і дітей, включаючи й гепатити з фульмінантним перебігом і швидким летальним наслідком. У 1990 р. відкрили ВГЛ-7 та ВГЛ-8, значення яких у патології досі мало вивчено. ВГЛ-7 асоціюється з лімфопроліферативними захворюваннями й синдромом хронічної втоми, а ВГЛ-8 - із саркомою Капоші. Лікування герпетичної інфекції залишається дотепер складною проблемою. Тривалий хронічний процес призводить до негативної імунної перебудови організму. Спостерігається розвиток повторної імунної недостатності, пригнічення реакцій клітинного імунітету, зниження неспецифічного захисту організму, що виражається у зниженій здатності лейкоцитів синтезувати α- та γ-інтерферони (ІФН), гіпоімуноглобулінемії, сенсибілізації до вірусних антигенів (Herpesviruses, in Baron's Medical Microbiology, Baron S et al., Eds.; 4th U. of Texas Medical Branch, 1996; Medical Microbiology, 5th Ed., Elsevier Mosby, 2005). Сьогодні антигерпетики складають близько 80 % наявних антивірусних препаратів, що знову ж таки доводить актуальність проблеми. Більшість з них це аномальні нуклеозиди. Виникає питання: чому при такій величезній кількості й розмаїтті лікарських засобів герпетичні захворювання все ще погано контролюються? Останнім часом зросла кількість повідомлень про стійкість ВПГ проти багатьох антигерпетичних препаратів на основі аномальних нуклеозидів. Механізм їх дії поєднує в собі як інгібування ферментів, які беруть участь в реплікації вірусу (тимідинкінази, ДНК-полімерази), так і індукцію синтезу інтерферону. Звідси і запитання: чому, незважаючи на значну кількість і різноманітність противірусних препаратів, герпетична інфекція, як і раніше, погано піддається лікуванню? Останні звіти показують, що стійкість ВПГ до протигерпетичних аномальних нуклеозидів зростає протягом останніх років. Тому, найбільш перспективним є шлях створення антивірусних препаратів, які впливають на перші стадії репродукції вірусів - адсорбцію та злиття вірусів з клітиною. Нові антивірусні препарати моделюються як ліганди імітації або імітатори рецепторів, що конкурентно заміщують природні компоненти при взаємодії з клітиною хазяїна. Вірус імунодефіциту людини. Синдром набутого імунодефіциту вперше було зафіксовано в США у 1983 році. Протягом двох місяців хворий помер. В даний час близько 14 000 нових випадків інфікування відбуваються щодня. Збудником є вірус, що має вигляд спіральки у трикутній серцевині. Він носить назву ВІЛ (вірус імунодефіциту людини) і має три типи: ВІЛ 1 та ВІЛ 2, що є дуже поширеними у Західній Європі,та ВІЛ 3, на який страждають переважно американці та африканці. Вірус вражає Тлімфоцити, що служать для його розмноження, та макрофаги, що розносять його по організму. Сам по собі СНІД не є смертельною хворобою, але функціонування його вірусу у організмі впливає на імунну систему так, що навіть проста нежить може призвести до смерті людини. ВІЛ руйнує Т-лімфоцити, і це призводить до втрати організмом захисних реакцій, в наслідок чого активізується так звана умовно-патогенна флора організму і різко підвищується ймовірність смертельних запалень, уражень нервової системи, розвитку онкологічних захворювань. Джерелом інфекції є безпосередній носій ВІЛу. Зараження можливе лише при статевому контакті з інфікованим чи при кровообміні з ним. Якщо ВІЛ-інфікована жінка народжує дитину, то за останніми дослідженнями, ця дитина зовсім не обов'язково має бути носієм вірусу. Антиретровірусна терапія дозволяє знизити ризик передачі вірусу від матері до дитини всього лише до 6 відсотків. (Sepkowitz КА. "AIDS-the first 20 years". N. Engl. J. Med. 2001, 344 (23):1764-72. Divisions of HIV/AIDS Prevention HIV and Its Transmission. Centers for Disease Control & Prevention, 2003). Перший антиретровірусний препарат, відомий як азидотимидин був синтезований в 1964 році, а в 1987 році він був схвалений для лікування ВІЛ-інфекції та з тих пір широко використовується в практиці (Balzarini J., Naesens L, Aquaro S., Knispel Т., Pemo C.-F., De Clercq Е., Meier C.: Intracellular Metabolism of CycloSaligenyl 3'-Azido-2'-3'-dideoxythymidine 7 UA 104484 C2 5 10 15 20 25 30 35 40 45 50 55 Monophosphate, a Prodrug of 3'-Azido-2'-3'-dideoxythymidine (Zidovudine). Molecular Pharmacology 1999; 56: pp. 1354-1361). В середині 90-х стали доступні перші інгібітори протеаз, в тому числі саквінавір, ритонавір і індинавір. Їх використання дозволило знизити смертність з 38 до 22 відсотків (Cameron DW, Heath-Chiozzi M, Danner S, Cohen C, Kravcik S, Maurath C, Sun E, Henry D, Rode R, Potthoff A, Leonard J. Randomised placebo-controlled trial of ritonavir in advanced HIV-1 disease. The Advanced HIV Disease Ritonavir Study Group. Lancet. 1998; 351 (9102):543-9). У 1996 році був запропонований перший ненуклеозидний інгібітор зворотної транскриптази невірапін та ще один інгібітор протеази нелфінавір. У Європі використання нових препаратів дозволило знизити пов'язані зі СНІДом захворювання з 30,7 % до 2,5 % (Harrington M, Carpenter CC. Hit HIV-1 hard, but only when necessary. Lancet 2000 Jun 17, 355 (9221).2147-52). Однак, незважаючи на велику кількість досить дорогих протиретровірусних препаратів, для цього вірусу теж існує проблема стійкості до запропонованих препаратів. Тому пошук нових препаратів здатних інактивувати багато білків ВІЛ, не припиняється, а останнім часом ще підсилюється. Особливо гостро стоїть потреба в препаратах, здатних не тільки інгібувати репродукцію ВІЛ, а також одночасно пригнічувати реплікацію інших вірусів, наприклад вірусів гепатиту, які часто супроводжують захворювання на СНІД. Ентеровіруси - віруси сімейства Picornaviridae. Вони включають 67 патогенних для людини серотипів: 3 типи вірусів поліомієліту, 23 типи вірусів Коксакі А, 6 типів вірусів Коксакі В, і інш. Назва ентеровірусів пов'язана з їх репродукцією в ШКТ, однак ентерит вони викликають рідко. Ентеровіруси людини містять одноланцюжкову РНК, що кодує поліпротеїн, який розщеплюється на 11 різних білків. РНК оточена ікосаедричним капсидом, що містить 4 вірусних білка (VP1VP4). VP1 - основна мішень нейтралізуючих антитіл. Ентеровіруси поширені повсюди. Вірус Коксакі викликає у людини різні захворювання, найчастіше - бактеріальний менінгіт і міалгію. Ці захворювання протікають у травному тракті, як і всі захворювання, викликані ентеровірусами. Розрізняються типи А і В. Тип А включає в себе близько 24 вірусів-збудників таких захворювань як герпетична ангіна, бактеріальний менінгіт, перикардит, загальні гарячкові інфекції і т.п. Тип В викликає хворобу Борнхольм (плевродінії, міалгію). Клінічні симптоми вірусів А і В чітко відрізняються один від одного. Тип В4 діє на центральну і периферичну нервові системи, при цьому можуть спостерігатися головні болі, болі в потилиці і в грудях. Потреба в нових противірусних препаратах. В даний час існує необхідність розробки нових противірусних препаратів з різними механізмами дії проти різних вірусних захворювань. Ці препарати повинні втручатися в механізми, відповідальні за проникнення вірусів у клітину-хазяїна і їх вивільнення з неї. Можливість створення препаратів, здатних пригнічувати багатьох представників сімейства вірусів, була заснована на відкриттях Чарльза Джейнвей і його послідовників (Janeway Jr., C.A., Approaching the asymptote? Evolution and revolution in immunology, Cold Spring Harbor Symposia on Quantitative Biology, 1989, 54, 1, pp. 1-13). По-перше, було показано, що всі живі організми мають уроджений імунітет. Цей уроджений імунітет існує на генетичному рівні і забезпечує здатність організмудо боротьби з чужими мікроорганізмами, трансплантантами, токсинами, пухлинними клітинами, і клітинами, інфікованими вірусами. Система уродженого імунітету включається з появи першого збудника і реагує на деякі класи антигенів, специфічних для збудника організмів. По-друге, клітини уродженого імунітету мають рецепторами, так званими Toll-подібними рецепторами, (TLR), які визнають ці класи антигенів і активують уроджений імунітет. По-третє, TLR специфічні для певного класу інфекцій, тобто здатні розпізнавати певний тип чужих молекул, наприклад, РНК вірусу, а не взагалі нуклеїнові кислоти. Люди мають більше десяти TLR-ів, кожен з яких спеціалізується на певному класі патогенів. Один визнає РНК вірусних інфекцій, інший - полісахариди бактерій, ще інший - білки одноклітинних паразитів, і т.д. Рецептори знаходяться на різних типах клітин, включаючи клітини шкіри і епітелію. У разі впізнання вірусу, фактор інфікованої клітини з допомогою TLR може відключити синтез вірусних білків, щоб почати запрограмовану загибель зараженої клітини (апоптоз). Імунні клітини, які виявили вірус, можуть поширювати сигнали для експресії цитокінів, факторів, що викликають запалення, а також можуть виділяти антивірусні фактори, такі як інтерферон. Короткий опис винаходу Оскільки, до цього часу більшість противірусних препаратів діяли тільки на один чинник інфекції, віруси дуже швидко виробляли стійкість до цих препаратів. 8 UA 104484 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід пропонує сполуку та спосіб лікування, який забезпечує множинну дію препарату на декілька етапів розвитку вірусів. Така тривала та стійка противірусна дія препарату унеможливлює швидке вироблення вірусом стійкості до таких препаратів. Оскільки, цілий ряд вірусних захворювань супроводжується дією багатьох вірусів, що вимагає застосування в клініці багатьох противірусних препаратів, даний винахід пропонує препарат, який здатний протидіяти багатьом вірусам. Наприклад, при ГРВІ хворі часто зустрічаються з комплексною інфекцією вірусів грипу і парагрипу, а застосування запропонованого препарату дозволяє подолати декілька цих вірусів. Подібна картина відмічається при захворюванні на СНІД, де часто разом з вірусом ВІЛ виявляють віруси гепатиту. Раніше запропоновані лікарські препарати на основі рибонуклеїнових кислот є хімічно синтезованими сполуками, вони досить дорогі і з точки зору технології їх використання не придатні для лікування масових вірусних захворювань. Даний винахід пропонує препарат, створений на основі дешевої природної субстанції дріжджової рибонуклеїнової кислоти, який можна використовувати в масовому порядку в вигляді капсул, таблеток та інших доступних лікарських форм. Такі вірусні інфекції як СНІД, гепатит С та інші вимагають тривалого комплексного лікування разом з антибіотиками та іншими противірусними препаратами, які часто супроводжуються високою токсичністю та впливом на психо-нервову діяльність пацієнтів. Даний винахід пропонує препарат, який є нетоксичним і не має побічних наслідків при довготривалому комплексному лікуванні. В той же час, в даному винаході було показано, що РНК сполуки, які схожі за своєю конформацією на РНК вірусу, здатні активувати імунну систему і діяти як антибіотики по відношенню до різних вірусів, що викликають важкі захворювання у людей, такі як пандемія грипу, гепатиту С, генітального герпесу та СНІД. Високо очищена дріжджова РНК, яка піддалася термообробці, мала, відповідно, покращені противірусні властивості. Як описано нижче, було виконане комплексне вивчення препаратів, що містять дріжджову рибонуклеїнову кислоту (РНК) в різних, in vitro та in vivo моделях. Використані моделі відповідають певним типам вірус індукованих захворювань. Дія РНК-вмісних препаратів була порівнянна з дією ліків, які в даний час схвалені для противірусної терапії. 1. Моделі грипозної інфекції in vitro і in vivo. Антигрипозну активність препарату in vitro визначали на перещеплюваній культурі клітин MDCK (клітини нирки собаки) із суцільним шаром відповідно до рекомендацій (Preclinical drug research: guidelines. - Kyiv, 2001. - С. 371-396). Антигрипозну активність препарату in vivo вивчали на моделі грипозної пневмонії у мишей за профілактичною та лікувальною схемами. Було показано, що РНК-ові препарати можуть бути застосовані для лікування грипу. У конкретному варіанті, максимально переносима концентрація (МПК) становить 5000 мкг/мл, мінімально активна концентрація (МАК) становить 31 мкг/мл, а хіміотерапевтичний індекс (ХТІ) становить 161. Ефективна доза композиції екстракту РНК та цукру, коли цукром є, наприклад, манітол (РНКМ), розрахована in vitro в межах 1.25-10 мг/мл в профілактичних цілях і 0,6-10 мг/мл для лікування. Висока антигрипозна активність препарату була продемонстрована при профілактичному лікуванні мишей при внутрішньочеревному та внутрішньовенному введенні в дозах від 15 до 150 мг/кг. У разі інтраназального введення, наприклад, ефективна доза була в десять разів вищою. Було встановлено, що антигрипозна дія РНК-М пов'язана з пригніченням нейрамінідази і гемаглютиніну вірусу грипу. Крім того, сполука екстракту РНК - цукор є пролонгованим індуктором альфа-інтерферону in vivo. В подальшому дозу введення розраховували за кількістю РНК в сполуці. Таким чином, на моделях in vitro та in vivo, які використовувалися для оцінки протигрипозної дії препаратів показано, що отримана з дріжджової РНК сполука характеризується потужною противірусною активністю. Оскільки РНК-М має антинейрамінідазну і гемаглютинінпригнічуючу дію, цей препарат може розглядатися як такий, що має специфічну антигрипозну активність. 2. In vitro та in vivo моделі віруси гепатиту. Разом з тим, в даному винаході було продемонстровано анти-HCV активність похідних сполук дріжджової РНК на експериментальній моделі суспензійної культури клітин МТ-4, інфікованої вірусом гепатиту С (HCV) та на новій моделі продукуючої культури клітин трансфікованих кДНК HCV (МТ-4-HCV кДНК модель), а також на сурогатній тест-моделі віруса гепатиту С з вірусом бичачої діареї (BVDV). Було встановлено, що препарат РНК-М досить ефективний проти вірусу гепатиту С, зокрема, ВГС людини. 9 UA 104484 C2 5 10 15 20 25 30 35 40 45 50 55 Результати дослідження ефективності препарату, що містить екстракт очищеної РНК, наприклад, виділений з дріжджів, в поєднанні з цукром, наприклад, манітом, на моделі культури МТ-4, інфікованої ВГС показали, що в кращому варіанті використання препарату на основі РНК МПК становить 50 мг/мл, а МАК становить 0,25 мг/мл, а хіміотерапевтичний індекс дорівнює 200. Результати досліджень антивірусної активності препарату, що містить по суті очищений екстракт РНК, наприклад, виділений з дріжджів, в поєднанні з цукром, наприклад, з манітом, на моделі MDVK-BVDV показують, що в концентрації щонайменше близько 1 мг/мл, препарат пригнічує розмноження вірусів на 2,0 Lg ID50, а в концентрації не менше 0,5 мг/мл - відповідно на 3,0 Lg ID50. Таким чином, препарат РНК-М може бути класифікований як високоефективний антивірусний препарат, здатний інгібувати реплікацію ВГС людини. Результати експерименту також показали, екстракт очищеної РНК, наприклад, з дріжджів, в поєднанні з цукром, наприклад, манітом, корисно використовувати в терапії пацієнтів, хворих гепатитом. Зокрема, була підтверджена висока ефективність лікування пацієнтів з гепатитом С з поліпшенням почуття пацієнтів, стабілізацією біохімічних показників, зниженням кількості копій вірусу у взірцях виділених в сироватці крові хворих. Сполука добре переноситься, побічних ефектів не було зареєстровано. Встановлено, що РНК-препарат має потужну протигерпетичну дію. Зокрема, препарат, що містить екстракт очищеної РНК, наприклад, з дріжджів, в поєднанні з цукром, наприклад, з манітом, виявився активним протигерпетичним агентом. В кращому варіанті, його вірусінгібуюча активність in vitro, лежить в межах від 60 до 1000 мкг/мл, його МАК складає 60 мкг/мл, МПК становить 5000 мкг/мл, а хіміотерапевтичний індекс складає 83,3. Ефективність препарату in vitro, що містить по суті очищений екстракт РНК, наприклад, з дріжджів, в поєднанні з цукром, наприклад, манітом, при профілактичній та лікувальній схемах введення, знаходиться в широкому діапазоні концентрацій від 0,6 до 10 мг/мл. Препарат в профілактичній дозі 0,1 мг/мл і в лікувальній дозі 1 мг/мл не впливає негативно на мітотичний індекс та на кількість патологічних мітозів. Зокрема, на моделі герпетичного менінгоенцефаліту при внутрішньочеревному введенні 0,5 мг/кг сполуки РНК-манітол (РНК-М) за лікувальної схеми введення, індекс ефективності складає 41.2. Зокрема, дуже ефективне використання мазі РНК-М при місцевому застосуванні на моделі генітального герпесу. При профілактичній (в дозах від 0,1 мг/мл) і при лікувальній (в дозі 1,0 мг/мл) схемах введення РНК-М, індекс терапевтичної активності (ІТА) склав відповідно 100 % і 73,2 %. У дослідах на тваринах виявилося, що РНК-М перевершує дію Virolex ®, який використовувався як референтний препарат. Результати, отримані на моделях in vitro та in vivo, які використовувалися для відбору протигерпетичних препаратів, дають можливість зробити висновок, що комбінація екстракту очищеної РНК, наприклад, з дріжджів, разом з цукром, наприклад, з манітом, має потужну протигерпетичну дію. Було продемонстровано, що вона ефективна при лікуванні вірусного герпетичного захворювання, зокрема для лікування герпесу статевих органів. 4. In vivo моделі віруса СНІДу. Відповідно до цього винаходу, показано, що екстракт очищеної РНК, наприклад, з дріжджів, в поєднанні з цукром, наприклад, з манітом, ефективно інгібує реплікацію ВІЛ. Зокрема, була продемонстрована ефективність РНК-М в лікуванні ВІЛінфікованих пацієнтів і як наслідок дії - зниження рівня вірусного навантаження та збільшення + кількості CD4 T-лімфоцитів. 5. In vivo моделі ентеровірусів. Відповідно до цього винаходу показано, що екстракт очищеної РНК, наприклад, з дріжджів, в поєднанні з цукром, таким як маніт, є високоактивним противірусним засобом, з високою антиентеровірусною дією. 6. Склад і введення препарату. Як правило, введення сполуки очищеної РНК після температурної обробки з цукром для профілактичної дії може бути в дозі не менше 0,1 мг/кг/на день, і для лікування близько 10 мг/кг/на день, принаймні з одним фармацевтичним транспортним засобом, наприклад з прийнятним носієм, наповнювачем і розчинником. Далі дозу введення препарату розраховують за кількістю РНК в сполуці. Для профілактики грипу, при внутрішньочеревному або внутрішньовенному введенні найкраще застосовувати препарат в концентрації від приблизно 1,5 до приблизно 10 мг/кг/добу, а при інтраназальному введенні, найкраще щонайменше 2,5 мг/кг/день, або ще краще щонайменше близько 25 мг/кг/добу. Для лікування грипу при внутрішньочеревному або внутрішньовенному введенні, краще застосовувати препарат в дозах від близько 1,5 до приблизно 25 мг/кг/добу, а при інтраназальному введенні, переважно від близько 2,5 до приблизно 25 мг/кг/день, та найкраще переважно щонайменше близько 50 мг/кг/добу. 10 UA 104484 C2 5 10 15 20 25 30 35 40 45 50 55 60 Краща ефективна доза для пригнічення гемаглютинації, близько 1 мг/мл, ще краще щонайменше близько 10 мг/мл. Краща ефективна доза для пригнічення розмноження вірусу гепатиту С в культурі клітин щонайменше 0,25 мг/мл, ще краще щонайменше 0,5 мг/мл. Для профілактичних і лікувальних схем введення при лікуванні герпетичного захворювання агента ефективна доз знаходиться в широкому діапазоні концентрацій від 0,6 до 10 мг/мл. Ефективна доза для профілактичних і лікувальних схем введення препарату находиться в широкому діапазоні концентрацій від 0,1 до 10 мг/мл сполуки екстракту очищеної РНК, наприклад, з дріжджів, з цукром, наприклад, з манітом, зокрема в профілактичних дозах вона є від 0,1 до 1,0 мг/мл, і в лікувальних дозах від 1,0 мг/мл до 10 мг/мл. Профілактична доза 0,1 мг/мл і лікувальна доза 1 мг/мл не впливає несприятливо на мітотичний індекс, та на кількість патологічних мітозів. Наприклад, ефективна доза препарату становить 5-10 мг РНК на 1 кг ваги пацієнта в день. Тривалість лікування антивірусними РНК-М переважно від 7 днів при ГРВІ по крайній мірі, близько 3-5 місяців для вірусів герпесу і до 1,5 років і більше для вірусу гепатиту С. Короткий опис рисунків. Малюнки 1-10 є графіками вимірювання динаміки середніх значень суб'єктивних скарг та об'єктивних симптомів захворювання, відповідно (1) висока температура тіла, (2) головний біль (3) катаральні ознаки, (4) загальна слабкість, (5) білю в суглобах, (6), міалгія, (7), свербіж і печія в носі, (8), стомлюваність (9) лихоманка, і (10) біль в горлі. Малюнки 11-14 є порівняльними діаграмами, що показують відповідність між дослідною та контрольною групами хворих підгрупи, заражених різними вірусами, відповідно, (11) вірус грипу А (12) вірус грипу В, (13) вірус парагрипу, а також (14) аденовірус, відповідно з основними змінними (І) час нормалізації температури, (II) час проходження головного болю, і (III) час відчуття загальної слабкості. На малюнку 15 показані результати електрофорезу для малих РНК в 15 % ПААГ, що містить DS-Na та 7М сечовини, препаратами: Е. Соlі тРНК (смуга-1, сектор-а), 25-членний олігорибонуклеотид (смуга-1, сектор-б) високоочищена дріжджова РНК (смуга-2), натрієва сіль дріжджової РНК (смуга-3). Детальний опис винаходу Приклад 1. Приклад методу для отримання противірусних РНК Приклад 1.1 Виділення, очищення та аналіз РНК. Оскільки препарат на основі РНК містить екстракт високоочищеної РНК, наприклад, дріжджової РНК, для виділення і очищення РНК можуть бути з успіхом використані два види дріжджів Saccharomyces cerevisiae і Candida utilis. Відповідно до винаходу, також можуть бути використані препарати промислових дріжджових РНК, виділені з цих двох видів дріжджів. Може бути також використана РНК, виділена і отримана з інших джерел, якщо вона відповідає вимогам противірусної ефективності, як описано тут. Найкращими є відповідні критерії по молекулярній масі і чистоті виділеної РНК; по молекулярній масі, бажано, щоб РНК складалася головним чином з фрагментів з 25±10 нуклеотидів, що відповідає діапазону молекулярної маси від 4200 до 9800. Наприклад, екстракт РНК містить не менше 75 % від ваги олігонуклеотидів з молекулярною масою від 4200 до 9800, більш переважно не менше 90 % від маси фрагментів, які мають від 20 до 25 нуклеотидів, із загального екстракту дріжджової РНК. Переважно, частка по відношенню до вищевказаних діапазонів кількості нуклеотидів або діапазонів молекулярних мас, або обох, повинна бути принаймні 95 %, ще більше переважно по 100 %, в прикладі, принаймні 99 %. Переважно, одна або декілька наступних умов: молекулярна маса становить близько 7000; вміст азоту вище 14 %, вміст фосфору перевищує 8,5 %, вміст ДНК становить менше 1 %, негативний вміст білка, відповідно до біуретового тесту. Наприклад, очищений екстракт РНК містить більше 14,5 % від маси азоту і більше 8,5 % від маси фосфору. Екстракт очищеної РНК переважно практично не містить білків, ДНК і нуклеотидів, наприклад, принаймні 95 % за вагою, з чистотою переважно щонайменше 99 %. Молекулярна маса може бути визначена за допомогою електрофоретичного дослідження малих РНК в 15 % поліакриламідному гелі (ПААГ), що містить DS-Na та 7М сечовину (Mette M.F., Autsatz W., van der Winden J., Matzke M.A., Matzke A. J.M. Transcriptional silencig and promoter methylation triggered by double-stranded // EMBO J.-2000.-19.- P. 5194-5201). Наприклад, електрофоретичне дослідження екстракту дріжджової РНК показало суттєві відмінності молекулярної маси (рис. 15). Як видно на малюнку 15, відповідно до молекулярної маси маркерів tRNA Е. Соlі і 25 членного олігорибонуклеотида, високоочищена дріжджова РНК міститься як однорідна смуга в зоні, яка відповідає 25-нуклеотидам, в той час як натрієва сіль дріжджової РНК переміщається як гетерогенна смуга, починаючи з маркеру tRNA з 11 UA 104484 C2 5 10 15 20 25 30 35 40 45 50 55 молекулярною масою 19000, і весь шлях до смуги 25 членного олигонуклеотида з молекулярною масою 7000. Це вказує на високий ступінь очищення дріжджової РНК, цілком однорідної відповідно до молекулярної маси і містить головним чином по суті 25±10 нуклеотидів. Метод очищення загальної РНК дріжджів може бути використано, як описано в повному обсязі в патенті США № 6737271, зміст якого включено як посилання (Tkachuk Z., Compound, composition and method for the treatment of inflammatory and inflammatory-related disorders. U.S. Patent No. 6,737,271, May 18, 2004). Для отримання готової РНК-композиції для профілактичного або терапевтичного використання екстракт очищеної РНК може бути модифікований. В композиції РНК-вмісного препарату, яка використовується як противірусний засіб, відповідно до винаходу, кількість очищеного екстракту РНК в готовому до використання складі є за вагою принаймні близько 50 %, переважно близько від 60 до 80 %, більш переважно близько від 65 % до 75 %, ще більш переважно щонайменше близько 70 %. Відповідно до винаходу готова до використання сполука також містить цукор, в пропорції, де екстракт РНК: цукор складає переважно від 1,5:1 до 3,5:1 співвідношення за вагою, більш переважно приблизно від 2:1 до приблизно 3:1, більш переважно близько 2,5:1. Таким чином, взята як приклад РНК-М має манітол в пропорції РНК: манітол 2,5:1, тобто, цей препарат містить не менше 70 % РНК. Замість маніту або на додаток до маніту можуть бути використані інші види цукру, наприклад, лактоза для РНК-Л, використовується як загальна кількість цукру в пропорції, що описана вище. Щодо прикладу РНК-аргінін (і/або лізин, гістидин, спермін, спермідин, гуанідин), частки екстракту РНК та лужної органічної сполуки в данім препараті складає переважно близько від 1:1 до 2:1 за вагою, більш переважно від 2.5:2 до 3.5:2, ще більш переважно близько 3:2. Таким чином, взята як приклад РНК-А має пропорцію РНК: аргінін 3:2. Інші лужні амінокислоти лізину і гістидину, а також сперміну, спермідину, і гуанідину можуть бути використані в тих же пропорціях. Відповідно до іншого аспекту винаходу, готова з екстракту РНК та цукорвмісна сполука отримується шляхом нагрівання екстракту РНК принаймні з одним цукром, таким як маніт. Температура нагріву, наприклад, знаходиться в діапазоні близько від 40 до близько 70 °C і переважно близько від 50 до 70 °C, більш переважно близько від 55 до близько 65 °C, наприклад, близько до 60 °C. Таким чином, як приклад для отримання композиції на основі РНК-М, готується суміш дріжджової РНК: манітол в пропорції 2,5:1, яку розчиняють у воді, підігрівають до температури 60-65 °C і витримують протягом 10 хвилин. Потім розчин охолоджують до кімнатної температури і висушують у вакуумі. Висушена композиція використовується для дослідження противірусних властивостей, як описано нижче. Як додаткові речовини в композиції можуть бути використані різні цукри, такі як маніт, або лактоза, лужні амінокислоти, такі як аргінін, лізин, гістидин та аліфатичні поліаміди, такі як гуанідин, спермін та спермідин. Наприклад, екстракт РНК-А обробляють лужною амінокислотою, такою як аргінін. В готовій для використання сполуці можуть використовуватися різні фармакологічно прийнятні наповнювачі, носії та розчинники. Приклад 1.2. Модифікація і відбір РНК з противірусною активністю. Відомо, що більшість протигрипозних препаратів, такі як Tamiflu та інші, діють тільки проти нейрамінідазної активності і не пригнічують рецептори гемаглютиніну. Тому ми вирішили провести спочатку відбір препаратів з антигемаглютиніновою активністю. Реакція гемаглютинації була проведена паралельно з 1 % курячими еритроцитами або 0,75 % еритроцитами морської свинки відповідно до загальноприйнятої методології (Посібник з лабораторної діагностики вірусних захворювань і рикетсій, Москва, Медицина, 1965, стор 136.) Антигемаглютинінову активність високоочищеної дріжджової РНК, її аргінінової і натрієвої солей вивчали в концентрації 1 % і 3 %. Як показали результати експерименту, представлені в таблиці 1.2.1. нижче, дріжджова РНК та її натрієва сіль не мають антигемаглютинінової активності, в той час як аргінінова сіль дріжджової РНК, особливо в концентрації 1 %, має істотну антигемаглютинінову активність. 12 UA 104484 C2 Таблиця 1.2.1 Вплив препаратів РНК на активність гемаглютиніну вірусу грипу АСМ 1/47 (H 1N1) Препарат Дріжджова РНК Концентрація препарату Титр вірусу в досліді в Різниця даних досліду і контролю x x в% lg2 в lg2 5 10 7 1 1 Аргінінова сіль РНК РНК-А Натрієва сіль РНК-Н Контроль вірусу 3 8 0 3 5 3 1 1 3 4 7 8 4 1 0 8 На другому етапі ми вивчали комплексні препарати дріжджової РНК та цукрів, таких як маніт (М) і лактоза (Л), які часто використовуються у виробництві лікарських препаратів як додаткові речовини. Для приготування кінцевої композиції дріжджової РНК і маніту, ми вивчали вплив температури на їх розчини шляхом визначення їх антигемаглютинінової активності. Водний розчин дріжджової РНК і маніту готували у вагових співвідношеннях 2,5:1, які потім витримували по 10 хв. відповідно при 50, 60, 70, 80 та 90 С°, а також при кімнатній температурі. Потім розчини РНК і маніту охолоджували до кімнатної температури, висушували і вивчали вплив отриманого препарату РНК-М в концентрації 0,5 мг/мл на гемаглютинуючу активність вірусу грипу AFM 1/47 H1N1. За контроль служили вихідні розчини дріжджової РНК та маніту. Результати досліду представлені в таблиці 1.2.2. нижче. Таблиця 1.2.2 Вплив температури реакції на активність гемаглютинін вірусу грипу АСМ 1/47 H1N1. Препарат РНК Маніт РНК+Маніт РНК+Маніт РНК+Маніт РНК+Маніт РНК+Маніт РНК+Маніт Контроль вірусу 15 20 Температура реакції в С° 30 30 40 50 60 70 80 90 Титр вірусу в досліді в х Іg2 7 8 6 5 4 5 6 7 Різниця титру вірусу в досліді в х Іg2 1 0 2 3 4 3 2 1 8 Як показали результати експерименту, комбінований препарат РНК-М отриманий шляхом нагрівання при 60±10 °C, істотно знижують активність гемаглютиніну вірусу грипу. Найкраща антигемаглютинінова активність була продемонстрована при нагріванні розчину РНК і манітолу при 60 °C. Далі ми досліджували противірусну активність препаратів, отриманих при оптимальній температурі, який ми позначили як РНК-М. Ми припустили, що інші цукри в поєднанні з дріжджовою РНК також будуть стимулювати його антигемаглютинінову активність. Був проведений порівняльний аналіз антигемаглютинінової активності препарату дріжджової РНК з використанням цукру лактози (РНК-Л), приготовлений при температурі 60 °C, як описано вище для отримання РНК-М. Результати порівняльного аналізу представлені в таблиці 1.2.3. нижче. 25 13 UA 104484 C2 Таблиця 1.2.3 Вплив РНК-М і РНК-Л у концентрації 10 мг/мл на активність гемаглютиніну вірусу грипу АСМ 1/47 H1N1. Препарат Титр вірусу в контролі, в х Іg2 Титр вірусу в досліді в х Іg2 Різниця титру вірусу, в х Іg2 9 9 9 5 7 4 2 Контроль вірусу РНК-М РНК-Л 5 Як видно з результатів досліду, найвищу антигемаглютинінову активність вірусу грипу AFM 1/47 H1N1 проявляє препарат дріжджової РНК, який піддавали температурній обробці в суміші з манітом. Одночасно ми вивчили інші полірибонуклеотиди на їх антигемаглютинінову активність. Як видно з результатів досліду, представленого в таблиці 1.2.4, тільки препарат полії проявляв виразну антигемаглютинінову активність вірусугрипу AFM 1/47 Н1N1. Таблиця 1.2.4 Вплив препаратів полірибонуклеотидів у концентрації 10 мг/мл на активність гемаглютиніну вірусу грипу АСМ 1/47 H1N1 Препарат Полі А Поліаденілова кислота Полі С Поліцитиділова кислота Полі I Поліінозилова кислота Полі G Полігуанілова кислота Полі U Поліуридилова кислота Полі IС Поліінозинова: поліцитидилова кислота Контроль вірусу 10 15 20 25 Титр вірусу в контролі, Титр вірусу в досліді, Різниця у титрах вірусу, х х х в Іg2 в Іg2 в Іg2 9 7 2 9 7 2 9 6 3 9 9 0 9 9 2 9 9 3 9 9 Сполуки Poly, С, І, G, і РоІуІС були отримані з Науково-виробничого об'єднання "Вектор" Бердянськ, Росія. Як видно вище з таблиці 1.2.4., препарати полірибонуклеотидів мають низьку антигемаглютинінову активність. Тільки дволанцюгова поліінозилова та поліцитидилова кислоти і одноланцюгова поліінозилова кислоти показали значну антигемаглютинінову активність, але вона була нижчою, ніж РНК-М. Оскільки отримана при температурі 55-65 °C РНК-М показала максимальну антигемаглютинінову активність, вона була використана для подальшого дослідження противірусної активності в моделях in vitro та in vivo. Приклад 2. Підсумок експериментальних моделей і результати Приклад 2.1. Моделі вірусів грипу. Приклад 2.1.1. Модель вірусу грипу in vitro. Препарати. Досліджуваний препарат РНК-М, Таміфлю (Tamiflu-Oseltamivir) фірми "Rochen" (75 мг у капсулі). ПоліІ:ПоліЦ - еталонний індуктор інтерферону (ІФН) фірми "Calbiochem". Нейрамінідаза - препарат нейрамінідази з Astrobacter ureafacнeris 1 unit Calbiochern. Віруси. Вірус грипу в дослідах in vitro: A/FM/1/47(H1N1), інфекційний титр в MDCK-3,0-7,0 Ig ID50. Вірус грипу в дослідах in vivo: A/FM/1/47(H1N1), адаптований до легенів білих мишей, який пройшов 15 пасажів на мишах, інфекційний титр - 4,0 Ід ID50, 100 % летальність тварин спостерігалася протягом 5 діб. Вірус везикулярного стоматиту, штам Індіана, одержаний з 14 UA 104484 C2 5 10 15 20 25 музею вірусів Інституту вірусології ім. Д.І. Івановського РАМН (Москва). Інфекційний титр у культурі тканин L41 становив 4,0-5,0 lg ТЦД50. Клітинні культури. MDCK - перещеплювана культура клітин нирки собаки, середовище для культивування: RPMI-1640+10 % фетальної сироватки великої рогатої худоби + антибіотики. L41 - лімфобластоїдні клітини людини. ОН-1 - лімфобластоїдні клітини миші. Визначення МПК та МАК. За МПК вважали його найбільшу дозу, яка не спричиняла дегенерації клітин, а МАК являє собою мінімальну кількість препарату, яка гальмує розвиток вірусоспецифічної цитопатогенної дії (ЦПД) на 50 %. ХТІ препарату стосовно вірусу грипу визначали шляхом встановлення співвідношення МПК до МАК. Відсутність ЦПД у досліді, при наявності його в контролі вірусу, а також різниця інфекційного титру в досліді у порівнянні з контролем вірусу грипу, дозволили розрахувати МАК препарату. Антигрипозну активність препарату РНК-М in vitro визначали на перещеплюваній культурі клітин MDCK (клітини нирки собаки) із суцільним шаром. Антигрипозну активність РНК-М in vivo вивчали на моделі грипозної пневмонії у мишей за профілактичною та лікувальною схемами. Неінбредним мишам внутрішньочеревно, внутрішньовенно або інтраназально вводили розчин препарату РНК-М за 24 год. до інтраназального інфікування вірусом грипу, адаптованого до легеневої тканини мишей, у дозі 10 LD50 (профілактична схема) і через 24 год. після зараження вірусом грипу (лікувальна схема). Одночасно ставили контроль вірусу грипу для профілактичної та лікувальної схеми дослідів. Ефективність дії препарату оцінювали за індексом ефективності інгібіції летальності та інфекційного титру вірусу грипу в легеневій тканині мишей [12]. Антигрипозну активність препарату РНК-М in vitro вивчали на, перещеплюваній культурі клітин MDCK (клітини нирки собаки) з суцільним шаром. Розрахована нами МПК РНК-М дорівнює 5000 мкг/мл, МАК - 31 мкг/мл, а ХТІ препарату становить 161. Показники МПК, МАК та ХТІ дозволяють віднести препарат РНК-М до високоактивних противірусних ліків. При проведенні випробувань по антигрипозній активності препарату РНК-М in vitro досліджували його профілактичну та лікувальну дію. Згідно з представленими нижче результатами в таблиці 2.1.1. при застосуванні профілактичної схеми введення РНК-М був ефективний у дозах 1,25-10 мг/мл, при лікувальній схемі - у дозах 0,6-10 мг/мл. 30 Таблиця 2.1.1 Антигрипозна дія препарату РНК-М in vitro Концентрація препарату, мг/мл 10 5 2,5 1,25 0,6 Контроль вірусу Вплив Профілактичний Лікувальний Інфекційний титр Показник Інфекційний титр Показник вірусу, ІgID50 інгібіції, ІgID50 вірусу, ІgID50 інгібіції, ІgID50 2,0±0,3 5,0±0,75 0 3,0±0,45 2,0±0,3 5,0±0,75 0 3.0±0,45 0 7,0±1,05 0 3,0±0,45 0 7,0±1,05 0 3,0±0,45 7,0±1,05 0 0 3,0±0,45 7,0+1,05 3,0±0,45 *Р 2 находиться в діапазоні концентрацій від 60 до 1000 мкг/мл, його МАК становить 60 мкг/мл, ХТІ 83,3. Відповідно до методичних рекомендацій (Guidelines: Pre-clinical drug research, Kyiv, 2001, pp. 371-396), речовину (або препарат) вважають такою, що має антивірусну активність, якщо рівень репродукції вірусу знижується на ІgID50=2 і більше. Це дозволяє віднести РНК-М до високоактивних антивірусних препаратів. Профілактичну та лікувальну дію препарату РНК-М in vitro вивчали на культурі клітин RK-13. Використовували ВПГ-1. штам VC, інфекційний титр 4,0 Іg ТЦД50 та ВПГ-2. штам ВН, інфекційний титр 4,0-5,0 Іg ТЦД50. При вивченні профілактичної дії препарату його в різних розведеннях вносили в культуру за 24 год. до інфікування вірусом, а при дослідженні лікувальної дії - через 24 год. після інфікування. Культуру інкубували в термостаті з подачею 24 UA 104484 C2 5 СО2 протягом 5 діб, щодня контролюючи за допомогою мікроскопа і відмічаючи репродукцію вірусу за ЦПД на клітини RK-13 у порівнянні з контрольними культурами, де моношар не піддавався ніяким впливам. Морфологічно ЦПД ВПГ на клітини виявляється в утворенні симпластів або округлих клітин у сполученні з появою гігантських багатоядерних клітин. Через 5 діб збирали культуральне середовище з лунок плашок і в ньому вивчали інфекційний титр у кожній пробі при профілактичній і лікувальній дії препарату. Результати реплікації ВПГ-1 і ВПГ-2 наведені в таблиці 2.3.1. нижче. Таблиця 2.3.1 Профілактичний і терапевтичний ефект РНК-М на ВПГ-1 і ВПГ-2 в культурі клітин RK13 Концентрація мг/мл ВПГ-1 Інфекційний титр, ІgТЦД50 10 5 2,5 1,25 0,6 Контроль вірусу 10 5 2,5 1,25 0,6 Контроль вірусу 10 15 1,0 1,0 1,0 1,0 2,0 4,0 4,0 2,0 1.0 1,0 0 4,0 ВПГ-2 Пригнічення в Інфекційний титр, ІgТЦД50 ІgТЦД50 Профілактична дія 3,0 1,0 3,0 1,0 3,0 0 3,0 0 2,0 0 4,0 Лікувальна дія ВПГ-1 0 1,0 2,0 1,0 3,0 1,5 3,0 0 3,0 0 5,0 Пригнічення, в ІgТЦД50 3,0 3,0 4,0 4,0 4,0 4,0 4,0 3,5 5,0 5,0 Аналіз одержаних результатів з визначення репродукції ВПГ-1 та ВПГ-2 (таблиці 2.3.1) свідчить про те, що РНК-М має високу протигерпетичну активність в широкому діапазоні концентрацій - від 0,6 до 10 мг/мл, як при профілактичній, так і при лікувальній схемах введення препарату в культуру клітин ВК-13. В клітинах НГВЩ заражених вірусом герпесу та оброблених РНК-М, вивчали мітотичний режим при профілактичній та лікувальній схемах введення препарату в концентрації 0,1 та 1 мг/мл, як показано в таблиці 2.3.2. нижче Таблиця 2.3.2 Вплив РНК-М на мітотичний режим клітин НГВЩ, інфікованих вірусом герпесу ВПГ Схема досліду Обробка і зараження клітин, доза, мг/мл Мітотичний індекс, % Аномальні мітози, % Профілактика РНК-М 1,0 + ВПГ 8,6 19,0 РНК-М 0,1 +ВПГ 19,4 19,3 ВПГ 8,7 35,8 Інтактні клітини 20,8 19,4 Лікування ВПГ + РНК-М, 1,0 20,3 18,0 ВІ1Г + РНК-М, 0,1 22,0 19,1 ВПГ 6,0 38,3 Інтактні клітини 21,6 17,5 РНК-М 1,0 10,9 21,3 20 Як видно з таблиці 2.3.2., при профілактичній схемі введення РНК-М у концентрації 0,1 мг/мл запобігав зміні мітотичного режиму клітин. Показник мітотичної активності в дослідних групах та в контрольній (інтактні клітини) майже не відрізнялися. Те ж саме реєструвалося і по показниках патологічних форм мітозів. Отже, у культурі клітин НГВПЦ, заражених ВПГ, препарат РНК-М у 25 UA 104484 C2 5 10 15 20 25 30 35 40 45 50 дозі 0,1 мг/мл при профілактичній дії та в дозах 0,1 та 1 мг/мл при лікувальній дії не справляв негативного впливу на рівень мітотичного індексу та кількість патологічних форм мітозу. Приклад 2.3.2. In vivo модель вірусів герпесу. Тварини. У дослідженні використовували білих неінбредних мишей масою 14-18 г, яких утримували в стандартних умовах віварію, морських свинок, мурчаків (самців), масою 250 300 г. Антигерпетичпу дію РНК-М щодо ВПГ-1 вивчали на моделі герпетичного менінгоенцефаліту. Тварин заражали вірусом герпесу шляхом введення в середину мозку в об'ємі 0,03 мл вірусної суспензії. Інфекційну активність вірусу герпесу визначали за летальністю тварин. Дана модель зручна для оцінки вираженості симптоматики, відзначається 100 % відтворенням, не потребує додаткових контролів. Розвиток клінічних симптомів починався на 56-ту добу з моменту інфікування і досягав максимуму на 13-14-ту добу, далі відмічалось зменшення вираженості симптоматики з наступним клінічним одужанням тварин, що вижили. Наявність гострої герпетичної інфекції підтверджувалась за допомогою імунофлюоресценції. Так, найбільш інтенсивне свічення спостерігалось в тканинах головного мозку (особливо в стовбурових відділах), яке з'являлось через 6-7 діб з моменту інфікування, що відповідає моменту виникнення клінічних ознак захворювання. Летальність тварин, інфікованих ВПГ, становила 100 %. Антигерпетичну активність РНК-М щодо ВПГ-2 вивчали на моделі генітальної герпетичної інфекції морських свинок, яку відтворювали шляхом зараження останніх вірусовмісною рідиною з інфекційним титром 5,0-5,5 Іg ТЦД50/мл за методикою, запропонованою Маренніковою (Marennikova S.S., Matsevich G.R., Chekunova E.V. et al., The development and use of new experimental models of different forms of herpes infection, Vopr. virusol., 1986, 1, pp. 59-65). Вірусовмісну рідину наносили на попередньо скарифіковану шкіру пенісу. Скарифікацію проводили за допомогою хірургічного ланцета після того, як тварини були анестезовані ефіром. 2 Розмір поверхні скарифікації дорівнював 4-7 мм . Вірусовмісну рідину наносили за допомогою піпетки відразу після скарифікації (з наступним втиранням). Клінічні симптоми експериментального герпесу геніталій реєстрували щодобово перед проведенням лікування і спостерігали протягом всього періоду хвороби. Критеріями оцінки тяжкості інфекційного процесу були поверхня і ступінь специфічних уражень, наявність набряку, гіперемії, орхіт. Максимальна вираженість кожної ознаки становила 4 бали. Спостереження за тваринами проводили протягом 21 доби. Кожна досліджувана група складалася з трьох тварин. Препарат наносили на скарифіковану і заражену поверхню 1 раз на добу протягом 5 діб. Як референс-препарат використовували мазь Віролекс фірми КРКА (Словенія), яку наносили як і досліджуваний препарат у вигляді аплікацій на поверхню рани щодобово протягом 5 діб. Лікування препаратом РНК-М та віролексом починали через 2 год. після інфікування. Антигерпетичну активність РНК-М в експериментах in vivo вивчали на моделі герпевірусного менінгоенцефаліту на білих безпородних мишах. Препарати РНК-М у дозі 0,5 та 5 мг/мл і віролекс у дозі 10 мг/кг вводили по 0,2 мл внутрішньочеревно через 24 год. після зараження вірусом герпесу. Показано, що в дозі 0,5 мг/кг РНК-М мав високу лікувальну ефективність, його індекс ефективності при цьому становив 41,2, тобто був майже на рівні стандартного препарату віролекс (50,0). Антивірусну активність РНК-М досліджували також на моделі генітального герпесу у морських свинок. Лікування препаратом РНК-М проводили у дозі 0,1 та 1 мг/кг маси до та після інфікування вірусом герпесу, як контроль використовували віролекс. Усього в досліді було шість груп тварин: тварини, яких заражали лише вірусом герпесу; тварини, яких заражали вірусом герпесу та лікували віролексом; тварини, яких заражали вірусом герпесу та лікували аплікаціями препарату РНК-М у дозі 1,0 мг/кг маси; тварини, яких заражали вірусом герпесу і лікували РНК-М у концентрації 0,1 мг/кг маси; тварини, яких обробляли РНК-М у дозі 1,0 мг/кг маси та заражали вірусом герпесу; тварини, яких обробляли РНК-М у дозі 0,1 мг/кг маси та заражали вірусом герпесу. 26 UA 104484 C2 Таблиця 2.3.3 Ефективність RNA-M на моделі генітального герпесу Препарат, доза, мг/кг Тривалість захворювання, діб Середня інтенсивність виявів захворювання СІВЗ Профілактика Індекс лікувальної дії ІЛД, % РНК-М, 1,0 0 0 100 РНК-М, 0,1 0 0 100 5,0 10 82 Віролекс Р > 0,001 > 0,001 > 0,001 Лікування РНК-М 1,0 20 25 30 35 5 14 73,2 9,75 22 56,0 Контроль вірусу 15 73,2 Віролекс 10 14 РНК-М, 0,1 5 7 15 56 0 > 0,001 > 0,001 > 0,001 Результати дослідження, представлені в Таблиці 2.3.3 показали, що при профілактичній дії препарату в дозах 0,1 та 1,0 мг/кг маси тварини середня інтенсивність вираженості захворювання (СІВЗ) дорівнювала нулю, а індекс лікувальної дії становив 100, тоді як аналогічні показники для віролексу були значно нижчими (табл. 3). Ефективність лікування тварин РНК-М після зараження вірусом виявилася також значно вищою, ніж при застосуванні стандартного препарату віролекс: показник СІВЗ для РНК-М становив 14, для віролексу - 22.0, а ІЛД - 73.2 та 56,0 % відповідно. 2.3.3. Лікування пацієнтів, хворих вірусом герпесу. Провідна роль у лікуванні герпесвірусних захворювань належить хіміотерапевтичним препаратам, які містять анормальні нуклеозиди (ацикловір та його похідні), які шляхом конкурентного пригнічення вірусної ДНК-полімерази інгібують синтез вірусної ДНК і реплікацію вірусу. Однак, ці препарати є токсичними, особливо при тривалому використанні, а в деяких випадках вони мало ефективні через розвиток стійкості до герпесвірусів. Тому в роботі використали препарат РНК-М для оцінки ефективності лікування пацієнтів з генітальним герпесом. У дослідження були відібрані пацієнти з генітальним герпесом. Реплікації вірусу герпесу 1 та 2 типу діагностували за допомогою полімеразної ланцюгової реакції, яку проводили з тампонів, отриманих з вагіни або зі зскрібка уретри. У всіх пацієнтів були зареєстровані високі концентрації (+ + +) ДНК-копії ВПГ 1 і 2 типу. Терапія препаратом РНК-М була призначена пацієнтам у дозі 0,5 г 3 рази на день після їди. Як контрольна група були використані пацієнти з аналогічними результатами ПЛР, які лікувалися "Placebo". Через місяць після лікування всі пацієнти були обстежені ще раз. В групі лікування препаратом РНК-М полімеразна ланцюгова реакція в 83,3 % пацієнтів була негативною, тільки в 16,7 % обстежень показали наявність ДНК збудника в низьких концентраціях (+). В контрольній групі 71,4 % пацієнтів були позитивним результатом наявності збудника при обстеженні методом ПЛР. Ці результати підтверджують ефективність і доцільність використання РНК-М при лікуванні генітального герпесу. Приклад 2.4. Моделі ВІЛ Приклад 2.4.1. Модель репродукції ВІЛ. Вірус імунодефіциту людини (еталонний штам BUI-1RF) - у вигляді продукуючої культури МТ4/ВІЛ LBK - Т-лейкоцити людини - продуцента вірусу імунодефіциту І типу, отриманий з музею вірусів Інституту вірусології ім. Д.І. Івановського. Вірус зберігався при -70 °C. Джерелом ВІЛ було культуральне середовище клітин МТ4/ВІІІ LBK. Попередньо було визначено, що інфікованість цих клітин досягала практично 100 %, за даними непрямої імунофлюоресценції з моноклональними антитілами до антигену р-24 ВІЛ-1. Тотожність вірусу, що продукується клітинами МТ4/ВІІІ LBK, з ВІЛ-1 було підтверджено в реакції нейтралізації. 27 UA 104484 C2 5 10 15 20 Культура клітин. Лімфобластоїдні клітини МТ-4, отримані з банку клітин Інституту експериментальної патології, онкології і радіобіології НАН України. Поживне середовище 1 складалось із 88 % середовища RPMI 1640 ("Sigma" ) з додаванням 10 % інактивованої прогріванням фетальної сироватки теляти ("Sigma") і антибіотиків. Клітини вирощували в пластикових флаконах ("Nunc") об'ємом 50 мл при 37 °C та 5 % СО2. Кожні 3-4 дні живі клітини підраховували за допомогою трипанового синього та розсівали в початковій концентрації 5 2,5×10 клітин на 1 мл. Дослідження анти-ВІЛ дії препарату RNA-M. Використовували традиційну модель первинно-інфікованих вірусом імунодефіциту людини суспензійних клітин МТ-4. Інфікування клітин МТ-4 штамом ВІЛ-1 проводили додаванням вірусу 5 до клітинної суспензії в концентрації 4-5×10 кл/мл та множинністю зараження (100 ID30/лунку). Інгібуючий ефект препаратів оцінювали на 5 добу культивування по кількості вірусного антигену імуноферментним методом. Інфекційний титр ВІЛ-1 визначали таким чином: десятикратні розведення тестованого середовища вносили в полістиролові планшети, в лунках яких були культивовані клітини МТ-4. Інфіковані клітини культивували при 37 °C протягом 5 діб в атмосфері 5 % СО2. Потім з кожної лунки відбирали культуральну рідину і визначали наявність антигену р24 методом ІФА за допомогою тест-системи "Genetic Systems™ HIV-1 Ag EIA" (BioRad). Інфекційний титр ВІЛ дорівнював 4,0-6,5 Ig ID50. Вивчення анти-ВІЛ активності препару РНК-М in vitro. ВІЛ культивували в суспензії культури МТ-4 і в культурі невриноми гасеріанових ганглій щура (НГГЩ). Характеристики ВІЛ1 представлені в таблиці 2.4.1. нижче. Таблиця 2.4.1 Характеристика вірусу імунодефіциту людини Культура клітин МТ-4 НГУК 25 30 35 40 45 50 Експресія Р24 (ОП 492) 3.069 3.024 Інфекційний титр ВІЛ в Іg ID50 6,0 4,5 Дослідження проводили з препаратом РНК-М в культурі клітин МТ-4 за методом (Tkachuk Z.YU., Rybalko S.L, Semernikova L.I., Tkachuk V.V., Zavelevich M.P., Tkachuk L.V., Myhaylopulo I., Matsuka H.KH., Action of 2', 5'-tryolihoadenilate and its epoxy-derivative on reproduction of human immunodeficiency virus and reverse transcriptase activity of retroviruses, Biopolymers and cells, 1999, 15, 4, pp. 314-319). В одному варіанті препарат вносили за 24 години до інфікування вірусом (профілактична схема), в іншому через 24 години після інфікування вірусом (лікувальна схема). В кожну пробу вносили вірус імунодефіциту людини, культивували його протягом 5 діб, потім в кожній пробі визначали інфекційний титр вірусу. Препарат залишався в середовищі протягом всього циклу дослідження. Як еталонний препарат використовували ретровір в розведенні 0,25. Показано, що препарати РНК-М і РНК-А значно пригнічують розмноження ВІЛ на 1,9 Lg ID50 при представлених схемах введення препаратів. Препарат Ретровір мав подібний ефект. Результати цього дослідження свідчать про високу противірусну активність РНК-М і РНКА при терапевтичній схемі введення препаратів. Було виявлено, що вони значно переверщують дію Ретровіру. Це дозволило віднести РНК-М і РНК-А до ефективних препаратів здатних пригнічувати репродукцію ВІЛ. Приклад 2.4.2. Лікування СНІДу в хворих пацієнтів Тактика лікування пацієнтів з ВІЛ-інфекцією полягає в регулярному лабораторному контролі + + CD4 Т-лімфоцитів і вірусного навантаження. У тому випадку, коли кількість CD4 Т-лімфоцитів стає менше 350 клітин в 1 мкл крові і вірусне навантаження перевищує 100000 копій РНК ВІЛ в 1 мл крові, потрібно застосовувати антиретровірусну терапію (APT). У ВІЛ-інфікованих пацієнтів + було вивчено ефективність застосування РНК-М для відновлення кількості CD4 T-лімфоцитів і зменшення рівня вірусного навантаження. + Три групи людей з різним вірусним навантаженням та кількістю CD4 T-лімфоцитів, які перебували на 1 і 2 клінічних стадіях, отримували РНК-М всередину по 0,75 г в день протягом 2 місяців. Через відсутність показань вони не отримували специфічного APT. У хворих після + одного і двох місяців лікування проводилося визначення рівня CD4 Т-лімфоцитів і вірусного навантаження. Після першого місяця застосування РНК-М вірусне навантаження в групах було знижено в 1,7, 1,9 і 12,7 раз, в порівнянні з первинними даними до лікування. У всіх трьох групах + абсолютна кількість CD4 Т-лімфоцитів виросла в середньому на 285 клітин в 1 мкл крові (350, 351 і 154 клітин/мкл). Загальна кількість лімфоцитів в периферичній крові зросла в середньому 28
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61P 31/12, A61K 31/70, A61K 39/12
Мітки: множинної, противірусна, спосіб, захворювань, вірусних, дії, лікування, склад, сполука
Код посилання
<a href="https://ua.patents.su/35-104484-protivirusna-spoluka-mnozhinno-di-sklad-ta-sposib-likuvannya-virusnikh-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Противірусна сполука множинної дії, її склад та спосіб лікування вірусних захворювань</a>
Попередній патент: Аутентифікація потоків даних
Наступний патент: Спосіб прогнозування вектора стану центра мас космічного апарата на орбіті
Випадковий патент: Гармата детонаційно-газова