Застосування остеопротегерину для лікування та/або запобігання фіброзу
Формула / Реферат
1. Застосування для виготовлення лікарського засобу для лікування та/або запобігання фіброзному захворюванню речовини, вибраної з групи, до складу якої входять:
a) поліпептид, що містить Послідовність № 2 або Послідовність № 4;
b) поліпептид, що містить амінокислоти 22-401 Послідовності № 2 або Послідовності № 4;
c) поліпептид, що містить одну, дві, три або чотири збагачені цистеїном ділянки остеопротегерину;
d) поліпептид, що містить амінокислоти 22-194 Послідовності № 2 або Послідовності № 4;
e) мутеїн будь-якого з поліпептидів (a)-(d), де амінокислотна послідовність має щонайменше 90 % ідентичність із щонайменше однією з послідовностей поліпептидів (a)-(d);
f) мутеїн будь-якого з поліпептидів (a)-(d), який кодується послідовністю ДНК, що гібридизується з комплементом послідовності ДНК, що кодує будь-який з поліпептидів (a)-(d) за умов помірної жорсткості або за умов високої жорсткості;
g) мутеїн будь-якого з поліпептидів (a)-(d), де зміни амінокислотної послідовності є консервативними амінокислотними замінами амінокислотних послідовностей поліпептидів (a)-(d); та
h) сіль або ізоформа, гібридний білок, функціональна похідна, активна фракція або похідна з кільцевою перестановкою будь-якого поліпептиду (а)-(g).
2. Застосування за п. 1, причому фіброзним захворюванням є дифузна хвороба сполучної тканини.
3. Застосування за п. 1 або п. 2, причому фіброзним захворюванням є склеродермія.
4. Застосування за будь-яким із попередніх пунктів, причому згаданою речовиною є мономер або димер.
5. Застосування за будь-яким із попередніх пунктів, причому згадана речовина є глікозилованою на одній або декількох ділянках.
6. Застосування за будь-яким із попередніх пунктів, причому гібридний білок містить ділянку імуноглобуліну (Ig).
7. Застосування за п. 6, причому ділянкою Ig є Fc-фрагмент.
8. Застосування за будь-яким із попередніх пунктів, де функціональна похідна містить щонайменше одну складову, з'єднану з однією або декількома функціональними групами, які існують як один або декілька бічних ланцюгів на амінокислотних залишках.
9. Застосування за п. 8, причому згаданою складовою є поліетиленова складова.
10. Застосування молекули нуклеїнової кислоти для виготовлення лікарського засобу для лікування та/або запобігання фіброзному захворюванню, причому до складу молекули нуклеїнової кислоти входить нуклеїновокислотна послідовність, що кодує поліпептид, який містить амінокислотну послідовність, вибрану з групи, до складу якої входять:
a) поліпептид, що містить Послідовність № 2 або Послідовність № 4;
b) поліпептид, що містить амінокислоти 22-401 Послідовності № 2 або Послідовності № 4;
c) поліпептид, що містить одну, дві, три або чотири збагачені цистеїном ділянки остеопротегерину;
d) поліпептид, що містить амінокислоти 22-194 Послідовності № 2 або Послідовності № 4;
e) мутеїн будь-якого з поліпептидів (a)-(d), де амінокислотна послідовність має щонайменше 90 % ідентичність із щонайменше однією з послідовностей поліпептидів (a)-(d);
f) мутеїн будь-якого з поліпептидів (a)-(d), який кодується послідовністю ДНК, що гібридизується з комплементом послідовності нативної ДНК, що кодує будь-який з поліпептидів (a)-(d) за умов помірної жорсткості або за умов високої жорсткості;
g) мутеїн будь-якого з поліпептидів (a)-(d), де зміни амінокислотної послідовності є консервативними амінокислотними замінами амінокислотних послідовностей поліпептидів (a)-(d);
h) ізоформа, гібридний білок або активна фракція будь-якого поліпептиду (a)-(g).
11. Застосування за п. 10, причому фіброзним захворюванням є дифузна хвороба сполучної тканини.
12. Застосування за п. 10 або п. 11, причому фіброзним захворюванням є склеродермія.
13. Застосування за будь-яким із пп. 10-12, причому молекула нуклеїнової кислоти містить послідовність вектора експресії.
14. Застосування за п. 13, причому послідовністю вектора є послідовність генотерапевтичного вектора.
15. Застосування вектора для індукування та/або підсилення ендогенного продукування поліпептиду за п. 1 у клітині для виготовлення лікарського засобу для лікування та/або запобігання фіброзному захворюванню, зокрема склеродермії.
16. Застосування клітини, що містить молекулу нуклеїнової кислоти за будь-яким із пп. 10-15, для виготовлення лікарського засобу для лікування та/або запобігання фіброзному захворюванню, зокрема склеродермії.
17. Застосування клітини, що експресує речовину за пп. 1-9, для виготовлення лікарського засобу для лікування та/або запобігання фіброзному захворюванню, зокрема склеродермії.
18. Застосування клітини, що була генетично модифікована для продукування поліпептиду за пп. 1-9, для виготовлення лікарського засобу для лікування та/або запобігання фіброзному захворюванню, зокрема склеродермії.
19. Застосування за будь-яким із попередніх пунктів, де лікарський засіб додатково містить інтерферон.
20. Застосування за п. 19, причому інтерфероном є інтерферон-β.
21. Застосування за будь-яким із попередніх пунктів, де лікарський засіб додатково містить антагоніст некротичного пухлинного фактора (TNF).
22. Застосування за п. 21, причому антагоністом TNF є ТВР I та/або ТВР II.
23. Застосування за будь-яким із попередніх пунктів, причому лікарський засіб додатково містить протисклеродермійний агент.
24. Застосування за п. 23, де протисклеродермійний агент вибраний з групи, до складу якої входять інгібітори ацетилхолінестерази, блокатори кальцієвого каналу, інгібітори протонного насоса, нестероїдні протизапальні лікарські препарати, інгібітори циклооксигенази, кортикостероїди, тетрациклін, пентоксифілін, буциламін, інгібітори геранілгеранілтрансферази, роттерлін, інгібітори проліл-4-гідроксилази, інгібітори с-протеїнази, інгібітори лізилоксидази, релаксин, простагландини, простацикліни, ендотелій-1, оксид азоту, інгібітори ангіотензину II, антиоксиданти або білок SARP-1.
25. Спосіб лікування та/або запобігання фіброзному захворюванню, зокрема склеродермії, що включає введення пацієнту, який потребує цього, ефективної кількості речовини за будь-яким із пп. 1-24, факультативно разом із фармацевтично прийнятним носієм.
Текст
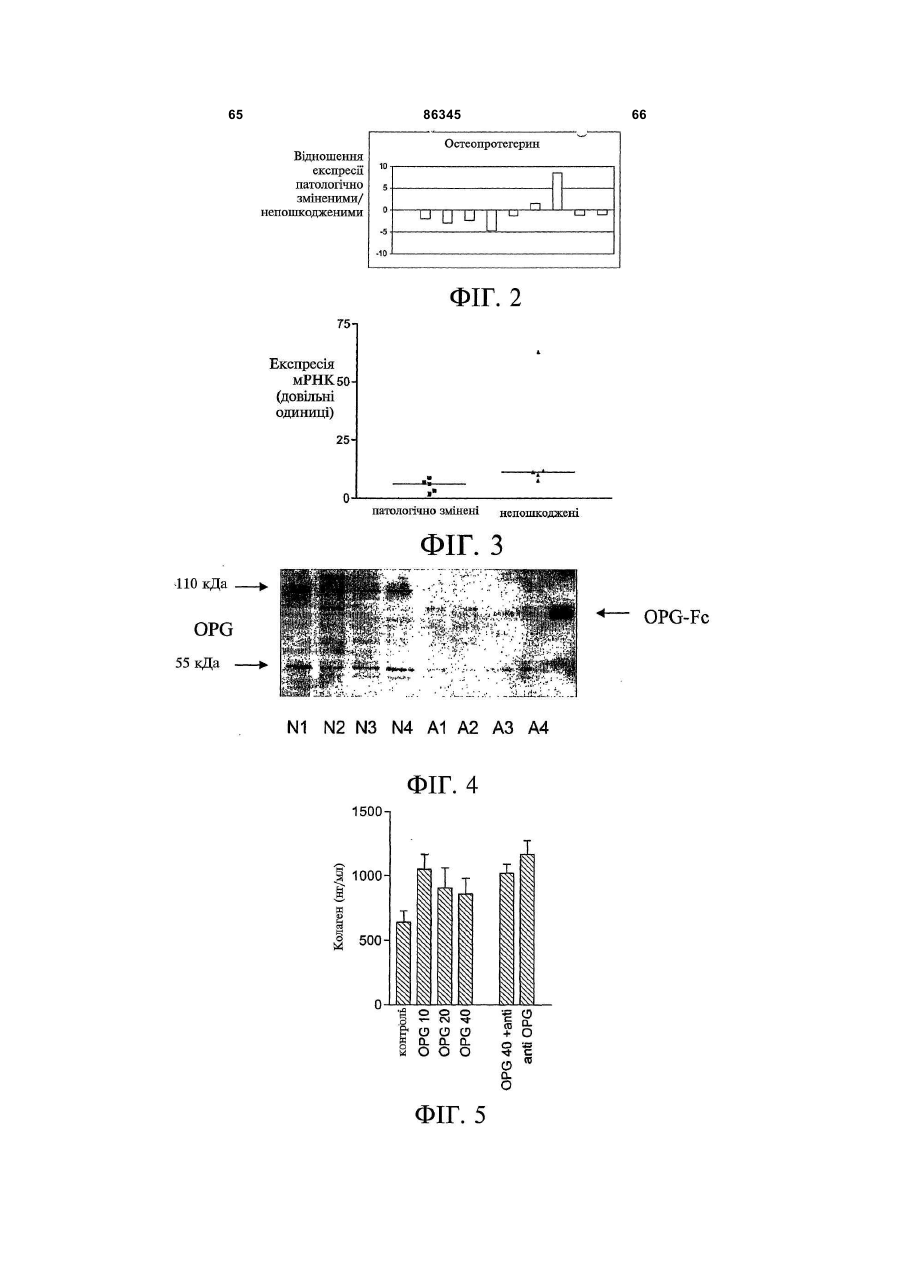
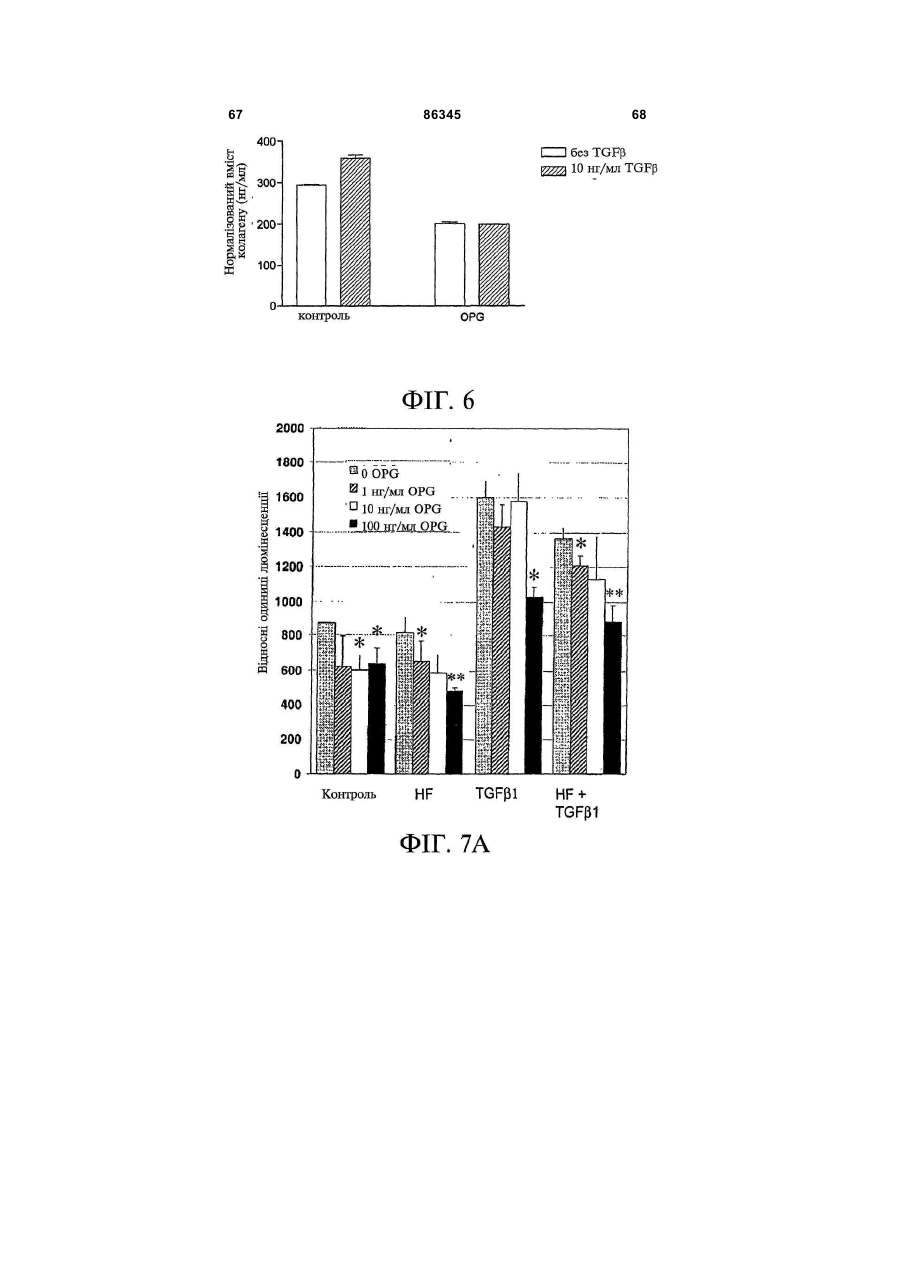
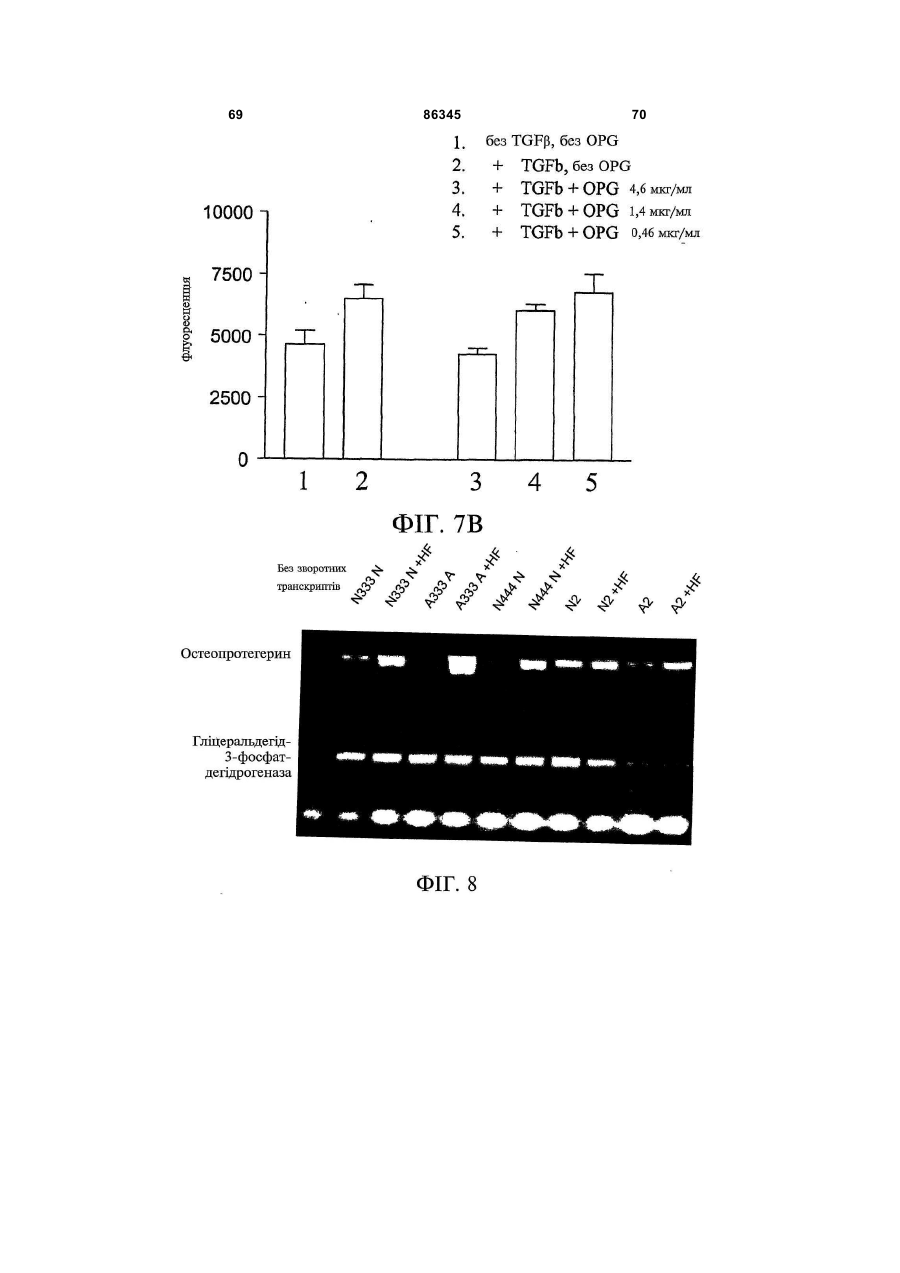
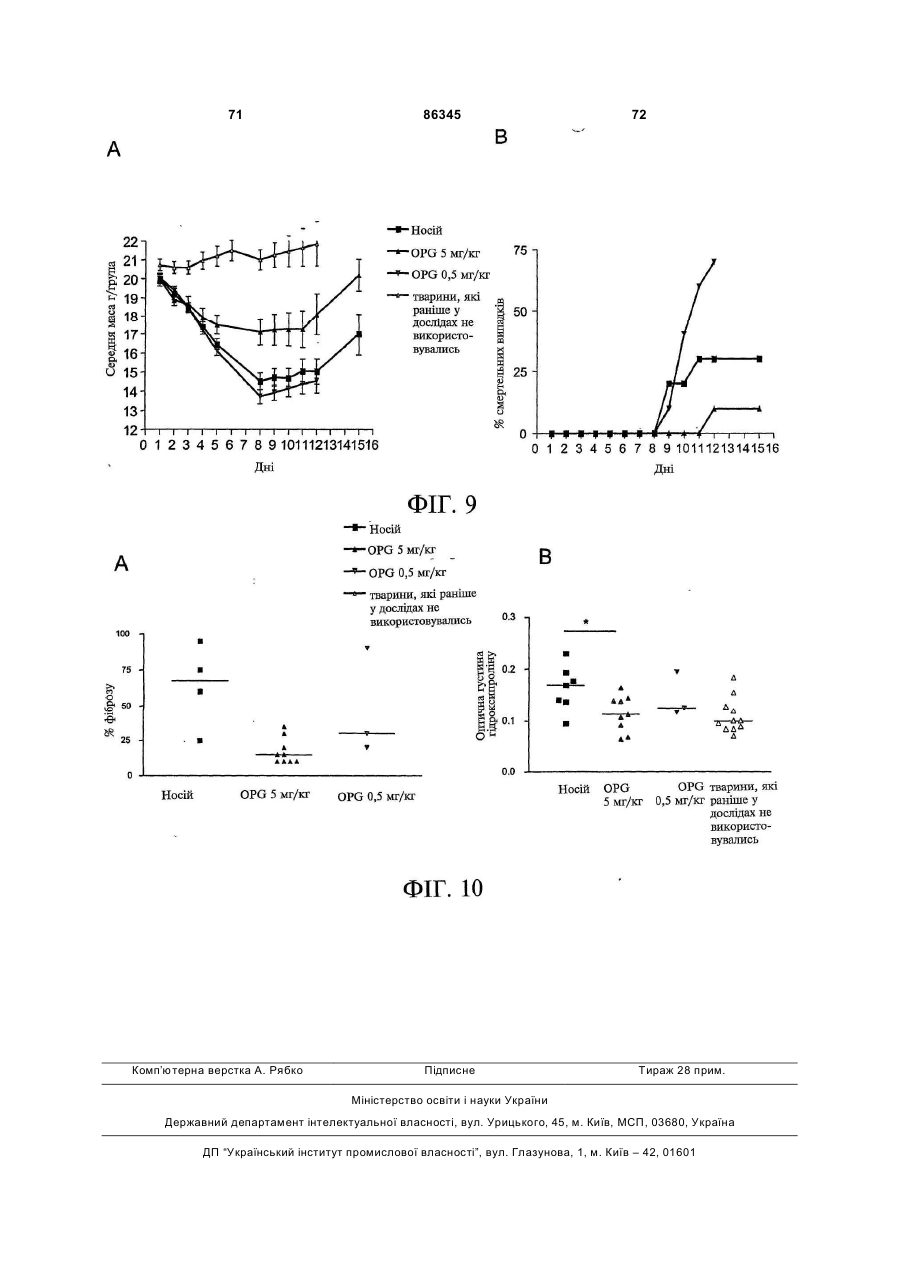
1. Застосування для виготовлення лікарського засобу для лікування та/або запобігання фіброзному захворюванню речовини, вибраної з групи, до складу якої входять: 2 (19) 1 3 86345 4 10. Застосування молекули нуклеїнової кислоти для 16. Застосування клітини, що містить молекулу виготовлення лікарського засобу для лікування нуклеїнової кислоти за будь-яким із пп. 10-15, та/або запобігання фіброзному захворюванню, придля виготовлення лікарського засобу для лікучому до складу молекули нуклеїнової кислоти вховання та/або запобігання фіброзному захворювандить нуклеїновокислотна послідовність, що кодує ню, зокрема склеродермії. поліпептид, який містить амінокислотну послідов17. Застосування клітини, що експресує речовину ність, вибрану з групи, до складу якої входять: за пп. 1-9, для виготовлення лікарського засобу a) поліпептид, що містить Послідовність № 2 або для лікування та/або запобігання фіброзному заПослідовність № 4; хворюванню, зокрема склеродермії. b) поліпептид, що містить амінокислоти 22-401 Послі18. Застосування клітини, що була генетично модовності № 2 або Послідовності № 4; дифікована для продукування поліпептиду за пп. 1c) поліпептид, що містить одну, дві, три або чотири 9, для виготовлення лікарського засобу для лікуванзбагачені цистеїном ділянки остеопротегерину; ня та/або запобігання фіброзному захворюванню, d) поліпептид, що містить амінокислоти 22-194 Позокрема склеродермії. слідовності № 2 або Послідовності № 4; 19. Застосування за будь-яким із попередніх пункe) мутеїн будь-якого з поліпептидів (a)-(d), тів, де лікарський засіб додатково містить інтерфеде амінокислотна послідовність має щонайменше рон. 90 % ідентичність із щонайменше однією з послідов20. Застосування за п. 19, причому інтерфероном є ностей поліпептидів (a)-(d); інтерферон-β. f) мутеїн будь-якого з поліпептидів (a)-(d), який коду21. Застосування за будь-яким із попередніх пункється послідовністю ДНК, що гібридизується з комтів, де лікарський засіб додатково містить антагоплементом послідовності нативної ДНК, що кодує ніст некротичного пухлинного фактора (TNF). будь-який з поліпептидів (a)-(d) за умов помірної жор22. Застосування за п. 21, причому антагоністом сткості або за умов високої жорсткості; TNF є ТВР I та/або ТВР II. g) мутеїн будь-якого з поліпептидів (a)-(d), де зміни 23. Застосування за будь-яким із попередніх пункамінокислотної послідовності є консервативними тів, причому лікарський засіб додатково містить проамінокислотними замінами амінокислотних послідотисклеродермійний агент. вностей поліпептидів (a)-(d); 24. Застосування за п. 23, де протисклеродерh) ізоформа, гібридний білок або активна фракція мійний агент вибраний з групи, до складу якої будь-якого поліпептиду (a)-(g). входять інгібітори ацетилхолінестерази, блокатори 11. Застосування за п. 10, причому фіброзним закальцієвого каналу, інгібітори протонного насоса, хворюванням є дифузна хвороба сполучної тканинестероїдні протизапальні лікарські препарати, ни. інгібітори циклооксигенази, кортикостероїди, тетра12. Застосування за п. 10 або п. 11, причому фібциклін, пентоксифілін, буциламін, інгібітори геранілрозним захворюванням є склеродермія. геранілтрансферази, роттерлін, інгібітори проліл-413. Застосування за будь-яким із пп. 10-12, причому гідроксилази, інгібітори с-протеїнази, інгібітори лізимолекула нуклеїнової кислоти містить послідовність локсидази, релаксин, простагландини, простациквектора експресії. ліни, ендотелій-1, оксид азоту, інгібітори ангіотен14. Застосування за п. 13, причому послідовністю зину II, антиоксиданти або білок SARP-1. вектора є послідовність генотерапевтичного векто25. Спосіб лікування та/або запобігання фіброзра. ному захворюванню, зокрема склеродермії, що 15. Застосування вектора для індукування та/або включає введення пацієнту, який потребує цього, підсилення ендогенного продукування поліпептиду ефективної кількості речовини за будь-яким із пп. за п. 1 у клітині для виготовлення лікарського 1-24, факультативно разом із фармацевтично призасобу для лікування та/або запобігання фіброзйнятним носієм. ному захворюванню, зокрема склеродермії. Цей винахід належить до галузі фіброзних захворювань та дифузних хвороб сполучної тканини. Зокрема, цей винахід має відношення до застосування остеопротегерину для лікування та/або запобігання фіброзних захворювань, зокрема, склеродермії. Комбінації остеопротегерину з інтерфероном, антагоністом TNF (некротичного пухлинного фактора) або додатковим протифіброзним засобом, наприклад, білком SARP-1 (секретований апоптоз-асоційований білок 1), також входять до обсягу цього винаходу. Фіброз є станом, пов'язаним із надпродукуванням колагену, наприклад, у внутрішніх органах, у тому числі нирках, серці, легенях, шлунку та суглобах. Фіброз легень є одним з поширених фіброзів. Ідіопатичний фіброз легень (IPF) характеризується хронічним запаленням стінок альвеол із прогресуючим фіброзом невідомої етіології. Ідіопатичний фіброз легень або фіброзний альвеоліт невідомого походження є причиною 50-60% випадків ідіопатичного інтерстиціального захворювання легень. Звичайна інтерстиціальна пневмонія (UIP), специфічна гістопатологічна картина інтерстиціальної пневмонії, є класичною картиною, що спостерігається при біопсії легень у разі ідіопатичного фіброзу легень. При невеликому збільшенні тканина виглядає неоднорідною, з переміжними ділянками нормальної легеневої тканини, інтерстиціального запалення, фіброзу і пористості. У разі інтерстиціального запалення спостерігається інфільтрація міжальвеолярних перегородок лімфоцитами, плазмоцитами і гістіоцитами, що пов'язується з гіперплазією пневмоцитів II типу. Фіброзні 5 86345 6 метаболітів (наприклад, у разі тирозинемії, фрукзони складаються, головним чином, із щільного тоземії та галактоземії); і пероксисомні розлади безклітинного колагену, хоча можуть спостеріга(синдром Цельвегера). Фіброз викликають числентись (як правило, на інтраальвеолярних ділянках) ні хімічні речовини і лікарські засоби, особливо розсіяні осередки проліферуючих фібробластів спирт, метотрексат, ізоніазид, оксифенізатин, ме(фібробластні осередки), які являють собою ділянтилдофа, хлорпромазин, толбутамід і аміодарон. ки початкової стадії та активного перебігу захвоПорушення печінкового кровообігу (наприклад, рювання. Пористі ділянки включають кістозні фібхронічна серцева недостатність, синдром Баддарозні порожнини, часто-густо вистелені Кіарі, первинний тромбоз вен, тромбофлебіт ворібронхіолярним епітелієм і заповнені слизом. У тної вени) і хронічна обструкція виділення жовчі слизу можуть накопичуватись нейтрофіли. На діможуть привести до виникнення фіброзу. 1, врешлянках фіброзу та пористості часто відбувається ті-решт, вроджений фіброз печінки є аутосомним гіперплазія гладеньких м'язів. Найкориснішими рецесивним пороком розвитку. особливостями при ідентифікуванні звичайної інДо складу нормальної печінки входять гепатотерстиціальної пневмонії є підплевральний та нацити і синусоїдні капіляри, розподілені у межах вколосептальний розподіл, плямистий характер і позаклітинного матриксу, що складається з колатимчасова неоднорідність. гену (головним чином, типів І, III і IV) і неколагеноІдентична картина інтерстиціального запаленвих білків, у тому числі глікопротеїнів (наприклад, ня та фіброзу спостерігається у разі дифузних фібронектину, ламініну) і декількох протеогліканів хвороб сполучної тканини судин (наприклад, рев(наприклад, гепаран-сульфату, хондроїтинматоїдного артриту, системного червоного вовчасульфату, дерматан-сульфату, гіалуронату). Фібка, прогресуючого системного склерозу, змішаної робласти, які за нормальних обставин знаходяться хвороби сполучної тканини, цукрового діабету), лише у трактах ворітної вени, можуть продукувати пневмоконіозу (наприклад, асбестозу), радіаційноколаген, великі глікопротеїни і протеоглікани. го ураження і певних захворювань легень, індукоІнші клітини печінки (зокрема, гепатоцити, живаних лікарськими засобами (наприклад, нітрофурові клітини, купферівські клітини і ендотеліальні рантоїном). клітини) також можуть продукувати компоненти Клінічний перебіг ідіопатичного фіброзу легень позаклітинного матриксу. Жирові клітини, які знає прогресуючим; середній рівень виживаності після ходяться під синусоїдальним ендотелієм у простовстановлення діагнозу становить від 4 років до 6 рі Діссе, є попередниками фібробластів, здатними років. Преднізон є звичайним лікарським засобом до проліферації і продукування надлишку позакліу разі ідіопатичного фіброзу легень. Реакція на тинного матриксу. Розвиток фіброзу з активного лікування є змінною, однак у пацієнта з початковідкладення колагену є наслідком пошкодження вою фазою захворювання, на більш клітинній стаклітин печінки, зокрема, некрозу, та клітин зони дії перед тим, як домінуючим стає поява рубцевих запалення. Точно визначені фактори, що виділязмін у сполучній тканині, існує більша ймовірність ються з цих клітин, є невідомими, однак ймовірниполіпшення у разі застосування кортикостероїдної ми є один або декілька цитокінів або продуктів або цитотоксичної терапії. Підтримувальна терапія перекисного окиснення ліпідів. Клітини Купфера і і паліативне лікування включають застосування О2 у великих концентраціях для полегшення гіпоксемії активовані макрофаги продукують запальні цитокіі, у разі бактеріальної інфекції, антибіотиків. ни. Нові фібробласти утворюються довкола некроТрансплантація легень була успішною у пацієнтів тичних клітин печінки; наслідком підвищеного синіз хворобою легень кінцевої стадії. тезу колагену є поява рубцевих змін у сполучній Фіброз легень пов'язується із накопиченням у тканині. Фіброз може бути наслідком активного печінці сполучної тканини, що є наслідком поруфіброгенезу і порушеного розщеплення нормальшення рівноваги між продукуванням та розкладом ного або зміненого колагену. Жирові клітини, куппозаклітинного матриксу, і загострюється спадінферівські клітини і ендотеліальні клітини відіграням та ущільненням попередньо існуючих волоють важливу роль у виведенні колагену типу І, кон. декількох протеогліканів і денатурованих колагеФіброз легень є звичайною реакцією на гепанових волокон. Зміни активності цих клітин можуть тоцелюлярний некроз або пошкодження, яке може модифікувати поширеність фіброзу. Для гістопавикликатись найрізноманітнішими агентами, натолога фіброзна тканина може стати більш явною приклад, будь-яким процесом, що порушує гомеоунаслідок пасивного спадіння та ущільнення попестаз печінки (зокрема, запалення, токсичне поредньо існуючих волокон. шкодження або зміна печінкового кровотоку) і Таким чином, наслідком підвищеного синтезу інфекціями печінки (вірусними, бактеріальними, або зменшеного розщеплення колагену є активне грибковими і паразитарними). Численні порушення відкладення надлишкової сполучної тканини, яка накопичення, що є наслідком вроджених порушень негативно впливає на функціонування печінки: (1) обміну речовин, часто пов'язуються з фіброзом, у Довколаклітинний фіброз порушує живлення клітому числі порушення ліпідного обміну (хвороба тин і веде до гепатоцелюлярної атрофії. (2) ФіброГоше); глікогеноз (зокрема, типів III, IV, VI, IX та X); зна тканина у просторі Діссе накопичується довкодефіцит інгібітора α1-трипсину; накопичення екзола синусоїдних капілярів і перешкоджає вільному генних речовин, що спостерігається у разі синдропроходженню речовин із крові до гепатоцитів. (3) мів із підвищеним засвоєнням та надлишковим Фіброз довкола венул печінки і трактів ворітної накопиченням заліза у організмі (гемохроматоз) та вени порушує печінковий кровотік. Венозний опір вроджені порушення метаболізму міді (хвороба печінки зростає від гілок ворітної вени до синусоїВільсона-Коновалова); накопичення токсичних дних капілярів і, врешті-решт, до вен печінки. За 7 86345 8 лученими до цього процесу можуть бути усі три Ішемія і товщина шкіри є симптомами хвороби згадані шляхи. Рейно. Фіброзні зв'язки, які з'єднують тракти ворітної Як гадають, декілька вихідних біологічних провени з центральними венами, також сприяють цесів є залученими до початку, тяжкості і прогреутворенню анастомозних каналів: артеріальна сування захворювання. Вони включають порушенкров, що обходить нормальні гепатоцити, переня функції судин, активацію і пошкодження ключається на еферентні печінкові вени, що додаендотеліальних клітин, накопичення лейкоцитів, тково ослаблює функціонування печінки і може продукування автоантитіл і, найважливіше, неконпосилити гепатоцелюлярний некроз. Поширеність трольовану фіброзну реакцію, яка може привести цих процесів визначає ступінь порушення функцідо смерті (Клементе (Clements), Фюрст (Furst), онування печінки: наприклад, у разі вродженого 1996). Фібробласти відіграють центральну роль у фіброзу печінки, великі фіброзні зв'язки охоплюпатогенезі цієї хвороби. Первинні фібробласти, ють переважно ділянки ворітної вени і, як правило, одержані від пацієнтів, що страждають на склероне пошкоджують паренхиму печінки. Вроджений дермію, демонструють багато характеристичних фіброз печінки виглядає, таким чином, як портальвластивостей цього захворювання, що спостерігана гіпертензія зі збереженою гепатоцелюлярною ються in vivo, а саме підвищений синтез і відклафункцією. дення позаклітинного матриксу, а саме колагену і Склеродермія є захворюванням сполучної фібронектину, та змінене продукування фактора тканини, що характеризується фіброзом шкіри і росту і цитокінів, наприклад, TGFp (трансформуювнутрішніх органів, наслідком чого є недостатність чий фактор росту) і CTGF (фактор росту сполучної внутрішніх органів і смерть (Блек (Black) та ін., тканини) (Стреглоу (Strehlow), Корн (Korn), 1998; 1998; Клементе (Clements), Фюрст (Furst), 1996). Лерой (LeRoy), 1974). Склеродермія має певний спектр проявів і цілий Методів цілющого лікування склеродермії не ряд різноманітних терапевтичних аспектів. Сюди існує. Інноваційним, однак пов'язаним із високим входить локалізована склеродермія, прогресуючий ступенем ризику, терапевтичним методом пропосистемний склероз, склеродермоподібні розлади нується трансплантація автологічних стовбурових та склеродермія Сайна (Сміт (Smith), 2000). У той клітин (Мартіні (Martini) та ін., 1999). На сучасному час як локалізована склеродермія є рідкісним деретапі, зокрема, не існує методів лікування склероматологічним захворюванням, пов'язаним із фібдермії, спрямованих на фіброзний процес (Уіглі розом та проявами, які обмежуються шкірою, про(Wigley), Боулінг (Boling), 2000). гресуючий системний склероз є багатосистемним Ідентифікація генів, пов'язаних із ризиком визахворюванням зі змінним ступенем ризику щодо никнення хвороби та прогресуванням склеродерураження внутрішніх органів та коливаннями стумії, може привести до розробки ефективних страпеню ураження шкіри. Прогресуючий системний тегій втручання на різних стадіях захворювання. склероз може бути дифузним або обмеженим. Остеопротегерин (OPG) вперше ідентифікуваОбмежений системний склероз називають також ли у 1997 році як новий цитокін, що секретується синдромом CREST (кальциноз, дисфункція страфібробластами (Сімоне (Simonet) та ін., 1997). воходу Рейно, склеродактилія, телеангіектазія). Людський OPG являє собою білок із 401 амінокисСклеродермоподібні розлади, як гадають, пов'ялоти, до складу якого входить сигнальний пептид зуються з впливом промислового забруднення із 21 амінокислоти, який розщеплюється перед навколишнього середовища. У разі хвороби Сайна глутаміновою кислотою 22 з одержанням зрілого спостерігається ураження внутрішніх органів без білка, що складається з 380 амінокислот. Таким шкірних змін. чином, OPG є розчинним білком. Він є членом сіГоловними проявами склеродермії і, зокрема, мейства рецепторів TNF (некротичний пухлинний прогресуючого системного склерозу, є невідповідфактор) (Морінага (Morinaga) та ін., 1998, Ясуда но надмірний синтез та відкладення колагену, по(Yasuda) та ін., 1998), N-кінцева ділянка якого має рушення функціонування ендотелію, судоми, кочотири збагачені цистеїном TNFR-подібні ділянки лапс та облітерація, як наслідок фіброзу. (TNFR — рецептор некротичного пухлинного факСклеродермія є рідкісним захворюванням зі тора) (Сімоне (Simonet) та ін., 1997). Було показастабільною захворюваністю приблизно 19 випадків но, що OPG відіграє роль у розвитку кісткової ткана 1 млн. людей. Причина виникнення склеродернини, і миші, яким бракує гена OPG, мали мії є невідомою. Важливою, однак, є генетична остеопорозний фенотип і значні відхилення скелесхильність. До відхилень від норми належать автота від норми (Мін (Міn) та ін., 2000). імунітет та зміна функцій ендотеліальних клітин і Остеопротегерин, який продукується остеофібробластів. Дійсно, прогресуючий системний бластами та стромальними клітинами кісткового склероз є, ймовірно, найбільш тяжким з автоімунмозку, не має трансмембранного домену і діє як них захворювань із зареєстрованою 50% смертніссекретований рецептор-приманка, який не має тю у межах 5 років з моменту встановлення діагздатності до прямої передачі сигналу. OPG діє нозу (Сілмен (Silman), 1991). шляхом зв'язування зі своїм природним лігандом З точки зору встановлення діагнозу, важливим остеопротегерину (OPGL), відомим також як клінічним параметром є товщина шкіри на ділянці, RANKL (рецептор-активатор ліганду NF-каппа В). проксимальній до п'ястково-фалангових суглобів. Завдяки зв'язуванню OPG і OPGL, запобігається Синдром Рейно є частою, майже універсальною активація OPGL його спорідненого рецептора складовою склеродермії. Він діагностується за RANK, який являє собою рецептор остеокластів, зміною забарвлення шкіри під впливом холоду. життєво важливий для диференціювання, активування та виживаності остеокластів. 9 86345 10 Людський OPG є членом сімейства TNFR і явФіг.1. Експресія мРНК OPG у нормальних (наляє собою одноколійний ген, що складається з 5 вскісна штриховка) та уражених хворобою (гориекзонів і займає у геномі 29 т.п.н. (Сімоне зонтальна штриховка) фібробластах 6 пацієнтів, (Simonet) та ін., 1997). Рекомбінантний OPG існує що страждають на склеродермію, визначена шляу мономерній та димерній формах з позірною мохом гібридизаційного аналізу на комплектах міклекулярною масою 55КДа і 110КДа, відповідно рофільтрів. Частина (а) відображає середній рі(Сімоне (Simonet) та ін., 1997). "Скорочення" Nвень експресії, частина (b) відображає медіану. кінцевої ділянки до цистеїну 185 викликає інактиФіг.2. ПЛР (полімеразна ланцюгова реакція) вацію, ймовірно, шляхом розриву SS3 дисульфіданаліз у масштабі реального часу мРНК OPG 9 ного зв'язку TNFR-подібної ділянки, у той час як пацієнтів, що страждають на склеродермію. Для "скорочення" С-кінцевої ділянки білка до амінокискожного пацієнта результати виражено як віднолоти 194 зміни біологічної активності не викликає. шення експресії мРНК OPG патологічно змінениТаким чином, N-кінцева TNFR-подібна ділянка ми/непошкодженими фібробластами. OPG є достатньою для запобігання остеокластоФіг.3. Експресія мРНК OPG у біопсіях патологенезу (Сімоне (Simonet) та ін., 1997). гічно зміненої і непошкодженої шкіри 5 пацієнтів, Надекспресія OPG у трансгенних мишей веде що страждають на склеродермію, визначена за до глибокого вродженого системного остеопетродопомогою ПЛР у масштабі реального часу. Стовзу, що є наслідком майже повної відсутності оспчики означають середній рівень експресії для теокластів. І, навпаки, видалення гена OPG викликожної групи. кає у мишей тяжкий остеопороз. Видалення OPGL Фіг.4. Вестерн-блот-аналіз експресії OPG паабо RANK також викликає глибокий вроджений тологічно зміненими і непошкодженими фібробласистемний остеопетроз, що вказує на важливу стами шкіри. Патологічно змінені фібробласти (А1фізіологічну роль цих білків у регулюванні резорбА4) і нормальні фібробласти (N1-N4). Стрілки з ції кістки. Секреція OPG і OPGL остеобластами та лівого боку гелю вказують положення нативного стромальними клітинами регулюється численними OPG (55кДа мономер) і його димерної форми гормонами і цитокінами, часто реципрокним чи(110кДа). Гібридний білок OPG Fc (закуплений від ном. Гадають, що відносні рівні продукування OPG фірми R&D systems) було застосовано як позитиві OPGL кінцевим чином диктують ступінь резорбції ний контроль для антитіла. кістки. Надлишок OPGL підвищує резорбцію кістки, Фіг.5. Вплив OPG на синтез колагену людсьу той час як надлишок OPG резорбцію пригнічує. кими фібробластами лінії AG1518. Клітини лінії Рекомбінантний OPG блокує ефекти фактично усіх AG1518 або зовсім не піддавались обробці, або факторів, які стимулюють остеокласта, in vitro та in піддавались попередній обробці 10нг/мл, 20нг/мл, vivo. OPG також пригнічує резорбцію кістки у разі 40нг/мл OPG впродовж 24год чи 40нг OPG+антирізноманітних хвороб, що моделюються на твариOPG нейтралізуюче моноклональне антитіло нах, у тому числі при остеопорозі, індукованому (1мкг/мл) або лише анти-OPG нейтралізуючим оваріоектомією, гуморальній гіперкальціємії, обумоноклональним антитілом із подальшою обробмовленій злоякісною пухлиною, та експериментакою 2нг/мл TGFβi впродовж 24 год. Синтез колагельних метастазах до кісткової тканини. Таким чину визначали за допомогою ELISA (твердофазного ном, OPG може являти собою ефективний імуноферментного аналізу). Результати являють терапевтичний варіант для захворювань, пов'язасобою середнє потрійних визначень + середня них із надмірною активністю остеокластів (Костеквадратична помилка середнього. нюк (Kostenuik), Шалгуб (Shalhoub), 2001). Фіг.6. Вплив трансфекції OPG на синтез колаПоки що, однак, припущення про залучення гену α2 типу І первинними людськими фібробласостеопротегерину до фіброзів не висувалось. тами (клітини ОВНС). Клітини ОВНС трансфікуваЦей винахід ґрунтується на відкритті того, що ли pcDNA3.1/OPG (OPG) або лише pcDNA3.1 наслідком введення остеопротегерину є значне (контроль), як описано у методах. Вміст колагену у зменшення інтенсивності симптомів захворювання кондиціонованому середовищі визначали через у тварин, на яких моделюють фіброз легень. Фіб24год після обробки TGFβi засобами ELISA. Рероз легень є одним із проявів склеродермії. зультати являють собою середнє потрійних визнаТаким чином, перша ціль цього винаходу почень + середня квадратична помилка середнього. лягає у застосуванні остеопротегерину для одерФіг.7А. Вплив OPG на активність промотору жання лікарського засобу для лікування та/або колагену α2 типу І у фібробластах мишачого зарозапобігання фіброзних захворювань, зокрема, дка. Фібробласти мишачого зародка (клітини pS3) склеродермії. Другою ціллю цього винаходу є затрансфікували вектором pGL3, що містить 3,5 стосування клітини, що експресує остеопротегет.п.н. промотору колагену α2 типу І, зв'язаним із рин, або вектора експресії, що містить кодувальну кДНК люциферази. Після трансфекції клітини пепослідовність остеопротегерину, для одержання реносилидо свіжого живильного середовища і або лікарського засобу для лікування та/або запобіганне піддавали обробці (контроль), або обробляли ня фіброзного захворювання, зокрема, прогресуюлише галофугіноном (10-10Μ) (HF); TGFβ1 (5нг/мл) чого системного склерозу. Фармацевтичні компо(TGFβ1); або TGFβ (5нг/мл)+НF (10-8М) (HF+TGFpl) зиції, що містять остеопротегерин і додаткові впродовж 12год зі зростаючими концентраціями протифіброзні лікарські засоби, наприклад, галоостеопротегерину. Результати являють собою фугінон, і способи лікування, що включають ввесереднє потрійних визначень. * означає Р
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;use of osteoprotegerin for the prevention and/or treatment of fibrosis
Автори англійськоюPower Christine, Plater-Zyberk Christine
Назва патенту російськоюПрименение остеопротегерина для лечения и/или предотвращения фиброза
Автори російськоюПауэ Кристин, Платер-Циберк Кристин
МПК / Мітки
МПК: A61K 38/17
Мітки: фіброзу, застосування, запобігання, лікування, остеопротегерину
Код посилання
<a href="https://ua.patents.su/36-86345-zastosuvannya-osteoprotegerinu-dlya-likuvannya-ta-abo-zapobigannya-fibrozu.html" target="_blank" rel="follow" title="База патентів України">Застосування остеопротегерину для лікування та/або запобігання фіброзу</a>
Попередній патент: Спосіб лікування судинних захворювань
Наступний патент: Спосіб лікування відкритокутової глаукоми
Випадковий патент: Спосіб отримання термостійкої начинки замороженої