Спосіб приготування імморталізованої людської клітинної лінії
Формула / Реферат
1. Спосіб приготування імморталізованої людської клітинної лінії, стійко трансфікованої послідовністю нуклеїнової кислоти, що включає ген, який кодує людський протеїн направленої доставки, або його похідне, або його мутант, промотор, а також сигнал поліаденіляції (роlуА) бичачого гормону росту, причому даний промотор і роlуА-сигнал зв'язуються з 5' і 3' кінцем гена, відповідно, кодуючого згаданий людський протеїн направленої доставки, при цьому даний спосіб включає операцію трансфікування імморталізованої людської клітинної лінії-хазяїна в безсироваткових умовах шляхом використовування вектора трансфекції, що містить згадану послідовність нуклеїнової кислоти і оріджин реплікації.
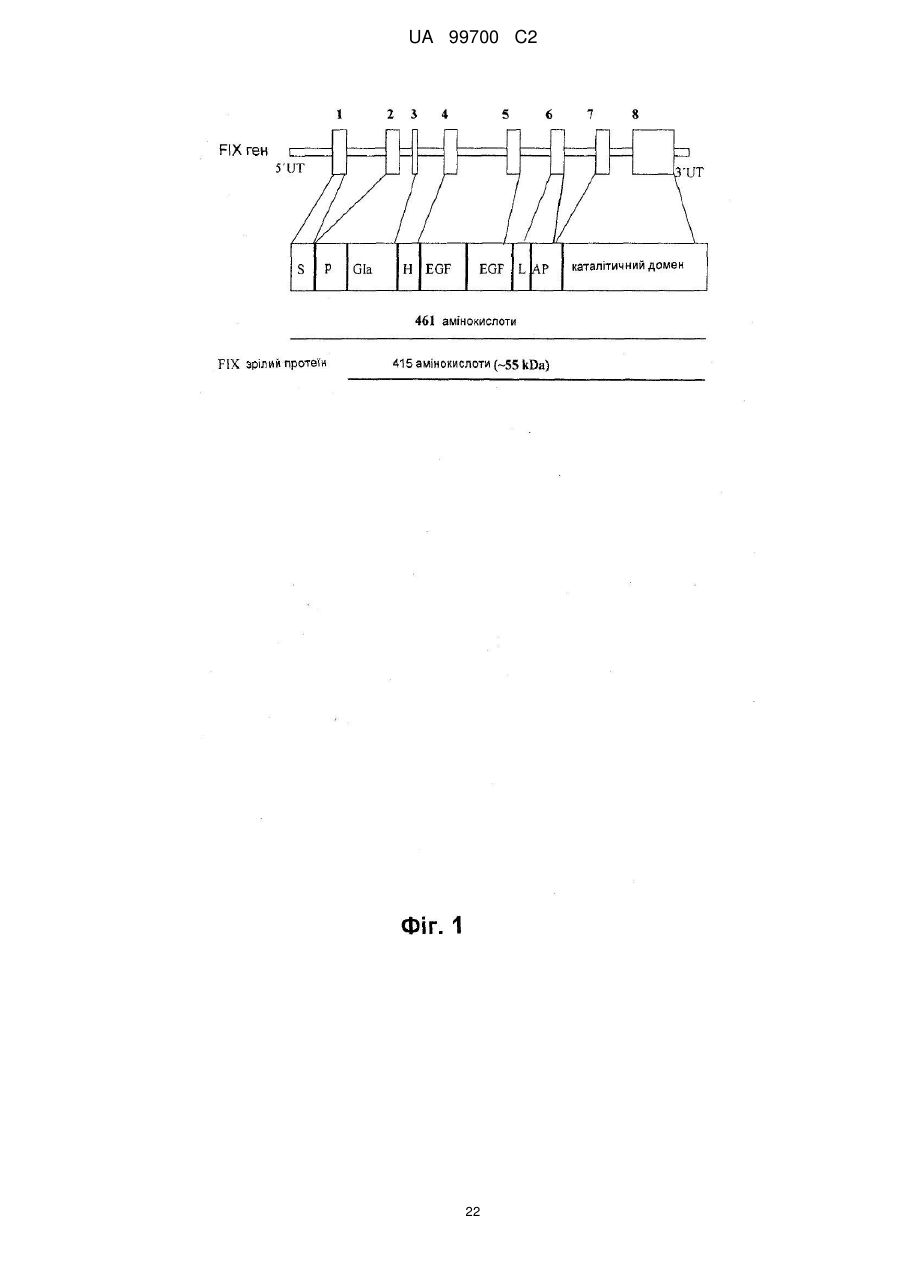
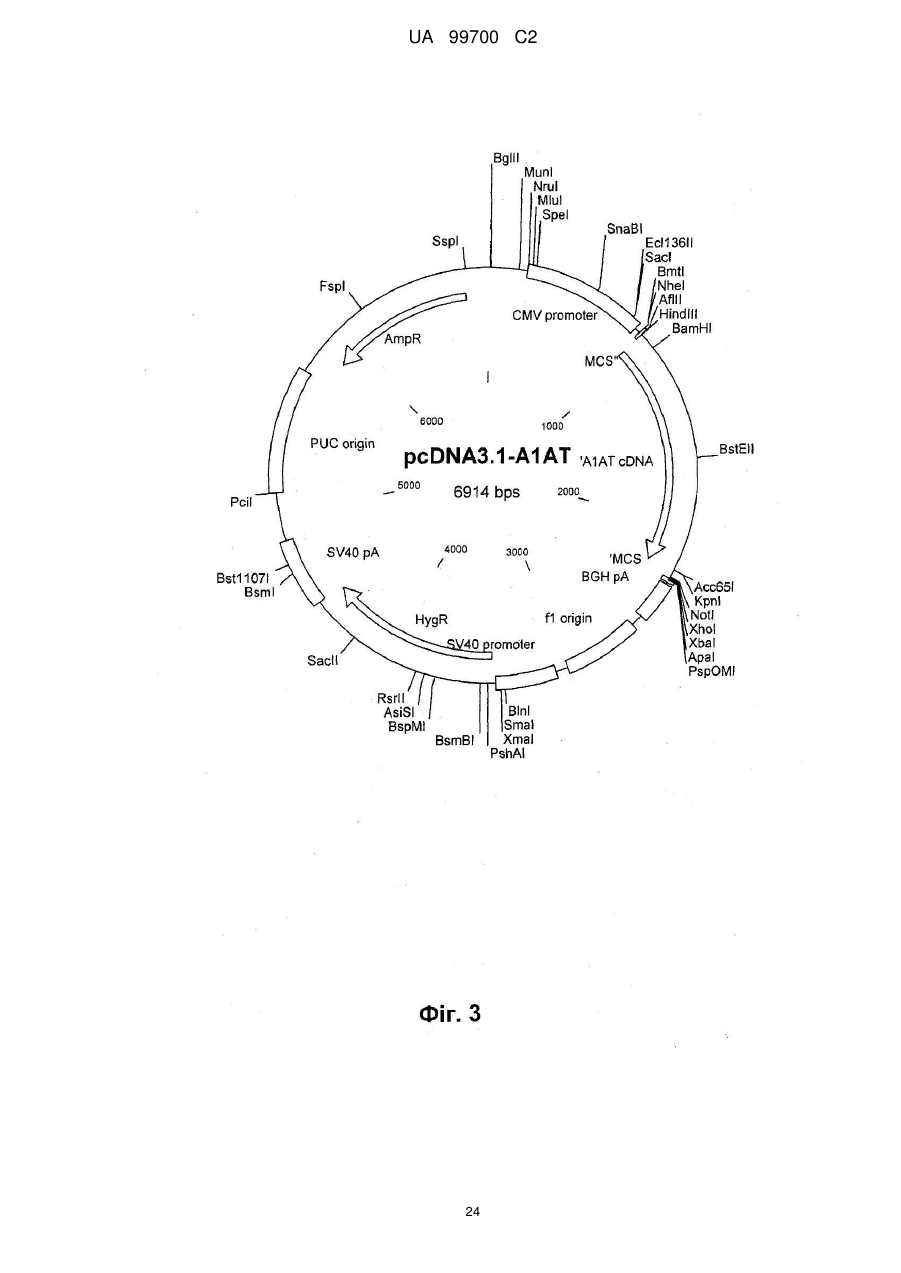
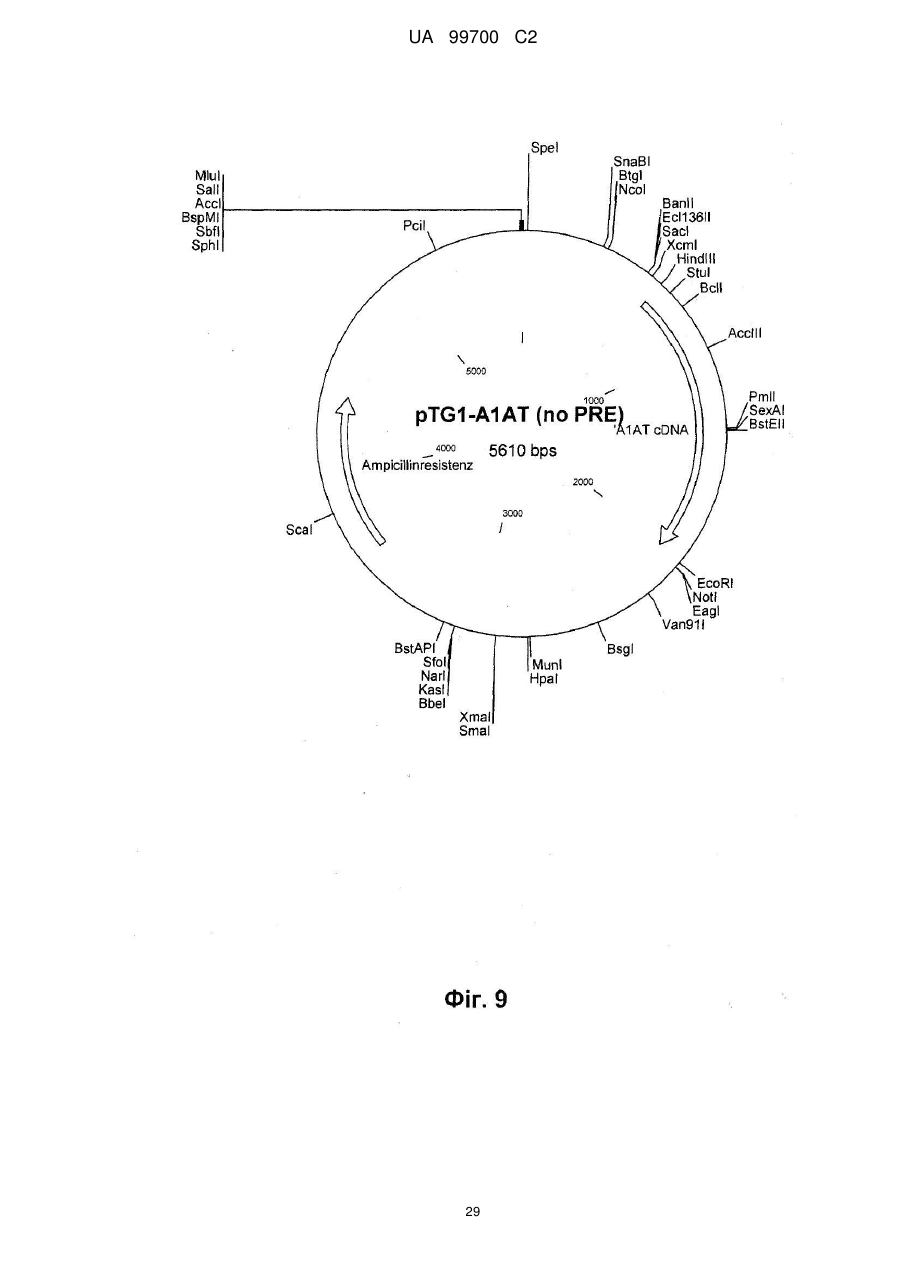
2. Спосіб за п. 1, який відрізняється тим, що людським протеїном направленої доставки є людський протеїн плазми, вибраний з факторів системи згортання крові: фактор IX, фактор VIII ("дикого типу" і В-домен-делетований), фактор VII/VIIa і фактор фон Віллебранда (vWF); факторів росту: еритропоетин, колонієстимулюючі фактори (CSFs): гранулоцит-стимулюючий фактор (G-СSF), макрофаг CSF (М-CSF) і гранулоцит-макрофаг CSF (GM-CSF); цитокінів: інтерлейкіни; інгібіторів протеази: альфа-1-антитрипсин (А1AT) і хімотрипсин; транспортуючих протеїнів: гормони; інгібіторно або регуляторно діючих протеїнів і їх похідних і мутантів; переважно людський протеїн вибирають з групи, що містить фактор IX, фактор VIII, що включає фактор VIII "дикого типу" і фактор VIII з делетованим В-доменом, фактор VII/VIIa, G-CSF, vWF і А1AT, найбільш переважним людським протеїном є фактор IX системи згортання крові, кодований парами основ від 939 до 2324 SEQ ID NО: 1, людський А1АТ, кодований парами основ від 973 до 2259 SEQ ID NО: 2, wt фактор VIII, що відповідає SEQ ID NО: 9, людський фактор VIII з делетованим В-доменом, кодований парами основ від 783 до 5162 SEQ ID NО: 3, фактор VII/VIIa, кодований SEQ ID NОs: 13 і 14, G-CSF, кодований SEQ ID NОs: 15, 16 і 17, або vWF, кодований SEQ ID NО: 18.
3. Спосіб за п. 1 або 2, який відрізняється тим, що для вектора трансфекції:
(і) промотор вибирають з вірусних промоторів, промоторів гена "домашнього господарства", тканиноспецифічних промоторів, переважно як промотор використовують промотор SV40, промотор CMV з або без інтрону, промотор EF-1альфа, промотор HSV ТK і інші, найбільш переважним промотором є промотор CMV; та/або
(іі) використовують оріджин реплікації, що забезпечує реплікацію і ампліфікацію плазміди в бактерії;
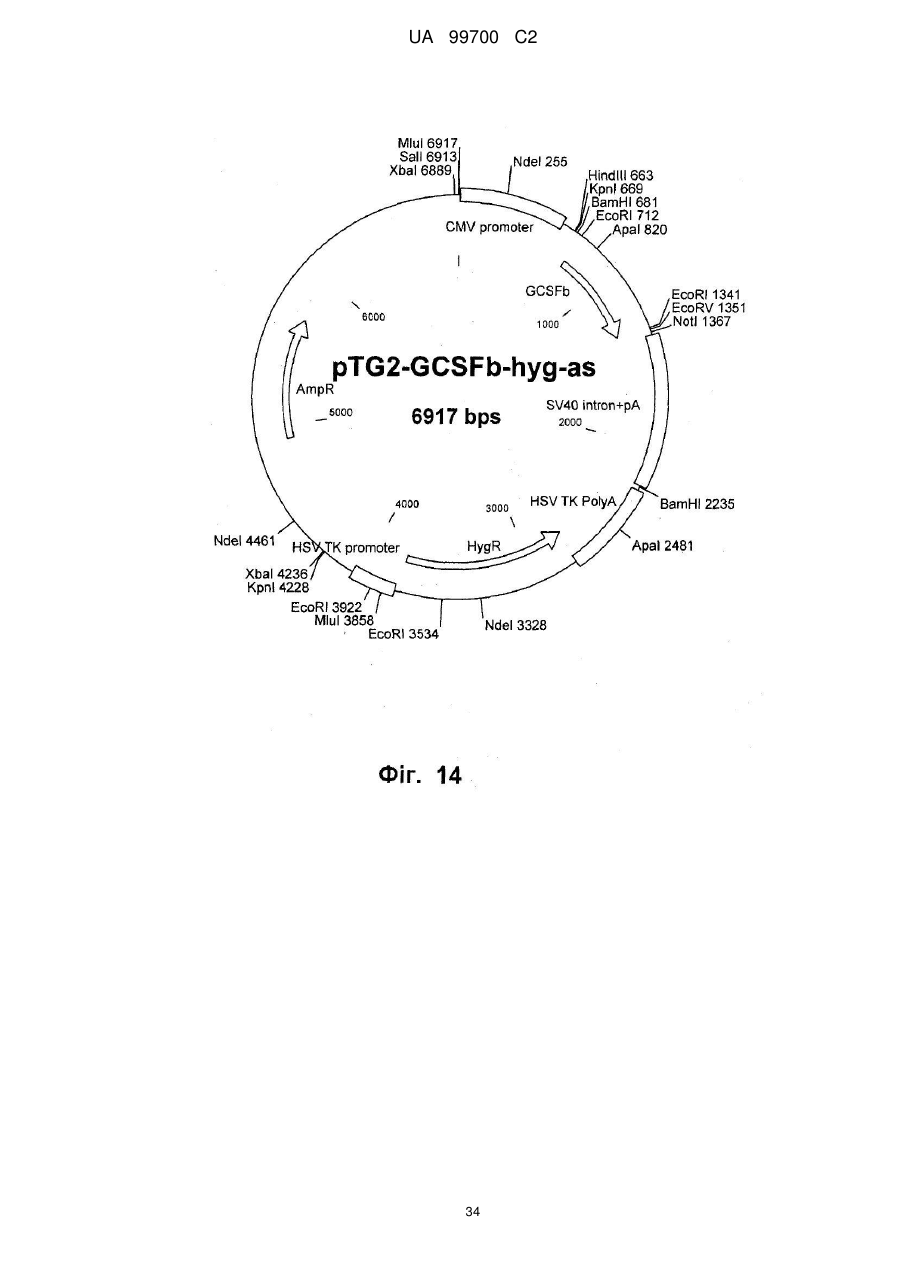
(ііі) вектор додатково несе принаймні один ген для селективного маркера, який, переважно, вибирають з групи, що включає резистентність гігроміцину, резистентність неоміцину, резистентність аміноглікозидфосфотрансферази (neo, G418, АРН), резистентність блеоміцину (флео, блео, зеоцин) і резистентність ксантин-гуанін-фосфорибозилтрансферази (XGPRT, gpt), та/або знаходиться під контролем промотора, як було вказано вище (і);
(iv) вектор додатково несе один або декілька додаткових регуляторних елементів, причому дані регуляторні елементи переважно вибирають із сплайс-сайтів, сайтів рекомбінації, роlуА-сайтів, підсилювачів, мультиклонуючих сайтів і прокаріотичних послідовностей плазміди.
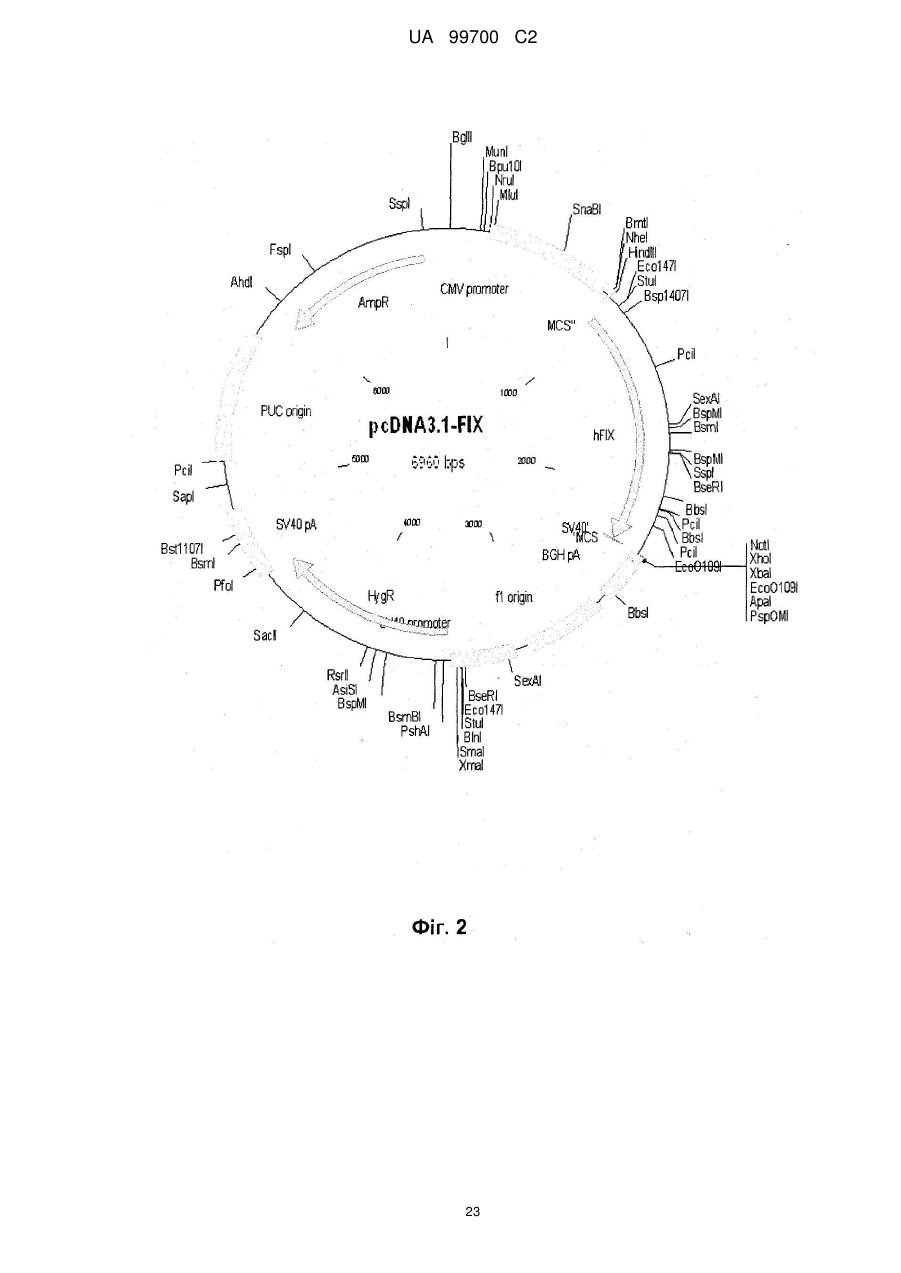
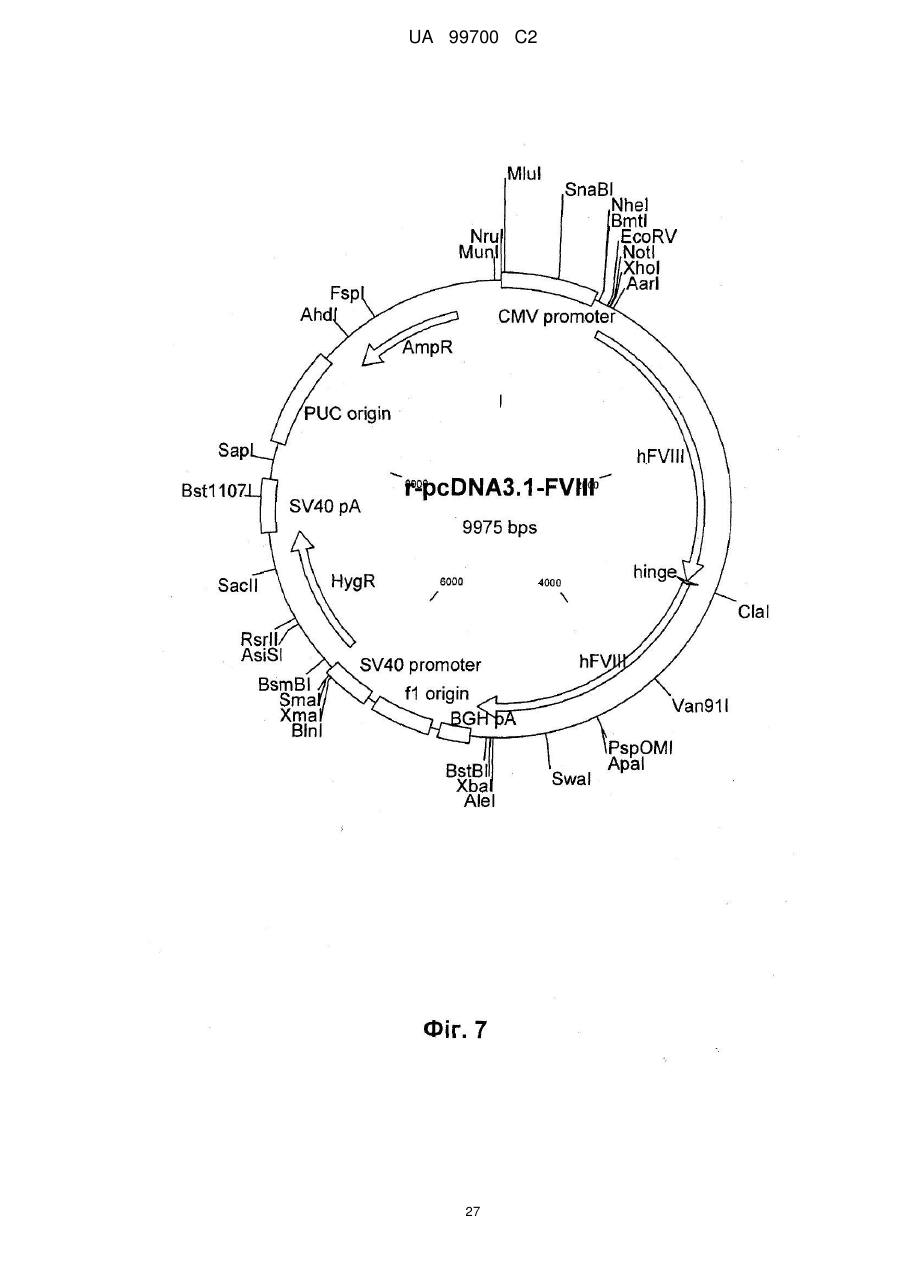
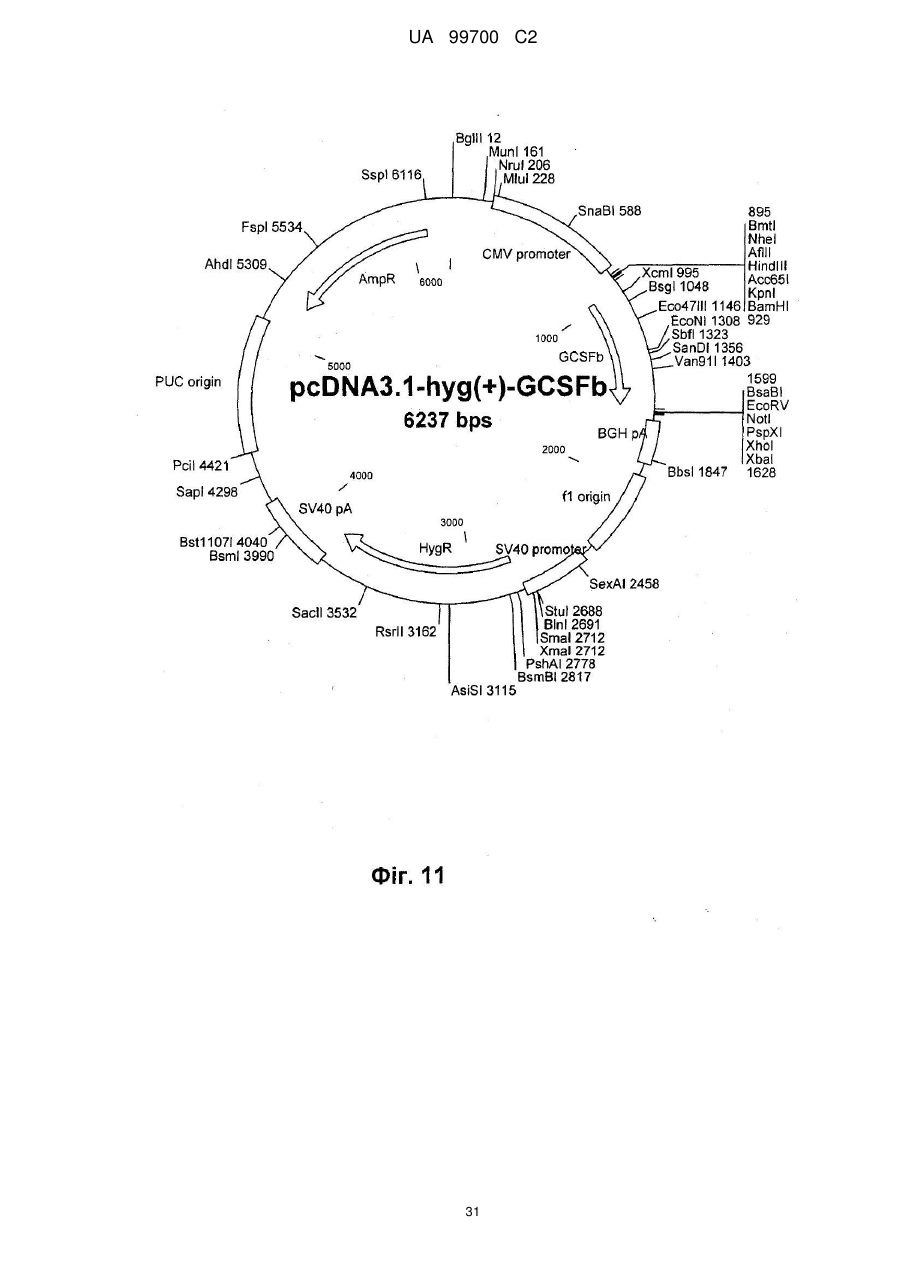
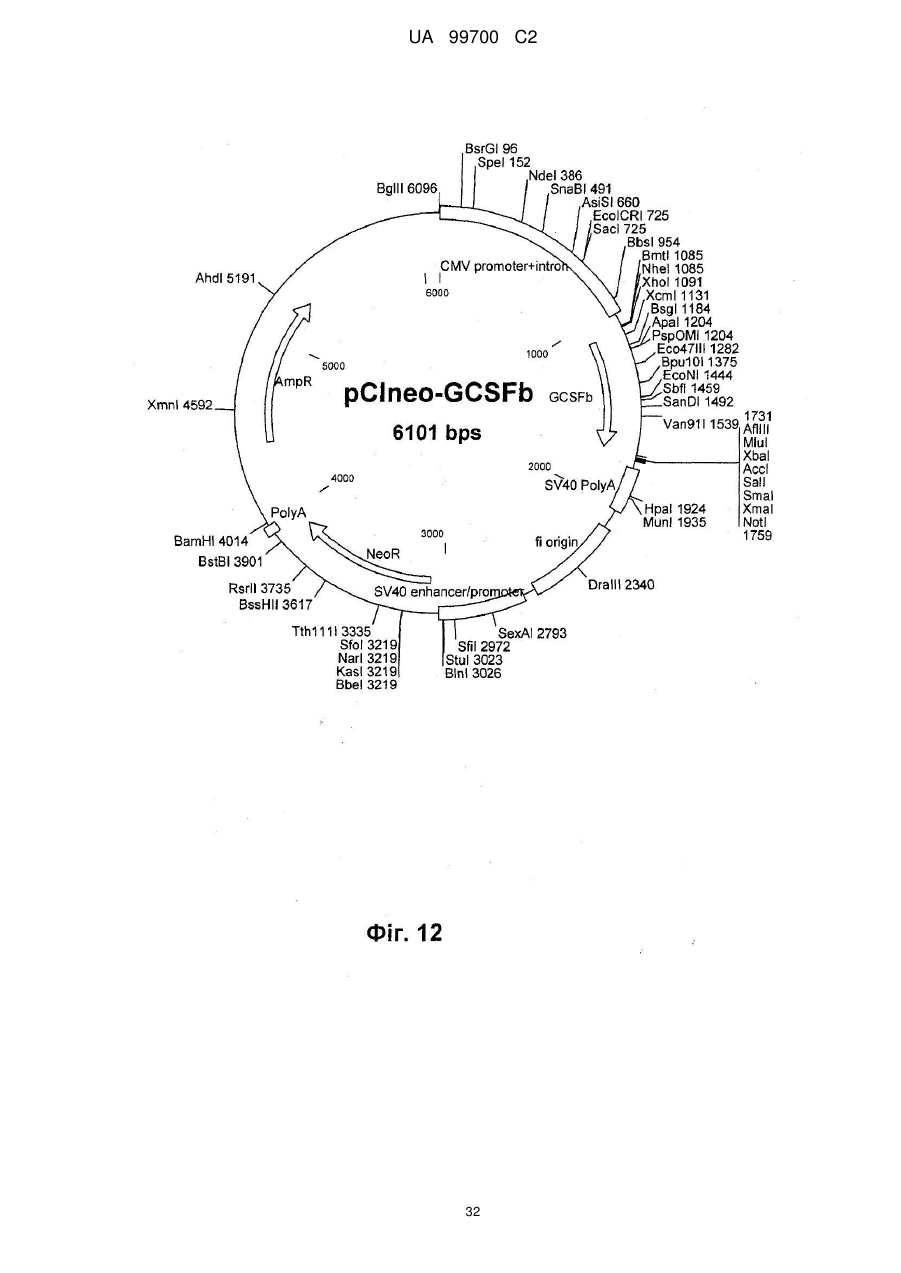
4. Спосіб за п. 3, який відрізняється тим, що вектор трансфекції несе промотор CMV, ген гігроміцину, роlуА-послідовність і заданий ген і, переважно, є похідним вектора pcDNA3.1, що має послідовність SEQ ID NО: 4 або 5.
5. Спосіб за пп. 1-4, який відрізняється тим, що імморталізована людська клітинна лінія:
(і) здатна до трансфекції і вирощування в безсироваткових умовах, та/або
(іі) має інтегровані аденовірусні послідовності в своєму геномі, та/або
(ііі) її вибирають з переліку клітин, що включає клітини нирки, сечового міхура, печінки, легенів, серцевого м'яза, гладкої мускулатури, яєчника, клітини шлунково-кишкового тракту, переважною є клітинною лінією людської нирки, та/або
(iv) не здатна експресувати людський протеїн.
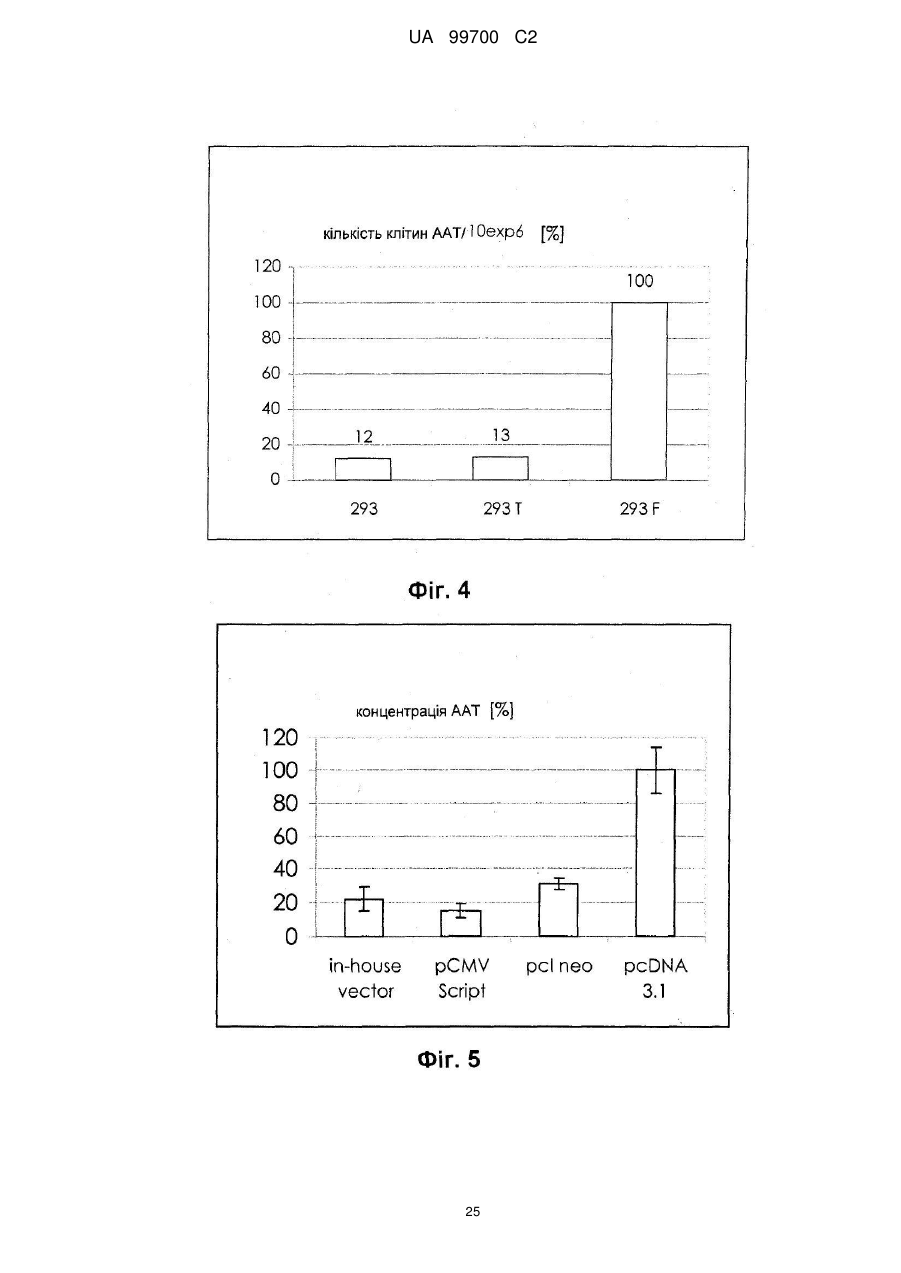
6. Спосіб за п. 5, який відрізняється тим, що клітинами нирки є клітини нирки ембріона людини, переважно клітини нирки ембріона людини, вибрані з клітин 293 (АТСС CRL-1573; DSM АСС 305), клітин 293Т (DSM АСС 2494), клітин FreeStyle 293 (клітин 293F; Invitrogen R79007), переважно клітинами є клітини 293F (Invitrogen R79007).
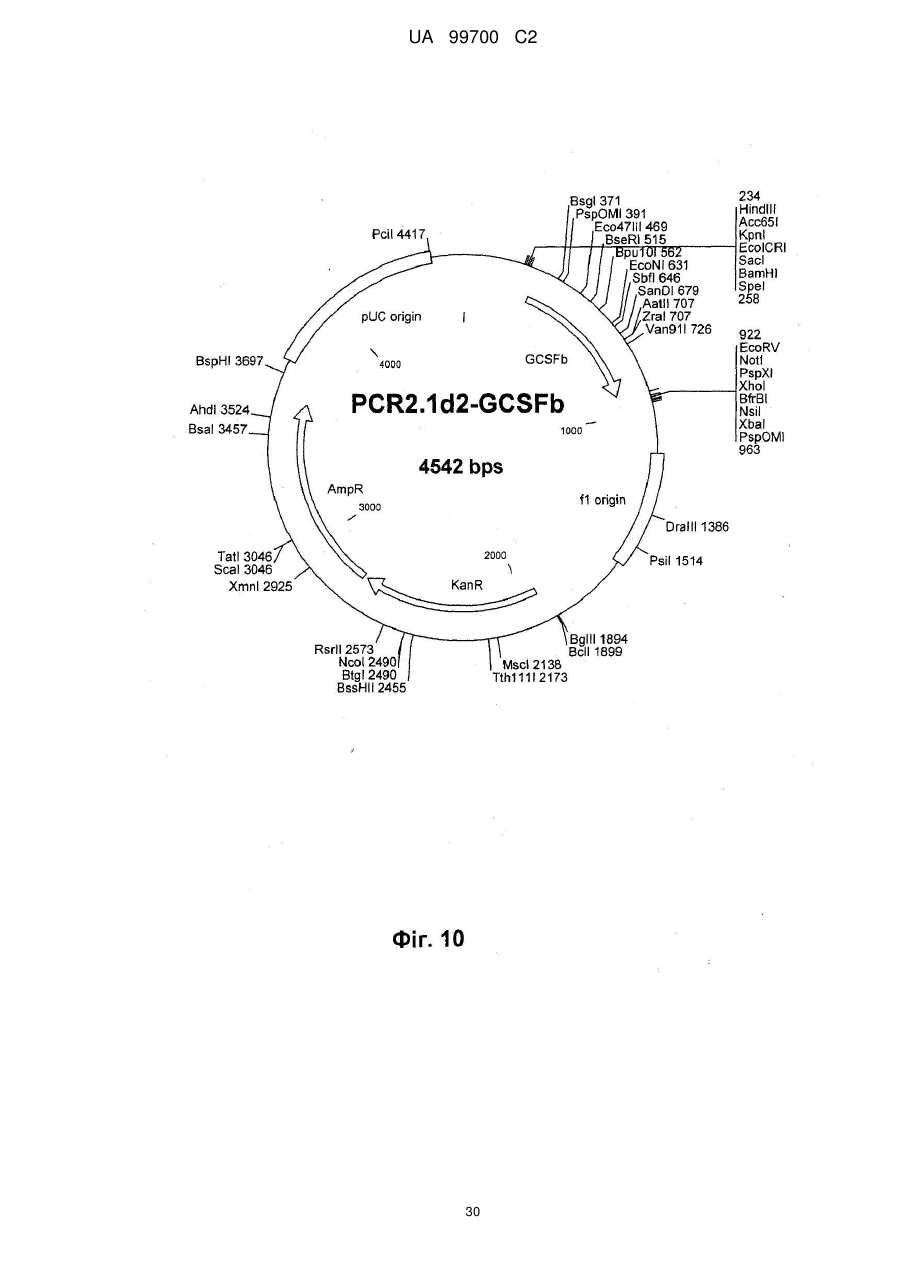
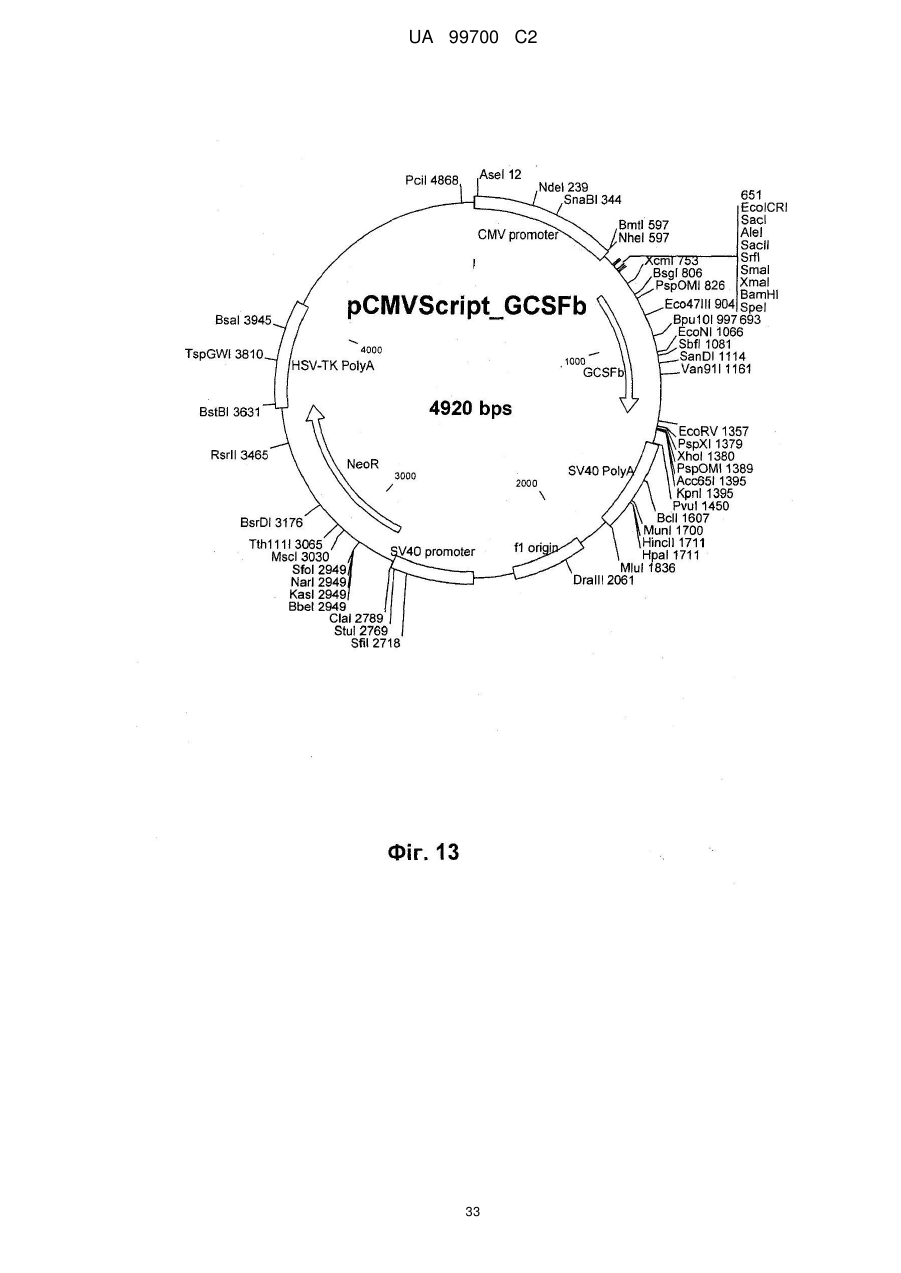
7. Спосіб за п. 6, який відрізняється тим, що клітинною лінією є 293F, а вектором трансфекції є похідне pcDNA3.1, причому вектор переважно кодує людський фактор IX системи згортання крові, як показано парами основ від 939 до 2324 SEQ ID NО: 1, людський А1АТ, кодований парами основ від 973 до 2259 SEQ ID NО: 2, людський wt фактор VIII, як показано в SEQ ID NО: 9, або людський фактор VIII з делетованим В-доменом, як показано в SEQ ID NО: 3, FVII/VIIa, G-CSF, включаючи G-CSFb, показаний в SEQ ID NО: 27, або фактор фон Віллебранда.
8. Спосіб за пп. 1-7, який відрізняється тим, що безсироваткову трансфекцію здійснюють в культуральній суспензії без сироватки з катіонним агентом трансфекції або фосфатом кальцію, переважно реагентом ліпофектаміном 2000 CD (Invitrogen).
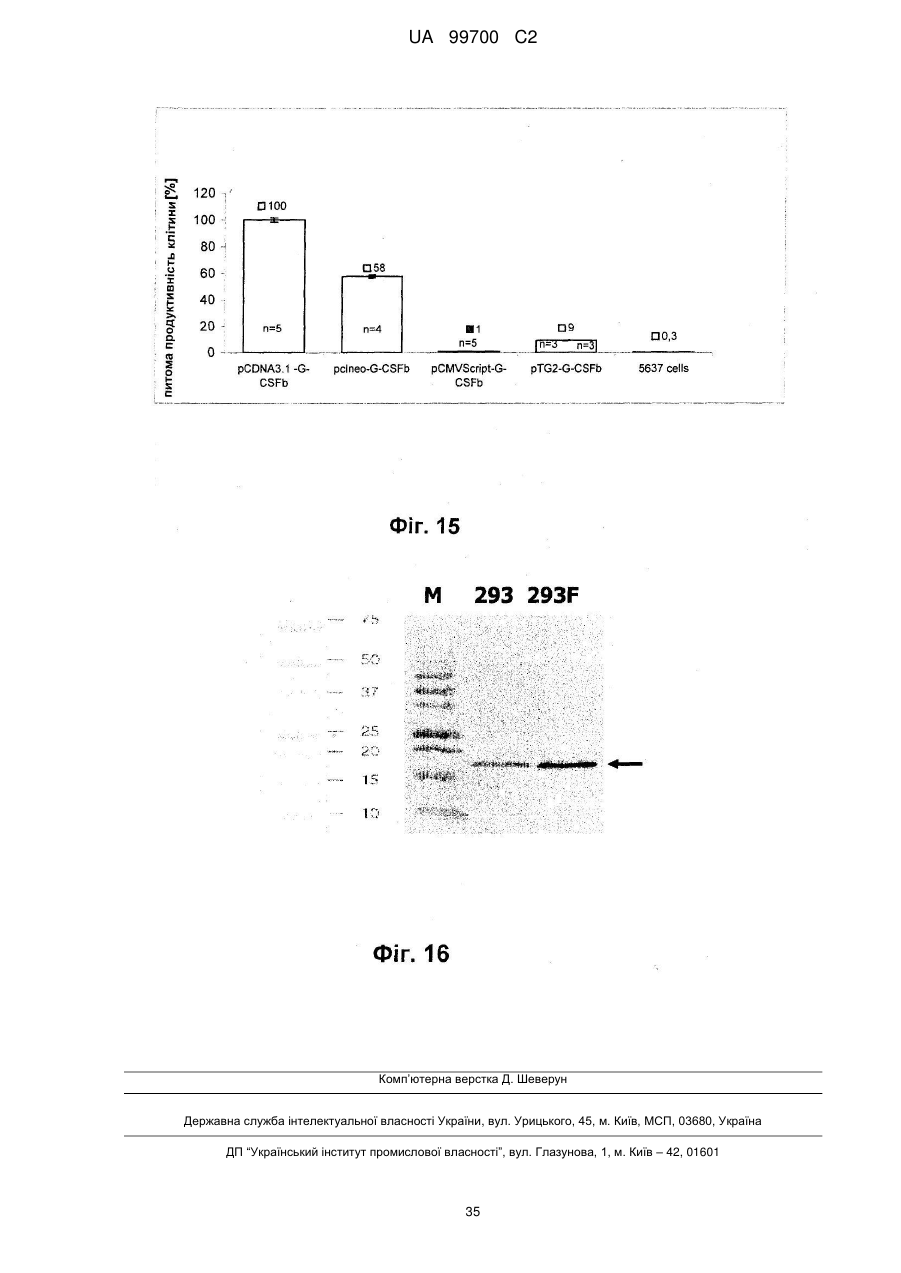
9. Спосіб за пп. 1-8, який відрізняється тим, що він додатково включає відбір стійко трансфікованих клітин, переважно за критеріями продуктивності, активності і товарної якості виробленого рекомбінантного протеїну.
10. Стійко трансфікована імморталізована людська клітинна лінія, отримана з використанням способу за пп. 1-9.
11. Клітинна лінія за п. 10, отримана з використанням способу за пп. 4-9, яка відрізняється тим, що клітинною лінією переважно є 293F, а вектором трансфекції є похідне pcDNA3.1.
12. Спосіб рекомбінантного продукування людського протеїну направленої доставки або його похідного, або мутанта, який відрізняється тим, що він включає вирощування імморталізованої людської клітинної лінії за п. 10 або 11.
13. Спосіб за п. 12, який відрізняється тим, що людським протеїном направленої доставки є людський фактор IX системи згортання крові, як показано парами основ від 939 до 2324 SEQ ID NО: 1, людський А1АТ, кодований парами основ від 973 до 2259 SEQ ID NО: 2, людський wt фактор VIII, як показано в SEQ ID NО: 9, або людський фактор VIII з делетованим В-доменом, як показано в SEQ ID NО: 3, FVII/VIIa, G-CSF, включаючи G-CSFb, показаний в SEQ ID NО: 27, або фактор фон Віллебранда.
14. Спосіб за п. 12 або 13, який відрізняється тим, що додатково включає операції, при яких концентрують рекомбінантний людський протеїн з культурального бульйону та/або очищають протеїн, та/або видаляють пріон.
15. Спосіб за пп. 12-14, який відрізняється тим, що продукування людського протеїну здійснюють в безсироваткових умовах.
Текст
Реферат: Даний винахід належить до вдосконаленого способу приготування імморталізованої людської клітинної лінії, стійко трансфікованої в безсироваткових умовах специфічним вектором, що несе UA 99700 C2 (12) UA 99700 C2 ген, кодуючий заданий протеїн. Крім того, винахід належить до клітинної лінії, отриманої з використанням згаданого способу, способу отримання заданого протеїну з використанням вказаної клітинної лінії. UA 99700 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід відноситься до вдосконаленого способу безсироваткового продукування имморталізованої людської клітинної лінії, що стійко трансфікується в безсироваткових умовах специфічним вектором, який несе ген, кодуючий заданий протеїн. Крім того, винахід відноситься до клітинної лінії продукування, отриманої з використанням згаданого способу, способу отримання заданого протешу з використанням вказаної клітинної лінії продукування, до специфічного вектора, що несе заданий ген. Передумови створення винаходу Рекомбінантне продукування людських протеїнів, в основному, здійснюється шляхом вирощування стабільно трансфікованих евкаріотичних клітинних ліній, переважно, клітинних ліній ссавців, і виділення протеїну з живильного культурного середовища. Що стосується випадків, коли рекомбінантні протеши призначені для використовування як фармацевтичного продукту, протягом довгого часу на практиці застосовувалися клітинні лінії не людського походження, щоб виключити ризик сумісного очищення інфекційних агентів, які можуть залучатися і експресуватися людськими клітинами. В процесі продукування деяких людських протеїнів, наприклад, людського фактора VIII системи згортання крові, було знайдено, що використовування клітинних ліній не людського походження пов'язано з появою певних проблем, наприклад, з появою незадовільних рівнів секреції експресованого протеїну в середовищі. Ясно, що це може відбуватися через малі відмінності в межах різних типів клітин ссавців відносно внутріклітинних шляхів трансляції і модифікації протеїну, які також можуть впливати на біологічну активність експресованого поліпептиду. Крім того, існували побоювання щодо того, що протеши терапевтичного призначення, очищені від експресійних систем не людського походження, забруднюються клітинними компонентами, які можуть дати поштовх виникненню антигенних реакцій в пацієнтів. Проблема також полягала в глюкозіляційному зразку не людського походження, знайденому на людських протеїнах, рекомбінантно отриманих в експресійних системах не людського походження. Напрошується висновок, що ця обставина збільшує вірогідність антигенних реакцій у пацієнта. Більш того, біологічна стабільність і ефективність протеїнів кровоносної системи, наприклад, факторів згортання крові, значною мірою, відчувають вплив з боку їх Nглікозіляційного зразка. Особливого значення набувають периферійні і кінцеві моносахариди, оскільки вони виявляються спеціальними рецепторами з кліток, які відповідальні за їх деградацію. Фактори здатності крові до згортання, наприклад, несуть залишки сіалової кислоти як кінцевих моносахаридів. Модифікація композицій сіалових кислот у «вусиках» глікопротеїнів може привести до гетерогенних зразків (малюнкам) глікозилювання. Таким чином, біологічна стабільність і ефективність зазнають зміни при виникненні таких модифікацій. Отже, можна зробити висновок про те, наскільки важливо для виробництва рекомбінантних факторів системи згортання крові оцінити відмінність у впливі глікозилювання, що йде від клітинних ліній не людського походження, порівняно з людськими клітинними лініями. З другого боку, відомі основні способи високорівневої протеїнової експресії заданого гена, що містить імморталізовані стійко трансфіковані клітинні лінії ссавців, що експресують протеїни активаторів вірусної транскрипції (наприклад, патент США № 5,712, 119). Такі клітинні лінії можуть бути трансформовані конструкцією вектора, в якому відповідний промотор вірусної транскрипції функціонально асоційований з DNA-послідовністю, яка визначає заданий ген, протеїни активатора транскрипції, забезпечені клітинними лініями, активізують промотор вірусної трансляції, а отже, ініціюють експресію заданого гена. Таким же значущим, як і клітинна лінія, є вектор, використовуваний для введення рекомбінантного гена в іммобілізовану продукуючу клітинну лінію. Широка різноманітність векторів була використана для трансляції протеїнів ссавців (наприклад, Witch-Baumgartner, M et al.,Am.J. Genet (2000). 66, 402-412 клонували DHCR7 cDNA в pCI-neo вектор експресії ссавця і експресували в клітинах 293 HEK; McGarvey, T.W. et. A1. Oncogene (2001). 20, 1041-1051 клонували ген TEREl в pTARGET вектор експресії і експресували в людських перехідних клітинах карциноми сечового міхура; і Lin. Lin et. al. J Biol Chem (2002) 277 (44) 41872-8 клонували ген ArchR у вектор експресії клітини ссавця pEF6/myc - His вектор - і експресували його в клітинах 293). Недавно створений вектор, що володіє великими потенційними можливостями, який, як було підтверджено, здатний забезпечувати надекспресію рекомбінантних протеїнів. Це так званий вектор Invitrogen (Інвітроген) pcDNATM 3,1. Li J et.al., Life Sci. 2004 Apr 16; 74(22) :2693-705 успішно над експресували гістодеацетилази, використовуючи pcDNA™ 3,1 в HEK клітинах 293. Дані клітини були стійко трансфіковані і вирощені у присутності сорватки. Yuan-Gen Fu. et al., World J Gastroenterol 2003 продукував рекомбінантний Caspase-З, використовуючи евкаріотичний вектор на основі pcDNA3,1(+), на раковій клітинній лінії шлунково-кишкового тракту SGC7901, проміжно трансфікованої даним 1 UA 99700 C2 5 10 15 20 25 30 35 40 45 50 55 60 вектором і вирощеної у присутності сироватки. Ma H. et al., Invest Ophtalmol Vis Sci. 2000 Dec; 41(13):4232-9 проаналізував відсутність (брак) стійкого протеїну і втрату ензиматичної активності, екпресуючої протеїни Lp82 і протеїни, пов'язані з Lp82, субклоновані у вектор pcDNA3,1, використовуючи COS-7 як клітинні лінії. Такі клітини були проміжно трансфіковані і вирощені у присутності сироватки в живильному середовищі. Надекспресія тіоредозину передує No-індукованому зниженню активності NO-синтази в ендотеліальних клітинах легені. Zhang J. et al., Am J Physiol. 1998 Aug; 275(2 Pt 1): L288-93 розкривають надсинтез гена тіоредоксину в культурних ендотеліальних клітинах легеневої артерії свині шляхом проміжної трансфекції даних клітин вектором pcDNA3,1. Трансфіковані клітини були вирощені в середовищі, в яке була додана сироватка. Shinki T et al., Proc Natl. Acad. Асі. USA 1997 Nov 25; 94(24): 12920-5 порівняли повну довжину cDNA для оксидази змішаної функції мітохондріальної цитохроми Р450 щурячої нирки, 25-гідроксивітамін О3-1-гідроксилази з вітамін D-дефицитною cDNA і субклонували її у вектор pcDNA 3,1(+) експресії ссавця і в проміжному режимі трансфікували (внесли) вектор в COS-7 - трансформовані клітини нирки мавпи. Трансфіковані клітки були вирощені в середовищі з додаванням сироватки. Zhang et al., Acta Biochimica et Biophysica 2004, 36(10): 707-712 розкриває трансфекцію людських ембріональних ниркоподібних клітин 293 за допомогою pcDNA, що містить ген, який кодує олюднене антитіло Fv з єдиним ланцюгом 520С9/людський інтерлейкін-2-слитий протеїн. Супернатант був відібраний після вирощування клітин протягом трьох днів у вільному від сироватки середовищі SFM II. Отриманий злитий протеїн володіє зв'язуючою специфічністю проти р185 (багатообіцяюча клітина-мішень для лікування раку грудей з використанням антитіла) і підтримує важливу імуно-стимулюючу активність IL-2. Chen, J.Z. et al., Int J Biochem Cell Biol. 2004 Aug; 36(8): 1554-61 отримали методом надсинтезу Bim-протеїни, які є істотними чинниками для апоптоза з використанням клітин HEK 293 трансфікованих pcDNA-Bim альфаЗ. Додатковим засобом підвищення безпечності рекомбінантних протеїнів для фармацевтичного застосування є використовування безсироваткового середовища в процесі вирощування культури, оскільки використовування сироватки представляє загрозу безпечності, рівно як і є джерелом небажаних забруднень. Існуючий безсироватковий вид вирощування культури має недолік, який полягає в тому, що виходи такого процесу приготування продукту, в основному, значно знижуються. Ще однією проблемою, пов'язаною з безпечністю продукту, є використовування сироватки при трансфікуванні кліток-господарів, що є звичайною процедурою, вживаною на практиці, оскільки використовування сироватки в операції трансфікування може викликати появу небажаного біологічного матеріалу, що інтегрується в клітини, які надалі забруднюють продукт, що експресується клітинами у виробничому процесі. Якщо деякі з існуючих способів виробництва рекомбінантних протеїнів (включаючи згадані вище) дійсно забезпечують безсироваткове вирощування культури, то спосіб безсироваткової стійкої трансфекції людських клітин невідомий. На 19-м з'їзді ESACT, Harrogate, який проходив 5-8 червня 2005 року, спосіб безсироваткової трансфекції CHO був запропонований Kuchenbecker et al. Таким чином, існує насущна потреба в розробці ефективного і надійного способу виробництва людських рекомбінантних протеїнів. Суть винаходу Несподівано було знайдено, що не забруднений людський протеїн (тобто протеїн, отриманий в результаті операції, яка не супроводиться появою продуктів, супутніх протеїну) може бути отриманий в достатній кількості з імморталізованих клітинних ліній людини, стійко трансфікованих в безсироваткових умовах, з використанням гена, що кодує заданий протеїн. Більш конкретно, даний винахід забезпечує: (1) спосіб приготування імморталізованої людської клітинної лінії, стійко трансфікованої послідовністю нуклеїнової кислоти, що включає ген, який кодує людський протеїн направленої доставки, або його похідне, або його мутант, промотор, а також сигнал поліаденіляції (роlуА) бичачого гормону росту, причому даний промотор і роlуА-сигнал зв'язуються з 5' і 3' кінцем гена, що кодує згаданий людський протеїн направленої доставки, при цьому даний спосіб включає операцію трансфікування імморталізованої людської клітинної лінії-господаря в безсироваткових умовах шляхом використовування вектора трансфекції, що містить згадану послідовність нуклеїнової кислоти і оріджин (джерело) реплікації; (2) спосіб за (1), при якому вектор трансфекції є похідним вектора pcDNA3,1, що має послідовність SEQ ID NO: 4 або 5; (3) спосіб за (1) або (2), при якому людська клітинна лінія є клітиною нирки людського ембріона, вибраною з клітин 293 (ATCC CRL-1573; DSM АСС305), клітин FreeStyle 293 (далі по тексту «293F»; Invitrogen R79007) і клітини 293Т (ATCC CRL-11268; DSM ACC 2494); 2 UA 99700 C2 5 10 15 20 25 30 35 40 45 50 55 60 (4) спосіб за (1) - (3), при якому людським протеїном є фактор IX системи згортання крові, (наприклад, кодований в bps (базових парах) від 239 до 2324 для SEQ ID NO: 1), альфа-1антитрипсин (далі по тексту «А1АТ»; наприклад, кодований bps від 239 до 2259 для SEQ ID NO: 2), фактор VIII системи згортання крові (включаючи wt (дикого типу) фактор VIII, як показано в SEQ ID NO: 8 або В-доменом стертий мутант фактора VIII, кодований bps від 783 до 5162 для SEQ ID NO: 3), фактор VII/VHa (включаючи його форму а і b, кодовану SEQ ID NOs: 13 і 14), GCSF (включаючи форму G-CSF a, b і с, показану в SEQ ID NOs: 15, 16 і 17, відповідно) або фактор (von Willebrand) фон Віллебранда (vWF); (5) вектор трансфекції, що включає оріджин реплікації і ген, який кодує людський протеїн у відповідності з (1) і (2), переважно, даний вектор трансфекції представлено вектором pcDNA3,1, що містить ген для людського протеїну у відповідності з (4); (6) імморталізована людська клітинна лінія, отримана відповідно до абзаців від (1) до (5), переважною є людська клітинна лінія, розкрита в абзацах (3) або (4); (7) спосіб рекомбінантного продукування людського протеїну направленої доставки або його похідного, або його мутанта, який включає операцію вирощування культури імморталізованої людської клітинної лінії, відповідно до абзацу (6), переважно в безсироваткових умовах. Опис малюнків Фіг. 1: Необроблений («дикого типу») людський протеїн системи згортання крові (FIX). Схематичне зображення гена FIX з його 5' не трансльованою (5'UTR) областю і його 3'UTR областю. Позначено вісім доменів необробленого амінокислотного протеїну 461: S: пептид сигналу; P: пропептид; GIa домен: γ-карбоксиглютаміловий домен; Η-домен: гідрофобна послідовність; EGF домен: епідермальний, подібний фактору росту домен; L: зв'язуюча послідовність; AP: пептид активації; Каталітичний домен. Зрілий протеїн FIX має довжину амінокислот 415 і наближену молекулярну вагу 55kDa. Фіг. 2: Вектор pcDNA3,1-FIX Циркулярний вектор DNA містить 6 960 базових пар, точна їх послідовність дана в SEQ ID NO: 1. На схематичному малюнку позначені: промотор CMV (CMV); людський ген FIX (hFIX); оріджин f1 (f1); гигроміциновий ген (Hyg), контрольований промотором SV40 (SV40); область polyA (SV40 poly); оріджин pUC і ампіцилін-стійкий ген (Amp), крім того, позначені численні сайти рестрикції. Даний вектор є похідним від ресеквенованого pcDNA3. 1 вектора pcDNA3. IHygro(+)-zz для SEQ ID NO: 5. Фіг. 3 .Вектор pcDNA3,1-A!AT. Циркулярний вектор DNA містить 6 914 базових пар (bps), точна їх послідовність дана в SEQ ID NO: 2. На схематичному малюнку позначені: промотор гена-підсилювача CMV; cDNA вектора A1AT, сигнал поліаденіляції (polyA) бичачого гормону росту, що включає послідовність терминації транскрипції для посиленої стійкості mRNA, оріджин f1 (f1); гігроміциновий ген (Hyg), контрольований промотором SV40 (SV40); область polyA (SV40 polyA); оріджин pUC і ампіцилін-стійкий ген (Amp), крім того, позначені численні сайти рестрикції. Даний вектор є похідним вектора pcDNA3. lHygro(+)-zz для SEQ ID NO:5. Фіг. 4. Проміжна трансфекция різних людських ембріональних ниркоподібних клітин за допомогою векторів, що кодують альфа-1-антитрипсин. Показані результати досліджень, при яких проводився порівняльний аналіз клітинних ліній. Кількість (%) альфа-1-трипсину (A1AT), 6 виділеного на 10 кліток, показано для клітин 293, 293Т і 293F. Кількість A1AT, виділеного в клітинах 293F, проміжно трансфікованих pcDNA3,1-A1AT, було визначено як 100%. Фіг. 5. Проміжна трансфекція клітинній лінії 293F за допомогою різних векторів, що кодують альфа-1-антитрипсин. Надані результати порівняльного аналізу концентрацій A1AT, еэкспресованих з різних векторів, використовуючи проміжно трансфіковану вільно вибрану клітинну лінію 293F. Рівень експресії A1AT pcDNA3,1-A1AT був встановлений дорівнюючим 100%. Були також випробувані різні інші вектори, що несуть ген A1AT: Внутрішній вектор pTGlΑΙΑΤ (внутрішній вектор для отримання людського рекомбінантного A1AT, як показано на фіг. 10), pCMV Script® A1AT (Stratagene) і реї пео-АІАТ (Promega) порівнювалися з pcDNA3,1-A1AT (pcDNA3. 1) Жоден з інших векторів і близько не наближався до високих рівнів експресії, що спостерігалися в pcDNA3,1 -A 1AT. Фіг. 6: SDS-PAGE і вестерн-блотінг супернатанту клітинної культури. Аліквотні проби супернатанту вільно вибраних клітин (freestyle) 293F, проміжно трансфікованих pcDNA3,ΙΑ 1AT (лінії 1-3 або 6-8) або GFP-експресуючим контрольним плазмідом (лінії 4 і 8), обидві, були досліджені з використанням SDS-PAGE і вестерн-блотінгу. Лінія 1 містить маркер розміру, а лінія 5 залишається порожньою. Смуга для A1AT помічена стрілкою. Також видимою є смуга 27 kDa, відповідна GFP в лініях 4 і 8. Фіг. 7: демонструє вектор pcDNA3,1-F.VIII. Даний вектор містить 9975 базових пар, їх точна послідовність показана в SEQ ID NO: 3. Протеїн фактора VIII, кодований базовими парами від 783 до 5162, представляє собою мутант фактора VIII, стертого В-доменом, описаний в 3 UA 99700 C2 5 10 15 20 25 30 35 40 45 50 55 60 публікації WO 01/70968. І знову-таки даний вектор є похідним вектора pcDNA3. lHygro(+)-zz для SEQ ID NO: 5. Фіг. 8: Порівняльний аналіз середньої кількості отриманого фактора VIII для трьох кращих стійко трансфікованих клонів, трансфі кування клітин 293 і 293F за допомогою pcDNA3,1-F.VIII і внутрішнім вектором pTGF8-2hyg-s, точна їх послідовність показана в SEQ ID NO: 7. Фіг. 9: Показаний вектор pTGl-ΑΙΑΤ. Вектор включає 5610 базових пар, точна послідовність показана в SEQ ID NO: 6. Фіг. 10: Представлений вектор pCR2.1d2-GCSFb. Вектор включає 4542 базових пар, точна послідовність показана в SEQ ID NO: 21. Фіг. 11: Представлений вектор pDNA3.1-GCSFb. Вектор включає 6237 базових пар, точна послідовність показана в SEQ ID NO: 22. Фіг. 12: Представлений вектор pCiNeo-GCSFb. Вектор включає 6101 базових пар, точна послідовність показана в SEQ ID NO: 23. Фіг. 13: Представлений вектор pCMVScript-GCSFb. Вектор включає 4920 базових пар, точна послідовність показана в SEQ ID NO: 24. Фіг. 14: Представлений вектор pTG2-GCSFb-hyg-as. Вектор включає 6917 базових пар, точна послідовність показана в SEQ ID NO: 25. Фіг. 15: Порівнюються кількості rhG-CSF, отримані різними конструкціями експресій відповідно до прикладу 9. Фіг. 16: Представлені результати досліджень rhG-CSF з використанням методики вестернблотінгу відповідно до прикладу 9. Докладний опис винаходу Даний винахід забезпечує вдосконалений спосіб трансфекції і продукування людських рекомбінантних протеїнів в людських імморталізованих клітинних лініях в умовах повної відсутності сироватки і протеїну. Це забезпечує можливість здійснення безсироваткової трансфекції і продукування людських протеїнів. Даний спосіб може включати одну або декілька операцій очищення, включаючи процедури інактивації вірусів, які знижують ризик забруднення рекомбінантних протеїнів людськими патогенами. Оскільки людські рекомбінантні протеїни, продуковані в людських клітинних лініях, несуть людський зразок (тип) глікозилювання, вони також менш схильні до руйнування (розпаду), порівняно з людськими протеїнами, позбавленими свого природного зразка (типу) глікозилювання. У результаті, спосіб за даним винаходом пропонує велику кількість переваг, порівняно з існуючим рівнем техніки. Зокрема, спосіб, наданий в опису прикладу (7) здійснення винаходу, забезпечує ефективну систему отримання безпечних і у високому ступені активних людських рекомбінантних факторів системи згортання крові, наприклад, фактори IX і FVIII для терапевтичного використовування при лікуванні гемофілії типу В і А людини. Спосіб доцільно використовувати не тільки для експресії необроблених протеїнів, він може також використовуватися для мутантів вказаних вище протеїнів, наприклад, фактора VIII, які прогнозовано стійкі проти протеолітичної інактивації і тому можуть бути піддані жорстким протоколам вірусної інактивації. В своєму переважному прикладі здійснення (7) винахід відноситься до без сироваткового вирощування культури імморталізованої клітинної лінії, що несе вектор, який містить промотор, зв'язаний з 5'кінцем послідовності DNA, кодуючої протеїн людської крові. 3'Кінець послідовності DNA, кодуючої протеїн людської крові, функціонально зв'язаний з роlуА -сигналом бичачого гормону росту. Відповідно до винаходу, імморталізована людська клітинна лінія стійко трансфікується вектором. Для припинення стійкої трансфекції вектор може додатково містити, окрім гена протеїну людської крові, принаймні, один ген селективної маркерної системи, яка функціонально зв'язана з промотором. Перелік придатних до використовування промоторів включає вірусний промотор, промотор гена життєво важливих функцій, тканеспецифічні промотори і інші. В тому випадку, якщо промотором є вірусний промотор, клітинна лінія не містить відповідного протеїну активатора транскрипції вірусу для такого промотору. Проте, клітина може містити такий протеїн активатора транскрипції вірусу, як Т-антіген, який додає інший вірусний промотор, функціонально не зв'язаний з геном, що кодує протеїн людської крові. Переважно, як промотора, використовують промотор SV40, промотор CMV, промотор EF-I альфа, промотор HSV TK і інші. Найбільш переважним промотором є промотор CMV, тобто основний, найбільш важливий проміжний ранній промотор цитомегаловирусу. Вираз «трансфекція» або «трансфікований» відноситься до поняття введення нуклеїнової кислоти в клітину за умовами, що забезпечують експресію протеїну. В основному, нуклеїновою кислотою є послідовність DNA, зокрема, вектор або плазмід, що несе заданий ген у присутності відповідного промотора, при цьому експресія гена контролюється даним промотором. Проте, 4 UA 99700 C2 5 10 15 20 25 30 35 40 45 50 55 60 термін «трансфекція» включає також поняття «трансфекції RNA». Фахівець, кваліфікований в даній області техніки, добре знайомий з різними способами трансфекції, наприклад, заснованими на використовуванні молекул носіїв, подібних катіонним ліпідам, таким як DOTAR (Roche), DOSPER (Roche), Fugene (Roche), Transfectam® (Promega), TransFastTM (Promega) і TfxTM (Promega), Ліпофектамін (Інвітроген) і 293fectinTM (Інвітроген) або фосфат кальцію і декстран DEAE. Такому фахівцю знайомі також технології жорсткої трансфекції. їх перелік включає електропорацію, бомбардування несучими частинками, покритими нуклеїновою кислотою (генна гармата) і мікроін'єкцію. Крім того, кваліфікований фахівець також знайомий з трансфекцією нуклеїнової кислоти при використовуванні вірусних векторів. Терміни «проміжно трансфікований» або «проміжна трансфекція» відносяться до проміжних, швидкоплинних, тобто не постійних у часі експресіям заданого гена, через епізомальну природу введеної нуклеїнової кислоти. По своїй природі трансфекція RNA або цитолітичні віруси можуть використовуватися тільки для проміжної експресії. Епізомальні нуклеїнові кислоти, що включають DNA (плазміди або вектори), руйнуються клітинами через проміжок часу, що становить від двох до чотирьох днів, після цього експресія заданого гена припиняється. Терміни «стійко трансфікований» або «стійка трансфекція» відноситься до перманентної (безперервній) експресії заданого гена, завдяки інтеграції трансфікованої DNA в геном клітини. Більшість, якщо не всі, клітини наділені потенційною можливістю включати епізомальну DNA в свій геном навіть при дуже низькій інтенсивності. Проте використовуються дуже ускладнені методи відбору для експансії (розмноження) тих клітин, які інтегрували транфіковану DNA. Тому задача полягає в тому, щоб створити умови, при яких вектор обов'язково містить, принаймні, один ген для селективного маркера, наприклад, гігроміцину. В контексті даного винаходу термін «стійка трансфекція» або «стійко трансфікований» використовується також відносно клітин, що несуть плазміди, які можуть автономно реплікуватися і, отже, можуть бути використані для довготривалої експресії чужорідних генів. Одна з переважно вживаних систем перенесення «стійко трансфікуючих» клітин заснована на рекомбінантних ретровірусах. Оскільки інтеграція провірусної DNA є обов'язковою операцією при циклі ретровірусної реплікації, інфекція клітин з рекомбінантними ретровірусами може спровокувати дуже високий відсоток клітин, які інтегрували заданий ген і таким чином є стійко трансфікованими. Термін «вирощування культури» відноситься до підтримки клітин/клітинних ліній in vitro в контейнерах з середовищем, що підтримує їх проліферацію і експресію гена. Таким чином, вирощування культури викликає акумуляцію експресованих секретабельних протеїнів в культурному середовищі. Звичайно, середовище містить добавки, що стабілізують показник рН, а також амінокислоти, ліпіди, сліди елементів, вітаміни і інші підсилюючі ріст компоненти. Термін «безсироватковий», «безсироваткова трансфекція» або «безсироваткове вирощування» відноситься до трансфекції і вирощування клітин у середовищі, що містить будьякі відповідні добавки, за винятком будь-яких видів сироватки. Добавки вибирають з переліку амінокислот, ліпідів, слідів елементів, вітамінів і інших компонентів інтенсифікації росту. Часто умови «безсироваткової» культури є навіть більш жорсткими і, якщо ще не доданий екзогенний протеїн або не включений в середовище, середовище називається «вільним від протеїну». Термін «імморталізована клітинна лінія» відноситься до людських клітин, які спочатку не були узяті безпосередньо з організму. Зокрема, він відноситься до клітинної культури, що перманентно акліматизувалася, яка повинна забезпечувати проліферацію відповідного вільного середовища і простору і, завдяки цьому отримати можливість уникнути межі Hayf1ick. Термін «концентрація» відноситься до концентрації рекомбінантного протеїну, отриманого з культурного середовища. По суті, це відображається на концентрації протеїну. Кваліфікований фахівець в даному виді техніки ознайомлений з цілим поряд технічних засобів, що дозволяють досягти заданої концентрації, наприклад, таких як: фільтрація, включаючи і ультрафільтрацію, центрифугування, осадження і інші. Процес концентрації не обов'язково пов'язаний із забезпеченням отримання чистого протешу. Виділений протеїн все ще може містити непротеїнові компоненти і забруднення протеїну. Часто необхідні додаткові операції очищення. Термін «очищення» відноситься до операцій, яким піддається виділений протеїн, з метою отримання достатньо чистого продукту (щонайменше, з чистотою 60%, переважно, принаймні, з чистотою 75%, більш переважно, понад 90%, і найбільш переважно, з чистотою понад 99,9%), тобто рекомбінантного людського протеїну. Чистота може бути виміряна будь-яким прийнятним способом з рівня техніки. Кваліфікований фахівець, знайомий з технологіями, використовуваними для очищення рекомбінантного протеїну, наприклад, такими, як імунноафінна хроматографія, афінна хроматографія, протеїнове осадження, буферні обмінні процеси, 5 UA 99700 C2 5 10 15 20 25 30 35 40 45 50 55 60 іонно-обмінна хроматографія, гідрофобна інтерактивна хроматографія, гель-фільтрація, електрофорез. Крім того, процес очищення може містити операцію обеззараження вірусу, наприклад, теплову обробку та/або обробку за допомогою розчинного миючого засобу (SD), в сухому або рідкому стані, в присутності або без хімічних речовин, включаючи інгібіторів протеази. Додатково до перерахованого вище, очищення може включати одну або більш операцій видалення пріону, наприклад, протеїнове осадження, фільтрацію, операції методом хроматографії, зокрема операції афінної хроматографії (див., наприклад, «Partitioning TSE infectivity during ethanol fractionation human plasma (Розділення TSE-інфективності в процесі етанолового фракціонування людської плазми)», Gregori, L. et all,Biologicals 32 1-10; 2 (2004); «Removal TSE agents from blood products (Видалення Tse-агентів з продуктів крові)», Foster, P. R., Vax Sanguinis 87 (suppl. 2), S7-S10 (2004)). Після знезараження вірусу може виявитися необхідною додаткова операція очищення, вибрана з перерахованих вище дій для видалення хімічних речовин, використаних для знезараження вірусів. Термін «вектор» відноситься до будь-якої генетичної конструкції, наприклад, плазміду, фагу, косміду і іншим, які здібні до реплікації, будучи зв'язаними з відповідними контрольними елементами, в які фрагменти DNA можуть бути інсертовані або клоновані. Вектор містить унікальні сайти рестрикції і може виявитися здібним до автономної реплікації в клітинігосподареві. Термін включає поняття засобів перенесення при клонуванні і експресії. «Вектор» може додатково нести один або декілька додаткових елементів з регуляторними функціями. Дані елементи, переважно, вибираються із сплайс-сайтів, сайтів рекомбінації, роlуА-сайтів, підсилювачів, мультиклонуючого сайту і прокаріотичних послідовностей плазміду. Термін «функціонально сполучений» відноситься до конфігурації вектора, в якому промотор знаходиться в межах вектора, розташовуючись таким чином, що він може стимулювати транскрипцію послідовності DNA, що кодує заданий протеїн, зокрема, протеїн людської крові. Термін «зрілий» відноситься до молекулярної структури даного протешу вже обробленого протеїну, тобто протеїну, в якому відсутній експортний сигнал N-термінації. Термін «промотор» відноситься до області регуляторної послідовності DNA, зв'язаної РНКполімеразою і факторами транскрипції при ініціації транскрипції. Термін «підсилювач» відноситься до цис-діючої послідовності, яка підсилює утилізацію эвкариотичногоеского промотора і може функціонувати при будь-якій орієнтації і в будь-якому місцерозташуванні (в зворотному або прямому напрямі) щодо промотора. Термін «сигнал поліаденіляції (роlуА)» відноситься до спеціалізованої послідовності термінації. Він сигналізує про додавання «хвоста» аденіну до кінця mRNA, що забезпечує експорт mRNA в цитоплазму. Після досягнення цитоплазми хвіст polyA mRNA підтримується протягом трансляції протеїну і стабілізує mRNA протягом експресії протеїну. Термін «кодує» або «кодуючий» відноситься до здатності послідовності нуклеїнової кислоти транскрибуватися (у випадку з DNA) або транслюватися (у випадку з mRNA) в поліпептид (протеїн) in vitro або in vivo, знаходячись під контролем відповідної регуляторної послідовності. В контексті даної заявки на винахід термін «експресувати», «експресуючий» або «експресія» відноситься до транскрипції і трансляції гена, що кодує протеїн. Термін «людський протеїн» в контексті винаходу включає, але не обмежується поняттям людських протеїнів, поліпептидів, мутацій і їх модифікацій. Зокрема, людські протеїни включають рекомбінентні протеши плазми, наприклад, фактори системи згортання крові (фактор VIII, Фактор VII/VIIa, Фактор V, фактор IX, Фактор XI, фактор фон Віллебранда і інші), фактори росту (наприклад, еритропойетин і інші), колонія-стимулюючі фактори (CSFs) (наприклад, гранулоцит-стимулюючий фактор(О-С8Р), макрофаг CSF (M-CSF), гранулоцитмакрофаг CSF (GM-CSF), цитокіни (наприклад, інтерлейкіни, включаючи інтерлейкін 3 і інші), інгібітори протеази (наприклад, альфа-1-анитрипсин(А1AT), інгітбіторно або регуляторно діючі протеїни і інші. Крім того, включені мутації і модифікації даних протеїнів або поліпептидів, зокрема, мутації і модифікації, що забезпечують кращу стійкість рекомбінантного протеїну, більш тривалий період напіврозпаду або кращу регенерацію, і включають делеційних, субституційних або інсерційних мутантів, а також хімічних мутантів функціональних груп, відповідно. Зокрема, переважними протеїнами, які можуть бути отримані відповідно до способу за даним винаходом, є людський фактор VIII (включаючи В-домен-стертий або «дикого типу» ), людський фактор XI, людський G-CSF, людський A1AT, людський фактор VII/VIIa і фактор фон Віллебранда. Рекомбінантне продукування фактора VIII і IX відоме з рівня техніки (EP-A-160457; WOА86/01961, U.S. патенти 4,770,999; 5,521,070 і 5,521,070). Що стосується фактора VIII, рекомбінантна експресія субодиниць продукування комплексів, що проявляють активність коагуляції, відома з рівня техніки (наприклад, з EP-A-150735; ЕР-А 6 UA 99700 C2 5 10 15 20 25 30 35 40 45 50 55 60 232112, ЕР-А-0500734, WO-91/07490, WO-95/13300, U.S. патенти 5,045,455 і 5,789,203). Крім того, експресія усічених cDNA-версій частково або повністю позбавлених послідовності, кодуючої у високому ступені глікозильований В-домен, вже описана (наприклад, в WO-86/06101, WO-87/04187, WO-87/07144, WO-88/00381, ЕР-А-251843; ЕР-А-253455, EP-A-254076, U.S. патенти 4,868,112 і 4,980,456, ЕР-А-294910, ЕР-А-265778, ЕР-А-303540 і WO-91/09122). Окремий мутант фактора VIII, в якому В-домен між позиціями Arg740 і GIu 1649 замінений лінкерним пептидом Arg-rich, має, принаймні, 3 Arg-залишки і містить від 10 до 25 амінокислотних залишків (де нумерація даного φ3κτορ3νΐΙΙ здійснюється щодо послідовності зрілого фактора VIII «дикого типу», представленої в SEQ ID NO:9), розкритий в документі WO01/70968, який включений в дану заявку у всій своїй повноті. Зокрема, лінкерний пептид Arg-rich, має від 14 до 20 амінокислотних залишків, причому лінкер містить: амінокислотну послідовність SFSQNSRH (SEQ ID NO:10), та/або амінокислотну послідовність QAYRYRRG (SEQ ID NO: 11), та/або амінокислотну послідовність SFSQNSRHQAYRYRRG (SEQ ID NO:12), є переважним. Такий mutein фактор VIII з доменом В кодований за допомогою від nt 783 до 5162 для SEQ ID NO:3. G-CSF представляє собою невелику молекулу із специфічною лінією диференціювання в людській крові, яка стимулює продукування типу білих кров'яних телець з кісткового мозку, відомих під назвою нейтрофіли. Нейтрофіли грають центральну роль в імунній системі організму людини і захищають від інфекцій. G-CSF (особливі cDNA-послідовності, форми а, b, с якої представлені в SEQ ID NOs: 15, 16 і 17, відповідно; протеїн G-CSF форми b (далі по тексту протеїн «G-CSF форми b ») представлений в SEQ ID NO:27) натурально продукований моноцитами, фібробластами і ендотеліальними клітинами. Нормальним вважається, якщо їх концентрація в крові складає близько 40 пг/мл (pg/ml) в здорової людини. В плазмі пацієнта рівень G-CSF може знизитись більш, ніж в 10 разів. G-CSF також продукується в ракових клітинних лініях, подібних клітинам 5637, які секретуют близько 70 нг/мл. Для терапевтичного використовування рекомбінантний людський G-CSF продукується в Е.соlі у вигляді N-кінцевої метильованої, не глікозильованої форми фірмою Amgen Inc (Filgrastim/Neupogen®), яка також відома як РЕОильований продукт (Pegfilgrastim/Neulasta®). Ще один лікарський засіб продукується в клітинах CHO фірмою Chugal Pharmaceuticals Co, результатом чого є гликозильований продукт (Lenograstim/Granocyte®). G-CSF використовується як лікарський засіб для лікування нейтропенії або природженої, або викликаної хіміотерапією (рак), снідом або трансплантацією кісткового мозку. При такому лікуванні типовою дозою є 5 мкг/кг на добу. Специфічна послідовність cDNA A1AT, відповідна винаходу за даною заявкою, представлена в bps від 973 до 2259 для SEQ ID NO:2. Специфічна послідовність cDNA фактора VH/VIIa, відповідно до винаходу за даною заявкою, надана в SEQ ID NOs: 13 та 14, відповідає формам а і b. Специфічна cDNA vWF надана в SEQ ID NO:18. Селективна маркерна система включає резистентність гігроміцину, резистентність піроміцину, резистентність неоміцину, резистентність аденозин-деаміназі (ADA), резистентність аміноглікозид-фосфотрансферазі (neo, G418, APH), резистентність блеоміцину (флео, блео, зеоцин), резистентність цитозин-діаміназі (CDA, CD), резистентність цитозин-діаміназі (CDA, CD), резистентність дигідрофолат-редуктазі (DHFR), резистентність гістидинол-дегідрогеназі (hisD), резистентність гігроміцин-В-фосфотрансферазі (HPH), резистентність піроміцин-Nпіроміцин-N-ацетил-трансферазі (РАС, puro), резистентність (TK) тимідин-кіназі, резистентність Ксантін-гуанІн-фосфорібосілтрансферазі (XGPRT, gpt). Особливо переважним є ген резистентності гігроміцину. Крім того, ген для селективного маркера може бути функціонально зв'язаним з polyA-сигналом, наприклад, одним з похідних бичачого гормону росту (BGH) або сигналом поліадениляції SV40. Трансфіковані клітини в своєму культурному середовищі постійно доступні для протеїну селективної маркерної системи, наприклад гігроміцину в процесі селективної фази, внаслідок чого виживають тільки ті клітини, які несуть вектор. Кваліфікований фахівець в даній галузі техніки добре знайомий з альтернативними селективними маркерами, придатними для отримання стійких трансфікованих клітин, а також концентрацій вибраних селективних речовин, які повинні бути використані. В особливому ступені переважний вектор за даним винаходом несе промотор CMV, гігроміциновий ген, роlуА - послідовність і заданий ген і являє собою, переважно, вектор pcDNA3.1 (Invitrogen), що має послідовність SEQ ID NO:4, причому при ресеквенуванні даного вектора було знайдено, що він, насправді, має послідовність, представлену в SEQ ID NO:5. Імморталізовані клітинні лінії, придатні для використовування в даному способі, вибрані з групи клітин нирки, сечового міхура, печінки, легені, серцевого м'яза, гладкої мускулатури, яєчника або шлунково-кишкового тракту. Дані клітини можуть нести в своєму геномі 7 UA 99700 C2 5 10 15 20 25 30 35 40 45 50 55 60 аденовірусні послідовності DNA, зокрема, перші нуклеотиди 4344 для послідовностей Ad5. Переважними є людські ембріональні ниркоподібні клітини (HEK), вибрані з групи, що складається з клітин 293 (ATCC CRL-1573; DSM ACC 305 ECACC ref.: 85120602), клітини 293Т (DSM ACC 2494, ECACC: tsa201, ref.96121229), FreeStyle (вільні) клітини 293(клітини 293F; Інвітроген R79007). Найбільш переважними клітинами є клітини 293F. Дані імморталізовані клітинні лінії, що несуть згаданий вектор, вирощуються в умовах, які забезпечують експресію рекомбінантного гена. По суті, це стандартні умови вирощування культури, відомі кваліфікованому фахівцю з рівня техніки, проте слід знати, що, якщо клітини несуть ген для людського фактора IX, до середовища повинен бути доданий вітамін K. Окремим прикладом здійснення винаходу є безсироваткове отримання (продукування) рекомбінантного протеїну в безсироватковій культурі стійко імморталізованих клітин, які також трансфіковані в безсироваткових умовах. З цією метою, будь-яка з описаних вище імморталізованих людських клітинних ліній, переважно, клітинна лінія 293F, трансф і кується і вирощується в безсироваткових умовах. Клітини стабільно трансфікуються в культурній суспензії за відсутності сироватки, потім пристосовуються до росту склеюючих клітин для селекції одиночних (індивідуальних) клітинних клонів. Як тільки досягається отримання індивідуальних клонів, останні розширюються із забезпеченням їх налипання. Після відбору якнайкращих продукуючих клонів клітини переносяться в культурну суспензію. Протягом всього стабільного процесу обробки клітинної лінії і подальшого відбору за якістю для продукування клітини вирощуються в безсироватковому середовищі і ніколи не вступають в контакт з сироваткою або людськими чи тваринними протеїнами. Рекомбінантний протеїн крові, наприклад, будь-який з чинників системи згортання крові або інгібітор протеази, наприклад A1AT, або фактори росту (наприклад, G-CSF або GM-CSF) виділяються з культурного бульйону, і далі слідують традиційні операції очищення. Більш конкретно, один з прикладів безсироваткового отримання рекомбінантного протеїну людської крові, зокрема, людського фактора VIII або фактора IX, або A1AT, або G-CSFb включає наступні операції, при яких здійснюють: (1) Трансфекцію людських імморталізованих клітин, переважно, клітин 293F в культурній суспензії без сироватки. Клітини вирощуються в одноразових стерильних полікарбонатних 6 колбах Ерленмейера. Клітини трансфікуються при густині, наприклад 1x10 життєздатних кліток на 1мл за допомогою трансфікуючого агента, переважно, катіонного трансфікуючого агента, ще більш переважно, реагента ліпофектаміну 2000CD (Інвітрогена) або реагента для метода трансфекції за допомогою фосфату кальцію); вектор трансфікується, кодуючи людський протеїн крові, переважним вектором є pcDNA3.1-FlX, pcDNA3.1-FVIII, pcDNA3.1-A1AT або pcDNA3.1-GCSFb; (2) Від 24 до 120 годин, переважно, від 36 до 96, більш переважно, 48 годин пост3 10 5 8 трансфекції відповідна кількість клітин (від 10 до 10 ; переважно від 10 до 10 , найбільш 6 переважно 10 клітин) переносяться в плоску чашку для вирощування культури, з метою осадження і для створення умов росту із забезпеченням процесу склеювання. Переважно, чашка для вирощування культури має розмір 10 см, а клітини вирощуються в середовищі, позбавленому сироватки і позбавленому протешу, переважно, в середовищі FreeStyle 293 Expression (12338-018, Invitrogen) або в безсироватковому внутрішньому середовищі (Octapharma Stockholm). (3) Селективний тиск прикладається через проміжок часу від 2 до 50 годин, переважно 48 годин після перенесення в плоску чашку для вирощування культури. До середовища додається відповідний селективний агент, вибраний з групи, що складається з селективних маркерів, наприклад, гігроміцину, неоміцину, G418 і зеоцину. Переважним селективним агентом є гігроміцин з концентрацією від 10 до 300 мкг/мл, переважно, від 50 до 200 мкг/мл, найбільш переважно, 50 мкг/мл. Тиск підтримується, принаймні, в перебіг від 10 до 20 днів, переважно, протягом 14 днів, при цьому середовище з додаванням гігроміцину замінюється через день. Тільки стійко трансфіковані клітини виживають в таких умовах відбору і формують клони із склеєних клітин, які можуть бути відібрані індивідуально. Крім того, може бути використаний приєднувальний фактор для закріплення клітин на чашці і запобігання клітин від плаваючого переміщення від одного клона до іншого клона клітини. Такими приєднувальними факторами можуть бути, наприклад, полі-D-Лізин, синтетичні добавки до середовища без людських або тваринних протеїнів або інші речовини. Як альтернативі, клонуючі кільця можуть бути використані для відбору клонів. (4) Індивідуальні клітинні клони відбираються і переносяться в окремі контейнери для культури, з метою розширення клітин (набухання) при виключенні селективної дії тиском. Будьякий контейнер придатний для зберігання культури, але є переважним, якщо окремі клони 8 UA 99700 C2 5 10 15 20 25 30 35 40 45 50 55 60 спочатку переносяться в планшети з 96 лунками з достатньою кількістю середовища, потім - в планшети з 48-, 25-, 12- і 6 лунками, а потім - в спеціальні центрифуги. На стадії центрифугування клітини вирощуються в безсироватковому середовищі при дуже легкому перемішуванні для повернення клітин назад до стану суспензійного зростання. Як тільки клітини досягають планшета з 6 -лунками для клітин або стадії центрифугування, доцільно відібрати кращі клітинні клони відповідно до деяких критеріїв відбору, тобто, виходячи з інтенсивності зростання клітин, клітини з швидким зростанням більш переважні, і з кількості виробленого рекомбінантного протеїну. Проте, така селекція може бути виконана і на пізнішій стадії. (5) Клітини, отримані в результаті центрифугування, були висіяні в місткості для культури Ерленмейера з достатньою кількістю безсироваткового середовища. Додатковими селективними критеріями для набряклих, зростаючих в суспензії безсироваткових і безпротеїнових клітинних клонів є: життєздатність, морфологія клітини, відсутність агрегації, міцність і стійкість при центрифугуванні і відносно клітинного розпаду. Спосіб за даним винаходом може бути здійснений особливо успішно, якщо вектором є pcDNA3.1-hygro(+)-zz. Переважним є, якщо ген, що кодує людський протеїн, зокрема, людський FIX, FVIII, A1AT або GCSFb, вбудований таким чином, що він контролюється промотором CMV, як показано на фіг. 2, 3, 7 і 11, відповідно. Переважно, якщо послідовності «дикого типу» таких генів вбудовані так, що рекомбінантно експресований протеїн позбавлений ознак мутації і структурований ідентично протеїну «дикого типу», виділеному з плазми крові. Схематичний малюнок необробленого («дикого типу») людського фактора IX показаний на фіг. 1. SEQ ID NOs: 1,2, 3 і 20 забезпечують послідовність нуклеїнової кислоти для pcDNA3.1-FIX, pcDNA3. ΙΑ 1AT, pcDNA3.1 -FVIII, і pcDNA3.1-G-CSFb, відповідно. Відповідні протеїни кодовані нуклеотидами від 939 до 2224, від 913 до 2259, від 679 до 5055 і від 970 до 1584, відповідно. Таким чином, даний винахід забезпечує спосіб рекомбінантного продукування людського фактора IX, A1AT, фактора VIII і G-CSFb, клонованих в pcDNA3.1TM, надаючи початку pcDNA3.1-FIX, pcDNA3.1-A1AT, pcDNA3.1-FVIII, pcDNA3.1-G-CSFb, відповідно, які інтегровані в геном імморталізованих людських клітин, переважно, в клітини нирки людського ембріона, наприклад, клітини 293 (ATCC CRL-1573; DSM ACC 305; ECACC ref.: 85120602), FreeStyle (вільні) клітини 293 (клітини 293F; Інвітроген R79007) або клітини 293Т (DSM ACC 2494, ECACC: tsa201, ref.96121229). Дані клітини, що несуть або pcDNA3,1-FIX, або pcDNA3,1-A1AT, або pcDNA3,1 -FVIII, або pcDNA3,1 -G-CSFb, вирощені в середовищі в стандартних умовах, що забезпечують експресію гена, або, як альтернатива, вони вирощуються в безсироваткових умовах для зведення до мінімуму ризику забруднення людськими патогенами. Може бути включена одна або декілька операцій видалення пріону, наприклад, протеїнове осадження, фільтрація, хроматографічні операції, зокрема, операції афінної хроматографії. Альтернативно/додатково, як експресійна клітина, може бути використана клітинна лінія ударної сепарації пріону. Це може бути забезпечено повним геномним викидом або шляхом використовування десенсибілізувальної технології. При отриманні людського фактора IX клітини, переважно, вирощується у присутності вітаміну K. Людський протеїн крові виділяється з культурного супернатанту і підлягає операціям послідовного очищення, які відомі з рівня техніки як операції, що доводять до максимуму вихід чистого, стійкого і у високому ступені активного продукту. Такі операції вибираються з переліку, що включає имунно-афінну хроматографію, аніон-обмінну хроматографію, гель-фільтрацію і інші, а також їх комбінації. Вони можуть бути легко пристосовані до специфічних вимог, що висуваються до виділення рекомбінантного фактора IX, G-CSFb або A1AT. Кількість і активність очищеного протеїну в час і після операції очищення може бути проконтрольована за допомогою ELISA та/або дослідженнями часу одноступінчатої коагуляції (аРТТ) Для подолання проблеми можливого інфікування очищених протеїнових зразків або продукту, отриманого безпосередньо з супернатанту клітинної культури, що містить вибраний секретований рекомбінантний протеїн, супернатант культури може бути оброблений з використанням операцій знезараження вірусу, включаючи теплову обробку та/або Sd-обробку (в сухому або в рідкому стані, з або без додавання хімічних речовин, включаючи інгібіторів протеази). Кваліфікований фахівець знайомий з технологіями очищення. Наприклад, спосіб виділення, очищення і регенерація високочистого вірус-інактивованого фактора VIII з плазми крові шляхом аніон-обмінної хроматографії був вже описаний (WO93/15105). Крім того, існує інформація про цілий ряд способів отримання високочистих знезаражуючих факторів коагуляції з плазми крові або інших біологічних джерел. Ліпідні покриті віруси ефективно знезаражуються шляхом обробки потенційно інфікованого матеріалу гідрофобною фазою, що формує двофазну систему, з якої поступово виводиться частина, розчинна у воді. Підтверджений додатковий позитивний ефект, що виникає в результаті одночасного або подальшого доповнення обробки 9 UA 99700 C2 5 10 15 20 25 30 35 40 45 50 55 60 за допомогою гідрофобної фази обробкою неіонними біосумісними детергентами і диалкіл-або триалкілфосфатами (WO96/36369, EP 0131740, US6,007,979). Неліпідні покриті віруси вимагають знезаражуючих протоколів, що полягають в обробці неіонними детергентами з подальшою тепловою обробкою (60-65C) протягом декількох годин (WO94/17834). Після знезараження вірусу може виникнути потреба в додатковій операції очищення для видалення хімічних речовин. У результаті, даний винахід пропонує ефективний спосіб отримання протеїну, грунтуючись на забезпеченні асоціювання людської клітинної лінії з вдосконаленими способами очищення протеїну, а також спосіб знезараження потенційно небезпечних інфікуючих агентів. Створена безпечна і проста у використовуванні система отримання рекомбінантних протеїнів, наприклад, факторів системи згортання крові: IX, VIII, A1AT і G-CSFb. Активність рекомбінантно отриманих протеїнів може бути перевірена з використанням стандартних випробувань. Наприклад, у випадку з людським чинником IX, був проведений часовий аналіз частково активованого тромбопластину з використанням активації ручним приладом Dapptin TC коагуляції (Kaolin/Sulfatid-Phospholipid Cat.No. 3035090, Technoclone GmbH). Отримані відповідно до винаходу рекомбінантні протеїни, наприклад, протеїн крові, описаний вище, більш конкретно, людський фактор IX, може бути використаний у фармацевтичній композиції. Далі винахід описується з використанням наступних прикладів здійснення, які не можуть розглядатися як такі, що обмежують об'єм захисту, наданий винаходом. Приклади Матеріали і способи Людські клітинні лінії для експресії протеїну: Переважною клітинною лінією є НЕК293 (ECACC ref.: 85120602), FreeStyle 293 (клітини 293F; Інвітроген R79007) і клітини 293Т (tsa201, ECACC Ref.96121229), яка представляє собою транформовану клітинну лінію нирки людського ембріона, стійко экспресуючу SV40, чутливий до температури T антиген. Дані епітеліальні клітинні лінії використовуються в цілому ряді досліджень функціональних експресій і показують продукування високих рівнів рекомбінантих протеїнів. Клітинна лінія 293F (Інвітроген), яка є похідною клітинної лінії 293, переважно, використана в прикладі здійснення, представленому нижче. Батьківська клітинна лінія 293 є постійною лінією, отриманою з первинної ембріональної людської нирки, трансформованої розділеним людським аденовірусом 5DNA (Graham et al.,1977; Harrison et al., 1877). Клітинна лінія 293F є варіантом клітинної лінії 293, яка була пристосована до суспензійного росту в FreeStyle™ 293(293F) Expression Medium (12338-018, Інвітроген) Клітинна лінія 293F була отримана від Robert Horlik з Pharmacopeia. Клітинна лінія 293F була спочатку приготована з культур Master Cell Bank нижнього пасажа, похідних батьківських клітин 293F, які були повторно клоновані лімітуючим розрідженням. Клітини безперервно вирощувалися в безсироватковому середовищі FreeStyle 293 Expression або в безсироватковому середовищі (Octapharma Stockholm) з доброю життєздатністю і доброю морфологією протягом більше року під час створення даного винаходу. Для ефективного продукування людського фактора IX середовище може бути модифіковано шляхом додавання вітаміну K. Вказані клітини здатні вирощуватися в безсироватковому та/або позбавленому протешу середовищі, що містить відповідні добавки. Детерміація і вимірювання протеїнів направленої доставки. Детерміація концентрації людського фактора IX за допомогою ELISA Рівні людського рекомбінантного фактора IX в супернатанті були визначені за допомогою ELISA, використовуючи козлиний протилюдський FIX (GAFIX-AP, Affinit Biologicals) як поглинаюче антитіло, відповідно до стандартної технології. Всі інкубації були здійснені у вологій камері при RT. Були використані обидва стандарти, Octanyne (плазма-похідний FIX, Octapharma) і BeneFIX (рекомбінантний FIX, Genetics Institute). Пошуковим антитілом був пероксидазою конъюгований козлиний протилюдський FIX (GAFIX-APHRP, Affinit Biologicals). ABTS (Cat.No. 1682008, Roche Diagnostics) додавали в кожну лунку як субстрат, колориметрична реакція була знайдена при 405 нм через 15 хвилин. Результати були підраховані методом лінійної регресії стандартної концентрації до стандартної поглинальної здатності. Визначення активності фактора IX системи згортання крові Згущувальна активність людського рекомбінантного фактора IX в супернатанті визначалася за наступною схемою: Згущувальна активність оцінювалася, грунтуючись на дослідженні часу активованого розділеного на частини тромбопластину, використовуючи Dapptin TC (Kaolin/Sulfatid-Phospholipid Cat.No. 3035090, Technoclone GmbH) активацію за допомогою ручного коагулюючого приладу (Amelung KC 4А micro, Amelung GmbH). B процесі досліджень 50 мкл супернатанту з трансфікованих клітин, 50 мкл FIX-дефіцитної плазми (Progen) і 50 мкл Dapptin TC були інкубовані протягом 2 хвилин при 37C. Коагуляцію починали при додаванні 5 10 UA 99700 C2 5 10 15 мкл CaCb (Cat. No. 84687-22F, Instrumentation Laboratory). Час коагуляції зразка порівнювали з обома Octanyne та/або BeneFIX. Визначення BDDrhFVIII за допомогою аналізу COAMATIC:FVIII (Chromogenix): Комерційний хромогенний дослідницький набір COAMATICrFVIII (Chromogenix, cat. No.822585) містить FIX, FX і хромоген, який перетворюється на жовтий розчинний у воді фарбник в результаті розщеплювання FXa. FVIII, що містить зразки, завершує дану систему: FVIII активізує FIX, завдяки утворенню комплексу, даний комплекс активізує FX шляхом протеолітичного розщеплювання, внаслідок чого одержують FXa, який перетворює хромоген на фарбник, що згодом визначається фотометрично при 405 нм. Даний тест призначений для детерміації FVIII з плазми пацієнта. Для забезпечення можливості застосування даного тесту для вимірювання фактора FVIII в розрідженому культурному середовищі була застосована наступна методика. Відповідно до контрольних стандартів, був використаний рекомбінантний людський фактор FVIII системи згортання крові повної довжини (NIBSC, порядковий номер 57814F) і нормальна контрольна плазма (Instrumentation Laboratory Company). Приготування зразка: Зразки розбавляли в буферній речовині, що поставляється з COAMATIC реагентами до очікуваної кінцевої активності FVIII від 2 до 20 mIU/ml і порівнювали з WHO №6 стандартної кривої. Методика: На 96-лунковому ранжирувальному ряді, розміщеному в термоблоці, вимірювалися в трьох прим, як стандарти, так і зразки. Схема роботи (на 1 лунку): 20 Реагент Розбавлені стандарти і зразки Фактор-реагент (37C) S-2765+I-2581 (37C) 30 35 40 45 50 мкл 20% оцтова кислота 25 Об'єм 50 мкл 50 мкл 50 мкл Інкубація (37C) 4 хв. розмістіть в 96-лунковому фотометричному пристрої; інкубуйте протягом 2 хвилин при 37°С в інкубаторі розмістіть в 96-лунковому фотометричному пристрої; інкубуйте протягом 2 хвилин при 37C в інкубаторі розмістіть в 96-лунковому фотометричному пристрої; струсіть протягом 15 секунд в 96лунковому фотометрі негайно визначите абсорбцію при 405 нм Визначення активності A1AT методом тестування активності еластази: Після трансфекції A1AT cDNA, A1AT був експресований і секретований в середовище клітинної культури. Після видалення клітин методом центрифугування (5 хвилин, 1000 об/хв.) активність A1AT була виміряна в супернатанті культури. В даному тесті на активність A1AT-активность була визначена по інгібіторній ефективності еластази. Еластаза відщеплює pNA від субстрата Мсусциніл^АіаР-рКА. Ступінь виділення pNA вимірюється фотометричним шляхом при 405 нм. Активність відповідних зразків визначалася шляхом їх порівняння із стандартними зразками з традиційною встановленою АІАТ-активностью. Відповідно до підтвердження іншими експериментами, тест справедливий для безсироваткового середовища Freestyle. Щоб підтвердити факт відсутності впливу середовища Freestyle на результати тестування, було підготовлено два стандартні графіки: стандартна людська плазма була розбавлена в розчині Т+буферна речовина або в середовищі Freestyle. Розбавлення зразків: Всі зразки тестувалися в не розбавленому стані, розбавленими 1:10 і 1:50 в середовищі Freestyle, після чого було виконано їх порівняння із стандартними розчинами людської плазми. Метод: 50 мкл кожного, стандартного розчину і розчину досліджуваного зразка, відповідно, піпеткою вносилися в лунку 96-лункового мікротитруючого планшета. Після додавання 150 мкл робочого розчину еластази в кожну лунку 96-лунковий планшет струшували протягом 1 хвилини на рідері ELISA (зчитуючому пристрої) і інкубували протягом 30 хвилин при 37 °С. 100 мкл робочого розчину субстрату додавали мікропіпеткою в кожну лунку. Абсорбція при 405 нм була виміряна відразу ж після додавання розчину субстрату і через 7 хвилин після інкубації в темноті при 37 °C. Перше значення представляє собою базисну абсорбцію без еластаза-каталізованої реакції і відрізняється від другого, яке представляє собою абсорбцію еластаза-відщепленого фрагмента pNA із субстрату. Використовуючи результат, отриманий після субстракції, розраховували активність A1АТ-зразків відповідно до стандартної кривої. Визначення активності G-CSF на ELISA 11 UA 99700 C2 5 10 15 20 25 30 35 40 45 50 55 60 Рівні людського рекомбінантного G-CSF в клітинній культурі супернатантів були визначені за допомогою пристрою ELISA, використовуючи мишаче протилюдське антитіло G-CSF(MAB-214, R&D System) як уловлююче антитіла, відповідно до стандартної методики. Всі інкубації були здійснені у вологій камері при кімнатній температурі. Був використаний стандартний G-CSF (рекомбінантний hG-CSF, E.coli, 214-CS-025, R&D Systems). Антитілом виявлення, був біотинілований козлиний протилюдський G-CSF (BAF-214, R&D Systems). Стрептавідін був конъюгований до пероксидази з хріну (Dy998, R&D Systems), приєднаній до антитіла виявлення. Субстрат фторогенної пероксидази QuantaBlue ™ (Fluorogenic Peroxidase Substrate) (15169, Pierce) був доданий в кожну лунку як субстрат, флюорометрична реакція була знайдена при екстинкції 320 нм/Емісії 420нм в межах 60 хвилин. Результати були підраховані методом лінійної регресії стандартної концентрації versus стандартних відносних флюоресцентних одиниць (RFU) Приклад 1: Клонування протеїнів направленої доставки A. Клонування людського фактора IX: З вектора PTG36, відповідно до опису в WOO1/70968, методом подвійного перевара Hind III і Notl був вирізаний фрагмент 1,4 kb, що містить відкриту зчитуючу рамку людського фактора IX системи згортання крові. Даний фрагмент був зшитий (лігований) з фрагментом 5,6 kb, підданим подвійному перевару Hind III і Notl вектора pcDNA3.1Hygro(+)-zz ( похідного від V870-20, Invitrogen), внаслідок чого був отриманий вектор pcDNA3.1-FIX, представлений на фіг. 2. Послідовність DNA, а саме, pcDNA3.1-FIX показана в SEQ ID NO.1. Були знайдені три додаткові нуклеотидні інсерції в каркасі вектора pcDNA3.1Hygro(+)-zz (див. SEQ ID NO:5), порівняно з послідовністю, забезпеченою Інвітрогеном (як показано в SEQ ID NO:4). Вектор pcDNA3.1-FIX містить касетний (кластерний) ге, стійкий до гігроміцину, здатний здійснити селекцію стійко трансфікованого клітинного клона (див. фіг. 2, 3 і 7). Даний вектор забезпечує створення стійко експресуючих клітинних ліній шляхом трансфекції кальційфосфату (або інших речовин) і подальшої селекції для гігроміцин-резістентності. B. Клонування людського фактора VIII: А4380 bp FVIIIcDNA, що містить відкриту зчитуючу рамку В-домен-стертого людського фактора VIII системи згортання крові, був виділений з вектора pTGF8-2hyg-s (SEQ ID NO:7), виробництво якого розкрито в WO01/70968) за допомогою Notl+Xhol і лігуваний (зшитий) з pcDNA3.1Hygro(+)-zz, який було лінеаризовано з XhoI+PspOMI, внаслідок чого був отриманий вектор pcDNA3.1-FVIII, показаний на фіг. 7. C. Клонування людського A1AT: A1AT mRNA був виділений безпосередньо з клітин HepD-2 (DSMZ# ACC 180), використовуючи медичний набір mRNA Miniprep Kit (Sigma, Cat# MRN-10). При здійсненні наступної операції mRNA був культивований на оліго-гранулах (dT). Після цього mRNA транскрибується в дволанцюгову cDNA за допомогою зворотної транскриптази (Avian Myeloblastosis Virus Reverse Transcriptase (AMV RT, Promega, Cat# M5101) з подальшою RTPCR (Reverse Transcriptase-Polymerase Chain Reaction (зворотною «транскриптаза-полімераза» ланцюговою реакцією). A1AT cDNA було підсилено реакцією PCR. Продукт PCR завантажували на агароза гелі. Відповідна смуга DNA була виділена і піддана очищенню з використанням медичного набору (Qiaquik Gel Extraction Kit (Qiagen, Cat# 28704). Після цього фрагмент A1AT був субклонований в комерційний Вектор (TORO® Invitrogen, Cat# K4650-01). Для клонування pCMV-Script: PCR II TOPO-A1AT був гідролізований (переварений) з EcoRI, фрагмент A1AT 1370 bр був лігований з pCMV-Script, лінеаризованим з EcoRI. Для клонування рСІ-пео-АІАТ: PCR II TOPO-A1AT був гідролізований (переварений) з EcoRI, фрагмент A1AT 1370 bр був лігований з рСІ-neo, лінеаризованим з EcoRI. Для клонування pcDNA3.1-FVIII: 1370 bp A1AT був виділений з PCR II TOPO-A1AT, переварений з Xhol+Hindlll і лігований з pcDNA3.1, лінеаризованим за допомогою XhoI+HindlH. Отриманий вектор представлений на фіг.3. Для клонування pTGl-ΑΙΑΤ: PCR II TOPO-A1AT був переварений з HindIII і Notl. Фрагмент A1AT 1370 bр був лігований з pTGl (HePRE), лінеаризований з HindIII і Notl. Отриманий вектор показаний на фіг. 9. D Клонування людської G-CSF cDNA: Загальна RNA була виділена безпосередньо з натуральних 5637 людських уринальних клітин карциноми сечового міхура за допомогою міні-медичного комплекту (RNeasy mini kit (QIAGEN, cat. No.74104). Виділена загальна RNA була інкубована з DNase I до отримання перевару, можливо, перемішаної геномної DNA 5637 клітин. Для отримання загальної RNA, вільної від DNase, реакційна суміш була оброблена чистячим медичним набором (RNeasy kit (QIAGEN, cat. No.74204). RT-PCR із загальною RNA, як матрицею, здійснювали праймером 12 UA 99700 C2 5 10 15 20 25 30 35 40 45 50 55 60 оліго(dТ)12-18 (Invitrogen, Cat. No. 18418-012) і Superscript™ II RNase Η-Reverse Transcriptase (Invitrogen, Cat. No. 18064-022) у присутності інгібітора RNase (Roche, Cat. No. 799-017), з метою синтезу ds cDNA-пулу з 5637 клітин. G-CSF cDNA посилена реакцією PCR. G-CSF cDNA виділена з агароза гелю за допомогою швидкодійного гель-екстракційного медичного набору (QIA quick Gel Extruction kit (QIAGEN, cat. No.28704) і секвенували двома наступними G-CSF PCR-праймерами: -G-CSF Forward (прямий): 5'-ATG GCT GGA CCT GCC ACC CAG AGC-3'(SEQ ID NO: 19) -G-CSF Reverse (зворотний): 5'-TCA GGG CTG GGC AAG GTG GCG TAG-3'(SEQ ID NO:20) Послідовність DNA, синтезована з 5637 клітин, була підтверджена аналізом послідовності у формі GCSF-b (маючи послідовність, показану в SEQ ID NO:26). CDNA у формі GCSF-b виділено відповідно до процедури, описаної вище, потім безпосередньо ліговано в комерційний вектор pCR2,1 (Інвітроген). Отриманий плазмід був позначений як pCR2,1d2-GCSFb і представлений на фіг. 10. PCR2,1d2-GCSF-b був підданий перевару (гідролізу) з використанням HindIII і Notl, фрагмент 705bp GCSFb cDNA був виділений і лігований у вектор pcDNA3.1Hygro(+)-zz, який був лінеаризований з HindIII і Notl. Отриманий вектор pcDNA3.1-GCSFb показаний на фіг. 11. PCR2,1d2-GCSF-b був підданий перевару (гідролізу) з використанням EcoRI, фрагмент 629 bр GCSFb cDNA був виділений і лігуваний у вектор pCINeo, який був лінеаризований з EcoRI. Отриманий вектор pCINeo-GCSFb показаний на фіг. 12. PCR2,1d2-GCSF-b був підданий (гідролізу) з використанням ВаmНІ і Xhol, фрагмент 693 bр GCSFb cDNA був виділений і лігуваний у вектор pCMVSript, який був лінеаризований з ВаmНІ і Xhol. Отриманий вектор pCMVSript-GCSFb показаний на фіг. 13. PCR2,1d2-GCSF-b був підданий перевару (гідролізу) з використанням HindIII і Notl, фрагмент 705 bp GCSFb cDNA був виділений і лігуваний у вектор pTG2-hyg-as, який був лінеаризований з HindIII і Notl. Отриманий вектор pTG2-GCSFb-hyg-as показаний на фіг. 14. Приклад 2: Експресія протеїнів направленої доставки в різних клітинних лініях і різних векторах: При оптимізації даного способу отримання рекомбінантного протеїну була досліджена здатність до забезпечення високих рівнів експресії різних клітинних ліній, причому всі вони несуть вектор, що включає рекомбінантний ген для Альфа-1-антитрипсину (A1AT). В дослідженнях процесу проміжної трансфекції було знайдене, що CHO, BHK і інші клітинні лінії виробляють менше рекомбінантного протеїну порівняно з 293Т - клітинною лінією. Тому були досліджені інші похідні клітинних ліній нирки ембріона людини. Результати представлені на фіг. 4-6. Приклад 3: Проміжна трансфекція клітин 293Т і 293 в середовищі, що містить сироватку, порівняно з клітинами 293F, які були трансфіковані і вирощені в безсироваткових умовах: 6 0,1 - 0,2x10 життєздатних клітин 293Т або 293 були розміщені в 6-лунковій чашці. Наступного дня клітини були трансфіковані, використовуючи метод фосфату кальцію (Biotechniques 6:7 632-638 (1988)): 4мкг плазміду DNA були розчинені в 0,1 χ ТЕ-буфферному розчині (ad 200 мкл суміші трансфекції), обережно перемішані, до зразка трансфекції було додано 20мкл 2,5 M СаСl2 і 100мкл 2х HBS. Зразок трансфекції був інкубований протягом 20 хвилин при кімнатній температурі. Після закінчення 6 годин інкубаційне середовище замінювали, після чого клітини були інкубовані протягом 48 годин. Приклад 4: Безсивороткова трансфекція і експресія протеїнів направленої доставки в клітинах 293F в безсироватковому середовищі: 6 28 мл суспензії було приготовано при клітинній густині 10 життєздатних клітин 293F (в день проведення експерименту трансфекції). Ліпідний Dna-комплекс був приготований шляхом розчинення 30 мкг плазміду DNA в Opti-MEM® I (Invitrogen) до повного об'єму 1 мл, і 40 мкл 293fectin® були розчинені в Opti-MEM® I до повного об'єму 1мл. Після 5 хвилин інкубації при кімнатній температурі розчинена DNA була додана до 293fectin® для отримання загального об'єму 2 мл. Трансфіковані зразки були інкубовані в темноті протягом 20 хвилин при кімнатній температурі. 20 мл суміші трансфекції додавалися до 28 мл культурної суспензії (фінальна 6 клітинна густина складає 1x10 клітин/мл). Трансфіковані клітини 293F були інкубовані протягом 72 годин при 37C у вологій атмосфері з 8% вмістом СО2 в повітрі на орбітальному вібраторі, що обертається із швидкістю 125 об/хв. А: Трансфекція і експресія A1AT Результати експериментів, що порівнюють клітини 293F з клітинами 293 і 293Т, 6 представлені на фіг. 4. У всіх експериментах певна кількість клітин (10 кліток) були трансфіковані за допомогою pcDNA3.1-A1AT. Порівнювалася кількість A1AT, експресованого в названих різних клітинних лініях. Експресована кількість A1AT в клітинах 293F була 13 UA 99700 C2 5 10 15 20 25 30 35 40 45 встановлена як 100%. Як видно з малюнка на фіг. 4, клітини 293 і 293Т, продукували тільки 1213% тієї кількості A1AT, яку продукували клітини 293F. Крім того, було досліджено питання про те, чи впливають відмінності у векторній несучій конструкції на кількість рекомбінантного протеїну, продукованого в клітинах 293F. Кодуюча послідовність для Альфа-1-антитрипсину (A1AT) була вбудована в pTG (внутрішні вектори), pCMV Scropt ® (Stratagene), рсі пео (Promega), а також у вектор pcDNA3,1TM. Рівень експресії A1AT з pcDNA3,1-A1AT був встановлений дорівнюючим 100%. Жоден з інших векторів не наближався до високого рівня експресії, яку проявляв pcDNATM3,1-A1AT. Було знайдено, що pcDNA3,1-A1AT продукує щонайбільшу кількість A1AT, згідно результатам, показаним ELISA (див. фіг.5). Внутрішній вектор експресував тільки 20% кількість A1AT, а інші комерційні вектори проявляли діапазон експресії від 15% до 30%, порівняно з кількістю A1AT, експресованою з pcDNA3,1. Тому pcDNA3,1 був вибраний для всіх подальших експериментів. M У результаті, різні клітинні лінії були проміжно трансфіковані pcDNA3,1T , що несе ген A1AT. 6 Було показано, що безсироваткова клітинна лінія 293F експресує в 7 разів більше A1AT на 10 кліток, ніж клітини 293Т і 293. Тому freestyle клітинна лінія 293F була вибрана для проведення досліджень процесу стійкої трансфекції. Результати досліджень проміжної трансфекції показані на фіг. 6. Верхня панель (А) демонструє дослідження SDS-PAGE супернатанту 6 різних випробувальних ліній трансфекції, що використовують різні вектори трансфекції. Виходячи з фігур, що демонструють результати досліджень, можна зробити висновок про те, що альфа-1-антитрипсин, присутній в супернатантах досліджуваних клітинних культур, є якісним матеріалом, оскільки може бути виведений показник із ступеня активності відносно антигена, дорівнюючийий 1 (дані не приведені). Достовірність результатів тестування може бути доведена тим фактом, що негативний контроль не знайшов ні альфа-1-антитрипсин-активности, ні антигена. Розподіл молекулярної ваги, досліджуваний SDS-PAGE, демонструє наочні відмінності між трьома зразками, що містять альфа-1-антитрипсин. При контролі по негативних показниках, за відсутності смуги, що представляє альфа-1-антитрипсин, як і очікувалося, видно додаткову смугу з молекулярною вагою 27 kd. За наслідками досліджень, що використовують «вестерн-блотінг», (використовуючих основне протилюдське альфа-1-антитрипсин-антитело), протеїн може бути ідентифікований в очікуваній зоні молекулярної ваги в режимах відновлення. Продуктів руйнування не знайдено. Чорна стрілка указує на виступаючу смугу, яка відповідає 52 kDa рекомбінантного протеїну альфа-1-антитрипсину. Видимою є також смуга, відповідна 27 kDa GFP протешу в лініях 4 і 8, які були проміжно експресовані, з метою контролю у freestyle клітинах 293F клітинних ліній. Додатковими смугами в лінії 1, 2, 3 і 5, 6 і 7 є протеїни клітини - господаря (із freestyle клітин 293 F). Нижня панель (В) демонструє результати досліджень вестерн-блотінга. Результати ідентичні, за винятком тих, які залежать від більш високої жорсткості випробувань, за результатами, видимою є тільки смуга, відповідна A1AT. В: Трансфекція і експресія FVIII: На фіг.8 показано середню кількість фактора VIII трьох кращих стійко трансфікованих клонів. Середня кількість фактора VIII трьох кращих клонів, експресованих вектором pcDNA-FVIII, встановлено рівним 100% продуктивності. Порівняння з внутрішнім (in-house) pTGF8-2hyg-s вектором знаходить майже потрійне підвищення продуктивності фактора VIII з pcDNA3,1-FVIII в клітинах 293F. 3: Трансфекция і експресія FIX: В стійко трансфікованих клітинах 293F, використовуючих pcDNA3,1-FIX і pUC 19/Хбазований вектор pTGF36 (див. WO 01/70968), експресуючий фактор IX, майже потрійне збільшення продуктивності може бути досягнуте при використовуванні вектора pcDNA3,1 в клітках 293F, що наочно продемонстровано в таблиці 1. 50 Таблиця 1 Клітинна лінія субстрата/вектор 293 (+сыроватка) 293F (-сироватка) FIX - продуктивність в % [mIU/106 клітин, доба] pcDNA3,1-FIX IPTG2-FIX 100% 100% 60% Приклад 5: Виробництво G-CSFb Трансфекція клітин 293F в безсироватковому середовищі, проміжна трансфекція: 14 UA 99700 C2 5 10 15 20 25 30 35 40 45 50 55 60 В день проведення експерименту трансфекції 28 мл суспензії культури клітин 293F було 6 приготовано при клітинній густині 1,1х10 життєздатних клітин 293F на 1 мл. Ліпідний DNAкомплекс був приготований шляхом розчинення 30 мкг плазміду DNA (pcDNA3,1 -G-CSFb) в Opti-MEM® I (Invitrogen) до повного об'єму 1 мл, і 30 мкл Lipofectamine 2000 CD були розчинені в Opti-MEM® I до повного об'єму 1мл. Після 5 хвилин інкубації при кімнатній температурі розчинена DNA була додана до Lipofectamine 2000 CD для отримання загального об'єму 2 мл. Зразки трансфекції були інкубовані в темноті протягом 20 хвилин при кімнатній температурі. 20 мл суміші трансфекції додавалися до 28 мл культурної суспензії 293F (фінальна клітинна густина складає 1х106 клітин/мл). Трансфіковані клітини 293F були інкубовані протягом 72 годин при 37C у вологій атмосфері з 8% вмістом СО2 в повітрі на орбітальному вібраторі, що обертається із швидкістю 125 об/хв. B. Стійка трансфекція Через 72 години після проміжної трансфекції, як було описано в розділі А, відповідна 5 6 кількість клітин (10 і 10 кліток) переносилася на плоску чашку для осадження, з метою забезпечення умов росту в склеєному стані. Селективний тиск прикладали через проміжок часу від 2 до 50 годин, переважно, через 48 годин після перенесення на чашку. Переважним селективным агентом є гігроміцин з концентрацією 75 мкг/мл. Тиск підтримувався, принаймні, в перебіг від 10 до 20 днів, переважно, протягом 14 днів, при цьому, середовище з додаванням гігроміцину повністю замінювалося за період від 2 до 3 днів. C. Відбір кращих клонів G-CSF-продуцента, використовуючи аналізуючий і відбираючий робот ClonePixFL (Genetix): FreeStyle 293F клітини, стійко трансфіковані відповідно до розділу В, представленому вище, були висіяні в напівтверде середовище на основі метилцелюлози, що містить відповідний антибіотик для відбору клонів, приблизно, після двох днів, і мічене антитіло для виявлення клонів найефективнішого продуцента за допомогою флюоресценції. Велика кількість (тисячі) клонів були проаналізовані, використовуючи ClonePixFL (Genetix), щодо кількості клітин і секреції G-CSF, щоб згодом вибрати тільки декілька сотень клонів-найкращих продуцентів GCSF. На відміну від інших відомих способів, в яких випадково відбираються не продукуючі клони і змішані клони, використовування G-CSF дозволяє відбирати клони, що швидко ростуть, які є високопродукуючими і походять від одиночних клітин. Відібрані клітини набухають в мікротитрувальних чашках, а далі потрапляють в трубки, що обертаються, типу центрифуги, колби для клітинної культури і ферментатори, що функціонують в безсироватковому режимі, для завершення процесу. Весь процес стійкої трансфекції генерується в безсироваткових умовах. Крім того, весь процес подальшого набухання і вирощування клітин відбувається з дотриманням строгого правила недопущення контакту клітин з сироваткою або протеїнами тваринного походження. Під час набухання кращі клони відбираються з урахуванням міцності, високої інтенсивності зростання, життєздатності і продукування активних G-CSF, виміряних в ELISA форматі. Після фази селекції відібрані клони вирощуються в безсироваткових умовах і без добавки антибіотиків. Клітини 293 F були повністю вирощені без наявності сироватки на всіх етапах технології. Середовище мінялося через день. Набухання клітин здійснювалося в безсироваткових умовах, починаючи від колб Ерленмейера, у вібраторах Кюхнера до великих об'ємів в реакторах (Wave Biotech Europe). Під час такого відбору кількість знову-таки знижується тільки до декількох продукуючих клонів. Коректна послідовність cDNA, вміст mRNA і стан після ферментації є критеріями ідентифікації кращого клона (клонів) для субклонування. Для цього клітини відібраних клонів розташовуються на планшеті, аналізуються і відбираються за допомогою ClonePixFL, потім розширяються і відбираються відповідно до попереднього опису. Субклонування є важливим етапом, на якому знову відбираються клони кращих продуцентів, з метою виключення можливості появи генетичних варіацій в субпопуляції клона на чашці. Після субклонування відібрані клони (клон) поміщаються в банк клонів знову за безсироваткових умов. Експресований рекомбінантний людський протеїн G-CSF біохімічно характеризується більш детально. D. Детерміація концентрації людського G-CSF з використанням ELISA Кількість rhG-CSF, експресованих за допомогою клітинних ліній FreeStyle 293F, отриманих таким чином, визначалася за допомогою ELISA, при цьому порівнювався вихід протеїну, отриманого з клітками, трансфікованими різними векторами (див.Фіг. 15). Як і очікувалося, на підставі результатів експериментів експресування FIX і A1AT, описаних в прикладах здійснення 2 і 3, в даному випадку також можна зробити висновок, що комбінація вектора pcDNA3,1-GCSFb з клітиною 293F знайшла найвищу продуктивність і тому була використана для отримання рекомбінантного людського 293F. 15 UA 99700 C2 5 E. Вестерн-блотінг rhG-CSF у відновленні SDS PAGE: 10 мкл G-CSF, продукованих в супернатанті з клітин НЕК293 і НЕК293F, піддавали аналізу на 15% SDS PAGE і вестерн-блотінгу. Визначення G-CSF здійснювали через BAF214-bio/SAHRP/DAB (див.фіг. 16). Стрілка указує на монометричну смугу rhG-CSF коректної молекулярної маси. До опису додається вільний текст з переліком послідовностей на 3 сторінках. Перелік послідовностей 10 16 UA 99700 C2 17 UA 99700 C2 18 UA 99700 C2 19 UA 99700 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 40 1. Спосіб приготування імморталізованої людської клітинної лінії, стійко трансфікованої послідовністю нуклеїнової кислоти, що включає ген, який кодує людський протеїн направленої доставки, або його похідне, або його мутант, промотор, а також сигнал поліаденіляції (роlуА) бичачого гормону росту, причому даний промотор і роlуА-сигнал зв'язуються з 5' і 3' кінцем гена, відповідно, кодуючого згаданий людський протеїн направленої доставки, при цьому даний спосіб включає операцію трансфікування імморталізованої людської клітинної лінії-хазяїна в безсироваткових умовах шляхом використовування вектора трансфекції, що містить згадану послідовність нуклеїнової кислоти і оріджин реплікації. 2. Спосіб за п. 1, який відрізняється тим, що людським протеїном направленої доставки є людський протеїн плазми, вибраний з факторів системи згортання крові: фактор IX, фактор VIII ("дикого типу" і В-домен-делетований), фактор VII/VIIa і фактор фон Віллебранда (vWF); факторів росту: еритропоетин, колонієстимулюючі фактори (CSFs): гранулоцит-стимулюючий фактор (G-СSF), макрофаг CSF (М-CSF) і гранулоцит-макрофаг CSF (GM-CSF); цитокінів: інтерлейкіни; інгібіторів протеази: альфа-1-антитрипсин (А1AT) і хімотрипсин; транспортуючих протеїнів: гормони; інгібіторно або регуляторно діючих протеїнів і їх похідних і мутантів; переважно людський протеїн вибирають з групи, що містить фактор IX, фактор VIII, що включає фактор VIII "дикого типу" і фактор VIII з делетованим В-доменом, фактор VII/VIIa, G-CSF, vWF і А1AT, найбільш переважним людським протеїном є фактор IX системи згортання крові, кодований парами основ від 939 до 2324 SEQ ID NО: 1, людський А1АТ, кодований парами основ від 973 до 2259 SEQ ID NО: 2, wt фактор VIII, що відповідає SEQ ID NО: 9, людський фактор VIII з делетованим В-доменом, кодований парами основ від 783 до 5162 SEQ ID NО: 3, фактор VII/VIIa, кодований SEQ ID NОs: 13 і 14, G-CSF, кодований SEQ ID NОs: 15, 16 і 17, або vWF, кодований SEQ ID NО: 18. 3. Спосіб за п. 1 або 2, який відрізняється тим, що для вектора трансфекції: (і) промотор вибирають з вірусних промоторів, промоторів гена "домашнього господарства", тканиноспецифічних промоторів, переважно як промотор використовують промотор SV40, промотор CMV з або без інтрону, промотор EF-1альфа, промотор HSV ТK і інші, найбільш переважним промотором є промотор CMV; та/або (іі) використовують оріджин реплікації, що забезпечує реплікацію і ампліфікацію плазміди в бактерії; (ііі) вектор додатково несе принаймні один ген для селективного маркера, який, переважно, вибирають з групи, що включає резистентність гігроміцину, резистентність неоміцину, резистентність аміноглікозидфосфотрансферази (neo, G418, АРН), резистентність блеоміцину (флео, блео, зеоцин) і резистентність ксантин-гуанін-фосфорибозилтрансферази (XGPRT, gpt), та/або знаходиться під контролем промотора, як було вказано вище (і); 20 UA 99700 C2 5 10 15 20 25 30 35 40 45 (iv) вектор додатково несе один або декілька додаткових регуляторних елементів, причому дані регуляторні елементи переважно вибирають із сплайс-сайтів, сайтів рекомбінації, роlуА-сайтів, підсилювачів, мультиклонуючих сайтів і прокаріотичних послідовностей плазміди. 4. Спосіб за п. 3, який відрізняється тим, що вектор трансфекції несе промотор CMV, ген гігроміцину, роlуА-послідовність і заданий ген і, переважно, є похідним вектора pcDNA3.1, що має послідовність SEQ ID NО: 4 або 5. 5. Спосіб за пп. 1-4, який відрізняється тим, що імморталізована людська клітинна лінія: (і) здатна до трансфекції і вирощування в безсироваткових умовах, та/або (іі) має інтегровані аденовірусні послідовності в своєму геномі, та/або (ііі) її вибирають з переліку клітин, що включає клітини нирки, сечового міхура, печінки, легенів, серцевого м'яза, гладкої мускулатури, яєчника, клітини шлунково-кишкового тракту, переважною є клітинною лінією людської нирки, та/або (iv) не здатна експресувати людський протеїн. 6. Спосіб за п. 5, який відрізняється тим, що клітинами нирки є клітини нирки ембріона людини, переважно клітини нирки ембріона людини, вибрані з клітин 293 (АТСС CRL-1573; DSM АСС 305), клітин 293Т (DSM АСС 2494), клітин FreeStyle 293 (клітин 293F; Invitrogen R79007), переважно клітинами є клітини 293F (Invitrogen R79007). 7. Спосіб за п. 6, який відрізняється тим, що клітинною лінією є 293F, а вектором трансфекції є похідне pcDNA3.1, причому вектор переважно кодує людський фактор IX системи згортання крові, як показано парами основ від 939 до 2324 SEQ ID NО: 1, людський А1АТ, кодований парами основ від 973 до 2259 SEQ ID NО: 2, людський wt фактор VIII, як показано в SEQ ID NО: 9, або людський фактор VIII з делетованим В-доменом, як показано в SEQ ID NО: 3, FVII/VIIa, GCSF, включаючи G-CSFb, показаний в SEQ ID NО: 27, або фактор фон Віллебранда. 8. Спосіб за пп. 1-7, який відрізняється тим, що безсироваткову трансфекцію здійснюють в культуральній суспензії без сироватки з катіонним агентом трансфекції або фосфатом кальцію, переважно реагентом ліпофектаміном 2000 CD (Invitrogen). 9. Спосіб за пп. 1-8, який відрізняється тим, що він додатково включає відбір стійко трансфікованих клітин, переважно за критеріями продуктивності, активності і товарної якості виробленого рекомбінантного протеїну. 10. Стійко трансфікована імморталізована людська клітинна лінія, отримана з використанням способу за пп. 1-9. 11. Клітинна лінія за п. 10, отримана з використанням способу за пп. 4-9, яка відрізняється тим, що клітинною лінією переважно є 293F, а вектором трансфекції є похідне pcDNA3.1. 12. Спосіб рекомбінантного продукування людського протеїну направленої доставки або його похідного, або мутанта, який відрізняється тим, що він включає вирощування імморталізованої людської клітинної лінії за п. 10 або 11. 13. Спосіб за п. 12, який відрізняється тим, що людським протеїном направленої доставки є людський фактор IX системи згортання крові, як показано парами основ від 939 до 2324 SEQ ID NО: 1, людський А1АТ, кодований парами основ від 973 до 2259 SEQ ID NО: 2, людський wt фактор VIII, як показано в SEQ ID NО: 9, або людський фактор VIII з делетованим В-доменом, як показано в SEQ ID NО: 3, FVII/VIIa, G-CSF, включаючи G-CSFb, показаний в SEQ ID NО: 27, або фактор фон Віллебранда. 14. Спосіб за п. 12 або 13, який відрізняється тим, що додатково включає операції, при яких концентрують рекомбінантний людський протеїн з культурального бульйону та/або очищають протеїн, та/або видаляють пріон. 15. Спосіб за пп. 12-14, який відрізняється тим, що продукування людського протеїну здійснюють в безсироваткових умовах. 21 UA 99700 C2 22 UA 99700 C2 23 UA 99700 C2 24 UA 99700 C2 25 UA 99700 C2 26 UA 99700 C2 27 UA 99700 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for the serum-free production of an immortalized human cell line
Автори англійськоюSchroder, Carola, WEGMANN CATHLEEN, DING HAIYAN
Назва патенту російськоюСпособ приготовления иммортализированной человеческой клеточной линии
Автори російськоюШрьодер Карола, Вегманн Кэтлин, Динг Хайан
МПК / Мітки
МПК: C12P 21/02, C12N 15/67, C12N 15/79, C12N 5/07
Мітки: людської, клітинної, лінії, імморталізованої, спосіб, приготування
Код посилання
<a href="https://ua.patents.su/37-99700-sposib-prigotuvannya-immortalizovano-lyudsko-klitinno-lini.html" target="_blank" rel="follow" title="База патентів України">Спосіб приготування імморталізованої людської клітинної лінії</a>
Попередній патент: Похідні індолкарбоксаміду та фармацевтична композиція, що їх містить
Наступний патент: Людське моноклональне антитіло, яке специфічно зв’язується з лігандом-1 запрограмованої загибелі клітин (pd-l1)
Випадковий патент: Вібраційний грохот