Стабільні інсектицидні композиції на основі сульфоксиміну
Формула / Реферат
1. Композиція, яка містить:
сполуку, що має наступну формулу (І):
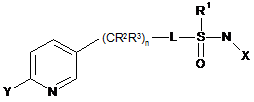 , (І)
, (І)
де
X являє собою NO2, CN або COOR4;
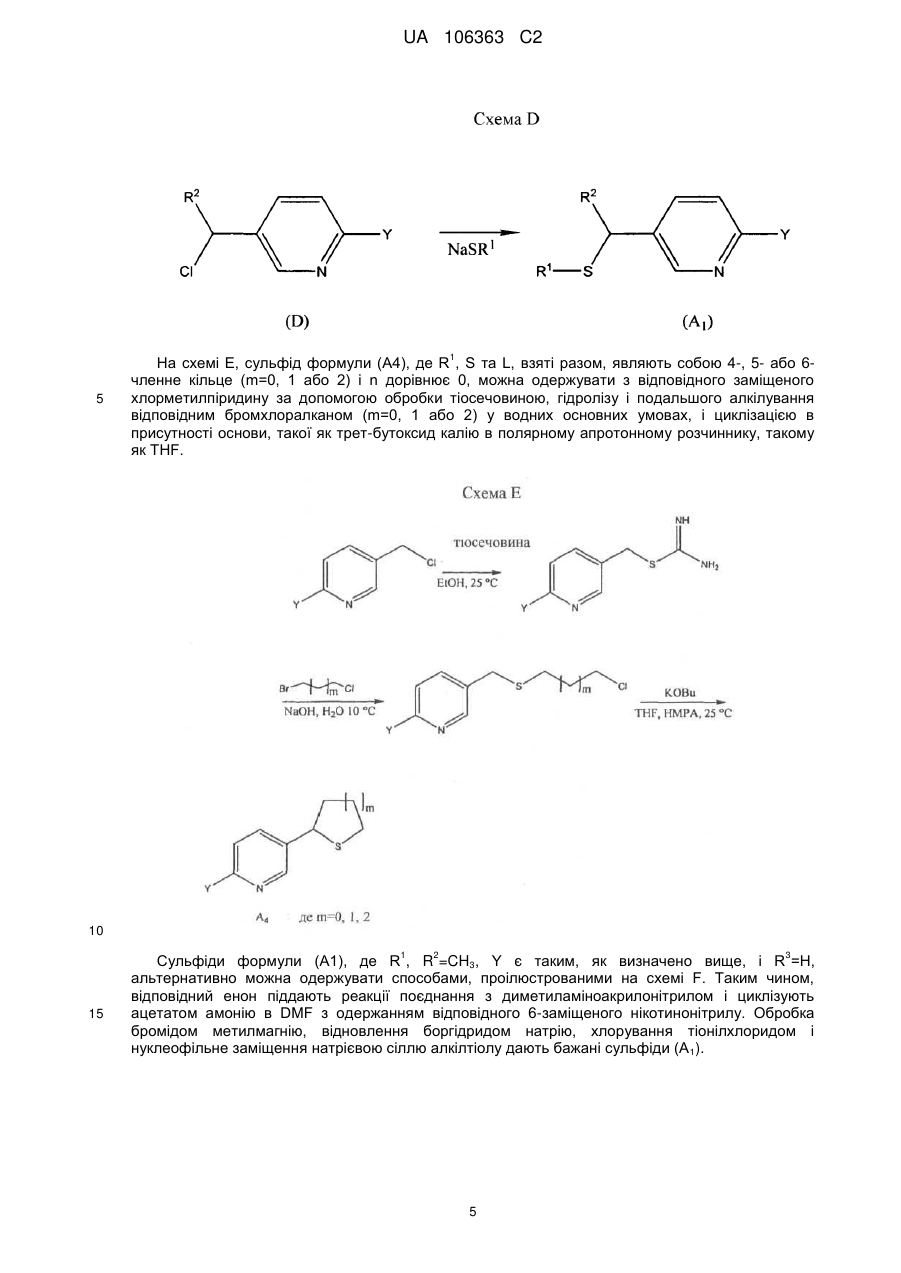
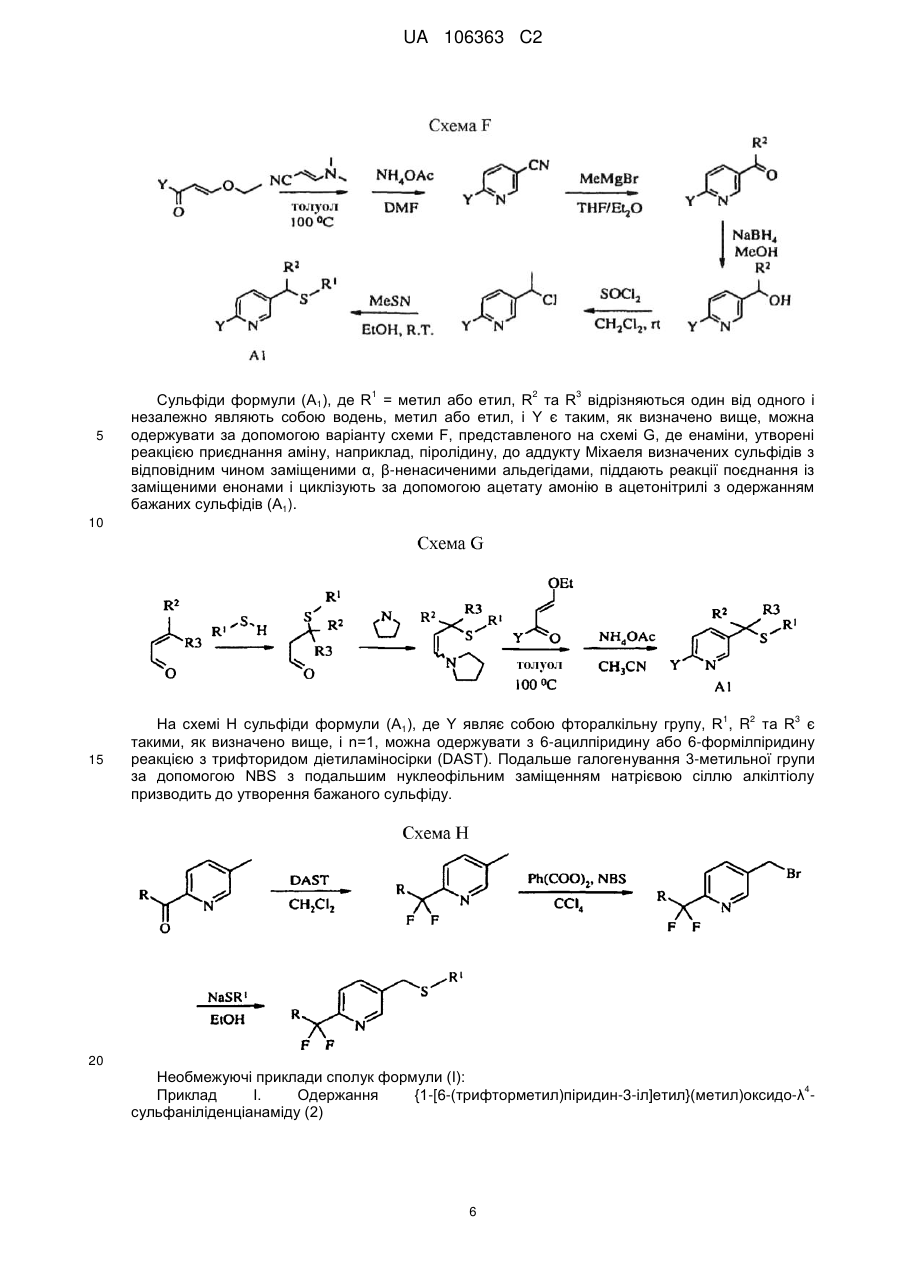
L являє собою одинарний зв'язок або R1, S та L, взяті разом, являють собою 4-, 5- або 6-членне кільце;
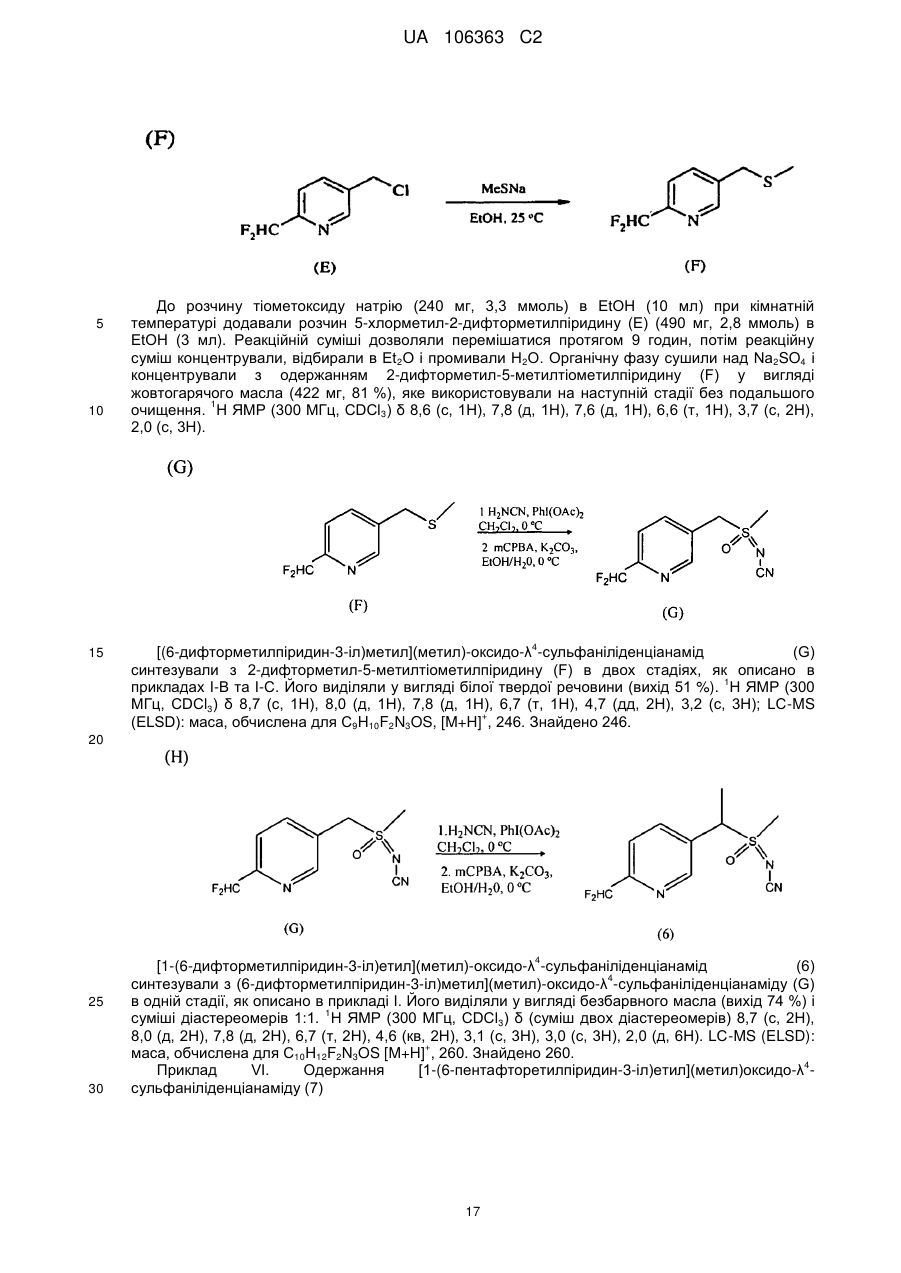
R1 являє собою (С1-С4)алкіл;
R2 являє собою метил, етил, фтор, хлор або бром, і R3 являє собою водень;
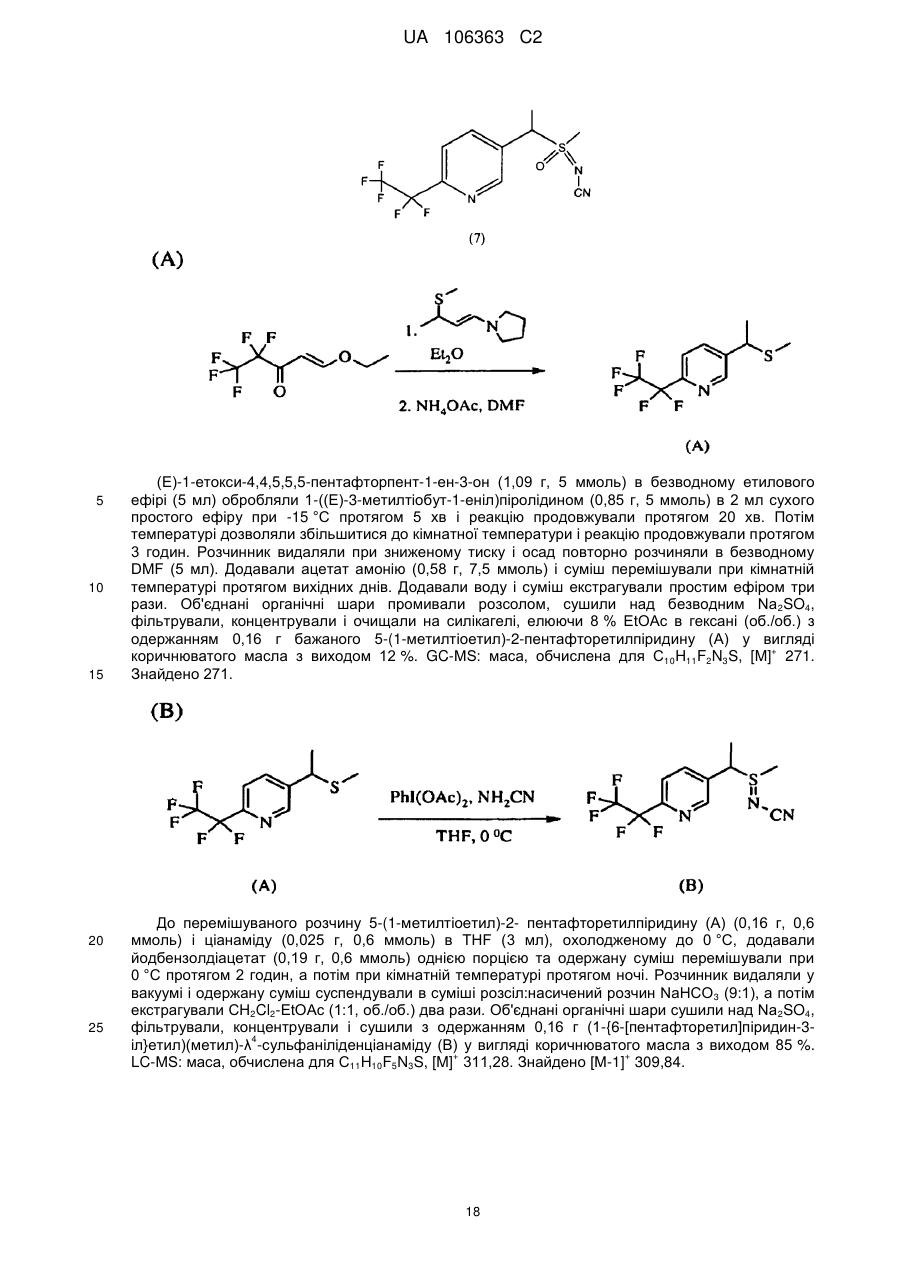
n дорівнює 1, коли L являє собою одинарний зв'язок, або дорівнює 0, коли R1, S та L, взяті разом, являють собою 4-, 5- або 6-членне кільце;
Y являє собою (С1-С4)галогеналкіл, F, Сl, Вr або І; і
R4 являє собою (С1-С3)алкіл;
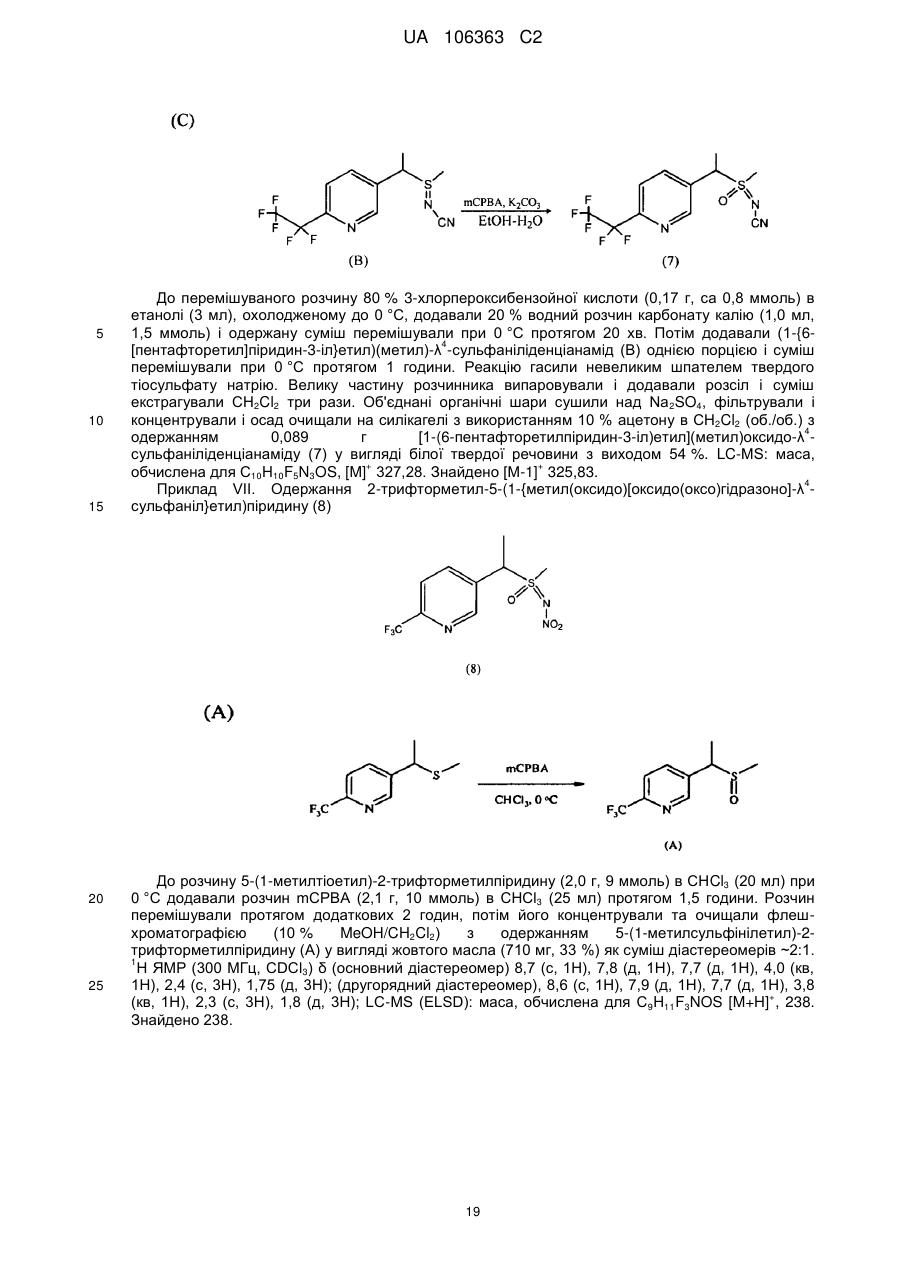
органічну кислоту або її сіль, де органічна кислота вибрана з групи, яка складається з лимонної, фталевої, яблучної, винної, малеїнової, малонової, молочної і бурштинової кислот.
2. Композиція за п. 1, де L являє собою одинарний зв'язок і сполука включає наступну структуру:
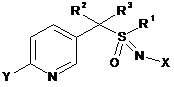 ,
,
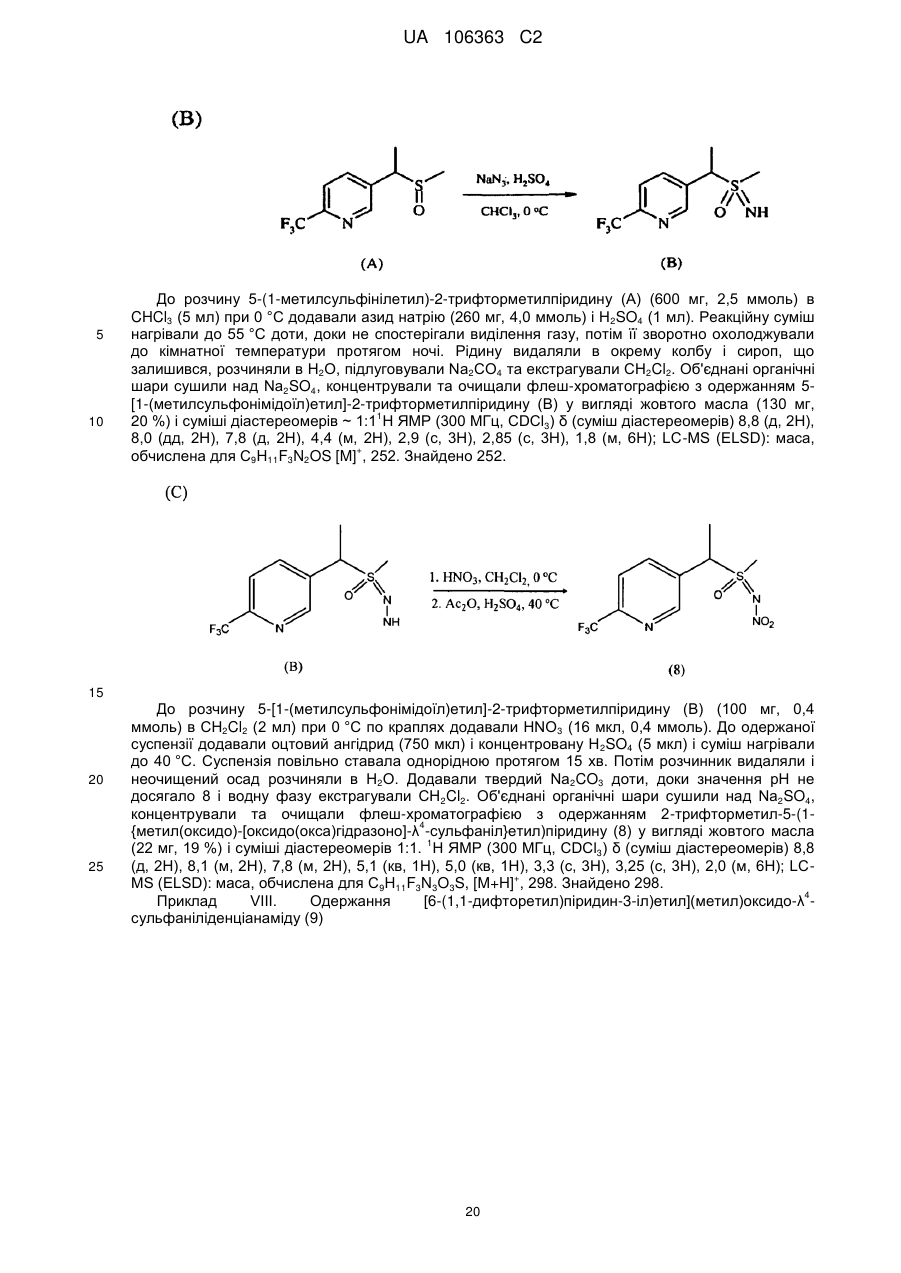
де
X являє собою NO2, CN або COOR4;
R1 являє собою (С1-С4)алкіл;
R2 являє собою метил, етил, фтор, хлор або бром, і R3 являє собою водень;
Y являє собою (С1-С4)галогеналкіл, F, Сl, Вr або І; і
R4 являє собою (С1-С3)алкіл.
3. Композиція за п. 1, де R1, S та L, взяті разом, утворюють 5-членне кільце, і n дорівнює 0, і сполука включає наступну структуру:
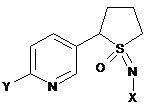 ,
,
де
X являє собою NO2, CN або COOR4;
Y являє собою (С1-С4)галогеналкіл, F, Сl, Вr або І; і
R4 являє собою (С1-С3)алкіл.
4. Композиція за будь-яким з пп. 1-3, де X являє собою NO2 або CN.
5. Композиція за будь-яким з пп. 1-3, де Y являє собою -CF3.
6. Композиція за будь-яким з пп. 1-3, де R2 являє собою метил або етил.
7. Композиція за будь-яким з пп. 1-3, яка додатково містить фітологічно прийнятний носій.
8. Композиція, яка містить: сполуку, що має наступну структуру:
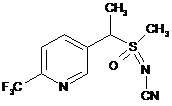 ,
,
і органічну кислоту або її сіль, де органічна кислота вибрана з групи, яка складається з лимонної, фталевої, яблучної, винної, малеїнової, малонової, молочної і бурштинової кислот.
9. Композиція за п. 8, де вказана органічна кислота являє собою лимонну кислоту.
10. Композиція за п. 8, яка додатково містить щонайменше одну речовину, вибрану зі спінетораму, спіносаду і піретроїдного інсектициду.
11. Композиція за п. 8, де співвідношення, по масі, між сполукою та органічною кислотою або її сіллю становить від приблизно 240:1 до приблизно 48:1.
12. Спосіб боротьби з комахами, який включає застосування в зоні, де є бажаною боротьба, інактивуючої комах кількості композиції за будь-яким з п. 1-11.
Текст
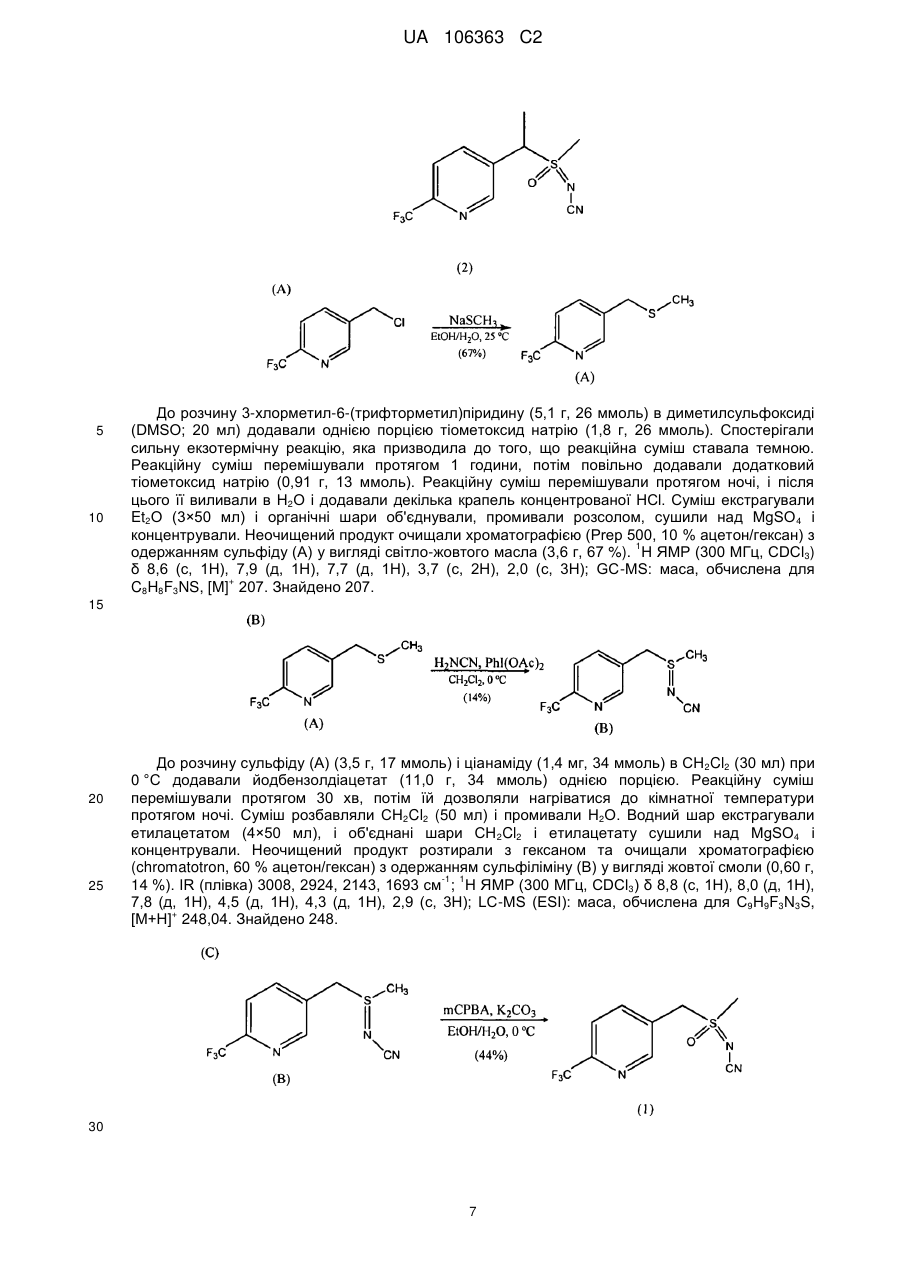
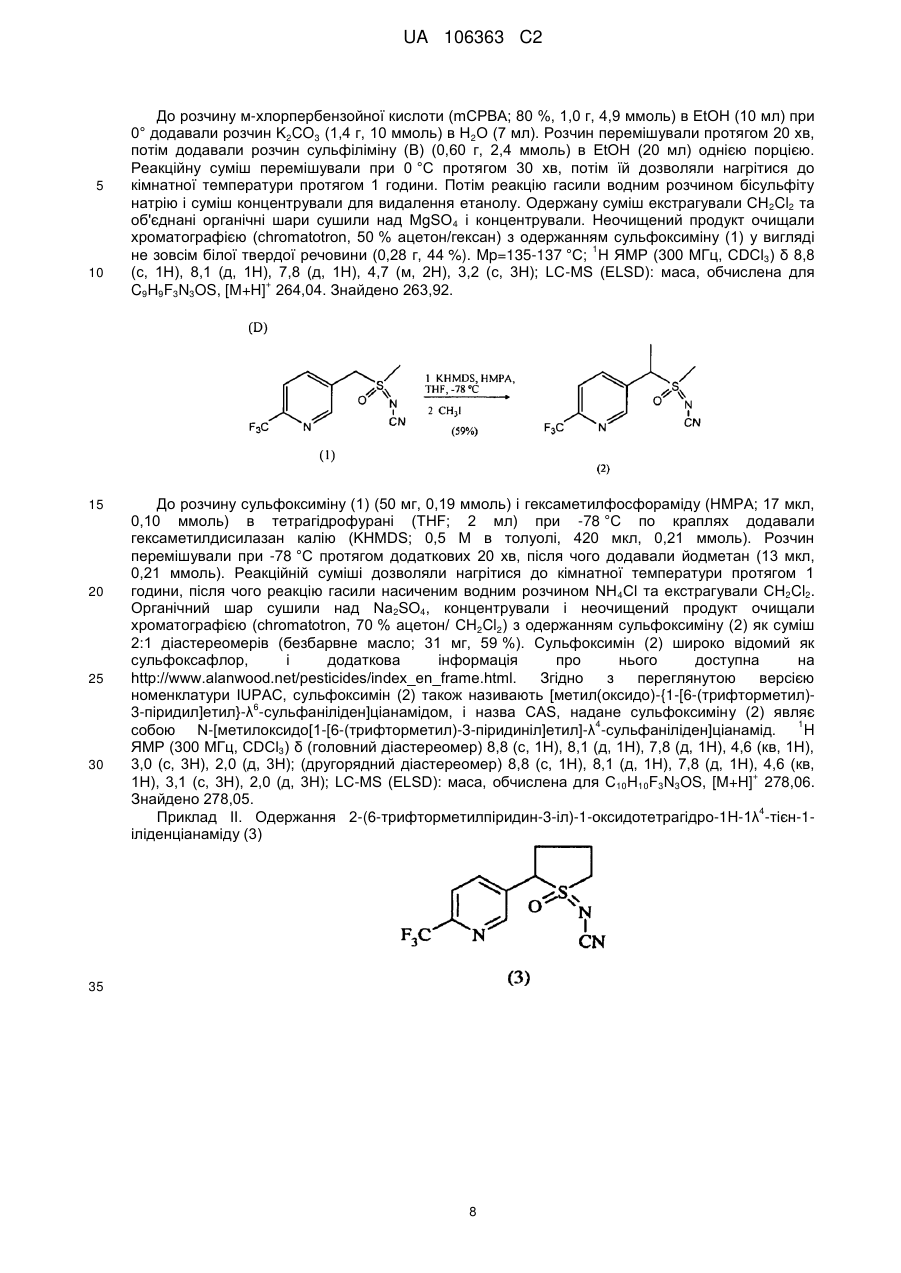
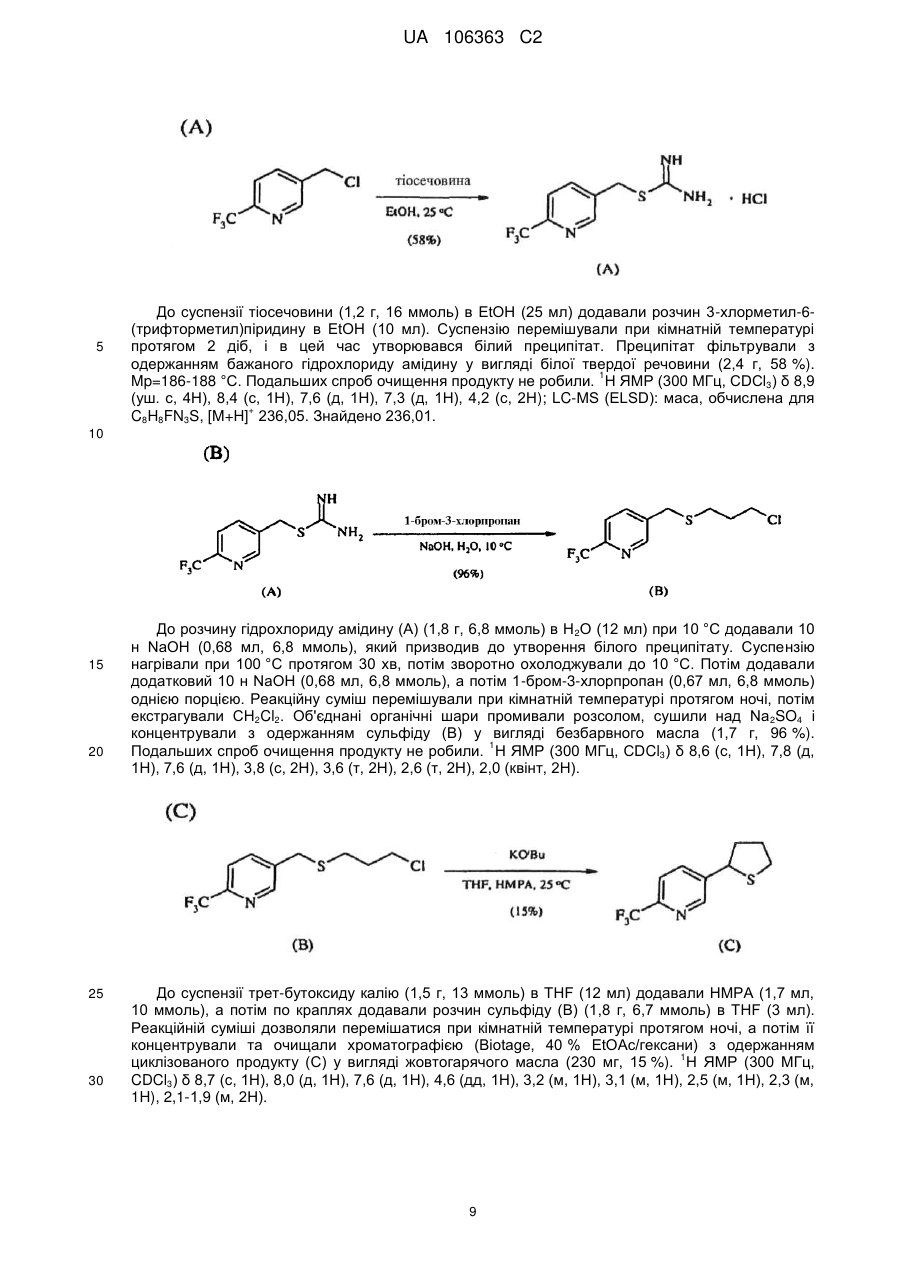
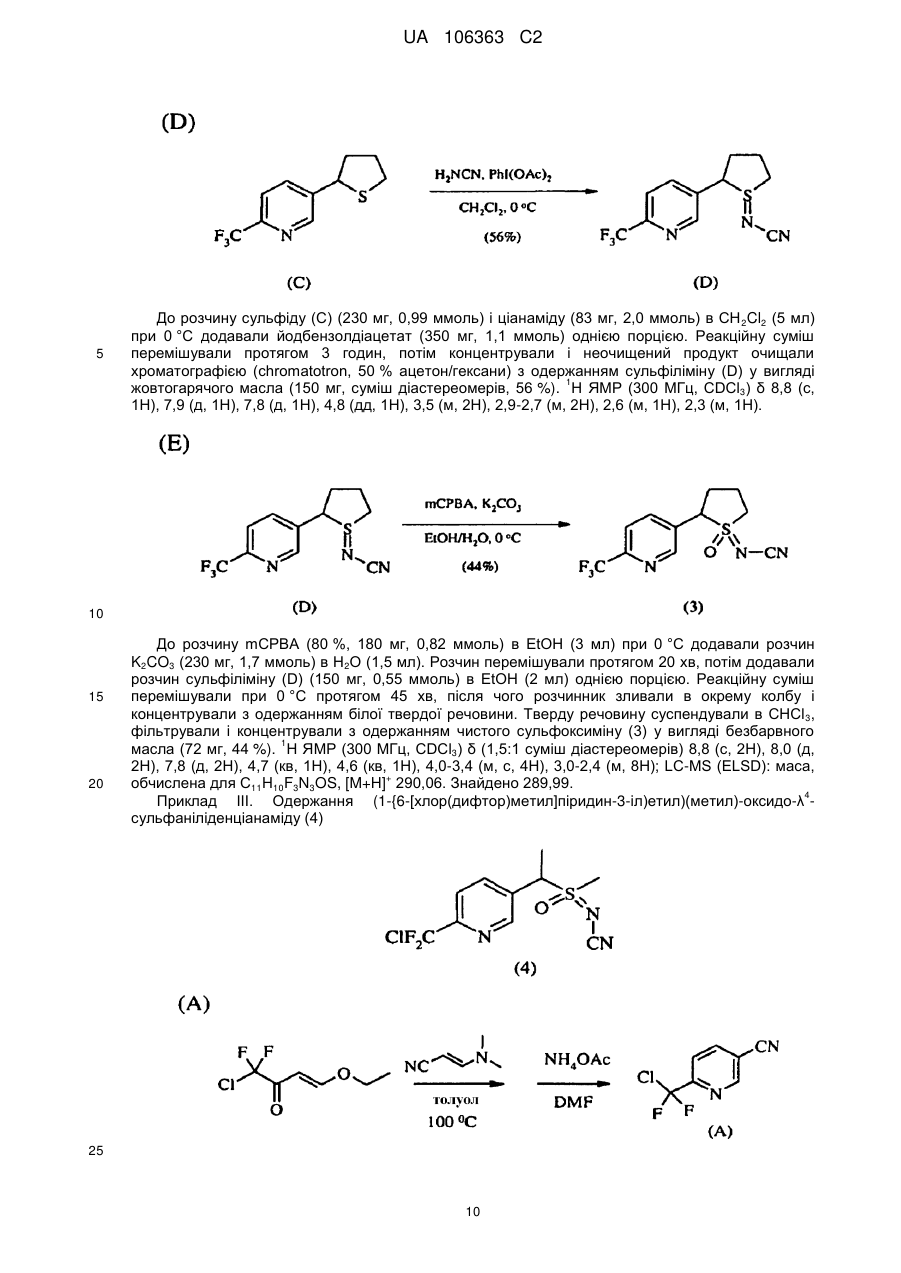
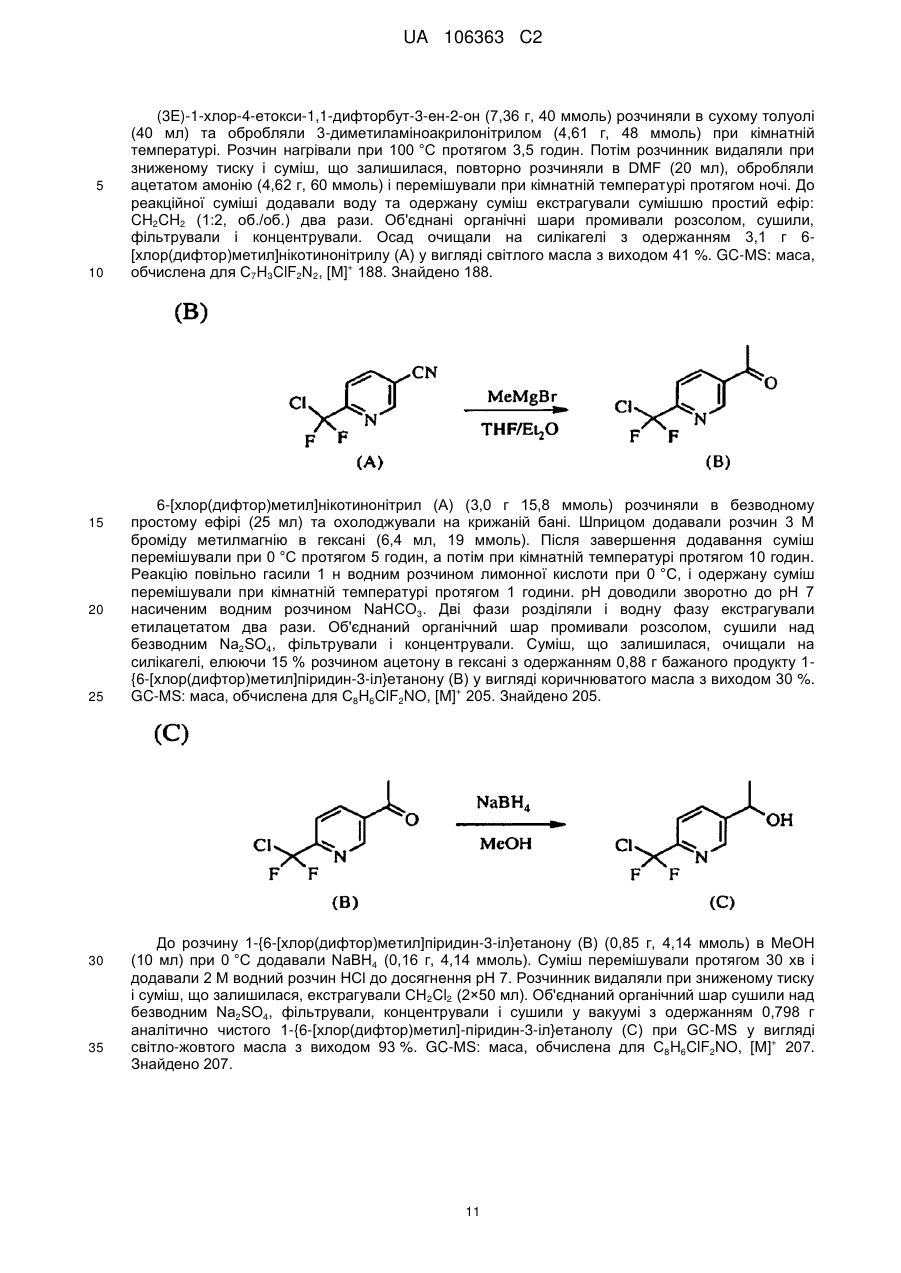
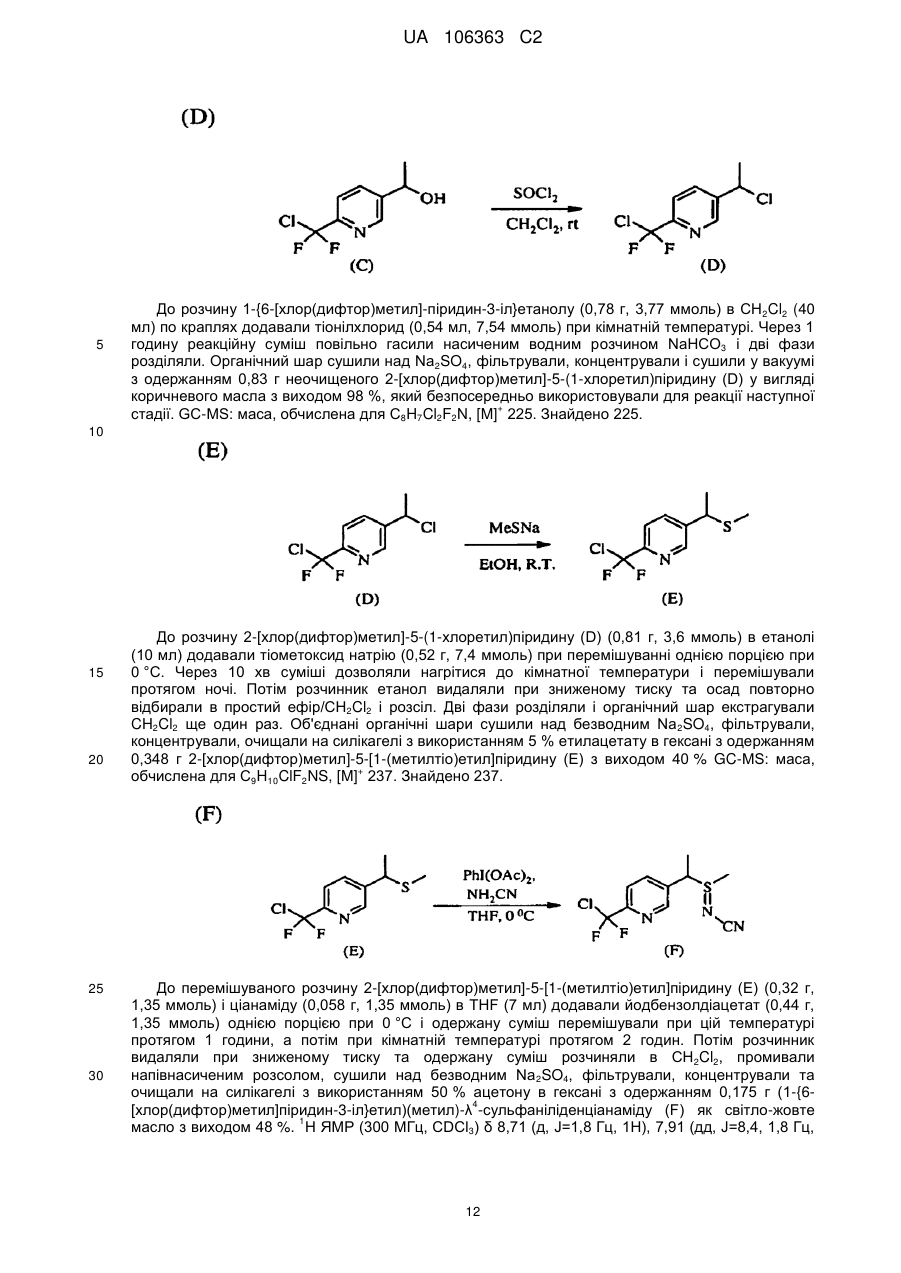
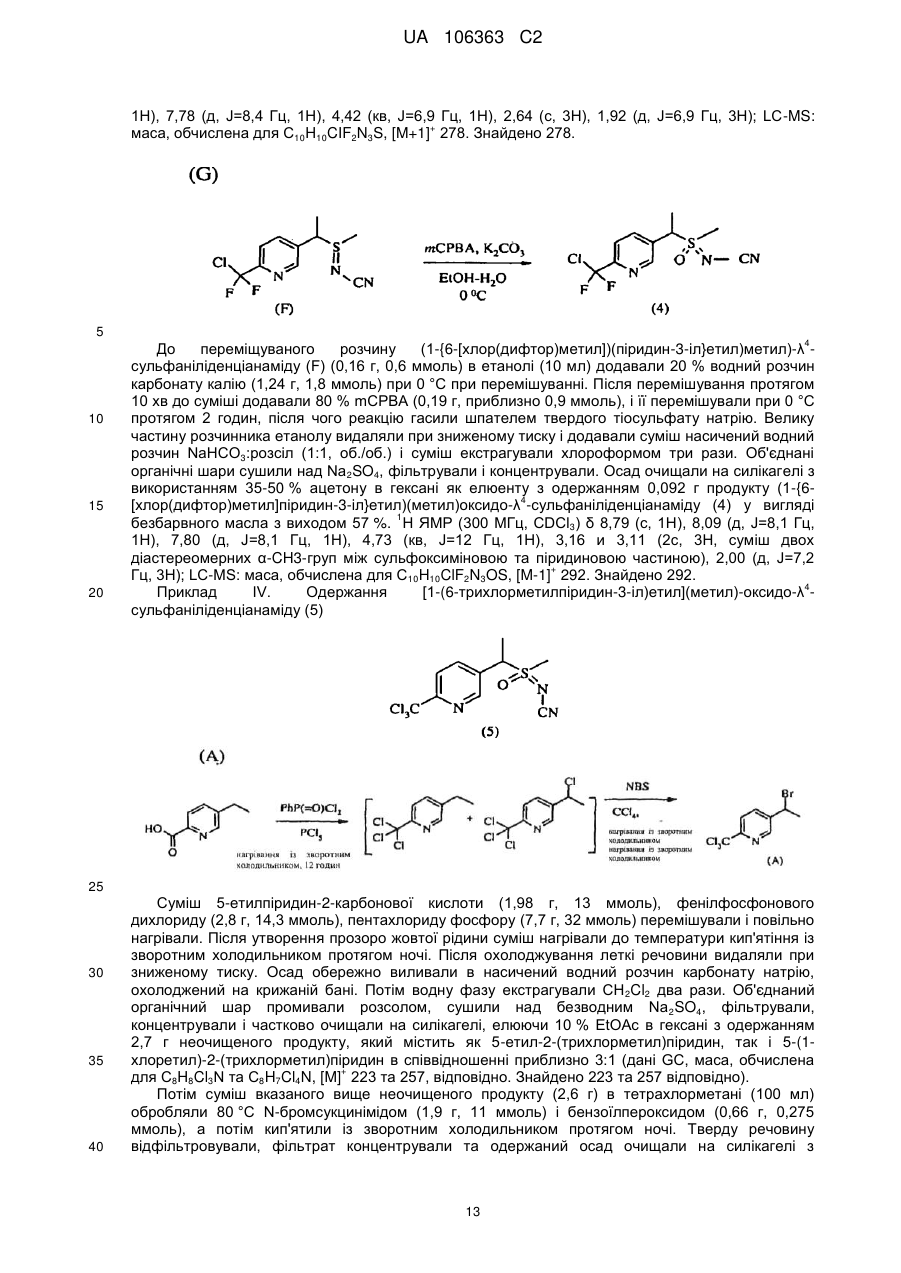
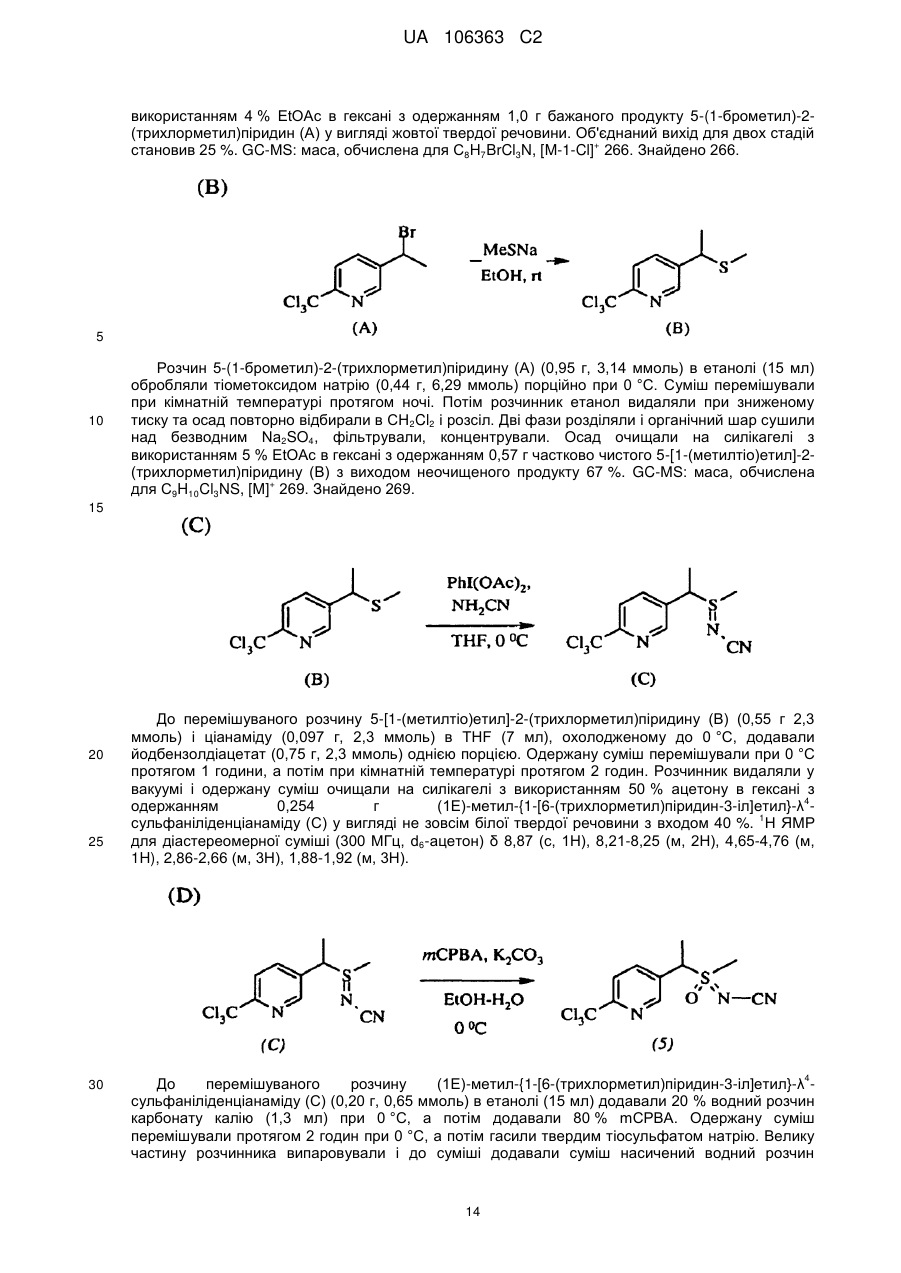
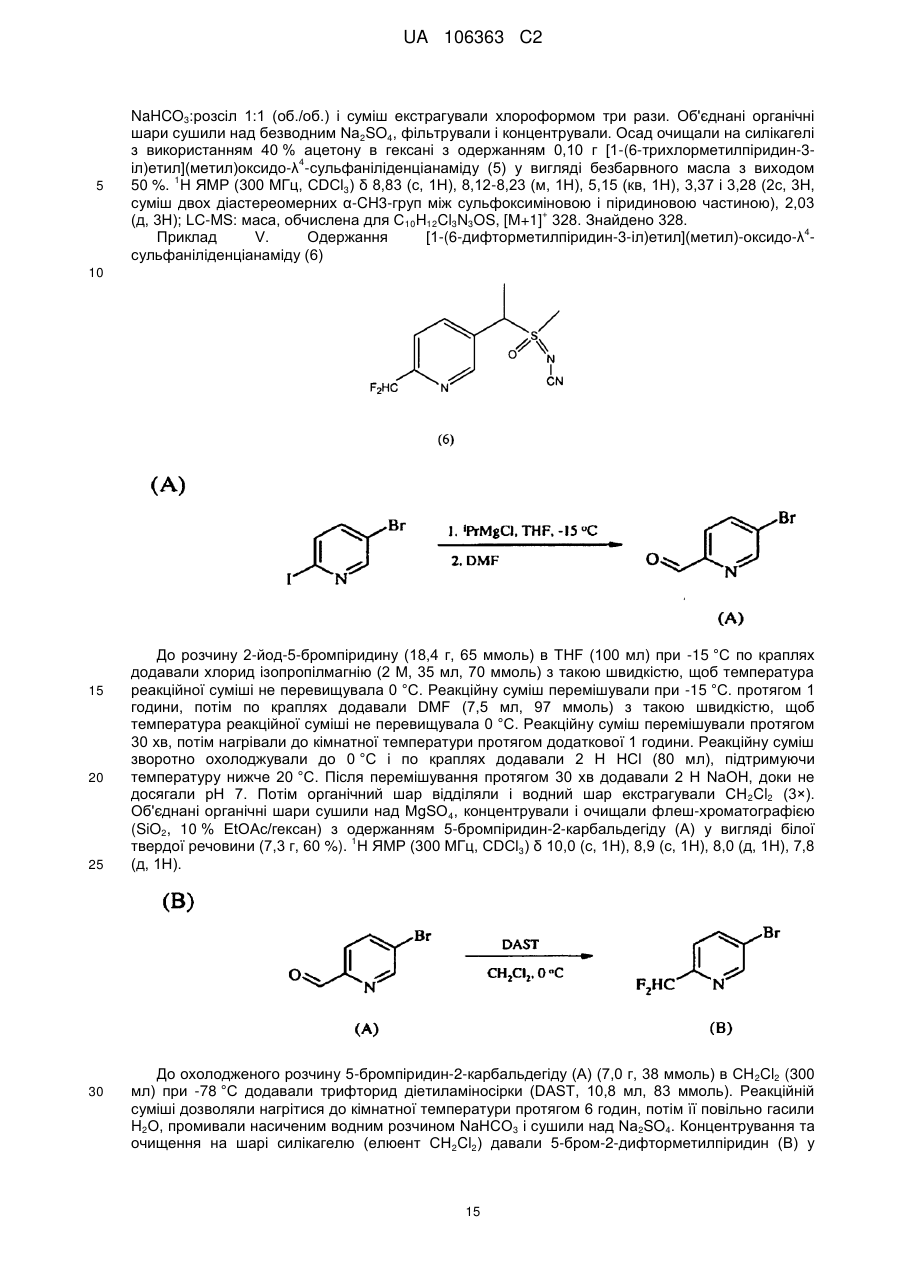
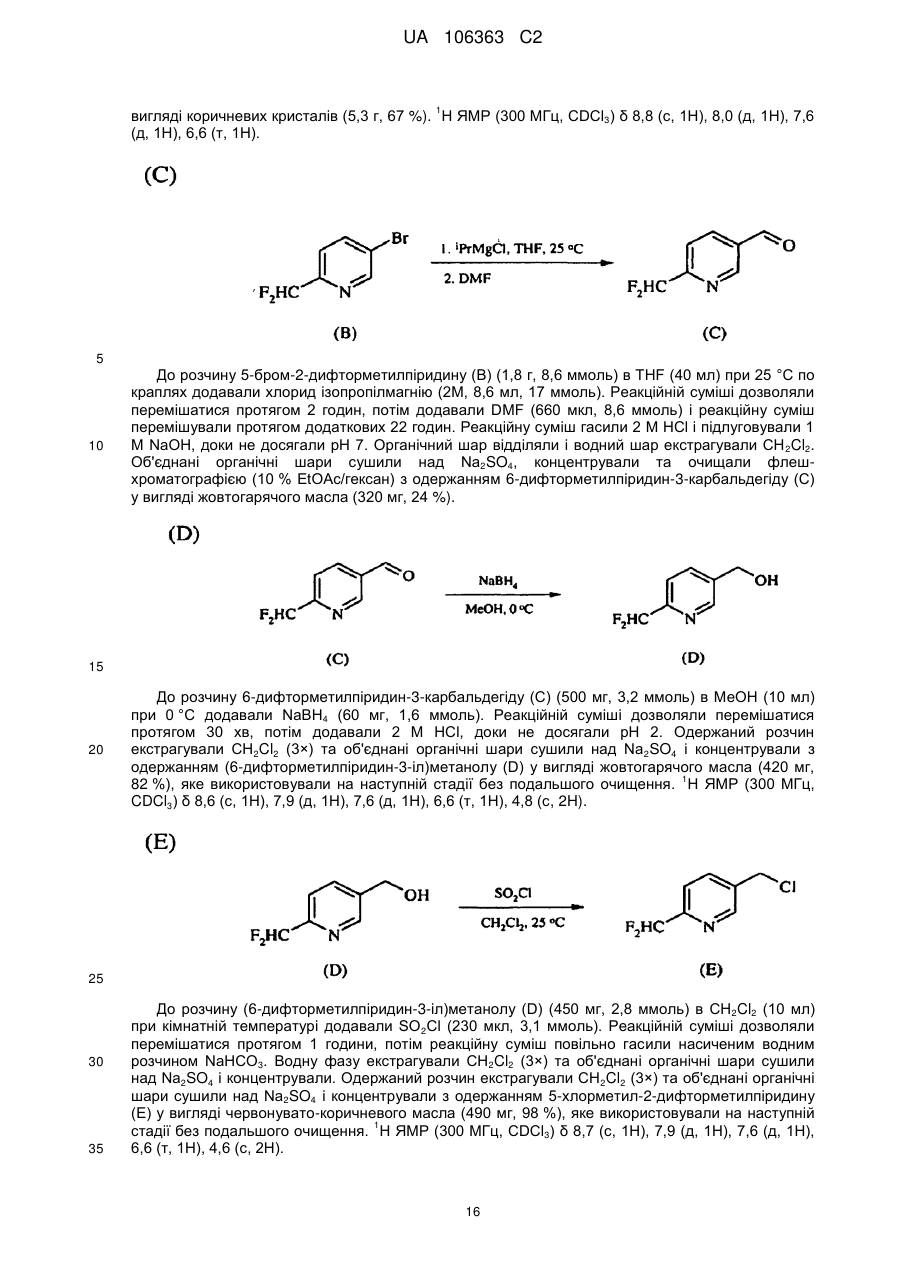
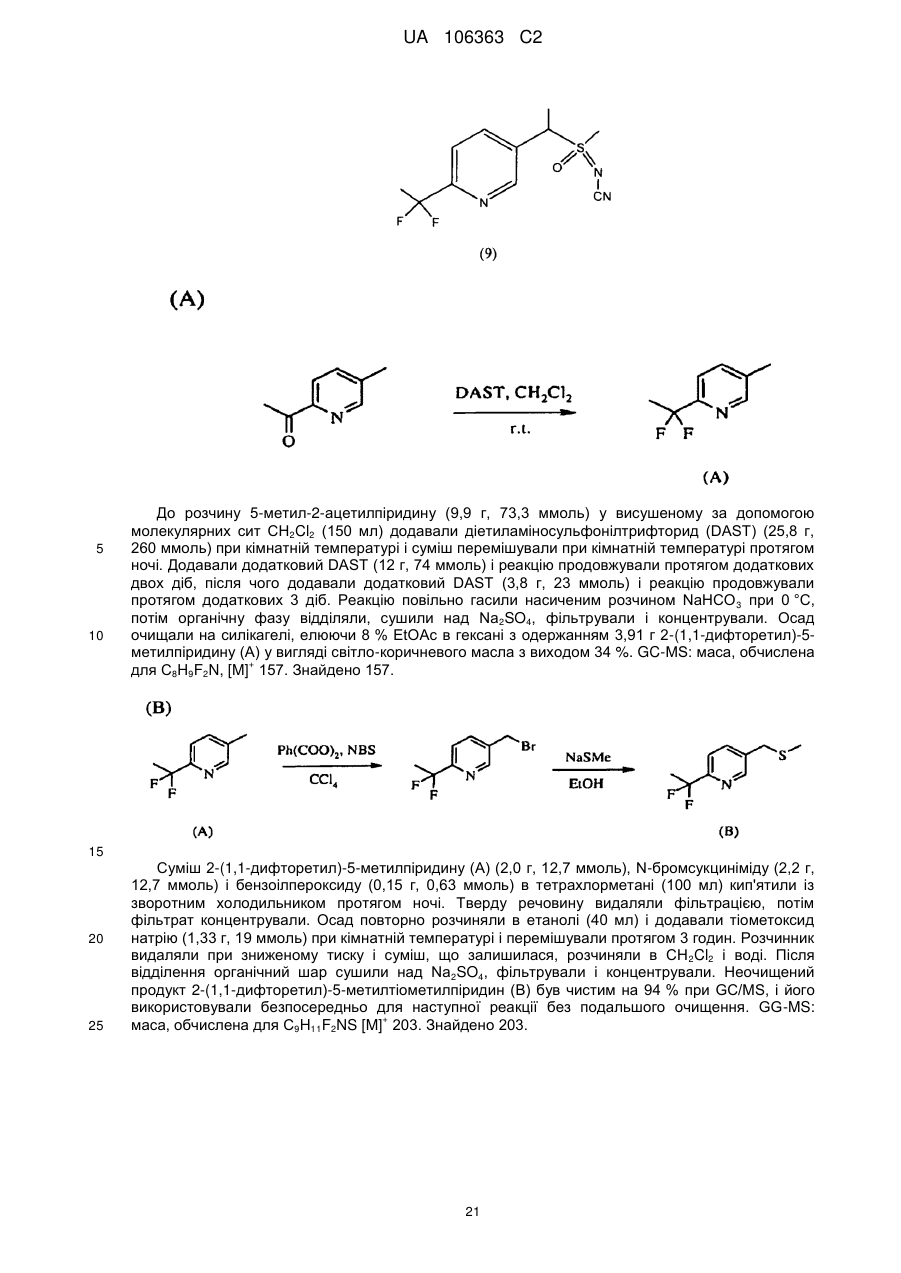
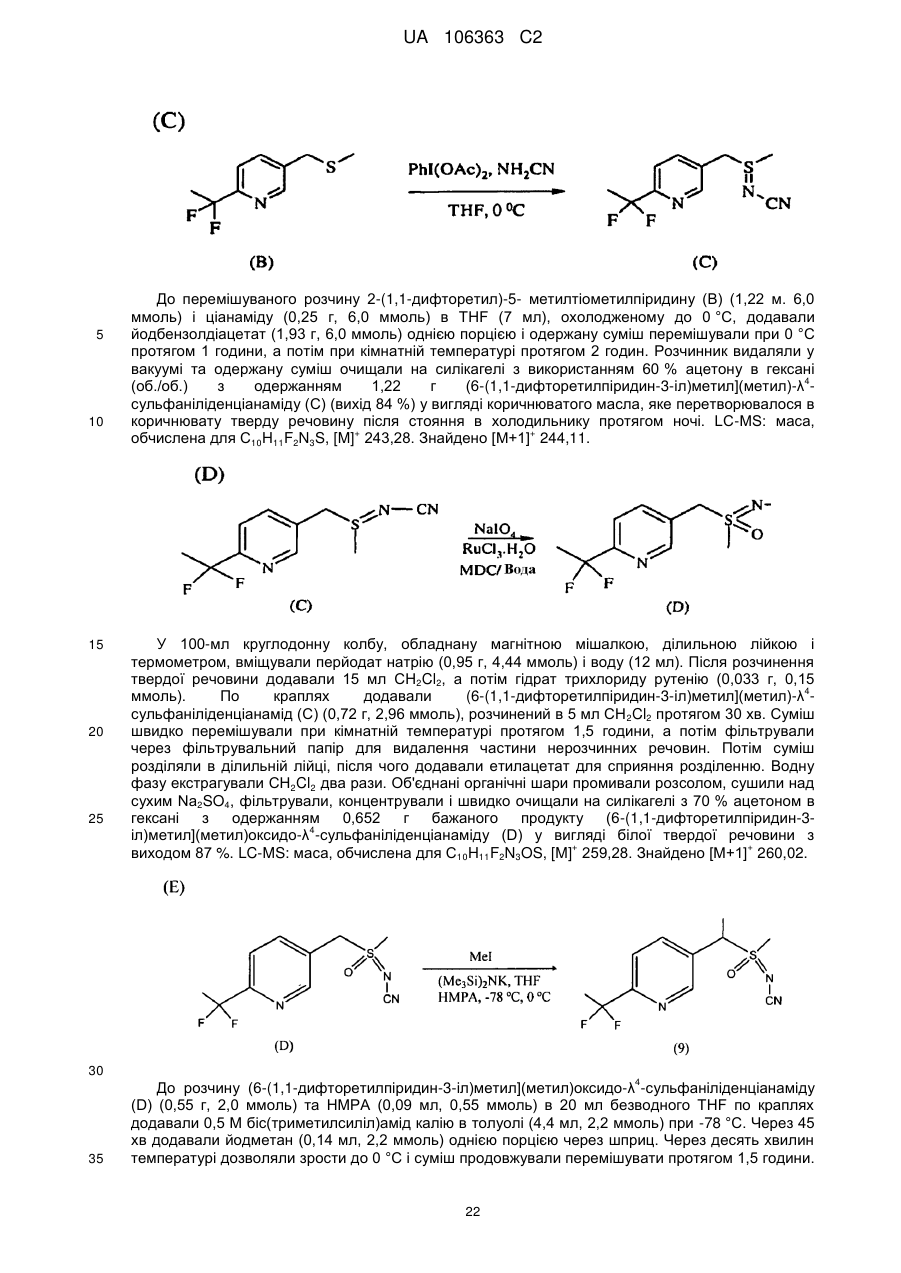
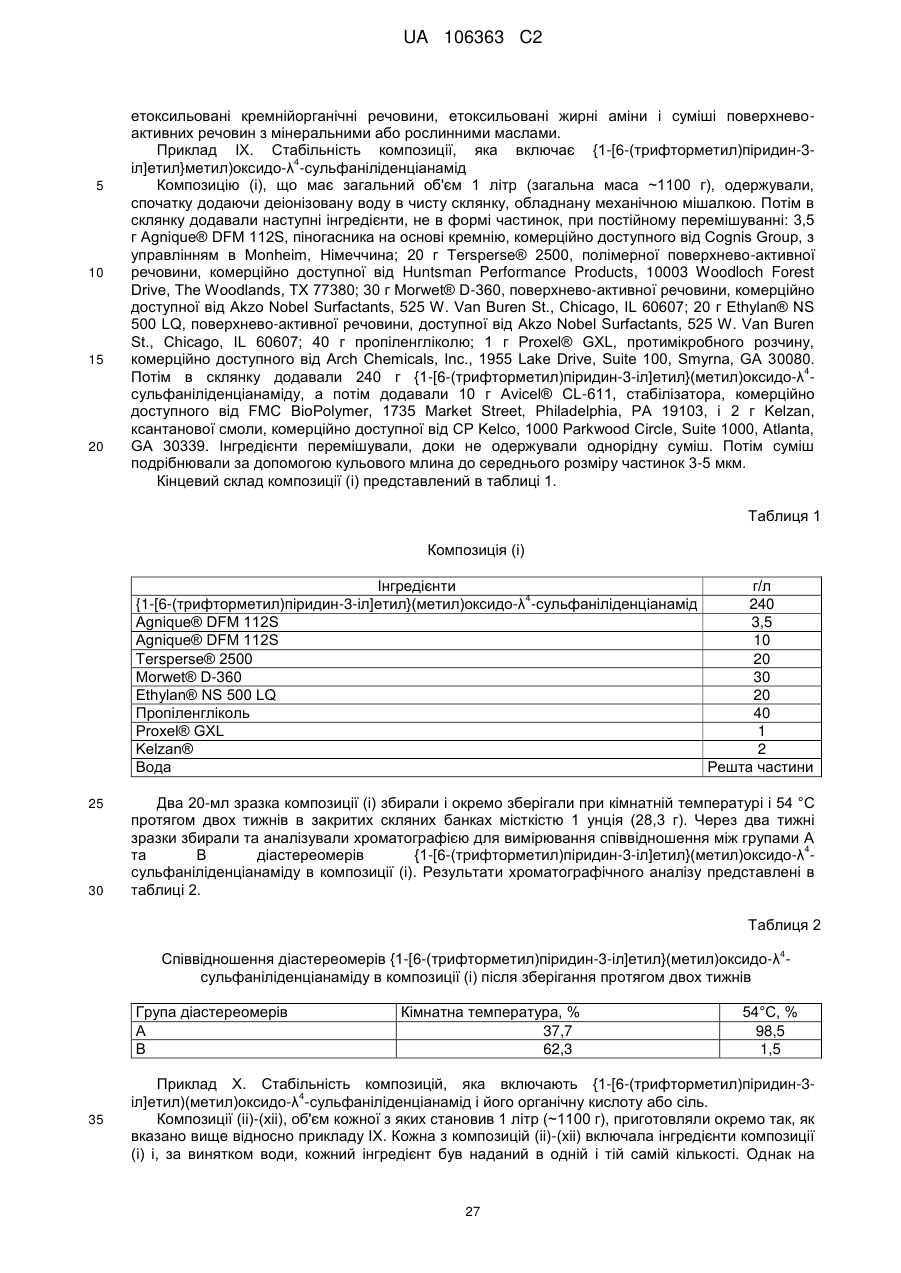
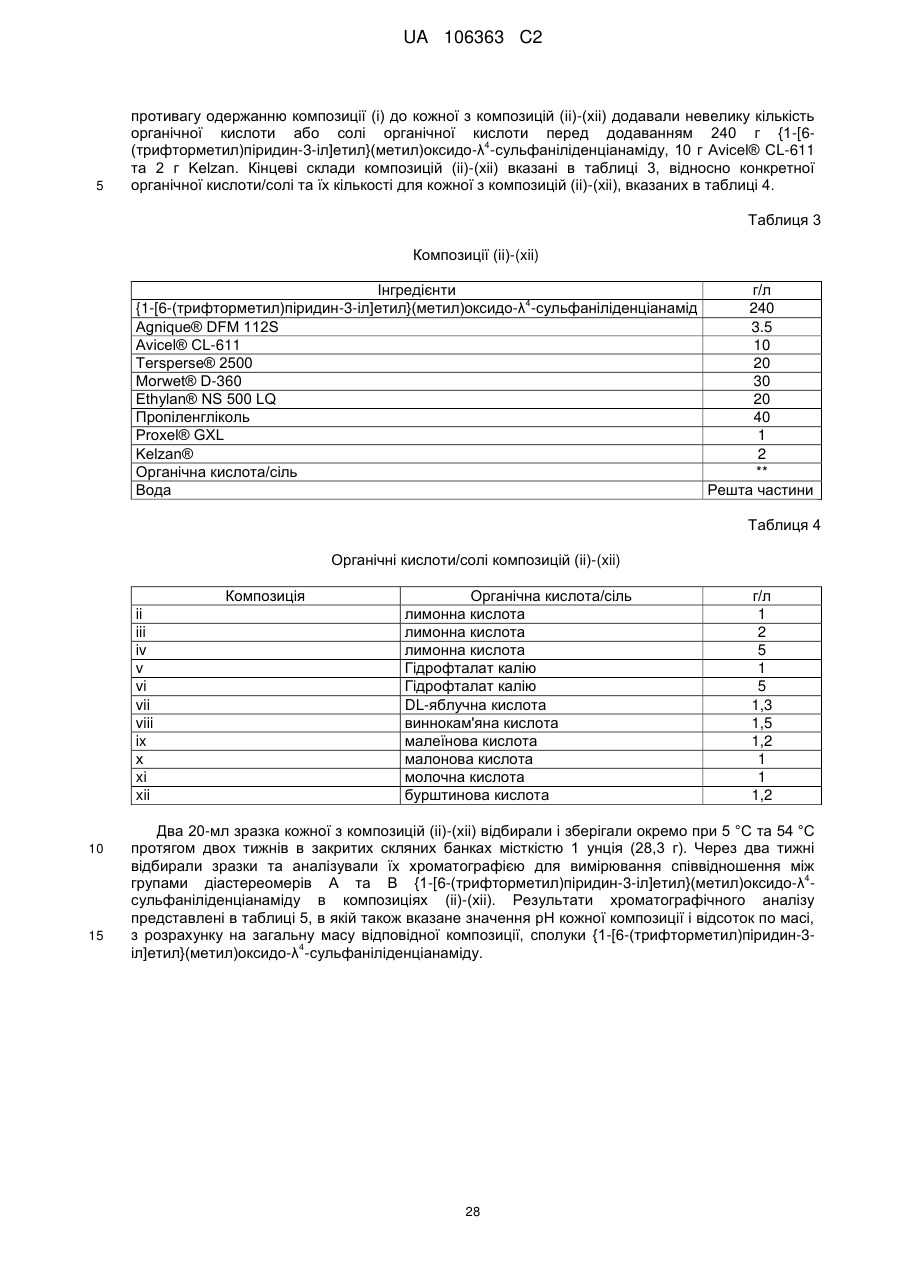
Реферат: Композиції для боротьби з комахами, які включають N-заміщену сполуку (6галогеналкілпіридин-3-іл)алкілсульфоксиміну та органічну кислоту або її сіль, де органічна кислота вибрана з групи, яка складається з лимонної, фталевої, яблучної, виннокам′яної, малеїнової, малонової, молочної і бурштинової кислот. UA 106363 C2 (12) UA 106363 C2 UA 106363 C2 5 10 15 20 25 30 35 40 45 ПЕРЕХРЕСНЕ ПОСИЛАННЯ НА СПОРІДНЕНІ ЗАЯВКИ За даною заявкою заявляється пріоритет за попередньою патентною заявкою США № 61/203689, поданою 26 грудня 2008 року, зміст якої включений в цей документ як посилання в повному обсязі. ГАЛУЗЬ ВИНАХОДУ Винахід, описаний в цьому документі, належить до галузі пестицидів та їх застосування для боротьби із шкідниками. РІВЕНЬ ТЕХНІКИ Кожний рік шкідники спричиняють мільйони людських смертей по всьому світу. Більше того, існує більше десяти тисяч видів шкідників, які спричиняють збитки в сільському господарстві. Ці збитки в сільському господарстві досягають мільярдів доларів США кожний рік. Терміти спричиняють пошкодження різних будівель, таких як будинки. Збитки від цих пошкоджень термітами досягають мільярдів доларів США кожний рік. Як заключна інформація, багато шкідників харчових продуктів, що зберігаються, їдять і псують харчові продукти, що зберігаються. Ці збитки з харчовими продуктами, що зберігаються, досягають мільярдів доларів США кожний рік, однак більш важливо, що вони позбавляють людей необхідної їм їжі. Протягом часу була розроблена множина пестицидних композицій для знищення шкідників і зменшення пошкоджень, які вони спричиняють. Що стосується щонайменше деяких з цих композицій, їх фізична і хімічна нестабільність може призвести до зниження пестицидної активності композиції і/або забезпечити складності, коли настає час для застосування композиції в тій галузі, в якій є необхідною або бажаною боротьба з комахами. Наприклад, фізична і хімічна нестабільність може змінити одну або декілька властивостей композиції, що робить складним або неможливим приготування належних розчинів композиції для застосування. Більш конкретно, багато пестицидних композицій надаються виробником в концентрованому складі і кінцевий користувач згодом розбавляє їх перед застосуванням. У час між виготовленням і застосуванням рідкі форми пестицидних композицій можуть застигати внаслідок хімічної і фізичної нестабільності композиції. Часто, це застигання заважає або по суті перешкоджає диспергуванню композиції в розчин, придатний для застосування, що призводить до великих витрат і витрат для користувача і/або зіпсованих пестицидних продуктів. Більше того, коли фізична і хімічна нестабільність призводять до зменшення пестицидної активність композиції, часто потрібне збільшення концентрації, в якій пестицид застосовують, і/або більш часте застосування пестицидної композиції. У результаті, можуть зростати витрати користування і вартість для споживачів. Таким чином, існує необхідність в нових пестицидних композиціях, які мають властивості збільшеної хімічної і фізичної стабільності. У публікації патентної заявки США 2007/0203191 A1 описані визначені N-заміщені сполуки (6-галогеналкілпіридин-3-іл)алкілсульфоксиміну та їх застосування в боротьбі з комахами. У цей час відкрито, як підвищити стабільність композицій, які включають одну або декілька з цих сполук, протягом більш тривалих періодів часу. СУТЬ ВИНАХОДУ Даний винахід належить до нових композицій, які включають одне або декілька N-заміщених (6-галоалкілпіридин-3-іл)алкілсульфоксимінів та органічну кислоту або її сіль, для боротьби з комахами і деякими іншими безхребетними, зокрема, попелицею та іншими сисними комахами. Також цей винахід належить до нових способів синтезу для одержання композицій і до способів боротьби з комахами з використанням композицій. Цей винахід належить до композицій, придатних для боротьби з комахами, особливо придатних для боротьби з попелицею та іншими сисними комахами. Більш конкретно, винахід належить до композицій, що включають органічну кислоту або її сіль і сполуку формули (I) 4 50 X являє собою NO2, CN або COOR ; 1 L являє собою одинарний зв'язок або R , S та L, взяті разом, являють собою 4-, 5- або 6членне кільце; 1 R являє собою (C1-C4)алкіл; 1 UA 106363 C2 2 5 10 15 20 25 30 35 40 45 3 R та R відрізняються один від одного і окремо являють собою водень, метил, етил, фтор, хлор або бром; 1 n дорівнює 1, коли L являє собою одинарний зв'язок, і дорівнює 0, коли R , S і L, взяті разом, являють собою 4-, 5- або 6-членне кільце; Y являє собою (C1-C4)галогеналкіл, F, Cl, Br або I; і 4 R являє собою (C1-C3)алкіл. В одному конкретному варіанті здійснення композиція включає сполуку формули (I), де L являє собою одинарний зв'язок, тобто, яка має наступну структуру, де n дорівнює 1 , де 4 X являє собою NO2, CN або COOR ; 1 R являє собою (C1-C4)алкіл; 2 3 R та R відрізняються один від одного і окремо являють собою водень, метил, етил, фтор, хлор або бром; Y являє собою (C1-C4)галогеналкіл, F, Cl, Br або I; і 4 R являє собою (C1-C3)алкіл. 1 В іншому конкретному варіанті здійснення композиція включає сполуку формули (I), де R , S та L, взяті разом, утворюють насичене 5-членне кільце, і n дорівнює 0, тобто, яка має структуру , де 4 X являє собою NO2, CN або COOR ; 4 Y являє собою (C1-C4)галогеналкіл, F, Cl, Br або I; і R являє собою (C1-C3)алкіл. У визначених варіантах здійснення композиція включає сполуки формули (I) з одного або декількох з наступних класів: (1) Сполуки формули (I), де X являє собою NO 2 або CN, найбільш переважно CN. (2) Сполуки формули (I), де Y являє собою CF 3. (3) Сполуки формули (I), де R2 та R3 відрізняються одна від одної і незалежно являють собою водень, метил або етил. 1 (4) Сполуки формули (I), де R являє собою CH3. Фахівцям в даній галузі буде зрозуміло, що одна або декілька з композицій, описаних в цьому документі, може містити комбінації описаних вище класів сполуки формули (I). В одному або декількох конкретних варіантах здійснення органічна кислота являє собою карбонову кислоту, вибрану з групи, яка складається з лимонної кислоти, фталевої кислоти, яблучної кислоти, виннокам'яної кислоти, малеїнової кислоти, малонової кислоти, молочної кислоти та бурштинової кислоти. В іншому варіанті здійснення спосіб включає застосування в галузі, в якій є бажаною боротьба, інактивуючої комах кількості пестицидної композиції. Наступні варіанти здійснення, форми, ознаки, аспекти, вигода, задачі і переваги даного винаходу стануть зрозумілими з представлених докладного опису і прикладів. ЗАМІСНИКИ (НЕПОВНИЙ СПИСОК) Приклади, наведені для замісників, є (за винятком галогену) неповними, і їх не треба тлумачити як такі, що обмежують винахід, описаний в цьому документі. "Алкіл" (включаючи похідні терміни, такі як алкокси) означає нерозгалужені, розгалужені і циклічні групи, які включають, наприклад, метил, етил, 1-метилетил, пропіл, 1,1-диметилетил і циклопропіл. 2 UA 106363 C2 5 10 "Алкокси" означає алкіл, який додатково містить вуглець-кисневий одинарний зв'язок, наприклад, метокси, етокси, пропокси, ізопропокси, 1-бутокси, 2-бутокси, ізобутокси, третбутокси, пентокси, 2-метилбутокси, 1,1-диметилпропокси, гексокси, гептокси, октокси, нонокси та декокси. "Арил" означає циклічний ароматичний замісник, що складається з водню і вуглецю, наприклад феніл, нафтил та біфеніліл. "Галоген" означає фтор, хлор, бром і йод. "Галогеналкіл" означає алкільну групу, заміщену за допомогою від одного до максимально можливої кількості атомів галогенів, включаючи всі комбінації галогенів. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Протягом цього документа всі значення температури наведені в градусах Цельсія і всі відсотки являють собою масові відсотки, якщо немає інших вказівок. 1 2 3 4 Сполуки формули (Ia), де R , R , R , R , X, і Y є такими, як визначено вище, L являє собою одинарний зв'язок і n дорівнює 1, можна одержувати способами, проілюстрованими на схемі А: 15 20 25 30 На стадії а схеми А сульфід формули (А) окислюється мета-хлорпероксибензойною кислотою (mCPBA) в полярному розчиннику при температурі нижче 0 °C з утворенням сульфоксиду формули (В). У більшості випадків переважним для окиснення розчинником є дихлорметан. На стадії b схеми А сульфоксид (В) імінується азидом натрію в присутності концентрованої сірчаної кислоти в апротонному розчиннику при нагріванні з утворенням сульфоксиміну формули (С). У більшості випадків хлороформ є переважним розчинником для цієї реакції. На стадії с схеми А азот сульфоксиміну (С) може бути ціанований ціаногенбромідом в присутності основи або нітрований азотною кислотою в присутності оцтового ангідриду при дещо підвищеній температурі, або карбоксилований алкіл-(R4)-хлорформіатом в присутності основи, такої як 4-диметиламінопіридин (DMAP), з утворенням N-заміщеного сульфоксиміну (Ia). Основа потрібна для ефективного ціанування і карбоксилування і переважною основою є DMAP, в той час як сірчану кислоту використовують як каталізатор для ефективної реакції нітрування. 1 2 3 4 Сполуки формули (Ia), де X являє собою CN, і R , R , R , R і Y є такими, як визначено вище, і n дорівнює 1, можна одержувати м'яким та ефективним способом, проілюстрованим на схемі В. 35 3 UA 106363 C2 5 10 15 На стадії а схеми В сульфід окислюється йодбензолдіацетатом вприсутності ціанаміду при 0 °C з утворенням сульфіліміну (D). Реакцію можна провести в полярному апротонному розчиннику, такому як CH2Cl2. На стадії b схеми В сульфілімін (D) окисляють mCPBA. Для нейтралізації кислотність mCPBA використовує основу, таку як карбонат калію. Для підвищення розчинності вихідного матеріалу сульфіліміну і основи, що використовується, використовують протонні полярні розчинники, такі як етанол і вода. Сульфілімін (D) можна окисляти водним розчином перйодинату натрію або калію в присутності каталізатора гідрату трихлориду рутенію або схожого каталізатора. Органічний розчинник для цього каталізу може являти собою полярний апротонний розчинник, такий як CH2Cl2, хлороформ або ацетонітрил. 3 2 3 α-вуглець N-заміщеного сульфоксиміну формули (Ia), тобто, n=1, R =Н в групі (CR R ), сусідній з N-заміщеною функціональною групою сульфоксиміну, може бути далі алкілований або 5 галогенований (R ) в присутності основи, такої як гексаметилдисиламід (KHMDS), з утворенням 1 2 3 4 N-заміщених сульфоксимінів формули (Ib), де R , R , R , R , X, L та Y є такими, як визначено вище, і Z являє собою придатну групу, що йде, як проілюстровано на схемі C. Переважними 5 5 5 групами, що йдуть, є йодид (R =алкіл), бензосульфонімід (R =F), тетрахлоретен (R =Cl) і 5 тетрафторетен (R =Br). 20 25 Вихідні сульфіди (А) на схемі А можна одержувати різними способами, як проілюстровано на схемах D, Е, F, G та Н. 1 2 3 На схемі D сульфід формули (A1), де R , R і Y є такими, як визначено вище, n=1 і R =Н, можна одержувати з хлориду формули (D) нуклеофільним заміщенням з натрієвою сіллю алкілтіолу. 4 UA 106363 C2 1 5 На схемі Е, сульфід формули (A4), де R , S та L, взяті разом, являють собою 4-, 5- або 6членне кільце (m=0, 1 або 2) і n дорівнює 0, можна одержувати з відповідного заміщеного хлорметилпіридину за допомогою обробки тіосечовиною, гідролізу і подальшого алкілування відповідним бромхлоралканом (m=0, 1 або 2) у водних основних умовах, і циклізацією в присутності основи, такої як трет-бутоксид калію в полярному апротонному розчиннику, такому як THF. 10 1 15 2 3 Сульфіди формули (A1), де R , R =CH3, Y є таким, як визначено вище, і R =Н, альтернативно можна одержувати способами, проілюстрованими на схемі F. Таким чином, відповідний енон піддають реакції поєднання з диметиламіноакрилонітрилом і циклізують ацетатом амонію в DMF з одержанням відповідного 6-заміщеного нікотинонітрилу. Обробка бромідом метилмагнію, відновлення боргідридом натрію, хлорування тіонілхлоридом і нуклеофільне заміщення натрієвою сіллю алкілтіолу дають бажані сульфіди (A 1). 5 UA 106363 C2 1 5 2 3 Сульфіди формули (A1), де R = метил або етил, R та R відрізняються один від одного і незалежно являють собою водень, метил або етил, і Y є таким, як визначено вище, можна одержувати за допомогою варіанту схеми F, представленого на схемі G, де енаміни, утворені реакцією приєднання аміну, наприклад, піролідину, до аддукту Міхаеля визначених сульфідів з відповідним чином заміщеними α, β-ненасиченими альдегідами, піддають реакції поєднання із заміщеними енонами і циклізують за допомогою ацетату амонію в ацетонітрилі з одержанням бажаних сульфідів (A1). 10 1 15 2 3 На схемі Н сульфіди формули (A1), де Y являє собою фторалкільну групу, R , R та R є такими, як визначено вище, і n=1, можна одержувати з 6-ацилпіридину або 6-формілпіридину реакцією з трифторидом діетиламіносірки (DAST). Подальше галогенування 3-метильної групи за допомогою NBS з подальшим нуклеофільним заміщенням натрієвою сіллю алкілтіолу призводить до утворення бажаного сульфіду. 20 Необмежуючі приклади сполук формули (I): 4 Приклад I. Одержання {1-[6-(трифторметил)піридин-3-іл]етил}(метил)оксидо-λ сульфаніліденціанаміду (2) 6 UA 106363 C2 5 10 До розчину 3-хлорметил-6-(трифторметил)піридину (5,1 г, 26 ммоль) в диметилсульфоксиді (DMSO; 20 мл) додавали однією порцією тіометоксид натрію (1,8 г, 26 ммоль). Спостерігали сильну екзотермічну реакцію, яка призводила до того, що реакційна суміш ставала темною. Реакційну суміш перемішували протягом 1 години, потім повільно додавали додатковий тіометоксид натрію (0,91 г, 13 ммоль). Реакційну суміш перемішували протягом ночі, і після цього її виливали в H2O і додавали декілька крапель концентрованої HCl. Суміш екстрагували Et2O (3×50 мл) і органічні шари об'єднували, промивали розсолом, сушили над MgSO 4 і концентрували. Неочищений продукт очищали хроматографією (Prep 500, 10 % ацетон/гексан) з 1 одержанням сульфіду (А) у вигляді світло-жовтого масла (3,6 г, 67 %). H ЯМР (300 MГц, CDCl3) δ 8,6 (с, 1H), 7,9 (д, 1H), 7,7 (д, 1H), 3,7 (с, 2H), 2,0 (с, 3H); GC-MS: маса, обчислена для + C8H8F3NS, [M] 207. Знайдено 207. 15 20 25 До розчину сульфіду (А) (3,5 г, 17 ммоль) і ціанаміду (1,4 мг, 34 ммоль) в CH2Cl2 (30 мл) при 0 °C додавали йодбензолдіацетат (11,0 г, 34 ммоль) однією порцією. Реакційну суміш перемішували протягом 30 хв, потім їй дозволяли нагріватися до кімнатної температури протягом ночі. Суміш розбавляли CH2Cl2 (50 мл) і промивали H2O. Водний шар екстрагували етилацетатом (4×50 мл), і об'єднані шари CH 2Cl2 і етилацетату сушили над MgSO4 і концентрували. Неочищений продукт розтирали з гексаном та очищали хроматографією (chromatotron, 60 % ацетон/гексан) з одержанням сульфіліміну (В) у вигляді жовтої смоли (0,60 г, -1 1 14 %). IR (плівка) 3008, 2924, 2143, 1693 см ; H ЯМР (300 MГц, CDCl3) δ 8,8 (с, 1H), 8,0 (д, 1H), 7,8 (д, 1H), 4,5 (д, 1H), 4,3 (д, 1H), 2,9 (с, 3H); LC-MS (ESI): маса, обчислена для C9H9F3N3S, + [M+Н] 248,04. Знайдено 248. 30 7 UA 106363 C2 5 10 15 20 25 30 До розчину м-хлорпербензойної кислоти (mCPBA; 80 %, 1,0 г, 4,9 ммоль) в EtOH (10 мл) при 0° додавали розчин K2CO3 (1,4 г, 10 ммоль) в H2O (7 мл). Розчин перемішували протягом 20 хв, потім додавали розчин сульфіліміну (В) (0,60 г, 2,4 ммоль) в EtOH (20 мл) однією порцією. Реакційну суміш перемішували при 0 °C протягом 30 хв, потім їй дозволяли нагрітися до кімнатної температури протягом 1 години. Потім реакцію гасили водним розчином бісульфіту натрію і суміш концентрували для видалення етанолу. Одержану суміш екстрагували CH2Cl2 та об'єднані органічні шари сушили над MgSO 4 і концентрували. Неочищений продукт очищали хроматографією (chromatotron, 50 % ацетон/гексан) з одержанням сульфоксиміну (1) у вигляді 1 не зовсім білої твердої речовини (0,28 г, 44 %). Mp=135-137 °C; H ЯМР (300 MГц, CDCl3) δ 8,8 (с, 1H), 8,1 (д, 1H), 7,8 (д, 1H), 4,7 (м, 2H), 3,2 (с, 3H); LC-MS (ELSD): маса, обчислена для + C9H9F3N3OS, [M+H] 264,04. Знайдено 263,92. До розчину сульфоксиміну (1) (50 мг, 0,19 ммоль) і гексаметилфосфораміду (HMPA; 17 мкл, 0,10 ммоль) в тетрагідрофурані (THF; 2 мл) при -78 °C по краплях додавали гексаметилдисилазан калію (KHMDS; 0,5 M в толуолі, 420 мкл, 0,21 ммоль). Розчин перемішували при -78 °C протягом додаткових 20 хв, після чого додавали йодметан (13 мкл, 0,21 ммоль). Реакційній суміші дозволяли нагрітися до кімнатної температури протягом 1 години, після чого реакцію гасили насиченим водним розчином NH 4Cl та екстрагували CH2Cl2. Органічний шар сушили над Na2SO4, концентрували і неочищений продукт очищали хроматографією (chromatotron, 70 % ацетон/ CH2Cl2) з одержанням сульфоксиміну (2) як суміш 2:1 діастереомерів (безбарвне масло; 31 мг, 59 %). Сульфоксимін (2) широко відомий як сульфоксафлор, і додаткова інформація про нього доступна на http://www.alanwood.net/pesticides/index_en_frame.html. Згідно з переглянутою версією номенклатури IUPAC, сульфоксимін (2) також називають [метил(оксидо)-{1-[6-(трифторметил)6 3-піридил]етил}-λ -сульфаніліден]ціанамідом, і назва CAS, надане сульфоксиміну (2) являє 4 1 собою N-[метилоксидо[1-[6-(трифторметил)-3-піридиніл]етил]-λ -сульфаніліден]ціанамід. H ЯМР (300 MГц, CDCl3) δ (головний діастереомер) 8,8 (с, 1H), 8,1 (д, 1H), 7,8 (д, 1H), 4,6 (кв, 1Н), 3,0 (с, 3H), 2,0 (д, 3H); (другорядний діастереомер) 8,8 (с, 1H), 8,1 (д, 1H), 7,8 (д, 1H), 4,6 (кв, + 1H), 3,1 (с, 3H), 2,0 (д, 3H); LC-MS (ELSD): маса, обчислена для C10H10F3N3OS, [M+H] 278,06. Знайдено 278,05. 4 Приклад II. Одержання 2-(6-трифторметилпіридин-3-іл)-1-оксидотетрагідро-1H-1λ -тієн-1іліденціанаміду (3) 35 8 UA 106363 C2 5 До суспензії тіосечовини (1,2 г, 16 ммоль) в EtOH (25 мл) додавали розчин 3-хлорметил-6(трифторметил)піридину в EtOH (10 мл). Суспензію перемішували при кімнатній температурі протягом 2 діб, і в цей час утворювався білий преципітат. Преципітат фільтрували з одержанням бажаного гідрохлориду амідину у вигляді білої твердої речовини (2,4 г, 58 %). 1 Mp=186-188 °C. Подальших спроб очищення продукту не робили. H ЯМР (300 MГц, CDCl3) δ 8,9 (уш. с, 4H), 8,4 (с, 1H), 7,6 (д, 1H), 7,3 (д, 1H), 4,2 (с, 2H); LC-MS (ELSD): маса, обчислена для + C8H8FN3S, [M+H] 236,05. Знайдено 236,01. 10 15 20 25 30 До розчину гідрохлориду амідину (А) (1,8 г, 6,8 ммоль) в H 2O (12 мл) при 10 °C додавали 10 н NaOH (0,68 мл, 6,8 ммоль), який призводив до утворення білого преципітату. Суспензію нагрівали при 100 °C протягом 30 хв, потім зворотно охолоджували до 10 °C. Потім додавали додатковий 10 н NaOH (0,68 мл, 6,8 ммоль), а потім 1-бром-3-хлорпропан (0,67 мл, 6,8 ммоль) однією порцією. Реакційну суміш перемішували при кімнатній температурі протягом ночі, потім екстрагували CH2Cl2. Об'єднані органічні шари промивали розсолом, сушили над Na 2SO4 і концентрували з одержанням сульфіду (В) у вигляді безбарвного масла (1,7 г, 96 %). 1 Подальших спроб очищення продукту не робили. H ЯМР (300 MГц, CDCl3) δ 8,6 (с, 1H), 7,8 (д, 1H), 7,6 (д, 1H), 3,8 (с, 2H), 3,6 (т, 2H), 2,6 (т, 2H), 2,0 (квінт, 2H). До суспензії трет-бутоксиду калію (1,5 г, 13 ммоль) в THF (12 мл) додавали HMPA (1,7 мл, 10 ммоль), а потім по краплях додавали розчин сульфіду (В) (1,8 г, 6,7 ммоль) в THF (3 мл). Реакційній суміші дозволяли перемішатися при кімнатній температурі протягом ночі, а потім її концентрували та очищали хроматографією (Biotage, 40 % EtOAc/гексани) з одержанням 1 циклізованого продукту (С) у вигляді жовтогарячого масла (230 мг, 15 %). H ЯМР(300 MГц, CDCl3) δ 8,7 (с, 1H), 8,0 (д, 1H), 7,6 (д, 1H), 4,6 (дд, 1H), 3,2 (м, 1H), 3,1 (м, 1H), 2,5 (м, 1H), 2,3 (м, 1H), 2,1-1,9 (м, 2H). 9 UA 106363 C2 5 До розчину сульфіду (С) (230 мг, 0,99 ммоль) і ціанаміду (83 мг, 2,0 ммоль) в CH 2Cl2 (5 мл) при 0 °C додавали йодбензолдіацетат (350 мг, 1,1 ммоль) однією порцією. Реакційну суміш перемішували протягом 3 годин, потім концентрували і неочищений продукт очищали хроматографією (chromatotron, 50 % ацетон/гексани) з одержанням сульфіліміну (D) у вигляді 1 жовтогарячого масла (150 мг, суміш діастереомерів, 56 %). H ЯМР (300 MГц, CDCl3) δ 8,8 (с, 1H), 7,9 (д, 1H), 7,8 (д, 1H), 4,8 (дд, 1H), 3,5 (м, 2H), 2,9-2,7 (м, 2H), 2,6 (м, 1H), 2,3 (м, 1H). 10 15 20 До розчину mCPBA (80 %, 180 мг, 0,82 ммоль) в EtOH (3 мл) при 0 °C додавали розчин K2CO3 (230 мг, 1,7 ммоль) в H2O (1,5 мл). Розчин перемішували протягом 20 хв, потім додавали розчин сульфіліміну (D) (150 мг, 0,55 ммоль) в EtOH (2 мл) однією порцією. Реакційну суміш перемішували при 0 °C протягом 45 хв, після чого розчинник зливали в окрему колбу і концентрували з одержанням білої твердої речовини. Тверду речовину суспендували в CHCl 3, фільтрували і концентрували з одержанням чистого сульфоксиміну (3) у вигляді безбарвного 1 масла (72 мг, 44 %). H ЯМР (300 MГц, CDCl3) δ (1,5:1 суміш діастереомерів) 8,8 (с, 2H), 8,0 (д, 2H), 7,8 (д, 2H), 4,7 (кв, 1H), 4,6 (кв, 1H), 4,0-3,4 (м, с, 4H), 3,0-2,4 (м, 8H); LC-MS (ELSD): маса, + обчислена для C11H10F3N3OS, [M+H] 290,06. Знайдено 289,99. 4 Приклад III. Одержання (1-{6-[хлор(дифтор)метил]піридин-3-іл)етил)(метил)-оксидо-λ сульфаніліденціанаміду (4) 25 10 UA 106363 C2 5 10 15 20 25 30 35 (3E)-1-хлор-4-етокси-1,1-дифторбут-3-ен-2-он (7,36 г, 40 ммоль) розчиняли в сухому толуолі (40 мл) та обробляли 3-диметиламіноакрилoнітрилом (4,61 г, 48 ммоль) при кімнатній температурі. Розчин нагрівали при 100 °C протягом 3,5 годин. Потім розчинник видаляли при зниженому тиску і суміш, що залишилася, повторно розчиняли в DMF (20 мл), обробляли ацетатом амонію (4,62 г, 60 ммоль) і перемішували при кімнатній температурі протягом ночі. До реакційної суміші додавали воду та одержану суміш екстрагували сумішшю простий ефір: CH2CH2 (1:2, об./об.) два рази. Об'єднані органічні шари промивали розсолом, сушили, фільтрували і концентрували. Осад очищали на силікагелі з одержанням 3,1 г 6[хлор(дифтор)метил]нікотинонітрилу (А) у вигляді світлого масла з виходом 41 %. GC-MS: маса, + обчислена для C7H3ClF2N2, [M] 188. Знайдено 188. 6-[хлор(дифтор)метил]нікотинонітрил (А) (3,0 г 15,8 ммоль) розчиняли в безводному простому ефірі (25 мл) та охолоджували на крижаній бані. Шприцом додавали розчин 3 M броміду метилмагнію в гексані (6,4 мл, 19 ммоль). Після завершення додавання суміш перемішували при 0 °C протягом 5 годин, а потім при кімнатній температурі протягом 10 годин. Реакцію повільно гасили 1 н водним розчином лимонної кислоти при 0 °C, і одержану суміш перемішували при кімнатній температурі протягом 1 години. pH доводили зворотно до pH 7 насиченим водним розчином NaHCO3. Дві фази розділяли і водну фазу екстрагували етилацетатом два рази. Об'єднаний органічний шар промивали розсолом, сушили над безводним Na2SO4, фільтрували і концентрували. Суміш, що залишилася, очищали на силікагелі, елюючи 15 % розчином ацетону в гексані з одержанням 0,88 г бажаного продукту 1{6-[хлор(дифтор)метил]піридин-3-іл}етанону (В) у вигляді коричнюватого масла з виходом 30 %. + GC-MS: маса, обчислена для C8H6ClF2NO, [M] 205. Знайдено 205. До розчину 1-{6-[хлор(дифтор)метил]піридин-3-іл}етанону (В) (0,85 г, 4,14 ммоль) в MeOH (10 мл) при 0 °C додавали NaBH4 (0,16 г, 4,14 ммоль). Суміш перемішували протягом 30 хв і додавали 2 M водний розчин HCl до досягнення pH 7. Розчинник видаляли при зниженому тиску і суміш, що залишилася, екстрагували CH2Cl2 (2×50 мл). Об'єднаний органічний шар сушили над безводним Na2SO4, фільтрували, концентрували і сушили у вакуумі з одержанням 0,798 г аналітично чистого 1-{6-[хлор(дифтор)метил]-піридин-3-іл}етанолу (С) при GC-MS у вигляді + світло-жовтого масла з виходом 93 %. GC-MS: маса, обчислена для C8H6ClF2NO, [M] 207. Знайдено 207. 11 UA 106363 C2 5 До розчину 1-{6-[хлор(дифтор)метил]-піридин-3-іл}етанолу (0,78 г, 3,77 ммоль) в CH2Cl2 (40 мл) по краплях додавали тіонілхлорид (0,54 мл, 7,54 ммоль) при кімнатній температурі. Через 1 годину реакційну суміш повільно гасили насиченим водним розчином NaHCO3 і дві фази розділяли. Органічний шар сушили над Na2SO4, фільтрували, концентрували і сушили у вакуумі з одержанням 0,83 г неочищеного 2-[хлор(дифтор)метил]-5-(1-хлоретил)піридину (D) у вигляді коричневого масла з виходом 98 %, який безпосередньо використовували для реакції наступної + стадії. GC-MS: маса, обчислена для C8H7Cl2F2N, [M] 225. Знайдено 225. 10 15 20 25 30 До розчину 2-[хлор(дифтор)метил]-5-(1-хлоретил)піридину (D) (0,81 г, 3,6 ммоль) в етанолі (10 мл) додавали тіометоксид натрію (0,52 г, 7,4 ммоль) при перемішуванні однією порцією при 0 °C. Через 10 хв суміші дозволяли нагрітися до кімнатної температури і перемішували протягом ночі. Потім розчинник етанол видаляли при зниженому тиску та осад повторно відбирали в простий ефір/CH2Cl2 і розсіл. Дві фази розділяли і органічний шар екстрагували CH2Cl2 ще один раз. Об'єднані органічні шари сушили над безводним Na 2SO4, фільтрували, концентрували, очищали на силікагелі з використанням 5 % етилацетату в гексані з одержанням 0,348 г 2-[хлор(дифтор)метил]-5-[1-(метилтіо)етил]піридину (Е) з виходом 40 % GC-MS: маса, + обчислена для C9H10ClF2NS, [M] 237. Знайдено 237. До перемішуваного розчину 2-[хлор(дифтор)метил]-5-[1-(метилтіо)етил]піридину (Е) (0,32 г, 1,35 ммоль) і ціанаміду (0,058 г, 1,35 ммоль) в THF (7 мл) додавали йодбензолдіацетат (0,44 г, 1,35 ммоль) однією порцією при 0 °C і одержану суміш перемішували при цій температурі протягом 1 години, а потім при кімнатній температурі протягом 2 годин. Потім розчинник видаляли при зниженому тиску та одержану суміш розчиняли в CH2Cl2, промивали напівнасиченим розсолом, сушили над безводним Na 2SO4, фільтрували, концентрували та очищали на силікагелі з використанням 50 % ацетону в гексані з одержанням 0,175 г (1-{64 [хлор(дифтор)метил]піридин-3-іл}етил)(метил)-λ -сульфаніліденціанаміду (F) як світло-жовте 1 масло з виходом 48 %. H ЯМР (300 MГц, CDCl3) δ 8,71 (д, J=1,8 Гц, 1H), 7,91 (дд, J=8,4, 1,8 Гц, 12 UA 106363 C2 1H), 7,78 (д, J=8,4 Гц, 1H), 4,42 (кв, J=6,9 Гц, 1H), 2,64 (с, 3H), 1,92 (д, J=6,9 Гц, 3H); LC-MS: + маса, обчислена для C10H10CIF2N3S, [M+1] 278. Знайдено 278. 5 10 15 20 4 До переміщуваного розчину (1-{6-[хлор(дифтор)метил])(піридин-3-іл}етил)метил)-λ сульфаніліденціанаміду (F) (0,16 г, 0,6 ммоль) в етанолі (10 мл) додавали 20 % водний розчин карбонату калію (1,24 г, 1,8 ммоль) при 0 °C при перемішуванні. Після перемішування протягом 10 хв до суміші додавали 80 % mCPBA (0,19 г, приблизно 0,9 ммоль), і її перемішували при 0 °C протягом 2 годин, після чого реакцію гасили шпателем твердого тіосульфату натрію. Велику частину розчинника етанолу видаляли при зниженому тиску і додавали суміш насичений водний розчин NaHCO3:розсіл (1:1, об./об.) і суміш екстрагували хлороформом три рази. Об'єднані органічні шари сушили над Na 2SO4, фільтрували і концентрували. Осад очищали на силікагелі з використанням 35-50 % ацетону в гексані як елюенту з одержанням 0,092 г продукту (1-{64 [хлор(дифтор)метил]піридин-3-іл}етил)(метил)оксидо-λ -сульфаніліденціанаміду (4) у вигляді 1 безбарвного масла з виходом 57 %. H ЯМР (300 MГц, CDCl3) δ 8,79 (с, 1H), 8,09 (д, J=8,1 Гц, 1H), 7,80 (д, J=8,1 Гц, 1H), 4,73 (кв, J=12 Гц, 1H), 3,16 и 3,11 (2с, 3H, суміш двох діастереомерних α-CH3-груп між сульфоксиміновою та піридиновою частиною), 2,00 (д, J=7,2 + Гц, 3H); LC-MS: маса, обчислена для C10H10ClF2N3OS, [M-1] 292. Знайдено 292. 4 Приклад IV. Одержання [1-(6-трихлорметилпіридин-3-іл)етил](метил)-оксидо-λ сульфаніліденціанаміду (5) 25 30 35 40 Суміш 5-етилпіридин-2-карбонової кислоти (1,98 г, 13 ммоль), фенілфосфонового дихлориду (2,8 г, 14,3 ммоль), пентахлориду фосфору (7,7 г, 32 ммоль) перемішували і повільно нагрівали. Після утворення прозоро жовтої рідини суміш нагрівали до температури кип'ятіння із зворотним холодильником протягом ночі. Після охолоджування леткі речовини видаляли при зниженому тиску. Осад обережно виливали в насичений водний розчин карбонату натрію, охолоджений на крижаній бані. Потім водну фазу екстрагували CH 2Cl2 два рази. Об'єднаний органічний шар промивали розсолом, сушили над безводним Na 2SO4, фільтрували, концентрували і частково очищали на силікагелі, елюючи 10 % EtOAc в гексані з одержанням 2,7 г неочищеного продукту, який містить як 5-етил-2-(трихлорметил)піридин, так і 5-(1хлоретил)-2-(трихлорметил)піридин в співвідношенні приблизно 3:1 (дані GC, маса, обчислена + для C8H8Cl3N та C8H7Cl4N, [M] 223 та 257, відповідно. Знайдено 223 та 257 відповідно). Потім суміш вказаного вище неочищеного продукту (2,6 г) в тетрахлорметані (100 мл) обробляли 80 °C N-бромсукцинімідом (1,9 г, 11 ммоль) і бензоїлпероксидом (0,66 г, 0,275 ммоль), а потім кип'ятили із зворотним холодильником протягом ночі. Тверду речовину відфільтровували, фільтрат концентрували та одержаний осад очищали на силікагелі з 13 UA 106363 C2 використанням 4 % EtOAc в гексані з одержанням 1,0 г бажаного продукту 5-(1-брометил)-2(трихлорметил)піридин (А) у вигляді жовтої твердої речовини. Об'єднаний вихід для двох стадій + становив 25 %. GC-MS: маса, обчислена для C8H7BrCl3N, [M-1-Cl] 266. Знайдено 266. 5 10 Розчин 5-(1-брометил)-2-(трихлорметил)піридину (А) (0,95 г, 3,14 ммоль) в етанолі (15 мл) обробляли тіометоксидом натрію (0,44 г, 6,29 ммоль) порційно при 0 °C. Суміш перемішували при кімнатній температурі протягом ночі. Потім розчинник етанол видаляли при зниженому тиску та осад повторно відбирали в CH2Cl2 і розсіл. Дві фази розділяли і органічний шар сушили над безводним Na2SO4, фільтрували, концентрували. Осад очищали на силікагелі з використанням 5 % EtOAc в гексані з одержанням 0,57 г частково чистого 5-[1-(метилтіо)етил]-2(трихлорметил)піридину (В) з виходом неочищеного продукту 67 %. GC-MS: маса, обчислена + для C9H10Cl3NS, [M] 269. Знайдено 269. 15 20 25 30 До перемішуваного розчину 5-[1-(метилтіо)етил]-2-(трихлорметил)піридину (В) (0,55 г 2,3 ммоль) і ціанаміду (0,097 г, 2,3 ммоль) в THF (7 мл), охолодженому до 0 °C, додавали йодбензолдіацетат (0,75 г, 2,3 ммоль) однією порцією. Одержану суміш перемішували при 0 °C протягом 1 години, а потім при кімнатній температурі протягом 2 годин. Розчинник видаляли у вакуумі і одержану суміш очищали на силікагелі з використанням 50 % ацетону в гексані з 4 одержанням 0,254 г (1E)-метил-{1-[6-(трихлорметил)піридин-3-іл]етил}-λ 1 сульфаніліденціанаміду (С) у вигляді не зовсім білої твердої речовини з входом 40 %. H ЯМР для діастереомерної суміші (300 MГц, d6-ацетон) δ 8,87 (с, 1H), 8,21-8,25 (м, 2H), 4,65-4,76 (м, 1H), 2,86-2,66 (м, 3H), 1,88-1,92 (м, 3H). 4 До перемішуваного розчину (1E)-метил-{1-[6-(трихлорметил)піридин-3-іл]етил}-λ сульфаніліденціанаміду (С) (0,20 г, 0,65 ммоль) в етанолі (15 мл) додавали 20 % водний розчин карбонату калію (1,3 мл) при 0 °C, а потім додавали 80 % mCPBA. Одержану суміш перемішували протягом 2 годин при 0 °C, а потім гасили твердим тіосульфатом натрію. Велику частину розчинника випаровували і до суміші додавали суміш насичений водний розчин 14 UA 106363 C2 5 NaHCO3:розсіл 1:1 (об./об.) і суміш екстрагували хлороформом три рази. Об'єднані органічні шари сушили над безводним Na2SO4, фільтрували і концентрували. Осад очищали на силікагелі з використанням 40 % ацетону в гексані з одержанням 0,10 г [1-(6-трихлорметилпіридин-34 іл)етил](метил)оксидо-λ -сульфаніліденціанаміду (5) у вигляді безбарвного масла з виходом 1 50 %. H ЯМР (300 MГц, CDCl3) δ 8,83 (с, 1H), 8,12-8,23 (м, 1H), 5,15 (кв, 1H), 3,37 і 3,28 (2с, 3H, суміш двох діастереомерних α-CH3-груп між сульфоксиміновою і піридиновою частиною), 2,03 + (д, 3H); LC-MS: маса, обчислена для C10H12Cl3N3OS, [M+1] 328. Знайдено 328. 4 Приклад V. Одержання [1-(6-дифторметилпіридин-3-іл)етил](метил)-оксидо-λ сульфаніліденціанаміду (6) 10 15 20 25 30 До розчину 2-йод-5-бромпіридину (18,4 г, 65 ммоль) в THF (100 мл) при -15 °C по краплях додавали хлорид ізопропілмагнію (2 M, 35 мл, 70 ммоль) з такою швидкістю, щоб температура реакційної суміші не перевищувала 0 °C. Реакційну суміш перемішували при -15 °C. протягом 1 години, потім по краплях додавали DMF (7,5 мл, 97 ммоль) з такою швидкістю, щоб температура реакційної суміші не перевищувала 0 °C. Реакційну суміш перемішували протягом 30 хв, потім нагрівали до кімнатної температури протягом додаткової 1 години. Реакційну суміш зворотно охолоджували до 0 °C і по краплях додавали 2 Н HCl (80 мл), підтримуючи температуру нижче 20 °C. Після перемішування протягом 30 хв додавали 2 Н NaOH, доки не досягали pH 7. Потім органічний шар відділяли і водний шар екстрагували CH 2Cl2 (3×). Об'єднані органічні шари сушили над MgSO 4, концентрували і очищали флеш-хроматографією (SiO2, 10 % EtOAc/гексан) з одержанням 5-бромпіридин-2-карбальдегіду (А) у вигляді білої 1 твердої речовини (7,3 г, 60 %). H ЯМР (300 MГц, CDCl3) δ 10,0 (с, 1H), 8,9 (с, 1H), 8,0 (д, 1H), 7,8 (д, 1H). До охолодженого розчину 5-бромпіридин-2-карбальдегіду (А) (7,0 г, 38 ммоль) в CH2Cl2 (300 мл) при -78 °C додавали трифторид діетиламіносірки (DAST, 10,8 мл, 83 ммоль). Реакційній суміші дозволяли нагрітися до кімнатної температури протягом 6 годин, потім її повільно гасили H2O, промивали насиченим водним розчином NaHCO3 і сушили над Na2SO4. Концентрування та очищення на шарі силікагелю (елюент CH2Cl2) давали 5-бром-2-дифторметилпіридин (В) у 15 UA 106363 C2 1 вигляді коричневих кристалів (5,3 г, 67 %). H ЯМР (300 MГц, CDCl3) δ 8,8 (с, 1H), 8,0 (д, 1H), 7,6 (д, 1H), 6,6 (т, 1H). 5 10 До розчину 5-бром-2-дифторметилпіридину (В) (1,8 г, 8,6 ммоль) в THF (40 мл) при 25 °C по краплях додавали хлорид ізопропілмагнію (2M, 8,6 мл, 17 ммоль). Реакційній суміші дозволяли перемішатися протягом 2 годин, потім додавали DMF (660 мкл, 8,6 ммоль) і реакційну суміш перемішували протягом додаткових 22 годин. Реакційну суміш гасили 2 M HCl і підлуговували 1 M NaOH, доки не досягали pH 7. Органічний шар відділяли і водний шар екстрагували CH 2Cl2. Об'єднані органічні шари сушили над Na2SO4, концентрували та очищали флешхроматографією (10 % EtOAc/гексан) з одержанням 6-дифторметилпіридин-3-карбальдегіду (С) у вигляді жовтогарячого масла (320 мг, 24 %). 15 20 До розчину 6-дифторметилпіридин-3-карбальдегіду (С) (500 мг, 3,2 ммоль) в MeOH (10 мл) при 0 °C додавали NaBH4 (60 мг, 1,6 ммоль). Реакційній суміші дозволяли перемішатися протягом 30 хв, потім додавали 2 M HCl, доки не досягали pH 2. Одержаний розчин екстрагували CH2Cl2 (3×) та об'єднані органічні шари сушили над Na 2SO4 і концентрували з одержанням (6-дифторметилпіридин-3-іл)метанолу (D) у вигляді жовтогарячого масла (420 мг, 1 82 %), яке використовували на наступній стадії без подальшого очищення. H ЯМР (300 MГц, CDCl3) δ 8,6 (с, 1H), 7,9 (д, 1H), 7,6(д, 1H), 6,6 (т, 1H), 4,8 (с, 2H). 25 30 35 До розчину (6-дифторметилпіридин-3-іл)метанолу (D) (450 мг, 2,8 ммоль) в CH2Cl2 (10 мл) при кімнатній температурі додавали SO2Cl (230 мкл, 3,1 ммоль). Реакційній суміші дозволяли перемішатися протягом 1 години, потім реакційну суміш повільно гасили насиченим водним розчином NaHCO3. Водну фазу екстрагували CH2Cl2 (3×) та об'єднані органічні шари сушили над Na2SO4 і концентрували. Одержаний розчин екстрагували CH 2Cl2 (3×) та об'єднані органічні шари сушили над Na2SO4 і концентрували з одержанням 5-хлорметил-2-дифторметилпіридину (Е) у вигляді червонувато-коричневого масла (490 мг, 98 %), яке використовували на наступній 1 стадії без подальшого очищення. H ЯМР (300 MГц, CDCl3) δ 8,7 (с, 1H), 7,9 (д, 1H), 7,6 (д, 1H), 6,6 (т, 1H), 4,6 (с, 2H). 16 UA 106363 C2 5 10 15 До розчину тіометоксиду натрію (240 мг, 3,3 ммоль) в EtOH (10 мл) при кімнатній температурі додавали розчин 5-хлорметил-2-дифторметилпіридину (Е) (490 мг, 2,8 ммоль) в EtOH (3 мл). Реакційній суміші дозволяли перемішатися протягом 9 годин, потім реакційну суміш концентрували, відбирали в Et2O і промивали H2O. Органічну фазу сушили над Na 2SO4 і концентрували з одержанням 2-дифторметил-5-метилтіометилпіридину (F) у вигляді жовтогарячого масла (422 мг, 81 %), яке використовували на наступній стадії без подальшого 1 очищення. H ЯМР (300 MГц, CDCl3) δ 8,6 (с, 1H), 7,8 (д, 1H), 7,6 (д, 1H), 6,6 (т, 1H), 3,7 (с, 2H), 2,0 (с, 3H). 4 [(6-дифторметилпіридин-3-іл)метил](метил)-оксидо-λ -сульфаніліденціанамід (G) синтезували з 2-дифторметил-5-метилтіометилпіридину (F) в двох стадіях, як описано в 1 прикладах I-B та I-C. Його виділяли у вигляді білої твердої речовини (вихід 51 %). H ЯМР (300 MГц, CDCl3) δ 8,7 (с, 1H), 8,0 (д, 1H), 7,8 (д, 1H), 6,7 (т, 1H), 4,7 (дд, 2H), 3,2 (с, 3H); LC-MS + (ELSD): маса, обчислена для C9H10F2N3OS, [M+H] , 246. Знайдено 246. 20 4 25 30 [1-(6-дифторметилпіридин-3-іл)етил](метил)-оксидо-λ -сульфаніліденціанамід (6) 4 синтезували з (6-дифторметилпіридин-3-іл)метил](метил)-оксидо-λ -сульфаніліденціанаміду (G) в одній стадії, як описано в прикладі I. Його виділяли у вигляді безбарвного масла (вихід 74 %) і 1 суміші діастереомерів 1:1. H ЯМР (300 MГц, CDCl3) δ (суміш двох діастереомерів) 8,7 (с, 2H), 8,0 (д, 2H), 7,8 (д, 2H), 6,7 (т, 2H), 4,6 (кв, 2H), 3,1 (с, 3H), 3,0 (с, 3H), 2,0 (д, 6H). LC-MS (ELSD): + маса, обчислена для C10H12F2N3OS [M+H] , 260. Знайдено 260. 4 Приклад VI. Одержання [1-(6-пентафторетилпіридин-3-іл)етил](метил)оксидо-λ сульфаніліденціанаміду (7) 17 UA 106363 C2 5 10 15 20 25 (Е)-1-етокси-4,4,5,5,5-пентафторпент-1-ен-3-он (1,09 г, 5 ммоль) в безводному етилового ефірі (5 мл) обробляли 1-((Е)-3-метилтіобут-1-еніл)піролідином (0,85 г, 5 ммоль) в 2 мл сухого простого ефіру при -15 °C протягом 5 хв і реакцію продовжували протягом 20 хв. Потім температурі дозволяли збільшитися до кімнатної температури і реакцію продовжували протягом 3 годин. Розчинник видаляли при зниженому тиску і осад повторно розчиняли в безводному DMF (5 мл). Додавали ацетат амонію (0,58 г, 7,5 ммоль) і суміш перемішували при кімнатній температурі протягом вихідних днів. Додавали воду і суміш екстрагували простим ефіром три рази. Об'єднані органічні шари промивали розсолом, сушили над безводним Na 2SO4, фільтрували, концентрували і очищали на силікагелі, елюючи 8 % EtOAc в гексані (об./об.) з одержанням 0,16 г бажаного 5-(1-метилтіоетил)-2-пентафторетилпіридину (А) у вигляді + коричнюватого масла з виходом 12 %. GC-MS: маса, обчислена для C10H11F2N3S, [M] 271. Знайдено 271. До перемішуваного розчину 5-(1-метилтіоетил)-2- пентафторетилпіридину (А) (0,16 г, 0,6 ммоль) і ціанаміду (0,025 г, 0,6 ммоль) в THF (3 мл), охолодженому до 0 °C, додавали йодбензолдіацетат (0,19 г, 0,6 ммоль) однією порцією та одержану суміш перемішували при 0 °C протягом 2 годин, а потім при кімнатній температурі протягом ночі. Розчинник видаляли у вакуумі і одержану суміш суспендували в суміші розсіл:насичений розчин NaHCO 3 (9:1), а потім екстрагували CH2Cl2-EtOAc (1:1, об./об.) два рази. Об'єднані органічні шари сушили над Na 2SO4, фільтрували, концентрували і сушили з одержанням 0,16 г (1-{6-[пентафторетил]піридин-34 іл}етил)(метил)-λ -сульфаніліденціанаміду (В) у вигляді коричнюватого масла з виходом 85 %. + + LC-MS: маса, обчислена для C11H10F5N3S, [M] 311,28. Знайдено [M-1] 309,84. 18 UA 106363 C2 5 10 15 20 25 До перемішуваного розчину 80 % 3-хлорпероксибензойної кислоти (0,17 г, ca 0,8 ммоль) в етанолі (3 мл), охолодженому до 0 °C, додавали 20 % водний розчин карбонату калію (1,0 мл, 1,5 ммоль) і одержану суміш перемішували при 0 °C протягом 20 хв. Потім додавали (1-{64 [пентафторетил]піридин-3-іл}етил)(метил)-λ -сульфаніліденціанамід (В) однією порцією і суміш перемішували при 0 °C протягом 1 години. Реакцію гасили невеликим шпателем твердого тіосульфату натрію. Велику частину розчинника випаровували і додавали розсіл і суміш екстрагували CH2Cl2 три рази. Об'єднані органічні шари сушили над Na 2SO4, фільтрували і концентрували і осад очищали на силікагелі з використанням 10 % ацетону в CH2Cl2 (об./об.) з 4 одержанням 0,089 г [1-(6-пентафторетилпіридин-3-іл)етил](метил)оксидо-λ сульфаніліденціанаміду (7) у вигляді білої твердої речовини з виходом 54 %. LC-MS: маса, + + обчислена для C10H10F5N3OS, [M] 327,28. Знайдено [M-1] 325,83. 4 Приклад VII. Одержання 2-трифторметил-5-(1-{метил(оксидо)[оксидо(оксо)гідразоно]-λ сульфаніл}етил)піридину (8) До розчину 5-(1-метилтіоетил)-2-трифторметилпіридину (2,0 г, 9 ммоль) в CHCl3 (20 мл) при 0 °C додавали розчин mCPBA (2,1 г, 10 ммоль) в CHCl3 (25 мл) протягом 1,5 години. Розчин перемішували протягом додаткових 2 годин, потім його концентрували та очищали флешхроматографією (10 % MeOH/CH2Cl2) з одержанням 5-(1-метилсульфінілетил)-2трифторметилпіридину (А) у вигляді жовтого масла (710 мг, 33 %) як суміш діастереомерів ~2:1. 1 H ЯМР (300 MГц, CDCl3) δ (основний діастереомер) 8,7 (с, 1H), 7,8 (д, 1H), 7,7 (д, 1H), 4,0 (кв, 1H), 2,4 (с, 3H), 1,75 (д, 3H); (другорядний діастереомер), 8,6 (с, 1H), 7,9 (д, 1H), 7,7 (д, 1H), 3,8 + (кв, 1H), 2,3 (с, 3H), 1,8 (д, 3H); LC-MS (ELSD): маса, обчислена для C9H11F3NOS [M+H] , 238. Знайдено 238. 19 UA 106363 C2 5 10 До розчину 5-(1-метилсульфінілетил)-2-трифторметилпіридину (А) (600 мг, 2,5 ммоль) в CHCl3 (5 мл) при 0 °C додавали азид натрію (260 мг, 4,0 ммоль) і H2SO4 (1 мл). Реакційну суміш нагрівали до 55 °C доти, доки не спостерігали виділення газу, потім її зворотно охолоджували до кімнатної температури протягом ночі. Рідину видаляли в окрему колбу і сироп, що залишився, розчиняли в H2O, підлуговували Na2СO4 та екстрагували CH2Cl2. Об'єднані органічні шари сушили над Na2SO4, концентрували та очищали флеш-хроматографією з одержанням 5[1-(метилсульфонімідоїл)етил]-2-трифторметилпіридину (В) у вигляді жовтого масла (130 мг, 1 20 %) і суміші діастереомерів ~ 1:1 H ЯМР (300 MГц, CDCl3) δ (суміш діастереомерів) 8,8 (д, 2H), 8,0 (дд, 2H), 7,8 (д, 2H), 4,4 (м, 2H), 2,9 (с, 3H), 2,85 (с, 3H), 1,8 (м, 6H); LC-MS (ELSD): маса, + обчислена для C9H11F3N2OS [M] , 252. Знайдено 252. 15 20 25 До розчину 5-[1-(метилсульфонімідоїл)етил]-2-трифторметилпіридину (В) (100 мг, 0,4 ммоль) в CH2Cl2 (2 мл) при 0 °C по краплях додавали HNO3 (16 мкл, 0,4 ммоль). До одержаної суспензії додавали оцтовий ангідрид (750 мкл) і концентровану H 2SO4 (5 мкл) і суміш нагрівали до 40 °C. Суспензія повільно ставала однорідною протягом 15 хв. Потім розчинник видаляли і неочищений осад розчиняли в H2O. Додавали твердий Na2CO3 доти, доки значення pH не досягало 8 і водну фазу екстрагували CH2Cl2. Об'єднані органічні шари сушили над Na2SO4, концентрували та очищали флеш-хроматографією з одержанням 2-трифторметил-5-(14 {метил(оксидо)-[оксидо(окса)гідразоно]-λ -сульфаніл}етил)піридину (8) у вигляді жовтого масла 1 (22 мг, 19 %) і суміші діастереомерів 1:1. H ЯМР (300 MГц, CDCl3) δ (суміш діастереомерів) 8,8 (д, 2H), 8,1 (м, 2H), 7,8 (м, 2H), 5,1 (кв, 1H), 5,0 (кв, 1H), 3,3 (с, 3H), 3,25 (с, 3H), 2,0 (м, 6H); LC+ MS (ELSD): маса, обчислена для C9H11F3N3O3S, [M+H] , 298. Знайдено 298. 4 Приклад VIII. Одержання [6-(1,1-дифторетил)піридин-3-іл)етил](метил)оксидо-λ сульфаніліденціанаміду (9) 20 UA 106363 C2 5 10 До розчину 5-метил-2-ацетилпіридину (9,9 г, 73,3 ммоль) у висушеному за допомогою молекулярних сит CH2Cl2 (150 мл) додавали діетиламіносульфонілтрифторид (DAST) (25,8 г, 260 ммоль) при кімнатній температурі і суміш перемішували при кімнатній температурі протягом ночі. Додавали додатковий DAST (12 г, 74 ммоль) і реакцію продовжували протягом додаткових двох діб, після чого додавали додатковий DAST (3,8 г, 23 ммоль) і реакцію продовжували протягом додаткових 3 діб. Реакцію повільно гасили насиченим розчином NaHCO 3 при 0 °C, потім органічну фазу відділяли, сушили над Na2SO4, фільтрували і концентрували. Осад очищали на силікагелі, елюючи 8 % EtOAc в гексані з одержанням 3,91 г 2-(1,1-дифторетил)-5метилпіридину (А) у вигляді світло-коричневого масла з виходом 34 %. GC-MS: маса, обчислена + для C8H9F2N, [M] 157. Знайдено 157. 15 20 25 Суміш 2-(1,1-дифторетил)-5-метилпіридину (А) (2,0 г, 12,7 ммоль), N-бромсукциніміду (2,2 г, 12,7 ммоль) і бензоілпероксиду (0,15 г, 0,63 ммоль) в тетрахлорметані (100 мл) кип'ятили із зворотним холодильником протягом ночі. Тверду речовину видаляли фільтрацією, потім фільтрат концентрували. Осад повторно розчиняли в етанолі (40 мл) і додавали тіометоксид натрію (1,33 г, 19 ммоль) при кімнатній температурі і перемішували протягом 3 годин. Розчинник видаляли при зниженому тиску і суміш, що залишилася, розчиняли в CH 2Cl2 і воді. Після відділення органічний шар сушили над Na2SO4, фільтрували і концентрували. Неочищений продукт 2-(1,1-дифторетил)-5-метилтіометилпіридин (В) був чистим на 94 % при GC/MS, і його використовували безпосередньо для наступної реакції без подальшого очищення. GG-MS: + маса, обчислена для C9H11F2NS [M] 203. Знайдено 203. 21 UA 106363 C2 5 10 15 20 25 До перемішуваного розчину 2-(1,1-дифторетил)-5- метилтіометилпіридину (В) (1,22 м. 6,0 ммоль) і ціанаміду (0,25 г, 6,0 ммоль) в THF (7 мл), охолодженому до 0 °C, додавали йодбензолдіацетат (1,93 г, 6,0 ммоль) однією порцією і одержану суміш перемішували при 0 °C протягом 1 години, а потім при кімнатній температурі протягом 2 годин. Розчинник видаляли у вакуумі та одержану суміш очищали на силікагелі з використанням 60 % ацетону в гексані 4 (об./об.) з одержанням 1,22 г (6-(1,1-дифторетилпіридин-3-іл)метил](метил)-λ сульфаніліденціанаміду (С) (вихід 84 %) у вигляді коричнюватого масла, яке перетворювалося в коричнювату тверду речовину після стояння в холодильнику протягом ночі. LC-MS: маса, + + обчислена для C10H11F2N3S, [M] 243,28. Знайдено [M+1] 244,11. У 100-мл круглодонну колбу, обладнану магнітною мішалкою, ділильною лійкою і термометром, вміщували перйодат натрію (0,95 г, 4,44 ммоль) і воду (12 мл). Після розчинення твердої речовини додавали 15 мл CH2Cl2, а потім гідрат трихлориду рутенію (0,033 г, 0,15 4 ммоль). По краплях додавали (6-(1,1-дифторетилпіридин-3-іл)метил](метил)-λ сульфаніліденціанамід (С) (0,72 г, 2,96 ммоль), розчинений в 5 мл CH 2Cl2 протягом 30 хв. Суміш швидко перемішували при кімнатній температурі протягом 1,5 години, а потім фільтрували через фільтрувальний папір для видалення частини нерозчинних речовин. Потім суміш розділяли в ділильній лійці, після чого додавали етилацетат для сприяння розділенню. Водну фазу екстрагували CH2Cl2 два рази. Об'єднані органічні шари промивали розсолом, сушили над сухим Na2SO4, фільтрували, концентрували і швидко очищали на силікагелі з 70 % ацетоном в гексані з одержанням 0,652 г бажаного продукту (6-(1,1-дифторетилпіридин-34 іл)метил](метил)оксидо-λ -сульфаніліденціанаміду (D) у вигляді білої твердої речовини з + + виходом 87 %. LC-MS: маса, обчислена для C10H11F2N3OS, [M] 259,28. Знайдено [M+1] 260,02. 30 35 4 До розчину (6-(1,1-дифторетилпіридин-3-іл)метил](метил)оксидо-λ -сульфаніліденціанаміду (D) (0,55 г, 2,0 ммоль) та HMPA (0,09 мл, 0,55 ммоль) в 20 мл безводного THF по краплях додавали 0,5 M біс(триметилсиліл)амід калію в толуолі (4,4 мл, 2,2 ммоль) при -78 °C. Через 45 хв додавали йодметан (0,14 мл, 2,2 ммоль) однією порцією через шприц. Через десять хвилин температурі дозволяли зрости до 0 °C і суміш продовжували перемішувати протягом 1,5 години. 22 UA 106363 C2 5 10 15 20 25 Реакційну суміш гасили насиченим водним розчином NH 4Cl, розбавляли розсолом, екстрагували один раз EtOAc та CH2Cl2. Об'єднані органічні шари сушили над Na2SO4, фільтрували і концентрували. Осад очищали препаративною ВЕРХ з одержанням 0,15 г 4 бажаного [6-(1,1-дифторетил)піридин-3-іл)етил](метил)оксидо-λ -сульфаніліденціанаміду (9) з + + виходом 26 %. LC-MS: маса, обчислена для C11H13F2N3OS, [M] 273,31. Знайдено [M+1] 274,21. Подальші деталі, що стосуються сполук прикладів I-VIII та інших споріднених сполук, представлені в публікації патентної заявки США 2007/0203191 A1, вміст якої включений в цей документ як посилання в повному обсязі. Потрібно розуміти, що композиції за цим винаходом можуть включати сполуки, які можуть існувати як один або декілька стереоізомерів. Різні стереоізомери включають геометричні ізомери, діастереомери та енантіомери. Таким чином, композиції за даним винаходом можуть включати сполуки у вигляді рацемічних сумішей, окремих стереоізомерів та оптично активних сумішей. Фахівцям в даній галузі буде зрозуміло, що один стереоізомер може бути більш активним, ніж інші. Окремі стереоізомери та оптично активні суміші можна одержувати селективними способами синтезу, загальноприйнятими способами синтезу з використанням розділених вихідними матеріалів або загальноприйнятими способами розділення. Як більш конкретний приклад, що стосується стереоізомерів, сполука {1-[64 (трифторметил)піридин-3-іл]етил}(метил)оксидо-λ -сульфаніліденціанамід, описана в прикладі I, включає чотири окремих стереоізомери. Ці чотири стереоізомери визначають дві пари діастереомерів, які для цілей цього документа позначені як групи діастереомерів А та B. Група 4 діастереомерів А визначається {(R)-1-[6-(трифторметил)піридин-3-іл]етил}-(R)-(метил)оксидо-λ 1 сульфаніліденціанамідом (A ) та {(S)-1-[6-(трифторметил)піридин-3-іл]етил}-(S)-(метил)оксидо4 2 λ -сульфаніліденціанамідом (A ), як представлено нижче. Група діастереомерів А 4 1 4 2 4 1 {(R)-1-[6-(трифторметил)піридин-3-іл]етил}-(R)-(метил)оксидо-λ -сульфаніліденціанамід (A ) 30 35 {(S)-1-[6-(трифторметил)піридин-3-іл]етил}-(S)-(метил)оксидо-λ -сульфаніліденціанамід (A ) Група діастереомерів В визначається {(R)-1-[6-(трифторметил)піридин-3-іл]етил}-(S)4 1 (метил)оксидо-λ -сульфаніліденціанамідом (B ) та {(S)-1-[6-(трифторметил)піридин-3-іл]етил}4 2 (R)-(метил)оксидо-λ -сульфаніліденціанамідом (B ), як зазначено нижче. Група діастереомерів В {(R)-1-[6-(трифторметил)піридин-3-іл]етил}-(S)-(метил)оксидо-λ -сульфаніліденціанамід (B ) 23 UA 106363 C2 4 5 10 15 20 25 30 35 40 45 50 2 {(S)-1-[6-(трифторметил)піридин-3-іл]етил}-(R)-(метил)оксидо-λ -сульфаніліденціанамід (B ) 4 Згідно з вихідним синтезом сполуки {1-[6-(трифторметил)піридин-3-іл]етил}(метил)оксидо-λ сульфаніліденціанаміду, групи діастереомерів (А) та (В) присутні в суміші приблизно 1:2. Однак було відкрито, що з часом відбувається взаємоперетворення між групами діастереомерів (А) та (В). Наприклад, як зазначено в прикладі IX нижче, присутність групи діастереомерів А значно зростає внаслідок впливу підвищених температур з часом, тим самим, відображаючи проблеми хімічної і фізичної стабільності композицій, що включають сполуку {1-[6-(трифторметил)піридин4 3-іл]етил}(метил)оксидо-λ -сульфаніліденціанамід. У цей час несподівано відкрито, що додавання невеликих кількостей однієї або декількох органічних кислот або їх солей до сполуки формули (I) по суті стабілізує співвідношення між стереоізомерами сполуки. В одній формі додавання органічної кислоти зберігає співвідношення між двома парами діастереомерів. В одній конкретній формі органічна кислота включає щонайменше одну функціональну групу карбонової кислоти. Як використовують в цьому документі, "функціональна група карбонової кислоти" належить до функціональної групи, що має структурну формулу . Приклади органічних кислот щонайменше з однією функціональною групою карбонової кислоти включають карбонову кислоту, мурашину кислоту, оцтову кислоту, стеаринову кислоту, молочну кислоту, маделінову кислоту, акрилову кислоту, олеїнову кислоту, бензойну кислоту, лимонну кислоту, саліцилову кислоту, виннокам'яну кислоту, бурштинову кислоту, фталеву кислоту, малонову кислоту, метакрилову кислоту, щавлеву кислоту, ізолимонну кислоту, кротонову кислоту, гліцеринову кислоту, п-толуілову кислоту, пропанову кислоту, гептанову кислоту, бутанову кислоту, тартронову кислоту, нітрооцтову кислоту, ціанооцтову кислоту, метоксіоцтову кислоту, фтороцтову кислоту, хлороцтову кислоту, бромоцтову кислоту, дихлороцтову кислоту, глутарову кислоту, трихлороцтову кислоту, яблучну кислоту, гексанову кислоту, тримелітову кислоту, тримезинову кислоту, аконітинову кислоту, трикарбалілову кислоту і галову кислоту. В іншому варіанті здійснення органічна кислота включає три функціональні групи карбонових кислот. Приклади органічних кислот з трьома групами карбонових кислот включають лимонну кислоту, ізолимонну кислоту, тримелітову кислоту, тримезинову кислоту, трикарбалілову кислоту, аконітинову кислоту та їх суміші. Як використовують в цьому документі, "сіль" органічної кислоти відноситься до сполуки, в якій водень кислоти замінений металом або його еквівалентами при збереженні тієї самої органічної групи як органічної кислоти. Приклади металів, які можуть зустрічатися в солях, включають, але не обмежуються ними, калій, натрій, літій, кальцій та алюміній. В одній конкретній формі сіль являє собою цитратну сіль лимонної кислоти. Необмежуючі приклади цитратних солей включають цитрат натрію, дигідрат трицитрату натрію, дигідрат цитрату натрію, цитрат калію, цитрат літію та їх суміші. В іншій формі сіль являє собою гідрофталат калію, який є сіллю фталевої кислоти. Крім того, передбачається, що сіль також може бути надана в одній або декількох альтернативних формах. В одному варіанті здійснення композиція включає одну сполуку або суміш сполук формули (I) та органічну кислоту або її сіль. В одній формі композиція включає співвідношення по масі між сполукою формули (I) та органічною кислотою або її сіллю від приблизно 300:1 до приблизно 10:1. В іншій формі співвідношення по масі між сполукою формули (I) та органічною кислотою або її сіллю становить від приблизно 280:1 до приблизно 20:1. В іншій формі співвідношення по масі між сполукою згідно з формулою (I) та органічною кислотою або її сіллю становить від приблизно 260:1 до приблизно 30:1. В іншій формі співвідношення по масі між сполукою формули (I) та органічною кислотою або її сіллю становить від приблизно 250:1 до приблизно 40:1. В іншій формі співвідношення по масі між сполукою формули (I) та органічною кислотою або її сіллю становить від приблизно 245:1 до приблизно 45:1. В іншій формі 24 UA 106363 C2 5 10 15 20 25 30 35 40 45 50 55 60 співвідношення по масі між сполукою формули (I) та органічною кислотою або її сіллю становить від приблизно 240:1 до приблизно 48:1. В іншому варіанті здійснення спосіб включає надання композиції, яка включає сполуку формули (I) в суміші ізомерів. Більш конкретно, суміш ізомерів визначається двома парами діастереомерів. В одній формі цього варіанту здійснення дві пари діастереомерів присутні в співвідношенні приблизно 2:1. Однак передбачені альтернативні значення для співвідношення між діастереомерами. Наприклад, дві пари діастереомерів можуть бути присутніми в співвідношенні від приблизно 1:4 до приблизно 12:1, від приблизно 1:2 до приблизно 8:1 або від приблизно 1:1 до приблизно 4:1. Крім того, спосіб включає додавання органічної кислоти або її солі в композицію. В одному аспекті цього варіанту здійснення додавання органічної кислоти або її солі в композицію по суті зберігає співвідношення між двома парами діастереомерів протягом періоду часу. Необмежуючі приклади періоду часу, протягом якого зберігається співвідношення, можуть являти собою щонайменше два тижні, щонайменше один місяць, щонайменше три місяці, щонайменше шість місяців або щонайменше 12 місяців або більше. Однак передбачаються альтернативні величини для періоду часу, протягом якого зберігається співвідношення. В іншому аспекті цього варіанту здійснення співвідношення між двома парами діастереомерів по суті зберігається протягом щонайменше двох тижнів, коли композиція знаходиться при температурах вище температури навколишнього середовища, яка, як використовують в цьому документі, означає 18-28 °C. Як один необмежуючий приклад температура вище температури навколишнього середовища знаходиться в діапазоні 50-60 °C, хоча передбачаються альтернативні діапазони температур вище температури навколишнього середовища, а також період часу, протягом якого співвідношення зберігаються. Композиції за цим винаходом також можуть бути надані з фітологічно прийнятним інертним носієм у вигляді спреїв, форм для місцевої обробки, гелів, покриття для насіння, мікрокапсул, системного введення, приманки, бирок, болюсів, розпилювальних засобів, фумігантних аерозолів, порошку та багатьох інших. Як правило, склади застосовують як водні суспензії або емульсії. Такі суспензії або емульсії одержують з розчинних у воді, суспендованих у воді або емульгованих складів, які є (1) твердими речовинами, звичайно відомими як змочувані порошки або дисперговані у воді гранули або (2) рідинами, звичайно відомими як емульговані концентрати, водні емульсії, суспензійні концентрати і суспендовані у воді капсули, що містять композицію. Як буде добре зрозуміло, можна використовувати будь-який матеріал, до якого можна додавати композицію, за умови, що вони призводять до бажаної застосовності без значного перешкоджання активності композиції як пестициду. Змочувані порошки, які можуть бути пресованими, екструдованими або переробленими шляхом диспергування у воді з подальшим розпилювальним сушінням або агломерації в псевдозрідженому шарі з утворенням диспергованих у воді гранул, включають однорідну суміш композиції, інертний носій і поверхнево-активні речовини. Концентрація композиції в змочуваному порошку, як правило, становить від 10 % до 90 % по масі з розрахунку на загальну масу змочуваного порошку, більш переважно від 25 мас. % до 75 мас. %. При одержанні змочуваних порошкових складів, композицію можна змішувати з будь-якою тонко подрібненою твердою речовиною, такою як профіліт, тальк, крейда, гіпс, фулерова земля, бентоніт, аттапульгіт, крохмаль, казеїн, глютен, монтморилонітові глини, діатомітова земля, очищені силікати або схожі з ними. При таких діях тонко подрібнений носій і поверхнево-активні речовини, як правило, змішують з композицією і подрібнюють. Емульговані концентрати композиції мають традиційну концентрацію, таку як від 5 мас. % до 75 мас. % композиції, в придатній рідині, з розрахунку на загальну масу концентрату. Композицію розчиняють в інертному носії, який являє собою воду, розчинник, що змішується з водою, розчинник, що не змішується з водою, або їх суміш, і емульгатори. Концентрати можна розбавляти водою і маслом з одержанням розпилювальних сумішей в формі емульсії типу "масло-в-воді". Придатні органічні розчинники включають ароматичні речовини, особливо нафталенові та олефінові фракції нафти з високою температурою кипіння, такі як важка ароматична нафта. Також можна використовувати інші органічні розчинники, наприклад, такі як терпенові розчинники, що включають похідні смол, аліфатичні кетони, такі як циклогексанон, і складні спирти, такі як 2-етоксиетанол. Емульгатори, які можна переважно використовувати в даному винаході, можуть легко визначити фахівці в даній галузі, і вони включають різні неіонні, аніонні, катіонні та амфотерні емульгатори, або суміш двох або більше емульгаторів. Приклади неіонних емульгаторів, придатних для одержання емульгованих концентратів, включають простий ефір поліалкіленгліколю і продукти конденсації алкіл- та арилфенолів, аліфатичних спиртів, аліфатичних амінів або жирних кислот з оксидом етилену, оксиди пропілену, такі як 25 UA 106363 C2 5 10 15 20 25 30 35 40 45 50 55 етоксильовані алкілфеноли і складні ефіри карбонових кислот, солюбілізовані поліолами або поліоксіалкіленами. Катіонні емульгатори включають четвертинні сполуки амонію та солі жирних амінів. Аніонні емульгатори включають розчинні в маслі солі (наприклад, сіль кальцію) алкіларилсульфонових кислот, розчинні в маслі солі або сульфатовані прості ефіри полігліколю і підходящі солі фосфатованого простого ефіру полігліколю. Типові органічні рідини, які можна використовувати при одержанні емульгованих концентратів композиції, являють собою ароматичні рідини, такі як ксилол, фракції пропілбензолу; або змішані нафталінові фракції, мінеральні масла, заміщені ароматичні органічні рідкі речовини, такі як діоктилфталат; керосин; діалкіламіди різних жирних кислот, зокрема, диметиламіди жирних гліколів і похідних гліколів, такі як н-бутиловий ефір, етиловий ефір або метиловий ефір діетиленгліколю, і метиловий ефір триетиленгліколю тощо. Також при одержанні емульгованого концентрату можна використовувати суміші двох або більше органічних рідин. Переважні органічні рідини включають ксилол і фракції пропілбензолу, причому найбільш переважними є фракції пропілбензолу. У рідких складах звичайно використовують поверхнево-активні емульгатори в кількості від 0,1 до 20 % по масі з розрахунку на загальну масу емульгатора з композицією. Склади, що містять композицію за даним винаходом, також можуть містити інші сумісні домішки, наприклад, мітициди, інсектициди, регулятори росту рослин, інші фунгіциди та інші біологічно активні сполуки, що використовуються в сільському господарстві. Водні суспензії містять суспензії композиції, дисперговані у водному носії в концентрації в діапазоні від 5 до 50 мас. % з розрахунку на загальну масу водної суспензії. Водні суспензії приготовляють енергійним домішуванням композиції за даним винаходом, або її розчину, до носія, що складається з води і поверхнево-активних речовин, вибраних з типів поверхневоактивних речовин, розглянутих вище. Також можна додавати інші компоненти, такі як неорганічні солі і синтетичні або природні камеді, для збільшення щільності і в'язкості водного носія. Приклади водних суспензій включають суспензії масляних крапель (EW), твердих речовин (SC) і капсул (CS). Композицію також можна застосовувати як гранулярні склади, які особливо придатні для застосувань на грунті. Гранулярні склади звичайно містять від 0,5 до 10 мас. % з розрахунку на загальну масу гранулярного складу композиції, диспергованого в інертному носії, який складається повністю або переважно з грубо подрібненого інертного матеріалу, такого як атапульгіт, бентоніт, діатоміт, глина або схожа недорога речовина. Такі склади звичайно приготовляють розведенням композиції в придатному розчиннику і нанесенням її на гранулярний носій, який був заздалегідь сформований до відповідного розміру частинок, в діапазоні від 0,5 до 3 мм. Придатний розчинник являє собою розчинник, в якому сполука є по суті або повністю розчинною. Такі склади також можна одержувати одержанням густої маси або пасти з носія і композиції і розчинника, і дробленням їх і висушуванням з одержанням бажаної гранулярної частинки. Композицію за даним винаходом також можна застосовувати як дисперговані у воді гранули або сухий сипкий склад. Дисперговані у воді гранули, як правило, містять від 10 до 70 % композиції, з розрахунку на загальну масу складу. Такі склади звичайно одержують змішуванням і/або розпиленням суміші на носій з додаванням диспергучої і/або змочувальної речовини, і комбінуванням з водою з утворенням суміші, придатної для подальшої переробки з використанням добре відомих технологій грануляції, таких як грануляція в чаші, екструзія, розпилювальне сушіння, агломерація в псевдозрідженому шарі тощо. Пилоподібну речовину, яка містить композицію, можна одержувати однорідним змішенням композиції з придатним пилоподібним сільськогосподарським носієм, наприклад, таким як каолінова глина, розтерта вулканічна порода тощо. Пилоподібні речовини можуть придатним чином містити від 1 до 10 мас. % композиції з розрахунку на загальну масу порошку. Пилоподібні речовини також можна одержувати шляхом просочення композицією носія аналогічно тому, як описано для гранул вище. Склади за даним винаходом, крім того, можуть містити допоміжні поверхнево-активні речовини для посилення нашарування, змочування і проникнення композиції в намічені культуру та організм. Ці допоміжні поверхнево-активні речовини необов'язково можна використовувати як компонент складу або як суміш в місткості. Кількість допоміжної поверхневоактивної речовини, як правило, варіює від 0,01 до 1,0 % за об'ємом з розрахунку на об'єм води, що розпилюється, переважно від 0,05 до 0,5 об. %. Придатні допоміжні поверхнево-активні речовини включають, але не обмежуються ними, етоксильовані нонілфеноли, етоксильовані синтетичні або природні спирти, солі складних ефірів або сульфобурштинових кислот, 26 UA 106363 C2 5 10 15 20 етоксильовані кремнійорганічні речовини, етоксильовані жирні аміни і суміші поверхневоактивних речовин з мінеральними або рослинними маслами. Приклад IX. Стабільність композиції, яка включає {1-[6-(трифторметил)піридин-34 іл]етил}метил)оксидо-λ -сульфаніліденціанамід Композицію (i), що має загальний об'єм 1 літр (загальна маса ~1100 г), одержували, спочатку додаючи деіонізовану воду в чисту склянку, обладнану механічною мішалкою. Потім в склянку додавали наступні інгредієнти, не в формі частинок, при постійному перемішуванні: 3,5 г Agnique® DFM 112S, піногасника на основі кремнію, комерційно доступного від Cognis Group, з управлінням в Monheim, Німеччина; 20 г Тersperse® 2500, полімерної поверхнево-активної речовини, комерційно доступної від Huntsman Performance Products, 10003 Woodloch Forest Drive, The Woodlands, TX 77380; 30 г Morwet® D-360, поверхнево-активної речовини, комерційно доступної від Akzo Nobel Surfactants, 525 W. Van Buren St., Chicago, IL 60607; 20 г Ethylan® NS 500 LQ, поверхнево-активної речовини, доступної від Akzo Nobel Surfactants, 525 W. Van Buren St., Chicago, IL 60607; 40 г пропіленгліколю; 1 г Proxel® GXL, протимікробного розчину, комерційно доступного від Arch Chemicals, Inc., 1955 Lake Drive, Suite 100, Smyrna, GA 30080. 4 Потім в склянку додавали 240 г {1-[6-(трифторметил)піридин-3-іл]етил}(метил)оксидо-λ сульфаніліденціанаміду, а потім додавали 10 г Avicel® CL-611, стабілізатора, комерційно доступного від FMC BioPolymer, 1735 Market Street, Philadelphia, PA 19103, і 2 г Kelzan, ксантанової смоли, комерційно доступної від CP Kelco, 1000 Parkwood Circle, Suite 1000, Atlanta, GA 30339. Інгредієнти перемішували, доки не одержували однорідну суміш. Потім суміш подрібнювали за допомогою кульового млина до середнього розміру частинок 3-5 мкм. Кінцевий склад композиції (i) представлений в таблиці 1. Таблиця 1 Композиція (i) Інгредієнти г/л 4 {1-[6-(трифторметил)піридин-3-іл]етил}(метил)оксидо-λ -сульфаніліденціанамід 240 Agnique® DFM 112S 3,5 Agnique® DFM 112S 10 Tersperse® 2500 20 Morwet® D-360 30 Ethylan® NS 500 LQ 20 Пропіленгліколь 40 Proxel® GXL 1 Kelzan® 2 Вода Решта частини 25 30 Два 20-мл зразка композиції (i) збирали і окремо зберігали при кімнатній температурі і 54 °C протягом двох тижнів в закритих скляних банках місткістю 1 унція (28,3 г). Через два тижні зразки збирали та аналізували хроматографією для вимірювання співвідношення між групами А 4 та В діастереомерів {1-[6-(трифторметил)піридин-3-іл]етил}(метил)оксидо-λ сульфаніліденціанаміду в композиції (i). Результати хроматографічного аналізу представлені в таблиці 2. Таблиця 2 4 Співвідношення діастереомерів {1-[6-(трифторметил)піридин-3-іл]етил}(метил)оксидо-λ сульфаніліденціанаміду в композиції (i) після зберігання протягом двох тижнів Група діастереомерів А В 35 Кімнатна температура, % 37,7 62,3 54°С, % 98,5 1,5 Приклад X. Стабільність композицій, яка включають {1-[6-(трифторметил)піридин-34 іл]етил)(метил)оксидо-λ -сульфаніліденціанамід і його органічну кислоту або сіль. Композиції (ii)-(xii), об'єм кожної з яких становив 1 літр (~1100 г), приготовляли окремо так, як вказано вище відносно прикладу IX. Кожна з композицій (ii)-(xii) включала інгредієнти композиції (i) і, за винятком води, кожний інгредієнт був наданий в одній і тій самій кількості. Однак на 27 UA 106363 C2 5 противагу одержанню композиції (i) до кожної з композицій (ii)-(xii) додавали невелику кількість органічної кислоти або солі органічної кислоти перед додаванням 240 г {1-[64 (трифторметил)піридин-3-іл]етил}(метил)оксидо-λ -сульфаніліденціанаміду, 10 г Avicel® CL-611 та 2 г Kelzan. Кінцеві склади композицій (ii)-(xii) вказані в таблиці 3, відносно конкретної органічної кислоти/солі та їх кількості для кожної з композицій (ii)-(xii), вказаних в таблиці 4. Таблиця 3 Композиції (ii)-(xii) Інгредієнти г/л 4 {1-[6-(трифторметил)піридин-3-іл]етил}(метил)оксидо-λ -сульфаніліденціанамід 240 Agnique® DFM 112S 3.5 Avicel® CL-611 10 Tersperse® 2500 20 Morwet® D-360 30 Ethylan® NS 500 LQ 20 Пропіленгліколь 40 Proxel® GXL 1 Kelzan® 2 Органічна кислота/сіль ** Вода Решта частини Таблиця 4 Органічні кислоти/солі композицій (ii)-(xii) Композиція ii iii iv v vi vii viii ix х xi xii 10 15 Органічна кислота/сіль лимонна кислота лимонна кислота лимонна кислота Гідрофталат калію Гідрофталат калію DL-яблучна кислота виннокам'яна кислота малеїнова кислота малонова кислота молочна кислота бурштинова кислота г/л 1 2 5 1 5 1,3 1,5 1,2 1 1 1,2 Два 20-мл зразка кожної з композицій (ii)-(xii) відбирали і зберігали окремо при 5 °C та 54 °C протягом двох тижнів в закритих скляних банках місткістю 1 унція (28,3 г). Через два тижні відбирали зразки та аналізували їх хроматографією для вимірювання співвідношення між 4 групами діастереомерів А та В {1-[6-(трифторметил)піридин-3-іл]етил}(метил)оксидо-λ сульфаніліденціанаміду в композиціях (ii)-(xii). Результати хроматографічного аналізу представлені в таблиці 5, в якій також вказане значення pH кожної композиції і відсоток по масі, з розрахунку на загальну масу відповідної композиції, сполуки {1-[6-(трифторметил)піридин-34 іл]етил}(метил)оксидо-λ -сульфаніліденціанаміду. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюStable sulfoximine-insecticide compositions
Автори російськоюQin, Kuide, Boucher, Raymond, E.
МПК / Мітки
МПК: A01N 25/22, A01P 7/04, C07D 213/26, A01N 51/00, C07D 409/04, C07D 213/34, A01N 47/40
Мітки: композиції, сульфоксиміну, основі, інсектицидні, стабільні
Код посилання
<a href="https://ua.patents.su/39-106363-stabilni-insekticidni-kompozici-na-osnovi-sulfoksiminu.html" target="_blank" rel="follow" title="База патентів України">Стабільні інсектицидні композиції на основі сульфоксиміну</a>
Попередній патент: Спосіб підвищення виходу сахарози при сільськогосподарському вирощуванні цукрового буряка та цукрової тростини
Наступний патент: Спосіб одержання шоколадної крихти
Випадковий патент: Атракціон "магнетик-xxl"