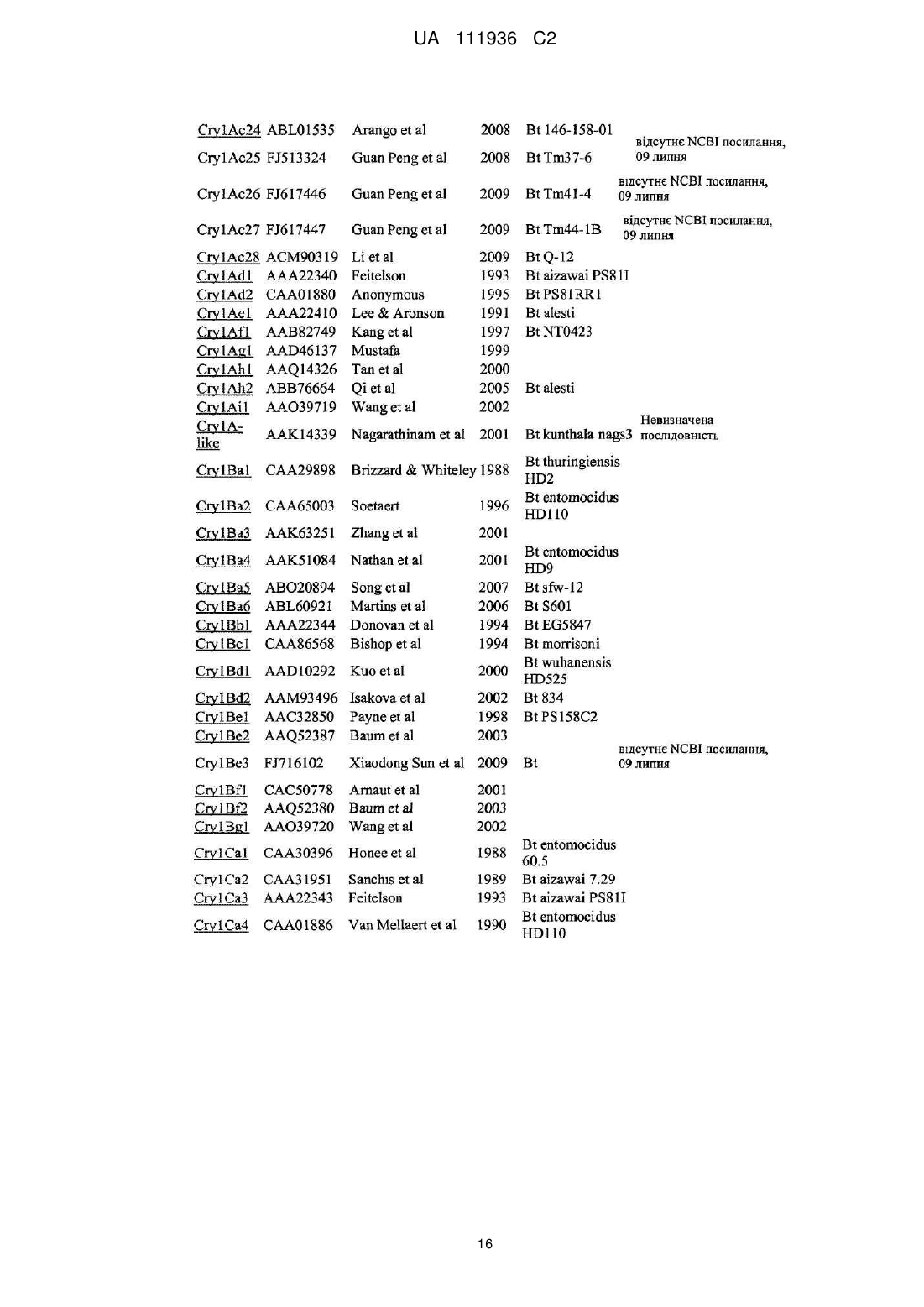
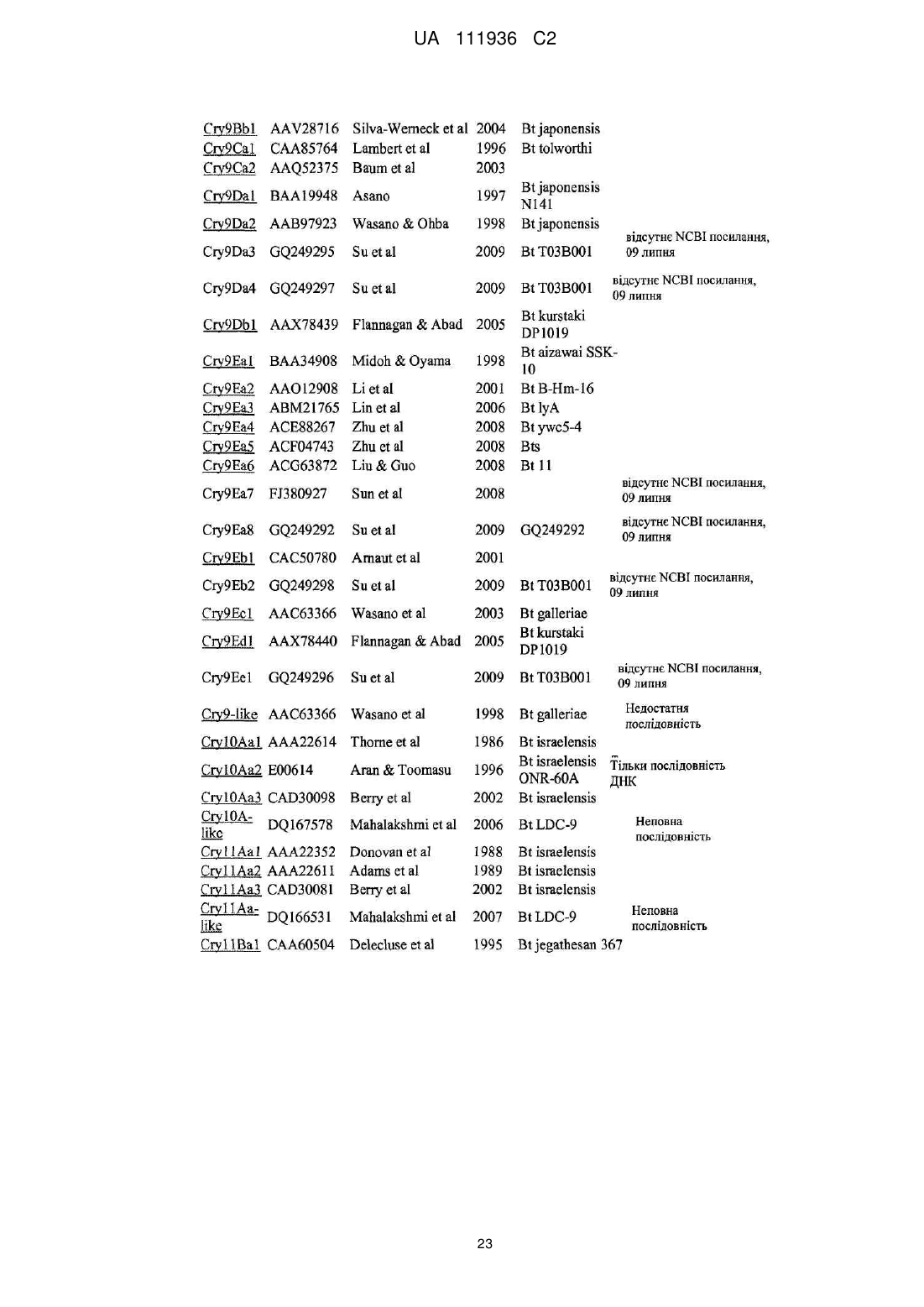
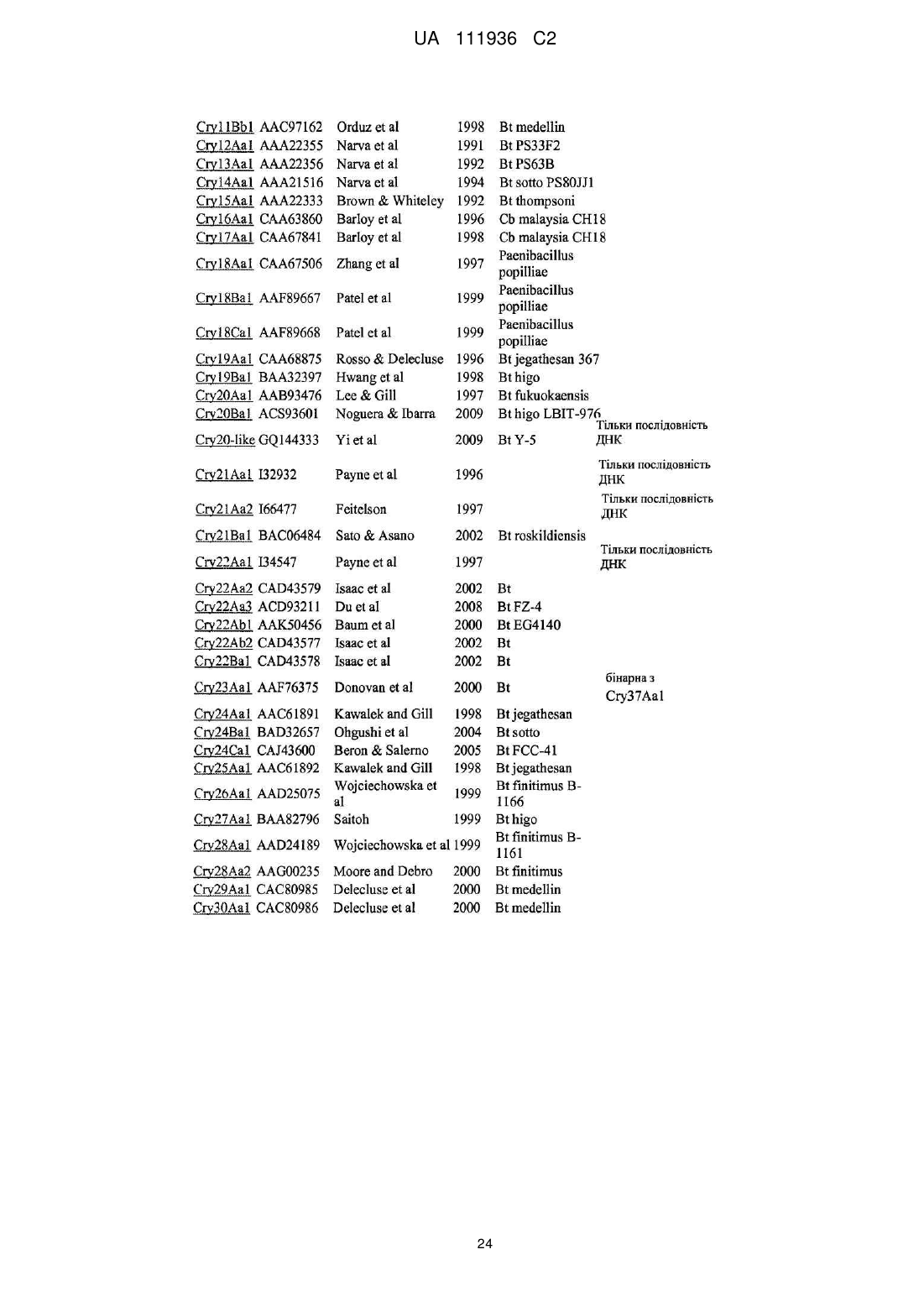
Трансгенна рослина, яка містить днк, що кодує інсектицидний білок vip3ab, і днк, що кодує інсектицидний білок cry1ca, для керування резистентністю комах
Номер патенту: 111936
Опубліковано: 11.07.2016
Автори: Сторер Ніколас П., Бертон Стефані Л., Вуслі Аарон Т., Нарва Кеннет, Мід Томас, Шитс Джоел Дж.
Формула / Реферат
1. Трансгенна рослина, яка містить ДНК, що кодує білок Vip3Ab, який має інсектицидну дію, і ДНК, що кодує білок Cry1Сa, який має інсектицидну дію.
2. Трансгенна рослина за п. 1, де вказана рослина додатково містить ДНК, що кодує третій білок, який має інсектицидну дію, при цьому вказаний третій білок вибирають з групи, що складається з Cry1Fa, Cry1Da, Cry1Be і Cry1E.
3. Трансгенна рослина за п. 2, де вказаний третій білок вибирають з групи, що складається з Cry1Fa і Cry1Be, при цьому рослина додатково містить ДНК, що кодує четвертий і п'ятий білки, які мають інсектицидну дію, вибрані з групи, що складається з Cry2A, Cry1I, DIG-3 і Cry1Ab.
4. Трансгенне насіння рослини за будь-яким з пп. 1-3, де вказане насіння містить ДНК, яка кодує білок Vip3Ab, що має інсектицидну дію, і ДНК, яка кодує білок Cry1Ca, що має інсектицидну дію.
5. Множина рослин на полі, що містить рослини-сховища, які не містять гени Bt, і множину трансгенних рослин за будь-яким з пп. 1-3, де вказані рослини-сховища складають менше ніж 40 % всіх зернових рослин в указаній множині рослин.
6. Множина рослин на полі за п. 5, де вказані рослини-сховища складають менше ніж 30 % всіх зернових рослин в указаній множині рослин.
7. Множина рослин на полі за п. 5, де вказані рослини-сховища складають менше ніж 20 % всіх зернових рослин в указаній множині рослин.
8. Множина рослин на полі за п. 5, де вказані рослини-сховища складають менше ніж 10 % всіх зернових рослин в указаній множині рослин.
9. Множина рослин на полі за п. 5, де вказані рослини-сховища складають менше ніж 5 % всіх зернових рослин в указаній множині рослин.
10. Множина рослин на полі за п. 5, де вказані рослини-сховища розташовані блоками або смугами.
11. Суміш насіння, що містить насіння-сховища рослин-сховищ, у яких відсутній ген Bt, і множину трансгенного насіння за п. 4, що містить ДНК, яка кодує білок Vip3Ab, що має інсектицидну дію, і ДНК, яка кодує білок Cry1Ca, що має інсектицидну дію, де вказане насіння-сховище складає менше ніж 40 % від всього насіння в суміші.
12. Суміш насіння за п. 11, де вказане насіння-сховище складає менше ніж 30 % від всього насіння в суміші.
13. Суміш насіння за п. 11, де вказане насіння-сховища складає менше ніж 20 % від всього насіння в суміші.
14. Суміш насіння за п. 11, де вказане насіння-сховище складає менше ніж 10 % від всього насіння в суміші.
15. Суміш насіння за п. 11, де вказане насіння-сховище складає менше ніж 5 % від всього насіння в суміші.
16. Спосіб керованого розвитку стійкості до білка Cry у комах, який включає саджання насіння для створення множини рослин за п. 5, і приведення вказаної комахи в контакт із вказаною множиною рослин.
17. Множина рослин за будь-яким з пп. 5-10, де вказані рослини займають більше 10 акрів.
18. Трансгенна рослина за будь-яким з пп. 1-3, де вказану рослину вибирають з групи, яка складається з кукурудзи, сої і бавовни.
19. Трансгенна рослина за п. 18, де вказана рослина являє собою рослину маїсу.
20. Трансгенна рослина за п. 1, де вказана рослина додатково містить ДНК, що кодує білок Cry1Fa, який має інсектицидну дію.
21. Клітина рослини від трансгенної рослини за будь-яким з пп. 1-3, де вказана клітина рослини містить вказану ДНК, що кодує вказаний білок Vip3Ab, що має інсектицидну дію, і вказану ДНК, що кодує вказаний білок Cry1Сa, який має інсектицидну дію, причому вказаний білок Vip3Ab, який має інсектицидну дію, є щонайменше на 99 % ідентичним послідовності SEQ ID NO:1, а вказаний білок Cry1Сa, що має інсектицидну дію, є щонайменше на 99 % ідентичним послідовності SEQ ID NO:2.
22. Трансгенна рослина за будь-яким з пп. 1-3, де вказаний білок Vip3Ab, що має інсектицидну дію, містить SEQ ID NO:1, а вказаний білок Cry1Сa, що має інсектицидну дію, містить SEQ ID NO:2.
23. Спосіб контролювання кукурудзяної листової совки за допомогою приведення в контакт вказаної комахи з білком Vip3Ab, що має інсектицидну дію, і білком Cry1Сa, що має інсектицидну дію.
Текст
Реферат: Даний винахід включає способи і рослини для контролювання комах - кукурудзяної листової совки, де вказані рослини містять білок Vip3Ab, що має інсектицидну дію, і білок Сrу1Са, що має інсектицидну дію, а також різні комбінації інших білків, що містять вказану пару білків, для сповільнення або запобігання розвитку стійкості у комах. UA 111936 C2 (12) UA 111936 C2 UA 111936 C2 5 10 15 20 25 30 35 40 45 50 55 60 ОПИС РІВЕНЬ ТЕХНІКИ Люди вирощують кукурудзу для використання при виробництві їжі і енергії. Люди також вирощують велику кількість інших видів зернових, включаючи сою і бавовну. Комахи поїдають і пошкоджують рослини і, тим самим, підривають зусилля людей. Мільярди доларів щорічно витрачаються на контроль комах-шкідників і, крім цього, мільярди доларів втрачаються у вигляді збитку, нанесеного комахами. Синтетичні органічні хімічні інсектициди є основним інструментом контролю комах-шкідників, але біологічні інсектициди, наприклад, білки, що мають інсектицидну дію, отримані з Bacillus thuringiensis (Bt), грають важливу роль в тих же галузях застосування. Можливість отримання стійких до комах рослин шляхом трансформації генами Bt білків, що мають інсектицидну дію, здійснила революцію в сучасному сільському господарстві і підвищила важливість і цінність білків, що мають інсектицидну дію, і їх генів. Декілька Bt білків були використані для створення стійких до комах трансгенних рослин, які до теперішнього часу успішно зареєстровані і виведені на ринок. Вказані білки включають Cry1Ab, Cry1Ac, Cry1F і Cry3Bb у кукурудзи, Cry1Ac і Cry2Ab у бавовни, і Cry3A у картоплі. Комерційні продукти, експресуючі ці білки, експресують один білок за винятком випадків, коли бажаний комбінований інсектицидний спектр дії двох білків (наприклад, Cry1Ab і Cry3Bb у кукурудзи комбінують для забезпечення стійкість, відповідно, до лускокрилих комах-шкідників і кореневих черв'яків), або коли незалежна дія білків дозволяє використовувати їх як засіб, що сповільнює розвиток стійкості в цільовій популяції комах (наприклад, Cry1Ac і Cry2Ab у бавовни комбінують для забезпечення контролю розвитку стійкості у тютюнової листокрутки-брунькоїда). Див. також публікацію заявки на патент США № 2009/0313717, що стосується білка Cry2 плюс Vip3Aa, Cry1F або Cry1A для контролю Helicoverpa zea або armigerain. WO 2009/132850 стосується використання Cry1F або Cry1A і Vip3Aa для контролю Spodoptera frugiperda. Публікація заявки на патент США №2008/0311096 частково стосується використання Cry1Ab для контролю ECB, стійкого до Cry1F. Таким чином, деякі властивості трансгенних рослин, стійких до комах, які привели до швидкого і широкого впровадження цієї технології, але також викликали побоювання, що популяції комах-шкідників вироблять стійкість до білків, які мають інсектицидну дію, що продукуються цими рослинами. Було запропоновано декілька стратегій для збереження утилітарності пов'язаних з стійкістю до комах ознак, основаних на Bt, які включали введення білків у високих дозах в комбінації з організацією сховищ (рефугій) і почергове або одночасне введення різних токсинів (McGaughey et al. (1998), "B.t. Resistance Management", Nature Biotechnol. 16: 144-146). Білки, вибрані для використання в наборі для керування стійкістю комах (IRM) повинні виявляти свою інсектицидну дію незалежно таким чином, щоб стійкість, розвинена до одного білка, не спричиняла появи стійкості до другого білка (тобто, щоб була відсутня перехресна стійкість до білків). Наприклад, якщо популяція комахи-шкідника, яка виявляє стійкість до "Білка А", є чутливою до "Білка В", можна зробити висновок, що перехресна стійкість відсутня і, що комбінація Білка А і Білка В буде ефективною для сповільнення розвитку стійкості до Білка А, що застосовується ізольовано. При відсутності популяцій комах, що мають стійкість, може бути проведений аналіз на основі інших характеристик, які, як передбачається, пов'язані з механізмом дії і потенціалом розвитку перехресної стійкості. Були висунуті припущення, згідно з якими для ідентифікації білків, що мають інсектицидну дію, які, ймовірно, не мають властивості перехресної стійкості, можна використовувати рецептор-опосередковане зв'язування (van Mellaert et al. 1999). Ключовий прогнозуючий параметр відсутності перехресної стійкості, природно властивий такому підходу, полягає в тому, що білки, які мають інсектицидну дію, не конкурують за рецептори у чутливих до них видів комах. Якщо два Bt токсини конкурують за один і той же рецептор, то у випадку мутації цього рецептора у комахи, при якій один з токсинів більше не зв'язується з цим рецептором і, отже, більше не має інсектицидної дії відносно цієї комахи, ця комаха може стати стійкою також і до другого токсину (який конкурентно зв'язується з тим же рецептором). При цьому комаха розглядається як така, що має перехресну стійкість до обох Bt токсинів. Однак якщо два токсини зв'язуються з різними рецепторами, це може служити вказівкою на те, що комаха може не бути одночасно стійкою до цих двох токсинів. Наприклад білок Cry1Fa застосуємо для контролю багатьох лускокрилих комах-шкідників, включаючи метелика кукурудзяного (ECB; Ostrinia nubilalis (Hübner)) і кукурудзяну листову совку (FAW; Spodoptera frugiperda), і виявляє активність відносно вогнівки цукрової тростини (SCB; Diatraea saccharalis). Білок Cry1Fa, що виробляється в трансгенних рослинах кукурудзи, що 1 UA 111936 C2 5 10 15 20 25 30 35 40 45 50 55 60 містять фактор TC1 507, є відповідальним за розвиток стійкості до домінуючих в даній галузі комах, тобто за контроль FAW. Cry1Fa також використовується в продуктах Herculex®, SmartStax™ і WideStrike™. Додаткові Cry токсини перераховані на веб-сайті офіційного комітету по номенклатурі B.t. (Crickmore et al.; lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt/). У цей час існує приблизно 60 основних груп "Cry" токсинів (Cry1-Cry59) з додатковими Cyt токсинами, VIP токсинами і т. п. Багато груп з числовими позначеннями мають підгрупи, позначені великими буквами, а позначені великими буквами підгрупи мають підгрупи, позначені маленькими буквами. (Наприклад, Cry1 має підгрупи A-L, а Cry1A має підгрупи a-i). КОРОТКИЙ ОПИС ВИНАХОДУ Таким чином, даний винахід частково стосується застосування білка Vip3Ab в комбінації з білком Cry1Ca. Рослини (і площа угідь, засіяних такими рослинами), які виробляють обидва ці білки, включені в об'єм даного винаходу. Даний винахід частково стосується несподіваного відкриття того, що Vip3Ab і Cry1Ca не конкурують один з одним за ділянки зв'язування в мембранних препаратах, отриманих з клітин кишечнику кукурудзяної листової совки (FAW; Spodoptera frugiperda). Даний винахід також стосується пакетів або "пірамід" з трьох (або більше) токсинів, в яких Vip3Ab і Cry1Ca є основною парою. У деяких переважних варіантах здійснення пірамід комбінація вибраних токсинів забезпечує активність відносно FAW без розвитку перехресної стійкості. Деякі переважні комбінації-піраміди з "трьома місцями дії" включають основну пару білків, плюс Cry1Fa, Cry1Da, Cry1Be або Cry1E як третій білок, що впливає на FAW. Ці конкретні потрійні пакети, згідно з даним винаходом, несподівано забезпечують три місця дії у FAW. Це може сприяти пом'якшенню або усуненню вимоги до площ сховищ. Відповідно до даного винаходу також можуть бути додані додаткові токсини/гени. Наприклад, якщо Cry1Fa або Cry1Be вводять в пакет разом з парою білків за винаходом (обидва білки Cry1Fa і Cry1Be виявляють активність як відносно FAW так і відносно метелика кукурудзяного (ECB)), додавання двох додаткових білків в цей потрійний пакет, в якому два додаткових білки націлені на ECB, забезпечить три місця дії у FAW і три місця дії у ECB. Ці два додані білки (четвертий і п'ятий білок) можуть бути вибрані з групи, що складається з Cry2A, Cry1I, DIG-3 і Cry1Ab, що дає в результаті пакет з п'яти білків, що мають по три місця дії у двох комах (ECB і FAW). ДОКЛАДНИЙ ОПИС ВИНАХОДУ Даний винахід частково стосується несподіваного відкриття, яке полягає в тому, що Vip3Ab і Cry1Ca не конкурують один з одним за ділянки зв'язування в мембранних препаратах, отриманих з клітин кишечнику кукурудзяної листової совки (FAW; Spodoptera frugiperda). Таким чином, білок Vip3Ab може бути використаний в комбінації з білком Cry1Ca в трансгенній кукурудзі (і інших рослинах, наприклад, бавовні і сої) для сповільнення або запобігання розвитку у FAW стійкості до кожного з вказаних білків окремо. Пара білків, що розглядається, може бути ефективною при захисті рослин (таких рослин, як маїс і соя) від пошкоджень, що наносяться кукурудзяною листовою совкою, стійкою до Cry. Іншими словами, одна з галузей застосування даного винаходу стосується захисту кукурудзи і інших економічно важливих видів рослин від пошкоджень і втрати урожаю, викликаних популяціями кукурудзяної листової совки, у яких може розвинутися стійкість до Vip3Ab або Cry1Ca. У даному винаході, таким чином, розкривається пакет для керування стійкістю комахами (IRM), що містить Vip3Ab і Cry1Ca і призначений для запобігання або послаблення розвитку у FAW стійкості до кожного або обох цих білків. Даний винахід забезпечує композиції для контролю лускокрилих комах-шкідників, що містять клітини, які продукують білок Vip3Ab, що має інсектицидну дію, і білок Cry1Ca, що має інсектицидну дію. Винахід також стосується хазяїна, трансформованого для продукування як білка Vip3Ab, що має інсектицидну дію, що так і білка Cry1Ca, що має інсектицидну дію, причому вказаний хазяїн являє собою мікроорганізм або клітину рослини. Полінуклеотид(и), що розглядається, переважно знаходиться в генетичній конструкції під керуванням промотору(ів), що не належить Bacillus thuringiensis. Полінуклеотиди, що розглядаються, можуть містити кодони, що використовуються для посиленої експресії в рослинах. Додатково передбачається, що винахід забезпечує спосіб контролю лускокрилих комахшкідників, що містить приведення в контакт вказаних комах-шкідників з ефективною кількістю композиції, яка містить білок Vip3Ab, що містить ядро токсину, і білок Cry1Сa, що містить ядро токсину. Один з варіантів здійснення винаходу містить рослину маїсу, що містить експресований в 2 UA 111936 C2 5 10 15 20 25 30 35 40 45 50 55 60 рослині ген, який кодує білок Cry1Сa, що має інсектицидну дію, і експресований в рослині ген, який кодує білок Vip3Ab, що має інсектицидну дію. Інший варіант здійснення винаходу містить рослину маїсу, в якій експресований в рослині ген, який кодує білок Cry1Сa, що має інсектицидну дію, і експресований в рослині ген, який кодує білок Vip3Ab, що має інсектицидну дію, були введені у вказану рослину маїсу шляхом інтрогрессії. Як описано в Прикладах, дослідження конкурентного зв'язування з рецептором з використанням міченого радіоактивним ізотопом білка Cry1Сa показали, що білок Cry1Сa не конкурує за зв'язування в тканинах FAW, в яких відбувається зв'язування Vip3Ab. Ці результати також вказують на те, що комбінація білків Vip3Ab і Cry1Сa може являти собою ефективний засіб для послаблення розвитку стійкості в популяціях FAW до кожного з цих білків. Таким чином, частково основуючись на даних, представлених в цьому документі, можна передбачити, що спільне продукування (пакетування) білків Cry1Сa і Vip3Ab може бути використане для отримання IRM пакету з високими дозами для FAW. До цієї пари можуть бути додані інші білки. Наприклад, винахід, що розглядається, також частково стосується потрійних пакетів або "пірамід", що складаються з трьох (або більше) токсинів, де Vip3Ab і Cry1Сa є основною парою. У деяких переважних варіантах здійснення піраміди вибрані токсини мають три окремі місця дії у FAW. Деякі переважні комбінації для піраміди з "трьома місцями дії" включають основну пару білків, що розглядається, плюс Cry1Fa, Cry1Da, Cry1Be або Cry1E як третій білок для впливу на FAW. Під "окремими місцями дії" мається на увазі те, що кожний з даних білків не викликає розвитку перехресної стійкості з іншими білками. Ці конкретні потрійні пакети, згідно з даним винаходом, несподівано забезпечують три місця дії у FAW. Це може сприяти пом'якшенню або усуненню вимоги до площ сховищ. Що стосується деяких приватних варіантів здійснення даного винаходу, автори показали, що популяція FAW, стійка до інсектицидної активності білка Cry1Fa, не є стійкою до інсектицидної активності білка Vip3Ab або інсектицидної активності білка Cry1Сa. Автори продемонстрували, що Cry1Сa не конкурує за ділянки зв'язування з Cry1Fa, і що Vip3Ab не конкурує за ділянки зв'язування з Cry1Fa в кишечнику FAW. ДИВ. US 61/284281 (подану 16 грудня 2009) відносно Cry1Fa і Cry1Ca, і паралельно подану заявку PCT озаглавлену "COMBINED USE OF Vip3Ab AND Cry1Fa FOR MANAGEMENT OF RESISTANT INSECTS". Таким чином, пари токсинів Cry1Fa плюс Vip3Ab і Cry1Fa плюс Cry1Сa забезпечують активність відносно FAW без розвитку перехресної стійкості. Нездатність Vip3Ab1 конкурувати з Cry1Сa за зв'язування в кишечнику FAW демонструє, що ці три білки-токсини (Cry1Fa, Vip3Ab, Cry1Сa) представляють потрійний пакет - піраміду токсинів Cry, яка забезпечує три окремі цільові ділянки взаємодії в кишечнику FAW. Ці конкретні потрійні пакети, згідно з даним винаходом, несподівано забезпечують вплив на FAW без розвитку перехресної стійкості. Більше того, демонстрація того, що ці три білки не конкурують один з одним, дозволяє фахівцеві в даній галузі техніки прийти до висновку, що це може сприяти пом'якшенню або усуненню вимоги до площ сховищ. Дане розкриття забезпечує перевагу, яка полягає в тому, що рослини, експресуючі комбінацію Cry1Fa, Vip3Ab і Cry1Сa будуть корисні для сповільнення або запобігання розвитку у FAW стійкості до кожного з цих білків і їх комбінації. Відповідно до даного винаходу також можуть бути додані додаткові токсини/гени. Наприклад, якщо Cry1Fa або Cry1Be вводять в пакет разом з парою білків за винаходом (обидва білки Cry1Fa і Cry1Be виявляють активності як відносно FAW, так і відносно метелика кукурудзяного (ECB)), додавання двох додаткових білків в цей потрійний пакет, в якому два додаткові білки націлені на ECB, забезпечить три місця дії у FAW і три місця дії у ECB. Ці два додані білки (четвертий і п'ятий білок) можуть бути вибрані з групи, що складається з Cry2A, Cry1I, DIG-3 (див. заявку на патент США № 61/284278 (подана 16 грудня 2009) і US 2010 00269223) і Cry1Ab, що дає в результаті пакет з п'яти білків, що мають по три місця дії у двох комах (ECB і FAW) Таким чином, одна з можливих схем обробки являє собою використання пари білків, що розглядається, в комбінації з третім токсином/геном і використання цього потрійного пакету для послаблення розвитку у FAW стійкості до кожного з цих токсинів. Відповідно, винахід, що розглядається, також стосується потрійних пакетів або "пірамід", що складаються з трьох (або більше) токсинів. У деяких переважних варіантах здійснення піраміди вибрані токсини мають три окремі місця дії відносно FAW. Серед інших схем обробки за даним винаходом можуть бути використані два, три або більше білків з білків, що розглядаються в регіонах зростання кукурудзи, в яких FAW може формувати популяції з розвиненою стійкістю. 3 UA 111936 C2 5 10 15 20 25 30 35 40 45 50 55 60 З урахуванням того, що Cry1Fa активний відносно FAW і ECB, Vip3Ab плюс Cry1Сa плюс Cry1Fa несподівано забезпечують, згідно з даним винаходом, три місця дії у FAW. Це може сприяти пом'якшенню або усуненню вимоги про площі сховищ. Cry1Fa міститься в продуктах Herculex®, SmartStax™ і WideStrike™. Пара генів (Vip3Ab і Cry1Сa), що розглядається, може бути скомбінована, наприклад з продуктом, що містить Cry1Fa, таким як Herculex®, SmartStax™ і WideStrike™. Відповідно, пара білків, що розглядається, може відігравати значну роль в зменшенні тиску відбирання на ці і інші білки. Пара білків, що розглядається, може бути використана в комбінаціях з трьох генів для кукурудзи і інших рослин (наприклад, бавовни і сої). Як вже вказувалося вище, згідно з даним винаходом також можуть бути додані додаткові токсини/гени. Відносно використання Cry1E (для контролю FAW), див. заявку на патент США № 61/284278 (подана 16 грудня 2009). Рослини (і площі угідь, засіяних такими рослинами), які виробляють будь-які з комбінацій білків, що розглядаються, включені в об'єм даного винаходу. Також можуть бути додані додаткові токсини/гени, однак вище конкретні пакети, що обговорюються, несподівано забезпечують множину місць дії у FAW і ECB. Це може сприяти пом'якшенню або усуненню вимоги до площ сховищ. Отже, засіяним таким чином поле, площа якого перевищує десять акрів, входить в об'єм даного винаходу. Для отримання послідовностей будь-яких генів і білків, розкритих або згаданих в цьому документі, також може бути використаний GENBANK. ДИВ. Додаток А нижче. Релевантні послідовності також доступні з патентів. Наприклад, патент США № 5188960 і патент США № 5827514 описують білки, що містять ядро токсину Cry1Fa, які є відповідними для здійснення даного винаходу. Патент США № 6218188 описує оптимізовані для рослин послідовності ДНК, що кодують білки, які містять ядро токсину Cry1Fa, які підходять для використання в даному винаході. У US 61/284275 (подана 16 грудня 2009) розкриті деякі укорочені білки Cry1Сa, які можуть бути використані відповідно до даного винаходу. Комбінації білків, описаних в цьому документі, можуть бути використані для контролю лускокрилих комах-шкідників. Дорослі лускокрилі, наприклад, метелі і метелики, в основному харчуються квітковим нектаром і є важливими запилювачами. Практично всі личинки лускокрилих, тобто гусениці, харчуються рослинами, і багато які з них є важливими комахамишкідниками. Гусениці поїдають внутрішню частину листя, коріння або стебло рослини, лишаючи рослину можливості отримувати поживні речовини і часто руйнуючи фізичну опорну структуру рослини. Крім цього, гусениці поїдають плоди, тканини і зерно і борошно, що зберігаються, надаючи цим продуктам нетоварного вигляду або серйозно знижуючи їх цінність. Як використовується в цьому документі, під лускокрилими комахами-шкідниками маються на увазі різні стадії життєвого циклу комахи-шкідника, включаючи стадії личинки. Деякі химерні токсини за даним винаходом містять повну N-кінцеву частину ядра токсину Bt і, в деякій точці від кінця частини, що містить ядро токсину, білок переходить в гетерологічну послідовність протоксину. N-кінцева частина токсину Bt, що має інсектицидну активність, називається "ядром" токсину. Перехід від сегмента ядра токсину до сегмента гетерологічного протоксину може знаходитися приблизно в місці з'єднання токсин/протоксин або, як альтернатива, може бути збережена частина природного протоксину (що простягається за межі частини ядра токсину) з переходом в гетерологічну частину, протоксин, розташовану далі. Як приклад, один з химерних токсинів за даним винаходом являє собою частину, що стосується ядра токсину Cry1Сa (приблизно 600 амінокислот) і/або гетерологічний протоксин (інші амінокислоти до С-кінця). У одному з переважних варіантів здійснення, частина химерного токсину, що містить протоксин, отримують з білка-токсину Cry1Ab. У переважному варіанті здійснення, частина химерного токсину, що містить протоксин, отримують з білка-токсину Cry1Ab. Фахівець в даній галузі техніки визнає, що Bt токсини, навіть в рамках певного класу, такого як Cry1Сa, трохи розрізнюються по довжині і точному положенню переходу від ядра токсину до частини, що стосується протоксину. Звичайно токсини Cry1Сa мають довжину від приблизно 1150 до приблизно 1200 амінокислот. Перехід від частини, що стосується ядра токсину, до частини, що стосується протоксину, звичайно знаходиться в межах від 50 % до 60 % повної довжини токсину. Химерний токсин винаходу, що розглядається, повністю включає вказану Nкінцеву частину ядра токсину. Таким чином, химерний токсин містить щонайменше 50 % повної довжини білка-токсину Cry1 Bt, що звичайно складає щонайменше 590 амінокислот. Що стосується частини, яка стосується протоксину, то повна довжина частини, яка стосується протоксину Cry1Ab, простягається від кінця частини, що стосується ядра токсину, до С-кінця молекули. 4 UA 111936 C2 5 10 15 20 25 30 35 40 45 50 55 60 Гени і токсини. Гени і токсини, що використовуються за даним винаходом, включають не тільки розкриті послідовності повної довжини, але також фрагменти цих послідовностей, варіанти, мутанти і злиті білки, які зберігають характеристики пестицидної активності токсинів, приклади яких приведені в цьому документі. У цьому документі термін "варіанти" або "варіації" генів стосується нуклеотидних послідовностей, які кодують одні і ті ж токсини або які кодують токсини-еквіваленти, що мають пестицидну активність. У цьому документі термін "токсиниеквіваленти" стосується токсинів, що мають таку ж або по суті таку ж біологічну активність відносно цільових комах-шкідників, що і заявлені токсини. У цьому документі використовуються наступні обмежувальні ознаки: приблизно 95 % (для Vip3Ab і Cry1Ca), 78 % (для Vip3Ab і Cry1C) і 45 % (для Cry1) ідентичність послідовностей згідно з "Revision of the Nomenclature for the Bacillus thuringiensis Pesticidal Crystal Proteins", N. Crickmore, D.R. Zeigler, J. Feitelson, E. Schnepf, J. Van Rie, D. Lereclus, J. Baum, and D.H. Dean. Microbiology and Molecular Biology Reviews (1998) Vol. 62: 807-813. Ці обмеження застосовні тільки відносно ядра токсинів. Для фахівця в даній галузі техніки очевидно, що гени, які кодують активні токсини, можуть бути ідентифіковані і отримані декількома способами. Конкретні гени або частини генів, проілюстровані в цьому документі, можуть бути отримані з ізолятів, депонованих в депозитарії культур. Ці гени або їх частини, або варіанти також можуть бути сконструйовані синтетично, наприклад, з використанням синтезатора генів. Варіації генів можуть бути легко сконструйовані стандартними методами для здійснення точкових мутацій. Фрагменти цих генів також можуть бути отримані з використанням комерційно доступних екзонуклеаз або ендонуклеаз згідно зі стандартними процедурами. Наприклад, для послідовного відщеплення нуклеотидів від кінців цих генів можуть бути використані такі ферменти, як Bal31, або сайт-направлений мутагенез. Гени, що кодують активні фрагменти, також можуть бути отримані з використанням різних рестрикційних ферментів. Для безпосереднього отримання активних фрагментів вказаних білків-токсинів можуть бути використані протеази. Фрагменти і еквіваленти, які зберігають пестицидну активність проілюстрованих токсинів, також знаходяться в межах об'єму даного винаходу. Внаслідок надлишковості генетичного коду амінокислотні послідовності, розкриті в цьому документі, можуть кодуватися множиною різних ДНК-послідовностей. Фахівцеві в даній галузі техніки не складе труднощів створити такі альтернативні ДНК-послідовності, що кодують такі ж або по суті такі ж токсини. Такі варіанти ДНК-послідовностей знаходяться в межах об'єму даного винаходу. У цьому документі "по суті такі ж" послідовності означають послідовності, що мають заміни, делеції, додавання або вставки, які істотно не впливають на пестицидну активність. Це визначення також охоплює фрагменти генів, що кодують білки, які зберігають пестицидну активність. Ще один спосіб ідентифікації генів, що кодують токсини, і частин генів, придатних згідно з даним винаходом, полягає у використанні олігонуклеотидних зондів. Такі зонди являють собою детектовані нуклеотидні послідовності. Ці послідовності можуть бути детектованими внаслідок наявності відповідної мітки або можуть бути виконані з можливістю їх природної флуоресценції, як описано в міжнародній заявці WO93/16094. Як відомо з рівня техніки, якщо зонд і зразок нуклеїнової кислоти гібридизуються, формуючи сильний зв'язок між двома вказаними молекулами, можна зробити досить обґрунтоване припущення, що зонд і зразок є по суті гомологічними. Переважно, гібридизацію проводять в жорстких умовах методом, добре відомим з рівня техніки, наприклад, описаним в Keller, G. FL, M. M. Manak (1987) DNA Probes, Stockton Press, New York, N.Y., pp. 169-170. Деякі приклади комбінацій концентрації солі і температури є наступними (в порядку зростання жорсткості): 2X SSPE або SSC при кімнатній температурі; 1X SSPE або SSC при 42 °C; 0,1X SSPE або SSC при 42 °C; 0,1X SSPE або SSC при 65 °C. Детектування зонда забезпечує засіб для визначення відомим способом, чи сталася гібридизація. Такий зондовий аналіз забезпечує швидкий спосіб ідентифікації кодуючих токсин генів за даним винаходом. Нуклеотидні сегменти, що використовуються як зонди, згідно з винаходом, можуть синтезуватися в ДНК-синтезаторі і за допомогою стандартних процедур. Дані нуклеотидні послідовності також можуть використовуватися як ПЦР-праймери для ампліфікації генів за винаходом. Варіанти токсинів. У цьому документі, зокрема, приведені приклади деяких токсинів за винаходом. Оскільки ці токсини є усього лише прикладами токсинів за винаходом, очевидно, що даний винахід містить варіанти або еквівалентні токсини (і нуклеотидні послідовності, що кодують еквівалентні токсини), що мають пестицидну активність, таку ж або аналогічну пестицидній активності токсину, приведеного як приклад. Еквівалентні токсини мають гомологію по амінокислотах з приведеним як приклад токсином. Така гомологія по амінокислотах звичайно перевищує 75 %, переважно перевищує 90 %, і найбільш переважно перевищує 95 %. Гомологія 5 UA 111936 C2 5 10 по амінокислотах є найбільшою в критичних областях, які відповідальні за біологічну активність або беруть участь у визначенні тривимірної конфігурації, яка, зрештою, і відповідає за біологічну активність. У цьому відношенні, певні амінокислотні заміни є прийнятними і допустимими, якщо ці заміни знаходяться в областях, які не є критичними для активності або являють собою консервативні амінокислотні заміни, які не впливають на тривимірну конфігурацію молекули. Наприклад, амінокислоти можуть бути віднесені до наступних класів: неполярні, незаряджені полярні, основні і кислі. Консервативні заміни, в яких амінокислота одного класу замінюється амінокислотою з того ж класу, знаходяться в межах об'єму даного винаходу за умови, що заміна не змінює істотно біологічну активність сполуки. Нижче приводиться список прикладів амінокислот, що належать кожному класу. Клас амінокислот неполярні незаряджені полярні кислі основні 15 20 25 30 35 40 45 50 55 Приклади амінокислот Ala, Val, Leu, Ile, Pro, Met, Phe, Trp Gly, Ser, Thr, Cys, Tyr, Asn, Gln Asp, Glu Lys, Arg, His У деяких прикладах також можуть бути використані неконсервативні заміни. При цьому критичним фактором є те, що такі заміни не повинні істотно погіршувати біологічну активність токсину. Рекомбінантні хазяїни. Гени, що кодують токсини за даним винаходом, можуть бути введені у множину різних мікроорганізмів-хазяїнів або рослин-хазяїнів. Експресія гена токсину приводить в результаті, прямо або опосередковано, до внутрішньоклітинного продукування і підтримування пестициду. Для створення штаму Bt, що експресує обидва токсини за винаходом, можуть бути використані кон'югаційне перенесення і рекомбінантне перенесення. Один або обидва гени токсинів можуть бути перенесені також в інші організми-хазяїни, які можуть потім використовуватися для отримання синергічного ефекту. При використанні прийнятних мікроорганізмів-хазяїнів, наприклад, Pseudomonas, такі мікроорганізми можна застосовувати в місцях знаходження комахи-шкідника, де вони будуть розмножуватися і потрапити в кишечник комахи, що приведе в результаті до контролю комахи-шкідника. Як альтернатива, мікроорганізми, що містять ген токсину, можуть бути оброблені в умовах, що продовжують активність токсину і стабілізують клітину. Потім оброблені клітини, які зберігають токсичну активність, вносять в середовище проживання цільової комахи-шкідника. Якщо ген Bt токсину вводять за допомогою прийнятного вектора в мікроорганізм-хазяїн, а вказаний хазяїн потім вводять в середовище проживання в живому стані, то принциповим моментом є використання певних мікроорганізмів-хазяїнів. Вибираються такі мікроорганізмихазяїні, відносно яких відомо, що вони проживають в "фітосфері" (філоплані, філосфері, ризосфері і/або ризоплані) однієї або більше представляючих інтерес зернових культур. Такі мікроорганізми вибирають таким чином, щоб вони мали здатність успішно конкурувати в конкретному середовищі проживання (зерновій культурі або інших місцях проживання комах) з дикими типами мікроорганізмів, забезпечували стабільну підтримку і експресію поліпептидупестициду і, бажано, забезпечували поліпшений захист пестициду від розкладання і інактивації під дією навколишнього середовища. Відносно величезної кількості мікроорганізмів відомо, що вони проживають в філоплані (поверхні листя рослин) і/або в ризосфері (ґрунті, що оточує кореневу систему рослини) множини важливих зернових культур. Ці мікроорганізми включають бактерії, водорості і гриби. Особливий інтерес представляють такі мікроорганізми, як бактерії, наприклад, що належать до родів Pseudomonas, Erwinia, Serratia, Klebsiella, Xanthomonas, Streptomyces, Rhizobium, Rhodopseudomonas, Methylophilius, Agrobactenum, Acetobacter, Lactobacillus, Arthrobacter, Azotobacter, Leuconostoc і Alcaligenes; гриби, зокрема, дріжджі, наприклад, що належать до видів Saccharomyces, Cryptococcus, Kluyveromyces, Sporobolomyces, Rhodotorula і Aureobasidium. Особливий інтерес представляють такі види бактерій, що проживають в фітосфері, як Pseudomonas syringae, Pseudomonas fluorescens, Serratia marcescens, Acetobacter xylinum, Agrobactenium tumefaciens, Rhodopseudomonas spheroides, Xanthomonas campestris, Rhizobium melioti, Alcaligenes entrophus і Azotobacter vinlandii, такі види проживаючих в фітосфері дріжджів, як Rhodotorula rubra, R. glutinis, R. marina, R. aurantiaca, Cryptococcus albidus, С. diffluens, С. laurentii, Saccharomyces rosei, S. pretoriensis, S. cerevisiae, Sporobolomyces roseus, S. odorus, Kluyveromyces veronae і Aureobasidium pollulans. Особливий інтерес представляють пігментовані мікроорганізми. Існує широкий спектр способів введення Bt генів, що кодують токсин, в мікроорганізм-хазяїн 6 UA 111936 C2 5 10 15 20 25 30 35 40 45 50 55 60 в умовах що забезпечують стабільну підтримку і експресію цього гена. Ці способи добре відомі фахівцям в даній галузі техніки і описані, наприклад, в патенті США № 5135867, який включений в цей документ у вигляді посилання. Обробка клітин. Клітини Bacillus thuringiensis або рекомбінантні клітини, що експресують Bt токсини, можуть бути оброблені з метою продовження активності токсину і стабілізації клітини. Мікрокапсула, що формується з пестицидом містить Bt токсин або токсини всередині клітинної структури, яка була стабілізована і захищає токсин при внесенні мікрокапсули в середовище проживання цільової комахи-шкідника. Прийнятні клітини-хазяїни можуть включати або клітини прокаріот, або еукаріот, і звичайно обмежені тільки тими клітинами, які не виробляють речовини, токсичні для вищих організмів, таких як ссавці. Проте, можуть бути використані організми, що виробляють речовини, токсичні для вищих організмів, якщо ці токсичні речовини є нестабільними, або кількість, що вноситься, є настільки низькою, що при цьому відсутня яканебудь імовірність інтоксикації ссавця-хазяїна. Як хазяїни особливий інтерес представляють прокаріоти і нижчі еукаріоти, такі як гриби. При обробці клітини звичайно є інтактними і по суті знаходяться в проліферативній формі, а не в формі спор, хоча в деяких випадках можуть бути використані спори. Обробка клітин мікроорганізмів, тобто клітин, що містять ген або гени Bt токсину, може виконуватися з використанням хімічних або фізичних засобів або з використанням комбінації хімічних і/або фізичних засобів за умови, що ці методи не впливають негативного чином на властивості токсину, а також не погіршують здатності клітини захищати токсин. Прикладами хімічних реагентів є галогенуючі агенти, зокрема, галогени з атомними номерами 17-80. Точніше, можна використовувати йод в м'яких умовах протягом часу, достатнього для досягнення бажаних результатів. Інші прийнятні методи включають обробку альдегідами, такими як глутаральдегід; протиінфекційними засобами, такими як зефіран хлорид і цетилпіридинхлорид; спиртами, такими як ізопропіловий спирт і етанол; різними гістологічними фіксаторами, такими як Люголь-йод, фіксатор Буена, різні кислоти і фіксатор Helly (див. Humason, Gretchen L., Animal Tissue Techniques, W. H. Freeman and Company, 1967); або комбінацією фізичних (тепло) і хімічних агентів, які захищають і сприяють пролонгуванню активності токсину, що продукується в клітині при введенні цієї клітини тварини-хазяїна. Прикладами фізичних засобів є короткохвильове випромінювання, таке як гаммавипромінювання і рентгенівське випромінювання, заморожування, УФ-опромінення, ліофілізація і інші. Способи обробки клітин мікроорганізмів описані в патентах США №№ 4695455 і 4695462, які включені в цей документ у вигляді посилання. Клітини звичайно мають підвищену структурну стабільність, що збільшує їх стійкість до умов навколишнього середовища. Якщо пестицид знаходиться в проформі, спосіб обробки клітини потрібно вибирати таким чином, щоб патогеном цільової комахи-шкідника не пригнічувався процесинг від проформи до зрілої форми пестициду. Наприклад, формальдегід буде зшивати білки і може пригнічувати процесинг проформи поліпептиду-пестициду. Спосіб обробки клітини повинен сприяти збереженню щонайменше істотної частки біодоступності або біоактивності токсину. Представляючий особливий інтерес характеристики при виборі клітини-хазяїна з метою продукування, включають легкість введення Bt гена або генів в клітину-хазяїна, доступність експресуючої системи, ефективність експресії, стабільність пестициду в клітині-хазяїні і наявність допоміжних генетичних можливостей. Представляючий особливий інтерес характеристики у випадку використання у вигляді пестицидної мікрокапсули включають захисні властивості відносно пестициду, такі як товсті клітинні стінки, пігментація і внутрішньоклітинна упаковка або формування включень; виживання у водному середовищі; відсутність токсичності для ссавця; привабливість для поглинання комахами-шкідниками; легкість в знищенні і фіксації без пошкодження токсину і тому подібне. Також може розглядатися легкість в створенні і звертанні, економічність, стабільність при зберіганні і тому подібне. Вирощування клітин. Клітину-хазяїна, що містить інсектицидний Bt ген або гени можна вирощувати в будь-якому прийнятному поживному середовищі, в якому ДНК-конструкція забезпечує селективну перевагу, забезпечуючи таке селективне середовище, що всі або по суті всі клітини зберігають Bt генів. Потім ці клітини можуть бути зібрані відомими методами. З іншого боку, клітини можна обробляти до їх збирання. Bt клітини, що продукують токсини за винаходом, можуть бути культивовані з використанням стандартних середовищ і методів ферментації, відомих в даній галузі техніки. Після завершення циклу ферментації бактерії можуть бути зібрані спочатку шляхом виділення спор і кристалів Bt з ферментаційного бульйону способами, добре відомими в даній галузі. Відновлені спори і кристали Bt можуть бути представлені в складах у вигляді змочуваного порошку, рідкого 7 UA 111936 C2 5 10 15 20 25 30 35 40 45 50 55 60 концентрату, гранул або у вигляді інших складів з додаванням поверхнево-активних речовин, диспергуючих речовин, інертних наповнювачів і інших компонентів для полегшення поводження з ними і їх застосування відносно конкретних цільових комах-шкідників. Такі склади і процедури нанесення добре відомі в даній галузі. Склади. Сформовані гранули-приманки, що містять атрактант і спори, кристали і токсини Bt ізолятів, або рекомбінантні мікроби, що містять гени, отримані з Bt ізолятів, розкритих в цьому документі, можуть бути внесені в ґрунт. Сформований продукт також може бути нанесений у вигляді покриття на насіння або в процесі обробки коріння або обробки всієї рослини на пізніх стадіях циклу розвитку кукурудзи. Обробка рослин і ґрунту Bt клітинами може проводитися з використанням змочуваних порошків, гранул або пудри шляхом змішування з різними інертними матеріалами, такими як неорганічні мінерали (філосилікати, карбонати, сульфати, фосфати і т. п.) або рослинними матеріалами (подрібненою серцевиною кукурудзяного качана, рисовим лушпинням, горіховою шкаралупою і т. п.). Склади можуть включати адгезивні ад'юванти, стабілізуючі агенти, інші пестицидні добавки або поверхнево-активні речовини. Рідкі склади можуть бути водними або неводними і можуть застосовуватися у вигляді пін, гелів, суспензій, емульгованих концентратів і т. п. Інгредієнти можуть включати реологічні агенти, поверхневоактивні речовини, емульгатори або полімери. Як добре відомо фахівцеві в даній галузі, пестицидна концентрація може варіювати в широких межах залежно від природи конкретної композиції, зокрема, від того, чи буде вона являти собою концентрат або буде використовуватися безпосередньо. Пестицид може бути присутнім щонайменше в кількості 1 ваг. % і може становити 100 % ваги композиції. Сухі композиції можуть містити пестицид в кількості приблизно від 1 до 95 ваг. % в той час як рідкі склади як правило, можуть містити приблизно від 1 до 60 ваг. % твердої речовини в рідкій фазі. 2 4 Композиції, як правило, можуть містити приблизно від 10 до 10 клітин/мг. Ці склади застосовуються в кількості від приблизно 50 мг (в рідкому або сухому вигляді) до 1 кг або більше на гектар. Склади можуть наноситися на середовище проживання лускокрилої комахи-шкідника, наприклад, на листя або на ґрунт, шляхом зрошування, запилення, оббризкування і т. п. Трансформація рослин. Переважним рекомбінантним хазяїном для продукування білків, що мають інсектицидну дію, за винаходом є трансформована рослина. Гени, що кодують білки Bt токсину, як це розкрито в цьому документі, можуть бути введені в клітини рослини множиною різних методів, які добре відомі в даній галузі техніки. Наприклад, для підготовки до введення чужорідних генів у вищі рослини доступна множина клонуючих векторів, що містять реплікаційну систему Escherichia coli і маркер, який забезпечує можливість відбирання трансформованих клітин. У число таких векторів входять, крім інших, pBR322, pUC серія, M13mp серія і pACYC184. Відповідно, фрагмент ДНК, що містить послідовність, що кодує білок Bt токсину, може бути вставлений у вектор у прийнятному сайті рестрикції. Отримана в результаті плазміда використовується для трансформації в Е. coli. Клітини E. coli культивують у прийнятному поживному середовищі, потім збирають і лізують. Плазміди виділяють. Як способи аналізу звичайно використовують секвенування, рестрикційний аналіз, електрофорез і інші біохімічні і молекулярно-біологічні способи. Після кожної операції використана ДНК-послідовність може бути відщеплена і приєднана до наступної ДНК-послідовності. Кожна плазмідна послідовність може бути клонована в тих же або інших плазмідах. Залежно від способу введення в рослину бажаних генів також можуть бути необхідні інші ДНК-послідовності. Наприклад, якщо для трансформації клітини рослини використовуються плазміди Ti або Ri, то щонайменше правий кінець, а часто як правий, так і лівий кінці Ti або Ri плазмідної Т-ДНК, повинні бути приєднані як фланкуючі області призначених для вставки генів. Використання Т-ДНК для трансформації клітин рослин детально досліджене і вичерпно розкрите в EP 120516, Lee and Gelvin (2008), Hoekema (1985), Fraley et al, (1986) and An et al., (1985) і є добре відомим в даній галузі техніки. Після того як введена ДНК інтегрується в геном рослини, вона стає відносно стабільною. Трансформаційний вектор звичайно містить забезпечуючий можливість відбирання маркер, який забезпечує стійкість трансформованої клітини рослини до біоциду або антибіотику, такого як, наприклад, Біалафос, Канаміцин, G418, Блеоміцин або Гігроміцин. Окремо використовуваний маркер повинен, відповідно, забезпечувати відбір трансформованих клітин, а не тих клітин, які не містять ДНК, що вводиться. Існує множина способів уведення ДНК у рослинну клітину-хазяїна. Ці способи включають трансформацію за допомогою Т-ДНК, використовуючи Agrobacterium tumefaciens або Agrobacterium rhizogenes як трансформуючого агента, злиття, ін'єкцію, біолістику (бомбардування мікрочастинками) або електорпорацію, а також інші можливі способи. Якщо для трансформації використовуються Agrobacteria, призначена для введення ДНК повинна бути 8 UA 111936 C2 5 10 15 20 25 30 35 40 45 50 55 60 клонована в спеціальні плазміди, а саме, або в проміжний вектор, або в бінарний вектор. Проміжні вектора можуть бути вбудовані в Ti або Ri плазміду методом гомологічної рекомбінації завдяки послідовностям, що гомологічні послідовностям у Т-ДНК. Ti або Ri плазміди також стримають vir-область, необхідну для перенесення Т-ДНК. Проміжні вектора не можуть самореплікуватися в Agrobacteria. Проміжний вектор може бути перенесений у Agrobacterium tumefaciens за допомогою плазміди-хелпера (кон'югація). Бінарні вектора можуть самореплікуватися як у E. coli, так і в Agrobacteria. Вони містять ген маркера селекції і лінкер або полілінкер, що обмежений областями правої і лівої меж Т-ДНК. Вони можуть бути трансформовані безпосередньо в Agrobacteria (Holsters et ah, 1978). Agrobacteria, використовувані як клітини-хазяи, повинні містити плазміду, що несе vir-область. Vir-область необхідна для перенесення Т-ДНК у клітину рослини. Також можуть міститися додаткові Т-ДНК. Трансформовані в такий спосіб бактерії використовуються для трансформації клітин рослини. Для переносу ДНК у клітину рослини рослинні експлантанти можна переважно культивувати з Agrobacterium tumefaciens або Agrobacterium rhizogenes. Потім з інфікованого рослинного матеріалу (наприклад, частин листя, сегментів стебла, коренів, а також з протопластів або клітин, культивованих у суспензії) у придатному середовищі, що може містити антибіотики або біоциди для селекції, може бути регенерована ціла рослина. Отримані в такий спосіб рослини потім можуть бути досліджені на наявність упровадженої ДНК. У випадку ін'єкції або електропорації до плазмід не пред'являється ніяких додаткових вимог. Можливе використання звичайних плазмід, таких як, наприклад, похідні від pUC. Трансформовані клітини ростуть у рослинах звичайним чином. Вони можуть формувати зародкові клітини і передавати трансформовану ознаку(и) рослинам-нащадкам. Такі рослини можна вирощувати звичайним способом і схрещувати з рослинами, що мають такі ж трансформовані спадкоємні фактори або інші спадкоємні фактори. Отримані в результаті гібридні особи мають відповідні фенотипічні властивості. У переважному варіанті здійснення даного винаходу, рослини трансформують генами, у яких використання кодона оптимізовано для рослин. Див., наприклад, патент США № 5380831, включений у даний документ у вигляді посилання. Хоча в даному документі як приклади приведені укорочені токсини, в галузі використання Bt добре відомо, що 130 кДа (повнорозмірні) токсини мають N-кінцеву половину, що є ядром токсину, і С-кінцеву половину, що являє собою "хвіст" протоксину. Таким чином, з укороченими/ядерними токсинами за даним винаходом можна використовувати придатні "хвости". Див., наприклад, патент США № 6218188 і патент США № 6673990. Крім цього, способи створення синтетичних Bt генів для використання в рослинах відомі в даній галузі техніки (Stewart and Burgin, 2007). Одним з необмежуючих прикладів трансформованої рослини є плодоносна рослина маїсу, що містить експресований рослиною ген, що кодує білок Vip3Ab, і що додатково містить експресований рослиною ген, що кодує білок Cry1Са. Перенесення (або інтрогресія) ознаки(ознак) обумовленої Vip3Ab і Cry1Са в інбредні лінії маїсу може досягатися шляхом виведення рослин на основі рекурентного відбору, наприклад, шляхом зворотного схрещування. У цьому випадку, бажаний рекурентний батько спочатку схрещується з донорною інбредною особиною (нерекурентним батьком), що несе придатний ген(и) для ознак, обумовлених Vip3Ab і Cry1C. Потім потомство від цього зворотного схрещування спаровують з рекурентним батьком з наступним відбором отриманого потомства по бажаній ознаці(ах), що повинна бути перенесена від нерекурентного батька. Після трьох, переважно, чотирьох, більш переважно, п'яти або більше поколінь отриманих методом зворотного схрещування з рекурентним батьком у результаті відбору по бажаній ознаці(ах), потомство стає гетерозиготним по локусі, що контролює переносиму ознаку(и), але залишається подібним до рекурентного батька по більшості або майже по всіх інших генах (див., наприклад, Poehlman & Sleper (1995) Breeding Field Crops, 4th Ed., 172-175; Fehr (1987) Principles of Cultivar Development, Vol. 1: Theory and Technique, 360-376). Стратегії керування стійкістю комах (IRM). Наприклад, Roush et al. описує стратегії з двома токсинами, що також називається створенням "пірамід" або "пакетів", для керування трансгенними рослинами, що мають інсектицидні властивості. (The Royal Society. Phil. Trans. R. Soc. Lond. B. (1998) 353, 1777-1786). На іншому веб-сайті Агентство США по захисту навколишнього середовища (epa.gov/oppbppdl/biopesticides/pips/bt_corn_refuge_2006.htm) опублікувало наступні вимоги для забезпечення нетрансгенних (тобто що не містить Bt генів) сховищ (розділ зернові культури/кукурудза, що не містять Bt генів) для використання з трансгенними зерновими культурами, продукуючими один Bt білок, активний стосовно цільових комах-шкідників. "Конкретні структуровані вимоги до кукурудзи, захищеної від кукурудзяного метелика білками Bt 9 UA 111936 C2 5 10 15 20 25 30 35 40 45 50 55 60 (Cry1Ab або Cry1F) є наступними: Структуровані сховища: 20 % сховища з кукурудзи, що не має Bt захисту від лускокрилих в областях, де кукурудза є основною культурою; 50 % сховища з рослин, що не мають Bt захисту від лускокрилих, в областях, де бавовна є основною культурою; Блоки: Внутрішні (тобто усередині Bt поля). Зовнішні (тобто окремі поля в межах 1/2 милі (1/4 милі, якщо можливо) від Bt поля для забезпечення максимального обсягу випадкового спарювання). Розташовані на полі смуги Смуги повинні мати щонайменше 4 ряди в ширину (переважно 6 рядів) для зменшення ефекту переміщення личинок". Крім цього, Національна Асоціація Виробників Кукурудзи на своєму веб-сайті (ncga.com/insect-resistance-management-fact-sheet-bt-corn) також представила схожі рекомендації відносно вимог на сховища. Наприклад: "Вимоги відносно IRM для метелика кукурудзяного: - засівати щонайменше 20 % від площі посіву кукурудзи під гібриди-сховища. - У регіонах, що вирощують бавовну, сховища повинні складати 50 %. - Посіви необхідно висаджувати в межах 1/2 милі від гібридів-сховищ. - Сховища можна засівати у вигляді смуг усередині Bt поля; смуги-сховища повинні складати щонайменше 4 ряди в ширину. - Сховища можуть оброблятися звичайними пестицидами тільки у випадку досягнення економічного порога, що досягається для цільової комахи. - Основані на Bt розпилювані інсектициди не можна використовувати відносно кукурудзисховища. - Придатні сховища необхідно висаджувати на кожній фермі з Bt кукурудзою". Як зазначено в Roush et al. (наприклад, на стор. 1780 і 1784, права колонка), створення пакетів або пірамід із двох різних білків, кожний з який є активним відносно цільової комахишкідника, і з малою або без перехресної стійкості може забезпечувати можливість використання менших сховищ. Roush указує, що для успішно розробленого пакета розмір сховища менший ніж 10 % може забезпечити ефект по керуванню стійкістю, порівнянний з 50 % притулком для одиночного (на організованого у вигляді піраміди) ознаки. Для доступних у даний час Bt продуктів кукурудзи Агентство Захисту Навколишнього Середовища США вимагає істотно меншого обсягу (звичайно 5 %) висаджених структурованих сховищ кукурудзи, що не містить Bt гени, ніж у випадку продуктів з єдиною ознакою (звичайно 20 %). Існують різні способи забезпечення IRM ефектів сховищ, включаючи різні геометричні патерни саджань на полях (як уже згадувалося вище) і змішування насіння перед висіванням як обговорювалося в Roush et al. (см. вище) і в патенті США № 6551962. Приведені вище процентні співвідношення або близькі до них співвідношення сховищ можуть використовуватися для розглянутих подвійних і потрійних пакетів або пірамід. Для потрійних пакетів і трьома місцями дії на одну цільову комаху-шкідника цільовим значенням є нульова площа сховища (або сховище із площею, наприклад, менше 5 %). Це особливо вірно для комерційних посівних площ, наприклад, більших ніж 10 акрів. Усі патенти, заявки на патент, попередні заявки і публікації, на які приведені посилання або які цитуються в даному документі, включені у вигляді посилання у всій своїй повноті в тій частині, у якій вони не суперечать зведенням, у явному вигляді приводиться в даному описі. За винятком випадків, коли це спеціально обговорено або випливає з контексту, граматичні форми однини варто розуміти як означаючі "щонайменше один". Нижче приведені приклади, що ілюструють способи здійснення винаходу. Ці приклади не слід розглядати як обмежуючі. Усі процентні співвідношення зазначені по масі, а співвідношення в розчинах зазначені по об'єму. Усі температури зазначені в градусах Цельсія. ПРИКЛАДИ Приклад 1 - Одержання й обробка трипсином білків Vip3Ab і Cry1Сa Гени, що кодують протоксини Cry1Сa і Vip3Ab1 експресували в експресуючих штамах Pseudomonas fluorescens, і білки повної довжини виділяли у вигляді нерозчинних внутрішньоклітинних тілець. Промиті внутрішньоклітинні тільця солюбілізували перемішуванням при 37 °C у буфері, що містить 20 мМ CAPS буфера, pН 11, доповненому 10 мМ DDT і, 0,1 % 2меркаптоетанолом, протягом 2 годин. Розчин центрифугували при 27000x g протягом 10 хвилин 10 UA 111936 C2 5 10 15 20 25 30 35 40 45 50 55 60 при 37 °C, супернатант обробляли 0,5 % (ваг./об.) TCPK-оброблений трипсин (Sigma). Цей розчин інкубували при одночасному перемішуванні протягом 1 години при кімнатній температурі, фільтрували, потім завантажували в колонку Pharmacia Mono Q 1010, урівноважену 20 мм CAPS, p 10,5. Після промивання зарядженого колонки буфером у кількості 2-х об'ємів колонки укорочений токсин елюювали, використовуючи лінійний градієнт 0-0,5 M NaCl у 20 мм CAPS у кількості 15-ти об'ємів колонки зі швидкістю потоку 1,0 мол/хв. Очищені Cry білки, укорочені трипсином, елюювали, використовуючи приблизно 0,2-0,3 M NaCl. Чистоту білків оцінювали ДСН-ПААГ електрофорезом і візуалізували за допомогою барвника Кумасі діамантового синього. У деяких випадках об'єднані фракції очищеного токсину концентрували і завантажували в колонку із Сефарозою 6 (діаметром 1,6 см, довжиною 60 см) і очищали гельхроматографією. Фракції, які містять один пік, що відповідає молекулярній вазі мономера, об'єднували і концентрували, одержуючи препарат, гомологічний більше ніж на 95 % білку з молекулярною вагою приблизно 60000 кДа. Обробку Vip3Ab1 проводили аналогічним чином, узявши як вихідний білок очищений 85 кДа білок повної довжини (DIG-307). Білок (12 мг) діалізували в 50 мм натрій фосфатного буфера, pН 8,4, потім обробляли шляхом додавання 1 мг твердого трипсину і інкубували протягом 1 години при кімнатній температурі. Розчин завантажували в Mono аніонно-обмінний стовпчик (діаметром 1 см, довжиною 10 см) і елюювали, використовуючи лінійний градієнт 0-500 мМ NaCl у 20 мМ натрій фосфатному буфері, pН 8,4, у кількості, що дорівнює 7-ми об'ємам колонки. Елюювання білка контролювали ДСН-ПААГ електрофорезом. Основна оброблена смуга мала молекулярну вагу 65 кДа, визначену методом ДСН-ПААГ електрофорезу з використанням для порівняння стандартів молекулярної ваги. Приклад 2 - Йодування Cry1Ca білки ядра токсину Попередня робота показала, що Cry1Ca важко піддається введенню радіоактивної мітки з використанням традиційних способів, хоча в деяких особливих випадках він може бути оснащений радіоактивною міткою і добре працювати в аналізі зв'язування з рецептором. Для введення радіоактивної мітки в Cry1Ca було вирішено використовувати метод з використанням 125 I-міченого флуоресцеїн-5-малеіміду, що успішно працював при міченні Cry1Fa (Prov. 69919). Йодування флуоресцеїн-5-малеіміду і наступна кон'югація цього радіоактивно міченої хімічної речовини з Cry1Ca забезпечили цистеїн-специфічне мічення білка. Така процедура введення радіоактивної мітки є високо специфічною стосовно призначеного для мічення залишкам. Сегмент Cry1Ca ядра токсину (залишки 29-619) містить два амінокислотні цистеїнові залишки в положеннях 210 і 438. Palmer et al. (1997) показав, що фенільне кільце флуоресцеїн-5-малеіміду може бути йодоване за допомогою радіоактивного йоду. Потім йодований флуоресцеїн-5малеімід може реагувати з білками, що містять сульфгідрильні групи (що забезпечується, наприклад, вільними цистеїновими залишками), шляхом алкілування вільних цистеїнів у білку, і в такий спосіб утворити радіоактивно мічений білок. Укорочене трипсином ядро токсину Cry1Ca містить два цистеїнові залишки й у такий спосіб забезпечує субстрат для алкілування і введення радіоактивної мітки в цих двох (специфічних) ділянках білка. Флуоресцеїн-5-малеімід (F5-M) розчиняли в 10 мМ ДМСО (диметилсульфоксид), потім розводили до концентрації 1 мМ забуференим фосфатом розсолом (PBS; 20 мМ фосфат натрію, 0,15 М NaCl, pН 7,5), що визначали за коефіцієнтом молярної екстинкції F 5-M (68000 М 1 -1 см ). До 100 мкл розчину PBS, що містить дві гранули Pierce для йодування (Thermo Fisher 125 Scientific), додавали 1,0 мКі Na I за свинцевим екраном. Реакцію між компонентами проводили протягом 5 хвилин при кімнатній температурі, потім у цей розчин додавали 10 мкл 1 мМ розчину F 5-M. Після проведення реакції йодування протягом 10 хв видаляли розчин за допомогою піпетки, і до розчину додавали 2 мкг укороченого трипсином Cry1Ca білка ядра токсину високої чистоти в PBS. Білок інкубували при 4 °C с розчином йодованого F 5-M протягом 48 годин, потім реакцію зупиняли додаванням β-меркаптоетанолу до одержання кінцевої концентрації, що дорівнює 14 мМ. Реакційну суміш вводили в центрифугальну колонку Zeba™ (Invitrogen), урівноважену 20 мМ CAPS, 150 мМ KCl, pН 9, і центрифугували при 1500x g протягом 2 хв для 125 відділення йодованого барвника, що не прореагував, від білка. I-мічений флуоресцеїн-Cry1Ca білок ядра токсину вимірювали на гамма-лічильнику для визначення питомої радіоактивності, виходячи з припущення, що було витягнуто 80 % отриманого білка токсину. Питома активність радіоактивно міченого Cry1Ca білка ядра токсину склала приблизно 6,8 мкКі/мкг білка. Радіоактивно мічений білок також аналізували ДСН-ПААГ електрофорезом і візуалізували методом одержання зображення з використанням люмінесцентної сполуки для підтвердження того, що вибміряна радіоактивність є ковалентно зв'язаною з CrylCa білком ядра токсину. Пофарбовані Кумаси ДСН-ПААГ гелі SDS-PAGE візуалізували шляхом обгортання їх плівкою Mylar™ (товщиною 12 мкм) і експонування під люмінесцентним екраном Molecular 11 UA 111936 C2 5 10 15 20 25 30 35 40 45 50 Dynamics (Sunnyvale, CA) (35 см × 43 см) із тривалим післясвітінням протягом 1 години. Пластини виявляли в люмінесцентному пристрої візуалізації Molecular Dynamics Storm 820, і зображення аналізували за допомогою програмного забезпечення ImageQuant™. Невелика радіоактивність була зареєстрована в області гелю, розташованій набагато нижче смуги Cry1Ca білка ядра токсину (тобто, фрагментів, що були по розмірі менше Cry1Ca білка ядра токсину на приблизно 10 кДа і більше). Ці радіоактивні речовини, певно, являли собою невеликі пептиди, можливо, асоційовані з укороченим Cry1Ca білком унаслідок впливу трипсину, використаного для розщеплення білка до його ядерної структури. Приклад 3 - Порівняльний аналіз зв'язування BBMV, виділеного з S. frugiperda, з білками ядра токсину Cry1Ca і Vip3Ab Аналіз конкурентного гомологічного і гетерологічного зв'язування виконували, 125 використовуючи 150 мкг/мл BBMV білка і 2 нМ I-міченого Cry1Ca білки ядра токсину. Концентрації гомологічного конкурентного неміченого Cry1Ca білка ядра токсину, доданого до реакційної суміші, складали 0,1, 1, 10, 100 і 1000 нМ. Гетерологічний укорочений трипсином Vip3Ab білок досліджували при концентраціях 10 і 1000 нМ, і білки додавали одночасно з радіоактивним Cry1Ca білком ядра токсину для гарантії наявності щирої конкуренції за 125 зв'язування. Інкубацію проводили протягом 1 години при 28 °C, і I-мічений Cry1Ca білок ядра токсину, незв'язаний з BBMV (тобто, не зв'язаного з рецепторним білком комах), відокремлювали від зв'язаного білка центрифугуванням суміші BBMV при 16000x g протягом 8 хв і відділенням супернатанту від отриманого осаду. Осад промивали три рази охолодженим льодом буфером для зв'язування (PBS; 11,9 мМ Na2HPО4, 137 мМ NaCl, 2,7 мМ KCl, pН 7,4 плюс 0,1 % бичачий сироватковий альбумін; Sigma-Aldrich, St. Louis, MO) для повного 125 видалення будь-якого незв'язаного I-міченого Cry1Ca. Дно центрифугальної пробірки з осадом, що знаходиться в ньому, відрізали і поміщали в 13×100 мм скляну культуральну пробірку, і за допомогою гамма-лічильників підраховували події протягом 10 хвилин для одержання кількості зв'язаної радіоактивності, що міститься в осадовій фракції. Кількість радіоактивності у фракції зв'язаного білка є показником кількості білка Cry, зв'язаного з рецептором комахи (загальне зв'язування). Неспецифічне зв'язування було представлено кількістю подій, отриманою в осаді в присутності 1000 нМ неміченого Cry1Ca білка ядра токсину. Кількість міченого Cry1Ca, специфічно зв'язаного з BBMV (специфічне зв'язування), одержували вирахуванням величини неспецифічного зв'язування з величини загального зв'язування. Вважалося, що сто відсотків загального зв'язування являє собою величину зв'язування при відсутності будь-якого конкурентного Cry1Fa білка ядра токсину. Дані виражені у відсотках 125 специфічного зв'язування I Cry1Ca залежно від концентрації конкуруючого неміченого ліганду. Приклад 4 - Короткий огляд результатів Результати (Фіг. 1) демонструють, що гомологічний немічений Cry1Ca білок ефективно замінює радіоактивно мічений Cry1Ca білок ядра токсину при специфічному зв'язуванні з BBMV 125 білком, причому це заміщення залежить від дози. Vip3Ab не замінює зв'язаний I-мічений CrylCa білок ядра токсину з рецепторного білка(ів) при обох показаних концентраціях (10 або 1000 нМ). Найвища досліджена концентрація Vip3Ab (1000 нМ) в 500 разів перевищує концентрацію радіоактивно міченого Cry1Ca, використаного в аналізі, демонструючи, що Vip3Ab не конкурує ефективно з радіоактивно міченим Cry1Ca за зв'язування з BBMV S. frugiperda. 125 Фіг. 1 являє собою криву доза-відповідь для заміщення I-міченого флуоресцеїн-5-малеімід укороченого трипсином Cry1Ca в BBMV, виділеному з личинки S. frugiperda (FAW). Ця фігура показує, що немічений Cry1Ca () здатний замінювати мічений Cry1Ca залежно від дози в діапазоні від 0,1 до 1000 нМ. На графіку показана процентна частка специфічно зв'язаного міченого Cry1Ca (загальне зв'язування мінус неспецифічне зв'язування) залежно від концентрації доданих лігандів без радіоактивної мітки. Показана нездатність Vip3Ab1 (▲) без радіоактивної мітки заміняти специфічно зв'язаний радіоактивно мічений Cry1Ca в концентраціях 10 і 1000 нМ. 12 UA 111936 C2 Джерела інформації: 13 UA 111936 C2 14 UA 111936 C2 15 UA 111936 C2 16 UA 111936 C2 17 UA 111936 C2 18 UA 111936 C2 19 UA 111936 C2 20 UA 111936 C2 21 UA 111936 C2 22 UA 111936 C2 23 UA 111936 C2 24 UA 111936 C2 25 UA 111936 C2 26 UA 111936 C2 27 UA 111936 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of vip3ab in combination with cry1ca for management of resistant insects
Автори англійськоюMeade, Thomas, Narva, Kenneth, Storer, Nicholas, P., Sheets, Joel, J., Woosley, Aaron, T., Burton, Stephanie, L.
Автори російськоюМид Томас, Нарва Кеннет, Сторер Николас П., Шитс Джоел Дж., Вусли Аарон Т., Бертон Стэфани Л.
МПК / Мітки
МПК: A01N 63/02, A01H 5/10, C07K 14/325, A01H 5/00, A01P 7/04, C12N 15/82
Мітки: vip3ab, білок, містить, cry1ca, яка, трансгенна, керування, днк, резистентністю, рослина, інсектицидний, кодує, комах
Код посилання
<a href="https://ua.patents.su/39-111936-transgenna-roslina-yaka-mistit-dnk-shho-kodueh-insekticidnijj-bilok-vip3ab-i-dnk-shho-kodueh-insekticidnijj-bilok-cry1ca-dlya-keruvannya-rezistentnistyu-komakh.html" target="_blank" rel="follow" title="База патентів України">Трансгенна рослина, яка містить днк, що кодує інсектицидний білок vip3ab, і днк, що кодує інсектицидний білок cry1ca, для керування резистентністю комах</a>
Попередній патент: Трансгенна рослина, яка містить днк, що кодує інсектицидний білок cry1ab, і днк, що кодує інсектицидний білок cry1be, для керування резистентністю комах
Наступний патент: Спосіб виявлення рослини zea mays, яка містить щонайменше один алель, асоційований з оптимізацією водоспоживання
Випадковий патент: Пакети, що складаються щонайменше з двох комплектів одиниць товарів, засіб, спосіб і пристрій для виготовлення пакетів