Сполука 2-(n-параметилфенілсукцинімідо-3)-меркаптобензойна кислота з потенційними біологічними властивостями
Номер патенту: 41657
Опубліковано: 25.05.2009
Автори: Драпайло Андрій Богданович, Вельчинська Валерія Валеріївна, Губський Юрій Іванович, Вельчинська Олена Василівна
Формула / Реферат
Сполука 2-(N-параметилфенілсукцинімідо-3)-меркаптобензойна кислота з потенційними біологічними властивостями загальної формули:
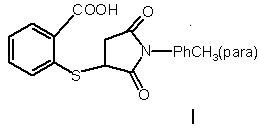 .
.
Текст
Сполука 2-(N-параметилфенілсукцинімідо-3)меркаптобензойна кислота з потенційними біологічними властивостями загальної формули: Корисна модель відноситься до хімії гетероциклічних сполук, а саме, до сполуки 2-(Nпараметилфенілсукцинімідо-3)-меркаптобензойна кислота (далі, сполука І) з потенційними біологічними властивостями та високою реакційною здатністю, які можуть проявлятися за рахунок наявності в будові молекули спряженої системи між ароматичними ядрами та фрагментом молекули циклічного іміду. В науковому світі інтенсивно досліджуються біологічно активні сполуки, що містять в будові фрагмент молекули насиченого або ненасиченого циклічного іміду і можуть стати основою нових лікарських засобів, (схема 1): психотропні агенти (г) та з іншими типами дії, (схема 2): N O O Alk або N Ph O Дані вітчизняних і зарубіжних наукових робіт свідчать про залежність і спрямованість фізіологічної дії речовини від будови введеного замісника в молекулу малеїніміду [1, 2]. Було синтезовано похідні малеїніміду з анксіолітичним типом дії (а, б); що впливають на постсинаптичні рецептори (в); N PhCH3(para) S O I O O R3 CH3 O R N R2 CH3 б O C2H5 в O CH3 O O (CH2)m~Cycl N R1 CH3 г 41657 a NH 2OS (11) NH (13) Схема 2 U . O Зацікавленість до цього класу сполук як до потенційного джерела протиепілептичних препаратів виникла після експериментальних досліджень [3]. N-вмісткі гетероциклічні сполуки менш нуклеофільні, у порівнянні з аліфатичними та ароматичними амінами, але їх нуклеофільність достатня для здійснення реакції Міхаеля [4]. При взаємодії малеїнімідів із заміщеним бензолом в присутності сірчаної кислоти або сірчаної та фосфорної кислот можливе отримання Nарилмалеїнімідів із збереженням або розкриттям циклу малеїніміду (схема 3), [5]: UA O O (19) Схема 1 COOH 3 41657 Схeмa 3 R2 R1 O R1 R3 N O R5 R3 O R2 NH або R4 OR R5 O R4 R1-R5 = H, Hal, NO2, OH, COOH, Ph, SO3H Огляд літературних даних дає можливість прогнозувати, що в результаті нуклеофільного приєднання молекул ароматичних поук з активною меркаптогрупою до N-заміщеного малеїніміду можливе утворення нових сполук з потенційною біологічною активністю: протипухлинною, протисудомною, а також антимікробною дією [1, 8, 9]. Раніше авторами були синтезовані нові гетероциклічні похідні сукцинімідів шляхом нуклеофільного приєднання по подвійному зв'язку молекули малеїніміду амінотіоурацилів [6, 7]. Даний метод синтезу нових сукцинімідів перенесено нами на ароматичні сполуки з меркаптогрупою, а саме 2-меркаптобензойну кислоту. Структурні аналоги сполуки 2-(Nпараметилфенілсукцинімідо-3)-меркаптобензойна кислота (далі, сполука І) з потенційними біологічними властивостями в літературі не описано. Сполука І синтезована з метою отримання нового поліфункціонального циклічного синтону для подальшого вивчення її фізико-хімічних та біологічних властивостей, а також вивчення можливості проходження хімічних реакцій між ароматичними сполуками з активною меркаптогрупою та Nзаміщеними малеїнімідами. 4 В основу корисної моделі поставлено хімічну будову молекули сполуки 2-(Nпараметилфенілсукцинімідо-3)-меркаптобензойна кислота (далі, сполука І) з потенційними біологічними властивостями шляхом взаємодії Nпараметилфеніл-малеїніміду та 2меркаптобензойної кислоти у молярному співвідношенні 1:1. На відмінність від імідів насичених дикарбонових кислот іміди ненасичених дикарбонових кислот мають у складі молекули активований двома карбонільними групами подвійний зв'язок, який здатен при певних умовах приєднувати нуклеофільні реагенти з утворенням похідних сукциніміду. В результаті спряження карбонільних груп з гетероатомом азоту електрофільна активність карбонільних груп малеїніміду знижена і саме на атомах вуглецю етиленового зв'язку знаходиться значний за величиною позитивний заряд, (схема 4): Схeмa 4 + + .. N O O R Типовим прикладом нуклеофільного приєднання по подвійному зв'язку є взаємодія Nзаміщеного малеїніміду з 2-меркаптобензойною кислотою. Реакції проводилися у системі розчинників (бензол-піридин) при температурі 60-80°С та перемішуванні реакційної суміші 3 години з обробкою продукту реакції розчином етилового спирту у воді (1:1) та безводним бензолом, фільтруванням, сушкою у вакуумі водострумного насосу, (схема 5). Схeмa 5 COOH + O N SH COOH PhCH3(para) to, C6H6 N Py O Позитивними рисами описаного методу синтезу є легкість його проведення та простота обробки кінцевого продукту. Варіювання умов проведення реакцій та внесення змін до методики синтезу, а саме: обробка продукту реакції розчином етилового спирту у воді (1:1) та безводним бензолом, дозволили збільшити практичний вихід сполуки І до 38%. УФ - спектр сполуки І характеризується наявністю λмах при 240нм. В той час, як УФ - спектр стандартної речовини (сукциніміду) відрізняється наявністю інтенсивної смуги при 207нм і малоінтенсивної смуги при 243нм (за рахунок спряження груп С=O, ρ-електронів гетероатому азоту). -1 В ІЧ-спектрі сполуки І в області 600-900см спостерігаються інтенсивні смуги непласких деформаційних коливань С-Н ароматичних кілець, в той час як валентні коливання С-С зв'язків бензольних ядер при 1585-1600см-1 та 1400-1500см-1 ідентифі O PhCH3(para) S O кувати неможливо, так як дані області спектру близькі до коливань зв'язку С=С, >N-H групи. В ІЧспектрі стандартної речовини (сукцинімід) деформаційні коливання С-Н ароматичного кільця в області 600-900см-1 відсутні. В ІЧ-спектрі сполуки І смуги ON-R спостерігаються в області 1470, -1 1495см , а смуги δN-R при бензольному кільці - в області 2910-2930см-1. Валентні коливання карбонільних груп С=О сполуки І проявляються високоінтенсивним максимумом в області 1680-1750см-1 (дві смуги) і є найбільш характеристичними, так як інші смуги в даній області практично відсутні. І ЯМР Н спектр сполуки І має сигнали у вигляді дублетів дублетів при 7,0-7,65м.д., що відповідає протонам ароматичних кілець, сигнал у вигляді дублету при 2,6-2,85м.д., що відповідає двом протонам молекули сукциніміду в четвертому положенні, сигнал у вигляді триплету при 3,9-4,12м.д., який відповідає протону молекули сукциніміду в 5 41657 третьому положенні. Сигнал у вигляді триплету спостерігається при 2,2-2,4м.д. та відповідає протонам СН3-групи при ароматичному кільці. Положення сигналу від протону карбоксильної групи відповідає теоретичному значенню і спостерігається при 10,0-13,0м.д. Таким чином, можна зробити висновок, що сполука І з потенційними біологічними властивостями може бути перспективною у розробці нових лікарських засобів з проти-судомною активністю, з анксіолітичним типом дії; що впливають на постсинаптичні рецептори, психотропних агентів та з іншими типами дії. Ознаки способу Методики синтезу сполуки 2-(Nпараметилфенілсукцинімідо-3)-меркаптобензойна кислота (І). До розчину 0,44г (0,0024 моль) Nпараметилфенілмалеїніміду в 10мл бензолу безводного додають 0,37г (0,0024 моль) 2меркаптобензойної кислоти в 10мл піридину безводного, витримують реакційну суміш при температурі 60-80°С та перемішуванні 3 години. Осад, що утворився, відфільтровують, промивають розчином етилового спирту у воді (1:1), безводним бензолом, фільтрують, сушать у вакуумі водострумного насосу. Залишок - осад світло-жовтого забарвлення промивають під час фільтрування в вакуумі сухим гексаном, сушать на повітрі. Практичний вихід 0,30г (38%). Ттопл. 135-138°С. Індивідуальність сполуки І контролювали методом тонкошарової хроматографії, склад підтверджували даними елементного аналізу. ТШХ виконували на пластинах Silufol-254. ГРХ проводили на газорідинному хроматографі "Perkin Еlmer" з УФ-детектором (виробник "Perkin", Germany). УФ-спектр сполуки І записували на спектрофотометрі Mel Temp II (USA). ІЧ-спектр записували на спектрофотометрі UR-20 (виробник "Charles Ceise Hena", Germany). l Спектри ЯМР Н сполуки І записували на приладах "Bruker WP-200" (виробник "Bruker", 6 Switzerland) або "Varian Т-60" (виробник "Varian", USA) з робочою частотою 200-132МГц у виді розчину ДМСО-D6 (внутрішній стандарт ГМДС). Хроматограма, УФ, ІЧ, ЯМР'Н спектри сполуки І ідентифікували у порівнянні з хроматограмами, l УФ, ІЧ, ЯМР H спектрами вихідних сполук. Синтезована сполука І - це кристалічний порошок світло-жовтого забарвлення. Дані елементного аналізу на С, Н, N сполуки І відповідають обчисленим значенням. В УФ-спектрі сполуки І ідентифіковано значення λмах при 240нм. В ІЧ-спектрі сполуки І смуги непласких деформаційних коливань С-Н ароматичних кілець спостерігаються в області 600-900см-1, в той час як валентні коливання С-С зв'язків бензольних ядер при 1585-1600см-1 та 1400-1500см-1 ідентифікувати неможливо, так як дані області спектру близькі до коливань зв'язку С=С, >N-H групи. В ІЧ-спектрі сполуки І ідентифіковано смуги δN-R в області 1470, -1 1495см , смуги νCH3 при бензольному кільці - в області 2910-2930см-1. Валентні коливання карбонільних груп С=O сполуки І ідентифіковано як ви-1 сокоінтенсивний максимум в області 1680-1750см (дві смуги) і є найбільш характеристичними, так як інші смуги в даній області практично відсутні. Співвідношення інтегральних інтенсивностей сигналів в ЯМРlН спектрі сполуки І підтверджує наявність протонів ароматичних кілець у вигляді дублетів дублетів при 7,0-7,65м.д., двох протонів молекули сукциніміду в четвертому положенні та протону молекули сукциніміду в третьому положенні у вигляді дублету при 2,6-2,85м.д. та триплету при 3,9-4,12м.д. відповідно. Ідентифіковано сигнал у вигляді триплету при 2,2-2,4м.д., який підтверджує наявність протонів СН3-групи при ароматичному кільці, синглет при 10,0-13,0м.д. протону карбоксильної групи. Віднесення сигналів І в ІЧ та ЯМР Н спектрах сполуки І наведено в Таблиці. Таблиця Віднесення сигналів в ІЧ, ЯМРІH спектрах, дані елементного аналізу сполуки І Знайдено, у % С Н N 63,13; 4,28; 4,07 Брутто-формула C18H15NО4S Спектр I ЯМP Н (ДМСО-D6), С Н N ∂, м.д. (J, Гц) 2,2-2,4 (т., СН3, 3Н); 2,6-2,85 600-900 (C-H,Ph); (д., Sue., 2H (4 position)); 3,91470,1495 (>N-R); 63,33; 4,4; 4,10 4,12 (т., Sue., 1Н (3 position)); 1680-1750 (C=O); 7,0-7,65 (д.д., д.д., 2 Ph, 8H); 2910-2930 (СН3-Ph). 10,0-13,0 (с., СООН, 1Н). Обчислено, у % Таким чином, можна зробити висновок, що сполука І з потенційними біологічними властивостями за рахунок наявності в молекулі фармакофорних угрупувань може бути перспективною у створенні нових лікарських засобів. На основі літературних даних, шляхом порівняння хімічної будови сполуки І із сполуками описаними в літературі, можна передбачити, що наявність в її молекулі ароматичних фрагментів та сукциніміду одно ІЧ-спектр -1 (KBr), см , γ часно можуть наділити її анксіолітичними властивостями. Завданням корисної моделі є опис хімічної будови нової сполуки І з потенційними біологічними властивостями та високою реакційною здатністю, які можуть проявлятися за рахунок наявності в будові молекули спряженої системи між ароматичними ядрами та фрагментом молекули циклічного іміду. 7 41657 Джерела інформації: 1. Magid Abou - Gharbia, Usha R. Patel and all. // J. Med. Chem. - 1988. - Vol.31, №7. - P.1382-1385. 2. Richards M.N. (Merrel D., Res. hist. 67084, Strasbourg, Fr.) // J. Pharmacol. Exp. Ther. - 1990. 255(1). - P. 83-89. 3. Amagat P. // Traite de Chemie Organique. 1941. - Vol. 13. - P. 502-521. 4. N. Fehling // Arm. - 1844. - Vol.49. - P. 198. 5. Bunge // Ann. Suppl. - 1870. - Vol.7. - P.118. 6. Пат.18825 Україна. МПК C07D239/553, А61КЗЗ/16.С07С 21/00. Сполуки N-феніл-3(уридин-2'-тіо-4'-гідроксі-6'-аміно)сукцинімід та Nпара-метоксифеніл-3-(уридин-2'-тіо-4'-гідроксі-6'аміно)сукцинімід з потенційними фізіологічними властивостями / Губський Ю.І., Вельчинська О.В. Комп’ютерна верстка М. Ломалова 8 (Україна); Заявл.09.06.06; Опубл. 15.11.06, Бюл. №11. - 8с. 7. Пат.18096 Україна. МПК C07D239/553.A61K33/16.C07C 21/00. Сполуки Nпара-бромфеніл-3-(уридин-5'-аміно)сукцинімід та N-пара-бромфеніл-3-(уридин-6'-аміно)сукцинімід з потенційними фізіологічними властивостями/ Губський Ю.І., Вельчинська О.В. (Україна); Заявл.24.05.06; Опубл. 16.10.06, Бюл. №10. - 8с. 8. M. Farcaslu, R. Istratolu, Rev. Roum. Chim., Vol. 15, №12, 253 (1970). 9. Jnove Massayasu, Jwao Ebashi, Tetsuo Tkigawo Eur. Pat. Appl. Ep 507, 348 (C1.C12N9/02), 07.Оct. 1992, Jp. Appl. 91/102,023,05. Apr. 1991.//Chem. Abstr. - 1993. Vol.118, 55129j. Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCompound 2-(n-paramethylphenylsuccinimido-3)-mercaptobenzoic acid with potential biological properties
Автори англійськоюHubskyi Yurii Ivanovych, Velchynska Olena Vasylivna, Drapailo Andrii Bohdanovych, Velchynska Valeria Valeriivna
Назва патенту російськоюСоединение 2-(n-параметилфенилсукцинимидо-3)-меркаптобензойная кислота с потенциальными биологическими свойствами
Автори російськоюГубский Юрий Иванович, Вельчинская Елена Васильевна, Драпайло Андрей Богданович, Вельчинская Валерия Валерьевна
МПК / Мітки
МПК: C07C 21/00, A61K 33/00, C07D 239/00
Мітки: сполука, 2-(n-параметилфенілсукцинімідо-3)-меркаптобензойна, кислота, біологічними, властивостями, потенційними
Код посилання
<a href="https://ua.patents.su/4-41657-spoluka-2-n-parametilfenilsukcinimido-3-merkaptobenzojjna-kislota-z-potencijjnimi-biologichnimi-vlastivostyami.html" target="_blank" rel="follow" title="База патентів України">Сполука 2-(n-параметилфенілсукцинімідо-3)-меркаптобензойна кислота з потенційними біологічними властивостями</a>
Попередній патент: Спосіб отримання сполуки 2-(n-ортохлорфенілсукцинімідо-3)-меркаптобензойна кислота з потенційними біологічними властивостями
Наступний патент: Спосіб оцінки порушень ліпідного метаболізму у дітей з цукровим діабетом
Випадковий патент: Берегозахисна споруда








