Сполука n-парахлорфеніл-3-(1-[2-піридин-2-іл-етил]піперазину)-сукцинімід з потенційними фізіологічними властивостями
Номер патенту: 36940
Опубліковано: 10.11.2008
Автори: Кобко Олександр Сергійович, Губський Юрій Іванович, Скибюк Ганна Василівна, Вельчинська Олена Василівна
Формула / Реферат
Сполука N-парахлорфеніл-3-(1-[2-піридин-2-іл-етил]піперазину)-сукцинімід з потенційними фізіологічними властивостями загальної формули:
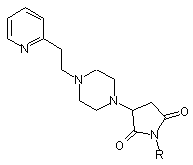 ,
,
де R = PhCl (пара).
Текст
Сполука N-парахлорфеніл-3-(1-[2-піридин-2іл-етил]піперазину)-сукцинімід з потенційними фізіологічними властивостями загальної формули: N N N Схема 1. O NH R2 CH 3 O N C 2H 5 CH 3 OS NH 2 O a R3 O O в Успішно застосовуються у медичній практиці такі лікарські засоби, що мають протисудомну активність, як етосуксімід, фенсуксімід, морсуксімід, метсуксімід, пуфемід. Їх застосовують при лікуван O б R CH 3 O N R1 CH 3 O (CH 2)m- Cycl г ні малих приступів епілепсії, а також при міоклонічних приступах, пікнолептичних приступах та непікнолептичних приступах у підлітків, які супроводжуються короткочасною втратою свідо (13) 36940 Інтенсивно досліджуються біологічно активні сполуки, що містять в будові фрагмент молекули насиченого або ненасиченого циклічного іміду і можуть стати основою нових лікарських засобів [1, 2]. Було синтезовано похідні малеїніміду з анксіолітичним типом дії (а, б); що впливають на постсинаптичні рецептори (в); психотропні агенти (г) та з іншими типами дії, (схема 1): U , (11) Корисна модель відноситься до хімії гетероциклічних сполук, а саме, до сполуки Nпарахлорфеніл-3-(1-[2-піридин-2-ілетил]піперазину)-сукцинімід (далі, сполука І) з потенційними фізіологічними властивостями та високою реакційною здатністю, які можуть проявлятися за рахунок наявності в будові молекули спряженої системи між ароматичними ядрами та фрагментом молекули циклічного іміду. R UA де R = PhCl (пара). N (19) O O 3 36940 мості, короткочасних втратах свідомості у маленьких дітей, атипових загальних приступах при вторинній епілепсії, тяжких комплексних приступах. Зацікавленість до цього класу сполук, як до потенційного джерела протиепілептичних препаратів, виникла після експериментальних досліджень, що проведені науковцями у 1936 p. [3]. Описано метод синтезу поліциклічних гетероарилпіперазинілімідів реакцією арил- або гетероарилпіперазинів з поліциклічними алкілімідами, (схема 2) [1]: Схема 2. O O N NH O 4 Реакцією сульфалену з малеїнімідом в ацетоні в умовах фотолізу за допомогою L-ртутної лампи типу Hanovia 450-W синтезовано тетрагідротієноциклобутапіроледіон-2,2-діоксид, (схема 3) [1]: Схема 3. O O O S + NH O h, ацетон O O S O NH O Синтезована сполука вступає в реакції заміщення по атому водню при гетероатомі азоту, (схема 4): O Схема 4. O O O O NH + HN S N R O Br(CH2)4 Br O S O N (СH2 )4 N O N N-вмісні гетероциклічні сполуки менш нуклеофільні, у порівнянні з аліфатичними та ароматичними амінами, але їх нуклеофільність достатня для здійснення реакції Міхаеля [4]. При взаємодії малеїнімідів із заміщеним бензолом в присутності сірчаної кислоти або сірчаної та фосфорної кислот можливе отримання Nарилмалеїнімідів із збереженням або розкриттям циклу малеїніміду, (схема 5) [5]: R Фрагмент гомополімеру, який утворюється при цьому, може мати наступний вигляд, (схема 7): С хема 7 Схема 5. R2 R1 R1 O O R5 R4 O R3 N R3 NH R2 або OR R4 R5 O R 1-R 5 = H, Hal, NO 2, OH, COOH, Ph, SO3H Термічна циклізація N-арилмалеїнімідів з фенолами призводить до утворення біциклічних продуктів наступного типу, які можуть виділятися як екзо- і ендоциклоадукти або утворювати полімери, наприклад, при УФ-опроміненні, (схема 6) [6]: Схема 6. O R N Ar O R=OPh, орто-HOC 6H4-, пара-CH3C6 H4 O Огляд літературних даних дає можливість прогнозувати, що в результаті нуклеофільного приєднання молекул складних азотовмісних циклічних систем (піридин-піперизинів, бензотієнотіопіримідинів, морфолін-амінів, піридин-амінів) до Nзаміщеного малеїніміду можливе утворення нових сполук з потенційною біологічною активністю: протипухлинною, протисудомною, а також антимікробною дією [1, 7, 8]. Раніше авторами роботи були отримані нові гетероциклічні похідні малеїнімідів шляхом нуклеофільного приєднання по подвійному зв'язку [9, 10]. Вважається, що малеїніміди взаємодіють з ароматичними амінами через утворення проміжних донорно-акцепторних комплексів, з утворенням похідних аріламіносукцинімідів, як описано в літературі [11]. Даний метод синтезу нових похідних малеїнімідів перенесено на нові об'єкти - піридинпіперазини, а саме - на 1-[2-піридин-2-іл-етил]піперазин. Структурні аналоги сполуки N-парахлорфеніл3-(1-[2-піридин-2-іл-етил]піперазину)-сукцинімід (далі, сполука І) з потенційними фізіологічними 5 36940 властивостями в літературі не описано. Сполука (І) синтезована з метою отримання нового поліфункціонального гетероциклічного синтону для подальшого вивчення її фізико-хімічних та біологічних властивостей, а також вивчення можливості проходження хімічних реакцій між Nзаміщеним малеїнімідом та піридинпіперазином. В основу корисної моделі поставлено хімічну будову молекули сполуки N-парахлорфеніл-3-(1[2-піридин-2-іл-етил]піперазину)-сукцинімід (далі, сполука І) з потенційними фізіологічними властивостями, яка отримана шляхом взаємодії Nпарахлорфеніл-малеїніміду з 1-[2-піридин-2-ілетил]піперазиному молярному співвідношенні 1:1. На відмінність від імідів насичених дикарбонових кислот іміди ненасичених дикарбонових кислот мають у складі молекули активований двома карбонільними групами подвійний зв'язок, який здатен при певних умовах приєднувати н уклеофільні реагенти з утворенням похідних сукцинімід. В результаті спряження карбонільних груп з гетероатомом азоту електрофільна активність карбонільних груп малеїніміду знижена і саме на атомах вуглецю 6 етиленового зв'язку знаходиться значний за величиною позитивний заряд, (схема 8): Схема 8. + + .. N O O R Типовим прикладом нуклеофільного приєднання по подвійному зв'язку є взаємодія Nзаміщеного малеїніміду з 1-[2-піридин-2-ілетил]піперазином. Реакції проводилися в бензолі при кімнатній температурі протягом 24 годин з наступною перекристалізацією в ізопропіловому спирті та сушкою отриманого продукту реакції. Позитивними рисами описаного методу синтезу є легкість його проведення та простота обробки кінцевого продукту, (схема 9): Схема 9. O N R N O N C6H6 , де R=PhCl (para) N NH N N O O N R N-парахлорфеніл-3-(1-[2-піридин-2іл-етил]піперазину)-сукцинімід (сполука І) Варіювання умов проведення реакцій та вне1680-1750см-1 (дві смуги) і є найбільш характериссення змін до методики синтезу, а саме: тичними, так як інші смуги в даній області практичкристалізація із ізопропілового спирту та проно відсутні. мивання залишку - осаду під час фільтрування в ЯМРIН спектр сполуки (І) має сигнали у виглявакуумі сухим гексаном дозволили збільшити ді дублета дублетів при 6,54-7,35 м.д., що відповіпрактичний вихід сполуки (І) до 68%. дає протонам ароматичного кільця, характерні сигнали у вигляді дублетів при 7,22; 7,45; 8, 53; УФ-спектр сполуки (І) характеризується lмах 8,59 м.д., що відповідає протонам піридинієвого при 250нм. кільця, сигнали у вигляді дублетів при 2,77-3,87 В ІЧ-спектрі сполуки (І) в області 600-900см-1 м.д., що відповідає двом протонам молекули сукспостерігаються інтенсивні смуги непласких дефоциніміду в четвертому положенні, сигнал у вигляді рмаційних коливань С-Н ароматичних кілець, в той триплету при 4,72 м.д., що відповідає протону мочас як валентні коливання С-С зв'язків бензольних лекули сукциніміду в третьому положенні. Крім ядер при 1585-1600см-1 та 1400-1500см-1 ідентифітого, ідентифіковано сигнали протонів молекули кувати неможливо, так як дані області спектру піперазину в області 2,03-3,24 м.д. та сигнали проблизькі до коливань зв'язку С=С, >N-Н групи. В ІЧтонів етил-групи при 5,66-6,89 у вигляді мультиспектрі стандартної речовини (сукцинімід) дефорплетів. маційні коливання С-Н ароматичного кільця в обТаким чином, можна зробити висновок, що ласті 600-900см-1 відсутні. сполука (І) з потенційними фізіологічними властиДеформаційні коливання вторинної аміногрупи востями може бути перспективною у розробці номолекули сукциніміду дають нехарактеристичні вих лікарських засобів з проти-судомною активніссмуги середньої інтенсивності в області 1500тю, з анксіолітичним типом дії; що впливають на 1600см -1, а в ІЧ-спектрі сполуки (І) смуги dN-R спопостсинаптичні рецептори, психотропних агентів стерігаються в області 1495см-1. Валентні колита з іншими типами дії. вання карбонільних груп (С=О) сполуки (І) проявМетодика синтезу сполуки N-парахлорфенілляються високоінтенсивним максимумом в області 7 36940 3-(1-[2-піридин-2-іл-етил]піперазину)-сукцинімід. До розчину 0,5г (0,0024моль) Nпарахлорфенілмалеїніміду в 6мл бензолу додають 0,46г (0,0024моль) 1-[2-піридин-2-ілетил]піперазину в 4мл бензолу. Реакційну суміш залишають при кімнатній температурі на 24 години. Залишок - осад жовтого забарвлення відфільтровують, кристалізують з ізопропілового спирту, промивають залишок під час фільтрування в вакуумі сухим гексаном, сушать у пістолеті Фішера. Вихід 0,65г (68%). Т.топл. 169-171°С. Обчислено (%):С 63,23; Н 5,81; О 8,02; N 14,05; СІ 8,89. Знайдено (%):С 63,18; Н 5,79; О 8,14; N 14,1; СІ 8,79. Індивідуальність сполуки (І) контролювали методом тонкошарової хроматографії, склад підтверджено даними елементного аналізу. ТШХ виконували на пластинах Silufol-254. ГРХ визначали на газорідинному хроматографі "Perkin Еlmеr" з УФдетектором (виробник "Perkin", Germany). УФ-спектр сполуки (І) записували на спектрофотометрі Mel Temp II (USA). ІЧ-спектр записували на спектрофотометрі UR-20 (виробник "Charles Ceise Hena", Germany). Спектри ЯМРІН сполуки (І) записували на приладах "Bruker WP-200" (виробник "Bruker", Switzerland), "Varian T-60" (виробник "Varian", USA) з робочою частотою 200-132МГц у виді розчинів ДМСО-D6 (вн утрішні стандарти ТМС та Г МДС). Хроматограма, УФ-, ІЧ-, ЯМРІН спектри сполуки (І) ідентифікували у порівнянні з хроматограмами, УФ-, ІЧ-, Я МРІH спектрами вихідних сполук. Синтезована сполука (І) - це кристалічний порошок жовтого забарвлення, ізолюється з кристалізацією із ізопропілового спирту, з метою очистки промивається сухим гексаном. Дані елементного аналізу на С, Н, О, N, СІ. сполуки (І) відповідають обчисленим значенням. В УФ-спектрі сполуки (І) ідентифіковано значення lмах при 250нм, в той час, як УФ-спектр стандартної речовини (сукциніміду) відрізняється на 8 явністю інтенсивної смуги при 207нм і мало інтенсивної смуги при 243нм (за рахунок спряження груп С=O, r-електронів гетероатому азоту). В ІЧ-спектрі сполуки (І) смуги непласких деформаційних коливань С-Н ароматичних кілець спостерігаються в області 600-900см -1, в той час як валентні коливання С-С зв'язків бензольних ядер при 1585-1600см -1 та 1400-1500см-1 ідентифікувати неможливо, так як дані області спектру близькі до коливань зв'язку С=С , >N-Н групи. В ІЧ-спектрі стандартної речовини (сукцинімід) деформаційні коливання С-Н ароматичного кільця в області 600900см -1 відсутні. Деформаційні коливання вторинної аміногрупи молекули сукциніміду дають нехарактеристичні смуги середньої інтенсивності в області 1500-1600см-1, а в ІЧ-спектрі сполуки (І) смуги dn-r спостерігаються в області 1495см -1. Валентні коливання карбонільних груп (С=O) сполуки (І) ідентифіковано як високоінтенсивний максимум в області 1680-1750см -1 (дві смуги) і є найбільш характеристичними, так як інші смуги в даній області практично відсутні. Співвідношення інтегральних інтенсивностей сигналів в ЯМРIН спектрі сполуки (І) підтверджує наявність протонів ароматичного кільця у вигляді дублета дублетів при 6,54-7,35 м.д., двох протонів молекули сукциніміду в четвертому положенні та протону молекули сукциніміду в третьому положенні у вигляді дублетів при 2,77; 3,87 м.д. та триплету при 4,72 м.д. відповідно. Ідентифіковано сигнали протонів молекули піперазину в області 2,03-3,24 м.д. у вигляді мультиплету та сигнали протонів піридінієвого кільця при 7,22; 7,45; 8, 53; 8,59 у вигляді дублетів. Сигнали протонів етилгрупи ідентифіковано при 5,66-6,89 м.д. у вигляді мультиплету. Віднесення сигналів в УФ-, ІЧ- та Я МРIН спектрах сполуки (І) наведено в таблиці. Таблиця Спектральні характеристики сполуки (І). Сполука І Брутто-формула C21H23ClN4O2 УФспектр lmax, нм 250 Таким чином, можна зробити висновок, що сполука (І) з потенційними фізіологічними властивостями може бути перспективною у розробці нових лікарських засобів. На основі літературних даних, шляхом порівняння хімічної будови сполуки (І) із сполуками описаними в літературі, можна передбачити, що наявність в її молекули фрагментів піридину, піперазину та сукциніміду одночасно можуть наді ІЧ-спектр (КВr), см -1, g Спектр ЯМРIН (ДМСО-D6), ¶, м.д. (J, Гц) 530-600 (ССl), 600-900 (C-H, Ph), 1495(>N-R), 1680-1750 (C=O) 2,03-3,24(м., Pyperaz.,8H); 2,77; 3,87 (д., д., Suc., 2H (4 position)), 4,72 (т., Suc., 1H (3 position)), 5,66-6,89 (м., СН2-СН2-, 4Н), 6,54 -7,35 (д.д., Ph, 4H); 7,22; 7,45; 8, 53; 8,59 (д., д., д., д., Ру, 4H) лити її фізіологічними властивостями [12]. Завданням корисної моделі є опис хімічної будови нової сполуки N-парахлорфеніл-3-(1-[2піридин-2-іл-етил]піперазину)-сукцинімід (сполука І) з потенційними фізіологічними властивостями та високою реакційною здатністю, які можуть проявлятися за рахунок наявності в будові молекули потужної спряженої системи. Джерела інформації: 9 36940 1. Magid Abou - Gharbia, Usha R. Patel and all. // J. Med. Chem. - 1988. - Vol.31, №7. - P.1382-1385. 2. Richards M.N. (Merrel D., Res. Inst. 67084, Strasbourg, Fr.) // J. Pharmacol. Exp. Ther. - 1990. 255(1). - P. 83-89. 3. Amagat P. // Traite de Chemie Organique. 1941. - Vol.13. - P. 502-521. 4. N. Fehling // Ann. - 1844. - Vol.49. - p. 198. 5. Bunge // Ann. Suppl. - 1870. - Vol.7. - p.118. 6. Franchimant, Friedmann // Rec.trav.chim. 1906. - Vol.25. - p.79. 7. Cooncy David A., Milman Harry A., Cable Ritchard G. // Biochem. Pharmacol. - 1978, 27(2), P. 151-166. 8. Balasubramaniyan V., Balasubramaniyan P., Shaikh A.S. // Tetrahedron. - 1986, 42(10), P.27312738. Комп’ютерна в ерстка А. Крулевський 10 9. Вельчинская Е.В., Кузьменко И.Й., Кулик Л.С. Синтез новых производных замещенных урацилов и пиримидинов.// Химикофармацевтический журнал. Росс. Федерация. 1999.- №3. - С.40-42. 10. Вельчинська О.В., Кузьменко І.Й., Драпайло А.Б. Синтез нових похідних заміщених малеїнімідів як потенційних фізіологічно активних агентів. Тези. доп. XVIII-ої Укр.конф.з орг.хімії. 1998. Дніпропетровськ, с.369. 11. М. Farcaslu, R. Istratolu, Rev. Roum. Chim., Vol. 15, №12, 253 (1970). 12. Watanabe S., Jgarashi Y. and all. (Fac. Eng., Chiba Unir., Chiba, Japan, 260) Ynt. Y. Mater. Prod. Technol. 1990, 5(4), 387-91 (Eng) // Chem. Abstr. 1991. - Vol.115, 45931р. Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCompound n-parachlorophenyl-3-(1-[2-pyridin-2-yl-ethyl]piperazine)-succinimide with potential physiological properties
Автори англійськоюHubskyi Yurii Ivanovych, Velchynska Olena Vasylivna, Skybiuk Hanna Vasylivna, Kobko Oleksandr Serhiiovych
Назва патенту російськоюСоединение n-парахлорфенил-3-(1-[2-пиридин-2-ил-этил]пиперазина)-сукцинимид с потенциальными физиологическими свойствами
Автори російськоюГубский Юрий Иванович, Вельчинская Елена Васильевна, Скибюк Анна Васильевна, Кобко Александр Сергеевич
МПК / Мітки
МПК: A61K 33/16, C07D 239/00, C07C 21/00
Мітки: n-парахлорфеніл-3-(1-[2-піридин-2-іл-етил]піперазину)-сукцинімід, потенційними, властивостями, сполука, фізіологічними
Код посилання
<a href="https://ua.patents.su/5-36940-spoluka-n-parakhlorfenil-3-1-2-piridin-2-il-etilpiperazinu-sukcinimid-z-potencijjnimi-fiziologichnimi-vlastivostyami.html" target="_blank" rel="follow" title="База патентів України">Сполука n-парахлорфеніл-3-(1-[2-піридин-2-іл-етил]піперазину)-сукцинімід з потенційними фізіологічними властивостями</a>
Попередній патент: Сполука n-парахлорфеніл-3-(1-[3-хлор-5(трифторметил)піридин-2-іл]піперизино)-сукцинімід з потенційними фізіологічними властивостями
Наступний патент: Сполука n-параметоксифеніл-3-(1-[2-піридин-2-іл-етил] піперазину)-сукцинімід з потенційними фізіологічними властивостями
Випадковий патент: Лабораторний картридж-реактор для гідрогенізації багатокомпонентної рідинної композиції









