Гідратований аміачний пірофосфат нікелю
Номер патенту: 6383
Опубліковано: 16.05.2005
Автори: Жиляк Іван Дмитрович, Войтенко Лариса Владиславівна, Копілевич Володимир Абрамович
Формула / Реферат
Гідратований аміачний пірофосфат нікелю, що одночасно містить макро- і мікроелементи живлення рослин, який відрізняється тим, що як аніон містить пірофосфат-іон, а для одержання продукту індивідуального складу з загальною формулою Nі2Р2O7·nNH3·mН2О, де n=2-3, m=5-8, як вихідний фосфат використовують кристалічний Nі2Р2O7·6Н2О.
Текст
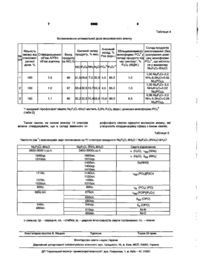
Гідратований аміачний пірофосфат нікелю, що одночасно містить макро- і мікроелементи живлення рослин, який відрізняється тим, що як аніон містить пірофосфат-іон, а для одержання продукту індивідуального складу з загальною формулою Ni2P2O7nNH3-mH2O, де n=2-3, m=5-8, як вихідний фосфат використовують кристалічний Ni2P2O7-6H2O. Корисна модель відноситься до нових хімічних речовин координаційної будови, а саме сполук нікелю з аміаком та пірофосфат-іоном у твердому стані загальної формули Ni2P2O7-nNH3-mH2O, де п=2-3; т=5-8. Так як синтезована речовина містить одночасно мікроелемент нікель та макроелементи живлення рослин азот і фосфор, то її можна використати у якості біологічно активної сполуки, а також в органічному синтезі як каталізатор. В хімії відомі координаційні сполуки в твердому стані, що відносяться до аміакатів нікелю і містять одночасно іони Ni 2 + аміак, воду та іони СІ" або NO3", або SO42" [Реми Г. Курс неорганической химии. - М.: "Мир", 1974, Т.2, С.316]. Відоме використання подібних сполук для синтезу координаційних сполук металів, у якості лікарських засобів, продуктів для одержання металів високої чистоти, металічного покриття та струмопровідних плівок [Химическая энциклопедия. М.: "Советская энциклопедия", 1988, Т.1, С.151]. Найбільш близькими за хімічною суттю і досягнутим результатом до корисної моделі, що передбачається, є аміакат нікелю складу [Ni(NH3)6]SO4-2H2O або [Ni(NH3)6]SO4-H2O чи [Ni(NH3)6]SC>4, одержаний шляхом пропускання газоподібного аміаку через насичений водний розчин сульфату нікелю та промивання осаду розчином аміаку і ефіру або його нагріванням до HOC, описаних в прототипі: Sato Т., Suda Т., Uchida H., Okabe T. Solubility of hexaaminenickel (II) complexes in aqueous ammonia solution and the thermal decomposition of ammine complexes of nickel (Il)//Bull. Chem. Soc. Japan. - 1978. - V.51, №8. P.2310-2316. Недоліком найближчого аналога стосовно об'єкту, що заявляється, є неможливість одержання гідратованого аміачного пірофосфату нікелю за вказаною процедурою внаслідок ряду причин: - вихідний пірофосфат нікелю нерозчинний у воді, а тому одержати його достатньо концентрований водний розчин неможливо; - осадити пірофосфат нікелю із розчину аміаком також неможливо із-за високої розчинності аміачного комплексу Ni 2 + . Корисною моделлю ставиться завдання одержання індивідуальної сполуки - твердого гідратованого аміачного пірофосфату нікелю, який одночасно містить такі поживні для рослин компоненти, як Ni 2 + NN 3 та Р2О74" і тому може проявляти біологічну активність. Поставлене корисною моделлю завдання досягається тим, що гідратований аміачний пірофосфат нікелю, що одночасно містить макро - і мікроелементи живлення рослин, згідно корисної моделі містить пірофосфат-іон, а для одержання продукту індивідуального складу з загальною формулою Ni2P2O7-nNH3-mH2O, де n=2-3; m=5-8 як вихідний фосфат використовують кристалічний Ni2P2O7-6H2O, який протягом 4-5 хвилин повністю розчиняють у 23-25%-ному водному аміаку, взятому із розрахунку 180% від стехіометрично необхідної кількості для утворення комплексних іонів тетрааміннікелю, а далі одержаний розчин вливають в ацетон, об'єм якого співвідноситься з об'ємом аміачного розчину пірофосфату нікелю як (2-нЗ):1, донну фазу відділяють від маточного розчину і витримують при температурі 15-25°С до її тверднення, одночасно висушуючи осад на повітрі до постійної маси. CO 00 со CD о> 6383 Приклад 1. В 10,3мл 23%-го водного аміаку повністю розчиняють 1г твердого Ni2P2O7-6H2O (37,0% NiO). Одержаний розчин вливають в 25мл ацетону. Донну фазу у вигляді маслянистої рідини синього кольору відділяють від маточного розчину і витримують при температурі 15-25°С до повного її тверднення. Висушують осад на повітрі до постійної маси. В результаті здійснення даного способу одержують полідисперсний порошок зеленого кольору, який містить, % (мас): NiO-33,41; P2O5-32,56; NH310,70; Н2О-23,34. Аніонний склад продукту становить, % Р2О5-(відн.): Р2О74"-95,5; РО43"-4,5. Бруттоформула речовини 2NiO-P2O5-3NH3-6H2O, молекулярна формула сполуки Ni2P2O7-3NH3-6H2O. Вихід продукту за вмістом NiO і P2Os становить не менше 97%. Приклад 2. В 40,0мл 25%-го розчину аміаку повністю розчиняють Зг твердого NI 2 P 2 Oy6H 2 O (37,0% NiO). Одержаний розчин вливають в 130мл ацетону. Донну фазу у вигляді маслянистої рідини синього кольору відділяють від маточного розчину і витримують при температурі 15-25°С до її тверд нення. Висушують осад на повітрі до постійної маси. В результаті здійснення даного способу одержують полідисперсний порошок зеленого кольору, який містить, % (мас): NiO 31,52; Р2О5 29,61; NH 3 7,00; Н2О 32,00. Аніонний склад продукту становить, % (відн.): Р2О74" 95,4; РО4 4,6. Бруттоформула речовини 4NiO-2P2O3-4NH3-17H2O, молекулярна формула сполуки 2Ni2P2O7-4NH3-17H2O. Вихід продукту за вмістом NiO і Р2О3- становить не менше 99%. Обґрунтування умов утворення індивідуального гідратованого аміачного пірофосфату нікелю наведено в табл. 1 -4. Найшвидше розчинення пірофосфату нікелю у концентрованому розчині аміаку, від чого залежить ступінь гідролізу пірофосфат-аніону, відбувається при використанні у якості вихідної сполуки Ni2P2O7-6H2O (протягом 5-15 хвилин при дозі аміаку 110-180% від стехіометричної) у порівнянні з безводним Ni2P2O7 (табл.1). Останній у таких умовах практично не розчиняється. Таблиця 1 Обґрунтування умов розчинення пірофосфату нікелю Ступінь розчин- Тривалість повНаважка Об'єм концентро№ Склад пірофосКількість аміаку від ності пірофосфа- ного розчиненпірофосфа- ваного розчину з/п фату нікелю стехіометричної, % аміаку, мл ту нікелю, % ня , годин ту нікелю 1 2 4 7 3 5 6 1. Ni 2 P 2 O 7 0,73 4,5 90 4,5 0,25 2. Ni2P2O7-6H2O 90 85 1,0 0,73 5,0 3. Ni 2 P 2 O 7 100 4. Ni2P2O7-6H2O 5,0 100 0,25 100 1,0 5. Ni 2 P 2 O 7 0,73 5,5 110 0,10 6. Ni2P2O7-6H2O 5,5 110 100 1,0 7. Ni 2 P 2 O 7 0,73 9,0 180 9.0 0,06 8. Ni2P2O7-6H2O 180 100 1,0 9. Ni 2 P 2 O 7 0,73 15,0 300 0,04 10. Ni2P2O7-6H2O 1,0 15,0 300 100 */ Наважки пірофосфатів нікелю вирівняні за вмістом Ni 2 P 2 O 7 Очевидно, що чим швидша стадія розчинення вихідного пірофосфату нікелю у аміаку, тим нижчий ступінь гідролізу пірофосфатаніону і тим вища індивідуальність складу продукту синтезу (табл.2). Таблиця 2 Вплив тривалості процесу розчинення пірофосфату нікелю в аміаку (у кількості 180% від стехіометричної дози) на процес деструкції (гідролізу) пірофосфат-аніону Розподіл аніонних форм Розподіл аніонних форм Тривалість розчинення фосфатів у вихідних сполуфосфатів у продуктах син№ Склад вихідного пірофосфату нікелю в аміках, % Р2О5(відн.) тезу,% Р 2 О 5 (відн.) з/п пірофосфату нікелю аку, годин PO4d" Р2О7 РО 4 * р2о/3,5 96,5 4,5 1. Ni2P2O7-6H2O 0,06 95,5 9,2 3,5 96,5 3. Ni2P2O7-6H2O 90,8 1,0 Отже, для мінімізації гідролітичної деструкції пірофосфатного аніону на стадії розчинення пірофосфату нікелю у водному аміаку потрібно використовувати: стехіометричну дозу для розчинення пірофосфату нікелю і утворення розчинного аміакату пірофосфату нікелю; 6383 як вихідну сполуку гідратований пірофосфат нікелю складу Ni2P2O7-6H2O, а не безводний пірофосфат нікелю. За цих умов тривалість стадії повного розчинення пірофосфату нікелю у водному аміаку мінімальна і не перевищує 0,06 години. Відповідно до даних табл.З, оптимальні умови для виділення твердої фази аміачного пірофосфату нікелю із розчину наступні: використання у якості висолюючого агенту ацетону; вливання аміачного розчину пірофосфату нікелю у розчин висолюючого агента (ацетону). Внаслідок такого порядку здійснення даного способу одержують полідисперсний порошок зеленого кольору, який містить, % (мас): NiO-33,41; Р2О5-32,56; NH3-10,70; H2O-23,34. Аніонний склад 4 3 продукту наступний, % (відн.): Р2С>7 "-95,5; РО4 "4,5. Брутто-формула речовини 2NiO-P2O5-3NH3-6H2O, молекулярна формула Ni2P2O7-3NH3-6H2O. Вихід продукту за вмістом NiO і Р2О5 становить не менше 97%. Таблиця З Вплив природи осаджувана та порядку його змішування з аміачним розчином пірофосфату нікелю (АРПН) на виділення донної фази аміачного пірофосфату нікелю (доза аміаку 180% стехіометричної) Наявність донної Осаджувач, висолюПорядок зливання реагентів фази ючий агент 1 2 3 АРПН до ацетону Ацетон Утворюється Ацетон до АРПН Утворюється Утворюється АРПН до метанолу МетаМетанол нол до АРПН Утворюється Утворюється Етанол АРПН до етанолу Етанол до АРПН Бутаном АРПН до бутанолу Утворюється н-пропанол АРПН до н-пропанолу Утворюється Ізопропа-нол АРПН до ізопропанолу Утворюється Na2HPO4 (розчин) Na 4 P 2 O 7 (розчин) Утворюється АРПН до осаджувача Оса- Немає джувач до АРПН Немає АРПН до осаджувача Оса- Немає джувач до АРПН Немає Оптимальну кількість висолюючого агента визначено для умов додавання аміачного розчину пірофосфату нікелю (кількість аміаку 180% стехіометричної) до ацетону (табл. 4). Згідно даних, наведених в табл. 4, донна фаза наближається за складом до індивідуального гідратованого аміачного пірофосфату нікелю при об'ємному співвідношенні АРПН:ацетон=1:(1-^-3). При цьому також досягається повнота осадження нікелю із розчину відповідно на 80-99%. Тому для забезпечення одержання гідратованого аміачного пірофосфату нікелю індивідуального складу з високим виходом потрібно використовувати 2-3кратний об'єм висолюючого агенту по відношенню до об'єму аміачного розчину пірофосфату нікелю. Координаційну структуру одержаних речовин складу Ni 2 P 2 O 7 3NH3-6H2O та 2Ni2P2O7-4NH3-17H2O підтверджують дані 14спектроскопії, які свідчать, що гідратований аміачний пірофосфат має специфічний набір смуг Тривалість процесу до початку утворення донної фази, годин 4 0,04-0,08 Більше 1 0,25-0,50 3,00 (спостерігається окиснення І\ІҐ+в Ni43"1") 0,10-0,20 5,00 (спостерігається окиснення Ni^B Nia+) більше 50 годин (спостерігається окиснення Ni2+B Ni3+) більше 50 годин (спостерігається окиснення Ni2+B Ni3+) більше 50 годин (спостерігається окиснення Ni2+B Ni3+) Утворення фази не спостерігається через 48 годин Утворення фази не спостерігається через 48 годин поглинання, відмінний від вихідного пірофосфату нікелю (табл.5). Зокрема, в області 1665-1510см" 1 на ІЧ спектрах Ni2P2O7-6H2O і аміачного пірофосфату нікелю спостерігаються смуги поглинання, що можуть відповідати одночасно як деформаційним коливанням води, так і асиметричним деформаційним коливанням аміаку. Однак в облас1 ті 1465-1410см" спектрів Ni2P2O7-3NH3-6H2O та 2Ni2P2O7-4NH3-17H2O зафіксовано смугу поглинання, що може бути віднесена лише до аміаку, який утворює стійкий донорно-акцепторний зв'язок з іоном металу. Асиметричні і симетричні валентні коливання пірофосфатної групи спостерігаються в областях 1140-890см"1 у вигляді сильних смуг поглинання. Слабкі смуги поглинання при 670-530см"1 відповідають коливанням груп POP, OPO. В межах 480450см"1 спостерігаються смуги, що відповідають валентним коливанням зв'язків Ni-N і Ni-O. Таблиця 4 Встановлення оптимальної дози висолюючого агенту Аніонний Хімічний склад Кількість склад, % Збільшеннявмісту аміаку від Співвідношення: Вихід продукту, % мас. Pos (відн.) моноформи Р О 4 3 у № стехіомет- об'єм АРПН: продукту складі продукту під з/п ричної об'єм ацетону за NiO,% час синтезу*, % дози, % Р 2 О 5 (ВІДН.) 4 Р2О7 " NiO Р2О5 NH 3 Н2О 1 180 1:3 99 31,5 29,6 7,0 32,0 4,5 95,5 1,0 2 180 1:2 97 33,4 32,5 10,7 23,3 4,5 95,5 1,0 3 180 1:1 80 35,2 32,5 10,4 22,0 10,0 90,0 6,5 Склад продуктів висолювання (без урахування домішки моноформи РО 4 3 ", що міститься у вихідному 1,00Ni 2 P 2 O 7 -2,0 NH 3 -8,5H 2 O+0,02 Ni 3 (PO 4 ) 2 1,00Ni 2 P 2 O 7 -3,0 NH 3 6H 2 O+0,02 Ni 3 (PO 4 ) 2 0,96 Ni 2 P2O 7 -3,0 NH 3 -5,3H 2 O+0,06 Ni 3 (PO 4 ) 2 */ вихідний пірофосфат нікелю Ni2P2O7-6H2O містить 3,5% P2Os (відн.) домішки моноформи РО43" (табл.2) рофосфату нікелю присутні молекули аміаку, які утворюють координаційну сферу з іоном нікелю. Таким чином, на основі аналізу 14 спектрів можна стверджувати, що в складі аміачного пі Таблиця 5 Частоти (см' ) максимумів смуг поглинання на ІЧ спектрах вихідного Ni2P2O7-6H2O і Ni2P2O7-3NH3O-6H2O Ni2P2O7-6H2O 3600-3000 с.ш.п. Ni2P2O7 3NH3-6H2O 3400-ЗОООс.ш.п. Смуги віднесення ь (Н2О), W N H s ) 1640ср. 1510сл. ь (Н2О), 5 a s (NH3) 1070с. ЮЗОсл. 895с. 1665пл. 1610ср. 1465пл. 1430ср. 1410пл. 1140сл. 1120сл. 1095с. ЮЮсл. 890с. 665С.ПЛ. 670сл. u a s (POP)[P 2 O 7 ] 650сл. 580пл. 540ср. 5 a s (OPO) 510ср. 450пл. Ni-N Ni-0 1110с. 540с. 480пл. 5s(NH3) ^as(PO 3 )[P2C4 u s (РОз) (РО) 5 S (OPO) с-сильна; ср. - середня; сл. - слабка; ш. - широка інтенсивність смуги поглинання; пл. - плече Комп'ютерна верстка В. Мацело Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП "Український інститут промислової власності", вул. Глазунова, 1, м. Київ - 4 2 , 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюA hydrated ammonium nickel pyrophosphate
Автори англійськоюKopilevych Volodymyr Abramovych, Zhyliak Ivan Dmytrovych, Voitenko Larysa Vladyslavivna
Назва патенту російськоюГидратированный аммиачный пирофосфат никеля
Автори російськоюКопилевич Владимир Абрамович, Жиляк Иван Дмитриевич, Войтенко Лариса Владиславовна
МПК / Мітки
МПК: C01B 25/26, C01B 25/42
Мітки: нікелю, аміачний, пірофосфат, гідратований
Код посилання
<a href="https://ua.patents.su/4-6383-gidratovanijj-amiachnijj-pirofosfat-nikelyu.html" target="_blank" rel="follow" title="База патентів України">Гідратований аміачний пірофосфат нікелю</a>
Попередній патент: Спосіб лікування хворих на хронічні обструктивні захворювання легень з імунною недостатністю
Наступний патент: Комплексний антимікробний сорбційний препарат метродисил-паста для профілактики хірургічної інфекції та лікування гнійних ран, трофічних виразок, опіків
Випадковий патент: Пневматичне спорудження